Изучение антиоксидантных и прооксидантных свойств
реклама

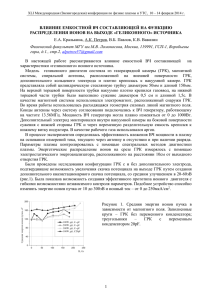
ДЕЙСТВИЕ ГЛИЦИРРЕТОВОЙ КИСЛОТЫ И ЕЕ ПРОИЗВОДНЫХ НА ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ В МЕМБРАНАХ МИТОХОНДРИЙ Асраров М.И., Чулиев И.Н., Далимов Д.Н. Институт биоорганической химии АН РУ, Ташкент, Узбекистан. [email protected] Препараты из корня солодки использовались как лекарственные средства для лечения различных болезней [1-7]. Исследования мембраноактивных свойств ГзК показали, что она не обладает антирадикальной активностью, однако, стабилизирует мембраны митохондрий (Мх), модифицирует состояние ЦсА-чувствительной поры Мх, предотвращая ее открытие [8,9]. Поиск и создание новых высокоэффективных лекарственных средств на основе ГзК и глицирретовой кислот (ГрК) путем модификации определенных функциональных групп, являются актуальными для исследовательской практики. Представляет интерес также изучение взаимосвязи между химической структурой и анти- и прооксидантыми свойствами производных ГрК. В связи с этим нами исследовано действие ГрК и ее некоторых производных (рис.1) на процесс ПОЛ мембран Мх. Материалы и методы. Мх выделяли из печени крыс массой 150-200 гр. методом дифференциального центрифугирования. ПОЛ индуцировали в присутствии FeSO4 (1x10-3 M) и аскорбата (2x10-4 M) или добавлением 4 мМ гидроперекись кумола (ГПК). Количество образовавшегося малонового диальдегида (МДА) определяли, пользуясь коэффициента молярной экстинкции (е=1,56.105 М-1 см-1) [10]. Результаты и их обсуждение. В результате проведенных исследований обнаружено, что ГрК увеличивает накопление малонового диальдегида (МДА) в мембранах Мх на 40% (рис. 2). В качестве индуктора ПОЛ была использована ГПК. Аналогичные данные были получены также и другими авторами [8]. Добавление других производных ГрК - 2-пиридил-ГЦ-амида, цитизин-изопропил-ГЦ и цитизин-этил-ГЦ в концентрации 50 мкМ предотвращало эффект ГПК на уровень МДА в изолированных Мх печени. При этом уменьшение накопления МДА составило 20%, 40% и 45%, соответственно, относительно контроля (рис.2). Нами также изучено действие производных ГрК на систему ПОЛ, индуцированную 2+ Fe /аскорбатом (рис. 3). В этих условиях производные ГрК - 2-пиридил-ГЦ-амид, цитизин-изопропил-ГЦ и цитизин-этил-ГЦ в концентрации 50 мкМ предотвращали эффект Fe2+/аскорбат на уровень МДА в изолированных Мх на 15%, 30,6% и 50 %, соответственно. Таким образом, производные ГрК: 2-пиридил-ГЦ-амид, цитизинизопропил-ГЦ и цитизин-этил-ГЦ обладают антиоксидантными свойствами и оказывают протекторное действие на Мх, уменьшая повреждающее действие ГПК и процесса ПОЛ на Мх. При изучении влияния морфолин-ГЦ, 4-пиридил-ГЦ-амида на ПОЛ мембран Мх, показано, что эти производные ГрК индуцируют ПОЛ. Однако, эффекты соединений морфолин-ГЦ и 4-пиридил-ГЦ-амида в концентрации 50 мкМ, действуют слабее, чем классические индукторы ПОЛ – ГПК и системы Fe2+/аскорбат (рис.2, рис.3). Увеличение концентрации препаратов (100 мкМ) в инкубационной среде приводило к дальнейшему увеличению накопления МДА в мембранах Мх. Как показали опыты, в присутствии ГПК наблюдается увеличение накопления МДА (рис.2). На этом фоне препараты морфолин-ГЦ и 4-пиридил-ГЦ-амида (50 мкМ), привели к дальнейшему увеличению накопления МДА в мембранах Мх. Более высокие концентрации препаратов (100 мкМ) морфолин-ГЦ и 4-пиридил-ГЦ-амида в СИ приводили к дальнейшему увеличению накопления МДА в мембранах Мх на 26% и 30%, соответственно. Полученные результаты показываюи, что соединения морфолин-ГЦ и 4пиридил-ГЦ-амида обладают прооксидантными свойствами (рис.2). COOH COOH H H O O N CH2 O CH2 O HO морфолин-ГЦ ГрК COOH COOH H H O O O O N CH2 CH2 O N N N CH2 CH O CH3 цитизин-изопропил-ГЦ цитизин-этил-ГЦ CONH2 CONH2 H H O O HN HN O O N N 4-пиридил-ГЦ-амид 2-пиридил-ГЦ-амид Рис. 1. Структурные формулы глицирретовой кислоты и ее производных. (Список использованных сокращений: ГрК - глицирретовая кислота; Цитизин-этилГЦ: 2-(N-цитизин)-этил-3-0-ацетил-18Н-глицирретат; Цитизин-изопропил-ГЦ: 2-(Nцитизин)-изопропил-3-0-ацетил-18Н-глицирретат; Морфолин- ГЦ: 2-(N-морфолин)этил-3-0-ацетил-18Н-глицирретат; 2-пиридил- ГЦ -амид: N-(2-пиридил)-3-0-ацетил-11кетоолеан-12-ен-30-амид; 4-пиридил- ГЦ -амид: N-(4-пиридил)-3-0-ацетил-11-кетоолеан12-ен-30-амид.) Аналогичные результаты были получены также при изучении действия морфолинГЦ и 4-пиридил-ГЦ-амида на систему ПОЛ, индуцированную Fe2+/аскорбатом (рис.3). В этих же условиях апробированные нами препараты в концентрации 50 мкМ, способствовали к увеличению накопления МДА в мембранах Мх на 30% и 37%, соответственно. 160 Продукция ПОЛ, % 140 120 100 80 60 40 20 0 1 2 3 контроль 4 50 мкМ 5 6 100 мкМ Рис.2. Влияние ГрК и ее производных на ГПК-зависимый ПОЛ 1. - 2-пиридил-ГЦ-амид; 2. - цитизин-изопропил-ГЦ; 3. - цитизин-этил-ГЦ; 4. - 4пиридил-ГЦ-амид; 5. - морфолин-ГЦ; 6. - ГрК. (Условия эксперимента см. раздел Материалы и методы; n =6, Р0,05). Таким образом, 2-пиридил-ГЦ-амид, цитизин-изопропил-ГЦ и цитизин-этил-ГЦ обладают антиоксидантными свойствами и оказывают протекторное действие на Мх, уменьшая повреждающее действие ГПК и системs Fe2+/аскорбат. ГрК и ее другие производные - морфолин-ГЦ и 4-пиридил-ГЦ-амид обладают прооксидантными свойствами, усиливая повреждающее действие ГПК и системы Fe2+/аскорбат на митохондрии. 180 Продукция ПОЛ, % 160 140 120 100 80 60 40 20 0 1 2 3 контроль 4 50 мкМ 5 100 мкМ 6 Рис.3. Влияние производных ГрК кислоты на Fe+2/аскорбат зависимый ПОЛ 1. - 2-пиридил-ГЦ-амид; 2. - цитизин-изопропил-ГЦ; 3. - цитизин-этил-ГЦ; 4. - 4-пиридилГЦ -амид; 5. - морфолин-ГЦ; 6. - ГрК. (Условия эксперимента см. раздел Материалы и методы; n =6, Р0,05). Литература 1. Толстиков Г.А., Балтина Л.А., Шульц Э.Э., Покровский А.Г. Глицирризиновая кислота. // Биоорганическая химия. – Москва, 1997. - Т.23. - С.691-709. 2. Балтина Л.А., Давыдова В.А., Муринов Ю.И. и др. Мононатриевая соль 18глицирризиновой кислоты, обладающая противоязвенным действием и стимулирующая репаративную регенерацию кожи. // А.с. 1536785 СССР. - Б.И. - 1992. - №17. - С.19. 3. Dehpour A.R., Zahedi H., Amini Sh., Akhgari М., Abdollahi М. Effects of clycyrrhiza derivatives against acetaminophen-induced hepatotoxicity. // Irn J Med Sci. – 1999. - V.24(1&2). – P.26-31. 4. Оболенцева Г.В., Литвиненко В.И., Аммосов А.С., Попова Т.П., Сампиев А.М. Фармакологические и терапевтические свойства препаратов солодки (обзор). // Хим.прир.соед. – Ташкент, 1999. - Т.8. - С.24-30. 5. Zeuzem S. Glycyrrhizin for the treatment of allergic diseases and chronic hepatitis.// Dtsch. Med. Wochenschr. - 1998. - V.123. - P.372-379. б. Van Rossum T.G., Vulto A.G., de Man R.A., Brouwer J.T., Schalm S.W. Review article: glycyrrhizin as a potential treatment for chronic hepatitis C. // Aliment. Pharmacol. Ther. - 1998. - V.12. - P.199-205. 8. Камбурова В.С. Регуляция циклоспорин А – чувствительной поры митохондрий: эффекты глицирризиновой кислоты и ее агликона: Дисс. … канд. биол. наук. Т.: 2001. 110с. 9. Бескина О.А., Бакунц А.Г., Исаев Ю. Влияние глицирризиновой кислоты и ее комплекса со свинцом на энергетический метаболизм митохондрий печени крыс // ХПС. – Ташкент, 2000. – Спец. вып. – С.122-124. 10. Болдырев А.А. Введение в биомембранологию. - Москва.: Университет, 1990. – С.7778.