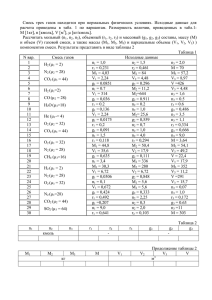
Задание 2 Абсорбция
реклама

ДОМАШНЕЕ ЗАДАНИЕ №2 АБСОРБЦИЯ ГАЗООБРАЗНЫХ ПРИМЕСЕЙ ИЗ ОТХОДЯЩИХ ГАЗОВ ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 1. При температуре 25°С приведены в соприкосновение: воздух атмосферного давления, содержащий 14% (об.) ацетилена (С2Н2), и вода, содержащая растворенный ацетилен в количестве: 1) 0,29∙10-3 кг на 1 кг воды; 2) 0,153∙10-3 кг на 1 кг воды. Определить: 1) из какой фазы в какую будет переходить ацетилен; 2) движущую силу этого процесса в начальный момент времени (в мольных долях). Атмосферное давление равно 765 мм рт. ст. Константа Генри ацетилена равна Kг(С2Н2) = 9,9∙10-7 мм рт. ст.-1 Решение: Равновесные концентрации С2Н2 в газовой и жидкой фазах связаны законом Генри: 1 N(С2Н2) = Kг(С2Н2), ∙ р*(С2Н2), р*(С2Н2) = N(С2Н2) , где K г (С2 H 2 ) N(С2Н2) – мольная доля С2Н2 в водном растворе; Kг(С2Н2) – константа Генри ацетилена ; р*(С2Н2) – равновесное давление ацетилена над раствором. Парциальное давление ацетилена в воздухе р(С2Н2) пропорционально его мольной доле Y(С2Н2): р (С2Н2) = Робщ · Y(С2Н2) = 0,14 ∙ 765 = 107 мм рт. ст. 1-й вариант 2-й вариант Содержание ацетилена в растворе: Содержание ацетилена в растворе: 0,29∙10-3 кг С2Н2 на 1 кг Н2О. 0,153∙10-3 кг С2Н2 на 1 кг Н2О. Количество ацетилена в растворе: Количество ацетилена в растворе: ν (С2Н2) = m(С2Н2) / M(С2Н2) = 0,29 / 26 = ν (С2Н2) = m(С2Н2) / M(С2Н2) = 0,153 / 26 = 0,0112 моль. 0,00588 моль. Количество воды в растворе: Количество воды в растворе: ν (Н2O) = m(Н2O) / M(Н2O) = 1000 / 18 = ν (Н2O) = m(Н2O) / M(Н2O) = 1000 / 18 = 55,55 моль. 55,55 моль. Мольная доля ацетилена в растворе: Мольная доля ацетилена в растворе: N = ν (С2Н2) / [ν (С2Н2) + ν (Н2O)] = N = ν (С2Н2) / [ν (С2Н2) + ν (Н2O)] = 0,0112 / (0,0112 + 55,55) = 0,2∙10-3. 0,00588 / (0, 00588+ 55,55) = 1,06∙10-4. Давление насыщенного пара ацетилена над Давление насыщенного пара ацетилена над раствором раствором р*(С2Н2), = N(С2Н2) / Kг(С2Н2) = р*(С2Н2), = N(С2Н2) / Kг(С2Н2) = 0,2∙10-3 ∙ (9,9∙10-7)-1 = 202 мм рт. ст. 1,06∙10-4 ∙ (9,9∙10-7)-1 = 107 мм рт. ст. Движущая сила процесса определяется Движущая сила процесса ∆р = р* – р = разностью между рабочим давлением 107 – 107 = 0 мм рт. ст. ацетилена в воздухе и его равновесным давлением ∆р = р* – р = 202 – 107 = 95 мм рт. ст. Поскольку равновесное давление больше Перехода ацетилена из одной фазы в рабочего р* > р, С2Н2 будет переходить из другую не будет, т.к. ∆р = 0, воды в воздух. т.е.соприкасающиеся фазы находятся в равновесии. Движущая сила процесса в мольных долях: Движущая сила процесса в мольных долях: ∆Y = Y* – Y = 202 / 765 – 0,14 = 0,124 ∆Y = Y* – Y = 107 / 765 – 0,14 = 0 Ответ: в первом случае происходит десорбция ацетилена из раствора в газовую фазу. Движущая сила процесса 95 мм рт.ст. или 0,124 (мольн. доли). Во втором случае раствор ацетилена и воздух, содержащий ацетилен, находятся в равновесии. Движущая сила процесса равна нулю. Пример 2. Рассчитайте движущую силу процесса взаимодействия NH3 с водой при проведении его в аппарате с движением фаз: а) при прямотоке; б) при противотоке. В процессе абсорбции, проводимой при давлении 0,1 МПа (105 Па) и 27°С, концентрация NH3 в газе снижается от Снач(г) = 4% (об.) до Скон(г) = 0,8% (об.), а концентрация NH3 в воде увеличивается от Снач(ж) = 0,05 кмоль/м3 до Скон(ж) = 0,25 кмоль/м3. Константа Генри аммиака Kг (NH3) = 5∙10-4 кмоль/(м3∙Па). Решение: Равновесные концентрации NH3 в газовой и жидкой фазах определяются законом Генри: С(NH3) = Kг(NH3), ∙ р*( NH3), р*( NH3) = С(NH3) 1 , где K г (NH 3 ) С(NH3) – молярная концентрация NH3 в водном растворе; Kг(NH3) – константа Генри аммиака ; р*(NH3) – равновесное давление аммиака над раствором. Парциальное давление аммиака в воздухе р(NH3) пропорционально его мольной доле Y(NH3): р (NH3) = Робщ · Y(NH3). Равновесные давления аммиака на входе в аппарат р*нач и на выходе из аппарата р*кон равны: р*нач = 0,05 / 5 ∙ 10-4 = 100 Па. р*кон = 0,25 / 5 ∙ 10-4 = 500 Па Рабочие парциальные давления аммиака в газовой фазе на входе в аппарат ргнач и на выходе из аппарата ргкон равны: ргнач = 0,04 ∙ 105 = 4000 Па ргкон = 0,008 ∙ 105 = 800 Па Движущие силы процесса при противотоке и прямотоке рассчитывают как среднее рвх pвых логарифмическое ∆рср = . р вх ln p вых Противоток Прямоток ∆рвх = ргнач – р*кон = 4000 – 500 = 3500 Па ∆рвх = ргнач – р*нач = 4000 – 100 = 3900 Па ∆рвых = ргкон – р*нач = 800 – 100 = 700 Па ∆рвых = ргкон – р*кон = 800 – 500 = 300 Па ∆рср = 3500 700 = 1740 Па 3500 ln 700 ∆рср = 3900 300 = 1405 Па 3900 ln 300 Ответ: Движущие силы процесса при противотоке и прямотоке равны 1740 Па и 1405 Па соответственно. Пример 3. Рассчитайте площадь поверхности орошения насадки бензольного скруббера, где в 1 час улавливается бензол массой 1800 кг. Давление паров бензола в газовой фазе 103 и 102 Па, давление насыщенного пара бензола над маслом 38 и 90 Па (соответственно в начале и в конце процесса). Коэффициент адсорбции бензола 0,00012 кг / (м2∙час∙Па). Решение: В общем виде процесс абсорбции подчиняется уравнению: mа = ka ∙ F ∙ ∆pср, где mа – масса абсорбтива, поглощаемого орошающей жидкостью в единицу времени; ka – коэффициент массопередачи; F – площадь поверхности раздела фаз (площадь поверхности насадки); ∆pср– средняя движущая сила процесса абсорбции. Определим среднюю движущую силу процесса ∆pср. ∆рвх = 1000 – 38 = 962 Па; ∆рср = ∆рвых = 100 – 90 = 10 Па; Δpвх -Δpвых 962 10 = = 208 Па Δp вх 962 ln ln 10 Δp вых Площадь поверхности насадки: F= ma 1800 = = 7211,5 м2 k a Δpср 0, 0012 208 Ответ: Площадь поверхности насадки равна 7211,5 м2. Пример 4. Определить расход серной кислоты для осушки воздуха при заданных условиях. Производительность скруббера 500 м3/час (считая на сухой воздух при н.у.); начальное содержание влаги в воздухе 0,016 кг/кг сухого воздуха, конечное содержание влаги – 0,006 кг/кг сухого воздуха; начальное содержание воды в кислоте 0,6 кг/кг моногидрата, конечное содержание – 1,4 кг/кг моногидрата. Осушка воздуха производится при атмосферном давлении. Решение: Расход серной кислоты можно найти из уравнения материального баланса процесса осушки воздуха: G (Yн – Yк) = L (Xк – Xн), где G – массовый расход воздуха, кг/ час; L – массовый жидкости (серной кислоты); Yн, Yк – массовые концентрации водяного пара в воздухе на входе в скруббер и на выходе из него; Xк Xн– массовые концентрации воды в кислоте на выходе из скруббер и на входе в него. Массовый расход воздуха: G = Q ∙ ρ, где Q – объемный расход воздуха, м3 / час. ρ – плотность воздуха, кг / м3. Плотность воздуха при н.у. равна 1,293 кг / м3 G = Q ∙ ρ = 500 ∙ 1,293 = 646 кг / час. Расход серной кислоты (моногидрата): L= G (Yн - Yк ) 0,016 0,006 = 646 = 8,1 кг/час 1,4 0,6 X к -X н Ответ: Расход серной кислоты, необходимой для осушки воздуха, равен 8,1 кг/ час. Пример 4. Определить коэффициент массопередачи в водяном скруббере при поглощении из газа СО2 по следующим данным. В скруббер поступает 5000 м3/час газовой смеси, считая при атмосферном давлении и при рабочей температуре и 650 м3/час чистой воды. Начальное содержание СО2 в газе 28,4% (об.), конечное (в верху скруббера) – 0,2% (об.). Давление в скруббере Робщ = 1620 кПа; температура 15°С. Площадь поверхности насадки составляет 5212 м2. Константа Генри диоксида углерода Kг(СО2) = 8,06 ∙ 10-6 кПа-1 при 15°С. Решение: Определим количество СО2, поглощенного водой. Объем диоксида углерода на входе в скруббер равен: Vн (СО2) = Vн СМ ∙ Yн = 5000 ∙ 0,284 = 1420 м3/час Чтобы определить объем диоксида углерода на выходе из скруббера, необходимо учесть, что объем воздуха в смеси, равный (5000 – 1420) м3/час, составляет (1 – 0,002) об. доли. Значит объем смеси равен Vв СМ = Vвозд / Yвозд. В смеси выходящей из скруббера объемная доля СО2 составляет 0,002. Тогда объем СО2 равен Vв (СО2) = Vв СМ ∙ Yв = [Vвозд / Yвозд] · Yв = 5000 1420 0, 002 = 7,2 м3/час. 1 0, 002 Объем СО2, поглощенного водой, равен: Vпогл (СО2) = Vн (СО2) – Vв (СО2) = 1420 – 7,2 = 1412,8 м3/час. Объем поглощенного СО2 необходимо привести к нормальным условиям, чтобы рассчитать массу поглощенного СО2 через его плотность и объем. Но плотность СО2 задана только для н.у. V°погл (СО2) = Vпогл (СО2) · T° / Tр.у. = 1412,8 ∙ 273 / (273 + 15) = 1339,2 м3/час. Gпогл(СО2) = V°погл. (СО2) · ρ°(СО2) = 1339,2 ∙ 1,976 = 2646 кг/час Определим среднюю движущую силу процесса абсорбции ∆pср. Парциальное давление диоксида углерода на входе в скруббер равно: рнг = Робщ · Yн(СО2) = 0,284 ∙ 1620 = 460 кПа. Парциальное давление диоксида углерода на выходе из скруббера равно рвг = Робщ ∙ Yв(СО2) = 0,002 ∙ 1620 = 3,24 кПа Для расчета равновесного давления диоксида углерода по уравнению Генри необходимо определить его концентрацию в водном растворе в мольных долях. На входе в скруббер: Xн = (CO2 ) m(CO2 ) / M (CO2 ) 2646 / 44 = = 2646 / 44 650000 /18 (CO2 ) ( H 2O) m(CO2 ) / M (CO2 ) m( H 2O) / M ( H 2O) 0,00166. Равновесное давление диоксида углерода на входе в скруббер: р*н = Xн ∙ 1/Kг = 0,00166 / 8,06 ∙ 10-6 = 206 кПа На выходе из скруббера р*в = 0, т.к. на орошение подается чистая вода и мольная доля диоксида углерода равна нулю. Движущая сила процесса на входе в скруббер равна: ∆рвх = рнг – р*н = 460 – 206 = 254 кПа; на выходе из скруббера: ∆рвых = рвг – р*в = 3,24 – 0 = 3,24 кПа. Средняя движущая сила для всего процесса в целом: ∆рср = 254 3, 24 = 57,56 кПа 254 ln 3, 24 Коэффициент массопередачи найдем из основного уравнения абсорбции. ka = ma 2646 = = 0,0088 кг/(м2∙час∙кПа). F Δp ср 5212 57,56 Ответ: Коэффициент массопередачи в водяном скруббере для поглощения диоксида углерода равен 0,0088 кг/(м2∙час∙кПа). ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ Условия задач для самостоятельного решения представлены в виде таблицы. Рекомендации по решению задач: 1). Условия, при которых протекает процесс абсорбции, следующие: Pобщ = 1 атм (101325 Па = 101,3 кПа), Т = 293 К (20°С). Поэтому необходимо привести к нормальным условиям (Pобщ = 1 атм = 101325 Па, Т = 273К) объемы газо-воздушных смесей либо объемы поглощаемых газов (абсорбтивов). Далее можно рассчитать количества и массы поглощаемых газов, используя молярный объем газа при н.у. 22,4 л/моль или 22,4 м3/кмоль. 2). Движение газовой и жидкой фаз организовано противотоком. 3). Во всех случаях содержание поглощаемого вещества в поглотительной жидкости при входе ее в абсорбер равно нулю Xн.= 0. Равновесное парциальное давление поглощаемого газа над этой жидкостью тоже будет равно нулю Y*к = 0, и движущая сила процесса на выходе из аппарата равна ∆Yвых = Yвг – Y*в = Yвг. 4). Если найдена масса (количество) поглощенного вещества ma (νa) и средняя движущая сила процесса ∆рср (Yср), то можно рассчитать либо площадь поверхности насадки F, либо коэффициент массопередачи ka из основного уравнения абсорбции: a a F= или ka = . k a ΔYср F ΔYср 5). Объем поглотительной жидкости L следует найти из уравнения материального G (Yн - Yк ) G (Yн - Yк ) баланса процесса абсорбции: L = = , т.к. Xн.= 0. X к -X н Xк Массовый расход газо-воздушной смеси можно рассчитать, зная ее объем и плотность при н.у., G = V° · ρ°. Плотность смеси принимают равной плотности воздуха 1,29кг/м3. Таблица – Варианты домашних заданий по теме «Абсорбция» № Расход вари- газовой анта смеси (р.у.), Расход орошающей жидк. Абсорбтив Конц-я абсорб тива в газ. фазе на входе в аппарат 0,03 кмоль/кмоль воздуха 100г/м3 воздуха (р.у.) Конц-я абсорбтива в газ.фазе на выходе из аппарата –– Степень абсорбции –– Конц-я абсорбтива в жидк. фазе на выходе из аппарата 0,02 кмоль/кмоль воды –– 90% Площадь поверхности насадки Найти 98% Найти –– –– 98% Найти –– –– 5000м2 0,15 кмоль/кмоль поглотителя –– 85% 7200м2 –– Найти 0,8%(об.) –– –– Найти –– 0,0072кг SO2/кг воды 90% Найти 1 3000 м3/ч Найти NH3 2 1500 кг/ч. Метанол CH3OH 3000 кг/ч Ацетон CH3COCH3 6%(об.) 4 1500м3/ч воздуха (р.у.) 1400м3/ч воздуха (р.у.) 4500 м3/ч 600м3/ч CO2 12%(об.) 5 1200 м3/ч Найти Пары бензола C6H6 4%(об.) 6 3000 м3/ч 9м3/ч NH3 0,1 кг/м3 0,005кг/м3 7 2700 м3/ч 8м3/ч NH3 4%(об.) 8 1800 м3/ч Найти SO2 7%(об.) 3 0,15%(об.) –– Уравнение равновесной линии Y = f(X) Коэффициент массопередачи Y* = 1,25X; кмоль/кмоль 2-ого комп. Y* = 1,15X кмоль/кмоль 2-ого комп. Y* = 1,68X; кмоль/кмоль 2-ого комп. Кг = 3,3 · 10-2 моль/(л·атм) Y* = 0,2X; кмоль/кмоль 2-ого комп Y* = 5,5 · 10-4X; кг/м3 Y* = 1,25X; кмоль/кмоль 2-ого комп. Кг = 5,34 моль/(л·атм) 3,6 кмоль/(м2*ч* моль.доля) 0,5 кмоль/(м2*ч* моль.доля) 0,4 кмоль/(м2*ч* моль.доля) Найти Найти 0,01 м/с 3,6 кмоль/(м2*ч* моль.доля) 0,005 кг/(м2*с* масс. доля) Продолжение таблицы – Варианты домашних заданий по теме «Абсорбция» № Расход вари- газовой анта смеси (р.у.) Расход орошающей жидк Абсорбтив 1000 кг/ч Ацетон CH3COCH3 10 500 м3/ч воздуха (р.у.) 500 м3/ч 7500 кг/ч 11 3000 м3/ч 12 13 9 14 15 Конц-я абсорб тива в газ. фазе на входе в аппарат 5% Конц-я абсорбтива в газ.фазе на выходе из аппарата –– Конц-я абсорбтива в жидк. фазе на выходе из аппарата –– SO2 5%(об.) –– –– 90% Найти 300м3/ч CO2 10%(об.) 0,2%(об.) –– –– 3500м2 3600 м3/ч 360 м3/ч CO2 10% 0,1% –– –– 4200м2 2400 м3/ч воздуха (р.у.) 3500 м3/ч 2500 кг/ч Метанол CH3OH 96г/м3 воздуха (р.у.) –– –– 96% 2400м2 Найти Пары бензола C6H6 2% –– 3000 кг/ч Метанол CH3OH 3 10-3кмоль/м3 воздуха (р.у.) –– 0,06 кмоль/кмоль поглотителя –– 3000 м3/ч воздуха (р.у.) Степень абсорбции 94% Площадь поверхности насадки Найти 95% 6500м2 93% Найти Уравнение равновесной линии Y = f(X) Коэффициент массопередачи Y* = 1,68X; кмоль/кмоль 2-ого комп Кг = 5,34 моль/(л·атм) 0,4 кмоль/(м2*ч* моль.доля) 0,005 кг/(м2*с* масс. доля) Найти Кг = 3,3 · 10-2 моль/(л·атм) Кг = 3,3 · 10-2 моль/(л·атм) Y* = 1,15X; кмоль/кмоль 2-ого комп. Y* = 0,2X; кмоль/кмоль 2-ого комп. Y* = 1,15X; кмоль/кмоль 2-ого комп. Найти Найти 0,5 кмоль/(м2*ч* моль.доля)