Перевод статьи Malaguarnera M., Cammalleri L., Gargante M.P.
реклама

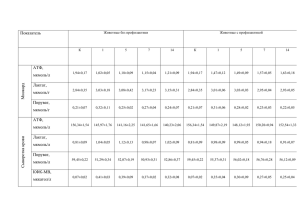
Перевод статьи Malaguarnera M., Cammalleri L., Gargante M.P., Vacante M., Colonna V., Motta M. L-carnitine treatment reduces severity of physical and mental fatigue and increases cognitive functions in centenarians: a randomized and controlled clinical trial // Am J Clin Nutr 2007; 86: 1738–44. Регулярный прием L-карнитина снижает тяжесть физического и умственного утомления и улучшает когнитивные способности долгожителей (в возрасте 100 и более лет): рандомизированное контролируемое клиническое исследование М. Малагуарнера, Л. Каммаллери, М.П. Гарганте, М. Ваканте, В. Колонна, М. Мотта Резюме Предпосылки. Долгожители отличаются слабостью, ослаблением умственного здоровья, сниженной подвижностью и выносливостью. L-карнитин – важный участник клеточного энергетического метаболизма. Цель. В этом исследовании мы поставили цель исследовать влияние L-карнитина на физическую и умственную утомляемость и когнитивные способности долгожителей (в возрасте ста и более лет). Характер исследования. Нами было проведено плацебо-контролируемое рандомизированное двойное слепое двухфазное исследование. Были привлечены шестьдесят шесть долгожителей, страдающих приступами утомления после даже легкой физической активности. Две группы получали 2 г левокарнитина ежедневно (n = 32) или плацебо (n = 34). Измерялись следующие параметры: изменения общей массы жира и общей мышечной массы, уровень сывороточного триацилглицерина, общего холестерина, холестерина липопротеинов высокой плотности, холестерина липопротеинов низкой плотности, оценка психического статуса по краткой шкале (MMSE), оценка повседневной активности, результаты шестиминутной локомоторной активности. Результаты. К концу периода исследований долгожители, принимавшие левокарнитин, в сравнении с контрольной группой, принимавшей плацебо, демонстрировали значительное улучшение следующих показателей: общая масса жира (–1,80 по сравнению с 0,6 кг; P < 0,01), общая мышечная масса (3,80 по сравнению с 0,8 кг; P < 0,01), плазматическая концентрация карнитина (12,60 по сравнению с –1,7 мкмоль; P < 0,001), плазматическая концентрация длинноцепочечного ацилкарнитина (LCAC) (1,50 по сравнению с –0.1 мкмоль; P < 0,01), плазматического карнитина с короткими радикалами (SCAC) (6,0 по сравнению с –1,5 мкмоль; P < 0,01). Значительные отличия были получены и для физического утомления (–4,10 по сравнению с –1,10; P < 0,01), умственного утомления (–2,70 по сравнению с 0,30; P < 0,001), остроты утомления (–23.60 по сравнению с 1,90; P < 0,001), MMSE (4,1 по сравнению с 0,6; P < 0,001) Выводы. Наше исследование показало, что пероральный прием левокарнитина вызывает снижение общей массы жира, увеличение общей массы мышц и приводит к увеличению физической и умственной активности благодаря снижению утомления и усилению когнитивных функций. Ключевые слова: L-карнитин, L-ацетилкарнитин, долгожители, утомление, когнитивные функции . Введение Старение характеризуется медленным снижением физиологических функций, прогрессирующим расстройством различных внутренних органов, приводящее к смерти. Есть основания предполагать, что эти дегенеративные процессы связаны со значительной утратой способности организма регулировать энергетический баланс [1, 2]. Митохондрии, в свете их важнейшей роли в производстве энергии, привлекали внимание исследователей, интересующихся комплексными изменениями организма, в связи с возрастными изменениями и старческими болезнями [3, 4]. Митохондрии отвечают за энергетический баланс клетки, с этим фактом согласуется гипотеза о связи между накоплением повреждений митохондриальной ДНК и возрастным снижением энергетического баланса и, вследствие этого, физической активности [5]. 1 Материал сайта www.carniton.ru. Копирование материалов данной страницы и их размещение на других сайтах разрешается только при условии установки активной гиперссылки на сайт www.carniton.ru. L-карнитин – эндогенное соединение, роль которого в энергетическом метаболизме клеток сложно переоценить. Карнитин представлен в организме повсеместно, но больше всего его в метаболически активных тканях, таких как миокард и скелетные мышцы. L-карнитин – необходимый транспортер жирных кислот с длинной цепью через внутреннюю мембрану митохондрий к месту окисления и образования энергии в форме АТФ [6, 7]. Среди соединений, чья концентрация снижается с возрастом, уменьшение концентрации карнитина представляется особенно серьезным, в связи с его участием в производстве клеточной энергии. Таким образом, важнейшим последствием недостатка карнитина является нарушение метаболических путей, ответственных за производство энергии. В нашем предыдущем исследовании прием карнитина пожилыми пациентами вызвал прогрессивное увеличение общей мышечной массы и значительное уменьшение мышечного утомления в сравнении с группой, принимавшей плацебо [8]. Среди пожилых пациентов были найдены вариации в плазматической концентрации карнитина, даже без видимых для того оснований. Действительно, концентрация карнитина существенно возрастает при введении у пациентов до 70 лет, а в дальнейшем имеет тенденцию к снижению вслед за индексом массы тела (кг/м2) и мышечной массой [9]. Целью данной работы являлось установление влияния Lкарнитина на физическое и умственное утомление и когнитивные функции долгожителей, достигших столетнего возраста. Объекты и методы Объекты Для исследований были привлечены 70 долгожителей в возрасте от 100 до 106 лет: 24 мужчины, 46 женщин. Прием L-карнитина осуществлялся в течение 6 месяцев. Тест Весселя (Wessely’s test) и тест Пауэлла (Powell’s test) были использованы для определения физического и умственного утомления; острота утомления определялась с помощью теста Круппа (Krupp’s test). Оценка тестов Весселя и Пауэлла состоит из двух шкал, соответствующих физическому утомлению (восемь слагаемых на шкале от 0 (нет утомления) до 2 (максимальное утомление); интервал значений 0–16) и умственному утомлению (пять слагаемых; интервал значений 0–16) [10]. Мы также использовали шкалу остроты утомления, состоящую из 9 слагаемых [11]. В этом тесте общая оценка находится в интервале от 9 до 63 и напрямую зависит от наблюдаемой остроты утомления. Определение статуса психического утомления по краткой шкале (MMSE) мы применяли для оценки когнитивных функций [12–14]. Оценка MMSE находится в пределах от 0 до 30. Описание исследования Данное исследование – рандомизированное двойное слепое плацебо-контролируемое – проводилось с 1999 по 2002 г., участники исследования – жители Сицилии – привлекались через бюро записи актов гражданского состояния. 70 долгожителей были в случайном порядке Мы исключали из исследования пациентов, если они перенесли серьезное медицинское или хирургическое вмешательство в течение предшествовавших исследованию трех месяцев, страдали серьезной сердечной недостаточностью [15], острой или хронической почечной недостаточностью, острыми респираторными, пищеварительными или когнитивными заболеваниями, страдали от сахарного диабета или других нарушений эндокринной системы. Также были исключены из исследования кандидаты, принимавшие кортикостероиды или диуретики. Данное исследование было разработано и осуществлено в соответствии с этическими принципами надлежащей клинической практики и Хельсинской декларации [16]. Протокол исследований был одобрен этической комиссией госпиталя Канниццаро (Катания, Италия). Сознательное согласие было получено от долгожителей или их родственников (в случаях неграмотности, проблем со слухом и зрением) до начала исследования. азделены на группы, принимающие левокарнитин и плацебо. Прием препарата проводился в течение 6 месяцев. Дополнительно через 6 месяцев после прекращения приема препарата была оценена выживаемость. Каждый месяц проводились 2 Материал сайта www.carniton.ru. Копирование материалов данной страницы и их размещение на других сайтах разрешается только при условии установки активной гиперссылки на сайт www.carniton.ru. перечисленные выше тесты, а также оценка Прерандомизационный этап Пациенты или их сиделки полностью документировали потребление калорий с помощью дневника каждые два дня. Это фаза была проведена для снижения влияния диеты на получаемые результаты. В течение двух недель пациенты (сиделки или медсестры) были проинструктированы Этап рандомизации В ходе всего исследования L-карнитин поставлялся в ампулах по 2 г и принимался перорально один раз в день. Все препараты и плацебо были внешне идентичны, и ни пациенты, ни персонал не были осведомлены о характере препарата до конца исследования. Инструкциями по дозировке сопровождалась каждая упаковка препарата. Было рекомендовано употреблять препараты в соответствии с Определение L-карнитина Отбор проб проводился утром между 8 и 10 часами, после ночного голодания, после опорожнения мочевого пузыря. Образцы венозной крови отбирались в пробирки с EDTA или гепарином, сыворотка или плазма получалась центрифугированием (2 000 × g в течение 5 минут при 25 ºС). Образцы мочи получали спустя 10 минут после сбора образцов крови. Сыворотка анализировалась немедленно, плазма и моча хранились при температуре –20 ºС вплоть до анализа. Концентрация L-карнитина в плазме и моче определялась по методу, описанному Cederblad and Lindstedt [17] и модифицированному Brass and Hoppel [18]. Плазма смешивалась с перхлорной кислотой (до конечной концентрации 3 %) и центрифугировалась в течение 2 минут при 10 000 × g при 25 ºС. Содержание длинноцепочечного ацилкарнитина (LCAC) в осадке определялось после щелочного гидролиза, а содержание свободного карнитина и Полезное действие В ходе фазы рандомизации для сбора информации трижды в неделю применялись алиментарные карты. Первичными параметрами полезного действия были изменения общей массы жира, общей мышечной массы, триацилглицерола, общего холестерина, холестерина липопротеинов высокой плотности и холестерина липопротеинов низкой плотности. Измерения проводились в начале и конце периода наблюдения. Образцы отбирались утром после ночного голодания. переносимости препарата. диетологом по возможности следовать диете, рекомендованной Национальной образовательной холестериновой программой. Пациенты проходили еженедельный контроль на предмет следования протоколу исследования, при этом измерялось давление и когнитивные функции, регистрировались побочные эффекты. предписанием. Мы считали, что пациенты следуют предписанию, если число возвращенных ампул было в пределах от 80 до 120 % от запланированного. В ходе всего исследования сопутствующие медицинские препараты принимались насколько возможно в минимальных терапевтических и неизменных дозах. ацилкарнитина с короткими радикалами (SCAC) измерялось в супернатанте. Коэффициенты вариации данных внутри выборки составляли 3,8; 3,9; 4,1 % соответственно. Между выборками коэффициенты вариации были 5,4; 5,8; 6,4 %. Суммирование всех трех значений давало значение общего ацилкарнитина. При анализе мочи преципитации перхлорной кислотой не проводили (длинноцепочечный ацилкарнитин в норме отсутствует в моче). В плазме определялось содержание свободного карнитина и ацилкарнитина с короткими радикалами. Внутри выборки коэффициенты вариации составили 4,1 % и 3,9 % соответственно, между выборками – 5,2 % и 5,8 %. Концентрация креатинина определялась с помощью кинетической калориметрической реакции в тех же образцах. Коэффициент вариации был 3,9 % внутри выборки и 5,4 % между выборками. Антропометрические данные были собраны в начале и конце периода наблюдения. Индекс массы тела рассчитывался, исходя из массы тела и роста. Для определения мышечной и жировой массы использовался метод биоэлектрического импеданса. Накануне измерения пациентам рекомендовалось воздерживаться от физической активности в течение 12 часов, употребления жидкостей в течение 4 часов, произвести акт мочеиспускания за 30 минут до тестирования. За пять минут до тестирования пациенты 3 Материал сайта www.carniton.ru. Копирование материалов данной страницы и их размещение на других сайтах разрешается только при условии установки активной гиперссылки на сайт www.carniton.ru. принимали лежачее положение. После обработки кожи 70 % спиртом четыре электрода (3 M Red Dot T; 3 M Health Care, Borken, Germany) закреплялись на поверхностях правой руки и правой ноги согласно рекомендациям производителя. Мы использовали генератор BioZ2 (Spengler, Paris, France). Вариабельность измерений составляла 0,003 кг для массы без жира (95 % ДИ: –0,2; 0,2). Физическое и умственное утомление, острота утомления и MMSE оценивались до и после курса применения препарата. Функциональный анализ был проведен с использованием индекса повседневной активности Катца (ADL; интервал значений: 0–6). ADL охватывает прогулки, прием пищи, использование ванны и туалета и одевание [19]. Оценка переносимости Лабораторные оценки переносимости были получены накануне исследования и ежемесячно до окончания испытаний. Данные включали содержание глюкозы в крови, общего холестерина, холестерина липопротеинов высокой плотности, триацилглицерина, креатининфосфокиназы, лактатдегидрогеназы, аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфотазы, креатинина и азота в крови. Плазма крови, взятая после ночного голодания, тестировалась на содержание глюкозы с помощью глюкозооксидазного метода. Содержание общего холестерина и триацилглицерина в сыворотке определялось энзиматически. Концентрация холестерина липопротеинов высокой плотности оценивалась кальциево-гепариновым методом. Сывороточный креатинин определялся с помощью реакции Яффе. Электрокардиограмма и измерение давления проводились по стандартным методикам. Физическая активность оценивалась еженедельно с помощью шестиминутного прогулочного теста (6MWT). Тест проводился по утрам после ночного голодания, в тихой комнате, при постоянной температуре 22 ± 2 ºC. Тестовая дистанция определялась как расстояние, которое пациенты могут пройти за шесть минут. Статистический анализ Для всех непараметрических данных дискретные и непрерывные переменные были оценены с помощью критерия Стьюдента или критерия Вилкоксона. Качественные переменные сравнивались с помощью критерия χ2 или критерия Фишера. Применялось программное обеспечение STATISTICAL ANALYSIS SYSTEM (6.11; SAS Institute, Cary, NC). Был проведен повторный двухфакторный анализ. В качестве эталонного стандарта для определения значимости результатов использовалась α = 0,05. В качестве первичной популяции для статистического анализа использовалась совокупная популяция пациентов. Результаты Начальные характеристики Начальные характеристики были поровну распределены между двумя группами отобранных пациентов. Достоверных различий между группами накануне курса приема препарата обнаружено не было (табл. 1). Сравнивая группы, мы обнаружили, что в домах престарелых проживали 87,5 % пациентов из группы, принимавшей карнитин, и 79,5 % из группы, принимавшей плацебо, доля остающихся в обществе составляла 12,5 % и 20,6 % соответственно, неграмотных – 46,9 % и 52,9 %, с нарушением зрения – 78,1 % и 64,7 %, с потерей слуха – 87,5 % и 58,8 %, с нарушением когнитивных функций – 50 % и 44,1 %, курильщиков и бывших курильщиков – 62,5 % и 52,9 %. Плазматические и клинические маркеры Содержание общего холестерина демонстрирует значительное падение в ходе приема L-карнитина (P < 0,01; 95 % ДИ: 0,17; 1,21) в сравнении с плацебо (табл. 2). L-карнитин в моче и плазме В карнитиновой группе в ходе приема препарата были обнаружены значительные изменения следующих параметров: плазматическая концентрация L-карнитина, плазматического LCAC (1.5 мкмоль/л) и SCAC (6.0 мкмоль/л). Значительных отличий концентрации карнитина в моче обнаружено не было. В группе, принимавшей плацебо, не было отмечено серьезных изменений плазматической 4 Материал сайта www.carniton.ru. Копирование материалов данной страницы и их размещение на других сайтах разрешается только при условии установки активной гиперссылки на сайт www.carniton.ru. концентрации свободного карнитина и LCAC, так же как и изменений уринальной экскреции карнитина и SCAC в ходе всех испытаний. По окончании периода исследований пациенты из карнитиновой группы продемонстрировали значительное улучшение в сравнении с пациентами, принимавшими плацебо, по следующим параметрам: плазматическая концентрация общего L-карнитина (12,6 по сравнению с –1,7 мкмоль/л), LCAC (1,5 по сравнению с –0,1 мкмоль/л) и SCAC (6,0 по сравнению с –1,50 мкмоль/л). Существенных отличий в уринальной концентрации карнитина между группами обнаружено не было (табл. 3). Физическая результативность и ежедневная активность В карнитиновой группе были обнаружены значительное изменение следующих параметров следующие значительные изменения по по сравнению с пациентами из контрольной истечении курса приема препарата. Общая группы: общая жировая масса (–1,80 по сравнению мышечная масса возросла на 3,8 кг. Общая с 0,6 кг), общая мышечная масса (3,80 по сравнению жировая масса уменьшилась на 1,8 кг; ADL с 0,8 кг), концентрация плазматического общего вырос на 0,5; 6MWT – 4,4 м. В контрольной карнитина (12,6 по сравнению с –1,7 мкмоль/л), группе физическая результативность и LCAC (1,5 по сравнению с –0,1 мкмоль/л), SCAC ежедневная активность остались на прежнем (6,0 по сравнению с –1,5 мкмоль/л), ADL (0,5 по уровне. сравнению с 0,1) и 6MWT (4,4 по сравнению с К концу периода исследований пациенты из 0,4) (табл. 4). карнитиновой группы продемонстрировали Утомление В карнитиновой группе, по сравнению со стартовыми, после окончания курса были обнаружены следующие значительные изменения: значения результатов тестов Весселя и Пауэлла по шкале физического утомления снизились на 4,10 пункта, по шкале умственного утомления – на 2,7. Значения остроты утомления снизились на 23,60. В контрольной группе соответствующие показатели в ходе курса не изменились. К концу периода наблюдений, в сравнении с контрольной группой, в группе пациентов, принимавших карнитин, произошли следующие изменения: снизилось физическое утомление (–4,10 и –1,10), умственное утомление (–2,70 и 0,03), острота утомления (–23,6 и 1,90) (табл. 4). Когнитивные функции В группе, принимавшей карнитин, в ходе исследований было отмечено значительное изменение MMSE на 4,10 пунктов. В контрольной группе подобных изменений обнаружено не было. В конце периода исследований изменение значения MMSE в карнитиновой группе значительно превышало изменение этого параметра в контрольной (4.10 по сравнению с 0,60) (табл. 4). Переносимость Из 70 случайно отобранных пациентов 3 отозвали согласие, 1 умер, 66 пациентов принимали препараты. В группе, принимавшей карнитин, 5 пациентов отказались закончить курс, 3 умерли (через 66, 121 и 156 дней после начала курса), у 1 были обнаружены побочные эффекты, 1 отозвал согласие. В контрольной группе 7 отказались закончить курс, 5 умерли (на 37, 65, 86, 95, 111-й дни приема препарата), у 1 были обнаружены побочные эффекты, 1 отозвал согласие. Обе группы были гомогенны по предварительным характеристикам и клиническим параметрам. В группе, принимавшей карнитин, 1 пациент отказался продолжать курс после приступа диареи (диарея была следствием приема карнитина). В контрольной группе у пациента развилась закупоренная хроническая бронхопневмопатия, и на этом основании курс был прекращен. В остальных случаях регулярный прием Lкарнитина переносился хорошо. Обсуждение Долгожители в возрасте ста и более лет характеризуются общей слабостью, снижением умственного здоровья, ослаблением физической активности, низкой выносливостью. Прием L5 Материал сайта www.carniton.ru. Копирование материалов данной страницы и их размещение на других сайтах разрешается только при условии установки активной гиперссылки на сайт www.carniton.ru. карнитина приводит к увеличению концентрации общего карнитина, SCAC и LCAC, которые динамически взаимодействуют с коэнзим Азависимыми биохимическими путями. Lкарнитин участвует в митохондриальном окислении жирных кислот [6] – главном источнике энергии при физической нагрузке [20]. Увеличение уровня карнитина может увеличить интенсивность окисления жирных кислот, снижая уровень окисления глюкозы и поддерживая мышечный гликоген в интактном состоянии, стимулируя, таким образом, образование АТФ. В нормальных условиях питания и у здоровых людей доступность L-карнитина не является лимитирующим фактором при βокислении. Однако добавление его в рацион долгожителей может иметь положительный эффект. Действительно, было показано, что Lкарнитин увеличивает общую мышечную массу, снижает общую массу жира и усиливает физическую активность. Карнитин усиливает физическую работоспособность посредством образования SCAC. Биоэнергетические потребности при физических нагрузках приводят к активации метаболического аппарата мышц [24, 25]. Прием карнитина увеличивает работоспособность (также и ежедневную активность), подтверждая, таким образом, что нарушения митохондриального гомеостаза могут послужить основой для развития таких симптомов, как утомление, депрессия и саркопения, наблюдаемых у долгожителей [26]. При пероральном введении карнитин усиливает работоспособность при выполнении упражнений высокой мышечной интенсивности. Положительный эффект от приема карнитина не ограничивается метаболизмом скелетных мышц, но также наблюдается в миокарде [27, 28]. Действительно, применение карнитина приводит к увеличению содержания карнитина в тканях, восстанавливает карнитиновые потери и снижает остроту симптомов при ишемических повреждениях [29, 30]. В тканях мозга карнитин осуществляет транспорт ацетильных остатков из митохондрий в цитозоль, участвуя таким образом в синтезе ацетилхолина и ацетилкарнитина [31, 32]. Нейробиологические эффекты ацетилкарнитина включают прямое влияние на энергетический метаболизм и метаболизм фосфолипидов, клеточных макромолекул (таких как нейротрофные факторы и нейрогормоны), синапсическую морфологию и передачу многочисленных нейротрансмиттеров [33, 34]. Наше исследование имеет несколько ограничений. Анализ наших данных не учитывает некоторых традиционных рисков, таких как дислипидемия и курение. Они, как нам кажется, перестают играть роль в группах долгожителей в возрасте 100 и более лет, которые находятся скорее на заключительных клинических стадиях, а не представляют популяцию, подверженную традиционным рискам. Другим ограничением является включение в исследуемую группу пациентов с умеренными когнитивными нарушениями, расстройствами зрения и слуха, а также неграмотных пациентов. Эти обстоятельства значительно ограничивают их способности давать аккуратные ответы во время интервью. Однако долгожители всегда использовали помощь родственников, медсестер или сиделок. В нашем исследовании, по сравнению с первоначальными данными, мы изучали не только изменения физического и умственного утомления, но и когнитивные функции. В нашей предыдущей работе мы обнаружили, что прием экзогенного карнитина пожилыми пациентами ассоциирован с увеличением мышечной массы и значительным снижением физического утомления в сравнении с контролем [8]. Положительный эффект карнитина на восстановление сердечной функции при ишемии не может быть объяснен с позиции стимуляции только окисления жирных кислот. Прием L-карнитина увеличивает не только концентрацию плазматического L-карнитина, но и концентрацию ацетилкарнитина в плазме крови. Более того, благотворное действие Lкарнитина на центральную нервную систему может замедлить ухудшение когнитивных функций, представляющее собой результат нормального физиологического старения нервных клеток. Карнитин увеличивает систолический объем и улучшает мышечную функцию [26, 29]. У долгожителей мы наблюдали стабильную уринальную экскрецию общего карнитина и его ацетилированных форм. Вероятно, это связано с различиями в тканевых потребностях в этих соединениях и их способностями к синтезу карнитина [35]. Различия в накоплении и метаболизме карнитина между тканями (печени, почек, сердца, скелетных мышц, мозга и поджелудочной железы) и 6 Материал сайта www.carniton.ru. Копирование материалов данной страницы и их размещение на других сайтах разрешается только при условии установки активной гиперссылки на сайт www.carniton.ru. возможная нестабильная экскреция могут объяснить отсутствие корреляции между содержанием карнитина в крови и моче наших пациентов. Введение L-карнитина увеличивает систолический объем, усиливает мышечную функцию и замедляет развитие расстройств когнитивных функций [31, 36]. Наши исследования свидетельствуют, что прием левокарнитина приводит к уменьшению общей массы жира, увеличивает мышечную массу, усиливает способности к физической и когнитивной активности, благодаря снижению утомления и усилению когнитивных функций. Приложение Таблица 1. Значения основных параметров и плазматических переменных перед началом приема препарата Возраст (лет) Пол (n) Мужчин Женщин Систолическое давление (мм рт. ст.) Диастолическое давление (мм рт. ст.) Частота сердечных сокращений (уд./мин) Индекс массы тела (кг/м2) Уринальный азот (мкмоль/л) Плазматический креатинин (мкмоль/л) Плазматическая глюкоза (мкмоль/л) Общий холестерин (мкмоль/л) HDL-холестерин (мкмоль/л) Триацилглицерин (мкмоль/л) Креатинфосфокиназа (мкмоль/л) Лактатдегидрогеназа (мкмоль/л) L-карнитин (n = 32) 101 ± 1,32 Плацебо (n = 34) 101 ± 1,4 10 22 155 ± 24,2 86,2 ± 10,1 88 ± 10 11 23 154 ± 25,1 84.7 ± 10,3 87 ± 12 22,2 ± 4,7 7,42 ± 3,14 95,47 ± 49,50 4,44 ± 1,45 4,87 ± 1,01 1,27 ± 0,21 1,51 ± 0,63 45,4 ± 18,2 341,2 ± 44,6 22.6 ± 4.1 7.01 ± 3.50 84.86 ± 61.88 4.68 ± 1.13 4.79 ± 1.04 1.22 ± 0.21 1.47 ± 0.64 44 ± 20,1 356 ± 40,2 Таблица 2. Сравнение плазматических переменных и клинических маркеров между тестируемыми группами Систолическое давление (мм рт. ст.) Диастолическое давление (мм рт. ст.) Частота сердечных сокращений (уд./мин) Индекс массы тела (кг/м2) Общий холестерин (мкмоль/л) HDL-холестерин (мкмоль/л) Триацилглицерин (мкмоль/л) Плазматический креатинин (мкмоль/л) Уринальный азот (мкмоль/л) Плазматическая глюкоза (мкмоль/л) Креатинфосфокиназа (мкмоль/л) Лактатдегидрогеназа (мкмоль/л) L-карнитин (n = 32) До После 158,2 ± 22,1 156,1 ± 21,8 Плацебо (n = 34) До После 151,4 ± 23,8 152,1 ± 24,7 81,4 ± 11,1 80,2 ± 12,8 83,2 ± 10,7 82,8 ± 11,9 85 ± 9 86 ± 8 84 ± 10 87 ± 8 22,3 ± 4,6 4,79 ± 1,06 1,24 ± 0,10 1,59 ± 0,44 93,70 ± 44,2 7,65 ± 2,89 4,65 ± 1,02 45,1 ± 19,3 358,1 ± 36,71 23,4 ± 4,2 4,10 ± 1,02 1,28 ± 0,11 1,50 ± 0,38 90,17 ± 53,92 7,47 ± 2,97 4,39 ± 1,04 40,2 ± 18,2 354,2 ± 38,2 22,8 ± 4,7 4,84 ± 1,04 1,27 ± 0,21 1,61 ± 0,45 84,86 ± 60,11 7,19 ± 3,34 4,67 ± 1,08 43,8 ± 19,4 354,1 ± 36,82 22,8 ± 43,1 4,69 ± 1,043 1,27 ± 0,23 1,60 ± 0,46 79,56 ± 62,76 7,27 ± 3,25 4,65 ± 1,01 42,2 ± 18,7 351,6 ± 39,6 7 Материал сайта www.carniton.ru. Копирование материалов данной страницы и их размещение на других сайтах разрешается только при условии установки активной гиперссылки на сайт www.carniton.ru. Таблица 3. Сравнение плазматических и уринальных концентраций L-карнитина между тестируемыми группами Плацебо (n = 34) До После L-карнитин (n = 32) До После Свободный плазматический карнитин (мкмоль/л) Плазматические SCAC (мкмоль/л) Плазматические LCAC (мкмоль/л) Общий плазматический карнитин (мкмоль/л) Свободный уринальный карнитин (мкмоль/л) 41,8 ± 7,73 49,2 ± 17,6 40,3 ± 8,4 43,3 ± 10,7 P для P для групп времени2 X время2 < 0,05 NS 10,3 ± 5,1 2,8 ± 0,7 55,2 ± 9,9 16,3 ± 13,04 4,3 ± 1,84 67,8 ± 29,94 10,1 ± 5,4 3,0 ± 0,8 53,4 ± 12,5 8,6 ± 2,95 3,1 ± 0,95 55,1 ± 12,05 < 0,01 < 0,001 < 0,05 < 0,001 < 0,001 < 0,05 15,8 ± 9,6 16,7 ± 8,7 14,9 ± 10,6 13,2 ± 10,1 NS NS Уринальные SCAC (мкмоль/л) 12,8 ± 7,1 13,2 ± 7,4 13,1 ± 9,4 12,0 ± 9,0 NS NS Таблица 4. Сравнение физических и умственных маркеров и клинических характеристик между тестируемыми группами Плацебо (n = 34) До После L-карнитин (n = 32) До После Общая жировая масса (кг) Общая масса без жира (кг) Физическое утомление (0–16) Умственное утомление (0–16) Острота утомления (9–63) MMSE (0–30) ADL 6MWT (м) 3 21,4 ± 3,8 35,1 ± 3,2 12,9 ± 2,6 7,5 ± 2,1 54,2 ± 5,6 16,4 ± 3,6 3,1 ± 0,4 10,2 ± 3,8 4 19,6 ± 3,9 38,9 ± 3,94 8,8 ± 2,44 4,8 ± 1,74 30,6 ± 9,44 20,5 ± 2,94 3,6 ± 0,54 14,6 ± 3,94 21,2 ± 3,6 35,4 ± 3,5 12,7 ± 2,4 7,4 ± 2,3 53,8 ± 5,2 16,6 ± 2,9 2,9 ± 0,6 10,8 ± 3,4 P для 5 21,8 ± 3,4 36,2 ± 3,95 11,6 ± 2,55 7,1 ± 2,05 51,9 ± 7,65 17,2 ± 2,85 3,0 ± 0,45 11,2 ± 3,45 времени2 NS < 0,001 < 0,001 < 0,001 < 0,001 < 0,001 < 0,001 < 0,001 P для групп X время2 < 0,01 < 0,01 < 0,001 < 0,001 < 0,001 < 0,001 < 0,01 < 0,001 Литература 1. Malaguarnera M., Pistone G., Motta M. Mythology in medicine: the elderly and quality of life. Br Med J 1995; 311: 1136. 6. Brenner R.R. Essential fatty acids: its transformations and functions Arch Latinoam Nutr 1983; 33: 735–47. 2. Motta M., Bennati E., Ferlito L., Malaguarnera M., Motta L. Italian Multicenter Study on Centenarians (IMUSCE). Successful aging in centenarians: myths and reality. Arch Gerontol Geriatr 2005; 40: 241–51. 3. Liu J., Head E., Kuratsune H., Cotman C.W., Ames B.N. Comparison of the effects of L-carnitine and acetyl-L-carnitine on carnitine levels, ambulatory activity, and oxidative stress biomarkers in the brain of old rats. Ann N Y Acad Sci 2004; 1033: 117–31. 7. Long C.S., Haller R.G., Foster D.W., McGarry J.D. Kinetics of carnitinedependent fatty acid oxidation: implications for human carnitine deficiency. Neurology 1982; 32: 663–6. 4. Hagen T.M., Ingersoll R.T., Wehr C.M. et al. Acetyl-L-carnitine fed to old rats partially restores mitochondrial function and ambulatory activity. Proc Natl Acad Sci USA 1998; 95: 9562–6. 5. Wallace D.C. Mitochondrial paradigm of metabolic and degenerative diseases, aging, and cancer: a dawn for evolutionary medicine. Annu Rev Genet 2005; 39: 359–407. 8. Pistone G., Marino A., Leotta C., Dell’arte S., Finocchiaro G., Malaguarnera M. Levocarnitine administration in elderly subjects with rapid muscle fatigue. Drugs Aging 2003; 20: 761–7. 9. Malaguarnera M., Pistone G., Receputo G. et al. Serum carnitine levels in centenarians. Clin Drug Invest 1999; 17: 321–7. 10. Wessely S, Powell R. Fatigue syndromes: a comparison of chronic “postviral” fatigue with neuromuscular and affective disorders. J Neurol Neurosurg Psych 1989; 52: 940–8. 11. Krupp L.B., La Rocca N.G., Muir-Nash J., Steinberg A.D. The fatigue severity scale. Application to patients with multiple sclerosis and systemic lupus erythematosus. Arch. Neurol 1989; 46: 1121–3. 8 Материал сайта www.carniton.ru. Копирование материалов данной страницы и их размещение на других сайтах разрешается только при условии установки активной гиперссылки на сайт www.carniton.ru. 12. Folstein M.F., Folstein S.E., McHugh P.R. «Mini Mental State» a practical method for grading the cognitive state of patients for the cognitive state of patients for the clinician. J Psychiatr Research 1975; 12: 189–98. 13. Maugeri D., Santangelo A., Abbate S. et al. Correlation between the bone mass, psychometric performances and the levels of autonomy and autosufficiency in an elderly Italian population above 80 years of age. Arch Gerontol Ger 2001; 33: 265–271. 14. Malaguarnera M., Pistone G., Motta M., Lo Manto P.C., Di Fazio I. Assessment of self-sufficiency in ultraoctogenarians. Arch Gerontol Geriatr 1996; 22(suppl): 505–8. 15. Hurst J.W., Morris D.C., Alexander R.W. The use of the New York Heart Association’s classification of cardiovascular disease as a part of the patient’s complete problem list. Clin Cardiol 1999; 22: 385–90. 16. World Medical Association Declaration of Helsinki. Recommendations guiding physicians in biomedical research involving human subjects. JAMA 1997; 277: 925–6. 33. Pettegrew J.W., Levine J., McClure R.J. Acetyl-L-carnitine physicalchemical, metabolic and therapeutic properties: relevance for its mode of action in Alzheimer’s disease and geriatric depression. Mol Psychiatry 2000; 5: 616–32. 34. Virmani A., Binienda Z. Role of carnitine esters in brain neuropathology. Mol Aspects Med 2004; 25: 533–49. 35. Rodrigues B., Xiang H., McNeill J.H. Effect of L-carnitine treatment on lipid metabolism and cardiac performance in chronically diabetic rats. Diabetes 1988; 37: 1358–64. 36. Liu J., Head E., Gharib A.M. et al. Memory loss in old rats is associated with brain mitochondrial decay and RNA/DNA oxidation partial reversal by feeding acetyl-L-carnitine and/or R-lipoic acid. Proc Natl Acad Sci USA 2002; 99: 2356–61. 17. Cederblad G., Lindstedt S. Amethod for the determination of carnitine in the picomole range. Clin Chim Acta 1972; 37: 235–43. 18. Brass E.P., Hoppel C.L. Carnitine metabolism in the fasting rat. J Biol Chem 1978; 253: 2688–93. 19. Katz S., Ford A.B., Moskowitz R.W., Jackson B.A., Jafee M.W. Studies of illness in the aged: the index of ADL: the standardized measure of biological and psychosocial function. JAMA 1963; 185: 914–9. 20. Hiatt W.R., Regensteiner J.G., Wolfel E.E., Ruff L., Brass E.P. Carnitine and acylcarnitine metabolism during exercise in humans. Dependence on skeletal muscle metabolic state. J Clin Invest 1989; 84: 1167–73. 21. Brass E.P., Hoppel C.L., Hiatt W.R. Effect of intravenous Lcarnitine on carnitine homeostasis and fuel metabolism during exercise in humans. Clin Pharmacol Ther 1994; 55: 681–92. 22. Brass E.P. Overview of coenzyme A metabolism and its role in cellular toxicity. Chem Biol Interact 1994; 90: 203–14. 23. Brass E.P., Hiatt W.R. Carnitine metabolism during exercise. Life Sci 1994; 54: 1383–93. 24. Paradies G., Ruggiero F.M., Petrosillo G., Gadaleta M.N., Quagliariello E. Effect of aging and acetyl-L-carnitine on the activity of cytochromeoxidase and adenine nucleotide translocase in rat heart mitochondria. FEBS Lett 1994; 350: 213–5. 25. Paradies G., Petrosillo G., Gadaleta M.N., Ruggiero F.M. The effect of aging and acetyl-L-carnitine on the pyruvate transport and oxidation in rat heart mitochondria. FEBS Lett 1999; 454: 207–9. 26. Malaguarnera M., Di Mauro A., Gargante M.P., Rampello L.Lcarnitine reduces severity of physical and mental fatigue and improves daily activities in the elderly. South Med J 2006; 99: 315–6. 27. Siliprandi N., Di Lisa F., Menabo R., Ciman M., Sartorelli L. Transport and functions of carnitine in muscles. J Clin Chem Clin Biochem 1990; 28: 303–6. 28. Vecchiet L., Di Lisa F., Pieralisi G. et al. Influence of Lcarnitine administration on maximal physical exercise. Eur J Appl Physiol Occup Physiol 1990; 61: 486–90. 29. Brevetti G., Angelini C., Rosa M. et al. Muscle carnitine deficiency in patients with severe peripheral vascular disease. Circulation 1991; 84: 1490–5. 30. Liu B., El Alaoui-Talibi Z., Clanachan A.S., Schulz R., Lopaschuk G.D. Uncoupling of contractile function from mitochondrial TCA cycle activity and MVO2 during reperfusion of ischemic hearts. Am J Physiol 1996; 270: H72–80. 31. Montgomery S.A., Thal L.J., Amrein R. Meta-analysis of double blind randomized controlled clinical trials of acetyl-L-carnitine versus placebo in the treatment of mild cognitive impairment and mild Alzheimer’s disease. Int Clin Psychopharmacol 2003; 18: 61–71. 32. Nalecz K.A., Nalecz M.J. Carnitine-a known compound, a novel function in neural cells. Acta Neurobiol Exp (Wars) 1996; 56: 597–609. 9 Материал с сайта www.carniton.ru