109. Спектральные закономерности В середине XVIII в. Г
реклама
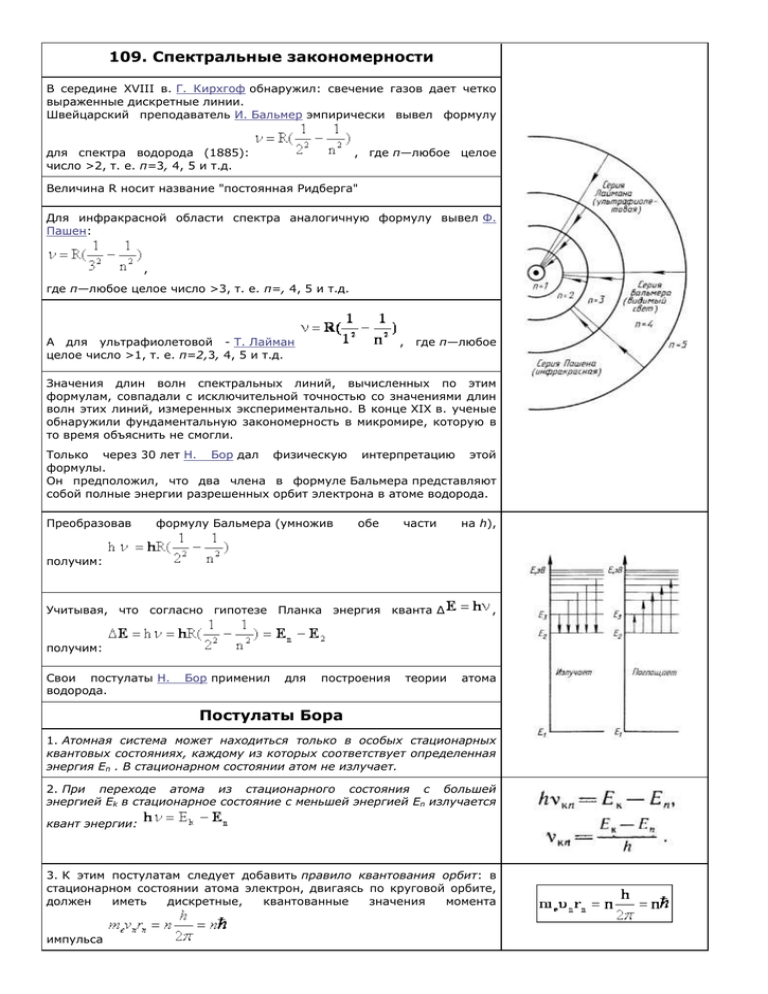
109. Спектральные закономерности В середине XVIII в. Г. Кирхгоф обнаружил: свечение газов дает четко выраженные дискретные линии. Швейцарский преподаватель И. Бальмер эмпирически вывел формулу для спектра водорода (1885): число >2, т. е. п=3, 4, 5 и т.д. , где п—любое целое Величина R носит название "постоянная Ридберга" Для инфракрасной области спектра аналогичную формулу вывел Ф. Пашен: , где п—любое целое число >3, т. е. п=, 4, 5 и т.д. А для ультрафиолетовой - Т. Лайман целое число >1, т. е. п=2,3, 4, 5 и т.д. , где п—любое Значения длин волн спектральных линий, вычисленных по этим формулам, совпадали с исключительной точностью со значениями длин волн этих линий, измеренных экспериментально. В конце XIX в. ученые обнаружили фундаментальную закономерность в микромире, которую в то время объяснить не смогли. Только через 30 лет Н. Бор дал физическую интерпретацию этой формулы. Он предположил, что два члена в формуле Бальмера представляют собой полные энергии разрешенных орбит электрона в атоме водорода. Преобразовав формулу Бальмера (умножив обе части на h), получим: Учитывая, что согласно гипотезе Планка энергия кванта Δ , получим: Свои постулаты Н. водорода. Бор применил для построения теории атома Постулаты Бора 1. Атомная система может находиться только в особых стационарных квантовых состояниях, каждому из которых соответствует определенная энергия Еn . В стационарном состоянии атом не излучает. 2. При переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En излучается квант энергии: 3. К этим постулатам следует добавить правило квантования орбит: в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса где rn радиус n-ой орбиты; vn—скорость электрона на этой орбите; me— масса электрона, п—целое число - номер орбиты или главное квантовое число. Модель атома водорода по Бору На электрон со стороны ядра действует кулоновская сила, сообщая ему центростремительное ускорение. Поэтому Из правила квантования: Подставляя уравнение для скорости электрона на орбите в предыдущее, получим: , где n=1,2,3... Если п=1, а r1 =0,5-10-10 м, то r2=r1.n2=4r1, r3=9r1 и т.д. Т.о. или rn~n2. Полная энергия атома равна: Подставляя выражение Е = Ek + Eп для радиуса стационарной орбиты, получим: Знак "-" говорит о том, что между электроном и ядром действуют силы притяжения. Переход электрона с более высокой орбиты k на провождается излучением фотона с частотой: орбиту п со- Таким образом, мы пришли к формуле Бальмера, где - постоянная Ридберга. Трудности теории Бора Правило квантования Бора применимо не всегда, представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось условным. Теория Бора неприменима для многоэлектронных атомов и не объясняет ряд спектральных закономерностей. В 1917 г. А. Эйнштейн предсказал возможность перехода атома с высшего энергетического состояния в низшее под влиянием внешнего воздействия. Такое излучение называется вынужденным излучением и лежит в основе работы лазеров.










![Контроль успеваемости [DOC, 84 КБ]](http://s1.studylib.ru/store/data/001004896_1-12012c63987a773bbf70c98f71a56fe6-300x300.png)
