Тема занятия: Химические свойства аминов
реклама
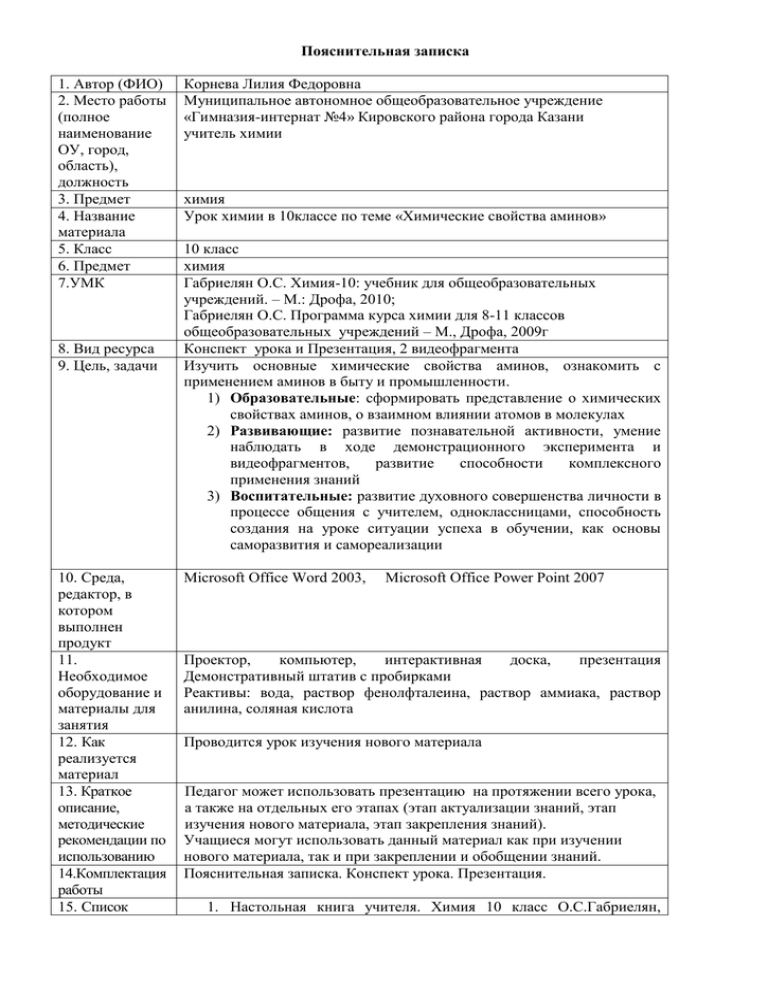
Пояснительная записка 1. Автор (ФИО) 2. Место работы (полное наименование ОУ, город, область), должность 3. Предмет 4. Название материала 5. Класс 6. Предмет 7.УМК 8. Вид ресурса 9. Цель, задачи 10. Среда, редактор, в котором выполнен продукт 11. Необходимое оборудование и материалы для занятия 12. Как реализуется материал 13. Краткое описание, методические рекомендации по использованию 14.Комплектация работы 15. Список Корнева Лилия Федоровна Муниципальное автономное общеобразовательное учреждение «Гимназия-интернат №4» Кировского района города Казани учитель химии химия Урок химии в 10классе по теме «Химические свойства аминов» 10 класс химия Габриелян О.С. Химия-10: учебник для общеобразовательных учреждений. – М.: Дрофа, 2010; Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений – М., Дрофа, 2009г Конспект урока и Презентация, 2 видеофрагмента Изучить основные химические свойства аминов, ознакомить с применением аминов в быту и промышленности. 1) Образовательные: сформировать представление о химических свойствах аминов, о взаимном влиянии атомов в молекулах 2) Развивающие: развитие познавательной активности, умение наблюдать в ходе демонстрационного эксперимента и видеофрагментов, развитие способности комплексного применения знаний 3) Воспитательные: развитие духовного совершенства личности в процессе общения с учителем, одноклассницами, способность создания на уроке ситуации успеха в обучении, как основы саморазвития и самореализации Microsoft Office Word 2003, Microsoft Office Power Point 2007 Проектор, компьютер, интерактивная доска, презентация Демонстративный штатив с пробирками Реактивы: вода, раствор фенолфталеина, раствор аммиака, раствор анилина, соляная кислота Проводится урок изучения нового материала Педагог может использовать презентацию на протяжении всего урока, а также на отдельных его этапах (этап актуализации знаний, этап изучения нового материала, этап закрепления знаний). Учащиеся могут использовать данный материал как при изучении нового материала, так и при закреплении и обобщении знаний. Пояснительная записка. Конспект урока. Презентация. 1. Настольная книга учителя. Химия 10 класс О.С.Габриелян, используемых источников 2. 3. 4. 5. 6. И.Г.Остроумов Готовимся к ЕГЭ- 2012. Тематические тесты В.Н.Доронькин Химия «Контрольные и проверочные работы» к учебнику О.С.Габриеляна. «Начала химии» Н.Е.Кузьменко Журнал «Химия в школе» http://files.school-collection.edu.ru/dlrstore/a46afba6-f788-60c40552-7216670bfd66/index.htm Конспект урока Тема занятия: Химические свойства аминов. Используемая образовательная система (методика, технология): реализация компетентностного подхода к обучению химии через использование компьютерной презентации, интерактивной доски, видеофрагментов, демонстрационных опытов как средств активизации познавательной деятельности учащихся. Используемый учебник: О.С.Габриелян «Химия», 10 класс, издательство «Дрофа» Цели и задачи урока: Изучить основные химические свойства аминов, ознакомить с применением аминов в быту и промышленности. 4) Образовательные: сформировать представление о химических свойствах аминов, о взаимном влиянии атомов в молекулах 5) Развивающие: развитие познавательной активности, умение наблюдать в ходе демонстрационного эксперимента и видеофрагментов, развитие способности комплексного применения знаний 6) Воспитательные: развитие духовного совершенства личности в процессе общения с учителем, одноклассницами, способность создания на уроке ситуации успеха в обучении, как основы саморазвития и самореализации Оборудование: Интерактивная доска StarBoard Notebook Проектор Демонстративный штатив с пробирками Реактивы: вода, раствор фенолфталеина, раствор аммиака, раствор анилина, соляная кислота Дидактические средства: Презентация Power Point Демонстрационные опыты Видеоролики Тесты Использованная литература: 7. Настольная книга учителя. Химия 10 класс О.С.Габриелян, И.Г.Остроумов 8. Готовимся к ЕГЭ- 2012. Тематические тесты В.Н.Доронькин 9. Химия «Контрольные и проверочные работы» к учебнику О.С.Габриеляна. Базовый уровень 10. «Начала химии» Н.Е.Кузьменко 1. Организационный момент Цели и задачи учителя: Создать мотивационно-целевую установку на изучение нового материала 1) Образовательные: на основание ранее изученного материала показать зависимость свойств аминов от их строения 2) Развивающие: развитие способности комплексного применения знаний, умение анализировать, сравнивать, обобщать 3) Воспитательные: способствовать оценивать свою учебную деятельность, развитие на уроке ситуации успеха Цель для учащихся: мотивация на изучение нового материала Метод организации работы учащихся: объяснительно-иллюстративный Учитель приветствует учащихся, на интерактивной доске выводится тема урока, определяются цели урока 2. Актуализация знаний Цели и задачи учителя: Определить степень усвоения материала предыдущей темы 1) Образовательные: скорректировать знания и умения по пройденному материалу 2) Развивающие: имея хорошее представление о строении аминов, функциональной группе, понятиях гомологии и изомерии, способах получения аминов, развить способность предсказывания некоторых свойств аминов 3) Воспитательные: научить систематически работать, выработка чувства ответственности, стремления добиться лучших результатов, воспитать целеустремленность, настойчивость и трудолюбие Цель для учащихся: Закрепление знаний о строении аминов, о функциональной группе аминов, о классификации аминов, изомерии, физических свойствах, методах получения аминов Критерии достижения целей и задач: Учащиеся должны иметь хорошее представление о строении аминов, функциональной группе аминов, о понятиях гомологии и изомерии, о физических свойствах, методах получения аминов, должны знать взаимное влияние атомов в молекулах Метод организации деятельности учащихся: Письменный контроль знаний с помощью тестов, в которых представлены тесты с выбором 1 правильного ответа, тесты с множественным выбором правильных ответов. Представлено 6 вопросов, 3 варианта для дифференцированного оценивания знаний. Критерии оценивания: Представлено 6 вопросов, 1-5 вопросы оцениваются по 1 баллу, 6 вопрос в 2 балла. 6-7 баллов «5» 5 баллов «4» 4 балла «3» Менее 4 баллов «2» Вариант 1 Выберите один правильный ответ 1. Амином является вещество, формула которого: А. CH3OH B. CH3NO2 C. CH3NH2 D. CH3COOH 2. Первичным амином является: A. Диметиламин B. Метиламин C. Триметиламин D. Метилэтиламин 3. Свойство нехарактерное для метиламина: A. Аммиачный запах B. Хорошая растворимость в воде C. Жидкое агрегатное состояние D. Горючесть 4. Реакцию промышленного получения анилина из нитробензола осуществил A. А.Бутлеров B. М.Кучеров C. Н.Зинин D. С.Лебедев 5. Гомологами являются вещества: A. Этиламин и метиламин B. Нитроэтан и метиламин C. Нитробензол и анилин D. Анилин и нитроэтан Выберите правильные ответы 6. Метиламин ….. A. не имеет запаха B. является донором C. реагирует с этаном D. изменяет окраску лакмуса на синий E. горит F. проявляет амфотерность Вариант 2 Выберите один правильный ответ 1 . Формула гомолга этиламина А. C6H5NH2 B. C3H7NO2 C. C3H7NH2 D. CH3-NH-CH3 2. Утверждение, соответствующее характеристике фениламина: A. Используется для производства красителей B. Имеет газообразное агрегатное состояние C. Хорошо растворим в воде D. Имеет запах аммиака 3. Название вещества, формула которого CH3-NH-CH2-CH3 A. Диметиламин B. Метилэтиламин C. Диэтиламин D. Фениламин 4. Ученый, который получил анилин в 1842 году A. А. Бутлеров B. Д.Менделеев C. П.Бертло D. Н.Зинин 5. Третичным амином является A. Диметиламин B. Метиламин C. Метилэтиламин D. Метилдиэтиламин Выберите правильные ответы 6. Метиламин …. A. проявляет основные свойства B. имеет окраску C. газообразное вещество D. реагирует с водой E. реагирует с этиламином F. проявляет амфотерные свойства Проводится анализ работы, эталон ответов представляется на доске. Обсуждаются вопросы, вызвавшие затруднения фронтально, либо с вовлечением в процесс учащихся правильно справившихся со всеми вопросами. Эталон ответов: 5. A Вариант 1 1. C 6. BDE 2. B Вариант 2 3. C 1. C 4. C 2. B 3. B 4.D 5. D 6. ACD 3. Изучение нового материала Цели и задачи учителя: Рассмотреть основные химические свойства аминов в сравнении со свойствами аммиака, ознакомить с применением аминов в быту и в промышленности 1) Образовательные: создать условия для воспроизведения знаний и умений по теме, обучить химические свойства аминов, их применение, 2) Развивающие: создать условия для поиска взаимосвязи между ранее изученным материалом о свойствах и строении аммиака, об электронном строении ароматических углеводородов и их производных, аминов и изученным материалом – химическими свойствами аминов, развитие логического мышления, умений приобретать знания не памятью, а мыслью 3) Воспитательные: создать условия для формирования культуры умственного и практического труда, интереса к знаниям, умение проводить самооценку Цели, поставленные перед учащимися: Изучить основные химические свойства аминов в сравнении с аммиаком, научиться составлять химические уравнения реакций, доказывающие основные свойства аминов Методы организации деятельности учащихся: 1) Объяснительно-иллюстративный метод – используя презентацию, интерактивную доску 2) Практический метод – демонстрационный опыт, видеофрагменты 3) Эвристический метод – изучение химических свойств аминов проходит в сравнении со свойствами аммиака, учащиеся самостоятельно при помощи учителя заполняют таблицу 4) Проблемный метод Форма организации учебной деятельности: фронтальная Основные положения нового учебного материала: Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства, т. к. имеют неподелённую электронную пару на азоте. Рассматривая свойства аминов давайте сопоставим их со свойствами аммиака и запишем в виде таблицы. Используя презентацию и интерактивную доску, учащиеся заполняют таблицу по ходу урока. Повторим с учащимися строение молекулы аммиака. (Опорные знания учащихся, отвечают учащиеся) Строение молекулы аммиака – связь ковалентная полярная, образована за счёт спаривания электронов и образования общих электронных пар. В молекуле аммиака из пяти валентных электронов атома азота три участвуют в образовании ковалентных связей с атомами водорода, одна электронная пара остаётся свободной. Электронное строение аминов аналогично строению аммиака. У атома азота в них так же имеется неподелённая пара электронов. Познакомившись на прошлом уроке со строением аминов, учащиеся приходят к выводу, что электронное строение аминов аналогично строению аммиака. У атома азота в них так же имеется неподелённая пара электронов. Учитель просит обратить внимание на неподеленную электронную пару. Учащиеся вспоминают, что в водном растворе неподеленная электронная пара атомов азота взаимодействует с протоном и присоединяет его. Причем химическая связь возникает не за счёт спаривания электронов двух атомов, а по донорно-акцепторному механизму: азот (донор) предоставляет протону (акцептору) в общее пользование свою пару электронов. В результате молекула аммиака превращается в катион аммония, а в растворе накапливаются гидроксид-ионы, обуславливая щелочную среду водного раствора аммиака. В таблицу записывают реакцию взаимодействия с водой, указывая среду реакции. Рассматриваем амины в аналогии с аммиаком. Атомы азота в молекулах аминов также имеют неподелённую пару электронов. Пространственное строение аминов, также как и в случае аммиака, не препятствует взаимодействию протона с неподелённой парой электронов атома азота. Очевидно, это сказывается на их свойствах ,при взаимодействии аминов с водой образовались гидроксид -ионы. Учащиеся записывают уравнение реакции на примере метиламина, показывая, как образуется новая NH связь (по донорно-акцепторному механизму) и ионы метиламмония и гидроксид -ионы. По записанным уравнениям учащиеся делают вывод, что амины, так же как и аммиак проявляют основные свойства. Химические свойства Диссоциация Взаимодействие с кислотами Аммиак При добавлении соляной кислоты к раствору аммиака появляется белый дым - выделяется соль - хлорид аммония. NH3 + HCl = NH4Cl↑ Добавление азотной кислоты в стакан с аммиаком приводит к появлению белого нитрата аммония. NH3 + HNO3 = NH4 NO3↓ При добавлении серной кислоты появляются белые кристаллы сульфата аммония. 2NH3 + H2SO4 = (NH4)2SO4↓ реакции горения 4NH3 + 3O2= 2N2 + 6H2O Амины Следующее свойство иллюстрирует способность аминов взаимодействовать с кислотами . С2Н5NH2 + HCI = [С2Н5NH3] CI 2.(СН3)2NH + HCI = [(СН3)2NH2] CI 4СH3NH2 + 9O2 = 4CO2 + 10H2O + 2N2 4С2Н5NH2+ 15O2 = 8CO2 + 14H2O + 2N2 4(СН3)2NH +15 O2 = 8CO2 + 14H2O + 2N2 Далее учитель предлагает сравнить основные свойства аммиака, анилина и алифатических аминов. Выполняется демонстрационный эксперимент. Цели и задачи демонстрационных экспериментов и видеофрагментов: Наглядно показать взаимодействие аминов и аммиака с кислотами, изменение цвета индикатора в водном растворе, горение аммиака и аминов 1) Образовательные: учащиеся получают информацию о протекании химических реакций взаимодействие аминов и аммиака с кислотами, горение аммиака и аминов 2) Развивающие: развивается наблюдательность, умение анализировать наблюдаемые явления, делать выводы об основных свойствах аминов, исходя из химических реакций. 3) Воспитательные: формирование убеждения в том, что опыт - это инструмент познания, что мир познаваем. Каким способом можно сравнить силу оснований? Учащиеся: с помощью индикатора фенолфталеина Добавляем 1-2 капли фенолфталеина в пробирки с растворами аммиака и анилина. Содержимое пробирок хорошо перемешиваем стеклянной палочкой. Сравниваем окраски полученных растворов. В случае аммиака раствор приобрел малиновую окраску, раствор анилина окраску не изменил. Учащиеся формулируют вывод и записывают свои наблюдения в тетрадях: Основные свойства аммиака выражены сильнее, чем у ароматических аминов. Учитель ставит проблемный вопрос: Что более сильное основание - аммиак или алифатические амины? Для ответа на этот вопрос учащиеся вспоминают 4ое положение теории химического строения А.М.Бутлерова: «Атомы и группы атомов, входящие в состав молекулы, взаимно влияют друг на друга. Наибольшее влияние оказывают те атомы, которые стоят непосредственно друг с другом. Влияние атомов или групп атомов несвязанных непосредственно ослабевает по мере их удаления друг от друга». Углеводородный радикал смещает электронную плотность к азоту, вследствие этого электронная плотность на азоте возрастает, и он прочнее удерживает присоединенный протон (катион) водорода. Гидроксильные группы воды от этого становятся более свободными и основные свойства раствора усиливаются. (На презентации изображены молекулы аммиака, метиламина и анилина, показано распределение электронной плотности, Flash программа) Слабые основные свойства ароматических аминов объясняется влиянием групп атомов в органических веществах, а именно бензольного кольца на аминогруппу. (Бензольное кольцо, наоборот, притягивает к себе электроны атома азота, тем самым, уменьшая электронную плотность на атоме азота, следовательно, уменьшается способность присоединения протона (катиона) водорода и основные свойства уменьшаются). На основании вышеизложенного учащиеся совместно с учителем делают вывод: основания обладают свойством присоединять протон (катион), а кислоты отщеплять его, аммиак и амины - основания, основные свойства аминов предельного ряда выражены сильнее. R3N > R2NH > RNH2 > NH3 > C6H5NH2 Учащиеся вспоминают следующее свойство аммиака и аминов взаимодействие с кислотами с образованием солей по донорно-акцепторному механизму. Демонстрация учителем взаимодействие аммиака с HCl, видеофрагмент взаимодействие метиламина с соляной кислотой. Примеры реакций записывают в таблицу. Учащиеся вспоминают, что все органические вещества способны вступать в реакцию горения. Аммиак на воздухе не горит. Но в чистом кислороде он сгорает, окисляясь до азота. Демонстрационный опыт: В колбу нальем 50 мл концентрированного раствора аммиака и закроем пробкой с горелкой для сжигания газов. Осторожно нагреем раствор аммиака и подадим в горелку кислород. Поднесем зажженную лучинку к отверстию горелки. Аммиак загорается и горит желтоватозеленым пламенем. 4NH3 + 3O2= 2N2 + 6H2O Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени. Далее рассматриваем химические свойства анилина. Видеофрагмент взаимодействия анилина с бромной водой. В пробирку с анилином добавляют несколько капель бромной воды, наблюдают исчезновение желтой окраски брома и появление белого осадка 2,4,6-триброманилина. Учащиеся делают предположение, что это является качественной реакцией на анилин. Записывают в тетрадях реакцию. Учитель просит вспомнить, при каких условиях происходит бромирование бензола. Учащиеся отвечают, что бромирование бензола происходит только в присутствии катализатора. C6H6 + Br2 = (FeBr3) C6H5Br + HBr Учитель подчеркивает, что анилин взаимодействует с бромом без катализатора, т.е. проявляет более высокую химическую активность в реакциях замещения и ставит вопрос: С чем связано увеличение химической активности анилина в сравнении с бензолом в реакциях замещения? Учащиеся пытаются объяснить влияние аминогруппы на бензольное кольцо, опираясь на ранее изученный материал. Аминогруппа повышает электронную плотность в бензольном кольце и увеличивает подвижность атомов водорода в положениях 2,4,6 (орто- и пара- положениях). Приходят к выводу: влияние аминогруппы на радикал фенил проявляется в увеличении подвижности водородных атомов бензольного кольца (в орто- и пара- положениях) и облегчении протекания реакций замещения в молекуле анилина. Проводим реакцию анилина с соляной кислотой. К водной эмульсии анилина добавляем раствор соляной кислоты. Содержимое пробирки становится прозрачным, протекает химическая реакция с образованием хорошо растворимой соли анилина. После этого добавляем концентрированный раствор гидроксида натрия и анилин вновь выделяется из раствора. Сильное основание вытесняет слабое основание из его соли. Аналогично ведут себя соли аммония. Составляем уравнения реакций. Далее рассмотрим применение аминов. Учитель предлагает выступить ученику с заранее подготовленным материалом по теме «Применение аминов»: 1.метиламин – используется в синтезе лекарственных препаратов, красителей, поверхостно - активных веществ (ПАВ), дубильных веществ, ракетных топлив. 2.диметилами – применяется в качестве ускорителя вулканизации каучука и в производстве лекарственных веществ (например, аминазин). 3.высшие амины применяются в качестве ингибиторов коррозии металлов. 4. анилин - для производства анилиновых красителей, лекарств (сульфаниламидных препаратов), полимерных материалов (анилиноформальдегидных смол). 4. Закрепление учебного материала Цели и задачи учителя Установление правильности и осознанности усвоения нового материала, выявление пробелов, неверных представлений и их коррекция. 1) Образовательные: установить взаимосвязь между различными классами органических соединений, начиная с углеводородов и заканчивая с аминами. 2) Развивающие: развитие аналитического мышления, умение комплексного применения ранее изученного материала, способность создать генетическую связь между углеводородами и аминами. 3) Воспитательные: развитие способности к самоанализу Цель, которая ставится перед учащимися: Уметь составлять уравнения химических реакций, доказывающих основные свойства аминов, уметь составлять уравнения химических реакций, подтверждающих взаимосвязь изученных классов органических соединений. Форма работы: самостоятельная Используется дифференцированный подход, задания различных уровней. Осуществить следующие превращения: Карбид алюминия > метан > нитрометан > метиламин > хлорид метиламмония > метиламин > гидроксид метиламмония Учитель даёт анализ и оценку успешности цели изучения аминов и намечает перспективу последующей работы 5. Домашняя работа Цель и задачи учителя: Научить применять полученные знания. 1) Образовательные: 2) Развивающие: развить навыки решения задач, выполнение цепочек реакций, развитие аналитического мышления 3) Воспитательные: формирование усидчивости, аккуратности, внимательности, ответственности. Цель для ученика Закрепить знания полученные на уроке о химических свойствах аминов, применении аминов в быту и промышленности Для правильного выполнения домашнего задания учитель рекомендует повторить пройденный материал, вновь обратить внимание на особенность строения аминов, химические свойства аминов, провести генетическую связь с другими классами органических соединений. Работа по карточкам, различного уровня сложности.




