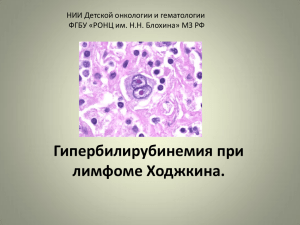
эндовидеохирургия желчнокаменной болезни сегодня
реклама

Российское общество эндоскопических хирургов Уральская государственная медицинская академия Европейский медицинский центр «УГМК-Здоровье» ООО «Олимпас Москва» ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ: ПРОБЛЕМЫ И ПУТИ ИХ ПРЕОДОЛЕНИЯ Выездной Пленум Правления РОЭХ Расширенное заседание хирургического Совета Уральского федерального округа Екатеринбург, 30 ноября 2012 Заболевания, объединяемые термином «постхолецистэктомический синдром» М.И.Прудков Уральская государственная медицинская академия Кафедра хирургических болезней ФПК и ПП Частота рецидивов боли и холелитиаза после органосохраняющих вмешательств оказалась во много раз больше, что связывалось с необратимым изменениями желчного пузыря, как причины рецидивирующего литогенезе. Отсюда главенствующие долгне годы теории «воспаления» и «застоя». Сегодня мы знаем, что это не так. Причина рецидивирующего литогенеза - в степени исходных нарушений коллоидной стабильности желчи и камни, как раз, наиболее успешно вновь образовываются в нормально функционирующем желчном пузыре. К известному выражению С.П.Федорова, характеризующего желчный пузырь как «фабрику желчных камней», сегодня мы с уверенностью можем добавить « ... путем концентрации исходно ненормальной желчи, не обладающей достаточной гидрофильной защитой от концентрирования». Рис. 1. Заболевания, объединяемые термином «Постхолецистэктомический синдром» Термин «постхолецистэктомический синдром» по аналогии с «пострезекционными» был предложен Прибрамом в 1950 году, однако очерчиваемый им круг патологических состояний возник намного раньше и до настоящего времени продолжает оставаться предметом дискуссий. Рис. 3. Диапазон значений термина ПХЭС Рис. 2. Основные варианты хирургического лечения ЖКБ. Как известно, холецистэктомия была предложена даже чуть раньше операций, сохраняющих желчный пузырь. После короткого периода их совместного использования выяснилось, что эти операции резко отличаются по отдаленным результатам. 2 В последующем не все сочли удачной аналогию Прибрама в отношении постгатрорезекционных и постхолецистэктомических патологических состояний. Если постгастрорезекционные расстройства возникают именно в результате резекции желудка, то с «постхолецистэктомическими» ситуация оказалась намного сложнее. Как видно из слайда, многие исследователи, занимавшиеся этой проблемой даже не стремились связывать «постхолецистэктомический синдром» исключительно с последствиями холецистэктомии. В этот круг неизменно попадали заболевания и патологические состояние, развившиеся независимо от факта холецистэктомии, до- или после ее выполнения. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ временная связь событий принимается за причинноследственную. Рис 4. Исторические предпосылки термина «постхолецистэктомический синдром» Схожими были лишь клинические проявления и стойкие цифры частоты их обнаружения на протяжении многих десятилетий, несмотря на гигантский прогресс в методах исследования внепеченочных желчных путей. Поразительно, но столетие назад в серии работ Kehr (1899-1913) приводится сходная частота неудовлетворительных результатов холецистэктомии. Так, частота оставления камней им оценивалась в 2-5%, а частота рецидивов боли - в 10%. Это обстоятельство можно объяснить лишь тем, что на протяжении прошедших десятилетий с эволюцией методов хирургической коррекции расширялись масштабы хирургического лечения желчнокаменной болезни и возрастала агрессивность операций. Параллельно с этими процессами росла требовательность к отдаленным результатам и возможности послеоперационных исследований. Рис 6. ПХЭС – как ситуационный диагноз. Намного более перспективным нам представляется рассматривать ситуационный, а не этиопатогенетический подход к понятию «постхолецистэктомический синдром». В таком случае, он становится констатацией лишь факта клинической неудачи операции, предпринимаемой с радикальными целями, когда после операции больного продолжают беспокоить те или иные расстройства, позволяющие заподозрить неустраненную желчнокаменную болезнь или ее последствия. Общим в этой схеме является лишь схожесть комплекса клинических проявлений, что в каком-то смысле соответствует понятию «синдром». В общепринятом значении синдром (от греч. syndrome - скопление) предполагает сочетание симптомов, имеющих общий патогенез. Неправильность такой трактовки, подмеченная еще В.М.Ситенко с А.И.Нечаем, заключается лишь в отсутствии общего патогенеза, но ведь его так и не нашли. Рис. 5. После этого – не значит вследствие этого. При этом общую трактовку термина так и не удалось свести к последствиям удаления желчного пузыря. Известная латинская поговорка «после этого - значит вследствие этого» стала в данном случае оказалась примером типичной логической ошибки, когда ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Рис 7. Целесообразность практического использования Практическое использование этого понятия дей- 3 ствительно оказалось удобным со многих позиций. Во-первых, оно реально характеризует качество оказания хирургической помощи больным желчнокаменной болезнью и частоту реализации ожиданий пациентов на излечение. Во-вторых, все больные этой группы, фактически независимо от причин возникновения патологических состояний нуждаются в сходном алгоритме диагностических мероприятий, включающем проверку трех основных диагностических гипотез. И, наконец, третья диагностическая гипотеза - пациента беспокоит какое-то другое заболевание, никак не связанное ни с желчнокаменной болезнью, ни с операцией. Подобные ситуации тоже не являются редкостью в клинической практике, поскольку распространенность остеохондроза позвоночника с корешковым синдромом, различных гепатитов, гастритов, дуоденитов, мочекаменной болезни, нефрритов, заболеваний толстой кишки и другой патологии, сопровождающихся болью или дискомфортом в правом подреберье достаточно велико и суммарная частота встречаемости этих патологических процессов в несколько раз превосходит заболеваемость желчнокаменной болезнью. При этом сама желчнокаменная болезнь далеко не всегда сопровождается выраженными клиническими проявления, и, тем более, не всегда способна объяснять весь комплекс жалоб, предъявляемый больным перед операций. В этой ситуации надежды пациента на избавление от всех жалоб не оправдываются, больного и хирурга ждут разочарования. Но после операции в случае повторного обращения пациента ему все равно придется проверять все 3 диагностические гипотезы. Что, собственно, и явилось еще одним основанием рассматривать термин «постхолецистэктомический синдром» как преимущественно ситуационный диагноз. Рис. 8. Классификация Благодарю за внимание! Первая - операция оказалась недостаточно радикальной в связи с просмотреным или продолжающимся литогенезом, неустраненными или функциональными изменениями в желчных путях, печени или поджелудочной железы. Нужно найти и устранить эти изменения. Профилактика будет заключаться в совершенствоавнии методов до- и интраоперационной диагностики всего комплекса изменений, обусловленных исходной желчнокаменной болезнью. При этом следует учитывать, что такие изменения как билиарный цирроз печени или хронический индуративный панкреатит - практически необратимы. Вторая по значимости диагностическая гипотеза (и ее тоже предстоит проверять) заключается в том, что в результате перенесенной операции могли возникнуть новые патологические состояния, которые объясняют причину неудачи. Такое вполне возможно, поскольку вмешательство происходило в той же зоне и на тех же анатомических образованиях, на которых происходили изменения, обусловленные холелитиазом. И часть этих последствий, например, последствия выпадения функции желчного пузыря такие как рефлюкс-гастриты и дуодениты или утраты автономности билиарного тракта после папиллотомии - практически неизбежны. Принципы диагностики этой группы патологических состояний весьма сходны с изложенными ранее, хотя направленность профилактических мероприятий - совсем иная и заключается в совершенствовании интрументов, приспособлений и хирургических методик и техники оперирования. 4 ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Повреждение магистральных желчных протоков при лапароскопической холецистэктомии (обзор литературы) Натрошвили И.Г., проф. Прудков М.И. Кисловодск, Екатеринбург, 2012 цистэктомии возросло число как выполняемых холецистэктомий, так и повреждений протоков, по сравнению с «долапароскопической эрой». Частота повреждений, по данным литературы, варьирует от 0,1% до 0,74% [1, 2, 5, 6, 12, 16, 26, 28–30, 41, 44, 48] , однако истинное значение этого показателя установить трудно. Повреждение желчевыводящих протоков — наиболее серьезное осложнение холецистэктомии, которое может существенно влиять на качество и продолжительность жизни пациентов, являющихся, зачастую людьми достаточно молодого возраста (в среднем 4455 лет). Как сообщают Flum DR et al. (2003) [17], повреждение желчных протоков увеличивает риск смерти пациентов в 3 раза. Рис. 1. Повреждения магистральных желчных протоков при лапароскопической холецистэктомии. Лапароскопическая холецистэктомия заняла твердые позиции в качестве «золотого стандарта» лечения желчнокаменной болезни. Учитывая то обстоятельство, что инструментарий и техника реализации этой операции оказались определенно сложнее, степень ее безопасности стала предметом пристального внимания практически с момента ее возникновения. Вскоре после выполнения первых вмешательств появились публикации о безопасности операции и оценке её осложнений [49]. Рис 3. Частота повреждений, вероятно, выше! Рис 2. Частота возникновения «больших» повреждений. С внедрением в практику лапароскопической холеЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Изучение не только хирургической периодики, но и публикаций специалистов смежных специальностей, косвенно свидетельствует, что реальное число повреждений желчных протоков может быть выше. Причины, не позволяющие уточнить частоту этого осложнения, представлены на слайде. На фоне отчетливой тенденции к снижению частоты таких осложнений, как пневмония, парез кишечника, грыжи и нагноение послеоперационной раны, частота ятрогенных повреждений магистральных желчных протоков на протяжении более, чем четвертьвекового опыта широкого использования лапароскопической холецистэктомии, к сожалению, не имеет тенденции к снижению. Как полагают Francoeur JR et al (2003) [18], каждый второй хирург может столкнуться с повреждением желчных протоков в своей практике. А, по данным опроса, более 70% хирургов считают повреждения желчных протоков неизбежными. 5 Предложено множество классификаций повреждений протоков [2, 4, 10, 13, 22, 33, 34, 38]. Пожалуй наиболее известной, но сложной для запоминания и, наверное, излишне подробной (включает 9 типов повреждений) является классификация Strasberg’а [38]. Более простая классификация Bergman’а [9] (т. н. «Амстердамские критерии») основана на морфологии повреждения, клинических проявлениях и возможном выборе метода лечения - повреждения делятся на две группы: с пресечением протока (типы A, B и D) и с его сужением. Stewart L. и Way L.W. [34] отразили в классификации причины и механизмы повреждения. Многие клиники, по-прежнему, пользуются классификацией Bismuth’а. Э.И. Гальперин [2] в 2009 предложил классификацию повреждений, учитывающую не только вид повреждения и его локализацию, но и наличие хирурга с опытом реконструктивной хирургии желчных протоков, позволяющую определить выбор дальнейшей тактики. Ни одна из классификаций на сегодняшний день не является общепринятой. С внедрением лапароскопических операций изменилась структура осложнений. Например, желчеистечение вследствие малых повреждений (пузырного протока или периферийных желчных протоков) было относительно редким до внедрения лапароскопических операций, а в настоящее время составляет около 25% билиарных осложнений лапароскопической холецистэктомии [42]. протока. По данным Nuzzo G et al [28] до 5% повреждений желчных протоков во время лапароскопической холецистэктомии связаны с развитием внезапного кровотечения. Кроме того, повреждение небольших артерий, через которые осуществляется кровоснабжение, может привести к ишемии анастомозируемого протока и неудаче реконструктивной операции. Принято считать, что есть обстоятельства, увеличивающие риск повреждения протоков при плановых вмешательствах и их, безусловно, следует учитывать. Рис. 5. Факторы риска. Есть и другие мнения. Так Nuzzo G et al. [28] в своем исследовании сообщают о 235 повреждениях желчных протоков у 56’591 пациентов, половина из которых произошли в ходе «технически простых» лапароскопических холецистэктомий. Более того, у 80% больных не было никаких факторов риска. Частота повреждений ЖП была 0,42%, причем при выполнении лапароскопической холецистэктомии по поводу хронического холецистита она составила 0,32%, а при остром — 0,56%. Рис 4. Варианты повреждений. Чаще стали встречаться случаи высоких повреждений, частичного или полного иссечения общего печеночного протока и сочетанных повреждений желчных протоков и артериальных сосудов. Последствия подобных осложнений трудно прогнозировать. По данным Strasberg and Helton [37] в четверти случаев травмы протоков повреждаются и сосуды. Наиболее часто - в 92% - травмируется правая печеночная артерия, что в 10% наблюдений приводит к некрозу правой доли печени. Но даже повреждения сосудов малого диаметра зачастую приводят к трагическим последствиям — попытки добиться гемостаза «в слепую» заканчиваются повреждением более крупного сосуда или желчного 6 Рис 6. Острый холецистит, как фактор риска. Krahenbuhl L. et al [23] сообщают о двукратном увеличении числа повреждений при остром холецистите. Конечно, любая холецистэктомия может стать сложЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ ной в процессе её выполнения, но многие сложные ситуации можно предугадать, а лапароскопическая холецистэктомия достаточно широко применяется в лечении острого калькулезного холецистита. В условиях острого воспаления лапароскопическое вмешательство сложнее. Не случайно Европейская ассоциация эндоскопической хирургии рекомендует выполнять его только опытными хирургами. Интересен тот факт, что у более опытных хирургов частота повреждений протоков в целом, по данным Nuzzi, была реже, но во время операций по поводу острого холецистита возникало чаще. Напротив, менее опытные коллеги имели большую общую частоту повреждений желчных протоков, но при остром холецистите она была ниже. Вероятнее всего, это связано с большим числом вмешательств по поводу острого холецистита и более «агрессивным» поведением опытных хирургов и, наоборот, меньшим количеством операций и большей осторожностью и частотой конверсий менее опытных хирургов. Рис 7. Варианты анатомического строения Анатомия билиарного дерева вариабельна, отклонения от «нормы» встречаются в 30-50% случаев, что должно учитываться при выполнении операции. Однако, вариативность анатомии является причиной повреждений протоков лишь у 12,9% пациентов. Основой безопасной техники выполнения лапароскопической холецистэктомии является хорошая визуализация пузырного протока и гепатодуоденальной связки и категорический отказ от пересечения любых структур до полной идентификации. Strasberg SM с коллегами [36] сообщили, что более чем 80% случаев повреждений желчных протоков произошли при пересечении пузырного протока до его идентификации и выделения других анатомических структур. Ими же в 1995 г. был предложен способ профилактики повреждений желчных протоков - «critical view of safety» [38]. Он включает три критерия. Во-первых, треугольник Кало должен быть освобожден от жировой ткани и фиброзных сращений. Затем, нижняя часть желчного пузыря отделяется от ложа. И последнее — две (и только две) трубчатые структуры должны входить в желчный пузырь. Использование «критического взгляда безопасности» позволяет снизить частоту повреждений желчных протоков до 0-0,03% [3, 8, 35, 47] и считается «золотым стандартом» проведения вмешательства [11]. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Рис. 8. Значимость обучения. В начале становления лапароскопической холецистэктомии большую частоту повреждений протоков связывали с кривой обучения хирургов [19] . Дальнейшие исследования показали, что частота повреждений желчных протоков существенно снижается с увеличением числа операций, варьируя от 0,9% у хирургов, выполнивших менее 150 лапароскопических холецистэктомий за 3 года, до 0,3% у тех, кто за этот же период выполнил более 450 вмешательств. Аналогичный результат наблюдался и при больших повреждениях (0,86% против 0,19%). Однако одного лишь опыта не достаточно. Хоть большинство повреждений протоков возникают в первые 100 операций, выполненных хирургом, до одной трети случаев этого осложнения регистрируют после выполнения 200 лапароскопических холецистэктомий [7]. Возможно, это связано с переоценкой хирургами своих возможностей, или распространением их активности на более сложные контингенты больных. Следует отметить и еще один немаловажный фактор — усталость хирурга. В своем исследовании Yaghoubianс соавт. показали, что переход резидентов на 80-часовую рабочую неделю позволило снизить число осложнений лапароскопической холецистэктомии с 5 до 2%, в том числе повреждения протоков с 1,1% до 0,4% [45]. Рис. 9. Холецистэктомия из объединенного доступа. 7 В настоящее время набирают популярность операции из единого трансумбиликального или трансвагинального доступов. И хотя даже совокупный опыт операций еще мал для полноценного сравнения с «традиционными» лапароскопическими вмешательствами, усложнение техники оперирования, применение изогнутых инструментов, уменьшение угла действия и увеличение расстояния манипулирования, при прочих равных условиях непременно приведут к определенному увеличению числа осложнений. В анализе Joseph M. с соавт 45 публикаций, включавших 2626 лапароскопических холецистэктомий из единого доступа, частота повреждений желчных протоков составила 0,72% [21]. При том, что у более 90% пациентов был хронический холецистит и, что подобные операции выполняют обычно высококвалифицированные хирурги у тщательно отобранных категорий пациентов. проблеме, можно отметить наиболее важные направления исследований, направленных на преодоление трудностей. Рис 11. Эволюция инструментов для лапароскопического оперирования. Рис. 10. Стриктура общего печеночного протока и оставленные камни на послеоперационной МР-холангиограмме. На холангиограмме - результат, казалось бы успешной, 4-х часовой однопортовой холецистэктомии, фиброхоледохоскопии, удаления камней из общего желчного протока через культю пузырного протока и его клипирования у больной острым холециститом в инфильтрате, осложненным перивезикальным абсцессом. МРТ-холангиограмма выполнена через месяц после операции в связи с перенесенным приступом холедохеальной колики и обтурационного холангита. Видны субкомпенсированная стриктура общего желчного протока на уровне пузырного с его престенотическим расширением. Вероятно, клипсу пришлось положить очень низко в связи с повреждением пузырного протока в процессе холангиоскопии. Кроме того, видно еще два оставленных камня в общем желчном протоке. Оперирующий хирург явно превысил свои возможности, вполне вероятно, что и возможности технологии. После эндоскопической папиллотомии камни, конечно, отойдут, но есть существенная вероятность прогрессирования стриктуры и рецидивирующего холангита вышерасположенных отделов билиарного тракта. Подводя итоги очень краткому и далеко не исчерпывающему обзору сведений, опубликованных по этой 8 Первое и самое главное - разработка единого стандарта безопасности хирургического лечения, который должен обеспечиваться при любом способе оперирования за счет соответствующей подготовки и допуска хирургов, селекции больных и технического оснащения операций. Для обеспечения сопоставимой безопасности разных хирургических операций необходимы свои инструменты и оборудование, адекватные по своей конструкции, качеству изготовления, удобству и надежности в использовании. К примеру, по данным Savassi-Rocha с соавт., проанализировавших результаты более 91 тыс. лапароскопических холецистэктомий, одним из ведущих факторов риска повреждения протоков является использование 0о лапароскопа [32]. Понятно, что по стоимости, срокам и кратности их эксплуатации они окажутся совершенно разными, но это уже совершенно другой аспект проблемы. Рис 12. Уточнение анатомических особенностей во время операции. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Безусловно, много проблем создает вариабельность строения внепеченочных желчных путей. В этой связи ряд хирургов рекомендует рутинное использование интраоперационной холангиографии, что позволяет уточнить анатомию желчевыводящих путей и избежать их повреждения [14], а в 90% случаев своевременно диагностировать возникшее осложнение [25]. В то же время, другие авторы [31] рекомендуют выполнять интраоперационную холангиографию только в случае возникших затруднений, подтверждая свою точку зрения низким числом повреждений желчных протоков — 0,16% на 2538 лапароскопических холецистэктомий. Альтернативой рентгенологическому методу является интраоперационное УЗИ, позволяющее идентифицировать общий желчный проток, место впадения пузырного протока, портальную вену, печеночную артерию в 95 и более процентах случаев. В сообщении о проспективном мультицентровом исследовании [27] не было ни одного повреждения желчных протоков и имелось всего три случая желчеистечения у 1381 пациента при использовании лапароскопического УЗИ. Однако, лапароскопическое УЗИ имеет длинную кривую обучения — для освоения метода требуется 50-100 операций. Появляются и новые экспериментальные методы, позволяющие идентифицировать желчные протоки во время операции: холангиография с красителем, световая холангиография, пассивная инфракрасная холангиография, гиперспектральная холангиография, флуоресцентная холангиография в ближнем ИК-диапазоне [11]. Эти исследования в настоящее время имеют ограниченное применение или находятся в стадии разработки. Рис. 13. Совершенствование видеопотока при обучении и оперировании. Создаются компьютерные системы для анализа видеопотока в реальном времени, предостерегающие хирурга от возможных опасных действий [24, системы «дополненной реальности» и тактильной обратной связи («телетактильные» системы) [43] . Возможно и дооперационное изучение анатомических соотношений в треугольнике Кало: использование 64-детекторного КТ позволяет в одно исследование проследить ход как пузырного протока, так и артерии [40]. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Однако, самым главным путем решения этой проблемы было и остается качественная подготовка хирургов и соблюдение классических принципов билиарной хирургии и своевременный переход на менее опосредованные способы оперирования в неясных и технически сложных ситуациях. Рис 14. Уточнение показаний и селекция больных для разных способов оперирования. Следующим по степени важности направлением, по нашему мнению, является совершенствование показаний и противопоказаний к различным способам выполнения операций в различных клинических ситуациях. Фактически речь идет о совершенствовании системы селекции больных для каждой технологии. С накоплением опыта многие относительные противопоказания к выполнению классического варианта лапароскопической холецистэктомии из дискретного хирургического доступа («multiple puncture techniqe») — ожирение, ранее перенесенные вмешательства и пр. - перестали таковыми являться. Однако, чем сложнее ситуация и способ оперирования, тем выше риск осложнений. К примеру, избыточный вес на сегодняшний день остается одним из общепринятых ограничений к лапароскопической холецистэктомии из единого доступа. С этих позиций несомненный интерес представляет подход, реализованный в «Токийском соглашении» по острому холециститу, разработанном 300 экспертами из различных стран в 2007 году [20, 46]. Согласно этим рекомендациям, ранняя лапароскопическая холецистэктомия, причем многопортовая, целесообразна лишь при легком остром холецистите - при отсутствии осложняющих моментов в сроки до 72 часов от начала заболевания. В условиях постоянно возрастающей многовариантности хирургии желчнокаменной болезни, все более актуальными становятся мультицентровые исследования, учитывающие не только вид и частоту, но и тяжесть возникающих осложнений. Точечная несостоятельность культи пузырного протока, может проявиться подтеканием незначительного количества желчи по контрольному дренажу в течение 2-х дней. Однако, такое же по механизму осложнение без дренажа, может закончиться перитонитом, повлекшим за собой длительное лечение, серьезную угро- 9 Рис. 15. Роль многоцентровых исследований с учетом тяжести осложнений. зу жизни, инвалидизацию и даже смерть пациента. Примером подобного подхода может служить классификация Clavien-Dindo [15], которая всё чаще встречается в работах отечественных и зарубежных авторов, или модифицированный её вариант — шкалу «Аккордеон» [39]. Литература 1. Борисов А.Е. и др. Осложнения лапароскопической холецистэктомии. // Эндоскопическая хирургия. 2001. № 3. С. 34. 2. Гальперин Э.И., Чевокин А.Ю. Факторы, определяющие выбор операции при “свежих” повреждениях магистральных желчных протоков // Анналы хирургической гепатологии. 2009. Т. 14. № 1. С. 49–56. 3. Радзиховский А.П., Мендель Н.А., Туманов К.В. Учет анатомических вариаций расположения пузырной артерии и пузырного протока для профилактики осложнений лапароскопической холецистэктомии // Український Журнал Хірургії. 2011. Т. 3. № 12. С. 101– 104. 4. Скумс А.В., Ничитайло М.Е., Снопок Ю.В. К вопросу о класификации ятрогенных повреждений желчных протоков при холецистэктомии // Клінічна хірургія. 2008. № 8. С. 25–30. 5. Шуркалин Б.К. и др. Десятилетний опыт лапароскопической холецистэктомии // Анналы хирургической гепатологии. 2004. Т. 9. № 1. С. 110–114. 6. Adamsen S. et al. Bile duct injury during laparoscopic cholecystectomy: a prospective nationwide series. // Journal of the American College of Surgeons. 1997. V. 184. № 6. p. 571–8. 7. Archer S.B. et al. Bile duct injury during laparoscopic cholecystectomy: results of a national survey. // Annals of Surgery. 2001. V. 234. № 4. p. 549–58; discussion 558–9. 8. Avgerinos C. et al. One thousand laparoscopic cholecystectomies in a single surgical unit using the “critical view of safety” technique. // Journal of Gastrointestinal Surgery : official journal of the Society for Surgery of the Alimentary Tract. 2009. V. 13. № 3. p. 498–503. 9. Bergman J.J., Brink G.R. van den, Rauws E.A. Treatment of bile duct lesions after laparoscopic cholecystectomy // Gut. 1996. № 38. p. 141–147. 10 10. Bismuth H. Postoperative strictures of the bile duct // The Biliary Tract / ed. L.H. Blumgart. Edinburgh: Churchill Livingstone, 1982. p. 209–218. 11. Buddingh K.T., Nieuwenhuijs V.B. Intraoperative assessment of biliary anatomy for prevention of bile duct injury : a review of current and future patient safety interventions // Surg Endosc. 2011. № 25. p. 2449–2461. 12. Chuang K.I. et al. Does increased experience with laparoscopic cholecystectomy yield more complex bile duct injuries? // American Journal of Surgery. 2012. V. 203. № 4. p. 480–7. 13. Csendes A. et al. Treatment of common bile duct injuries during laparoscopic cholecystectomy: endoscopic and surgical management. // World Journal of Surgery. 2001. V. 25. № 10. p. 1346–51. 14. Debru E. et al. Does routine intraoperative cholangiography prevent bile duct transection? // Surg Endosc. 2005. V. 19. № 4. p. 589–593. 15. Dindo D., Demartines N., Clavien P.-A. Classification of Surgical Complications // Annals of Surgery. 2004. V. 240. № 2. p. 205–213. 16. Dolan J.P. et al. Ten-year trend in the national volume of bile duct injuries requiring operative repair. // Surgical Endoscopy. 2005. V. 19. № 7. p. 967–73. 17. Flum D.R. et al. Bile duct injury during cholecystectomy and survival in medicare beneficiaries. // JAMA : the journal of the American Medical Association. 2003. V. 290. № 16. p. 2168–73. 18. Francoeur J.R. et al. Surgeons’ anonymous response after bile duct injury during cholecystectomy. // American Journal of Surgery. 2003. V. 185. № 5. p. 468–75. 19. Gigot J. et al. The dramatic reality of biliary tract injury during laparoscopic cholecystectomy. An anonymous multicenter Belgian survey of 65 patients. // Surgical Endoscopy. 1997. V. 11. № 12. p. 1171–8. 20. Hirota M. et al. Diagnostic criteria and severity assessment of acute cholecystitis: Tokyo Guidelines // J Hepatobiliary Pancreat Surg. 2007. V. 14. № 1. p. 78–82. 21. Joseph M. et al. Single incision laparoscopic cholecystectomy is associated with a higher bile duct injury rate: a review and a word of caution. // Annals of Surgery. 2012. V. 256. № 1. p. 1–6. 22. Keulemans Y.C. et al. Improvement in the management of bile duct injuries? // Journal of the American College of Surgeons. 1998. V. 187. № 3. p. 246–54. 23. Krahenbuhl L. et al. Incidence, risk factors, and prevention of biliary tract injuries during laparoscopic cholecystectomy in Switzerland. // World Journal of Surgery. 2001. V. 25. № 10. p. 1325–30. 24. Lahane A. et al. Detection of Unsafe Action from Laparoscopic Cholecystectomy Video // ACM SIGHIT International Health Informatics Symposium (ACM IHI). 2012. 25. Ludwig K. et al. Contribution of intraoperative cholangiography to incidence and outcome of common bile duct injuries during laparoscopic cholecystectomy // Surgical Endoscopy. 2002. № 16. p. 1098–1104. 26. MacFadyen B.V. et al. Bile duct injury after laparoscopic cholecystectomy. The United States experience. // Surgical Endoscopy. 1998. V. 12. № 4. p. 315–21. 27. Machi J. et al. The routine use of laparoscopic ultrasound decreases bile duct injury: a multicenter study. // Surgical Endoscopy. 2009. V. 23. № 2. p. 384–8. 28. Nuzzo G. et al. Bile Duct Injury During Laparoscopic Cholecystectomy. Results of an Italian National Survey on ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ 56 591 Cholecystectomies // Arch Surg. 2005. V. 140. p. 986–992. 29. Richardson M.C., Bell G., Fullarton G.M. Incidence and nature of bile duct injuries following laparoscopic cholecystectomy: an audit of 5913 cases. West of Scotland Laparoscopic Cholecystectomy Audit Group. // The British Journal of Surgery. 1996. V. 83. № 10. p. 1356–60. 30. Russell J.C. et al. Bile duct injuries, 1989-1993. A statewide experience. Connecticut Laparoscopic Cholecystectomy Registry. // Archives of Surgery (Chicago, Ill. : 1960). 1996. V. 131. № 4. p. 382–8. 31. Sarli L., Costi R., Roncoroni L. Intraoperative cholangiography and bile duct injury // Surgical Endoscopy. 2006. № 20. p. 176–177. 32. Savassi-Rocha P.R. et al. Iatrogenic bile duct injuries. // Surgical Endoscopy. 2003. V. 17. № 9. p. 1356–61. 33. Schmidt S.C. et al. Long-term results and risk factors influencing outcome of major bile duct injuries following cholecystectomy. // The British Journal of Surgery. 2005. V. 92. № 1. p. 76–82. 34. Stewart L. et al. Right hepatic artery injury associated with laparoscopic bile duct injury: incidence, mechanism, and consequences. // Journal of Gastrointestinal Surgery : official journal of the Society for Surgery of the Alimentary Tract. 2004. V. 8. № 5. p. 523–30; discussion 530–1. 35. Strasberg S.M., Brunt L.M. Rationale and use of the critical view of safety in laparoscopic cholecystectomy. // Journal of the American College of Surgeons. 2010. V. 211. № 1. p. 132–8. 36. Strasberg S.M., Eagon C.J., Drebin J.A. The “hidden cystic duct” syndrome and the infundibular technique of laparoscopic cholecystectomy--the danger of the false infundibulum. // Journal of the American College of Surgeons. 2000. V. 191. № 6. p. 661–7. 37. Strasberg S.M., Helton W.S. An analytical review of vasculobiliary injury in laparoscopic and open cholecystectomy. // HPB : the official journal of the International Hepato Pancreato Biliary Association. 2011. V. 13. № 1. p. 1–14. 38. Strasberg S.M., Hertl M., Soper N.J. An analysis of the problem of biliary injury during laparoscopic cholecystectomy. // Journal of the American College of Surgeons. 1995. V. 180. № 1. p. 101–25. 39. Strasberg S.M., Linehan D.C., Hawkins W.G. The accordion severity grading system of surgical complications. // Annals of surgery. 2009. V. 250. № 2. p. 177–86. 40. Sugita R. et al. Cystic artery and cystic duct assessment with 64-detector row CT before laparoscopic cholecystectomy. // Radiology. 2008. V. 248. № 1. p. 124–31. 41. Tantia O. et al. Iatrogenic biliary injury: 13,305 cholecystectomies experienced by a single surgical team over more than 13 years. // Surgical Endoscopy. 2008. V. 22. № 4. p. 1077–86. 42. Traverso L.W. Commentary - Bile duct injuries. Spectrum, mechanisms of injury, and their prevention. // The Surgical clinics of North America. 1994. V. 74. № 4. p. 781–803; discussion 805–7. 43. Volont F. et al. Augmented reality and image overlay navigation with OsiriX in laparoscopic and robotic surgery: not only a matter of fashion. // Journal of hepato-biliarypancreatic sciences. 2011. V. 18. № 4. p. 506–9. 44. Wherry D.C. et al. An external audit of laparoscopic cholecystectomy in the steady state performed in medical ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ treatment facilities of the Department of Defense. // Annals of Surgery. 1996. V. 224. № 2. p. 145–54. 45. Yaghoubian A. et al. Decreased bile duct injury rate during laparoscopic cholecystectomy in the era of the 80hour resident workweek // Arch Surg. 2008. V. 143. № 9. p. 847–51; discussion 851. 46. Yamashita Y. et al. Surgical treatment of patients with acute cholecystitis: Tokyo Guidelines // J Hepatobiliary Pancreat Surg. 2007. V. 14. № 1. p. 91–97. 47. Yegiyants S., Collins J.C. Operative strategy can reduce the incidence of major bile duct injury in laparoscopic cholecystectomy. // The American Surgeon. 2008. V. 74. № 10. p. 985–7. 48. Z’graggen K. et al. Complications of laparoscopic cholecystectomy in Switzerland. A prospective 3-year study of 10,174 patients. // Surgical Endoscopy. 1998. V. 12. № 11. p. 1303–10. 49. A prospective analysis of 1518 laparoscopic cholecystectomies. The Southern Surgeons Club. // The New England Journal of Medicine. 1991. V. 324. № 16. p. 1073–8. 11 Повреждения магистральных желчных протоков при холецистэктомии из минидоступа В.Г. Агаджанов, А.М. Шулутко, М.О. Чантурия, Ф.Н. Насиров, Н.Х. Кяров, О.А. Цветиков, Г.М. Арутюнян Московская Медицинская Академия им. И.М. Сеченова кафедра факультетской хирургии № 2, лечебного факультета Введение Интраоперационные повреждения магистральных желчных протоков (МЖП) продолжают оставаться одним из наиболее грозных осложнений как в хирургии билиопанкреатодуоденальной зоны, так и в абдоминальной хирургии в целом. Такие осложнения зачастую требуют от хирурга незамедлительного принятия решения (1-5,21). При этом повторные операции на МЖП сопровождаются послеоперационной летальностью от 7 до 17% (14,15,23). Частота интраоперационных повреждений МЖП составляет, по данным разных авторов, 0,09-3,0% всех операций на органах брюшной полости (1-4, 13). Как правило, травмы МЖП чаще всего происходят при холецистэктомии, реже - при операциях на желудке, двенадцатиперстной кишке, поджелудочной железе (1,2,4,12,16,22). Одной из главных причин, приводящей к повреждениям МЖП, являются тактические и технические ошибки (4). Ранения МЖП различны как по характеру, таки по последствиям и варьируют от небольшого желчеистечения до неизлечимых рубцовых стриктур внутрипеченочных протоков. Хирургические вмешательства, выполняемые в связи с повреждением МЖП, отличаются технической сложностью и многообразием (4,6-8,10,11,15,18). Существуют различные классификации повреждений МЖП (17). Э.И. Гальперином и соавторами предложили классификацию ILS «свежих» повреждений МЖП, в которой рассмариваются вопросы локализации и протяженности поражения, а также квалификации хирурга и методов выбора дальнейшей оперативной тактики (9). Мы, в свою очередь, обобщили, в связи с этой классификацией, результаты 3328 холецистэктомий из минидоступа по М.И. Прудкову, выполненных в клинике за период с 1995 по 2008 гг. Материал и методы За период с 1995 г. по 2008 г. по поводу ЖКБ и её осложнений оперировано 3328 пациентов, поступивших последовательно и без предварительного отбора. Из них 3108 пациентов было оперировано по поводу калькулезного холецистита и 220 пациентов оперировано с вмешательством на ма- 12 гистральных желчных протоках в сочетании с холецистэктомией. Из 3108 оперированных пациентов с калькулезным холециститом, больных с острым холециститом было 1371 (44,1%), с хроническим – 1737 (55,9%). Анализированы 13 больных (0,4%), получивших повреждения магистральных желчных протоков. Все операции изначально предпринимались из минилапаротомного доступа по М.И. Прудкову. Операция по поводу острого калькулезного холецистита проведена у 7 пациентов, хронического – у 6. Имело место 4 пересечения МЖП. Все больные оперированы, произведены реконструктивные операции. У 9 пациентов интраоперационное повреждение МЖП носило краевой характер. Локализация повреждений определена у всех пациентов. Результаты Краевые повреждения магистральных желчных протоков. Этот вид повреждения наблюдали у 9 (69,23%) пациентов из 13. У 6 пациентов имело место краевое повреждение общего желчного протока, у 2- общего печеночного протока, у 1 – левого печеночного протока. В 6 случаях констатировано механическое, и в 3 случаях, термическое повреждение. Все повреждения выявлены интраоперационно. В 3 случаях краевого повреждения общего желчного протока выполнено его ушивание, в 2 случаях – холедоходуоденостомия, в 1 случае – наружное дренирование Т-дренажем. После ушивания краевого ранения общего желчного протока, имел место 1 наружный желчный свищ, который самостоятельно закрылся. И в 1 случае, после выполнения холецистодуоденостомии наблюдалось длительное желчеистечение по подпеченочному дренажу. В 1 случае повреждения общего печеночного протока, операция завершена ушиванием ранения, в другом – наружным дренированием Т-дренажем. Ситуация с 1 ранением левого печеночного протока завершена ушиванием ранения и наружным дренированием через культю пузырного протока по Пиковскому. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Все операции выполнены из минидоступа по М.И. Прудкову, опытными в абдоминальной хирургии и имеющими опыт оперирования из минидоступа хирургами. Все 9 пациентов выписаны с выздоровлением. Пересечение магистральных желчных протоков. Данный вид повреждения МЖП наблюдали у 4 пациентов. Во всех случаях выполнялось расширение доступа в трансректальную лапаротомию. В 2 случаях пересечение обнаружено интраоперационно, и в 2 – в течение первых суток после операции, что проявилось желтухой и обильным желчеистечением по подпеченочному дренажу. По классификации ILS и терминологии стриктур ЖП (Э.И. Гальперин и соавт.), повреждение общего печеночного протока «+1» (длина сохранившегося проксимального отЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ дела общего печеночного протока 1 см.) зафиксировано в 3 случаях, и в одном случае зафиксировано повреждение общего печеночного протока «-1» (сохранен свод конфлюэнса печеночных протоков). Соответственно выполнено 3 гепатикоеюностомии и 1 бигепатикоеюностомия на выключеной по Ру петле кишки. Для проведения операции у всех больных, после обнаружения повреждения МЖП, был вызван хирург, имеющий опыт в реконструктивной хирургии желчных протоков. Послеоперационный период после гепатикоеюностомии на выключено по Ру петле кишки, в одном случае сопровождался длительным желчеистечением по дренажу. Имел место 1 летальный исход (массивная тромбоэмболия легочной артерии) после гепатикоеюностомии на выключеной по Ру петле кишки. 13 Обсуждение и выводы Основным положительным фактором в лечении ранений МЖП является присутствие хирурга, имеющего опыт в реконструктивной хирургии желчных протоков, который может провести операцию при узком протоке и тонкой стенке, а также при бифуркационном ранении печеночных протоков. L. Stewart и L.W. Way сообщают об успехе вмешательства лишь у 17% больных при продолжении операции хирургом, который пересек проток (20). Кроме того, большое значение в определении показаний к различным операциям имеет характер и локализация повреждения МЖП (9). Анализируя собственный опыт, можно заключить: во всех случаях травм МЖП, оперативное пособие изначально выполнялось опытным в абдоминальной хирургии и имеющим опыт оперирования из минидоступа хирургом. Большинство травм МЖП диагностировано на операции и устранено без расширения доступа. Операции из минидоступа сопровождались «низким» уровнем повреждения МЖП (в частности общего желчного и общего печеночного протоков). Соотношение травм МЖП возникших во время операций по поводу острого и по поводу хронического холециститов примерно одинаково (7:6 соответственно). Не зафиксировано ни одного повреждения МЖП, в случаях изначально выполняемой операции на внепеченочных желчных протоках. Однако для окончательного заключения по этому вопросу необходим анализ большего количества наблюдений. Список литературы 1.Агеев М.А. К профилактике ятрогенных повреждений внепеченочных желчных путей при резекции желудка // Анналы хир. гепатол. 1996. Т.1 (приложение). С. 266. 2. Азимшоев М.А., Касымов Х. Ранения желчных протоков при холецистэктомии и резекции желудка // Анналы хир. гепатол. 1996. Т.1 (приложение). С. 266-267. 3. Апсатаров Э.А., Ибальдин А.С. О результатах устранения ятрогенных повреждений в желчной хирургии // Анналы хир. гепатол. 1996. Т.1 (приложение). С. 268. 4. Артемьева Н.Н. Повреждения желчных протоков во время операции и способы их исправления // Анналы хир. гепатол. 1996. Т.1 С. 269. 5. Бебуришвили А.Г. и соавт. Хирургическая травма желчевыводящих протоков // Анналы хир. гепатол. 1996. Т.! (приложение). С. 272-273. 6. Витебский Я.Д. Новые требования к технике оперативных вмешательств на желчных путях // В кн. «Актуальные проблемы патологии в хирургии желчевыводящих путей». Свердловск, 1976. С. 34. 7. Вишневский В.А. и соавт. Желчеотводящие анастамо- 14 зы. М., 1972. С. 186. 8. Виноградов В.В. Вишневский В.А. и соавт. Билиодигестивные анастамозы // М., 1972. С. 191. 9. Гальперин Э.И., Чевокин А.Ю. Факторы определяющие выбор операции при «свежих» повреждениях магистральных желчных протоков // Анналы хир. гепатол. 2009 (1). Т. 14 10. Гальперин Э.И. и соавт. Лечение повреждений внепеченочных желчных протоков, полученных при лапароскопической холецистэктомии // Хирургия. 2001. №1. С. 51-53. 11. Ермолов А.С., Упырев А.В. Опыт реконструктивновосстановительных операций при ятрогенных повреждениях желчных протоков // Анналы хир. гепатол. 2000. №1. С. 90-97. 12. Лапкин К.В. Причины, профилактика и хирургическое лечение интраабдоминальных повреждений желчеотводящих протоков и их отдаленных осложнений // Анналы хир. гепатол. 1996. Т.1 (приложение). С. 291. 13. Лидов П.И. и соавт Показания к прецизионному шву гепатикохоледоха и методика его применения // Актуальные проблемы реконструктивной хирургии. М. 1989. 14. Малиновский Н.Н. и соавт. Тактика хирурга при технически сложных холецистэктомиях // Хирургия 1980. №6. С. 3-10. 15. Милонов О.Б. Опыт повторных реконструктивных и восстановительных операций на желчных путях // Хирургия. 1988. №6. С. 109-116. 16.Нечай А.И., Майстренко Н.А. Ятрогенные повреждения желчных протоков – причины и способствующие обстоятельства // Анналы хир. гепатол 1996. Т.1 (приложение) С. 293-294. 17. Тоскин К.Д. и соавт. Классификация повреждений желчных протоков // Анналы хир. гепатол. 1996. Т.1 (приложение). С. 305-306. 18. Шалимов А.А. и соавт. Современные аспекты диагностики и хирургического лечения рубцовой стриктуры желчных протоков // Клин. Хир. 1997. С. 135-140. 19. Arkossy P. et al. New reconstructive surgery of remnant pancreas in cases of cancer of Vater papilla // Hepatogastroenterology. 2002. Jan. –Feb.; 49(43). 255-257. 20. Stewart L., Way L.W. Bile duct injuries duridg laparoscopic cholecystectomy. Arch. Surg. 1995. V. 130. P. 1123-1129. 21. Fudaba Y. et al. Stable technique for reconstruction of hepatic artery in hamster-torat liver transplantation. Transp. Proct. 2000 Now. 32(7). 2341-2341. 22. Larusso N.F. The Fifth Carlos E. Rubio Memorial Lecture. Sclerosing cholangitis. Pathogenesis, pathology and practice. PR Health Sci. J. 1999 Mar. 18(1). 11-17. Review. 23. Piecuch J., Witkowski K. Biliary tract complications following 52 reconstructive orthotopic liver transplants. Ann. Transplant. 2001. 6(1). 36-38. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ «Эндобилиарные чресфистульные операции в этапном лечении холангиолитиаза: центральная районная больница – специализированный центр» М.И. Прудков, А.Д. Ковалевский, А.И. Бобак, А.В. Кульминский Введение: Проблема лечения больных холангиолитиазом, поступающих в небольшие неспециализированные стационары, продолжает оставаться одной из наиболее актуальных. В небольших ЛПУ общей сети здравоохранения оказывается преимущественно неотложная хирургическая помощь основной части населения нашей страны. Недостаточная плановая оперативная санация населения, особенно в сельских и малонаселенных районах, ведет к увеличению числа больных запущенными формами ЖКБ, преобладанию вынужденных операций по неотложным показаниям, в том числе у пациентов старших возрастных групп, у которых частота холангиолитиаза может достигать 46% [1-5] Возникающие при этом ситуации трудно разрешимы в условиях хирургического отделения, в котором оказался больной. Здесь, как правило, нет условий для полноценного предоперационного обследования (УЗИ экспертного класса, КТ, МРТ) и соответствующих специалистов, работающих в круглосуточном режиме, интраоперационной ревизии и санации протоковой системы. Нет возможности и направлять всех подобных больных с подозрением на наличие камней в протоках, поступающих в неотложном порядке в специализированные клиники. Следует также учитывать, что пред- и интраоперационное подозрение на наличие холангиолитиаза далеко не всегда подтверждается в последующем. В ряде случаев камней не оказывается или выявляется другая патология, например опухолевая, требующая узкоспециализированной диагностики и лечения. Выходом из положения может стать неотложная холецистэктомия с наружным дренированием протоков в стационаре по месту жительства с последующим уточненным обследованием и высококвалифицированной помощью в специализированной клинике с применением транспапиллярных эндоскопических [6-9], чрескожных чреспеченочных [10, 11] или чресфистульных [3, 12, 13] процедур. Последний вариант представляется наиболее рациональным, поскольку первичная операция была завершена наружным дренированием гепатикохоледоха. Выполнение чресфистульных процедур через сформированный на дренаже свищ описано достаточно давно. Выполнение эндобилиарных вмешательств производят, как под контролем рентгеноскопии, так и с применением эндоскопических методик. Последняя более точна и не сопровождается лучевой нагрузкой на пациента и операционную бригаду [14, 15]. Мы предпочитаем комбинированный вариант чресфистульных процедур, основанный на выполнении каждого элемента вмешательства наиболее рациональным способом: ориентируясь на мануальные навыки и ощущения больного, рентгенотелевизионное и чресфистульное фиброэндоскопическое наблюдение, в показанных случаях дополняя эти методы УЗИ [16-19]. Материалы и методы. В нашей клинике на протяжении многих лет концентрируются больные с холангиолитиазом, ранее перенесшие холецистэктомию в стационарах Свердловской обЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ ласти и города Екатеринбурга. В данной работе представлен опыт лечения 678 больных в хирургических отделениях СОКБ №1 и МБУ ГКБ№14 г. Екатеринбурга за период с 2009 по 2011г.г. Возраст пациентов находился в пределах от 15 до 92 лет и в среднем составил 58+6,4 года. Женщин было почти в 4 раза больше чем мужчин (79,1% и 20,9% соответственно). 611 больных ранее были оперированы в объеме холецистэктомии с дренированием желчных протоков в различных стационарах города и области. У 59 пациентов холецистэктомия была выполнена много лет назад, операция предпринималась повторно, а дренаж холедоха был установлен по поводу резидуального холедохолитиаза. В 8 наблюдениях наружного дренажа уже не было и дренирование общего желчного протока было выполнено с помощью пункционной чрескожной чреспеченочной холангиостомии под УЗ-контролем. Виды установленных ранее дренажей представлены в таблице 1: Таблица 1 Виды установленных ранее дренажей желчных протоков. Вид дренажа для формирования свища Т-образный дренаж Дренаж Холстеда-Пиковского Чрескожный чреспеченочный дренаж ВСЕГО: Количество больных 629 41 8 795 Следующим этапом было создание чресфистульного доступа в протоковую систему – достаточно удобного и безопасного для манипулирования. Свищевой канал формировали на дренаже в течение минимум 4-х недель. При наличии правильно установленного Т-образного дренажа достаточного диаметра (не менее 5,3 мм или 16F) на первой операции на это время просто откладывали дату госпитализации. После лапароскопических операций, при оставлении в брюшной полости дренирующих тампонов, а также у больных старческого возраста и пациентов с тяжелой сопутствующей патологией (сахарный диабет, ВИЧ, длительная гормональная терапия и др.) срок формирования свища составляет 4-5 недель и более. Свищи меньшего диаметра после формирования его стенок предварительно расширяли поэтапной дилатацией по проводнику. Для этого под рентгеноскопическим контролем через дренаж в протоки вводили проводник, дренаж извлекали и на его место устанавливали новый, диаметр которого был на 2-4F больше. Через 2-3 дня свищевой ход расслаблялся и ранее плотно обжатый стенками свища дренаж оказывался несколько более широким. Подобные процедуры продолжали до достижения необходимой ширины просвета свищевого канала. Важную роль для проведения чресфистульных манипуляций имела траектория установленного дренажа холедоха. В 7 наблюдениях установленный ранее дренаж имел выраженные изгибы в брюшной полости, непреодолимые для проведения холедохоскопа (Рисунок 1). Эти больные были прооперированы с применением других малоинвазивных 15 А Б Рисунок 1. А: Дренаж Холстеда-Пиковского опускается в малый таз, после чего поднимается к холедоху. Б: Дренаж создает петлю в свободной брюшной полости методик (ЭПСТ, ЧЧХС) и в настоящее исследование включены не были. Для выполнения чресфистульных манипуляций использовали холедохоскопы «OLYMPUS» CHF P-20 и CHF P-10 с наружным диаметром 4,9 мм и манипуляционным каналом диаметром 2,2 мм. Углы изгибания дистальной части холедохоскопа составляли 160о вверх и 130о вниз. В связи с этим наилучшие условия для последующего чресфистульного оперирования создавали Т-образные дренажи, ранее установленные у 629 больных. Сформированные на них свищи соединялся с желчным протоком под углом близким к 90 градусам и формировали две оси уверенного операционного манипулирования - в дистальный и проксимальный отделы холедоха. (Рисунок 2) Дренажи Холстеда-Пиковского через культю пузырного протока ранее были установлены у 41 пациента (Рисунок 3). Доступы, формирующиеся на таких дренажах, имели ряд недостатков. Прежде всего, ширина их просвета ограничена диаметром культи пузырного протока. Нередко, дренаж, на котором формировался чресфистульный доступ, располагался в брюшной полости с множественными изгибами. Кроме того, наличие острого угла между пузырным протоком и холедохом делало практически невозможными манипуляции в проксимальных его отделах. И, наконец, при низком впадении пузырного протока в холедоха зона доступности в протоковой системе оказывалась очень небольшой (Рис. 3А). Несколько лучшие условия для формирования чресфистульного доступа возникали после интраоперационного дренирования холедоха по Холстеду-Пиковскому «дренажем в дренаже» в модификации И.Д. Прудкова, предусма- Рисунок 2: Схема формирования желчного свища на Т-образном дренаже. Параметры операционного доступа 16 Рисунок 3: Схема формирования свища на дренаже через культю пузырного протока. Параметры операционного доступа тривающей проведение тонкого дренажа холедоха внутри более толстого подпеченочного дренажа (Рис. 3Б). В этом случае свищ формировался сразу большего диаметра и практически не имел изгибов в брюшной полости. Его подготовка заключалась только в дилатации суженной части пузырного протока. Выполнение предварительного бужирования свищевого хода до необходимого размера удлиняло срок стационарного лечения больного и оказалось выполнимым лишь у 37 из 41 больного (90% наблюдений), что делало данный вид дренирования менее удачным с позиций возможностей последующего чресфистульного лечения. С другой стороны, дренирование по Холстеду-Пиковскому при узких протоках является по существу единственным вариантом наружного дренирования желчных протоков при абдоминальной операции. А установка такого дренажа в большинстве случаев позволила решить проблему холангиолитиаза с помощью менее рискованной антеградно ассистированной ЭПСТ или вообще без разрушения сфинктерного аппарата сосочка (Рисунок 4). У 8 больных холангиолитиазом и доброкачественными рубцовыми стриктурами желчных протоков чресфистульный доступ в билиарный тракт формировали на чрескожных чреспеченочных дренажах. Из них у 3 пациентов пункционная чрескожная чреспеченочная холангиостомия ранее была предпринята по поводу холедохолитиаза при высоком риске выполнения абдоминальных вмешательств и при неэффективности попыток эндоскопической ретроградной литоэкстракции. Еще у 5 больных эта процедура была выполнена по поводу внутрипеченочных конкрементов и замазкообразных масс, сочетавшихся с послеоперационными рубцовыми стриктурами желчных протоков или билиодигестивных анастомозов. Сформированный на чрескожном чреспеченочном дренаже свищ имеет все преимущества прямого свища после дренажа Кера, позволяет выполнять чресфистульные процедуры во всех отделах холедоха, имеет мало изгибов и острых углов. (Рисунок 5).Рисунок 5: Схема формирования желчного свища после чрескожной чреспеченочной холангиостомии. Параметры операционного доступа. Следует отметить, что реальные возможности такого подхода у больных с доброкачественными поражениями желчЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ А Б В Рисунок 4: Больная М. Интраоперационная холангиограмма – холедох 6мм, в просвете камень 5мм (А); Чрездренажная холангиограмма – холедохолитиаз подтвержден (Б); Чрездренажная холангиограмма после эндоскопической чресфистульной литоэкстракции (В) ных протоков относительно невелики из-за редкости и рисков использования чрескожной чреспеченочной холангиостомии в качестве первичной ургентной процедуры. Ее чаще применяют при опухолевой окклюзии магистральных желчных протоков. Еще у 91 больного формирующийся чресфистульный чреспеченочный доступ был использован для взятия биопсии, реканализации, проведения наружно-внутреннего дренажа и эндопротезирования у больных с опухолевыми поражениями желчных протоков и органов панкреатодуоденальной зоны. Всего за период с 2009 по 2011 годы было выполнено 1171 чресфистульная эндоскопическая процедура. Для их проведения использовали фиброхоледохоскопы фирмы «Olympus» CHF P.10. и CHF P.20., электрохирургический блок PSD-10 фирмы «Olympus», электрогидравлический литотриптор АЕН-2AD производства «Circon ACMI», фиброгастродуоденоскопы фирмы «Olympus» JF-T20, рентгенологические аппараты типа С-дуга «Сименс» и «Кармекс», эндоскопические инструменты производства фирм «Olympus», «Эндофлекс» и «MTW». Виды чресфистульных эндоскопических процедур представлены в таблице 2. Таблица 2 Виды чресфистульных эндоскопических вмешательств Виды чресфистульных эндоскопических Количество операций и манипуляций больных Диагностическая холедохоскопия 189 Холедохоскопия с литоэкстракцией 336 Холедохоскопия с литотрипсией и 110 литоэкстракцией Антеградно ассистированная ЭПСТ 34 Балонная дилатация стриктуры холедоха, 5 анастомоза Фистулоскопия, удаление обрывка дренажа 3 Холстеда, Пиковского Холедохоскопия, удаление эндостента 1 ИТОГО: 678 Количество процедур 189 619 286 42 31 3 1 1171 678 пациентам была выполнена 1171 чресфистульная фиброхолангиоскопия. У 189 (28%) пациентов было исключено наличие органической патологии желчных протоков, а наличие дефектов наполнения на рентгенограммах было обусловлено другими причинами (пузырьки газа, сгустки фибрина, деформация стенки протока торцом дренажа, парафатериальным диЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Рисунок 5: Антеградно ассистированная эндоскопическая папиллосфинктеротомия. 5А: Фиброхоледохоскоп установлен через свищевой канал в терминальный отдел холедоха. 5Б: Под визуальным контролем через манипуляционный канал фиброхоледохоскопа через просвет БСДК в ДПК введены биопсийные щипцы. 5В: Фибродуоденоскоп введен в ДПК и сориентирован на БСДК. 5Г: Папиллотом захвачен биопсийными щипцами, что позволит втянуть его в устье БСДК и далее в холедох без риска случайного попадания в проток поджелудочной железы вертикулом и т.п.). Чресфистульный доступ у них ликвидировался самостоятельно через 2-3 дня после извлечения дренажных трубок. При значительном желчном дебите в целях гарантированного заживления свища «изнутри» дренаж сначала подтягивали в свище до выхода из просвета билиарного тракта и удаляли после прекращения отделения желчи. У 446 больных (66%) с помощью фиброхолангиоскопии было выявлено или подтверждено наличие органических изменений. У 336 пациентов были выявлены конкременты холедоха размерами менее 6 мм, которые были удалены при помощи корзинки Дормиа. В 110 наблюдениях размеры камней превышали диаметр сформированного свища. Они были разрушены методом ударно-волновой литотрипсии с последующим удалением отломков корзинкой. Еще в 126 случаях холедохолитиаз сопровождался стриктурами БСДК, что явилось основанием для папиллотомии. Наличие чресфистульного доступа позволило реализовать эту операции наиболее безопасным способом – с помощью антеградно ассистированной эндоскопической папиллосфинктеротомии Преимуществом такого подхода является возможность катетеризации БСДК из просвета холедоха, что практически исключает риск травмирования вирсунгова протока и панкреонекроза (Рисунок 5.). 34 пациента были прооперированы в объеме антеградноассистированной папиллосфинктеротомии по поводу рубцовых стриктур ампулярного отдела холедоха без холедохолитиаза. У 5 больных были выполнены баллонные дилатации высоких стриктур холедоха или гепатикоеюноанастомоза под контролем холедохоскопа. У 2 больных была выполнена сочетанная холецистохоледохоскопия. В одном из наблюдений после санации желчного пузыря был выявлен холецистохоледохиальный свищ (синдром Мириззи). Через соустье холедохоскоп был заведен в холедох, где и была выполнена литотрипсия и литоэкстракция крупных конкрементов. У второго пациента перенесшего холецистостомию по поводу механической желтухи и холедохолитиаза выполнить эндоскопическую ретроградную санацию холедоха не удалось из-за парафатериального дивертикула больших размеров. При холецистоскопии через просвет пузырного протока в холедох был заведен проводник, выполнено его бужирование. После чего через 17 доступ, сформированный через пузырный проток, была произведена холедохоскопия и литоэкстракция. Еще в 5 наблюдениях сформированный на дренаже по И.Д.Прудкову свищ позволил удалить оборвавшийся в глубине раны дренаж Холстеда-Пиковского – в свищ был заведен холедохоскоп, обрывок дренажа визуализирован, захвачен корзинкой Дормиа и извлечен наружу. Наиболее грозным осложнением при выполнении чресфистульных эндоскопических манипуляций была перфорация свища, которая имела место у 18 пациентов (2,6%). Абдоминальная операция для ликвидации осложнения потребовалась у 11 пациентов. Были выполнены лапароскопия, дренирование брюшной полости, минилапаротомия, рехоледохостомия. Показанием к выполнению абдоминальной операции являлись невозможность восстановить дренаж холедоха в обрывках свища и развитие клиники желчного перитонита. 3 больным после перфорации свища удалось повторно завести дренаж в холедох. В последующем, чресфистульные манипуляции были отложены на 3-4 недели до повторного формирования свища. При повторной госпитализации все эти больные были успешно прооперированы без конверсии доступа. 4 пациентам с перфорацией свища была выполнена эндоскопическая папиллосфинктеротомия с литоэкстракцией и назобилиарным дренированием. В подпеченочное пространство через обрывки свища был установлен контрольный дренаж. Выполнение данного объема операции не привело к развитию желчного перитонита, все больные выздоровели. Летальный исход был зафиксирован у 1 пациента (0,1%). Причиной смерти явилась тромбоэмболия легочной артерии после перенесенной абдоминальной операции по поводу перфорации желчного свища. Обсуждение Анализируя полученные результаты, мы убедились в высокой эффективности и целесообразности самого метода и концентрации подобных пациентов в специализированных центрах. Следует отметить, что приведенная выше методика применяется и в других хирургических клиниках г. Екатеринбурга (ЦГКБ № 1, ГКБ № 7 и АНО № 40). Прежде всего, он позволяет избавить значительное число пациентов от оставленных конкрементов в желчных протоках и обеспечивает общедоступность высокотехнологичной хирургической помощи больным холангиолитиазом, проживающим на всей территории Свердловской области. Дополнительным достоинствам такого подхода можно считать определенное снижение операционных рисков ятрогении и летальности первичных операций в общей сети стационаров, в которых оперирующим хирургам в технически и тактически сложных ситуациях предоставляется возможность ограничить объем первичного вмешательства холецистэктомией и наружным дренированием гепатикохоледоха. Кроме того, чресфистульное удаление конкрементов позволяет сохранить сфинктерный аппарат БСДК при отсутствии в нем изменений или выполнить папиллотомию наиболее щадящим и безопасным методом при его рубцовой трансформации. Недостатками технологии следует считать недостаточное знакомство общих хирургов с требованиями к наружному дренированию желчных протоков (наружный диаметр не менее 16 Fr, кратчайший путь дренажа к передней брюшной стенки без выраженных изгибов) и риск перфорации свищевого канала во время чресфистульных процедур. Первая проблема решается информированием хирурги- 18 ческого сообщества, вторая - требует дальнейшего совершенствования методики и ее технического дооснащения. Заключение Накопленный опыт концентрации больных с наружными дренажами гепатикохоледоха, оставленными камнями в желчных протоках и широкого внедрения эндобилиарных чресфистульных операций в областных клиниках, может оказаться полезным и в других регионах Российской Федерации. Список литературы: Гальперин Э.И., Волкова Н.В. Заболевание желчных путей после холецистэктомии. М.: Медицина, 1988. Шалимов А.А., Шалимов С.А., Нечитайло М.Е. и др. Хирургия печени и желчных путей. Киев.: Здоров,я, 1993. Майстренко Н.А., Стукалов В.В. Холедохолитиаз. СПб.: ЭЛБИ-СПб, 2000. Ермаков Е.А. Лечение малоинвазивными методами желчнокаменной болезни, осложненной нарушенной проходимостью магистральных желчевыводящих протоков. Автореф. дис....канд. мед. наук. Краснодар.: КА, 2003. Тимошин А.Д., Шестаков А.Л., Юрасов А.В. Малоинвазивные вмешательства в абдоминальной хирургии. М.: Триада-Х, 2003. Балалыкин А.С., Луцевич О.Э., Сажин В.П. и др. Эндоскопическая абдоминальная хирургия. М.: ИМА-пресс, 1996. Малярчук В.И., Пауткин Ю.Ф., Плавунов Н.Ф. Заболевания большого дуоденального сосочка. М.: Изд. Дом «Камерон», 2004. Lauschke H., Kaminski M., Verfurth B. et al. Choledochus revision in the age of endoscopic papillotomy. Indications and outcome // Zentralbl. Chir. 2001. V.126(5). P.364-368. Saito M., Tsuvuguchi T., Yamaguchi T. et al. Long-term outcome of endoscopic papillotomy for choledocholithiasis with cholecystolitiasis // Gastrointestinal Endjscopy, 2001. V.51(5). P.540-545. Борисов А.Е., Борисова Н.А., Верховский В.С. Эндобилиарные вмешательства в лечении механической желтухи. СПб.: Эскулап, 1997. Ившин В.Г., Лукичев О.Д. Малоинвазивные методы декомпрессии желчных путей у больных механической желтухой. Тула.: Гриф и К, 2003. Mazzariello R. A fourteen-year experience with nonoperative instrument extraction of retained bile duct stones // World J. Surg., 1978. V.2. №4.P.447-455. Burhenne H.J. Cholelithiasis and the interventional radiologist // Radiology, 1992. V.32. №1. Р.2-7. Стукалов В.В. Резидуальный холедохолитиаз. Автореф. дис. … докт. мед. наук. СПб.: ВМедА, 1999. Yamakawa T., Komaki F., Shikata J. Expirience with routine postoperative choledochoscopy via T-tube sinus tract // World. J. Surg., 1978. V.2.№3.Р.379-385. Прудков М.И. Извлечение камней гепатикохоледоха и бужирование фатерова сосочка через холецистостому с помощью фиброхоледохоскопа. // Хирургия, 1981. №10. С. 103104. Прудков И.Д., Прудков М.И. Чресфистульное эндоскопическое лечение холелитиаза. // Хирургия, 1983. №8. С 64-67. Прудков М.И., Кухаркин В.Н., Ковалевский А.Д. Чресфистульные комбинированные вмешательства на желчевыводящих путях в послеоперационном периоде. // Эндоскопическая хирургия. 2006. №2. С108. Прудков М.И. Основы минимально инвазивной хирургии. Екатеринбург.: ОАО «Полиграфист», 2007. С25-30. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Малоинвазивные технологии в лечении повреждений и стриктур желчных протоков Королев М.П., Федотов Л.Е., Аванесян Р.Г., Хусейнов Г.А., Ахмедов М.С. Кафедра общей хирургии с курсом эндоскопии и ухода за хирургическим больным (зав. – проф. М.П.Королев) ГОУ ВПО Санкт-Петербургский государственный педиатрический медицинский университет Ключевые слова: повреждения и стриктуры желчных протоков. Введение. До настоящего времени не удается исключить интраоперационные осложнение, ранние и поздние осложнения послеоперационного периода, связанные с повреждением различного характера желчных протоков после холецистэктомии. Катастрофические последствия, сложности в ранней диагностике подобных осложнений, трудности в хирургической коррекции, значительное число неудовлетворительных результатов, а также не самое лучшее качество жизни пациентов после реконструктивных операциях на желчных путях заставляют хирургов и интервенционных специалистов искать новые пути решения проблемы [1 – 3, 6]. Повторные операции на желчных протоках не только сложны в техническом исполнении, но и все еще сопровождаются высокой летальностью – 7-17% [4, 5, 7 — 9, 10]. Наш опыт лечения данной категории больных с применением малоинвазивных методов лечения позволяет считать, что лечение этих пациентов не может быть стандартизировано. Также считаем, что комбинированные малоинвазивные методики не являются приоритетными в лечении доброкачественных заболеваний и повреждений желчных протоков. Однако в некоторых ситуациях данные операции могут быть единственно возможным видом помощи на первом этапе лечения и, нередко, окончательным методом лечения. Целью работы: показать эффективность мининвазивных технологий при повреждениях и стриктурах желчных протоков, констатировать факт альтернативности этих вмешательств традиционным операциям, а также показать, что в редких случаях малоинвазивные комбинированные операции являются единственно возможным методом оказания помощи больным с патологией желчных протоков. Материал и методы. Работа основана на опыте лечения 93 больных, которым выполнены малоинвазивные операции под комбинированным (ультразвуковым, рентгенологическим и эндоскопическим) контролем по поводу стриктур и повреждений желчных протоков. Мужчин в исследуемой группе было 39, женщин – 54. Средний возраст мужчин – 48,6 лет, женщин – 63,9 лет. Комбинированные малоинвазивные вмешательства выполнены у 51 пациентов с осложнениями холецистэктомии, у 14 – со стриктурами общего желчного протока (ОЖП) в результате ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ хронического панкреатита и его осложнений, у 2 – в результате длительно существующей кисты поджелудочной железы, у 3 – с повреждение общего желчного протока во время резекции желудка, у 23 – со стриктурами различных анастомозов. Оперативные вмешательства выполняли в специализированной операционной, оснащенной эндоскопической, ультразвуковой и рентгенологической установками. Применяли инструменты для чрескожного доступа к внутрипеченочным желчным протокам и дренирования последних, баллонные дилататоры и бужи фирмы СООК (США), стенты фирмы M.I. Tech (Южная Корея); инструменты для эндоскопической папилосфинктеротомии, литоэкстракции фирмы Olympus (Япония), проводники различной конструкции и длины. Результаты и их обсуждение. Несмотря на разработанные стандарты операции – холецистэктомии, как открытой, так и лапароскопической, до сих пор не удается исключить осложнения, возникающие во время операции, связанные с повреждением внепеченочных протоков. В клинике выполнены малоинвазивные вмешательства 51 больному с подобными осложнениями. Условно нами эти больные разделены на 2 группы: 1-я — 19 пациентов, у которых осложнения возникли после открытой холецистэктомии и 2-я — 32 пациентов, у которых повреждения внепеченочных протоков получены после лапароскопических операций. У 6 больных после открытой холецистэктомии повреждение общего печеночного протока (ОПП) было в объеме неполного пересечения. Приведем примеры. У одного больного, после холецистэктомии выполнена лапаротомия в ближайшем послеоперационном периоде, ушит дефект на дренаже. Дренаж удален через месяц, что привело к формированию стриктуры ОПП и, как следствие, холангиту и механической желтухе. В данном случае выполнено чрескожная чреспеченочная холангиостомия (ЧЧХлС) и баллонная дилатация стриктуры с каркасным наружновнутренним дренированием ОПП и ОЖП (рис №1). Через 6 месяцев дренаж удален, рецидива не было. У второго пациента, на 2-е сутки после холецистэктомии по поводу деструктивного холецистита, отмечено поступление желчи по дренажу из подпеченочного пространства. На 7-е сутки больному выполнено ЧЧХлС, обнаружен дефект в ОПП при контрастировании. Пересечение ОПП было неполное, в связи с чем, удалось манипуляционный катетер провести через поврежденный проток дистальнее и выполнить наружновнутреннее дренирование внепеченочных протоков. 19 Рис 1. Восстановление адекватной проходимости ОЖП в области стриктуры с помощью каркасного наружновнутреннего дренирования и баллонной дилатации (больная Г. 58 лет, история болезни №31630, 04.07.2011г). а) каркасное наружновнутреннее дренирование стриктуры ОПП; б) баллонная дилатация стриктуры; в) результат после 3 сеансов баллонной дилатации. Рис 2. Восстановление целостности пересеченного на 2/3 ОПП на проведенном антеградно каркасном дренаже (больной П. 76 лет, история болезни №32134, 14.07.2009г). а) каркасное наружновнутреннее дренирование ОПП после интраоперационного повреждения последнего; б) фистулохолангиография через 6 мес после восстановления ОПП. Каркасное дренирование длилось 8 месяцев, дренаж удален без последствий (рис №2). У 13 больных пересечения ОЖП после открытой холецистэктомии были полными. У одного пациента ОЖП был ушит на дренаже, дренаж удален через 2 месяца, что было причиной формирования стриктуры. Выполнено наружновнутреннее каркасное дренирование желчных протоков. У другого пациента после холецистэктомии в послеоперационном периоде отмечено поступление желчи по дренажу из брюшной полости несмотря на то, что ОЖП был дренирован Т-образным дренажем. При контрастировании через дренаж выявлено, что дренаж мигрировал из протока и расположен парадренажно. В операционной выполнена ЧЧХлС, при этом обнаружен полный блок на уровне ОПП на 2 см ниже конфлюенса. При комбинации антеградного, чрескожного чреспеченочного и ретроградного – эндоскопического контрастирования выявлен дефект в протоке протяженностью около 0,5 – 0,7 см. При этом все попытки провести атнеградно проводник и манипуляционный катетер в дистальный отдел протока или ретроградно в проксимальный – были безуспешными (рис №3). Больной выполнено наружное дренирование 20 Рис 3. Попытка комбинированного восстановления проходимости ОПП после пересечения протока (больная К. 66 лет, история болезни №37919, 17.08.0210г). Рис 4. Фистулохолангиография спустя 2 месяца после наружного дренирования желчных протоков (больная К. 66 лет, история болезни №52409, 15.11.2010г). печеночных протоков. Спустя 2 месяца, при контрастировании желчных протоков, контрастное вещество через рубцово-изменённые ткани, ограничивающее пространство вокруг дефекта протока, поступало небольшими порциями в дистальный отдел ОЖП (рис №4). Благодаря этому, удалось гидрофильный проводник провести через поврежденный участок в просвет ОЖП и через БДС в просвет двенадцатиперстной кишки, затем выполнить наружновнутреннее дренирование внепеченочных протоков (рис №5). Планируется каркасное дренирование протока в течение 2 лет со сменой каркасных дренажей с периодичностью каждые 6 месяцев. Осложнения лапароскопической холецистэктомии мы разделили на следующие группы: 1) клипирование ОПП (у 9 больных), 2) ожоговая стриктура ОПП и ОЖП (у 8 больных), 3) полное пересечение ОПП (у 15 больных). При клипировании протока одному больному, после ЧЧХлС, выполнено оперативное вмешательство – лапаротомия, удаление клипсы, каркасное дренирование протока. В двух наблюдениях клипирование протоков были краевыми, каркасный дренаж удалось провести ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Рис 8. Попытка антеградного проведения проводника ниже клипированного участка (больной Б. 25 лет, история №37507, 11.08.2011г). а) интраоперационная холангиография; б) фистулохолангиография через неделю после ЧЧХлС. Рис 5. Фистулохолангиография после антеградного наружновнутреннего каркасного дренирования желчных протоков (больная К. 66 лет, история болезни №52409, 15.11.2010г). Рис 9. Комбинированное восстановление проходимости ОПП (больной Б. 25 лет, история №37507, 11.08.2011г). а), б) ретроградное эндоскопическое низведение проводника из просвета протока в просвет 12 перстной кишки; в) наружновнутреннее каркасное дренирование желчных протоков. Рис 6. Дренированный подпеченочный абсцесс через левый долевой проток. Осложнение возникло после клипирования ОПП в области конфлюенса (больная Н. 43 года, история болезни №48409, 27.10.2009г). Рис 7. Наружновнутреннее каркасное дренирование желчных протоков после восстановления проходимости (больная Н. 43 года, история болезни №56092, 11.12.2009г). ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ под рентгенологическим контролем без открытой операции, тем самым восстановив проходимость протоков на дренаже. Еще у одной больной 43 лет поступила в клинику с диагнозом подпеченочный абсцесс, состояние после лапароскопической холецистэктомии, холангит, механическая желтуха. При обследовании выявлено расширение внутрипеченочных протоков до уровня конфлюенса. В подпеченочном пространстве определялась полость неправильной формы с неоднородным содержимым. Первым этапом выполнена ЧЧХлС через левый долевой проток, при этом, обнаружено, что ОПП клипирован на уровне конфлюенса, проток сообщается с полость в подпеченочном пространстве. Дренаж установлен через просвет протока в полость в подпеченочном пространстве (рис №6). После купирования воспалительных явлений, последовательно выполнено наружновнутреннее дренирование левого и правого долевых протоков (рис №7). Учитывая весьма сложную ситуацию, больной рекомендовано было в течение 2 лет билобарное каркасное наружновнутреннее дренирование или установку через 6 месяцев биодеградирующих непокрытых стентов в долевые протоки с низведением дистальных концов в ОПП. Однако, больной в другой клинике выполнено оперативное вмешательство в объеме билиодигестивного анастомоза с левым долевым протоком на сменном каркасном дренаже, правый долевой проток выделить не удалось. Мы считаем, что выполнять данную операцию у больной с выраженными рубцовыми изменениями в области ворот печени тем более на фоне недавно перенесенного малоинвазивно- 21 Рис 12. Каркасное билобарное наружновнутреннее дренирование. ОПП и ОЖП (больная Х. 50 лет, история болезни №52424, 24.11.2008г). Рис 10. Каркасное дренирование стриктуры ОПП. В основе дренаж диаметром 14F, в области стриктуры каркас из двух дренажей общим диаметром 23F (больной Б. 26 лет, история болезни №58102, 14.12.2011г). Рис 13. Наружновнутреннее дренирование стриктуры левого долевого протока после сформированного бигепатикоанастомоза при ятрогенном повреждении ОПП (больная К. 42 года, история болезни №48334, 27.10.2009г). а) доступ в левый долевой проток;б) проведение проводника через стриктуру; в) наружновнутреннее дренирование левого долевого протока и гепатикоеюноанастомоза. Рис 11. Сонограмма (а) и фистулограмма (б) ожоговой стриктуры ОПП и ОЖП (больная Х. 50 лет, история болезни №33582. 28.07.2008). го оперативного лечения по поводу подпеченочного абсцесса, не правильным. Качество жизни больной после перенесенной открытой операции не улучшилось, кроме того, имеется неопределенность в выборе дальнейшего объема операции. Еще у одного больного после клипирования ОПП ниже конфлюенса выполнено восстановление проходимости только благодаря комбинации эндоскопической, ультразвуковой и рентгенологической техники. В данном наблюдении после ЧЧХлС, провести антеградно проводник ниже препятствия не удалось (рис №8). Проводник низведен с помощью эндоскопически ретроградно проведенной корзины Дормиа (рис №9). В дальнейшем выполнено каркасное дренирование стриктуры ОПП с помощью разработанной в клинике методике, при которой, в основе имея дренаж диаметром 14F, в области стриктуры формируется каркас из двух дренажей общим диаметром 23F (рис №10). Одна из наиболее сложных проблем в лечении осложнений лапароскопических холецистэктомия является ожоговая стриктура внепеченочных желчных протоков. Невозможно в течение 2 последующих лет определить протяженность поражения в связи с тем, что ожоговые изменения в течение данного промежутка времени формируют стриктуру. Мы располагаем не- 22 большим опытом лечения подобного рода осложнений. Приведем примеры. В одном наблюдении при небольшой протяженности стриктуры выполнено каркасное наружновнутреннее дренирование. Во втором наблюдении во время холецистэктомии в связи с возникшим кровотечение в области печеночнодвенадцатиперстной связки, при коагуляции получен ожог всего ОПП и ОЖП до уровня конфлюенса. Больная поступила в клинику в тяжелом состоянии, с концентрацией билирубина в крови 1200 ммоль/л. При обследовании выявлена рубцовая стриктура всего внепеченочного протока (рис №11). Поэтапно выполнено билобарное ЧЧХлС и каркасное наружновнутреннее дренирование желчных протоков (рис №12). В дальнейшем выполнены 4 попытки реконструктивных операций на желчных протоках в ведущих клиниках страны, которые оказались неэффективными: выделить элементы ворот печени не удалось в связи с рубцовым процессом после перенесенного постожогового продуктивного воспаления. У 3-го больного, после перенесенной лапароскопической холецистэктомии, на 4-е сутки отмечено поступление желчи по дренажу из брюшной полости, на 7-е сутки выполнена релапаротомия, при этом выявлен ожог ОЖП и ОПП до уровня на 2 см ниже конфлюенса. Выполнено наружное дренирование правого долевого протока. В клинике произведено антеградное каркасное наружновнутреннее дренирование внепеченочЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Рис 15. Наружное (а) и каркасное наружновнутреннее (б) дренирование ОПП, ОЖП и главного панкреатического протока (больной Т. 50 лет, история болезни №13272, 19.03.2011г). Рис 14. Наружновнутреннее дренирование (а) и эндопротоезирование (б) стриктуры ОПП после ятрогенного повреждения последнего (больная Ш. 77 лет, история болезни №3231, 20.01.2011г). ных желчных протоков, больной выписан в удовлетворительном состоянии. Через месяц госпитализирован повторно с клинической картиной деструктивного панкреатита. Выполненное оперативное вмешательство и интенсивная терапия оказались неэффективными, больной скончался. При полном пересечении внепеченочных желчных протоков наиболее оптимальным видом операции является билиодигестивный анастомоз на длинной выключенной по Ру петле. В большинстве случаев формирования стриктуры анастомозов после реконструктивных операций на пересеченных протоках возникают в результате игнорирования вышеуказанного правила, т.е. или формируется билиобилиоанастомоз, или петля кишки, выключенная из пищеварительного тракта слишком короткая. Малоинвазивные комбинированные операции мы применяли после формирования стриктуры анастомоза. При этом, уровень стриктуры, естественно, зависел от уровня формирования анастомоза. Приведем некоторые примеры. У одной больной после пересечения ОПП на уровне на 1 см ниже конфлюенса, на 4-е сутки после лапароскопической холецистэктомии выполнена реконструктивная операция – гепатикоеюноанастомоз. Однако в виду рефлюкс-холангита, через 3 года сформировалась стриктура анастомоза. Несмотря на повторную реконструктивную операцию, направленную на удлинение отключенной петли и формирование нового анастомоза на уровне долевых протоков, после удаления одного из каркасных дренажей, стриктура рецидивировала на уровне долевого протока. В данном случае, проходимость в области сужения восстановлена с помощью наружновнутреннего дренажа, проведенного антеградно, чрескожно-чреспеченочно (рис №13). Как правило, восстановление стриктуры определенного диаметра в области анастомоза мы формируем на каркасном дренаже в течение 2 лет. Редко в область стриктуры устанавливаем стент, что позволяет на несколько лет избавить больного от психологической травмы – наличия дренажной трубки и ухода за ней (рис №14). При наличии стриктуры, связанной со сдавлением интрапанкреатической части ОЖП в результате хронического панкреатита, выполняются идентичные комбинированные малоинвазивные операции, наЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ правленные на создание временного каркаса на дренаже, при этом дренаж может быть проведен антеградно или эндоскопически ретроградно в виде пластикового стента с помощью антеградно проведенного проводника. Иногда формирование каркаса выполнялось на саморасширяющемся нитиноловом стенте. В 2 наблюдениях кроме наружновнутреннего дренирования желчных протоков, была необходимость антеградной литоэкстракции конкрементов из главного панкреатического протока с дальнейшим каркасным дренированием последнего (рис №15). Еще у двух пациентов в результате длительно существующей кисты головки поджелудочной железы, сформировалась стриктура терминального отдела ОЖП, что потребовало не только дренирования полости кисты под ультразвуковым контролем, но и поэтапного восстановления проходимости желчного протока путем ЧЧХлС и антеградного стентирования ОЖП. Летальность составила 1,07% - (один больной умер от тяжелого панкреонекроза, нарастающей печеночнопочечной недостаточности в позднем послеоперационном периоде). В заключении можно отметить, что малоинвазивные оперативные вмешательства являются эффективным методом как декомпрессии желчных протоков, так и восстановления непрерывности и проходимости желчных протоков при повреждениях и стриктурах. Как видно из нашего опыта, каждая ситуация, связанная с повреждением или стриктурой желчного протока требует индивидуального подхода. Необходимо отметить, что наиболее благоприятная с точки зрения прогноза травма протока – это неполное пересечение. Данное обстоятельство объясняется тем, что сохраняется часть питающих сосудов, которые проходят параллельно протоку. Крайне неблагоприятное повреждение протока с точки зрения прогноза по нашему мнению и по мнению многих авторов – это ожоговая травма. Это связано с тем, что предугадать дальнейшее рубцевание по времени и по протяженности невозможно. В связи с чем, при ожоговой стриктуре необходимо длительное (не менее 24 месяцев) каркасное наружновнутреннее дренирование. Выводы. Эффективным методом помощи больным со стриктурами желчных протоков является каркасное дренирование суженного участка протока или стентирование; При краевом клипировании внепеченочных желч- 23 ных протоков показана баллонная дилатация области повреждения, направленная на удаления клипсы с протока, и каркасное наружновнутреннее дренирование протока; При неполном пересечении желчного протока необходимо чрескожное чреспеченочное проведение манипуляционного катетера ниже поврежденного участка с дальнейшим каркасным наружновнутренним дренированием желчного протока; Эти операции необходимо выполнять в специализированных операционных, которые оснащены ультразвуковой, эндоскопической и рентгенологической техникой. Библиографический список. Бебуришвили А.Г., Житников К.С. и др. Хирургическая травма желчевыводящих протоков // Анн. хир. гепатол. — 1996. — Т 1 (приложение). — С. 272-273. Боровой Е.И., Шпизель Р.С. Повреждение магистральных желчных протоков при холецистэктомии // Вестн. хир. — 1987. № 8. — С. 115-117. Бражникова Н.А., Мерзликин Н.В., Портнягин М.П. Ятрогенные повреждения желчных протоков при холецистэктомии // Анн. хир. гепатол. — 1996. — Т 1 (приложение). — С. 275. Гальперин Э.И., Кузовлев Н.Ф., Чевокин А.Ю. Лечение повреждений внепеченочных желчных протоков, полученных при лапароскопической холецистэктомии // Хирургия. — 2001. — № 1. — С. 51-53. Милонов О.Б., Мовчун А.А., Смирнов В.А. и др. Опыт повторных реконструктивных и восстановительных операций на желчных путях // Хирургия. — 1988. — № 6. — С. 3-10. Панченков Д.Н., Мамалыгина Л.А. Ятрогенные повреждения внепеченочных желчных протоков: диагностика и хирургическая тактика на современном этапе. // Анн. хир. гепатол. — 2004. – № 1, — С. 156-163. Peiper H.J. Repeat surgery of the biliary tract including reconstructive surgery // Internist. 1980. — № 10. — Р. 597–606. Piecuch J., Witkowski K. Biliary tract complications following 52 consecutive orthotopic liver transplants // Ann Transplant. — 2001. — Vol 6, № 1. — Р. 36–38. Raczynska S., Gacyk W., Draczkowski T. Results of reconstructive surgery for bile duct injury // Wiad Lek. — 1997. — Vol 50, Suppl 1. — P. 304–308. Raute M., Schaupp W. Iatrogenic damage of the bile ducts caused by cholecystectomy. Treatment and results // Langenbecks Arch. Chir. — 1988. — Bd. 373, № 6. — P. 345–354. 24 ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ ЭНДОСКОПИЧЕСКОЕ ЛЕЧЕНИе РУБЦОВЫХ ПОСЛЕОПЕРАЦИОННЫХ СТРИКТУР ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ С.Г. Шаповальянц, С.А. Будзинский, А.Г.Мыльников, Т.Б. Ардасенов, А.А. Никонов, В.С. Веселова Научно-образовательный центр абдоминальной хирургии и эндоскопии Росиийского Государственного медицинского университета имени Н.И. Пирогова, Москва (зав. – проф. С.Г. Шаповальянц). Городская клиническая больница № 31, Москва (глав. врач –Р.А. Маслова) Одним из наиболее сложных и актуальных направлений современной панкреатобилиарной хирургии является лечение рубцовых послеоперационных стриктур внепеченочных желчных протоков. Причиной рубцовых поражений желчного дерева в 82.9 – 97% случаев является ятрогенная травма. Повреждение желчных протоков происходит главным образом при холецистэктомии и, гораздо реже, при резекции желудка. Важным этиологическим фактором формирования рубцовой стриктуры билиарного тракта является и раннее удаление дренажа Кера после наружного дренирования желчных протоков, особенно при незначительном расширении последних . После того, как в 1982 году Siegel J.H. впервые предложил способ эндоскопической декомпрессии желчного дерева при его рубцовом поражении , этот метод лечения получил широкое признание и продолжает совершенствоваться в силу высокой эффективности и малой травматичности. Последнее обстоятельство представляется наиболее важным, поскольку большинство больных с данной патологией поступают в стационары с явлениями механической желтухи и холангита, а выполнение хирургических операций в таких условиях сопровождается большой частотой осложнений и летальности (5 -30%) . На первых этапах развития данной методики, эндоскопические вмешательства при рубцовых стриктурах желчного дерева рассматривались, как основной подготовительный этап к реконструктивному хирургическому вмешательству, направленные на разрешение механической желтухи и холангита. Однако в последние десятилетия по мере накопления опыта и стремительного развития эндоскопических технологий становится очевидным, что малоинвазивные ретроградные вмешательства могут использоваться как самостоятельный окончательный метода лечения рубцовых послеоперационных стриктур желчных протоков. Актуальность данной проблемы углубляется и тем, что частота интраоперационной травмы магистральных желчных протоков в настоящее время возросла в связи с широким внедрением в клиническую практику лапароскопической холецистэктомии, при которой подобные осложнения встречаются почти в 2 раза чаще, чем при традиционных вмешательствах . С 01.1991 по 01.2011 г. 68 больным с рубцовым поражением желчных протоков проведены эндоскопические лечебно-диагностические вмешательства. Женщин было 51 (75.4%), мужчин – 17 (24.6%); средний возраст больных составил 55.6 + 20.9 года. (11-85 лет). Во всех случаях стриктуры развились после ятрогенного повреждения желчевыводящих протоков – в результате открытой холецистэктомии – у 15 (21.5%) ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ больных, после холецистэктомии, холедохотомии и наружного дренирования холедоха – у 26 (40%), после лапароскопической холецистэктомии – у 21 (29.2%), после холецистэктомии из минилапаротомного доступа и гемигепатэктомии – по 1 (1.5%) больному и после повреждения стенки дистального отдела холедоха при эндоскопической экстракции крупных конкрементов – в 4 (6.2%) случаях. Сроки появления клинической симптоматики после ятрогенной травмы внепеченочных желчных протоков составили от 1.5 месяцев до 13 лет, причем механическая желтуха и холангит наиболее часто развивались в течение первого года после травмы желчных протоков – в 36 случаях (55.4%) Наиболее частым клиническим проявлением заболевания у данной категории пациентов являлась механическая желтуха, которая встречалась у 63 (95.4%) больных, в том числе с признаками холангита – у 19 (27.7%). При этом у 3 (4.4%) пациентов были обнаружены холангиогенные абсцессы печени. Формирование наружного желчного свища на фоне РПС билиарного тракта отмечено в 4 (6%) случаях. Холедохолитиаз был обнаружен в 28 (43.1%) случаях, в том числе в 17 – с расположением конкрементов над стриктурой. Во всех случаях проведено традиционное ультразвуковое исследование панкреатобилиарной зоны. Кроме того, в 15 наблюдениях выполнялась компьютерная томография, а в 13 - эндоскопическое ультразвуковое исследование. Магнитно-резонансная холангиопанкреатикография производилась 4 больным. Кроме того, в 8 наблюдениях производилась внутрипротоковая биопсия с последующим гистологическим исследованием. Однако, основными методами инструментальной диагностики являлись различные варианты прямого контрастирования желчного дерева. Так ЭРХГ выполнили у всех 68 пациентов, в 22 наблюдениях производилась фистулография ( в 4 случаях через наружный желчный свищ, а у 18 больных через ранее установленный назобилиарный дренаж). Еще в 4 случаях проведена прямая холангиография антеградным способом. При определении уровня рубцового поражения желчного дерева мы использовали классификацию послеоперационных стриктур ГальперинаЭ.И.(1982). Стриктура общего печеночного протока встретилась в нашем исследовании в 46 (70.8%) случаях, а общего желчного протока – в 19 (29.2%). Окклюзия долевых печеночных протоков, наиболее сложная локализация РПС как для хирургической, так и для эндоскопической коррекции, встретилась нам лишь в 2 наблюдения. Наиболее низкое расположение рубцовых поражений – в интрапанкреатическом (1) и в ретродуоденаль- 25 ном отделах (3) холедоха – было характерным для травмы стенки общего желчного протока при выполнении эндоскопической экстракции крупных конкрементов. Протяженность стриктур варьировала от 2 до 30 мм, но чаще всего составляла от 5 до 20 мм (73.8%). Небольшие по протяженности сужения внепеченочных желчных протоков менее 5 мм отмечались в 14 наблюдениях, в то время, как протяженные рубцовые стриктуры более 20 мм - у 3 больных. Одним из важнейших факторов, определяющим клиническую картину и успех эндоскопического лечения является выраженность сужения желчного протока и его угловая деформация в области рубцового поражения . Нитевидный ход стриктуры был отмечен в 40 (59.5%) наблюдениях, при этом в 23 случаях ход рубцового канала был неровным и извитым, что существенно затрудняло проведение эндоскопических коррегирующих вмешательств. В 24 (34.9%) наблюдениях сужение в области рубцовой окклюзии не превышало 2\3 от диаметра холедоха, а в 1 (1.5%) случае 1\3 его просвета, однако у этих пациентов имела место выраженная углообразная деформация хода внепеченочных желчных протоков, что приводило к нарушению желчеоттока. После селективной канюляции холедоха выполнялась эндоскопическая ретроградная холангиография с оценкой уровня, протяженности и выраженности сужения желчных протоков . После предварительно произведенной эндоскопической папиллосфинктеротомии, манипуляции по поводу рубцовой стриктуры начинались с бужирования области сужения. После бужирования области рубцовой окклюзии появлялась возможность выполнения баллонной дилатации, что позволяло расширить область стриктуры до 4-10 мм на протяжении 2-5 см. Данная процедура продолжалась от 20 секунд до нескольких мин до полного расправления рентгенологической “талии баллона”. Для достижения стойкого расширения стриктуры обычно требовалось 2-4 сеанса дилатации во время одного исследования . После расправления стриктуры посредством бужирования и баллонной дилатации, устанавливался пластиковый билиодуоденальный протез с целью создания временного каркаса, предупреждающего рецидив стриктуры. Через 3 месяца производили замену дренажа-каркаса на более широкий, или в области сужения устанавливалось несколько стентов (Рис. 8,9). Последние оставались в просвете холедоха на срок не менее 12 месяцев с их периодической санацией либо репротезированием дренажами сходного диаметра с периодичностью 1 раз в 3-4 месяца. За больными осуществлялось динамическое наблюдение и при отсутствии клинических проявлений желтухи и холангита в течение указанного выше срока, производилось удаление протеза с оценкой эффективности комплекса лечения по клиническим и рентгенологическим данным. Результаты Во всех 68 наблюдениях вмешательства начинались с эндоскопической папиллосфинктеротомии. Бужирование и (или) баллонная дилатация в качестве первого этапа коррекции РПС были предприняты в 61 случаях (87.2%). У остальных 7 больных эти мани- 26 пуляции оказались невыполненными из-за выраженности стриктуры. На фоне сохраняющихся механической желтухи и холангита у 6 из этих больных выполнены срочные хирургические вмешательства - наложение билиодигестивных соустий. У 1 пациента этой группы отмечено тяжелое рецидивное кровотечение из области папиллотомии, приведшее на фоне желтухи и печеночно-клеточной недостаточности к летальному исходу. Еще у 11 пациентов лечебные эндоскопические вмешательства ограничены бужированием стриктуры, а билиодуоденальные стенты не размещались. Среди этой группы в 2 случаях при незначительном сужении, но выраженной деформации протока и супрастенотическом холедохолитиазе бужирование области рубцового поражения с последующим удалением конкрементов явилось достаточным объемом эндоскопического вмешательства для нормализации желчеоттока. У остальных 9 пациентов после выполнения ЭПСТ и бужирования стриктуры, провести дренаж выше области окклюзии не представлялось возможным. В то же время, у всех больных данной группы удалось добиться разрешения механической желтухи и холангита, что позволило выполнить хирургическую коррекцию в плановом порядке. У 50 (72.3%) пациентов выше стриктуры удалось провести билио-дуоденальные протезы. Для этого во всех случаях потребовалось предварительное бужирование области окклюзии, которое в 17(36.2%) наблюдениях сочеталось с баллонной дилатацией. Таблица №1. Виды эндоскопических вмешательств, выполненных у больных с рубцовыми стриктурами желчных путей (n - 68). Объем эндоскопической коррекции Изолированная ЭПСТ ЭПСТ + бужирование (в том числе с Экстракцией супрастенотических конкрементов) ЭПСТ + бужирование + Этапное билиодуоденальное протезирование ЭПСТ + бужирование + баллонная дилатация + Этапное билиодуоденальное протезирование Кол-во больных (n – 68) 7 (10.8%) 11/2 (16.9 %/3.1%) 31 (46.2%) 19 (26.2%) Таким образом, билиарное стентирование не было выполнено в 18 наблюдениях. Хирургические операции были произведены 15 пациентам данной группы – наложение гепатикоэнтероанастомоза в 12 случаях и холедоходуоденоанастомоза – в 3. При этом, как было сказано выше, 9 оперативных вмешательств были выполнены в плановом порядке, после эндоскопического разрешения клинической картины механической желтухи и холангита. Срочные операции при отсутствии положительной динамики после эндоскопических мероприятий были произведены в 6 случаях. В остальных 3 наблюдениях для разрешения желтухи оказалось достаточно лишь бужирования области сужения и экстракции конкрементов. Осложнения и летальность. При проведении эндоскопического лечения РПС у 5 больных (7.4%) отмечены послеоперационные осложнения, в виде кровотечений из области ЭПСТ (2), ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ острого панкреатита (2) и дистальной миграции стента с травмой стенки ДПК (1). Эндоскопическая коррекция осложнений выполнена в 1 случае кровотечения посредством эндоскопического гемостаза, 1 случае острого панкреатита, развившегося после манипуляций на БДС, с помощью панкреатического стентирования и при дистальной миграции эндопротеза путем удаления дренажа и клипирования дефекта стенки ДПК. Еще в 1 случае острый панкреатит средней степени тяжести разрешился на фоне консервативной терапии и не потребовал выполнения повторных эндоскопических и хирургических вмешательств. В нашем наблюдении имел место 1 (1.5 %) летальный исход у больного с выраженной сопутствующей патологией после многократных рецидивов кровотечения из области атипичной ЭПСТ. После эндоскопического разрешения клинической картины механической желтухи и холангита в 50 случаях принято решение о проведении этапного эндоскопического лечения РПС внепеченочных желчных протоков как окончательного метода коррекции. Срок эндоскопического лечения в нашем исследовании составлял от 8 до 46 месяцев у разных пациентов, однако, чаще всего находился в интервале от 12 до 20 месяцев (50%). Повторные сеансы эндоскопического лечения РПС включали в себя дополнительные сеансы баллонной дилатации РПС, этапное репротезирование области окклюзии, и в ряде случаев, установку назобилиарных дренажей и плановую санацию стентов. Во всех наблюденниях курс лечения завершался извлечением дренажей-каркасов и выполнением контрольной ретроградной холангиографии. При этом наиболее частым приемом при проведении этапного эндоскопического лечения РПС магистральных желчных путей явилось билиодуоденальное репротезирование, которое было предпринято у всех 50 больных. При этом мы стремились к постепенному увеличению общего диаметра дренажей-каркасов, посредством увеличения диаметра ранее установленных протезов или их количества, чего удалось достичь в 42 случаях из 50 (83%). В нашем исследовании двойное протезирование было выполнено у 24 (48.1%) больных, в том числе у 9 (17.1%) из них билатерально. Установку трех билиодуоденальных дренажей в нашей работе удалось осуществить у 6 (10%) пациентов. Отдаленные результаты эндоскопической коррекции рубцовых послеоперационных поражений желчного дерева. Из 52 больных, у которых эндоскопическая коррекция РПС являлась окончательным методом лечения, оценка отдаленных результатов в сроки от 1 до 16 лет к настоящему времени осуществлена у 38 пациентов. У остальных 8 больных продолжается комплекс лечебных эндоскопических мероприятий, 6 пациентов не доступны для контроля. С целью проведения оценки отдаленных результатов эндоскопической коррекции РПС после завершения их этапного лечения за всеми больными осуществлялось динамическое наблюдение. УЗИ и биохимический анализ крови выполнялись через 6 и 12 месяцев, а ЭРХГ – через 1 год после завершения этапного эндоскопического лечения. Хорошие исходы были получены у 35 (94.6%) пациЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ ентов при отсутствии жалоб, клинико-лабораторных проявлений рецидива механической желтухи. По данным ультразвуковых исследований во всех наблюдениях отмечена ликвидация признаков билиарной гипертензии и отсутсвие рецидивного холедохолитиаза, что у 26 больных было подтверждено путем ретроградной холангиографии. Удовлетворительные результаты в нашей работе выявлены в 2 случаях. В обоих наблюдениях при УЗИ выявлялось сохранение дилатации внепеченочных желчных протоков, а при контрольной ЭРХГ – деформация в области ранее расположенной стриктуры и рецидивный холедохолитиаз без клинических и рентгенологических признаков нарушения желчеоттока и рецидива стриктуры. Этим больным выполнена эндоскопическая литоэкстракция. Плохих отдаленных результатов в нашем исследовании выявлено не было. Таким образом, комплекс эндоскопических вмешательств (бужирование, баллонная дилатация, билиодуоденальное протезирование) является эффективным методом, позволяющим выполнить адекватное дренирование билиарного тракта и разрешить явления механической желтухи и холангита в 91.2% случаев, а также провести эндоскопическую коррекцию рубцовых послеоперационных стриктур внепеченочных желчных протоков как окончательный метод лечения в 77,3% наблюдений. В остальных случаях эндоскопические методы служат этапом в подготовке больного к традиционному хирургическому вмешательству. 27 ЯТРОГЕННЫЕ ТРАВМЫ И СТРИКТУРЫ ЖЕЛЧЕВЫВОДЯЩИХ ПРОТОКОВ А.Г. Бебуришвили, Е.Н. Зюбина, В.В.Мандриков Волгоградский государственный медицинский университет, Волгоград, Россия Совершенствование традиционной и видеоэндохирургической техники операций при желчнокаменной болезни, накопление клинического опыта, к сожалению, не застраховывает хирурга от повреждений желчных протоков, частота которых во время «открытой» холецистэктомии составляет 0,1-0,8%, достигая при лапароскопическом доступе 3%. Травмы гепатикохоледоха, возникающие при ЛХЭ, отличаются особой тяжестью, поскольку, наряду с известными механизмами повреждения (перевязка, прошивание, пересечение, иссечение), сопровождаются термическим ожогом стенки общего желчного или правого печеночного протоков, который проявляется развитием стриктуры через 3-4 месяца после операции и требует несколько иных подходов к лечению. Кроме того, во время ЛХЭ, как правило, повреждаются нерасширенные желчные протоки на уровне бифуркции долевых желчных протоков. Обнаружив повреждение, хирурги, нередко недостаточно владеющие техникой операций на узких протоках, а подчас не имеющие надлежащих условий и оснащения, стремятся самостоятельно исправить создавшееся положение и восстановить проходимость желчных протоков без учета особенностей поражения. Летальность у таких больных после повторных операций достигает 13-25%. Отсутствие обоснованных критериев выбора способа хирургической коррекции ятрогенных травм и рубцовых стриктур желчных протоков приводит к тому, что, зачастую, при лечении одинаковых повреждений применяются как восстановительные, так и реконструктивные операции, а также различные способы каркасного дренирования. Основной тенденцией в настоящее время является стабилизация частоты травмы желчевыводящих протоков. Вместе с тем, ни длительность заболевания, ни характер операции (плановая или срочная), ни диаметр протока ни даже профессиональный стаж хирурга не влияют на возможность повреждения протоков. Клиника факультетской хирургии ВолгГМУ располагает опытом лечения 256 больных с ятрогеннымы повреждениями и рубцовыми стриктурами желчных протоков. Им было выполнено 269 операций. Большую часть больных составили женщины работоспособного возраста (57,5%). Главной причиной ятрогенных травм желчных протоков являются, прежде всего, технические ошибки хирурга во время операции, грубые манипуляции в зоне гепатодуоденальной связки, а также поспешность при выполнении определенных этапов хирургического вмешательства. Наряду с этим, возникновению технических ошибок могут способствовать и объективные причины, такие как инфильтрат в области шейки желчного пузыря, плохо контролируемое кровотечение во время операции, наличие пузырно-холедохеального свища, аномальное расположение пузырных протока и артерии. Предпосылкой к повреждению гепатикохоледоха служит сочетание узко- 28 го общего желчного протока с коротким пузырным протоком. При этом во время тракции за карман Гартмана хирург принимает подтянутый общий желчный проток за пузырный проток и иссекает его. При синдроме Мириззи или наличии пузырно-холедохеального свища желчный пузырь «сидит верхом» на холедохе и хирург может иссечь стенку желчного пузыря со сращенным с ним желчным протоком. Наш собственный опыт пересечения гепатикохоледоха составляет 51 наблюдение (за 40 лет на 29687 холецистэктомий частота травмы протока составила 0,17%). Пятнадцать пациентов были доставлены в клинику из других стационаров города и области. Таким образом, в клинике находились на лечении 66 больных с ятрогенными травмами желчных протоков. Травма протока возникла при ЛХЭ у 29 пациентов, во время открытой операции у 27 больных. Из собственных наблюдений повреждения гепатикохоледоха острый холецистит имелся у 26 больных, синдром Мирризи у 4, холецистодуоденальный свищ у 2, аномалии билиарного тракта выявлены у 1 больной. В 13 наблюдениях причинами травмы стали ошибки хирургов во время операции. (Таблица 1). Таблица 1. Характер повреждения внепеченочных желчных протоков Характер повреждения Пристеночное ранение Полное пересечение Клипирование или перевязка Коагуляционный некроз Всего больных Число больных 30 16 12 8 66 К сожалению, ятрогенные повреждения протоков не всегда распознаются во время операции. В нашей клинике лишь у 87% пациентов травма гепатикохоледоха была выявлена при первичной операции. Желчеистечение из ворот печени или в области гепатодуоденальной связки, контрастирование при операционной холангиографии только дистального отдела гепатикохоледоха и отсутствие выделения желчи из культи пузырного протока позволили своевременно диагностировать повреждение желчевыводящих протоков. У 7 больных травма желчного протока было заподозрена в 1-3 сутки после операции на основании появления клиники перитонита, желтухи или желчеистечению по улавливающему дренажу. Отсутствие четкой клинической картины, УЗИ признаков желчного перитонита, привели к диагностике травмы протока у 8 больных более чем через 7 суток после операции. Для диагностики ятрогенных повреждений желчных протоков использовали УЗИ, при котором обращали внимание на дилатацию внутрипеченочных желчных протоков и обрыв визуализации тени протока на различном уровне, ЭРХГ (рис.1). При небольшом пристеночном ранении гепатикохоледоха, обнаруженном при первичной операции испольЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Рис.1. ЭРХГ. На холангиограмме виден обрыв тени правого печеночного протока с фиксированной в нем дренажной трубкой. зовали первичный шов протока с последующим дренированием его через культю пузырного протока. При выполнении лапароскопической операции возможно пристеночное клипирование стенки протока при условии сохранения адекватного пассажа желчи. Такие вмешательства выполнены у 6 пациентов с хорошими ближайшими и отдаленными результатами. При значительных размерах дефекта стенки протока (более чем на 1/2 просвета) выполняем пластику гепатикохоледоха на Т-образном дренаже в поперечном или продольном направлении однорядным прецизионным швом рассасывающейся атравматической нитью Полисорб 4/0 или 5/0. Этот вид оперативного вмешательства также применяем при полном пересечении протока и отсутствии диастаза между проксимальной и дистальной культей. В пяти наблюдениях при пристеночном повреждении правого долевого протока (3 больных) или иссечении общего желчного протока (2 пациента) выполняли ЭПСТ со стентированием гепатикохоледоха пластиковыми стентами. (Таблица 2). Таблица 2. Виды хирургических вмешательств у больных со «свежими» повреждениями желчных протоков Вид операции Первичный шов протока Пластика протока на Т-дренаже Пластика протока на дренаже Вишневского Эндопротезирование Гепатикоэнтеростомия на СТД Гепатостомия Всего больных Число больных 11 26 6 Стриктура Умерло 3 1 1 1 4 2 1 5 7 9 7 66 ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ В тех ситуациях, когда распознать повреждение протока удается лишь через 2 и более суток после первой операции, выполнение восстановительной операции становится проблематичным. Это связано со значительной инфильтрацией тканей подпеченочного пространства, а также тем, что у подавляющего большинства больных проток на значительном протяжении оказывался резецированным вместе со стенкой желчного пузыря. В таких ситуациях целесообразно выполнение реконструктивных вмешательств с использованием транспеченочных каркасных дренажей. Мы полностью отказались от холедохо- или гепатикодуоденостомии, несмотря на их кажущуюся простоту, так как 27,9% больных, госпитализированных к нам с рецидивами стриктуры желчных протоков в прошлом перенесли данную операцию. Пяти пациентам при ожоговой травме протока или с поздно диагностированным желчным перитонитом выполнили гепатикостомию. Один из них умер, у четырех – в качестве второго этапа хирургического лечения использовали реконструктивную операцию. Послеоперационная летальность составила 12,5% (умерли 5 пациентов). Причиной смерти стали ТЭЛА – 1, ОППН – 4. К развитию ППН привели поздно поставленный диагноз, тяжесть осложнения и превышенный объем операции. Таким образом, при интраоперационной диагностике краевого повреждения гепатикохоледоха показано выполнение восстановительной операции в объеме ушивания, пристеночного клипирования желчного протока, или эндоскопическое проведение стента выше зоны повреждения. При значительном повреждении протока целесообразно использование реконструктивной операции. Условиями для ее выполнения является диаметр поврежденного протока более 4 мм, достаточная толщина стенки. В остальных случаях предпочтительным является наружное дренирование желчных протоков с выполнением реконструктивной операции через 2 – 3 месяца после травмы гепатикохоледоха. При обнаружении повреждения желчных протоков в послеоперационном периоде, при клинических признаках перитонита показана лапаротомия, ревизия брюшной полости с наружным дренированием поврежденных желчных протоков, при отсутствии клинической картины перитонита - выжидательная тактика с выполнением реконструктивного вмешательства через 2 - 3 месяца. После перенесенной травмы протока рубцовые стриктуры гепатикохоледоха развиваются у 20-30% больных. Почему это происходит? Для этого существуют объективные причины: наложение анастомоза с тонкостенной узкой проксимальной культей пересеченного протока; особенности кровоснабжения гепатикохоледоха, заключающиеся в том, что чрезмерная мобилизация краев культи приводит к ее ишемии с развитием грубого калезного рубца в зоне шва протока. Рубцовая стриктура формируется у больных с негерметично наложенным билиодигестивным или билиобилиарным анастомозом, что обусловлено раздражающим действием желчи на окружающие ткани и инфекцией, способствующей замедлению созревания соединительной ткани и образованию рубца в зоне анастомоза. Наиболее частыми техническими погрешностями при выполнении хирургических вмешательств по поводу ятрогенных повреждений желчных протоков является: 29 стремление выполнить восстановительную операцию, даже при обширной травме протока, одномоментное наложение билиодигестивного анастомоза с проксимальной культей гепатикохоледоха, диаметр которой менее 4-5мм, использование многорядного шва и нерассасывающегося шовного материала, недостаточная прецизионность анастомозов, отсутствие опыта выполнения реконструктивных и восстановительных операций на внепеченочных желчных протоках. При выполнении гепатикостомии наиболее частыми ошибками является стремление интубировать внутрипеченочные протоки дренажами максимального диаметра, что сопровождается развитием трофических расстройств и гиперплазии слизистой оболочки долевых протоков, наложение грубого циркулярного шва выше зоны повреждения для фиксации дренажей, что способствует развитию грубой рубцовой ткани выше уровня пересечения протока, стремление дренировать подпеченочное пространство дренажами диаметром более 7-10 мм, что приводит к значительному болевому синдрому в послеоперационном периоде и не улучшает отток желчи. Таким образом, наименьшие тактические и технические проблемы возникают при точечном или линейном ранении одной из стенок магистральных желчевыводящих протоков. При небольшом пристеночном повреждении протока целесообразно использовать узловые швы рассасывающимся шовным материалом с атравматичной иглой с последующим наружным дренированием желчевыводящих протоков. При пересечении или иссечении гепатикохоледоха с оставлением целостности одной из его стенок возможно эндопротезирование протока или выполнение восстановительной операции с длительным наружным дренированием. При более обширной травме протока показано выполнение реконструктивных вмешательств. При термической травме гепатикохоледоха следует ограничиться наружной холангиостомией с выполнением реконструктивной операции через 2-3 месяца. С 1965 года у нас находились на лечении 198 пациентов с рубцовыми стриктурами желчевыводящих протоков или билиодигестивных анастомозов, наложенных по поводу травмы протока. (Таблица 3). Таблица 3. Виды первичных операций у больных со стриктурой желчных протоков Характер операции Традиционная холецистэктомия Число больных 121 Холецистэктомия, холедохотомия 11 Малоинвазивная холецистэктомия 62 Резекция желудка 4 Всего больных 198 У подавляющего числа пациентов чаще всего зонами локализации рубцовой стриктуры являлись: бифуркационная стриктура 0 - или трансбифуркационная стриктура. Гораздо реже встречались дуктальные стриктуры. Технически проще выполнять операции у пациентов с полной обструкцией желчных протоков, так как имеющаяся холангиоэктазия позволяет создать достаточный диаметр билиодигестивного соустья. При наличии достаточной проксимальной культи желчного протока (стриктура +2,+1 или 0) и не измененной рубцовым процессом слизистой, считаем целесообразным накладывать гепа- 30 тикоэнтероанастомоз с выключенной петлей кишки рассасывающейся нитью прецизионным швом без длительного каркасного дренирования При высоких стриктурах выделить из рубцовых тканей и сопоставить неизмененные слизистые сшиваемых стенок протока и кишки не представляется возможным. Такой анастомоз в отдаленном периоде с большой долей вероятности рубцуется. Выходом из этого положения считаем использование каркасных дренажей, на котором соустье формируется длительное время. При развитии в послеоперационном периоде гемобилии, используем дренаж для введения гемостатических препаратов, а при появлении атак холангита – антибиотиков. Дренаж извлекаем через 1 – 3 года после операции. Вместе с тем, наличие дренажных осложнений (гемобилия, внутрипеченочное абсцедирование, синдром недренируемой доли, дислокация дренажей) способствовало тому, что сначала мы использовали различные модификации траспеченочных дренажей, а затем и вовсе ограничили показания к их применению. (Таблица 4). Таблица 4. Виды хирургических вмешательств у больных со стриктурой желчных протоков Виды операций Гепатикодуоденостомия Гепатикоэнтеростомия Гепатикоэнтеростомия на СТД Билиобилиарный анастомоз Эндопротезирование Всего операций Число больных 13 88 68 22 7 198 Число операций 13 92 76 22 7 210 Рецидив стриктуры 4 3 4 3 14 Рецидив стриктуры в сроки от 3 месяцев до 10 лет отмечен у 4 больных (1,9%). Попытки эндопротезирования при стриктуре магистральных желчных протоков были предприняты у 7 больных. Метод показал хорошие результаты при низких стриктурах (4 наблюдения), когда введение эндопротеза позволило раздренировать желчные пути и ликвидировать желтуху. При высоких (бифуркационных) стриктурах мы не добились хороших результатов в связи с транспозицией протеза в паренхиму печени и отсутствием эффекта от манипуляции. Всех больных (3) пришлось оперировать. Умерли два больных от прогрессирования почечно-печеночной недостаточности. Оценивая отдаленные результаты реконструктивных операций при стриктурах гепатикохоледоха, мы не выявили существенных различий между теми вмешательствами, которые выполнялись с помощью прецизионного шва, и теми, где использовалось длительное каркасное дренирование. В связи с этим, мы считаем, что в настоящее время при хирургической коррекции рубцовых стриктур желчных протоков или наложенных ранее билиодигестивных анастомозов, при уверенности в полном иссечении рубцовых тканей и достаточной ширине проксимальной культи протока целесообразно использование прецизионных анастомозов. При невозможности адекватного иссечения рубцовых тканей в зоне стриктуры, значительных воспалительных изменениях слизистой оболочки культи протока, а также при небольшом диаметре проксимальной культи, показано выполнение реконструктивных вмешательств с длительным каркасным дренированием. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Малоинвазивное хирургическое лечение обтурационного гнойного холангита А.В. Столин, Е.В. Нишневич, М.И. Прудков ГБОУ ВПО «Уральская государственная медицинская академия» Минздравсоцразвития России Г. Екатеринбург Введение Возрастающий удельный вес билиарной патологии в настоящее время привлекает все большее внимание хирургов. Согласно общепринятой концепции, камень или опухоль перекрывают просвет желчного протока, развивается механическая желтуха, сопровождающаяся холестазом, билирубинемией и ахолией. Гнойный холангит, рассматриваемый ранее как спутник механической желтухи, в настоящий момент приобретает статус самостоятельной проблемы. Связано это не только с высокой летальностью – 15 - 60%, но и, в первую очередь, с его ключевой ролью в развитии билиарного сепсиса. Нарушение оттока желчи с присоединением инфекции ведет не только к вовлечению огромной поверхности (до 10 м2) желчных протоков в воспалительный процесс, но и образованию дефектов в защитном слое клеточных мембран [1]. Увеличение количества микроорганизмов и эндотоксинов в кишечнике, в совокупности с повреждением слизистой кишечника, ведут к их транслокации в портальный кровоток [2]. Известны данные об увеличении эндотоксемии в воротной вене при механической желтухе [3]. В печени находится до 80% клеток ретикулоэндотелиальной системы и соответственно фиксированных макрофагов. Глубокая ишемия печени, развивающаяся при механической желтухе, приводит к снижению функции печеночных и купферовских клеток, что непосредственно сказывается на состоянии иммунитета и появлении множественных абсцессов [4]. Материалы и методы На клинических базах кафедры хирургии факультета повышения квалификации и последипломной подготовки Уральской государственной медицинской академии с 1999 по 2010 г. методами малоинвазивной хирургии оперировано 3497 пациентов по поводу острого калькулезного холецистита и других осложнений ЖКБ. В настоящее исследование включены, 136 больных острым калькулезным холециститом (ОКХ), холедохолитиазом, обтурационным гнойным холангитом (ОГХ), что составляет 3,9% от общего числа больных оперированных с ургентными осложнениями калькулезного холецистита. Предметом анализа являлись данные анамнеза, клинико-лабораторные показатели, данные инструментальных методов исследования, операционные находки, особенности оперативных вмешательств, данные гистологического исследования операционных препаратов, течение послеоперационного периода, всего 96 самостоятельных критерия. Результаты При поступлении все больные отмечали быстрое развитие заболевания с характерными жалобами: боль ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ в правом подреберье, ознобы, желтуха в течение первых часов или суток. Согласно полученным данным, клинические показатели всей группы больных заметно отличались от нормальных значений. У пациентов наблюдались тахикардия, увеличение частоты дыхания, гипертермия, что является клиническим проявлением синдрома системной воспалительной реакции (Чикаго, 1992 г.) [6] (табл.1). Таблица 1. Клинические показатели всей группы пациентов Показатель Норма Пульс уд / мин. АД сист. мм рт.ст. АД диаст. мм рт.ст. Частота дыханий Т °С 60 – 80 110 – 140 60 – 90 14 – 18 36,3 – 37,0 Средний показатель 105,7 + 13,49: 107,56 + 11,9 62,66 + 9,57 21,99 + 3,18 37,9 + 1,02 Число наблюдений 136 136 136 136 136 Анализ лабораторных показателей выявил увеличение билирубина и ферментов, мочевины и креатинина, достоверное увеличение лейкоцитов, лейкоцитарного индекса интоксикации (табл.2). Таблица 2. Исходные лабораторные показатели у всей группы больных Показатель Норма Больные Гемоглобин, 125 – 155 106,29 + 3,08 г / л. 3,12 + 0,36 Эритроциты, ґ 3,7 – 5,0 Лейкоциты, ґ 4,0 – 9,0 14,51 + 1,15 ЛИИ, ед. 0,3 – 1,5 6,15 + 0,83 Общий белок, 64 – 83 55,51 + 3,39 г / л. Билирубин, 3,4 – 20,5 58,4 + 19,7 мкмоль/л. ALT, ед/л. 5 – 55 140,07+ 4,35 Мочевина, 2,5 – 9,2 13,26 + 2,51 ммоль/л. Креатинин, 53 – 115 149,21 + 20,63 мкмоль/л. Амилаза, ед / л. 18 – 32 28,75 + 3,6 Количество Критерий наблюдений Стьюдента 136 < 0,01 136 136 115 < 0,01 < 0,01 < 0,01 114 < 0,05 136 < 0,001 105 < 0,05 136 < 0,05 136 < 0,05 136 > 0,05 Характеризуя исследуемую группу больных, можно констатировать, что полученные средние значения клинико-лабораторных данных в сочетании с органными и системными дисфункциями свидетельствуют о наличии у пациентов системного воспаления. Сравнительное изучение клинических и лабораторных параметров проводилось для определения структуры генерализованного системного воспаления у паци- 31 Рис. 1. Распределение системного воспаления по тяжести проявления. Рис.2 Сопутствующая терапевтическая патология. ентов с ОГХ (табл.3). При нарастании тяжести системного воспаления отмечалось достоверное значительное увеличение прямых показателей интоксикации: концентрации лейкоцитов, лейкоцитарного индекса интоксикации, рост критериев системной воспалительной реакции (тахикардия, тахипное, лихорадка). Показатели красной крови отвечали на прогрессирование воспаления снижением концентрации гемоглобина и эритроцитов. Происходило уменьшение нагнетательной функции сердца в виде гипотонии. Нарастала почечно-печеночная недостаточность по всем показателям, с наиболее выраженным сдвигом при септическом шоке. Прокальцитониновый тест, в предоперационном периоде был изучен у 14 (10,3%) пациентов. Уровень прокальцитонина у всех пациентов с сепсисом и тяжелым сепсисом составил от 2 до 10 нг/мл. Полученные результаты подтверждают высокую ценность прокальцитонинового теста как маркера системного воспаления. В динамике, в результате лечения наиболее значимое снижение клинико-лабораторных показателей наблюдалось в группе пациентов с синдромом системной воспалительной реакции: нормализация пульса, температуры, билирубина, мочевины, значимая тенденция к нормализации показателей гемограммы, печеночных ферментов. При септическом шоке отмечалось ухудшение практически всех клинико-лабораторных показателей: выраженная гипотония, прогрессирование острой дыхательной недостаточности с переводом пациентов на искусственную вентиляцию легких, снижение диуреза, нарастание печеночных ферментов, билирубина, мочевины, амилазы, гипопротинемии, анемии, увеличение лейкоцитоза в среднем на 26,5%, ЛИИ – на 14,8%, присоединение полиорганной недостаточности. На основании полученных клинико-лабораторных данных системное воспаление по стадиям распредели- 32 Рис. 3 Показатели значений прогностических шкал у пациентов всей группы. лось следующим образом: синдром системной воспалительной реакции – 26,5% пациентов, сепсис – 57,8%, тяжелый сепсис – 15,4%, септический шок – 1,7% (рис.1). У большинства пациентов отмечалась сопутствующая терапевтическая патология. Ишемическая болезнь сердца наблюдалась – у 98 человек (72,1%), гипертоническая болезнь – у 88 (64,7%) человек, сахарный диабет – 22 человек (16,2%), хронические заболевание почек без ХПН – 9 человек (6,6%), заболевания органов дыхания – 13 (9,4%) человек, проявление ожирения III-IV степени – 17 (9,9%) человек, прочие заболевания – 10(6,9%) человек. Сочетание патологии по разным системам зарегистрировано у 84 (61,7%) пациентов (рис.2). При анализе структуры сопутствующих заболеваний выяснено, что чем тяжелее степень системного воспаления, тем чаще у пациентов выявлялись различные сочетанные терапевтические заболевания в стадии декомпенсации. Течение основного заболевания осложнялось органной и полиорганной недостаточностью: острая дыхательная – 17(12,5%), острая сердечно-сосудистая – 38(27,9%) пациентов, острая почечная – 22(16,2%), острая печеночно-почечная – 61(44,9%), синдром полиорганной недостаточности – 25(18,4%) пациентов. Таким образом, системная воспалительная реакция оказывает значительное влияние на течение сопутствующей терапевтической патологии, а развитие и нарастание степени декомпенсации органов и систем свидетельствует о наличии тяжелых форм системного воспаления. Результаты оценки тяжести и угрозы неблагоприятного исхода лечения данной группы пациентов по интегральным шкалам существенно отличалась от значений, характерных для благоприятного течения заболевания (рис.3). Перед началом лечения она характеризовались как группа пациентов с достаточно серьезным прогнозом. По мере нарастания степени системного воспаления (от синдрома системной воспалительной реакции до септического шока) у пациентов с ОГХ наблюдалась выраженная отрицательная динамика; чем тяжелее течение процесса, тем ярче были клинико-лабораторные проявления, а, следовательно, тем чаще приходилось активизировать лечение. Наличие гнойного холангита считали показанием к неотложной операции. Объем вмешательства определялся характером выявленной патологии. Во всех случаях операция заканчивалась наружным дренированием холедоха. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Таблица 3. Клинико-лабораторные данные больных в зависимости от степени системного воспалительного процесса Показатели Пульс уд/мин. АД сист. мм рт. ст. Частота дыханий АLТ, ед/л. АSТ, ед/л. Креатинин, мкмоль/л. Лейкоциты, ґ Мочевина, ммоль/л. ЛИИ, ед. Эритроциты,ґ ССВР = 34 При поступле10 день нии (п.о) 92,35+13,52 76,1+3,2* 32,15+12,2 130,3+3,5 20,15+2,85 19,3+0,7 85,35+11,7 56,1+2,1* 114,85+25,93 62,3+1,76* 109,5+22,71 Сепсис = 78 Тяжелый сепсис = 21 Септический шок = 3 В начале 10 день В начале В начале 10 день (п.о.) ч\з 12 часов лечения (п.о.) лечения лечения 103,85+13,1 91,5+3,8* 110,08+25,7 93,2+21,2* 116,4+6,8 119,3+6,8 112,5+11,15 128,8+10,1 100,35+14,2 115,7+16,3* 75,25+10,02 30,1+4,5* 21,1+2,3 18,0+0,6 22,3+3,5 20,1+2,3 24,42+4,1 ИВЛ* 142,45+27,8 67,6+1,8* 154,45+34,95 73,5+2,5* 178,05+4,2 182,3+4,9 121,9+27,5 88,5+1,4* 154,9+18,25 104,6+3,8* 190,9+10,13 198,3+5,7 84,7+21,3* 126,3+12,2 87,3+10,9* 145,6+19,95 107,3+21,5* 215,45+27,7 213,7+25,6 8,25+1,05 6,9+0,9* 11,53+0,92 10,6+1,2 16,06+0,89 10,9+1,1* 22,2+1,75 28,1+1,28* 9,91+3,5 5,8+4,8* 12,6+2,03 10,2+3,0 12,9+1,25 10,7+1,3 17,65+3,25 19,5+2,3 3,05+0,95 3,65+0,25 2,7+0,8 4,1+0,1 4,87+0,6 3,24+0,15 3,6+0,54* 3,45+0,2 7,78+0,57 3,0+0,25 4,1+0,48* 3,21+0,4 8,53+1,2 2,6+0,79 9,8+1,1 0,3+0,8 *Р<0,01 Таблица 4. Госпитальная летальность хирургического лечения больных обтурационным гнойным холангитом в зависимости от степени выраженности системного воспаления. Воспалительная реакция ССВР Сепсис Тяжелый сепсис Септический шок Всего Первая группа, n=44 Количество Летальность (%) больных (%) 0 (0%) 0 (0%) 33 (75%) 3 (9,1%) 9 (20,5%) 3 (33,3%) 2 (4,5%) 2 (100%) 44 (100%) 8 (18,2%) Деструктивные формы острого холецистита не осложненные перитонитом имели место у 44(32,4%) больных (1 группа). Из них флегмонозный холецистит – у 32(72,3%) больных, а гангренозный у 12(27,7%) больных. В целях предотвращения угрозы перитонита всем этим больным была выполнена неотложная трансабдоминальная операция - холецистэктомия, холедохолитотомия с наружным дренированием по Керу из минилапаротомного доступа. По клинико-лабораторным данным в этой группе генерализованное системное воспаление развивалось по типу сепсиса у 33(75,0%) пациентов, тяжелого сепсиса – у 9(20,5%) и септического шока – у 2(4,5%). Во время операции у 30 пациентов производился забор желчи из холедоха с целью дальнейшего бактериологического исследования. Рост микрофлоры получен в 28 (93.3%) случаях. Превалирующими микроорганизмами являлись E.coli – 33.3%, Ps.aeruginosae – 20%. Посев крови на стерильность и чувствительность к антибиотикам проведен у 27(19,9%) больных. Из них пациентов с сепсисом и тяжелым сепсисом 19(70,3%). Бактериемия выявлена только в 6(22,2%) случаев. Полученные данные подтверждают, что наличие верифицированной бактериемии является совсем не обязательным признаком сепсиса и главный акцент при диагностике системного воспаления необходимо делать на клиническую картину, а не на выявление микроорганизма в крови. Обтурационный гнойный холангит без признаков ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ Вторая группа, n=92 Количество Летальность (%) больных (%) 34 (37%) 0 (0%) 45 (48,9%) 3 (6,7%) 12 (13%) 3 (25%) 1 (1,1%) 1 (100%) 92 (100%) 7 (7,6%) Итого, n=136 Количество Летальность (%) больных (%) 34 (25%) 0 (0%) 78 (57,4%) 6 (7,7%) 21 (15,4%) 6 (28,6%) 3 (8,2%) 3 (100%) 136 (100%) 15 (11,0%) деструкции желчного пузыря был выявлен у 92(67,6%) больных (2 группа). Непосредственной угрозы перитонита у этих пациентов не было и первым этапом оперативного лечения им была выполнена эндоскопическая папиллосфинктеротомия. По клинико-лабораторным данным в этой группе генерализованное системное воспаление развивалось по типу синдрома системной воспалительной реакции – у 34(36,3%) пациентов, по типу сепсиса - у 45(48,9%) , тяжелого сепсиса – у 12(13,1%) и септического шока – у 1(1,7%). У 2-х пациентов не удалось удалить камни. Осложнения (кровотечение, панкреатит) развились у 6 человек. Все они лечились консервативно. Летальность в первой группе составила 18,2 %, во второй 7,6%. Во всех случаях причиной неблагоприятного исхода лечения больных являлось прогрессирование полиорганной недостаточности или не купируемый септический шок. Смертельных исходов, связанных с осложнениями ближайшего послеоперационного периода зафиксировано не было (табл.4). Из представленных данных видно, что исходно степень системного воспаления более выражена у пациентов, которых пришлось оперировать трансабдоминально. Скорее всего, это связано с наличием дополнительного гнойно-деструктивного процесса в желчном пузыре. По клинико-лабораторным данным генерализованное системное воспаление в этой группе проявлялось в виде тяжелого сепсиса и септического шока у 25% боль- 33 ных. Во второй группе больных, у которых дренирование билиарного тракта осуществлялось эндоскопически, этот показатель составил 14%. Обсуждение. Известно, что гнойный холангит значительно отягощает течение механической желтухи, обуславливая быстрое развитие билиарного сепсиса. Использование для диагностики генерализованного системного воспаления критериев АССР/SCCM способствует проведению ранних диагностических мероприятий, и способствует объективизации оценки тяжести состояния больных. Полученные данные свидетельствуют о нарастании риска неблагоприятного исхода при гнойном холангите по мере прогрессирования системной воспалительной реакции. Это означает, что консервативное лечение подобных больных недостаточно эффективно. Необходимость в оперативном лечении становится более настоятельной по мере нарастания признаков системного воспаления. Исключение составляют больные с септическим шоком. Прогнозируемая летальность у этих пациентов по балльной оценке составляет от 80 до 100%. В нашей практике умерли все 3 пациента, независимо от варианта предпринятого хирургического лечения. На наш взгляд, это обстоятельство свидетельствует о том, что в этом состоянии хирургическое вмешательство не должно предприниматься. Первоочередной задачей в лечении подобных пациентов должно быть купирование явлений шока, а хирургическое лечение должно предприниматься только после стабилизации состояния. Наиболее благоприятные результаты лечения больных гнойным холангитом получены в группе пациентов, у которых предпринималась ретроградная трансдуоденальная декомпрессия желчных протоков. Активная хирургическая тактика лечения с ранним выполнением эндоскопической папиллотомии является вполне адекватной данной патологии и исходной тяжести состояния больных. Результаты лапаротомной операции, даже минимально инвазивной, у больных гнойным холангитом оказались хуже. Однако, следует учитывать, что пациенты этой группы, тяжелее, поскольку у них, кроме гнойного холангита, имеется ургентный гнойнодеструктивный процесс в желчном пузыре. Выводы 1. Оценка клинико-лабораторных параметров системного воспаления вместе с формализацией последнего (сепсис, тяжелый сепсис, септический шок) способствуют объективной оценке тяжести состояния и может быть использована для диагностики ОГХ, выбора хирургической тактики и оценки прогноза предпринимаемого лечения. 2. Больные ОГХ с септическим шоком, в первую очередь, нуждаются в проведении противошоковых мероприятий. После стабилизации показателей гемодинамики появится возможность выполнения тех или иных хирургических процедур. 3. ЭПСТ – эффективная и наименее травматичная операция у больных обтурационным гнойным холангитом, не имеющих признаков ургентного гнойнодеструктивного процесса в желчном пузыре. 4. Трансабдоминальная операция из минидоступа 34 наиболее оправдана для удаления желчного пузыря с одномоментным вмешательством на протоках при лечении гнойно-деструктивных форм острого калькулезного холецистита осложненных ОГХ, а также при отсутствии возможности выполнения ЭПСТ. Список литературы. Kakkos S.K., Vagenas C.A., Androulakis J.A. Conservative surgery in the treatment of hepatic hydatidosis.//Eur J Surg.- 1995.-161- Vol.- 6/-P. 415—420. Воротынцев А.С., Гостищев В.К., Кириллин А.В., Меграбян Р.А. Выбор дифференцированной тактики лечения больных острым холециститом, осложненным гнойным холангитом.// РМЖ – 2010.-Т. 13- № 25.-C 1642-1647. Ахаладзе Г.Г. Патогенетические аспекты гнойного холангита, почему нет системной воспалительной реакции при механической желтиухе?// Анналы хирургической гепатологии.- 2009.- Т. 14.- № 4.-С. 9-15. Bone RC, Balk RA, Cerra FB, et al. American College of Chest Physicians//Society of Critical Care Medicine Consensus Conference: Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med.- 1992.-20.-P.864–874. ЭНДОВИДЕОХИРУРГИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ СЕГОДНЯ