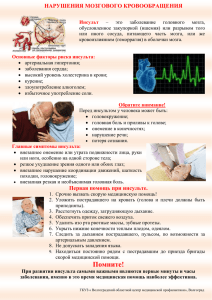
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ
advertisement

ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ Н.И. ПИРОГОВА» МИНЗДРАВА РОССИИ И ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ПЕРВЫЙ МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ И.М. СЕЧЕНОВА» МИНЗДРАВА РОССИИ На правах рукописи ГОМБОЕВА НОМИН АЖИПОВНА КЛИНИКО-ПАТОФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ТЕЧЕНИЯ ИШЕМИЧЕСКОГО ИНСУЛЬТА С РАННЕЙ И ПОЗДНЕЙ ВИЗУАЛИЗАЦИЕЙ 14.01.11 - нервные болезни 14.03.03 - патологическая физиология ДИССЕРТАЦИЯ НА СОИСКАНИЕ УЧЕНОЙ СТЕПЕНИ КАНДИДАТА МЕДИЦИНСКИХ НАУК НАУЧНЫЕ РУКОВОДИТЕЛИ: доктор медицинских наук, профессор С.А. РУМЯНЦЕВА доктор медицинских наук, профессор Е.В. СИЛИНА Москва - 2015 1 Оглавление ВВЕДЕНИЕ .............................................................................................................. 4 Глава 1. ОБЗОР ЛИТЕРАТУРЫ .......................................................................... 10 1.1. Патофизиологические изменения при ишемическом инсульте. ............ 10 1.2. Ранние лабораторные изменения при остром ишемическом инсульте. 17 1.3. Компьютерная томография в диагностике ишемического инсульта. .... 20 1.4.Другие современные методы визуализации ишемического инсульта. ..... 27 1.5. Энергодефицит при ишемическом инсульте и его фармакологическая коррекция. .............................................................................................................. 32 Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ ................................ 37 2.1. Характеристика больных. .......................................................................... 37 2.2. Методы исследования................................................................................. 44 2.3. Методы статистической обработки результатов исследования. ............ 47 Глава 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ...................................................... 49 3.1. Клинические особенности острого ишемического инсульта при ранних и поздних сроках его визуализации ................................................................. 49 3.2. Госпитальный исходи динамика функционального статуса ишемического инсульта при ранних и поздних сроках его визуализации. . 63 3.3. Инструментальные особенности острого ишемического инсульта с ранней и поздней визуализацией...................................................................... 68 3.4. Лабораторные особенности острого ишемического инсульта при ранних и поздних сроках его визуализации. ................................................... 72 3.5. Корреляционный анализ острого ишемического инсульта с ранней и поздней визуализацией ...................................................................................... 90 3.6. Результаты катамнестического исследования. ........................................ 93 ЗАКЛЮЧЕНИЕ ..................................................................................................... 98 ВЫВОДЫ ............................................................................................................. 107 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ............................................................. 109 КЛИНИЧЕСКИЕ ПРИМЕРЫ ............................................................................ 110 СПИСОК ЛИТЕРАТУРЫ................................................................................... 120 2 СПИСОК СОКРАЩЕНИЙ АГ АД АЛТ АДФ АМФ АОТ АСК АСТ АТФ АЧТВ ГЭБ ДАД ДВИ ИБС ИИ ИМ КТ КЩС ЛДГ ЛСМА МА МНО МСКТ ПВИ МРТ ОАК ОНМК ПВ ПВр ПИКС ПСМА ПТИ ПЭТ РВ САД СД СМА ТИА ТВ ХИГМ ЦВБ ЧСС Са Cl HCO3ˉ HU K Na pH pCO2 pO2 sO2 Артериальная гипертензия Артериальное давление Аланинаминотрансфераза Аденозиндифосфат Аденозинмонофосфата Антиоксидантная терапия Аскорбиновая кислота Аспартатаминотрансфераза Аденозинтрифосфат Активированное частичное тромбопластиновое время Гематоэнцефалический барьер Диастолическое артериальное давление Диффузно-взвешенное изображение Ишемическая болезнь сердца Ишемический инсульт Инфаркт миокарда Компъютерная томография Кислотно-щелочное состояние Лактатдегидрогеназа Левая средняя мозговая артерия Мерцательная аритмия Международное нормализованное отношение Мультиспиральная компьютерная томография Перфузионно-взвешенное изображение Магнитно-резонансная томография Общий анализ крови Острое нарушение мозгового кровообращения Поздняя визуализация Протромбиновое время Постинфарктный кардиосклероз Правая средняя мозговая артерия Протромбиновый индекс Позитронно-эмиссионая томография Ранняя визуализация Систолическое артериальное давление Сахарный диабет Средняя мозговая артерия Транзиторная ишемическая атака Тромбиновое время Хроническая ишемия головного мозга Цереброваскулярная болезнь Частота сердечных сокращений Кальций Хлор Актуальный бикарбонат Хаунсфилд Калий Натрий Кислотоно-щелочное равновесие Парциальное давление углекислого газа Парциальное давление кислорода Сатурация кислорода 3 ВВЕДЕНИЕ Ежегодно в мире более 15 миллионов человек переносят инсульт, который является одной из основных причин летальности и приводит к тяжѐлой инвалидизации, при этом в 80% случаев инсульт является ишемическим [23, 78, 85, 88, 123, 125, 193, 202]. В Российской Федерации заболеваемость инсультом неуклонно растет и составила 235,9 на 100 тыс. населения в 2013 году, превышая показатель заболеваемости в 2012 году на 13,7%. Несмотря на достигнутые успехи Федеральной целевой программы по снижению заболеваемости, смертности и инвалидизации населения от церебрального инсульта отмечаются проблемы ранней диагностики, одна из которых связана с отсутствием очага ишемии у части пациентов [46, 66, 85]. Происходящее при этом снижение мозгового кровотока и энергодефицит запускают последовательные стадии ишемического каскада, приводящего к гибели нервных клеток по типу некроза и апоптоза [22, 56, 57, 59, 60, 61, 62, 63, 64, 65, 66, 67, 79, 149, 181]. Учитывая гетерогенный патогенез развития инсульта, выбор тактики лечения, точность и быстрота диагностики характера ишемического инсульта (ИИ) являются определяющей задачей практического здравоохранения, так как предпринятые действия, попадающие в «окно терапевтических возможностей», обуславливают исход и прогноз заболевания [38, 46, 47, 64, 80, 86, 87, 88, 109, 172, 213]. Благодаря развитию современных технологий накоплен большой опыт исследований, сфокусированных на ранней диагностике инсульта. Но вместе с тем, несмотря на множество современных методов визуализации ИИ, главным методом, входящим в стандарты, сегодня является компьютерная томография (КТ), хотя известно, что в ранние сроки КТ наиболее информативна у больных с геморрагическим инсультом. Более информативный метод магнитно - резонансной томографии используется только у 1 больного из 10 в соответствии со стандартами [19, 23, 79, 107, 114, 126, 132]. Поэтому особую актуальность приобретает тактика по отношению 4 к пациентам, имеющим клиническую картину острого инсульта, не подтвержденного методами визуализации, проводимыми при госпитализации. Отсутствие верифицированного диагноза не позволяет в полной мере осуществлять лечебные мероприятия, ограничивает продолжительность и целесообразность нахождения больных в нейроблоках симптоматики [23, 79]. Особенности клиники, исходы, клинико-биохимические корреляции и другие аспекты течения инфаркта мозга, визуализируемого с помощью КТ в разные сроки от дебюта заболевания в литературе не освещены. При этом сроки визуализации ИИ определяются патофизиологическими механизмами, приводящими к гибели ткани мозга. В данной связи целью нашего исследования стало выявление особенностей клинической картины, морфологических и патофизиологических корреляций при инфаркте мозга, визуализируемом методом КТ в разные сроки от дебюта клинических симптомов. Задачи исследования: 1. Определить частоту ишемического инсульта с ранней и поздней визуализацией. 2. Изучить клинические особенности течения и исход ишемического инсульта с ранней и поздней визуализацией на госпитальном этапе. 3. Оценить динамику морфологической картины и объема очага ишемического повреждения при инфаркте мозга, визуализированном с помощью КТ в разные сроки от начала заболевания. 4. Выявить структуру патогенетических подтипов инфаркта мозга с ранней и поздней визуализацией. 5. Исследовать динамику состояния гликолиза, ферментного состава, кислотно-основного состояния артериальной и венозной крови и гемостаза у больных ишемическим инсультом с ранней и поздней визуализацией. 5 6. Провести анализ летальности и функционального исхода пациентов с ранней и поздней визуализацией ишемического инсульта в катамнестическом периоде длительностью до 2 лет. Научная новизна Впервые проведен комплексный анализ клинико-лабораторных и нейровизуализационных изменений при ишемическом инсульте, показавший существенные различия между ранней и поздней визуализацией очага ишемии по данным компьютерной томографии, и доказавший необходимость повторного проведения нейровизуализации не только для оценки течения заболевания, но и для оптимизации интенсивной терапии инсульта. Показана взаимосвязь поздней визуализации ишемического инсульта с клинической тяжестью и неблагоприятным исходом с высокой госпитальной летальностью, а также с массивной зоной поражения вещества мозга. Установлено, что ранняя визуализация (первые 3-48 часов от начала заболевания) атеротромбоза характерна и для длительно атеротромботического развивающегося инсульта. Это системного обуславливает постепенное развитие адаптативных и приспособительных механизмов и, как следствие имеет лучший исход. Инсульт с поздней визуализацией чаще встречается при внезапно развивающемся кардиоэмболическом и других подтипах, обуславливая более тяжелое клиническое течение и худший прогноз. Впервые прослежена роль гипоксии и энергодефицита, достигающего своего максимума при поздней визуализации ишемического инсульта на 3-7 сутки на фоне истощения компенсаторных возможностей организма с более резким срывом ауторегуляции, коррелируюших с массивностью очага повреждения головного мозга, тяжелым течением и неблагоприятным исходом заболевания. Продемонстрирована возможность использования таких показателей как лактатдегидрогеназа, молочная кислота, глюкоза, pH, рСО2, рО2, sО2 6 артериальной и венозной крови в качестве маркера для оценки течения, функционального исхода и прогноза острого инсульта. Практическая значимость исследования заключается в разработке нового подхода к ранней диагностике острого ишемического инсульта, уточнении роли нарушения энергосинтеза и гипоксии в патогенезе острого инсульта с ранней и поздней визуализацией. Доказано, что в основе РВ и ПВ по данным КТ лежат нарушения составляющих аэробного и анаэробного окисления глюкозы, протекающие с определенной последовательностью, выраженностью и направленностью, определяя степень и скорость развития тканевой деструкции. Установлена корреляция данных КТ, динамики кислотно-щелочного равновесия и ферментного состава крови при остром ишемическом инсульте. Полученные данные дали возможность разработать критерии раннего прогноза, течения и исхода острого инсульта с ранними и поздними сроками его визуализации, уточнить роль нарушения энергосинтеза и гипоксии в его патогенезе, а также сформулировать патогенетически обоснованную концепцию дифференцированной терапии. Положения, выносимые на защиту У половины пациентов, проходящих лечение в сосудистом центре по поводу острого инфаркта головного мозга, очаг ишемии визуализируется на КТ позднее 6-48 часов от дебюта появления клинических симптомов. У пациентов с поздней визуализацией ИИ отмечается более тяжелое клиническое течение на протяжении всего периода госпитализации и худший исход. Постепенное развитие системного атеротромбоза и атеротромботического инсульта коррелирует с ранними сроками визуализации инсульта (первые 3-48 часов), а также активацией адаптативных механизмов. Внезапное развитие кардиоэмболического инсульта коррелирует с поздней визуализацией ИИ, тяжелым течением и худшим госпитальным прогнозом. 7 При ИИ с поздней визуализацией больше гибнет ткани мозга. Невизуализируемый в ранние сроки очаг ишемии к моменту визуализации становится в два раза больше, чем очаг, рано проявляющийся на КТ в одноименные сроки. Выраженные расстройства гликолиза и кислотно-щелочного равновесия на 1 сутки с накоплением лактатацидоза при инсульте с ранней визуализацией на фоне активации приспособительных механизмов сменяются опережающей нормализацией показателей энергосинтеза и результируются ранним развитием меньшего по размеру очага гибели нейронов. При ПВ истощаются резко активированные в дебюте инсульта резервные возможности организма, к 3-7 суткам нарастает выраженный энергодефицит и метаболический ацидоз, длительно сохраняющийся вплоть до выписки из стационара, что коррелирует с массивной гибелью нервной ткани и госпитальной летальностью. Внедрение результатов исследования в практическое здравоохранение Результаты исследования внедрены в практику работы неврологических отделений ГКБ № 15 имени О.М. Филатова г. Москвы, в первичное сосудистое отделение ГКБ скорой медицинской помощи имени В.В. Ангапова Министерства Республиканскую здравоохранения клиническую республики больницу имени Бурятия Н.А. и в Семашко Министерства здравоохранения республики Бурятия. Апробация работы Материалы диссертации доложены 29 января 2015 года на объединенной научной конференции кафедр патологии человека института профессионального образования ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, неврологии факультета дополнительного профессионального образования ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, сотрудников ГКБ №15 им. О.М. Филатова г. Москвы. Материалы диссертационной работы доложены на XXVI Международной Конференции «Мозговой кровоток, метаболизм и функции», 8 BRAIN-2013 (Шанхай, 2013),региональной конференции «Актуальные вопросы диагностики, клиники и лечения болезней нервной системы» (Пенза, 2013), I интернациональной научно-практической конференции «Наука и образование» (Белгород, 2014). Личное участие автора в получении научных результатов В выполненной работе вклад автора заключается в непосредственном его участии на всех этапах исследования: от постановки целей и задач до обсуждения результатов и научных публикаций. Автор лично проводил отбор пациентов, активно учавствовал в лечебном процессе, анализировал и обобщал полученные результаты. Автор самостоятельно наблюдала динамику пациентов, включенных в диссертационную работу, работала в медицинском архиве, создала электронную базу данных, включающую результаты клинического, лабораторного и инструментального обследования пациентов различного профиля, провела большую аналитическую работу, изучая научную медицинскую литературу, анализируя состояние проблемы диагностики острого инсульта методом КТ. Автор активно принимал участие в статистической обработке полученных данных, анализе результатов исследования и их оформлении, формулировки научных положений. Публикация результатов исследования По теме диссертации опубликовано 9 печатных работ; из них 4 работы опубликованы в центральной печати в научных журналах, рекомендованных ВАК РФ. Объем и структура диссертации Диссертация изложена на 142 страницах машинописного текста, состоит из введения, обзора литературы, главы материалы и методы, 6 глав результатов исследования, заключения, выводов, практических рекомендаций, клинических примеров и списка литературы. Работа содержит 31 рисунок, 28 таблиц. Библиографический указатель включает 215 источников, в том числе, 104 работы отечественных и 111 работ иностранных авторов. 9 Глава 1. ОБЗОР ЛИТЕРАТУРЫ Церебральный инсульт - одна из серьезнейших проблем неврологии и медицины, являющаяся глобальной эпидемией и наиболее значимой причиной летальности и инвалидизации взрослого населения. Инсульты каждый год поражают от 5,6 до 6,6 миллионов человек и уносят 4,6 миллиона жизней [23, 25, 48, 64, 79, 82]. Особенно остро стоит проблема в нашей стране, где смертность от инсульта занимает второе место в структуре общей смертности населения России и составляет 23,4%, а в структуре смертности от болезней системы кровообращения – 39% [23, 66, 78]. При этом распространенность инсульта в России составляет 350-530 случаев на 100 тыс. жителей ежегодно, что превышает показатели развитых стран, где частота возникновения инсультов составляет около 200 случаев в год [22, 38, 52, 85]. Ежегодная летальность от инсульта в России одна из самых высоких в мире и составляет 175 на 100 тыс. населения [78, 79]. Ранняя 30-дневная смертность после инсульта достигает 34%, а в течение года умирают до 48% больных [4, 13, 22, 178]. Учитывая наличие патогенетических механизмов, лежащих в основе развития ишемического инсульта, главной задачей врачебного персонала является точность и скорость диагностики характера инсульта в тот промежуток времени, в процессе которого лечение может быть наиболее эффективным, обуславливая исход и прогноз заболевания [14, 38, 66]. 1.1. Патофизиологические изменения при ишемическом инсульте Большое количество исследований как отечественных, так и зарубежных авторов посвящено вопросам этиологии, патогенеза, клиники, диагностики и лечения ишемического инсульта (ИИ). Инфаркт мозга обусловлен снижением или прекращением мозгового кровотока, вследствие чего развиваюся необратимые морфологические изменения ткани мозга [16, 42, 59, 114, 124, 171]. Известно, что вследствие снижения или прекращения 10 кровотока в очаге инфаркта выделяют две зоны: зону некроза и окружающую ее зону ишемии (пенумбру), где клетки сохраняют жизнеспособность в течение нескольких часов. В зоне некроза недостаток глюкозы и кислорода быстро приводит к истощению запасов энергии и гибели клетки, в пенумбре энергетический метаболизм остается сохранен и присутствуют лишь функциональные изменения [25, 72, 127, 187]. При инсульте происходит нарушение поставки кислорода в мозг, при этом глюкоза распадается путем анаэробного гликолиза до лактата и возникает ацидоз. Излишнее высвобождение и неполноценное обратное овладение астроцитами глутамата приводит к его нейротоксическому действию, вследствие чего в нейронах накапливается кальций, приводящий к активации липаз, протеаз и других субстанций, разрушающих клетку [29, 56, 77, 207, 214]. Кроме того, происходит уменьшение разности потенциалов мембран нейронов, ведущая к возрастанию необходимости нейронов в энергии и накоплению глутамата во внеклеточном пространстве, приводящих к образованию свободных радикалов кислорода, которые стимулируют процессы перекисного окисления липидов, вследствие чего возникает гибель нейронов [21, 31, 49, 56, 96, 215]. В результате происходящих биохимических процессов, ишемия мозга сначала приводит к цитотоксическому отеку, затем к вазогенному [55]. Цитотоксический отек развивается в первые минуты, и преимущественно затрагивает астроциты, в минимальной степени - нейроны, которые располагаются вокруг капилляров [17, 34, 45, 179]. Если кровоснабжение возобновляется, то эти изменения могут быть обратимыми[13, 60]. В обратном случае, из-за увеличения размеров астроцитов и эндотелиальных клеток просвет капилляров сокращается настолько, что даже после возобновления кровообращения кровь не может попасть в капилляры. Это усложняет ишемию и некроз [20, 32, 158]. Увеличение пропускаемости стенки капилляров происходит на этапе формирования вазогенного отека, а 11 после восстановления кровотока проницаемость гематоэнцефалического барьера (ГЭБ) увеличивается еще больше [46, 72, 162]. Одновременно c набуханием развивается некроз, которому в большей степени склонны нейроны и глия в сравнении с эндотелием [64]. Некротическая стадия развивается в первые три дня начала инсульта, и характеризуется нарушением перфузии с развитием цитотоксического набухания периваскулярных астроцитов и клеток эндотелия (цитотоксический отек мозга). Спустя 6 часов развивается нарушение гематоэнцефалического барьера с вазогенным отеком мозга, а через 24 часа возникает инфильтрация лейкоцитами [73, 83, 104, Ошибка! Неизвестный аргумент ключа., 194]. Примерно с третьего дня развивается стадия абсорбции, происходит фагоцитоз некротической ткани с максимальной выраженностью отека на 35-й день [100, 103]. Отек при ишемии становится максимальным на 2-4-е сутки после инфаркта и угасает к концу второй недели (Скворцова В.И., 2001) [77]. Далее в зоне некроза образуется воспаление, включая фагоцитоз. В фазу организации - с 10-го по 30-й день после инсульта происходит формирование постишемических кист или глиоза [76, 81, 113]. По данным ряда авторов, развитие этапов ишемического каскада происходит в первые минуты и часы инсульта, которые приводят к катастрофическому функционально-морфологическому разрушению вещества мозга [22, 77]. Запуск механизма ишемического каскада начинается со снижения скорости мозгового кровотока с дальнейшим развитием гипоксии мозга, следовательно, и дефицита энергии. Основным энергетическим субстратом для нервной системы является глюкоза [59, 203, 207]. При достаточном уровне кислорода, то есть в аэробных условиях, продукты гликолиза расщепляются в дыхательной цепи митохондрий в цикле Кребса. В норме эта энергия накапливается в виде разности потенциалов и АТФ, где расщепление одной молекулы глюкозы образует 38 молекул АТФ [54, 149, 181]. При 12 ишемическом повреждении мозга, то есть в условиях гипоксии, образование энергии реализуется путем анаэробного гликолиза, который приводит к образованию только 2 молекул АТФ и накоплению лактата [26, 214]. Скорость аэробного окисления в митохондриях снижается на начальном этапе ишемии мозга, что приводит к снижению содержания АТФ и возрастанию количества аденозиндифосфата (АДФ) и аденозинмонофосфата (АМФ),вследствие чего снижается коэффициент АТФ/АДФ+АМФ. Низкое соотношение АТФ/АДФ+АМФ активирует фермент фосфофруктокиназа (ФФК), резко повышая пропускную способность реакций бескислородного окисления [35, 203]. На этом этапе еще может произойти временная адаптация к гипоксии, однако эта адаптация сопровождается истощением запасов, накапливая продукты гликолитических реакций - молочной и пировиноградной кислот [71, 77, 95, 153, 155, 172]. Поскольку снижение регуляторно-трофических функций нервной системы происходит за счет локального или диффузного повреждения нейронов, церебральная гипоксия чаще всего является системным процессом, который вызывает развитие стресса. Гормоны стресса - катехоламины и глюкокортикоиды обостряют такие процессы как гликолиз, гликогенолиз, глюконеогенез и поставку экзогенной глюкозы в жизненно важные органы и ткани [62, 73, 96]. Роль данного приспособления высока вследствие меньшей энергетической потребности бескислородного пути сравнительно с кислородным. Последним продуктом гликолиза является молочная кислота, увеличение которой вызывает ацидоз внутри клетки. Вначале ишемического повреждения мозга клеточный ацидоз играет роль защитной реакции, поскольку снижение рН производит компенсирующее влияние на клеточные мембраны [98, 203]. Однако дальнейшее возрастание ацидоза вызывает разрушение белков и появление в цитоплазме зерен (набухших митохондрий), что проявляется в помутнении цитоплазмы, называемой «зернистой дистрофией» [26, 214]. При гипоксии усиленное освобождение лактата приводит к метаболическому лактатацидозу, который блокирует активность 13 ключевого фермента гликолиза - фосфофруктокиназу (ФФК), которая ограничивает адаптацию. На этом этапе развивается истинный недостаток АТФ, так как аэробное окисление отключается из-за гипоксии, а анаэробное из-за ацидоза [5, 31, 56, 72, 190]. Как известно, главными клеточными потребителями энергии являются градиентсоздающие и сократительные системы клетки, подвергающиеся наибольшим расстройствам. Одним из наиболее энергоемких ферментов является калий - натриевая АТФ-аза, обеспечивающая перенос ионов против градиента концентрации, тем самым поддерживая уровень потенциала покоя клетки и ее возбуждение. Подавление K/Na-АТФ-азы приводит к избыточному проникновению в цитоплазму натрия и воды с последующей гипергидратацией, развитием отека и «мутного набухания» клетки [49, 76, 102, 191, 204]. На следующем этапе ишемического каскада происходит избыточный выброс глутамата с развитием глутаматной «эксайтотоксичности», примерно через 20-30 минут от начала его запуска [195, 214]. Глутамат является основным возбуждающим участвующим в нейротрансмиттером осуществлении когнитивных нервной функций, системы, вместе с ацетилхолином, который сохраняет уровень бодрствования и в больших концентрациях является нейротоксином. Свои свойства глутамат осуществляет посредством групп ионотропных мембранных рецепторовканалов: NMDA, AMPA, каинатных рецепторов. Активация глутаматных NMDA-рецепторов происходит под регуляцией содержания калия (K+), натрия (Na+), кальция (Са2+) и хлора (Cl-) во вне- и внутриклеточном пространстве, а также активацией Ca-каналов, в связи с чем усиливается поступление внеклеточного кальция в клетку и высвобождается внутриклеточный Са2+ из депо [35, 182, 203]. В последующем происходит нарушение фосфорилированиея белков, расщепление фосфолипидов и высвобождение арахидоновой кислоты, а также выход Са2+ из депо, образование токсичных продуктов и свободных 14 радикалов, оказывающих цитоксическое, иммунногенное и мутагенное действия и осуществляющих повреждение клеточной ДНК и РНК [45, 73, 127, 141]. В связи с проникновением ионов калия, фосфата и воды в митохондрии развивается их набухание, что в свою очередь сопровождается смещением процесса в цитоплазму клетки и выходом на межклеточный уровень, делая гипоксию тканевой. При этом восстановление становится невозможным из-за активации внутриклеточных ферментов и разрушения митохондрий, соединяющихся в цитоплазме с натрием и кальцием, и формирующих эндогенные вещества, которые растворяют липидные мембраны. Вследствие чего митохондрии перестают принимать кислород и субстраты [1, 64, 73, 86, 118]. В дыхательной митохондриальной цепи кислород для клеток мозга является главным энергодонором, где молекула кислорода присоединяя атом железа цитохромоксидазы подвергается четырехэлектронной регенерации и становится водой. Однако в условиях нарушения энергообразования кислород восстанавливается неполностью, что негативно сказывается на клетке и даже приводит ее к гибели, причиной которой является образование высокореакционных, токсичных, свободных радикалов. Таким образом, повышается синтез оксида азота (NO), генерируются активные формы кислорода, активируются свободнорадикальные процессы с развитием оксидантного стресса [73, 87, 102, 149]. Особое место среди свободнорадиальных процессов занимают образование двух видов свободных радикалов, таких как активные формы кислорода (АФК), и появление при окислении липидов радикалов органического происхождения. В митохондриях, микросомах, пероксисомах внутриклеточно образуются АФК и в процессе фагоцитоза вне клетки возникают свободнорадикальные процессы, которые взаимодействуют с клеточными субстратами, оказывая мутагенный и цитотоксический эффекты [72, 172]. Однако основным механизмом токсичности АФК является их 15 способность развивать свободнорадикальное перекисное окисление липидов (СПОЛ), главным субстратом которого предстают полиненасыщенные жирные кислоты (линолевая, линоленовая и арахидоновая), которые формируют липидный слой клеточных мембран [174, 175]. Наиболее восприимчивым и склонным к обобщению свободнорадикальных реакций органом является головной мозг. На фоне ишемии возбуждение СРП активируется за счет высокого содержания в тканях мозга фосфолипидов, ионов двухвалентного железа, низкого содержания трансферрина, церулоплазмина и каталазы, высокого отношения белков/липидов, низкой активности глутатионпероксидазы, а также недостаточности антиоксидантных защитных систем в мозге [56, 155, 202]. Именно поэтому необходима антиоксидантная защита для мозга. На следующем этапе ишемического каскада развивается относительно неспецифичная реакция генома на ишемию. Возникает индукция в ядре генов раннего реагирования, «третичных мессенджеров» (гена c-fos, гена c-jun, гена krox-20, гена zif/268 и др.). Известно, что белки fos-, jun- и krox-генных семейств учавствуют в осуществлении контроля клеточного цикла, его прогрессированием, укреплению и клеточному различию, а также решают участь дифференцированных образование ДНК-связанных нейронов. белков, Экспрессия генов транскрипционных рождает факторов, усиливающих экспрессию других генов раннего реагирования, участвующих в передаче информации от клетки к клетке [65, 73, 109]. Реакции местного воспаления, микроваскулярные нарушения, повреждение ГЭБ являются отдаленными последствиями ишемии и характерны для завершающего этапа ишемического каскада. Наиболее выраженным нарушение проницаемости ГЭБ становится через несколько часов, однако присутствует с первых минут возникновения ишемии. Повреждение ГЭБ приводит к проникновению в кровь нейроспецифических белков, которые стимулируют образование аутоантител, усиливающих 16 повреждение нервной ткани и активацию вторичной аутоиммунной реакции [74, 104, 127]. 1.2. Ранние лабораторные изменения при остром ишемическом инсульте Развитие патофизиологического каскада при ишемическом инсульте связывают с избыточным накоплением воды, осмотически активных веществ, таких как натрий, хлор, бикарбонат, а также свободных радикалов и выделением токсичных веществ (фосфолипаз) [26, 169]. При развитии острой ишемии мозга происходит повреждение эндотелия сосудов, усиливающее отек из-за повреждения ГЭБ, способствуя трансформации противосвертывающих свойств эндотелия в свертывающие, тем самым усиливая адгезию тромбоцитов, лейкоцитов и способствуя формированию обструкции микроциркулярного русла, называемого феноменом невосстановимого кровотока (no-reflow phenomenon) [35, 42, 182]. В свою очередь изменение физико-химических свойств крови, прежде всего реологических и свертываемости, приводит к развитию окклюзирующих процессов, способствующих затрудняющих увеличения капиллярный вязкости образованию внутрисосудистых кровоток очаге крови, агрегации в ишемии тромбов, вследствие эритроцитов, тромбоцитов и фибриногена, возникающих из-за снижения объема циркулирующей крови, повреждения эндотелия сосудов и увеличения проницаемости капилляров [98, 182]. Эти изменения в кровеносном русле способствуют образованию отека периваскулярных и перилимфатических пространств, повышению интерстициального онкотического давления и давления во внесосудистых пространствах, приводящих к избыточному накоплению воды во внесосудистом пространстве и интерстициальному отеку [59, 169, 195]. Также повышается проницаемость мембраны для Na, в результате чего происходит внутриклеточный сдвиг жидкости, нарушается водно-солевой обмен веществ, препятствующий 17 транспортировке энергетических субстратов, ухудшающих тканевую оксигенацию, нарушая тем самым нормальное функционирование нейронов [21, 65, 134, 162]. Известно, что при инфаркте мозга ранние лабораторные изменения характеризуются изменения микоагуляционных параметров в виде укорочения активированного частичного тромбопластинового времени (АЧТВ), повышения общего фибриногена и тромбинового времени. Изменение этих показателей приводит к повышению внутричерепного давления и уменьшению легочной вентиляции, вызывая нарушение ритма дыхания, и соответственно, развитие гипокапнии и гипоксемии, проявляющихся снижением углекислого газа и кислорода в крови, при этом парциальное давление кислорода (pO2) в артериальной крови может снижаться ниже 60 мм рт ст, сатурация кислорода (SO2) становится ниже 90%, уменьшается парциальное давление углекислого газа (pCO2) [26, 195, 207]. Развитие гипокапнии снижает устойчивость организма к гипоксии, причем вначале повышается рН и нормализуется концентрация бикарбонатов, однако в дальнешем развивается метаболический ацидоз, при котором организм регистрируются борется низкие со стрессом значения посредством pCO2, снижение одышки, и концентрации бикарбонатов и рН артериальной крови, в конечном счете происходит возникновение компенсаторного дыхательного алкалоза, и соответственно нормализуется pH [98, 182, 203]. При обширном поражении головного мозга с повреждением ствола в области дыхательного центра, возникает остановка или нарушение дыхания и развивается метаболический ацидоз, образующийся вследствие накопления молочной кислоты в тканях и недостаточного ее разрушения. При этом в крови происходит избыточное накопление лактата и смещение pH в кислую сторону, и развивается лактатацидоз [35, 195, 203, 214]. При метаболическом ацидозе в течение нескольких минут происходит включение буферных систем компенсации. 18 Компенсация ацидоза достигается путем увеличения объема легочной вентиляции, стабилизируя соотношение НСО3-/Н2СО3, которое в условиях гипоксии становится меньше нормы равной 1:20 и ускоряя выведение углекислого газа из организма [98, 169, 203]. Однако ведущую роль в компенсации метаболического ацидоза выполняют почечные механизмы, поскольку причиной развития ацидоза может быть накопление лактата. В норме путѐм глюконеогенеза превращение молочной кислоты обратно в глюкозу происходит в печени, либо за счет окисления. К потребителям молочной кислоты относятся печень, почки, миокард и головной мозг, где в условиях достаточного количества кислорода лактат может окисляться до углекислоты и воды и использоваться как источник энергии [35, 182, 199, 214]. Известно, что уровень лактата в крови зависит от баланса между процессами его образования и утилизации, именно поэтому выделяют компенсированный и некомпенсированный лактатацидоз. У здоровых людей часто встречается компенсированный лактатацидоз, развивающийся при интенсивной физической нагрузке, у неприспособленных к физической работе людей лактатацидоз возникает как следствие недостатка кислорода в мышцах, компенсация при котором осуществляется путѐм гипервентиляции [26, 98, 195, 207]. Некомпенсированный лактоацидоз является следствием нарушения обеспечения тканей кислородом или кровью, из-за нарушения метаболизма пирувата, причем уровень молочной кислоты в крови может достигать 5 ммоль/л, а рН может быть ниже 7,25. Кроме этого снижается активность пируватдегидрогеназного комплекса и окислительного декарбоксилирования пирувата [172, 203]. В этих условиях баланс между пируватом и лактатом сдвигается в сторону избыточного образования молочной кислоты. А скорость утилизации лактата при глюконеогенезе снижается из-за уменьшения синтеза АТФ при гипоксии, что приводит к накоплению концентрации лактата и кислотному сдвигу pH, которые отрицательно 19 влияют на фермент пируваткарбоксилазу, который ускоряет начальную реакцию глюконеогенеза [26, 35, 182, 190]. Для определения характера и происхождения инфаркта мозга требуется выполнение скрупулезного сбора анамнеза, оценки общего состояния и неврологического статуса больного, а также назначение диагностических и нейровизуализационных методов исследования [11, 27, 43]. 1.3. Компьютерная томография в диагностике ишемического инсульта В настоящее время большинство исследований сфокусировано на ранней диагностике изменений мозга, возникаюших вследствие нарушения мозгового кровобрашения, а также тактики лечения данной категории больных [18, 47, 101, 107, 109, 178]. Несмотря на значительные достижения в вопросах ранней диагностики инфаркта мозга, по-прежнему главным методом визуализации инсульта является компьютерная томография (КТ). КТ является первым диагностическим методом, позволяющим прижизненно надежно определить наличие, выраженность и распространенность патологического очаго и отека мозга [107, 135, 164]. Именно КТ входит в стандарты нейровизуализации для оценки степени повреждения ткани мозга при церебральном инсульте [3, 8, 33, 69, 94, 143, 206]. Как известно, метод КТ внедрен в клиническую практику в 1962-1964 гг. медицинским физиком из Университета Тафтса штата Массачусетс А. Кормаком. Метод давал возможность получить поперечные срезы, так как он был основан на многочисленных измерениях поглощения тонкого рентгеновского пучка, проходящего через тело под различными углами [120, 121]. В 1967 г. английский инженер - физик Г. Хаунсфилд из английского объединения «Electrical and musical instruments limited» (EMI) независимо от А. Кормака начал разработку своего собственного метода КТ, использовающего количественную шкалу рентгеновской плотности (шкала 20 денситометрических показателей) [6, 15, 145]. Вначале время сканирования объекта составляло 9 дней, поскольку источник гамма-лучей был низкоинтенсивным, требующий длительных экспозиций. В последующем, гамма-источник был заменен более мощной рентгеновской трубкой, и время сканирования снизилось до 9 часов. Далее, в течение 21 дня происходила компьютерная обработка информации. Удачные изображения были получены при обследовании головного мозга человека, живого теленка и области почек свиньи [96, 156]. За производство метода КТ А. Кормаку и Г. Хаунсфилду в1979 г. была присуждена Нобелевская премия по медицине и физиологии [122, 146]. В 1971 г. в госпитале Аткинсона Морли в Уимблдоне был сконструирован «ЭМИ-сканер» (EMI-scanner) - первый компьютерный рентгеновский томограф, который клинически испытали в 1967-1972 гг. Это открытие ознаменовало начало нового этапа в развитии медицинской техники [106]. Сегодня из всех нейровизуализационных методов, получивших наиболее значительное распространение и владеющих масштабными преимуществами, является спиральная компьютерная томография [143]. В основу метода КТ положено измерение и сложная компьютерная расшифровка разности ослабления рентгеновского излучения различными по плотности тканями [Ошибка! аргумент ключа., Неизвестный аргумент ключа., Ошибка! Неизвестный 171, Ошибка! Неизвестный аргумент ключа.]. КТ разрешает определить характер, местонахождение, размер инфаркта мозга, позволяет четко дифференциировать свежее кровоизлияние в мозг от других типов инсульта и предоставляет возможность идентифицировать механизм развития инсульта, и соответственно конкретизировать прогноз данного заболевания [95, 118, 132]. Известно, что процедура диагностики, проходящая в три стадии, осуществляется с помощью томографа, в котором одновременно используются электронные и механические составляющие. На I стадии диагностики с помощью направленных рентгеновских лучей сканируется 21 поверхность объекта, попадая на особые датчики, передающие полученную картину в прибор. На II стадии прибор перерабатывает данные в цифровой формат, при получении данных одного сканирования тут же выполняется следующее под другим ракурсом, при этом длительность сканирования одного слоя составляет в среднем 3 секунды. На III стадии компьютер, получив данные со всех датчиков, анализирует их и выдает графическое изображение исследуемого органа[3, 123, 133]. При этом врач может увеличить любой фрагмент изображения для более тщательного изучения [136, 166]. Используется количественная шкала (шкала Хаунсфилда) рентгеновской плотности (радиоденсивности), которая визуализируется в виде чѐрно-белого спектра изображения на мониторе аппарата, основанная на снижении плотности в зоне инфаркта [90, 117]. Коэффициенты ослабления рентгеновского называемых излучения единицами выражаются Хаунсфилда в (HU). относительных Нижняя единицах, граница шкалы составляет 1000 условных единиц (HU), что соответствует ослаблению рентгеновского излучения в воздухе. Коэффициент поглощения воды принимают за ноль [184]. Величина HU вычисляется по формуле: HU=1000 х μX - μwater / μwater - μair, где μX - линейный коэффициент ослабления материала, а μwater и μair - линейные коэффициенты ослабления для воды и воздуха при стандартных условиях. Таким образом, одна единица Хаунсфилда соответствует 0,1% разницы в ослаблении излучения между водой и воздухом, или приблизительно 0,1% коэффициента ослабления воды, так как коэффициент ослабления воздуха практически равен нулю [91, 110]. Средний показатель в шкале HU равен насыщенности воды, отрицательные величины шкалы соответствуют воздуху и жировой ткани, положительные более густому веществу, например, мягким тканям, костной ткани, в наибольшей степени металлу [206] (табл. 1). Таблица 1. Средние денситометрические показатели Вещество Воздух Жир HU −1000 −100 22 Вода Паренхиматозные органы Кровь Серое вещество мозга Белое вещество мозга Кости 0 +20…+60 +30…+60 +30…+35 +25…+29 +400 и выше Необходимо отметить, что в практическом применении измеряемые показатели уменьшения могут быть различными на разных аппаратах. Понятие «рентгеновская плотность» - это стандартное значение поглощения тканью излучения. При оценке непростой анатомо-гистологической структуры определение еѐ «рентгеновской плотности» не всегда с точностью выявляет, какая ткань визуализируется, например, насыщенные жиром мягкие ткани имеют консистенцию, равносильной плотности воды [28, 41, 91, 94, 200]. Обычный компьютерный томограф и экран способен показать до 256 оттенков серого цвета, а некоторые высокоспециализированные медицинские томографы показывают до 1024 оттенков. В связи с большим размахом шкалы HU и отсутствием возможности действующих мониторов выразить весь еѐ диапазон в черно-белом спектре, употребляется перерасчет серого градиента с помощью программы [33, 87, 92, 141, 168, 208]. Длительное время ранняя диагностика инфаркта мозга с помощью метода КТ изучается в специальных мультицентровых исследованиях и активно обсуждается в литературе [90, 97, 166]. 1.3.1. Ранние КТ изменения при ишемическом инсульте На протяжении дифференциальная многих диагностика лет основной ОНМК и задачей исключение КТ являлась несосудистого повреждения мозга. Однако с укоренением в клинической практике системного тромболизиса появилась потребность в более скрупулезном анализе КТ-изменений [99, 138, 165]. Поскольку принятие решения о проведении тромболизиса необходимо в первые часы от момента развития инсульта и есть необходимость в оперативности проведения диагностических мероприятий, большое количество авторов описали ранние КТ признаки 23 ИИ[185, 197, 200, 204]. Установлено, что ранняя КТ диагностика ИИ позволяет выявить и оценить выраженность ишемического повреждения мозга, которая в свою очередь определяет тактику лечения ипрогноз осложнений [86, 151, 198]. По мнению ряда авторов, из всех ранних признаков ИИ в системе артерий головного мозга наиболее часто можно увидеть снижение различий между серым и белым веществом мозга. Помимо этого признака в ранние сроки ИИ возможно дифференциировать утрату полярности в зоне базальных ядер, внутренней капсулы и конвекситальной коры, а также утрату ребристой поверхности коры островка [2, 174, 198]. Ранний признак в виде сдавления корковых борозд проявляется на КТ при цитотоксическом отеке, когда возникает увеличение объѐма внутриклеточной жидкости, приводящее к набуханию извилин коры [19, 115]. По мнению Warren D.J. [205], данный признак часто отсутствует в первые три часа инфаркта мозга. Многие авторы настаивают на 23% выявляемости данного признака в этот период времени и приводят цифры: 33% - в первые 3 часа и 37% - в первые 5 часов от начала инсульта. Другими авторами была изучена вероятность появления гиподенсивных участков на КТ изображениях мозга на ранних этапах развития инфаркта мозга (первые 6 часов), а также союз данного симптома с функциональными исходами инсульта [19, 155, 190]. Специфичность такого признака как гиперденсивность ствола мозговых артерий составила 95%, чувствительность - 39%, общая диагностическая точность - 81%. По данным КТ при сочетании гиперденсивности ствола мозговой артерии и «симптома точки», где тромбоз охватывает М2 и М3 сегменты артерий мозга в области сильвиевой борозды, имеется обширная ишемия мозга [92, 126, 140]. У больных с изолированным «симптомом точки» выявлена менее выраженная зона поражения, и соответственно, более благоприятные клинические исходы [93, 119, 141]. 1.3.2. Тканевые изменения при ишемическом инсульте на КТ. 24 Из патологоанатомических исследований известно, что КТ-диагностика инфаркта мозга оценивается по структурным изменениям, которые отражают основные четыре стадии инфаркта мозга [112]. Так, в первые часы по данным КТ (I стадия) наблюдается изоденсивное состояние, то есть показатель КП в очаге поражения остается в пределах нормы [197]. Для II стадии характерно нарастание цитотоксического отека мозга и развитие некрозо- апоптотической гибели вещества мозга, которая визуализируется в виде гиподенсивной (более темной) зоны на КТ, так как КП белого и серого вещества становится ниже нормы [11, 114, 150]. При этом происходит относительно равномерное вовлечение серого и белого вещества, так как начинается процесс гибели нервных элементов и появляются единичные макрофаги с нейтральными липидами (начало реактивных изменений) [9, 162, 205]. Начиная с 5-х суток инфаркта мозга (III стадия) формируется организация ИИ, на протяжении которой активно развиваются процессы распада ткани мозга (процессы резорбции и репарации), в сером веществе появляются изменения (реактивный неовазогенез), вызывающие повышение рентегеновской плотности, и соответственно определяются отличия по КП между серым и белым веществом. В зонах репарации образуются новые капилляры и кровь повышает КП серого вещества до изоденсивного, а иногда и до слабогиперденсивного состояния [18, 30, 188]. Эти отклонения носят название «эффекта затуманивания». При исследовании с помощью микроскопа обнаруживаются мелкие пропитанные кровоизлияния из свежих мелких сосудов, свидетельствующие о нарушенной проницаемости стенок этих сосудов [Ошибка! Неизвестный аргумент ключа., 156]. Приблизительно с 18-20 суток (IV стадия) от начала ИИ «эффект затуманивания» уменьшается и показатели КП в сером веществе снижаются из-за отека мозга. И уже через 11,5 месяца показатели КП серого вещества становятся равными значениям белого вещества, что совпадает со временем формирования глиомезодермального рубца с полостью [19, 40, 151]. Кистозно-глиозная трансформация (КГТ) по данным КТ соответствует области мозга со 25 стабильно низкими показателями плотности, близкими к КП цереброспинальной жидкости [68]. Небольшие инфаркты выявляются позже, нежели обширные, то есть вероятность выявления лакунарных инфарктов в первые сутки мала[157, 171]. Изображения лакунарных инфарктов на КТ выглядят как небольшие от 5 до 10 мм зоны со сниженной плотностью ткани мозга. Однако по мере организации инфаркта к концу острого периода гиподенсивные очаги часто перестают визуализироваться на КТ изображениях (изоденсивная стадия), и плотность мозга с патологически измененной тканью не отличается от плотности с неизмененным веществом мозга [70, 114]. В последующем лакунарные инфаркты визуализируются как зоны со значительным снижением плотности, что свидетельствует о формировании псевдокисты лакуны [7, 158]. Подострый и хронический ИИ по данным КТ выглядят как гиподенсная зона в области кровоснабжаемой артерии; вначале зона увеличивается в размере (1-7 день), а затем уменьшается (после 7-го дня) (Butcher К., 2010) [118]. В стадии абсорбции (со 2 по 3 неделю) наблюдается «эффект затуманивания», при этом инсульт выглядит изоденсным по отношению к веществу мозга из-за гиперемии и петехиальных кровоизлияний [111, 130, 141, 181]. Итак, КТ является главным методом визуализации инсульта, однако в первые часы возникновения инфаркта мозга на КТ отсутствуют ранние признаки в половине случаев [40, 94, 173]. Это объясняется тем, что в условиях гипоксии клетка не получает достаточного количества энергии, так как запускается процесс анаэробного гликолиза. В клеточных условиях гликолиз является необратимой реакцией, следовательно, изменения на функциональном клеточном изменениям в мозге [102, 126, уровне предшевствуют морфологическим Ошибка! Неизвестный аргумент ключа., 138]. При масштабном поражении острую ишемию нередко удается обнаружить на КТ, чем при минимальных очагах в коре и массивной ишемии мозга. 26 Отсутствие визуализированного инфаркта мозга не говорит, что у пациента не произошло нарушения мозгового кровообращения, и это не становится основанием для аннулирования диагноза, когда имеется четкая клиника болезни [109, 166, 186]. Примерно в 80 % случаях КТ видит зону гиподенсной плотности, соответствующей клинике инфаркта мозга в течение первых же суток от развития заболевания, и соответственно, в 20% случаях не определяет зону ИИ [10]. Трудно обнаружить на КТ малые инфаркты ствола и мозжечка из-за помех, образующихся от пирамид височных костей [2, 7, Ошибка! Неизвестный аргумент ключа., Ошибка! Неизвестный аргумент ключа.]. По мнению Матиаса Хофера, при предубеждении на инфаркт мозга может понадобиться до 30 часов для четкого проявления отека в виде гиподенсной зоны, отличающийся от неповрежденной ткани мозга. Поэтому КТисследование необходимо повторить, в случае если первоначальное сканирование не показало патологических изменений даже при наличии неврологических симптомов [39, 89, 139]. Таким образом, несмотря на множество исследований, вопрос о прогнозировании ранних КТ-признаков инфаркта мозга остается дискуссионным и настаивает на дальнейшем изучении, особенно в случае назначения тромболитической терапии. В отечественной литературе сведений по данному вопросу мы не выявили. В клинической практике используются дополнительные методы нейровизуализации острой ишемии головного мозга, однако они не входят в стандарты стационарного обследования больных с инфарктом мозга. 1.4.Другие современные методы визуализации ишемического инсульта. Другим резонансная высокодиагностическим томография (МРТ), методом позволяющая является магнитно- визуализировать ИИ, используя ядерный магнитный резонанс. Метод основан на измерении электромагнитного отклика насыщенных водородом тканей организма, 27 находящихся в окружении разных атомов и молекул. Электромагнитный отклик возникает в ответ на возбуждение определѐнной комбинацией электромагнитных волн в постоянном магнитном поле высокой напряжѐнности [19, 40, 69, 92, Ошибка! Неизвестный аргумент ключа.]. В 1973 г. профессор химии Пол Лотербур опубликовал в журнале Nature статью индуцированного под названием локального «Создание изображения взаимодействия; примеры с помощью на основе магнитного резонанса; метод МРТ», а в 2003 г. он вместе с физиком Питером Мэнсфилдом были удостоены Нобелевской премии за изобретение метода МРТ [163, 167]. В 1992 г. компанией «Elscint Co» впервые была показана многослойная «мультиспиральная» компьютерная томография (МСКТ) [105, 116]. Известны основные режимыМРТ: протон-ВИ; Т1-ВИ; Т2-ВИ; Т2٭-ВИ (градиентное ЭХО); FLAIR (Fluid Attenuated Inversion Recovery) –режим с подавлением сигнала свободной воды; ДВИ (диффузно-взвешенное изображение); ПВИ (перфузионно-взвешенное изображение) [129, 147]. Так, Т2 - это время, в течение которого магнитное поле по оси xy теряет 63% от своего первоначального максимального значения, то есть мы видим сигнал от объекта; Т1-время, в течение которого магнитное поле по оси z восстанавливает до 63% от своего первоначального максимального значения. Скорость Т1-релаксации зависит от размера и мобильности молекул, при этом Т1 минимально визуализированно для жира (яркий сигнал) и максимально видимо для воды (темный сигнал), например, для ЦСЖ. Время Т2 зависит от физических и химических свойств тканей, при этом жидкости имеют длительное время Т2, то есть сигнал исчезает медленно - мы можем увидеть яркий сигнал, подобным образом на Т2-ВИ выглядят ЦСЖ и другие жидкости с низким содержанием белка. Твердые (плотные) ткани имеют короткое время, то есть Т2–сигнал менее яркий [90, 129, 147, 154, 180]. Т2*ВИ или градиентное ЭХО, где градиент - это наложение сигнала на частицы в стационарном магнитном поле с использованием специальных градиентных 28 катушек, приводящих к увеличению силы магнитного поля в одном направлении, вследствие чего сигналы можно записывать от тонкого слоя ткани [68, 129]. Градиентное ЭХО используют в диагностике острых кровоизлияний в мозг, а также для обнаружения зон отложения гемосидерина в тканях, что разрешает ретроспективно визуализировать перенесенные геморрагические нарушения мозгового кровообращения [123, 144]. Режим FLAIR (Fluid Attenuated Inversion Recovery) подавляет сигнал свободной воды и позволяет получать Т2-ВИ с подавлением сигнала ЦСЖ, что проявляется темным ликвором или ликвором одного цвета с веществом мозга [192]. Режим FLAIR имеет свои преимущества перед обычными режимами, так как с его помощью можно получить Т2-ВИ, оценивая характер тканевых изменений при инфаркте мозга, а также проводить дифференцировку мелких кист от участков глиозной трансформации и определить четкие границы желудочков мозга, и зоны перивентрикулярного отека [137, 159, 161]. Магнитно-резонансные томографы различаются в зависимости от силы индукции магнитного поля, которая выражается в теслах (Т), которые подразделяются на ультранизкие единицы измерения, которые ниже 0,1 Т, низкие - от 0,1 до 0,5 Т, средние - от 0,5 до 1 Т, высокие - от 1 до 2 Т и ультравысокие - свыше 2 Т. Чаще всего в аппаратах для МРТ используется магнитное поле, сила которого равна 1,5 Т. Каждая тесла равна 10 000 гаусс (G), например, сила магнитного поля Земли равна 0,6 G [111, 131, 185]. Для визуализации мозга с помощью МРТ в любых заданных плоскостях необходимо получение Т1-, Т2- и протон-взвешенных изображений в трех взаимно перпендикулярных плоскостях (аксиальной, корональной и сагиттальной) [137, 152, 189]. Большое признание МРТ получила благодаря возможности исследовать структурные, патологические изменения вещества мозга пациента и изменения контрастности изображений, также МРТ позволяет проводить функциональные исследования мозга, основанные на трансформации 29 локальной активности. МРТ является безопасным неинвазивным методом лучевой диагностики, получающим серию тонких срезов, изображения в любой плоскости и выполняющего трехмерные пространственные реконструкции изучаемых областей [107, 109; 153, 171, 175]. Известно, что на основе патофизиологических изменений, возникающих при ИИ выделяют стадии ишемического повреждения мозга, которые оказывают влияние на показатели МРТ [19, 108] (табл. 2). Таблица 2. Харатеристика МРТ изменений при инфаркте мозга Стадии ИИ Сверхострая стадия (0-6 часов) Острая стадия (6-24 часа) Ранняя подострая стадия (1-7 дней) Поздняя подострая стадия (1-6 недель) Хроническая стадия (более 6 недель) МРТ изменения - Изменение величины вычисляемого коэффициента диффузии; - Сокращение тканевой перфузии; - Локальный объемный эффект, характеризующийся набуханием извилин на Tl, Т2 и PD-взвешенных изображениях; - Отсутствие феномена выпадения сигналаот потока крови в церебральных артериях; - Контрастное усиление сосудов в области инфаркта. - Усиление сигнала на Т2 и PD-взвешенных изображениях; - Нарастание положительного объемного эффекта; - Нарастание положительного объемного эффекта, смещение срединных структур мозга, дислокационный и вторичный стволовой синдромы; - Отсутствие контрастного усиления сосудов оболочек мозга в зоне поражения; - Появление паренхиматозного контрастного усиления в зоне инфаркта мозга; - Сокращение объемного эффекта; - Максимальная выраженность тканевого контрастного усиления в зоне инфаркта мозга; - Отсутствие положительного объемного эффекта; - Признаки атрофии вещества мозга; - Сокращение тканевого контрастного усиления; - Гипоинтенсивный сигнал на Т1-ВИ при формировании КГТ; - Гиперинтенсивный сигнал на Т2-ВИ при формировании КГТ. Высокоинформативными неинвазивными методиками в диагностике острейшей стадии ишемии являются диффузионно-взвешенная (ДВИ) и перфузионно-взвешенная (ПВИ) МРТ [144]. ДВИ режим позволяет визуализировать изображения, взвешенные по параметру рассеивания воды в физиологических тканях [50, 108, 181, 213]. На ДВИ уже через 15-20 минут от начала инсульта происходит избыточное накопление воды в зоне 30 пенумбры, что проявляется ярким сигналом, уменьшаясь через неделю и исчезая через 3 недели [111, 186]. Вначале инфаркта мозга по данным ДВИ выявляются признаки увеличения интенсивности МР-сигнала с факторами взвешивания (b>=500) и снижение измеряемого коэффициента диффузии на картах ИКД [92, 117, 165, 199]. ПВИ позволяет количественно оценивать основные параметры мозгового кровообращения, получая изображение при прохождении болюса контрастного вещества с помощью динамического контрастирования, многократно регистрируя изображения одного и того же среза. Для получения ПВИ используют различные контрастные вещества, содержащие хелты гадолиния [50, 144]. Инфаркт мозга на ПВИ выглядит как низкий сигнал в соответствующих последовательностях в острейшей стадии ИИ, а при возникновении реперфузии обнаруживается высокий сигнал [92, 150, 174, 193]. В настоящее время еще более информативными, однако, не входящими в стандарты диагностики инфаркта мозга методами являются перфузионная компьютерная томография (ПКТ) и позитронно-эмиссионная томография (ПЭТ) [142, 149]. ПКТ является актуальным методом оценки мозгового кровотока, сущность которого заключается в отслеживании при помощи серии КТ-срезов и количественном измерении кровотока с помощью оценки изменения рентгеновской плотности припроникновении внутривенно введенного контрастного препарата по церебральной сети капилляров [30, 37, 123, 157, 165, 192, 212]. Посредством вращения рентгеновской трубки во время быстрого введения контрастного вещества начинается динамическое сканирование исследуемых областей, срезы которых составляют толщиной от 4 до 5 см кровоснабжения дифференцировать и позволяют участков пороги получить мозга [128, обратимой и визуальное 160, 211]. необратимой представление ПКТ может ткани мозга, следовательно, позволяет выявить пенумбру [134, 156, 174, 183, 184, 209, 210]. 31 ПЭТ является радионуклеидным методом, в основе которого лежит отслеживание распределения соединений, меченных (радиофармпрепаратов) в организме биологически позитрон-излучающими [176, 198]. Именно активных радиоизотопами выбор подходящего радиофармпрепарата позволяет изучать с помощью ПЭТ скорость обмена веществ по кислороду или глюкозе, транспорт веществ, лиганд-рецепторные взаимодействия, экспрессию генов [51, 175, 177, 200]. С помощью ПЭТ возможно выявить нарушения мозгового кровотока задолго до появления этих изменения на КТ и МРТ, а также дифференциировать нефункционирующую, однако еще жизнеспособную зону от необратимого ишемического поражения мозга [159, 162, 185]. Таким образом, наиболее экономически информативным является совместное использование КТ и МРТ, с учетом восприимчивости и особенностей нейровизуализации, в соответствии со временем и совершающихся патофизиологических процессов при инфаркте мозга, вызванных энергодефицитом. Однако МРТ по стандартам может быть проведен не более, чем 1 больному из 10. Основным и единственным методом нейровизуализации сегодня для всех пациентов с церебральным инсультом является КТ. 1.5. Энергодефицит при ишемическом инсульте и его фармакологическая коррекция. Учитывая формирующих наличие множества ишемическое поражение патогенетических мозга, тяжесть факторов, повреждения мозговой ткани определяется размерами, локализацией ИИ, а также вторичным повреждением посредством отека головного мозга [57, 87]. Несмотря на многочисленные причины возникновения инсульта, главным патобиохимическим условием происхождения инфаркта мозга является энергодефицит, который возникает при отключении саморегулирующих 32 систем, поддерживающих равновесие между процессами, отвечающими за потерю и продукцию энергии [24, 61, 195]. Известно, что процесс образования энергии происходит в цитоплазме при анаэробном окислении и в митохондриях в цикле Кребса. При этом каждый этап синтеза АТФ осуществляется за счет реакций разложения, трансформации или декарбоксилирования субстратов окисления, в результате чего образуется 38 молекул АТФ [44, 63, 78]. Самой важной стадией цикла окислительного фосфорилирования является активация окисления янтарной кислоты, активирующей синтез энергии, так как ресинтез янтарной кислоты при инфаркте мозга может приводить к пагубным последствиям, как для мозговой ткани, так и для всего организма в целом [58, 71, 199]. Учитывая насколько быстро на ранних этапах гипоксии возрастает уровень молочной кислоты и пирувата, янтарная кислота быстро снижает их концентрацию в крови, выполняя роль катализатора в цикле Кребса. Поскольку янтарная кислота улучшает микроциркуляцию в органах и тканях, нормализует содержание гистамина и серотонина, оказывает влияние на транспорт медиаторных аминокислот и обладает противоишемической активностью, ее относят к антиоксидантам. Также янтарная кислота активизирует сукцинатдегидрогеназное окисление и восстанавливает активность цитохромоксидазы, которая является ключевым окислительновосстановительным ферментом дыхательной цепи митохондрий [24, 75, 95, 203, 214]. Известно, что мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат), в состав которого входят соли янтарной кислоты (сукцинат), является одним из наиболее эффективных и широко используемых энергокорректоров для лечения энергодефицита [45, 87]. Препарат был создан и внедрен в лечебную практику группой ученых (Дюмаев К.Н., Бурлакова Е.Б., Смирнов Л.Д., Воронина Т.А., Гарибова Т.Л., Жестков В.П., Сернов Л.Н., Верещагин Н.В., Суслина З.А., Миронов Н.В., Шмырев В.И. , Федин А.И., Князев Б.А., Авакян Э.А., Лопатухин Э.Ю.), которым была 33 присуждена премия Правительства Российской Федерации в области науки и техники за «Создание антиоксидантных и препаратов внедрение для в медицинскую лечения и практику профилактики цереброваскулярных заболеваний» (№ 4861, 2003) [12]. Мексидол представляет собой синтетический антиоксидант, ингибирующий действие свободных радикалов, уменьшающий активацию перекисного окисления липидов, а также он является антигипоксантом прямого энергизирующего действия, поскольку активирует синтез АТФ в митохондриях, обладает гиполипидемическим действием, снижая уровень общего холестерина и липопротеидов низкой плотности. Кроме того, мексидол является церебропротектором, транквилизатором, мембраностабилизатором, оказывая модулирующее влияние на ионные каналы - транспортеры нейромедиаторов, улучшает синаптическую передачу, оказывает антистрессорное и ноотропное действие [24, 172, 190]. В настоящее время наиболее положительно мексидол проявил себя в терапевтическом использовании при инфаркте мозга, так как он борется с гипероксией, развивающейся уже к концу первых суток из-за гипервентиляции, снижающей концетрацию компонентов антиоксидантных систем. На госпитальном этапе мексидол входит в стандарты оказания медицинской помощи больным с острым инсультом и назначается в дозе 800 мг совместно с раствором глюкозы, раствором Рингера или физиологическим раствором, так как он не имеет инфузионных форм. После окончания курса в качестве антиоксидантной терапии, мексидол предлагают принимать в таблетированной форме в дозе 125 мг по 2 таблетки 2 раза в сутки в течение 4-х недель [61, 87, 203]. Механизмы действия мексидола различны, поскольку он является ингибитором свободно-радикальных процессов и перекисного окисления липидов. Также мексидол активирует окисление сукцината в дыхательной цепи, поступая во внеклеточное пространство, при этом усиливая образование энергии в цикле Кребса, увеличивая количество полярных фракций липидов и снижая соотношение холестерин/фосфолипиды 34 в мембранах, защищая тем самым структуры нейрональных мембран при ишемии и улучшая энергетический метаболизм в мозге [12, 24]. Другим препаратом, повышающим энергопродукцию и устраняющим гипоксию при инсульте, обеспечивая аэробный путь окисления глюкозы является актовегин, получаемый методами гемодиализа и ультрафильтрации из крови телят, а также состоящий из олигопептидов, аминокислот и микроэлементов. Антигипоксическое действие актовегина приводит к регенерации окислительно-восстановительных процессов с возрастанием АТФ и снижением АДФ, а также способствует активации фермента сукцинатдегидрогеназы, усилению транспорта и утилизации глюкозы, и ускорения разложения лактата [53, 75]. Актовегин является антиоксидантом, поскольку обладает супероксиддисмутазной активностью. При инфаркте мозга актовегин применяется на разных этапах оказания медицинской помощи в качестве внутривенных инъекций 1000 мг / сутки препарата, разведенного в 0,9%-250 мл хлорида натрия [36, 55, 95, 170]. Наиболее распространенным в клинической практике препаратом, обладающим антиоксидантным действием, является аскорбиновая кислота (АСК), за открытие формулы которой биохимик Альберт Сент-Дьѐрдь получил Нобелевскую премию в 1937 г. [196]. АСК необходима для поддержания энергии в жизнедеятельности организма, выработка которой происходит в процессе аэробного гликолиза. Сбой при окислении глюкозы в присутствии кислорода приводит к избыточной выработке свободных радикалов и развитию окислительного стресса, оказывающих разрушительное действие на ткани, приводя к ишемии мозга, однако наличие достаточного количества АСК не допускает накопления свободных радикалов, избегая тем самым тяжелых последствий [67]. АСК имеет органическое происхождение и учавствует в окислительновосстановительных реакциях, обладает свойствами родственными глюкозе, учавствуя в регуляции углеводного и липидного обменов, свертываемости крови, регенерации тканей ипроцессов тканевого дыхания. Также АСК 35 способствует образованию нуклеиновых кислот и участвует в процессах биосинтеза, главным образом в синтезе РНК [67, 84]. При инфаркте мозга назначается 5% аскорбиновая кислота 10 мл, растворенная в 0,9%-250 мл физиологического раствора, вводится внутривенно капельно. Для развития антиоксидантных свойств АСК необходим длительный прием АСК, примерно 3-4 недели, так как она обладает накопительным действием [67, 148, 201]. Таким образом, основопологающим патофизиологическим звеном инфаркта мозга является энергодефицит, от выраженности и развития которого зависит исход заболевания. Поэтому важной задачей определения течения и прогноза острого ИИ является поиск ранних взаимосвязей кислотно-щелочного равновесия и нейровизуализационного аспектов для своевременного назначения патогенетически обоснованного лечения. Однако данных о том какие патофизиологические механизмы лежат в основе отсутствия признаков ишемии на КТ-изображениях у больных с клиникой тяжелого инфаркта мозга ни в отечественной, ни в зарубежной литературе обнаружено не было, что и вызвало у нас интерес к проведению данного исследования. 36 Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Настоящее проспективное клинико-лабораторное исследование проводилось в период с 2011 г. по 2014 г. включительно. Пациенты, участвующие в исследовании, проходили обследование и лечение в городской клинической больнице № 15 имени О.М. Филатова Департамента Здравоохранения г. Москвы. 2.1. Характеристика больных. В исследование включен 221 пациент в возрасте от 32 до 93 лет (средний возраст 69,4±13,7, медиана = 72 года), включая 90 (40,7%) мужчин в возрасте от 32 до 90 лет (средний возраст мужчин 64,3±12,2; Ме=65 лет) и 131 (59,3%) женщину в возрасте от 33 до 93 лет (средний возраст женщин 73,1±12,6; Ме=74 лет) с установленным диагнозом ишемический инсульт (инфаркт головного мозга). Критериями включения в настоящее исследование были: - установка диагноза (в выписке/посмертном эпикризе, паталогоанатомическом заключении) инфаркт головного мозга; - госпитализация в первые 48 часов от момента начала инсульта при четко известном времени дебюта заболевания; - подтвержденный данными МСКТ ишемический инсульт; - наличие очаговой неврологической симптоматики при госпитализации, сохраняющейся более 24 часов; Из исследования были исключены пациенты, у которых по данным КТ (первой/повторной) отсутствовал очаг острой церебральной ишемии (то есть отсутствие подтвержденной нейровизуализационной картины инфаркта мозга), в том числе, при наличии по данным КТ (первой/повторной) кистозно-глиозной трансформации (КГТ) без свежих очагов ишемии. Таким образом, из исследования были исключены пациенты с ТИА, неострым (перенесенным ранее) ОНМК, декомпенсацией ХИМ, с сомато37 неврологической патологией, которым установленный диагноз острого инфаркта головного мозга был не подтвержден. Включенные в исследование мужчины были достоверно моложе женщин в среднем на 9 лет (р<0,001), что соответствует популяционным данным. Основная доля мужчин (n=27; 30,0%) были в возрасте 50-59 лет, основная доля женщин (n=47; 35,9%) были старше 80 лет (рис. 1). 50 47 44 40 27 30 20 10 0 18 8 8 <50 лет 25 23 12 9 50-59 лет 60-69 лет Мужчины 70-79 лет >=80 лет Женщины Рисунок 1. Распределение пациентов по полу и возрасту (р<0,001) Время госпитализации пациентов в стационар от дебюта заболевания варьировала от 3 до 48 часов и в среднем (Ме) составила 6 часов. В период до 6 часов от момента появления клинических симптомов инсульта были госпиталзированы 70 (31,7%) пациентов, в период 6-12 часов -53 (24,0%), 1224 часа – 75 (33,9%), 24-48 часов – 23 (10,4%) (рис.2). 23; 10% 70; 32% 75; 34% 53; 24% до 6 ч 6-12 ч 12-24 ч 24-48 ч Рисунок 2. Характеристика больных по времени госпитализации от дебюта заболевания (n=221) Среди включенных в исследование пациентов до инсульта 27 человек (12,2%) работали, 59 (26,7%) человек, несмотря на трудоспособный возраст и отсутствие инвалидности не работали, 60 (27,1%) пациентов были 38 работающими пенсионерами. Остальные 75 (33,9%) больных имели разный уровень инвалидизации: 1 группа – 22 (10,0%), 2 группа – 46 (20,8%), 3 группа – 7 (3,2%), как это представлено на рисунке 3. 22; 10% 27; 12% 46; 21% 7; 3% 59; 27% 60; 27% работает работающий пенсионер инвалид 2 гр не работает не пенсионер инвалид 3 гр инвалид 1 гр Рисунок 3.Распределение больных по социальному статусу Уровень сознания при госпитализации варьировал от ясного до комы II, при этом 171 (77,4%) пациент поступал в ясном сознании, у 21 (9,5%) больного сознание было нарушено до уровня сонливости, у 23 (10,4%) – оглушения, 5 (2,3%) – сопора, 1 (0,5%) – комы (рис. 4). 23; 10% 5; 2% 1; 1% 21; 10% 171; 77% в сознании сонливость оглушение сопор кома Рисунок 4. Уровень сознания при поступлении больных в стационар У всех больных диагноз инфаркта мозга был установлен по клиническим данным и подтвержден нейровизуализацией с помощью МСКТ (КТ) в разные сроки. Первичное КТ-исследование проводили в период от 3,5 до 48 часов от дебюта заболевания, в среднем (Ме) на 6 час. Инсульт в левом полушарии головного мозга был выявлен у 107 (48,4%) пациентов, в правом –у 88 (39,8%), в ВБС – у 20 (9,0%) пациентов, в 6 (2,7%) случаях инсульт был мультифокальным. 39 В зависимости от сроков визуализации очага инфаркта мозга по данным КТ пациенты были разделены на две группы: 1) В первую группу, названную группой «ранней визуализации» (РВ), вошли 111 пациентов (50,2%), у которых очаг ишемии с соответствовавшей клинике локализацией, был выявлен в ходе первого КТ-исследования, проведенного на момент госпитализации. В данную группу вошли 49 (44,1%) мужчин и 62 (55,9%) женщины в возрасте от 41 до 93 лет (средний возраст составил 69,6±12,7 лет; Ме=72 года). В группе РВ 27 больным (24,3%) на 3-15 сутки (в среднем - на 6 сутки) была проведена повторная КТ для уточнения динамики морфологических изменений в мозге. 2) Вторую группу «поздней визуализации» (ПВ) составили 110 (49,8%) больных, у которых при госпитализации по данным КТ инсульт не был выявлен, но при проведении повторной КТ всем 110 пациентам данной группы инсульт был обнаружен. Повторную КТ проводили в среднем на 5,2±3,9 сутки госпитализации (Ме=3 сутки). В группу ПВ вошли 41 (37,3%) мужчина и 69 (62,7%) женщин в возрасте от 32 до 93 лет (средний возраст составил 69,5±13,4 лет; Ме=73 года). У пациентов группы ПВ отсутствовали такие «классические» ранние признаки инсульта, как объемные воздействия на ликворные пространства, снижение рентгеновской гиперденсивных дифференцировки участков между плотности по ходу серым вещества пораженной и белым мозга, появление артерии, снижение веществом мозга. Не обнаруживалась и гиподенсивность, которая считается высокоспецифичным (95%) ранним симптомом при визуализации очага ишемии в первые сутки с момента появления клинических симптомов. Число мужчин и женщин в группах с ранней и поздней визуализацией инсульта было сопоставимым (р>0,05). Наибольшая доля мужчин в обеих группах была в возрасте от 50 до 59 лет (30%), основная возрастная группа женщин была в возрасте ≥ 80 лет (35,9%). Гендерно-возрастных различий в группах РВ и ПВ не было (p>0,05) (табл. 3). 40 Таблица 3. Распределение больных по возрасту, полу и группе исследования возраст Моложе 50 лет 50-59 лет 60-69 лет 70-79 лет 80 лет и старше Итого Стат. хар-ка n (%) n (%) n (%) n (%) n (%) n (%) При оценке мужчины РВ 6 (12,2%) 14 (28,6%) 9 (18,4%) 13 (26,5%) 7 (14,3%) 49 (54,4%) сроков женщины ПВ 2 (4,9%) 13 (31,7%) 9 (22,0%) 12 (29,3%) 5 (12,2%) 41 (45,6%) Итого 8 (8,9%) 27 (30,0%) 18 (20,0%) 25 (27,8%) 12 (13,3%) 90 (100%) поступления РВ 3 (4,8%) 6 (9,7%) 8 (12,9%) 22 (35,5%) 23 (37,1%) 62 (47,3%) больных ПВ 5 (7,2%) 3 (4,3%) 15 (21,7%) 22 (31,9%) 24 (34,8%) 69 (52,7%) в Итого 8 (6,1%) 9 (6,9%) 23 (17,6%) 44 (33,6%) 47 (35,9%) 131 (100%) стационар было установлено, что в период до 6 часов от дебюта заболевания в стационар поступило 40 (36,0%) пациентов из группы РВ и 30 (27,2%) больных из группы ПВ; в период 6-12 часов - 27 (24,3%) пациентов из группы РВ и 26 (23,6%) -из группы ПВ; через 12-24 часа - 44 (39,7%) и 31 (28,3%) соответственно; и через 24-48 часов в стационар поступило - 23 (20,9%) больных из группы ПВ (табл. 4). Таблица 4. Время госпитализации от дебюта инсульта больных 2-х групп(p>0,05) Время 3-6 ч 6-12 ч 12-24 ч 24-48 ч Таким Стат.хар-ка n (%) n (%) n (%) n (%) образом, РВ 40 (36,0%) 27 (24,3%) 44 (39,7%) 0 статистических ПВ 30 (27,2%) 26 (23,6%) 31 (28,3%) 23 (20,9%) различий групп Итого 70 (31,7%) 53 (24,0%) 75 (33,9%) 23 (10,4%) по времени госпитализации и проведения КТ от момента начала заболевания не было (p>0,05), хотя в среднем пациенты группы РВ госпитализировались на 1,5-2 часа раньше от дебюта ИИ. Кроме того, максимальное число поздно госпитализированных больных пришлось на группу ПВ, при этом ни на первые, ни на вторые сутки от момента появления клинических симптомов, очага ишемии у них выявлено не было. 41 Визуализация инсульта не зависела от его локализации. Так, инсульт в левом полушарии был зарегистрирован в 52 (46,8%) случаях при РВ инсульте и в 55 (50,0%) случаях при ПВ ИИ, в правом - в 46 (41,4%) и 42 (38,2%), ВБС - в 13 (11,7%) и 7 (6,4%) соответственно (табл. 5). Таблица 5. Локализация инсульта у больных 2-х групп (р>0,05) Локализация Левое полушарие Правое полушарие ВБС Мультифокальный Итого Стат.хар-ка n (%) n (%) n (%) n (%) n (%) РВ 52 (46,8%) 46 (41,4%) 13 (11,7%) 0 (0,0%) 111 (50,2%) ПВ 55 (50,0%) 42 (38,2%) 7 (6,4%) 6 (5,5%) 110 (49,8%) Итого 107 (48,4%) 88 (39,8%) 20 (9,0%) 6 (2,7%) 221 (100,0%) Локализация инсульта также представлена на рисунке 5. Рисунок 5. Локализация инфаркта мозга у больных 2-х групп У больных обеих групп были выявлены различные фоновые заболевания. Все больные с РВ и ПВ инсультом имели в анамнезе артериальную гипертензию (n=221; 100%). Пациентов, страдающих ишемической болезнью сердца, стенокардией, было 154 (69,7%) человека. С мерцательной аритмией было 83 (37,6%) человека. Страдающих сахарным диабетом насчитывалось 54 (24,4%) больных. Имеющих в анамнезе постинфарктный кардиосклероз было 48 (21,%) человек. 66 (29,9%) пациентов перенесли в анамнезе острое нарушение мозгового кровообращения (от нескольких месяцев до 4-х лет назад, в среднем (Ме) 2 года назад). Ожирение было у 13 (5,9%) пациентов. У 35 (15,8%) пациентов ранее были диагностированы различные заболевания дыхательной системы 42 (ХОБЛ, бронхиальная астма и др.), у 29 (13,1%) - желудочно-кишечного тракта (язвенная болезнь, хронический гастрит, хронический панкреатит, ЖКБ), у 50 (22,6%) - заболевания мочеполовой системы (МБК, хронических пиелонефрит, диабетическая нефропатия и др.). Обе группы были сопоставимы по сопутствующим заболеваниям (табл. 6). Таблица 6. Фоновые заболевания у больных групп исследования Фоновые заболевания РВ (n=111) ПВ (n=110) р Артериальная гипертензия ИБС, стенокардия Мерцательная аритмия Сахарный диабет ПИКС Острый инсульт (ИИ/ГИ в анамнезе) 111 (100%) 81 (72,9%) 38 (34,2%) 31 (27,9%) 23 (20,7%) 110 (100%) 73 (66,3%) 45 (40,9%) 23 (20,9%) 25 (22,7%) 1,0 0,178 0,188 0,145 0,142 Всего (n=221) 221 (100%) 154 (69,7%) 83 (37,5%) 54 (24,4%) 48 (21,7%) 29 (26,1%) 37 (33,6%) 0,142 66 (29,8%) КОМОРБИДНОСТЬ 24 (21,6%) 18 (16,4%) 0 (0,0%) 6 (5,5%) 18 (16,2%) 24 (21,8%) 3 (2,7%) 5 (4,5%) 12 (10,8%) 12 (10,9%) 9 (8,1%) 7 (6,4%) 2 (1,8%) 3 (2,7%) 9 (8,1%) 5 (4,5%) 8 (7,2%) 4 (3,6%) 1 (0,9%) 2 (1,8%) 13 (11,7%) 11 (10,0%) АГ + ИБС, стенокардия 0,208 42 (19,0%) АГ + МА 0,014* 6 (2,7%) АГ + ИБС, стенок. + МА 0,187 42 (19,0%) АГ + СД 0,356 8 (3,6%) АГ + ПИКС 0,424 24 (10,8%) АГ+ПИКС+МА 0,405 16 (7,2%) АГ+ПИКС+СД 0,496 5 (2,2%) АГ+ИБС+СД 0,209 14 (6,3%) АГ + ИБС + МА +СД 0,192 12 (5,4%) АГ+ПИКС+МА+СД 0,497 3 (1,3%) Только АГ 0,486 24 (10,9%) Количество ССЗ 1 13 (11,7%) 11 (10,0%) 24 (10,9%) 2 10 (9,0%) 16 (14,5%) 0,214 26 (11,8%) 3 21 (18,9%) 18 (16,4%) 39 (17,6%) ≥4 67 (60,4%) 65 (59,1%) 132 (59,7%) Примечание: результаты представлены в виде абсолютных значений (n (%)) * р<0,05 – достоверное отличие между группами Таким образом, частота и выраженность различных сосудистых и фоновых заболеваний в 2-х группах была одинаковой, при этом у большинства пациентов с инсультом было установлено 4 и более сердечнососудистых заболеваний (у 59,1 % в группе ПВ и 60,4% в группе РВ). 43 Лечение пациентов обеих групп было однотипным и соответствовало стандартам оказания медицинской помощи больным с острым нарушением мозгового кровообращения в условиях стационара. 2.2. Методы исследования. Больным проводился комплексный клинико-инструментальный мониторинг в динамике, включающий следующие обследования: 1. Данные анамнеза и жалоб пациента, а также клинический соматический мониторинг с ежедневным контролем АД, ЧСС, ЧДД; 2. Неврологический осмотр с бальной оценкой по шкалам: - неврологического дефицита (по шкале NIHSS); - функционального статуса (по индексу социальной адаптации Bartel, модифицированной шкале Renkin); 3. МСКТ; 4. УЗДГ брахиоцефальных артерий; 5. ЭКГ; 6. Общий анализ крови (гемоглобин, гематокрит, количество эритроцитов, тромбоцитов, лейкоцитарная формула, СОЭ); 7. Биохимический анализ крови (глюкоза, общий белок, альбумин, мочевина, креатинин, общий билирубин, холестерин, АЛТ, АСТ, лактатдегидрогеназа (ЛДГ); 8. КЩС артериальной и венозной крови больным, находящимся в отделениях реанимации и интенсивной терапии (pH, pCO2, pO2, sO2, cHCO3c, лактат) 9. Коагулограмма крови (АЧТВ, протромбиновый индекс, МНО, общий фибриноген); 10. Консультации профильных специалистов (по показаниям). В течение стационарного периода нашего исследования динамика клинических маркеров проводилась на 1, 3, 7, 14 и 20 сутки, лабораторных на 1, 3, 7 сутки. 44 Исход также оценивали в катамнестическом периоде длительностью до 2-х лет после выписки. Удалось узнать судьбу 155 пациентов (из 182 ваписанных из стационара; 85,2%), в том числе 93 человек из группы РВ и 62 - группы ПВ. В катамнестическом периоде оценивали исход: выживаемость, неврологический и функциональный статус. Неврологический и функциональный статус больных были оценены по стандартизированным валидным шкалам: - Для оценки неврологическогодефицита использовали шкалу NIHSSNIDS(National Institutes of Health – Natonal Institute of Neurological Disorders and Stroke), в которой высокий балл характеризовал тяжелое клиниконеврологическое состояние больного. - Анализ функционального исхода оценивали по (активности повседневной жизнедеятельности) индексу социальной адаптации Bartel и модифицированной шкале Renkin. Суммарный балл по индексу Bartel варьирует от 0 до 100. Показатели от 0 до 20 баллов соответствует полной зависимости больного, до 60 баллов - выраженной зависимости, до 90 баллов - умеренной, от 90 до 95 баллов - легкой зависимости в повседневной жизни. 100 баллов соответствует полной независимости повседневной жизнедеятельности. - Использованная шкала Renkin включает шесть градаций и пять степеней инвалидизации. 0 баллов характеризует отсутствие признаков инвалидности, больной в состоянии выполнять без посторонней помощи все действия по уходу за собой. Первая степень (1 балл) предполагает незначительную симптоматику, утрату пациент трудоспособности, способен при выполнять этом, обычные несмотря на повседневные действия и ухаживать за собой без посторонней помощи. Вторая степень (2 балла) - легкая нетрудоспособность, пациент нуждается в некоторой посторонней помощи при выполнении повседневных действий, но способен выполнять некоторые процедуры без посторонней помощи и может пользоваться ортопедическими приспособлениями или тростью. Третья 45 степень (3 балла) предполагает наличие умеренных признаков инвалидности, умеренная нетрудоспособность, пациенту требуется некоторая помощь, но ходить он может самостоятельно или при минимальной помощи, или с помощью приспособлений. Четвертая степень (4 балла) - выраженные признаки инвалидности, стойкая нетрудоспособность, пациент не способен ходить без посторонней помощи, а также не способен самостоятельно выполнять гигиенические процедуры. Пятая степень (5 баллов) - сильно выраженные признаки инвалидности, выраженная нетрудоспособность, больной прикован к постели, страдает недержанием и нуждается в постоянном уходе и наблюдении. Морфологическое исследование головного мозга проводилось с помощью метода нейровизуализации - КТ головного мозга, на 40-срезовом спиральном компьютерном производственная фирма томографе «Siemens», Somatom Германия) Sensation (Научно- на кабинета базе компьютерной томографии ГКБ № 15 г. Москвы. Современный 40-срезовый спиральный томограф обладает возможностью субмиллиметрового сбора данных с пространственным разрешением 0,33x0,33x0,33 мм и скоростью вращения рентгеновской трубки один оборот за 0,37 с. Основные медикотехнические характеристики данного томографа представлены в таблице 7. Таблица 7. Основные характеристики компьютерного томографа "Somatom Sensation 40" рентгеновская трубка 5 MHU генератор 80 кВт скорость реконструкции томограммы 40 изображений в секунду возможность настройки толщины срезов скорость сканирования три оборота в секунду Данный компьютерный томограф оснащен сверхпроизводительной трубкой STRATON, которая обладает высокой скоростью охлаждения, благодаря чему можно проводить исследования практически непрерывно; а также томограф имеет широкий выбор клинических syngo-приложений: Syngo VRT, Syngo Osteo, Syngo Pulmo, Syngo Neuro Perfusion, Syngo Dental, 46 Syngo Image Fusion, Syngo Body Perfusion, Syngo Lung CARE, Syngo Colonography, CARE Vision, Syngo In Space 4D, CARE Bolus, Syngo Fly Through, Syngo Circulation, Syngo Heart View, Syngo Calcium Scoring. На основании следующих критериев компьютерной томографии был установлен диагноз инфаркта мозга: снижение дифференцировки между серым и белым веществом головного мозга; объѐмное воздействие на ликворные пространства рентгеновской плотности разной степени вещества мозга выраженности; различной снижение локализации в зависимости от бассейна повреждѐнного сосуда; появление гиперденсивных участков по ходу поврежденных артерий мозга. Функциональная диагностика проводилась с помощью метода УЗДГ 46 пациентам на ультразвуковом допплеровском комплексе «АнгиодинУниверсал» и «Ангиодин-К» фирмы БИОСС (Россия). Лабораторные исследования крови проводились на анализаторах: автоматический Mars (Корея), автоматический Cobas Emira Roch (Швейцария), фотометрический ФП-901 Labsystems (Финляндия), Cobas Micros-18, ABX (Швейцария), КХ-21 (Япония). Состояние кислотнощелочного равновесия получено при использовании анализатора ABL-5 фирмы Radiometer (Дания). 2.3. Методы статистической обработки результатов исследования. Обработка статистических результатов исследования проводилась с использованием Microsoft Excel, программ статистического анализа Statistica 8.0 for Windows (StatSoft Inc., USA) и SPSS 15.0. Статистически значимыми достоверными считались различия при уровне p<0,05. Описательная статистика непрерывных количественных данных представлена в виде среднего значения (M), стандартного отклонения (±SD) и стандартной ошибки среднего значения (m) при нормальном распределении, а также в виде медианы (Mе), значений верхнего (75%) и нижнего (25%) квартилей, а также в виде перцентилей (процентилей) при 47 распределении, отличном от нормального с указанием 5-95% доверительного интервала. Нормальным считалось распределение, у которого критерий отличия Колмогорова-Смирнова распределения был более от 0,05. Для теоретически сравнения нормального 2-х независимых непараметрических выборок использовали критерий Манна-Уитни, для множественного сравнения - Краскелла-Уоллиса. Для сравнения 2-х зависимых непараметрических выборок использовали критерий Уилкоксона, для множественного сравнения - Фридмана. Качественные переменные сравнивались с сопряженности). помощью Значение теста χ2 вероятности (хи-квадрат, менее 0,05 анализ таблиц демонстрировало статистическую достоверность. С целью определения взаимосвязи клиниколабораторных показателей проведен корреляционный анализ по методам Пирсона и Спирмана. 48 Глава 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Клинические особенности острого ишемического инсульта при ранних и поздних сроках его визуализации В ходе исследования было выявлено, что больные группы ПВ инсульта поступали в стационар в более тяжелом состоянии. Они чаще госпитализировались с нарушенным сознанием (n=36; 32,7% при ПВ ИИ и n=14; 12,6% при РВ ИИ) (p<0,05). В первые сутки большинство пациентов с РВ инсультом поступало в сознании (n=97; 87,4%), в группе ПВ – всего 67,3%. Количество больных с инсультом ПВ, поступавшие с уровнем сознания«сонливость» было 14 (12,7%), оглушение - 18 (16,4%), сопор – 3 (2,7%), а больных с РВ инсультом в сонливости поступило 7 человек (6,3%), в оглушении - 5 (4,5%), в сопоре - 2 (1,8%), что значительно в 2,01; 3,64; 1,5 раза меньше соответственно (p<0,05). Таким образом, у пациентов с ПВ ИИ сознание было чаще депрессировано,причем это зарегистрировано на всем периоде стационарного наблюдения (p<0,05) (табл. 8). Таблица 8. Динамика уровня сознания у больных обеих групп Уровень сознания 1 сут n=221 3 сут n=219 7 сут n=212 20 сут n=154 В сознании Сонливость Оглушение Сопор Кома 1-2 В сознании Сонливость Оглушение Сопор Кома 1-2 Кома 3-4 В сознании Сонливость Оглушение Сопор Кома 1-2 Кома 3-4 В сознании Сопор Кома 1-2 Стат. хар-ка n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) n (%) РВ ПВ р 97 (87,4%) 7 (6,3%) 5 (4,5%) 2 (1,8%) 0 (0,0%) 96 (88,1%) 1 (0,9%) 4 (3,7%) 6 (5,5%) 2 (1,8%) 0 (0,0%) 97 (91,5%) 0 (0,0%) 4 (3,8%) 2 (1,9%) 2 (1,9%) 1 (0,9%) 77 (96,2%) 1 (1,2%) 2 (2,5%) 74 (67,3%) 14 (12,7%) 18 (16,4%) 3 (2,7%) 1 (0,9%) 79 (71,8%) 7 (6,4%) 14 (12,7%) 5 (4,5%) 4 (3,6%) 1 (0,9%) 83 (78,3%) 4 (3,8%) 7 (6,6%) 3 (2,8%) 5 (4,7%) 4 (3,8%) 66 (89,2%) 8 (10,8%) 0 (0,0%) <0,05 49 <0,05 <0,05 <0,05 Итого 171 (77,4%) 21 (9,5%) 23 (10,4%) 5 (2,3%) 1 (0,5%) 175(79,9%) 8 (3,7%) 18 (8,2%) 11 (5,0%) 6 (2,7%) 1 (0,5%) 180(84,9%) 4 (1,9%) 11 (5,2%) 5 (2,4%) 7 (3,3%) 5 (2,4%) 143(92,9%) 9 (5,8%) 2 (1,3%) Так, больных группы ПВ с нарушенным сознанием было в 2,6 раза больше на 1 сутки, в 2,4 раза больше на 3 сутки, в 2,6 раза больше на 7 сутки и в 2,8 раз больше на 20 сутки госпитализации, чем в группе РВ (p<0,05). Даже на 20 сутки, когда многие «легкие» пациенты уже были выписаны, доля больных с нарушенным сознанием составила 10,8% (n=8) в группе ПВ, причем у всех был зарегистрирован сопор, а в группе РВ - 3,8% (n=2) (рис. 6). 35 32,7% 28,2% 30 25 21,7% 20 15 12,6%* 11,9%* 8,5%* 10 3,8%* 5 0 10,8% 1 сут 3 сут 7 сут Ранняя визуализация 20 сут Поздняя визуализация * - p<0,05 – достоверное отличие между группами Рисунок 6. Динамика доли больных исследуемых групп с нарушенным сознанием На этапе «скорой помощи» АД систолическое и диастолическое в группах РВ и ПВ было сопоставимо (р>0,05). Однако на госпитальном этапе группы больных отличались по состоянию гемодинамики. На 1 сутки госпитализации у больных в группе РВ САД/ДАД было на 10 мм рт ст выше, чем в группе ПВ. Так, при РВ АД в среднем составило 160/90 мм рт ст, варьируя в пределах 120–210/70-110 мм рт ст, что соответствовало уровню АД на этапе скорой помощи. В группе ПВ зарегистрирован регресс САД и ДАД в среднем на 10 мм рт ст (р<0,05), что выше, чем рекомендуется ВНОКом и НАБИ, и в среднем АД на 1 сутки в группе ПВ составило 150/80 мм рт ст,варьируя в пределах 110–200/63-100 мм рт ст, что на 10 мм рт ст ниже, чем в группе РВ (p<0,05) и ниже, чем указано в рекомендациях и стандартах лечения инсульта. Это может приводить к срыву церебральной ауторегуляции и, как следствие, худшему исходу ИИ. 50 На 7 и 20 сутки госпитализации САД и ДАД было также достоверно выше в группе РВ (p<0,05). Так, АД при РВ инсульта составило в среднем 140/80 мм рт ст на 3 и 7 сутки, 130/80 мм рт ст на 14 и 20 сутки, в группе ПВ -130/80 мм рт ст на 7, 14 и 20 сутки. ЧСС было достоверно выше при ПВ ИИ на 3 сутки (р<0,05) (табл. 9). Таблица 9. Динамическое измерение САД, ДАД и ЧСС у больных обеих групп На этапе скорой помощи Группы исследования РВ ПВ р 1 сутки РВ ПВ р 3 сутки РВ ПВ р 7 сутки РВ ПВ р 14 сутки РВ ПВ р 20 сутки РВ АД сист. АД диаст. ЧСС 160 140/180 113-214 160 140/180 126-215 0,875 160 138/180 120-210 150 135/169 110-200 0,050 140 130/150 110-180 140 126/150 120-180 0,360 140 123/150 112-170 130 120/140 105-160 0,045* 130 120/140 110-160 130 120/140 80-160 0,150 130 120/140 120-150 90 80/100 70-110 90 80/100 70-115 0,947 90 80/100 70-110 80 80/94 63-100 0,003* 80 80/90 70-100 80 79/90 70-100 0,260 80 80/90 70-100 75 70/80 60-97 0,001* 80 80/85 70-99 80 80/80 60-90 0,070 80 80/80 70-80 79 74/86 58-115 79 74/89 60-110 0,480 78 74/86 65-110 80 74/90 65-120 0,043* 80 74/80 70-100 78 72/84 60-107 0,226 76 74/80 68-95 76 72/80 14-100 0,319 77 74/80 70-84 51 128 80 76 120/130 80/80 74/80 105-146 60-90 65-92 р 0,015* 0,322 0,240 Примечание: данные представлены в виде медианы (первая строка), 25%/75% квартилей (вторая строка), 95%-доверительного интервала (третья строка). * - р<0,05 (критерий Манна-Уитни). ПВ Жалобы при госпитализации больше предъявляли пациенты с РВ инсультом (n=59; 53,2%), чем с ПВ (n=40; 36,4%). Это связано с более тяжелым состоянием пациентов группы ПВ, которые чаще не могли предъявить жалобы из-за тяжести состояния (34,5% против 16,2%) или из-за выраженных речевых нарушений (35,5% при ПВ, 7,2% при РВ; p<0,05). В данной связи при поступлении в стационар большее количество больных с РВ инсультом жаловались на головную боль(12,6% при РВ против 2,7% при ПВ; p<0,05), головокружение (10,8% против 2,7%; p<0,05). При этом жалобы на слабость в конечностях чаще зарегистрированы в группе больных с ПВ ИИ (62,7% при ПВ и 44,1% при РВ; р<0,05). Последующий анализ динамики жалоб больных исследуемых групп не выявил статистически значимых различий (табл. 10). Таблица 10. Динамика жалоб больных исследуемых групп 1 сут n=221 3 cут n=220 Жалобы Предъявляет Не предъявляет Нет из-за тяжести состояния / речевых нарушений есть Головная боль нет есть Головокружение нет есть Нарушение речи нет есть Слабость в конечностях нет есть Онемение /асимметрия лица нет есть Нарушение зрения нет Предъявляет Не предъявляет РВ 59 (53,2%) 18 (16,2%) ПВ 40 (36,4%) 38 (34,5%) 34 (30,6%) 32(29,1%) 14 (12,6%) 97 (87,4%) 12 (10,8%) 99 (89,2%) 8 (7,2%) 103 (92,8%) 49 (44,1%) 62 (55,9%) 8 (7,2%) 103 (92,8%) 2 (1,8%) 109 (98,2%) 31 (28,2%) 39 (35,5%) 52 р 0,001* Всего 99 (44,8%) 56 (25,3%) 66 (29,9%) 3 (2,7%) 17 (7,7%) 0,005* 107 (97,3%) 204 (92,3%) 3 (2,7%) 15 (6,8%) 0,015* 107 (97,3%) 206 (93,2%) 39 (35,5%) 47 (21,3%) <0,001* 71 (64,5%) 174 (78,7%) 69 (62,7%) 118(53,4%) 0,004* 41 (37,3%) 103(46,6%) 46 (41,8%) 54 (24,4%) <0,001* 64 (38,3%) 167 (75,6%) 15 (13,6%) 17 (7,7%) 0,01* 95 (86,4%) 204 (92,3%) 24 (21,8%) 55 (25,5%) <0,001* 75 (68,2%) 114 (51,8%) Головная боль Головокружение Нарушение речи есть нет есть нет есть нет есть нет есть нет Слабость в конечностях Онемение / асимметрия лица 7 сут Предъявляет n=212 Не предъявляет Нет из-за тяжести состояния / речевых нарушений Головная боль есть нет есть Голово-кружение нет есть Нарушение речи нет есть Слабость в конечностях нет есть Онемение/ асимметрия лица нет 14 сут Предъявляет n=193 Не предъявляет Нет из-за тяжести состояния / речевых нарушений есть Головная боль нет есть Голово-кружение нет есть Нарушение речи нет есть Слабость в конечностях нет 20 сут Предъявляет n=154 Не предъявляет Нет из-за тяжести состояния /речевых нарушений есть Тошнота, рвота нет Слабость в конечностях есть 4 (3,6%) 106 (96,4%) 4 (3,6%) 106 (96,4%) 27 (24,5%) 83 (75,5%) 5 (4,5%) 86 (78,2%) 1 (0,9%) 109 (99,1%) 21 (19,8%) 56 (52,8%) 0 (0,0%) 110 (100%) 0 (0,0%) 110 (100%) 21 (19,1%) 89 (80,9%) 0 (0,0%) 100(90,9%) 0 (0,0%) 110 (100%) 9 (8,5%) 74 (69,8%) 29 (27,4%) 23 (21,7%) 2 (1,9%) 104 (98,1%) 4 (3,8%) 102 (49,5%) 3 (2,8%) 105 (97,2%) 10 (9,4%) 96 (90,6%) 4 (3,8%) 102 (96,2%) 10 (9,9%) 73 (72,3%) 0 (0,0%) 106 (100%) 0 (0,0%) 106(50,5%) 1 (0,9%) 105(99,1%) 7 (6,6%) 99 (93,4%) 1 (0,9%) 105(99,1%) 7 (7,6%) 68 (73,9%) 18 (17,8%) 17 (18,5%) 1 (1,0%) 100 (52,1%) 1 (1,0%) 100 (52,1%) 1 (1,0%) 100 (52,1%) 1 (1,0%) 100 (52,1%) 1 (1,2%) 68 (85%) 0 (0,0%) 92 (47,9%) 0 (0,0%) 92 (47,9%) 0 (0,0%) 92 (47,9%) 0 (0,0%) 92 (47,9%) 0 (0,0%) 61 (82,4%) 11 (13,8%) 13 (17,6%) 1 (1,2%) 79 (98,8%) 0 (0,0%) 74 (100%) 0,519 1 (0,6%) 153 (94,4%) 0 (0,0%) 2 (2,7%) 0,229 2 (1,3%) 0,061 0,061 0,207 0,240 0,500 0,051 0,249 0,061 0,307 0,185 0,670 4 (1,8%) 216 (98,2%) 4 (1,8%) 216 (98,2%) 48 (21,8%) 172 (78,2%) 5 (2,3%) 186 (84,5%) 1 (0,5%) 219 (99,5%) 30 (14,2%) 130 (61,3%) 52 (24,5%) 2 (0,9%) 210 (99,1%) 4 (1,9%) 210 (99,1%) 4 (1,9%) 210 (98,1%) 17 (8,0%) 195 (92,0%) 5 (2,4%) 207 (97,6%) 17 (8,8%) 141 (73,1%) 35 (18,1%) 0,523 0,523 0,523 0,523 0,518 1 (0,5%) 192 (99,5%) 1 (0,5%) 192 (99,5%) 1 (0,5%) 192 (99,5%) 1 (0,5%) 192 (99,5%) 1 (0,6%) 129 (83,8%) 24 (15,6%) нет 80 (100%) 72 (97,3%) 1528,7%) Примечание: результаты представлены в виде абсолютных значений (n) и % * - р<0,05 – достоверное отличие между группами. 53 При госпитализации нарушения речи были выявлены у 136 (61,5%) больных, при этом в 25 (11,3%) случаях была обнаружена тотальная афазия, в 65 (29,4%) - элементы сенсо-моторной афазии (СМА) разной степени выраженности, дизартрия была выявлена в 46 (20,8%) случаях. При ПВ ИИ речевые нарушения были зарегистрированы чаще (n=79; 71,8%), чем при РВИИ (n=57; 51,4%) (p<0,05). Так, в группе РВ не было речевых нарушений при госпитализации у 54 (48,6%) больных, тотальная афазия была выявлена в 25 (11,3%) случаях, сенсо-моторной афазии - в 65 (29,4%), дизартрия - в 28 (25,5%) случаях. Большинство пациентов группы ПВ в поступали с нарушением речи, в том числе с тотальной афазией - 18 (16,4%) человек (в 1,45 раза больше), 33 (30,0%) - с сенсо-моторной афазией и 28 (25,5%) человек с дизартрией. Таким образом, в группе ПВ речевые нарушения на 1-е сутки были выражены в большей степени за счет числа пациентов с тотальной афазией. На 3 сутки стационарного наблюдения нарушения речи были зарегистрированы у 90 (59,8%) больных, из которых у 21 (9,6%) больного была тотальная афазия, у 57 (26,0%) - СМА, у 12 (5,5%) - элементы СМА, дизартрия была выявлена у 41 (18,7%) пациента. При этом вновь в группе ПВ речевые нарушения были чаще (n=81), чем в группе РВ (n=50) (p<0,05).Так, при ПВ инсульте 81 (73,7%) пациент был с нарушением речи, в том числе с тотальной афазией - 15 (13,6%) больных, с СМА - 28 (25,5%) человек, с элементами СМА– 9 (8,2%) и 28 (25,5%) – с дизартрией. При РВ ИИ речевые нарушения были зафиксированы в 54 (48,6%) случаях, тотальная афазия в 25 (11,3%) случаях, СМА - в 65 (29,4%) случаях и дизартрия - в 29 (26,4%) случаях. На 7 сутки госпитализации нарушения речи отмечались у 104 (49,5%) пациентов, из них в 16 (7,6%) случаях была тотальная афазия, в 39 (18,6%) СМА, в 8 (3,8%) - элементы СМА, дизартрия была выявлена у 41 (19,5%) больного. Как и ранее, речевые нарушения чаще наблюдались при инсульте ПВ (n=62), чем при РВ ИИ (n=42) (p<0,05). Так, в группе ПВ 62 (59,1%) 54 больных находилось с нарушением речи, в том числе с тотальной афазией 12 (11,4%) человек, с СМА- 17 (16,2%) пациентов, с элементами СМА- 5 (4,8%) и с дизартрией - 28 (26,7%) больных. В группе РВ у 42 (40,1%) больных обнаружены речевые нарушения, из которых тотальная афазия была выявлена у 5 (3,8%) пациентов, СМА - у 22 (21,0%), элементы СМА- у 3 (2,9%), дизартрия - у 13 (12,4%) человек соответственно. На 14 сутки госпитального наблюдения нарушения речи обнаружены у 95 (49,2%) больных, при этом в 11 (5,7%) случаях это была тотальная афазия, в 42 (21,8%) случаях – СМА, в 14 (7,3%) случаях - элементы СМА, в 28 (14,5%) случаях - дизартрия. При ПВ ИИ речевые нарушения были чаще (n=58), чем при РВ (n=37) (p<0,05). Так, с ПВ инсультом нарушения речи были у 58 (63,0%) больных, из них с тотальной афазией - 7 (7,6%) человек, с СМА - 22 (23,9%) пациента, с элементами СМА - 9 (9,8%) и с дизартрией - 20 (21,7%) больных. При РВ ИИ у 64 (63,4%) пациентов речевых нарушений не наблюдалось, у 4 (4,0%) больных была выявлена тотальная афазия, у 20 (19,8%) человек - СМА, у 5 (5,0%) пациентов - элементы СМА и у 8 (7,9%) человек была выявлена дизартрия. К 20 суткам стационарного наблюдения у 73 (47,4%) пациентов сохранялись нарушения речи, при этом в 10 (6,5%) случаях это была тотальная афазия, в 30 (19,5%) случаях - СМА, в 13 (8,4%) случаях элементы СМА, в 20 (13,0%) случаях - дизартрия. В группе ПВ речевые нарушения также были чаще (n=46), чем в группе РВ (n=26) (p<0,05). Большинство пациентов из группы ПВ (n=46; 62,2%) имели речевые нарушения в виде тотальной афазии - 7 (9,5%) человек, СМА - 14 (18,9%) пациентов, элементов СМА - 9 (12,2%) и дизатрии - 16 (21,6%) больных. У 53 (66,2%) человек из группы РВ речевых нарушений не было, у 3 (3,8%) тотальная афазия, у 16 (20,0%)- СМА, у 4 (5,0%) - элементы СМА и у 4 (5,0%) - дизартрия соответственно, как представлено в таблице 11. 55 Таблица 11. Наличие нарушения речи у больных в группах исследования (p<0,05) Нарушение речи Стат.хар-ка Речь в норме Дизартрия СМА Тотальная афазия Итого n (%) n (%) n (%) n (%) n (%) Речь в норме Дизартрия Элементы СМА СМА Тотальная афазия Итого n (%) n (%) n (%) n (%) n (%) n (%) Речь в норме Дизартрия Элементы СМА СМА Тотальная афазия Итого n (%) n (%) n (%) n (%) n (%) n (%) Речь в норме Дизартрия Элементы СМА СМА Тотальная афазия Итого n (%) n (%) n (%) n (%) n (%) n (%) Речь в норме Дизартрия Элементы СМА СМА Тотальная афазия Итого n (%) n (%) n (%) n (%) n (%) n (%) РВ 1 сутки 54 (48,6%) 18 (16,2%) 32 (28,8%) 7 (6,3%) 111 (50,2%) 3 сутки 59 (54,1%) 12 (11,0%) 3 (2,8%) 29 (26,6%) 6 (5,5%) 109 (49,8%) 7 сутки 63 (60,0%) 13 (12,4%) 3 (2,9%) 22 (21,0%) 4 (3,8%) 105 (50,0%) 14 сутки 64 (63,4%) 8 (7,9%) 5 (5,0%) 20 (19,8%) 4 (4,0%) 101 (52,3%) 20 сутки 53 (66,2%) 4 (5,0%) 4 (5,0%) 16 (20,0%) 3 (3,8%) 80 (51,9%) ПВ Всего 31 (28,2%) 28 (25,5%) 33 (30,0%) 18 (16,4%) 110 (49,8%) 85 (38,5%) 46 (20,8%) 65 (29,4%) 25 (11,3%) 221 (100%) 29 (26,4%) 29 (26,4%) 9 (8,2%) 28 (25,5%) 15 (13,6%) 110 (50,2%) 88 (40,2%) 41 (18,7%) 12 (5,5%) 57 (26,0%) 21 (9,6%) 219 (100%) 43 (41,0%) 28 (26,7%) 5 (4,8%) 17 (16,2%) 12 (11,4%) 105 (50,0%) 106 (50,5%) 41 (19,5%) 8 (3,8%) 39 (18,6%) 16 (7,6%) 210 (100%) 34 (37,0%) 20 (21,7%) 9 (9,8%) 22 (23,9%) 7 (7,6%) 92 (47,7%) 98 (50,8%) 28 (14,5%) 14 (7,3%) 42 (21,8%) 11 (5,7%) 193 (100%) 28 (37,8%) 16 (21,6%) 9 (12,2%) 14 (18,9%) 7 (9,5%) 74 (48,1%) 81 (52,6%) 20 (13,0%) 13 (8,4%) 30 (19,5%) 10 (6,5%) 154 (100%) В ходе исследования выяснилось, что для группы ПВ характерен более тяжелый парез конечностей. Так, при ПВ ИИ в стационар поступило 36 (32,7%) пациентов с плегией в ноге и 52 (47,3%) – с плегией в руке, что в 1,5 раза больше, чем в группе РВ (p<0,05). На 1-е сутки госпитализации в группе ПВ парез до 1 балла в ноге был выявлен в 22 (20,0%) случаях, а в руке –в 12 (10,9%) случаях; парез до 2 баллов в ноге и руке был зарегистрирован в 13 56 (11,8%) и 12 (10,9%) случаях; парез до 3 баллов в ноге и руке – в 21 (19,0%) и 16 (14,5%) случаях, сила мышц была оценена в 4 балла в ноге и руке в 13 (11,8%) и 15 (13,6%) случаях соответственно; не было пареза в ноге у 5 (4,5%) пациентов данной группы, в руке - 3 (2,7%). В группе РВ у 24 (21,6%) пациентов была плегия в ноге, у 35 (31,5%) - в руке; 1 балл в ноге при госпитализации имели 6 (5,4%) человек, в руке - 9 (8,1%) больных; 2 балла в руке и ноге было зарегистрировано у 15 (13,5%) и 10 (9,0%) пациентов соответственно; 3 балла в ноге и руке - 25 (22,5%) и 19 (17,1%); 4 балла в ноге и руке - 22 (19,8%) и 21 (18,9%) соответственно; не было парезов нижних конечностей при госпитализации у 19 (17,1%), верхних конечностей - 17 (15,3%) пациентов группы РВ. На 3 сутки в группе ПВ парез также был более тяжелым, чем в группе РВ. Так, при ПВ ИИ плегия в ноге выявлена в 39 (35,4%) случаях, а в руке - в 58 (52,7%) случаях, 1 балл в ноге и руке был зарегистрирован в 22 (15,0%) и 9 (9,2%) случаях, 2 балла - в 11 (10,0%) и 7 (6,4%), 3 балла - в 13 (11,9%) и 12 (10,9%), 4 балла - в 17 (15,5%) и 16 (14,5%) случаях соответственно. У 8 (7,3%) пациентов из группы ПВ парез в ноге и руке отсутствовал. При РВ инсульте плегия в ноге обнаружена у 20 (18,3%) пациентов и в руке у 33 (30,3%) пациентов, 1 балл в ноге и руке зафиксирован у 11 (10,1%) и 5 (4,6%) пациентов, 2 балла в ноге и руке – у 11 (10,1%) и 12 (11,0%) человек, 3 балла в ноге и руке – у 16 (14,6%) и 19 (17,4%) больных, 4 балла – у 30 (27,6%) и 20 (18,3%) пациентов соответственно. В группе РВ пареза в ноге и руке не было обнаружено у 21 (19,3%) и 20 (18,3%) человек (p<0,05). На 7 сутки больные в группе ПВ по-прежнему имели более тяжелый парез. Плегия в ноге и руке сохранялась у 34 (32,1%) и 49 (46,2%) пациентов, 1 балл - у 10 (9,4%) и 6 (5,6%) человек, 2 балла - у 12 (11,3%) и 7 (6,6%) больных, 3 балла - у 21 (19,8%) и 14 (13,2%) пациентов, 4 балла - у 18 (17,0%) и 18 (17,0%) больных, парез отсутствовал - у 11 (10,4%) и 12 (11,3%) человек соответственно. При инсульте РВ плегия в ноге и руке была зарегистрирована в 17 (16,2%) и 29 (27,6%) случаях, 1 балл в ноге и руке - в 57 11 (10,5%) и 10 (9,6%) случаях, 2 балла в ноге и руке - в 4 (3,9%) и 5 (4,8%) случаях, 3 балла в ноге и руке - в 27 (25,7%) и 20 (19,1%) случаях, 4 балла в ноге и руке - в 26 (24,8%) и 21 (20,0%) случаях соответственно, отсутствие пареза в ноге и руке составило 20 (19,0%) случаев (p<0,05). К 14 суткам в группе ПВ чаще наблюдался тяжелый парез. Так, при ПВ ИИ плегия в ноге и руке была выявлена у 20 (21,7%) и 34 (37,0%) больных, 1 балл в ноге и руке - у 11 (12,0%) и 4 (4,3%) человек, 2 балла - у 9 (9,8%) и 8 (8,7%) больных, 3 балла - у 16 (17,4%) и 13 (14,1%) пациентов, 4 балла - у 22 (23,9%) и 17 (18,5%) людей, парез отсутствовал - у 14 (15,2%) и 16 (17,4%) человек соответственно. В группе РВ количество больных с плегией в ноге и руке составило 14 (13,9%) и 25 (24,8%), 1 балл в ноге и руке - у 9 (8,9%) и 7 (6,9%) больных, 2 балла в ноге и руке - у 7 (6,90%) и 5 (5,0%) больных, 3 балла в ноге и руке - у 11 (10,9%) и 11 (10,9%), 4 балла в ноге и руке – у 35 (34,7%) и 27 (26,7%), парез в ноге и руке отсутствовал - у 25 (24,8%) и 26 (25,7%) пациентов соответственно (p<0,05). К 20 суткам стационарного лечения пациенты из группы ПВ попрежнему отличались более тяжелым двигательным неврологическим дефицитом. При этом в группе ПВ плегия в ноге была в 15 (20,3%) случаях и в руке - в 27 (36,5%) случаях, 1 балл в ноге и руке - в 10 (13,5%) и 5 (6,8%) соответственно, 2 балла в ноге и руке - в 10 (13,5%) и 5 (6,8%) соответственно, 3 балла в ноге и руке - в 10 (13,5%) и 6 (8,1%) случаях, 4 балла в ноге и руке - в 14 (18,9%) и 16 (21,6%) случаях, парез в ноге и руке отсутствовал в 15 (20,3%) и 15 (20,3%) случаях соответственно. В группе РВ плегия в ноге оставалась у 7 (8,8%) пациентов, в руке - у 21(26,2%), 1 балл в ноге и руке - 10 (12,5%) и 3 (3,8%), 2 балла - 7 (8,8%) и 5 (6,2%), 3 балла - 9 (11,2%) и 7 (8,8%), 4 балла - 20 (25,0%) и 17 (21,2%); отсутсвовал парез в ноге и руке в 27 (33,8%) и 27 (33,8%) случаях соответственно (p<0,05). Таким образом, пациенты группы ПВ имели более выраженную и длительно сохраняющуюся слабость в конечностях. Клинически малый инсульт с регрессом симптоматики в первые 3 недели заболевания был у 58 каждого 3-го пациента из группы РВ и лишь каждого у 5-го пациента из группы ПВ (табл. 12). Таблица 12. Наличие пареза при поступлении и в динамике Парез руки Плегия 1 балл 2 балла 3 балла 4 балла Нет пареза Итого 35 (31,5%) 9 (8,1%) 10 (9,0%) 19 (17,1%) 21 (18,9%) Плегия 1 балл 2 балла 3 балла 4 балла Нет пареза Итого Плегия 1 балл 2 балла 3 балла 4 балла Нет пареза Итого Плегия 1 балл 2 балла 3 балла 4 балла Нет пареза Итого Плегия 1 балл 2 балла 3 балла 4 балла Нет пареза Итого РВ ноги ПВ ноги руки Итого 24 (21,6%) 6 (5,4%) 15 (13,5%) 25 (22,5%) 22 (19,8%) руки 1 сутки (p<0,001)* 52 (47,3%) 12 (10,9%) 12 (10,9%) 16 (14,5%) 15 (13,6%) 36 (32,7%) 22 (20,0%) 13 (11,8%) 21 (19,0%) 13 (11,8%) 87 (39,4%) 21 (9,5%) 22 (9,9%) 35 (15,8%) 36 (16,3%) 60 (27,2%) 28 (12,7%) 28 (12,7%) 46 (20,8%) 35 (15,9%) 17 (15,3%) 19 (17,1%) 3 (2,7%) 5 (4,5%) 20 (9,0%) 24 (10,9%) 111 (50,2%) 111 (50,2%) 33 (30,3%) 5 (4,6%) 12 (11,0%) 19 (17,4%) 20 (18,3%) 20 (18,3%) 11 (10,1%) 11 (10,1%) 16 (14,6%) 30 (27,6%) 20 (18,3%) 21 (19,3%) 109 (49,8%) 109 (49,8%) 29 (27,6%) 10 (9,6%) 5 (4,8%) 20 (19,1%) 21 (20,0%) 17 (16,2%) 11 (10,5%) 4 (3,9%) 27 (25,7%) 26 (24,8%) 20 (19,0%) 20 (19,0%) 105 (49,8%) 105 (49,8%) 110 (49,8%) 110 (49,8%) 221 (100%) 3 сутки (p<0,001)* 58 (52,7%) 39 (35,4%) 91 (41,6%) 9 (9,2%) 22 (15,0%) 14 (6,4%) 7 (6,4%) 11 (10,0%) 19 (8,6%) 12 (10,9%) 13 (11,9%) 31 (14,1%) 16 (14,5%) 17 (15,5%) 36 (16,5%) 8 (7,3%) ноги 221 (100%) 59 (27,0%) 33 (15,1%) 22 (10,0%) 29 (13,2%) 47 (21,5%) 8 (7,3%) 28 (12,8%) 29 (13,2%) 110(50,2%) 219(100%) 219(100%) 34 (32,1%) 10 (9,4%) 12 (11,3%) 21 (19,8%) 18 (17,0%) 78 (37,0%) 16 (7,6%) 12 (5,7%) 34 (16,1%) 39 (18,4%) 51 (24,2%) 21 (10,0%) 16 (7,5%) 48 (22,7%) 44 (20,9%) 11 (10,4%) 32 (15,2%) 31 (14,7%) 211 (100%) 211 (100%) 25 (24,8%) 7 (6,9%) 5 (5,0%) 11 (10,9%) 27 (26,7%) 106 (50,2%) 106 (50,2%) 14 сутки (р<0,05)* 14 (13,9%) 34 (37,0%) 20 (21,7%) 9 (8,9%) 4 (4,3%) 11 (12,0%) 7 (6,9%) 8 (8,7%) 9 (9,8%) 11 (10,9%) 13 (14,1%) 16 (17,4%) 35 (34,7%) 17 (18,5%) 22 (23,9%) 59 (30,6%) 11 (5,7%) 13 (6,7%) 24 (12,4%) 44 (22,8%) 34 (17,6%) 20 (10,4%) 16 (8,3%) 27 (14,0%) 57 (29,5%) 26 (25,7%) 25 (24,8%) 14 (15,2%) 42 (21,8%) 39 (20,2%) 101 (53,3%) 101 (52,3%) 193 (100%) 193 (100%) 21 (26,2%) 3 (3,8%) 5 (6,2%) 7 (8,8%) 17 (21,2%) 92 (47,7%) 92 (47,7%) 20 сутки (р<0,05)* 7 (8,8%) 27 (36,5%) 15 (20,3%) 10 (12,5%) 5 (6,8%) 10 (13,5%) 7 (8,8%) 5 (6,8%) 10 (13,5%) 9 (11,2%) 6 (8,1%) 10 (13,5%) 20 (25,0%) 16 (21,6%) 14 (18,9%) 48 (31,2%) 8 (5,2%) 10 (6,5%) 13 (8,4%) 33 (21,4%) 22 (14,3%) 20 (13,0%) 17 (11,0%) 19 (12,3%) 34 (22,1%) 27 (33,8%) 27 (33,8%) 15 (20,3%) 15 (20,3%) 42 (27,3%) 42(27,3%) 80 (51,9%) 80 (51,9%) 74 (48,1%) 59 74 (48,1%) 154 (100%) 154(100%) 110 (50,2%) 7 сутки (р<0,05)* 49 (46,2%) 6 (5,6%) 7 (6,6%) 14 (13,2%) 18 (17,0%) 12 (11,3%) 16 (17,4%) * - p<0,05 – достоверное отличие между группами В связи с более тяжелой клинической картиной пациенты с ПВ имели более выраженный неврологический дефицит, оцениваемый по шкале NIHSS. Средний балл по шкале NIHSS в группе РВ составил 8,52±4,79/0,46 (Ме=8 при межквартильном интервале 5/12 баллов), а в группе ПВ 13,87±6,40/0,61 (Ме=14 при межквартильном интервале 9/19 баллов). Таким образом, в группе ПВ тяжесть неврологической симптоматики была в среднем на 6 баллов больше, чем в группеРВ (p<0,001) (рис. 8). Рисунок 7. Выраженность неврологического дефицита по шкале NIHSS у больных обеих групп на 1 сутки Данная тенденция сохранилась в течение всего срока стационарного наблюдения. Так, на 3 сутки средний балл по шкале NIHSS в группе РВ составил 8,13±5,47/0,61 (Ме=6 при межквартильном интервале 4/13 баллов), в группе ПВ - 11,49±6,16/0,70 (Ме=10 при межквартильном интервале 6/17 баллов). Таким образом, при ПВ инсульта тяжесть неврологической симптоматики была в среднем на 4 баллов больше, чем при РВ ИИ(p<0,001). На 7 сутки средний балл по шкале NIHSS составил 7,86±5,71/0,64 (Ме=6 при межквартильном интервале 3/13 баллов) в группе РВ, в группе ПВ - 10,62±6,37/0,73 (Ме=10 при межквартильном интервале 6/15 баллов), что в среднем на 4 баллов больше, чем в группе РВ (p<0,001). 60 На 14 сутки при РВ инсульте средний балл по шкале NIHSS составил 6,78±5,71/0,64 (Ме=4 при межквартильном интервале 3/10 баллов), а при ПВ ИИ - 10,90±7,98/0,91 (Ме=9 при межквартильном интервале 4/18 баллов), что в среднем на 5 баллов больше, чем при РВ (p<0,001). На 20 суткисредний балл по шкале NIHSSв группе РВ составил 6,67±6,22/0,68 (Ме=4 при межквартильном интервале 2/11 баллов) и 10,91±8,22/0,93 (Ме=7 при межквартильном интервале 4/18 баллов) в группе ПВ. Таким образом, в группе ПВ тяжесть неврологической симптоматики на 20 сутки была в среднем на 3 балла больше, чем при РВ инсульте (p<0,001). На момент выписки, которая наблюдалась с 7 по 48 сутки, в среднем (Ме) на 21 сутки, у пациентов группы РВ балл по шкале NIHSS в среднем (Ме) составил 4 балла, варьируя от 0 до 25 баллов. В то время как в группе ПВ средний балл по шкале NIHSS был на 2 балла больше (Ме = 6 баллов; от 0 до 26), чем при РВ ИИ. Динамика неврологической симптоматики по шкале NIHSS в группах больных с РВи ПВ представлена на рисунке 8. Рисунок 8. Динамика неврологической симптоматики по шкале NIHSS в группах больных обеих групп Таким образом, в течение всего стационарного периода тяжесть неврологической симптоматики по шкале NIHSS была выше у больных 61 группы ПВ (на 1, 3, 7, 14 и 20 сутки - на 6, 4, 4, 5 и 3 балла соответственно; р<0,05). К моменту выписки менее 6 баллов по шкале NIHSS, которые свидетельствуют о хорошем исходе, было у 61,2% (n=62) больных группы РВ и 39,1% (n=33) группы ПВ (в 1,91 раза меньше), а свыше 15 баллов, отражающих грубый неврологический дефицит, было у 7,8% пациентов группы РВ и 24,1% больных группы ПВ (в 3,09 раза больше; р<0,05) как это представлено на рисунке 9. 100% 80% 60% 7,8% 19,4% 24,1% 11,2% 12% 26,5% 40% 61,2% 20% 39,1% 0% Ранняя визуализация <=5 баллов Поздняя визуализация 6-9 баллов 10-15 баллов >15 баллов Рисунок 9. Уровень неврологической симптоматики к моменту выписки по шкале NIHSS у больных обеих групп (p<0,05) Таким образом, более тяжелое клиническое течение характерно для пациентов с поздней визуализацией ИИ на протяжении всего периода госпитализации:сознание чаще и длительнее депрессировано (в 2,6 раза чаще на 1 сутки, в 2,4 раза - 3 сутки, в 2,6 раза - 7 сутки, в 2,8 раза - 20 сутки); неврологический дефицит более выражен, включая уровень пареза конечностей и речевые нарушения (различия по шкале NIHSS на 1, 3, 7, 14, 20 сутки в среднем составляют 6, 4, 4, 5, 3 баллов), при этом зарегистрировано более значительное снижение АД на 1-7 сутки стационарного наблюдения в группе ПВ. Столь существенная разница говорит о более тяжелых метаболических патофизиологических механизмах головного мозга при инсульте, не визуализируемом с помощью КТ в первые 3-48 часов заболевания. 62 3.2. Госпитальный исход и динамика функционального статуса ишемического инсульта при ранних и поздних сроках его визуализации. Более тяжелое состояние пациентов группы ПВ результировалось худшим исходом и более высоким уровнем летальности. Общая госпитальная летальность составила 18,1% (n=40), при этом она была в 2,09 раз выше при ПВ ИИ (n=27; 24,5%), чем при РВ ИИ (n=13; 11,7%; р<0,05) как предствалено в таблице 13. Таблица 13. Исход в госпитальном периоде (р<0,05) Выжившие Умершие Всего Стат. хар-ка n % от исхода % от группы n % от исхода % от группы n % РВ 98 54,1% 88,3% 13 32,5% 11,7% 111 50,2% ПВ 83 45,9% 75,5% 27 67,5% 24,5% 110 49,8% Итого 181 100,0% 81,9% 40 100,0% 18,1% 221 100,0% Летальные исходы на стационарном этапе были констатированы у больных обеих групп в период до 48 суток (Ме=12 суток). При этом в период до 10 суток, когда неблагоприятный исход преимущественно обусловлен размером и тяжестью самого инсульта, умерло 19 из 40 (48,7%) человек. Позднее 10-х суток умерло 51,3% больных в основном в результате развития вторичных гнойно-септических и тромбоэмболических осложнений и синдрома полиорганной недостаточности. Сроки госпитальной летальности представлены на рисунке 10. 63 10 8 6 4 2 0 0-2 сут 3-5 сут 6-7 сут 8-10 11-13 14-16 17-19 20-22 23-25 26-28 29-31 32-34 35-37 >37 сут сут сут сут сут сут сут сут сут сут сут летальность в стационаре Рисунок 10. Сроки летальности больных ИИ в стационаре При РВ инсульте летальность составила 33,3% в период до 10 дней и 66,7% - позднее 10 суток (до 25 дней). При ПВ ИИ, наоборот, максимальная летальность была в первые 10 дней заболевания (n=15; 55,5%, что в 1,67 раза больше), позднее 10-х суток в более длительный, чем в 1-й группе период (до 48 дней), умерло 44,5% (n=12) больных (p<0,05). Сроки госпитальной летальности в группах РВ и ПВ шагом в 5 дней представлены на рисунке 11. 60 48,1% 50 40 30 20 10 0 33,3% 25,0% 16,7% 16,7% 8,3% 7,4% 7,4% 1-5 сут 6-10 сут 11-15 сут Ранняя визуализация 11,1% 16-20 сут 22,2% 3,7% 21-25 сут 0,0% >25 сут Поздняя визуализация Рисунок 11. Сроки госпитальной летальности больных с РВ и ПВ ИИ Таким образом, более тяжелое состояние пациентов группы ПВ ИИ подтверждалось более высоким уровнем госпитальной летальности, которая была в 2,1 раза выше, причем максимальный уровень летальности у пациентов группы РВ приходился на 21-25 сутки (33,3%), а ПВ - на 6-10 сутки (48,1%). Это говорит о более масштабных тяжелых и сложных патофизиологических механизмах, протекающих в головном мозге у больных с инсультом ПВ в течение первые 10 дней заболевания. 64 Анализ функционального исхода выявил закономерное ухудшение при ПВ инфаркта мозга. Всем больным была проведена оценка активности повседневной жизнедеятельности с помощью шкалы Bartel (Bartel Activities of Daily Living (ADL) Index). Установлено, что превалирующее число больных обеих групп исследования при поступлении в стационар были полностью зависимы. В группе РВ средний балл по шкале Bartel составил 25,77±13,12/1,25 (Ме=20 при межквартильном интервале 20/30 баллов). При ПВ средний балл составил 15,91±15,74/1,51 (Ме=20 при межквартильном интервале 0/20 баллов). Следовательно, пациенты из группы ПВ были более зависимы (p<0,05). На 3 сутки среднее значение индекса Bartel в группе РВ составило 30,95±15,20/1,45 (Ме=30 при межквартильном интервале 20/40 баллов), а в группе ПВ - 24,45±21,69/2,07 (Ме=20 при межквартильном интервале 0/35 баллов). Таким образом, больные с ПВ ИИ были в среднем на 10 баллов более нуждающимися в посторонней помощи (p<0,05). На 7 сутки у пациентов с инсультом РВ среднее значение индекса Bartel соответствовало 37,14±16,73/1,63 (Ме=35 при межквартильном интервале 25/45 баллов), а у ПВИИ - 29,43±25,13/2,45 (Ме=25 при межквартильном интервале 10/40 баллов). Таким образом, пациенты обеих групп к 7 суткам имели выраженную зависимость, однако больные с ПВ ИИ в среднем на 10 баллов больше нуждались в постороннем уходе (p<0,05). На 14 сутки среднее значение индекса Bartel составило 44,46±19,80/1,97 (Ме=45 при межквартильном интервале 30/55 баллов) в группе РВ и 40,27±27,60/2,88 (Ме=35 при межквартильном интервале 20/60 баллов) - в группе ПВ.Пациенты в группе ПВ в среднем на 10 баллов больше нуждались в посторонней помощи, чем пациенты в группе РВ(p>0,05). На 20 сутки пациенты в группе РВ нуждались в большей посторонней помощи нежели пациенты в группе ПВ. Среднее значение индекса Bartel составило 52,25±23,69/2,65 (Ме=55 при межквартильном интервале 30/70 65 баллов) в группе РВ и 44,80±28,38/3,28 (Ме=40 при межквартильном интервале 20/70 баллов) в группе ПВ (p<0,05). Таким образом, пациенты с ПВ инсультом были более социально зависимы в течение всего периода стационарного наблюдения (различия по индексу Bartel на 3, 7, 14 и 20 сутки составили в среднем на 10, 10, 10 и 15 баллов соответственно) (р<0,05), как представлено на рисунке 12. Рисунок 12.Динамическая оценка активности повседневной жизнедеятельности больных обеих групп исследования по шкале Bartel К моменту выписки в группе РВ оценка функционального статуса по индексу Bartelвыявиласледующие показатели. Так, в группе РВ у 10 (10,2%) пациентов была зафиксирована грубая инвалидизация (≤20 баллов по индексу Bartel), у 45 (45,9%) - выраженная инвалидизация (25-60 баллов по индексу Bartel), у 28 (28,6%) - умеренная инвалидизация (65-90 баллов по индексу Bartel), у 15 (15,3%) человек при выписке было зарегистрировано 95100 баллов по индексу Bartel. В группе ПВ отмечалось смещение функционального статуса в сторону неблагоприятного исхода. Так, при ПВ 15 (18,1%) больных имели грубую инвалидизацию (≤20 баллов по Bartel), 42 (50,6%) - выраженную инвалидизацию (25-60 баллов по индексу Bartel), 17 (20,5%) - умеренную инвалидизацию (65-90 баллов поиндексуBartel) и лишь 9 (10,8%) пациентов к моменту выписки имели 95-100 баллов по индексу Bartel. Таким образом, при ПВ ИИ доля негативных функциональных 66 исходов (до 60 баллов по индексу Bartel) была в 1,23 раза больше, а позитивных (95-100 балловпо индексу Bartel) – в 1,42 раза меньше, чем при РВ ИИ (p<0,05) (рис. 13). 18,1 ПВ РВ 10,2 0% 50,6 20,5 45,9 20% 28,6 40% 0-20 баллов 65-90 баллов 60% 80% 10,8 15,3 100% 25-60 баллов 95-100 баллов Рисунок 13. Функциональное состояние при выписке по индексу Bartel Во время стационарного наблюдения за пациентами обеих групп исследования мы проводили оценку функционального состояния по модифицированной шкале Renkin на 1, 3, 7, 14, 20 сутки и при выписке. Достоверные различия имелись на 1, 3, 7 и 14 сутки. Так, больные на 1 сутки исследования в группе ПВ имели 5 баллов по шкале Renkin, то есть выраженную нетрудоспособность, были прикованы к постели, страдали недержанием и нуждались в постоянном уходе в 44,5% (n=49) случаях, а в группе РВ - всего в 16,2% (n=18) случаях. На 3 сутки - в 18,2% при РВ ИИ и в 38,2% случаях при ПВ ИИ; на 7 сутки – в 13,3% и 32,4% случаях; на 14 сутки - в 7,9% и 27,2% случаях соответственно. А на 20 сутки - в 10,8% при РВ ИИ и 22,8% при ПВ ИИ. Таким образом, в группе ПВ пациентов, оцененных на 5 баллов по шкале Renkin на 1, 3, 7, 14 и 20 сутки было в 2,75; 2,10; 2,44; 3,44 и 2,11 раза больше (p<0,05) (табл. 14). К моменту выписки, происходящей в разные сроки в зависимости от тяжести инсульта, достоверных отличий по шкале Renkin установлено не было (p>0,05). В группе ПВ 13,3% пациентов и в группе РВ 14,3% больных 67 выписывались в «относительно хорошем» функциональном состоянии, оцененном в 0-1 балл по шкале Renkin, а в неудовлетворительном (4-5 баллов) - 38,6% при ПВ ИИ и 36,7% РВ ИИ. Таблица 14. Динамика функционального состояния обеих групп исследования по модифицированной шкале Ренкин Ренкин (балл) 0 РВ ПВ - РВ ПВ РВ ПВ 0 (0,0%) 1 (1,0%) РВ ПВ 0 (0,0%) 3 (3,3%) РВ ПВ 0 (0,0%) 1 (1,3%) 1 2 3 4 5 1 сутки 2 (1,8%) 18 (16,2%) 73 (65,8%) 18 (16,2%) 3 (2,7%) 14 (12,7%) 44 (40,0%) 49 (44,5%) 3 сутки (0,0%) 3 (2,7%) 30 (27,3%) 57 (51,8%) 20 (18,2%) 4 (3,6%) 6 (5,5%) 21 (19,1%) 37 (33,6%) 42 (38,2%) 7 сутки 1 (1,0%) 1 (1,0%) 35 (33,3%) 54 (51,4%) 14 (13,3%) 7 (6,7%) 10 9,5%) 20 (19,0%) 33 (31,4%) 34 (32,4%) 14 сутки 2 (2,0%) 5 (5,0%) 46 (45,5%) 40 (39,6%) 8 (7,9%) 5 (5,4%) 9 (9,8%) 27 (29,3%) 23 (25,0%) 25 (27,2%) 20 сутки 3 (3,6%) 9 (10,8%) 38 (45,8%) 24 (28,9%) 6 (10,8%) 3 (3,8%) 7 (8,9%) 27 (34,2%) 23 (29,1%) 18 (22,8%) * - p<0,05 – достоверное отличие между группами - р 0,002* 0,001 * 0,000 * 0,000 * 0,180 Таким образом, худший госпитальный исход зарегистрирован в группе пациентов с ПВ ИИ. Так, в группе ПВ госпитальная летальность была в 2,1 раза выше (24,5%), чем в группе РВ(11,7%), причем при ПВ ИИ максимальная госпитальная летальность зарегистрирована в первые 10 дней (55,5%), а при РВ ИИ - позднее 10 суток (66,7%). Выжившие пациенты группы ПВ к моменту выписки были более социально зависимы (доля негативных функциональных исходов была в 1,23 раза больше, а позитивных - в 1,42 раза меньше, чем в группе РВ). 3.3. Инструментальные особенности острого ишемического инсульта с ранней и поздней визуализацией Проведенное ультразвуковое исследование брахиоцефальных артерий (БЦА) позволило выявить ряд особенностей ишемического инсульта с ранней и поздней визулизацией. 68 Так, УЗДГ проводили 46 пациентам обеих групп исследования, в том числе 23 (50%) пациентам с РВ и 23 (50%) пациентам с ПВ ИИ. Стеноз ВСА менее 50% был обнаружен у 19 (41,2%) больных, 50-70% - у 13 (28,2%) человек, более 70% - у 14 (30,6%) пациентов. В группе ПВ пациентов, имеющих стеноз БЦА менее 50%, было в 1,37 раза больше, чем в группе РВ (n=11 (47,8%) при РВ и n=8 (34,8%) при ПВ). Стеноз от 51% до 70% был сопоставим в обеих группах - 6 (26,1%) и 7 (30,4%) соответственно. Стеноз БЦА более 70% зарегистрирован у 6 (26,1%) больных из группы РВ и 8 (34,8%) пациентов группы ПВ. Таким образом, при ПВ ИИ гемодинамически незначимый стеноз ВСА(<50%) встречался в 1,37 раза реже, а гемодинамически значимый (>70%) - в 1,33 раза чаще, чем в группе РВ (рис. 14). 60 50 40 30 20 10 0 47,8% 34,8% 26,1% <50% 30,4% 50-70% Ранняя визуализация 26,1% 34,8% >70% Поздняя визуализация Рисунок 14. Стеноз БЦА обеих групп исследования по данным УЗДГ БЦА Анализ подтипов ИИ у пациентов, которым было проведено ультразвуковое исследование БЦА, установил, что инсульт РВ был в 3,2 раза чаще атеротромботическим (82,6% в группе РВ и 26,1% в группе ПВ). В то время как при ПВ ИИ чаще встречался кардиоэмболический инфаркт мозга (34,8%), что в 4 раза больше, чем при РВ ИИ (8,7%), как представлено на рисунке 15. Анализ гетерогенных подтипов ИИ с ранней и поздней визуализацией всей выборки пациентов (с/без данных УЗДГ) выявил аналогичные закономерности. 69 100 82,6% 80 60 40 39,1% 34,8% 26,1% 8,7% 20 8,7% 0 Атеротромботический Кардиоэмболический Ранняя визуализация Другие Поздняя визуализация Рисунок 15. Подтипы ИИ с ранней и поздней визуализацией Таким образом, РВ ИИ чаще наблюдается при длительно развивающемся системном атеротромбозе и атеротромботическом инсульте, поэтому пациенты данной группы пребывают в состоянии нарастающей гипоксии, что обуславливает постепенное развитие долгосрочных и краткосрочных адаптативных приспособительных механизмов. Другие подтипы ИИ, развивающиеся в большинстве случаев внезапно, чаще характерны для ПВ ишемического инсульта. Отсутствие адаптационного времени обуславливает более тяжелое клиническое состояние пациентов и худший исход. Изучение морфологической картины по данным КТ у больных обеих групп выявило принципиальные различия. При госпитализации объем инсульта в группе РВ составил 56,1±10,1 см3 (Ме=14,62 см3 при межквартильном интервале 2,94/76,28 см3 ; 95% -ДИ: [0,28; 257,78]), на повторной КТ, выполненной на 3-15 сутки от дебюта инсульта (в среднем (Ме) – на 6 сутки), объем значимо увеличился и составил 69,0±15,8 см3 (Ме=27,10 см3 при межквартильном интервале 7,14/104,38 см3 ; 95% -ДИ: [1,76; 297,73]). В группе ПВ очага инсульта не было обнаружено на 1 сутки госпитализации, а на повторном КТ, объем ИИ был достоверно больше (в 2,08 раза, чем при РВ; p<0,05) и составил 105,8±15,9 см3 (Ме=56,38 см3 при межквартильном интервале 5,87/142,56 см3 70 [0,86; 390,32]). Таким образом, ПВ отрицательно сказывается на динамике объема очага ишемии мозга (рис. 16). Рисунок 16. Динамика объема ИИ по данным КТ в группах с РВ и ПВ Важно отметить, что в группе РВ средний объем ишемической зоны повреждения мозга прогрессировал и достигал своего максимума на 3-4 сутки, в меньшей степени на 5-7 сутки. В группе ПВ максимальный объем ишемии по данным КТ зафиксирован на 2 сутки госпитализации, в дальнейшем в период 3-7 сутки объем инфаркта мозга был меньше, однако в 2-3 раза больше, чем в группе РВ в те же сроки (рис.17). Рисунок 17. Динамика объема очага ишемии по данным КТ в обеих группах исследования 71 Поскольку метод КТ использует физические принципы, позволяющие визуализировать критическую ишемию мозговой ткани с выявлением зон функционального молчания (пенумбры) и очагового некроза (ядерная зона), в основе развития которых лежит разная степень локального энергодефицита, обусловленного снижением внутриклеточного энергосинтеза, поэтому лабораторный этап нашего исследования был посвящен данной оценке. 3.4. Лабораторные особенности острого ишемического инсульта при ранних и поздних сроках его визуализации С целью поиска патофизиологического объяснения более позднего появления КТ-признаков церебральной ишемии в группе больных с ПВ ИИ со значительной разницей объема поражения вещества мозга проведена оценка скрининговых параметров биохимического анализа крови, кислотнощелочного состояния и ферментного спектра крови, характеризующих у пациентов двух анализируемых групп различные патофизиологические процессы. При анализе динамики биохимических показателей крови у больных групп РВ и ПВ наиболее ярким межгрупповым различием обладали процессы тканевого энергосинтеза (табл. 15). Таблица 15. Динамика показателей биохимического анализа крови у больных обеих групп Показатель Белок (Норма: 65-85 г/л) группа РВ ПВ Альбумин (Норма: 35-55 г/л) РВ ПВ Глюкоза (Норма: РВ 1 сутки 69 * 65/73 49-88 71 * 67/76 57-83 41 37/44 27-51 39 38/42 23-72 6,5 5,4/9,1 3 сутки 65 59/72 46-93 67 62/74 46-84 35 31/37 25-50 35 29/37 15-57 6,4 5,4/8,2 72 7 сутки 68 57/75 47-88 63 60/72 41-86 29 27/36 18-44 29 24/31 19-39 6,7* 5,6/8,1 14 сутки 70 64/73 47-83 70 63/73 51-86 29 23/38 22-38 26 23/37 23-38 5,6 * 5,1/6,6 20 сутки 64 57/76 47-83 66 59/77 49-84 20 16/21 17,0-22 20 5/29 19-37 7,1 5,8/8,1 3,3-6,1 ммоль/л) ПВ Мочевина (2,1-8,2 ммоль/л) РВ ПВ Креатинин (53-150 мкмоль/л) РВ ПВ Холестерин Норма:(0,9-4,9 ммоль/л) РВ ПВ Общий билирубин (8,5-20,5 ммоль/л) РВ 3,3-13,8 3,8-29,4 4,4-15,0 4,8-10,2 4,8-9,5 6,5 5,4/8,4 3,8-21,0 5,9 4,5/8,0 2,4-26,9 6,0 4,5/7,6 1,5-17,7 100 * 81/115 37-537 89 * 77/107 47-221 5,2 4,3/6,2 2,8-10,0 5,3 4,6/6,2 3,2-8,8 6,1 5,4/7,7 4,4-13,2 6,2 5,0/9,0 2,5-23 6,2 4,9/8,0 2,9-19,8 95 74/106 42-550 99 80/115 48-586 4,9 4,0/5,6 2,2-8,2 5,3 4,5/5,9 3,3-9,1 7,2* 5,4/12,0 3,3-20,3 9,1 5,5/11,1 2,9-42,0 9,2 5,4/12,1 2,6-38,9 96 78/126 63-512 99 80/124 48-759 4,7 4,1/5,7 2,4-7,4 4,6 3,9/5,5 2,7-6,3 6,2 * 5,4/8,1 2,7-15,4 9,5 * 7,6/14,4 5,6-45,9 7,8 * 5,4/11,9 2,3-26,3 99 95/119 78-508 107 93/117 55-576 4,7 4,0/6,1 2,5-6,6 4,3 3,5/5,2 3,1-5,9 6,3 4,4/9,9 4,1-17,1 7,5 6,6/10,5 5,0-59,0 7,4 5,4/13,5 3,9-25,5 98 83/114 59-670 84 72/97 51-202 4,8 3,9/5,3 1,3-6,8 4,5 3,4/5,1 2,7-6,2 12,8 10,6/16,5 3,5-51,2 15,0 * 12,2/19,5 4,2-38,5 13,4 11,0/14,9 5,5-45,0 12,8 9,2/16,4 6,6-24 12,8 9,0/14,0 3,0-22,8 11,7 15,5 * 11,2 11,7 13,3 9,7/15,3 13,1/23,6 9,0/15,4 9,5/14,8 8,4/16,9 1,2-34,4 6,0-62,7 5,0-79,0 5,5-20,4 6,7-29,4 19 * 26 33 31 35 * АЛТ (Норма: РВ 12/30 16/35 17/58 25/44 23/40 менее 40 ЕД/л) 7-114 10-162 11-187 7-103 19-59 22 * 23 37 31 21 * ПВ 17/33 17/35 23/49 23/55 17/34 6-145 8-135 12-121 12-141 3-60 25 34 46 28 25 АСТ (Норма: РВ 18/31 21/46 24/72 25/43 23/43 менее 20 ЕД/л 8-94 13-166 18-97 15-120 14-65 23 30 35 27 22 ПВ 21/31 23/40 23/51 26/56 20/34 9-320 13-224 15-96 23-161 15-107 ЛДГ-1 434 * 425 491 447 422 * (110-620 РВ 336/544 304/615 401/911 391/696 346/465 нмоль/с*л) 236-869 217-979 235-1314 341-722 299-580 396 * 531 494 475 569 * ПВ 290/470 355/626 345/657 453/591 417/610 235-970 182-1228 207-1286 391-1118 337-679 *- p<0,05 – достоверное отличие между группами (критерий Манна-Уитни) ПВ 73 Соотношения уровней лактата и гидролизующего его фермента ЛДГ позволяет охарактеризовать степень ингибирования трансформации глюкозы в пировиноградную кислоту с ростом лактата и подавлением синтеза ацетилкоэнзима-А [31, 59, 64, 77], что является отражением гипоксии и грубой депрессии процессов энергосинтеза в циклах анаэробного и аэробного гликолиза при церебальной ишемии – важнейшего способа получения энергии головным мозгом. Представленный в основном в сердце и мозге фермент гликолиза ЛДГ1, катализирующий превращение лактата в пируват с образованием NADH+, был достоверно выше (в среднем на 10%) у больных группы РВ (Ме ЛДГ-1 на 1 сутки пребывания больных в стационаре составила 434 нмоль/с*л при РВ ИИ и 396 нмоль/с*л при ПВ ИИ; p<0,05). Это свидетельствует о большей ишемии тканей головного мозга при РВ инсульте с большим накоплением лактата в результате ингибирования аэробного и активацией анаэробного гликолиза, что результируется более ранним развитием очага некрозоапоптотической гибели нейронов, различаемой на КТ. В то же время это говорит о более ранней активации компенсаторно-приспособительных механизмов именно при РВ инсульта, что подтверждается более выраженным ростом ЛДГ к 3 суткам в группе ПВ по сравнению с группой РВ (Ме ЛДГ-1 на 3 сутки пребывания больных в стационаре составила 425 нмоль/с*л при РВ ИИ и 531 нмоль/с*л при ПВ ИИ; p>0,05), при этом рост ЛДГ-1 в среднем составил 9 нмоль/с*л (p>0,05) и 135 нмоль/с*л (p<0,05) соответственно. Полученные данные могут свидетельствовать об истощении резко активированных в дебюте инсульта резервных возможностей организма у больных с ПВ ИИ с более резким срывом ауторегуляции в дальнейшем, чем при РВ ИИ. В последующем динамика данного фермента не различалась в обеих группах (рис. 18). 74 Рисунок 18. Уровень ЛДГ при госпитализации и в динамике в обеих группах исследования Изменения ЛДГ сопровождались более высоким уровнем лактата в артериальной и венозной крови на 1 сутки в группе РВ. В последующем, на 3-7 сутки, уровень лактата венозной и артериальной крови был значимо выше в группе ПВ, что коррелирует с более массивной гибелью нервной ткани (рис. 19). Полученные данные, коррелирующие с более легким течением и лучшим исходом РВ ИИ, говорят о защитной роли нарастающей ишемии, характерной для атеротромботического инсульта, поскольку при постепенном развитии сосудистой катастрофы организм успевает развернуть каскад приспособительных механизмов с активацией всех 6 механизмов защиты клеток, в том числе от кислорода, в целях предотвращения развития пагубных последствий. 75 Рисунок 19. Динамика уровня лактата артериальной и венозной крови у больных с ранней и поздней визуалзацией ИИ Так, проводя анализ концентрации лактата в группах исследования выяснилось, что на протяжении 1, 3 и 7 суток его уровень в обеих группах был выше нормы, однако на 1 сутки в группе РВ уровень молочной кислоты был выше, чем в группе ПВ: в среднем составил 2,1 ммоль/л в группе РВ и 2,0 ммоль/л в группе ПВ (р>0,05). При этом лактат выше 1,7 ммоль/л был у 58,8% пациентов группы РВ и 60,3% пациентов группы ПВ. К третьим суткам уровень лактата вырос только в группе ПВ до 2,1 ммоль/л, тогда как в группе РВ выявлен регресс показателя в среднем на 11% до 1,9 ммоль/л. Лактат выше 1,7 ммоль/л был у 52,8% пациентов группы РВ и 69,7% - группы ПВ. На 3 сутки показатель лактата венозной крови свидетельствует о тенденции к нормализации уровня молочной кислоты в группе РВ и о ее возрастании с ингибированием энергосинтеза в группе ПВ (р<0,05). На 7 сутки у больных с РВ инсультом уровень молочной кислоты значительно снизился по сравнению с 1 и 3 сутками до нормы (в среднем до 1,6 ммоль/л), тогда как в группе ПВ концентрация лактата сохранялась на критическом уровне (в среднем 2,1 ммоль/л) (р<0,05). 76 Таким образом, кислородное голодание и энергодефицит с 3-х суток возрастали в группе ПВ. Поэтому лактатацидоз увеличивал распад фосфолипидов в мемранах внутриклеточных органелл и наружной клеточной мембране, что в свою очередь могло способствовать усилению процессов перекисного окисления липидов и образованию свободных радикалов, которые оказывали нейротоксическое действие и приводили к гибели (некрозу) нервной ткани у больных с ПВ ИИ. Это объясняет наличие срыва ауторегуляции у больных с ПВ ИИ начиная с 3-х суток стационарного наблюдения и преобладание умерших больных в первые 6-10 дней госпитализации. При проведении анализа уровня глюкозы была выявлена динамика в сторону нарастающего нарушения энергосинтеза в группе ПВ. Так, на 1 сутки уровень глюкозы в обеих группах составил в среднем Ме=6,5 ммоль/л при РВ и Ме=6,5 ммоль при ПВ ИИ. К 3 суткам в группе ПВ отметилась положительная динамика в сторону нормы (Ме=6,1 ммоль/л), в группе РВ уровень глюкозы по-прежнему составил Ме=6,4 ммоль/л. На 7 сутки в группе ПВ отметилось резкое возрастание уровня глюкозы Ме=7,2 ммоль/л, что было достоверно больше, чем в группе РВ (Ме=6,7 ммоль/л). К 14 суткам уровень глюкозы нормализовался в обеих группах, однако в группе ПВ был выше на 10%, чем в группе РВ (p<0,05) (рис. 20). Таким образом, результатом выявленных биохимических нарушений стал рост уровня глюкозы в группе ПВ к 7 суткам (Ме=7,5 ммоль/л, что в среднем на 15% больше, чем в группе РВ (p<0,05), при этом у 63% пациентов группы ПВ уровень глюкозы был больше верхней границы нормы. Именно в этот период (6-10 сутки) летальность в группе ПВ была максимальной, превосходя в 2,88 раза летальность в группе РВ в этот период. Это еще раз подтверждает более выраженный и нарастающий дисбаланс энергосинтеза при ПВ ИИ (рис. 20). 77 Рисунок 20. Динамика уровня глюкозы крови у больных обеих групп Нарастание ишемии с расстройствами гликолиза и энергосинтеза сопровождались помимо лактатацидоза другими изменениями кислотноосновного состава венозной крови (табл. 16). Таблица 16. Динамика кислотно-щелочного состава венозной и артериальной крови Показатель pH (Норма: 7,35-7,45) pCO2 (Норма: вена 46-58; арт 32-48 мм рт. ст.) pO2 (Норма:вена Группа 1 сутки РВ 7,36 7,32/7,40 7,24-7,52 ПВ 7,37 7,34/7,39 7,28-7,45 р 0,966 РВ 45,0 39,3/48,4 30,5-56,5 ПВ 46,7 42,3/50,1 38,3-56,8 р 0,027 * РВ 36,5 27,9/42,2 16,0-55,2 ПВ 36,0 ВЕНА АРТЕРИЯ 3 сутки 7 сутки 1 сутки 3 сутки 7,41 7,39 7,43 7,47 7,35/7,45 7,35/7,41 7,38/7,44 7,41/7,50 6,867,347,347,307,58 7,53 7,47 7,52 7,39 7,38 7,41 7,41 7,33/7,42 7,34/7,42 7,37/7,44 7,39/7,47 7,317,257,287,317,45 7,47 7,51 7,54 0,120 0,592 0,385 0,242 42,0 41,0 36,0 33,8 34,7/47,2 34,0/44,5 30,0/40,0 26,9/38,8 30,933,323,023,853,9 47,8 54,8 42,1 44,0 45,5 35,0 38,2 39,4/52,3 36,2/50,9 29,0/36,5 32,1/43,0 29,125,519,122,162,0 55,0 46,8 49,0 0,175 0,045 * 42,6 41,0 30,5/51,1 36,6/48,0 21,232,456,7 58,0 39,0 37,8 78 7 сутки 7,45 7,42/7,50 7,40-7,51 7,44 7,40/7,49 7,40-7,49 0,800 29,0 27,9/45,8 27,9-51,0 34,1 31,4/36,7 31,4-36,7 0,563 0,295 0,533 90 79/103 69-190 99 95/152 92-174 97 77/152 70-170 74 68 105 38-50 ; арт 83-108 мм рт. ст.) sO2 (норма: 9599%) 27,7/44,5 19,0-53,7 р РВ ПВ р cHCO3cактуальный бикарбонат РВ (норма: 2127 ммоль/л) ПВ р Лактат (Норма: 0,51,6 ммоль/л) РВ ПВ р 36,0/46,0 31,9/44,5 63/130 66/96 20,219,960-186 60-173 58,1 57,0 0,921 0,897 0,154 0,145 0,016 * 81,0 83,0 96,6 66,4 96,7 65,2/85,5 71,4/89,0 93,1/98,2 48,8/77,5 94,3/98,8 24,665,889,925-88,5 80-100 95,4 95,0 99,5 71,0 74,0 92,2 64,4 93 64,8/82,0 61,0/79,6 89,9/97,8 50,8/77,0 93/97 28,324,989,127,4-89 82-99 90,8 93,0 99,4 0,822 0,382 0,036* 0,047* 0,006 * 25,7 23,8 22,5 23,2 24,3 24,2/28,7 22,0/25,9 16,9/23,4 21,7/27,9 22,1/25,9 22,218,913,720,618,3-31,2 32,5 27,2 29,0 31,7 25,4 24,8 23,3 24,5 25,1 22,4/26,6 21,2/27,9 21,8/24,5 22,1/27,2 23,5/27,7 19,616,721,112,919,9-31,1 35,0 35,7 24,8 30,4 0,049 * 0,181 0,614 0,270 0,882 2,1 1,9 1,6 1,6 1,5 1,6/2,4 1,8/2,7 1,4/2,3 1,0/2,25 1,2/1,7 1,2-4,3 1,0-4,2 0,9-3,1 1,0-2,4 1,1-1,7 2,0 2,10 2,1 1,5 1,7 1,6/2,2 1,55/2,5 1,1/2,4 1,1/3,6 1,2/2,0 1,1-2,6 0,97-2,9 1,0-2,8 0,9-4,6 1,0-2,4 0,459 0,047* 0,028* 0,820 0,638 * - p<0,05 – достоверное отличие между группами 90/121 90-121 1,000 97,3 95,3/98,6 92-100 98 96/99 96-99 1,000 22,3 20,6/36,5 20,6-40,7 24,0 23,0/25,0 23,0-25,0 0,800 1,4 1,3/2,2 1,1-2,5 2,0 1,7/2,3 1,7-2,3 0,333 В ходе исследования выяснилось, что на 1 сутки в группе РВ pH венозной крови находилось на нижней границе нормы, в отличие от группы ПВ, то есть произошел сдвиг pH в кислотную сторону (увеличение кислотности) и потепенно развивался ацидоз в обеих группах исследования с преобладанием сдвига у больных с РВ ИИ. Так, на 1 сутки пациенты с РВ ИИ имели pH в среднем 7,36±0,63/0,01 (Ме=7,36 при межквартильном интервале 7,32/7,40), а в группе ПВ - 7,36±0,06/0,07 (Ме=7,37 при межквартильном интервале 7,34/7,39) (p>0,05). У больных в группе РВ рН выше 7,45 было у 3,6% больных и в группе ПВ - у 3,6% пациентов, а рН меньше 7,36 было у 40,8% пациентов группы РВ и 34,2% - группы ПВ. Следовательно, пациентов с неизмененным рН на 1 сутки было больше в группе ПВ, а в группе РВ в 79 1,19 раза чаще был ацидоз (р<0,05). К 3 суткам в группе РВ отмечалось восстановление кислотно-щелочного равновесия, однако при ПВ ИИ pH венозной крови близилось к сдвигу в кислотную сторону. Так, на 3 сутки pH составляло 7,39±0,15/0,04 (Ме=7,41 при межквартильном интервале 7,35/7,45) в группе РВ и 7,38±0,05/0,01 (Ме=7,39 при межквартильном интервале 7,33/7,42) в группе ПВ (р>0,05). К 3 суткам в группе РВ уменьшилась кислотность крови, что коррелировало с быстрым восстановлением уровня сознания и неврологического дефицита. К 7 суткам в отличие от РВ ИИ, значение pH в группе ПВ оставалось приближенным к ацидозу. Так, на 7 сутки в группе РВ уровень pH составил в среднем 7,40±0,07/0,02 (Ме=7,39 при межквартильном интервале 7,35/7,41), а в группе ПВ - 7,38±0,05/0,01 (Ме=7,38 при межквартильном интервале 7,34/7,42) (р>0,05).На 14 сутки pH продолжало уменьшаться в группе ПВ и составило в среднем 7,37±0,04/0,01 (Ме=7,36 при межквартильном интервале 7,34/7,42), тогда как в группе РВ уровень pH соответствовал нормальным значениям и был равен в среднем 7,44±0,03/0,02 (Ме=7,43 при межквартильном интервале 7,42/7,46) (р>0,05).На 20 сутки в группе ПВ сохранялся сдвиг в кислотную сторону - 7,37±0,05/0,02 (Ме=7,35 при межкварильном интервале 7,33/7,44), а у больных с РВ ИИ pH составило 7,38±0,04 (Ме=7,39 при межквартильном интервале 7,36/7,41) и при ПВ (р>0,05). На 1 сутки pH артериальной крови у больных обеих групп исследования варьировало в пределах нормы. Так, на 1 сутки у больных с РВ pH составляла в среднем 7,41±0,04/0,01 (Ме=7,43 при межвартильном интервале 7,38/7,44), а у больных с ПВ ИИ - 7,40±0,05/0,01 (Ме=7,41 при межквартильном интервале 7,37/7,44) (р>0,05). При этом пациентов со сдвигом рН в сторону алколоза было 5,9% в группе ПВ и 15,4% в группе РВ, а в сторону ацидоза – наоборот, 7,7% при РВ ИИ и 17,6% при ПВ ИИ.На 3 сутки отмечался относительный избыток оснований в группе РВ и pH артериальной крови составило 7,42±0,07/0,01 (Ме=7,47 при межквартильном интервале 7,41/7,50) и в группе ПВ - 7,45±0,08/ 0,03 (Ме = 7,41 при 80 межквартильном интервале 7,39/7,47). Таким образом, нарастание гипервентиляциина 3 сутки в группе РВявляется отражением ишемического повреждения мозга (p>0,05).На 7 сутки в обеих группах показатели варьировали в пределах нормы, однако при РВ инсульте pH артериальной крови находилось на верхней границе нормы и составило 7,44±0,06/0,04 (Ме=7,45 при межквартильном интервале 7,42/7,50) и при ПВ ИИ – 7,48±0,02/0,01 (Ме=7,44 при межквартильном интервале 7,40/7,49) (p>0,05). Таким образом, на 1 сутки у пациентов с РВ инсультом произошло усиление активации гликолиза и быстрое развитие общих компенсаторных регионарных гемодинамических изменений. Это объясняет появление ранних признаков ишемии на КТ-снимках в первые часы от начала заболевания у больных с РВ ИИ. С 3-х и в последующие 7, 14 и 20 сутки в группе РВ произошла компенсация развивающегося ацидоза и восстановление кислотно-щелочного равновесия. В группе ПВ, наоборот, с 1 по 20 сутки развивалось постепенное нарастание ацидоза и кислотно-щелочного дисбаланса. На 1 сутки парциальное давление углекислого газа (pCO2) в артериальной крови было в пределах нормы, однако в группе РВ его значение было несколько выше, чем в группе ПВ. Так, в группе РВ pCO2 составило в среднем 35,5±7,99/2,22 мм рт ст (Ме=36,0 при межквартильном интервале 30,0/40,0 мм рт ст), а в группе ПВ – 33,4±8,04/1,95 мм рт ст (Ме=35,0 при межквартильном интервале 29,0/36,5 мм рт ст) (р>0,05). На 3 и 7 день исследования в обеих группах данный показатель также варьировал в пределах нормы и статистически различался (рис. 21). На 1 сутки парциальное давление углекислого газа (pCO2) венозной кровиу пациентов группы РВ было ниже нормы и значимо ниже, чем у больных с ПВ, отличаясь при этом регрессирующей динамикой. Так, в группе РВ pCO2 составило в среднем 44,7±9,39/1,34 мм рт ст (Ме=45,0 при межквартильном интервале 39,3/48,4мм рт ст), тогда как у больных с ПВ ИИ – 47,1±6,18/0,71 мм рт ст (Ме=46,7 при межквартильном интервале 42,3/50,1 81 мм рт ст) (р<0,05). На 3 сутки в группе РВ pCO2 венозной крови продолжало снижаться, одновременно с нормализацией pH. При РВ pCO2 составило 41,9±7,29/1,72 мм рт ст (Ме=42,0 при межквартильном интервале 34,7/47,2 мм рт ст), при ПВ – 45,7±9,02/1,44 мм рт ст (Ме=44,0 при межквартильном интервале 39,4/52,3 мм рт ст). На 7 сутки при РВ ИИ pCO2 венозной крови составило в среднем 40,1±5,03/1,51 мм рт ст (Ме=41,0 при межквартильном интервале 34,0/44,5 мм рт ст), а в группе ПВ - 44,3±8,57/1,52мм рт ст (Ме=45,5 при межквартильном интервале 36,2/50,9 мм рт ст) (р<0,05). Таким образом, изменения pCO2 были рефлекторной реакцией организма в ответ на гипоксию (восстановление pH до нормальных значений), направленной на улучшение доставки кислорода в капилляры и оксигенацию гемоглобина в легких в группе РВ, в том числе за счет гипервентиляции. 50 48 46 44 42 40 45 норма 46,7 45 45,5 pCO2 вена 1 сут Ранняя визуализация 35 44 42 3 сут норма 40 30 41 38,2 36 35 33,8 34,1 34 25 10 сут рСО2 арт 1 сут Поздняя визуализация Ранняя визуализация 3 сут 10 сут Поздняя визуализация Вена Артерия Рисунок 21. Динамика pCO2 венозной и артериальной крови у пациентов групп исследования В ходе исследования парциального давления кислорода (pO2) артериальной крови выяснилось, что на 1 и 3 сутки pO2 в группе ПВ было значительно ниже (р<0,05), чем в группе РВ, где оно было в пределах нормы на протяжении всего периода наблюдения. Так, на 1 сутки pO2 в группе РВ составило в среднем 97,5±32,35/8,97мм рт ст (Ме=90,0 при межквартильном интервале 79,0/103,0 мм рт ст), а в группе ПВ – 95,9±46,02/11,16 мм рт ст (Ме=74,0 при межквартильном интервале 63,0/130,0мм рт ст; р<0,05). На 3 сутки рО2 артериальной крови равнялось 117,6±33,89/13,83 мм рт ст (Ме=99,0 мм рт ст при межквартильном интервале 95,0/152 мм рт ст) в 82 группе РВ и 85,6±32,35/7,23 мм рт ст (68,0 мм рт ст при межквартильном интервале 66,0/96,0 мм рт ст; p<0,05) в группе ПВ, на 7 сутки 108,6±42,82/21,41 мм рт ст (Ме=97,0 мм рт ст при межквартильном интервале 77,0/152 мм рт ст) и 105,4±22,06/15,6 мм рт ст (Ме=105,0 м рт ст при межквартильном интервале 90,0/ 121 мм рт ст; p>0,05) в группах РВ и ПВ соответственно как представлено на рисунке 22. Исследование парциального давления кислорода (pO2) венозной крови выявило, что на 1,3 и 7 сутки оно было ниже у больных с ПВ ИИ. Так, на 1 суткив группе РВ венозное pO2 составило 35,9±10,69/1,53 мм рт ст (Ме=36,5 при межквартильном интервале 27,9/42,2 мм рт ст), а в группе ПВ – 36,0±10,86/1,25 мм рт ст(Ме=36,0 при межквартильном интервале 27,7/44,5 мм рт ст; р>0,05), на 3 сутки pO2 венозной крови повысилосьдо 41,1±11,23/2,65 мм рт ст (Ме=42,6 при межквартильном интервале 30,5/51,1 мм рт ст) в группе РВ и 41,0±9,21/1,47 мм рт ст (Ме=39,0 при межквартильном интервале 36,0/46,0 мм рт ст; р>0,05) в группе ПВ, на 7 сутки - 43,3±7,85/2,37 мм рт ст (Ме=41,0 при межквартильном интервале 36,6/48,0 мм рт ст) и 39,1±10,72/1,90 мм рт ст (Ме=37,8 при межквартильном интервале 31,9/44,5 мм рт ст; р<0,05) при РВ и ПВ ИИ соответственно. Таким образом, у пациентов с ПВ инсультомс 1-х по 7 сутки отмечалось нарастание тканевой гипоксии. Выявлена низкая резистентность клеток к гипоксии, обусловленная тканевым повреждением мембран и усилением кислородного голодания. Тогда как больные из группы РВ имели сравнительно высокую резистентность к гипоксии, следовательно, и лучший госпитальный исход. 83 50 45 110 норма 42,6 41,0 40 36,5 35 39,0 100 норма 90 90 80 37,8* 99 30 97 74* 70 36,0 105 68* 60 рО2 вена 1 сут Ранняя визуализация 3 сут 7 сут рО2 арт 1 сут Поздняя визуализация Ранняя визуализация 3 сут 7 сут Поздняя визуализация Рисунок 22. Динамика pO2 венозной и артериальной крови у больных обеих групп При исследовании сатурации (sO2) артериальной крови были выявлены следующие результаты. В группе РВ данный показатель на 1-3-7 сутки был стабильно в пределах нормы. В группе ПВ на 1-3 сутки уровень сатурация кислорода был ниже нормы и значимо меньше, чем в группе РВ, но к 7 дню данный показатель нормализовался. Так, на 1 сутки sO2 артерии в группе РВ составила в среднем 96,1±2,70/0,78 % (Ме=96,6 при межквартильном интервале 93,1/98,2 %), а в группе ПВ - 93,5±3,58/0,87 % (Ме=92,2 при межквартильном интервале 89,9/97,8 %; р<0,05), на 3 сутки - 53,8±51,53/15,54 % (Ме=96,7 при межквартильном интервале 94,3/98,8 %) и 60,7±45,90/8,24 % (Ме=93,0 при межквартильном интервале 93,0/97,0 %; р<0,05), на 7 сутки 55,78±52,20/19,73 % (М=97,3 при межквартильном интервале 95,3/98,6 %) и 97,7±1,98/1,40 % (Ме=98,0 при межквартильном интервале 96,0/99,0%; р>0,05) в группах РВ и ПВ соответственно. Сатурация кислорода (sO2) венозной крови на протяжении 1, 3, 7 и 14 суток была значительно ниже нормы в обеих группах исследования, однако в группе ПВ sO2 была значительно ниже, чем в группе РВ. Так, на 1 сутки sO2 в группе РВ в среднем составила 61,1±20,09/2,87 % (Ме=66,4 при межквартильном интервале 48,8/77,5 %), а в группе ПВ - 62,6±20,42/2,36 % (Ме=64,4 при межквартильном интервале 50,8/77,0 %), на 3 сутки72,0±20,08/4,73 % (Ме=81,0 при межквартильном интервале 65,2/85,5 %) и 70,1±16,09/2,72 % (Ме=71,0 при межквартильном интервале 64,8/82,0 %), на 7 сутки - 84,8±4,83/1,46 % (Ме=83,0 при межквартильном интервале 71,4/89,0 84 и 77,4±17,47/3,30 % (Ме=74,0 при межквартильном интервале 61,0/79,6 %) в группах РВ и ПВ соответственно (р<0,05). Таким образом, насыщение тканей кислородом при ПВ ИИ значимо снижена (рис. 23). 100 100 норма 97,3 90 81,0 80 70 60 98,0 норма 83,0 74,0* 66,4 95 96,6 90 92,2* 96,7 93,0* 71,0 64,4 SО2 вена 1 сут Ранняя визуализация 85 3 сут 7 сут SО2 арт 1 сут Поздняя визуализация Ранняя визуализация 3 сут 7 сут Поздняя визуализация Рисунок 23. Динамика SO2 венозной и артериальной крови у больных обеих групп При исследовании концентрации актуального бикарбоната (HCO3) венозной крови выяснилось, что на 1, 3 и 7 сутки он находился в пределах нормы, причем в группе РВ его концентрация была ниже, чем в группе ПВ на 1 и 7 сутки. Так, на 1 сутки при РВ инсульте HCO3 составила в среднем 24,1±3,99/0,59 ммоль/л (Ме=24,3 при межквартильном интервале 22,1/25,9 ммоль/л), а в группе ПВ - 25,3±3,35/0,40 ммоль/л (Ме=25,1 при межквартильном интервале 23,5/27,7 ммоль/л; p<0,05), на 3 сутки 26,5±3,14/0,84 ммоль/л (Ме=25,7 при межквартильном интервале 24,2/28,7 ммоль/л) и 25,1±3,58/0,63 ммоль/л (Ме=25,4 при межквартильном интервале 22,4/26,6 ммоль/л; р>0,05), на 7 сутки - 23,7±2,69/0,95 ммоль/л (Ме=23,8 при межквартильном интервале 22,0/25,9 ммоль/л) и 25,1±5,05/0,95 ммоль/л (Ме=24,8 при межквартильном интервале 21,2/27,9 ммоль/л; р>0,05) при РВ и ПВ инсульте соответственно. На 1, 3 и 7 сутки HCO3 в артериальной крови был в норме, однако в группе ПВ его значения были ниже значений группы РВ, что говорит включении компенсаторных механизмов в ответ на ацидоз в венозной крови. Так, в группе РВ HCO3 составил в среднем 21,7±4,49/1,35 ммоль/л (Ме=22,5 при межквартильном интервале 16,9/23,4 ммоль/л) и группе ПВ 22,3±1,33/0,40 ммоль/л (Ме=23,3 при межквартильном интервале 21,8/24,5 85 ммоль/л; р>0,05), на 3 сутки – 13,4±13,13/3,96 ммоль/л (Ме=23,2 при межквартильном интервале 21,7/27,9 ммоль/л) и 15,4±12,17/2,19 ммоль/л (Ме=24,5 при межквартильном интервале 22,1/27,2 ммоль/л; р>0,05), на 7 сутки -15,1±15,70/5,93 ммоль/л (Ме=22,3 при межквартильном интервале 20,6/36,5 ммоль/л) и 24,0±1,41/1,00 ммоль/л (Ме=24,0 при межквартильном интервале 23,0/25,0 ммоль/л;р>0,05) в группах РВ и ПВ соответственно (рис. 24). 27 26 25 24 23 22 21 27 норма 26 25,7 25,4 25,1 24,3 24,8 23,8 норма 25 24,5 24 23,3 22,5 23 22 НСО3 вена 1 сут* 3 сут 22,3 21 7 сут НСО3 арт 1 сут Ранняя визуализация 24 23,2 Поздняя визуализация 3 сут Ранняя визуализация 7 сут Поздняя визуализация Рисунок 24. ДинамикаHCO3 венозной и артериальной крови у больных обеих групп. Таким образом, при РВ инсульте на 1 сутки pH значительно снизилось и развивался нейтрализацию смешанный кислых лактатацидоз, веществ, но а уже HCO3 к расходовался третьим суткам на pH нормализовалось и HCO3, соответственно, тоже. Однако в случае ПВ ИИ к 3м суткам развитие ацидоза усилилось, а концентрация HCO3 повысилась, что усугубило расстройства гликолиза. Раннее появление КТ-признаков в группе РВ обусловлено ранним (на 1 сутки) увеличением pH (сдвигом в кислотную сторону), а увеличение продолжительности жизни связано с восстановлением pH к 3 суткам, тогда как в группе ПВ произошло постепенное нарастание сдвига в сторону ацидоза. В группе ПВ ишемия была более клинически выраженной, что связано с нарастанием гипоксии на 1 сутки (снижением уровня парциального давления кислорода и уменьшением насыщаемости крови кислородом в венозной, и артериальной крови), и соответственно сниженной резистентностью клеток мозга к кислородному голоданию с каждыми последующими сутками. В отличие от ПВ ИИ в группе РВ 86 гипоксия к 3 суткам была компенсирована за счет ответной реакции организма на гипоксию (в т.ч. снижение парциального давления кислорода), направленной на улучшение доставки кислорода в капилляры и оксигенацию гемоглобина в легких, а также восстановление насыщаемости крови кислородом. Поэтому в группе РВ кислотно-основное состояние крови и кислородный статус к 3-7 суткам постепенно восстановились, а в группе ПВ, наоборот, произошло нарастание тканевой гипоксии с максимальной выраженностью к 3-7 суткам, что явилось причиной тяжелого течения ИИ и ранней летальности больных. У больных обеих групп исследования брали ОАК при поступлении, на 1, 3, 7, 14 и 20 сутки динамического наблюдения. Ярких межгрупповых различий динамики показателей ОАК установлено не было (табл. 18). Таблица 17. Динамика показателей общего клинического анализа крови у больных обеих групп Показатель Эритроциты (Норма: 3,8-5,1 х 1012/л) группа РВ ПВ 1 сут 3 сут 7 сут Динамика кровяного ростка 4,50 4,25 4,36 4,13/4,97 4,01/4,86 3,66/4,78 3,44-5,53 2,92-5,47 3,05-5,35 4,54 4,37 4,36 4,14/4,99 3,87/4,79 3,64/4,87 4,42-5,62 3,15-5,57 2,65-5,71 0,961 Гемоглобин (Норма: 120-160 г/л) РВ ПВ р Тромбоциты (180-320 х1012/мкл) РВ ПВ р Лейкоциты (4-9 х 109 /л) РВ 0,683 0,995 143 131 136 128/153 119/152 114/150 97-175 90-173 92-165 136 131 130 123/151 120/147 118/141 92-168 100-165 70-160 0,193 0,946 0,338 209 219 244 175/255 184/254 191/283 128-346 134-378 158-417 224 196 253 178/291 151/263 152/323 128-407 44-415 44-393 0,185 0,133 0,932 Динамика белого кровяного ростка 9,00 8,40 8,75 7,00/10,60 6,55/12,85 6,58/12,2 4,20-16,10 4,45-16,20 5,18-18,68 87 14 сут 20 сут 3,99 3,88/5,09 2,48-5,55 4,46 3,79/4,87 2,62-5,15 3,89 3,60/4,48 2,19-5,15 4,27 4,02/4,80 3,02-5,82 131 117/153 77-173 132 108/145 73-158 0,435 224 207/285 125-409 228 180/288 101-399 0,824 127 100/140 72-155 121 112/138 81-157 0,734 243 207/305 107-630 228 151/268 112-424 0,263 0,828 0,049* 9,90 9,10 6,90/14,20 7,25/11,08 5,83-40,46 5,55-25,20 8,65 9,80 9,00 9,40 9,40 6,78/11,33 7,00/11,50 7,55/11,50 7,55/13,19 7,60/12,00 5,53-16,73 4,52-100,0 2,53-20,94 5,24-30,80 5,30-18,60 р 0,862 0,711 0,838 0,797 0,897 19 18 16 13 17 РВ 11/24 13/26 10/26 4/16 8/20 7-39 6-32 5-38 2-30 4-31 Лимфоциты (19-37%) 17 15 14 14 14 ПВ 10/24 12/18 9/23 11/25 10/20 6-30 6-32 5-42 2-42 5-38 р 0,303 0,146 0,516 0,120 0,893 5 5 7 5 5 РВ 3/8 4/9 5/9 1/7 4/8 2-10 2-17 2-15 1-10 2-15 Моноциты (3-11%) 5 5 5 5 6 ПВ 4/6 3/7 2/8 3/7 3/7 2-8 2-10 1-17 1-13 3-10 р 0,638 0,146 0,085* 0,424 0,936 16 28 27 28 26 РВ 8/25 22/44 15/44 10/41 19/42 4-47 5-55 4-76 2-80 9-78 СОЭ (2-15 мм/ч) 19,0 16,0 29 21 28,0 ПВ 10,0/34,8 11/30 12/40 12/43 15/38 3,7-40,7 1-56 5-49 4-65 2-61 р 0,442 0,004* 0,737 0,819 0,695 Результаты представлены в виде следующих статистических характеристик: первая строка - медиана (средняя), вторая строка -25%/75% квартили; третья строка – 5%95% доверительный интервал.* - р<0,05- достоверное отличие между группами. ПВ Анализ динамики показателей коагулограммы установил склонность к гиперкоагуляции у пациентов группы ПВ инсульта с 3-х суток госпитализации (табл. 19). Таблица 18. Показатели коагулограммы в разные сроки госпитализации больных обеих групп Показатель АЧТВ (Норма: 24-35 секунд) Группа РВ ПВ р ПТИ (Норма: 95105%) РВ ПВ 1 сутки 26,1 22,7/27,8 18,0-30,3 24,8 19,4/26,9 16,8-32,0 0,014* 100 95/105 80-117 100 94/109 88 3 сутки 26,0 23,6/29,7 18,0-33,7 23,8 21,1/26,7 16,7-34,5 0,006* 94 85/99 79-117 89 80/97 7 сутки 26,8 24,1/30,2 19,0-40,0 24,9 23,1/28,5 18,3-38,9 0,136 85 78/100 75-101 82 67/84 76-146 38-110 0,422 0,287 1,00 1,07 РВ 0,95/1,05 1,00/1,15 0,87-1,18 0,91-1,33 МНО (Норма: 0,85-1,35) 1,00 1,10 ПВ 0,93/1,08 1,03/1,17 0,87-1,28 0,96-1,77 p 0,941 0,130 4,6 4,7 РВ 3,7/5,1 3,1/5,1 Общий 1,1-6,9 2,1-5,8 фибриноген 4,1 6,3 (Норма: 2-4 г/л) ПВ 3,6/4,8 3,8/9,2 2,7-6,1 1,2-10,6 р 0,381 0,043* .* - р<0,05- достоверное отличие между группами р 54-91 0,158 1,15 1,00/1,25 0,92-1,96 1,12 1,09/1,25 0,89-1,60 0,736 6,0 3,3/6,1 1,9-6,2 6,6 5,1/14,9 4,7-15,0 0,090 Так, к 3 суткам уровень АЧТВ в группе ПВ снизился с 24,2 до 23,8 секунд (p<0,05), что говорит о сокращении времени образования сгустка крови и развитии гиперкоагуляции данной группы. В группе РВ уровень АЧТВ был стабильным в период 1-7 сутки и варьировал в пределах от 26,0 до 26,8 секунд (рис. 25). ПТИ в обеих группах исследования варьировал в пределах нормы и на 1 сутки он в среднем составил 100% как при РВ ИИ, так и при ПВ ИИ, однако в последующем ПТИ регрессировал. На 3 сутки в группе ПВ значение ПТИ резко снизилось до 89%, в группе РВ данный показатель был в нормальных пределах у большинства больных (в среднем 94%). К 7 суткам ПТИ еще больше снизился и составил 82% и 85% в группах ПВ и РВ соответственно, что свительствует о развитии тенденции к гипокоагуляции, то есть склонности к кровотечениям, особенно в группе ПВ. МНО в обеих группах исследования на протяжении периода 1–7 сутки варьровало в пределах нормы, что связано со строгим приемом антиагрегантной терапии в период стационарного наблюдения. Показатель фибриногена, демонстрирующий основу сгустка тромба (фибрин), у большинства пациентов был повышен на 1 сутки и составил 4,6 г/л в группе РВ и 4,1 г/л в группе ПВ. К 3 суткам в группе ПВ уровень 89 фибриногена значительно вырос до 6,3 г/л по сравнению с РВ ИИ, где он составил 4,7 г/л (p<0,05), что говорит об усиленном тромбообразовании в системе кровообращения больных с ПВ инсультом. К 7 суткам показатель фибриногена увеличился до 6,6 г/л в группе ПВ и до 6,0 г/лв группе РВ. Таким образом, в группе ПВ к 3 суткам склонность к гиперкоагуляции выражена значимо больше с максимальной ее тяжестью на 3-7 сутки (рис. 25). 7 6,3 6,6 6 6 4,6 5 4 4,7 4,1 3 1 сут 3 сут 7 сут Ранняя визуализация Поздняя визуализация Динамика АЧТВ Динамика общего фибриногена Рисунок 25. Динамика АЧТВ и общего фибриногена. Резюмируя полученные данные анализа лабораторных данных отметим, что при ПВ ИИ отмечается кумулирующий и максимально выраженный энергодефицит, расстройства КЩС и гиперкоагуляция, выявляемые в наибольшей степени к третьим и седьмым суткам. Это то время, когда максимально часто визуализируется обширный очаг ишемического повреждения мозга на КТ и зарегистрирована максимальная смертность в данной группе. 3.5. Корреляционный анализ острого ишемического инсульта с ранней и поздней визуализацией Результаты корреляционного анализа, представленные в таблице 19, говорят о многочисленных клинико-патофизиологических взаимосвязях ПВ инсульта. 90 Так, ПВ инфаркта мозга прямо коррелирует с госпитальной летальностью, тяжелым состоянием, различными жалобами, выраженностью неврологического статуса (включая депрессию сознания, афазию, дизартрию, парезы верхних и нижних конечностей, гемигипестезию, рефлекс Бабинского), баллом по шкале NIHSS и Renkin на 1-3-7-14-20 сутки. Обратная корреляция инсульта ПВ зарегистрирована с баллом по индексу Bartel в динамике. Это подтверждает более тяжелое клиническое течение и худший госпитальный исход у больных группы ПВ. Кроме того, ПВ инфаркта мозга коррелирует с лобной и височной локализацией, в то время как РВ ИИ взаимосвязан с повторным инсультом, особенно при наличии большого очага кистозно-глиозной трансформации головного мозга, а также с развитием мультифокального инсульта. Корреляции с лабораторными показателями в основном представлены взаимосвязью ПВ с энергодефицитом на 3 и 7 сутки стационарного наблюдения. Таблица 19. Взаимозвязь инсульта ПВ с клинико-патофизиологическими данными Параметр Лобная и височная локализация ИИ Мультифокальный инсульт Размер кистозно-глиозной трансформации пред. инсульта Клиническое течение в стационаре Тяжелое состояние при поступлении Тяжелое состояние на 3 сутки Тяжелое состояние на 7 сутки Тяжелое состояние на 14 сутки Тяжелое состояние на 20 сутки Летальность в стационаре Отсутствие жалоб при поступлении Жалобы на изменение речи при поступлении Жалобы на слабость в руке и/или в ноге Жалобы на асимметрию лица Жалобы на изменение зрения Жалобы на боли в области сердца Нарушение сознания при поступлении Тотальная афазия при поступлении Дизартрия при поступлении Гемиплегия при поступлении Рефлекс Бабинского при поступлении Гемигипостезия при поступлении 91 R p 0,245 0,013 -0,166 0,028 -0,431 0,028 0,221 0,243 0,247 0,153 0,253 0,167 -0,216 0,345 0,192 0,403 0,222 0,147 0,229 0,198 0,222 0,222 0,225 0,283 0,02 0,000 0,000 0,034 0,002 0,013 0,001 0,000 0,004 0,000 0,001 0,029 0,001 0,003 0,001 0,001 0,004 0,000 Задержка мочеиспускания при поступлении Балл по шкале NIHSS при поступлении Балл по шкале Renkin Нет жалоб на 3 сутки Нарушение сознания на 3 сутки Тотальная афазия на 3 сутки Дизартрия на 3 сутки Гемиплегия на 3 сутки Парез в руке на 3 сутки Парез в ноге на 3 сутки Рефлекс Бабинского на 3 сутки Гемигипостезия на 3 сутки Задержка мочеиспускания на 3 сутки Балл по шкале NIHSS на 3 сутки Балл по шкале Bartel на 3 сутки Не предъявляли жалоб на 7 сутки Тотальная афазия на 7 сутки Нарушение сознания на 7 сутки Парез в руке на 7 сутки Парез в ноге на 7 сутки Гемигипостезия на 7 сутки Рефлекс Бабинского на 7 сутки Балл по шкале NIHSS на 7 сутки Балл по шкале Bartel на 7 сутки Тотальная афазия у б-х с поражением левого полушария на 14 сутки Дизартрия у больных с поражением правого полушария на 14 сутки Парез в ноге на 14 сутки Рефлекс Бабинского на 14 сутки Гемигипостезия на 14 сутки Балл по шкале NIHSS на 14 сутки Элементы СМА на 20 сутки Дизартрия на 20 сутки Парез в руке на 20 сутки Парез в ноге на 20 сутки Рефлекс Бабинского на 20 сутки Гемигипостезия на 20 сутки Балл по шкале NIHSS на 20 сутки Балл по шкале Bartel на 20 сутки Балл по шкале NIHSS при выписке Балл по шкале Bartel при выписке Балл по шкале Renkin при выписке Динамика лабораторных маркеров Количество лейкоцитов при поступлении Уровень креатинина на 1 сутки Холестерин крови на 1 сутки Глюкоза 14 сутки ЛДГ на 1 сутки ЛДГ на 3 сутки ЛДГ на 20 сутки Лактат вены 3 сутки Лактат вены 7 сутки 92 0,226 0,430 0,207 -0,361 0,134 0,234 0,251 0,158 0,252 0,277 0,214 0,302 0,191 0,331 -0,172 -0,194 0,152 0,160 0,181 0,219 0,307 0,210 0,282 -0,179 0,269 0,321 0,180 0,184 0,302 0,242 0,325 0,254 0,159 0,209 0,207 0,185 0,271 -0,159 0,178 -0,177 0,156 0,001 0,000 0,002 0,000 0,48 0,000 0,000 0,019 0,000 0,000 0,001 0,000 0,004 0,000 0,011 0,005 0,27 0,20 0,008 0,001 0,000 0,002 0,000 0,009 0,000 0,000 0,012 0,010 0,000 0,001 0,000 0,001 0,048 0,009 0,010 0,021 0,000 0,044 0,016 0,006 0,016 -0,190 -0,135 0,137 0,207 -0,209 0,247 0,342 0,191 0,221 0,003 0,031 0,036 0,041 0,028 0,012 0,021 0,039 0,029 HCO3std вены на 1 сутки BEb вены на 1 сутки pCO2 вены на 7 сутки 0,310 0,290 0,277 0,034 0,017 0,004 Проведенный корреляционный анализ подтверждает более сложный патофизиологических феномен ПВ инфаркта мозга, обосновывая необходимость ранней фармакологической коррекции энергодефицита. 3.6. Результаты катамнестического исследования В катамнестический период длительностью до 2-х лет удалось собрать данные методом телефонного интервью у 155 пациентов (из 182 выписанных из стационара; 85,16%), в том числе 93 человека, у которых ИИ был РВ при госпитализации и 62 человека - ПВ ИИ. При телефонном интервью оценивали следующие данные: выживаемость, наличие перенесенных повторных острых сердечно-сосудистых событий, наличие повторных плановых и/или экстренных госпитализации из-за повторного ОНМК. Выжившие были повторно осмотрены неврологом. Установлено, что в катамнестическом периоде умерло 54,2% (n=84) человек, перенесших церебральный инсульт. Причем летальность в группе РВ была достоверно в 1,41 раз выше, чем в группе ПВ. Так, в группе РВ умерло 57 (61,3%) больных, а в группе ПВ - 27 (43,5%) больных (p<0,05) (табл. 20, рис. 26). Таблица 20. Исход в катамнестическом периоде (р<0,05) Умершие Выжившие Всего Стат.хар-ка n % от исхода % от группы n % от исхода % от группы n % РВ 57 67,9% 61,3% 36 50,7% 38,7% 93 60,0% ПВ 27 32,1% 43,5% 35 49,3% 56,5% 62 40,0% 93 Итого 84 100,0% 54,2% 71 100,0% 45,8% 155 100,0% Летальный исход в госпитальном и катамнестическом периодах представлен на рисунке 26. 45 40 35 30 25 20 15 10 5 0 38,7% 30,7% 24,5% 12,9% 11,7% 6,5% *Госпитальный период 9,7% 6,5% Катамнез <6 мес Катамнез 6-12 мес Катамнез >12 мес Ранняя визуализация Поздняя визуализация * - p<0,05 – достоверное отличие между группами Рисунок 26. Летальность в госпитальном и катамнестическом периодах Сроки смерти пациентов варьировали от 1 месяца до 2-х лет после выписки. Большинство летальных исходов было в течение полугода после выписки (65,5%), следовательно, летальность через 6 месяцев после выписки составила 35,5% (55 из 155 выписанных пациентов). В течение 6-12 месяцев умерло 16 (19,0%) пациентов, то есть летальность на протяжении года после выписки составила 47,7% (71 из 155 выписанных пациентов). В течение 1324 месяцев умерло 13 (15,5%) пациентов. Таким образом, госпитальная летальность составила 18,1% (гл. 3.1), двугодичная летальность - 54,2%, при этом максимальной она была в период до 6 месяцев после выписки. Сроки постгоспитальной летальности в обеих исследуемых группах были сопоставимы (табл. 21). Таблица 21. Сроки летальности в катамнестическом периоде (p>0,05) В течение <6 месяцев 6-12 месяцев 13-24 месяцев РВ 36 (63,2%) 12 (21,0%) 9 (15,8%) ПВ 19 (70,4%) 4 (14,8%) 4 (14,8%) 94 Итого 55 (65,5%) 16 (19,0%) 13 (15,5%) Из 71 выжившего в течение 3-х лет пациента, перенесших церебральный инсульт, было 36 человек из группы РВ и 35 из группы ПВ. Способных к самостоятельному передвижению оказалось 53 (74,6%) человека, включая 30 (83,3%) пациентов из группы РВ и 23 (65,7%) из группы ПВ(табл. 22, рис. 27). Таблица 22. Самостоятельная ходьба в катамнестическом периоде (р<0,05) Не ходят Ходят Всего Стат.хар-ка n % от исхода % от группы n % от исхода % от группы n % РВ 6 33,3% 16,7% 30 56,6% 83,3% 36 50,7% ПВ 12 66,7% 34,3% 23 43,4% 65,7% 35 49,3% Итого 18 100,0% 25,4% 53 100,0% 74,6% 71 100,0% Таким образом, «неходячих» при ПВ ИИ было в 2,05 раза больше, чем при РВ инсульте (p<0,05) (рис. 27). 100 83,3%* 80 65,7%* 60 40 20 34,3% 16,7% 0 Ранняя визуализация Ходят Поздняя визуализация Не ходят * - p< 0,05 – достоверное отличие между группами Рисунок 27. Способность к самостоятельному передвижению в катамнастическом периоде Повторно госпитализировалось всего 6 человек (8,5%), включая 2 (5,6%) пациентов из группы РВ и 4 (11,4%) из группы ПВ (p>0,05) (табл. 23). Таблица 23. Повторные госпитализации в катамнестическом периоде (р>0,05) Не было повторных госпитализации Повторные госпитализации Стат.хар-ка n % от исхода % от группы n % от исхода РВ 34 52,3% 94,4% 2 33,3% 95 ПВ 31 47,7% 88,6% 4 66,7% Итого 65 100,0% 91,5% 6 100,0% Всего % от группы n % 5,6% 36 50,7% 11,4% 35 49,3% 8,5% 71 100,0% В течение 2-х лет получали различные курсы реабилитации в реабилитационных центрах, санаториях, отделениях и специализированных центрах восстановительного лечениях, и прочих всего 15 (21,1%) пациентов, перенесших инсульт в 2012 году (8 человек из 122; 6,7%) и в 2013 году (7 человек из 33; 21,2%). Среди пациентов, прошедших курсы реабилитации, было 6 (16,7%) из группы РВ и 9 (25,7%) из группы ПВ (p>0,05). Несмотря на явную целесообразность проведения реабилитационных мероприятий после выписки больных с ИИ, достоверного различия по функциональному исходу, оцененному по модифицированной шкале Renkin через 2 года после выписки, выявлено не было (p>0,05). При этом отмечена тенденция к улучшению функциональных возможностей пациентов, у которых был проведен курс(ы) реабилитации: в 53,3% случаях зарегистрировано 0 баллов (не было реабилитации - у 42,9% пациентов), 5 баллов не было зарегистрировано ни у одного больного (не было реабилитации - у 1,8% пациентов), как это представлено в таблице 24. Таблица 24. Реабилитация в катамнестическом периоде (р>0,05) Ренкин (балл) Нет реабилит. 0 24 (42,9%) 1 11 (19,6%) 2 11(19,6%) 3 5 (8,9%) 4 4 (7,1%) Реабилитация 8 (53,3%) 2 (13,3%) 2 (13,3%) 0 3 (20,0%) 5 1 (1,8%) 0 В катамнестический период в группе РВ 2 (5,6%) человека находились в полной зависимости от посторонней помощи в повседневной жизни, также как и в группе ПВ – 2 (5,7%) человека. Имеют выраженную зависимость при РВ ИИ 4 (11,1%) больных и при ПВ ИИ 12 (34,3%) человек. Умеренную зависимость от посторонней помощи имеют 12 (33,3%) пациентов из группы РВ и 3 (8,6%) больных – из группы ПВ. Находятся в легкой зависимости от посторонней помощи 18 (50%) человек с РВ ИИ и 18 (51,4%) человек сПВ ИИ (р>0,05) (табл. 25). 96 Таблица 25. Оценка функционального статуа по индексу Bartel в катамнезе Группы исследования РВ ПВ Всего 0-20 баллов 25-60 баллов 65-90 баллов 2 (5,6%) 2 (5,7%) 4 (5,7%) 4 (11,1%) 12 (34,3%) 16 (22,5%) 12 (33,3%) 3 (8,6%) 15 (21,1%) 95-100 баллов 18 (50%) 18 (51,4%) 36 (50,7%) Всего 36 (50,7%) 35 (49,3%) 71 (100%) Анализ функционального исхода по истечении 2-х лет после инсульта по модифицированной шкале Renkin также не выявил принципиальных отличий между группами, при этом более половины (63,4%) выживших имели хороший исход (от 0 до 1 балла по шкале Renkin) (табл. 26). Таблица 26. Функциональный исход по модифицированной шкале Renkin через 2 года после перенесенного ИИ в группах с ранней и поздней визуализацией инсульта (р>0,05) Ренкин (балл) РВ ПВ Всего 0 14 (38,9%) 18 (51,4%) 32 (45,1%) 1 10 (27,8%) 3 (8,6%) 13 (18,3%) 2 3 7 (19,4%) 2 (5,6%) 6 (17,1%) 3 (8,6%) 13 (18,3%) 5 (7,0%) 4 3 (8,3%) 4 (11,4%) 7 (9,9%) 5 0 1 (2,9%) 1 (1,4%) Таким образом, в катамнестическом периоде длительностью до 2-х лет умерло 54,2% больных, максимальная летальность была в первые 6 месяцев после выписки. Причем летальность в группе РВ была в 1,41 раза выше (61,3%), чем в группе ПВ (43,5%). Несмотря на то, что неспособных к самостоятельному передвижению среди выживших через 24 месяца после выписки пациентов было в 2 раза больше в группе ПВ при хорошем функциональном исходе у 63,4% пациентов, достоверных отличий между группами по шкалам Renkin и Bartel мы не получили. 97 ЗАКЛЮЧЕНИЕ В настоящее время актуальной медицинской задачей является тактика по отношению к пациентам, имеющим клиническую картину острого инсульта, не подтверждаемого данными нейровизуализации, прежде всего, компьютерной томографией, входящей в стандарты ранней диагностики инсульта. Это создает проблемы в постановке диагноза и общении РСЦ и ПСО со страховыми компаниями. Согласно Приказу МЗ РФ № 1740н от 29.12.2012 г. в стандарты диагностики инсульта в 90% случаев (0,9) включена «компьютерная томография головы», хотя известно, что в ранние сроки она наиболее информативна у больных с геморрагическим инсультом. МРТ же, которая позволяет рано идентифицировать ишемические изменения в мозге, будет оплачена страховыми компаниями только у 1 больного из 10 (0,1) [19, 23, 107, 114, 126, 132]. Отсутствие верифицированного диагноза не позволяет в полной мере осуществлять лечебные мероприятия и целесообразность нахождения больных в нейроблоках сосудистых отделений подтверждается только наличием симптоматики [23, 79]. К сожалению, особенности клиники, исходы, клинико-биохимические корреляции и другие аспекты течения инфаркта мозга, визуализируемого по КТ через сутки и более после госпитализации больных, изучены в неврологической литературе недостаточно подробно. В данной связи целью настоящего исследования стало изучение особенностей клиники и патофизиологических корреляций при инфаркте мозга, визуализируемом методом КТ в разные сроки от дебюта клинических симптомов. Для реализации поставленной цели в исследование был включен 221 пациент в возрасте от 32 до 93 лет (средний возраст 69,4±3,7 лет), поступавший в стационар в сроки от 3 до 48 часов с момента развития клинических симптомов инсульта. У всех больных диагноз инфаркта мозга был установлен по клиническим данным и подтвержден нейровизуализацией 98 с помощью метода КТ в разные сроки. 90 (40,7%)пациентов были мужчинами и 131 (59,3%) - женщинами. В зависимости от сроков визуализации очага инфаркта по КТ, пациенты были разделены на две группы. В первую, названную группой «ранней визуализации» (РВ), вошли 111 человек (50,2%), у которых очаг ишемии с локализацией, соответствовавшей клиническим симптомам инсульта, был выявлен уже в ходе первого КТ исследования, проведенного на момент госпитализации. 27 больным данной группы на 3-15 (в среднем на 6 сутки) для уточнения динамики морфологических изменений в мозге была проведена повторная КТ. Группу «поздней визуализации» (ПВ) составили 110 (49,8%) больных, у которых очаг ишемии был обнаружен только при КТ, проведенной повторно, на 2-3 сутки от момента госпитализации, так как при первом исследовании обнаружить даже ранние ишемические интрацеребральные изменения не удалось. Сроки визуализации инсульта не зависели от пола, возраста и локализации инсульта и были сопоставимы в обеих группах. Оценка состояния пациентов проводилась в динамике (на 1, 3, 7, 14 и 20 сутки) на основании комплекса клинических, лабораторных и инструментальных методов: 1. МСКТ 2. Соматического и неврологического осмотров; 3. Общего и биохимического анализа крови; 4. КЩС и ферментного спектра венозной крови; 5. Когорта шкал, оценивающих неврологические расстройства, динамику социальной адаптации и мобильности пациентов (шкала NIHSS, индекс социальной адаптации Bartel, модифицированная шкала Renkin). В ходе исследования было установлено, что большая фоновая тяжесть на момент госпитализации отмечена в группе ПВ, что было обусловлено, в том числе, большей частотой расстройств сознания, которые наблюдались у 32,7% больных группы поздней и у 12,6% пациентов группы ранней визуализации (p<0,05). Эта тенденция сохранялась весь период нахождения больных в стационаре. Так, в группе ПВ больных с нарушенным сознанием 99 было в 2,6 раза больше на 1, в 2,4 раза больше на 3, и в 2,6 раза больше на 7 сутки, чем в группе РВ (p<0,05). При оценке неврологической симптоматики по шкале NIHSS установлено, что фоновая тяжесть в группе ПВ была в среднем на 6 баллов больше, чем при РВ (p<0,001). Средний балл по NIHSS составил 8,5±0,5 баллов (Ме=8 баллов) в группе РВ и 13,9±0,6 (Ме=14 баллов) в группе ПВ. Эта тенденция прослеживалась в группе ПВ на протяжении всего периода пребывания в стационаре, несмотря на однотипный объем и характер терапии у больных обоих групп. К моменту выписки менее 6 баллов по шкале NIHSS, свидетельствующее о хорошем исходе, было у 61,2% больных из группы РВ и 39,1% из группы ПВ, а свыше 15 баллов, отражающих грубый неврологический дефицит, у 7,8% и 24,1% больных соответственно (p<0,01). Разница в тяжести очаговой симптоматики нашла отражение и в особенностях динамики функционального статуса больных, оцениваемого по индексу Bartel (р<0,05). Более тяжелое течение инсульта, выявленное в группе больных с поздней визуализацией, влияло и на рост летальности. Так, госпитальная летальность составила 18,1% (n=40), при этом она была в 2,09 раза выше при поздней (n=27; 24,5%), чем при ранней визуализации (n=13; 11,7%; р<0,05). При этом в период до 10 суток, когда неблагоприятный исход обусловлен размером и тяжестью самого инсульта, умерло 19 из 40 (48,7%) человек; 51,3% больных умерло позднее 10-х суток в результате развития вторичных осложнений и синдрома полиорганной недостаточности. При этом у пациентов с РВ ИИ летальность составила 33,3% в период до 10 дней и 66,7% - позднее 10 суток (до 25 дней). При ПВ ИИ, наоборот, максимальная летальность была в первые 10 дней заболевания (n=15; 55,5%), а позднее 10-х суток (до 48 дней) умерло 44,5% (n=12) больных (p<0,05). Максимальная летальность в группе ПВ была на 6-10 сутки госпитализации. 100 Анализ подтипов ИИ у пациентов, которым было проведено ультразвуковое исследование БЦА установил, что инсульт РВ был в 3,5 раза чаще атеротромботическим (91,3% при РВ ИИ и 26,1% при ПВ ИИ), что свидетельствует о постепенном развитии адаптативных и приспособительных механизмов. В то время как при ПВ ИИ чаще встречались кардиоэмболический (34,8%, что в 4 раза чаще, чем при РВ ИИ (8,7%), а также другие (гемодинамический, гемореологический) подтипы (в 39,1% при ПВ ИИ и 0% при РВ ИИ), которые, как правило, развиваются внезапно. Более высокая летальность, тяжесть очаговой симптоматики и худшие функциональные исходы коррелировали с разными размерами очагов ишемии у больных групп ранней и поздней визуализации. Так, объем очага ишемии в группе РВ составил 56,1±10,1 см³ (Ме=14,62 см³). На повторном КТ, выполненном в среднем на 6 сутки, объем ишемии составил 69,0±15,8 см³ (Ме=27,10 см³). В группе ПВ на 1 сутки госпитализации очаг ишемии не был обнаружен, а при повторном исследовании, проведенном в среднем (Ме) на 3 сутки от дебюта инсульта, объем инсульта составил уже 105,8±15,9 см³ (Ме=56,38 см³). Таким образом, в ходе исследования был выявлен парадокс, свидетельствующий о том, что объем очага ишемии, не визуализируемого в ранние сроки инсульта, к моменту визуализации, на 3 сутки, становится в 2,08 раза больше, чем очаг, рано проявляющийся на КТ (p<0,05). Представленные данные требовали патофизиологического объяснения более позднего появления КТ-признаков церебральной ишемии в группе больных с ПВ. Как известно, метод КТ, стандартно применяющийся для фоновой визуализации объема и характера церебрального поражения у больных с подозрением на острый инсульт, поступающих в РСЦ или ПСО, использует физические принципы, позволяющие увидеть критическую ишемию мозговой ткани с выявлением зон функционального молчания (пенумбры) и очагового некроза (ядерная зона) [25, 72, 127, 187]. 101 В основе их развития у больных с ишемическим инсультом лежит разная степень локального энергодефицита, обусловленного снижением интрацеребрального кровотока, приводящего к расстройствам внутриклеточного энергосинтеза [24, 61, 195]. В связи с этим, была сделана попытка оценить биохимические константы, характеризующие у пациентов двух групп такие процессы внутриклеточного энергосинтеза, как аэробный и анаэробный гликолиз. Для этого были проанализированы некоторые параметры кислотно-щелочного состояния и ферментного выраженная и длительная спектра артериальной и венозной крови. Зарегистрирована более парциального давления кислорода (рО2) и депрессия сатурации кислорода (SО2) у больных группы ПВ, что говорит об усилении кислородного голодания у данной категории пациентов. Парциальное напряжение углекислого газа (рСО2) на 1 и 7 сутки венозной крови было ниже при РВ ИИ, что является ответом на гипоксемию, направленным на улучшение доставки кислорода в капилляры и оксигенацию. Кроме того, к моменту поступления в венозной крови у больных с ПВ инсультом концентрация бикарбоната (HCO3) варьировала в пределах нормы, а при РВ их уровень был снижен, что свидетельствует о развивающемся метаболическом ацидозе уже на 1 сутки. К 3 суткам уровень HCO3 нормализовался в группе РВ, что наряду с ростом рН свидетельствует об активации механизмов компенсации. Так, на 1 сутки пациентов с рН меньше 7,36 было 40,8% в группе РВ и 34,2% в группе ПВ (р<0,05). Таким образом, у пациентов с РВ ИИ на 1 сутки КЩС и кислородный статус отличался наибольшим дисбалансом, но к 3-7 суткам отмечалось постепенное их восстановление, а при ПВ, наоборот, отмечалось нарастание тканевой гипоксии с максимальной выраженностью к 3-7 суткам, что коррелировало с более тяжелым течением и летальностью. В тоже время, показатели, характеризующие завершенность или незавершенность анаэробного гликолиза, а именно, уровни лактата и pСО2, достоверно 102 различались с превалированием незавершенности ферментации глюкозы в группе поздней визуализации. В ходе анализа маркеров гликолиза (лактат, лактатдегидрогеназа (ЛДГ1)) обнаружены различия, позволяющие приблизиться к раскрытию механизмов разных сроков визуализации очага ишемии по КТ. Известно, что соотношения уровней лактата и катализирующего его фермента ЛДГ-1, позволяет охарактеризовать степени ингибирования трансформации глюкозы в пировиноградную кислоту с ростом лактата и подавлением синтеза ацетилкоэнзима-А, что является отражением грубой депрессии процессов энергосинтеза в циклах анаэробного и аэробного гликолиза при церебральной ишемии [31, 59, 64, 77]. Представленный в основном в сердце и мозге фермент гликолиза ЛДГ-1, катализирующий превращение лактата в пируват с образованием NADH+, синтезируемый организмом при дефиците внутриклеточной энергии, был достоверно выше (в среднем на 14%) у больных группы РВ (медиана ЛДГ-1 на 1 сутки пребывания больных в стационаре составила 434 нмоль/с*л при РВ инсульте и 396 нмоль/с*л при ПВ ИИ; p<0,05). Рост ЛДГ-1 приводил к изменению уровня лактата. Эффект повышения уровня ферментов способствующих переходу от анаэробного к аэробному гликолизу при увеличении уровня лактата является прямым признаком возрастающих энергетических запросов ткани на фоне невозможности перейти на этап полного аэробного гликолиза ввиду недостатка глюкозы или кислорода. Именно такой эффект роста лактата при повышении ЛДГ-1 наблюдался в группе больных с поздней визуализацией, особенно к третьим суткам, когда у них, наконец, выявлялся очаг ишемии. Таким образом, отсутствие полной трансформации глюкозы в цикле глюкозо-пируватного и лактатного превращений лежит в основе отсутствия полноценного энергосинтеза в цикле анаэробного гликолиза. Это свидетельствует о большем накоплением лактата в результате ингибирования аэробного и активации анаэробного гликолиза на фоне более раннего развития критической ишемии тканей головного мозга при РВ инсульте, 103 приводящего к раннему появлению некрозо-апоптотического очага, визуализируемого на КТ. В то же время, повышение ЛДГ-1 говорит о более ранней активации компенсаторно-приспособительных механизмов преодоления ишемии. Эффект увеличения уровня ЛДГ в случаях реализации механизмов компенсации, должен сопровождаться падением лактата. Это подтверждается и более выраженным ростом ЛДГ-1 к 3 суткам при поздней визуализации инсульта. В среднем концентрация ЛДГ-1 на 3 сутки пребывания больных в стационаре составила 425 нмоль/с*л при РВ ИИ и 531 нмоль/с*л при ПВ ИИ, при этом рост ЛДГ-1 в среднем составил 9 (p>0,05) и 135 (p<0,05) нмоль/с*л соответственно. Результатом выявленных биохимических нарушений стал рост уровня глюкозы в группе ПВ к 7 суткам (Ме=7,5 ммоль/л, что в среднем на 15% больше, чем в группе РВ (p<0,05), при этом у 63% пациентов группы ПВ уровень глюкозы был выше верхней границы нормы. Это еще раз подтверждает более выраженный и нарастающий дисбаланс энергосинтеза при ПВ ИИ. Полученные данные свидетельствуют об истощении резко активированных в дебюте инсульта резервных возможностей организма у больных с ПВ инсульта, что приводит, в конечном итоге, к более резким срывам ауторегуляции с лавинобразным ростом объемов очага ишемии к моменту его визуализации на КТ. Следующим этапом нашего исследования стала оценка исхода пациентов с инсультом РВ и ПВ в катамнестическом периоде длительностью до 2-х лет после выписки. При этом удалось собрать данные у 155 пациентов, в том числе 93 человека, у которых инфаркт мозга был РВ при госпитализации и 62 человека с ПВ ИИ. В катамнестическом периоде умерло 54,2% (n=84) больных, однако, несмотря на тенденцию к большей катамнестической летальности в группе РВ, статистическая достоверность была только на госпитальном этапе. Выжившие (71 человек, включая 36 из группы РВ и 35 из группы ПВ) были 104 повторно осмотрены неврологом. Способных к самостоятельному передвижению было 53 (74,6%) человека, включая 30 (83,3%) пациентов из группы РВ и 23 (65,7%) - из группы ПВ. Таким образом, «неходячих» в группе ПВ было в 2,05 раза больше. При оценке функционального статуса по индексу Bartel было установлено, что в группе ПВ доля пациентов, у которых индекс варьировал от 25 до 60 баллов, была в 3,1 раза больше, а от 61 до 90 баллов – в 3,9 раз меньше, чем в группе РВ. Таким образом, более легкое течение и лучший функциональный исход как на госпитальном этапе, так и в катамнестическом периоде при РВ инсульте свидетельствует в пользу защитной роли нарастающей ишемии, характерной для атеротромботического инсульта. Ведь именно в группе с РВ частота атеротромботического инсульта, обусловленного стенозирующим поражением сонных артерий и проявляющегося закономерными морфологическими и биохимическими изменениями, была выше, поскольку при постепенном развитии сосудистой катастрофы организм успевает развернуть каскад адаптативно-приспособительных механизмов. Жесткие рамки стандартов и трудоемкость процесса, которые делают практически невозможным проведение постоянного мониторирования динамики морфологических изменений вещества мозга по КТ или МРТ при остром инсульте, требует поиска иных простых и технологичных методов определения патофизиологических паттернов поздней визуализации инфаркта мозга. Такими паттернами до момента выявления очага может стать оценка динамики КЩС, уровня лактата, глюкозы и лактатдегидрогеназы. Более выраженная клиническая тяжесть ИИ с ПВ с более массивной зоной гибели ткани мозга, развивающейся на фоне ярких проявлений расстройств гликолиза и кислотно-основного состояния, диктует целесообразность проведения дифференцированной интенсивной терапии с включением более высокой концентрации кислорода и энергокорректоров с 1-х суток госпитализации. 105 Полученные нами данные показали, что повышение уровня глюкозы, лактата и ЛДГ к 3-7 суткам более чем на 20% относительно фонового уровня, а также наличие очага ишемического повреждения головного мозга более 27 см3 обуславливает целесообразность повторного проведения КТ, а также назначения более длительной интенсивной терапии и высокодозной энергокоррекции в нейроблоках и неврологических отделениях. 106 ВЫВОДЫ 1. Поздняя визуализация ишемического инсульта (позднее 6-48 часов от начала заболевания) встречается в половине случаев среди пациентов с установленным диагнозом инфаркт головного мозга. Сроки визуализации не зависят от пола, возраста, локализации инсульта и имеющейся сопутствующей сердечно-сосудистой патологии при сопоставимых сроках проведения КТ от момента дебюта заболевания. 2. У пациентов с поздней визуализацией ИИ отмечается более тяжелое клиническое течение на протяжении всего периода госпитализации и худший исход: сознание чаще и длительнее депрессировано (в 2,6 раза чаще на 1 сутки, в 2,4 раза - 3 сутки, в 2,6 раза - 7 сутки, в 2,8 раза - 20 сутки); зарегистрирован более выраженный неврологический дефицит (различия по шкале NIHSS на 1, 3, 7, 14, 20 сутки в среднем составляют 6, 4, 4, 5, 3 баллов); и худший исход – госпитальная летальность в 2,09 раза выше (24,5%), чем при РВ (11,7%); более выраженная инвалидизация (к моменту выписки доля негативных функциональных исходов в 1,23 раза больше, позитивных - в 1,42 раза меньше). 3. Ранняя визуализация наблюдается при ишемического длительно инсульта развивающемся в 3,2 раза чаще атеротромботическом инсульте, имевшем место у пациентов в 82,6% случаев в группе РВ, что обусловлено постепенным развитием адаптативных механизмов. При ПВ в 4 раза чаще встречается развивающийся внезапно кардиоэмболический инсульт, обуславливая более тяжелое клиническое течение и неблагоприятный исход. При ПВ ИИ гемодинамически незначимый стеноз ВСА (<50%) встречается в 1,37 раза реже, а гемодинамически значимый (>70%) - в 1,33 раза чаще, чем в группе РВ. 4. Инфаркт мозга с поздней визуализацией характеризуется большим объемом очага ишемии мозга. При госпитализации объем инсульта в группе РВ составил 56,1±10,1 см³ (Ме=14,6 см³), при проведении 107 повторной КТ - 69,0±15,8 невизуализируемый визуализации в ранние становится проявляющийся на см³ (Ме=27,1 в КТ сроки 2,1 очаг раза (105,8±15,9; см³); в группе ишемии больше, Ме=56,4 чем к моменту очаг, см³). ПВ рано Данная закономерность прослеживается вне зависимости от сроков проведения повторной КТ. 5. При РВ характерны ранние (на 1 сутки) выраженные расстройства гликолиза с накоплением лактата и более ранняя (на 3 сутки) активация компенсаторно-приспособительных механизмов, что выражается нормализацией показателей энергосинтеза (ЛДГ, глюказа, лактат), коррелируя с ранним развитием меньшего по размеру очага гибели мозговой ткани по данным КТ. При ПВ отмечается нарастающий и более выраженный энергодефицит, подтверждаемый нарушением энергосинтеза с максимальной выраженностью на 3-7 сутки и сохраняющийся до выписки из стационара. 6. У пациентов с РВ инсульта отмечается восстановление КЩС артериальной и венозной крови и кислородного статуса к 3-7 суткам от дебюта заболевания, а при ПВ, наоборот, к 3-7 суткам отмечается нарастание ацидоза, тканевой гипоксии и гиперкоагуляции, что коррелирует с тяжелым течением ИИ и неблагоприятным исходом. 7. В катамнестический период длительностью до 2-х лет летальность среди пациентов обеих групп составила 54,2% больных (максимальная – в первые 6 месяцев после выписки), при этом летальность в группе ПВ в 1,4 раза выше (61,3%), чем в группе РВ (43,5%). 63,4% выживших имеют хороший функциональный исход, однако неспособных к самостоятельному передвижению пациентов в 2 раза больше в группе ПВ. 108 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. КТ головного мозга позволяет выявить начальные признаки ишемии мозга, достоверно оценить локализацию и размеры ИИ в первые 48 часов у половины больных, что обуславливает необходимость проведения повторного КТ исследования при сохраняющейся клинической картине заболевания. 2. Отсутствие КТ признаков ИИ при госпитализации при наличии клинической картины инфаркта готовного мозга не может служить основанием для помещения пациента в общее неврологическое отделение. 3. Полученная высокая информативность показателей ЛДГ, лактата и глюкозы, характеризующих расстройство энергосинтеза, а также показателей КЩС крови, обуславливает целесообразность исследования этих показателей в динамике всем пациентам с ИИ для оценки течения заболевания и контроля эффективности проводимого лечения. 4. Выраженная клиническая тяжесть течения ИИ с ПВ, обусловленная более массивной зоной гибели ткани мозга, развивающейся на фоне ярких проявлений расстройств гликолиза и кислотно-основного состояния, диктует целесообразность проведения дифференцированной интенсивной терапии с включением более высокой концентрации кислорода и энергокорректоров с 1-х суток госпитализации. 5. Повышение уровня глюкозы, лактата и ЛДГ к 3-7 суткам более чем на 20% относительно фонового уровня, а также наличие очага ишемического повреждения головного мозга более 27 см3 обуславливает целесообразность повторного проведения КТ, а также назначения более длительной и высокодозной патогенетически обоснованной интенсивной терапии. 109 КЛИНИЧЕСКИЕ ПРИМЕРЫ 1. На клиническом примере № 1 продемонстрирован случай с ранней визуализацией ишемического инсульта. Так, пациент Домышев В.В. 48 лет поступил 02.04.2012 года в 18 часов 49 минут в нейрореанимационное отделение ГКБ № 15 с диагнозом: ИИ в системе ПСМА (атеротромботический) через 2 часа 30 минут от дебюта заболевания. В анамнезе жизни: артериальная гипертония 3-4 степени; желчекаменная болезнь, хронический холецистит. При госпитализации состояние было тяжелым, АД 180/90 мм рт ст. При поступлении предъявлял жалобы на головную боль, онемение и слабость в левых конечностях. При оценке неврологического статуса больной был в сознании, безречевых нарушений, а также менингеальных знаков. Обращало на себя внимание наличие центрального пареза VII и XII пар черепно-мозговых нервов слева, левосторонний гемипарез до 2 баллов в руке и 3 баллов в ноге с акцентом сухожильных рефлексов справа, левосторонняя гемигипестезия и положительный рефлекс Бабинского слева. Оценка неврологического дефицита по шкале NIHSS составила 7 баллов, динамической активности повседневной жизни по шкале Bartel - 30 баллов, модифицированной шкале Renkin - 3 балла. При проведении УЗДГ БЦА определен стеноз правой внутренней сонной артерии до 73%, а также спазм правой передней мозговой артерии. Лабораторные данные Домышева В.В. представлены в таблице 27. Таблица 27. Лабораторные данные Домышева В.В. Параметр Эритроциты Гемоглобин Тромбоциты Лейкоциты Лимфоциты Моноциты СОЭ Белок 1сутки 5,4 105 317 6,8 23 5 16 69 3сутки 4,25 93 290 5,9 22 5 25 74 110 7сутки 4,36 93 299 5,6 19 7 24 77 15 сутки 4,58 92 309 5,3 16 5 26 69,5 20 сутки 4,56 91 305 5,4 21 5 25 64 Альбумин Мочевина Креатинин Холестерин Билирубин Амилаза АЛТ АСТ ЛДГ АЧТВ ПТИ МНО Общий фибриноген pH вена pCO2 pO2 sO2 Глюкоза Лактат cHCO3 41 5,9 100 5,2 31,0 56 90 84 434 26,1 100 1,00 4,6 7,36 45 36,5 66,4 6,5 2,1 24,3 35 6,2 95 4,3 39,4 58 114,4 90,4 425 26,0 95 1,05 4,7 7,41 42 42,6 81 6,4 1,9 25,7 38 9,1 96 4,5 24,0 85 119 97 411 26,8 85 1,07 6,6 7,39 41 41,0 83 6,7 1,6 22 38 9,5 110,2 4,5 14,9 78 70,9 71,3 401,1 23,1 92 1,25 4,8 7,34 42 41 73 9,3 2,9 22,7 22 7,5 98 4,7 12,8 85 65 417 26,3 63 1,37 7,39 38 39,9 7,1 20,5 КТ была проведена через 3 часа 30 минут от начала заболевания, на котором выявлена гиподенсная зона 26-28HU перивентрикулярно справа в бассейне средней мозговой артерии размерами 99х76х45 мм, а также энцефалопатия (рис. 28, 29, 30). Рисунок 28. Компьютерная томография головного мозга Домышева В. от 02.04.2012г. 111 На рисунке 29 представлена КТ головного мозга пациента Домышева В., проведенная от 02.04.2012 г., на которой можно увидеть ранние КТ признаки ИИ такие как сглаженность борозд, утрата ребристой поверхности, сдавление ликворных пространств. Рисунок 29.На компьютерной томографии головного мозга Домышева В. заметны ранние КТ-признаки инфаркта мозга: сглаженность борозд, утрата ребристой поверхности, сдавление ликворных пространств в правом полушарии 112 113 Рисунок 30. Серия КТ-снимков головного мозга Домышева В. На 3 сутки стационарного наблюдения состояние Домышева В. оценивалось как средней тяжести, АД 150/90 мм рт ст. При этом пациент предъявлял жалобы на слабость и онемение в левых конечностях. В неврологическом статусе был выявлен центральный парез VII и XII черепномозговых нервов слева, левосторонний гемипарез до 4 баллов в руке и ноге с акцентом сухожильных рефлексов, 114 левосторонняя гемигипестезия, положительный рефлекс Бабинского слева. При оценке состояния по шкалам: NIHSS выявлено 4 балла, Bartel- 35 баллов, Renkin- 3 балла. На 7 сутки состояние пациента ухудшилось, стало тяжелым, АД 125/80 мм рт ст. Сохранялись жалобы на слабость и онемение в левых конечностях. В неврологическом статусе был обнаружен центральный парез VII и XII черепно-мозговых нервов слева, левосторонний гемипарез до плегии в руке и 3-х баллов в ноге с акцентом сухожильных рефлексов, левосторонняя гемигипестезия, положительный рефлекс Бабинского слева. Оценка по шкалам: NIHSS показала 7 баллов, Bartel - 25 баллов, Renkin - 4 балла. На 14 сутки состояние несколько улучшилось и стало средней тяжести. АД 120/80 мм рт ст. Пациент жалоб активно не предъявлял. В неврологическом статусе обращало на себя внимание центральный парез VII и XII черепно-мозговых нервов слева, левосторонний гемипарез до 4 баллов в руке и ноге с акцентом сухожильных рефлексов, левосторонняя гемигипестезия, положительный рефлекс Бабинского слева. Оценка по шкалам: NIHSS составила 2 балла, Bartel - 45 баллов, Renkin 3 - балла. С 20-х по 28 сутки состояние Домышева В.В. оставалось стабильным, на 28 сутки пациент был выписал. В неврологическом статусе сохранялся левосторонний гемипарез до 4 баллов в руке и ноге с акцентом сухожильных рефлексов, левосторонняя гемигипестезия, положительный рефлекс Бабинского слева. Неврологический дефицит по шкале NIHSS составил 3 балла, функциональный исход по индексу Bartel - 55 баллов, оценка по шкале Renkin - 3 баллам. Позже при обзвоне через 2 года после выписки, со слов жены, пациент Домышев В. был жив, реабилитацию не проходил, повторных эпизодов ОНМК не было. 2. В клиническом примере № 2 продемонстрирован случай пациентки Онопко Л.П. 73 лет, которая поступила 01.11.2013 г. в 12 часов 1 минуту в нейрореанимацию ГКБ № 15 с диагнозом: ИИ в системе ЛСМА через 1 час 40 минут от начала заболевания. Со слов мужа, у больной внезапно 115 нарушилась речь, ослабли правые конечности. Длительное время страдала артериальной гипертонией 3-4 степени, ишемической болезнью сердца, стенокардией. Поступила в тяжелом состоянии. При объективном осмотре кожные покровы были влажные и чистые, АД 180/100 мм рт ст, ЧСС 90 ударов в минуту, в легких выслушивалось жесткое дыхание, мочевой пузырь в нейрореанмации был катетеризирован. При поступлении больная жалоб не предъявляла из-за нарушения речи. При оценке неврологического статуса больная находилась в сознании, контакт был невозможен из-за тотальной афазии, менингеальных знаков не было обнаружено, также был выявлен парез взора влево, центральный парез VII и XII черепно-мозговых нервов справа, правосторонняя гемиплегия с акцентом сухожильных рефлексов, положительный рефлекс Бабинского справа. Оценка по шкалам: NIHSS составила 22 балла, Bartel - 0 баллов, Renkin - 5 баллов. Лабораторное исследование крови пациентки Онопко Л.П. (табл. 28). Таблица 28. Лабораторное исследование крови Онопко Л.П. Параметр Эритроциты Гемоглобин Тромбоциты Лейкоциты Лимфоциты Моноциты СОЭ Белок Альбумин Мочевина Креатинин Холестерин Билирубин АЛТ АСТ ЛДГ АЧТВ ПТИ МНО Общий фибриноген pH вена pCO2 pO2 sO2 1 сутки 5,14 155 186 5,8 5,5 2,8 34 77 49 5,4 62,9 8,6 35 29 28 420 23,5 124 0,88 3,6 7,37 46,7 43,1 77 3 сутки 5,04 152 127 16,3 4,2 2,4 30 78 37 6,3 165 7,5 56 42 72 489 21,4 89 1,07 6,5 7,43 33 57 90 116 6 сутки 3,81 117 44 11,4 7,2 2,1 40 41 31 38,9 313 7,7 79 51 130 502 25,7 67 1,3 3,3 7,43 33 57 90 Глюкоза Лактат cHCO3 8,1 2,1 24,3 7,5 2,2 21,9 10,2 2,6 21,9 КТ была проведена через 3 часа 35 минут от дебюта заболевания, на которой данных за свежую ишемию обнаружено не было. На повторной КТ, проведенной на 2-е сутки, была выявлена гиподенсная зона 26–28HU в левом полушарии мозга размерами 130х73х69 мм с геморрагическим пропитыванием, смещением мозга на 1,6 см и признаки отека мозга (рис. 31). Первое Повторное Первое Повторное КТ-исследование КТ-исследование КТ-исследование КТ-исследование 117 1 сутки 2 сутки 1 сутки 2 сутки Данных за свежую патологию не выявлено. Гиподенсная зона 26-28HU в левом полушарии р-рами 130х73х69 мм с геморрагическим пропитыванием, смещение мозга на 1,6 см. признаки отека мозга. Данных за свежую патологию не выявлено. Гиподенсная зона 26-28HU в левом полушарии р-рами 130х73х69 мм с геморрагическим пропитыванием, смещение мозга на 1,6 см. признаки отека мозга. Рисунок 31. КТ-снимки головного мозга Онопко Л. на 1-е и 2-е сутки заболевания На 3 сутки состояние пациентки Онопко Л. оценивалось как тяжелое, АД 140/80 мм рт ст. Больная была в сознании. В неврологическом статусе обращало на себя внимание наличие тотальной афазии, пареза взора влево, центрального пареза правосторонняя VII и гемиплегия, XII черепно-мозговых нервов справа, акцент сухожильных рефлексов слева, положительный рефлекс Бабинского справа. При оценке по шкалам: NIHSS было обнаружено 30 баллов, Bartel - 0 баллов, Renkin - 5 баллов. На 6 сутки у пациентки Онопко Л. в 7 часов 40 минут произошла остановка сердечной деятельности. Причиной смерти стал инфаркт мозга на фоне длительной артериальной гипертонии, осложнившегося двусторонней пневмонией с дальшейшей Непосредственной причиной дислокацией смерти стал ствола отек и отеком мозга. головного мозга. Патологоанатомический диагноз звучал как обширный инфаркт лобной, 118 теменной, затылочной областей левого полушария с множественными точечными геморрагиями на фоне артериальной гипертонии, артериолонефросклероза, осложнившегося двусторонней мелкоочаговой нижнедолевой пневмонией, двусторонним гидротораксом, отеком легких и мозга с вклинением миндалин мозжечка в большое затылочное отверстие, паренхиматозом и дистрофией внутренних органов, которым сопутствовали мелкоочаговый кардиосклероз, атеросклероз артерий сердца, атеросклероз аорты, почечных, подвздошных артерий, а также серозно-гнойный трахеит, эмфизема легких и пневмосклероз. 119 СПИСОК ЛИТЕРАТУРЫ 1. Агафьина А. Эффективность нейрометаболического протектора цитофлавина у больных, перенесших ишемический инсульт, в раннем восстановительном периоде (многоцентровое рандомизированное исследование) / Агафьина А., Коваленко А., Румянцева С., и др. // Врач. 2006. № 1. С. 60-65. 2. Акимова Г.А. Дифференциальная диагностика нервных болезней: Руководство для врачей // Под. ред. Акимова Г.А. и Одинака М.М. - 3-е изд., испр. и доп. - СПб.: Гиппократ+. 2004. - С. 454. 3. Ананьева Н.И. КТ и МРТ - диагностика острых ишемических инсультов / Ананьева Н.И., Трофимова Т.Н. // СПб.: СПбМАПО, 2005. С. 62-101. 4. Ананьева Е.С. Алгоритмизация мониторинга и моделирование эпидемиологии инсульта в Воронежском регионе // дис…. канд. мед. наук 2009. – С. 22. 5. Бархатов Д. Ю. Гемодинамический резерв // Журн. неврологии и психиатрии им. С.С. Корсакова. 2005. - Приложение. Инсульт. Вып. 13. - С. 63-71. 6. Вавилов С.Б. Компьютерная томография при мозговом инсульте // дис…. канд. мед. наук – М., 1984. - С. 20-22. 7. Верещагин Н.В. Компьютерная томография головного мозга / Верещагин Н.В., Брагина Л.К., Вавилов С.Б., и др. // М.: Медицина, 1986. - С.11. 8. Верещагин Н.В. Инсульт: Увидим ли свет в конце тоннеля? // Врач. - 1998. - № 3. - С. 2-4. 9. Верещагин Н.В. Оценка цереброваскулярного резерва при атеросклеротическом поражении сонных артерий / Верещагин Н.В., Бархатов Д.Ю., Джибладзе Д.Н. // Журн. невропатологии и психиатрии им. С.С. Корсакова. - 1999. - Т. 99, № 2. - С. 57-64. 120 10. Верещагин Н.В. Интенсивная терапия острых нарушений мозгового кровообращения / Верещагин Н.В., Пирадов М.А. // Медицинская газета, № 43, 09.06.1999. С. 13. 11. Ворлоу Ч.П. Инсульт. Практическое руководство для ведения больных / Ворлоу Ч.П., Деннис М.С., Ж. ван Гейн и др.// СПб.: Политехника, 1998. – С. 629. 12. Воронина Т.А. Мексидол: Основные нейропсихотропные эффекты и механизм действия // Фарматека, № 6, 2009. С. 28-31. 13. Воронцов М.М. Подтипы ишемического инсульта: острый период, факторы риска, течение, инвалидность и вторичная профилактика // дис…. канд. мед. наук. код спец. 14.01.11 - 2010. - С. 34. 14. Гавриленко А.В. Неврологический статус и качество жизни у больных с хронической ишемией головного мозга IV степени после каротидной эндартерэктомии // Журн. ангиология и сосудистая хирургия. Т. 17, № 1. 2011. - С. 118-122. 15. Галеев Н.Э. Использование рентгеновской компьютерной и магнитно- резонансной томографии в лечебно-профилактических учреждениях на различных этапах оказания медицинской помощи населению // Казан. мед. журн. 2002. Т.83. №1. C. 1-3. 16. Гафаров В.В. Влияние депрессии на риск возникновения инсульта у мужчин в возрасте 25-64 лет // Неврологический журн. 2006. - Т. 11, № 3. С. 26-29. 17. Григорьева В.Н. Диагностика ишемического инсульта // Учебное пособие, 2008. С. 35-38. 18. Губский Л.В. кровообращения Диагностика методами острых компьютерной нарушений и мозгового магнитно-резонансной томографии / Губский Л.В., Шамалов Н.А., Абдурасулов А.Т., и др. // Consilium Medicum, 2003. - Том 5, № 5, - Приложение. С.16-18. 121 19. Губский Л.В. Клинико-томографические сопоставления и оценка характера внутричерепных изменений при инсульте // дис…. докт. мед. наук М. – 2009. С. 27–34. 20. Гусев Е.И. Ишемическая болезнь мозга // М., 1992. С. 7-8. 21. Гусев Е.И. Механизмы повреждения ткани мозга на фоне острой фокальной ишемии / Гусев Е.И., Скворцова В.И., Ковеленко А.В., и др. // Журн. неврологии и психиатрии им. С.С. Корсакова. - 1999. - Т. 99, № 5. С. 55-61. 22. Гусев Е.И. Ишемия головного мозга / Гусев Е.И., Скворцова В.И. // М., Медицина, 2001; С. 327. 23. Гусев Е.И. Эпидемиология инсульта в России / Гусев Е.И., Скворцова Л.В., Стаховская Л.В., и др. // Журн. Consilium medicum неврология. – 2003. специальный выпуск. С. 5-7. 24. Евсеев В.Н. Церебральная ишемия и ее коррекция антиоксидантами / Евсеев В.Н., Румянцева С.А., Силина Е.В., и др. // РМЖ, Т. 19, № 5, 2011. С. 325-329. 25. Есин Р.Г. Инсульт: диагностика, лечение, реабилитация, профилактика // М. – 2011. С. 25. 26. Жданова С.Г. Состояние кислотно-щелочного равновесия и кислородтранспортной функции крови у больных с острым каротидным ишемическим инсультом / Жданова С.Г., Алиев Э.С., Камчатнов П.Р., и др. // Журн. неврологии и психиатрии им. С.С. Корсакова, 8, 2012; Вып. 2. С. 15-19. 27. Заец Т.Я. Реабилитация и ведение больных с полушарным инсультом в свете новой концепции патогенеза постинсультного двигательного дефицита // Кремлев. медицина. 2001 № 2. C. 34-37. 28. Зартор К. Лучевая диагностика: Головной мозг / Зартор К., Хэннэль С., Кресс Б. // пер. с англ. - 2-е изд. - М.: МЕДпресс-информ, 2011. - С. 112-114. 122 29. Игнатьев И.М. Операции на сонных артериях в остром периоде ишемического инсульта // Ангиология и сосудистая хирургия. Т. 17, № 2. 2011. - С. 113-118. 30. Иксанова томографии Г.Р. мозга Использование для оценки перфузионной эффективности компьютерной берлитиона при ишемическом инсульте // Журн. неврологии и психиатрии им. С.С. Корсакова. 2008. - Т. 108, № 1. - С. 45-50. 31. Камчатнов П.Р. Коррекция свободнорадикального окисления - патогенетический подход к лечению острого ишемического инсульта / Камчатнов П.Р., Чугунов А.В., Михайлова Н.А. // Журн. неврологии и психиатрии им. С.С. Корсакова. Инсульт, 2009. - N 10.- С. 65-68. 32. Кольман Я. Наглядная биохимия / Кольман Я., Рем К.Г. // М., Мир, БИНОМ. Лаборатория знаний, 2009.- С. 469. 33. Корниенко В.Н. Диагностическая нейрорадиология / Корниенко В.Н., Пронин И.Н. // 2006. - С. 13-36, 238-328. 34. Крылов В.В. Сосудистый спазм при разрыве аневризм головного мозга / Крылов В.В., Гусев С.А., Гусев А.С. // Нейрохирургия. 2000. № 3. С. 4-13. 35. Крылова Л.Г. Патология гомеостаза в остром периоде ишемического инсульта в зависимости от степени тяжести / Крылова Л.Г., Бельская Г.Н., Колесников О.Л. // Известия Челябинского научного центра, вып. 2 (23), 2004. С.178-181. 36. Кухтевич И.И. Активная нейропротективная терапия острого каротидного ишемического инсульта средней степени тяжести / Кухтевич И.И., Алешина Н.И., Левашова О.А. // Журн. неврологии и психиатрии им. С.С. Корсакова 2014; 12 (2): С. 38-42. 37. Кулеш С.Д. Применение перфузионной компьютерной томографии при тромболитической терапии ишемического инсульта // Неврологический журн. Т. 16, № 2. 2011. - С. 38-43. 38. Липовецкий Б.М. Об особенностях течения цереброваскулярного заболевания с учетом данных визуализации мозговых сосудов и оценки 123 перфузии мозга // Журн. неврологии и психиатрии им. С.С. Корсакова. Т. 111, № 5. Вып. 1, 2011. - С. 50-52. 39. Матиас Хофер. Базовое руководство // 2-е изд. перераб. и доп. М. Медицинская литература, 2008. - С. 44-57. 40. Мунис М. Визуализация в остром периоде инсульта. Инсульт / Мунис М., Фишер М. // приложение к журн. неврологии и психиатрии им. С.С. Корсакова. 2001; (2): С. 4-12. 41. Немков А.Г. Клиническая и компьютерно-томографическая дифференциальная диагностика ушибов головного мозга и инсультов в остром периоде // дис…. канд. мед. наук. код спец. 14.00.13 – 2008. – С. 2627. 42. Одинак М.М. Сосудистые заболевания головного мозга / Одинак М.М., Михайленко А.А., Иванов Ю.С., и др. // СПб.: Гиппократ, 1998. – С. 160. 43. Одинак М.М. Инсульт в молодом возрасте / Одинак М.М., Коваленко П.А., Шматов В.И., и др. // ГВКГ им. Н.Н. Бурденко, М., 2001. – С. 62. 44. Одинак М.М. Оценка эффективности цитофлавина у больных в остром периоде ишемического инсульта / Одинак М.М., Скворцова В.И., Румянцева С.А., и др.// Журн. неврологии и психиатрии им. С.С. Корсакова. - 2010 - Т.110; №12. - С.29-36. 45. Одинак М.М. Применение сукцинатов для коррекции метаболических нарушений в зоне ишемической полутени у пациентов с инсультом / Одинак М.М., Янишевский С.Н., Цыган Н.В. и др. // Журн. неврологии и психиатрии им. С.С. Корсакова. Инсульт, 2013.-N 12.- С.55-60. 46. Парфенов В.А. Ишемический инсульт / Парфенов В.А., Хасанова Д.Р. // М.: МИА, 2012. – С. 288. 47. Парфенов В.А. Профилактика инсульта на основе снижения артериального давления и исследвание POWER / Парфенов В.А., Вербицкая С.В. // Неврология, нейропсихиатрия, психосоматика, 2013, - № 1, - С. 64-68. 124 48. Пирадов М.А. Синдром полиорганной недостаточности при инсульте / Пирадов М.А., Румянцева С.А. // Тезисы всероссийской научно– практической конференции «Актуальные проблемы современной неврологии, психиатрии и нейрохирургии». - 2003 - СПб. - С. 328. 49. Пирадов М.А. Синдром полиорганной недостаточности при тяжелых формах инсульта (клинико-морфологическое исследование) / Пирадов М.А., Гулевская Т.С., Реброва О.Ю. и др. // Неврологический журн., 2006, № 5., С. 9-13. 50. Пьянов И.В. Возможности диффузионной и перфузионной магнитно- резонансной томографии в диагностике ишемических инсультов в острой стадии // дис…. канд. мед. наук - СПб. 2005. - С. 18-24. 51. Рудас М.С. Позитронно-эмиссионная томография в клинической практике / Рудас М.С., Насникова И.Ю., Матякин Г.Г. // Учебнометодическое пособие, М., 2007. - С. 39-40. 52. Румянцева С.А. Неврологические расстройства при синдпроме полиорганной недостаточности (клиника, диагностика и лечение) // дис….докт. мед. наук. - М., 2002. С. 10-17. 53. Румянцева С.А. Актовегин в комплексной терапии критических состояний неврологического генеза // Неотложные состояния в неврологии. Орел, 2002; с. 376–383. 54. Румянцева С.А. Неврологические расстройства при синдроме полиорганной недостаточности / Румянцева С.А., Федин А.И. // М., 2002, ЗАО РКИ «Соверо пресс» - С. 252. 55. Румянцева С.А. Некоторые вопросы антигипоксантной терапии посткритических неврологических расстройств / Румянцева С.А., Беневольская Н.Г. // Атмосфера. Нервные болезни. 2006. № 1. - С. 2-6. 56. Румянцева С.А. Свободнорадикальные процессы у больных с острым нарушением мозгового кровообращения в остром периоде / Румянцева С.А., Силина Е.В., Федин А.И., и др. // Журн. неврологии и психиатрии им. С.С. Корсакова, 2007. С. 235-236. 125 57. Румянцева С.А. Антиоксидантная нейропротекция при инсульте / Румянцева С.А., Федин А.И., Силина Е.В., и др. // Спб. Тактик-Студио. 2008. - С. 104. 58. Румянцева С.А. Антиоксидантная терапия при остром ишемическом инсульте / Румянцева С.А., Евсеев В.Н., Елисеев Е.В. // Атмосфера. Нервные болезни. №3. 2009. С. 8-12. 59. Румянцева С.А. Патофизиологическая основа комплексной нейропротекции при ишемии мозга / Румянцева С.А., Афанасьев В.В, Силина Е.В. // Журн. неврологии и психиатрии им. С.С. Корсакова. - 2009 Т.109; №3. - С. 64-68. 60. Румянцева С.А. Ишемия мозга: пути и методы коррекции / Румянцева С.А., Силина Е.В., Елисеев Е.В., и др. //Журн. Врач. 2009. - №3. - С.14-18. 61. Румянцева С.А. Второй шанс (современные представления об энергокоррекции) / Румянцева С.А., Ступин В.А., Афанасьев В.В., и др.// М: МИГ «Медицинская книга», 2010. – С. 176. 62. Румянцева С.А. Влияние ранней коррекции энергетического и свободнорадикального гомеостаза на клиническую и морфологическую картину инфаркта мозга / Румянцева С.А., Федин А.И., Болевич С.Б., и др. // Журн. неврологии и психиатрии им. C.C. Корсакова, 2010. Т. 110. № 8. С. 16-21. 63. Румянцева С.А. Антиоксидантная терапия ишемических поражений головного мозга // Журн. неврологии и психиатрии им. С.С. Корсакова. Т. 111, № 4. Вып. 2, Инсульт. 2011. - С. 28-31. 64. Румянцева С.А. Закономерности течения свободнорадикальных процессов и прогноз ишемического и геморрагического инсульта / Румянцева С.А., Силина Е.В., Болевич С.Б., и др. // Журн. неврологии и психиатрии им. С.С. Корсакова, 2011, № 12., вып. 2, С. 36-42. 65. Румянцева С.А. Критические состояния в клинической практике / Румянцева С.А., Ступин В.А., Афанасьев В.В. // М.- Спб., Международная издательская группа «Медицинская книга», 2011, С. 65-88. 126 66. Румянцева С.А. Медицинские и организационные проблемы до- и постинсультной инвалидизации / Румянцева С.А., Силина Е.В., Свищева С.П. // Журн. неврологии и психиатрии им. С.С. Корсакова. Инсульт: выпуск 2. 2013, - Т.111; № 9. - C. 43-49. 67. Румянцева С.А. Эффективность антиоксидантной энергокоррекции при инфаркте головного мозга (результаты многоцентрового рандомизированного исследования) / Румянцева С.А., Силина Е.В., Чичановская Л.В., и др. // Журн. неврологии и психиатрии им. С.С. Корсакова 2014; 10: с. 49-55. 68. Сайфуллина Э.И. Нейровизуализация в ранней диагностике ишемического поражения головного мозга у лиц молодого возраста // Неврологический журн. 2007. - Т. 12, № 4. - С. 9-13. 69. Сайфулина Э.И. Церебральный инсульт: нейровизуализация в диагностике и оценке эффективности различных методов лечения // дис…. канд. мед. наук - Уфа 2008. - С. 9. 70. Сафонова Н.Ю. Клинические особенности единичных и множественных лакунарных инфарктов головного мозга // Журн. неврологии и психиатрии им. С.С. Корсакова. 2006. - Приложение: Инсульт. Вып. 18. - С. 26-31. 71. Силина Е.В. Коррекция оксидантного стресса при внутримозговых кровоизлияниях метаболическим церебропротектором цитофлавином / Силина Е.В., Румянцева С.А. // Вестник интенсивной терапии. - 2006. - №2. - С.82-88. 72. Силина Е.В. Оксидантный стресс и его корреляция у больных с гипертензивными внутримозговыми кровоизлияниями // дис…. кан. мед. наук. М. – 2007. С. 12-18. 73. Силина Е.В. Закономерности течения свободнорадикальных процессов при критических состояниях // дис….докт. мед. наук М. - 2012. С.135-138. 127 74. Силина Е.В. Свободнорадикальный дисбаланс и гипергликемия как прогностические маркеры инсульта / Силина Е.В., Орлова А.С., Румянцева С.А., и др. // Современная медицинская наука. 2012. - №2. - С. 80-87. 75. Силина Е.В. Энергокоррекция геморрагического инсульта у пожилых / Силина Е.В., Румянцева С.А., Комаров А.Н., и др. // Успехи геронтологии, 2013. - Т. 26. №2. - С.275-280. 76. Симанов Ю. В. Гипертензивные внутримозговые кровоизлияния. Часть I. Этиология, патогенез, патоморфология // Журн. нейрохирургия. №1. 2001. - C. 66-70. 77. Скворцова В.И. Ишемический инсульт. Патогенез ишемии, терапевтические подходы // Неврологический журн. Т. 6. №3. 2001. - C. 4-9. 78. Скворцова В.И. Эпидемиология инсульта в Российской Федерации / Скворцова В.И., Стаховская Л.В., Айриян Н.Ю. // Consilium medicum 2005. Прил. 1. - С. 10-12. 79. Скворцова В.И. Снижение заболеваемости, смертности и инвалидизации от инсультов в Российской Федерации // Журн. неврологии и психиатрии им. С.С. Корсакова. - 2007. специальный выпуск. С. 25-27. 80. Скворцова В.И. Постинсультное генерализованное тревожное расстройство: соотношение с депрессией, факторы риска, влияние на восстановление утраченных функций, патогенез, лечение // Журн. неврологии и психиатрии им. С. С. Корсакова. - Т. 110, № 10, 2010. - С. 4-7. 81. Скворцова В.И. Результаты внедрения тромболитической терапии при ишемическом инсульте в Российской Федерации // Журн. неврологии и психиатрии им. С.С. Корсакова. Т. 110, № 12. Вып.2, Инсульт. 2010. - С. 17-22. 82. Скоромец А.А. Эпидемиология инсультов, организация медицинской помощи и практические рекомендации по ее совершенствованию / Скоромец А.А., Ковальчук В.В. // Сосудистая патология нервной системы. - СПб., 1998. – С. 216-218. 128 83. Смертина Е.Г. Система гемостаза в остром и восстановительном периодах ишемических инсультов // дис…. канд. мед. наук. код спец. 14.00.13. 03.00.04 – 2009. – С. 28. 84. Стаховская Л.В. Лечение ишемического каротидного инсульта с позиций доказательной медицины (результаты многоцентрового двойного слепого рандомизированного плацебо-контролируемого клинического исследования) / Стаховская Л.В., Румянцева С.А., Силина Е.В., и др. // Фарматека - 2011 - № 9 - С. 60-66. 85. Стаховская Л.В. Эпидемиология инсульта в России по результатам территориально-популяционного регистра (2009 - 2012) / Стаховская Л.В., Клочихина О.А., Богатырева М.Д., и др. // Журн. неврологии и психиатрии им. С.С. Корсакова, 2013. - N 5.- С.4-10. 86. Суслина З.А. Эффективность цитофлавина при ишемии головного мозга / Суслина З.А., Румянцева С.А., Клочева Е.Г., .и др. // Клиническая медицина, 2010. - № 3. - С. 50-53. 87. Суслина З.А. Комплексная энергокоррекция хронической ишемии мозга / Суслина З.А., Румянцева С.А., Танашян М.М., и др. // Журн. неврологии и психиатрии им. С.С. Корсакова, 2011. - № 3. – С. 25-30. 88. Суслина З.А. Неврология на рубеже веков: достижения и перспективы // Вестник Российской Академии медицинских наук, 2012. - № 8. – С. 57-65. 89. Тинсли Р. Харрисон. Внутренние болезни по Тинсли Р. Харрисону // Под ред. Э. Фаучи, Ю. Браунвальда, К. Иссельбахера, Дж. Уилсона, Дж. Мартина, Д. Каспера, С. Хаузера и Д. Лонго. Пер. с англ. – М., Практика – Мак-ГроуХилл (совместное издание), 2005. С. 2817-2841. 90. Трифанова В.А. Полиморфизм клинических и томографических проявлений при инфарктах мозга в бассейнах артерий каротидной системы // Автореф. дисс. канд.... мед. наук. М., 2008. – C. 25. 91. Труфанов Г.Е. Возможности рентгеновской компьютерной томографии в ранней диагностике ишемического инсульта / Труфанов Г.Е., Дергунова Н.И. // Материалы конференции 129 «Актуальные вопросы лучевой диагностики заболеваний и повреждений у военнослужащих». СПб. 2001. C. 20. 92. Труфанов Г.Е. Рентгеновская компьютерная томография и магнитно- резонансная томография в диагностике ишемического инсульта / Труфанов Г.Е., Фокин В.А., Пьянов И.В., и др. // СПб.: ЭЛБИ-СПб, 2005. – С. 36-163. 93. Труфанова Г.Е. Лучевая диагностика // Учебник для вузов. – Том 1. М.: ГЭОТАР-Медиа, 2009. С. 52-55, 330-356. 94. Уордлоу Д. Нейровизуализация при инсульте: достижения и преимущества // Журн. неврологии и психиатрии им. С.С. Корсакова. – Том 100. N 8 - 2000. С. 35-37. 95. Федин А.И. Интенсивная терапия ишемического инсульта / Федин А.И., Румянцева С.А. // М.: Медицинская книга. 2004. – С. 284. 96. Фейгин В.Л. Диагностика и лечение больных с цереброваскулярными заболеваниями / Фейгин В.Л., Пилипенко П.И. // Краткое руководство для врачей, Новосибирск, 2003. С. 5-12. 97. Хасанова Д.Р. Опыт лечения ишемического инсульта с применением современных технологий в условиях межрегионального клинико- диагностического центра / Хасанова Д.Р., Демин Т.В., Володюхин М.Ю., и др. // Инсульт, приложение к журн. неврологии и психиатрии им. С.С.Корсакова. 2007; Спецвыпуск. - С. 54-58. 98. Хызыров М.М. Расстройства гомеостаза в остром периоде ишемического инсульта на фоне гипертонической болезни / Хызыров М.М., Солодянкина М.Е., Равелин Э.Э., и др. // Вестник ЮУрГУ, №3, 2006, серия «Образование, здравоохранение, физическая культура», вып. 7, Т. 1. С. 169-172. 99. Черемисин В.М. Ранние компьютерно-томографические признаки ишемических инсультов / Черемисин В.М., Позднякова О.Ф., Дергунова Н.И. // Материалы симпозиума «Современные минимально-инвазивные технологии». М., 2000. - С. 59. 130 100. Штульман Д.Р. Неврология: Справочник практ. врача / Штульман Д.Р., Левин О.С. // 4-е изд., перераб. и доп. - М.: МЕДпресс-информ, 2005. - С. 385. 101. Щербаков А.Е. Ранняя диагностика и лечение инсультов в областной клинической больнице // Материалы научно-практической конференции врачей и научных работников, посвященной 75-летию Омской областной клинической больницы. 1995. - C. 98-100. 102. Шурдумова М.Х. Исследование иммунновоспалительных маркеров развития атеротромботического ишемического инсульта и механизмов реализации ишемического повреждения головного мозга // дис…. канд. мед. наук. код спец. 14.01.11 - 2011. - С. 27. 103. Яхно Н.Н. Болезни нервной системы: Руководство для врачей: в 2-х т. // Т. 1, под ред. Н.Н. Яхно - 4-е изд., перераб. и доп. - М.: Медицина, 2005. – С. 232. 104. Яхно Н.Н. Кардиоэмболический инсульт в молодом возрасте при незаращенном овальном отверстии // Неврологический журн. Т. 13, № 5. 2008. - С. 35-38. 105. Adachi M. Dilated Virchow-Robin spaces. MRI pathological study / Adachi M., Hosoya T., Haku T. et al. // Neuroradiology, 1998; 40: p. 27-31. 106. Ambrose J. Computerized transverse axial scanning (tomography): Part 2. Clinical application // British Journal of Radiology, 1973, 46 (552): p. 10231047. 107. Amie W.H. Developments in Neuroimaging for Acute Ischemic Stroke: Diagnostic and Clinical Trial Applications / Amie W.H., Chelsea S.K. // Cur. Atherosclerosis Reports 2008, 10: p. 339-346. 108. Bahn M.M. CT and MRI of stroke / Bahn M.M., Oser A.B., Cross D.T. // J. Magn. Reson. Imaging. 1996. - Vol. 6. - N 5. - p. 833-845. 109. Balami J.S. Neurological complications of acute ischaemic stroke / Balami J.S., Chen R.L., Grunwald I.Q., et al. // Lancet Neurol. 2011 Apr; Vol. 10. № 4: p. 357-371. 131 110. Becker H. CT Fogging Effects with Ischemic Cerebral Infarcts / Becker H., Desch H., Hacker H., et al. // Neuroradiology 18, – 1979. p. 185-192. 111. Beltz E.E. Radiological reasoning: hyperintensity of the basal ganglia and cortex on FLAIR and diffusion-weighted imaging / Beltz E.E., Mullins M.E. // AJR Am J Roentgenol. 2010. - Sep; 195(3 Suppl): p. 1-8. 112. Besson G. Vertebrobasillar infarcts in patients with dolichoectatic basilar artery / Besson G., Bogousslavsky J., Moulin T., et al. // Acta Neurol. Scand. 1995. - Vol. 91, № 1. - p. 37-42. 113. Bermingham S.L. The appropriate use of neuroimaging in the diagnostic work-up of dementia: an economic literature review and cost-effectiveness analysis // Ont Health Technol Assess Ser. 2014 Feb 1; 14(2): p. 1-67. 114. Boiten J. Lacunar infarcts / Boiten J., Lodder J. // Stroke. - 1991. - Vol. 22. p. 1374-1378. 115. Bokura H. Distinguishing silent lacunar infarction from enlarged VirchowRobin spaces: a MRI and pathological study / Bokura H., Kobayashi S., Yamaguchi S. // Journal of Neurology 1998; 245 (2): p. 116-122. 116. Bradley W.G. MR appearance of hemorrhage in the brain // Radiology 1993; 189 (1): p. 15-26. 117. Butcher K. Perfusion thresholds in acute stroke thrombolysis / Butcher K., Parsons M., Baird T., et al. // Stroke 2003, 34: p. 2159-2164. 118. Butcher K. Acute stroke imaging. Part I: Fundamentals / Butcher K., Emery D. // Can J Neurol Sci. 2010 Jan; Vol. 37. № 1: p. 4-16. 119. Chalela J.A. Magnetic comparison / Chalela J.A., Kidwell C.S., Nentwich L.M., et al. // Lancet 2007, 369: p. 293-298.Cerebral Infarcts* 120. Cormack A.M. Representation of a function by its line integrals, with some radiological applications // Journal Appl Physics 1963; 34: p. 2722-2727. 121. Cormack A.M. Representation of a function by its line integrals, with some radiological applications. II // Journal Appl Physics 1964; 35: p. 2908-2913. 132 122. Cormack A.M. Early two-dimensional reconstruction and recent topics stemming from it // Nobel Lectures in Physiology or Medicine 1971-1980. World Scientific Publishing Co., 1992. - p. 551-563. 123. Dani K.A. Translational Medicine Research Collaboration Multicentre Acute Stroke Imaging Study. Computed tomography and magnetic resonance perfusion imaging in ischemic stroke: definitions and thresholds / Dani K.A., Thomas R.G., Chappell F.M., et al. // Ann Neurol. 2011 Sep; Vol. 70 № 3: p. 384-401. 124. Davis S.M. Magnetic resonanc imaging in posterior circulation infarction: impact on diagnosis and managmant / Davis S.M., Tress B.M., Dowling R. et al. // A.N.Z.J. Med. - 1989. - Bd. 19, H. 3. - p. 219-225. 125. De Veber G. Stroke and the child’s brain: an overview of epidemiology, syndromes and risk factors // CurrOpin Neurol 2002; 15 (2): p. 133-138. 126. Demchuk A.M. Importance of early ischemic computed tomography changes using ASPECTS in NINDS rtPA Stroke Study / Demchuk A.M., Hill M.D., Barber P.A., et al. // Stroke 2005, 36: p. 2110-2115. 127. Ebinger M. Imaging the penumbra - strategies to detect tissue at risk after ischemic stroke / Ebinger M., De Silva D.A., Christensen S., et al. // J Clin Neurosci. 2009 Feb; Vol.16. № 2: p. 178-187. 128. Endo M. Development and performance evaluation of the second model 256-detector row CT / Endo M., Mori S., Kandatsu S., et al. // Radiol Physics Technol 2008, 1: p. 20-26. 129. Fazekas F. Histopathologic analysis of foci of signal loss on gradient-echo T2*-weighted MR images in patients with spontaneous intracerebral hemorrhage: evidence of microangiopathy-related microbleeds / Fazekas F., Kleinert R., Roob G., et al. // AJNR Am J Neuroradiol 1999, 20: p. 637-642. 130. Fiebach J.B. Modern magnetic resonance techniques in stroke / Fiebach J.B., Schellinger P.D. // Radiologe 2003; 43 (3): p. 251-263. 133 131. Fiebach J.B. Stroke magnetic resonance imaging is accurate in hyperacute intracerebral hemorrhage: a multicenter study on the validity of stroke imaging / Fiebach J.B., Schellinger P.D., Gass A., et al. // Stroke 2004, 35: p. 502-506. 132. Freeman W.D. Prevention of cardioembolic stroke / Freeman W.D., Aguilar M.I. // Neurotherapeutics. 2011 Jul; Vol. 8. № 3: p. 488-502. 133. Furlan A. Spontaneous abdominal hemorrhage: causes, CT findings, and clinical implications / Furlan A., Fakhran S., Federle M.P. // AJR Am J Roentgenology. 2009, Oct; Vol. 193. № 4: p. 1077-1087. 134. Gavrilescu T. Clinical stroke syndromes: clinical-anatomical correlations / Gavrilescu T., Kase C.S. // Cerebrovasc. Brain Metab. Rev. - 1995. - Vol. 7, № 3. - p. 218-239. 135. Giroud M. Role of associated cortical lesions in motor partial seizures and lenticulostriate infarcts / Giroud M., Dumas R. // Epilepsia. - 1995. - Vol. 36, № 5. - p. 465-470. 136. Gomez C.R. Isolated vertigo as a manifestation of vertebrobasilar ischemia / Gomez C.R., Cruz-Flores S., Malkoff M.D. et al. // Neurology. - 1996. - Vol. 47, № 1. - p. 94-97. 137. Good C.D. Amiloid angiopathy causing widespread miliary hemorrhages within the brain evident on MRI / Good C.D., Ng V.W., Clifton A., et al. // Neuroradiology 1998; 40 (5): p. 308-311. 138. Grond M. Early computed-tomography abnormalities in acute stroke / Grond M., von Kummer R., Sobesky J., et al. // Lancet. 1997; 350 (9091): p. 15951596. 139. Grunwald I. Intrazerebral tumors in adulthood. 2: Extra-axial tumors / Grunwald I.Q., Struffert T., Moller V., et al. // Radiologe 2002; 42 (10): p. 843849. 140. Hacke W. Intravenous thrombolysis with recombinant tissue plasminogen activator for acute hemispheric stroke. The European Cooperative Acute Stroke Study (ECASS) / Hacke W., Kaste M., Fieschi C., et al. // JAMA 1995, 274: p. 1017-1025. 134 141. Hacke W. Randomised doubleblind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS II). Second European-Australasian Acute Stroke Study Investigators / Hacke W., Kaste M., Fieschi C., et al. // Lancet 1998, 352: p. 1245-1251. 142. Heiland S. Is perfusion MRI feasible in lesions with disrupted blood-brain barrier? Pitfalls and possible solutions / Heiland S., Hartmann M., Sartor K. // Rofo Fortschr Geb Rontgenstr Neuen Bildgeb Verfahr 2000; 11, 172(10): p. 814-816. 143. Heiss W.D. Imaging in cerebrovascular disease / Heiss W.D., Forsting M., Diener H.C. // Curr. Opin. Neurol. - 2001. - Vol. 14. - N 1. - p. 67-75. 144. Hjort N. Magnetic resonance imaging criteria for thrombolysis in acute cerebral infarct / Hjort N., Butcher K., Davis S.M., et al. // Stroke 2005, 36: p. 388-397. 145. Hounsfield G.N. Computerized transverse axial scanning (tomography): Part 1. Description of system // British Journal of Radiology, 46. – 1973. - p. 10161022. 146. Hounsfield G.N. Computed Medical Imaging // Nobel Lectures in Physiology or Medicine 1971-1980. - World Scientific Publishing Co., 1992. p. 568-586. 147. Huang F. A fast iterated conditional modes algorithm for water-fat decomposition in MRI / Huang F., Narayan S., Wilson D., et al. // IEEE Trans Med Imaging, 2011 Aug; Vol. 30. № 8: p. 1480-1492. 148. Iwata N. Orally administrated ascorbic acid suppresses neuronal damage and modifies expression of SVCT2 and GLUT1 in the brain of diabetic rats with cerebral ischemia-reperfusion / Iwata N., Okazaki M., Xuan M., et al. // Nutrients, 2014 Apr 15; 6(4): p. 1554-1577. 149. Jovanovic A. Stroke and diabetic ketoacidosis-some diagnostic and therapeutic considerations / Jovanovic A., Stolic R.V., Rasic D.V., et al. // Vasc Health Risk Manag. 2014 Apr 8; 10: p. 201-204. 135 150. Kane I. Comparison of 10 different magnetic resonance perfusion imaging processing methods in acute ischemic stroke: effect on lesion size, proportion of patients with diffusion/perfusion mismatch, clinical scores, and radiologic outcomes / Kane I., Carpenter T., Chappell F., et al. // Stroke 2007, 38: p. 31583164. 151. Khurana D. Vertebral artery dissection: issues in diagnosis and management / Khurana D., Bonneman C.G., Dooling E.C. et al. // Pediatr. Neurol. – 1996. – Vol. 14, № 3. – p. 255-258. 152. Kidwell C.S. Magnetic resonance imaging detection of microbleeds before thrombolysis: an emerging application / Kidwell C.S., Saver J.L., Villablanca J.P., et al. // Stroke 2002, 33: p. 95-98. 153. Kidwell C.S. Beyond mismatch: evolving paradigms in imaging the ischemic penumbra with multimodal magnetic resonance imaging Kidwell C.S., Alger J.R., Saver J.L. // Stroke 2003, 34: p. 2729-2735. 154. Kidwell C.S. Comparison of MRI and CT for detection of acute intracerebral hemorrhage / Kidwell C.S., Chalela J.A., Saver J.L., et al. // JAMA 2004, 292: p. 1823- 1830. 155. Kleihues P. The WHO classification of tumors of the nervous system / Kleihues P., Louis D.N., Scheithauer B.W. et al. // J Neuropathol Exp Neurol, 2002, 61(3): p. 215-225. 156. Kloska S.P. Acute strokе assessment with CT: do we need multimodal evaluation? Kloska S.P., Nabavi D.G., Gaus C., et al. // Radiology 2004, 233: Р. 79-86. 157. Klotz E. Perfusion measurements of the brain: using dynamic CT for the quantitative assessment of cerebral ischemia in acute stroke / Klotz E., Konig M. // Eur J Radiol 1999, 30: p. 170-184. 158. Koch S. Imaging evolution of acute lacunar infarction: leukoariosis or lacune? / Koch S., McClendon M.S., Bhatia R. // Neurology. 2011 Sep 13; Vol. 77 № 11: p. 1091-1095. 136 159. Kohrmann M. MRI versus CT-based thrombolysis treatment within and beyond the 3 h time window after stroke onset: a cohort study / Kohrmann M., Juttler E., Fiebach J.B., et al. // Lancet Neurol 2006, 5: p. 661-667. 160. Konstas A.A. CT perfusion imaging in acute stroke / Konstas A.A., Wintermark M., Lev M.H. // Neuroimaging Clin N Am. 2011 May; Vol. 21. № 2: Р. 215-238. 161. Lamby P. Post-operative monitoring of tissue transfers: advantages using contrast enhanced ultrasound (CEUS) and contrast enhanced MRI (ceMRI) with dynamic perfusion analysis? / Lamby P., Prantl L., Fellner C., et al. // Clin Hemorheol Microcirc, 2011; Vol.48. № 1: p. 105-117. 162. Lassen N.A. Ischemic penumbra and neuronal death: comments on the therapeutic window in acute stroke with particular reference to thrombolytic theraphy / Lassen N.A., Lenzi G.L., Fieschi C. // Cerebrovasc. Dis. 1991; 1: p. 32-35. 163. Lauterbur P.C. All science is interdisciplinary – from magnetic moments to molecules to men // Nobel Lecture, December 8, 2003. p. 245-251. 164. Leys D. Cervical artery dissections / Leys D., Lucas C., Gobert M. et al. // Europ. Neurol. – 1997. – Vol. 37, № 1. - p. 3-12. 165. Lin K. Accuracy of the Alberta Stroke Program Early CT Score during the first 3 hours of middle cerebral artery stroke: comparison of noncontrast CT, CTangiography source images, and CT perfusion / Lin K., Rapalino O., Law M., et al. // AJNR Am J Neuroradiol, 2008; 29 (5): p. 931-936. 166. Lоvblad K.O. Computed tomography in acute ischemic stroke / Lоvblad K.O., Baird A.E. // Neuroradiology, 2010 Mar; Vol. 52. № 3: p. 175-187. 167. Mansfield P. SNAP-SHOT MRI // Nobel Lecture, December 8, 2003. p. 266-283. 168. Mast H. “Steal” is an unestabilished mechanism for the clinical presentation of cerebral arteriovenous malformations / Mast H., Mohr J.P., Osipov A. et al. // Stroke. – 1995. – Vol. 26, № 7. - p. 1215-1220. 137 169. Matsumoto M T. Cortical activity, ionic homeostasis, and acidosis during rat brain repetitive ischemia / Matsumoto M T., Obrenovitch T.P., Parkinson N.A., et al. // Stroke, 1990 (8): р. 1192-1198. 170. Meilin S. Treatment with Actovegin improves spatial learning and memory in rats following transient forebrain ischaemia / Meilin S., Machicao F., Elmlinger M. // J Cell Mol Med. 2014 Aug; 18(8): p.1623-1630. 171. Merino J.G. Imaging of acute stroke / Merino J.G., Warach S. // Nat Rev Neurol, 2010 Oct; Vol. 6. № 10: Р. 560-571. 172. Miao Y. Potential serum biomarkers in the pathophysiological processes of stroke / Miao Y., Liao J.K. // Expert Rev Neurother. 2014 Feb; 14(2): P. 173185. 173. Moulin T. Brain CT scan for acute cerebral infarction: early signs of ischemia / Moulin T., Tatu L., Vuillier F., et al. // Rev Neurol (Paris). 1999; 155 (9): Р. 649-655. 174. Murphy B.D. Identification of penumbra and infarct in acute ischemic stroke using computed tomography perfusion-derived blood flow and blood volume measurements / Murphy B.D., Fox A.J., Lee D.H., et al. // Stroke 2006, 37: Р. 1771-1777. 175. North K.N. International Standard of Care Committee for Congenital Myopathies. Approach to the diagnosis of congenital myopathies / North K.N., Wang C.H., Clarke N., et al. // Neuromuscul Disord, 2014 Feb; 24(2): p. 97-116. 176. Oh-Hoon Kwon. 4D Electron Tomography / Oh-Hoon Kwon, Ahmed H. Zewail // Science. – 2010. Vol. 328. No. 5986. p. 1668-1673. 177. Orbay H. Positron emission tomography imaging of atherosclerosis / Orbay H., Hong H., Zhang Y., Cai W. // Theranostics, 2013 Nov 2; 3(11): P. 894-902. 178. Pan A. Depression and risk of stroke morbidity and mortality: a metaanalysis and systematic review / Pan A., Sun Q., Okereke O.I., et al. // JAMA. 2011; 306 (11): p. 1241-1249. 138 179. Papayannis C.E. Expanding Virchow-Robin spaces in the midbrain causing hydrocephalus / Papayannis C.E., Saidon P., Rugilo C.A. et al. // AJNR Am J Neuroradiol., 2003; 24(7): p. 1399-1403. 180. Parizel P. et al. / Intracranial hemorrhage: Principles of CT and MRI interpretation // Europ Radiol 2001; 11 (9): p. 1770-1783. 181. Rehme A.K. Dynamic causal modeling of cortical activity from the acute to the chronic stage after stroke / Rehme A.K., Eickhoff S.B., Wang L.E., et al. // Neuroimage, 2011 Apr 1; Vol. 55. № 3: p. 1147-1158. 182. Salat D. Immunological biomarkers improve the accuracy of clinical risk models of infection in the acute phase of ischemic stroke / Salat D., Penalba A., García-Berrocoso T., et al. // Cerebrovasc Dis. 2013; 35(3): p. 220-227. 183. Sanelli P.C. The effect of varying user-selected input parameters on quantitative values in CT perfusion maps / Sanelli P.C., Lev M.H., Eastwood J.D., et al. // Acad Radiol 2004, 11: p. 1085-1092. 184. Schaefer P. W. Firstpass quantitative CT perfusion identifies thresholds for salvageable penumbra in acute stroke patients treated with intra-arterial therapy / Schaefer P. W., Ledezma C., Roccatagliata L., et al. // AJNR Am J Neuroradiol 2006, 27: p. 20-25. 185. Schellinger P.D. MRI-based and CT-based thrombolytic therapy in acute stroke within and beyond established time windows: an analysis of 1210 patients / Schellinger P.D., Thomalla G., Fiehler J., et al. // Stroke 2007, 38: p. 26402645. 186. Schrader J. Prevention of stroke by blood pressure lowering / Schrader J., Luders S. // Dtsch Med Wochenschr, 2011 Oct; Vol. 136. № 40: Р. 2045-2049. 187. Selim M.H. Conundra of the penumbra and acute stroke imaging / Selim M.H., Molina C.A. // Stroke. 2011 Sep; 42 (9): Р. 2670-2671. 188. Serrati C. Contralaleral cerebellar hypometabolism: a predictor for stroke outcome? / Serrati C., Marchal G., Rioux P., et al. // J. Neurol. Neurosurg. Psychiatry 1994; 57: p. 174-179. 139 189. Shenoy R. Functional MRI brain imaging studies using the Contact Heat Evoked Potential Stimulator (CHEPS) in a human volunteer topical capsaicin pain model / Shenoy R., Roberts K., Papadaki A., et al. // J Pain Res. 2011; 4: p. 365-371. 190. Sierra C. Vascular mechanisms in the pathogenesis of stroke / Sierra C., Coca A., Schiffrin E.L. // Curr Hypertens Rep. 2011 Jun; Vol. 13. № 3: Р. 200207. 191. Sobesky J. Does the mismatch match the penumbra? Magnetic resonance imaging and positron emission tomography in early ischemic stroke / Sobesky J., Zaro Weber O., Lehnhardt F.G., et al. // Stroke 2005, 36: p. 980-985. 192. Souza L.C. Admission CT Perfusion Is an Independent Predictor of Hemorrhagic Transformation in Acute Stroke with Similar Accuracy to DWI / Souza L.C., Payabvash S., Wang Y., et al. // Cerebrovasc Dis. 2011 Nov 30; Vol. 33. № 1: p. 8-15. 193. Stroebele N. Knowledge of risk factors, and warning signs of stroke: a systematic review from a gender perspective / Stroebele N., MullerRiemenschneider F., Nolte C.H., et al. // Journal of Stroke. - 2011. Vol. 6: p. 6066. 194. Struffert T. Craniocerebral trauma. 2: Intra-axial injuries, secondary injuries / Struffert T., Axmann C., Reith W. // Radiologe, 2003; 43(11): p. 1001-1014. 195. Sun P.Z. Association between pH-weighted endogenous amide proton chemical exchange saturation transfer MRI and tissue lactic acidosis during acute ischemic stroke / Sun P.Z., Cheung J.S., Wang E., et al. // Journal of Cerebral Blood Flow & Metabolism, 2011 (8): р. 1743-1750. 196. Szent-Gyorgyi A. Oxidation, energy transfer, and vitamins // Nobel Lecture, Dec 11, 1937, p. 440-449. 197. Tambasco N. Multimodal use of computed tomography in early acute stroke, part 1 / Tambasco N., Scaroni R., Corea F., et al. // Clin Exp Hypertens. 2006; 28 (3-4): p. 421-426. 140 198. Tanaka C. Effect of CT acquisition parameters in the detection of subtle hypoattenuation in acute cerebral infarction: a phantom study / Tanaka C., Ueguchi T., Shimosegawa E., et al. // AJNR Am J Neuroradiol. 2006; 27 (l): p. 40-45. 199. Teng Z. Plaque hemorrhage in carotid artery disease: pathogenesis, clinical and biomechanical considerations / Teng Z., Sadat U., Brown A.J., et al. // J Biomech. 2014 Mar 3; 47(4): p. 847-858. 200. Todo K. Early CT findings in unknown-onset and wake-up strokes / Todo K., Moriwaki H., Saito K., et al. // Cerebrovasc Dis. 2006; 21 (5-6): p. 367-371. 201. Varshosaz J. Niosomes of ascorbic acid and α-tocopherol in the cerebral ischemia-reperfusion model in male rats / Varshosaz J., Taymouri S., Pardakhty A., et al. // BioMed Res Int. Vol. 2014 (2014), Article ID 816103, p. 9. 202. Wald N.J. Quantifying the health benefits of chronic disease prevention: a fresh approach using cardiovascular disease as an example / Wald N.J., Morris J.K. // Eur J. Epidemiol. 2014 Sep; 29(9): p. 605-612. 203. Wang Y. Dynamic metabolites profile of cerebral ischemia/reperfusion revealed by (1) HNMR-based metabolomics contributes to potential biomarkers / Wang Y., Wang Y.G., Ma T.F., et al. // International Journal of Clinical & Experimental Pathology. 2014; 7(7): p. 4067-4075. 204. Wardlaw J.M. Can stroke physicians and neuroradiologists identify signs of early cerebral infarction on CT? / Wardlaw J.M., Dorman P.J., Lewis S.C., et al. // J. Neurol Neurosurg Psychiatry. 1999; 67 (5): p. 651-653. 205. Warren D.J. Imaging in acute ischaemic stroke: essential for modern stroke care / Warren D.J., Musson R., Connolly D.J., et al. // Postgrad Med J. 2010 Jul; Vol. 86, - № 1017: p. 409-418. 206. Wechsler L.R. Imaging evaluation of acute ischemic stroke // Stroke. 2011 Jan; 42(1 Suppl): p. 12-15. 207. Wexler B.C. Comparative effects of unilateral and bilateral carotid artery ligation in the spontaneously hypertensive rat // Stroke, 1980 (1): р. 72-78. 141 208. Wiesmann M. Bildgebende Diagnostik akuter Schadel-Hirn-Verletzungen / Wiesmann M., Bruckmann H. // Radiologe 1998; 38(8): p. 645-658. 209. Wintermark M. Prognostic accuracy of cerebral blood flow measurement by perfusion computed tomography, at the time of emergency room admission, in acute stroke patients / Wintermark M., Reichhart M., Thiran J.P., et al. // Ann Neurol, 2002, 51: p. 417-432. 210. Wintermark M. Accuracy of dynamic perfusion CT with deconvolution in detecting acute hemispheric stroke / Wintermark M., Fischbein N.J., Smith W.S., et al. // AJNR Am J Neuroradiol 2005, 26: p. 104-112. 211. Wintermark M. Perfusion-CT assessment of infarct core and penumbra: receiver operating characteristic curve analysis in 130 patients suspected of acute hemispheric stroke / Wintermark M., Flanders A.E., Velthuis B., et al. // Stroke 2006, 37: p. 979-985. 212. Wintermark M. Comparison of CT perfusion and angiography and MRI in selecting stroke patients for acute treatment / Wintermark M., Meuli R., Browaeys P., et al. // Neurology, 2007, 68: p. 694-697. 213. Wood P.W. Left ventricular ejection fraction and volumes: it depends on the imaging method / Wood P.W., Choy J.B., Nanda N.C., et al. // Echocardiography. 2014; 31(1): p. 87-100. 214. Zhang J. Leptin attenuates cerebral ischemia injury through the promotion of energy metabolism via the PI3K/Akt pathway / Zhang J., Deng Z., Liao J., et al. // Journal of Cerebral Blood Flow & Metabolism, 2013 (4): p. 567-574. 215. Zivin J.A. Factors determining the therapeutic window for stroke // Neurology, 1998. – Vol. 50. - p. 599-603. 142