Медицина 217 Литература
реклама

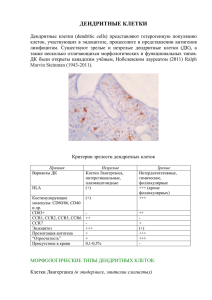
217 Медицина Литература 1. Багненко С.Ф., Гольцов В.Р. Острый панкреатит – современное состояние проблемы и нерешенные вопросы // Альманах Института хирургии имени А.В. Вишневского. 2008. Т. 3, № 3. С. 104–112. 2. Бэнкс П. Панкреатит: пер. с англ. М.: Медицина,1982. 208 с. 3. Волков В.Е., Волков С.В. Острый некротический панкреатит. Чебоксары: Изд-во Чуваш. ун-та, 2009. 240 с. 4. Гостищев В.К., Глушко В.А. Панкреонекроз и его осложнения, основные принципы хирургической тактики // Хирургия. Журнал имени Н.И. Пирогова. 2003. № 3. С. 50–54. 5. Диагностика и хирургическое лечение панкреонекроза / Э.И. Гальперин, Т.Г. Дюжева, К.В. Докучаев и др. // Хирургия. Журнал имени Н.И. Пирогова. 2003. № 3. С. 55–59. 6. Лечение панкреонекроза с поражением забрюшинной клетчатки / А.Г. Кригер, В.Г. Владимиров, И.Л. Андрейцев и др. // Хирургия. Журнал имени Н.И. Пирогова. 2004. № 2. С. 18–22. 7. Нестеренко Ю.А., Шаповальянц С.Г., Лаптев В.В. Панкреонекроз (клиника, диагностика, лечение). М.: МЗ РФ, 1994. 264 с. 8. Нестеренко Ю.А., Лищенко А.Н., Михайлусов Ю.А. Гнойно-некротические осложнения острого панкреатита. М.: МЗ РФ, 1998. 170 с. 9. Cавельев В.С., Филимонов М.И., Гельфанд Б.Р. Панкреонекроз: актуальные вопросы классификации, диагностики и лечения // Consilium Medicum. 2000. № 7. С. 293–298. 10. Савельев В.С., Филимонов М.И., Бурневич С.З. Панкреонекрозы. М.: МИА, 2008. 264 с. 11. Classification of acute pancreatitis-2012: Revision of the atlanta classification and definitions by international consensus / P. Banks, T.L. Bollen, C. Dervenis et al. // Gut. 2013. № 62 (1). P. 102–111. 12. Organ failure and infection of pancreatic necrosis as determinants of mortality in patients with acute pancreatitis / M.S. Petrov, S. Shanbhag, M. Chakraborty et al. // Gastroenterology. 2010. № 139(3). P. 813–820. ВОЛКОВ ВЛАДИМИР ЕГОРОВИЧ. См. с. 205. ЧЕСНОКОВА НАТАЛИЯ НИКОЛАЕВНА. См. с. 205. УДК 612.42.017.1 ББК Е60*743.34 В.С. ГОРДОВА, И.М. ДЬЯЧКОВА АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ ЛИМФОИДНЫХ ОРГАНОВ Ключевые слова: антигенпрезентирующие клетки, тимус, селезенка, лимфатические узлы, макрофаги, дендритные клетки. Дан обзор публикаций, посвященных антигенпрезентирующим клеткам тимуса, селезенки, лимфатических узлов. В дендритных клетках в зависимости от главных комплексов гистосовместимости существуют разные механизмы презентации антигена Т-лимфоцитам. V. GORDOVA, I. DJACHKOVA ANTIGEN-PRESENTING CELLS OF LYMPHOID ORGANS Key words: antigen-presenting cells, thymus, spleen, lymph nodes, macrophages, dendritic cells. A review of publications on the aspects of аntigen-presentation in such lymphoid organs as thymus, spleen and lymph nodes is attached. In dendritic cells, heterogeneous intracellular pathways and mechanisms are responsible for generating complexes of MHC class I and class II molecules with peptide antigens for presentation to T cells. Антигенпрезентирующие клетки – это клетки лимфогемоэтической системы, в которых антигенные пептиды связываются молекулами главного комплекса гистосовместимости (МНС) для их презентации Т-лимфоцитам [8]. Они участвуют в важнейших для формирования иммунной системы процессах тимической селекции и Т-клеточного гомеостаза, являясь ключевым звеном в регуляции адаптивного иммунного ответа [8, 10]. Исследование антигенпрезентирующих клеток стало неотъемлемой частью оценки деятельности иммунной системы в целом, в связи с этим возросла актуальность определения функциональной активности этих клеток. Кроме того, вопрос о возможности . 218 Вестник Чувашского университета. 2014. № 2 экстаполяции данных, полученных для антигенпрезентирующих клеток в экспериментах на животных, на человека является принципиальным. В тимусе и костном мозге в качестве антигенпрезентирующих клеток функционируют клетки стромы (т.е. клетки соединительной ткани, дендритные клетки и так называемые «клетки-няньки»); кроме того, в тимусе эту функцию выполняют и эпителиальные клетки [14]. В периферических лимфоидных органах присутствуют следующие антигенпрезентирующие клетки: циркулирующие моноциты, оседлые тканевые макрофаги, способные к миграции дендритные клетки костно-мозгового происхождения, участвующие в переносе антигена через афферентные лимфатические сосуды, интердигитирующие клетки в селезенке и лимфатических узлах, интерстициальные дендритные клетки; в центрах размножения внутри периферических лимфоидных органов – это фолликулярные дендритные клетки. В-лимфоциты тоже могут выступать в роли антигенпрезентирующих клеток, но лишь при взаимодействии В-клеток с хелперными Т-лимфоцитами (табл. 1). Таблица 1 Характеристики профессиональных антигенпрезентирующих клеток (адаптировано из [8]) Отличительные признаки Экспрессия конститутивная МНС II индуцируемая Наличие рецепторов Продукция и секреция ИЛ-1 Способность к фагоцитозу Способность к пиноцитозу Переработка антигена Презентация антигена макрофаги ++ IFN-γ, TNF-α FcR, CR-1 +++ +++ +++ +++ + Тип клеток дендритные клетки +++ IFN-γ, TNF-α FcR + – +++ + +++ В-лимфоциты ++ IL-4, но не IFN-γ SIg, FcR, CR-1 + – + + +++ Молекулы МНС кодируются генами главного комплекса гистосовместимости и представляют собой сильные антигены гистосовместимости (у человека это HLA-антигены). Спектр молекул MHC уникален для каждого организма и определяет его биологическую индивидуальность [10]. Наименование «молекулы МНС» возникло потому, что вначале была открыта функция этих антигенов в качестве структур клеточной поверхности, ответственных за иммунное отторжение клеток и тканей после трансфузии или трансплантации. Основная функция молекул МНС – презентация антигенов – была открыта позже, когда в 1970-е гг. при исследовании вирусспецифичных цитотоксических Т-лимфоцитов было обнаружено, что они способны разрушать только те инфицированные вирусом клетки, которые получены от идентичной МНС особи [11]. Кроме антигенного пептида Т-клеточные рецепторы распознают также определенные структуры молекул МНС. Корецепторы CD4 и CD8 стабилизируют контакт между антигенпрезентирующими клетками и Т-клеткой [4]. Различают три группы молекул МНС в зависимости от их распределения на клетках организма, а также от типа клеток, с которыми они взаимодействуют. Молекулы МНС класса I с различной плотностью присутствуют на всех клетках человеческого организма. Кроме того, на лимфогемопоэтических клетках обнаруживаются низкополиморфные, выполняющие дифференцировочную функцию, МНС антигены класса I, называемые также неклассическими. Молекулы MHC класса II – гликопротеины плазматической мембраны – присутствуют главным образом на лимфогемопоэтических клетках, макрофагах, антигенпрезентирующих клетках. Молекулы МНС класса III не являются собственно антигенами МНС, . Медицина 219 а представляют собой продукты других генов, локализованных в области МНС. К молекулам класса III относят компоненты С4 и С2 комплемента, интерлейкины, фактор некроза опухолей, белок теплового шока и другие молекулы, не имеющие отношения к презентации антигенов [10, 11, 14]. Основная функция молекул МНС-I и МНС-II состоит в презентации антигенов, причем роли молекул различаются в зависимости от класса (рисунок). Синтезируемые в клетке эндогенные антигенные пептиды связываются в эндоплазматическом ретикулуме с молекулами МНС класса I, образуя комплекс с фрагментами эндогенных клеточных антигенов, расщепляемых в протеасомах, и презентируются на клеточной поверхности. Экзогенные антигены вначале расщепляются на пептиды в фагосомах, которые сливаются с лизосомами, содержащими молекулы МНС класса II. Образованный комплекс презентируется на клеточной поверхности. При этом в фаголизосомах в отсутствие экзогенного антигена пептид, ингибирующий функцию молекул МНС-II, блокирует пептидсвязывающую полость молекул, предотвращая их взаимодействие с эндогенными пептидами. При поступлении антигена инвариантная цепь замещается фрагментом антигена [17]. Комплекс MНС-молекула класса I (вирусный пептид) и комплекс МНС-молекула класса II (фрагмент бактериального токсина) являются пептидами линейной формы, поэтому в отличие от антител, распознающих трехмерные структуры, рецепторы, расположенные на Т-лимфоцитах, распознают только изменения клеточной поверхности [11]. Презентация эндогенных и экзогенных антигенов молекулами классов МНС-I и МНС-II дендритных клеток (адаптировано из [21]): ЭПР – эндоплазматический ретикулум, ПТ – пептид-транспортер Молекулы MHC класса II участвуют в представлении антигенов T-клеткам и во взаимодействии Т- и В-лимфоцитов. Динамичность экспрессии молекул MHC-II зависит от функционального состояния клетки и изменяется под влиянием различных стимулов. Это один из механизмов, контролирующих индукцию и реализацию иммунного ответа [10, 13, 26]. Помимо молекул MHC-II, на антигенпредставляющих клетках экспрессируются все корецепторные молекулы и цитокины, необходимые для активации Т-лимфоцитов к иммунному ответу. Дендритные клетки – это гетерогенная группа клеток, которые отличаются по фенотипу, локализации и функциям, однако многочисленные исследования позволили выделить ряд общих черт [21]. Во-первых, предшественники этих клеток, образующиеся из стволовых клеток костного мозга CD34, с током крови по. 220 Вестник Чувашского университета. 2014. № 2 падают в органы, где из них образуются незрелые дендритные клетки (будущие клетки Лангерганса и интерстинальные (дермальные) дендритные клетки). Вовторых, незрелые дендритные клетки способны захватывать антигены (опосредованно и неопосредованно через рецепторы), подвергать их деградации в эндосомах и связывать антигенные пептиды с МНС II. В-третьих, в ответ на повреждение тканей или действие воспалительных цитокинов дендритные клетки созревают и мигрируют в лимфоидные органы, где они взаимодействуют с CD4 Т-лимфоцитами и инициируют иммунный ответ. В-четвертых, хемокиновые рецепторы зрелых и незрелых дендритных клеток отличаются, и этим обеспечивается миграция дендритных клеток в ткани в ответ на выделение воспалительных хемокинов. В-пятых, у зрелых дендритных клеток наблюдается более высокая плотность молекул MHC-II, связанных с антигеном, для распознавания последних рецепторами Т-лимфоцитов. Кроме того, показано, что продукция дендритными клетками IL-12 определяет направление Т-клеточного ответа. Продукция этого интерлейкина инициирует Тh-1 (клеточный) ответ, а в случае, когда синтез IL-12 подавляется, происходит активация Th2 (гуморального) ответа [21]. У мышей выделяли две популяции дендритных клеток: миелоидную и лимфоидную, однако более детальные исследования выявили, что дендритные клетки способны к экспрессии как CD4, так и CD8α, маркеров, по которым идентифицировали Т-лимфоциты. Экспрессия этих маркеров позволила выделить пять подтипов дендритных клеток (табл. 2). Таблица 2 Подтипы дендритных клеток мышей в тимусе, селезенке и лимфатических узлах (адаптировано из [21]) Признаки Фенотип CD 11c CD 11b CD80 CD86 CD 40 MHC II DEC 205 F4/ 80 Способность к фагоцитозу Локализация в органах CD4+8– CD4-8+ CD4-8+ + + + + + + + + + + + низкая степень экспрессии (НСЭ) + + + -/НСЭ + -/НСЭ + + есть лимфоузлы, маргинальные зоны селезенки есть Т-зоны лимфоидных органов CD4-8–/ CD4-8+ + + + + + + - + + + + + + - есть лимфоузлы, маргинальные зоны селезенки тимус, Т-зоны кортикальная лимфоидных зона тимуса органов Исследования Kohler C. демонстрируют сравнительно высокое число дендритных клеток в Т-зоне селезенки крыс [20], что также было описано относительно селезенки человека [15] и лимфатических узлов. Дендритные клетки пейеровых бляшек по сравнению с дендритными клетками селезенки обладают более выраженной способностью к стимуляции Т-лимфоцитов [19]. Антигенпрезентирующие клетки участвуют в позитивной и негативной селекции тимоцитов, играют важную роль в процессах их развития и дифференцировки. К антигенпрезентирующим клеткам тимуса, принимающим участие в селекции Т-лимфоцитов, относят эпителиальные клетки, дендритные клетки и макрофаги [14, 22, 23]. Причем, чем выше фагоцитарная активность макрофагов, тем выше степень экспрессии MHC-II [24]. Дендритные клетки непосредственно связаны с процессами дифференцировки Т-лимфоцитов. Дендритные клетки в тимусе локализуются в кортико-медуллярной зоне и в мозговом слое тимуса и принимают участие в отрицательной селекции Т-лимфоцитов, вызывая их апоп. Медицина 221 тоз [14]. Дендритные клетки способны образовывать розетки с незрелыми Т-лимфоцитами [18]. От типичных макрофагов дендритные клетки отличает неспособность к фагоцитозу, специфический маркер – белок S-100 и отрицательная реакция на лизоцим [2]. В типичных макрофагах, напротив, выявлено высокое содержание лизоцима [25]. Макрофаги, клетки неправильной формы, обнаруживаются во всех зонах тимуса, располагаясь среди лимфоидных клеток [14]. Ядро макрофагов имеет неправильную форму, в цитоплазме выявлены многочисленные лизосомы и круглые фагосомы, внутри которых нередко обнаруживаются фагоцитированные лимфоциты [8]. При изучении роли макрофагов тимуса человека в морфогенезе телец Гассаля были выявлены различия между морфологией и топографией корковых макрофагов и макрофагов мозгового вещества тимуса [6]. В корковом веществе макрофаги представлены крупными клетками с небольшими отростками, интенсивной иммуногистохимической реакцией. Макрофаги мозгового вещества тимуса меньше по размерам, характеризуются менее интенсивной иммуногистохимической реакцией и расположены возле телец Гассаля и непосредственно в их полости. Кроме того, этими же авторами было показано, что различие между макрофагами коркового и мозгового вещества заключается в меньшей фагоцитарной активности последних. Установлено, что CD68-положительные макрофаги в паренхиме тимуса человека располагаются как в корковом, так и мозговом веществе, с более высокой плотностью распределения на кортико-медуллярной границе. В мозговом веществе CD68-положительные макрофаги располагаются диффузно, имеют тенденцию к расположению возле телец Гассаля, преимущественно возле старых их форм [3]. Совсем недавно было установлено, что в тимусе человека дендритные клетки имеют максимальную плотность расположения на кортико-медуллярной границе и возле телец Гассаля. При этом они могут иметь как округлую форму без отростков, так и неправильную отростчатую, что отражает различные стадии их дифференцировки. Топография дендритных клеток, связанных с тельцами Гассаля, зависит от стадии развития последних, причем максимальное их число наблюдается в юных и молодых тельцах, снижаясь на стадии зрелости и практически исчезая в стареющих тельцах. Авторы утверждают, что такая корреляция может свидетельствовать об активном участии телец Гассаля в механизмах антигенпрезентации и формировании толерантности к аутоантигенам в тимусе [7]. По данным А.Н. Платонова и соавт., в тимусе человека CD1a-положительные (созревающие) дендритные клетки располагаются в мозговом веществе тимуса диффузно, имеют отростчатую форму и осуществляют антигенпрезентацию, наибольшая плотность их расположения зафиксирована возле молодых и зрелых форм телец Гассаля, что обусловлено взаимодействием указанных структур в процессах антигенпрезентации. В тельцах Гассаля дендритные клетки получают информацию об антигенах, которые в дальнейшем предоставляются пулу созревающих тимоцитов [5]. Сопоставление данных по результатам опытов на лабораторных крысах [24] и сведений, касающихся распределения макрофагов и дендритных клеток в тимусе человека [5, 7], свидетельствует о том, что лабораторные крысы могут быть вполне адекватной моделью для изучения антигенпрезентирующих клеток в структурах тимуса. Кроме того, оправданность использования грызунов в медико-биологических исследованиях подтверждается и другими микроморфологическими параметрами [13]. Различные воздействия на организм способны изменять как количественные, так и качественные характеристики популяций антигенпрезентирующих клеток в лимфоидных органах. . 222 Вестник Чувашского университета. 2014. № 2 Так было выявлено, что при длительном введении мелатонина при условии искусственного затемнения увеличивается приток макрофагов в периартериальные лимфоидные муфты, а также их миграция во все зоны красной и белой пульпы селезёнки [12]. Стресс-индуцированные состояния приводят к деструктивным и макрофагопролиферативным процессам в функционально активных зонах селезенки и лимфоидных бляшек тонкой кишки [1]. В экспериментах было показано, что наночастицы как диоксида кремния, так и кристаллического кремния оказывают сильное влияние на статус активации дендритных клеток лимфоидной ткани кишечника мышей – в них увеличивается экспрессия MHC-II, CD80, CD86 [16]. При обезвоживании в тимусе происходит перестройка макрофагального звена – наблюдаются как морфологические, так и численные изменения популяции макрофагов [9]. Гонадэктомия приводит к увеличению количества MHC-II-позитивных антигенпредставляющих клеток как в корковом, так и в мозговом веществе долек тимуса. В кортикомедуллярной зоне при недостатке мужских половых гормонов их количество снижается [26]. Наши собственные исследования показали, что длительное поступление соединения кремния ad libitum с питьевой водой обладает определенным влиянием на антигенпрезентирующие клетки лабораторных крыс как во вторичных лимфоидных органах, селезенке и пейеровых бляшках, так и в тимусе. В герминативных центрах селезенки и пейеровых бляшек значительно увеличивается количество антигенпрезентирующих клеток. При поступлении кремния с питьевой водой количество MHC-II-позитивных клеток в корковом веществе тимуса уменьшается в 3,75 раза. В кортикомедуллярной зоне количество MHC-II-позитивных клеток возрастает в 2,4 раза. Увеличение количества МНС-II-позитивных клеток в кортико-медуллярной зоне и снижение их численности в корковом веществе долек тимуса позволяют предполагать, что процессы созревания тимусных макрофагов смещаются в сторону образования фагоцитирующих и антигенпрезентирующих форм, а также происходит активация дендритных клеток. MHC-II-позитивные клетки, активированные MHC-II макрофаги и дендритные клетки, продуцируют цитокины, такие как IL-1, 3, 6, 7, колониестимулирующий фактор. Они же продуцируют вещества, которые необходимы в регуляции экспрессии генов в дифференцирующихся тимоцитах, в том числе в индукции апоптоза тимоцитов при позитивной и негативной селекции [10, 14]. У животных, получавших с питьевой водой кремний, в дольках тимуса происходит перераспределение клеток, относящихся к моноцитарно-макрофагальному звену, а также определенное изменение их функционального состояния, свидетельствующее о недостаточности компенсаторных реакций на снижение интенсивности протекания отрицательной селекции. Полное совпадение описания морфологии и локализации макрофагов и дендритных клеток в вилочковой железе интактных лабораторных крыс [26] и у иммунотолерантных детей [5, 7] позволяет предположить, что у людей, систематически получающих с питьевой водой или пищей соединения кремния, в главном органе иммунитета происходят соответствующие морфофункциональные процессы. Нарушения в механизмах антигенпрезентации в тимусе теоретически могут приводить к развитию таких патологических состояний, как аутоиммунные заболевания, и иным следствиям нарушения центральной толерантности [5]. Таким образом, антигенпрезентирующие клетки в лимфоидных органах рассматриваются в современной научной литературе в качестве морфологического субстрата адаптационных физиологических реакций. Изменение их морфофункциональных характеристик находится в прямой зависимости от вида воз. 223 Медицина действия на организм. Вопрос об адекватной экспериментальной модели для изучения антигенпрезентирующих клеток в структурах тимуса может быть снят. Литература 1. Бахмет А.А. Влияние некоторых олигопептидов на иммунные структуры лимфоидных бляшек тонкой кишки (экспериментальное исследование) // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2008. № 5. С. 38–44. 2. Идентификация люминесцирующих гранулярных клеток тимуса с дендритными макрофагами / Д.С. Гордон, В.Е. Сергеева, А.Т. Смородченко, Н.А. Кириллов и др. // Бюллетень экспериментальной биологии и медицины. 2001. Т. 132, № 7. С. 118–120. 3. Луговцова П.А., Луговцов Н.А, Платонов А.Н. Изучение локализации CD68-положительных макрофагов в тимусе человека в норме // Время смотреть в будущее: тез. докл. 51-й итоговой студ. науч. конф. с междунар. участием / Северо-Осетинская гос. мед. академия. Владикавказ, 2012. С. 71–72. 4. Маянский Н.А., Маянский А.Н. Номенклатура и функции главного комплекса гистосовместимости человека // Иммунология. 2006. Т. 27, № 1. С. 43–46. 5. Платонов А.Н., Луговцов Н.А., Луговцова П.А. Участие CD1a-положительных дендритных клеток и телец Гассаля в процессах антигенпрезентации в тимусе // Время смотреть в будущее: тез. докл. 51-й итоговой студ. науч. конф. с междунар. участием / Северо-Осетинская гос. мед. академия. Владикавказ, 2012. С. 72–73. 6. Стельмах И.А., Беловешкин А.Г. Участие макрофагов в процессе разрушения телец Гассаля тимуса человека // БГМУ: 90 лет в авангарде медицинской науки и практики: сб. науч. тр. / Белорус. гос. мед. ун-т; редкол.: А.В. Сикорский и др. Минск, 2011. Т. 1. С. 88–89. 7. Студеникина Т.М., Беловешкин А.Г. Топография S-100-положительных дендритных клеток, ассоциированных с тельцами Гассаля в тимусе человека // БГМУ: 90 лет в авангарде медицинской науки и практики: сб. науч. тр. / Белорус. гос. мед. ун-т; редкол.: А.В. Сикорский и др. Минск, 2011. Т. 1. С. 89-90. 8. Тололян А.А., Фрейдлин И.С. Клетки иммунной системы. СПб.: Наука, 2000. 231 с. 9. Федорова Н.П. Морфологические основы защитно-приспособительных реакций соединительной ткани кожи и тимуса при повреждающих и корригирующих воздействиях: автореф. дис. … канд. биол. наук. М., 2009. 25 с. 10. Хаитов Р.М. Иммунология. М.: ГЭОТАР-Медиа, 2006. 320 с. 11. Цинкернагель Р. Основы иммунологии. М.: Мир, 2008. 135 с. 12. Шатских О.А. Морфо-функциональная реакция СD68+ клеток селезёнки на искусственный сдвиг циркадных ритмов // «Ретиноиды» – Бабухинские чтения в Орле: материалы 8-й Всерос. конф. / ЗАО «Ретиноиды». М., 2011. Вып. 32. С. 282–283. 13. Юрчинский В.Я., Забродин В.А. Особенности микроморфологии тимуса млекопитающих // Морфология. 2012. Т. 141, № 3. С. 184. 14. Ярилин А.А., Пинчук В.Г., Гриневич Ю.А. Структура тимуса и дифференцировка Т-лимфоцитов. Киев: Наукова думка, 1991. 244 с. 15. Actin-binding proteins coronin-1a and IBA-1 are effective microglial markers for immunohistochemistry / Z. Ahmed, G. Shaw, V.P. Sharma, C. Yang, E. McGowan, D.W. Dickson // J. Histochem Cytochem. 2007. Vol. 55, № 7. P. 687–700. 16. Activation of the inflammasome by amorphous silica and TiO2 nanoparticles in murine dendritic cells / M. Winter, H.D. Beer, V. Hornung, U. Krämer, R.P. Schins, I. Förster // Nanotoxicology. 2011. Vol. 5. № 3. P. 326–340. 17. Crotzer V.L., Blum J.S. Autophagy and adaptive immunity // Immunology. 2010. Vol. 131. Р. 9–17. 18. Hemandez-Verdun D., Roussel P. Cell biological basis of AgNOR stain // Virchows Archiv B. 1995. Vol. 427. P. 326–327. 19. Jung C., Hugot J.-P., Barreau F. Peyer’s Patches: The Immune Sensors of the Intestine // International J. of Inflammation. 2010. Vol. 2010. doi:10.4061/2010/823710. 20. Kohler С. Allograft inflammatory factor-1/Ionized calcium-binding adapter molecule I is specifically expressed by most subpopulations of macrophages and spermatids in testis // Cell Tissue Res. 2007. Vol. 330. P. 291–302. 21. Lipscomb M.F., Masten B.J. Dendritic Cells: Immune Regulators in Health and Disease // Physiol Rev. 2002. Vol. 82. Р. 97–130. 22. Liu Y.-J. TSLP in Epithelial Cell and Dendritic Cell Cross Talk // Adv. Immunol. 2009. Vol. 101. P. 1–25. doi:10.1016/S0065-2776(08)01001-8. 23. McKenna K., Beignon A.-S., Bhardwaj N. Innate and Adaptive Immunity Plasmacytoid Dendritic Cells: Linking // J. Virol. 2005. Vol. 79, № 1. Р. 17–27. 24. Ontogeny of rat thymic macrophages. Phenotypic characterization and possible relationships between different cell subsets / V.A. Varas, J. Moreno, R. Sacedon, E. Jimenez, A.G. Zapata // Immunology. 1995. Vol. 85. P. 99–105. . 224 Вестник Чувашского университета. 2014. № 2 25. Ontogeny of the rat thymus micro-environment: development of the interdigitating cell and macrophage populations / A.M. Duijvestijn, T. Sminia, Y.G. Kohler, E.M. Janse, E.С Hoefsmit // Devel. Compar. Immunol. 1984. Vol. 8. № 4. P. 451–460. 26. Sarilova I.L., Sergeeva V.E., Smorodchenko A.T. Effect of orchiectomy on structures of the thymus expressing major histocompatibility complex class II molecules // Bul. Exp. Biol. Med. 2008. Vol. 145, № 1. P. 96–98. ГОРДОВА ВАЛЕНТИНА СЕРГЕЕВНА – ассистент кафедры медицинской биологии с курсом микробиологии и вирусологии, Чувашский государственный университет, Россия, Чебоксары ([email protected]). GORDOVA VALENTINA – assistant of Medical Biology Chair with the Microbiology and Virology Course, Chuvash State University, Russia, Cheboksary. ДЬЯЧКОВА ИРАИДА МИХАЙЛОВНА – кандидат биологических наук, доцент кафедры медицинской биологии с курсом микробиологии и вирусологии, Чувашский государственный университет, Россия, Чебоксары ([email protected]). DJACHKOVA IRAIDA – candidate of biological sciences, assistant professor of Medical Biology Chair with the Microbiology and Virology Course, Chuvash State University, Russia, Cheboksary ([email protected]). УДК 616–018.2–007.17:616–053.2–036.882–08 ББК Р733.552:Р733.419.4–5,3 Н.Х. ЖАМЛИХАНОВ, М.Н. ЛАРИНА, А.Г. ФЕДОРОВ ПРОБЛЕМА ДИСПЛАЗИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ В ИНТЕНСИВНОЙ ТЕРАПИИ ОСТРЫХ ОТРАВЛЕНИЙ ДЕТЕЙ РАННЕГО ВОЗРАСТА Ключевые слова: дисплазия соединительной ткани, острые полимедикаментозные отравления, дети раннего возраста. Изучены особенности клинического течения острых отравлений у детей раннего возраста с дисплазией соединительной ткани (ДСТ). Материалом для исследования послужили клинические наблюдения за 139 детьми в возрасте от 1 месяца до 3 лет. В ходе исследований подтверждена большая распространенность ДСТ среди детей, выявлены наиболее характерные фены ДСТ. Установлено, что степень выраженности ДСТ определяет тяжесть острого токсикогенного периода, частоту и характер осложнений в отдаленный посттоксический период, общую длительность заболевания. Авторами представлена программа метаболитной терапии на различных этапах лечения и реабилитации детей с проявлениями ДСТ. N. ZHAMLIHANOV, M. LARINA, A. FEDOROV THE PROBLEM OF CONNECTIVE TISSUE DYSPLASIA IN THE INTENSIVE CARE OF ACUTE POISONING OF INFANTS Key words: connective tissue dysplasia, acute polymedicalpoisoning, infant. The article examines the characteristics of the clinical course of acute poisoning of infants with connective tissue dysplasia (CTD). The material for the study is based on clinical examination of 139 children between the ages of 1 month till 3 years old. The studies confirmed a high prevalence of CTD among children, identified the most specific phenotypic traits of CTD. It is established that the severity of the CTD determines the severity of acute toxigenic period, frequency and nature of complications in remote post-toxic period, the total duration of the disease. The authors presented a program of metabolite therapy at various stages of treatment and rehabilitation of children with manifestations of CTD. Дисплазии соединительной ткани (ДСТ) являются достаточно распространенным явлением в детской популяции [1, 3]. Тем не менее точных сведений о частоте данной патологии нет. Это во многом обусловлено различными методологическими подходами и отсутствием единых критериев диагностики, а также сложностью точного определения характера и количества специфических диагностических признаков. Поэтому многие вопросы его дифференциальной диагностики, тактики ведения и прогноза остаются неразработанными. .