3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ
advertisement

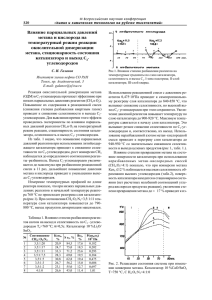
3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ ЦЕЛЬ РАБОТЫ: знакомство с основами ионометрии и изучение методов определения коэффициентов селективности ионометрических электродов. ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ: иономер, комбинированный мембранный электрод (либо комплект - измерительный электрод с электродом сравнения), пипетка, промывалка, измерительные сосуды, бумажные фильтры. ЭЛЕМЕНТЫ ТЕОРИИ И МЕТОД ЭКСПЕРИМЕНТА Ионоселективные электроды (ИСЭ) применяются для определения концентрации ионов в растворе. Метод анализа концентрации с помощью ИСЭ называется ионометрией. Среди современных аналитических методов ионометрия относится к числу весьма перспективных и позволяет быстро и с большой точностью определять концентрацию многих неорганических ионов. Широкие возможности применения, небольшой расход исследуемого вещества и простота работы с ионоселективными электродами способствовали их широкому распространению. Ионометрия используется в химии, медицине, биологии, почвоведении и геологии. Сущность метода ионометрии заключается в следующем. При погружении в исследуемый раствор двух датчиков, называемых электродами, между ними возникает электродвижущая сила, которая зависит от потенциалов каждого электрода. Один электрод является электродом сравнения; его потенциал имеет постоянную величину и не зависит от состава исследуемого раствора. Второй электрод является индикаторным; он называется ионоселективным, поскольку его потенциал изменяется пропорционально концентрации только тех ионов в растворе, для измерения которых он предназначен. Если в исследуемый раствор, содержащий ионы, поместить соответствующий индикаторный элек­трод, на его поверхности вследствие протекания самопро­извольной реакции возникает электрический потенциал, вели­чина которого зависит от кон­центрации определяемого иона. 1 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ Главной частью ионоселективного (индикаторного) электрода, определяющей его свойства, является элек­трохимическая мембрана. Это тонкий слой материала, который обладает селективностью, то есть избирательно взаимодействует только с одним видом ионов в растворе. По этой причине на обеих сторонах мембраны возникает двойной электрический слой, характеризуемый определенным потенциалом. Сторона мембраны, обращенная внутрь электрода, связана с металлическим выводом через жидкостное или твердофазное наполнение электрода, которое содержит внутренний электрод сравнения. При анализе методом ионометрии практически измеряют э.д.с. между внешним электродом сравнения и конструктивно встроенным в корпус ионоселективного электрода внутренним электродом сравнения (рис. 1). Возникающая между электродами э.д.с. обусловлена суммарным дейст­вием химических и электрохимических сил. Разность потенциалов индикаторного электрода и электрода сравнения является мерой концентрации определяемой частицы. С изменением концентрации частицы, принимающей участие в реакции на поверхности индикаторного электрода, меняется э.д.с. цепи. Электродную функцию, как впервые показал Нернст, можно описать с помощью линейного уравнения: E = E 0 + S∙lga, (1) где E - разность потенциалов между индикаторным электродом и элек­тродом сравнения, мВ; 2 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ Е 0 - константа, зависящая в основном от свойств электрода сравне­ния; а - активность иона ( в раз- бавленных растворах активность равна концентрации С, в иных случаях пропорциональна кон- центрации: а = γ∙С); S - нернстовский угловой коэффициент S = 2,3∙R∙T/Z∙F, мВ; R- газовая постоянная; T - температура, К; F - число Фарадея (заряд грамм-эквивалента ионов); Z - заряд иона. Случай, когда в растворе присутствуют ионы одного вида, является идеальным. При практическом анализе всегда надо учитывать влияние примесей. Электродно-активные примеси - вещества, вносящие, наряду с определяемым ионом, вклад в потен­циал ионоселективного электрода. Электродно-неактивные примеси - вещества, взаимодей-ствующие с опре­деляемым ионом и снижающие его активность (концентрацию) в измеряемом растворе. Влияние электродно-активных примесей можно приближенно описать уравнением Никольского, вытекающим из уравнения Нернста (1): 3 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ E = E 0 + S∙lg(aA + K∙aB ), (2) где а A - активность определяемого иона A; а B - активность мешающего иона; К - коэффициент селективности по отношению к иону В. Уравнение Никольского описывает ситуацию, когда ионы примеси дают вклад в образование потенциала на мембране по такому же механизму, как и определяемые ионы. Коэффициент селективности - это количественная характери­стика избирательности электрода. Чем меньше коэффициент селективности, тем выше избирательность электрода к ионам, для которых он предназначен. Если коэффициент селективности -3 , то опреде­ляемый ион составляет, например, 10 фиксируется в 1000 раз чувствительнее, чем мешающий ион. Это следует понимать -3 таким образом, что при К=10 можно определять концен­трацию ионов А в присутствии почти 1000-кратного избытка ионов В. Если ко­эффициент селективности К = 1 , то мешающие и определяемые ионы вносят одинаковый вклад в электродный потенциал. Если коэффициент селективности больше единицы, то мешающий ион определяется предпочтительнее, чем ион, для которого предназначался электрод. Такой вариант 4 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ реализуется почти у всех Са-электродов, которые к Zn ++ чувствительнее в 3 раза. В тех случаях, когда исследуемый раствор содержит мешающие ионы в очень большом количестве, предварительно понижают их концентрацию химическим осаждением, комплексообразованием или другими подобными операциями. Имеются две группы методов определения коэффициента селективности: первая - на основе отдельных растворов, один из которых содержит только ионы А, а другой только ионы В; вторая - определение с помощью смешанных растворов. Методы определения коэффициента селективности с помощью отдельных растворов 1. Метод биионных потенциалов Для простоты будем рассматривать однозарядные катионы. Если раствор содержит только ионы А (ав = 0), то уравнение Никольского принимает вид: E1 = E0 + S∙lgaA . (3) 5 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ Если раствор содержит только ионы В (аА), то E2 = E0 + S∙lgK + S∙lgaB. (4) Вычитая из уравнения (4) уравнение (3), получаем Е2 – E1 = S∙lgK + S∙lgaB - S∙lgaA. (5) Если в отдельных растворах аА = aB, то из (5) имеем lgK = (Е2 – E1)/S, откуда К = 10 ΔE/S, (6) 6 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ где ΔЕ = Е2 – E1. Для вычисления К по уравнению (6) требуется построить зависимости э.д.с. от концентрации в отдельных растворах основного и постороннего ионов в одной системе координат. Выполняя условие аА = aB, проводим прямую, пересекающую обе зависимости, перпендикулярно оси абсцисс. Проекции точек пересечения на ось ординат дадут потенциалы Е 2 и E1 (рис. 2). 2. Метод равных потенциалов Если E1 = Е2, то получим lgaA = lg(K∙aB), откуда К = аА/аB, (7) то есть коэффициент селективности в этом случае равен отношению активностей ионов в отдельных растворах, в которых электрод имеет одинаковый потенциал. Выбрав значение E (рис. 3), можно найти соответствующие ему концентрации двух растворов и рассчитать K по формуле (7). 7 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ Поскольку коэффициент селективности сам является функцией концентраций определяемых и мешающих ионов, то рассмотренные методы могут применяться только для быстрой ориентировочной оценки. Эти методы не дают точной величины коэффициента селективности, так как практически всегда анализируют смеси ионов, а не отдельные растворы. Методы определения коэффициента селективности с помощью смешанных растворов 1. Метод постоянного фона Метод основан на измерении потенциалов в смешанных растворах с переменной концентрацией основного иона и постоянным содержанием (фоном) постороннего иона. По мере уменьшения концентрации основного иона происходит увеличение влияния постороннего иона. Это значит, что электрод приобрел функцию постороннего иона и потерял функцию основного. Точка пересечения аппроксимирующих прямых нернстовского (прямолинейного) участка кривой и горизонтальной прямой (рис. 4) отвечает условию ЕА = ЕВ , и по этой точке определяют значение lg aA. В этом случае коэффициент селективности может быть рассчитан по формуле (7). Этот метод наиболее надежен при оценке электродной селективности, поскольку условия, при которых определяется коэффициент селективности, ближе всего к реальным. 2. Метод переменного фона 8 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ В основе метода - измерения э.д.с. в растворе А при последовательном добавлении известного объема чистого раствора В. Коэффициент селективности определяется из следующей формулы: K = (10ΔE/S - 1)(aA/aB), (8) где ΔE = EB - EA; ЕА - э.д.с. в растворе основного иона; ЕB - э.д.с. в смешанном растворе. К определяют графически по зависимости величины (10AE/S - l)∙aA от ав. Этот способ удобен при невысокой селективности электрода. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ 9 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ 1. Подключить электроды, как показано на рис.1. При проведении измерений каждый раствор наливать в новый измерительный сосуд. Ориентировочное время установления показаний 0,5 1,5 мин. 2. Провести измерения э.д.с для трех серий растворов: отдельного раствора А, отдельного раствора В и смешанного раствора (A + В). Электроды погружать в раствор на глубину не более 2-3 мм от поверхности. Для смены раствора электроды извлечь и осушить, снимая капли фильтровальной бумагой, касаясь электрода только фильтром. ( Не трогать мембрану пальцами! ) Для каждого раствора измерение э.д.с. провести два раза и вычислить среднее значение. Значения активностей указаны на сосудах с растворами. Результаты измерений округлить до 1 мВ и занести в табл.1. Таблица 1 Результаты измерений э.д.с.(мВ) в исследуемых растворах: Активность, моль/л. 10 -5 10 -4 10 -3 10 -2 10 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ 10 -1 Э.д.с. отдельного раствора А, мВ 11 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ Э.д.с. отдельного раствора B, мВ 12 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ 13 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ Э.д.с. смешанного раствора (А+В), мВ 14 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ 1. Для определения погрешности измерений провести 5-7 измерений э.д.с. в контрольном растворе, осушая электроды после каждого измерения. Результаты измерений занести в табл. 2. Таблица 2 Результаты измерений э.д.с. (мВ) в контрольном растворе 1 2 15 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ 3 4 5 6 7 Контрольный раствор 16 / 17 3715 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ИОНОМЕТРИЧЕСКИХ ЭЛЕКТРОДОВ 1. Построить графики зависимости э.д.с. от активностей растворов (рис. 2). По графикам для отдельных растворов рассчитать коэффициент селективности методом биионных потенциалов (R = 8,31 Дж/(моль • К), Т = t°С + 273, F = 96500 Кл/моль). Величины а B и Z указаны на установке. Значение t °C определить по термометру. 2. Рассчитать коэффициент селективности методом равных потенциалов (рис. 3). 3. Построить график зависимости э.д.с. от активностей для смешанного раствора (рис.4) и рассчитать значение коэффициента селективности методом постоянного фона. 4. Используя формулу расчета погрешности для прямых измерений, рассчитать погрешность измерений э.д.с. по результатам определений в контрольном растворе. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. 2. 3. 4. 5. 6. 7. Сущность метода ионометрии. Схема установки для измерения э.д.с. Устройство ионоселективного электрода. Уравнение Нернста. Понятие коэффициента электродной селективности. Уравнение Никольского. Методы определения коэффициента селективности в отдельных растворах. Методы определения коэффициента селективности в смешанных растворах. 17 / 17