Разработка наноразмерного устройства для одностадийной
реклама

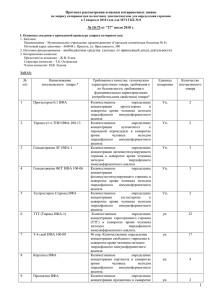
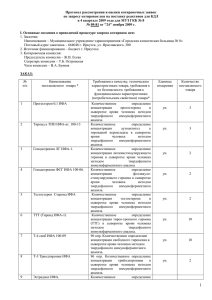
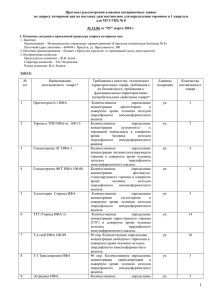
НОВЫЙ МЕТОД ОДНОСТАДИЙНОЙ ДЕТЕКЦИИ АНТИГЕН-АНТИТЕЛЬНОГО СВЯЗЫВАНИЯ Маракасова Е.С., Шибаева А.В., Белоусова Ж.В., Валиуллин Л.Ф., Малышева Е.В., Дудорова М.Г., Осипенкова О.В., Гусева М.А., Елагина Е.М. Московская государственная академия ветеринарной медицины и биотехнологии им. К.И. Скрябина, Москва, Россия ФГУ «Федеральный центр токсикологической и радиационной безопасности животных», Казань, Татарстан, Россия Набережночелнинский государственный педагогический институт, Набережные Челны, Татарстан, Россия Курский государственный университет, Курск, Россия Учреждение российской академии медицинских наук Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН, МО, Россия Смоленский государственный университет, Смоленск, Россия В течение многих лет антиген-антительное распознавание в варианте твердофазного иммуноферментного анализа, в частности, с использованием моноклональных антител, повсеместно применяется в диагностике инфекционных заболеваний и служит простым и универсальным средством обнаружения широкого круга самых разнообразных химических соединений в составе различных сложных смесей. По данным Роспотребнадзора РФ в нашей стране ежегодно производится и потребляется более 90 млн. наборов для тИФА на сумму более 20 млрд. руб. Однако, для разработки такого типа тестов необходима оборудованная лаборатория. В последние время получили распространение такие разновидности иммуноферментного анализа, как гомофазные и «быстрые» тесты, которые могут быть разработаны вне оборудованных лабораторий. Эти тесты нашли широкое применение при выявлении химических загрязнителей, антибиотиков, психотропных и других лекарственных средств, идентификации химического состава материалов органического происхождения. Одними из отличительных черт гомофазных тестов являются быстрота получения самих тестов и результата, а также независимость этого типа иммунохимических тестов от приборного оснащения. Перечисленные преимущества «быстрых» тестов вызывают большой интерес технологов предприятий, природоохранных и правоохранительных организаций, а также индивидуальных потребителей. Не смотря на то, что тесты данного типа уже выпускаются в нашей стране, до настоящего времени их широкое применение было ограничено недостаточной чувствительностью, делающей их непригодными для большинства задач медицинской и ветеринарной диагностики. Целью данной работы было разработать универсальный наноразмерный набор, пригодный для моментальной одностадийной детекции антиген-антительного связывания. В соответствии с данной целью были поставлены следующие задачи: полученный набор должен быть 1) совместим с широким спектром уже известных и перспективных моно- и поликлональных антител, 2) обеспечивать возможность разработки диагностикумов силами широкого круга лабораторий. 3) Стоимость производства и применения нового набора не должна превышать стоимости существующих «быстрых» тестов. 4) Набор не должен уступать современным системам твердофазного ИФА III поколения по чувствительности. Разработанный нами метод основан на новом физическом принципе: выявлении конформационной перестройки константной области иммуноглобулина в результате связывания антигена. Молекулярный наносенсор, позволяющий визуализировать перемещение доменов константной области антитела, был получен на основе слияния двух бифункциональных белков, гены которых были экспрессированы в клетках E. coli в растворимой форме. Способность компонента C1q связываться с участком домена CH2, экспонируемым в раствор в результате антиген-зависимой перестройки иммуноглобулина была основным фактором для слияния. Именно это связывание лежит в основе передачи сигнала на начало активации комплемента с вновь образованными иммунными комплексами. Детекцию сигнала проводили следующими способами: 1) За счет цветного ферментативного теста с ферментом -галактозидазы - накопление сигнала и оптимизация чувствительности в предлагаемой схеме достигалась за счет того, что субстрат -галактозидазы Х-gal – растворим и бесцветен, а продукт его расщепления имеет синий цвет и не растворим. 2) За счет переноса лучистой энергии между двумя флуоресцирующими сенсорами при их сближении (FRET - fluorescence resonance energy transfer). В этом случае комплекс моноклонального антитела формировался не с двуцепочечным производным галактозидазы, а только с одной ее цепью, содержащей лектин (белок 1). Репортерный белок 2 был получен и очищен отдельно. Полученный наноразмерный молекулярный сенсор позволяет визуализировать перемещение доменов константной области антитела, вызываемое связыванием антигена в активных центрах антител. В дальнейшем предлагается использовать сенсор для препаративного получения комплексов с антителом против какого-либо модельного гаптена и в модельных экспериментах по отработке схемы кинетического контроля реассоциации -галактозидазы. Основным преимуществом разработанного метода детекции является возможность использования таких традиционных подходов и объектов белковой инженерии, как -галактозидазы E. coli, что практически исключает сложности и риски, связанные низкими выходами белка и необходимостью рефолдинга белков in vitro. Это обусловлено возможностью получения рекомбинантных производных галактозидазы E. coli непосредственно в растворимой форме с высокими выходами. Использование аффинных тагов (6His) позволило провести хроматографию в мягких условиях, исключающих разрушение неустойчивого комплекса. Высокая аффинность лектина VIP36 к пентаманнозному кору олигасахаридной цепи иммуноглобулина позволила исключить сложности при получении и очистке комплекса молекулярного сенсора с антителом. Разработка универсального белка, дающего прочные комплексы с полисахаридными группировками иммуноглобулинов и обладающего ферментативной активностью, может представлять самостоятельную ценность для создания систем иммуноферментного анализа. На основании полученных данных предлагается разработать серию белков, различающихся длиной и аминокислотным составом линкера, которые могут быть испытаны в практических экспериментах по конструированию систем быстрой иммунохимической детекции. Полученные результаты представляют самостоятельную ценность, которые планируется защитить патентами. Настоящая работа выполнена при поддержке Государственных контрактов № 14.740.11.0184, №П807, №П1253, №П1263, № 16.740.11.0027, №14.740.11.0123, № 14.740.11.0122; проектов в рамках мероприятия 1.2.2 шифры заявок (2010-1.2.2-203-002-038, 2010-1.2.2-207-003-082, 2010-1.2.2-141-022-040, 2010-1.2.2-141-022-018); мероприятия 1.3.1 шифры заявок (2010-1.3.1-207-003-043, 20101.3.1-203-002-017, 2010-1.3.1-203-002-018, 2010-1.3.1-220-006-021); проектов № 2.1.1/2468, № 2.1.1/4510, № 2.1.1/2516 ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009 – 2013 годы.