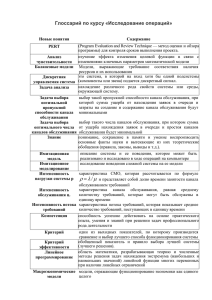
Молекулярное моделирование потенциал
реклама

РОССИЙСКАЯ АКАДЕМИЯ НАУК Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН На правах рукописи Коркош Вячеслав Сергеевич Молекулярное моделирование потенциал-управляемых натриевых каналов эукариот и их взаимодействия с лигандами Специальность 03.03.01 – физиология Диссертация на соискание ученой степени кандидата биологических наук Научный руководитель: доктор биологических наук Тихонов Д.Б. Санкт-Петербург 2015 Оглавление Список сокращений ...................................................................................................................... 4 Общая характеристика работы .................................................................................................... 5 Глава 1. Обзор литературы .......................................................................................................... 9 1.1. Ионные каналы ................................................................................................................... 9 1.1.1. Общие сведения ........................................................................................................... 9 1.1.2. Потенциал-управляемые ионные каналы ................................................................ 11 1.1.3. Лиганд-управляемые ионные каналы ...................................................................... 12 1.1.4. Каналы, активируемые растяжением и теплом ...................................................... 13 1.2. Молекулярная структура ионных каналов как основа классификации ...................... 14 1.2.1. P-loop каналы ............................................................................................................. 14 1.2.2. Потенциал-управляемые натриевые каналы........................................................... 19 1.3. Фармакология ионных каналов ...................................................................................... 22 1.3.1. Фармакология потенциал-управляемых Na-каналов. ............................................ 22 1.3.2. Конотоксины .............................................................................................................. 35 1.3.3. µ-конотоксины и Na-каналы..................................................................................... 40 Глава 2. Методы .......................................................................................................................... 42 2.1. Методы исследования ионных каналов ......................................................................... 42 2.1.1. Экспериментальные методы ..................................................................................... 42 2.1.2. Рентгеноструктурный анализ ................................................................................... 42 2.1.3. Теоретические методы .............................................................................................. 44 2.1.4. Молекулярная динамика ........................................................................................... 48 2.1.5. Метод Монте-Карло .................................................................................................. 50 2.2. Параметры и методы расчётов, использованные в работе........................................... 51 2.2.1. Расчёт энергетически оптимальных конформеров методами молекулярной механики ............................................................................................................................... 51 2 2.2.2. Гомологическое моделирование и системы ограничителей ................................. 52 2.2.3. Анализ лиганд-рецепторного взаимодействия ....................................................... 54 2.3. Программное обеспечение .............................................................................................. 56 2.3.1. ZMM ............................................................................................................................ 56 2.3.2. Прочие......................................................................................................................... 57 Глава 3. Результаты и их обсуждение. ...................................................................................... 58 3.1. Проблемы гомологического моделирования................................................................. 58 3.1.1. Выбор выравнивания порообразующих спиралей Р-loop каналов ....................... 59 3.1.2. Анализ стабилизаторов в структурах каналов ........................................................ 62 3.1.3. Выбор выравнивания S5 и S6 спиралей в гомологических моделях.................... 68 3.1.4. Заключение ................................................................................................................. 71 3.2. Стерические и электростатические факторы блокады ионных каналов .................... 71 3.2.1. Изучение возможных способов связывания лиганда............................................. 74 3.2.2. Распределение ионов в области селективного фильтра ......................................... 77 3.2.3. Влияние Pl1 на энергию связи ионов....................................................................... 79 3.2.4. Заключение ................................................................................................................. 81 3.3. Блокада натриевых каналов µ-конотоксинами ............................................................. 82 3.3.1. Выбор модели ............................................................................................................ 82 3.3.2. Связывание GIIIA ...................................................................................................... 92 3.3.3. Связывание PIIIA ....................................................................................................... 99 3.3.4. Связывание KIIIA .................................................................................................... 104 3.3.5. Механизм неполного блока .................................................................................... 110 Общее заключение .................................................................................................................... 122 Выводы....................................................................................................................................... 124 Список литературы ................................................................................................................... 125 3 Список сокращений TRP – транзиторный рецепторный потенциал nAChR – никотиновый ацетилхолиновый рецептор TTX – тетродотоксин STX – сакситоксин µCTX – мю-конотоксин ЛА – локальные анестетики PyR – пиретроидный рецептор BTX – батрахотоксин МСМ – Монте-Карло минимизация МД – молекулярная динамика NMDA – N-метил-D-аспартат AMPA - α-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота СО – среднеквадратическое отклонение Pl1 - 2-(4-бромфенил)-1-(5-(4-хлорфенил)-1Н-имидазол-2-ил)этанамин) 4 Общая характеристика работы Актуальность проблемы. Белки ионных каналов, обеспечивающие пассивный транспорт ионов, являются важными компонентами клеточных мембран. Активность потенциал-чувствительных натриевых и калиевых каналов лежит в основе генерации и распространения потенциала действия в нейронах. Синаптические ионные каналы, активируемые нейромедиаторами, необходимы для передачи возбуждающих и тормозных сигналов между нейронами. Многие модуляторы клеточного метаболизма также оказывают свое действие через ионные каналы. Поскольку каналообразующие белки являются трансмембранными, их внеклеточные участки и сама пора канала доступны для действия внеклеточных химических агентов, как естественных, так и искусственных. Изучение молекулярных механизмов ионных каналов необходимо для медицины, фармакологии. Несмотря на наличие огромного арсенала лекарственных препаратов, смертность от заболеваний сердечно-сосудистой системы, например, артериальной гипертонии, постоянно растет. Одной из основных проблем современной фармакологии является недостаток информации о молекулярных основах действия препаратов, то есть о клеточных и субклеточных структурах, участвующих в патологических процессах. Большая проблема заключается еще и в том, что «фармакологическая мишень» так же неисчерпаема, как «атом». Как только исследователь установит, что мишенью является, например, потенциал-управляемый натриевый канал, встает вопрос о механизмах действия, зависимости активности препарата от уловий работы канала и т.д. Чтобы иметь возможность предсказать поведение тех или иных препаратов в физиологических и патологических условиях необходимо изучать структуру ионных каналов и механизмы их взаимодействия с лигандами на молекулярном уровне. Современные научные подходы, такие как рентгеноструктурный анализ, методы молекулярной биологии (например, точечные мутации), а также теоретические методы, включая молекулярное моделирование, дают возможность проводить такой анализ 5 Натриевые каналы играют важную роль во многих процессах в организме, например, в генерации потенциала действия. Неудивительно, что фармакология ионных каналов является одним из наиболее важных предметов изучения на данный момент. Хорошо известны такие токсины как тетродотоксин, локальные анестетики, батрахотоксин, однако механизмы действия лигандов изучены не до конца. Отсутствие рентгеновских структур эукариотических натриевых каналов можно восполнить при помощи теоретических методов. Молекулярное моделирование позволяет объединить разрозненные экспериментальные данные в одной модели, которая может не только объяснить имеющиеся экспериментальные данные, но и имеет предсказательную силу. Такие модели позволяют исследователям точнее направлять свои усилия и создавать подходящие фармакологические агенты. Одним из наиболее интересных классов лигандов натриевых каналов являются µконотоксины. Они особенно интересны тем, что некоторые нативные конотоксины, а также мутанты, созданные на основе конотоксинов, вызывают эффект неполного блока в натриевых потенциал-управляемых каналах. Данный эффект интересен с точки зрения разработки новых лигандов, поскольку не приводит к необратимым последстви ям для организма. Однако на данный момент не существует структурного объяснения для этого эффекта, что затрудняет работу по созданию новых агентов. Целью работы было изучение методами молекулярного моделирования строения эукариотических натриевых каналов, а также механизмов ионной проницаемости и блокады каналов. В рамках этой цели были поставлены следующие задачи: Изучение роли межсегментных конткатов в стабилизации пространственной укладки ионных каналов Изучение роли стерических и электростатических факторов при блокаде натриевых каналов Построение гомологической модели поры эукариотического натриевого канала Моделирование связывания µ-конотоксинов с эукариотическим натриевым каналом Моделирование эффекта неполного блока эукариотических натриевых каналов µ-конотоксинами 6 Научная новизна. В результате проведённых исследований получена модель потенциал-управляемого натриевого ионного канала Nav1.4, позволяющая объяснить экспериментальные данные по взаимодействию с µ-конотоксинами. Впервые предложено объяснение возникновению остаточных токов при неполной блокаде поры канала токсинами. Также в рамках работы впервые показаны эволюционные изменения в структурных мотивах ионных каналов, приводящие к пространственным различиям. Научно-практическая значимость работы. Полученные в работе данные о строении, механизмах проводимости и блокады натриевых каналов объясняют широкий спектр экспериментальных данных. Модели, полученные в результате работы, могут использоваться для дизайна новых препаратов, имеющих медицинское значение. Модель ионной проводимисти позволяет целенаправленно подходить к созданию качественно новых лигандов, обеспечивающих неполный блок канала, что открывает новые перспективы в области фармаколонии. Положения, выносимые на защиту: Эукариотические потенциал-управляемые ионные каналы в области поры аналогичны по структуре прокариотическим натриевым каналам. В частности, структуру наружного вестибюля образуют восемь спиральных участков, что отличает эти каналы от других представителей структурного семейства, например, калиевых каналов, содержащих лишь четыре спиральных участка в области наружного вестибюля. Механизм блокады преимущественно положительно потенциал-управляемых электростатическую заряженных групп натриевых каналов имеет природу. Он состоит в связывании токсина с отрицательно заряженными аминокислотами во внешнем вестибюле канала, участвующими в обеспечении проводимости. При неспособности токсина связать все четыре отрицательно заряженные группы наблюдается эффект неполной блокады. 7 Апробация работы. Результаты работы докладывались на следующих конференциях: IV съезд физиологов СНГ (Дагомыс, Россия, 2014), Biophysical Society 58 Annual Meeting (San Francisco), 11-й конгресс «Нейронаука для Медицины и Психологии » (Судак, Россия, 2015). Публикации. По теме диссертации опубликовано 4 статьи в рецензируемых журналах и 3 тезисов докладов. Структура и объём диссертации. Диссертация изложена на 135 страницах машинописного текста и состоит общей характеристики работы, обзора литературы по исследуемой теме – глава 1, описания методики – глава 2, описания результатов исследования и их обсуждения – глава 3, заключения – глава 4, выводов и списка литературы, который включает 204 источника (из них 202 иностранных). Работа иллюстрирована 53 рисунками и 7 таблицами. 8 Глава 1. Обзор литературы 1.1. Ионные каналы 1.1.1. Общие сведения Согласно теории Ходжкина-Хаксли модель возбудимой мембраны предполагает регулируемый перенос ионов через мембрану (Hille, 1992, Sperelakis, 1995, Soria and Cenã , 1998, Nicholls, 2003, Camerino, Tricarico et al., 2007, Siegel, 2011). Однако непосредственный переход иона через липидный бислой весьма затруднен. Очевидно, что в мембране должны существовать некоторые специальные структуры, проводящие ионы. Такие структуры были найдены и названы ионными каналами (рисунок 1). Каналы могут быть выделены из различных объектов: плазматической мембраны клеток, постсинаптической мембраны мышечных клеток и т.д. Известны также ионные каналы, образованные антибиотиками (Nicholls, 2003). К основным свойствам ионных каналов относятся: селективность; независимость работы отдельных каналов; дискретный характер проводимости; зависимость параметров каналов от мембранного потенциала. Селективностью называют способность ионных каналов избирательно пропускать ионы какого-либо одного типа. Еще в первых опытах на аксоне кальмара было обнаружено что ионы Na+ и К+ по-разному влияют на мембранный потенциал. Ионы К + регулируют потенциал покоя, а ионы Na+ - ответственны за формирование потенциала действия (Hodgkin, Huxley et al., 1952) . В модели Ходжкина-Хаксли это описывается путем введения независимых калиевых и натриевых ионных каналов. Предполагалось, что первые пропускают только ионы К +, а вторые - только ионы Na+. Измерения показали, что ионные каналы обладают очень высокой селективностью по отношению к катионам (катион селективные каналы) либо к анионам (анион-селективные каналы) (Hodgkin and Huxley, 1952). В то же время через катион-селективные каналы способны проходить различные катионы. Например, для Na+-кaнала калиевый ток в 20 раз меньше натриевого (Hille, 1992). 9 Независимость работы отдельных каналов. Прохождение тока через отдельный ионный канал не зависит от того, идет ли ток через другие каналы. Например, К +-каналы могут быть включены или выключены, но ток через Nа +-каналы не меняется (Aldrich, 1985). Влияние каналов друг на друга происходит опосредованно: изменение проницаемостей каких-либо каналов (например, натриевых) меняет мембранный потенциал, а уже он влияет на токи прочих ионных каналов. Дискретный характер проводимости ионных каналов. Ионные каналы представляют собой субъединичный комплекс белков, пронизывающий мембрану (K ew and Davies 2010). В центре его существует пора, сквозь которую могут проходить ионы. Результаты экспериментов, выполненных на различных ионных каналах, показали, что проводимость ионного канала дискретна, и он может находиться в двух состояниях: открытом или закрытом. Переходы между состояниями происходят в случайные моменты времени и подчиняются статистическим закономерностям (Kew and Davies, 2010). Зависимость параметров канала от мембранного потенциала. Ионные каналы нервных волокон чувствительны к мембранному потенциалу, например, натриевый и калиевый каналы аксона кальмара. Это проявляется в том, что после начала деполяризации мембраны соответствующие токи начинают изменяться. Ион-селективный канал имеет сенсор - некоторый элемент своей конструкции, чувствительный к действию электрического поля. При изменении мембранного потенциала меняется величина действующей на него силы, в результате эта часть ионного канала перемещается и меняет вероятность открывания или закрывания ворот - своеобразных заслонок, действующих по закону "всё или ничего" (Hille, 1978). Изучение ионных каналов в мембранах яляется одной из важнейших задач современной биофизики. Начиная с 90-х, исследования в рамках молекулярной генетики, в сочетании с методом локальной фиксации потенциала (пэтч-кламп) и другими методиками, значительно расширили наши знания об ионных каналах. Были выделены и клонированы гены, кодирующие натриевые, калиевые и многие другие типы каналов. Было обнаружено более чем 400 различных генов, кодирующих ионные каналы, чего никак нельзя было ожидать исходя из ранних исследований функций ионных каналов. 10 Чтобы понять значимость такого количества различных генов ионных каналов, проводились многочисленные исследования с помощью пэтч-клампа и других физиологических методов. Подобные исследования обнаружили большое количество потенциал-управляемых ионных каналов, которые отвечают на мембранный потенциал во многом так же, как натриевые и калиевые каналы, которые лежат в основе потенциала действия. Но существуют и другие типы каналов. Существуют каналы, активируемые химическими агентами (лигандами) с внеклеточной или с внутриклеточной стороны мембраны (Nicholls, 2003). Другие каналы могут реагировать на механические воздействия или изменения температуры. Таким образом, хотя основные электрические сигналы нервной системы относительно стереотипны, белки, ответственные за генерацию этих сигналов, весьма разнообразны, тем самым обеспечивая специализированные сигнальные свойства нейронных клеток, образующих нервную систему. 1.1.2. Потенциал-управляемые ионные каналы На данный момент обнаружены потенциал-управляемые ионные каналы, которые выборочно проницаемы для каждого из основных физиологических ионов – натрия, калия, кальция и хлора (Purves, 2012). Кроме того, было обнаружено множество различных генов для каждого типа потенциал-управляемых ионных каналов. Примером может служить обнаружение 10 человеческих генов натриевых каналов. Эти гены натриевых каналов (SCN гены) кодируют белки, различающиеся по структуре, свойствам и распространению в определённых тканях. Кроме быстро инактивируемых натриевых каналов, обнаруженных Ходжкином и Хаксли в аксоне кальмара, были обнаружены потенциал-чувствительные натриевые каналы, которые не инактивируются (Bendahhou, Cummins et al., 1999). Как и следовало ожидать, этот канал производит потенциалы действия большой продолжительности и является мишенью для местных обезболивающих, таких как бензокаин и лидокаин (Khodorova, Meissner et al., 2001). В некоторых нейронах, потенциал-управляемые кальциевые каналы порождают потенциалы действия, как и потенциал-чувствительные натриевые каналы (Catterall, Perez11 Reyes et al., 2005). В других нейронах кальциевые каналы контролируют форму потенциалов действия, сгенерированных преимущественно натриевыми каналами (Van Goor, Krsmanovic et al., 1999). В целом, воздействуя на внутриклеточную концентрацию кальция, активность кальциевых каналов регулирует огромный диапазон биохимических процессов внутри клеток (Catterall, Perez-Reyes et al., 2005). Одним из важных процессов, регулируемых потенциал-чувствительными кальциевыми каналами является секреция нейромедиаторов в синапсах. Но всё же наиболее крупным и разнообразным классом потенциал-управляемых ионных каналов являются калиевые каналы. На данный момент известно около 100 генов калиевых каналов, которые разбиты на несколько групп, значительно различающихся по активационным, пропускным и инактивационным свойствам. Некоторые инактивируются в течение минут, как в случае калиевых каналов аксона кальмара, изученного Ходжкином и Хаксли (Hodgkin and Huxley, 1952, Hodgkin, Huxley et al., 1952). Другие инактивируются в течение миллисекунд, что типично для большинства потенциал-управляемых натриевых каналов. Пожалуй, наиболее важную роль калиевые каналы играют в регуляции мембранного потенциала покоя. Как минимум две семьи калиевых каналов, которые открыты при значительном отрицательном потенциале на мембране, вносят вклад в установление мембранного потенциала покоя. Наконец, было обнаружено несколько типов потенциал-управляемых хлорных каналов. Эти каналы находятся в нейронах, контролируя возбудимость и внося вклад в мембранный потенциал покоя (Jentsch, Günther et al., 1995). 1.1.3. Лиганд-управляемые ионные каналы Другой класс ионных каналов реагирует на химические сигналы (лиганды), но не реагирует на изменения в мембранном потенциале (Purves, 2012). Наиболее важным из этих лиганд-управляемых ионных каналов в нервной системе является класс каналов, активируемых связыванием нейромедиаторов (Sobolevsky, Rosconi et al., 2009, Lee, Lu et al., 2014). В то время как потенциал-управляемые ионные каналы обычно пропускают только один вид ионов, каналы, активируемые внеклеточными лигандами, обычно менее избирательны, позволяя двум и более типам ионов проходить через пору канала (Green, Lambert et al., 1996). 12 Другие лиганд-управляемые каналы чувствительны к химическим сигналам, возникающим в цитоплазме нейронов и могут быть избирательны к конкретным ионам, таким как калий или хлор, или же могут быть проницаемы для всех физиологических катионов. Примерами каналов, отвечающих на внутриклеточные воздействия являются кальций-активируемые калиевые каналы, катионные каналы, управляемые циклическими нуклеотидами и кислотно-чувствительные ионные каналы (Bassler, Ngo-Anh et al., 2001, Craven and Zagotta, 2006). Основная функция таких каналов - это преобразование внутриклеточных химических сигналов в электрические сигналы. Классическим примером являются каналы, управляемые циклическими нуклеотидами в светочувствительных клетках сетчатки (Becirovic, Nguyen et al., 2014). Хотя многие из лиганд-управляемых ионных каналов находятся во внешней клеточной мембране, некоторые находятся в мембранах внутриклеточных органелл, таких как митохондрии или эндоплазматический ретикулум. Некоторые из этих внутриклеточных каналов выборочно проницаемы для кальция и регулируют выход кальция из цистерн эндоплазматического ретикулума в цитоплазму, где этот вторичный передатчик может в свою очередь запускать набор клеточных ответов (Pinto, Kihara et al., 2015). 1.1.4. Каналы, активируемые растяжением и теплом Существуют также классы ионных каналов, которые отвечают на изменение температуры или на деформацию мембраны. Температурно-чувствительные ионные каналы, такие как некоторые члены семейства каналов TRP (Hellmich and Gaudet, 2014, Yue, Xie et al., 2015), вносят вклад в чувствительность к боли и температурам, а также участвуют в воспалительных процессах. Эти каналы зачастую специализируются на определённых температурах, а некоторые активируются при охлаждении. Механо-чувствительные ионные каналы реагируют на механические изменения в плазматической мембране и лежат в основе рецепторов растяжения и нейромышечных рефлексов растяжения (Delmas and Coste, 2013). Одна из специфических форм таких каналов играет ключевую роль в механизме восприятия звука (Delmas and Coste, 2013). Подытоживая, стоит отметить, что огромное разнообразие ионных каналов позволяет нейронам генерировать электрические сигналы в ответ на изменения в 13 мембранном потенциале, синаптическую передачу и внутриклеточные вторичные передатчики. Таким образом, ионные каналы играют ключевую роль в функционировании нервной системы в целом. 1.2. Молекулярная структура ионных каналов как основа классификации До последнего времени большая часть информации о структуре каналов была получена не напрямую, а посредством изучения свойств этих белков. Существующие классификации каналов основаны именно на таких признаках. Один из подходов к классификации основан на том, чтобы объединять ионные каналы в зависимости от способа регуляции их действия. Именно так систематизированы ионные каналы в предыдущих разделах. Другой вариант заключается в разделении ионных каналов в соответствии с основным проводимым ионом, однако оба варианта имеют очевидные недостатки. Например, nAChRs (Itier and Bertrand, 2001) проводит ионы натрия, как и потенциалуправляемые натриевые каналы. Однако он в корне отличается от них по механизму активации, а также по аминокислотной последовательности. Другой пример, который иллюстрирует необходимость создания новой системы классификации, состоит в том, что некоторые каналы, управляемые циклическими нуклеотидами (Kaupp and Seifert, 2002), настолько гомологичны по последовательности потенциал-управляемым каналам, что могут быть эволюционно ближе к ним, чем к лиганд-управляемым каналам. Ещё одним примером служит то, что глутаматные рецеторы (Traynelis, Wollmuth et al., 2010), которые часто относят к семейству лиганд-управляемых ионных каналов, не имеют никакого сходства последовательностей и, следовательно, вероятно, не связаны эволюционно с другими каналами этой группы. Таким образом, хотя ионные каналы выполняют одну главную функцию, они обладают различным строением и эволюционным происхождением, поэтому имеет смысл выделять семейства каналов, гомологичных друг к другу, то есть имеющих общее эволюционное происхождение и схожие трёхмерные структуры. 1.2.1. P-loop каналы Суперсемейство так называемых “P-loop” каналов включает потенциал-управляемые калиевые, натриевые, кальциевые каналы, каналы, активируемые 14 циклическими нуклеотидами, каналы ионотропных рецепторов глутамата, и TRPV каналы (Zhorov and Tikhonov, 2004, Yue, Xie et al., 2015). Несмотря на огромное разнообразие свойств, функций и механизмов активации, все эти каналы имеют главную отличительную особенность - домен, образующий ионную пору в мембране, который формируется четырьмя субъединицами (или псевдосубъединицами в случае эукариотических натриевых и кальциевых каналов). От каждой субъединицы в этом домене присутствует две трансмембранных α-спирали (S5 и S6 у потенциал-управляемых каналов), соединенных так называемой Р-петлей (P-loop), которая включает аминокислоты, образующие селективный фильтр (рисунок 1). Наличие этой петли и послужило основанием для классификации – все разнородное семейство называют p-loop каналами (Zhorov and Tikhonov, 2004). Именно в петле, которая формирует самую узкую часть канала расположены остатки, образующие так называемый селективный фильтр – структуру, обеспечивающую выборочное пропускание конкретных ионов. Как и следовало ожидать, аминокислотный состав селективных фильтров различен для каналов, которые пропускают разные ионы. Рисунок 1. Трёхмерная структура p-loop канала Kv1.2. Цилиндры отображают спиральные участки канала. Оранжевым показаны участки p-спирали (p-loop), голубым – внутренние спирали (inner helices, s6), жёлтым – внешние спирали (outer helices, s5). 15 Другие домены этих каналов отвечают за активацию потенциалом или лигандом (рисунок 2). Вероятно, порообразующие домены всех этих каналов имеют общего предшественника, однако судить об их эволюции крайне сложно в силу низкого подобия последовательностей. Рисунок 2. Схематическое представление канала из суперсемейства p-loop. Четыре домена с S1 до S4 отвечает за потенциал-чувствительность, в то время как S5 и S6, вместе с соединяющей их p-петлёй образуют непосредственно пору канала. В последние десятилетия более точная информация о структурных особенностях ионных каналов получается посредством рентгеновской кристаллографии. Фактически, для ряда представителей этого суперсемейства сама идея гомологии пришла не из сопоставления последовательностей, а из структурных данных. К примеру, каналы TRPV1 и Kv1.2 относятся к суперсемейству Р-loop каналов, однако, как видно из выравнивания, они обладают весьма низкой гомологией в области селективного фильтра (рисунок 3). В то 16 же время, наложение рентгеновских структур показывает, что каналы обладают схожей топологией в области поры (рисунок 3). Для удобства работы с белками, имеющими различную нумерацию аминокислотных остатков, использовалась универсальная индексация, предложенная Жоровым и Тихоновым. В данной индексации для обозначения аминокислотного остатка используется буквенное обозначение сегмента (“o” – outer helix, соответствующая сегменту S5, “i" – inner helix, соответствующая сегменту S6, “p” – Р-loop, внутримембранная петля между S5 и S6) и номер остатка внутри сегмента. Это связано с тем, что при работе с большим количеством каналов, выравнивание последовательностей неизбежно ведёт к возникновению большого разброса в нумерации, что затрудняет анализ. Введение универсальной индексации позволяет избежать этих проблем и облегчает работу с множественным выравниванием, особенно анализ контактов, образуемых каналом. Однако, несмотря на общую структурную организацию, внутри суперсемейства Рloop каналов существуют и свои важные отличия. Особенно интересны в этом плане структуры прокариотических натриевых каналов, полученные недавно (Payandeh, Scheuer et al., 2011, Zhang, Ren et al., 2012). Их отличительная особенность заключается в том, что область Р-петли состоит не из одной спирали, как в калиевых каналах (Doyle, Morais Cabral et al., 1998), а из двух спиралей, разделённых селективным фильтром (рисунок 4). Различия в структуре порообразующих сегментов также объясняют наличие уникальных сайтов связывания лекарств и различных нейротоксинов, которые действуют на конкретные подклассы Р-loop каналов. Таким образом, суперсемейство p-loop каналов объединяет каналы с похожей пространственной организацией поры. Это позволяет получать дополнительные данные о структуре слабо изученных каналов. 17 Рисунок 3. Пример наложения двух p-loop каналов: TRPV1 и Kv1.2. Сверху: выравнивание последовательностей между TRPV1 и Kv1.2. Снизу: трёхмерное наложение структур Kv1.2 (зелёным) и TRPV1 (лиловым); несмотря на низкую гомологию последовательностей, трёхмерное выравнивание показывает близость структур. 18 Рисунок 4. Трёхмерная структура p-loop канала NavMs. Цилиндры отображают спиральные участки канала. Оранжевым показаны участки p-спирали (p-loop), голубым – внутренние спирали (inner helices, s6), жёлтым – внешние спирали (outer helices, s5). Примечательно, что в области pпетли находятся две спирали: p1 и p2. 1.2.2. Потенциал-управляемые натриевые каналы Одной из важных проблем является изучение структуры потенциал-управляемых натриевых каналов. Натриевые каналы обнаружены практически во всех возбудимых и многих невозбудимых клетках. В возбудимых клетках потенциал-активируемые Na-каналы участвуют в формировании потенциала действия и обеспечивают достаточно высокую скорость его распространения по мембране (Зефиров, 1997). Самая высокая плотность Naканалов определяется в перехватах Ранвье миелинизированных нервных волокон, более низкая - в мембранах сомы нервной клетки, нервных окончаний, мышечных и эндокринных клеток. В пресинаптических структурах Na-каналы, участвуя в формировании потенциала действия, регулируют количество входящих ионов Са и, соответственно, количество освобождаемых квантов медиатора (Katz, 1971), а также синхронизируют секрецию медиатора во времени. 19 Детальный методами анализ фиксации функционирования потенциала на потенциал-активируемых гигантских аксонах Na-каналов беспозвоночных и миелинизированных нервных волокнах позвоночных животных прив ёл к созданию модели работы Na-канала (Hille, 1992). Воротный механизм Na-канала характеризуется 4 процессами: активация при деполяризации, инактивация при длительной деполяризации, деактивация после реполяризации инактивированного состояния. и реактивация канала Na-каналы закрыты при при его нормальных выходе из значениях мембранного потенциала покоя и открываются на очень короткое время (1 мс и менее) при деполяризации. Первым шагом в выявлении структуры Na-каналов было выделение молекул каналов с использованием нейротоксинов, специфически связывающихся с каналом. В результате были выделены три субъединицы, которые присутствуют в равных пропорциях в Na-канале: одна представляет собой большой гликопротеин с молекулярной массой 280 кДа (α1) и два малых полипептида с молекулярными массами 36 кДа (β1) и 33 кДа (β2) (Catterall 2000). α1-субъединица является основной и универсальной, тогда как малые субъединицы различаются в разных типах тканей. Биохимические исследования обнаружили, что α-субъединица состоит из четырёх повторов, нумеруемых от I до IV, каждый из которых содержит 6 трансмембранных сегментов, обозначаемых от S1 до S6 (рисунок 5). Сегмент S4 отвечает за чувствительность канала к изменению мембранного потенциала, и потому является одним из наиболее высококонсервативных участков. Кроме того, показано, что уменьшение общего положительного заряда в сегменте S4 путем сайт-направленного мутагенеза снижает потенциал-зависимость активационных ворот, а антитела, связывающиеся с тем же участком канала, замедляют инактивацию Na-каналов. 20 Рисунок 5. Строение α и β субъединиц Na-канала. Трансмембранные спиральные сегменты изображены в виде цилиндров. S4-сегмент содержит положительно заряженные аминокислоты и является сенсором потенциала; h - остатки, необходимые для быстрой инактивации; P в кружочках – сайты фосфорилирования цАМФ-зависимой протеинкиназой; P в ромбике - сайты фосфорилирования протеинкиназой С. Маленькие белые кружочки – остатки аминокислот с указанием их заряда, необходимые для высокоаффинного связывания с тетродотоксином (Siegel, 2011). Положительно заряженные остатки аминокислот на одной стороне S4-спирали позволяют ей определять изменения электрического потенциала на мембране. Деполяризация мембраны воздействует на заряженные аминокислоты таким образом, что происходит перемещение спирали, которое, в свою очередь, приводит к открытию поры канала. Предполагается, что спираль вращается для того, чтобы пора могла открыться (Yang and Horn, 1995). Однако, в отличие от многих типов каналов, потенциал-управляемые натриевые каналы эукариот до сих пор не закристаллизованы и их точная пространственная структура остаётся неизвестной. 21 1.3. Фармакология ионных каналов 1.3.1. Фармакология потенциал-управляемых Na-каналов. Потенциал-управляемые натривые каналы являются мишенями для многих токсинов и медицински важных препаратов. Несмотря на десятилетия интенсивных исследований, механизмы действия препаратов все ещё недостаточно хорошо изучены на структурном уровне. Основной причиной является именно отсутствие структур высокого разрешения эукариотических каналов и их комплексов с лигандами. Для решения этих проблем в частности используются методы гомологического моделирования, которое позволяет изучать действие лигандов на молекулярном уровне, используя имеющиеся рентгеновские структуры в качестве шаблонов. Из-за ограничений, присущих этому подходу, модели должны быть проверены на соответствующих экспериментальных данных. С другой стороны, такие модели дают уникальную возможность интегрировать различные экспериментальные данные в рамках одной модели. Использование гомологического моделирования позволило лучше изучить действие сразу нескольких классов лигандов. Это в первую очередь тетродотоксин, который блокирует внешнюю пору, местные анестетики, блокирующие внутреннюю пору, батрахотоксин, связывающийся во внутренней поре, но, как это ни парадоксально, активирующий канал, пиретроидные инсектициды, которые активируют канал, связываясь со стороны липидного слоя в интерфейсе между субъединицами и альфа и бета-токсины скорпионов, которые связываются в промежутке между порой и сенсором мембранного напряжения, влияя на активацию (рисунок 6). Рассмотрим подробнее достижения в области изучения механизмов действия этих лигандов. 22 Рисунок 6. Схематическое расположение сайтов связывания различных токсинов в потенциал-управляемом натриевом ионном канале. Сверху – схематическое изображение структуры, снизу – трёхмерное схематическое изображение. Оранжевым показаны участки S1-S3 спиралей, синим – сенсор напряжения S4, голубым – линкер между S4 и S5, жёлтым – внешняя спираль S5, зелёным – петлевая часть поры p-loop, лиловым – внутренняя спираль S6 (Tikhonov, Zhorov, unpublished). При рассмотрении различных классов лигандов, действующих на ионные каналы, уместно разбить их по группам в зависимости от области действия. К лигандам, действующим на внешнюю пору, в первую очередь относятся 23 тетродотоксин (TTX), сакситоксин (STX) и их аналоги. Интенсивные исследования методами сайт-направленного мутагенеза показали, что связывание этих токсинов происходит в основном за счёт остатков селективного фильтра и нескольких остатков рядом с ним. Среди них ключевая роль принадлежит кольцу внешних карбоксилатов, т.е. кислотных остатков в трёх-четырёх позициях вправо по последовательности от остатков селективного фиьтра. Детальный анализ позволил обнаружить контакты между некоторыми остатками каналов и отдельными химическими группами TTX и STX (Chang, French et al., 1998, Xue, Ennis et al., 2003). Для некоторых контактов была определена свободная энергии взаимодействия (Li, Ennis et al., 2001, Choudhary, Aliste et al., 2007). Хотя сайты связывания различных токсинов не идентичны, по существу они перекрывают друг друга. В частности, важную роль играют внешние карбоксилаты, которые также служат сайтами связывания для проникающих ионов натрия (Khan, Romantseva et al., 2002). Существует интригующая разница между действием TTX / STX, которые полностью блокируют ток через канал, и µ-конотоксинами, которые могут приводить к неполному блоку. Первая модель поры натриевого канала в комплексе с TTX и STX была предложена Липкиндом и Фоззардом до получения кристаллической структуры P-loop каналов (Lipkind and Fozzard, 1994). Важную роль в разработке модели сыграли экспериментальные данные, согласно которым действие токсинов резко ослабевало при мутациях аспартата и глутамата в селективном фильтре (I и II субъединицы), а также внешних карбоксилатов в повторах I, II, и IV (Terlau, Heinemann et al., 1991). Согласно предложенной модели, гуанидиновая группа TTX связывалась с селективным фильтром, а карбоксилат повтора II формировал водородную связь с гидроксильной группой TTX. Также модель показала, что при рассмотрении канала с внеклеточной стороны, субъединицы I, II III и IV расположены по часовой стрелке, и это важное предсказание было подтверждено позднее методами циклического мутационного анализа взаимодействия канала с µ-конотоксином GIIIA (Dudley, Chang et al., 2000). С появлением рентгеновской структуры KcsA, Липкинд и Фоззард разработали гомологическую модель Nav1.4 на основе KcsA и использовали экспериментальные данные о токсин-канальных взаимодействиях для посадки TTX и STX в модель (Lipkind and 24 Fozzard, 2000). Поскольку ширина внешней поры KcsA недостаточна, чтобы вместить крупные полужёсткие токсины, авторы поместили остатки селективного фильтра на Cконцах P-спиралей и предположили, что P-спирали сильнее смещены от оси поры, по сравнению с калиевыми каналами. В этой модели кольцо DEKA находится у границы между центральной полостью и внешней порой. Чтобы обеспечить структурное обоснование многочисленных экспериментально определённых контактов между большими пептидными µ-конотоксинами и натриевыми каналами, авторы вынуждены были дополнительно модифицировать модель натриевого канала путём сдвига P-спиралей дальше от оси поры и увеличения их наклона (Choudhary, Aliste et al., 2007). Альтернативные гомологические модели Nav1.4 с TTX и STX на основе KcsA предполагали сильное сходство между трёхмерными структурами натриевых и калиевых каналов (Tikhonov and Zhorov, 2005, Tikhonov and Zhorov, 2011). Эти модели были построены, чтобы объяснить те же экспериментальные данные по взаимодействию токсинов с каналом, но остатки селективного фильтра находились в середине восходящих участков, а не на изгибе Р-петли. Это позволило посадить TTX и STX во внешнюю пору без смещения P-спирали относительно калиевых каналов (рисунок 7). Появление рентгеновских структур бактериальных натриевых каналов (Payandeh, Scheuer et al., 2011, Zhang, Ren et al., 2012) свидетельствует в пользу моделей (Tikhonov and Zhorov, 2005, Tikhonov and Zhorov, 2011). Положение глутаматов селективного фильтра согласуется с предложенным в моделях, а P-спирали располагаются аналогично калиевым каналам. Тем не менее, обе модели (Lipkind and Fozzard, 2000, Tikhonov and Zhorov, 2005) не смогли предсказать пространственную укладку С-концевых половин P-петли. Структура NavAb показывает, что, в отличие от калиевых каналов, С-концевая часть P-петли содержит P2 спираль, направленную во внеклеточную сторону, в результате чего внешняя пора оказывается достаточно широкой, чтобы вместить большие токсины. Остается неясным, в какой степени рентгеновские структуры гомотетрамерических прокариотических натриевых каналов близки к структурам эукариотических каналов. В частности, симуляция методами молекулярной динамики взаимодействия TTX с моделью Nav1.4 на основе прямого выравнивания с NavAb предсказывает, что длинная ось TTX 25 перпендикулярна относительно оси поры и TTX образует водородные связи с внешними карбоксилатами в повторах I, II и III (Chen and Chung, 2014). Эти результаты плохо согласуются с экспериментальными данными по взаимодействию TTX с натриевым каналом. В частности, модель не объясняет значительный вклад D4p54 и слабый вклад D3p53 в действие токсина. В модели Nav1.4 на основе NavAb, которая была построена с помощью прямого выравнивания последовательностей Р-петель (Tikhonov and Zhorov, 2012), внешние карбоксилаты также не в состоянии взаимодействовать с TTX так эффективно, как следует из мутационных данных. Возможное решение проблемы было найдено с помощью скорректированного выравнивания последовательности между бактериальными и эукариотическими натриевыми каналами. Предлагаемые делеции в последовательности вблизи кольца DEKA (Tikhonov and Zhorov, 2012) обеспечивают ориентацию внешних карбоксилатов в согласии с экспериментальными данными (рисунок 7). Рисунок 7. Модель натриевого канала Nav1.4 в комплексе с TTX. Слева: модель на основе KcsA, данные из работы (Tikhonov and Zhorov 2005); справа: модель на основе NavAb, данные из работы (Tikhonov and Zhorov, 2012). Таким образом, использование метода моделирования позволило перейти от схематического представления о действии лигандов на внешнюю пору к более детальному пониманию механизмов их действия. Тем не менее, в отсутствие структур высокого разрешения токсин-канальных комплексов, остается неясным, насколько близки модели к реальности. 26 Особенно интересен механизм блокады натриевых каналов местными анестетиками (Catterall, 2000, Ruetsch, Boni et al., 2001, Nau and Wang, 2004, Fozzard, Lee et al., 2005, Clare, 2010). Несмотря на простую структуру этих лигандов и общий принцип механизма блока поры, феноменология их действия весьма сложна. Достаточно слабый "тонический блок" наблюдается при редкой ативации канала. Активация посредством длинной деполяризации усиливает блокирующее действие, этот эффект называется "частотно-зависимый блок". Для объяснения этих эффектов, Бертиль Хилль предложил "гипотезу модулированного рецептора" (Hille, 1977). Гипотеза предполагает слабое сродство ЛА с каналом в закрытом состоянии и значительное увеличиние сродства, когда канал переходит в открытое или инактивированное состояние (Hondeghem and Katzung, 1977, Hondeghem and Katzung, 1984). Эта гипотеза также предлагает существование двух путей доступа молекул ЛА к сайту связывания: гидрофильный путь через открытые ворота активации и гидрофобный путь через мембрану. Исследования методами мутагенеза позволили обнаружить остатки в S6 сегменте субъединиц I, III и IV, которые контролируют действие ЛА (Wang, Quan et al., 1998, Yarov-Yarovoy, Brown et al., 2001, Yarov-Yarovoy, McPhee et al., 2002). Это наводит на мысль, что связывание ЛА происходит во внутренней области поры. Интересно, что влияние отдельных замен на тонический блок, частотно-зависимый блок, и гидрофобный доступ неравны (Li, Galue et al., 1999). Антагонизм между проникающим ионом и заряженной частицей, блокирующей пору, не удивителен. Проникающие ионы могут влиять на блокаду канала либо путём конкуренции с блокаторами за сайт связывания внутри поры, или за счёт электростатического отталкивания от близко расположенных сайтов (Hille and Schwarz, 1978, Zhorov and Tikhonov, 2004, Zhorov and Tikhonov, 2013). Различные типы лигандионных взаимодействий серьезно осложняют картину зависимости действия лиганда на ионные каналы от состояния и напряжения (Hille and Schwarz, 1978, Triggle, 2007, Bruhova, Tikhonov et al., 2008, Wulff, Castle et al., 2009). Основная проблема с моделированием ЛА и родственных препаратов заключается в получении структурного обоснования сложного механизма действия, который описан в "гипотезе модулированного рецептора" (Hille, 1977). Гидрофильный путь доступа, очевидно, включает в себя открытые активационных ворот, которые находятся с 27 внутриклеточной стороны относительно сайта связывания ЛА. Тем не менее до сих пор не обнаружен точно гидрофобный путь, который обеспечивает доступ ЛА в закрытый канал. Остатки, которые контролируют этот путь были найдены в середине S6 и в P-петле (Qu, Rogers et al., 1995, Sunami, Dudley et al., 1997, Wang, Quan et al., 1998, Sunami, Glaaser et al., 2000). Так как ЛА имеют большее сродство к открытому/инактивированному каналу, чем к каналу в закрытом состоянии, Липкинд и Фоззард использовали первую опубликованную структуру открытого калиевого канала, MthK, в качестве шаблона для моделирования открытого состояния натриевого канала (Lipkind and Fozzard, 2005). Так как степень сходства структуры между MthK и натриевыми каналами неизвестна, авторы не пытались найти энергетически оптимальную конформацию, поскольку такое исследование критически чувствительно к структурным деталям, а исследовали набор различных конформаций, которые соответствуют экспериментальным данным по мутациям и взаимодействиям. В частности, Липкинд и Фоззард предположили, что алкиламинные и ароматические фрагменты ЛА находятся, соответственно, около фенилаланина и тирозина в D4S6, чувствительных к молекулам ЛА, ранее обнаруженым Уильямом Катераллом и соавторами (Ragsdale, McPhee et al., 1994). Были получены конформации, которые позволяли объяснить экспериментальные данные. Это позволило сделать важный вывод, что ЛА не полностью занимают пространство вунтри поры (рисунок 8). А электростатические расчёты позволили предположить, что блок должен иметь в первую очередь электростатическую природу (Lipkind and Fozzard, 2005). Авторы пришли к выводу, что лидокаин и ему подобные молекулы слишком велики, чтобы вписаться в модель закрытого канала на основе KcsA аналогично тому, как они располагаются в модели открытого канала на основе MthK. 28 Рисунок 8. Модель открытого натриевого канала в комплексе с мепивакаином на основе MthK. Данные из работы (Lipkind and Fozzard, 2005). В последующем была предложена модель открытого Nav1.4 на основе KvAP (Tikhonov and Zhorov, 2007), в которой оптимальное положение лидокаина схоже с моделью на основе MthK (Lipkind and Fozzard, 2005). В модели канала в закрытом состоянии, ЛА не могут поместиться в центральную полость и их ароматическое кольцо проникает в интерфейс между P-спиралью и соседними сегментами S6 (Bruhova, Tikhonov et al., 2008). Было отмечено, что некоторые остатки, контролирующие гидрофобный путь, смотрят в тот же интерфейс. Результаты моделирования позволили предположить, что интерфейс между субъединицами III и IV служит в качестве гидрофобного пути доступа для ЛА в закрытом натриевом канале (Tikhonov and Zhorov, 2005, Tikhonov and Zhorov, 2007, Bruhova, Tikhonov et al., 2008). Модели натриевых каналов, которые основаны на шаблонах калиевых каналов, имеют два слабых места. Во-первых, интерфейсы между субъединицами калиевых каналов достаточно узкие и возможность доступа ЛА через соответствующие интерфейсы в моделях натриевых каналов находится под вопросом. Во-вторых, некоторые остатки, которые влияют на доступ препаратов в закрытом канале, смотрят в сторону селективного фильтра, 29 а не в интерфейс (Sunami, Dudley et al., 1997, Sunami, Glaaser et al., 2000). В работе 2008 года Брухова, Тихонов и Жоров, используя гомологическое моделирование, предположили, что гидрофобный путь пролегает через боковое ответвление между S6 спиралями III и IV субъединиц канала, в области p-спирали III субъединицы (Bruhova, Tikhonov et al., 2008). Это предположение позволило создать модель, в которой молекулы локальных анестетиков связываются с закрытым натриевом каналом в горизонтальной ориентации, при этом ароматическая часть лиганда оказывается в интерфейсе между III и IV субъединицами, а аминогруппа попадает в пору. При таком связывании молекула анестетика должна вытеснить ион натрия из центральной полости и электростатически воздействовать на заселённость селективного фильтра. Недавно полученные рентгеновские структуры натриевых каналов служат подтверждением предложенного в моделях гидрофобного пути доступа. Субъединичные интерфейсы этих каналов значительно шире, чем в калиевых каналах, что может позволить большим ЛА проникать в поры. Особый интерес представляет структура бактериального натриевого канала, NavMs, с бромфенил содержащим блокатором (Bagneris, DeCaen et al., 2014). Из-за ограниченного разрешения в структуре видно только атом брома лиганда, но его положение в интерфейсе субъединицы совпадает с атомом азота, в модели 2008 года (Bruhova, Tikhonov et al., 2008). Кроме того, в присутствии блокатора ионная заселённость селективного фильтра уменьшается, что говорит о вытеснении ионов лигандом. Это согласуется с гипотезой о "взаимном влиянии" органических и неорганических катионов, в соответствии с которой молекула ЛА, которая входит в закрытый канал через межсубъединичный интерфейс, должна вытеснить ион из центральной полости, который может покинуть канал только через селективный фильтр (Bruhova, Tikhonov et al., 2008). Эта модель объясняет данные, согласно которым мутации в наружной поре или блок TTX приводят к предотвращению блока закрытого канала ЛА (Bruhova, Tikhonov et al., 2008). Таким образом, разработанные модели натриевых каналов с блокаторами внутренней поры позволили объяснить эффекты мутаций на действие лигандов. Модели позволили сделать важные прогнозы по ориентации и путям доступа лигандов в открытых и закрытых каналах. Недавно полученные рентгеновские структуры согласуются с этими 30 прогнозами. Природные вещества батрахотоксин, аконитин, вератридин и грайанотоксин известны как стероидные активаторы натриевых каналов (агонисты). Сайты и механизмы действия этих токсинов, возможно, одна из самых интригующих загадок, связанных с лигандами натриевых каналов. В присутствии таких соединений порог активации смещается в сторону отрицательных значений так, что каналы открываются вблизи мембранного потенциала покоя. Кроме того, это делает невозможной инактивацию и каналы остаются постоянно открытыми. Столь сложное действие этих липидорастворимых молекул на активацию и проницаемость изначально вдохновило предложение об аллостерическом характере действия лигандов, которые связываются на границе липидного слоя (Catterall, 1979, Hille, 2001). Тем не менее, последующие данные мутационного анализа не подтвердили это предположение. Остатки, чувствительные к BTX были найдены в S6 сегментах всех четырёх субъединиц канала. Более того, схема остатков, чувствительных к BTX сильно перекрывается со схемой остатков, чувствительных к ЛА, тем самым предполагая, что сайт связывания находится в поре. Некоторые прочие характеристики активаторов и блокаторов также схожи (Wang and Wang, 2003). Например, крупные блокаторы предотвращают закрытие канала (Yeh and Narahashi, 1977, Yamamoto, 1986). В разработанных моделях BTX, вератридин и аконитин предположительно связываются во внутренней поре, не блокируя проникновение ионов (Tikhonov and Zhorov, 2005). В этих моделях активаторы не перекрывают путь ионов полностью. Напротив, они обращены катионофильной стороной (так называемые триады кислорода) в пору, что позволяет ионам проникать между агонистом и внутренней стенкой поры. Кроме того, связывание этих относительно больших токсинов предотвращает закрытие канала. Эта модель и её последующее развитие (Du, Garden et al., 2011) предполагают, что BTX действует в ионном канале аналогично тому, как хируригический стент действует в кровеносном сосуде. На основании предсказаний модели были проведены мутационные исследования, в которых были определены несколько новых остатков, чувствительных к BTX (Wang, Mitchell et al., 2006, Wang, Tikhonov et al., 2007, Du, Garden et al., 2011). Особый интерес 31 представляет собой замена аспарагина в D2S6 на лизин, который преобразует действие BTX от активации канала к необратимой блокаде (Wang, Tikhonov et al., 2007). Это показывает общее сходство в сайтах и характере связывания стероидных молекул, которые, в зависимости от их структуры и аминокислотного состава внутренних спиралей канала, может либо блокировать, либо активировать натриевые каналы. Другой тип активаторов натриевых каналов включает в себя пиретроиды, большой класс синтетических аналогов природных пиретринов из цветков pyrethrum daisy (Dong, Du et al., 2014). Пиретроиды, которые имеют относительно низкую токсичность для млекопитающих и относительно благоприятные экологические свойства, широко используются в качестве одной из наиболее эффективных мер контроля в глобальной борьбе против вредных в сельском хозяйстве вредителей и заболеваний, включая малярию и лихорадку денге. Другим хорошо известным агонистом натриевого канала является ДДТ, инсектицид, который, как полагают, имеет сайт связывания, перекрывающийся с пиретроидным рецептором. Интенсивное использование ДДТ, а затем и пиретроидов в течение нескольких десятилетий привело к развитию резистентности во многих популяциях насекомых. Основной механизм резистентности, известный как KDR, был зарегистрирован почти во всех медицински и агрономически важных членистоногих вредителях и в настоящее время более 50 мутаций натриевых каналов связаны с сопротивлением к перитроидам в различных членистоногих вредителях (Silver, Du et al., 2014). Поэтому до сих пор активно ведётся поиск пиретроидных сайтов связывания с целью разработки новых инсектицидов. Новаторская модель (O'Reilly, Khambay et al., 2006) интегрировала мутационные данные, в том числе резистентные мутации, и предсказала связывание пиретроидов в интерфейсе между повторами II и III. Анализ дополнительных экспериментальных данных привел к моделированию рецептора пиретроидов между повторами I и II, и на основании этой модели были проведены исследования методами мутагенеза, что позволило обнаружить новые остатки, отвечающие за связывание (Du, Nomura et al., 2013). К последним относятся остатки, которые отличаются между натриевыми каналами насекомых и млекопитающих, давая тем самым молекулярное основание для избирательной токсичности пиретроидов. Недавно разработана модель натриевого канала 32 комаров с двумя пиретроидными рецепторами, PyR1 и PyR2, показавшая наличие квазисимметрии вокруг оси поры (Du, Nomura et al., 2015). Мутагенез на основе данных модели привёл к открытию семи новых остатков, связывающихся с пиретроидами. Это позволяет предположить, что каждый рецептор расположен между четырьмя спиралями (L45, S5 и два S6), принадлежащими соседним повторам, причём четыре остатка D2S6 относятся к PyR1 и ещё четыре остатка относятся к PyR2 (Du, Nomura et al., 2015). Предполагается, что связывание лигандов как с PyR1, так и с PyR2 необходимо для активации канала. Из рентгеновских структур потенциал-управляемых гомотетрамерных каналов известно, что внеклеточные участки S1-S2 и S3-S4 петель данного повтора близки к S5-S6 петле смежного повтора. Пептидный токсин, связавшийся с этими петлями между областью поры и областью сенсора напряжения может зафиксировать последний в определённом состоянии и, таким образом, модифицировать гейтинг канала. К таким токсинам относятся токсины скорпионов (Wang, Yarov-Yarovoy et al., 2011, Zhang, Yarov-Yarovoy et al., 2011, Zhang, Yarov-Yarovoy et al., 2012), пауков (Bosmans and Swartz, 2010, Minassian, Gibbs et al., 2014) и актиний (Xiao, Blumenthal et al., 2014). Альфа- и бета-токсины скорпионов связываются с различными участками и вызывают различные эффекты. Альфа-токсины замедляют инактивацию, а бета-токсины вызывают отрицательный сдвиг активации путём захвата сенсора напряжения II повтора в активированном состоянии. Внеклеточные S1-S2 и S3-S4 участвуют в образовании рецепторов альфа- и бета-токсинов, но связывающие области расположены на противоположной стороне канала и включают IV повтор для альфа токсинов и II повтор для бета токсинов (Thomsen and Catterall, 1989, Rogers, Qu et al., 1996, Cestele, Yarov-Yarovoy et al., 2006). Удивительно, но остатки, чувствительные к бета-токсину найдены не только в IIS1-S2 и IIS3-S4, но и в IIIP2-S6 (Zhang, Yarov-Yarovoy et al., 2012). Сочетание мутационных и молекулярных исследований с моделированием позволило определить картину действия токсина скорпионов на молекулярном уровне (Catterall, Cestele et al., 2007). Главная проблема заключалась в моделировании гибких участков каналов, которые не образуют регулярную вторичную структуру. Для решения этой проблемы авторы сгенерировали набор энергетически возможных моделей и выбрали модель, в которой ключевые остатки канала, связанные с токсином, образовывали кластеры 33 (Zhang, Yarov-Yarovoy et al., 2012). Клиновидная форма бета-токсина, CssIV, предположительно связывается глубоко в области между петлями IIS1-S2 и IIS3-S4. Посадка токсина в этой модели воспроизводит большинство экспериментально известных взаимодействий. Однако один из важных экспериментально обнаруженных остатков, D1445 (Zhang, Yarov-Yarovoy et al., 2012), находится за пределами предлагаемого сайта связывания. Это может свидетельствовать либо об ограниченной точности модели , либо о косвенном влиянии замещения остатков на действие токсина. Аналогичный анализ был проведен для альфа-токсинов, которые по-видимому связываются квази-симметрично относительно бета-токсинов (рисунок 9) (Wang, YarovYarovoy et al., 2011). Моделирование показывает, что они проникают в коническую щель между петлями IVS1-S2 и IVS3-S4. Разница между основными эффектами альфа-токсинов (ингибирующими быструю инактивацию) и бета-токсинов (усиливающими активацию) может быть связана с функциональной и структурной асимметрией канала. В частности, известно, что сенсоры напряжения в повторах I и II быстро реагируют в ответ на деполяризацию, в то время как сенсор напряжения в IV повторе реагирует медленно, и его время активации аналогично времени быстрой инактивации (Chanda and Bezanilla, 2002). Рисунок 9. Схематическое изображение сайтов связывания для α- и β-токсинов скорпиона (Tikhonov, Zhorov, unpublished). 34 Связывание лиганда в одной и той же области может привести к различным, а иногда и противоположным эффектам. Например, как ЛА, так и BTX действуют на внутреннюю область поры, но ЛА блокируют канал, тогда как BTX активирует его. Другие примеры могут включать токсины, которые связываются с внешними петлями. Так, поначалу предполагалось, что токсины пауков, такие как Huwentoxin-IV из Ornithoctonus huwena и некоторые Hainantoxins связываются во внешней поре, аналогично TTX, так как они ингибируют Na+ проводимость (Li, Xiao et al., 2003). Однако, остатки, чувствительные к Huwentoxin и остатки, влияющие на бета-токсины скорпионов, находятся в одной области (Leipold, DeBie et al., 2007). Моделирование преполагает, что Huwentoxin-IV связывается в области между IIS1-S2 и IIS3-S4 (Minassian, Gibbs et al., 2014), что сходно с моделью связывания альфа-токсина скорпиона. По-видимому, главное отличие в том, что бетатоксины скорпиона фиксируют сенсор напряжения в активированном состоянии, в то время как Huwentoxin-IV и связанные с ним токсины фиксируют сенсор напряжения в состоянии покоя. Подробная информация об этих специфических взаимодействиях требует дальнейшего анализа. Таким образом, существует большое количество токсинов, воздействующих на натриевые каналы. Их действие весьма различно, как и механизмы воздействия. Какие-то являются хорошо изученными, а какие-то изучены хуже. Одним из наиболее интересных семейств токсинов с точки зрения наличия экспериментальных данных является семейство конотоксинов. 1.3.2. Конотоксины Конотоксины представляют собой природные нейротоксины, выделенные из яда хищных морских моллюсков рода Conus. Яд моллюска обычно содержит смесь различных конотоксинов, и применяется моллюском для защиты и нападения на жертву. По характеру действия, конотоксины подобны постсинаптическим токсинам змей, но могут значительно превосходить их по токсичности. Большинство конотоксинов способны избирательно и с высокой специфичностью связываться и модулировать работу различных ионных каналов воздействуя на передачу импульса по нервному волокну (Terlau and Olivera, 2004). При этом детальный механизм действия для большинства соединений остается не до конца ясным. Состав яда может различаться в зависимости от рациона улитки, таким образом, детальный 35 состав яда может сильно различаться даже между особями одного вида. По причине высокой специфичности блокирования нервной проводимости, конотоксины широко используются в качестве избирательно действующих агентов при электрофизиологических и клинических исследованиях механизмов передачи возбуждения в нервной системе, в качестве основы для производства обезболивающих препаратов (Wang and Chi, 2004, Olivera and Teichert, 2007). В связи с высоким терапевтическим и диагностическим потенциалом конотоксинов, большой интерес представляет более детальное изучение механизмов действия подобных биологических активных веществ и производство на их основе новых соединений с помощью современных методов био и нанотехнологий. Структурно конотоксины представляют собой пептиды, состоящие из 10-30 аминокислотных остатков, и имеющие обычно одну, две или более дисульфидных связей (рисунок 10). Структурное разнообразие конотоксинов определяется их высокой специфичностью, и разнообразием возможных механизмов действия. Мишенями для различных групп конотоксинов могут быть различные семейства ионных каналов, помимо этого конотоксины могут иметь разные сайты связывания с одним и тем же типом ионного канала. Рисунок 10. Структура конотоксинов. Строение ω-конотоксина MVIIA (слева) и α-конотоксина 36 PnIB (справа). Структура окрашена от N-конца (синий) к C-концу (красный), жёлтым показаны дисульфидные связи Яд улиток содержит смесь конотоксинов (до 50), при этом, состав яда зависит от рациона и таким образом может различаться даже у представителей одного вида. Таким образом, 500-700 существующих видов Conus, могут синтезировать до 50000 различных конотоксинов (Olivera, 2006). Общепринятая классификация подобного разнообразия представлена на рисунке 11. Рисунок 11. Классификация конотоксинов. Конотоксины делятся на две основные группы: с одной дисульфидной связью, и богатые дисульфидными связями пептиды (2 и более). Большинство известных конотоксинов принадлежат второй группе, являющейся наиболее многочисленной. Конотоксины второй группы классифицируются в соответствии с их химическим строением, а также по общему механизму их действия. Изучение конотоксинов показало значительное разнообразие их воздействия: некоторые блокируют передачу сигнала от нервов к мышцам, другие способны вызывать судороги, сон или снимать болевой синдром. Детальный механизм их действия не всегда 37 известен, хотя известно, что большинство способно модулировать работу ионных каналов клеточных мембран (Terlau and Olivera, 2004). В некоторых случаях, удается не только установить мишень токсина, но и определить сайт связывания лиганда и построить структуру комплекса токсина с лигандом. Так, например, для α-конотоксина PnIA была определена детальная структура (Celie, Kasheverov et al., 2005) (рисунок 12). Рисунок 12. Структура комплекса α-конотоксина PnIA с сайтом связывания в надмембранной части никотинового-ацетилхолинового рецептора. Токсин встраивается между 2-мя субъединицами рецептора, вызывая конформационные изменения в надмембранной части рецептора, которые влияют на проводимость ионного канала Конотоксины делятся согласно соответствующему белку-мишени на следующие группы: α-конотоксины способные с высокой специфичностью блокировать различные типы никотиновых-ацетилхолиновых рецепторов; δ-конотоксины ингибирующие инактивацию потенциал-зависимых натриевых каналов; 38 κ-конотоксины ингибирующие калиевые каналы; μ-конотоксины способные блокировать потенциал-зависимые натриевые каналы; ω-конотоксины способные блокировать потенциал-зависимые кальциевые каналы. Высокое разнообразие по механизму действия делает конотоксины весьма перспективными объектами с медицинской точки зрения. Уже сейчас на их основе разрабатываются лекарства для лечения некоторых неврологических заболеваний, таких, например, как эпилепсия (Alonso, Khalil et al., 2003). Способность ω-конотоксинов ингибировать потенциал-зависимые кальциевые каналы N-типа, отвечающие за чувствительность к боли, позволила использовать их в качестве основы для производства обезболивающих средств, не вызывающих привыкания, для лечения хронических болей (Miljanich, 2004). Сравнительно небольшой размер, а также чрезвычайно высокая специфичность воздействия конотоксинов на различные компоненты нервной системы, делает их ценным инструментом при исследовании функций ионных каналов, механизмов передачи возбуждения в нервной системе на молекулярном уровне (Nicke, Wonnacott et al., 2004) . Поскольку конотоксины имеют небольшой размер, процессы их синтеза и модификации сравнительно простоты и дёшевы. Избирательное специфическое блокирование нервной проводимости делает возможность производства на их основе неопиоидных лекарственных препаратов анальгезирующего действия, не вызывающих привыкания и отличающихся длительностью действия, а также для производства перспективных препаратов для лечения неврологических заболеваний человека. Как видно из вышесказанного, фармакологические агенты, такие как конотоксины, играют ключевую роль в создании и разработке лекарств. Однако недостаток экспериментальных данных приводит к неполному пониманию механизмов действия подобных лигандов, что, в свою очередь, затрудняет исследования. Именно поэтому необходимо использовать теоретические методы, такие как молекулярное моделирование, 39 для углублённого изучения механизмов связывания и поиска молекулярных детерминантов связывания лигандов с мишенями, в частности, с ионными каналами. 1.3.3. µ-конотоксины и Na-каналы Натриевые каналы эукариот, которые играют ключевую роль в физиологии возбудимых клеток, были предметом экспериментальных исследований в течение последних десятилетий (Trimmer, Cooperman et al., 1989, Priestley, 2004, Wood, Boorman et al., 2004, Rogers, Tang et al., 2006). Действие природных токсинов и синтетических препаратов на Nav1 каналы интенсивно изучается уже много лет. Эти токсины, как было рассмотренно ранее, включают в себя широко известные антагонисты натриевых каналов тетродотоксин, сакситоксин и µ-конотоксины, агонисты натриевых каналов батрахотоксин, вератридин, аконитин и грайанотоксин, местные анестетики, и многие другие лиганды (French, Worley et al., 1984, Moczydlowski, Hall et al., 1984, Linford, Cantrell et al., 1998, French and Terlau, 2004, Eijkelkamp, Linley et al., 2012, Waszkielewicz, Gunia et al., 2013). Выше была рассмотрена работа Тихонова и Жорова, в который было смоделировано действие TTX на модель натриевого канала Nav1.4, построенной на основании структуры NavAb (Tikhonov and Zhorov, 2012). Тем не менее, TTX взаимодействует только с областью селективного фильтра (DEKA-кольца) и кольцом внешних карбоксилатов, расположенным ближе к внеклеточному пространству относительно DEKA-кольца. Пока неясно, может ли структура прокариотических натриевых каналов быть использована для объяснения действия гораздо более крупных токсинов, которые нацелены на внешнюю пору. Особенно интересным является действие μ-конотоксинов (Olivera and Cruz, 2001, Lewis, Dutertre et al., 2012). μ-конотоксины представляют собой довольно небольшие пептиды (16-26 аминокислот) с несколькими дисульфидными поперечными связями, которые стабилизируют типичную пространственную укладку, так называемую III (Lewis, Dutertre et al., 2012). С точки зрения структуры, конотоксины за счёт своего размера нацелены на другой участок канала, нежели TTX и STX (Zhang, Gruszczynski et al., 2010). Они не так сильно взаимодействуют с селективным фильтром, но зато взаимодействуют с внешними карбоксилатами и несколькими соседними с ними остатками. 40 Семья μ-конотоксинов включает в себя 3 токсина, которые особенно хорошо изучены: GIIIA, PIIIA и KIIIA (Cruz, Kupryszewski et al., 1989, Shon, Olivera et al., 1998, Zhang, Green et al., 2007). Наиболее изученным из них является GIIIA, токсин с высоким сродством к натриевому каналу Nav1.4 (Sato, Ishida et al., 1991, Becker, Prusak-Sochaczewski et al., 1992, Dudley, Todt et al., 1995, French, Prusak-Sochaczewski et al., 1996, Chang, French et al., 1998, Dudley, Chang et al., 2000, Li, Ennis et al., 2001, Cummins, Aglieco et al., 2002, Hui, Lipkind et al., 2002, Hui, McIntyre et al., 2003, Xue, Ennis et al., 2003, Choudhary, Aliste et al., 2007). PIIIA представляет собой близкий гомолог GIIIA, но с некоторыми отличительными особенностями, которые делают его интересным объектом для изучения (Safo, Rosenbaum et al., 2000, McArthur, Ostroumov et al., 2011, McArthur, Singh et al., 2011, Chen and Chung, 2012, Tietze, Tietze et al., 2012). И, наконец, KIIIA, самый короткий из них (всего 16 остатков), представляет особый интерес из-за своего небольшого размера и способности связываться с каналом одновременно с ТТХ (Zhang, McArthur et al., 2009, Van Der Haegen, Peigneur et al., 2011, Wilson, Yoshikami et al., 2011, Khoo, Gupta et al., 2012, Stevens, Peigneur et al., 2012). Предыдущие модели связывания μ-конотоксинов в поре канала (Choudhary, Aliste et al., 2007, McArthur, Singh et al., 2011, McArthur, Singh et al., 2011) были разработаны для объяснения экспериментальных данных, используя гомологические модели, основанные на структуре калиевого канала KcsA. Но так как NavAb имеет отличную от KcsA укладку в области селективного фильтра и наружной поры, то появляется возможность изучить альтернативную модель на предмет объяснения экспериментальных данных. Модель натриевого канала Nav1.4, построенная на основе NavAb, служит хорошей отправной точкой (Tikhonov and Zhorov, 2012), чтобы изучить связывание μ-конотоксинов GIIIA, PIIIA и KIIIA в поре канала. 41 Глава 2. Методы 2.1. Методы исследования ионных каналов 2.1.1. Экспериментальные методы На данный момент существует значительное количество методов по изучению строения и функций ионных каналов, которые можно разделить на две группы: экспериментальные и теоретические. Экспериментальные методы, в свою очередь, можно разделить на несколько основных групп: электрофизиологические методы (регистрация интегральных токов и потенциалов, внутриклеточная регистрация, метод фиксации мембранного потенциала и т.д.); биохимические методы; фармакологические методы; генетические методы; рентгеноструктурный метод. Многообразие подходов позволяет взглянуть с разных сторон на проблемы, связанные с функциями и строением ионных каналов, что позволяет значительно расширить наше понимание вопросов, связанных с ними. 2.1.2. Рентгеноструктурный анализ Наиболее важным подходом, с точки зрения структурного анализа ионных каналов, несомненно, является метод рентгеноструктурного анализа. Использование метода рентгенокристаллографии электрофизиологическими совместно методами с биохимическими, генетическими, позволило выявить принципы структуры и функционирования канальных белков. Рентгенокристаллографический метод позволяет непосредственно оценить трехмерную структуру ионного канала. Этот метод стал относительно недавно использоваться для структурного анализа каналов, так как они содержат трансмембранные гидрофобные домены, что затрудняет их кристаллизацию. Мак-Киннон и его коллеги впервые проанализировали молекулярную структуру ионного канала с помощью рентгенокристаллографического метода с высоким разрешением на примере бактериального К-канала, (Doyle, Morais Cabral et al., 1998) (рисунок 13). 42 Рисунок 13. Структура калиевого канала, полученная с помощью рентгенокристаллического метода. А) Вид на канал с внешней стороны мембраны. Б) Вид на канал сбоку. В) Вид на канал сбоку, показаны две из четырех субъединиц, селективный фильтр образован карбоксильными группами трех остатков аминокислот – глицин (G), тирозин (Y) и глицин (G). Г) Схема канала в мембране, иллюстрирующая три калий-связывающих сайта внутри канала. Спирали поры образуют отрицательный диполь, который помогает стабилизировать ион К внутри поры (Doyle, Morais Cabral et al., 1998). 43 Особенностью этих каналов является относительно небольшой размер и простая трансмембранная топология. Проведённый анализ трехмерной структуры показал, что канал образован четырьмя идентичными субъединицами, окружающими центральную пору (рисунок 13, А). Каждая субъединица состоит из двух трансмембранных участков, соединяющихся петлей – областью Р, которая формирует селективный фильтр канала (рисунок 13, Б). Четыре внутренних сегмента каждой субъединицы образуют область поры с цитоплазматической стороны. Форма и структура поры определяют ион-проводящие свойства. Внутреннее и внешнее устья поры выстланы кислыми аминокислотами, чьи отрицательные заряды притягивают катионы из внеклеточной среды. Наиболее узкий участок поры формирует селективный фильтр, который ограничивает скорость прохождения ионов. Селективный фильтр образован тремя карбонильными атомами белкового скелета каждой из четырех субъединиц, отрицательный заряд которых обеспечивает полярное окружение для ионов К, проходящих через канал (Jiang, Lee et al., 2003) (рисунок 13В). Рентгенокристаллографический анализ показал, что c порой канала могут связываться три иона К, один из которых находится в широкой внутренней полости, и до двух ионов К могут одновременно занимать селективный фильтр (рисунок 13, Г) (Jiang, Lee et al., 2003). На данный момент получены рентгеновские структуры многих ионных каналов: например калиевые каналы в открытом (MthK, Kv1.2, KvaP) (Jiang, Lee et al., 2002, Jiang, Lee et al., 2003, Long, Campbell et al., 2005) и закрытом (KcsA, KirBac1.1, KirBac3.1) (Doyle, Morais Cabral et al., 1998, Clarke, Caputo et al., 2010, Zubcevic, Bavro et al., 2014) состояниях, каналы глутаматного рецептора (NMDA и AmpA) (Sobolevsky, Rosconi et al., 2009, Lee, Lu et al., 2014), а недавно были получены структуры прокариотических натриевых каналов (NavMs, NavAb, NavRh) (Payandeh, Scheuer et al., 2011, Zhang, Ren et al., 2012, Bagneris, Decaen et al., 2013). Обилие доступных структур позволяет использовать теоретические методы компьютерного моделирования для изучения молекулярных детерминант и функциональных особенностей строения каналов. 2.1.3. Теоретические методы Экспериментальные данные, полученные из разных источников и разными 44 методами, могут быть объединены в рамках модели. Это позволяет более корректно интерпретировать экспериментальные данные и дает возможность более тонкого планирования новых исследований, например, выбора участков для направленного мутагенеза. При этом отклонение получаемых экспериментальных результатов от предсказанных свидетельствует о расхождении между использованным «шаблоном» или моделью и реальным объектом исследования. Анализ этих отклонений позволяет корректировать модель и, используя новые экспериментальные подходы, получать более точные сведения об изучаемом ионном канале. Основным подходом к изучению неизвестных канальных белков методами компьютерного моделирования является, безусловно, гомологическое моделирование (Rigden, 2009). Эмпирически установлено, что если последовательности двух белков идентичны друг другу более чем на 30%, то белки почти наверняка являются «родственниками» и степень эволюционной дивергенции ещё не столь велика, чтобы их структуры утратили общность. Эти наблюдения и являются основой методики предсказания пространственной структуры, называемой моделированием на основании гомологии. На настоящий момент моделирование по гомологии позволяет установить структуру более половины белков, чьё строение ещё неизвестно. Если же выбирать мишени для экспериментального определения структуры таким образом, чтобы в результате для каждого белка был получен хотя бы один структурный гомолог (с идентичностью последовательностей свыше 30%), то окажется, что достаточно получить всего 16 000 структур (Vitkup, Melamud et al., 2001), а «степень покрытия» при этом составит более 90%, включая и мембранные белки. Моделирование по гомологии в этом случае поможет предсказать структуры большей части оставшихся белков. Процесс моделирования по гомологии (Hillisch, Pineda et al., 2004, Ginalski, 2006) включает несколько шагов: Идентификация структурного шаблона — белка с известной пространственной структурой, гомологичного моделируемому (идентичность последовательностей свыше 30%). Поиск производится с помощью серверов FASTA или PSI-BLAST (или 45 их аналогов) в базе структур белков PDB (едином депозитарии структурных данных для биомакромолекул); Выравнивание аминокислотных последовательностей шаблона и модели. Парное выравнивание служит «инструкцией» программам, осуществляющим моделирование. Множественное выравнивание может быть полезно для выявления консервативных остатков во всём семействе или отдельных подсемействах белков. Множественное выравнивание и идентифицировать более профили последовательностей слабые гомологии, чем позволяют «обыкновенное» парное выравнивание. Выравнивание проводят с помощью сервера ClustalW (или его аналогов); Построение модели последовательности заключается, моделируемого главным белка на образом, «остов» в «натягивании» шаблона согласно выравниванию. «Петлевые» участки (не имеющие гомологии с шаблоном) достраиваются независимо, положение боковых цепей оптимизируется с помощью методов эмпирических силовых полей. Оценка качества, оптимизация и использование модели. Самый сложный этап моделирования по гомологии — оптимизировать модель с учётом всей доступной биологической информации по моделируемому белку. Вообще, моделирование структуры по гомологии с белком, выполняющим иную функцию, не способно автоматически дать модель, пригодную для практически важных задач. Обязательно требуется аккуратная оптимизация, превращающая «заготовку» (которой, по сути, является модель «нулевого приближения») в рабочий инструмент, — задача, зависящая скорее от интуиции и опыта исследователя, чем от конкретных компьютерных методик. Решающим фактором, определяющим качество получаемых моделей, является степень гомологии (или идентичности) последовательностей моделируемого белка и шаблона. Высокая идентичность означает, что эволюционное расхождение обоих белков от общего «предка» произошло не настолько давно, чтобы эти белки утратили структурную общность. 46 Рисунок 14. Схема моделирования по гомологии на примере рецептора мелатонина MT 1 человека (Chugunov, Farce et al., 2006). Одним из наиболее важных шагов в гомологическом моделировании является построение выравнивания. На данный момент разработано и реализовано множество алгоритмов, предназначенных для выравнивания первичных структур. Разделяют два основных подхода: парное выравнивание, при котором ищутся сходные участки для двух последовательностей, и множественное выравнивание, которое применяется для нахождения консервативных участков в наборе последовательностей. Различают глобальное и локальное выравнивание. Глобальное выравнивание 47 предполагает, что последовательности подобны по всей длине. В глобальное выравнивание включаются входные последовательности целиком. Локальное выравнивание применяется, если последовательности содержат как родственные (гомологичные), так и негомологичные участки. Результатом локального выравнивания является выбор участка в каждой из последовательностей и выравнивание между этими участками. Локальное выравнивание, в частности, широко применяется для многодоменных белков в том случае, если родственными предполагаются не все домены сравниваемых белков. Глобальное выравнивание применяется в случае исследования двух родственных белков, зачастую из одного семейства. В этом случае можно ожидать близкого сходства, и большинство изменений носят характер точечных замен в аминокислотной последовательности. Наиболее известным и часто используемым инструментом для выравнивания последовательностей является программа Clustal (Goujon, McWilliam et al., 2010, Sievers, Wilm et al., 2011, McWilliam, Li et al., 2013). Для построения и оптимизации моделей применяются два основных метода: молекулярная динамика и метод Монте-Карло. 2.1.4. Молекулярная динамика Метод классической молекулярной динамики (метод МД) — это метод, в котором временная эволюция системы взаимодействующих атомов или частиц отслеживается интегрированием их уравнений движения (Rigden, 2009). Метод молекулярной динамики является одним из наиболее важных инструментов теоретического изучения структуры и динамики биологических макромолекул, жидкостей, газов и других молекулярных систем. Изначально разработанный в теоретической физике, метод молекулярной динамики получил большое распространение в науке о веществе и, начиная с 1970-х годов, в биохимии и биофизике. Метод молекулярной динамики играет важную роль в определении структуры белка и уточнении его свойств. Взаимодействие между объектами может быть описано силовым полем (классическая молекулярная динамика), квантово-химической моделью или смешанной теорией, содержащей элементы двух предыдущих. В основе метода молекулярной динамики лежит расчёт классических траектори й движения макромолекулы в фазовом пространстве координат и импульсов её атомов. 48 Молекулярно-динамические расчёты позволяют получить информацию о флуктуациях и конформационных изменениях белков, нуклеиновых кислот и других молекул. В настоящее время метод молекулярной динамики повсеместно используется для исследования структурных, динамических и термодинамических характеристик биологических молекул и их комплексов. К задачам, решаемым методом молекулярной динамики, относится изучение стабильности белков, исследование конформационных превращений систем, сворачивания белков, докинга лигандов, изучение процессов ионного транспорта. Важную роль метод молекулярной динамики играет и при установке конечной структуры молекул и комплексов, определённой методами ЯМР и рентгеноструктурного анализа, а также в фармакологии при разработке новых лекарственных препаратов. Основные положения метода: Для описания движения атомов или частиц применяется классическая механика. Уравнение движения частиц находят при помощи аналитической механики; Силы межатомного взаимодействия можно представить в форме классических потенциальных сил (как градиент потенциальной энергии системы); Точное знание траекторий движения частиц системы на больших промежутках времени не является необходимым для получения результатов макроскопического, (термодинамического) характера; Наборы конфигураций, получаемые в ходе расчетов методом молекулярной динамики, распределены в соответствии с некоторой статистической функцией распределения, например, отвечающей микроканоническому распределению (Микроканоническое распределение Гиббса — распределение вероятностей различных состояний замкнутой макроскопической системы, т. е. системы, не взаимодействующей с окружающими телами и имеющей постоянную энергию). Методы молекулярной динамики играют одну из ключевых ролей в развитии теоретической биохимии. Исследования методами МД позволили получить огромное количество моделей белков, как ионных каналов, так и прочих. Однако и этот метод связан с определёнными ограничениями, что не позволяет использовать его для любых задач. Во многом это связано с тем, что расчёт требует слишком большого времени и компьютерных 49 мощностей (Rigden, 2009). 2.1.5. Метод Монте-Карло Наряду с методом молекулярной динамики используется ещё одна группа квазидинамических методов, объединённых под общим названием «метод Монте-Карло». Метод Монте-Карло отличается от метода молекулярной динамики тем, что каждая следующая конформация молекулы определяется не путём решения уравнений Ньютона, а как результат случайного процесса. Суть этого подхода состоит в сочетании случайных бросков конформации с последующим градиентным спуском в ближайший энергетический минимум. При этом полная конформационная энергия системы (Eк) представляется в виде суммы компонент: Eк = Енев + Еэл + Етор + Евал + Евс + Егидр Енев – ван дер Ваальсово взаимодействие пар валентно не связанных атомов. Евал – энергия деформации валентных углов. Евс – энергия водородных связей. Eэл – элетростатическое (Кулоновское) взаимодействие пар валентно не связанных атомов. Етор – торсионная энергия в четверке валентно связанных атомов. Егидр – энергия гидратации. На первом этапе проводится минимизация энергии стартовой конформации (Е0). Затем одна из обобщённых координат системы изменяется случайным образом, и проводится новая минимизация (Е1). Новая конформация принимается в траекторию, если её энергия меньше предыдущей Е1<Е0. В противном случае, вероятность принятия новой конформации равна Больцмановскому фактору от разности энергий сравниваемых конформаций E0 и E1. Если новая конформация принята, следующий шаг делается уже из неё. Температура обычно принимается 600 или 1000К. Таким образом, за счёт случайного изменения конформации система может перейти в новый энергетический минимум. Кроме того, возможность принятия конформера с повышением энергии обеспечивает более широкое исследование всего конформационного пространства. При МСМ поиске все низкоэнергетические конформации накапливаются для последующего анализа. Расчет 50 прекращается после того, как определенное число минимизаций не приводит к понижению энергии системы (Тихонов, 2004). Таким образом, в настоящее время только комплексное исследование способно значительно углубить и развить существующие представления о строении и функционировании ионных каналов. Сочетание экспериментальных и теоретических подходов представляется особенно продуктивным. Простое накопление опытных данных без теоретического анализа в рамках молекулярных или кинетических моделей не сулит существенного прогресса. В то же время моделирование, не являющееся обобщением всего набора доступных данных, остаётся ограниченным и не способствует дальнейшему прогрессу в экспериментальных исследованиях. Если же экспериментальные и теоретические подходы используются параллельно, в рамках единого проекта, их взаимодействие происходит непрерывно, и модельнотеоретическая работа становится непосредственным продолжением классических экспериментов, а подчас и исходным пунктом для планирования новых экспериментов и подходов. 2.2. Параметры и методы расчётов, использованные в работе 2.2.1. Расчёт энергетически оптимальных конформеров методами молекулярной механики Во всех расчётах использовалось приближение атом-атомных потенциалов, при котором квантовые эффекты игнорировались. При этом подходе валентная структура системы принимается неизменной, протонирование/депротонирование, то переходы есть между такие процессы, энантиомерами, разрыв как и образование ковалентных связей не могут быть смоделированы. Однако для обратимого связывания лигандов, что и служило главной расчётной задачей, приближение атоматомных потенциалов является приемлемым компромиссом между точностью и скоростью. Ван дер Ваальсово взаимодействие рассчитывалось по потенциалу Морзе (6/12) с использованием силовых полей AMBER (Weiner, Kollman et al., 1984). Поскольку расчёт энергии гидратации является времяёмким, игнорировалась. Для учета влияния растворителя, состоящего 51 гидратация в экранировании электростатических взаимодействий, учитывалось введение зависимости диэлектрической постоянной от расстояния (Guenot and Kollman, 1992, Guenot and Kollman, 1993). Для того, чтобы учесть влияние среды, диэлектрическая проницаемость рассчитывалась по формуле ε = d · [ε0 + (1 - s) · (ε1 - ε0 )], где d – расстояние между взаимодействующими атомами, а s – величина, принимающая значения от 0 до 1 в зависимости от того, если взаимодействующие атомы находятся в водной среде (0) или в белковой поре (1), ε1 = 8, ε0 =2 (Garden and Zhorov, 2010). Для ускорения расчёта, взаимодействия между атомами, удаленными друг от друга более чем на 8 Å, не учитывались. Такая отсечка вносит заметные искажения при расчете дальнодействующих электростатических взаимодействий (Brooks, Brunger et al., 1985). Чтобы минимизировать этот эффект, в молекулах определялись электронейтральные группы атомов, и отсечка производилась не по отдельным атомам, а по электронейтральным группам. При этом для электростатических взаимодействий между ионизированными группами отсечка не применялась. Для пептидных цепей бралась стандартная валентная геометрия и заряды на атомах. В процессе расчётов валентные углы пептидов удерживались жесткими (Zimmerman, Pottle et al., 1977). Поиск оптимальной геометрии проводился методом Монте-Карло с минимизацией энергии (МСМ) (Li and Scheraga, 1987). Для оценочных расчётов этот параметр обычно брался равным 200 – 500, а для сложных задач определения возможных конформаций моделей - от 5000 до 10000. При построении трёхмерного выравнивания между различными каналами, проводилась минимизация расстояния между углеродами основной цепи двух витков pспирали, образованными остатками начиная с p39 и заканчивая p47. При этом минимизация проводилась одновременно для всех субъединиц. 2.2.2. Гомологическое моделирование и системы ограничителей Использование рентгеновских структур белков для создания моделей белков родственных в настоящее время широко распространено. Самый простой способ – 52 зафиксировать главные цепи модели в соответствии с рентгеновской структурой «шаблона». В этом случае свойства моделируемого белка будут отличаться от свойств шаблона только за счет локального влияния замещенных аминокислот. Очевидно, что такой подход продуктивен только для белков, демонстрирующих очень высокую гомологию с шаблоном. В противном случае, необходимо учитывать деформации главной цепи, вызванные замещением аминокислот. Альтернативным подходом является задание начальной геометрии в соответствии с рентгеноструктурными данными и её дальнейшая оптимизация. При этом, как правило, возникают две главные проблемы. В ряде случаев моделируется только часть белка, конформация которой без внешних стабилизирующих факторов не является стабильной. Очевидно, что свободная оптимизация такой незамкнутой системы приведет к её распаду. Вторая проблема состоит в том, что в начальной геометрии модели замещённые аминокислоты часто формируют запрещённые (близкие) контакты. Естественно, такие контакты обладают очень высокой энергией, и при оптимизации система буквально «взрывается», то есть теряет гомологию с шаблоном. Из сказанного очевидно, что создание корректной гомологической модели требует применения специфических приемов. В рамках данной работы при создании моделей использовались системы «ограничителей» (constraints). Ограничители представляют собой дополнительные потенциальные функции для удержания конформации системы в заданных пределах. Потенциальные функции ограничителей имели вид парабол с плоским дном (flat-bottom parabolic functions). Энергия ограничителя равна 0, если конформация системы находится в заданных пределах (плоское дно). Если же конформация отклоняется от предельных значений, энергия ограничителя растет пропорционально квадрату отклонения. Наиболее часто использовались два типа ограничителей: ограничитель отклонения декатровых координат атома от заданных значений и ограничитель расстояния между атомами. Ограничитель отклонения декартовых координат накладывался на С-альфа атомы аминокислот. В качестве центра разрешённой области брались рентгеновские координаты. Радиус плоского дна ограничителя обычно составлял от 1 до 2 Å. Ограничитель расстояния между атомами применялся для фиксации специфических взаимодействий, например, водородных связей или солевых мостиков. 53 Преимущество системы ограничителей состоит в том, что они не допускают развала системы и при этом не замораживают её степеней свободы. Как правило, ограничители отсеивают только те конформации, которые удовлетворяют заданным параметрам. В некоторых случаях после МСМ расчёта на ограничителях оставалась заметная энергия. Это означало, что в области, заданной ограничителями, система неустойчива. Такой ограничитель считался неестественным и снимался или модифицировался. Таким образом, построение модели включало разработку системы ограничителей и последующий МСМ расчет низкоэнергетических конформаций системы. При разработке системы ограничителей использовался весь спектр доступных экспериментальных данных. Простое ограничение декартовых координат С-альфа атомов аминокислот вблизи рентгеновских значений не всегда продуктивно. Простейший пример – вставки и делеции в цепи, вблизи которых применять ограничители декартовых координат С-альфа атомов просто невозможно. В некоторых случаях, как например при моделировании натриевых рецепторов по шаблону калиевого канала, изначально было ясно, что N-конец мембранной петли имеет иную конформацию, чем в шаблоне, поскольку свойства селективных фильтров каналов резко различаются. В этих случаях использовалась фиксация специфических взаимодействий. Например, ограничители расстояний, фиксирующие α-спиральные водородные связи, не препятствуют изменению ориентации спиралей и их деформации, однако удерживают вторичную структуру. Ценным методом выявления специфических связей является анализ первичных структур гомологичных белков. Например, в структуре прокариотического натриевого канала NavAb существует контакт между Q p45 и Rp58, которому можно найти аналоги в модели Nav1.4, построенной на его основе. 2.2.3. Анализ лиганд-рецепторного взаимодействия Ключевую роль в исследованиях методами Монте-Карло играет изучение взаимодействия между молекулами и отдельными функциональными группами. Для сложных систем, таких как ионные каналы и воздействующие на них токсины, основным рассматриваемым вопросом будет взаимодействие между частями системы. Экспериментальные данные по взаимодействию органических лигандов с каналами 54 являлись одним из оснований для построения моделей каналов. С другой стороны, одной из важнейших целей создания моделей был анализ действия лигандов и предсказание новых структур. Поэтому очевидно, что моделированию связывания блокаторов в каналах уделялось особое внимание. Конформационная энергия комплекса блокатор-канал может быть подразделена на три основные составляющие: внутренняя энергия блокатора, внутренняя энергия канала и энергия взаимодействия. Раздельный анализ этих компонент часто оказывается полезен. В свою очередь, энергия взаимодействия может быть разложена по отдельным аминокислотным остаткам модели, то есть может быть определён вклад каждом аминокислоты в энергию взаимодействия. Такой анализ необходим в тех случаях, когда блокатор взаимодействует одновременно с большим числом аминокислот, что очень актуально в случае связывания конотоксинов. Одним из методов, используемых при изучении вопросов связывания тетродотоксина с натриевым ионным каналом, было построение энергетических п рофилей связывания. Энергетический профиль представляет собой график, отображающий энергию взаимодействия между лигандом и рецептором, в зависимости от положения лиганда на оси канала (где канал является рецептором). Отсутствие на графике профиля областей с положительными энергиями, которые соответствуют отталкиванию, позволяет делать выводы о беспрепятственном движении лиганда относительно рецептора. Аналогичный подход применялся для расчёта траектории иона в канале, блокированном конотоксином. Так как основным объектом работы являлись µ-конотоксины, которые полностью или частично блокируют ток ионов через канал, то необходимо было разработать подход, который бы позволил оценить величину ионного тока через канал, связанный с конотоксином. Для этого был предложен следующий подход: создавалось 10 000 стартовых позиций, в которых ион случайным образом размещался в области селективного фильтра и наружной поры, после чего проводилась короткая минимизация энергии (10 минимизаций для каждой из 10 000 структур). Для анализа выбирались только те структуры, где энергия взаимодействия иона с остальной системой была отрицательной (то есть превалировали 55 силы притяжения). Такой подход позволял найти области, которые могут быть заполнены ионами. В качестве количественной характеристики тока использовалось число ионов на определённой точки оси координат. 2.3. Программное обеспечение Сложные протоколы гомологического моделирования и анализа связывания блокаторов предъявляют высокие требования к программному обеспечению расчетов. Многие существующие программные пакеты для конформационного анализа плохо приспособлены для решения таких задач. К тому же, в процессе исследования постоянно возникают новые потребности, такие как более развитые системы ограничителей, новые способы оптимизации структур и обработки результатов. Поэтому, для проведения серьёзной модельной работы, не ограничивающейся стандартными протоколами, необходимо поддерживать и развивать специализированные программы. 2.3.1. ZMM Такой пакет расчётных программ (ZMM) был создан Б.С.Жоровым. Он поддерживается и постоянно усовершенствуется (Zhorov, 1981, Zhorov, 1982, Zhorov, 1993, Zhorov and Ananthanarayanan, 1994, Zhorov and Ananthanarayanan, 1995, Zhorov and Ananthanarayanan, 1996, Zhorov and Ananthanarayanan, 1998, Zhorov and Ananthanaraya na n, 2000, Zhorov and Lin, 2000). В ZMM реализованы алгоритмы Монте-Карло с минимизацией энергии. Пакет поддерживает функции, необходимые для гомологического моделирования, в том числе системы ограничителей. Версия 2015 г. включает 11 отдельных программ, позволяющих задать практически любые условия расчёта (свыше 100 численных параметров расчёта!). Одно из основных преимуществ этого пакета – описание молекулярных систем и минимизация энергии во внутренних координатах. Внутренними координатами являются: длины валентных связей, валентные и торсионные углы, а также декартовы координаты и эйлеровы углы, определяющие положение отдельных молекул. Разумеется, полное описание системы в декартовых координатах атомов и во внутренних координатах идентичны. Однако во многих случаях, в частности для белков, можно без потери точности принимать длины связей, валентные углы и конформации отдельных групп (например, 56 фенильной) фиксироваными. Тогда конформация полипептидной цепи задается только частью торсионных углов, что приводит к более экономному описанию в терминах внутренних координат. 2.3.2. Прочие При анализе сложных белковых структур, эффективные и удобные средства визуализации становятся важным компонентом расчётных систем. В рамках данной работы использовалась программа молекулярной графики (MVM) для персональных компьютеров. Программа работает в операционной системе Windows. Для создания изображений используется библиотека OpenGl. Программа рассчитана на визуализацию молекулярных систем размером до 256 тысяч атомов. Кроме набора разнообразных средств управления и визуализации, MVM обеспечивает пользователю интерактивную среду для управления расчетным пакетом ZMM. При этом возможно управление расчетными программами и вывод информации в ходе работы. В то же время графическая (MVM) и расчетная (ZMM) части являются независимыми и могут использоваться раздельно. Для проведения статистического анализа и построения корреляционных зависимостей использовалась свободно распространяемая программная среда R, и её графическая оболочка RStudio. Также, в рамках изучение специфических контактов и молекулярных детерминантов фолдинга каналов, строились графы контактов внутри канала. При этом использовалась свободно распространяемая программа yEd graph editor. 57 Глава 3. Результаты и их обсуждение. Поставленная в исследовании цель: изучение методами молекулярного моделирования строения эукариотических натриевых каналов, а также механизмов ионной проницаемости и блокады каналов, требует комплексного подхода. Поэтому дальнейшую работу можно условно разбить на четыре взаимосвязанные части: изучение проблем гомологического моделирования, изучение механизмов блокады, создание модели канала и, непосредственно, изучение действия µ-конотоксинов при помощи модели. 3.1. Проблемы гомологического моделирования Как было сказано ранее, основным методом, позволяющим исследовать ионные каналы, структура которых ещё не известна, является гомологическое моделирование. Одним из ключевых моментов в гомологическом моделировании является именно выравнивание аминокислотных последовательностей, позволяющее найти совпадающие по положению остатки в структуре-шаблоне для остатков моделируемого белка. Очевидно, что неверное выравнивание делает всю гомологическую модель неадекв атной. Например, аминокислотный остаток, который смотрит в пору канала, в результате неверного выравнивания окажется сориентирован в другом направлении. Хотя в гомологическом моделировании используются методы оптимизации пространственных структур, результаты неверного выравнивания как правило не могут быть устранены, особенно в области регулярных вторичных структур. У современных методов выравнивания есть существенные недостатки. Например, макромолекулы, даже родственные, но находящиеся на достаточном удалении друг от друга в эволюционном дереве, зачастую последовательностям. Алгоритмы очень сильно различаются по своим же, которые используются в программах для выравнивания последовательностей, ищут определённые сходства, ориентируясь на консервативность аминокислот. Таким образом, построенное выравнивание носит 58 вероятностный характер и не застраховано от ошибок. Поэтому на первом этапе работы было проведено исследование, включающее комплексный анализ первичных структур, сравнение доступных трехмерных структур и косвенных (главным образом функциональных) данных, которое позволило выявить несовпадение традиционного выравнивания по первичным структурам с трехмерными структурами в p-loop каналах. 3.1.1. Выбор выравнивания порообразующих спиралей Р-loop каналов Для начала построим выравнивание между последовательностями канала TRPV1 и трёх калиевых каналов: Kv1.2, KcsA и MlotiK при помощи средств линейной (одномерной) биоиноформатики (в данном случае это сервер Clustal Omega), и сравним это линейное выравнивание (1D выравнивание) с результатами 3D выравнивания известных пространственных структур этих белков (рисунок 15) (здесь и далее используется универсальная нумерация, предложенная (Zhorov and Tikhonov 2004), см. п. 1.2.1). Рисунок 15. Выравнивание структур p-loop каналов. Сверху – линейное выравнивание. Снизу – расстояние между атомами углеродов основной цепи разных каналов относительно MlotiK. 59 Рисунок 16. Трёхмерное наложение p-спиралей p-loop каналов. Сверху вниз: наложение структур Kv1.2 и MlotiK; наложение структур TRPV1 и MlotiK, исходя из выравнивания Clustal Omega (A); наложение структур TRPV1 и MlotiK, с модифицированным выравниванием (B). Подобие последовательностей между TRPV1 и калиевыми каналами весьма низкое (порядка 21%). В таких случаях белки часто имеют совершенно разные пространственные структуры. 3D выравнивание структур каналов Kv1.2, KcsA, MlotiK и TRPV1 (PDB коды 2a79, 1bl8, 3beh и 3j5p соответственно) было произведено по процедуре минимизации RMSD для p-спиралей, описанной в разделе «Методы» (стр 52). Результаты представлены на рис. 1617. Видно, что в случае, к примеру, TRPV1 и MlotiK пространственная укладка сохраняется. Что же касается калиевых каналов, то они достаточно консервативны как по последовательности, так и по пространственной укладке. 60 Рисунок 17. Трёхмерное наложение структур каналов TRPV1 и MlotiK. Структура MlotiK показана оранжевым, структура TRPV1 – зелёным. Обратим более пристальное внимание на построенное нами одномерное выравнивание. Clustal-Omega правильно предсказывает выравнивание в области S5спиралей всех исследуемых каналов, ориентируясь на положение заряженного остатка аргинина в позиции о5 и наличие характерных ароматических остатков в позициях о14 и о19 (рисунок 15). В Р-спирали, используя мотив TХGХGD, свойственный калиевым каналам, ClustalOmega выравнивает области селективного фильтра. Как видно из рисунка 16, в случае калиевых каналов трёхмерное наложение полностью подтверждает этот вывод: к примеру, триптофаны в позиции p42 явно находятся в одной и той же позиции как в MlotiK, так и в Kv1.2 (то же самое верно и для KcsA). Но в то же время, в связи с низкой консервативностью TRPV1 относительно калиевых каналов, выравнивание Р-спирали неднозначно. Для количественной оценки различий в трёхмерном выравнивании была рассчитана величина среднеквадратического отклонения (СО) для α-углеродов двух центральных витков Рспирали (от остатка p39 до p47). Если использовать выравнивание, основанное на 61 совпадении сигнатуры селективного фильтра (GXG), то мы получим большое значение СО, равное 2.27 Å (TRPV/A). В то же время между калиевыми каналами мы получаем величину СО равную 0.58 Å для пары MlotiK/Kv1.2 и 0.91 Å для пары MlotiK/KcsA. Из рассмотрения трёхмерных структур видно, что остатки MlotiK_Lp45 и TRPV_K p45, занимающие одно и то же положение в выравнивании по Clustal-Omega, имеют совершенно разную пространственную ориентацию (рисунок 16). Визуальное сравнение трехмерных структур позволило предложить альтернативное выравнивание последовательностей, представленное на рис 15 (TRPV/B). В этом выравнивании мотив GMG сдвинут относительно GYG на две позиции. Расчет 3D выравнивания, проведенный на основе этого предположения показал, что СО падает более чем в полтора раза, и становится равным 1.32 Å. Хотя это по-прежнему выше, чем соответствующие значения для калиевых каналов, но это неудивительно, так как консервативность последовательностей между каналами достаточно низкая. Более того, 3D выравнивание ставит в одно положение остатки MlotiK_Lp42 и TRPV_Ep42 , ориентации которых совпадают (рисунок 16). Таким образом, сопоставление структур атомного разрешения, позволило однозначно установить роль и пространственное расположение каждого конкретного аминокислотного остатка в цепи. 3.1.2. Анализ стабилизаторов в структурах каналов Построение трёхмерного выравнивания позволило нам увидеть сходства и различия в структурах изучаемых ионных каналов, но само по себе оно не даёт ответа на вопрос, почему эти отличия возникают. Для этого необходимо было дополнительно изучить внутренние взаимодействия в канале, а именно: внутрисегментные и межсегментные контакты между остатками аминокислот. Анализ контактов внутри каналов проводился по следующей методике: контактом считались все взаимодействия, полученные в модели, при расстоянии между взаимодействующими группами не более 5 Å и энергией взаимодействия менее -0.3 ккал/моль (что соответствует более сильному притяжению). Такой порог был выбран эмпирически, путём рассмотрения контактов в трёхмерной структуре и сравнения их с общим списком взаимодействий. Следует 62 дополнительно отметить, что энергия, рассчитываемая в модели, не является свободной энергией, а служит оценкой конформационной энергии системы. Были рассмотрены следующие четыре канала: TRPV1, MlotiK, Kv1.2 и KcsA. Эти каналы имеют схожую структуру, свойственную калиевым каналам, что позволяет изучить их на предмет сходств и различий в контактах между аминокислотными остатками. Структуры этих ионных каналов были предварительно оптимизированы согласно методике минимизации, описанной в разделе «Методы» (стр 51). На рисунке 18 показаны рассчитанные энергии внутрисегментных и межсегментных контактов и количество значимых контактов для каждого остатка в p-спирали. Верхняя половина графика соответствует суммарному количеству контактов, образованных соответствующим остатком, а нижняя часть показывает суммарную энергию его контактов, взятую по модулю. В калиевых каналах консервативные триптофаны в позициях p41 и p42 образуют больше контактов, чем любой другой остаток, и суммарная энергия их контактов значительно ниже (более предпочтительна), чем для остальных остатков. Рисунок 18. Количество и энергия контактов, образуемых остатками в p-спирали. Верхняя часть графика показывает суммарное количество контактов, образовываемых соответствующим остатком, а нижняя – суммарную энергию этих контактов. 63 Для более наглядного представления данных по наиболее важным контактам была разработана схема графической визуализации контактов. На рисунке 19 схематически изображены контакты, образуемые наиболее важными остатками, и даны изображения этих контактов в трёхмерной структуре. Глядя на схемы, можно заметить, что, хотя между каналами и наблюдаются различия, но основные контакты достаточно консервативны. Боковая цепь триптофана Wp41 вытянута в сторону соседней субъединицы и взаимодействует с N-концом S6-спирали, особенно с остатками в позициях i4 и i8, а также образует плотный контакт с консервативным аспартатом в позиции p54. Эти контакты стабилизируют пространственную укладку селективного фильтра канала. Боков ая цепь второго триптофана (в позиции p42) вытянута в сторону полости между S5 и S6 спиралями субъединицы, в которой находится триптофан, и образует несколько контактов. Хотя в разных каналах Wp42 образует контакты с разными остатками в S6-спирали (это могут быть i6, i7 или i10), тем не менее, общая ориентация триптофана и его контакты в целом консервативны среди каналов. Такие же контакты можно найти и в других калиевых каналах, таких как KirBac1.1, KvAP и MthK. В канале KcsA есть ещё один остаток, играющий важную роль в стабилизации структуры: глутамат в позиции p45, боковая цепь которого согласно рентгеноструктурным данным (Doyle, Morais Cabral et al., 1998) близка к аспартату в позиции p54. Если оба остатка ионизированы, то электростатическое отталкивание не позволило бы им образовать контакт. Для решения этого парадокса (Berneche and Roux, 2002) было предположено, что такая пара имеет один общий протон, что позволяет им образовывать плотный контакт. В нашей модели Ep45 находился в протонированном состоянии, что позволило получить отрицательную энергию взаимодействия, что соответствует притяжению. В канале TRPV1 отсутствуют триптофаны в позициях p41 и p42. Вместо них в последовательности находятся лейцин и глутамат, которые, согласно расчётам, не формируют сильных контактов. Тем не менее, остатки F p44 , K p45 и Fp46 образуют много плотных контактов. Фенилаланин в позиции p44 взаимодействует с S6 спиралью той же субъединицы и дотягивается до боковой цепи тирозина o14 в центре S5 спирали соседней субъединицы. Фенилаланин в позиции p46 взаимодействует с S6 спиралью той же субъединицы, в частности, с тирозином o10. Стоит отметить, что o14 и o10 формируют 64 контакт друг с другом. Также интересен контакт, возникающий между аспартатом в позиции p54 и лизином в позиции p45 (который соответствует Ep45 в KcsA). По-видимому, между остатками образуется солевой мостик, что даёт сильный контакт. Таким образом, калиевые каналы и TRPV1 образуют цепь контактов, формирующих циклическую структуру, состоящую из контактов между остатками Р-петли и S6 спиралей различных субъединиц (рисунок 20). Если смотреть с внеклеточной стороны, то общий вид стабилизаторов похож в калиевых каналах и TRPV1. И там, и там пара ароматических остатков образует кольцо с участием остатков S6 спирали. 65 Рисунок 19. Схематическое и трёхмерное изображение наиболее важных контактов в pспирали. Цвет вершины графа соответсвует цвету субъединицы (жёлтый – I, зелёный – II, лиловый – III, голубой – IV), цифры рядом со стрелочками показывают энергию взаимодействия между вершинами. 66 Рисунок 20. Схематическое и трёхмерное изображение колец, образуемых контактами остатков p-спирали. Цвет вершины графа соответсвует цвету субъединицы (жёлтый – I, зелёный – II, лиловый – III, голубой – IV). 67 3.1.3. Выбор выравнивания S5 и S6 спиралей в гомологических моделях Все приведённые выше данные относятся преимущественно к Р-петлям и Рспиралям. Однако, не менее важную роль в формировании поры играют внешняя и внутренняя спирали канала: и здесь тоже существуют свои сложности в построении выравнивания. Ранее разными авторами было предложено несколько различных вариантов. Липкинд и Фоззард (Lipkind and Fozzard, 2000) в своей модели натриевого канала Na(V)1.4, построенной на шаблоне бактериального калиевого канала KcsA предложили выравнивание порообразующих спиралей (S6 в Na(V)1.4 и M2 в KcsA), исходя из следующих соображений. В KcsA ключевую роль в образовании спирали M2 играет триптофан в позиции i2, поэтому были выбраны наиболее подходящие крупные гидрофобные остатки в каждой из субъединиц Na(V)1.4, чтобы выравнивать последовательности по ним. Это позволило боковым цепям фенилаланина и тирозина в сегменте S6 четвертого домена (F4i15 and Y4i22 ), участвующим в связывании Na(V)1.4 с местными анестетиками (Chahine, Chen et al., 1992, Fozzard, Sheets et al., 2011), занять позиции, соответствующие изолейцину-i15 и треонину-i22, которые обращены в пору KcsA, согласно ретгеновской структуре. Аспарагин-1i19 и лейцин-1i22 в первом домене также оказались обращенными в пору, что согласуется с результатами мутационного анализа воздействия местных анестетиков (рисунок 21). Выравнивание между собой S5 различных субъединиц основывалось на наличии консервативных фенилаланинов на Cконце спирали (и тирозина в четвёртой субъединице). Хубер и соавторы (Huber, Wappl et al., 2000) для выравнивания последовательностей кальциевого канала L-типа и калиевого канала KcsA использовали процедуру «поиска посредника». Авторы использовали парные выравнивания между кальциевым каналом Cav1.2 и натриевым каналом Na(V)1.4, между KcsA и Shaker калиевым каналом (Schrempf, Schmidt et al., 1995), и между Na(V)1.4 и Shaker калиевым каналом (Guy and Conti, 1990). Однако ни одно из предложенных выравниваний не было достаточно убедительным, чтобы принять его как единственно верное. Поэтому в своей работе Жоров и соавторы (Zhorov, Folkman et al., 2001) предложили проверить эти варианты, используя их для 68 построения модели кальциевого канала L-типа, и анализируя данные по взаимодействию каналов с дигидропиридинами. Построив различные гомологичные модели кальциевого канала, авторы показали, что лучше всего объяснить экспериментальные данные можно только в определённой модели (рисунок 21), где остатки, отвечающие за связывание лиганда будут находиться в поре канала, а S5 спирали – согласно выравниванию из работы (Huber, Wappl et al., 2000). Последовательности S6 спиралей выравниваются аналогично с выравниванием, предложенным Липкиндом и Фоззардом, однако с изменениями в сегменте (IS6), которое в 3D моделях приводит к противоположным ориентациям ключевого остатка, аспарагина N1i20 , который не обращён в пору канала и участвует в межсегментных взаимодействиях, чем и объясняется его влияние на свойства каналов и связывание лигандов (Tikhonov, Bruhova et al., 2015). При таком выравнивании все высококонсервативные остатки аспарагина в S6 сегментах натриевых и кальциевых каналов занимают одно и то же положение (рисунок 21). Рисунок 21. Выравнивание между натриевыми, калиевыми и кальциевыми каналами. Материалы взяты из работ (Huber, Wappl et al. 2000, Lipkind and Fozzard 2000, Zhorov, Folkman et al. 2001). 69 Появление структуры бактериального натриевого канала NavAb (Payandeh, Scheuer et al., 2011) дает ценную информацию для решения проблемы выравнивания. Отметим два важных аспекта структуры NavAb. Во-первых, поскольку тип укладки NavAb такой же, как и в калиевых каналах, можно построить однозначное выравнивание последовательностей, основанное не на методах линейной биоинформатики, а на расчете выравнивания трёхмерных структур, по процедуре, описанной в методах (стр. 52). Результаты расчета, представленные на рис 22. позволяют получить однозначное выравнивание с калиевыми каналами, представленное на рис 21. Рисунок 22. Трёхмерное наложение структур каналов NavAb и MlotiK. Структура NavAb показана оранжевым, структура MlotiK – зелёным. С другой стороны, NavAb, как близкий родственник эукариотических натриевыхканалов, однозначно выравнивается по последовательностям с натриевыми и кальциевыми каналами (для выравнивания использовались алгоритмы Clustal Omega). NavAb и Nav1.4 гораздо легче выравнивать относительно друг друга, за счёт наличия высококонсревативных остатков в разных сегментах. Так, на N-конце S5 спирали находится мотив из аспарагина, лейцина и фенилаланина, полностью повторяющийся в двух доменах Nav1.4 и в NavAb, но отсутствующий в калиевых каналах, что позволяет однозначно построить выравнивание между S5 спиралями. Кроме того, такое выравнивание подтверждается консервативными ароматическими остатками в середине спирали S5. В S6 спиралях также есть несколько ключевых позиций: консервативные аспарагины в середине 70 спирали, консервативный набор фенилаланинов, которые, вероятно, являются стабилизаторами структуры натриевых каналов и поэтому у них должен быть аналог в родственных каналах. Разумеется, тот факт, что Nav1.4 является гетеротетрамером, затрудняет изучение структуры, но всё же сходство между последовательностями достаточно высоко, чтобы с высокой степенью вероятности говорить о возможности построения гомологической модели по такому выравниванию. Таким образом проведенный анализ одномерного и трехмерного выравнивания NavAB с известными последовательностями и трехмерными структурами показал, что этот канал может служить своеобразным посредником для построения выравнивания между калиевыми каналами и натриевыми каналами эукариот. Выравнивание S5 и S6 спиралей, полученное при использовании структуры NavAB совпало с выравниванием, предложенным в работе (Tikhonov and Zhorov, 2012). Именно это выравнивание было использовано в дальнейшем при построении модели. 3.1.4. Заключение Выравнивание последовательностей является ключевым шагом в построении гомологических моделей. Поскольку традиционные методы выравнивания, опирающиеся исключительно на анализ аминокислотных последовательностей, не несут информации о функциональных свойствах белков, то включение в рассмотрение трёхмерных структур и других данных является крайне важным. Проведенный анализ и расчеты позволили построить однозначное выравнивание междупоследовательностями и пространственными структурами p-loop каналов, включая натриевые каналы эукариот, моделирование который является основной задачей работы. 3.2. Стерические и электростатические факторы блокады ионных каналов Гомологическое моделирование представляет собой лишь первый этап работы по изучению механизмов лиганд-рецепторных взаимодействий. Не менее сложной частью является моделирование посадки лигандов в канале. И здесь, в свою очередь, существует большое количество факторов, которые необходимо принимать во 71 внимание при проведении комплексного исследования. Взаимодействие между ионами, блокирующими канал и ионами, обеспечивающими ток через канал, является одной из фундаментальных проблем в области фармакологии ионных каналов. Блокирующая пространственный/гидрофобный/электростатический барьер частица для создает нормального проникновения ионов (Catterall, 2002). Однако вклад этих компонент в блокирующий эффект остается предметом научной дискуссии (см. стр. 26). Недавно была опубликована структура NavMs канала, связанного с препаратом, родственным локальным анестетикам: 2-(4-бромфенил)-1-(5-(4-хлорфенил)-1Н-имидазол2-ил)этанамин) (Bagneris, DeCaen et al., 2014). Несмотря на то, что в структуре связанного лиганда виден лишь один тяжелый атом лиганды (бром), были обнаружены две очень важные особенности. Во-первых, атом брома, являющийся терминальным атомом ароматической группы использованного лиганда, находится в интерфейсе субъединицы. Во-вторых, ионная заселённость участка вблизи центральной полости существенно снижается в присутствии блокирующего препарата. На основании этих результатов авторы предложили модель, в которой ароматический фрагмент, содержащий атом брома, находится в интерфейсе субъединицы, в то время как аминогруппа выступает в пору и противоположный конец препарата располагается в селективном фильтре, тем самым стерически смещая находящийся там ион. Некоторые ключевые особенности этой модели совпадают с предыдущими предложениями, высказанными в работе Бруховой и соавторов, которые основаны на модельной интерпретации косвенных данных (Bruhova, Tikhonov et al., 2008). На рисунке 23 показано, что единственное существенное отличие состоит в том, что используемые в моделях молекулы местных анестетиков (такие как тетракаин и лидокаин) не имеют длинных групп на амино-конце, поэтому они не в состоянии войти в селективный фильтр и стерически вытеснить из него ионы. Поэтому, чтобы объяснить экспериментально наблюдаемые взаимодействия между местными анестетиками и ионами натрия, в этой модели предполагается, что природа этих 72 взаимодействий в первую очередь электростатична. Таким образом, модель, предложенная в работе (Bagneris, DeCaen et al., 2014) может быть верна для блокады канала NavMS лигандом Pl1, но, по-видимому, не может объяснить, взаимодействие между локальными анестетиками и ионами в эукариотических натриевых каналах. Рисунок 23. Посадка локальных анестетиков в канале. Сверху: наложение модели из работы (Bruhova, Tikhonov et al. 2008) со структурой, полученной в работе (Bagneris, DeCaen et al. 2014); видно, что хвост молекулы блокатора находится в интерфейсе между субъединицами канала; снизу: химические структуры локальных анестетиков. В связи с этим возникает вопрос: возможно ли предложить альтернативную интерпретацию данных, полученных исследователями в этой работе? Как будет показано далее, экспериментальные данные зачастую можно объяснить несколькими моделями, каждая из которых имеет свои плюсы и минусы. 73 3.2.1. Изучение возможных способов связывания лиганда Первым шагом, необходимым для построения модели связывания лиганда с каналом всегда является создание модели самого канала. Для этого использовалась структура высокого разрешения, которая была дополнительно оптимизирована для получения лучшей оценки энергетики системы. Оптимизация проводилась в два этапа: на первом этапе проводилась минимизации с ограничениями на альфа-углероды структуры, чтобы они не отклонялись от оригинальной структуры более чем на 1 Å. На втором этапе все ограничения были сняты и модель канала была оптимизирована до тех пор, пока 5000 шагов минимизации не уменьшили энергию кажущегося глобального минимума. С точки зрения моделирования, наиболее интересным из представленных в работе (Bagneris, DeCaen et al., 2014) данных является полученная структура с известной локализацией атома брома, входящего в состав лиганда – блокатора канала. Действительно, размеры интерфейса и размеры молекулы лиганда практически однозначно определяют положение ароматического фрагмента последнего. В то же время противоположный конец молекулы, который находится в достаточно широкой полости канала, обладает значительной конформационной свободой. Для того, чтобы изучить возможные ориентации лиганда, использовался следующий подход: лиганд помещался по центру вестибюля канала, после чего проводились случайные изменения его ориентации. Всего было создано 100 000 различно ориентированных стартовых позиций, каждая из которых была дополнительно оптимизирована. На рисунке 24 показан низкоэнергетических структур, полученных в результате минимизаций. 74 ансамбль Рисунок 24. Ансамбль низкоэнергетических структур, полученных для посадки Pl1. Жёлтым показан атом хлора в составе Pl1, оранжевым – атом брома, а синим – аминогруппа. Структура канала окрашена в цвета различных участков канала: p-спираль (лиловый), s5 (зелёный) и s6 (голубой). Атом брома (оранжевый), как правило, находится в интерфейсе между субъединицами, при этом учитывались только те конформации, при которых он находится не далее, чем в 3 Å от положения атома в рентгеновской структуре. При этом, как видно, аминогруппа лиганда находится в центре канала, а хлор, находящийся на противоположном конце, имеет значительную конформационную свободу. Аминогруппа лиганда в большинстве случаев подходит к свободному кислороду Tp48 , что согласуется с предположением, высказанным в работе (Bagneris, DeCaen et al., 2014). Если же рассматривать положение дальнего от брома конца лиганда, то в целом можно выделить два основных варианта его расположения (рисунок 25). В первом случае лиганд проникает в область селективного фильтра и смотрит в сторону внеклеточного пространства, что, опять же, согласуется с предложенным авторами вариантом посадки. Однако в большом количестве низкоэнергетических структур фрагмент остается в полости канала, и для таких конформаций стерическое вымещение иона из области селективности фильтра невозможно. 75 Таблица 1. Энергия взаимодействия лиганда с остатками канала в двух конформациях. Остаток канале в Горизонтальная конформация Вертикальная конформация TIVp48 -2.93 -2.96 LIIIp49 -1.49 -3.07 LIVp49 -1.12 -3.77 TIIIi15 -0.88 -2.38 FIVi22 -1.81 -1.92 MIVp47 -1.21 -1.09 LIp49 -0.31 -1.76 MIIIi12 -1.11 -0.82 EIp50 -0.32 -1.61 EIVp50 -0.40 -1.70 EIIp50 -0.23 -1.08 Таким образом, в одной возможной конформации лиганд стерически вытесняет ионы из селективного фильтра, что объясняет полученные экспериментальные данные, а в другой стерическое замещение ионов в фильтре невозможно. Но можно ли предложить другое объяснение для полученных данных, исходя из модели горизонтальной посадки лиганда? Чтобы ответить на этот вопрос изучим поведение ионов в канале, в особенности в области селективного фильтра. 76 Рисунок 25. Два варианта расположения лиганда Pl1 в канале. Слева: лиганд проникает в область селективного фильтра и стерически препятствует току ионов через канал; справа: лиганд располагается между различными субъединицами таким образом, что заряженная группа оказывается на оси канала, оказывая электростатическое воздействие на ионы. 3.2.2. Распределение ионов в области селективного фильтра Точное число ионов натрия, которые могут одновременно находиться в поре канала, неизвестно. Поэтому для поиска оптимальных вариантов распределения ионов в канале было решено провести поэтапное изучение распределения в случае с разным количеством ионов в системе. В первом приближении в систему был добавлен только один ион. Для оценки его вероятного местоположения было создано 40 стартовых позиций иона равномерно по всей оси канала в области селективного фильтра и проведена МК минимизации его положения. Если посмотреть на полученное распределение возможных положений иона вдоль оси канала, то видно, что наблюдается одна предпочтительная позиция для иона – в области глутаматов селективного фильтра (рисунок 26). Эта позиция хорошо соответствует данным о карте электронной плотности в селективном фильтре (Bagneris, DeCaen et al., 2014). Зная расположение одного иона в канале, можно усложнить задачу. Добавим второй ион в систему, распределив его стартовые положения так же, как и для одного иона, вдоль оси канала в области селективности фильтра. При этом первый ион находится в системе в оптимальном положении. Но при этом мы минимизировали положение не только «нового» 77 иона, но и первого, чтобы учесть ион-ионные взаимодействия, которые несомненно играют важную роль в распределении ионов в канале. Расчёты показали, что первый ион по-прежнему занимает свою позицию возле EP50 (будем называть такую позицию иона сайтом I), в то время как второй ион находится глубже в канале (рисунок 26), рядом с входом в центральную полость (назовём это сайт II). Опять же, существование такого сайта хорошо согласуется с данными по электронной плотности ионов в рентгеновской структуре. На следующем этапе был добавлен третий ион и расчеты были повторены, как описано выше (рисунок 26). Увеличение ион-ионного отталкивания привело к сглаживанию пиков оптимальных позиций I и II и к появлению третьего населенного сайта с внеклеточной стороны селективного фильтра (III сайта). При добавлении еще одного, четвёртого иона, ситуация существенно не изменилась, за исключением появления пика распределения в глубине центральной полости и увеличение популяции на I и III сайтах. Однако ионы, находящиеся вдалеке от селективного фильтра, нас не интересуют, поскольку лиганд воздействует на них слишком слабо. Таким образом, расчёты показали, что распределения ионов в селективном фильтре существенно не различаются для систем, содержащих три и четыре иона, достаточно остановиться на трёх ионах для анализа действия лиганда. 78 Рисунок 26. Распределение ионов в канале NavMs. Сверху: распределение ионов вдоль оси канала при наличии одного, двух и трёх ионов в канале. Увеличение количества ионов в модели приводит к незначительному расширению пиков и появлению дополнительных пиков вне канала (на дальних участках оси). Снизу: усреднённая энергия ионов в системе в отсутствии (красным) и при наличии (чёрным) лиганда. Зелёным показана разность энергий. 3.2.3. Влияние Pl1 на энергию связи ионов Для того, чтобы оценить вклад электростатического воздействия, оказываемого лигандом на ионы, необходимо рассмотреть две различные системы: в 79 присутствии лиганда и без него. Энергетика для каждой конформации была пересчитана при наличии в системе лиганда PL1. В качестве модели посадки лиганда использовалась полученная ранее модель с горизонтальной посадкой, оптимизированная для получения наилучшей моды связывания с каналом. На рисунке 26 показаны графики распределения средней энергии ионов для различных положений вдоль оси канала в отсутствии лиганда, в присутствии лиганда и разность между энергиями, что позволяет оценить вклад Pl1 в энергетику ионов в разных позициях. Для ионов, расположенных вблизи кольца Ep5, электростатический эффект присутствия лиганда был незначителен. Но для ионов в сайте II (около полости) расстояние до центра аминогруппы Pl1 составляла порядка 3 – 4 Å. Соответственно, электростатическое отталкивание увеличивается до 1,3 – 1,5 ккал / моль. Абсолютное значение этого отталкивания зависит от диэлектрической функции и ее параметров. Поэтому необходимо сравнить это отталкивание с другими электростатическими взаимодействиями. В таблице 2 показана энергия взаимодействия ионов с различными остатками канала в модели. Основной вклад в удержание ионов в канале вносят Тp48 , Q p45 и Ep50 . Из представленных данных видно, что увеличение электростатического отталкивания, путём включения PL1 в модель, может значительно изменить общую энергию иона в положении II. В целом суммарная энергия электростатического взаимодействия изменяется от -4,8 до -3,4 (изменение энергии на 31%). Таблица 2. Энергия электростатического взаимодействия ионов друг с другом, с остатками в канале и лигандом. Остаток Ион III Ион II Ион I Pl1 1.42 0.37 0.10 1.15 0.16 Ион III Ион II 1.15 0.47 Ион I 0.16 0.47 Ep50 -0.67 -2.51 Tp48 -0.44 Qp45 -0.26 80 -0.39 Следует отметить, что результаты находятся в соответствии с многочисленными наблюдениями. Например, было показано, что наличие ионов К+ внутри и вне клетки приводит к снижению блокады тетраэтиламмонием (Spassova and Lu, 1999, Thompson and Begenisich, 2003). Стоит также отметить, что эффект ионов четвертичного аммония отличается для разных калиевых каналов (например, Kir, Shaker и KcsA), что может быть объяснено различным сродством сайтов в каналах к ионам калия, что приводит к различиям в заселённости сайтов в течение цикла проводимости (Kutluay, Roux et al., 2005). Позднее было показано, что связывание тетрабутиламмония в канале KcsA зависит от заселённости селективного фильтра (1/3 или 2/4 сайтов) ионами калия (Faraldo-Gomez, Kutluay et al., 2007). Полученные же данные по NavMs и Pl1 предлагают аналогичное объяснение антагонизма между ЛА и ионами натрия. 3.2.4. Заключение Подытоживая, проведённое исследование методами молекулярного моделирования позволило продемонстрировать, что связывание лиганда PL1 в канале NavMs может повлиять на заселённость селективного фильтра ионами не только стерически (как предлагается авторами работы (Bagneris, DeCaen et al., 2014)), но также электростатически (когда ни одна из частей лиганда не входит непосредственно в селективный фильтр). Это не означает, что модель (Bagneris, DeCaen et al., 2014) является ошибочной. Как видно из приведённых рассуждений, для конкретного препарата и конкретного канала стерическое смещение действительно возможно. Тем не менее, даже в данном случае мы видим, что возможно предложить альтернативное объяснение экспериментальным данным. Поэтому вряд ли стоит предполагать, что стерический механизм воздействия лиганда является универсальным для молекул локальных анестетиков. В частности, подобный механизм не может быть реализован для молекул местных анестетиков в эукариотических натриевых каналах, потому что в этих молекулах обычно отсутствуют длинные участки, идущие от аминогруппы. Поэтому подобные лиганды просто слишком малы для проникновения в селективный фильтр и для них возможен только электростатический механизм воздействия. Как видно из примера Pl1 и NavMs, электростатический вклад лиганда может быть достаточно значительным, 81 по сравнению с другими электростатическими взаимодействиями в канале. Полученные результаты хорошо согласуются с данными, ранее полученными для гомологических моделей эукариотических натриевых каналов. Однако точность гомологических моделей всегда ограничена и выводы, сделанные из подобных исследований, всегда носят более или менее гипотетический характер. В данном случае использовалась реальная структура атомарного разрешения, в которой существуют чёткие ограничения, накладываемые на положение лиганда, и, что особенно важно, на положение его аминогруппы, которая играет ключевую роль в электростатическом отталкивании. Именно использование подобных экспериментальных данных позволяет получать результаты, которые более надежны, нежели чисто гомологическая модель. 3.3. Блокада натриевых каналов µ-конотоксинами Все предыдущие расчёты и полученные результаты подводят нас к наиболее важной части работы: изучению взаимодействия µ-конотоксинов с эукариотическим натриевым каналом Nav1.4. Для этого необходимо построить гомологическую модель канала, провести моделирование связывания токсинов и сравнить предсказания модели с экспериментальными данными. 3.3.1. Выбор модели В первую очередь, необходимо обратить внимание на некоторые особенности выбора структуры для моделирования. Доступные рентгеновские структуры прокариотических натриевых каналов (NavAb, NavMs, NavRh) имеют одинаковое строение в области поры и селективного фильтра (рисунок 27). В частности, как видно из рисунка, при наложении рентгеновских структур, P1 и P2 спирали разных каналов оказываются очень близки. 82 Рисунок 27. Наложение структур прокариотических натриевых каналов NavAb, NavMs и NavRh. NavAb показан зелёным, NavMs показан лиловым и NavRh показан красным. Дополнительно выделены остатки, формирующие селективный фильтр канала. Так как при построении модели проводится минимизация энергии, то выбор конкретного шаблона не является существенным для моделирования: расхождения в структурах меньше, чем допустимые отклонения модели от шаблона. Следующий важный этап работы – построение выравнивания между каналами. Выравнивание для спиральных сегментов рассматривалось ранее (см. стр. 68). Однако для моделирования связывания лигандов в области селективного фильтра канала критически важно правильно построить выравнивание полседовательностей именно в этой области. Последовательности прокариотических и эукариотических каналов достаточно сильно различаются. В области P-петли идентичность между последовательностью NavAb и первой субъединицей Nav1.4 составляет ~ 21%. В работе Тихонова и Жорова было показано, что прямое выравнивание последовательностей (без вставок-удалений, основанное на положении остатков селективного фильтра) не позволяет построить гомологическую модель Nav1.4, способную объяснить экспериментальные данные по связыванию TTX с каналом (Tikhonov and Zhorov, 2012). Для решения этой проблемы был предложен скорректированный вариант выравнивания с модификациями в области селективного фильтра (рисунок 28). 83 Рисунок 28. Скорректированный вариант выравнивания последовательностей субъединиц Nav1.4 с NavAb. Так как выравнивание последовательностей по остаткам, образующим селективный фильтр, не дало нужных результатов, в работе (Tikhonov and Zhorov 2012) было предложено внести дополнительные изменения. Такое выравнивание позволило построить 3D-модель, в которой остатки, взаимодействующие с TTX ориентированы внутрь поры, в то время как длинные полярные остатки, находящиеся на участках до и после селективного фильтра, образуют межспиральные водородные связи, которые стабилизируют структуру. При этом особенно стоит отметить, что в модели с прямым и модифицированным выравниваниями заметно отличается расположение кольца внешних карбоксилатов, что крайне важно для связывания µ-конотоксинов, как будет видно далее (рисунок 29). 84 Рисунок 29. Трёхмерное наложение моделей Nav1.4, построенных на основании разных выравниваний. Зелёным показана модель с модифицированным выравниванием, а лиловым – модель с прямым выравниванием. Дополнительно показаны внешние карбоксилаты. Однако, тот факт, что модель хорошо позволяет воспроизвести экспериментальн ые данные по взаимодействию с TTX, ещё не значит, что её можно использовать для изучения действия других лигандов, в данном случае – µ-конотоксинов. Для проверки было проведено сравнение моделей с прямым и модифицированным выравниваниями с точки зрения их способности описать экспериментальные данные по наиболее изученному из µконотоксинов: GIIIA. Наиболее важным для нас результаты циклического мутационного анализа, который позволили определить пары взаимодействующих остатков между токсином и каналом (таблица 3). Эти данные были получены в работе (Choudhary, Aliste et al., 2007), и ими можно воспользоваться, чтобы определить набор дистанционных ограничений, которые накладываются на водородные связи или солевые мостики между боковыми цепями соответствующих остатков в канале и токсине. 85 Таблица 3. Экспериментальные данные (Choudhary, Aliste et al., 2007), использованные при построении модели. 1 Остаток токсине K9 2 K11 D1241 сильное 1,9 3 K11 D1532 сильное 2 4 D12 T759 среднее 1,4 5 R13 E403 сильное 2 6 R13 E758 сильное 3 7 R13 K1237 среднее 1,3 8 K16 D1241 сильное 1,9 9 K16 D1532 среднее 1,4 11 R19 D1241 среднее 1,6 12 R19 D1532 сильное 1,9 № в Остаток канале E403 в Сила взаимодействия среднее Энергия (ккал/моль) 1,8 Известно достаточно большое количество взаимодействующих пар (12 пар), но в этом заключается и определённая сложность. В некоторых случаях невозможно однозначно описать взаимодействие между остатком токсина и остатком канала. Например, в соответствии с экспериментальными данными, внешние карбоксилаты III и IV субъединиц канала участвуют в контактах сразу с 3 остатками токсина (Choudhary, Aliste et al., 2007). При этом экспериментально полученная энергия взаимодействия для этих контактов различается. Поэтому при расчётах используются только те взаимодействия, которые отмечены в таблицы как «сильные». Для того, чтобы посадить токсин в пору, не внося никаких дополнительных искажений в структуру канала, GIIIA поместили во внеклеточное пространство над каналом. При этом токсин обращён к каналу стороной, которая содержит основные остатки (K9, K11, R13, и R19 K16), центр масс находится на оси поры и расстояние между плоскостью, образованной альфа углеродами внешних карбоксилат и ближайшим к ним альфа углеродом токсина составляет 11 Å. На этом расстоянии токсин не взаимодействует с каналом. Но если использовать только одну стартовую позицию для токсина, то может 86 оказаться, что его изначальная ориентация относительно оси канала скажется на его итоговой посадке. Чтобы исключить такую возможность, были созданы 36 стартовых конформаций токсина, последовательно вращая его вокруг оси поры. Используя описанные выше взаимодействия в качестве ограничений, проводилась МК-минимизация для каждого варианта. На рисунке 30 представлено изменение энергии системы в процессе минимизации для одного из вариантов. Рисунок 30. Изменение энергии системы в процессе минимизации при посадке GIIIA в канал. Показаны общая конформационная энергия системы, энергия на ограничителях и энергия взаимодействия токсина с каналом. После этого был проведён второй этап минимизаций, на котором все ограничения на взаимодействия были сняты. Это необходимо, чтобы убедиться, что полученные структуры достаточно стабильны. В целом, для различных стартовых точек была получена одна и та же ориентация токсина как в случае прямого, так и в случае модифицированного выравнивания. Рисунок 31 показывает наложение всех моделей, полученных при различных ориентациях GIIIA в модели с модифицированным выравниванием. Этот 87 результат показывает, что система ограничений, предложенная выше, однозначно определяет ориентацию токсина в канале. Рисунок 31. Наложение всех конформаций, полученных при различных ориентациях GIIIA в модели с модифицированным выравниванием. И в одной, и во второй моделях крупный токсин не может поместиться в узкий селективный фильтр. Скорее, он зависает над сужающейся порой таким образом, что боковые цепи основных остатков связывались с внешними карбоксилатами, которы е расположены выше селективного фильтра, ближе к внеклеточному пространству. Важно отметить, что центр масс токсина смещается от оси канала в сторону повтора III (рисунок 32). При этом С-конец спирали токсина сильно взаимодействует с Р2-спиралью повтора III. А N-конец токсина направлен во внеклеточное пространство. Центр же токсина, где находится аргинин R13, оказывается в поре около повтора II. 88 Рисунок 32. Ассиметричная посадка GIIIA в канал. Спираль токсина (оранжевый) смещена относительно оси канала в сторону повтора III. Несмотря на общее сходство в ориентации токсина, результаты показали значительное преимущество модели с модифицированным выравниванием. Для этой модели, СО альфа углеродов в области, где связывается токсин, от структуры NavAb составляло 1.39 Å. После снятия ограничений и повторной минимизации токсин слегка передвинулся (СО α- углеродов между моделью с ограничениями и без них составляет всего лишь 0,5 Å). Для модели с прямым выравниванием, в свою очередь, наложение ограничений привело к искажению структуры канала, и СО между α-карбонами модели и NavAb составляло 2.04 Å. При этом повторная минимизация без ограничений приводила к значительному смещению токсина ~ 4.5 Å (рисунок 33). Энергия взаимодействия между токсином и каналом в модели с прямым выравниванием была на 33% выше («хуже»), чем в модели с модифицированным выравниванием. 89 Рисунок 33. Модели посадки GIIIA полученные для варианта с прямым и модифицированным выравниваниями. Жёлтым показана ориентация GIIIA в модели с прямым выравниванием, а оранжевым – ориентация в модели с модифицированным выравниванием. Для количественной оценки модели дополнительно была рассчитана энергия взаимодействий между отдельными остатками токсина и канала в двух расслабленных моделях (рисунок 34). Используя экспериментально подсчитанные значения энергии парного взаимодействия, приведённые в таблице, можно построить график, отображающий связь между энергией, полученной в модели для данной пары, и экспериментальными данными. Следует отметить, что не все экспериментальные контакты были использованы в качестве ограничений во время процедуры стыковки. Для оценки связи между экспериментом и моделью был использован коэффициент корреляции Пирсона. Для модели с прямым выравниванием корреляция слаба (коэффициент корреляции Пирсона (Р) -0.44, достоверность р = 0,17). А для модели с модифицированным выравниванием коэффициент корреляции -0.71 и корреляция оказалась статистически значимой (р = 0,02). Это во многом неожиданный результат, поскольку модель хоть и ставит перед собой задачу объяснить происходящие в системе процессы, но далеко не всегда можно говорить о численной интерпретации данных. 90 Рисунок 34. Графики корреляций между экспериментально полученными энергиями взаимодействия остатков и расчётными значениями в моделях. Сверху: модель с прямым выравниванием; Снизу: модель с модифицированным выравниванием. Синим показаны контакты, использованные при построении модели. 91 Подводя итоги, можно констатировать, что, модель Nav1.4 с модифицированным выравниванием лучше подходит для изучения взаимодействия µ-конотоксинов с каналом. Поэтому для дальнейшего исследования используется только эта модель. 3.3.2. Связывание GIIIA Рассмотрим подробнее результаты, полученные для взаимодействия GIIIA с Nav1.4. Хотя модель легко воспроизводит многие экспериментально установленные специфические взаимодействия между токсином и каналом, есть и такие, которые не наблюдаются в модели. Наприме, контакт между гидроксипролином h P17 и M1240 (Dudley, Chang et al., 2000). h P17 в модели находится недалеко от Р2-спирали третьего повтора, где находится M1240, но не было найдено никаких специфических взаимодействий между двумя остатками. Гидроксильная группа h P17 при этом находится в непосредственной близости с D1248 на С-конце P2-спирали III повтора. Чтобы изучить возможный контакт между этими остатками, были введены дополнительные ограничения на расстояние между гидроксильной группой h P17 и кислородом D1248, что привело к модели, показанной на рисунке 35. При этом контакты, полученные в предыдущей модели, сохраняются. Такая модель обеспечивает структурное объяснение роли h P17 в действии токсина. Важно отметить, что новый контакт, который предсказывают расчеты, пока не был описан в экспериментальных исследованиях. D1248 не имеет аналогов в гомологичных позициях других повторов, и, таким образом, новый контакт может быть важным фактором, определяющим ориентацию токсина в канале. 92 Рисунок 35. Модель посадки GIIIA с учётом ограничителей на hP17. 93 Таблица 4. Энергия взаимодействия между остатками токсина и остатками канала, рассчитанная в модели. Ключевые остатки канала выделены жёлтым, ключевые остатки токсина – голубым. Красным обозначены экспериментально обнаруженные контакты. D400 Y401 R1 E403 R411 -0,18 0,19 D2 K723 R748 E755 E758 T759 F1216 K1237 M 1240 Y1244 A1245 D1248 R1250 0,24 -0,16 -0,66 -0,42 C10 -0,53 -1,14 -1,43 -1,25 -2,39 -8,22 D1532 -0,16 0,17 K9 0,55 D12 R13 I1242 -0,2 K8 K11 D1241 -1,66 -0,58 -0,55 0,58 0,55 -1,05 -7,41 -0,75 0,16 0,35 -5,23 -4,73 0,65 0,78 -1,52 -2,89 Q14 -0,79 -0,54 -1,3 -0,56 C15 -1,31 0,5 K16 -0,55 0,53 -0,59 -6,54 O17 -2,87 -0,51 -1,00 Q18 -1,28 -0,16 R19 -2,6 -0,89 -0,61 -14,74 -0,61 0,72 -0,57 0,72 -9,29 A22 Total -1,78 -3,53 -11,04 0,36 -0,2 0,5 -0,55 -9,69 -1,8 94 -3,11 1,36 -1,52 -2,09 -0,65 -1,8 Рисунок 36. Наиболее важные контакты, образуемые остатками токсина GIIIA с остатками канала. Показаны различные пары взаимодействующих остатков. В работе (Xue, Ennis et al., 2003), авторы обнаружили, что замена D762 и E765 во втором повторе канала влияет на связывание GIIIA. В полученной модели эти остатки расположены далеко от GIIIA и не могут непосредственно взаимодействовать с ним. Тем не менее, в соответствии с кристаллической структурой NavAb, D762 является важным 95 стабилизатором пространственной структуры поры, образуя солевой мостик с R399. E765 расположен на той же стороне P2-спирали, что и D762, будучи, таким образом, обращён к P1-спирали I повтора. Согласно модели, как D762, так и E765 образуют контакты с R399, что способствует стабилизации пространственной укладки поры. Таким образом, можно предположить, что описанные в работе замещения D762 и E765 аланином (Xue, Ennis et al., 2003) не влияют на связывание токсина непосредственно, а вызывают аллостерические эффекты. Рисунок 37. Межсубъединичные контакты в Nav1.4 играют важную роль в стабилизации структуры. Показаны остатки, образующие устойчивую связь, стабилизирующую структуру поры канала. В полученном комплексе, тело GIIIA, содержащее α-спираль, в основном взаимодействует с P2-спиралью III повтора. Примечательно, что в позиции 1248 находится аспартат, который является привлекательной мишенью для электростатического взаимодействия с токсином. Другие повторы канала имеют нейтральные или положительно заряженные остатки в соответствующих позициях выравнивания последовательностей (рисунок 28). Другой возможной причиной асимметричного связывания токсина является асимметрия внешнего карбоксилатного кольца. В то время как внешние карбоксилаты в повторах I, II, IV находятся в одинаковых позициях, в повторе III D1241 сдвигается на одну позицию по отношению к C-концу. 96 Если взглянуть ещё раз на график соответствия энергии взаимодействия в модели экспериментально рассчитанным энергиям, то видно, что, для некоторых «средних» контактов между внешними карбоксилатами повторов III и IV с токсином точки графика сильно отклоняются от прямой (рисунок 34). Возможной причиной является то, что в расчётах учитывается только одна структура, таким образом, нельзя учесть энтропийный вклад в энергию. Из-за большой конформационной свободы длинных боковых цепей основных остатков токсина и кислотных остатков канала, экспериментально определенные энергии парного взаимодействия складываются из многих микросостояний комплекса канал-белок. Чтобы исследовать эту возможность, были проведены дополнительные расчеты. Используя модель, описанную выше, были сгенерированы 20 000 стартовых точек со случайными конформациями боковых цепей основных остатков GIIIA. Для каждой сгенерированной конформации была проведена минимизация энергии с учётом ограничений, накладываемых на модель. Результаты показаны на рисунке 38. Рисунок 38. Ансамбль низкоэнергетических комплексов, полученных для боковых цепей токсина. Шариками показаны центры заряженных групп остатков токсина. В ансамбле самых низкоэнергетических комплексов, заряженные концы гибких 97 боковых цепей остатков токсина колебались в пределах 5 Å. Это позволяет предположить, что остатки токсина могут формировать контакты с различными остатками токсина, «переключаясь» между ними, не нарушая при этом общей пространственной ориентации токсина (рисунок 39). Рисунок 39. Пример переключения контактов между токсином и каналом. Сверху: R13 образует контакты с III и IV субъединицами, а K11 – с I и II; Снизу: в другой конформации остатки меняются партнёрами. К основным остаткам токсина относятся K11, R13, K16 и R19. Согласно полученным 98 результатам, К11 взаимодействует преимущественно с повторами I, III и IV, но не взаимодействует с повтором II в связи с наличием R13 в непосредственной близости от неё. R13 взаимодействует в основном с I и II, но может взаимодействовать с любым повтором из-за его длинной боковой цепи и пространственной ориентации токсина. K16 в середине спиральной части токсина может взаимодействовать с любым повтором канала, в зависимости от контактов, образуемых другими остатками токсина. R19 может достичь только повтора III, потому что он расположен близко к C-концу токсина, сразу после спиральной части, и никак не может дотянуться до повторов I и II. Таким образом, полученная модель предсказывает, что в рамках одной модели посадки тела токсина в пору канала его остатки могут образовывать различные контакты с остатками канала. 3.3.3. Связывание PIIIA Теперь рассмотрим проблему взаимодействия с каналом другого конотоксина – PIIIA. Согласно экспериментальным исследованиям, главную роль в связывании PIIIA с каналом играют остатки R12, R14, K17, и R20 (McArthur, Singh et al., 2011). Тем не менее, в отличие от GIIIA, парные контакты между PIIIA и Nav1.4 неизвестны. Таким образом, методология посадки, которая применялась для GIIIA, не подходит для PIIIA. Так как пространственная структура PIIIA подобна структуре GIIIA, можно предположить, что в комплексе с каналом α-спираль и ключевые основные остатки PIIIA ориентированы так же, как у GIIIA (рисунок 40). Исходя из этого предположения была сгенерирована стартовая позиция для расчётов. Модель, полученная в результате минимизации показана на рисунке 41. В полученной модели ключевые остатки PIIIA участвуют в следующих взаимодействиях: R12 / E403, R14 / E758, К17 / D1241, К17 / D1532, R20 / D1532 (рисунок 41 и таблица 5). 99 Рисунок 40. Трёхмерные структуры и выравнивание последовательностей между конотоксинами GIIIA, PIIIA и KIIIA. Слева направо: GIIIA (оранжевый), PIIIA (синий) и KIIIA (зелёный). 100 Рисунок 41. Модель посадки и контакты, образованные токсином PIIIA с каналом. Показаны различные взаимодействующие пары остатков. 101 Таблица 5. Энергия взаимодействия между остатками токсина PIIIA и остатками канала, рассчитанная в модели. Ключевые остатки канала выделены жёлтым, ключевые остатки токсина – голубым. D400 Y401 E403 R748 E755 E758 T759 F1216 M 1240 D1241 O8 0,13 K9 -0,48 -0,45 -7,13 -2,47 -2,45 0,16 0,13 R12 -0,6 -0,69 -0,79 -7,39 D1248 D1532 N1536 P1537 1,04 -0,57 -7,09 -1,22 -0,74 -1,74 C16 -15,08 0,29 -2,46 -0,56 -0,66 -0,71 -12,39 -2,05 -3,42 0,51 K17 -1,24 -1,17 0,51 -8,5 O18 -0,2 -3,86 -14,77 0,42 R20 0,22 -0,78 C22 -2,55 -2,16 -3,15 -0,12 -1,39 -0,69 -16,23 Total -0,93 Q15 Total A1245 0,13 S13 R14 Y1244 -8,64 -0,12 1,04 -0,57 -11,02 -1,22 -0,2 -0,74 102 -13,13 -0,66 -0,71 -2,05 -8,71 -2,16 -3,15 -61,59 Рисунок 42. Трёхмерное наложение моделей посадки GIIIA и PIIIA. Модель GIIIA показана жёлтым, модель PIIIA – оранжевым. Хотя полученные конформации GIIIA и PIIIA весьма схожи (СО для α-углерода ключевых основных остатков составляет 1,8 Å), есть определенные различия в парных взаимодействиях между токсином и каналом. Например, для GIIIA важную роль играет специфическое взаимодействие между D12 и T759 (Choudhary, Aliste et al. 2007), что отражается и в модели. В PIIIA отсутствует подходящий остаток в гомологичной позиции. В результате, в модели R12 в PIIIA образует контакты отличные от гомологичного K11 в GIIIA. R12 в PIIIA сильно взаимодействует с I повтором, в то время как K11 в GIIIA взаимодействует с III и IV потворами, потому что D12 стерически препятствует возникновению контактов между K11 и I повтором. R14 формирует тесные контакты с I и II повторами, но слабо взаимодействует с III повтором, и ещё слабее с IV повтором. К17 взаимодействует с повторами III и IV, как и его аналог в GIIIA, К16. Наконец, R20 (аналог R19 в GIIIA) взаимодействует только с IV повтором. Как и в случае с GIIIA, показанное макросостояние может быть представлено множеством микросостояний, которые существуют благодаря переключению контактов между длинными гибкими боковыми цепями. В работе (McArthur, Singh et al., 2011) авторы исследовали потенциал-зависимое 103 действие PIIIA и его мутантов и определяли глубину (δ) остатков в электрическом поле мембраны. Значения δ располагались по убыванию следующим образом: R14> K17> R20> R12> S13> R2> G6. В полученной модели, относительная глубина заряженных остатков (определяется расположением их заряженных групп) располагается следующим образом: R14> K17> R20> R12> R2; S13 находится примерно на той же глубине, что и R12, в то время как G6 и R2 расположены на N-конце токсина во внеклеточном пространстве. Таким образом, ориентация токсина PIIIA в модели согласуются с экспериментальными данными. Следует отметить, что эти данные не использовались при получении модели, что говорит о хорошем качестве модели. 3.3.4. Связывание KIIIA KIIIA представляет собой самый маленький µ-конотоксин в семействе, и не содержит аналога N-концевого сегмента, который присутствует в GIIIA и PIIIA. Поэтому его аминокислотная последовательность содержит только три основных остатка в α-спирали. Данные по парным взаимодействиям (McArthur, Singh et al., 2011) показывают, что все эти остатки взаимодействуют с внешним карбоксилатом III повтора (D1241). Используя эти данные, можно наложить ограничения по расстоянию на водородные связи между боковыми цепями токсина и карбоксилатом. Последующие минимизации привели к модели, где положение и ориентация α-спирали KIIIA аналогична ориентации спиралей PIIIA и GIIIA. Весь набор контактов, образуемых основными остатками KIIIA показан на рисунке 43 и в таблице 6. Важно отметить, что из-за своего небольшого размера и отсутствия N-концевого сегмента, KIIIA не может перекрыть пору канала своим телом. 104 Таблица 6. Энергия взаимодействия между остатками токсина KIIIA и остатками канала, рассчитанная в модели. Ключевые остатки канала выделены жёлтым, ключевые остатки токсина – голубым. E403 K723 R748 E755 C4 E758 F1216 M 1240 D1241 I1242 Y1244 A1245 -0,23 K7 0,47 D1532 0,5 -0,6 -1,62 -2,2 -2,01 -0,84 -1,46 -0,69 -0,92 -3,06 -10,82 -2,51 -1,35 0,7 D11 -3,56 -0,61 -5,56 -2,07 H12 S13 -0,28 0,34 -2,27 -2,2 -4,86 0,66 C16 -6,15 -0,88 -13,31 0,66 -2,92 -0,6 -2,8 -0,38 -0,85 0,59 -0,64 -3,43 -0,18 R14 0,24 -0,92 -0,74 -0,66 -0,2 -1,35 Total 0,16 W8 Total R1250 0,16 S6 R10 D1248 -9,67 105 -4,58 -8,35 0,06 -0,66 -0,84 -2,1 -7 -1,8 -7,38 -41,19 Рисунок 43. Модель посадки и контакты, образованные токсином KIIIA с каналом. Показаны различные взаимодействующие пары остатков. 106 Наиболее интересно то, что в присутствии KIIIA TTX может достигать своего сайта связывания в селективном фильтре, хотя кинетика связывания замедляется относительно свободного канала (Zhang, McArthur et al., 2009). Чтобы найти объяснение этих экспериментальных данных, можно построить модель канала, в комплексе с KIIIA и TTX. Модель взаимодействия TTX с каналом была предложена ранее в работе (Tikhonov and Zhorov, 2012). Поэтому для построения общей модели использовалась модель TTX из этой работы и модель посадки KIIIA, полученная нами ранее. Рисунок 44. Модель одновременной посадки TTX и KIIIA в канале. Слева: стрелочкой показан возможный путь выхода TTX из канала при наличии KIIIA в системе; справа: тело токсина смещено в сторону III субъединицы, что даёт больше места для посадки TTX. Как видно из рисунка 44, полученная суммарная модель не приводит к стерическим конфликтам в положении токсинов. Компактная молекула TTX глубоко связана в узкой части поры между кольцом DEKA и кольцом внешних карбоксилатов, в то время как более крупный конотоксин не проникает глубоко в пору, а приближается к внешним карбоксилатам с внеклеточной стороны, образуя солевые мостики с ними. Каждый карбоксилат может служить акцептором для нескольких водородных связей, что позволяет образовывать одновременные контакты с TTX и KIIIA. Внешний карбоксилат в III повторе, который, в отличие от других внешних карбоксилатов, не смотрит в сторону оси канала, не 107 взаимодействует с TTX, но формирует солевой мостик с R10 в KIIIA. Однако статическая модель не позволяет объяснить, как именно TTX может связываться с селективным фильтром в присутствии конотоксина. Чтобы ответить на этот вопрос, была создана модель, в которой на тетродотоксин вводились силы с целью вывести его из селективного фильтра во внеклеточное пространство. Для этого было введено ограничение на расстояние между центральным атомом углерода в группе гуанидина TTX и плоскостью, проходящей через четыре альфа атома углерода в кольце DEKA. Далее минимальное значение этого расстояния систематически увеличивалось с шагом 1 Å и проводились минимизации энергии на каждом шаге. Структура с минимальной энергией на данном шаге использовалась в качестве отправной точки для следующей стадии. Для того, чтобы не потерять связь между каналом и KIIIA, использовались ограничения на контакты между основными остатками KIIIA и внешними карбоксилатами. Как видно из рисунка 45, траектория, по которой проходит молекула TTX представляет собой достаточно гладкую кривую. Соответствующая ей энергия взаимодействия TTX с системой (рисунок 45) не содержит энергетических барьеров, что указывает на отсутствие стерических препятствий в предсказанном пути для выхода TTX. Таким образом, можно утверждать, что предложенная модель посадки KIIIA позволяет воспроизвести экспериментально наблюдаемую совместную посадку TTX и KIIIA в канал за счёт различия в местах связывания. Более того, небольшой токсин (KIIIA) не препятствует проходу TTX в канал, что хорошо видно из полученной траектории и энергетического профиля. 108 Рисунок 45. Траектория выхода TTX из канала при наличии связанного KIIIA. Сверху: трёхмерный вид траектории, тетродотоксин огибает тело KIIIA; Снизу: энергетический профиль выхода TTX из канала. 109 3.3.5. Механизм неполного блока В предыдущих разделах была построена модель и рассчитана посадка лигандов. Анализ полученной модели показал, что модель хорошо согласуе тся с экспериментальными данными. То есть на данном этапе можно перейти от создания и верификации модели к ее использованию для изучения феноменов, которые на данный момент не получили структурного объяснения. Наибольший интерес представляют данные, полученные при изучении ионного тока в каналах, блокированных конотоксинами. Было показано, что KIIIA и некоторые мутанты GIIIA и PIIIA приводят к неполному блоку ионного тока через канал (Hui, Lipkind et al., 2002, McArthur, Ostroumov et al., 2011, Wilson, Yoshikami et al., 2011). Важно отметить, что ни в одной из этих работ не было предложено структурного обоснования полученных данных. Ранее было показано, что ток уменьшается из-за снижения проводимости канала (Wang, Nau et al., 2000, Wang, Barile et al., 2001). Для решения проблемы молекулярных механизмов неполного блока натиревых каналов конотоксинами был использован следующий подход. Ион натрия был помещён в кольце DEKA, после чего была предпринято моделирование траектории его выхода из канала в присутствии GIIIA. Для этого ион помещался в селективный фильтр, после чего проводилась серия последовательных расчётов, в которых на ион накладывалось ограничение на расстояние до плоскости, перпендикулярной оси канала. На каждом последующем шаге плоскость сдвигалась на 1 ангстрем в сторону внеклеточного пространства, при этом результаты предыдущего расчёта использовались в качестве стартовой позиции для следующего. Как видно из результатов, представленных на рисунке 46, траектория иона прерывается вблизи токсина. При этом энергетический профиль для иона содержит как зоны отрицательных значений, где ион испытывает электростатическое притяжение с кольцом DEKA и наружными карбоксилатами, так и зоны положительных значений, что соответствует отталкиванию с токсином. 110 Рисунок 46. Траектория выхода иона из канала при наличии связанного GIIIA. Сверху: траектория в случае наличия в модели GIIIA; снизу: траектория в случае замены R13 в GIIIA на Ala. Аналогичный расчёт был проведён в присутствии мутанта GIIIA R13A. Для связывания мутанта с каналом не проводилось построение отдельной модели, а использовалась базовая модель GIIIA в канале, но с заменой R13 на аланин и последующей 111 минимизацией энергии структуры. Тело токсина не сдвигалось и все токсин-канальные контакты (за исключением тех, в которых принимал участие мутированный остаток) были сохранены. Тем не менее, путь иона натрия при выходе из поры в этой модели значительно отличается от полученного для чистого токсина в терминах энергии и геометрии пути (рисунок 46). Траектория стала гладкой. Если внимательно посмотреть на полученные траектории, то видно, что в случае с оригинальным токсином существует разрыв гладкой кривой иона в области R13. Рисунок 47. Энергетический профиль выхода иона из канала при наличии связанного GIIIA. Чёрным показана энергия иона в канале с GIIIA, а красным – при связывании мутанта GIIIA R13A. Неудивительно, что более короткий и электронейтральный аланин в этой позиции освобождает зону, через которую может проникать ион. На энергетической кривой явно видно, что зона положительных энергий, свойственная токсину, пропадает после мутации, что говорит об отсутствии препятствий для движения ионов между селективным фильтром и внеклеточным пространством. Таким образом, приведённые расчёты позволяют объяснить различное действие GIIIA, который полностью блокирует канал, и его R13A мутанта, который лишь частично блокирует пору. 112 Для подтверждения этого критического вывода был использован альтернативный алгоритм расчета. Было созданы 10 000 стартовых позиций, в которых ион случайным образом размещался в области селективного фильтра и наружной поры, после чего проводилась короткая минимизация энергии (10 минимизаций для каждой из 10 000 структур). Для анализа были выбраны только те структуры, где энергия взаимодействия иона с остальной системой была отрицательной (то есть превалировали силы притяжения). Такой подход позволил найти области, которые могут быть заполнены ионами. Расчеты проводились для модели канала без токсина и для комплексов канала с оригинальным токсином и его мутантами. Рисунок 48. Распределение ионов в свободном канале. Жёлтым показаны возможные положения ионов во внешнем вестибюле канала. Отдельно выделены остатки, образующие селективный фильтр. В модели свободного канала ионы размещены равномерно и непрерывно во всей области поры (рисунок 48). Большое количество энергетически возможных позиций ионов в внеклеточной половине поры связано с наличием большого свободного пространства в этой области. Присутствие в канале GIIIA вытесняет большую часть ионов из этого региона (рисунок 49), разбивая облако ионов на два: одно в области селективного фильтра, а второе во внеклеточной области. Важно отметить, что между этими двумя «облаками» есть зона, в 113 которой практически нет энергетически выгодных позиций для иона (рисунок 49). Рисунок 49. Распределение ионов в канале при наличии связанного GIIIA. Жёлтым показаны возможные положения ионов во внешнем вестибюле канала. Отдельно выделены остатки, образующие селективный фильтр и R13 в токсине. Стоит отметить, что отсутствие энергетически благоприятных положений для иона в этой зоне не обязательно является следствием стерического замещения токсином. Скорее всего, ионы не могут занимать эту область из-за электростатического отталкивания с положительно заряженными остатками GIIIA. Таким образом, в полученной модели блок имеет во многом электростатическую природу. В отличие от природного токсина, для R13A мутанта GIIIA форма распределения ионов больше похожа на ту, что получается для свободного канала. Хотя токсин попрежнему вытесняет ионы, значительно уменьшая количество возможных позиций в канале, но на всех уровнях внешней поры есть энергетически подходящие позиции, что позволяет сделать вывод о наличии возможного пути для прохождения ионов через пору канала (рисунок 50). 114 Таким образом, результаты, полученные двумя различными методами, дали одинаковые результаты: нативный токсин создает препятствие для иона за счет электростатического оттлкивания с аргинином в положении 13. Замена аргинина на аланин восстанавливает свободный путь для иона. Рисунок 50. Распределение ионов в канале при наличии связанного мутанта GIIIA. Жёлтым показаны возможные положения ионов во внешнем вестибюле канала. Отдельно выделены остатки, образующие селективный фильтр и A13 в токсине. На следующем этапе был проведен анализ серии мутантов, для которых имеются данные о неполном блоке (McArthur, Ostroumov et al., 2011). Для этого исследования был выбран метод случайной генерации, описанный выше, поскольку он является менее затратным с точки зрения времени расчетов. Аналогичные непрерывные ионные распределения были получены для мутантов KIIIA и PIIIA, которые лишь частично блокируют канал. И напротив, для GIIIA мутантов (K9A, K11A, K16A, R19A) и для R20A мутанта PIIIA (McArthur, Ostroumov et al., 2011), распределения ионов были аналогичны случаю с GIIIA, то есть два региона с ионами разделены зоной, где ионы отталкиваются от 115 токсина (рис 51). Полученные результаты согласуются с экспериментальными данными, которые показывают, что данные мутации не приводят к частичному блоку. 116 Рисунок 51. Распределение ионов в канале при наличии различных мутантов µконотоксинов. Жёлтым показаны возможные положения ионов во внешнем вестибюле канала. Для анализа полученных результатов, был составлен список контактов между каналом и токсином для оригинального токсина и его мутантов (таблица 7). Было обнаружено, что непрерывные распределения ионов в моделях наблюдаются, тогда, когда по крайней мере один из наружных карбоксилатов не участвует во взаимодействии с основными остатками токсина. Таким образом, KIIIA, который содержит только 3 основных остатка, не в состоянии полностью блокировать ток через канал. GIIIA и PIIIA, которые полностью блокируют ток, специфически взаимодействуют со всеми четырьмя внешними карбоксилатами. Модели, включающие в себя мутанты токсинов, где любой из наружных карбоксилатов не связан специфическими взаимодействиями с токсином, приводят к частичному блоку. Если внешний карбоксилат может образовывать солевые мостики с двумя или более основными остатками токсина, мутация одного основного 117 остатка не освобождает карбоксилат, который остаётся электронейтральным и, следовательно, непривлекательным для ионов натрия. В таких случаях по-прежнему наблюдается полный блок. Например, аланиновая замена R19 в GIIIA не приводит к появлению остаточного тока (McArthur, Ostroumov et al., 2011), потому что K16 и K11 могут взаимодействовать с D1532, который взаимодействует с R19 в природном GIIIA. Таблица 7. Наиболее сильные контакты между основными остатками µ-конотоксинов и внешними карбоксилатами Токсин GIIIA PIIIA KIIIA Внешние карбоксилаты E E (I повтор) (II повтор) R13 R13 R12, R14 R14 R10 D (III повтор) K11, K16 K17 R10, R14 D (IV повтор) K11, R19 K17, R20 R14 Таким образом, можно предположить, что решающую роль в механизме ионного тока через канал играют внешние карбоксилаты. Эти остатки, вероятно, служат в качестве промежуточных сайтов связывания для ионов, движущихся из внеклеточного пространства к селективному фильтру (рисунок 52). Если по крайней мере один из наружных карбоксилатов свободен, то ток ионов через канал возможен, хотя и снижается в зависимости от количества свободных сайтов. Эта модель согласуется с экспериментальными данными (McArthur, Ostroumov et al., 2011, McArthur, Singh et al., 2011) и с предыдущими моделями (Tikhonov and Zhorov, 2007). 118 Рисунок 52. Схематическая модель механизма блокады ионного тока через канал. Красным показаны внешние карбоксилаты и отрицательно заряженный остаток в селективном фильтре. Жёлтым обозначены ионы, стрелочками показано их движение через канал. Оранжевым изображены конотоксины, голубым – остаток в селективном фильтре и тетродотоксин. Предложенная схема позволяет сделать молекулярном механизме этого эффекта. обоснованные предположения о В отличие от TTX и ему подобных малогабаритных лигандов, µ-конотоксины не проникают в узкую часть поры и, таким образом, не блокируют её стерически. Согласно модели, конотоксины блокируют ток путём электростатического взаимодействия и нейтрализации внешних карбоксилатов. Если все четыре внешних карбоксилата участвуют во взаимодействии с токсином, то канал теряет свою способность проводить ионы, что приводит к полному блоку. Если некоторые из внешних карбоксилатов остаются свободными, токсин только частично перекрыв ает ток. Эта предложенная схема (рисунок 52), согласуется с данными, согласно которым мутации внешних карбоксилатов уменьшают проводимость канала. Хотя основным фактором, влияющим на наличие или отсутствие остаточных токов, согласно модели, являются электростатические взаимодействия, величина остаточного тока, очевидно, также зависит и от стерических эффектов. 119 На заключительном этапе тестирования разработанной модели неполного блока был проведен ряд расчетов для серии мутантов R13 в GIIIA. R13 особенно интересен тем, что этот остаток непосредственно проникает в пору, взаимодействия с каналом вплоть до селективного фильтра. Размер боковой цепи остатка в этом положении в значительной степени определяет количество ионов, которые вытесняются из кольца внешних карбоксилат, что согласуется с данными (Hui, Lipkind et al., 2002). Замены R13 в GIIIA систематически изучены в работе (Hui, Lipkind et al., 2002). Было показано, что величина остаточного тока зависит от размера и заряда/полярности замены. Чтобы воспроизвести эти результаты, были получены мутации R13 на K, Q, W, Q, N, А, Е и D, и подсчитаны распределения ионов, как описано выше. Результаты представлены на рисунке 53. Ионные распределения для всех мутантов непрерывны, что говорит в пользу (в соответствии с описанными выше результатами) наличия некоторого остаточного тока. Чтобы получить количественное соотношение с экспериментальными данными (Hui, Lipkind et al., 2002) был построен график количества ионов на оси координат z = 8 Å (эта точка соответствует разрыву для случая с оригинальным токсином) против остаточного тока (рисунок 53). Результаты расчетов показывают хорошую корреляцию с экспериментом (R = 0,96, р = 3,4 * 10-5). Таким образом, предложенная модель воспроизводит не только качественный эффект присутствия или отсутствия остаточного тока, но даже величину этих токов. 120 Рисунок 53. График распределения ионов в канале при наличии различных мутантов µконотоксинов. Сверху: графики распределения ионов вдоль оси канала для разных мутантов µконотоксинов; снизу: корреляция между током ионов через канал и количеством ионов в области селективного фильтра в моделях. 121 Общее заключение В данной работе методами компьютерного молекулярного моделирования было проведено исследование, целью которого было получение структурного объяснения механизмов взаимодействия µ-конотоксинов с потенциал-управляемым натриевым ионным каналом эукариот Nav1.4. Основным результатом является разработка модели молекулярного механизма неполного блока. На данный момент известно большое количество блокаторов потенциал- управляемых натриевых каналов эукариот. Из всего объема медицинской фармакологии порядка 10% соединений имеют мишенями именно ионные каналы. Это анестетики, анальгетики, антиаритмики и множество других классов фармакологических агентов. Однако подавляющее большинство из известных блокаторов приводит к полному блоку ионного тока через канал, что затрудняет их использование в медицинских целях. Передозировка таких блокаторов, как тетродотоксин, может вызвать негативные эффекты вплоть до летального исхода. Используемые для обезболивания локальные анестетики — тоже блокаторы именно этих каналов. Их основное отличие от тетродотоксина состоит в том, что они действуют только в высоких концентрациях — иначе говоря, только вблизи места укола. Локальные анестетики препятствуют возникновению потенциалов действия, а значит, и передаче в мозг болевых сигналов. Потенциально лиганды, вызывающие неполный блок натриевых каналов, имеют огромную фармакологическую ценность. Применение таких препаратов позволит снижать чувствительность ионных каналов, не нанося непоправимых повреждений организму. Вероятность отрицательных эффектов от передозировки также значительно снижается. Современная медицина постоянно нуждается в новых активных и избирательных фармакологических агентах, чтобы по возможности минимизировать побочные эффекты применения лекарств. На разработку новых препаратов тратятся огромные деньги. Но как же искать новые вещества, если мы не знаем, каковы механизмы действия уже известных соединений? Случайный перебор слишком дорого обходится. Рациональный поиск может 122 основываться только на глубоком научном понимании механизмов действия препаратов — во всем диапазоне от молекул до целых организмов. Именно поэтому столь важно было найти структурную основу для механизма возникновения эффекта неполного блока в потенциал-управляемых натриевых каналах эукариот. Понимания механизма действия лигандов позволит в будущем искусственно создавать препараты, способные специфически блокировать натриевые каналы. Это открывает широкий простор для исследований в области фармакологии. 123 Выводы 1. При выравнивании аминокислотных последовательностей p-loop каналов необходимо учитывать трехмерные структуры и специфические межсегментные взаимодействия. Исходя из такого анализа наиболее подходящей для моделирования эукариотических натриевых каналов является структура бактериального канала NavAb. 2. Моделирование связывание блокатора Pl1 в канале NavMs показало, что могут существовать различные конформационные состояния системы блокатор-канал. Показано, что блокада NavMs лигандом Pl1 может носить не только стерический, но и электростатический характер. 3. Модель, построенная на основе канала NavAb с учетом коррекции выравнивая, позволяет получить комплексы с мю-конотоксинами, свойства которых хорошо согласуются с экспериментальными данными. Это свидетельствует, что поры прокариотических и эукариотических натриевых каналов имеют общее строение и позволяет использовать данную модель для изучения механизмов блокады эукариотических каналов. 4. Предложена схема блокады ионных токов через натриевые каналы конотоксинами. В отличие от TTX и ему подобных низкомолекулярных лигандов, µ-конотоксины не проникают в узкую часть поры и, таким образом, не блокируют её стерически. Конотоксины блокируют ток путём электростатического взаимодействия и нейтрализации внешних карбоксилатов канала. Если все четыре внешних карбоксилата участвуют во взаимодействии с токсином, то канал теряет свою способность проводить ионы, что приводит к полному блоку. Если некоторые из внешних карбоксилатов остаются свободными, токсин только частично блокирует ток. 124 Список литературы 1. Aldrich R. Molecular biophysics: ionic channels of excitable membranes / Science. 1985. V. 228. № 4701. P. 867-868. 2. Alonso D., Khalil Z., Satkunanthan N. and Livett B.G. Drugs from the sea: conotoxins as drug leads for neuropathic pain and other neurological conditions / Mini Rev Med Chem. 2003. V. 3. № 7. P. 785-787. 3. Bagneris C., Decaen P.G., Hall B.A., Naylor C.E., Clapham D.E., Kay C.W. and Wallace B.A. Role of the C-terminal domain in the structure and function of tetrameric sodium channels / Nat Commun. 2013. V. 4. № P. 2465. 4. Bagneris C., DeCaen P.G., Naylor C.E., Pryde D.C., Nobeli I., Clapham D.E. and Wallace B.A. Prokaryotic NavMs channel as a structural and functional model for eukaryotic sodium channel antagonism / Proc Natl Acad Sci U S A. 2014. V. 111. № 23. P. 8428-8433. 5. Bassler E.L., Ngo-Anh T.J., Geisler H.S., Ruppersberg J.P. and Grunder S. Molecular and functional characterization of acid-sensing ion channel (ASIC) 1b / J Biol Chem. 2001. V. 276. № 36. P. 33782-33787. 6. Becirovic E., Nguyen O.N., Paparizos C., Butz E.S., Stern-Schneider G., Wolfrum U., Hauck S.M., Ueffing M., Wahl-Schott C., Michalakis S. and Biel M. Peripherin-2 couples rhodopsin to the CNG channel in outer segments of rod photoreceptors / Hum Mol Genet. 2014. V. 23. № 22. P. 5989-5997. 7. Becker S., Prusak-Sochaczewski E., Zamponi G., Beck-Sickinger A.G., Gordon R.D. and French R.J. Action of derivatives of mu-conotoxin GIIIA on sodium channels. Single amino acid substitutions in the toxin separately affect association and dissociation rates / Biochemistry. 1992. V. 31. № 35. P. 8229-8238. 8. Bendahhou S., Cummins T.R., Tawil R., Waxman S.G. and Ptacek L.J. Activation and inactivation of the voltage-gated sodium channel: role of segment S5 revealed by a novel hyperkalaemic periodic paralysis mutation / J Neurosci. 1999. V. 19. № 12. P. 4762-4771. 9. Berneche S. and Roux B. The ionization state and the conformation of Glu-71 in the KcsA K(+) channel / Biophys J. 2002. V. 82. № 2. P. 772-780. 10. Bosmans F. and Swartz K.J. Targeting voltage sensors in sodium channels with spider toxins / Trends Pharmacol Sci. 2010. V. 31. № 4. P. 175-182. 11. Brooks C.L., 3rd, Brunger A. and Karplus M. Active site dynamics in protein molecules : a stochastic boundary molecular-dynamics approach / Biopolymers. 1985. V. 24. № 5. P. 843-865. 12. Bruhova I., Tikhonov D.B. and Zhorov B.S. Access and binding of local anesthetics in the closed sodium channel / Mol Pharmacol. 2008. V. 74. № 4. P. 1033-1045. 13. Camerino D.C., Tricarico D. and Desaphy J.F. Ion channel pharmacology / Neurotherapeutics. 2007. V. 4. № 2. P. 184-198. 14. Catterall W.A. Neurotoxins as allosteric modifiers of voltage-sensitive sodium channels / Adv Cytopharmacol. 1979. V. 3. № P. 305-316. 15. Catterall W.A. From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels / Neuron. 2000. V. 26. № 1. P. 13-25. 16. Catterall W.A. Molecular mechanisms of gating and drug block of sodium channels / Novartis Found Symp. 2002. V. 241. № P. 206-218; discussion 218-232. 17. Catterall W.A., Cestele S., Yarov-Yarovoy V., Yu F.H., Konoki K. and Scheuer T. 125 Voltage-gated ion channels and gating modifier toxins / Toxicon. 2007. V. 49. № 2. P. 124-141. 18. Catterall W.A., Perez-Reyes E., Snutch T.P. and Striessnig J. International Union of Pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels / Pharmacol Rev. 2005. V. 57. № 4. P. 411-425. 19. Celie P.H., Kasheverov I.E., Mordvintsev D.Y., Hogg R.C., van Nierop P., van Elk R., van Rossum-Fikkert S.E., Zhmak M.N., Bertrand D., Tsetlin V., Sixma T.K. and Smit A.B. Crystal structure of nicotinic acetylcholine receptor homolog AChBP in complex with an alpha-conotoxin PnIA variant / Nat Struct Mol Biol. 2005. V. 12. № 7. P. 582-588. 20. Cestele S., Yarov-Yarovoy V., Qu Y., Sampieri F., Scheuer T. and Catterall W.A. Structure and function of the voltage sensor of sodium channels probed by a beta-scorpion toxin / J Biol Chem. 2006. V. 281. № 30. P. 21332-21344. 21. Chahine M., Chen L.Q., Barchi R.L., Kallen R.G. and Horn R. Lidocaine block of human heart sodium channels expressed in Xenopus oocytes / J Mol Cell Cardiol. 1992. V. 24. № 11. P. 1231-1236. 22. Chanda B. and Bezanilla F. Tracking voltage-dependent conformational changes in skeletal muscle sodium channel during activation / J Gen Physiol. 2002. V. 120. № 5. P. 629-645. 23. Chang N.S., French R.J., Lipkind G.M., Fozzard H.A. and Dudley S., Jr. Predomina nt interactions between mu-conotoxin Arg-13 and the skeletal muscle Na+ channel localized by mutant cycle analysis / Biochemistry. 1998. V. 37. № 13. P. 4407-4419. 24. Chen R. and Chung S.H. Binding modes of mu-conotoxin to the bacterial sodium channel (NaVAb) / Biophys J. 2012. V. 102. № 3. P. 483-488. 25. Chen R. and Chung S.H. Mechanism of tetrodotoxin block and resistance in sodium channels / Biochem Biophys Res Commun. 2014. V. 446. № 1. P. 370-374. 26. Choudhary G., Aliste M.P., Tieleman D.P., French R.J. and Dudley S.C., Jr. Docking of mu-conotoxin GIIIA in the sodium channel outer vestibule / Channels (Austin). 2007. V. 1. № 5. P. 344-352. 27. Chugunov A.O., Farce A., Chavatte P. and Efremov R.G. Differences in binding sites of two melatonin receptors help to explain their selectivity to some melatonin analogs: a molecular modeling study / J Biomol Struct Dyn. 2006. V. 24. № 2. P. 91-107. 28. Clare J.J. Targeting voltage-gated sodium channels for pain therapy / Expert Opin Investig Drugs. 2010. V. 19. № 1. P. 45-62. 29. Clarke O.B., Caputo A.T., Hill A.P., Vandenberg J.I., Smith B.J. and Gulbis J.M. Domain reorientation and rotation of an intracellular assembly regulate conduction in Kir potassium channels / Cell. 2010. V. 141. № 6. P. 1018-1029. 30. Craven K.B. and Zagotta W.N. CNG and HCN channels: two peas, one pod / Annu Rev Physiol. 2006. V. 68. № P. 375-401. 31. Cruz L.J., Kupryszewski G., LeCheminant G.W., Gray W.R., Olivera B.M. and Rivier J. mu-conotoxin GIIIA, a peptide ligand for muscle sodium channels: chemical synthesis, radiolabeling, and receptor characterization / Biochemistry. 1989. V. 28. № 8. P. 3437-3442. 32. Cummins T.R., Aglieco F. and Dib-Hajj S.D. Critical molecular determinants of voltage gated sodium channel sensitivity to mu-conotoxins GIIIA/B / Mol Pharmacol. 2002. V. 61. № 5. P. 1192-1201. 33. Delmas P. and Coste B. Mechano-gated ion channels in sensory systems / Cell. 2013. V. 155. № 2. P. 278-284. 34. Dong K., Du Y., Rinkevich F., Nomura Y., Xu P., Wang L., Silver K. and Zhorov B.S. Molecular biology of insect sodium channels and pyrethroid resistance / Insect Biochem Mol Biol. 126 2014. V. 50. № P. 1-17. 35. Doyle D.A., Morais Cabral J., Pfuetzner R.A., Kuo A., Gulbis J.M., Cohen S.L., Chait B.T. and MacKinnon R. The structure of the potassium channel: molecular basis of K+ conduction and selectivity / Science. 1998. V. 280. № 5360. P. 69-77. 36. Du Y., Garden D.P., Wang L., Zhorov B.S. and Dong K. Identification of new batrachotoxin-sensing residues in segment IIIS6 of the sodium channel / J Biol Chem. 2011. V. 286. № 15. P. 13151-13160. 37. Du Y., Nomura Y., Satar G., Hu Z., Nauen R., He S.Y., Zhorov B.S. and Dong K. Molecular evidence for dual pyrethroid-receptor sites on a mosquito sodium channel / Proc Natl Acad Sci U S A. 2013. V. 110. № 29. P. 11785-11790. 38. Du Y., Nomura Y., Zhorov B.S. and Dong K. Rotational Symmetry of Two Pyrethroid Receptor Sites in the Mosquito Sodium Channel / Mol Pharmacol. 2015. V. №. 39. Dudley S.C., Jr., Chang N., Hall J., Lipkind G., Fozzard H.A. and French R.J. muconotoxin GIIIA interactions with the voltage-gated Na(+) channel predict a clockwise arrangement of the domains / J Gen Physiol. 2000. V. 116. № 5. P. 679-690. 40. Dudley S.C., Jr., Todt H., Lipkind G. and Fozzard H.A. A mu-conotoxin- insensitive Na+ channel mutant: possible localization of a binding site at the outer vestibule / Biophys J. 1995. V. 69. № 5. P. 1657-1665. 41. Eijkelkamp N., Linley J.E., Baker M.D., Minett M.S., Cregg R., Werdehausen R., Rugiero F. and Wood J.N. Neurological perspectives on voltage-gated sodium channels / Brain. 2012. V. 135. № Pt 9. P. 2585-2612. 42. Faraldo-Gomez J.D., Kutluay E., Jogini V., Zhao Y., Heginbotham L. and Roux B. Mechanism of intracellular block of the KcsA K+ channel by tetrabutylammonium: insights from X-ray crystallography, electrophysiology and replica-exchange molecular dynamics simulations / J Mol Biol. 2007. V. 365. № 3. P. 649-662. 43. Fozzard H.A., Lee P.J. and Lipkind G.M. Mechanism of local anesthetic drug action on voltage-gated sodium channels / Curr Pharm Des. 2005. V. 11. № 21. P. 2671-2686. 44. Fozzard H.A., Sheets M.F. and Hanck D.A. The sodium channel as a target for local anesthetic drugs / Front Pharmacol. 2011. V. 2. № P. 68. 45. French R.J., Prusak-Sochaczewski E., Zamponi G.W., Becker S., Kularatna A.S. and Horn R. Interactions between a pore-blocking peptide and the voltage sensor of the sodium channel: an electrostatic approach to channel geometry / Neuron. 1996. V. 16. № 2. P. 407-413. 46. French R.J. and Terlau H. Sodium channel toxins--receptor targeting and therapeutic potential / Curr Med Chem. 2004. V. 11. № 23. P. 3053-3064. 47. French R.J., Worley J.F., 3rd and Krueger B.K. Voltage-dependent block by saxitoxin of sodium channels incorporated into planar lipid bilayers / Biophys J. 1984. V. 45. № 1. P. 301-310. 48. Garden D.P. and Zhorov B.S. Docking flexible ligands in proteins with a solvent exposure and distance-dependent dielectric function / J Comput Aided Mol Des. 2010. V. 24. № 2. P. 91105. 49. Ginalski K. Comparative modeling for protein structure prediction / Curr Opin Struct Biol. 2006. V. 16. № 2. P. 172-177. 50. Goujon M., McWilliam H., Li W., Valentin F., Squizzato S., Paern J. and Lopez R. A new bioinformatics analysis tools framework at EMBL-EBI / Nucleic Acids Res. 2010. V. 38. № Web Server issue. P. W695-699. 51. Green K.A., Lambert J.J. and Cottrell G.A. Ligand-gated ion channels opened by 5-HT in molluscan neurones / Br J Pharmacol. 1996. V. 119. № 3. P. 602-608. 127 52. Guenot J. and Kollman P.A. Molecular dynamics studies of a DNA-binding protein: 2. An evaluation of implicit and explicit solvent models for the molecular dynamics simulation of the Escherichia coli trp repressor / Protein Sci. 1992. V. 1. № 9. P. 1185-1205. 53. Guenot J. and Kollman P.A. Conformational and energetic effects of truncating nonbonded interactions in an aqueous protein dynamics simulation / J. Comput. Chem. 1993. V. 14. № 3. P. 295-311. 54. Guy H.R. and Conti F. Pursuing the structure and function of voltage-gated channels / Trends Neurosci. 1990. V. 13. № 6. P. 201-206. 55. Hellmich U.A. and Gaudet R. Structural biology of TRP channels / Handb Exp Pharmacol. 2014. V. 223. № P. 963-990. 56. Hille B. Local anesthetics: hydrophilic and hydrophobic pathways for the drug-receptor reaction / J Gen Physiol. 1977. V. 69. № 4. P. 497-515. 57. Hille B. Ionic channels in excitable membranes. Current problems and biophys ica l approaches / Biophys J. 1978. V. 22. № 2. P. 283-294. 58. Hille B. Ionic channels of excitable membranes. 1992. Sunderland, Mass., Sinauer Associates. 59. Hille B. Ion channels of excitable membranes. 2001. Sunderland, MA, U.S.A., Sinauer Associates, Inc. 60. Hille B. and Schwarz W. Potassium channels as multi- ion single- file pores / J Gen Physiol. 1978. V. 72. № 4. P. 409-442. 61. Hillisch A., Pineda L.F. and Hilgenfeld R. Utility of homology models in the drug discovery process / Drug Discov Today. 2004. V. 9. № 15. P. 659-669. 62. Hodgkin A.L. and Huxley A.F. The components of membrane conductance in the giant axon of Loligo / J Physiol. 1952. V. 116. № 4. P. 473-496. 63. Hodgkin A.L., Huxley A.F. and Katz B. Measurement of current-voltage relations in the membrane of the giant axon of Loligo / J Physiol. 1952. V. 116. № 4. P. 424-448. 64. Hondeghem L.M. and Katzung B.G. Time- and voltage-dependent interactions of antiarrhythmic drugs with cardiac sodium channels / Biochim Biophys Acta. 1977. V. 472. № 34. P. 373-398. 65. Hondeghem L.M. and Katzung B.G. Antiarrhythmic agents: the modulated receptor mechanism of action of sodium and calcium channel-blocking drugs / Annu Rev Pharmacol Toxicol. 1984. V. 24. № P. 387-423. 66. Huber I., Wappl E., Herzog A., Mitterdorfer J., Glossmann H., Langer T. and Striessnig J. Conserved Ca2+-antagonist-binding properties and putative folding structure of a recombina nt high-affinity dihydropyridine-binding domain / Biochem J. 2000. V. 347 Pt 3. № P. 829-836. 67. Hui K., Lipkind G., Fozzard H.A. and French R.J. Electrostatic and steric contributions to block of the skeletal muscle sodium channel by mu-conotoxin / J Gen Physiol. 2002. V. 119. № 1. P. 45-54. 68. Hui K., McIntyre D. and French R.J. Conotoxins as sensors of local pH and electrostatic potential in the outer vestibule of the sodium channel / J Gen Physiol. 2003. V. 122. № 1. P. 6379. 69. Itier V. and Bertrand D. Neuronal nicotinic receptors: from protein structure to function / FEBS Lett. 2001. V. 504. № 3. P. 118-125. 70. Jentsch T.J., Günther W., Pusch M. and Schwappach B. Properties of voltage-gated chloride channels of the ClC gene family / The Journal of Physiology. 1995. V. 482. № P. P. 19S25S. 128 71. Jiang Y., Lee A., Chen J., Cadene M., Chait B.T. and MacKinnon R. Crystal structure and mechanism of a calcium-gated potassium channel / Nature. 2002. V. 417. № 6888. P. 515-522. 72. Jiang Y., Lee A., Chen J., Ruta V., Cadene M., Chait B.T. and MacKinnon R. X-ray structure of a voltage-dependent K+ channel / Nature. 2003. V. 423. № 6935. P. 33-41. 73. Katz B. Quantal mechanism of neural transmitter release / Science. 1971. V. 173. № 3992. P. 123-126. 74. Kaupp U.B. and Seifert R. Cyclic nucleotide- gated ion channels / Physiol Rev. 2002. V. 82. № 3. P. 769-824. 75. Kew J.N.C. and Davies C.H. Ion channels : from structure to function. 2010. Oxford ; New York, Oxford University Press. 76. Khan A., Romantseva L., Lam A., Lipkind G. and Fozzard H.A. Role of outer ring carboxylates of the rat skeletal muscle sodium channel pore in proton block / J Physiol. 2002. V. 543. № Pt 1. P. 71-84. 77. Khodorova A., Meissner K., Leeson S. and Strichartz G.R. Lidocaine selectively blocks abnormal impulses arising from noninactivating Na channels / Muscle Nerve. 2001. V. 24. № 5. P. 634-647. 78. Khoo K.K., Gupta K., Green B.R., Zhang M.M., Watkins M., Olivera B.M., Balaram P., Yoshikami D., Bulaj G. and Norton R.S. Distinct disulfide isomers of mu-conotoxins KIIIA and KIIIB block voltage-gated sodium channels / Biochemistry. 2012. V. 51. № 49. P. 9826-9835. 79. Kutluay E., Roux B. and Heginbotham L. Rapid intracellular TEA block of the KcsA potassium channel / Biophys J. 2005. V. 88. № 2. P. 1018-1029. 80. Lee C.H., Lu W., Michel J.C., Goehring A., Du J., Song X. and Gouaux E. NMDA receptor structures reveal subunit arrangement and pore architecture / Nature. 2014. V. 511. № 7508. P. 191-197. 81. Leipold E., DeBie H., Zorn S., Borges A., Olivera B.M., Terlau H. and Heinemann S.H. muO conotoxins inhibit NaV channels by interfering with their voltage sensors in domain-2 / Channels (Austin). 2007. V. 1. № 4. P. 253-262. 82. Lewis R.J., Dutertre S., Vetter I. and Christie M.J. Conus venom peptide pharmacology / Pharmacol Rev. 2012. V. 64. № 2. P. 259-298. 83. Li D., Xiao Y., Hu W., Xie J., Bosmans F., Tytgat J. and Liang S. Function and solution structure of hainantoxin-I, a novel insect sodium channel inhibitor from the Chinese bird spider Selenocosmia hainana / FEBS Lett. 2003. V. 555. № 3. P. 616-622. 84. Li H.L., Galue A., Meadows L. and Ragsdale D.S. A molecular basis for the different local anesthetic affinities of resting versus open and inactivated states of the sodium channel / Mol Pharmacol. 1999. V. 55. № 1. P. 134-141. 85. Li R.A., Ennis I.L., French R.J., Dudley S.C., Jr., Tomaselli G.F. and Marban E. Clockwise domain arrangement of the sodium channel revealed by (mu)-conotoxin (GIIIA) docking orientation / J Biol Chem. 2001. V. 276. № 14. P. 11072-11077. 86. Li Z. and Scheraga H.A. Monte Carlo-minimization approach to the multiple- minima problem in protein folding / Proceedings of the National Academy of Sciences. 1987. V. 84. № 19. P. 6611-6615. 87. Linford N.J., Cantrell A.R., Qu Y., Scheuer T. and Catterall W.A. Interaction of batrachotoxin with the local anesthetic receptor site in transmembrane segment IVS6 of the voltage-gated sodium channel / Proc Natl Acad Sci U S A. 1998. V. 95. № 23. P. 13947-13952. 88. Lipkind G.M. and Fozzard H.A. A structural model of the tetrodotoxin and saxitoxin binding site of the Na+ channel / Biophys J. 1994. V. 66. № 1. P. 1-13. 129 89. Lipkind G.M. and Fozzard H.A. KcsA crystal structure as framework for a molecular model of the Na(+) channel pore / Biochemistry. 2000. V. 39. № 28. P. 8161-8170. 90. Lipkind G.M. and Fozzard H.A. Molecular modeling of local anesthetic drug binding by voltage-gated sodium channels / Mol Pharmacol. 2005. V. 68. № 6. P. 1611-1622. 91. Long S.B., Campbell E.B. and Mackinnon R. Crystal structure of a mammalian voltage dependent Shaker family K+ channel / Science. 2005. V. 309. № 5736. P. 897-903. 92. McArthur J.R., Ostroumov V., Al-Sabi A., McMaster D. and French R.J. Multip le, distributed interactions of mu-conotoxin PIIIA associated with broad targeting among voltage gated sodium channels / Biochemistry. 2011. V. 50. № 1. P. 116-124. 93. McArthur J.R., Singh G., McMaster D., Winkfein R., Tieleman D.P. and French R.J. Interactions of key charged residues contributing to selective block of neuronal sodium channels by mu-conotoxin KIIIA / Mol Pharmacol. 2011. V. 80. № 4. P. 573-584. 94. McArthur J.R., Singh G., O'Mara M.L., McMaster D., Ostroumov V., Tieleman D.P. and French R.J. Orientation of mu-conotoxin PIIIA in a sodium channel vestibule, based on voltage dependence of its binding / Mol Pharmacol. 2011. V. 80. № 2. P. 219-227. 95. McWilliam H., Li W., Uludag M., Squizzato S., Park Y.M., Buso N., Cowley A.P. and Lopez R. Analysis Tool Web Services from the EMBL-EBI / Nucleic Acids Res. 2013. V. 41. № Web Server issue. P. W597-600. 96. Miljanich G.P. Ziconotide: neuronal calcium channel blocker for treating severe chronic pain / Curr Med Chem. 2004. V. 11. № 23. P. 3029-3040. 97. Minassian N.A., Gibbs A., Shih A.Y., Liu Y., Neff R.A., Sutton S.W., Mirzadegan T., Connor J., Fellows R., Husovsky M., Nelson S., Hunter M.J., Flinspach M. and Wickenden A.D. Analysis of the structural and molecular basis of voltage-sensitive sodium channel inhibition by the spider toxin huwentoxin-IV (mu-TRTX-Hh2a) / J Biol Chem. 2014. V. 288. № 31. P. 2270722720. 98. Moczydlowski E., Hall S., Garber S.S., Strichartz G.S. and Miller C. Voltage-depende nt blockade of muscle Na+ channels by guanidinium toxins / J Gen Physiol. 1984. V. 84. № 5. P. 687-704. 99. Nau C. and Wang G.K. Interactions of local anesthetics with voltage-gated Na+ channels / J Membr Biol. 2004. V. 201. № 1. P. 1-8. 100. Nicholls J.G. From neuron to brain. 2003. Sunderland, Sinauer Associates, Inc. 101. Nicke A., Wonnacott S. and Lewis R.J. Alpha-conotoxins as tools for the elucidation of structure and function of neuronal nicotinic acetylcholine receptor subtypes / Eur J Biochem. 2004. V. 271. № 12. P. 2305-2319. 102. O'Reilly A.O., Khambay B.P., Williamson M.S., Field L.M., Wallace B.A. and Davies T.G. Modelling insecticide-binding sites in the voltage-gated sodium channel / Biochem J. 2006. V. 396. № 2. P. 255-263. 103. Olivera B.M. Conus peptides: biodiversity-based discovery and exogenomics / J Biol Chem. 2006. V. 281. № 42. P. 31173-31177. 104. Olivera B.M. and Cruz L.J. Conotoxins, in retrospect / Toxicon. 2001. V. 39. № 1. P. 714. 105. Olivera B.M. and Teichert R.W. Diversity of the neurotoxic Conus peptides: a model for concerted pharmacological discovery / Mol Interv. 2007. V. 7. № 5. P. 251-260. 106. Payandeh J., Scheuer T., Zheng N. and Catterall W.A. The crystal structure of a voltage gated sodium channel / Nature. 2011. V. 475. № 7356. P. 353-358. 107. Pinto M.C., Kihara A.H., Goulart V.A., Tonelli F.M., Gomes K.N., Ulrich H. and Resende 130 R.R. Calcium signaling and cell proliferation / Cell Signal. 2015. V. 27. № 11. P. 2139-2149. 108. Priestley T. Voltage-gated sodium channels and pain / Curr Drug Targets CNS Neurol Disord. 2004. V. 3. № 6. P. 441-456. 109. Purves D. Neuroscience. 2012. Sunderland, Mass., Sinauer Associates. 110. Qu Y., Rogers J., Tanada T., Scheuer T. and Catterall W.A. Molecular determinants of drug access to the receptor site for antiarrhythmic drugs in the cardiac Na+ channel / Proc Natl Acad Sci U S A. 1995. V. 92. № 25. P. 11839-11843. 111. Ragsdale D.S., McPhee J.C., Scheuer T. and Catterall W.A. Molecular determinants of state-dependent block of Na+ channels by local anesthetics / Science. 1994. V. 265. № 5179. P. 1724-1728. 112. Rigden D.J. From protein structure to function with bioinformatics. 2009. Dordrecht, Springer. 113. Rogers J.C., Qu Y., Tanada T.N., Scheuer T. and Catterall W.A. Molecular determina nts of high affinity binding of alpha-scorpion toxin and sea anemone toxin in the S3-S4 extracellular loop in domain IV of the Na+ channel alpha subunit / J Biol Chem. 1996. V. 271. № 27. P. 1595015962. 114. Rogers M., Tang L., Madge D.J. and Stevens E.B. The role of sodium channels in neuropathic pain / Semin Cell Dev Biol. 2006. V. 17. № 5. P. 571-581. 115. Ruetsch Y.A., Boni T. and Borgeat A. From cocaine to ropivacaine: the history of local anesthetic drugs / Curr Top Med Chem. 2001. V. 1. № 3. P. 175-182. 116. Safo P., Rosenbaum T., Shcherbatko A., Choi D.Y., Han E., Toledo-Aral J.J., Olivera B.M., Brehm P. and Mandel G. Distinction among neuronal subtypes of voltage-activated sodium channels by mu-conotoxin PIIIA / J Neurosci. 2000. V. 20. № 1. P. 76-80. 117. Sato K., Ishida Y., Wakamatsu K., Kato R., Honda H., Ohizumi Y., Nakamura H., Ohya M., Lancelin J.M., Kohda D. and et al. Active site of mu-conotoxin GIIIA, a peptide blocker of muscle sodium channels / J Biol Chem. 1991. V. 266. № 26. P. 16989-16991. 118. Schrempf H., Schmidt O., Kummerlen R., Hinnah S., Muller D., Betzler M., Steinkamp T. and Wagner R. A prokaryotic potassium ion channel with two predicted transmembrane segments from Streptomyces lividans / EMBO J. 1995. V. 14. № 21. P. 5170-5178. 119. Shon K.J., Olivera B.M., Watkins M., Jacobsen R.B., Gray W.R., Floresca C.Z., Cruz L.J., Hillyard D.R., Brink A., Terlau H. and Yoshikami D. mu-Conotoxin PIIIA, a new peptide for discriminating among tetrodotoxin-sensitive Na channel subtypes / J Neurosci. 1998. V. 18. № 12. P. 4473-4481. 120. Siegel G. Basic Neurochemistry. 2011. Academic Press. 121. Sievers F., Wilm A., Dineen D., Gibson T.J., Karplus K., Li W., Lopez R., McWilliam H., Remmert M., Soding J., Thompson J.D. and Higgins D.G. Fast, scalable generation of high-qua lity protein multiple sequence alignments using Clustal Omega / Mol Syst Biol. 2011. V. 7. № P. 539. 122. Silver K.S., Du Y., Nomura Y., Oliveira E.E., Salgado V.L., Zhorov B.S. and Dong K. (2014). Voltage-gated sodium channels as insecticide targets. Advances in insect physiology. E. Cohen. Oxford, UK, Academic Press 46. 123. Sobolevsky A.I., Rosconi M.P. and Gouaux E. X-ray structure, symmetry and mechanis m of an AMPA-subtype glutamate receptor / Nature. 2009. V. 462. № 7274. P. 745-756. 124. Soria B. and Cenã V. Ion channel pharmacology. 1998. Oxford ; New York, Oxford University Press. 125. Spassova M. and Lu Z. Tuning the voltage dependence of tetraethylammonium block with 131 permeant ions in an inward-rectifier K+ channel / J Gen Physiol. 1999. V. 114. № 3. P. 415-426. 126. Sperelakis N. Cell physiology source book. 1995. San Diego, Academic Press. 127. Stevens M., Peigneur S., Dyubankova N., Lescrinier E., Herdewijn P. and Tytgat J. Design of bioactive peptides from naturally occurring mu-conotoxin structures / J Biol Chem. 2012. V. 287. № 37. P. 31382-31392. 128. Sunami A., Dudley S.C., Jr. and Fozzard H.A. Sodium channel selectivity filter regulates antiarrhythmic drug binding / Proc Natl Acad Sci U S A. 1997. V. 94. № 25. P. 14126-14131. 129. Sunami A., Glaaser I.W. and Fozzard H.A. A critical residue for isoform difference in tetrodotoxin affinity is a molecular determinant of the external access path for local anesthetics in the cardiac sodium channel / Proc Natl Acad Sci U S A. 2000. V. 97. № 5. P. 2326-2331. 130. Terlau H., Heinemann S.H., Stuhmer W., Pusch M., Conti F., Imoto K. and Numa S. Mapping the site of block by tetrodotoxin and saxitoxin of sodium channel II / FEBS Lett. 1991. V. 293. № 1-2. P. 93-96. 131. Terlau H. and Olivera B.M. Conus venoms: a rich source of novel ion channel-targeted peptides / Physiol Rev. 2004. V. 84. № 1. P. 41-68. 132. Thompson J. and Begenisich T. Functional identification of ion binding sites at the interna l end of the pore in Shaker K+ channels / J Physiol. 2003. V. 549. № Pt 1. P. 107-120. 133. Thomsen W.J. and Catterall W.A. Localization of the receptor site for alpha-scorpion toxins by antibody mapping: implications for sodium channel topology / Proc Natl Acad Sci U S A. 1989. V. 86. № 24. P. 10161-10165. 134. Tietze A.A., Tietze D., Ohlenschlager O., Leipold E., Ullrich F., Kuhl T., Mischo A., Buntkowsky G., Gorlach M., Heinemann S.H. and Imhof D. Structurally diverse mu-conotoxin PIIIA isomers block sodium channel NaV 1.4 / Angew Chem Int Ed Engl. 2012. V. 51. № 17. P. 4058-4061. 135. Tikhonov D.B., Bruhova I., Garden D.P. and Zhorov B.S. State-dependent inter-repeat contacts of exceptionally conserved asparagines in the inner helices of sodium and calcium channels / Pflugers Arch. 2015. V. 467. № 2. P. 253-266. 136. Tikhonov D.B. and Zhorov B.S. Modeling P-loops domain of sodium channel: homology with potassium channels and interaction with ligands / Biophys J. 2005. V. 88. № 1. P. 184-197. 137. Tikhonov D.B. and Zhorov B.S. Sodium channel activators: model of binding inside the pore and a possible mechanism of action / FEBS Lett. 2005. V. 579. № 20. P. 4207-4212. 138. Tikhonov D.B. and Zhorov B.S. Sodium channels: ionic model of slow inactivation and state-dependent drug binding / Biophys J. 2007. V. 93. № 5. P. 1557-1570. 139. Tikhonov D.B. and Zhorov B.S. Possible roles of exceptionally conserved residues around the selectivity filters of sodium and calcium channels / J Biol Chem. 2011. V. 286. № 4. P. 29983006. 140. Tikhonov D.B. and Zhorov B.S. Architecture and pore block of eukaryotic voltage-gated sodium channels in view of NavAb bacterial sodium channel structure / Mol Pharmacol. 2012. V. 82. № 1. P. 97-104. 141. Traynelis S.F., Wollmuth L.P., McBain C.J., Menniti F.S., Vance K.M., Ogden K.K., Hansen K.B., Yuan H., Myers S.J. and Dingledine R. Glutamate Receptor Ion Channels: Structure, Regulation, and Function / Pharmacological Reviews. 2010. V. 62. № 3. P. 405-496. 142. Triggle D.J. Calcium channel antagonists: clinical uses--past, present and future / Biochem Pharmacol. 2007. V. 74. № 1. P. 1-9. 143. Trimmer J.S., Cooperman S.S., Tomiko S.A., Zhou J.Y., Crean S.M., Boyle M.B., Kallen R.G., Sheng Z.H., Barchi R.L., Sigworth F.J. and et al. Primary structure and functional expression 132 of a mammalian skeletal muscle sodium channel / Neuron. 1989. V. 3. № 1. P. 33-49. 144. Van Der Haegen A., Peigneur S. and Tytgat J. Importance of position 8 in mu-conotoxin KIIIA for voltage-gated sodium channel selectivity / Febs j. 2011. V. 278. № 18. P. 3408-3418. 145. Van Goor F., Krsmanovic L.Z., Catt K.J. and Stojilkovic S.S. Control of action potentialdriven calcium influx in GT1 neurons by the activation status of sodium and calcium channels / Mol Endocrinol. 1999. V. 13. № 4. P. 587-603. 146. Vitkup D., Melamud E., Moult J. and Sander C. Completeness in structural genomics / Nat Struct Biol. 2001. V. 8. № 6. P. 559-566. 147. Wang C.Z. and Chi C.W. Conus peptides--a rich pharmaceutical treasure / Acta Biochim Biophys Sin (Shanghai). 2004. V. 36. № 11. P. 713-723. 148. Wang G.K., Quan C. and Wang S. A common local anesthetic receptor for benzocaine and etidocaine in voltage-gated mu1 Na+ channels / Pflugers Arch. 1998. V. 435. № 2. P. 293-302. 149. Wang J., Yarov-Yarovoy V., Kahn R., Gordon D., Gurevitz M., Scheuer T. and Catterall W.A. Mapping the receptor site for alpha-scorpion toxins on a Na+ channel voltage sensor / Proc Natl Acad Sci U S A. 2011. V. 108. № 37. P. 15426-15431. 150. Wang S.Y., Barile M. and Wang G.K. Disparate role of Na(+) channel D2-S6 residues in batrachotoxin and local anesthetic action / Mol Pharmacol. 2001. V. 59. № 5. P. 1100-1107. 151. Wang S.Y., Mitchell J., Tikhonov D.B., Zhorov B.S. and Wang G.K. How batrachotoxin modifies the sodium channel permeation pathway: computer modeling and site-directed mutagenesis / Mol Pharmacol. 2006. V. 69. № 3. P. 788-795. 152. Wang S.Y., Nau C. and Wang G.K. Residues in Na(+) channel D3-S6 segment modulate both batrachotoxin and local anesthetic affinities / Biophys J. 2000. V. 79. № 3. P. 1379-1387. 153. Wang S.Y., Tikhonov D.B., Mitchell J., Zhorov B.S. and Wang G.K. Irreversible block of cardiac mutant Na+ channels by batrachotoxin / Channels (Austin). 2007. V. 1. № 3. P. 179-188. 154. Wang S.Y., Tikhonov D.B., Zhorov B.S., Mitchell J. and Wang G.K. Serine-401 as a batrachotoxin- and local anesthetic-sensing residue in the human cardiac Na+ channel / Pflugers Arch. 2007. V. 454. № 2. P. 277-287. 155. Wang S.Y. and Wang G.K. Voltage-gated sodium channels as primary targets of diverse lipid-soluble neurotoxins / Cell Signal. 2003. V. 15. № 2. P. 151-159. 156. Waszkielewicz A.M., Gunia A., Szkaradek N., Sloczynska K., Krupinska S. and Marona H. Ion channels as drug targets in central nervous system disorders / Curr Med Chem. 2013. V. 20. № 10. P. 1241-1285. 157. Weiner S.J., Kollman P.A., Case D.A., Singh U.C., Ghio C., Alagona G., Profeta S. and Weiner P. A new force field for molecular mechanical simulation of nucleic acids and proteins / Journal of the American Chemical Society. 1984. V. 106. № 3. P. 765-784. 158. Wilson M.J., Yoshikami D., Azam L., Gajewiak J., Olivera B.M., Bulaj G. and Zhang M.M. mu-Conotoxins that differentially block sodium channels NaV1.1 through 1.8 identify those responsible for action potentials in sciatic nerve / Proc Natl Acad Sci U S A. 2011. V. 108. № 25. P. 10302-10307. 159. Wood J.N., Boorman J.P., Okuse K. and Baker M.D. Voltage-gated sodium channels and pain pathways / J Neurobiol. 2004. V. 61. № 1. P. 55-71. 160. Wulff H., Castle N.A. and Pardo L.A. Voltage-gated potassium channels as therapeutic targets / Nat Rev Drug Discov. 2009. V. 8. № 12. P. 982-1001. 161. Xiao Y., Blumenthal K. and Cummins T.R. Gating-pore currents demonstrate selective and specific modulation of individual sodium channel voltage-sensors by biological toxins / Mol Pharmacol. 2014. V. 86. № 2. P. 159-167. 133 162. Xue T., Ennis I.L., Sato K., French R.J. and Li R.A. Novel interactions identified between micro -Conotoxin and the Na+ channel domain I P-loop: implications for toxin-pore binding geometry / Biophys J. 2003. V. 85. № 4. P. 2299-2310. 163. Yamamoto D. Dynamics of strychnine block of single sodium channels in bovine chromaffin cells / J Physiol. 1986. V. 370. № P. 395-407. 164. Yang N. and Horn R. Evidence for voltage-dependent S4 movement in sodium channels / Neuron. 1995. V. 15. № 1. P. 213-218. 165. Yarov-Yarovoy V., Brown J., Sharp E.M., Clare J.J., Scheuer T. and Catterall W.A. Molecular determinants of voltage-dependent gating and binding of pore-blocking drugs in transmembrane segment IIIS6 of the Na(+) channel alpha subunit / J Biol Chem. 2001. V. 276. № 1. P. 20-27. 166. Yarov-Yarovoy V., McPhee J.C., Idsvoog D., Pate C., Scheuer T. and Catterall W.A. Role of amino acid residues in transmembrane segments IS6 and IIS6 of the Na+ channel alpha subunit in voltage-dependent gating and drug block / J Biol Chem. 2002. V. 277. № 38. P. 35393-35401. 167. Yeh J.Z. and Narahashi T. Kinetic analysis of pancuronium interaction with sodium channels in squid axon membranes / J Gen Physiol. 1977. V. 69. № 3. P. 293-323. 168. Yue Z., Xie J., Yu A.S., Stock J., Du J. and Yue L. Role of TRP channels in the cardiovascular system / Am J Physiol Heart Circ Physiol. 2015. V. 308. № 3. P. H157-H182. 169. Zhang J.Z., Yarov-Yarovoy V., Scheuer T., Karbat I., Cohen L., Gordon D., Gurevitz M. and Catterall W.A. Structure-function map of the receptor site for beta-scorpion toxins in domain II of voltage-gated sodium channels / J Biol Chem. 2011. V. 286. № 38. P. 33641-33651. 170. Zhang J.Z., Yarov-Yarovoy V., Scheuer T., Karbat I., Cohen L., Gordon D., Gurevitz M. and Catterall W.A. Mapping the interaction site for a beta-scorpion toxin in the pore module of domain III of voltage-gated Na(+) channels / J Biol Chem. 2012. V. 287. № 36. P. 30719-30728. 171. Zhang M.M., Green B.R., Catlin P., Fiedler B., Azam L., Chadwick A., Terlau H., McArthur J.R., French R.J., Gulyas J., Rivier J.E., Smith B.J., Norton R.S., Olivera B.M., Yoshikami D. and Bulaj G. Structure/function characterization of micro-conotoxin KIIIA, an analgesic, nearly irreversible blocker of mammalian neuronal sodium channels / J Biol Chem. 2007. V. 282. № 42. P. 30699-30706. 172. Zhang M.M., Gruszczynski P., Walewska A., Bulaj G., Olivera B.M. and Yoshikami D. Cooccupancy of the outer vestibule of voltage-gated sodium channels by micro-conotoxin KIIIA and saxitoxin or tetrodotoxin / J Neurophysiol. 2010. V. 104. № 1. P. 88-97. 173. Zhang M.M., McArthur J.R., Azam L., Bulaj G., Olivera B.M., French R.J. and Yoshikami D. Synergistic and antagonistic interactions between tetrodotoxin and mu-conotoxin in blocking voltage-gated sodium channels / Channels (Austin). 2009. V. 3. № 1. P. 32-38. 174. Zhang X., Ren W., DeCaen P., Yan C., Tao X., Tang L., Wang J., Hasegawa K., Kumasaka T., He J., Wang J., Clapham D.E. and Yan N. Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel / Nature. 2012. V. 486. № 7401. P. 130-134. 175. Zhorov B.S. A vector method for calculating the derivatives of the energy of the atomatom interactions of complex molecules with respect to generalized coordinates / Journal of Structural Chemistry. 1981. V. 22. № 1. P. 4-8. 176. Zhorov B.S. Vector method for calculating the derivatives of the energy of deformation of the valence angles and the torsional enegy of complex molecules with respect to generalized coordinates / Journal of Structural Chemistry. 1982. V. 23. № 5. P. 649-655. 177. Zhorov B.S. Comparison of lowest energy conformations of dimethylcurine and methoxyverapamil: evidence of ternary association of calcium channel, Ca2+, and calcium entry 134 blockers / J Membr Biol. 1993. V. 135. № 2. P. 119-127. 178. Zhorov B.S. and Ananthanarayanan V.S. Similarity of Ca(2+)-bound conformations of morphine and Met-enkephalin: a computational study / FEBS Lett. 1994. V. 354. № 2. P. 131-134. 179. Zhorov B.S. and Ananthanarayanan V.S. Conformational analysis of the Ca(2+)-bound opioid peptides: implications for ligand-receptor interaction / J Biomol Struct Dyn. 1995. V. 13. № 1. P. 1-13. 180. Zhorov B.S. and Ananthanarayanan V.S. Conformational and electrostatic similar ity between polyprotonated and Ca(2+)-bound mu-opioid peptides / J Biomol Struct Dyn. 1996. V. 14. № 2. P. 173-183. 181. Zhorov B.S. and Ananthanarayanan V.S. Signal transduction within G-protein coupled receptors via an ion tunnel: a hypothesis / J Biomol Struct Dyn. 1998. V. 15. № 4. P. 631-637. 182. Zhorov B.S. and Ananthanarayanan V.S. Homology models of mu-opioid receptor with organic and inorganic cations at conserved aspartates in the second and third transmembra ne domains / Arch Biochem Biophys. 2000. V. 375. № 1. P. 31-49. 183. Zhorov B.S., Folkman E.V. and Ananthanarayanan V.S. Homology model of dihydropyridine receptor: implications for L-type Ca(2+) channel modulation by agonists and antagonists / Arch Biochem Biophys. 2001. V. 393. № 1. P. 22-41. 184. Zhorov B.S. and Lin S.X. Monte Carlo-minimized energy profile of estradiol in the ligand binding tunnel of 17 beta-hydroxysteroid dehydrogenase: atomic mechanisms of steroid recognition / Proteins. 2000. V. 38. № 4. P. 414-427. 185. Zhorov B.S. and Tikhonov D.B. Potassium, sodium, calcium and glutamate- gated channels: pore architecture and ligand action / J Neurochem. 2004. V. 88. № 4. P. 782-799. 186. Zhorov B.S. and Tikhonov D.B. Ligand action on sodium, potassium, and calcium channels: role of permeant ions / Trends Pharmacol Sci. 2013. V. 34. № 3. P. 154-161. 187. Zimmerman S.S., Pottle M.S., Nemethy G. and Scheraga H.A. Conformational analysis of the 20 naturally occurring amino acid residues using ECEPP / Macromolecules. 1977. V. 10. № 1. P. 1-9. 188. Zubcevic L., Bavro V.N., Muniz J.R., Schmidt M.R., Wang S., De Zorzi R., Venien-Brya n C., Sansom M.S., Nichols C.G. and Tucker S.J. Control of KirBac3.1 potassium channel gating at the interface between cytoplasmic domains / J Biol Chem. 2014. V. 289. № 1. P. 143-151. 189. Зефиров А.Л.Г., Б.Ш.; Шакирьянова, Д.М. Ионные токи двигательного нервного окончания мыши (электрофизиология и компьютерное моделирование) / Нейрофизиология. 1997. V. 1. № P. 8. 190. Тихонов Д.Б. Исследование строения и механизмов блокады ионных каналов никотиновых холинорецепторов и глутаматных рецепторов. доктор биологических наук (03.00.13) диссертация. 2004. ИЭФБ. 135