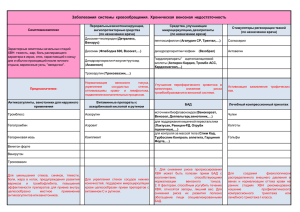
НИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ На правах рукописи Шлякова Анна Андреевна
реклама

86 НИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ На правах рукописи Шлякова Анна Андреевна САХАРНЫЙ ДИАБЕТ 2 ТИПА И ХРОНИЧЕСКАЯ ВЕНОЗНАЯ НЕДОСТАТОЧНОСТЬ: КЛИНИКО-ПАТОГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ ПОРАЖЕНИЯ НИЖНИХ КОНЕЧНОСТЕЙ ПРИ СОЧЕТАННОЙ ПАТОЛОГИИ 14. 01. 04 – внутренние болезни 14.01.26 – сердечно-сосудистая хирургия Диссертация на соискание ученой степени кандидата медицинских наук Научные руководители: доктор медицинских наук, профессор Л.Г. Стронгин, доктор медицинских наук М.Н. Кудыкин Нижний Новгород, 2014 2 Оглавление Список принятых сокращений ……………………………………………………..5 Введение …………………………………………………………………...…………..7 Глава I. Современные представления о влиянии сахарного диабета 2 типа на течение хронической венозной недостаточности нижних конечностей (обзор литературы)……………………………………………………………………………12 1.1. Сахарный диабет 2 типа и хроническая венозная недостаточность нижних конечностей, актуальность сочетанной патологии……………………………….12 1.2. Современные представления о патогенетических механизмах поражения нижних конечностей при сочетанной патологии …………………………………15 1.2.1. Нарушения в микроциркуляторном русле нижних конечностей у пациентов с СД 2 типа и хронической венозной недостаточностью ……………………….16 1.2.2. Изучение влияния диабетической полинейропатии на поражение нижних конечностей при сочетанной патологии…………………………………………….17 1.2.3. Особенности нарушения реологических свойств крови у пациентов с сочетанной патологией……………………………………………………………….19 1.2.4. Роль эндокринных нарушений при сочетанной патологии………………….21 1.2.5. Роль иммунной системы при сочетанной патологии………………………...22 1.3. Подходы к оптимизации лечения микрососудистых осложнений у пациентов СД 2 типа в сочетании с ХВН………………………………………………………..22 Глава 2. Материалы и методы исследования……………………………………….26 2.1. Общая характеристика пациентов………………………………………………26 2.2. Методы исследования……………………………………………………………32 2.2.1. Общеклиническое обследование ……………………………………………..33 3 2.2.2. Клинико-инструментальная оценка хронической венозной недостаточности………………………………………………………………………33 2.2.3. Инструментальная оценка макро- и микроангиопатии нижних конечностей……………………………………………………………………………40 2.2.4. Выявление симптомов нарушения иннервации нижних конечностей……...45 2.2.5. Исследование лабораторных показателей……………………………………47 2.2.6. Исследование влияния фенофибрата на микроциркуляцию нижних конечностей у больных с сочетанной патологией ……………………...………….49 2.2.7. Статистическая обработка данных……………………………………………49 Глава 3. Клинико-лабораторные показатели у больных с сахарным диабетом 2 типа и хронической венозной недостаточностью нижних конечностей...………..51 3.1. Особенности клинической картины…………………………………………….51 3.2. Особенности лабораторных показателей ………………………………………62 3.3. Резюме ……………………………………………………………………………65 Глава 4. Показатели инструментальных методов исследования у обследуемых контингентов больных ……………………………………………………………….68 4.1. Ультразвуковое ангиосканирование вен и артерий нижних конечностей …..68 4.2. Электрофизиологическая характеристика функционального состояния чувствительных и моторных нервов нижних конечностей ………………………86 4.3. Состояние микроциркуляции нижних конечностей по данным лазерной допплеровской флоуметрии …………………………………………………………90 4.4. Резюме ……………………………………………………………………………97 Глава 5. Возможные пути оптимизации лечения нарушения микроциркуляции у пациентов СД 2 типа в сочетании с ХВН ………………………………………….100 4 5.1. Влияние фенофибрата на клиническое проявление диабетической полинейропатии у пациентов с хронической венозной недостаточностью нижних конечностей ………………………………………………………………………….100 5.2. Эффективность фенофибрата в лечении диабетической полинейропатии и нарушения микроциркуляции нижних конечностей у наблюдаемых пациентов по данным ЭНМГ и ЛДФ ………………………………………………………………103 5.3. Резюме …………………………………………………………………………..109 Глава 6. Обсуждение результатов ………………………………………………....111 Выводы ……………………………………………………………………………...125 Практические рекомендации …………………………………………………….127 Список литературы ………………………………………………………………..128 Список работ, опубликованных по теме диссертации ………………………..148 5 Список принятых сокращений А – амплитуда колебаний кровотока в микрососудах Ад. – амплитуда колебаний дыхательного частотного диапазона Ам. – амплитуда колебаний собственно миогенного частотного диапазона Ан. – амплитуда колебаний симпатического частотного диапазона Ас. – амплитуда колебаний сердечного (кардиального) частотного диапазона Аэ. - амплитуда колебаний эндотелиального частотного диапазона АВА – артериоло-венулярный анастомоз АЧС – амплитудно-частотный спектр АЧТВ – активное частичное тромбопластиновое время БПВ – большая подкожная вена ВАШ – визуальная аналоговая шкала ВБНК – варикозная болезнь нижних конечностей ГН – гликемия натощак ДПН – диабетическая полинейропатия нижних конечностей ДР – диабетическая ретинопатия ДЭ – деформируемость эритроцитов ЗББА – задние больше-берцовые артерии ИК – индекс Карнегана ИМТ – индекс массы тела КИМ – комплекс интима-медиа ЛДФ – лазерная доплеровская флоуметрия М – постоянная составляющая перфузии МНО – международное нормализованное отношение М нутр. – нутритивный компонент М М шунт. – шунтовой компонент М МПВ – малая подкожная вена МЦР – микроциркуляторное русло HbA1c –гликированный гемоглобин 6 НДС – нейропатический дисфункциональный счет НСС – нейропатический симптоматический счет ОБ – окружность бедра ОБА – общая бедренная артерия ОСС – общий симптоматический счет ОТ – окружность талии ОХС - общий холестерин ППГ – постпрандиальная гликемия ПССТ - пероральная сахароснижающая терапия ПТВ – протромбиновое время ПТИ – протромбиновый индекс ПТФБ – посттромбофлебитическая болезнь пф.ед. – перфузионная единица ПББА – передние больше-берцовые артерии ПШ – показатель шунтирования РЛ – резидуальная латентность СД 2 типа – сахарный диабет 2 типа СПС – сафено-поплитеальное соустье СРВ – скорость распространения возбуждения СФС – сафено-феморальное соустье ТАС – тыльная артерия стопы ТВ – тромбиновое время УЗАС – ультразвуковое ангиосканирование ХВН – хроническая венозная недостаточность ХЗВ – хронические заболевания вен ЭНМГ – электронейромиография CEAP – Сlinical, Etiological, Anatomical, Pathophysiological RI – резистивный индекс VCSS – Venous Clinical Severity Score 7 ВВЕДЕНИЕ Актуальность научного исследования Сахарный диабет (СД) и хроническая венозная недостаточность (ХВН) являются распространенными заболеваниями взрослого населения экономически развитых стран. В качестве пандемии, СД является угрозой не только для здоровья человека, но и для глобальной экономики развитых стран и характеризуется высоким риском развития поражений сосудов уже на ранних стадиях нарушения углеводного обмена с дальнейшим прогрессированием по мере развития основного патологического процесса [71,109]. Наличие сосудистых осложнений для СД 2 типа настолько характерно, что послужило основанием отнести его к заболеваниям сердечнососудистой системы [27,31,78,120]. В России различные формы ХВН наблюдаются у 35 млн. человек, причем у 15% из них имеются трофические изменения кожи, открытые или рецидивирующие трофические язвы [86,98]. Значительно снижающая качество жизни, приводящая к инвалидизации больных трудоспособного возраста, ХВН превратилась из медицинской в социально-экономическую проблему [22,64,86, 93]. Ряд исследований показали, что СД 2 типа и ХВН достаточно часто сочетаются [112,134,142]. Кроме того, СД 2 типа ассоциируется с более тяжелым течением ХВН у 50% больных и даже в стадии компенсации в 8 раз снижает вероятность закрытия венозной трофической язвы [76,101,117]. Пациенты с СД 2 типа особенно подвержены возникновению и прогрессированию ХВН, так как уже имеют факторы риска, общие с хроническими заболеваниями вен (ХЗВ), такие, как нарушение микроциркуляции нижних конечностей, избыточный вес, артериальная гипертония (АГ), эндотелиальная дисфункция [131]. Остается открытым вопрос о влиянии макроангиопатии на поражение нижних конечностей у пациентов СД 2 типа в сочетании с ХВН. Мало изучены роль диабетической периферической полинейропатии (ДПН) при сочетанной патологии и связь 8 течения ХВН с дисгликемией. До настоящего времени не было исследований влияния фенофибрата на микроангиопатию у пациентов с СД 2 типа в сочетании с ХВН нижних конечностей. Все это определило цель и задачи нашего исследования. Цель исследования: комплексная оценка влияния сахарного диабета 2 типа на поражение нижних конечностей у пациентов с хронической венозной недостаточностью. Задачи исследования 1. Исследовать клинические особенности течения хронической венозной недостаточности и морфо-функциональные нарушения венозной системы нижних конечностей у пациентов с сочетанной патологией. 2. Изучить клинико-метаболические аспекты влияния СД 2 типа на поражение нижних конечностей у пациентов с сочетанной патологией. 3. Оценить роль диабетической полинейропатии и макроангиопатии нижних конечностей в усугублении тяжести ХВН у больных с СД 2 типа. 4. Выявить особенности нарушения микроциркуляции нижних конечностей у больных с сочетанной патологией и оценить возможность их коррекции фенофибратом. Положения, выносимые на защиту 1. СД 2 типа оказывает отягощающее влияние на поражение нижних конечностей при хронической венозной недостаточности, что проявляется в большей выраженности отечного и трофического синдромов, а так же морфофункциональных нарушений венозной системы. 9 2. Отягощающее влияние сахарного диабета на течение хронической венозной недостаточности обусловлено большей частотой неспецифических факторов (ожирение, артериальная гипертония, дислипидемия, гиперкоагуляция), а так же плохим контролем гликемии (HbA1с > 10%), большой длительностью диабета ( >10лет) и наличием макроангиопатии нижних конечностей. 3. Диабетическая сенсо-моторная нейропатия нижних конечностей и диабетическая микроангиопатия являются важнейшими факторами отягощения венозной патологии через нарушение микроциркуляции и трофики нижних конечностей. Эти проявления могут быть ослаблены применением фенофибрата. Научная новизна Впервые проведена комплексная оценка влияния СД 2 типа на течение ХВН. Установлено отягощающее влияние СД 2 типа на течение хронической венозной недостаточности, что клинически характеризуется большей выраженностью трофического и отечного синдромов. Выявлено, что морфо-функциональные изменения венозного кровотока у больных СД 2 типа с хронической венозной недостаточностью характеризуются двухсторонним поражением, чаще определяются несостоятельность сафенофеморального соустья (СФС) и перфорантных вен голени. Показано, что в патогенезе такого отягощения играют роль, как общие для всей субпопуляции больных ХВН факторы (ожирение, артериальная гипертония, гиперкоагуляция), которые чаще наблюдаются у пациентов с СД 2 типа, так и специфические для сахарного диабета факторы (гипергликемия НbА1с > 10%, длительность СД 2 типа более 10 лет, наличие диабетической микроангиопатии нижних конечностей). Выявлена особая роль диабетических полинейропатии и макроангиопатии, ассоциированные с нарушением морфо-функциональных характеристик венозной системы и нарушением способствующих микроциркуляции усугублению отечного и в нижних трофического конечностях, синдромов. 10 Одновременно, наличие диабетической полинейропатии может маскировать симптоматику ХВН за счет уменьшения болевого синдрома. Показано, что нейрососудистые нарушения у больных с СД 2 типа и ХВН могут частично корригироваться фенофибратом. Практическая значимость Установленная в работе роль нарушений углеводного обмена в прогрессировании хронической венозной недостаточности нижних конечностей у больных с сочетанной патологией обосновывает обязательность включения в лечебные мероприятия терапевтического обучения, самоконтроля, достижения целевых значений контроля гликемии. Продемонстрирована роль нарушения иннервации нижних конечностей, а так же макроангиопатии в прогрессировании хронической венозной недостаточности. Обоснована важность профилактики и ранней диагностики диабетического поражения конечностей у больных периферических нервов и артерий нижних с СД 2 типа в сочетании с хронической венозной недостаточностью. Ассоциированные с большей частотой у пациентов с СД 2 типа такие факторы как ожирение, дислипидемия и артериальная гипертензия оказывают неблагоприятное влияние на течение ХВН. Их своевременная и адекватная коррекция позволяет улучшить состояние венозного кровотока у больных с сочетанной патологией. Дополнительным препаратом, улучшающим микроциркуляторный кровоток нижних конечностей, а так же снижающим симптоматику диабетической полинейропатии и хронической венозной недостаточности у пациентов с сочетанной патологией, может быть фенофибрат. 11 Внедрение результатов исследований в практику Результаты исследования внедрены в практику лечебной работы ГБУЗ НО «Городская клиническая больница № 13» г. Нижнего Новгорода и в учебный процесс кафедры эндокринологии и внутренних болезней Нижегородской государственной медицинской академии. Публикации По теме диссертации опубликовано 12 научных работ в центральной и местной печати, из них 3 статьи в журналах, рекомендованных ВАК. Апробация работы Материалы диссертации доложены на IX научно-практической конференции Ассоциации флебологов России с международным участием (Москва, 2012), Российско-украинском венозном форуме (Ростов-на-Дону, 2013), 16th European Congress of Endocrinology (ECE), poster presentation (Poland, Wrozlav, 2014), на Х научно-практической конференции Ассоциации флебологов России (Нижний Новгород, 2014). Результаты работы доложены и обсуждены на заседании кафедры эндокринологии и внутренних болезней НижГМА (Нижний Новгород, 2013). Апробация диссертации состоялась на совместном расширенном заседании кафедры эндокринологии и внутренних болезней НижГМА, проблемной комиссии «Внутренние болезни, кардиология, токсикология, аллергология, эндокринология, клиническая фармакология», проблемной комиссии «Сердечнососудистая хирургия, лучевая диагностика и лучевая терапия» Нижегородской государственной медицинской академии (Нижний Новгород, 24.06.2014). Объем и структура работы Диссертация состоит из введения, 6 глав, выводов, практических рекомендаций и списка литературы, включающего 92 иностранных и 98 отечественных источников. Диссертация изложена на 150 машинописного текста, иллюстрирована 57 таблицами и 20 рисунками. страницах 12 Глава I. Современные представления о влиянии сахарного диабета 2 типа на течение хронической венозной недостаточности нижних конечностей (обзор литературы) 1.1.Сахарный диабет 2 типа и хроническая венозная недостаточность нижних конечностей, актуальность сочетанной патологии В настоящее время СД, преимущественно за счет СД 2 типа, – одна из основных проблем здравоохранения 21-го века, наряду с сердечно-сосудистыми заболеваниями [137]. Доктор Эдвин Гейл из Университета Бристоля назвал пандемию СД “the diabetes apocalypse” [115]. Если раньше СД 2 типа считался заболеванием пожилых людей и людей среднего возраста, то сейчас диагноз распространяется не только на молодых взрослых, но и подростков и детей [109,115]. Согласно данным экспертов в 2000 году насчитывалось 171 миллион человек с СД, прогнозировалось увеличение до 366 миллионов к 2030 году [139]. Но, как показывают новые данные, распространенность заболевания была недооценена [144]. Уже к 2013 году 382 миллиона человек имели СД, и к 2035 году это число, по прогнозам, вырастет до 600 миллионов [116]. По оценкам глобальных расходов здравоохранения на СД, к 2030 году ожидается их увеличение на 30-34% по сравнению с 2010 г., что достигнет между $ 490 млрд. и $ 893 млрд. [138]. Большая социальная значимость состоит в том, что уже у 10– 30% пациентов с СД 2 типа, одновременно с постановкой диагноза, выявляются микро- и макрососудистые осложнения, являющиеся основной причиной высокой инвалидизации и летальности больных, среди которых значительную часть составляют лица трудоспособного возраста [96]. Трофические нарушения нижних конечностей развиваются у 10% пациентов с сахарным диабетом в пожилом возрасте [2]. Частота ампутаций конечностей составляет от 6 до 8 случаев в год на 1000 больных сахарным диабетом [81]. 13 ХВН нижних конечностей не уступает по значимости СД и является глобальной медико-социальной проблемой современности и в настоящее время самой распространенной патологией сосудистой системы человека [118,187]. По данным Международного союза флебологов (2001г.), до 60 % трудоспособного населения нашей планеты страдает различными формами заболевания вен нижних конечностей [38]. Варикозной болезнью нижних конечностей (ВБНК), как основной разновидностью хронических заболеваний вен (ХЗВ), страдает до 70% женского и до 50% мужского населения, в основном трудоспособного возраста [38,116,127,141]. Российская статистика практически не отличается от зарубежной [5,16]. Более того, если раньше заболевание относили к проблемам лиц старшей возрастной группы (более 50 лет), то в настоящее время у 10-15% школьников в возрасте 12-13 лет выявляют первые признаки венозного рефлюкса [39,140]. Различные осложнения ХВН - тромбофлебиты, тромбозы глубоких вен, венозные язвы - возникают у большого числа больных. Тромбоз глубоких вен (ТГВ) нижних конечностей представляет реальную угрозу для жизни, его стандартизированная заболеваемость на 10.000 населения в год составляет от 4,6 до 9,5 [135]. ТГВ - наиболее частая причина тромбоэмболии легочной артерии (ТЭЛА), являющейся серьезной проблемой современного здравоохранения [6,86]. Heit J.A. в 2006 году выявил, что ТЭЛА является непосредственной причиной гибели одного из 1000 жителей планеты, а общая частота составляет около 117 случаев ТЭЛА на 100 000 человек [151]. Ежегодно в мире производится значительное число оперативных вмешательств на венах нижних конечностей, и отдаленные результаты этих вмешательств оставляют желать лучшего, рецидивы возникают в огромном проценте случаев [57,88]. Развитие ХВН – это длительный процесс, своевременное выявление и лечение которого может замедлить прогрессирование ХВН, и в конечном итоге, привести к уменьшению симптомов заболевания, способствовать профилактике развития тяжелых форм ХВН с трофическими язвами, а так же улучшить качество жизни пациентов, снизить риск потери нетрудоспособности. По статистическим 14 данным, из 35-50 миллионов россиян с ХВН, у 15% имеются язвенные формы [86]. Несмотря на тенденцию уменьшения частоты развития тяжелых форм ХВН, крупные европейские эпидемиологические исследования последних лет подтверждают их высокую распространенность [73]. Общий прогноз по заживлению венозных язв и на сегодняшний день остается пессимистическим: только 50% из них заживают в течение ближайших 4 месяцев, 20% остается открытыми на протяжении 2 лет, 8% не заживают при 5-летнем наблюдении, но даже в случае закрытия трофических язв частота их рецидивирования остается на уровне 6–15%. [70]. В России инвалидизирующие трофические язвы при ХВН, резистентные к самым современным методам хирургического и консервативного лечения, встречаются более чем у 1,5 млн. человек [17,72]. Причины, а так же факторы риска, прогноз рецидивирования до сих пор остаются открытыми для обсуждения и выводы многих работ очень часто не совпадают. Например, по данным зарубежной работы Gohel M.S. et al., основными рецидивообразующими факторами были признаны: не устранённый рефлюкс в системе поверхностных вен и удлиненное время заживления язвы. А, казалось бы, такие значимые клинические моменты, как возраст, длительность язвенного анамнеза, посттромбофлебитический генез, рефлюкс в глубоких и перфорантных венах, наличие сопутствующей патологии в виде сахарного диабета и ревматоидного артрита, по расчетам исследователей, не показали статистической значимости по отношению к рецидивированию [157]. Однако, по последним российским данным, значимую роль играют сопутствующие заболевания. Среди пациентов с ХВН достаточно часто встречается СД 2 типа. По данным многолетнего ретроспективного исследования, из 864 пациентов с ХВН, у 15% сопутствовал СД 2 типа [134]. S. Stuard et al, при наблюдении за 388 пациентами на протяжении пяти лет с ХВН выявили, что у 177 пациентов (45,6%) хроническому заболеванию вен (ХЗВ) нижних конечностей сопутствовал СД 2 типа [133]. В одном из зарубежных исследований 2011 года в Великобритании, Mani R. et al. выявили, что у пациентов с СД имеется недостаточность глубоких 15 вен в 64% правой нижней конечности и в 70,7% левой нижней конечности, что статистически значимо (р<0,05) больше, чем в общей популяции; а так же 42,7% и 49,3% пациентов имели сокращенное время венозного наполнения правой и левой нижней конечности соответственно, у 30,7% и 33,3% пациентов был снижен артериовенозный ответ в правой и левой нижних конечностях [162]. 1.2. Современные представления о патогенетических механизмах поражения нижних конечностей при сочетанной патологии ХВН - это относительно самостоятельное патологическое состояние (симптомокомплекс), в основе которого лежит каскад патологических изменений на молекулярном, клеточном и тканевом уровнях, вызванный венозным стазом [18,69,90]. Самыми частыми причинами ХВН являются варикозная болезнь нижних конечностей (ВБНК) и посттромбофлебитическая болезнь (ПТФБ). Одной из самых первых теорий развития ВБНК является теория клапанной недостаточности. На сегодняшний день предложены некоторые новые положения. Считается, что в основе повреждения венозных клапанов лежит лейкоцитарная (моноциты/макрофаги) агрессия [52]. Патологическая агрессия лейкоцитарного звена ведет к укорочению створок клапана, эрозии эндотелия и утолщению субэндотелиального слоя. Помимо этого, гидродинамические провокации приводят к гипертрофии основания клапана, утолщению и сморщиванию свободного края створок, изменению синусов. Отмечается дилатация мышечноэластического клапанного кольца и его повреждение, что вызывает расхождение клапанных створок и возникновение рефлюкса [52]. Однако, до сих пор непонятно, что лежит в основе развития клапанной недостаточности – механизм лейкоцитарной агрессии или слабость венозной стенки с расхождением комиссур. Высказываются мнения, что в данном случае имеют место оба механизма [19]. 16 1.2.1. Нарушения в микроциркуляторном русле нижних конечностей у пациентов с СД 2 типа и хронической венозной недостаточностью ХВН является нестабильным состоянием, однажды сформировавшись, она затрагивает не только венозную, но и артериальную и лимфатическую системы, а также микроциркуляторное русло [24]. Основную роль в возникновении ХВН играет извращенный кровоток, обусловленный венозной гипертензией, гидростатическим и гидродинамическим давлением [86]. Все это приводит к стойкому застою венозной крови в нижних конечностях и к вторичным нарушениям на уровне микроциркуляторного русла [172]. Поэтому, на сегодняшний день, более пристальное внимание при диагностике и лечении венозной патологии заслуживает микроциркуляторное русло, как основная зона нарушений при ХВН [92]. Достижением последних лет явилось открытие новых механизмов в системе микроциркуляции, приводящих к прогрессированию ХВН. Согласно этой теории, роль лейкоцитов определяется, как главный этиологический фактор поражения венозной системы [121]. Венозный стаз и гипоксия рассматриваются, как механизмы, вызывающие повреждение эндотелия, что в свою очередь, способствует адгезии лейкоцитов к венозной стенке и последующей их активации с высвобождением протеолитических ферментов, свободных радикалов и других биологически активных веществ [66,184]. Следствием этого является повреждение эндотелиального барьера, миграция лейкоцитов, других форменных элементов крови и ее жидкой части в паравазальное пространство [121]. Также считается, что фиксированные и мигрирующие лейкоциты становятся причиной частичной обструкции капилляров и могут участвовать в развитии капиллярной гипоперфузии [13]. Активированный эндотелий также индуцирует прокоагулянтную активность тромбоцитов, что усугубляет нарушение микроциркуляции [66,183]. Повышение капиллярной проницаемости приводит к миграции плазменных протеинов и накоплению интерстициального перикапиллярные фибрина фибриновые в тканях нижних «манжеты» конечностей. создают Такие дополнительный 17 диффузионный барьер, что приводит к гипоксии, недостаточности питания тканей с последующим развитием индурации, липодерматосклероза и формированием язв [52]. Следует отметить, что сахарный диабет раньше других хронических неинфекционных заболеваний вызывает генерализованное поражение сосудистого русла, приводящее к тяжелым последствиям. Ведущим звеном в их развитии и прогрессировании признается поражение сосудов микроциркуляторного русла – микроангиопатии [9,63]. При СД образуется множество артериовенозных шунтов, по которым артериальная кровь, минуя капиллярную сеть, сбрасывается в венозное русло, приводя к снижению капиллярного кровотока [58,59]. В тоже время, среди причин развития диабетических ангиопатий особая роль отводится состоянию клеток красной крови, снижению газотранспортной функции эритроцитов, а также изменению реологических свойств крови [17,86]. Все это приводит к нарушению микроциркуляции и может утяжелять течение ХВН у пациентов с сочетанной патологией. 1.2.2. Изучение влияния диабетической полинейропатии на поражение нижних конечностей при сочетанной патологии Диабетические дистрофическими микроангиопатии изменениями морфологически эндотелиоцитов, их характеризуются неполноценностью, увеличением проницаемости сосудистой стенки для белков плазмы крови, активацией перицитов и гладкомышечных клеток сосудов, утолщением базальной мембраны и гиалинозом артериол [122]. Патогенез сосудистых изменений при СД интенсивно играющие изучается. важную предрасположенность, сорбитолового пути Исследователями роль в развитии гипергликемия, метаболизма выявлены различные микроангиопатий: активация глюкозы, факторы, генетическая инсулиннезависимого гликозилирование белков, аутоиммунные реакции в сосудистой стенке, активация перекисного окисления 18 липидов, дисфункция эндотелия и увеличение агрегации тромбоцитов, активация глюкоронатного пути метаболизма глюкозы, снижение активности пентозного цикла метаболизма глюкозы, гиперпродукция контринсулярных гормонов, повышение активности системы ренин-ангиотензин-альдостерон [150,153]. Самым частым клиническим проявлением микроангиопатии при СД 2 типа является диабетическая полинейропатия (ДПН), в развитии которой значительное место отводится первичному поражению сосудов, участвующих кровоснабжении периферических отделов нервной системы [10]. в По данным различных исследований, частота невропатии среди больных СД 2 типа варьирует в широких пределах - от 10 до 90 %, в зависимости от методологии исследования и применяемых критериев диагностики [165]. У 5% пациентов неврологические нарушения являются первыми симптомами заболевания и позволяют в дальнейшем диагностировать диабет [43]. В среднем ДПН среди больных с СД 2 типа составляет около 25%, при углубленном неврологическом исследовании она возрастает до 50%, а при применении электрофизиологических методов исследования и количественной оценки чувствительности - до 90% [44]. В патогенезе ДПН существенная роль отводится хронической гипоксии нервов вследствие ишемии. Большое значение в настоящее взаимодействию нарушений эндоневрального кровотока время придается метаболическим сдвигам. Снижение скорости проведения импульса по миелиновым волокнам обусловлено патологически высокой внутриаксональной концентрацией ионов натрия, в развитии которой основная роль отводится снижению активности тканевой Na+-K+-АТФазы [7,9,25]. В условиях гипергликемии активизируется так называемый полиоловый шунт, т.е. увеличивается в 7-10 раз синтез сорбитола из глюкозы под действием фермента альдозоредуктазы и фруктозы при участии сорбитолдегидрогеназы. Уровень эндоневрального кровотока при этом снижается, что способствует гипоксии нервов. Важная роль отводится снижению интранейронального транспорта миоинозитола в условиях гипергликемии, что и считается основной причиной 19 снижения активности тканевой Na+-K+-АТФазы. Следствием этого является устойчивое снижение уровня утилизации энергии клеткой, угнетение анаболических процессов [7,102]. Сторонники нейротрофической теории развития варикозной трансформации вен и формирования ХВН считают, что в основе патологического процесса лежит поражение нервного аппарата вен [4,42]. Нарушение иннервации ведет к снижению венозного тонуса, а затем к дегенеративным изменениям мышечноэластических элементов в стенке сосуда. Участие нервной системы в развитии заболевания подтверждается деструктивными изменениями сегментарным в нервной поражением ткани, вен, а также обнаруженными при морфологических исследованиях. Так, в одном из исследований, у пациентов с СД 2 типа в сочетании с ДПН было выявлено более высокое давление в венозной системе, которое коррелировало с тяжестью нейропатии и количеством артериовенозных шунтов [160]. 1.2.3. Особенности нарушения реологических свойств крови у пациентов с сочетанной патологией Под воздействием гиперинсулинемии происходят изменения в системе гемокоагуляции и гемореологии. При этом возрастает способность тромбоцитов к агрегации: снижается концентрация цАМФ и цГМФ в тромбоцитах, повышается концентрация тромбоксана. Повышаются концентрации прокоагулянтов: фибриногена, фактора фон Вилленбранда, прокоагуляционная активность, активность тромбина. Снижаются концентрация и активность антитромботических факторов; снижается фибринолиз [27]. Таким образом, гиперинсулинемия способствует развитию и прогрессированию атеросклероза, как у лиц предрасположенных к развитию СД, так и у больных СД 2 типа [94]. Данные изменения в системе гемостаза и гемореологии действительно являются важным звеном атерогенеза при СД [11,79]. Наиболее существенными нарушениями являются: повышенная 20 склонность тромбоцитов и эритроцитов к агрегации [12,40], снижение антиагрегационной, антикоагулянтной и фибринолитической активности сосудистой стенки с повышением возможности развития ДВС-синдрома [27], увеличение вязкости крови, гиперфибриногенемия [31,83]. Помимо влияния на ускоренное развитие атеросклероза, изменения в системе гемокоагуляции и реологии приводят к повышенной возможности тромбообразования [46]. Все эти изменения реологических свойств крови являются мощным предрасполагающим фактором к развитию и прогрессированию ХВН [141]. Общеизвестно, что микроциркуляция в тканях зависит от состояния капиллярного русла и реологических свойств крови. Последние могут зависеть от целого ряда факторов, подразделяемых на гемодинамические, клеточные, плазменные, факторы взаимодействия и внешних условий [75]. Существенную роль в определении реологических свойств крови играют клеточные элементы и в первую очередь эритроциты, составляющие 45% её общего и 98% клеточного объема [26,35,36,105]. Одним из основных показателей, характеризующих функциональное состояние эритроцитов, является их деформируемость (ДЭ) [35,189]. Она определяется, как способность значительно изменять свою форму, не меняя при этом объёма и площади поверхности [35]. Нормальные эритроциты могут существенно деформироваться, что позволяет им беспрепятственно продвигаться по микроциркуляторному руслу [35]. Это свойство имеет огромное значение для микроциркуляции на участках, где диаметр сосудов меньше размеров эритроцита, и при низких градиентах внутрисосудистого давления. В целом, нормальная деформируемость эритроцитов позволяет обеспечивать адекватное кровообращение в микроциркуляторном русле и поддержание оптимального режима процессов диффузии газов. Ухудшение этого показателя приводит к выраженным нарушениям гомеостаза и гемодинамики [52]. В исследовании Сушкова С.А. и др. выявлено, что у пациентов с хроническим нарушениями венозного оттока наблюдается снижением деформируемости эритроцитов, при этом у больных с варикозной болезнью по мере 21 прогрессирования заболевания отмечается ухудшение показателей деформируемости эритроцитов. Таким образом, можно предположить, что ДЭ играет существенную роль в патогенезе ХВН. J.P. Simanonok [179] выдвинул гипотезу о ведущей роли в патогенезе атеросклероза неишемической гипоксии, вызванной нарушением деформабельных свойств ДЭ. Важное эритроцитов значение и в придается развитии нарушению диабетической микроангиопатии [52]. Возникающие в условиях гипергликемии метаболические и функциональные изменения эритроцитов выражаются в комплексе нарушений, связанных с повышенным гликированием белков клеточных мембран, что приводит к нарушению микроциркуляции крови, развитию гипоксии тканей [21,23], также стимулируется угнетаются рост кислородзависимые микроаэрофильных и функции анаэробных лейкоцитов, микроорганизмов, развивается недостаточность гуморальных и местных факторов [164]. 1.2.4. Роль эндокринных нарушений при сочетанной патологии Все большее внимание в возникновении и прогрессировании ХВН уделяется эндокринным нарушениям. У женщин вероятность развития ХВН в 2 раза выше, чем у мужчин [77]. Это различие, вероятно, является следствием влияния гормональных факторов (эстроген, прогестерон). Расслабляющее действие половых гормонов на мускулатуру венозной стенки подтверждают такие факты, как развитие заболевания в первые месяцы беременности, наклонность к заболеванию после двустороннего удаления яичников и в начале менопаузы [141]. Следует подчеркнуть, что указанные выше факторы сами по себе вызывают лишь анатомическую и функциональную неполноценность венозной системы нижних конечностей, что при наличии вредных воздействий заканчивается развитием ХВН [52]. У женщин с СД 2 типа и нарушением толерантности к углеводам выявлено более существенное снижение индекса ЛГ/ФСГ и повышение тестостерона, по сравнению с женщинами без нарушения углеводного обмена в пери- и постменопаузе [34], что так же может быть фактором развития ХВН. 22 Мало известно о патогенетической значимости нарушений гормональной регуляции метаболических реакций при этом заболевании, хотя изменения обмена углеводов и особенно липидов могут не только ассоциироваться с генерализованными проявлениями ХВН, но и быть отражением компенсаторноприспособительных процессов неспецифического характера, поскольку активация энергетического метаболизма, энергосубстраты, как глюкоза основу и которого свободные жирные составляют кислоты, такие является обязательным условием формирования патогенетических реакций [83]. 1.2.5. Роль иммунной системы при сочетанной патологии Роль иммунной системы в патогенезе ХВН показана рядом авторов [20,47], поэтому изменения, происходящие в показателях иммунного статуса, могут также являться отражением собственного течения ХВН. Неблагоприятное прогрессирующее течение ХВН в значительной мере определяется нарушениями иммунологической реактивности организма. Это усугубляется изменениями в Ти В - звеньях иммунной системы, неспецифической иммунологической резистентности организма у больных с сопутствующим СД 2 типа [33,37,87]. Участие иммунной системы в развитии хронического воспаления при СД 2 типа подтверждено многими исследователями [181, 190]. 1.3. Подходы к оптимизации лечения микрососудистых осложнений у пациентов СД 2 типа в сочетании с ХВН Микрососудистые осложнения, обусловленные сахарным диабетом 2 типа, существенно ухудшают качество жизни пациентов, а также тех, кто за ними ухаживает. Сахарный диабет является основной причиной нетравматических ампутаций нижних конечностей в развитых странах [159]. Новые данные международных исследований (UK Prospective Diabetes Study, ADVANCE, HOPE) говорят о том, что у пациентов с СД 2 типа строгий контроль уровня глюкозы и артериального давления существенно снижает, но не предотвращает 23 возникновение микро- и макрососудистых осложнений. До недавнего времени активно изучается и результаты последних исследований привели к пересмотру роли гиполипидемической терапии в снижении риска развития и прогрессирования диабетической микроангиопатии [45]. Так в исследовании FIELD (Fenofibrate Intervention and Event Lowering in Diabetes) получены доказательства того, что фенофибрат высоко эффективен в отношении замедления прогрессирования диабетических микрососудистых заболеваний: на 79% снижал частоту прогрессирования ДР [124], наблюдалось значимое снижение количества первых ампутаций 36%, малых ампутаций на 47% [123]. Исследование DAIS (Diabetes Atherosclerosis Intervention Study) показало, что у пациентов с СД 2 типа наряду со снижением ТГ и повышением ЛПВП фенофибрат снижает концентрацию самой опасной из атерогенных фракций – ЛПНП, снижая тем самым на 42% прогрессирование коронарного атеросклероза [114]. Фенофибрат — активатор PPAR-α (α рецепторы, активируемые пролифератором пероксисом), широко известен, как антиатеросклеротический препарат, предназначенный для коррекции дислипидемии: снижает уровень ТГ и повышает ЛПВП [45]. Однако, по последним данным, активно изучается механизм «нелипидного» действия фенофибрата: оказывает противовоспалительное и антиатерогенное воздействие на стенку сосудов [156,168]. Эти находки нашли свое подтверждение в работе Ferrara N. (2001), в которой сообщалось, что агонисты PPAR-α угнетают сосудистый эндотелиальный фактор роста (VEGF), участвующий в ангиогенезе, воспалении и миграции клеток [132]. В рандомизированном слепом перекрестном исследовании у пациентов с гиперлипидемией, получавших либо фенофибрат (200 мг), либо аторвастатин (10мг в день) в течение 10 недель, было продемонстрировано, что фенофибрат также улучшал эндотелийзависимую реактивность [106]. В 2005 г. Ganesaratam К. Balendrian и соавт. опубликовали работу, которая доказала роль фенофибрата в блокировании фермента альдозоредуктазы, что, по мнению авторов, играет важную роль в защите от прогрессирования диабетической ретинопатии и 24 нейропатии [136]. Представляет интерес публикация Maison P. и соавт., которые проанализировав исследование DESIR (Data from an Epidemiological Study on the Insulin Resistance syndrome), установили, что лечение фибратами сопровождалось снижением уровня фибриногена, и это снижение не зависело от изменений липидного спектра [100]. В рандомизированном, плацебо-контролируемом исследовании 12-недельная терапия фенофибратом сосудистой сопровождалась реактивности, снижением улучшением уровня эндотелийзависимой маркеров эндотелиальной дисфункции, а так же провоспалительных маркеров, включающих фактор некроза опухоли- α (ФНО- α), ИЛ-6 и ИЛ-1ß в плазме [129]. Другое исследование так же продемонстрировало, что терапия фенофибратом сопровождалась снижением вязкости крови [176]. Данные результаты должны быть подтверждены более длительными исследованиями. У пациентов с гпертриглицеридемией и различными признаками метаболического синдрома фенофибрат улучшал опосредованную гиперемией вазодилятацию, чувствительность увеличивал к инсулину концентрацию [152]. адипонектина Препарат может и улучшал оказывать свое антиангиогенное воздействие напрямую [169] или путем снижения ишемии посредством данных воздействий [129,152,176]. Фенофибрат так же может играть защитную роль в связи с подавлением окислительного стресса [158]. Сообщалось также, что фенофибрат оказывает нейропротективное действие на грызунов [167,169], что может быть особенно важно, если учесть ключевую роль нейропатии в отношении риска ампутаций. Все исследования и наблюдения говорят в пользу использования фенофибрата, независимо от присутствия дислипидемии, для лечения пациентов с СД 2 типа, у которых существует высокий риск ампутаций (включая пациентов с болезнью периферических сосудов, микрососудистыми осложнениями и с длительным периодом течения диабета). До настоящего времени не было исследований влияния фенофибрата на микроангиопатию у пациентов с СД 2 25 типа в сочетании с ХВН нижних конечностей. Учитывая, что при ХВН основным патогенетическим звеном является нарушение микроциркуляции, то изучение данной группы препаратов у пациентов с сочетанной патологией позволит поновому оценить и расширить показания для их применения. 26 Глава 2. Материалы и методы исследования 2.1. Общая характеристика пациентов С целью изучения влияния СД 2 типа на течение ХВН нижних конечностей проведено открытое проспективное неконтролируемое исследование. Работа выполнена на базе кафедры эндокринологии и внутренних болезней, отделения сосудистой хирургии ГБУЗ НО «Городская клинической больницы № 13» Нижнего Новгорода в период с 2011 по 2014 г. В исследование включено 80 пациентов с ХВН нижних конечностей, из них 40 больных с сопутствующим СД 2 типа, которые составили основную группу, и 40 пациентов без сопутствующего СД 2 типа – контрольная группа. Дизайн исследования представлен на рис. 2.1. Рис. 2.1. Дизайн исследования. 27 Диагноз СД устанавливался в соответствии с диагностическими критериями сахарного диабета, предложенными Комитетом экспертов ВОЗ (1999) [62]. Диагноз ХВН устанавливался в соответствии с международной классификацией хронических заболеваний вен (ХЗВ) нижних конечностей по системе CEAP [103,126]. Данная классификация предполагает учет клинических (Clinical), этиологических (Etiological) и анатомических (Anatomical) признаков, а также характер патофизиологических (Pathophysiological) расстройств, представлена в таблице 2.1. При оценке степени тяжести ХВН так же была использована классификация, предложенная Совещанием Экспертов (Москва, 2000), таблица 2.2. Таблица 2.1 Классификация ХВН по системе CEAP Стадия 0 отсутствие симптомов болезни при осмотре и пальпации Стадия 1 телеангиоэктазии или ретикулярные вены Стадия 2 варикозно-расширенные подкожные вены С Клинические Стадия 3 Отек Стадия 4 кожные изменения на (пигментация, проявления конечности индурация, липодерматосклероз, венозная экзема) Стадия 5 кожные изменения на конечности + зажившая трофическая язва Стадия 6 кожные изменения на конечности открытая трофическая язва. А Нет симптомов S Есть симптомы + 28 Е Этиология А Анатомия Ec Заболевание врожденное Ep Заболевание первичное Es Заболевание вторичное As Поверхностная венозная система Ad Глубокая венозная система Ap Перфорантные вены R Рефлюкс Окклюзия Р Патофизиология O Рефлюкс и окклюзия RO Таблица 2.2 Классификация степени ХВН, Москва (2000) Степень Проявление ХВН 0 Симптомы хронической венозной недостаточности отсутствуют 1 Пациентов беспокоят боли в ногах, чувство тяжести, преходящие отеки, ночные судороги 2 Отеки становятся стойкими. Визуально определяется гиперпигментация, явления липодерматосклероза, сухая или мокнущая экзема 3 Характеризуется наличием открытой или зажившей трофической язвы Критериями исключения были: 1) сахарный диабет 1 типа и другие специфические типы сахарного диабета; 2) тяжелая декомпенсированная соматическая патология; 29 3) наличие диагностированного онкологического заболевания на момент включения в исследования; 4) IV стадия хронической артериальной недостаточности нижних конечностей по Фонтейну–Покровскому [77]. В нашем исследовании мы провели анализ специфических, непосредственно связанных с СД 2 типа, и неспецифических факторов, влияющих на течение ХВН нижних конечностей, рис. 2.2. Рис. 2.2 Факторы, влияющие на течение ХВН нижних конечностей Клиническая характеристика включенных в исследование больных представлена в таблице 2.3. Таблица 2.3 Клиническая характеристика больных Характеристика Основная Контрольная группа группа р 30 Количество включенных 40 40 0,7 61,9 7,8 60,2 15,2 0,6 Женщины 35 (87,5%) 29 (72,5%) 0,09 Мужчины 5 (12,5%) 11 (27,5%) 40 (100%) 0 0 больных Возраст, годы (Mean SD) Пол Сахарный диабет 2 типа Длительность ХЗВ (лет) 19,9 11,5 19,5 13,8 0,5 (Mean SD) СД (лет) 12,7 9,5 0 0 Ι 3 (7,5%) 22 (55%) ΙΙ 24 (60%) 14 (35%) III 13 (32,5%) 4 (10%) ИМТ (кг/м2), (Mean SD) 33,9 5,9 29,5 4,3 0,001 Артериальная гипертония 38 (95%) 28 (70%) 0,003 24 (60%) 10 (25%) 0,001 Диабетическая ретинопатия 17 (42,5%) 0 0 Диабетическая нефропатия 3 (7,5%) 0 0 Полинейропатия н/к 33 (82,5%) 7 (17,5%) <0,0001 Макроангиопатия н/к 22 (55%) 4 (10%) <0,0001 Степень тяжести ХВН <0,0001 (АГ) Ишемическая болезнь сердца (ИБС) Группы статистически значимо не различались по возрасту. Медиана возраста пациентов основной группы составила 61 [57; 64] год и 59 [50; 74] лет в контрольной группе. Среди пациентов преобладали женщины, что соответствует данным Brand F.N. о том, что ХВН примерно в 2 раза чаще встречается у женщин [184]. Давность развития симптомов ХВН, от начала первых проявлений ХЗВ, в основной группе составила 15 [10;30] лет и 15 [7,5;30] лет в контрольной (р=0,5). Основные заболевания, приводящие к развитию ХВН среди обследованных 31 пациентов – это варикозная болезнь нижних конечностей (ВБНК) и посттромбофлебитическая болезнь (ПТФБ). ИЗ 80 пациентов у 4 причиной ХВН стала ПТФБ (2 – основная группа, 2 – контрольная), у 76 выявлены различные формы ВБНК. При этом у пациентов с СД 2 типа в 100% случаев выявлены признаки двухстороннего поражения вен нижних конечностей, а у пациентов без СД в 80% (р=0,002). До включения в исследование 11 (27,5%) больных контрольной группы и 9 (22,5%) основной группы были прооперированы по поводу ХЗВ (р=0,6). Медикаментозное лечение (венопротекторы) получали 13 (32,5%) пациентов основной группы, 15 (37,5%) контрольной (р=0,6), компрессионная терапия использовалась 18 (45%) больными основной группы и 12 (30%) контрольной (р=0,1). На момент обследования оперативное лечение ранее было проведено 7(17,5%) пациентам контрольной группы и 1(2,5%) основной (р=0,02). Такая значимая разница связана с отказом больных с СД 2 типа от предложенного хирургического вмешательства по различным субъективным причинам (сопутствующий сахарный диабет, страх операции, возраст). Длительность заболевания СД 2 типа была от нескольких месяцев до 40 лет, в среднем составила 12,7±9,5 лет. У 13 (32,5%) пациентов основной группы СД 2 типа предшествовал развитию ХЗВ. На момент включения в исследование, учитывая алгоритм индивидуализированного выбора целей терапии по НbА1с, рекомендованный национальными стандартами оказания специализированной помощи больным сахарным диабетом 2013 г., лишь у 15 % (n=6) больных уровень НbА1с был достигнут целевых значений, а у большинства пациентов – в 85% (n=34) уровень НbА1с целевых значений достигнут не был. Наиболее часто выявляемым поздним осложнением СД 2 типа оказалась диабетическая полинейропатия, диагностированная у 82,5 % больных. Среди пациентов контрольной группы выявлена полинейропатия у 7 (17,5%) человек, но другой этиологии. На момент включения в исследование 15 (37,5%) больных основной группы находились на лечении пероральными сахороснижающими 32 препаратами (ПСП), 5 (12,5%) пациентов на инсулинотерапии, комбинацию инсулинов с ПСП получали 20 (50%) человек. Частота сопутствующей патологии различалась в группах. Фиксировалась большая частота АГ у пациентов с СД 2 типа – 95%, в контрольной группе – 70% (р=0,003). Так же выявлена значимая разница частоты сопутствующей ИБС: 60% у исследуемых с СД 2 типа, 25% без СД 2 типа (р=0,001). Из них 3 (7,5%) больных основной группы и 2 (5%) контрольной имели постинфарктный кардиосклероз (ПИКС) (р=0,6) При ультразвуковом ангиосканировании (УЗАС) артерий нижних конечностей у 22 (55%) пациентов основной группы и 4 (10%) контрольной выявлены признаки макроангиопатии (р<0,0001). Курение в анамнезе и ожирение, как основные факторы риска сердечно-сосудистых заболеваний, по частоте так же различались в группах: у пациентов с СД 2 типа преобладало ожирение 30 (75%), в контрольной группе 22 (55%), (р=0,06). Курение в анамнезе чаще выявлено в контрольной группе – у 12 (30%) человек, чем в основной группе 3 (7,5%), (р=0,009). Наследственность по СД 2 типа отягощена у 52,5% (n=21) пациентов, по ХЗВ у 55% (n=22) в основной и 72,5% (n=29) в контрольной группе (р=0,1). Так же с одинаковой частотой у пациентов обеих групп встречались заболевания желудочно-кишечного тракта (хронический гастрит, язвенная болезнь желудка и двенадцати перстной кишки, хронический холецистит, панкреатит), дыхательной системы (хронический бронхит, бронхиальная астма), мочевыделительной системы (хронический пиелонефрит, мочекаменная болезнь). Анализируя клиническую характеристику исследуемых больных, следует подчеркнуть, что основная и контрольная группы были однотипны по возрасту, половому составу, длительности ХЗВ, а так же по проводимому лечению ХВН. 2.2. Методы исследования 2.2.1. Общеклиническое обследование 33 Обследование больных включало: сбор жалоб и анамнеза, физикальное обследование. При сборе анамнеза регистрировались продолжительность ХВН и сахарного диабета, характер проводимой терапии. Оценивались антропометрические показатели: рост, вес, индекс массы тела, окружность талии (ОТ), бедер (ОБ), ОТ/ОБ. Артериальная гипертония (АГ) диагностировалась при величинах САД выше 140 мм рт. ст. и/или ДАД выше 90 мм рт. ст. (Рекомендации ВОЗ и МОАГ, 1999г.). Наличие ИБС определялось по критериям, включенным в Российские национальные рекомендации по диагностике и лечению стабильной стенокардии (второй пересмотр) [60], по диагностике и лечению фибрилляции предсердий [61]. 2.2.2 Клинико-инструментальная оценка хронической венозной недостаточности Исследование нижних конечностей включало: осмотр, пальпация, оценка выраженности субъективных симптомов ХВН с использованием балльной клинической шкалы Venous Clinical Severity Score (VCSS), представлена в таблице 2.4. Для каждого пациента рассчитывался общий счет (Total score) тяжести ХЗВ в баллах (CAD score), равный сумме С+А+D, где С – общий клинический счет (VCSS), А – анатомический счет (сегментарный счет рефлюкса или обструкции), D – счет физической активности (таблица 2.5). Таблица 2.4 Клиническая шкала субъективных симптомов ХВН (VCSS) Признак Боли Балльная оценка признака 0 1 2 нет Эпизодические, Ежедневные, не требующие умеренное ограничения ограничение активности и активности, прием эпизодический анальгетиков прием анальгетиков 3 Ежедневные, выраженное ограничение активности, регулярный прием анальгетиков 34 Варикозные вены Венозный отек Гиперпигментация Индурация Не активная язва Количество активных язв Длительность существования активной язвы Размер самой большой активной язвы Компрессионная терапия Сумма Баллов нет Незначительно выраженные, единичные, отдельно расположенные притоки при состоятельности стволов нет Только вечерние окололодыжечн ые отеки нет Локальная, длительно существующая Множественные притоки, расширение ствола большой подкожной вены на голени или бедре Выраженный варикоз, расширение большой и малой подкожной вены Отеки во второй половине дня выше лодыжки Циркулярное поражение, голеностоп, недавно появившаяся Утренние отеки выше лодыжки нет Локальная (в диаметре менее 5 см) нет 1 нет 1 менее 1/3 голени Широкое распространение (более чем на нижнюю треть голени) Более 1/3 голени 2 2 >2 >2 нет >3 месяцев, < 1 года Не заживают более 1 года нет <2 см 2-6 см >6 см нет Нерегулярная, время от времени Несколько дней Длительная, круглосуточная <3 месяцев 35 Таблица 2.5 Анатомический счет Анатомический счет (сегментарный счет рефлюкса или обструкции) (А) Рефлюкс Окклюзия Малая подкожная вена 0.5 Большая подкожная вена 1.0 Перфорантные вены на бедре 0.5 Перфорантные вены на голени 1.0 Вены голени (множественные) 2.0 Вены голени (только задние большеберцовые) 1.0 Подколенная вена 2.0 Поверхностная бедренная вена 1.0 Глубокая вена бедра 1.0 Общая бедренная вена 1.0 Большая подкожная вена 1.0 Вены голени (множественные) 1.0 Подколенная вена 2.0 Поверхностная бедренная вена 1.0 Глубокая вена бедра 1.0 Общая бедренная вена 2.0 Подвздошная вена 1.0 Нижняя полая вена 1.0 Счет физической активности (D) Физическая активность нет симптомов ХВН 0 симптомы, не ограничивающие повседневную 1 активность, компрессии не требуется для нормальной активности необходима компрессия 2 активность снижена даже с компрессией 3 36 У всех пациентов выявлялся ведущий клинический синдром ХВН: отечный, болевой, варикозный и трофические изменения. Степень выраженности каждого синдрома оценивалась с использованием 10 балльной визуально-аналоговой шкалы (ВАШ) (рис. 2.3). На стороне, обращенной к исследуемому, опрашиваемый пациент отмечает выраженность своего симптома. Минимальное значение симптома или его отсутствие находится в крайнем левом участке шкалы, а максимальное значение симптома – в крайнем правом. Противоположная сторона шкалы, обращенная к исследователю, так же показывает оценку данного симптома в баллах – от 0 до 10. Таким образом, возможны шесть вариантов оценки боли:0 - нет боли; 2 - слабая боль; 4 - умеренная боль; 6 - сильная боль; 8 очень сильная боль; 10 - нестерпимая боль. Если пациент испытывает боль, которую нельзя охарактеризовать предложенными характеристиками, например между умеренной (4 балла) и сильной болью (6 баллов), то боль оценивается нечетным числом, которое находится между этими значениями (5 баллов). Рис. 2.3 Визуально-аналоговая шкала Всем пациентам выполнялось ультразвуковое триплексное ангиосканирование (УЗАС) вен и артерий нижних конечностей на аппарате 37 «Mindray M-7» (КНР) с использованием линейного ультразвукового датчика в диапазоне частот 5-12 МГц по стандартной методике [19,54]. При сканировании венозной системы: подвздошные вены, большая подкожная вена (БПВ), бедренные вены и вены голени в дистальном отделе нижних конечностей визуализировали в положении пациента лежа на спине. Исследование подколенных вен (ПВ), вен верхней трети голени и малой подкожной вены (МПВ) проводилось в положении лежа на животе с несколько согнутыми в коленных суставах нижними конечностями с опирающимися пальцами стоп, находящимися в положении максимального подошвенного разгибания, обеспечивая расслабление задней группы мышц голени и бедра. Так же осмотр проводили в положении больного стоя для уточнения несостоятельности клапанов сосудов. В области паховой связки лоцировали общую бедренную вену (ОБВ), ниже паховой связки визуализировали сафено-феморальное соустье (СФС) общей бедренной и большой подкожной вен. При перемещении датчика вниз лоцировали слияние глубокой бедренной вены (ГБВ) и поверхностной бедренной вены (ПБВ) в общую бедренную вену. При этом положении датчика ГБВ обычно видна только в проксимальном отделе. ПБВ определяли на всем протяжении по переднемедиальной поверхности бедра. ПВ исследовали из области подколенной ямки. Перемещая датчик дистальнее, сканировали проксимальные отделы вен голени. Передние большеберцовые вены (ПББВ) лоцировали на переднелатеральной поверхности голени, между большеберцовой и малоберцовой костями. Задние большеберцовые вены (ЗББВ) визуализировали из переднемедиального доступа по краю большеберцовой кости. Малоберцовые вены (МБВ) лоцировали из того же доступа, что и ЗББВ, при смещении датчика ближе к икроножной мышце. Исследование БПВ проводили от сафенофеморального соустья до уровня медиальной лодыжки по переднемедиальной поверхности бедра и голени. Начиная от уровня ахиллова сухожилия сканировали МПВ по средней линии голени вплоть до подколенной вены. 38 Выявлялись и регистрировались признаки патологического изменения венозной системы: синхронность кровотока с дыханием, локализация варикозной трансформации, состоятельность клапанов поверхностных, глубоких и перфорантных сосудов, посттромбофлебитические изменения, их локализация, особенности реканализации, формирование патологических токов венозной крови, протяженность и длительность рефлюкса крови, его направление и анатомические особенности его распространения. Выделяли 4 степени патологического рефлюкса [19]: I степень – рефлюкс в верхней трети бедра, II степень – до нижней трети бедра, III степень – до верхней трети голени, IV степень – на всем протяжении. При проведении анализа функционирования клапанного аппарата и выявлении всех вено-венозных рефлюксов обследование выполняли в горизонтальном и вертикальном положениях пациента. Использовали пробу Вальсальвы и пробу с проксимальной компрессией. При проведении пробы Вальсальвы больного просили выполнить максимальный вдох с одновременным натуживаем в течение 0,5-1,0 с и удерживанием внутрибрюшного давления в течение 10 с. У здоровых людей происходит ослабление венозного кровотока при вдохе, полное его исчезновение при натуживании и усиление кровотока при последующем выдохе. На недостаточность клапанов обследуемой вены указывает появление ретроградного кровотока при натуживании. Проксимальная компрессия дает информацию, аналогичную пробе Вальсальвы, в случаях затруднительного выполнения пробы Вальсальвы или при исследовании отделов подколенной вены производят сдавливание участка вены проксимальнее клапана в течение 5-6 с. При недостаточности клапанов возникает ретроградный кровоток. Нами разработан протокол ультразвукового исследования венозной системы, представленный в таблице 2.6. 39 Таблица 2.6 Протокол УЗАС вен нижних конечностей Ф.И.О.: Общая, поверхностная, глубокая бедренные вены: проходимы, просветы свободны, клапаны- лоцируются, не лоцируются. Кровоток синхронный с дыханием, компрессионная проба: положительная, отрицательная. Проба Вальсальвы (ретроградный кровоток): отрицательная, положительная. Тромбирована___________________________(окклюзивно, неокклюзивно). Реканализация____________________________________________________ БПВ: остиальный клапан (состоятельный, несостоятельный). Варикозно изменена, не изменена. Рефлюкс по ходу ствола: есть, нет; Степень:___________________ Диаметр ствола________________________ Компрессионная проба: положительная, отрицательная. Несостоятельность перфорантных вен: нет, есть в______________________ Проходимость (полная, неполная), ствол тромбирован в_________________ реканализация_________________________ МПВ: остиальный клапан (состоятельный, несостоятельный), рефлюкс по ходу ствола: есть, нет. Варикозно изменена, не изменена. Диаметр ствола____ Компрессионная проба положительная, отрицательная. Несостоятельность перфорантных вен: нет, есть в:______________________ Подколенная вена: проходима, компрессионная проба: положительная, отрицательная. Проба Вальсальвы: отрицательная, положительная. Проходимость (полная, неполная), ствол тромбирован в_________________ реканализация_________________________ Берцовы вены (ПББВ, ЗББВ): проходимы на участках доступных визуализации, компрессионная проба: положительная, отрицательная. Проходимость (полная, неполная), ствол тромбирован в________________ реканализация_________________________ Суральные и мышечные вены: проходимы, сжимаемы. Проходимость (полная, неполная), ствол тромбирован в_________________ реканализация_________________________ 40 2.2.3. Инструментальная оценка макро- и микроангиопатии нижних конечностей При УЗАС визуализация артерий нижних конечностей, за исключением подколенной артерии (ПА) и проксимальных сегментов задней большеберцовой артерии (ЗББА), проводили в положении пациента лежа на спине. Общая бедренная артерия (ОБА) визуализировалась в проекции внутренней трети паховой складки, кнаружи (латеральнее) от общей бедренной вены (ОБВ). Зона ее бифуркации, устье глубокой бедренной артерии (ГБА), а также поверхностная бедренная артерия (ПБА) визуализировались параллельно линии, соединяющей внутреннюю треть паховой складки и медиальную поверхность коленного сустава. При смещении датчика дистально по линии, соединяющей медиальный надмыщелок бедра и середину подколенной ямки (в положении пациента лежа на животе), визуализировали ПА, проксимальный сегмент ЗББА, а также мышечные артерии. При сканировании по условной линии, соединяющей середину подколенной ямки и середину линии между пяточной костью и медиальной лодыжкой, визуализировали ЗББА. Дистальный отдел ЗББА расположен за медиальной лодыжкой. Передняя большеберцовая артерия (ПББА) - определялась по латеральной поверхности голени, ее проксимальный отдел расположен на уровне подколенной впадины, латеральнее коленного сустава по боковой поверхности голени, дистальный - кпереди от латеральной лодыжки. Анализировали: проходимость, наличие внутрипросветных образований (локализацию, эхогенность, степень нарушения проходимости просвета сосуда), состояние комплекса интима-медиа (КИМ) и внутрипросветный диаметр (ВПД). Оценка характера кровотока: магистральный, магистрально-измененный, коллатеральный, не лоцируется. Структурная характеристика стенки сосуда включала анализ эхогенности, наличие кальциноза, неоднородности и степени дифференцировки на слои (четкая, частичная, полностью утрачена), измерение величины КИМ. Ультразвуковое исследование проводилось в В-режиме. Качественная оценка 41 артериальной стенки производилась в каждом случае в сравнении с общепринятой нормой. В норме стенка артерии представлена трехслойной структурой, состоящей из двух эхопозитивных слоев разной эхогенности (интимы и адвентиции) и одного эхонегативного слоя (медии). За условный эталон при оценке эхогенности интимы принимали эхогенность окружающих сосуд тканей, медии - эхогенность просвета сосуда. В общей бедренной артерии (ОБА) измерение выполняли на 1-2 см проксимальнее бифуркации артерии, в поверхностной бедренной артерии (ПБА) на 2 — 5 см дистальнее устья, ЗББА - на уровне медиальной лодыжки, в ПББА на 12 см проксимальнее латеральной лодыжки или в ее проекции, в ПКА - в средней трети подколенной впадины. В этих же областях оценивали ВПД артерии (как минимальное расстояние между внутренними поверхностями интимы по передней (относительно поверхности датчика) и задней стенке сосуда. Для уменьшения оператор-зависимой ошибки измерения плоскость сканирования ориентировали строго перпендикулярно к продольной оси сосуда (при отсутствии ограничений, связанных с анатомическими особенностями расположения сосуда). Для анализа ремоделирования сосудистой стенки рассчитывали модифицированный индекс Карнегана [19,54], как соотношение толщины КИМ и внутрипросветного диаметра сосуда. При проведении оценки в спектральном доплеровском режиме анализировали следующие показатели: 1. Пиковая систолическая скорость кровотока (Vps - peak systolic velocity) - характеризует амплитуду систолического пика, единицы измерения м/с, см/с. 2. Диастолическая скорость кровотока (Vd — diastolic velocity)' - амплитуда отрицательного пика в фазу ранней диастолы, единицы измерения м/с, см/с. 3. Индекс периферического сопротивления (Pourcelot, RI - resistive index) косвенно характеризует состояние периферического сопротивления в 42 исследуемом сосудистом бассейне. Величина индекса в артериях с высоким периферическим систолической сопротивлением и диастолической равна отношению скоростей суммы кровотока к пиковой пиковой систолической скорости кровотока Для наиболее точного отражения состояния сосудистого русла нижних конечностей нами разработан протокол ультразвукового ангиосканирования магистральных артерий с использованием созданного Лосевым Р.З. протокола у больных СД [56]. Протокол УЗАС магистральных артерий нижних конечностей 1. Общая, внутренняя и наружная подвздошные артерии – тип кровотока, наличие стенозирующих и окклюзирующих поражений. 2. ОБА, ГБА, ПБА – тип кровотока, ВПД, состояние стенок, измерение величины КИМ, Vps, Vd, RI. Локализация стенозирующих и окклюзирующих поражений (для ОБА - проксимальная и дистальная части; для ГБА - в устье и на протяжении; для ПБА верхняя треть, средняя треть, нижняя треть бедра), структура и плотность, протяженность, степень стенозирования по диаметру и площади. 3. ПА - тип кровотока, ВПД, состояние стенок, включая КИМ, Vps. Наличие стено-окклюзирующих поражений, структура и плотность, протяженность, степень стенозирования по диаметру и площади. 4. ПББА и ЗББА - тип кровотока, ВПД, состояние стенок. Наличие и локализация стено-окклюзирующих поражений (верхняя треть, средняя треть, нижняя треть голени), протяженность. 5. Артерия тыла стопы (ТАС) - тип кровотока, ВПД, наличие стенозирования. Для исследования нарушений гемодинамики нижних конечностей так же проводилось изучение состояния микроциркуляции в коже методом доплеровской лазерной флоуметрии. С помощью простой рандомизации были сформированы 2 группы: 15 пациентов основной и 15 пациентов контрольной группы, которым исследовали микроциркуляцию. Перфузия кожи изучалась на внутренней 43 поверхности доплеровской нижней трети флоуметрии голени (ЛДФ) с с использованием помощью метода анализатора лазерной ЛАКК 01 НПП«ЛАЗМА» Россия (рис. 2.4). А Б Рис. 2.4. А - Исследование микроциркуляции нижних конечностей, Б – анализатор ЛАКК 01 НПП «ЛАЗМА» Вычисление статических характеристик величины перфузии и расчет всех показателей проведено с помощью специального пакета программ (Версия 3.0.2.384, НПП «ЛАЗМА», Россия). Исследование проводили в покое в горизонтальном положении при одинаковой температуре в помещении около 2124°С. В течение 15 минут до начала диагностики пациент находился в спокойном состоянии, тестируемая область не была прикрыта. Определяли состояние базального кровотока, рассчитывали средние изменения показателей перфузии кожи: М — величина среднего потока крови в интервалах времени регистрации в перфузионных единицах (пф.ед.), σ — среднее колебание перфузии относительно среднего значения потока крови М (пф.ед.), характеризует временную изменчивость перфузии, отражает среднюю модуляцию кровотока во всех частотных диапазонах, Kv — коэффициент вариации, соотношение между σ и М, отражает динамику состояния микроциркуляции [91]. Вторым этапом проводилась активная функциональная дыхательная проба, которая очень проста 44 в применении. Сначала регистрируется фоновая величина перфузии кровотока, а затем реакция перфузии в ходе 15-секундной задержки дыхания на высоте глубокого вдоха. Затем рассчитывался индекс дыхательной пробы (ИДП), отражающий процент снижения кровотока (вазоконстрикции) в ответ на глубокий вдох. Стандартизация глубины вдоха с помощью спирометрии не повышает эффективность диагностики, в связи с чем факт глубокого вдоха достаточен для трактовки результата [51,180]. Для оценки состояния определенных механизмов контроля перфузии, дополнительно анализировали амплитудно-частотный спектр (АЧС) колебаний кровотока с помощью вейвлет-анализа. Так же рассчитывали показатель шунтирования (ПШ): ПШ=ПШ1+ПШ2, где ПШ1 – показатель шунтирования, связанный с различиями тонуса и/или скоростей перфузии в микрососудах нутритивных и ненутритивных путей кровотока непосредственно в пределах МЦР, а ПШ2 – показатель шунтирования, связанный с различиями перфузии микрососудов и более крупных сосудистых сегментов (артерий, венул, вен). ПШ1 = Ан. / Ам., где Ан. и Ам. – максимальные усредненные амплитуды осцилляций нейрогенного и миогенного диапазонов частот, соответственно. ПШ2 = Ас.(д.) / Ам., где Ас.(д.) – доминирующая амплитуда осцилляций среди колебаний сердечного и дыхательного ритмов. Если ПШ2 < 1, то его не учитывают в формуле ПШ и в этих случаях ПШ=ПШ1. С целью диагностики состояния перфузии по шунтовым и нутритивным путям рассчитывали величину нутритивной перфузии (М нутр.) по формуле М нутр. = М / (1+ПШ). Соответственно, величина шунтовой перфузии (М шунт.) оценивалась по формуле М шунт. = М – М нутр. (пф.ед.). В группе пациентов, наблюдаемых через 3 месяца после лечения, дополнительно проводили анализ нелинейной динамики. Выполняли фрактальный анализ, который позволяет охарактеризовать «изломанность», нерегулярность процесса двумя способами: 1) методом Хаусдорфа (D0) с применением алгоритма Минковского [48], 2) методом нормированного размаха (R/S анализ), по показателю Херста [85]. Анализировали фазовый портрет и корреляционную размерность (D2). 45 Все больные основной группы были консультированы офтальмологом для выявления и оценки степени тяжести диабетической ретинопатии (ДР). Ретинопатия оценивалась по классификации, рекомендованной национальными стандартами оказания помощи больным сахарным диабетом, (2002). [1]. 2.2.4. Выявление симптомов нарушения иннервации нижних конечностей Клиническое исследование выраженности симптомов нарушения иннервации нижних конечностей состояло из оценки жалоб, субъективных симптомов и неврологического обследования. У всех пациентов основной и контрольной группы выясняли наличие болевых и других чувствительных расстройств: ощущения жжения, жгучей или острой боли в стопах; трудно локализованных ноющих болей; покалывания; онемения; зуда; ощущения “ползания мурашек”, гиперестезии от прикосновения; судороги, усиливающиеся ночью. Для количественной оценки степени выраженности жалоб и субъективных симптомов нарушения нейропатический счет иннервации субъективных нижних конечностей симптомов (НСС), использовался для оценки интенсивности патологических ощущений полинейропатии была использована шкала Общего Симптоматического Счета (ОСС), предложенные D. Ziegler et al. в 1995г., таблица 2.7. Для подсчета НСС заполняли опросник, в котором анализировались наличие и выраженность следующих симптомов нейропатии: покалывание, жжение, онемение, судороги, ноющая боль, гиперестезия. Каждому симптому присваивался балл: 0 баллов при его отсутствии, 1 балл при наличии симптома и 2 балла при усилении симптомов ночью. Общая сумма баллов составляла значение шкалы НСС. 46 Таблица 2.7 Шкала общего симптоматического счета (ОСС) Симптомы Выраженность За Отсут- прошедшие ствуют слабо Умерен Частота Сильно редко часто постоян- но но 24 часа Вы испытывали Жжение 0 1 2 3 0 0,33 0,66 Боли 0 1 2 3 0 0,33 0,66 Покалывание 0 1 2 3 0 0,33 0,66 Онемение 0 1 2 3 0 0,33 0,66 Итого: *Ощущение считаются частыми, если они возникают до 5 раз в день и чаще Для определения степени тяжести нарушений иннервации нижних конечностей проводили количественную оценку имеющихся расстройств по шкале Нейропатический дисфункциональный счет (НДС), разработанной M.J. Young в 1986, по стандартной методике с использованием монофиламента весом 10 г., термического наконечника (Thip-term), градуированного камертона с частотой вибрации 128 Гц, неврологического молоточка.. Предварительно болевой, для температурной количественной и вибрационной оценки нарушения чувствительности тактильной, каждый вид оценивали в баллах в зависимости от выявленного уровня нарушения. Для каждого вида нарушения чувствительности высчитывали среднюю величину баллов по двум ногам: (правая нога + левая нога)/2. Количественную оценку ахилловых и коленных рефлексов производили следующим образом: рефлекторный ответ без патологии – 0 баллов; снижен (неадекватный рефлекс) – 1 балл; отсутствует – 2 балла. Сумма средних значений каждого вида чувствительности и сумма значений каждого из четырех рефлексов составили 47 шкалу НДС. НДС от 0 до 4 баллов свидетельствовала об отсутствии либо наличии у пациента начальных признаков периферической сенсорно-моторной нейропатии; НДС от 5 до 13 баллов соответствовала умеренно выраженной нейропатии; НДС > 14 баллов - выраженной периферической нейропатии. Для исследования функционального состояния мышц и периферических нервов всем пациентам основной и контрольной группы была выполнена электронейромиография нижних конечностей (ЭНМГ) с помощью 4-канального компьютерного электронейромиографа «Нейрон-Спектр-4/ВПМ и программного обеспечения на платформе.NET. Электронейромиографическое исследование осуществлялось при помощи стимулирующего поверхностного пластинчатого электрода (катод располагался дистальнее, анод проксимальнее), а отведение стандартным набором монополярных, пластинчатых электродов диаметром 5 мм. Для двигательных нервов: большеберцовый нерв (n. Тibialis), малоберцовый нерв (n.Peroneus), определялись скорость распространения возбуждения (СРВ), амплитуда М-ответа и резидуальная латентность (РЛ). Для чувствительных волокон (n. Suralis) - СРВ, амплитуда сенсорного ответа. 2.2.5. Исследование лабораторных показателей Параметры углеводного обмена оценивались по исследованию гликемии капиллярной крови с помощью глюкометра Accu-Chek Performa, а так же уровню гликированного гемоглобина (HbA1c) на аппарате «Olympus AU 400» с помощью реактива «Olympus AU 400» (Япония) с автоматическим определением уровня гемоглобина крови и вычислением процентного соотношения НbА1с от общего. Исследовался суточный гликемический профиль в стандартных 8 точках, включающий тощаковую, перед приемом пищи, постпрандиальную и ночную гликемию капиллярной крови. За тощаковую гликемию принимался уровень сахара крови утром натощак; перед обедом, перед ужином и в 20-21 час; постпрандиальная гликемия включала уровень глюкозы крови через 2 часа после завтрака, через 2 часа после обеда, через 2 часа после ужина. Ночная гликемия 48 исследовалась в 2 часа ночи. Затем рассчитывался уровень среднесуточной гликемии, как среднеарифметическое за сутки. Всем пациентам контрольной группы проводился тест толерантности к глюкозе для исключения нарушения углеводного обмена. В общем анализе крови исследовался уровень гемоглобина, тромбоцитов, скорости оседания эритроцитов (СОЭ) (анализатор «Cell Dyn 3700» «Abbot», США) Состояние липидного обмена исследовалось путем определения уровней общего холестерина (ОХС), липопротеидов высокой (ЛПВП) и низкой плотности (ЛПНП), триглицеридов (ТГ); свертывающей системы крови – коагулограмма: протромбиновое время (ПТВ), протромбиновый индекс (ПТИ), международное нормализованное тромбопластиновое отношение время (МНО), (АЧТВ), фибриноген, тромбиновое активное время (ТВ). частичное Для этих биохимических исследований использовались диагностические наборы для анализатора «ACL 7000» Instrument Laboratori (США). Перечисленные методы исследования подытожены в таблице 2.8. Таблица 2.8 Методы исследования Оценка ХВН Оценка СД 2 типа Анамнез Анамнез Осмотр нижних конечностей Гликемический профиль в 8 точках VCSS НbА1с ВАШ Неврологический статус CAD score Антропометрические показатели Коагулограмма Липидный спектр УЗАС ЭНМГ ЛДФ Лечение СД 2 Лечение ХВН 49 2.2.6. Исследование влияния фенофибрата на микроциркуляцию нижних конечностей у больных с сочетанной патологией В последнее время много внимания уделяется изучению механизма «нелипидного» действия фенофибрата при ДР, в том числе улучшению микроциркуляции. Так как микроангиопатия вместе с полинейропатией нижних конечностей нарушают кровоток в микроциркуляторном русле у больных с СД 2 типа, фенофибрат может быть полезен в данной группе пациентов. 15 пациентов основной группы в течение 3 месяцев получали препарат Трайкор в дозе 145 мг один раз в день перорально независимо от приема пищи. В течение периода наблюдения осуществлялось 2 контрольных визита: начало исследования и визит «3 месяц». Кроме этого, пациенты имели возможность постоянного контакта с врачом-исследователем. При включении в исследование у всех пациентов собраны жалобы, анамнез, проведены УЗТС вен и артерий нижних конечностей, ЭНМГ, ЛДФ, НСС, ОСС, НДС, VCSS, оценен уровень HbA1c, липидный спектр. На визите «3 месяц» проводился сбор жалоб, обследование включало проведение ЭНМГ, ЛДФ, НДС, НСС, ОСС, VCSS, контроль липидного спектра. 2.2.7. Статистическая обработка данных Статистическая обработка материала выполнена с использованием пакета прикладных программ Statistica 7.0 (“StatSoft Inc.”, USA). Данные представлены в виде Mean SD, где Mean – среднее значение показателя, SD – стандартное отклонение, а также медианы и интерквартильных интервалов (ИКИ) при описании данных, распределение которых отличалось от Гауссового. Для расчета коэффициентов корреляции использовался метод ранговой корреляции Спирмена. Для сравнения средних в двух независимых группах данных использовался непараметрический критерий Манна-Уитни, параметрический t-тест Стьюдента. При проведении множественных сравнений для оценки значимости различий средних величин, использовался ранговый 50 анализ вариаций Краскела – Уоллиса. Для оценки значимости различия долей применяли критерий χ2-Пирсона [65]. Сравнение количественных признаков в зависимых выборках проводилось при помощи теста Уилкоксона. Различия считались достоверными при уровне значимости р<0,05. Графическое изображение данных выполнено с помощью программ Statistica 7.0 (“StatSoft Inc.”, USA) и Microsoft Office Excel, 2010. 51 Глава 3. Клинико-лабораторные показатели у больных с сахарным диабетом 2 типа и хронической венозной недостаточностью нижних конечностей 3.1 Особенности клинической картины Особое внимание уделялось выявлению и формированию ведущего клинического синдрома, побуждающего к обращению за медицинской помощью. Большинство обследованных больных с ХВН в сочетании с СД 2 типа в качестве ведущего клинического синдрома отмечали отечный синдром и трофические изменения, в отличаи от пациентов контрольный группы, которых чаще беспокоила боль в нижних конечностях и варикозные изменения (см. таблицу 3.1). Таблица 3.1 Частота ведущего клинического синдрома ХВН в исследуемых группах Клинический Основная группа Контрольная группа р синдром ХВН N=40 N=40 Отечный 13 (32,5%) 5 (12,5%) 0,03 Болевой 2 (5%) 18 (45%) <0,0001 Варикозный 7 (17,5%) 14 (35%) 0,07 Трофические 18 (45%) 3 (7,5%) 0,0001 изменения При оценке выраженности клинического синдрома с использованием ВАШ выявлена достоверная разница по всем клиническим синдромам (см. таблицу 3.2). Таблица 3.2 Выраженность клинического синдрома ХВН по ВАШ Клинический синдром ХВН Основная группа Контрольная группа р 52 Отечный 5,3 2,1 3,4 2,4 0,001 Болевой 4,2 2,5 6,0 2,6 0,0004 Варикозный 3,8 2,4 5,7 2,2 0,001 Трофические 6,3 3,7 2,2 3,5 <0,0001 изменения У пациентов с СД 2 типа выявлены положительные корреляции между длительностью СД и: ведущим трофическим синдромом (r=0,6; p<0,0001), трофическими изменениями, обусловленными ХВН по балльной ВАШ (r=0,6; p<0,0001). Так же отмечается преобладание ведущего трофического синдрома у пациентов основной группы, у которых диагноз СД предшествовал появлению ХВН (n=13) – 76,9% (n=10), против группы пациентов (n=27) с установленным диагнозом ХВН раньше СД – 29,6% (n=8), (р=0,004). При оценке выраженности субъективных симптомов ХВН с использованием балльной клинической шкалы VCSS выявлена достоверная разница в группах: в основной 9,2 3,2 баллов, в контрольной 6,2 2,7 (р<0,0001). Данные представлены в таблице 3.3. Таблица 3.3 Показатели шкалы VCSS в исследуемых группах Признак Основная группа Контрольная группа р Боль 1,1 0,7 1,5 0,6 0,005 Варикозные вены 2,5 0,5 2,2 0,5 0,01 Венозный отек 1,7 0,8 1,0 0,8 0,0003 Гиперпигментация 1,5 0,9 0,5 0,8 <0,0001 Индурация 1,2 0,9 0,2 0,6 <0,0001 Неактивная язва 0,3 0,4 0,02 0,1 0,0007 53 Активная язва 0,2 0,6 0,4 1,2 0,3 Компрессионная 0,8 0,9 0,4 0,7 0,01 терапия У пациентов основной группы выявлена положительная корреляция между длительностью СД и VCSS (r=0,46; р=0,002). У пациентов с СД 2 типа в большинстве случаев выявлена более тяжелая степень ХВН: ХВН 2 степени (отек, гиперпигментация, липодерматосклероз, рис. 3.1) - 60%, сходные изменения в контрольной группе выявлены в 35% (р=0,02), ХВН 3 степени (наличие открытой или зашившей трофической язвы, рис. 3.2) в основной группе 32,5%, в контрольной 10% (р=0,01). В отличие от пациентов контрольной группы, у которых на фоне ХЗВ чаще выявлена ХВН 1 степени – 55%, в основной группе ХВН 1 степени определялась лишь в 7,5% (р<0,0001). Рис. 3.1. Больная П. 57 лет. Липодерматосклероз и гиперпигментация нижней трети голени 54 Рис. 3.2. Больная С. 73 года. Неактивная язва нижней трети голени По классификации СЕАР в основной группе чаще выявлены трофические изменения (классы С4, С5), структура пациентов по классам представлена в таблице 3.4. Таблица 3.4 Структура пациентов по классам СЕАР Класс по Основная группа Контрольная группа С1 0 0 С2 3 (7,5%) 22 (55%) С3 7 (17,5%) 5 (12,5%) С4 17 (42,5%) 9 (22,5%) С5 10 (25%) 0 (0%) С6 3 (7,5%) 4 (10%) р СЕАР <0,0001 55 У пациентов с СД 2 типа выявлена положительная корреляция между длительностью СД и тяжестью клинического класса по классификации СЕАР (r=0,67; p<0,0001), а так же степенью ХВН (r=0,5; p=0,0006). Некоторые субъективные симптомы ХЗВ в сравниваемых группах статистически значимо различались (рис.3.3): жжение выявлено у 20% (n=8) пациентов в контрольной группе, 75% (n=30) в основной (р<0,0001); боль 87,5% (n=35) в контрольной, 60% (n=24) в основной (р=0,005), что показывает существенное влияние ДПН на клинические проявления ХВН. В то же время судороги – симптом характерный как для ХВН, так и для ДПН, статистически значимо не отличался в обеих группах (р=0,1). Стойкие отеки (2 или 3 балла по VCSS) преобладали у пациентов с СД 50% (n=20), в контрольной группе 20% (n=8), (р=0,006). Рис. 3.3. Частота выявления симптомов хронической венозной недостаточности в исследуемых группах Для анализа влияния длительности ХВН на ее тяжесть все пациенты были разделены на 2 группы: 1 – с длительностью ХВН ≥10 лет, 2 – с длительностью ХВН < 10 лет, таблица 3.5. 56 Таблица 3.5 Течение ХВН в зависимости от ее длительности Характеристики Группа 1 (N=64) Группа 2 (N=16) р 3,7±1,3 2,8±1,2 0,01 степень ХВН 2,0±0,7 1,5±0,7 0,01 трофические 4,8±4,1 2,3±3,7 0,01 8,2±3,3 5,9±2,7 0,01 класс ХВН по СЕАР изменениями по балльной ВАШ VCSS Таким образом, при длительности ХВН 10 лет и более нарастают класс и степень ее тяжести, чаще встречаются трофические изменения нижних конечностей, больше баллов по субъективной шкале VCSS. Для дальнейшего анализа пациенты основной группы были разделены на 2 подгруппы: 1- с длительностью СД ≥10 лет, 2 – с длительностью СД меньше 10 лет, таблица 3.6. Таблица 3.6 Течение ХВН в зависимости от длительности СД Характеристики Группа 1 (N=25) Группа 2 (N=15) р 4,6±0,7 3,2±0,9 <0,0001 степень ХВН 2,5±0,5 1,9±0,5 0,006 ведущий отечный 4 (16%) 9 (60%) 0,004 2 (8%) 5 (33,3%) 0,04 класс ХВН по СЕАР синдром ведущий варикозный синдром 57 ведущий болевой 1 (4%) 1 (6,7%) 0,7 18 (72%) 0 <0,0001 5,5±2,6 5,5±0,8 0,6 4,2±2,6 4,8±1,9 0,7 4,1±2,6 4,7±2,3 0,7 8,7±2,4 4,1±3,5 0,002 10,0±3,0 7,8±3,3 0,01 синдром ведущий трофический синдром отечный синдром по балльной ВАШ варикозные изменениями по балльной ВАШ болевой синдром по балльной ВАШ трофические изменениями по балльной ВАШ VCSS Как видно из таблицы, длительность СД отягощает течение ХВН. Медиана ИМТ больных основной группы 32 [29,5;39] и контрольной 30 [26;32] указывает на наличие ожирения и избытка массы тела в группах. При сопоставлении ИМТ в обеих группах выявлено, что ожирением страдали 30 (75%) человек основной группы и 22 (55%) контрольной группы (р=0,06), избыток массы тела выявлен у 10 (25%) и 14 (35%) пациентов соответственно (р=0,3). И лишь 4 (10%) больных в контрольной группе имели нормальный вес (см. рис. 3.4). 58 Рис. 3.4. Структура пациентов исследуемых групп по значению ИМТ Согласно рекомендациям Европейского общества кардиологов (2003 г.), простым методом выявления абдоминального типа накопления жира является определение величины окружности талии. Количество висцеральной жировой ткани, определяемое с помощью антропометрических показателей: окружности талии (ОТ), ее отношения к окружности бедер (ОТ/ОБ), является клиническим маркером инсулинорезистентности. Проведенный анализ ИМТ и характеристик распределения жировой ткани у всех пациентов выявил следующие закономерности, таблица 3.7. Таблица 3.7 Значения ИМТ и характеристик распределения жировой ткани в группах представлены в виде медианы и квартилей (25; 75) Показатель Основная группа Контрольная группа р ИМТ, кг/м2 32 [29,5;39] 30 [26;32] 0,001 ОТ, см 112 [105; 120] 96 [91;109] <0,0001 ОТ/ОБ 0,95 [0,9; 0,99] 0,85 [0,84;0,9] <0,0001 59 Выявлено достоверное превышение окружности талии, отношения окружности талии к окружности бедер в группе больных, имеющих ХВН и СД 2 типа. Абдоминальное ожирение (ОТ/ОБ более 0,9 для мужчин, более 0,85 для женщин) наблюдалось у 87,5% больных основной группы и в 42,5% случаев контрольной (p<0,0001). Для дальнейшего анализа пациенты были разделены на 2 подгруппы: 1больные с ИМТ ≥30 кг/м2, 2 – больные c ИМТ <30 кг/м2, таблица 3.8. Таблица 3.8 Характеристика ХВН у пациентов с ИМТ ≥30 кг/м2 (1 группа) и с ИМТ <30 кг/м2 (2 группа) Характеристики класс ХВН по 1 группа 2 группа Р N= 52 N= 28 3,8±1,2 2,9±1,1 0,005 2,1±0,6 1,6±0,7 0,006 5,0±4,0 2,9±4,1 0,01 8,2±3,4 6,7±3,1 0,04 СЕАР степень тяжести ХВН трофические изменениями по балльной ВАШ VCSS Как видно из таблицы, у пациентов с ожирением преобладают более тяжелые степень и класс ХВН, чаще трофические изменения. При этом, в группе больных с ИМТ ≥30 кг/м2 пациентов с СД 2 типа было 57,7% (n=30), а во 2 группе 35,7% (n=10), (р=0,06). На фоне ожирения закономерно чаще наблюдалась АГ. В основной группе была диагностирована у 95%, в контрольной у 70%, преимущественно 2 степени 60 (р=0,003). Распространенность АГ различной степени в группах представлена на рисунке 3.5. Рис. 3.5. Распределение АГ в группах Группы больных достоверно различались по САД: медиана САД больных с СД 2 типа составила 140 [132; 150] мм рт.ст., в контрольной группе – 130 [110;140] мм рт.ст. (p=0,001). У обследуемых пациентов выявлены корреляционные связи в зависимости от степени АГ, таблица 3.9. Таблица 3.9 Течение ХВН в зависимости от степени АГ Характеристики класс ХВН по СЕАР степень тяжести ХВН трофические изменениями по балльной ВАШ VCSS Степень артериальной гипертонии r р 0,49 <0,0001 0,46 <0,0001 0,47 <0,0001 0,33 0,002 При оценке субъективных симптомов и степени тяжести ДПН отмечены достоверные различия по шкалам НДС, НСС и ОСС, что свидетельствует о наличии ДПН у пациентов с СД 2 типа (см. таблицу 3.10). 61 Таблица 3.10 Показатели шкал НДС, ОСС и НСС в группах Контрольная Шкала Основная группа НДС (балл) 9,7 4,5 2,9 2,1 <0,0001 НСС (балл) 6,0 2,6 2,7 1,5 <0,0001 ОСС (балл) 3,2 2,7 1,3 1,4 0,0004 группа Р Для дальнейшего анализа пациенты с СД 2 типа были разделены на 2 группы: 1 – пациенты с ДПН (n=33), 2 – без ДПН (n=7) (таблица 3.11). Таблица 3.11 Течение ХВН у пациентов с СД с ДПН (группа 1) и без ДПН (группа 2) Характеристики ХВН 1 группа (N=33) 2 группа (N=7) р Класс ХВН по СЕАР 4,4±0,86 2,7±0,5 <0,001 Тяжесть ХВН 2,4±0,55 1,7±0,5 0,01 54,5% 0% 0,008 7,8±3,1 3,1±3,4 0,003 9,8±3,2 6,3±1,6 0,006 Ведущий трофический синдром Трофический синдром по ВАШ VCSS Как видно из таблицы, у пациентов с СД 2 типа и с ДПН более тяжелое течение ХВН, выражены трофические изменения. В контрольной группе разницы в клинической картине ХВН у пациентов с полинейропатией и без нее выявлено не было, что указывает на специфичность поражения нервной системы в комплексе с метаболическими изменениями у пациентов с СД 2 типа, которая негативно сказывается на течение ХВН. 62 При проведении корреляционного анализа у пациентов с СД 2 типа выявлена тесная связь между шкалами оценки ДПН и клиническими характеристиками тяжести и течения ХВН (таблица 3.12). Таблица 3.12 Корреляционные связи НДС, НСС, ОСС с клиническими характеристиками ХВН у пациентов с СД Признаки ХВН НДС НСС ОСС r p r р r р 0,65 <0,0001 0,39 0,01 0,43 0,005 Тяжесть ХВН 0,49 0,001 0,33 0,03 0,36 0,02 Отечный 0,16 0,3 -0,08 0,6 -0,02 0,8 -0,07 0,6 0,2 0,08 0,2 0,1 -0,02 0,8 0,1 0,4 0,33 0,03 0,63 <0,0001 0,14 0,3 0,4 0,009 0,59 <0,0001 0,23 0,006 0,43 0,15 Класс ХВН по СЕАР синдром по ВАШ Варикозный синдром по ВАШ Болевой синдром по ВАШ Трофический синдром по ВАШ VCSS В результате данного анализа были получены положительные корреляционные связи между НДС, НСС, ОСС и тяжестью ХВН, трофическими нарушениями, а так же VCSS, что подтверждает влияние ДПН на тяжесть и течение ХВН у пациентов с сопутствующим СД 2 типа. 3.2 Особенности лабораторных показателей При исследовании липидного профиля больных с ХВН в сочетании с СД 2 типа в сравнении с больными ХВН без СД 2 типа выявлена достоверно значимая 63 атерогенная дислипидемия с увеличением уровня ОХС, ЛПНП и ТГ, см. таблицу 3.13. Таблица 3.13 Показатели липидного обмена в группах представлены в виде медианы и квартилей Показатель Основная группа Контрольная группа р ОХС, ммоль/л 6,7 [5,3;7,6] 5,4 [4,8;6,5] 0,006 ЛПВП, ммоль/л 1,2 [1,1;1,6] 1,4 [1,1;1,6] 0,5 ТГ, ммоль/л 2,0 [1,5;2,9] 1,4 [0,9;1,8] 0,0005 ЛПНП, ммоль/л 3,7 [2,9;4,2] 3,1 [2,5;3,8] 0,02 У пациентов контрольной группы отмечалась гиперхолестеринемия, но в меньшей степени, чем в основной группе; по содержанию ЛПВП они соответствовали друг другу. При корреляционном анализе у всех пациентов выявлены достоверные связи между ОХС и: трофическими изменениями по балльной ВАШ (r=0,24;р=0,03), шкалой НДС (r=0,32;р=0,003), а так же между ТГ и: тяжестью ХВН (r=0,25;р=0,02), субъективной шкалой VCSS (r=0,26;р=0,01), шкалами НДС (r=0,26;р=0,02) и НСС (r=0,31;р=0,007). При анализе параметров свертывающей системы крови выявлена склонность к гиперкоагуляции у пациентов с СД 2 типа (см. таблицу 3.14). Таблица 3.14 Показатели коагулограммы в группах представлены в виде медианы и квартилей Показатель ТВ, сек. Основная группа 14,7 [14,4;16,4] Контрольная Норма группа 15,2 [14,3;16,5] 11-17,8 р 0,5 64 ПТИ, % 120 [110;133] 113 [99; 124] 70-130 0,02 Фибриноген, г/л 4,9 [4,2;5,8] 4,3 [3,7;5,1] 3,1-6,1 0,03 МНО, ед. 0,8 [0,8;0,9] 0,93 [0,9;1,0] 0,85-1,0 <0,0001 АЧТВ, сек. 23,9 [23;25] 26,5 [25;28] 24,3-35,0 <0,0001 ПТВ, сек. 8,7 [8,1;9,2] 9,2 [8,9;10,0] 9,1-12,1 0,0002 Были получены достоверные корреляции между показателями коагулограммы и клиническими характеристиками ХВН в группах, таблица 3.15. Таблица 3.15 Корреляционные связи между показателями коагулограммы и клиническими характеристиками ХВН у обследуемых пациентов Показатель класс ХВН по ПТИ МНО АЧТВ r р 0,3 0,006 -0,32 0,003 -0,25 0,03 -0,33 0,003 0,41 0,006 -0,35 0,004 -0,21 0,06 -0,32 0,003 0,27 0,01 -0,35 0,001 -0,29 0,009 -0,29 0,008 0,23 0,03 -0,24 0,03 -0,25 0,02 0,007 r р ПТВ r p r р СЕАР степень тяжести ХВН трофические изменениями по бальной ВАШ VCSS -0,31 Таким образом, у пациентов с ХВН изменения реологических свойств крови в сторону гиперкоагуляции способствуют более тяжелому течению ХВН, и особенно появлению трофических изменений нижних конечностей. В основной группе в результате корреляционного анализа выявлены положительные корреляции между среднесуточной гликемией и: классом ХВН (r=0,5;р=0,002), тяжестью ХВН (r=0,4;р=0,01), VCSS (r=0,34;р=0,03). Между 65 HbA1C и: классом ХВН (r=0,5;р=0,0008), тяжестью ХВН (r=0,34;р=0,03), ведущим трофическим синдромом (r=0,33;р=0,03). Значительное влияние на течение ХВН имел уровень компенсации СД 2 типа, таблица 3.16. Таблица 3.16 Зависимость проявлений ХВН от уровня гликированного гемоглобина (HbA1с) у пациентов с СД 2 типа Показатель р HbA1с ≤ 7% 7,1-10% >10% n=7 n=24 n=9 Класс ХВН по СЕАР 3,2±0,9 4,0±0,9 4,8±0,7 0,005 Тяжесть ХВН 2,0±0,5 2,1±0,5 2,6±0,5 0,03 0% 12 (50%) 6 (66,7%) 0,02 5 (71,4%) 7 (29,2%) 1 (11,1%) 0,03 2 (28,6%) 3 (12,5%) 2 (22,2%) 0,5 0% 2 (8,3%) 0% 0,5 Ведущий трофический синдром Ведущий отечный синдром Ведущий варикозный синдром Ведущий болевой синдром В графе достоверность приведены уровни статистической значимости для критерия КраскелаУоллиса. Нарастание класса и тяжести ХВН, преобладание трофического синдрома чаще определялись при уровне HbA1с >10%. 3.3. Резюме Частота субъективных клинических проявлений ХВН, а также их выраженность по ВАШ у больных СД 2 типа, ассоциировалась с преобладанием 66 отечного и трофического синдромов. В контрольной группе ведущими клиническими синдромами ХВН были варикозный и болевой. Тяжесть субъективных симптомов по клинической балльной шкале VCSS была более выражена в группе с сопутствующим сахарным диабетом по всем признакам, за исключением болевого синдрома, который преобладал в контрольной группе. В группе больных СД 2 типа преобладала более тяжелая степень ХВН (2 и 3 степень). Более половины пациентов контрольной группы имели 1 степень. По классификации СЕАР в основной группе чаще выявлены трофические изменения кожи (классы С4, С5). В контрольной группе более часто встречались варикозно-расширенные подкожные вены. Трофические нарушения в группе больных СД 2 типа зависели от длительности сахарного диабета. Длительность СД 2 типа положительно коррелировала с выраженностью трофических нарушений, суммой баллов по шкале VCSS, тяжестью клинического класса по классификации СЕАР и степенью ХВН. Сахарный диабет 2 типа отягощает течение ХВН, что также подтверждалось при сравнении подгрупп с длительностью сахарного диабета менее 10 и более 10 лет. Анализируя влияние избыточной массы тела и ожирения на течение ХВН, было установлено, что у лиц с ИМТ>30 кг/м2 наблюдалось более тяжелое течение ХВН по таким признакам, как класс ХВН по классификации СЕАР, степень тяжести ХВН, субъективные симптомы ХВН (шкала VCSS) и трофические нарушения. При нарастании степени АГ у пациентов с ХЗВ наблюдаются более тяжелые степень и класс тяжести ХВН, чаще трофические изменения нижних конечностей и больше баллов по субъективной шкале VCSS. Наличие ДПН у больных основной группы в целом отягощало течение ХВН, и в большей степени оказывало влияние на трофические нарушения, что подтверждалось сравнением средних величин в баллах и корреляционным анализом между различными показателями тяжести ХВН и нейропатическими 67 шкалами. В контрольной группе нарушения иннервации нижних конечностей различной этиологии не влияло на клинические проявления ХВН. Возможно, это связано с дополнительным влиянием метаболических изменений при СД 2 типа. Пациенты с ХВН и СД 2 типа, в сравнении с контрольной группой, характеризовались наличием атерогенной дислипидемией и склонностью к гиперкоагуляции. В целом не было выявлено отклонений показателей коагулограммы от нормы у обследованных больных. Однако, у пациентов выявлены достоверные корреляции между ПТИ, МНО, АЧТВ, ПТВ и такими клиническими характеристиками ХВН как: тяжесть ХВН, класс ХВН по классификации СЕАР, трофические изменениями по балльной ВАШ, шкала VCSS. Недостаточно компенсированный СД 2 типа оказывал негативное влияние на течение ХВН. Нарастание класса и степени тяжести ХВН, а также преобладание трофического синдрома увеличивались с ростом HbA1с, особенно в группе с уровнем HbA1с >10%, что также подтверждалось положительными корреляциями между уровнем HbA1с и выше указанными показателями. 68 Глава 4. Показатели инструментальных методов исследования у обследуемых контингентов больных 4.1 Ультразвуковое ангиосканирование вен и артерий нижних конечностей При УЗАС вен нижних конечностей у всех пациентов установлены изменения, характерные для ВБНК: патологический ток крови по большой подкожной вене (БПВ), варикозная трансформация ее притоков, несостоятельность сафено-феморального соустья (СФС), несостоятельность перфорантных вен голени или бедра. У 2 пациентов основной группы и 2 пациентов контрольной выявлены признаки ПТФБ с поражение бедренноподколенного и подколенно-берцового сегмента. Во всех случаях имелась полная реканализация с формирование выраженного протяженного рефлюкса по бедренной вене и БПВ. (таблица 4.1). Таблица 4.1 Изменения вен нижних конечностей в обследуемых группах по данным УЗАС Показатели УЗАС вен нижних Основная Контрольная группа Р конечностей группа 40 (100%) 32 (80%) 0,03 6 (15%) 4 (10%) 0,5 32 (80%) 23 (57,5%) 0,02 9 (22,5%) 5 (12,5%) 0,2 33 (82,5%) 18 (45%) 0,0004 Степень рефлюкса по БПВ 3,6±0,7 2,5±1,2 0,0006 Несостоятельность СПС 4 (10%) 0% 0,04 Двухстороннее поражение Несостоятельность клапанов глубоких вен Несостоятельность перфорантных вен голени Несостоятельность перфорантных вен бедра Несостоятельность СФС 69 При анализе гемодинамических феноменов, как видно из таблицы, установлено, что у пациентов с СД в 100% случаев имеется двухстороннее поражение вен нижних конечностей, по сравнению с контрольной группой – 80% (р=0,03). При оценке несостоятельности клапанов глубоких вен, кроме 2 пациентов основной группы и 2 пациентов контрольной с ПТФБ, так же выявлена несостоятельность бедренных вен у 4 пациентов с СД и у 2 пациентов контрольной группы, без признаков ПТФБ. На сегодняшний день, вопрос о роли рефлюкса глубоких вен в развитии ВБНК остается не решенным и активно дискутируется. Мнения флебологов по этому вопросу расходятся. Некоторые считают, что рефлюкс по бедренной вене достоверно не влияет на течение и рецидивирование ВБНК [22,86]. Ряд авторов полагают, что основной причиной рецидива варикозного расширения вен является клапанная недостаточность глубоких вен [68,89]. Наряду с этим, в работах зарубежных флебологов указывается, что часто рефлюкс в глубоких венах носит функциональный характер и проходит самопроизвольно после удаления большой подкожной вены [110]. У больных с СД 2 типа преобладает более тяжелая степень рефлюкса по БПВ. Несостоятельность СФС статистически значимо чаще встречается у пациентов с СД. При этом, двухсторонняя несостоятельность СФС в основной группе выявлена у 57,5% (n=23), в контрольной группе у 17,5% (n=7) (р=0,0003). Важным компонентом, оказывающим влияние на течение ХЗВ, является состояние перфорантных вен, в особенности, вен голени, несостоятельность которых является одним из патогенетических звеньев в развитии трофических нарушений при ХВН [163,182]. У пациентов с СД двухстороння несостоятельность перфорантных вен (рис. 4.1а, б) выявлена у 85,7% (n=30), в контрольной группе - у 47,2% (n=17), (р=0,01). Несостоятельность сафенопоплитеального соустья (СПС) выявлена только у пациентов основной группы. 70 А Б Рис. 4.1. А- Расширенная перфорантная вена голени и ее несостоятельность (Б) В основной группе были получены достоверные корреляционные связи с несостоятельностью перфорантных вен, СФС, СПС, таблица 4.2. Таблица 4.2 Корреляционные связи несостоятельности перфорантных вен, СФС и СПС с характеристиками СД 2 типа Показатель Несостоятельность Несостоятельность Несостоятельность перфорантных вен СФС СПС r р r р r р 0,45 0,003 0,48 0,001 0,07 0,6 0,36 0,02 0,43 0,005 0,13 0,4 0,34 0,03 0,36 0,02 0,34 0,02 HbA1C 0,36 0,02 0,32 0,04 0,19 0,2 Шкала НДС 0,5 0,001 0,46 0,002 0,2 0,1 Длительность СД Трофические изменения по балльной ВАШ Среднесуточная гликемия 71 Как видно из таблицы, на патологические изменения венозной системы по данным УЗАС влияет длительность СД, компенсация углеводного обмена, а так же ДПН. При анализе тяжести ХЗВ, используя CAD score, у пациентов основной группы получено 13,1± 3,7 баллов, в контрольной группе 9,3±3,5 (р<0,0001), что свидетельствует о более тяжелом течении ХВН у пациентов с СД 2 типа не только клинически, но и по данным УЗАС. У пациентов с длительностью ХВН ≥10 лет чаще встречается двухстороннее поражение нижних конечностей, несостоятельность перфорантных вен, больше степень рефлюкса по БПВ и тяжесть ХЗВ по CAD score, таблица 4.3. Таблица 4.3 Изменения вен нижних конечностей по данным УЗАС у пациентов с ХВН ≥10 лет (1 группа), меньше 10 лет (2 группа) 1 группа (n=64) 2 группа (n=15) p Двухстороннее поражение 60 (93,7%) 12 (75%) 0,02 Несостоятельность 14 (21,8%) 0% 0,03 3,6±0,6 3,0±1,1 0,04 11,7±4,1 9,0±3,2 0,01 перфорантных вен Степень рефлюкса по БПВ Тяжесть ХЗВ CAD score Для дальнейшего анализа пациенты основной группы по длительности СД были разделены на 2 группы: 1 – СД ≥10 лет (n=25) , 2 – СД меньше 10 лет (n=15), (таблица 4.4). Таблица 4.4 Изменения вен нижних конечностей по данным УЗАС у пациентов с СД ≥10 лет (1 группа), с СД меньше 10 лет (2 группа) 72 1 группа (n=25) 2 группа (n=15) р Поражение глубоких вен 6 (24%) 0% 0,03 Несостоятельность СФС 25 (100%) 12 (80%) 0,003 Несостоятельность СПС 3 (12%) 3 (20%) 0,7 25 (100%) 10 (66,7%) 0,002 3,9±0,4 3,0±0,8 0,0003 Несостоятельность перфорантных вен Степень рефлюкса по БПВ Как видно из таблицы, морфологические изменения венозной системы нарастают при увеличении продолжительности СД 2 типа. Так же у пациентов 1 группы выявлена двухсторонняя несостоятельность СФС у 19 (76%) обследуемых, против 4 (26,7%) пациентов 2 группы (р=0,006). Имеется тенденция преобладания двухсторонней несостоятельности перфорантных вен: у 23 (92%) обследуемых 1 группы, против 7 (70%) во 2 группе (p=0,09). При этом, в 1 группе у всех пациентов выявлена несостоятельность перфорантных вен голени 100%, во 2 группе лишь у 10 (66,7%) – несостоятельность перфорантов голени и у 5 (33,3%) - бедра. Кроме длительности СД 2 типа, значительное влияние на морфологические изменения венозной системы по данным УЗАС имел уровень компенсации СД, таблица 4.5. Таблица 4.5 Зависимость изменений венозной системы по данным УЗАС от уровня гликированного гемоглобина (HbA1с) у пациентов с СД 2 типа Показатель Несостоятельность СФС р HbA1с ≤ 7% 7,1-10% >10% n=7 n=24 n=9 6 (85,7%) 23 (95,8%) 9 (100%) 0,08 73 Несостоятельность 4 (57%) 22 (91,6%) 9 (100%) 0,02 4 (57%) 22 (91,6%) 9 (100%) 0,02 1 (14,3%) 7 (29,2%) 4 (44,4%) 0,4 3,0±0,8 3,6±0,7 4,0±0 0,02 перфорантных вен Несостоятельность перфорантов голени Несостоятельность перфорантов бедра Степень рефлюкса по БПВ В графе достоверность приведены уровни статистической значимости для критерия КраскелаУоллиса. Частота выявления несостоятельности СФС и перфорантных вен различной локализации, а так же степень рефлюкса по БПВ нарастает при HbA1с >10%. У обследуемых пациентов при корреляционном анализе выявлены положительные связи между степенью АГ и морфологическими изменениями венозной системы по данным УЗАС, таблица 4.6. Таблица 4.6 Корреляционные связи между морфологическими изменениями вен по данным УЗАС и степенью АГ Показатель Степень АГ r p Двухстороннее поражение нижних конечностей 0,35 0,001 Несостоятельность перфорантных вен 0,33 0,003 Несостоятельность СФС 0,37 0,0008 Степень рефлюкса по БПВ 0,55 <0,0001 Несостоятельность СПС 0,25 0,02 Анализируя показатели коагулограммы у всех пациентов, были получены достоверные корреляционные связи между ПТИ, МНО, АЧТВ, ПТВ и изменениями венозной системы по данным УЗАС, таблица 4.7. 74 Таблица 4.7 Корреляционные связи между показателями коагулограммы и изменениями венозной системы по данным УЗАС Показатель ПТИ Двухстороннее МНО АЧТВ ПТВ r р r р r р r p 0,25 0,02 -0,27 0,01 -0,24 0,02 -0,3 0,01 0,18 0,1 -0,28 0,01 -0,22 0,04 -0,25 0,02 0,2 0,06 -0,34 0,001 -0,14 0,2 -0,25 0,02 0,52 0,0001 -0,49 0,0003 -0,34 0,01 -0,3 0,03 0,06 0,6 -0,22 0,04 -0,29 0,008 -0,32 0,002 поражение нижних конечностей Несостоятельность перфорантных вен Несостоятельность СФС Степень рефлюкса по БПВ Несостоятельность СПС Таким образом, изменения свертывающей системы крови в сторону гиперкоагуляции способствуют морфофункциональным изменениями венозной системы по данным УЗАС. При этом, у пациентов основной группы с несостоятельностью перфорантных вен нижних конечностей различной локализации, были получены достоверно меньшие значения МНО, АЧТВ, ПТВ, и выявлена тенденция к увеличению фибриногена и ПТИ, в сравнении с контрольной группой, связано со снижением антиагрегационной, антикоагулянтной что и фибринолитической активности сосудистой стенки у больных СД 2 типа [29, 36], таблица 4.8. 75 Таблица 4.8 Показатели коагулограммы в исследуемых группах с несостоятельностью перфорантных вен при УЗАС Показатели Основная группа Контрольная группа коагулограммы (n=35) (n=36) ТВ, сек. 14,6 [14,3;16,4] 15,2 [14,2;16,5] 0,4 ПТИ, % 120 [108;134] 113 [101;124,5] 0,08 4,8 [4,1;5,8] 4,2 [3,6;5,1] 0,05 0,82 [0,8;0,91] 0,93 [0,8;0,99] 0,0001 24 [23;25] 26 [25;28] 0,0004 8,9 [8,1;9,3] 9,2 [8,9;9,9] 0,004 Фибриноген, г/л МНО, ед. АЧТВ, сек. ПТВ, сек. p Ожирение влияло не только на клиническую характеристику ХВН, но и на морфофункциональные изменения по данным УЗАС. У пациентов с ИМТ ≥30 кг/м2 чаще было выявлено двухстороннее поражение нижних конечностей, поражение глубокой венозной системы, несостоятельность перфорантных вен голени, больше баллов по CAD score, таблица 4.9. Таблица 4.9 Изменения венозной системы по данным УЗАС у пациентов с ИМТ ≥30 кг/м2 (1 группа) и с ИМТ<30 кг/м2 (2 группа) Характеристики Двухстороннее поражение Поражение глубоких вен Несостоятельность перфорантных вен CAD score 1 группа N= 52 2 группа N= 28 Р 10 (19,2%) 0% 0,01 51 (98%) 21 (75%) 0,001 41 (78,8%) 14 (50%) 0,008 11,9±3,7 9,8±4,1 0,007 76 Лечение сахарного диабета проводилось, как пероральными сахароснижающими препаратами (n=15), так и с помощью инсулинотерапии (n=5); 20 больных получали комбинацию сахароснижающих препаратов с инсулином. Связи между характером сахароснижающей терапии и выраженностью ХВН не выявлено. По-видимому, на течение ХВН у больных с сочетанной патологией оказывает влияние состояние компенсации углеводного обмена, а не способ его достижения. При УЗАС артерий у 55% (n=22) пациентов основной группы и 10% (n=4) контрольной (р<0,0001), выявлены признаки нестенозирующего атеросклероза в виде появления в структуре комплекса интима-медиа (КИМ) дополнительных слоев повышенной или сниженной эхогенности, которые могут быть охарактеризованы, как неоднородность. В ряде случаев на фоне диффузного повышения эхогенности имелась частичная или полная утрата дифференцировки на слои, так же встречались множественные гиперэхогенные включения (кальциноз), рис. 4.2. Рис. 4.2. Структура изменения КИМ по данным УЗАС в группах Как видно из рисунка, у пациентов с СД 2 типа в большинстве случаев с нестенозирующим атеросклерозом встречается неоднородная эхоструктура КИМ, 77 у 52% обследуемых – полная или частичная утрата дифференцировки, в 22,5% случаев – кальциноз на фоне повышенной эхогенности КИМ и нарушения дифференцировки на слои (рис. 4.3). В контрольной группе с большей частотой встречалось нарушение дифференцировки КИМ на слои. Рис. 4.3 Неоднородность, утолщение, нарушение дифференцировки на слои стенки ПБА Для дальнейшего анализа пациенты с СД 2 типа были разделены на 2 группы: 1 – с признаками макроангиопатии при УЗАС, 2 – пациенты без признаков макроангиопатии при УЗАС, см. таблицу 4.10. Таблица 4.10 Особенности ХВН у пациентов с СД 2 типа с макроангиопатией нижних конечностей (1 группа) и без макроангиопатии (2 группа) Характеристики ХВН 1 группа 2 группа N=22 N=18 класс ХВН по СЕАР 4,6±0,6 3,4±0,9 <0,0001 тяжесть ХВН 2,5±0,5 1,8±0,5 0,0004 ведущий варикозный с-ом 1 (4,5%) 6 (33%) 0,01 ведущий трофический с-ом 15 (68,2%) 3 (16,6%) 0,001 трофические изменения по ВАШ 9,0±1,9 4,4±3,6 <0,0001 шкала НДС 12,5±3,9 6,4±2,5 <0,0001 VCSS 10,3±3,2 7,7±2,8 0,007 поражение глубоких вен 6 (27,3%) 0% 0,01 p 78 несостоятельность 21 (95,4%) 11 (61%) 0,007 несостоятельность СФС 20 (90,9%) 7 (38,8%) 0,0005 рефлюкс по БПВ 20 (100%) 8 (57%) 0,001 степень рефлюкса по БПВ 3,9±0,2 3,3±0,8 0,004 тяжесть ХЗВ по CAD score 14,1±3,6 11,9±3,5 0,04 перфорантных вен Установлено, что у пациентов с СД 2 типа и признаками макроангиопатии при УЗАС встречается более тяжелые степень и класс ХВН, клинически преобладают трофические изменения нижних конечностей, чаще выявляются несостоятельность перфорантных вен и СФС, выше степень рефлюкса по БПВ. Стенозирующий атеросклероз различной степени выявлен у 27,5% (n=11) пациентов с СД 2 типа, у 2,5% (n=1) обследуемого без СД (р=0,001). При обнаружении стенозирующего атеросклероза выделяли 3 степени стеноза: 1гемодинамически не значимый стеноз (менее 50% по диаметру), 2 – гемодинамически значимый стеноз (более 50% по диаметру), 3 – окклюзия артерии (рис. 4.4 а, б). А Б Рис. 4.4. А – гемодинамически незначимый стеноз ОБА (атеросклеротическая бляшка ОБА), Б – окклюзия ЗББА 79 Частота выявления стенозирующего атеросклероза различной степени выраженности артерий нижних конечностей у обследуемых больных представлена в таблице 4.11. Таблица 4.11 Частота выявления стенозирующего атеросклероза артерий нижних конечностей в группах при УЗАС Степень стеноза Основная группа Контрольная группа по диаметру N=11 N=1 стеноз <50% 9 (22,5%) 1 (2,5%) 0,006 стеноз >50% 6 (15%) 1 (2,5%) 0,04 окклюзия 3 (7,5%) 1 (2,5%) 0,3 p Мы проанализировали корреляционную зависимость между степенью стеноза артерий при УЗАС и клиническими проявлениями ХВН, морфологическими изменениями венозной системы при УЗАС, таблица 4.12. Таблица 4.12 Корреляционные связи степени стеноза при УЗАС Характеристики ХВН Степень стеноза при УЗАС r p класс ХВН по СЕАР 0,55 0,0002 тяжесть ХВН 0,56 0,0001 ведущий трофический синдром 0,39 0,01 трофические изменения по ВАШ 0,44 0,004 шкала НДС 0,5 0,0008 VCSS 0,53 0,0004 поражение глубоких вен 0,36 0,02 несостоятельность перфорантных вен 0,33 0,04 80 несостоятельность СПС 0,38 0,01 несостоятельность СФС 0,39 0,01 Таким образом, нарастание выраженности макроангиопатии по данным УЗАС отягощает клинические и морфологические показатели ХВН. Для объективизации проанализировали ремоделирования модифицированный индекс сосудистой Карнегана стенки (ИК) в мы ОБА, рассчитанный как отношение толщины КИМ и диаметра сосуда. Необходимость модификации общепринятого показателя (соотношение толщины стенки сосуда и его внутрипросветного диаметра) обоснована двумя обстоятельствами. Вопервых, определение толщины сосудистой стенки при УЗАС затруднено в связи со сходной эхогенностью адвентиции и окружающих сосуд тканей. Во-вторых, как известно из литературы [31,32, 80,97], структурные изменения при диабетической макроангиопатии преимущественно локализуются в медии и интиме артерий при относительно неизмененной адвентиции. Модифицированный ИК ОБА в группах статистически значимо различался, см. рис. 4.5 (а, б). Рис. 4.5(а) ИК правой нижней конечности в группах (р<0,0001) 81 Рис. 4.5(б) ИК левой нижней конечности в группах (р<0,0001) Более высокое значение ИК у пациентов с СД 2 типа может быть обусловлено утолщением либо компенсаторным расширением просвета сосуда, либо КИМ. В нашем исследовании достоверной разницы внутрипросветного диаметра ОБА в группах не выявлена, но имеется тенденция к преобладанию в основной группе 7,6±1,0 мм правой нижней конечности, против 7,4±0,8 мм в контрольной группе (р=0,2), 7,6±1,0 мм левой нижней конечности, против 7,5±0,6 мм (р=0,1) в контрольной группе. Значит выраженность компенсаторной дилатации сосудов, по всей видимости, была меньше, чем утолщение КИМ. Основными причинами этого несоответствия, возможно, являются структурные нарушения в медии, которые ограничивают функциональные возможности гладкомышечных элементов сосудистой стенки для компенсаторного расширения артерий [3]. У пациентов с СД 2 типа получены статистически значимые корреляционные связи между ИК и характеристиками ХВН, показателями СД, таблица 4.13. Таблица 4.13 82 Корреляционные связи ИК у пациентов с СД 2 типа Показатели Индекс Карнегана r Р длительность СД 0,51 0,0007 HbA1C 0,32 0,04 класс ХВН по СЕАР 0,43 0,005 тяжесть ХВН 0,39 0,01 трофический синдром по ВАШ 0,35 0,02 шкала НДС 0,46 0,002 VCSS 0,41 0,008 несостоятельность перфорантных вен 0,46 0,002 несостоятельность СФС 0,43 0,005 степень рефлюкса по БПВ 0,38 0,03 тяжесть ХЗВ по CAD score 0,42 0,007 У обследуемых пациентов были выявлены положительные корреляционные связи между показателями липидного обмена и изменениями артерий нижних конечностей по данным УЗАС: ОХС и ИК (r=0,26, p=0,01), ТГ и ИК (r=0,34, p=0,001), ТГ и кальциноз сосудистой стенки (r=0,24, p=0,03), ТГ и окклюзия артерии (r=0,24, p=0,02). Для оценки состояния периферического сопротивления сосудов анализировали резистивный индекс (RI). Статистически значимых различий RI в ОБА и ПБА в группах не выявлено. Но значительная разница выявлена в дистальных артериях (ЗББА, ПББА, ТАС), таблица 4.14. Таблица 4.14 Резистивный индекс в группах по данным УЗАС Артерии нижних конечностей Основная группа Контрольная группа р 83 ОБА 0,22±0,4 0,09±0,2 0,1 ПБА 0,11±0,2 0,05±0,04 0,6 ПА 0,09±0,1 0,04±0,03 0,02 ЗББА 0,16±0,3 0,1±0,05 0,002 ПББА 0,18±0,2 0,04±0,04 <0,0001 ТАС 0,23±0,2 0,05±0,1 0,0001 Более высокие значения RI дистальных артерий у пациентов с СД 2 типа говорит о ригидности артериальной стенки. При этом, пациенты основной группы с ДПН нижних конечностей имели более высокие значения RI, КИМ, что подтверждает влияние нейропатии на состояние стенки артерий и периферическое сопротивление сосудов у пациентов с СД 2 типа [53], (таблица 4.15). Таблица 4.15 Значение RI и КИМ у пациентов с СД 2 типа с ДПН нижних конечностей и без ДПН Ультразвуковые RI Пациенты с СД 2 типа Р Показатели с ДПН (n=34) без ДПН (n=6) КИМ в ОБА 1,25±0,3 0,86±0,1 0,003 ОБА 0,24±0,3 0,02±0 0,004 ПБА 0,14±0,2 0,02±0 0,01 ПА 0,11±0,1 0,02±0 0,002 ЗББА 0,18±0,2 0,02±0 0,0008 ПББА 0,21±0,2 0,02±0 0,0003 ТАС 0,27±0,2 0,02±0,01 0,0006 84 При корреляционном анализе между RI и показателями ХВН у пациентов с СД 2 типа выявлено, что при нарастании ригидности сосудистой стенки дистальных артерий (ЗББА, ПББА, ТАС) преобладают трофические изменения нижних конечностей, нарастает тяжесть ХВН, уменьшается болевой синдром. Уменьшение болевого синдрома одновременно с нарастанием RI ассоциируется с увеличением баллов по шкале НДС, что подтверждает влияние ДПН (таблица 4.16). 85 Таблица 4.16 Корреляционные связи между RI артерий нижних конечностей и характеристиками ХВН, шкалой НДС у пациентов с СД 2 типа Характеристики ХВН RI ОБА RI ПБА RI ПА RI ЗББА RI ПББА RI ТАС R P R P r P r P R P R Р класс ХВН по СЕАР 0,29 0,07 0,15 0,3 0,25 0,1 0,13 0,4 0,19 0,2 0,35 0,02 тяжесть ХВН 0,4 0,01 0,38 0,01 0,45 0,03 0,35 0,03 0,52 0,0005 0,65 <0,0001 отечный синдром по ВАШ 0,17 0,26 0,18 0,2 0,03 0,8 0,39 0,01 0,25 0,1 0,29 0,06 болевой синдром по ВАШ -0,23 0,1 -0,1 0,4 -0,1 0,6 -0,34 0,3 -0,25 0,1 -0,3 0,1 трофический синдром по ВАШ 0,48 0,001 0,35 0,02 0,38 0,01 0,41 0,009 0,51 0,0007 0,59 <0,0001 шкала НДС 0,53 0,004 0,36 0,02 0,44 0,004 0,54 0,0004 0,62 <0,0001 0,68 <0,0001 VCSS 0,38 0,01 0,3 0,06 0,39 0,01 0,46 0,003 0,57 0,0001 0,61 <0,0001 рефлюкс по БПВ 0,47 0,005 0,3 0,1 0,39 0,01 0,37 0,03 0,43 0,01 0,52 0,001 степень рефлюкса по БПВ 0,46 0,01 0,2 0,3 0,42 0,01 0,5 0,005 0,61 0,0001 0,48 0,007 несостоятельность перфорантных 0,45 0,003 0,3 0,06 0,47 0,002 0,37 0,02 0,41 0,008 0,42 0,007 несостоятельность СПС 0,1 0,4 0,32 0,04 0,2 0,1 0,06 0,7 0,05 0,7 0,15 0,3 несостоятельность СФС 0,44 0,004 0,23 0,1 0,43 0,005 0,41 0,009 0,49 0,001 0,63 <0,0001 вен 86 Ультразвуковые показатели ХЗВ так же ухудшаются при нарастании RI, особенно в дистальных артериях голени: чаще выявляются несостоятельность перфорантных вен, СФС, а так же увеличивается степень рефлюкса по БПВ. 4.2. Электрофизиологическая характеристика функционального состояния чувствительных и моторных нервов нижних конечностей Хроническая сенсомоторная полинейропатия является самым частым вариантом нейропатии, которая, чаще всего, начинается бессимптомно и может являться единственным проявлением СД 2 типа [185,188]. В клинических исследованиях у пациентов с ДПН предпочтительнее использовать электрофизиологические исследования [177]. В нашем исследовании всем пациентам основной группы и 33 (82%) пациентам контрольной группы проведена стимуляционная ЭНМГ нижних конечностей. Так как патологические изменения нервных структур нарастают в дистальном направлении нижних конечностей [28], нами были изучены двигательные нервы: n.peroneus и n.tibialis, и чувствительный нерв: n.suralis. Выявлены значительные изменения ЭНМГпараметров у пациентов с СД 2 типа, статистически значимо отличающиеся от контрольной группы (таблица 4.17). Таблица 4.17 Средние значения ЭНГМ-параметров периферических нервов в исследуемых группах Изучаемый Показатели Нормальные Основная Контрольная нерв ЭНМГ показатели группа группа (n=40) (n=33) ≥3 5,8 [3,3;5,9] 9,3 [5,4;14,8] 0,0009 РЛ, мс ≤2 2,5 [2,1;3,8] 1,8 [1,6;2,4] <0,0001 СРВ, м/с ≥40 38 [34,6;43] 44,8 [42;49] <0,0001 n. Tibialis А М-ответа, р мВ 87 n. Peroneus А М-ответа, ≥3 2,8 [1,4;4,1] 4,3 [2,5;4,8] 0,01 РЛ, мс ≤2 2,4 [2,1;2,8] 2,5 [2,2;2,9] 0,49 СРВ, м/с ≥40 44 [41;47] 48,5 [46;52] <0,0001 А ПД, мкВ ≥10 3,1 [2,5;5,1] 8 [4;10] 0,0002 СРВ, м/с ≥50 36,8 [26;39,6] 47 [41;50] <0,0001 мВ n.Suralis Как видно из таблицы, у пациентов с СД 2 типа по двигательным нервам снижены амплитуды М - ответа, СРВ, увеличена РЛ, нарушено проведение по чувствительным нервам: снижена СРВ и амплитуда ПД. При корреляционном анализе у пациентов основной группы установлена связь между показателями липидного обмена и нарушением иннервации нижних конечностей. Между амплитудой М – ответа по n. Tibialis и: ОХС (r= 0,25;р=0,04), ТГ (r= -0,34;р=0,006), между амплитудой ПД по n.Suralis и ТГ (r= 0,26;р=0,004), между СРВ n.Suralis и ТГ (r= -0,37;р=0,002). Для дальнейшего анализа пациенты с СД 2 типа были разделены на 2 группы по классификации СЕАР: 1 – с трофическими изменениями нижних конечностей (класс С4-С6), 2 – без трофических изменений (класс С1-С3), таблица 4.18. Таблица 4.18 Показатели ЭНМГ у пациентов с СД 2 типа с трофическими изменениями нижних конечностей (1 группа), без трофических изменений (2 группа) Изучаемый Показатели нерв ЭНМГ n. Tibialis n. Peroneus 1 группа (n=30) 2 группа (n=10) р А М-ответа, мВ 5,4 [2,9;6,6] 8,3 [6,4;10,7] 0,007 РЛ, мс 2,8 [2,2;3,8] 2,3 [2,1;3,1] 0,4 СРВ, м/с 37 [34;42,6] 40,5 [36;44] 0,3 А М-ответа, мВ 2,5 [1,3;4,1] 3,1 [2,7;4,1] 0,2 РЛ, мс 2,4 [2,1;2,9] 2,5 [2,3;2,6] 0,7 88 n.Suralis СРВ, м/с 42,8 [41;46,5] 46,8 [45,7;51] 0,01 А ПД, мкВ 3,1 [2,3;4,7] 5,0 [2,9;5,8] 0,2 СРВ, м/с 36,4 [25;41] 37,4 [34;38] 0,8 Анализируя данные таблицы 4.18, у пациентов с СД 2 типа с трофическими изменениями нижних конечностей (класс С4-С6 по СЕАР) более выражены нарушения по двигательным нервам: статистически значимо ниже амплитуда Мответа по n. Tibialis, СРВ по n. Peroneus. Так же в нашем исследовании у пациентов с СД 2 типа была выявлена связь между тяжестью поражения моторного волокна и выраженностью симптомов ХВН. Снижение амплитуды М-ответа по n. Peroneus обратно коррелировало с тяжестью ХВН (r= -0,41, p=0,02), снижение амплитуды М-ответа по n. Tibialis обратно коррелировало с тяжестью ХВН (r= -0,35, p=0,03). При анализе показателей ЭНМГ в зависимости от ведущего клинического синдрома установлено, сто снижение амплитуды М-ответа в большей степени наблюдалось у пациентов с ведущим трофическим синдромом: по n. Tibialis 3,4 [2,2;6,1] мВ (р=0,004), по n. Peroneus 1,4 [1,0;3,5] мВ (р=0,001). Снижение СРВ по n. Peroneus 42 [39;43,8] м/с статистически значимо (р=0,01) так же у пациентов с трофическими изменениями нижних конечностей, таблица 4.19. Таблица 4.19 Показатели ЭНМГ в зависимости от ведущего клинического синдрома у пациентов с СД 2 типа Изучаемый нерв Показатели ЭНМГ n. Tibialis А Мответа, мВ Ведущий отечный синдром (n=13) 6,5 [5,5;8,3] Ведущий варикозный с-ом (n=7) 8,4 [6,4;9,1] Ведущий болевой синдром (n=2) 4,6 [3,7;5,6] Ведущий трофический с-ом (n=18) 3,4 [2,2;6,1] р 0,004 89 РЛ, мс n. Peroneus n.Suralis СРВ, м/с А Мответа, мВ РЛ, мс СРВ, м/с А ПД, мкВ СРВ, м/с 2,4 [2,2;2,9] 40 [36,8;44] 2,8 [2,5;5,1] 2,3 [2,2;3,8] 36 [35;44] 3,2 [3;4,1] 3,7 [3,0;4,5] 38 [35;41] 4,16 [4,1;4,2] 2,8 [2,1;4,0] 36 [33;42,6] 1,4 [1,0;3,5] 2,5 [2,3;2,6] 47,5 [44;50] 5 [2,9;6,1] 39 [36,8;41] 2,2 [2,1;2,6] 46 [42;47] 3,1 [2,9;5,8] 35 [33;37,8] 2,1 [1,8;2,3] 44 [42;45,8] 4,1 [2,3;5,9] 39 [36;42,6] 2,5 [2,3;3,1] 42 [39;43,8] 2,9 [1,9;4,5] 27 [20,5;39] 0,5 0,8 0,01 0,3 0,01 0,2 0,1 В графе достоверность приведены уровни статистической значимости для критерия КраскелаУоллиса Для анализа влияния ЭНМГ показателей на морфологические изменения венозной системы по данным УЗТС пациентов с СД 2 типа разделили на 2 группы: 1(n=35) – с несостоятельностью перфорантных вен различной локализации, 2 (n=5) – без несостоятельности перфорантных вен нижних конечностей. У пациентов 1 группы получены более низкие показатели амплитуды М – ответа по двигательным нервам: по n. Tibialis 5,5 [2,9;6,7] мВ против 10,7 [9,1;11,5] мВ во 2 группе (р=0,002), по n. Peroneus 2,5 [1,2;4,1] мВ против 4,1 [3,6;6,1] мВ (р=0,03), таблица 4.20. Таблица 4.20 ЭНМГ показатели у пациентов с СД 2 типа в зависимости от наличия несостоятельности перфорантных вен при УЗАС Изучаемый Показатели 1 группа 2 группа нерв ЭНМГ (n=35) (n=5) n. Tibialis А М-ответа, мВ 5,5 [2,9;6,7] 10,7 [9,1;11,5] р 0,002 90 n. Peroneus n.Suralis РЛ, мс 2,5 [2,2;3,8] 2,2 [2,1;3,1] 0,6 СРВ, м/с 36,8 [34;42,6] 44 [40,9;45] 0,1 А М-ответа, мВ 2,5 [1,2;4,1] 4,1 [3,6;6,1] 0,03 РЛ, мс 2,3 [2,1;2,9] 2,5 [2,4;2,6] 0,5 СРВ, м/с 43,5 [40,9;47,2] 46,4 [45,7;47,5] 0,1 А ПД, мкВ 3,1 [2,3;4,9] 5,8 [5,3;6,3] 0,05 СРВ, м/с 36,8 [25,5;40,6] 36,9 [35,3;37,8] 0,8 4.3. Состояние микроциркуляции нижних конечностей по данным ЛДФ Изучены изменения микроциркуляции кожи нижних конечностей у 15 пациентов основной и 15 пациентов контрольной группы с помощью ЛДФ. При оценке базального кровотока в группах выявлена статистически значимая разница основных показателей перфузии. У пациентов контрольной группы М = 2,5 ± 2,2 пф. ед., у пациентов основной группы М = 3,7 ± 2,2, пф. ед. (р = 0,01), рис. 4.6. Рис. 4.6. Показатель микроциркуляции (М) в группах 91 Увеличение показателя М у пациентов с СД 2 типа может быть связано, как с ослаблением артериолярного сосудистого тонуса, которое приводит к увеличению объема крови в артериолах, так и с явлениями застоя крови в венулярном звене [51]. Но в микроциркуляторном русле величина перфузии определяется не только средней величиной М, но и ее гармоническими изменениями [51]. Последние характеризуются величинами амплитуд колебаний кровотока в активном тонус-формирующем диапазоне спектра осцилляций, что свидетельствует о приросте объема и скорости перфузии. Увеличение амплитуд колебаний сопровождается уменьшением эффективного сопротивления кровотоку [173]. В связи с этим, целесообразно ввести показатель эффективной перфузии (М эфф.). М эфф. = М × А макс. (пф.ед.2), где А макс. – максимальная усредненная амплитуда осцилляций, доминирующая по величине среди амплитуд колебаний всех активных тонус-формирующих диапазонов частот 0,005-0,145 Гц. При определенных физиологических состояниях значение показателя М эфф. может иметь большую информативность, чем величина М. Например, при ишемических синдромах, особенно в зонах без артериоло-венулярных анастомозов (АВА), активация колебательного контура имеет приспособительное значение для обеспечения капиллярной перфузии и трофики тканей [49,50]. В этих условиях величина М эфф. более значима, чем М, для оценки состояния микроциркуляции. У пациентов контрольной группы М эфф. = 40,8 [25,9;49] пф. ед.2, у пациентов основной группы М эфф. = 59,7 [42,6;85,4] пф. ед. 2 (р = 0,002), рис. 4.7. Что показывает увеличение перфузии кожи в ответ на более значимую ишемию у пациентов с СД 2 типа по сравнению с пациентами без сопутствующего сахарного диабета. 92 200 180 М эфф., пф.ед. 160 140 120 100 80 60 40 20 0 1 СД 0 Median 25%-75% Min-Max Без СД Рис. 4.7. Показатель эффективной перфузии (М эфф.) в группах При анализе коэффициента вариации, который отражает напряженность функционирования регуляторных систем микрососудистого русла, в основной группе: Kv = 18% [12,5;31,1], в контрольной – 26,2% [16,3;42,6] (р=0,02), что указывает на активацию механизмов контроля и улучшение микроциркуляции в динамике у пациентов без СД, рис. 4.8. 93 Рис. 4.8. Коэффициент вариации (Кv) в группах При расчете показателей шунтирования статистически значимой разницы в группах получено не было, таблица 4.21. Но у пациентов с СД 2 типа ПШ1 ≥1, а ПШ2 <1 – это вариант шунтирования кровотока за счет перераспределения перфузии в микрососудах. А у пациентов без диабета ПШ1≥1 и ПШ2 ≥1 – это за счет различия перфузии микрососудов и более крупных сосудистых сегментов, так как ПШ2 патогенетически связан с процессами, формирующимися проксимальнее и или дистальнее МЦР. Таблица 4.21 Показатели шунтирования в группах Показатель Основная группа Контрольная группа р ПШ1 1,2 [0,8;1,8] 1,27 [0,9;1,8] 0,9 ПШ2 0,9 [0,6;1,3] 1,0 [0,7;1,4] 0,4 ПШ 1,87 [1,0;3,1] 2,1 [1,3;3,2] 0,5 шунтирования 94 Однако при оценке состояния перфузии по шунтовым и нутритивным путям выявлено увеличение кровотока по артериовенозным шунтам в обход микроциркуляторного русла у пациентов с СД 2 типа, таблица 4.22. Но так же в основной группе наблюдалось и достоверное увеличение нутритивного кровотока (р=0,01), но абсолютная величина нутритивного кровотока может увеличиваться, хотя его доля в общей гемодинамике снижена [51]. Таблица 4.22 Нутритивный и шунтовой компоненты М в группах Показатель Основная группа Контрольная группа p Мнутр., пф. ед. 1,1 [0,7;1,8] 0,7 [0,5;1,1] 0,01 Мшунт., пф. ед. 2,1 [1,3;2,7] 1,4 [0,9;2] 0,04 При корреляционном анализе в основной группе выявлены достоверные корреляционные связи между трофическими изменениями нижних конечностей, обусловленными ХВН и: показателем М (r=0,37; р=0,04); ПШ (r= 0,39;р=0,02). В дальнейшем, с помощью вейвлет-преобразования ЛДФ-грамм, анализировали амплитуды колебаний кровотока: эндотелиальный, нейрогенный, миогенный ритмы, которые являются активными факторами контроля МЦР, а так же дыхательный и сердечный ритмы, пассивные факторы регуляции. Статистически значимой разницы выявлено не было. Однако диагностическое значение имеет выявление максимальной по амплитуде (А макс.) осцилляции среди всех активных диапазонов. Именно этот регуляторный фактор является доминирующим среди остальных тонус-формирующих влияний на мышечносодержащие артериолы [51], (см. таблицу 4.23). 95 Таблица 4.23 Максимальные амплитуды осцилляций во всех диапазонах частот в группах Амплитуды Основная группа Контрольная группа р Аэ. 15,7 [13,9;18,3] 14,2 [11,1;17,6] 0,08 Ан. 15,8 [12,7;17,4] 16,1 [12,9;18,2] 1,0 Ам. 12,4 [9,2;20,5] 11,5 [9,8;16,2] 0,9 Ад. 12,3 [8,1;14,7] 11,6 [8,1;17,9] 0,8 Ас. 6,4 [5,3;8,3] 6,9 [5,2;10,4] 0,7 колебаний Как видно из таблицы 4.23, у пациентов с СД 2 типа имеется тенденция к преобладанию Аэ. (р=0,08) по сравнению с контрольной группой и является одной из максимальных амплитуд среди всех активных диапазонов в группе, что свидетельствует о доминировании эндотелиальных NO-зависимых осцилляций и преобладание в исследуемой области перфузии по крупным микрососудам, где относительно высокое напряжение сдвига поддерживает секрецию оксида азота эндотелиоцитами, возможно это связано с большей эндотелиальной дисфункцией у пациентов с сочетанной патологией. Но отчетливое доминирование по амплитуде в диапазонах эндотелиальной и нейрогенной активности в целом по группе свидетельствует о преобладании вклада кровотока артериол, АВА и относительного снижения нутритивного кровотока. При этом у пациентов с СД 2 типа имеется положительная связь между HbA1c и Аэ. (r=0,53; р=0,04). Для дальнейшего анализа пациенты с СД 2 типа, учитывая данные ультразвуковой диагностики, были разделены на 2 группы: 1 группа - пациенты с несостоятельностью перфорантных вен по данным УЗАС (n=25), 2 группа пациенты с нормально функционирующими перфорантами (n=5). При сравнении максимальных амплитуд колебаний во всех диапазонах выявлено, что у пациентов 1 группы большая амплитуда дыхательных колебаний: Ад. = 12,8 96 [9,6;14,8] пф.ед., чем у пациентов 2 группы: Ад. = 5,6 [4,4;6,7], (р=0,04). Диагностическое значение дыхательной волны (диапазон 0,2-0,4ГЦ) заключается в ее связи с венулярным звеном в условиях естественного дыхания. Увеличение Ад. указывает на снижение микроциркуляторного давления и ухудшение венозного оттока [51]. Ухудшение оттока крови из МЦР может сопровождаться увеличением объема крови в венулах и эритроцитов венулярного звена; увеличивается отраженная от них составляющая ЛДФ-сигнала, что приводит к росту амплитуды дыхательной волны. При этом у пациентов с СД 2 типа имеется положительная корреляционная связь между HbA1c и Ад. (r=0,4;р=0,02). При ЛДФ-исследованиях МЦР кожи в клинике для выявления адаптационных резервов системы гемомикроциркуляции, оценки состояния механизмов регуляции тканевого кровотока, а так же общего функционального состояния МЦР необходимы функциональные пробы [51]. Реакция сосуда на активацию адренергических волокон во время пробы зависит, как от влияний со стороны симпатической иннервации, так и от реактивности сосудистой стенки, поэтому величина снижения кровотока отражает результирующую этих 2-х процессов, которые трудно оценить изолированно [51]. При проведении дыхательной пробы ИДП у пациентов с СД 2 типа оказался значительно ниже ИДП = 24,6% [12,3;45,2], чем у пациентов без СД 2 типа ИДП = 36,5 [26,9;48,9], (р=0,01). При корреляционном анализе у пациентов основной группы выявлены достоверные связи между ПТИ и: показателем перфузии М (r= 0,53, p=0,04), Кv (r= -0,48, p=0,02), Мнутр. (r= -0,55, p=0,03), что свидетельствует о нарушении кровотока в микроциркуляторном русле при повышении вязкости крови. У пациентов контрольной группы достоверных связей между показателями коагулограммы и МЦР выявлено не было. 97 4.4. Резюме По результатам УЗАС вен нижних конечностей установлено, что все пациенты в обеих группах имели признаки ВБНК. У больных СД 2 типа достоверно чаще регистрировались двухсторонне поражение, несостоятельность перфорантных вен голени, СФС и СПС, а также более выраженная степень рефлюкса по БПВ. Несостоятельность перфорантных вен и СФС в основной группе прямо коррелировали с такими параметрами, как длительность СД, уровень компенсации углеводного обмена по показателю HbA1C, субъективными проявлениями ДПН по шкале НДС и трофическими нарушениями по балльной ВАШ. При нарастании длительности ХВН чаще встречается двухстороннее поражение нижних конечностей, несостоятельность перфорантных вен, больше степень рефлюкса по БПВ и тяжесть ХЗВ по CAD score. Такие неспецифические факторы, как ожирение и АГ, оказывают негативное влияние на морфофункциональные изменения венозной системы по данным УЗАС: чаще двухстороннее поражение нижних конечностей, поражение глубоких вен, несостоятельность венозных клапанов и перфорантных вен различной локализации. Пациенты с длительностью СД ≥10 лет имели достоверно более выраженные изменения венозной системы нижних конечностей в виде более частого поражения глубоких вен, несостоятельности перфорантных вен и СФС, степени рефлюкса по ВБП. Несостоятельность перфорантных вен различной локализации и, особенно голени, с большей частотой регистрировалась у пациентов с плохо контролируемым (HbA1с >10%) сахарным диабетом. Состояние внутреннего и внешнего механизмов свертывания крови оказывало негативное влияние на течение ХВН у обследуемых пациентов. Пациенты с локализации, СД 2 типа и несостоятельностью перфорантных вен различной в отличие от пациентов гиперкоагуляционным состоянием гемостаза. без диабета, характеризовались 98 Атеросклеротические изменения артерий нижних конечностей по данным УЗАС в группе больных СД 2 типа достоверно чаще ассоциировались с более высоким классом ХВН по СЕАР, тяжестью ХВН, субъективными трофическими нарушениями и патологическим состоянием венозного кровотока в виде несостоятельности перфорантных вен и СФС, а также степень рефлюкса по БПВ. Частота стенозирующего атеросклеротического процесса была выше в группе СД, а его выраженность прямо коррелировала с выше указанными морфологическими изменениями венозной системы нижних конечностей. У больных СД 2 типа наблюдалось повышение модифицированного ИК, что указывало на ремоделирование артериальной стенки сосуда в виде утолщения КИМ и недостаточной компенсаторной дилатацией артерий в результате повышенной жесткости сосудистой стенки. Получены статистически значимые положительные корреляции между ИК и рядом параметров, оценивающих состояние венозного кровотока нижних конечностей (тяжесть и класс ХВН, трофическим синдромом, несостоятельность перфорантных вен и СФС, степень рефлюкса по БПВ), а также такими характеристиками диабета, как его длительность и уровень компенсации углеводного обмена по HbA1c. Было выявлено, что атерогенная дислипидемия (повышение уровня ОХС и ТГ) влияет на проявление макроангиопатии нижних конечностей по данным УЗАС (увеличение ИК, кальциноз стенки, окклюзия сосуда), а так же является патогенетическим фактором ДПН (снижение амплитуды М – ответа по двигательным волокнам, снижение СРВ и амплитуды ПД по чувствительным волокнам). Отмечалось повышение периферического сопротивления дистальных артерий, оцениваемое по значению резистивного индекса – RI у больных с СД 2 типа в сравнении с пациентами без диабета. Особенно высокие значения RI и КИМ выявлены у больных СД 2 типа и ДПН. При увеличении RI в группе больных СД 2 типа регистрировались нарастание тяжести ХВН, трофических изменений, и в тоже время уменьшение болевого синдрома, что связано с 99 сопутствующей ДПН (увеличение баллов по шкале НДС). Ультразвуковые показатели ХЗВ так же ухудшаются при нарастании RI, особенно в дистальных артериях голени: чаще выявляются несостоятельность перфорантных вен, СФС, а так же увеличивается степень рефлюкса по БПВ. Рассмотрев влияние ДПН на течение ХВН у больных СД 2 типа, по данным ЭНМГ были выявлены более выраженные нарушения по двигательным нервным волокнам (снижение амплитуды М-ответа по n. Tibialis и СРВ по n. Peroneus) у пациентов с трофическими изменениями нижних конечностей и несостоятельностью перфорантных вен различной локализации. Состояние микроциркуляции кожи нижних конечностей по результатам ЛДФ показало увеличение значения М и М эфф. в группе больных СД 2 типа, что указывало на более выраженный стаз в артериолярно-венулярном звене и нарушение капиллярной перфузии в сравнении с контрольной группой. При оценке состояния перфузии по шунтовым и нутритивным путям выявлено увеличение кровотока по артериовенозным шунтам в обход микроциркуляторного русла у пациентов с СД 2 типа, что снижает адекватное кровоснабжение тканей. Это также подтверждается положительными корреляционными связями в основной группе между трофическими изменениями нижних конечностей, обусловленными ХВН и показателем М и отрицательными связями между трофическими изменениями и показателем шунтирования. С помощью вейвлет-преобразования ЛДФ-грамм анализировали амплитуды колебаний кровотока, которые характеризуют активные и пассивные факторы контроля МЦР. У пациентов с СД 2 типа и несостоятельностью перфорантных вен выявлено увеличение амплитуды дыхательных колебаний, что указывает на снижение микроциркуляторного давления и ухудшение венозного оттока. Особенности гемостаза с изменением реологических свойств крови в сторону гиперкоагуляции у пациентов с СД 2 типа ухудшает кровоток в МЦР. 100 Глава 5. Возможные пути оптимизации лечения нарушения микроциркуляции у пациентов СД 2 типа в сочетании с ХВН 5.1 Влияние фенофибрата на клиническое проявление диабетической полинейропатии у пациентов с хронической венозной недостаточностью нижних конечностей Проведено открытое контролируемое проспективное исследование влияния фенофибрата на течение ДПН у пациентов с СД 2 типа в сочетании с ХВН. Для этого, методом простой рандомизации из основной группы было отобрано 15 человек. Больным назначался препарат из группы фенофибратов «Трайкор» (фирма Abbott) в дозе 145 мг 1 раз в день перорально в течение 3-х месяцев в дополнение к исходной гипогликемизирующей терапии. На момент включения в исследование других гиполипидемических средств пациенты не получали. Первая таблетка назначалась после окончания исходного обследования. Комплаентность оценивалась по возвращенным пустым блистерам. Медиана возраста больных составила 60 [62;70] лет, длительность СД 2 типа 10 [8;15] лет, HbA1c 8,9% [8,1;9,8]. Длительность ХВН 20 [14;30] лет. Через 3 месяца у пациентов выявлено достоверное уменьшение жалоб на судороги, зуд кожи, жжение и боль в нижних конечностях, таблица 5.1. Таблица 5.1 Динамика жалоб у обследуемых пациентов Жалобы преходящие отеки стойкие отеки Судороги Зуд Жжение Тяжесть боль До (на момент включения) 40% 46,6% 80% 40% 66,6% 86,6% 46,6% После (3 мес.) 40% 20% 46,6% 0 20% 80% 6,6% р 1,0 0,06 0,04 0,02 0,01 0,6 0,02 101 Выявлено достоверное уменьшение интенсивности ДПН по всем шкалам, таблица 5.2. Таблица 5.2 Динамика показателей шкал НДС, ОСС и НСС Шкала До (на момент включения) После (3 мес.) р НДС (балл) 8,7±3,2 7,6±3,1 0,003 НСС (балл) 6,7±2,1 3,1±1,8 0,001 ОСС (балл) 4,3±2,5 1,5±1,4 0,001 Оценка отдельных жалоб ДПН представлена в таблице 5.3. Таблица 5.3 Динамика показателей шкал НДС, ОСС и НСС До (на момент Жалоба После (3 мес.) Р включения) НСС (балл) покалывание 1,5±0,6 0,8±0,5 0,007 жжение 0,8±0,6 0,2±0,3 0,01 онемение 1,0±0,8 0,8±0,6 0,9 ноющие боли 1,2±0,6 0,3±0,4 0,007 судороги 1,8±0,3 0,7±0,6 0,002 жжение 0,82±1,1 0,08±0,3 0,04 боль покалывание 0,92±0,9 0,92±1,1 0,18±0,4 0,33±0,5 0,01 0,02 онемение в стопах 1,45±1,4 0,97±0,8 0,04 3,1±1,3 3,1±1,3 1,0 ОСС балл НДС балл Рефлексы 102 тактильная чувствительность болевая чувствительность температурная чувствительность вибрационная чувствительность 0,7±1,0 0,5±0,7 0,06 0,5±0,7 0,2±0,6 0,06 1,7±1,2 1,3±1,0 0,02 2,8±0,7 2,4±0,6 0,02 Учитывая, что основным звеном патогенеза при ХВН так же является нарушение МЦР, после лечения выявлена положительная динамика субъективных симптомов ХВН по шкале VCSS: до лечения 8,1±2,9, через 3 месяца 6,5±3,1, (р=0,002), за счет уменьшения отека нижних конечностей и уменьшения болей, а такие показатели, как варикозные изменения, гиперпигментация и индурация по балльной оценке оказались идентичными после лечения, таблица 5.4. Таблица 5.4 Динамика показателей шкалы VCSS Показатели VCSS До (на момент После (3 мес.) р включения) Боль 0,7±0,5 0,07±0,2 0,007 Отеки 1,8±0,8 1,0±0,8 0,003 При анализе липидного спектра через 3 месяца выявлено достоверное снижение ОХС и ТГ, таблица 5.5. Таблица 5.5 Динамика показателей липидного обмена Показатели До (на момент включения) После (3 мес.) р 103 ОХС, ммоль/л 6,4 [5,1;6,8] 5,3 [4,6;5,6] 0,007 ЛПВП, ммоль/л 1,2 [1,1;1,3] 1,3 [1,1;1,4] 0,08 ТГ, ммоль/л 1,9 [1,7;2,8] 1,1 [0,9;1,9] 0,001 ЛПНП, ммоль/л 3,5 [3,1;3,8] 3,5 [3,0;3,9] 0,3 5.2. Эффективность фенофибрата в лечении диабетической полинейропатии и нарушении микроциркуляции нижних конечностей у наблюдаемых пациентов по данным ЭНМГ и ЛДФ При анализе показателей ЭНМГ через 3 месяца выявлено достоверное уменьшение времени прохождения импульса по терминалям аксонов двигательных волокон (n.Peroneus): 2,1±0,5 мс против 2,4±0,3 мс (р=0,04), увеличение скорости распространения возбуждения (СРВ) по чувствительным волокнам (n.Suralis): 42,4 [36,2;45,4] м/с против 36,9 [28,5;41,8] м/с до лечения (р=0,02), таблица 5.6. Таблица 5.6 Динамика показателей ЭНМГ Изучаемый Показатели До (на момент После нерв ЭНМГ включения) (3 мес.) n. Tibialis А М-ответа, мВ 5,1 [3,0;6,4] 5,5 [3,4;5,9] 0,5 РЛ, мс 2,3 [2,1;2,9] 2,3 [2,1;2,6] 0,9 СРВ, м/с 39,5 [33,2;40,5] 41,1 [36,1;42,5] 0,1 2,8 [1,3;3,9] 3,0 [1,3;4,1] 0,5 РЛ, мс 2,3 [2,1;2,6] 2,1 [1,8;2,3] 0,04 СРВ, м/с 43,5 [40,9;46,5] 45,8 [42,6;47,8] 0,05 А ПД, мкВ 2,9 [2,4;5,0] 3,7 [3,5;4,7] 0,1 СРВ, м/с 36,9 [28,5;41,8] 42,4 [36,2;45,4] 0,02 n. Peroneus А М-ответа, мВ n.Suralis р 104 Вероятно, применение трайкора привело к снижению активности перекисного окисления, в том числе на мембранах нервных волокон, и восстановлению дефицита антиоксидантных ферментов в нервных клетках, так как рецепторы PPAR-α связаны с антивоспалительной и антиоксидантной активностью [55]. Кроме того, нейропротективные свойства препарата также могли способствовать восстановлению структуры нейрональной мембраны, нарушенного аксонального транспорта и проведения нервных импульсов по волокну [128, 154,155]. При анализе ЛДФ грамм и оценке микрососудистого кровотока выявлены изменения диагностических характеристик базального кровотока, таблица 5.7. Таблица 5.7 Динамика показателей базального кровотока МЦР по данным ЛДФ Показатели До (на момент После р включения) (3 мес.) М, пф.ед. 3,1 [2,1;5,0] 3,2 [2,1;4,2] 0,2 Кv, % 20,8 [12,4;26,8] 30,3 [16,8;43,5] 0,008 Σ 0,56 [0,45;1,1] 0,77 [0,49;1,3] 0,02 Несмотря на то, что показатель М, отражающий общий микрососудистый кровоток, включающий сигналы от артериол и венул, достоверно не изменился, выявлена динамика величины Кv, которая отражает функционирование регуляторных систем МЦР. Увеличение Кv (р=0,008) в сочетании с повышением σ (р=0,02) связано с усилением активных механизмов контроля (непосредственно воздействующих на микрососуды – эндотелиальный, миогенный и нейрогенный механизмы регуляции просвета сосудов и их тонуса). Эти факторы контроля регуляции модулируют поток крови со стороны сосудистой стенки и реализуются через ее мышечно-тонический компонент. При вейвлет-анализе получено достоверное снижение амплитуд пассивных колебаний и повышение амплитуды миогенных колебаний, таблица 5.8. 105 Таблица 5.8 Динамика амплитуд колебаний при вейвлет-анализе ЛДФ грамм Амплитуды До (на момент После колебаний включения) (3 мес.) Аэ. 16,5 [14,2;18,3] 16,0 [13,7;19,8] 0,1 Ан. 16,2 [14,7;18,9] 15,8 [14,1;19,1] 0,3 Ам. 14,4 [8,2;19,3] 16,4 [12,1;21,2] 0,007 Ад. 11,7 [8,2;14,5] 10,2 [7,4;12,8] 0,03 Ас. 6,7 [4,9;8,9] 5,4 [4,9;7,7] 0,02 Уменьшение амплитуды дыхательной волны р (р=0,03) указывает на увеличение микроциркуляторного давления и улучшение венозного оттока. Пульсовые и дыхательные осцилляции связаны преимущественно с распределением перфузии и давления вне капилляров в более крупных микрососудах (артериолах, венулах) [51]. В работе А.И. Крупаткина выявлена отрицательная корреляция средней линейной скорости кровотока артериального отдела капилляров по данным капилляроскопии с Ас. и Ад. [51]. Таким образом, уменьшение Ас и Ад свидетельствует об увеличении внекапиллярной перфузии микрососудов региона ткани. Однако, до лечения, при анализе вейвлет-спектра, преобладали амплитуды в диапазонах эндотелиальной и нейрогенной активности, что свидетельствует о доминировании вклада кровотока артериол, АВА и относительном снижении нутритивного кровотока у пациентов с СД 2 типа и ХВН, а после лечения, как видно из таблицы 5.8, преобладает амплитуда миогенных колебаний, рисунок 5.1 А,Б. 106 А Б Рис. 5.1. Амплитудно-частотный вейвлет-спектр осцилляций микрокровотока в ЛДФ-граммах пациентки К., 70 лет: А – на момент включения в исследование, Б – после (через 3 месяца) лечения В физиологической интеграции управления микрогемоциркуляции, именно, миогенное сопротивление (миогенный тонус) является наиболее дистальным звеном контроля микрокровотока перед капиллярным руслом [51]. В работе Meyer M.F. et al. (2003) обосновывается целесообразность вазомоторных колебаний тем, что при периодическом изменении мышечного тонуса сопротивление сосуда току жидкости меньше, чем сопротивление сосуда, имеющего постоянный диаметр [173]. Следовательно, у наших пациентов после лечения преобладание амплитуды миогенных колебаний свидетельствует о снижении колебательного компонента миогенного тонуса. Чем больше амплитуда этих колебаний, тем ниже миогенный компонент периферического сопротивления и, следовательно, лучше нутритивный кровоток. В работе Крупаткина А.И. (2007) с помощью одновременного применения ЛДФ и компьютерной капилляроскопии так же выявлена положительная корреляция нормированных амплитуд осцилляций собственно миогенного диапазона с числом функционирующих капилляров [49]. 107 При вычислении состояния перфузии по нутритивным и шунтовым путям выявлено достоверное улучшение нутритивного кровотока (р=0,003), снижение шунтового кровотока (р=0,0003) и ПШ (р<0,0001), (см. таблицу 5.9). Таблица 5.9 Динамика показателей перфузии у наблюдаемых больных Показатели До (на момент После р включения) (3 мес.) ПШ 1,6 [1,0;3,1] 1,0 [0,7;1,3] <0,0001 Мнутр., пф. ед. 1,1 [0,6;1,8] 1,3 [1,1;2,2] 0,003 Мшунт., пф. ед. 2,1 [1,3;2,9] 1,5 [1,1;2,1] 0,0003 При проведении дыхательной пробы у наблюдаемых пациентов ИДП оказался значительно выше 34,1% [23,9;56,8], чем до применения трайкора 27,5% [15,8;56,8], (р=0,008). Вероятно, все выше перечисленные изменения в МЦР связаны с сосудистыми эффектами активации PPAR-α, где главенствующую роль играет блокада действия нуклеарного фактора каппа би (NF-Κβ) и последующие эффекты: снижение активности сосудистого эндотелиального фактора роста (VEGF) и уменьшение степени пролиферации эндотелия сосудистой стенки; угнетение выработки фибриногена и ингибитора активатора плазминогена 1 типа (PAI-1); снижение выработки медиаторов воспаления, сопровождающееся угнетением активности тромбоцитов; снижением выработки молекул адгезии и эндотелина [104,113,119,130,148,170,187]. Перечисленные эффекты сопровождаются нормализацией функции эндотелия, улучшением эластических свойств сосудистой стенки, оптимизацией коагуляционной функции и, соответственно, улучшением микроциркуляции [171]. Для анализа временных связей используется подход, при котором МЦР рассматривается как динамическая система. В соответствии с теорией математического «хаоса» МЦР кровообращение представляет собой нелинейную 108 динамическую систему, которая характеризуется сильной чувствительностью поведения к начальным условиям [51]. При проведении анализа нелинейной динамики МЦР выявлено достоверное изменение показателей, таблица 5.10. Таблица 5.10 Анализ показателей нелинейной динамики у наблюдаемых пациентов Показатели До (на момент После включения) (3 мес.) D0 1,26 [1,18;1,31] 1,24 [1,14;1,35] 0,1 R/S 1,14 [1,0;1,3] 0,89 [0,72;0,98] 0,0005 H0 0,25 [0,23;0,29] 0,29 [0,25;0,35] 0,002 D2 1,17 [1,06;1,27] 1,25 [1,12;1,36] 0,01 Фрактальная размерность (D0) характеризует р иррегулярность или изрезанность, присущую ЛДФ-грамме, как видно из таблицы 5.10 у обследуемых пациентов на момент включения в исследование и через 3 месяца фрактальность менее 1,4, что соответствует влиянию на систему одного или нескольких факторов, изменяющих систему в одном направлении. Но тенденция (р=0,1) к снижению D0 свидетельствует о более устойчивой системе МЦР после лечения. Показатель Херста (R/S) дает понятие об изменении динамики перфузии во времени. Чем более регулярен процесс и чем более самоподобны осцилляции, тем меньше значение показателя [51]. До лечения у пациентов R/S больше 1, что говорит о слабом самоподобии в структуре ЛДФ-граммы, присутствии значительной нерегулярности. После лечения R/S достоверно (р=0,0005) снижается меньше 1, что совместно с показателем D0 свидетельствует об устойчивости системы с высоким самоподобием [51]. Достоверное увеличение энтропии (H0), которая характеризует степень хаотичности траекторий неопределенности динамических поведения системы систем [14], и совместно является с мерой увеличением 109 корреляционной размерности фазового портрета (D2) показывает, что изменение перфузии в МЦР после лечения более сложное, разнообразное и хаотичное, рис. 5.2. А1 А2 Б1 Б2 Рис. 5.2. Пример записи ЛДФ (1) и фазового портрета (2) пациентки П., 62 года. А – на момент включения в исследование, Б – после лечения. 5.3. Резюме На фоне проводимой терапии препаратом фенофибрат отмечалось достоверное улучшение субъективных симптомов ДПН в виде уменьшения 110 интенсивности жалоб на судороги, зуд кожи, жжение и боль в нижних конечностях по нейропатическим шкалам. При анализе показателей ЭНМГ отмечалось уменьшение времени прохождения импульса по терминалям аксонов двигательных волокон (n.Peroneus) и увеличение скорости распространения возбуждения по чувствительным волокнам (n.Suralis). Кроме того, наблюдалась положительная динамика субъективных симптомов ХВН по шкале VCSS, что возможно связано с улучшением микроциркуляции. Хотя базальный кровоток МЦР по данным ЛДФ достоверно не изменился, выявлена положительная динамика регуляции сосудистого тонуса. При вейвлет анализе получено достоверное снижение амплитуд пассивных колебаний и повышение амплитуды миогенных колебаний, что указывает на увеличение микроциркуляторного давления, снижение периферического сопротивления и улучшение венозного оттока. Состояние перфузии по нутритивным и шунтовым путям после лечения указывало на улучшение нутритивного кровотока за счет снижения кровотока по артериовенозным шунтам в обход микроциркуляторного русла. 111 Глава 6. Обсуждение результатов Сочетание сахарного диабета 2 типа и хронической венозной недостаточности определяется, как высокой распространенностью СД 2 типа в популяции, так и частотой развития ХВН. Пациенты с СД 2 типа особенно подвержены возникновению и прогрессированию ХВН, так как имеют общие факторы риска с ХЗВ. Однако особенности течения поражения нижних конечностей, влияние патогенетических факторов и осложнений, связанных с СД 2 типа на течение ХВН у пациентов с сочетанной патологией до конца не изучены. В нашей работе мы провели комплексную оценку негативного влияния СД 2 типа на поражение нижних конечностей у пациентов с ХВН, выявили особенности клинической картины у больных с сочетанной патологией, определили значимость как неспецифических, так и специфических факторов, ассоциированных с СД 2 типа на течение ХВН. Для решения поставленных задач обследовано 80 человек с ХВН. Все пациенты были разделены на две группы. Основная группа – 40 пациентов с сопутствующим СД 2 типа, контрольная группа – 40 больных без сахарного диабета. В ходе анализа клинических проявлений установлено, что СД 2 типа оказывает отягощающее влияние на поражение нижних конечностей у больных с сочетанной патологией в виде усиления трофических изменений, преобладание отечного синдрома, в отличие от пациентов без сахарного диабета, которых чаще беспокоила боль в нижних конечностях и варикозные изменения. Это подтверждается, как частотой субъективных клинических проявлений ХВН, так и их выраженностью по балльной ВАШ: отечный синдром (р=0,001), варикозные изменения (р=0,001), болевой синдром (р=0,0004), трофические изменения (р<0,0001). По клинической балльной шкале VCSS тяжесть субъективных 112 симптомов ХВН так же превалировала у пациентов с сахарным диабетом 9,2 3,2 баллов по сравнению с контрольной группой (6,2 2,7), (р<0,0001), по всем признакам, кроме болевого синдрома, который имел наибольшее распространение у пациентов без СД 2 типа (р=0,005). Более тяжелая степень тяжести ХВН по классификации, предложенной Совещанием Экспертов (Москва, 2000) наблюдалась у пациентов с СД 2 типа: ХВН 2 степени - 60%, (р=0,02), ХВН 3 степени - 32,5%, (р=0,01). В контрольной группе, наоборот, у 55% больных была выявлена ХВН 1 степени (р<0,0001). При анализе класса ХВН по международной классификации СЕАР при сочетанной патологии чаще встречались трофические формы заболевания вен: С4 – 42,5% (р=0,05), С5 – 25% (р=0,0007), без сопутствующего сахарного диабета варикозные изменения: класс С2 – 55% (<0,0001). При анализе жалоб пациентов с сочетанной патологией достоверно чаще беспокоили стойкие отеки (2 или 3 балла по VCSS) - 50%, (р=0,006), жжение в нижних конечностях - 75% против 20% в контрольной группе (р<0,0001), которое больше характерно не для ХВН, а для проявления ДПН. На боль в нижних конечностях чаще жаловались пациенты без диабета 87,5% против 60% в основной группе (р=0,005), что так же может быть следствием влияния ДПН. А вот судороги одинаково беспокоили как пациентов с СД 2 типа, так и без него (р=0,1). Такие неспецифические факторы, как длительность ХЗВ, ожирение, АГ и гиперкоагуляция отягощали клиническую картину ХВН в обеих группах. При наличии ХЗВ ≥10 лет установлены более тяжелые класс и степень тяжести ХВН (р=0,01), чаще отмечались трофические изменения нижних конечностей (р=0,01), преобладали субъективные симптомы ХВН по бальной шкале VCSS (р=0,01). Ожирение является общепринятым доказанным фактором риска развития ВБНК, увеличение индекса массы тела выше 27 кг/м2 повышает риск развития заболевания на 33 % [39]. Результаты нашего исследования показали, что у пациентов с ИМТ ≥30 кг/м2 выявлены более тяжелые класс и степень тяжести 113 ХВН (р=0,006), чаще трофические изменения кожи нижних конечностей (р=0,01), больше баллов по шкале VCSS (р=0,04). При этом, в группе с ИМТ ≥30 кг/м2 преобладали пациенты с СД 2 типа. На фоне ожирения чаще наблюдалась АГ. При увеличении степени АГ нарастали степень и класс тяжести ХВН (р<0,0001), чаще выявлялись трофические изменения (р<0,0001). Наряду с этим, у пациентов основной группы АГ диагностирована у 95%, в контрольной у 70% пациентов (р=0,003). Несмотря на то, что при анализе коагулограммы в группах отклонений показателей от нормы выявлено не было, у пациентов с СД 2 типа обнаружена склонность к гиперкоагуляции, по сравнению с больными без диабета: увеличение ПТИ (р=0,02), фибриногена (р=0,03), уменьшение МНО (<0,0001), АЧТВ (<0,0001) и ПТВ (р=0,0002), что по данным корреляционного анализа данных показателей и клинических характеристик ХВН усугубляла проявления последней. Длительность сахарного диабета достоверно коррелировала с трофическими изменениями ХВН по бальной ВАШ (r=0,6; p<0,0001), с субъективными проявлениями по шкале VCSS (r=0,46; р=0,002), с тяжестью клинического класса по классификации СЕАР (r=0,67; p<0,0001), а так же степенью ХВН (r=0,5; p=0,0006). Так же, выявлено преобладание ведущего трофического синдрома у пациентов основной группы, у которых диагноз СД предшествовал появлению ХВН – 76,9%, против группы пациентов с установленным диагнозом ХВН раньше СД – 29,6%, (р=0,004). Выявлено, что уровень компенсации сахарного диабета играет значительную роль в прогрессировании ХВН. Нарастание класса и степени тяжести ХВН, а также преобладание трофического синдрома увеличивались с увеличением уровня HbA1с, особенно в группе со значением HbA1с >10%. Изучая влияние поражения периферической нервной системы на ХВН у больных в сочетании с СД 2 типа и без него, полинейропатия нижних конечностей выявлена у 82,5% пациентов при сочетанной патологии и у 17,5% 114 больных без сопутствующего СД 2 типа (р<0,0001). Количественная оценка жалоб и субъективных симптомов по НСС, ОСС и выраженности нарушений иннервации нижних конечностей по шкале НДС показала существенно большую выраженность их у больных с диабетом, что подтверждается показателями индексов НСС (р<0,001), ОСС(р=0,004) и НДС (р<0,001), однако, данные нарушения периферической иннервации были выявлены и у больных без диабета. В результате корреляционного анализа в основной группе были выявлены положительные связи уровня НДС с классом тяжести ХВН по СЕАР (r=0,65, p<0,001), тяжестью ХВН (r=0,49, p=0,001), трофическими нарушениями по ВАШ (r=0,63, p<0,0001), субъективными симптомами по VCSS (r=0,59, p<0,0001), которые подтверждают патогенетическую роль нейрогенных нарушений в прогрессировании ХВН при сочетанной патологии. При исследовании липидного профиля больных с сочетанной патологией в сравнении с больными ХВН без диабета выявлена достоверно значимая атерогенная гиперлипидемия с увеличением уровня ОХС (р=0,006), ЛПНП (р=0,02) и ТГ (р=0,0005), что является известным закономерным изменением липидного спектра при диабете и оказывает негативное влияние на течение макроангиопатии. При корреляционном анализе у всех пациентов выявлены достоверные связи между ОХС и: трофическими изменениями по бальной ВАШ (r=0,24;р=0,03), шкалой НДС (r=0,32;р=0,003), а так же между ТГ и: тяжестью ХВН (r=0,25;р=0,02), субъективной шкалой VCSS (r=0,26;р=0,01), шкалами НДС (r=0,26;р=0,02) и НСС (r=0,31;р=0,007). Патологические процессы в сосудистом русле на макро- и микроуровне, характерные для СД 2 типа, являются необратимыми. В то же время, при отсутствии вторичных тромботических осложнений проходимость артериального русла, как правило, страдает незначительно, не приводя к развитию существенного перфузионного дефицита в кровоснабжаемых органах и тканях [97]. Ранняя доклиническая диагностика диабетической ангиопатии, то есть сочетание микро- и макроангиопатии, способствует предотвращению осложнений 115 и своевременному проведению комплекса адекватных лечебных и профилактических мероприятий [8,9,31,97]. При этом адекватная коррекция метаболических нарушений может привести к обратному регрессу сосудистых расстройств [149]. Ультразвуковое ангиосканирование является одним из основных методов выявления признаков диабетической ангиопатии и позволяет объективно оценивать структурные изменения стенок магистральных артериальных и венозных стволов [54,147,175]. Всем пациентам проведено УЗАС артерий и вен нижних конечностей. При исследовании венозной системы в обеих группах выявлены изменения характерные для варикозной болезни нижних конечностей. Однако, у пациентов с СД 2 типа чаще регистрировались двухстороннее поражение - в 100% случаев (р=0,002), несостоятельность перфорантных вен голени (р=0,02), СФС (р=0,0004) и СПС (р=0,04), а также более выраженная степень рефлюкса по БПВ (р=0,0006). При этом двухсторонняя несостоятельность СФС в основной группе выявлена у 57,5%, в контрольной группе у 17,5% (р=0,0003). Двухсторонняя несостоятельность перфорантных вен различной локализации выявлена у 85,7% пациентов с СД 2 типа и у 47,2% пациентов без диабета (р=0,01). У пациентов с сочетанной патологией выявлены корреляционные связи между длительностью СД 2 типа и несостоятельностью перфорантных вен (r=0,45, р=0,003), несостоятельностью СФС (r=0,48, р=0,001). Между HbA1с и несостоятельностью перфорантных вен (r=0,36, р=0,02), несостоятельностью СФС (r=0,32, р=0,04). А так же, между шкалой НДС и несостоятельностью перфорантных вен (r=0,5, р=0,001), несостоятельностью СФС (r=0,46, р=0,002); между трофическими нарушениями по балльной ВАШ и несостоятельностью перфорантных вен (r=0,36, р=0,02), несостоятельностью СФС (r=0,43, р=0,005). При этом, у пациентов с длительностью СД 10 лет и больше оказались более выраженные морфологические изменения венозной системы. Так, поражение глубоких вен выявлено только у больных с длительностью СД больше 10 лет – 24% (р=0,03), у всех установлены несостоятельность перфорантных вен 116 различной локализации – 100% (р=0,002) и СФС – 100% (р=0,002) , а степень рефлюкса по ВБП превышала как слева 3,9±0,4 (р=0,0003), так и справа 4,0±0 (р<0,0001). При сравнении групп пациентов с СД 2 типа в зависимости от уровня HbA1с в нашем исследовании было установлено, что тяжесть изменения венозной системы по данным УЗАС нижних конечностей усиливается при более высоких показателях HbA1c. Так, в группе с уровнем HbA1c 10% и более имелась тенденция к несостоятельности СФС (р=0,08) и чаще наблюдалась несостоятельность перфорантных вен голени (р=0,02), а так же более тяжелая степень рефлюкса по БПВ (р=0,02). Длительность течения ХВН так же оказывало негативное влияние на ультразвуковые морфо-функциональные изменения венозной системы: у пациентов с ХВН ≥10 лет чаще встречались двухстороннее поражение нижних конечностей (р=0,02), несостоятельность перфорантных вен (р=0,03), больше степень рефлюкса по БПВ (р=0,04) и тяжесть ХЗВ по CAD score (р=0,01). Наличие сопутствующей АГ способствовало двухстороннему поражению нижних конечностей (р=0,001), несостоятельности венозных клапанов (р=0,003), СФС (р=0,0008) и СПС (р=0,02), а также при нарастании степени АГ нарастала степень рефлюкса по БПВ (р<0,0001). У пациентов с СД особое внимание уделяется патологии системы гемореологии, как одному из факторов риска развития атеросклероза [30]. В нашем исследовании у всех пациентов выявлена достоверная связь показателей коагулограммы изменениями (ПТИ, венозной МНО, АЧТВ, системы, как ПТВ) с такими двухстороннее ультразвуковыми поражение вен, несостоятельность перфорантных вен различной локализации, несостоятельность СФС и СПС, степень рефлюкса по БПВ. Таким образом, ухудшение реологических параметров крови отягощает течение ХВН. Однако, у пациентов с сочетанной патологией и несостоятельностью перфорантных вен по данным УЗАС достоверно меньше МНО (р=0,0001), АЧТВ (р=0,0004) и ПТВ (р=0,004), 117 чем у больных в контрольной группе. А так же имеется тенденция к увеличению ПТИ (р=0,08) и фибриногена (р=0,05), что связано с особенностями нарушения гемостаза при СД 2 типа. Ожирение влияло не только на клиническую характеристику ХВН, но и на ультразвуковые изменения венозной системы. У пациентов с ИМТ ≥30 кг/м 2 чаще было выявлено двухстороннее поражение нижних конечностей (р=0,01), поражение глубокой венозной системы (р=0,001), несостоятельность перфорантных вен голени (р=0,008), больше баллов по CAD score (р=0,007). В настоящее время общеизвестно, что СД является одним из независимых факторов развития атеросклероза, а гипергликемия считается пусковым фактором в развитии любого сосудистого осложнения при СД [95]. В нашем исследовании оценивались различные проявления диабетической макроангиопатии: нарушение жесткости сосудистой стенки крупных артерий мышечно-эластического типа (ОБА), структурная перестройка сосудистой стенки (комплекса интима-медиа) различных сегментов артерий нижних конечностей, включая артерии крупного (ОБА), среднего (ПБА и ПА) и малого (ЗББА, ПББА) калибра, изменение толщины КИМ в исследованных артериях, наличие и степень выраженности стенозирующего атеросклеротического поражения, которое ряд авторов [71,84] включают в комплекс диабетической макроангиопатии. Атеросклеротические изменения по данным УЗАС выявлены у 55% пациентов с сочетанной патологией и у 10% без диабета (р<0,0001). У пациентов с СД 2 типа и макроангиопатией нижних конечностей установлена более тяжелые степень (р=0,0004) и класс (р<0,0001) ХВН, клинически преобладали трофические изменения нижних конечностей (р=0,001), чаще выявлены несостоятельность перфорантных вен (р=0,007) и СФС (р=0,0005), выше степень рефлюкса по БПВ (р=0,004) и тяжесть ХЗВ по САD score (р=0,04). Частота выявления стенозирующего атеросклероза различной степени выраженности артерий нижних конечностей так же была больше у пациентов с сочетанной патологией 27,5% (р=0,001). Степень стеноза коррелировала с 118 классом (r=0,55,р=0,0002) и степенью (r=0,56,р=0,0001) тяжести ХВН, с трофическими изменениями по ВАШ (r=0,44,р=0,0004), с субъективными симптомами ХВН по шкале VCSS (r=0,53,р=0,0004), с проявлениями ДПН по шкале НДС (r=0,5,р=0,0008); а так же с морфологическими изменениями венозной системы по данным УЗАС: несостоятельность клапанов глубоких вен (r=0,36,р=0,02), несостоятельность перфорантных вен различной локализации (r=0,33,р=0,04), несостоятельность СФС (r=0,39,р=0,01) и СПС (r=0,38,р=0,01). Возрастная инволюция в большей степени реализуется изменениями эластического каркаса сосудистой стенки [80]. Токсическое воздействие, обусловленное курением, преимущественно модифицирует структуру и функцию эндотелиальной выстилки [107,111,174]. Половые различия определяют особенности развития атеросклеротического процесса, который у мужчин встречается чаще, чему женщин, в более раннем возрасте [54,108]. Метаболические факторы, связанные с сахарным диабетом, реализуют свое влияние через изменения гладкомышечных элементов сосудистой стенки [84]. При расчете модифицированного ИК степень ремоделирования сосудистой стенки преобладала у пациентов с сочетанной патологией: 0,16±0,06 против пациентов без СД 0,09±0,02 (<0,0001). Основной причиной этого, по всей видимости, являются структурные нарушениям медии, ограничивающие функциональные возможности гладкомышечных элементов сосудистой стенки, которые обеспечивают компенсаторное расширение артерий. Таким образом, при СД 2 типа создаются условия для ограничения уровня объемного притока крови и развития гемодинамических нарушений. Выявлена взаимосвязь ИК с длительностью СД (r=0,51, р=0,0007) и HbA1c (r=0,32, р=0,04), с классом (r=0,43, р=0,005) и тяжестью (r=0,39, р=0,01) ХВН, трофическими изменениями по ВАШ (r=0,35, р=0,02), с шкалой VCSS (r=0,41, р=0,008) и НДС (r=0,46,р=0,002), а так же с несостоятельностью перфорантных вен (r=0,46,р=0,002), СФС (r=0,43,р=0,005) и степенью рефлюкса по БПВ (r=0,38,р=0,03). 119 Общеизвестно, что дислипидемия вносит существенный вклад в функциональную активность тромбоцитов. Увеличение содержания ОХС, и ЛПНП при дислипидемии вызывают патологическое усиление выделения тромбоксана А2 с повышением агрегации тромбоцитов. В нашем исследовании были выявлены достоверные корреляции между показателями липидного обмена и ультразвуковыми изменениями артерий нижних конечностей: ОХС и ИК (r=0,26, p=0,01), ТГ и ИК (r=0,34, p=0,001), ТГ и кальциноз сосудистой стенки (r=0,24, p=0,03), ТГ и окклюзия артерии (r=0,24, p=0,02). А так же выявлено негативное влияние нарушений липидного обмена (повышение ОХС, ТГ и ЛПНП) на проведение нервного импульса по данным ЭНМГ: снижение амплитуды М – ответа по двигательным волокнам (р=0,006), снижение СРВ (р=0,004) и амплитуды ПД по чувствительным волокнам (р=0,002). Таким образом, атерогенная дислипидемия является важным фактором развития поражения периферических артерий и нарушения иннервации нижних конечностей, что в свою очередь приводит к прогрессированию ХВН у пациентов с СД 2 типа. В работе Арутюняна Н.М. (2008г.) было показано, что состояние периферической сосудистой реактивности напрямую взаимосвязано со структурной перестройкой сосудистой стенки, сопряженной с комплексом нарушений при СД 2 типа [3]. Мы проанализировали периферическое сопротивление артерий нижних конечностей по значению резистивного индекса – RI и у больных с сочетанной патологией он оказался достоверно выше в дистальных артериях: ЗББА (р=0,002), ПББА (р<0,0001), ТАС (р=0,0002), что свидетельствует о ригидности сосудистой стенки у пациентов с СД 2 типа. При этом, у пациентов с сопутствующей диабетической полинейропатией были более высокие значения RI, КИМ, что подтверждает влияние нейропатии на состояние стенки артерий и периферическое сопротивление сосудов при СД 2 типа. Полученные нами результаты соответствуют другим экспериментальным и морфологическими диабетической данным, что макроангиопатии присутствует и определенная микроангиопатии. зависимость Диабетическая 120 микроангиопатия способствует формированию макроангиопатии в связи с первичной локализацией поражений в vasa vasorum сосудистой стенки [84]. Диабетическая микроангиопатия имеет более распространенный характер и усугубляет течение и прогноз при макроангиопатии. Результаты сопоставительного анализа с расчетом коэффициента ранговой корреляции Спирмена продемонстрировали положительную связь между RI дистальных артерий (ЗББА, ПББА, ТАС) и такими показателями ХВН у пациентов с СД 2 типа, как класс и тяжесть ХВН, трофические изменения нижних конечностей, субъективные проявления ХВН по VCSS, степень рефлюкса по БПВ, несостоятельность перфорантных вен и СФС, а так же шкалой НДС. При анализе влияния ДПН на поражение нижних конечностей у пациентов с сочетанной патологией по данным ЭНМГ было выявлено, что достоверно более выраженные нарушения по двигательным нервам встречаются у пациентов с трофическими изменениями, обусловленными ХВН, с несостоятельностью перфорантных вен различной локализации, что еще раз подтверждает значительную роль ДПН в поражении нижних конечностей у больных СД 2 типа в сочетании с ХВН. Вопрос о состоянии кожной микроциркуляции в нижних конечностях у больных сахарным диабетом и ее взаимосвязи с полинейропатией изучается достаточно давно, однако, несмотря на большое число исследований, многое остается неясным. В первую очередь, это относится к пациентам с сахарным диабетом 2 типа. Изучая поражение нервной системы, исследователям приходится пользоваться косвенными методами, т.к. биопсия нервных волокон, микроскопия или флоуметрия vasa nervorum сложны и, нередко, невозможны. Это в полной мере относится к оценке вклада микроциркуляторных нарушений, как проявления генерализованной эндотелиальной дисфункции в развитие полинейропатии, и, наоборот, влияния нейрогенных механизмов на сосудистую реактивность. Особенностью нашего исследования является изучение кожного кровотока при сочетанной патологии, так как при ХВН так же поражаются сосуды 121 микроциркуляторного русла. Анализ базального кровотока с помощью ЛДФ показал, что у больных с сочетанной патологией достоверно выше показатель М 3,7±2,2, пф. ед. (р = 0,01) и М эфф. - 59,7 [42,6;85,4] пф. ед.2 (р = 0,002), что свидетельствует о застое крови в артерио-венулярном звене, большем нарушении капиллярного кровотока и более значимой ишемии, чем у пациентов без СД 2 типа. При этом коэффициент вариации больше в контрольной группе – 26,2% [16,3;42,6], чем в основной: Kv = 18% [12,5;31,1], (р=0,02), что указывает на компенсаторную активацию механизмов контроля перфузии и улучшение микроциркуляции в динамике у пациентов без СД. При анализе показателя шунтирования статистически достоверной разницы по группам не выявлено, но у пациентов с сочетанной патологией оказался вариант шунтирования кровотока за счет перераспределения перфузии в микрососудах, а у пациентов без диабета - за счет различия перфузии микрососудов и более крупных сосудистых сегментов, что подтверждается преобладанием показателя кровотока по АВА (Мшунт = 2,1[1,3;2,7], (р=0,04)) у пациентов с СД 2 типа, который ухудшает состояние перфузии в капиллярном русле. При корреляционном анализе выявлена связь между показателем М и трофическими изменениями нижних конечностей обусловленными ХВН (r=0,37,р=0,04) у пациентов с сочетанной патологией. Колебания кровотока имеют не только гемодинамическое регуляторное значение, но и являются носителем информации в МЦР [53]. Процесс передачи информации в микрососудистых сетях может осуществляться через ряд каналов, как внешних, так и внутренних. К внешним можно отнести нейрогенные, гемодинамические (кардиальные, дыхательные венулярные), эндотелиальные; внутренние - связанны с собственной активностью миоцитов сосудистой стенки (миогенные). Для изучения информационных процессов в микроциркуляторном русле мы применяли анализ вейвлет-спектра колебаний кровотока. Достоверной разницы между максимальными амплитудами активных и пассивных факторов регуляции у пациентов с СД 2 типа и без него выявлено не было. Однако, у больных с сочетанной патологией преобладала амплитуда колебаний 122 эндотелиального частотного диапазона (р=0,08), что возможно связано с большей эндотелиальной дисфункцией у них. А так же, при сравнении амплитуд осцилляций в основной группе максимальными были колебания эндотелиального и нейрогенного диапазонов, что свидетельствует о снижении нутритивного кровотока и преобладании кровотока по АВА. У пациентов с СД 2 типа при корреляционном анализе установлена связь между HbA1c и Аэ. (r=0,53;р=0,04). Так же, у больных с сочетанной патологией и несостоятельностью перфорантных вен различной локализации преобладала амплитуда колебаний дыхательного частотного диапазона 12,8 [9,6;14,8] пф.ед., по сравнению с пациентами, у которых не выявлена несостоятельность перфорантных вен по данным УЗАС 5,6 [4,4;6,7], (р=0,04), что указывает на более низкое давление в МЦР и ухудшение венозного оттока у больных с сочетанной патологией. Это подтверждается положительной корреляционной связью в основной группе между HbA1c и Ад. (r=0,4;р=0,02). В процессе развития микроангиопатии при сахарном диабете имеет значение нарушение гемостаза с изменением реологических свойств крови. В нашем исследовании у пациентов основной группы выявлены достоверные корреляции между ПТИ и: показателем перфузии М (r= 0,53, p=0,04), Кv (r= -0,48, p=0,02), Мнутр. (r= -0,55, p=0,03), что свидетельствует о нарушении кровотока в микроциркуляторном русле при повышении вязкости крови. У пациентов контрольной группы достоверных связей между показателями коагулограммы и МЦР выявлено не было. Возможно, это связано с тем, что при СД имеет место не только изменение реологических свойств крови, но и дополнительно изменение самой сосудистой стенки (микроангиопатия). Таким образом, у пациентов с сочетанной патологией имеются дополнительные специфические факторы, которые оказывают влияние на клинические проявления ХЗВ и ультразвуковые морфофункциональные изменения венозной системы, в целом отягощающие течение ХВН, рис. 6.1. 123 Рис. 6.1. Специфические факторы, усугубляющие течение ХВН у пациентов с сочетанной патологией Проведено открытое контролируемое проспективное исследование влияния фенофибрата на поражение нижних конечностей у пациентов с СД 2 типа и ХВН. Для этого, 15 пациентам основной группы назначался препарат Трайкор в дозе 145 мг 1 раз в день перорально в течении 3 месяцев в дополнение к исходной гипогликемизирующей терапии. У пациентов выявлено достоверное уменьшение жалоб на судороги (р=0,04), зуд кожи (р=0,02), жжение (р=0,01) и боль в нижних конечностях (р=0,02), что свидетельствует о снижении субъективной симптоматики ДПН и ХВН. Это подтверждается уменьшением интенсивности ДПН по шкалам НДС (р=0,003), НСС (р=0,001), ОСС (р=0,001) и интенсивности ХВН по шкале VCSS (р=0,002). При лабораторном исследовании липидного обмена, применение трайкора привело к уменьшение выраженности атерогенной 124 дислипидемии (снижение ОХС (р=0,007), ТГ (р=0,001), повышение ЛПВП (р=0,08)). Имеются данные, что активации PPAR-α может снижать риск развития атеросклероза как за счет непрямого воздействия на метаболизм жировой ткани, скелетных мышц и печени, так и за счет непосредственного действия на эндотелиальные, гладкомышечные клетки сосудистой стенки [55]. Анализируя показатели ЭНМГ исследования, установлено уменьшение времени прохождения импульса по терминалям аксонов двигательных волокон (n.Peroneus=2,1±0,5 мс (р=0,04)) и увеличение скорости распространения возбуждения по чувствительным волокнам (n.Suralis=42,4 [36,2;45,4] м/с (р=0,02)). Возможно, как опубликовано в работе Ganessaratem К. и соавт. (2005г), за счет блокирования фенофибратом фермента альдозоредуктазы, что играет важную роль в защите от прогрессирования ДПН [136]. По данным ЛДФ показатель кожной перфузии М достоверно не изменился, но выявлено увеличение Кv (р=0,008) в сочетании с повышением σ (р=0,02), что связано с усилением активных механизмов контроля. И при вейвлет-анализе установлено, что именно за счет повышения амплитуды миогенных колебаний (р=0,007) и снижения пассивных факторов регуляции: Ад. (р=0,03) и Ас. (р=0,02). Это свидетельствует об улучшении нутритивного кровотока, увеличении числа функционирующих капилляров и вне капиллярной перфузии микрососудов региона ткани, а так же указывает на увеличение микроциркуляторного давления и улучшение венозного оттока. Состояние перфузии по нутритивным и шунтовым путям после лечения указывало на улучшение нутритивного (р=0,003) кровотока за счет снижения шунтового (р=0,0003). Показатель шунтирования так же достоверно снизился после лечения (р<0,0001). Имеются данные, что фенофибрат улучшает микроциркуляцию в сосудах за счет снижения агрегации тромбоцитов, вязкости крови и синтеза фибриногена [55]. Так же, возможно за счет антивоспалительной, антипролиферативной рецепторов PPAR-α [55]. и антиоксидантной активности 125 При проведении дыхательной пробы ИДП оказался значительно выше после лечения 34,1%, чем до применения трайкора 27,5% (р=0,008), что свидетельствует об улучшении реактивности микрососудов, возможно, как за счет нормализации регуляторных систем кровотока, так и за счет улучшения эластических свойств сосудистой стенки. Возможно, в данном случае и за счет улучшения эндотелийзависимой сосудистой реактивности, которую улучшает фенофибрат [106]. При проведении анализа нелинейной динамики МЦР установлено, что после лечения у пациентов более устойчивая система с высоким самоподобием и изменение перфузии в МЦР более сложное, разнообразное и хаотичное. Таким образом, лечение фенофибратом способствует уменьшению субъективных ощущений ДПН, улучшению проведения возбуждения по двигательным и чувствительным волокнам, улучшению кровотока в МЦР и положительно влияет на течение ХВН в исследуемой когорте пациентов. Выводы 1. Сахарный диабет 2 типа усугубляет тяжесть хронической венозной недостаточности у больных с сочетанной патологией, что обусловлено большей частотой неспецифических факторов, таких как ожирение, артериальная гипертония, дислипидемия, гиперкоагуляция, и наличием дополнительных факторов, ассоциированных с диабетом. У пациентов с сахарным диабетом 2 типа преобладают отечный синдром и трофические изменения нижних конечностей. У пациентов без сопутствующего сахарного диабета ведущими клиническими синдромами являются болевой и варикозные изменения. Более тяжелая степень и класс ХВН наблюдалась у пациентов с СД 2 типа: ХВН 2 степени - 60%, (р=0,02), ХВН 3 степени 32,5%, (р=0,01), класс С4 – 42,5% (р=0,05), С5 – 25% (р=0,0007), по сравнению с контрольной группой, у которых в 55% случаев была выявлена ХВН 1 степени (р<0,0001) и класс С2 – 55% (<0,0001). 126 2. Декомпенсация углеводного обмена (HbA1c > 10 %), длительность сахарного диабета более 10 лет и сопутствующая диабетическая макроангиопатия нижних конечностей у больных с сочетанной патологией ассоциированы с большей частотой несостоятельности сафено-феморального соустья и перфорантных вен голени, выраженными трофическими изменениями и, как следствие, с более высокой степенью тяжести хронической венозной недостаточности. Ремоделирование и ригидность артериальной сосудистой стенки по данным ультразвукового ангиосканирования усугубляют как клиническую картину ХВН, так и морфо-функциональные нарушения венозной системы. 3. Диабетическая сенсомоторная полинейропатия нижних конечностей у пациентов с сахарным диабетом 2 типа является важным патогенетическим механизмом отягощения проявляющимся в более хронической частом венозной обнаружении недостаточности, несостоятельности перфорантных вен, сафено-феморального соустья и большей степенью рефлюкса по большой подкожной вене по данным ультразвукового ангиосканирования и трофических изменений, отчасти, маскирующимся менее выраженным болевым синдромом. По данным ЭНМГ снижение амплитуды М-ответа по n. Tibialis и скорость распространения возбуждения по n. Peroneus ассоциируются с трофическими нарушениями и несостоятельностью перфорантных вен голени. 4. Наличие диабетической микроангиопатии нижних конечностей усугубляет микроциркуляторные изменения, обусловленные хронической венозной недостаточностью, что способствует развитию трофических изменений и прогрессированию венозной патологии. У пациентов с сочетанной патологией нарушения в микроциркуляторном русле характеризуются повышением амплитуды колебаний дыхательного частотного диапазона, снижением нутритивного кровотока, усилением кровотока по 127 артериовенозным шунтам, что приводит к большему венозному стазу и нарушению капиллярной перфузии, чем у пациентов без СД 2 типа. 5. Лечение фенофибратом способствует уменьшению субъективных ощущений ДПН, улучшению проведения возбуждения по двигательным и чувствительным волокнам, улучшению кровотока в микроциркуляторном русле и положительно влияет на течение хронической венозной недостаточности нижних конечностей в исследуемой когорте пациентов. Практические рекомендации 1. Необходима оптимизация контроля гликемии в соответствии с индивидуальными целевыми значениями HbA1c для снижения темпов прогрессирования ХВН у больных сочетанной патологией. 2. Рекомендуется проводить ЭНМГ и ультразвуковое ангиосканирование артерий нижних конечностей с целью раннего выявления диабетической макроангиопатии и полинейропатии, с соответствующей коррекцией данных осложнений. 3. Пациенты с ХВН в сочетании с СД 2 типа нуждаются в комплексном контроле таких метаболических нарушений, как ОХС, ТГ, ЛПНП, показателей гемостаза, а также коррекции массы тела и АГ, патологическое воздействие которых усугубляет течение ХВН у данной категории пациентов. 4. У больных с сочетанной микроциркуляторном русле, патологией с диабетической нарушением кровотока полинейропатией в нижних конечностей эффективным может оказаться применение фенофибрата. 128 Список литературы 1. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Вып. 6 / под ред. И.И. Дедова, М.В. Шестаковой. – 6-е изд., доп. – М. : Б.и., 2013. – 120 с. 2. «Алпростан» в лечении больных с критической ишемией нижних конечностей / A.B. Покровский, В.Н. Дан, А.В. Чупин, А.А. Калинин // Ангиология и сосудистая хирургия. – 2005. – № 11. – С. 7-10. 3. Арутюнян, Н.М. Комплексное ультразвуковое исследование в диагностике клинически асимптомных ангиопатий при сахарном диабете второго типа : дис. ... канд. мед. наук : 14.00.19 / Н.М. Арутюнян. – М., 2008. – 105 с. 4. Аскерханов, Р.П. Варикоз, тромбоз, псевдоварикоз вен конечностей / Р.П. Аскерханов. – Махачкала : Медицина, 1969. – 268 с. 5. Бабаджанов, Б.Р. Комплексная терапия длительно незаживающих трофических язв / Б.Р. Бабаджанов // Хирургия. – 1998. – № 4. – С. 42-45. 6. Баешко, А.А. Риск и профилактика тромбоза глубоких вен нижних конечностей в абдоминальной хирургии / А.А. Баешко, Т.П Шорох, А.В. Сысов // Вестник хирургии им. И.И. Грекова. – 1996. – Т. 155, № 3. – С. 34 39. 7. Балаболкин, М.И. Диабетическая невропатия / М.И. Балаболкин, В.М. Креминская // Журнал неврологии и психиатрии. – 2000. – Т. 100, № 3. – С. 57-65. 8. Балаболкин, М.И. Диабетология / М.И. Балаболкин. – М : Медицина, 2002. – 474 с. 9. Балаболкин М.И. Дифференциальная диагностика и лечение эндокринных заболеваний : руководство / М.И. Балаболкин, Е.М. Клебанова, В.М. Креминская. – М : Медицина, 2002. – 752 с. 10. Балаболкин, М.И. Микроангиопатия – одно из сосудистых осложнений сахарного диабета [Электронный ресурс] / М.И. Балаболкин, Е.М. Клебанова, 129 В.М. Креминская // Consilium Medicum. – 2000. – № 5. – Режим доступа: http://www.consilium-medicum.com. 11. Балаболкин, М.И. Роль окислительного стресса в патогенезе сосудистых осложнений диабета (лекция) / М.И. Балаболкин, Е.М. Клебанова // Проблемы эндокринологии. – 2000. – Т. 46, № 6. – С. 29-34. 12. Баркаган, З.С. Клинико-патогенетические варианты, номенклатура и основы диагностики гематогенных тромбофилий / З.С. Баркаган // Проблемы гематологии и переливания крови. – 1996. – № 3. – С. 5-15. 13. Бауэрзакс, Ж. Патофизиология хронической венозной недостаточности / Ж. Бауэрзакс, И. Флеминг, Р. Буссе // Флеболимфология. – 1998. – № 7. – С. 1-7. 14. Бекман, И.Н. Информатика : курс лекций. Лекция 8. «Энтропия и информация» [Электронный ресурс] / И.Н. Бекман. – М.-Рим, 2009. –– Режим доступа: http://profbeckman.narod.ru/InformLekc.htm 15. Богачев, В.Ю. Новые технологии диагностики и лечения варикозной болезни нижних конечностей : дис. ... д-ра мед. наук : 14.00.44 / В.Ю. Богачев. – М., 1999. – 357 с. 16. Богачев, В.Ю. Современные методы хирургического лечения варикозной болезни, осложненной трофическими расстройствами / В.Ю. Богачев, И.А. Золотухин // Флеболимфология. – 1996. – № 2. – С. 5-9. 17. Богачев, В.Ю. Хронические заболевания вен нижних конечностей: от патогенеза к лечению и профилактике / В.Ю. Богачев // Ангиология и сосудистая хирургия. – 2008. – Т. 14, № 2. –С. 65-72. 18. Богданец, Л.И. Фармакотерапия хронической венозной недостаточности / Л.И. Богданец, В.Ю. Богачев // Флеболимфология. – 1998. – № 9. – С. 9-12. 19. Бредихин, Р.А. Ультразвуковое ангиосканирование в диагностике и выборе метода лечения варикозной болезни и ее рецидивов : дис. ... канд. мед. наук : 14.00.27 / Р.А. Бредихин. – Казань, 2012. – 116 с. 20. Варшавский, И.М. Иммунологический аспект хронической венозной недостаточности / И.М. Варшавский, Т.Л. Ратнер, Н.Я. Шабанов // 130 Повторные реконструктивные сосудистые операции, актуальные вопросы флебологии. Ч. 2. – Ярославль : Б.и., 1990. – С. 18-19. 21. Вербовая, Н.И. Роль гликозилированных продуктов метаболизма в формировании сосудистых осложнений сахарного диабета / Н.И. Вербовая, Е.Н. Лебедева // Проблемы эндокринологии. – 1997. – Т. 43, № 1. – С. 43-46. 22. Гавриленко, A.B. Хирургическое лечение начальных форм варикозного расширения вен нижних конечностей / A.B. Гавриленко, П.Е. Вархатьян // Хирургия. – 2005. – № 4. – С. 42-44. 23. Галенок, В.А. Гемореология при нарушениях углеводного обмена / В.А. Галенок, Е.В. Гостинская, В.Е. Диккер. – Новосибирск : Б.и., 1987. – 86 с. 24. Гаркави, JI.X. Адаптационная терапия. Антистрессорные реакции активации и тренировки и их использование для оздоровления, профилактики и лечения / JI.X. Гаркави. – Ростов н/Д : Изд-во Рост. университета, 2006. – 256 с. 25. Густов, А.В. Неврологическое проявление артериальной гипертонии: диагностика, лечение / А.В. Густов, А.А. Смирнов, Н.И. Жулина. – Н. Новгород : Изд-во НижГМА, 1998. – 44 с. 26. Гущин, А.Г. Оценка комплекса гемореологических параметров при эритроцитозе / А.Г. Гущин, А.В. Муравьев, И.К. Шаечкина // Физиология человека. – 2000. – Т. 26. № 2. – С. 111-114. 27. Дедов, И.И. Сахарный диабет / И.И. Дедов, М.В. Шестакова. – М. : Универсум Паблишинг, 2003. – 455 с. 28. Демидова, И.Ю. Диабетическая дистальная полинейропатия / И.Ю. Демидова, В.Н. Храмилин, О.Ю. Игнатова // Эндокринная хирургия. – 2008. – № 1. – С.29-39. 29. Диабетическая стопа / А.П. Калинин [и др.]. – Бишкек : Б.и., 2002. – 283 с. 30. Диагностика и лечение больных с заболеваниями периферических артерий : рекомендации Российского общества ангиологов и сосудистых хирургов. – М. : Б.и., 2007. – 112 с. 131 31. Ефимов, А.С. Диабетические ангиопатии / А.С. Ефимов – М. : Медицина, 1989. – 288 с. 32. Ефимов, А.С. Некоторые итоги и перспективы развития диабетологии / А.С. Ефимов // Проблемы эндокринологии. – 1988. –№ 3. – С. 8-14. 33. Зак, К.П. Иммунитет у детей больных сахарным диабетом / К.П. Зак, Т.Н. Малиновская, Н.Д. Тронько. – Киев : Книга плюс, 2001. – 112 с. 34. Захбар М.Р. Клинико-патогенетические особенности сахарного диабета 2 типа у женщин в пери- и постменопаузе, пути фармакологической коррекции : автореф. дис. ... канд. мед. наук : 14.00.05 / М.Р. Захбар. – Ростов н/Д, 2003. – 26 с. 35. Зинчук, В.В. Деформируемость эритроцитов: физиологические аспекты / В.В. Зинчук // Успехи физиологических наук. – 2001. – Т. 32, № 3. – С. 66-78. 36. Иванов К.П. Успехи и спорные вопросы в изучении микроциркуляции / К.П. Иванов // Российский физиологический журнал им. И. М.Сеченова. – 1995. – № 6. – С. 11-17. 37. Иммунный статус и инсулинорезистентность у больных метаболическим синдромом / Е.А. Якименко [и др.] // Аллергология и иммунология. – 2009. – Т. 10, № 2. – С. 268. 38. Кириенко, А.И. Можно ли предотвратить развитие трофической язвы при варикозной болезни? / А.И. Кириенко, Л.И. Богданец, И.А. Золотухин // Справочник поликлинического врача. – 2007. – Т. 5, № 3. – С. 3-6. 39. Кириенко А.И. Современные принципы лечения хронических заболеваний вен нижних конечностей / А.И. Кириенко, Р.А. Григорян, И.А. Золотухин // 80 лекций по хирургии. – М. : Б.и., 2008. – С. 3-11. 40. Ковалева, Т.В. Опыт применения лазерной терапии у больных сахарным диабетом с дислипидемией / Т.В. Ковалева // Проблемы эндокринологии. – 2002. – Т.48, № 1. – С. 13-17. 41. Колебательный контур регуляции числа функционирующих капилляров / А.И. Крупаткин, В.В. Сидоров, А.А. Федорович, С.А. Ефимочкин, В.Т. 132 Зейналов // Регионарное кровообращение и микроциркуляция. – 2006. – № 3. – С. 54-58. 42. Колесникова, Р.С. Лечение заболеваний вен у женщин / Р.С. Колесникова. – М. : Медицина, 1977. – 185 с. 43. Котов, С.В. Диабетическая нейропатия / С.В. Котов, А.П. Калинин, И.Г. Рудакова. – 2-е изд., перераб. – М. : ООО Изд-во Медицинское информационное агентство, 2011. – 440 с. 44. Котов, C.B. Полинейропатия: диагностические и лечебные аспекты / С.В. Котов, М.А. Лобов // Полинейропатия – комплексная проблема современной медицины : материалы конф. – М. : Б.и., 2001. – С. 3-19. 45. Кошель, Л.В. Роль фенофибрата в лечении микрососудистых осложнений сахарного диабета 2 типа / Л.В. Кошель, Т.И. Романцова // Сахарный диабет. – 2009. – № 4. – С. 106-110. 46. Кошкин, В.М. Диабетическая ангиопатия : пособие для врачей / В.М. Кошкин, A.C. Аметов. – М. : Б.и., 1999. – 32 с. 47. Краковский, Н.И. Вопросы этиологии и патогенеза варикозно расширенных вен нижних конечностей / Н.И. Краковский, Р.С. Колесникова, И.И. Колкер // Хирургия. – 1973. – № 10. – С.42-48. 48. Кроновер С. Фракталы и хаос в динамических системах / С. Кроновер. – М : Техносфера, 2006. – С. 12, С. 144. 49. Крупаткин А.И. Динамический колебательный контур регуляции капиллярной гемодинамики / А.И. Крупаткин // Физиология человека. – 2007. – Т. 33, № 5. – С. 93-101. 50. Крупаткин, А.И. Колебательные структуры кровотока отражают динамику информационных процессов в микрососудистых сетях / А.И. Крупаткин // Физиология человека. – 2010. – Т. 36, № 2. – С. 101-113. 51. Крупаткин, А.И. Функциональная микроциркуляторно-тканевых систем. диагностика Колебания, состояния информация, 133 нелинейность : руководство для врачей / А.И. Крупаткин, В.В. Сидоров. – М. : ЛИБРОКОМ, 2013. – 496 с. 52. Кудыкин М.Н. Комплексное лечение больных с хронической венозной недостаточностью : дис. ... д-ра мед. наук : 14.00.27 / М.Н. Кудыкин. – М., 2009. – 263 с. 53. Куликова А.Н. Облитерирующий атеросклероз нижних конечностей на фоне сахарного диабета II типа (этиопатогенез, клиника, диагностика, хирургическое и медикаментозное лечение, профилактика) : дис. ... д-ра мед. наук : 14.00.27 / А.Н. Куликова. – Саратов, 2009. – 376 с. 54. Лелюк, В.Г. Ультразвуковая ангиология / В.Г. Лелюк, С.Э. Лелюк. – 3-е изд. – М. : Реальное время, 2007. – 416 с. 55. Липатов, Д.В. Механизм «нелипидного» действия фенофибрата при диабетической ретинопатии / Д.В. Липатов // Эффективная фармакология. Эндокринология. – 2010. – № 6. – С. 36-39. 56. Лосев, Р.З. Протокол ультразвукового исследования магистральных артерий нижних конечностей у больных сахарным диабетом / Р.З. Лосев, А.Н. Куликова, Л.А. Тихонова // Стандартизация медицинских технологий, реабилитация в ангиологии и сосудистой хирургии : материалы Всероссийской науч.-практ. конф. – Новокузнецк : Б.и., 2006. – С. 23-24. 57. Макаров, Н.А. Восстановление функции клапанного аппарата магистральных вен при хронической венознойнедостаточности нижних конечностей неокклюзионного генеза / Н.А. Макаров, А.Э. Клецкин, В.Н. Макаров // Ангиология и сосудистая хирургия. – 1996. – № 2. – С. 80-81. 58. Моисеев, С.В. Ожирение / В.С. Моисеев // Клиническая фармакология и терапия. – 2002. – № 5. – С. 64-72. 59. Моисеев, В.С. Симпатическая нервная система и метаболический синдром / В.С. Моисеев, В.В. Фомин // Клиническая фармакология и терапия. – 2004. – № 4. – С. 70-74. 134 60. Национальные рекомендации ВНОК по диагностике и лечению стабильной стенокардии (второй пересмотр) // Кардиоваскулярная терапия и профилактика. – 2008. – № 7, Прил. 4. 61. Национальные рекомендации РКО, ВНОА и АССХ по диагностике и лечению фибрилляции предсердий // Российский кардиологический журнал. – 2013. - № 4 (102), Прил. 3. 62. Недосугова, Л.В. Новые стратегии в лечении сахарного диабета 2 типа / Л.В. Недосугова //Эндокринология. – 2004. – № 12. –С. 732-736. 63. Панкин, В.З. Свободнорадикальные процессы в норме и при заболеваниях сердечно-сосудистой системы / В.З. Панкин, А.К. Тихазе, Ю.Н. Беленков. – М. : Б.и., 2000. – 135 с. 64. Покровский, A.B. Хроническая венозная недостаточность нижних конечностей /A.B. Покровский, C.B. Сапелкин // Ангиология и сосудистая хирургия. – 2003. – Т. 9, № 1. – С. 53-58. 65. Реброва, О.Ю. Статистический анализ медицинских данных / О.Ю. Реброва. – М. : МедиаСфера, 2002. – 312 с. 66. Рецидивы варикозной болезни. Диагностика и лечение / И.М. Игнатьев, Р.А. Бредихин, Л.И. Сафиуллина, Т.Н. Обухова // Вестник МКДЦ. – 2002. – С.100106. 67. Роль клапанной рецидивировании недостаточности варикозной бедренной болезни нижних вены в течении конечностей / и A.B. Гавриленко, В.А. Сандриков, П.Е. Вархатьян [и др.] // Ангиология и сосудистая хирургия. – 2006. – Т. 12. № 3. – С. 61-65. 68. Роль недостаточности клапанов глубоких вен в развитии послеоперационных рецидивов варикозной болезни нижних конечностей / В.А. Лазаренко, О.С. Пономарев, А.Н. Лесной [и др.] // Тез. докладов III конф. Ассоциации флебологов России. – Ростов н/Д : Б.и., 2001. – С. 80-81. 69. Савельев, В.С. Венозные трофические язвы. Мифы и реальность / В.С. Савельев, А.И. Кириенко // Флеболимфология. – 2000. – № 11. – С. 5-10. 135 70. Савельев, B.C. Микронизированный диосмин (Детралекс) при лечении трофических язв венозной этиологии. Европейский опыт / B.C. Савельев, А.В. Покровский, С.В. Сапелкин [и др.] // Ангиология и сосудистая хирургия. – 2006. – Т. 12, № 3. – С. 53-60. 71. Салтыков, Б.Б. Диабетическая микроангиопатия / Б.Б. Салтыков, B.C. Пауков. – М. : Медицина, 2002. – 240 с. 72. Сапелкин, С.В. Осложненные формы хронической венозной недостаточности: современные тенденции профилактики и –лечения / С.В. Сапелкин // Consilium medicum. – 2007. – Т. 9, № 7. – С. 98-101. 73. Сапелкин, С.В. Фармакотерапия трофических язв с точки зрения доказательной медицины / С.В. Сапелкин // ХВН: от ранних проявлений до трофических язв : материалы VI конф. Ассоциации флебологов России. – М : Б.и., 2006. – С. 9-12. 74. Сахарный диабет: ангиопатии и окислительный стресс: пособие для врачей / И.И. Дедов, М.И. Балаболкин, Г.Г. Мамаева [и др.]. – М. : МЗ РФ, ГУ ЭНЦ РАМН, 2003. – 85 с. 75. Селезнев, С.А. Клинические аспекты микрогемоциркуляции / С.А. Селезнев, Г.И. Назаренко, В.С. Зайцев. – Л. : Медицина, 1985. – 208 с. 76. Системная терапия венозных трофических язв. Результаты применения микронизированного диосмина (Детралекс) / В.С. Савельев, А.В Покровский, А.И. Кириенко [и др.] // Ангиология и сосудистая хирургия. – 2002. – № 4. – С. 47-53. 77. Современные подходы диагностики и лечения многоуровневых поражений артерий нижних конечностей ниже паховой складки в стадии критической ишемии / В.А. Янушко, Д.В. Турлюк, П.А. Ладыгин, Д.В. Исачкин // Новости хирургии. – 2011. – Т. 19, № 6. – С. 115-128. 78. Соколов, Е.И. Диабетическое сердце / Е.И. Соколов. – М. : Медицина, 2002. – 415 с. 136 79. Соколов, Е.И. Сахарный диабет и атеросклероз / Е.И. Соколов. – М. : Наука, 1996. – 404 с. 80. Струков, А.И. Патологическая анатомия / А.И. Струков, В.В. Серов. – М. : Медицина, 1995. – С. 435-438. 81. Сунцов, Ю.И. Скрининг осложнений сахарного диабета как метод оценки качества лечебной помощи больным / Ю.И. Сунцов, И.И Дедов, М.В. Шестакова. – М. : Мин. здрав. и соц. развития РФ совместно с ФГУ ЭНЦ Росмедтехнологий, 2008. – 63 с. 82. Теппермен, Дж. Физиология обмена веществ и эндокринной системы. Вводный курс / Дж. Теппермен, Х. Теппермен ; пер. с англ. – М. : Мир, 1989. – 656 с. 83. Токмакова, А.Ю. Антикоагулянты в терапии диабетической макроангиопатии / А.Ю. Токмакова, Д.Н. Староверова, М.Б. Анциферов // Consilium medicum. – 2002. – Т. 4, № 10. – С. 535-537. 84. Ультраструктура стенки артерий при диабетической ангиопатии. / А.А. Сергиенко, В.И. Ковалишин, П.Д. Гордий, В.И. Березюк // Проблемы патологии в эксперименте и клинике. – 1988. – Т. 10. – С. 132. 85. Федер, Е. Фракталы / Е. Федер ; пер. с англ. – М. : Мир, 1991. – 254 с. 86. Флебология : руководство для врачей / B.C Савельев., В.А Гологорский, А.И. Кириенко [и др.]. ; под ред. B.C. Савельева. – М. : Медицина, 2001. – 664 с. 87. Хаитов, P.M. Иммунодефициты: диагностика и иммунотерапия / P.M. Хаитов, Б.В. Пинегин // Лечащий врач. – 1999. – № 2-3. – С. 63-69. 88. Хирургическая коррекция вен при рецидивах варикозной болезни / И.А. Масунов, А.Ф. Ганичев, А.Л. Родин, Д.В. Егоров // Вопросы ангиологии и организации помощи больным сосудистой патологией : сб. тр. – Барнаул : Б.и., 2000. – С. 113-115. 89. Хирургическое лечение рецидивов варикозного расширения поверхностных вен конечностей / И.И. Затевахин, А.Н. Веденский, Г.В. Говорунов, В.П. 137 Иванов // Тез. докладов XIX пленума Правления Всесоюзного науч. о-ва хирургов. – Ярославль : Б.и., 1983. – С. 77-78. 90. Хронические заболевания вен нижних конечностей у работников промышленных предприятий г. Москвы / А.И. Кириенко, В.Ю. Богачев, С.Г. Гаврилов, И.А. Золотухин // Ангиология и сосудистая хирургия. – 2004. – Т. 10, № 1. – С. 77-85. 91. Чуриков. Д.А. Ультразвуковая диагностика болезней вен / Д.А. Чуриков, А.М. Кириенко. – М. : Литтерра, 2011. – 96 с. 92. Швальб, П.Г. Системный подход к патогенезу основных нарушений венозного возврата из нижних конечностей. Патологический венозный континуум / П.Г. Швальб // Флебология. – 2008. – № 1. – С. 3-9. 93. Шевченко, Ю.Л. Основы клинической флебологии / Ю.Л. Шевченко, Ю.М. Стойко, М.И. Лыткина. – М. : Медицина, 2005. – 312 с. 94. Шестакова, М.В. Инсулинорезистентность: патофизиология, клинические проявления, подходы к лечению / М.В. Шестакова, О.Ю. Брескина // Consilium Medicum. – 2002. – Т. 4, № 10. – С. 523-527. 95. Шестакова, М.В. Профилактика сосудистых осложнений сахарного диабета: решенные и нерешенные вопросы / М.В. Шестакова, И.Р. Ярек-Мартынов, Л.А. Кошель // Consilium Medicum. – 2002. – Т. 4, № 10. – С. 527-530. 96. Шишкова, В.Н. Диабетон МВ в лечении сахарного диабета 2-го типа / В.Н. Шишкова // Проблемы эндокринологии. – 2008. – Т. 54, № 3. – С. 3-7. 97. Эрдманис, Д.Ф. Диабетические макроангиопатии нижних конечностей / Д.Ф. Эрдманис // Архив патологии. – 1986. – № 11. – С. 26-34. 98. Яблоков, Е.Г. Хроническая венозная недостаточность / Е.Г. Яблоков, А.И. Кириенко, В.Ю. Богачев. – М. : Берег, 1999. – 126 с. 99. 2012 ACCF/AHA/ACP/FCP/AATS/PCNA/SCAI/SNS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease / S.D. Fihn, J.M. Cardin, J. Abrams [et al.] // J. Am. Coll. Cardiol. – 2012. – Vol. 60, № 24. – Р. 144-164. 138 100. A pharmacoepidemical assessment of the effect of statins and fibrates on fibrinogen concentration / P. Maison, L. Mennen, D. Sapinho [et al.] // Atherosclerosis. – 2002. – Vol. 160, № 1. – P. 155-160. 101. Agus, G.B. Nautilus survey on chronic venous diseases / G.B. Agus, A. Jawien, F. Carelli // Panminerva Med. – 2010. – Vol. 52, Suppl. 1. – Р. 5-9. 102. Altman, R. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip / R. Altman, G. Alarcon, D. Appelbrouth // Arthritis Rheum. – 1991. – Vol. 34. – P. 505-514. 103. American Venous Forum International Ad Hoc Committee for Revision of the CEAP Classification. Revision of the CEAP classification for chronic venous disorders: consensus statement / B. Eklöf, R.B. Rutherford, J.J. Bergan [et al.] // J. Vasc. Surg. – 2004. – Vol. 40. – Р. 1248-1252. 104. Anti-inflammatory effect of fibrate protects from cisplatin induced ARF / S. Li, N. Gokden, M.D. Okusa, R. Bhatt, D. Portilla // Am. J. Physiol. Renal. Physiol. – 2005. – Vol. 289, № 2. – Р. 469-480. 105. Banerjee, R. The diagnostic relevance of red cell rigidity / R. Banerjee, K. Nageshwari, R.R. Puniyani // Clin. Hemorheol Microcirc. – 1998. – Vol. 19, № 1. – Р. 21-24. 106. Both fenofibrate and atorvastatin improve vascular reactivity in combined hyperlipidemia (fenofibrate versus atorvastatin trial – FAT) / J. Malic, V. Melenovsky, D. Widilerle [et al.] // Cardiovasc. Res. – 2001. – Vol. 52. – P. 290298. 107. Brachial artery reactivity in asymptomatic patients with type 2 diabetes mellitus and microalbuminuria (from the Detection of Ischemia in Asymptomatic Diabetics-brachial artery reactivity study) / G.I. Papaioannou, R.L. Seip, N.J. Grey, D. Katten [et al.] // Am. J. Cardiol. – 2004. – Vol. 94. – P. 294-303. 108. Brohall, G. Carotid artery intima-media thickness in patients with Type 2 diabetes mellitus and impaired glucose tolerance: a systematic review / G. Brohall, A. Oden, B. Fagerberg // Diabet. Med. – 2006. – Vol. 23, № 6. – P. 609-616. 139 109. Chen, L. The worldwide epidemiology of type 2 diabetes mellitus-present and future perspectives / L. Chen, D.J. Magliano, P.Z. Zimmet // Nat. Rev. Endocrinol. – 2012. – Vol. 8. – Р. 228-236. 110. Correction of lower extremity deep venous incompetence by ablation of superficial venous reflux / C.M. Sales, M.L. Bilof, K.A. Petrillo, N.L. Luka // Ann. Vasc. Surg. – 1996. – Vol. 10, № 2. – Р. 186-189. 111. Correlation analysis between diabetic retinopathy and early atherosclerotic changes in adolescents with type 1 diabetes – preliminary report / В. GlowinskaOlszewska, M. Urban, В. Urban, J. Tolwinska // Endokrynol. Diabetol. Chor. Przemiany Materii. Wieku. Rozw. – 2006. – № 12. – P. 96-102. 112. CVI Research Group. Chronic venous insufficiency. A common health problem in general practice in Greece / C. Lionis, K. Erevnidou, N. Antonakis, S. Argyriadou, I. Vlachonikolis, A. Katsamouris // Int. Angiol. – 2002. – Vol. 21. – Р. 86-92. 113. Determination of vitreous interleukin-1 (IL-1) and tumour necrosis factor (TNF) levels in proliferative diabetic retinopathy / N. Demircan, B.G. Safran, M. Soylu [et al.] // Eye. – 2006. – Vol. 20, № 12. – Р. 1366-1369. 114. Diabetes Atherosclerosis Intervention Study Investigators. Effect of fenofibrate on progression of coronary artery disease in type 2 diabetes: the Diabetes Atherosclerosis Intervention Study, a randomized study // Lancet. – 2001. – Vol. 357. – Р. 905-910. 115. Diabetes: a 21st century challenge / P.Z. Zimmet, D.J. Magliano, W.H. Herman [et al.] // The Lancet Diabetes & Endocrinology. – 2014. – Vol. 2, Issue 1. – P. 56-64. 116. Diabetes Atlas [Electronic resources]. – 6th eds. – Brussels, Belgium : International Diabetes Federation, 2013. – URL: http://www.idf.org/diabetesatlas 117. Diabetic foot disorders: a clinical practice guideline. The development and complications of diabetic foot ulcers / R.G. Frykberg [et al.] // Journal Foot and Ankle Surgeons. – 2000. – Vol. 39, Supl. 5. – S. 1-60. 140 118. Diagnostic procedures for venous problems / M Kendler, J. Zajitschek, J.C. Simon, T. Wetzig // J. Dtsch. Dermatol. Ges. – 2010. – Vol. 8, № 11. – P. 903-910. 119. Dodson, P.M. Diabetic retinopathy / P.M. Dodson. – Oxford Diabetes Library, 2008. – Chapter 16. 120. Donnelly, R. Vascuar cjmplication of diabetes / R. Donnelly // BMJ. – 2000. – Vol. 320. – Р. 1062-1066. 121. Dormandy, J.A. Pathophysiology of venous leg ulceration:an update / J.A. Dormandy // Angiology. – 1997. – № 48. – Р. 71-75. 122. Duckworth, W.C. Hyperglycaemia and cardiovascular disease / W.C. Duckworth // Curr. Atheroscler. Rep. – 2001. – Vol. 5. – Р. 383-391. 123. Effect of fenofibrate on amputation events in people with type 2 diabetes mellitus (FIELD study): a prespecified analysis of randomized controlled trial / K. Rajamani, P.G. Colman, J.D. Best [et al.] // Lancet. – 2009. – Vol. 373. – P. 17801788. 124. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomized controlled trial / A.C. Keech, P. Mitchell, P.A. Summanen [et al.] // Lancet. – 2007. – Vol. 370. – P. 1687-1697. 125. Effect of reduced red cell deformability on flow velocity in capillaries of rat mesentery / G.K. Driessen [et al.] // Pflugers Arch. – 1980. – Vol. 388, № 1. – Р. 75-78. 126. Eklof, B. Revision of the CEAP classification / B. Eklof // Medicographia. – 2006. – Vol. 28, № 2. – P. 175-180. 127. Endovenous laser treatment of the incompetent greater saphenous vein / R.J. Min, S.E. Zimmet, M.N. Isaacs [et al.] // J. Vase Interv. Radiol. – 2001. – Vol. 12. – P. 1167-1171. 128. Fazio, S. Fenofibrate and risk of minor amputations in diabetes / S. Fazio, M.F. Linton // Lancet. – 2009. – Vol. 373. – Р. 1740-1741. 141 129. Fenofibrate and pioglitazone improve endothelial function and reduce arterial stiffness in obese glucose tolerant men / K.E. Ryan, D.R. Cancer, L. Powell, R. Mahon, E.R. Trimble // Atherosclerosis. – 2007. – Vol. 194. – Р. 123-130. 130. Fenofibrate regulates retinal endothelial. cell survival through the AMPK signal transduction pathway / J. Kim, J.H. Ahn, J.H. Kim [et al.] // Exp. Eye Res. – 2007. – Vol. 84. – Р. 886-893. 131. Ferrara, F. Sclerotherapy in the patient with diabetes: indications and results. / F. Ferrara, G. Ferrara // Phlebolymphology. – 2012. – Vol. 19, № 4. – Р. 193. 132. Ferrara, N. Role of vascular endothelial growth factor in regulation of physiological angiogenesis / N. Ferrara //Am. J. Physiol. – 2001. – Vol. 280. – Р. 1358-1366. 133. Five-year treatment of chronic venous insufficiency with O-(β-hydroxyethyl)rutosides: Safety aspects / S. Stuard, M.R. Cesarone, G. Belcaro [et al.] // International Journal of Angiology. – 2008. – Vol. 17, № 3. – Р. 143-148. 134. Florea, I. Chronic venous insufficiency – Clinical-Evolutional Aspects / I. Florea, L.E. Stoica, I. Jolea // Current Health Sciences Journal. – 2011. – Vol. 37, № 1. – Р. 135. Fowkes, F.J.I. The prevalence of Deep Venous Thrombosis (Review of the literature) / F.J.I. Fowkes, J.F. Price, P.G.R. Fowkes // Eur. J. Vase Endovasc. Surg. – 2003. – Vol. 25. – Р. 1-5. 136. Ganessaratem, K.B. Fibrates inhibit aldose reductase activity in the forward and reverse reactions / B.K. Ganessaratem, R. Balakrishnan // Biochemical Pharmacology. – 2005. – Vol. 70. – P. 1653-1663. 137. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010 / R. Lozano, M. Naghavi, K. Foreman [et al.] // Lancet. – 2012. – Vol. 380. – Р. 20952128. 138. Global healthcare expenditure on diabetes for 2010 and 2030 / P. Zhang, X. Zhang, J. Brown [et al.] // Diabetes Res. Clin. Pract. – 2010. – Vol. 87. – Р. 293-301. 142 139. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030 / S. Wild, G. Roglic, A. Green, R. Sicree, H. King // Diabetes Care. – 2004. – Vol. 27. – Р. 1047-1053. 140. Gloviczki, P. Hahdbook of venous disorders / P. Gloviczki. – London : UK, Hodder Arnold, 2009. – 345 p. 141. Golledge, J. Pathogenesis of varicose veins / J. Golledge, F.G. Quigley // J. Vasc. Endovasc. Surg. – 2003. – Vol. 25. – Р. 319-324. 142. Healing rates and cost efficacy of outpatient compression treatment for leg ulcers associated with venous insufficiency / W.A. Marston, R.E. Carlin, M.A. Passman, M.A. Farber, B.A. Keagy // J. Vasc. Surg. – 1999. – Vol. 30. – Р. 491-498. 143. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomized placebo controlled trial // Lancet. – 2003. – Vol. 361. – Р. 2005-2016. 144. IDF Diabetes Atlas: global estimates of the prevalence of diabetes for 2011 and 2030 / D.R. Whiting, L. Guariguata, C. Weil, J. Shaw // Diabetes Res. Clin. Pract. – 2011. – Vol. 94. – Р. 311-321. 145. Impaired 0.1 – Hz vasomotion assessed by laser Doppler anemometry as an early index of peripheral sympathetic neuropathy in diabetes / M.F. Meyer, C.J. Rose, J.O. Hulsmann [et al.] // Microvasc. Res. – 2003. – Vol. 65. – Р. 88-95. 146. Impaired deformability of erythrocytes and neutrophils in children with newly diagnosed insulin-dependent diabetes mellitus / O. Linderkamp [et al.] // Diabetologia. – 1999. – Vol. 42, № 7. – Р. 865-869. 147. Increased central artery stiffness in impaired glucose metabolism and type 2 diabetes / M.T. Schram, R.M.A. Henry, R.A. van Dijk, P.J. Kontense // Hypertension. – 2004. – Vol. 43. – P. 176-181. 148. Induction of I kappa-B-alpha expression as a mechanism contributing to the antiinflammatory activities of peroxisome proliferator-activated receptor-alpha activators / P. Delerive, P. Gervois, J.C. Fruchart, B. Staels // J. Biol. Chem. – 2000. – Vol. 275, № 47. – Р. 36703-36707. 143 149. Jackson, R. Basal membrane dynamics in patients with diabetes mellitus / R. Jackson, С. Peterson // Diabetes. – 1982. – Vol. 31. – P. 345-348. 150. Janca, H.U. Epidemiology and risk factors of macrovascular disease in diabetes mellitus / H.U. Janca // Horm. Metab. Res. Suppl. – 1990. – Vol. – Р. 8-11. 151. Johansson, E. Venous thrombectomy in the lower extremity-clinical phlebographic and plethysmographic evaluation of early and late results / E. Johansson, S. Nordlander, S. Zetterquist // Acta Chir. Scand. – 1973. – Vol. 139. – Р. 511-516. 152. Koh, K. Beneficial effects of fenofibrate to improve endothelial dysfunction and raise adiponectin levels in patients with primary hypertriglyceridemia / K. Koh, S. Han, M. Quon // Diabetes Care. – 2005. – Vol. 28. – Р. 1419-1424. 153. Krishnamurti, U. Glycohemoglobin: a primary predictor of the development or reversal of complications of diabetes mellitus / U. Krishnamurti, M.W. Steffes // Clin. Chem. – 2001. – Vol. 7. – Р. 1157-1165. 154. Law, B.M. Statins, Fibrates: A Neuropathy Buff er? Study suggests neuropathy protection may be new indication for drugs. / B.M. Law // Diabetes. – 2007. – Vol. 4, № 8. – Р. 1-3. 155. Lipid-lowering therapy and peripheral sensory neuropathy in type 2 diabetes: the Fremantle Diabetes Study / T.M.E. Davis, B.B. Yeap, W.A. Davis, D.G. Bruce // Diabetologia. – 2008. – Vol. 51. – Р. 562-566. 156. Lipolysis of triglyceridrich lipoproteins generates PPAR ligands: evidence for an anti-inflammatory role for lipoprotein lipase / O. Ziozenkova, S. Perrey, L. Asatryan [et al.] // Proc. Natl. Acad. Sci. USA. – 2003. – Vol. 100. – Р. 2730-2735. 157. Long term results of compression therapy alone versus compression plus surgery in chronic venous ulceration (ESCHAR): randomized controlled trial / M.S. Gohel, J.R. Barwell, J.J. Earnshaw, B.P. Heather [et al.] // Br. J. Surg. – 2005. – Vol. 92. – Р. 291-297. 158. Losada, M. Malondialdehyde serum concentration in type 1 diabetic with and without retinopathy / M. Losada, J.L. Alio // Doc. Ophtalmol. – 1997. – Vol. 93. – Р. 223-229. 144 159. Low-extremity amputation in people with diabetes. Epidemiology and prevention / D.E. Bild, J.V. Selby, P. Sinnock [et al.] // Diabetes Care. – 1980. – Vol. 12. – Р. 24-31. 160. Lower limb venous pressure in diabetic neuropathy / T.S. Purewal, D.E. Goss, P.J. Watkins, M.E. Edmonds // Diabetes Care. – 1995. – Vol. 18, № 3. – Р. 377-381. 161. Management of Hyperglycemia in Type 2 Diabetes: A Patient-Centered Approach Position Statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) / S. E. Inzucchi, R. M. Bergenstal, John B. Buse, [et al.] // Diabetes Care. - 2012. – Vol. 35, N 6. – P. 1364-1379. 162. Mani, R. Prevalence of deep venous incompetence and microvascular abnormalities in patients with diabetes mellitus / R. Mani, S. Yarde, M. Edmonds // Int. J. Low. Extrem. Wounds. – 2011. – Vol. 10. – Р. 75-79. 163. Mekky, S. Varicose veins in women cotton workers. An epidemiological study in England and Egypt / S. Mekky, R.S. Schilling, J. Walford // Br. Med. J. – 1969. – № 3 – Р. 591-595. 164. Na-H-antiport activity and cell growth in cultured skin fibroblast of IDDM patients with nephropathy / R. Trevisan, L.K. Li, J. Messent [et al.] // Diabetes. – 1999. – Vol. 41. – Р. 1239-1246. 165. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial / D. Ziegler, A. Ametov, A. Barinov [et al.] // Diabetes Care. – 2006. – Vol. 29, № 11. – Р. 2365-2370. 166. Patient-assessed health outcomes in peripheral arterial. Surg-disease / J. Golledge, A. Garratt, R.M. Greenhalgh [et al.] // Eur. J. Vasc. Endovasc. – 2000. – Vol. 19, № 2. – P. 109-110. 167. Peroxisome proliferator-activated receptor-alpha activation as a mechanism of preventive neuroprotection induced by chronic fenofibrate treatment / D. Deplanque, P. Gele, O. Petrault [et al.] // J. Neurosci. – 2003. – Vol. 23. – P. 62646271. 145 168. PPAR activators as anti-inflammatory mediators in human T lymphocytes. Implications for atherosclerosis and transplantation-associated arteriosclerosis / N. Marx, B. Kehrle, K. Kohlhammer [et al.] // Circ. Res. – 2002. – Vol. 90. – P. 703710. 169. PPAR alpha agonist fenofibrate suppresses tumor growth through direct and indirect angiogenesis inhibition / D. Panigrahy, A. Kaipainen, S. Huang [et al.] // Proc. Natl. Acad. Sci. USA. – 2008. – Vol. 105. – Р. 985-990. 170. PPARs activators and regulation of lipid metabolism, vascular inflammation and atherosclerosis / V. Bocher, G. Chinetti, J.C. Fruchart, B. Staels // Journ. Ann. Diabetol. Hotel Dieu. – 2001. – Vol. – Р. 23-32. 171. Proinflammatory effects of advanced lipoxidation end products in monocytes / N. Shanmugam, J.L. Figarola, Y. Li [et al.] // Diabetes. – 2008. – Vol. 57, № 4. – Р. 879-888. 172. Ramelet, A.A. Phlebology aesthetics. Telangiectasia: Therapeutic Opportunities / A.A. Ramelet // Cosmetology and aesthetic dermatology (Elsevier Masson SAS, Paris). – 2010. – Vol. 50-470-C-10. 173. Reassessing the mathematical modeling of the contribution of vasomotion to vascular resistance / C. Meyer, G. de Vries, S.T. Davidge, D.C. Mayes // J. Appl. Physiol. – 2002. – Vol. 92. – Р. 888-889. 174. Relationship between changes in brachial artery flow-mediated dilation and basal release of nitric oxide in subjects with Type 2 diabetes / D.J. Green, A.J. Maiorana, M.E. Tschakovsky, K.E. Руке, С.J. Weisbrod, G. O'Driscoll // Am. J. Physiol. Heart. Circ. Physiol. – 2006. – Vol. 291. – P. 1193-1202. 175. Reutern, G.-M. Ultrasound diagnosis of cerebrovascular disease / G.-M. Reutern, H.J. Budingen. – New York : Georg Thieme Verlag, 1993. – P. 1-36. 176. Rosenson, R.S. Fenofibrate abrogates postprandial blood viscosity among hypertriglyceridemia subjects with the metabolic syndrome / R.S. Rosenson, I.B. Helenowski // Diab. Met. Syndr. Clin. Res. Rev. – 2009. – Vol. 3. – Р. 17-23. 146 177. Scott, L.A. Measurement of somatic neuropathy for clinical practice and clinical trials / L.A. Scott, S. Tesfaye // Cur. Diabetes Rep. – 2001. – Vol. 1. – Р. 208-294. 178. Sex-based differences in early mortality after myocardial infarction. National Registry of Myocardial Infarction 2 Participants / V. Vaccarino [et al.] // N. Eng. J. Med. – 1999. – Vol. 341. – Р. 217-225. 179. Simanonok, J.P. Non-ischemic hypoxia of the arterial wall is a primary cause of atherosclerosis / J.P. Simanonok // Med. Hypotheses. – 1996. – Vol. 4, № 2. – Р. 155-161. 180. Skin vasomotor reflexes during inspiratory gasp: standardization by spirometric control does not improve reproducibility / P.W.G. Du Buf-Vereijken, P.M. Netten, H. Wollersheim, J. Festen, T. Thien // Int. J. Microcirc. Clin. Exp. – 1997. – Vol. 17. – Р. 86-92. 181. Song, Y. Circulating Levels of Endothelial Adhesion Molecules and Risk of Diabetes in an Ethnically Diverse Cohort of Women / Y. Song [et al.] // Diabetes. – 2007. – Vol. 56. – Р. 1898-1904. 182. Stoltz, J. Hemorheology in practice: an introduction to the concept of a hemorheology profile / J. Stoltz, M. Donner, S. Muller // Rev. Port. Hemorheol. – 1991. – Vol. 5. – Р. 175-188. 183. The "C" of CEAP: Suggested definitions and refinements: An International Union of Phlebology conference of expert / C. Allegra, P.L. Antignani, J. Bergan [et al.] // J. Vase. Surg. – 2003. – № 37. – Р. 129-131. 184. The epidemiology of varicose veins: the Framingham Study / F.N. Brand, A.L. Dannenberg, R.D. Abbott, W.B. Kannel // Am. J. Prev. Med. – 1988. – Vol. 4, № 2. – Р. 96-101. 185. The relationship between blood glucose excursions and painful diabetic peripheral neuropathy: a pilot study / S. Oyibo, Y.D. Prasad, N.J. Jackson, E.B. Jude, A.J.M. Boulton // Diabet. Med. – 2002. – Vol. 19. – Р. 870-873. 147 186. Transilluminated powered phlebectomy: Advantages and Disadvantages of a New Technique / A. Shamiyeh, P. Schrenk, E. Huber [et al.] // Dermatol. Surg . – 2003. – Vol. 29. – Р. 616-619. 187. Tumor necrosis factor alpha (TNF-alpha)-induced RANTES chemokine expression via activation of NF-kappaB and p38 MAP kinase: roles of TNF-alpha in alcoholic liver diseases / F. Hirano, K. Komura, E. Fukawa, I. Makino // J. Hepatol. – 2003. – Vol. 38, № 4. – Р. 483-489. 188. UKPDS: Intensive blood glucose with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes // Lancet. – 1998. – Vol. 352. – Р. 837-853. 189. Van-Gelder, J.M. Erythrocyte aggregation and erythrocyte deformability modify the permeability of erythrocyte enriched fibrin network / J.M. Van-Gelder, C.H. Nair, D.P. Dhall // Thromb. Res. – 1996. – Vol. 1, № 82. – Р. 33-42. 190. Viardot, A. The effects of weight loss and gastric banding on the innate and adaptive immune system in type 2 diabetes and prediabetes / A. Viardot, R.V. Lord, K. Samaras // J. Clin. Endocrinol. Metab. – 2010. – Vol. 95, № 6. – Р. 28452850. 148 Список работ, опубликованных по теме диссертации 1. Состояние микроциркуляции у пациентов с хронической венозной недостаточностью / М.Н. Кудыкин, А.Э. Клецкин, А.А. Шлякова, В.А. Пугин, А.Н. Васягин, Д.С. Красавин, А.М. Рябцев, И.Е. Алехина // Флебология : материалы IX-ой науч.-практ. конф. ассоциации флебологов России с междунар. участием. – 2012. – № 2 (6). – С. 50-51. 2. Хроническая венозная недостаточность у пациентов с сахарным диабетом. Особенности течения. / М.Н. Кудыкин, Л.Г. Стронгин, А.А. Шлякова, А.Э. Клецкин, В.А. Пугин, А.Н. Васягин, Д.С. Красавин, И.Е. Алехина // Флебология : материалы IX-ой науч.-практ. конф. ассоциации флебологов России с междунар. участием. – 2012. – № 2 (6). – С. 51. 3. Лечение хронической венозной недостаточности у пациентов с сопутствующим сахарным диабетом. / М.Н. Кудыкин, Л.Г. Стронгин, А.А. Шлякова, А.Э. Клецкин, В.А. Пугин, А.Н. Васягин, Д.С. Красавин, И.Е. Алехина // Флебология : материалы IX-ой науч.-практ. конф. ассоциации флебологов России с междунар. участием. – 2012. – № 2 (6). – С. 74. 4. Микроциркуляторные изменения у больных с хронической венозной недостаточностью и возможности их коррекции / М.Н. Кудыкин, А.Э. Клецкин, А.А. Шлякова, К.Г. Корнева, В.А. Пугин, А.Н. Васягин // Материалы Российско-украинского венозного форума «От Днепра до Дона». – Ростов-на-Дону : Б.и., 2013. – С. 38. 5. Клинические особенности течения хронической венозной недостаточности у больных с сахарным диабетом 2 типа / А.А. Шлякова, Л.Г. Стронгин, К.Г. Корнева, М.Н. Кудыкин // Актуальные вопросы диагностики, лечения и профилактики синдрома диабетической стопы : материалы IV Всероссийской науч.-практ. конф. с междунар. участием, посвященной 75-летию Городской клинической больницы № 5 г. Казани. – Казань : Б.и., 2012. – С. 97-98. 149 6. Особенности течения хронической венозной недостаточности у пациентов с сахарным диабетом 2 типа / А.А. Шлякова, К.Г. Корнева, М.Н. Кудыкин, Л.Г. Стронгин // Новости хирургии. – 2012. – № 4 (21). – С. 57-61. 7. Влияние поздних осложнений сахарного диабета 2 типа на течение хронической венозной недостаточности нижних конечностей / А.А. Шлякова, К.Г. Корнева, Л.Г. Стронгин, М.Н. Кудыкин // Медицинский альманах. – 2013. – № 6 (30). – С. 175-178. 8. Клинико-метаболические аспекты влияния сахарного диабета 2 типа на течение хронической венозной недостаточности нижних конечностей / А.А. Шлякова, Л.Г. Стронгин, К.Г. Корнева, М.Н. Кудыкин // Сборник тезисов VI Всероссийского диабетологического конгресса. – М. : Б.и., 2013. – С. 156. 9. Особенности микроциркуляции нижних конечностей у пациентов с сахарным диабетом 2 типа в сочетании с хронической венозной недостаточностью / А.А. Шлякова, К.Г. Корнева, М.Н. Кудыкин, П.В. Перетягин // Терапевт. – 2014. – № 1. – С. 15-18. 10. Characteristic features of the course of chronic venous insufficiency of the lower limbs in patients with impaired peripheral innervation of diabetes mellitus type 2 / А.А. Shlyakova, K.G. Korneva, L.G. Strongin, M.N. Kudykin // Book of Abstracts 16th European Congress of Endocrinology (ECE 2014). – Poland, 2014. – Р. 423. 11. Особенности поражения венозной системы у пациентов с сахарным диабетом 2 типа и хронической венозной недостаточностью нижних конечностей / А.А. Шлякова, М.Н. Кудыкин, Л.Г. Стронгин, К.Г. Корнева // Флебология : материалы Х-ой науч.-практ. конф. ассоциации флебологов России. – Н. Новгород : Б.и., 2014. – № 2 (8). – С. 11-12. 12. Влияние гиполипидемического препарата из группы фенофибраты на диабетическую полинейропатию нижних конечностей у пациентов с сахарным диабетом 2 типа в сочетании с хронической венозной 150 недостаточностью / А.А. Шлякова, К.Г. Корнева, Л.Г. Стронгин, М.Н. Кудыкин // II Всероссийский конгресс «Инновационные технологии в эндокринологии» с участием стран СНГ. – М. : Б.и., 2014. – С. 211.