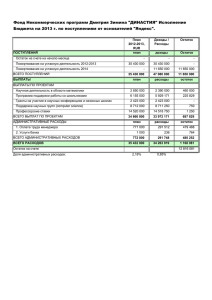
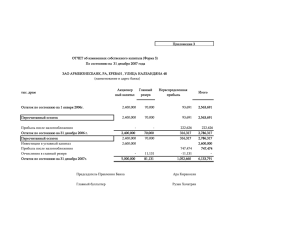
020537 B1 020537 B1 (11) 020537
реклама

Евразийское патентное ведомство (19) (11) 020537 (13) B1 (12) ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ (45) Дата публикации и выдачи патента (51) Int. Cl. C07K 14/605 (2006.01) 2014.11.28 (21) Номер заявки 201190047 (22) Дата подачи заявки 2008.12.15 (54) АНАЛОГИ ГЛЮКАГОНА B1 (72) Изобретатель: (74) Представитель: (57) Изобретение обеспечивает вещества и способы стимуляции снижения веса или предотвращения увеличения веса, в том числе при лечении сахарного диабета, метаболического синдрома и ассоциированных заболеваний. В частности, изобретение относится к новым пептидам-аналогам глюкагона, эффективным в таких способах. Действие указанных пептидов может быть обусловлено наличием повышенной селективности в отношении к рецептору GLP-1, по сравнению с глюкагоном человека. Мейер Эдди, Рибер Дитте, Сковгаард Мари, Ларсен Бьярне Дью, Даугаард Йенс Росенгрен (DK) Нилова М.И. (RU) B1 020537 (56) WO-A-2008101017 WO-A-2007056362 GKE R. ET AL.: "Exendin-4 is a high potency agonist and truncated exendin-(9-39)-amide an antagonist at the glucagon-like peptide 1(7-36)-amide receptor of insulin-secreting betacells". JOURNAL OF BIOLOGICAL CHEMISTRY, AMERICAN SOCIETY OF BIOLOCHEMICAL BIOLOGISTS, BIRMINGHAM, US, vol. 268, no. 26, 15 September 1993 (1993-09-15), pages 19650-19655, XP002966930, ISSN: 0021-9258. Title, abstract 020537 (43) 2012.02.28 (86) PCT/GB2008/004121 (87) WO 2010/070251 2010.06.24 (71)(73) Заявитель и патентовладелец: ЗИЛЭНД ФАРМА А/С (DK) 020537 Область изобретения Изобретение относится к аналогам глюкагона и их применению в медицине, например при лечении избыточного потребления пищи, ожирения и лишнего веса. Предпосылки создания изобретения Препроглюкагон представляет собой пептид-предшественник из 158 аминокислот, который претерпевает дифференциальный процессинг в тканях с образованием ряда структурно схожих производных от проглюкагона пептидов, в том числе глюкагона (Glu), глюкагон-подобного пептида 1 (glucagon-like peptide-1, GLP-1), глюкагон-подобного пептида 2 (GLP-2) и оксинтомодулина (ОХМ). Эти молекулы вовлечены в различные физиологические процессы, включающие поддержание гомеостаза глюкозы, секрецию инсулина, опорожнение желудка и рост кишечника, а также регуляцию потребления пищи. Глюкагон представляет собой пептид из 29 аминокислот, соответствующий аминокислотам 53-81 препроглюкагона и имеющий последовательность His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-TyrLeu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (SEQ ID NO: 1). Оксинтомодулин (ОХМ) представляет собой пептид из 37 аминокислот, включающий полноразмерную последовательность глюкагона из 29 аминокислот с дополнительным карбоксиконцевым октапептидом (аминокислоты 82-89 препроглюкагона, имеющие последовательность Lys-Arg-Asn-Arg-Asn-Asn-lle-Ala (SEQ ID NO: 2) и известные как "промежуточный пептид 1" (intervening peptide 1, IP-1); таким образом, полноразмерная последовательность оксинтомодулина человека представляет собой His-Ser-Gln-Gly-Thr-Phe-Thr-SerAsp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Lys-Arg-AsnArg-Asn-Asn-lle-Ala) (SEQ ID NO: 3). Основной биологически активный фрагмент GLP-1 образуется в виде пептида из 30 аминокислот, амидированного по С-концу, который соответствует аминокислотам 98127 препроглюкагона. Глюкагон способствует поддержанию уровня глюкозы в крови путем связывания с рецепторами глюкагона на поверхности гепатоцитов, в результате чего в печени посредством гликогенолиза высвобождается глюкоза, запасаемая в форме гликогена. При истощении запасов гликогена глюкагон стимулирует в печени синтез глюкозы посредством глюконеогенеза. Глюкоза поступает в кровоток, предотвращая развитие гипогликемии. ОХМ выбрасывается в кровь в ответ на прием пищи, пропорционально калорийности пищи. Показано, что ОХМ подавляет аппетит и потребление пищи у человека (Cohen et al., Journal of Endocrinology and Metabolism, 88, 4696-4701, 2003; WO 2003/022304). B дополнение к таким аноректическим эффектам, аналогичным действию GLP-1, ОХМ также, вероятно, регулирует вес тела посредством другого механизма, поскольку крысы, получавшие оксинтомодулин, демонстрировали меньшее увеличение массы тела, чем группа крыс, получающих одинаковое кормление (Bloom, Endocrinology. 2004, 145, 2687). Лечение страдающих ожирением грызунов с помощью ОХМ также повышает их толерантность к глюкозе (Parlevliet et al., Am. J. Physiol. Endocrinol. Metab., 294, E142-7, 2008) и снижает увеличение массы тела (WO 2003/022304). ОХМ активирует и рецептор глюкагона, и рецептор GLP-1, при этом является в 2 раза более эффективным по отношению к рецепторам глюкагона, чем к рецепторам GLP-1, но менее эффективным, чем нативный глюкагон и GLP-1 по отношению к их соответствующим рецепторам. Глюкагон также способен активировать оба рецептора, хотя и с большим предпочтением к рецептору глюкагона, чем к рецептору GLP-1. С другой стороны, GLP-1 не способен активировать рецептор глюкагона. Механизм действия оксинтомодулина не до конца исследован. B частности, неизвестно, опосредуется ли действие этого гормона исключительно через рецептор глюкагона и рецептор GLP-1 или же через один или несколько пока еще неизвестных рецепторов. Известны другие пептиды, связывающиеся как с рецептором глюкагона, так и с рецептором GLP-1 и активирующие их (Hjort et al., Journal of Biological Chemistry, 269, 30121-30124,1994) и способствующие снижению увеличения веса тела и уменьшению потребления пищи (WO 2006/134340, WO 2007/100535, WO 2008/101017). Ожирение, представляющее собой глобально нарастающую проблему здоровья человека, ассоциировано с различными заболеваниями, в частности с сердечно-сосудистыми заболеваниями (СС3), сахарным диабетом 2 типа, синдромом обструктивного апноэ сна, некоторыми видами рака и остеоартритом. Как следствие, ожирение приводит к снижению продолжительности жизни. По прогнозам 2005 г. от Всемирной организации здравоохранения во всем мире 400 миллионов взрослых (в возрасте старше 15 лет) страдают ожирением. B настоящее время в США ожирение считается второй после курения ведущей причиной предотвратимой смертности. Распространение ожирения вызывает увеличение заболеваемости диабетом, и около 90% людей, страдающих диабетом 2 типа, можно рассматривать как страдающих ожирением. B мире 246 миллионов человек страдают диабетом, а к 2025 г., по оценкам, число больных диабетом составит 380 миллионов. У многих больных имеются дополнительные факторы риска развития сердечно-сосудистых заболеваний, в том числе высокое содержание или аберрантные формы ЛПНП и триглицеридов и низкий уровень ЛПВП. Люди с сахарным диабетом в 2-4 раза более склонны к развитию сердечно-сосудистых заболеваний, -1- 020537 чем люди, не страдающие диабетом, что делает его наиболее частым осложнением сахарного диабета. На сердечно-сосудистые заболевания приходится около 50% смертности среди людей, страдающих диабетом. У молодых людей, страдающих диабетом, ишемическая болезнь сердца (ИБС) развивается в 12-40 раз чаще, чем у молодых людей, не страдающих диабетом; наряду с высокой заболеваемостью и распространенностью ожирения и сахарного диабета 2 типа, процент смертности и летальности, связанный с этими нарушениями обмена веществ, подчеркивает медицинскую потребность в эффективных способах их лечения. Таким образом, существует сильно выраженная медицинская потребность в лечении ожирения и в повышении толерантности к глюкозе. Краткое описание изобретения В первом аспекте настоящее изобретение обеспечивает соединение, имеющее формулу , где R1 представляет собой Н, С1-4алкил, ацетил, формил, бензоил или трифторацетил; R2 представляет собой ОН или NH2; X представляет собой пептид, который имеет формулу I или отличается от формулы I не более чем в четырех из следующих положений, при этом, если присутствует отличие от формулы I: остаток в положении 2 выбран из Aib, D-Ser; остаток в положении 12 выбран из Leu, Arg, Dpu, Dpr, Orn; остаток в положении 16 выбран из Arg, His, Lys, Glu, Asp; остаток в положении 17 выбран из Arg, Leu, Dpu, Dpr, Orn; остаток в положении 18 выбран из Arg, Lys, His, Ser, Tyr; остаток в положении 20 выбран из Gln, Lys, Arg, Glu, Asp; остаток в положении 21 представляет собой Glu; остаток в положении 24 выбран из Gln, Leu, Ala, Lys, Arg, Asp; остаток в положении 27 выбран из Met, Cys, Lys, Arg, Glu; остаток в положении 28 выбран из Asn, Ser, Lys, Glu, Ala, Leu, Asp и остаток в положении 29 выбран из Thr, Glu, Lys; Z отсутствует или представляет собой последовательность пептида из 1-20 аминокислотных единиц, выбранную из группы, включающей Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr и Orn; или фармацевтически приемлемую соль указанного соединения. В некоторых вариантах реализации первого аспекта настоящего изобретения X может отличаться от формулы I не более чем в четырех из следующих положений, при этом, если присутствует отличие от формулы I: остаток в положении 2 выбран из Aib, D-Ser; остаток в положении 16 выбран из Arg, His, Lys, Glu; остаток в положении 17 выбран из Arg, Leu; остаток в положении 18 выбран из Arg, Lys, His, Ser, Tyr; остаток в положении 20 выбран из Gln, Lys, Arg, Glu; остаток в положении 24 выбран из Gln, Leu, Ala, Lys, Arg; остаток в положении 27 выбран из Met, Cys, Lys, Arg, Glu; остаток в положении 28 выбран из Asn, Ser, Lys, Glu, Ala, Leu и остаток в положении 29 выбран из Thr, Glu, Lys. В некоторых вариантах первого аспекта настоящего изобретения X может отличаться от формулы I не более чем в четырех из следующих положений, при этом, если присутствует отличие от формулы I: остаток в положении 2 выбран из Aib, D-Ser; остаток в положении 16 выбран из Arg, His, Lys, Glu, Gly; остаток в положении 24 выбран из Gln, Leu, Ala, Lys, Arg; остаток в положении 27 выбран из Met, Cys, Lys, Arg, Glu; остаток в положении 28 выбран из Asn, Ser, Lys, Glu, Ala, Leu и остаток в положении 29 выбран из Thr, Glu, Lys. Без противоречия определениям первого аспекта, изложенного выше, может быть желательно, чтобы X включал одну или более из следующих комбинаций остатков: -2- 020537 и их комбинации. Например, X может иметь последовательность: Во втором аспекте изобретение обеспечивает соединение, имеющее формулу R1-X-Z-R2, 1 где R представляет собой Н, С1-4алкил, ацетил, формил, бензоил или трифторацетил; R2 представляет собой ОН или NH2; X представляет собой пептид, который имеет формулу I или отличается от формулы I не более чем в пяти из следующих положений, при этом, если присутствует отличие от формулы I: остаток в положении 2 выбран из Aib, D-Ser; остаток в положении 16 выбран из Arg, His, Lys, Glu; остаток в положении 17, представляющий собой Arg, Leu, Dpu, Dpr, Orn; -3- 020537 остаток в положении 20 выбран из Gln, Lys, Arg, Glu, Asp; остаток в положении 21 представляет собой Glu; остаток в положении 24 выбран из Gln, Leu, Ala, Lys, Arg, Asp; остаток в положении 27 выбран из Met, Cys, Lys, Arg, Glu; остаток в положении 28 выбран из Asn, Ser, Lys, Glu, Ala, Leu, Asp и остаток в положении 29 выбран из Thr, Glu, Lys; Z отсутствует или представляет собой пептидную последовательность из 1-20 аминокислотных единиц, выбранных из группы, включающей Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr и Orn; или фармацевтически приемлемую соль указанного соединения. В некоторых вариантах второго аспекта, X может отличаться от формулы I не более чем в пяти из следующих положений, при этом, если присутствует отличие от формулы I: остаток в положении 2 выбран из Aib, D-Ser; остаток в положении 16 выбран из Arg, His, Lys, Glu, Gly; остаток в положении 17 выбран из Arg, Leu; остаток в положении 18 выбран из Arg, Lys, His, Ser, Tyr; остаток в положении 20 выбран из Gln, Lys, Arg, Glu; остаток в положении 24 выбран из Gln, Leu, Ala, Lys, Arg; остаток в положении 27 выбран из Met, Cys, Lys, Arg, Glu; остаток в положении 28 выбран из Asn, Ser, Lys, Glu, Ala, Leu и остаток в положении 29 выбран из Thr, Glu, Lys. Без противоречия определению второго аспекта, изложенного выше, может быть желательно, что X включает одну или более из следующих комбинаций остатков: или или Настоящее изобретение также обеспечивает нуклеиновую кислоту (которая может представлять собой ДНК или РНК), кодирующую соединение согласно настоящему изобретению, экспрессионный вектор, содержащий такую нуклеиновую кислоту, и клетку-хозяин, содержащую такую нуклеиновую кислоту или экспрессионный вектор. Еще в одном своем аспекте настоящее изобретение обеспечивает композицию, которая содержит пептид-аналог глюкагона, как определено в настоящем документе, или соль или его производное, нуклеиновую кислоту, кодирующую такой пептид-аналог глюкагона, экспрессионный вектор, содержащий такую нуклеиновую кислоту, или клетку-хозяин, содержащую такую нуклеиновую кислоту или экспрессионный вектор, в смеси с носителем. B предпочтительных вариантах реализации указанная композиция представляет собой фармацевтически приемлемую композицию, а указанный носитель представляет собой фармацевтически приемлемый носитель. Пептид-аналог глюкагона может представлять собой фармацевтически приемлемую кислотно-аддитивную соль аналога глюкагона. Описанные соединения находят применение для предотвращения увеличения веса или для стимуляции снижения веса. "Предупреждение" означает ингибирование или уменьшение набора веса, по сравнению с отсутствием лечения, и необязательно подразумевает полное прекращение увеличения веса тела. Пептиды согласно настоящему изобретению могут обусловливать снижение потребления пищи и/или увеличение расхода энергии, в результате чего наблюдается влияние на вес тела. Независимо от их влияния на вес тела, соединения согласно настоящему изобретению могут оказывать благоприятное влияние на толерантность к глюкозе и уровень циркулирующего холестерина, будучи способными снижать циркулирующие ЛПНП и повышать соотношение ЛПВП/ЛПНП. Таким образом, соединения согласно настоящему изобретению можно применять для прямой или косвенной терапии любого патологического состояния, вызванного или характеризующегося избыточной массой тела, например лечения и/или профилактики ожирения, патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением. Указанные соединения также можно применять для лечения метаболического синдрома, резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2-го типа, артериальной гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. Действие соединений согласно настоящему изобретению при таких патологических состояниях может быть результатом их влияния или быть связано с их влиянием на массу тела или может не зависеть от него. Таким образом, изобретение предусматривает применение соединения согласно настоящему изобретению для лечения состояния, как описано выше, у индивидов, нуждающихся в таком лечении. Изобретение также обеспечивает соединение согласно настоящему изобретению для применения в способе лечения, особенно для применения в способе лечения состояния, как описано выше. Изобретение также обеспечивает применение соединения согласно настоящему изобретению с целью получения лекарственного средства для лечения состояния, как описано выше. -4- 020537 Как уже было упомянуто, настоящее изобретение распространяется на экспрессионные векторы, содержащие описанные выше последовательности нуклеиновых кислот, которые можно комбинировать с последовательностями, регулирующими их экспрессию, и клетки-хозяева, содержащие экспрессионные векторы. Предпочтительно клетки-хозяева способны экспрессировать и секретировать соединения согласно настоящему изобретению. B еще одном аспекте настоящее изобретение обеспечивает способ получения соединений, включающий культивирование указанных клеток-хозяев в условиях, подходящих для экспрессии указанного соединения, и очистку соединения, полученного таким образом. Изобретение также обеспечивает нуклеиновую кислоту согласно настоящему изобретению, экспрессионный вектор согласно изобретению или клетку-хозяина, способную экспрессировать и секретировать соединения согласно настоящему изобретению, для применения в способах лечения. Следует иметь в виду, что указанные нуклеиновые кислоты, экспрессионный вектор и клетки-хозяева можно применять для лечения любого из нарушений, описанных в настоящем документе, которые можно лечить с помощью указанных соединений. При упоминании терапевтической композиции, содержащей соединение согласно настоящему изобретению, вариантов введения соединения согласно изобретению или любого терапевтического применения таких соединений также подразумевается эквивалентное применение нуклеиновых кислот, экспрессионного вектора или клетки-хозяина согласно изобретению, если из контекста не следует иное. Описание графических материалов Фиг. 1. Влияние ZP2669 на толерантность к глюкозе при оральном тесте у мышей db/db. У мышей Db/db, не получавших корм в течение ночи, брали первичные образцы крови (уровень глюкозы в крови натощак) перед введением (внутрибрюшинно) наполнителя или ZP2669 (45 нмоль/кг). Через 15 мин мышам перорально вводили глюкозу (1 г/кг в 5 мл/кг) и измеряли уровень глюкозы в крови при t=30 мин, t=60 мин, t=120 мин и t=240 мин. Измеряли разницу по сравнению с базовым уровнем глюкозы (t=0) для каждого момента времени и определяли площадь под кривой AUC0-240 мин. ZP2669 значительно увеличивал толерантность к глюкозе у мышей db/db, страдающих диабетом. Фиг. 2. Влияние ZP2669 на потребление корма у мышей. Группы мышей, разделенных в соответствии с массой тела, не получавших корм в течение ночи, обрабатывали PYY3-36 (30 нмоль/кг) (внутренний положительный контроль), глюкагоном (500 нмоль/кг), ZP2669 (500 нмоль/кг) или наполнителем. Через 1 ч мышам давали предварительно взвешенный корм, оценивали потребление корма путем взвешивания оставшегося корма после 1 ч и рассчитывали значения относительно массы тела (мг пищи/г массы тела). PYY (3-36) демонстрировал аноректический эффект, как и ожидалось на основании полученных ранее результатов. ZP2669 (500 нмоль/кг) вызывал значительное сокращение потребления корма в течение первого часа после инъекции пептида. Глюкагон не оказывал влияние на потребление корма. Фиг. 3. Влияние 28-дневного лечения с помощью ZP2669 на массу тела у мышей с алиментарным ожирением (DIO). Самцов мышей C57Bl/6 содержали на диете с высоким содержанием жиров (HFD) и вводили им (дважды в день, подкожно) ZP2669 (500 нмоль/кг) или наполнитель. Контрольной группе мышей, не страдающих ожирением, которых содержали на обычном рационе, вводили наполнитель (CHOW) согласно схеме, указанной для группы мышей DIO. Массу тела измеряли ежедневно, и с учетом массы тела вводили мышам дозы пептида на протяжении всего исследования. ZP2669 замедлял прибавление массы тела на том же уровне, что и при содержании мышей на обычном рационе. Фиг. 4. Влияние обработки двойным агонистом GluGLP-1 мышей DIO в течение 4 недель (дважды в день) на концентрацию холестерина ЛПНП. Эффект ОХМ (р=0,002) и ZP2669 (р=0,0006) является статистически значимым, по сравнению с наполнителем. Фиг. 5. Влияние обработки двойным агонистом GluGLP-1 мышей DIO в течение 4 недель (дважды в день) на соотношение ЛПВП/ЛПНП. B качестве наполнителя для ОХМ, эксендина-4 применяли ФСБ (рН 7,4), в качестве наполнителя для ZP2669 применяли ацетат (рН 5,0). Эффект ОХМ (Р=0,2%) и ZP2669 (Р=0,05%) является статистически значимым, по сравнению с наполнителем. Фиг. 6. Химическая модификация 17-Lys в соединении ZP2872. Подробное описание изобретения В настоящем описании используется стандартный однобуквенный и трехбуквенный код для обозначения природных аминокислот, а также общепринятый трехбуквенный код для других аминокислот, таких как Aib (α-аминоизомасляная кислота), Orn (орнитин), Dbu (2,4-диаминомасляная кислота) и Dpr (2,3-диаминопропановая кислота). Термин "нативный глюкагон" относится к природному глюкагону человека, имеющему последовательность Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-TrpLeu-Met-Asn-Thr-OH (SEQ ID NO: 1). Термины "оксинтомодулин" и "ОХМ" относятся к природному оксинтомодулину человека, имеющему последовательность H-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-ArgAla-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Lys-Arg-Asn-Arg-Asn-Asn-lle-Ala-OH (SEQ ID NO: 3). Изобретение обеспечивает соединения, как определено выше. Во избежание неправильного толко-5- 020537 вания, в приводимых в настоящем документе определениях, как правило, предполагается, что последовательность X отличается от формулы I только по тем положениям, для которых указано, что в них разрешены изменения. Предполагается, что аминокислоты в последовательности X пронумерованы последовательно с 1 по 29 в общепринятом направлении от N-конца к С-концу. При упоминании "положения" в пределах X подразумевается соответствующее положение в пределах нативного глюкагона человека и других молекул. Соединения согласно настоящему изобретению могут содержать один или более внутримолекулярный мостик в пептидной последовательности X. Каждый такой мостик образуется между боковыми цепями двух аминокислотных остатков X, которые, как правило, разделены тремя аминокислотами в линейной последовательности X (т.е. между аминокислотой А и аминокислотой А+4). В частности, мостик может быть образован между боковыми цепями остатков пар 12 и 16, 16 и 20, 17 и 21, 20 и 24 или 24 и 28. Две боковые цепи могут быть соединены друг с другом посредством ионных взаимодействий или через ковалентные связи. Таким образом, эти пары могут включать остатки противоположно заряженных боковых цепей для формирования солевого мостика посредством ионных взаимодействий. Например, один из остатков может представлять собой Glu или Asp, тогда как другой может представлять собой Lys или Arg. Взаимодействие пары Lys и Glu и Asp Lys может также реагировать на форму лактамного кольца. Кроме того, Tyr и Glu или Tyr и Asp способны образовывать лактоновое кольцо. В частности, остатки в положениях 20 и 24 могут формировать внутримолекулярные мостики. Примеры подходящих пар остатков в этих положениях включают: Вне связи с какой-либо конкретной теорией считается, что такие внутримолекулярные мостики стабилизируют альфа-спиральную структуру молекулы и, таким образом, повышают эффективность и/или селективность в отношении рецепторов GLP-1 и, возможно, рецептора глюкагона. Замена в положении 12 (например, Arg или Leu) может повышать эффективность и/или селективности в отношении рецептора GLP-1. Наличие основных аминокислот (Arg, Lys или Ero) в положении 16 может повысить растворимость молекулы и ее биодоступность. Обнаружено, что остатки аргинина в положениях 17 и 18 нативного глюкагона обеспечивают значительную селективность по отношению к рецептору глюкагона. Ряд замен в одном или более из указанных положений может увеличить эффективность и/или селективность по отношению к рецептору GLP-1 и рецептору глюкагона. Lys или Leu в положении 17 может повысить эффективность по отношению к рецептору глюкагона. Lys может быть в особенности эффективным, особенно при наличии отрицательно заряженного остатка (например, Asp) в положении 21, благодаря возможности образования внутримолекулярного мостика. Гидрофобный или небольшой гидрофильный остаток (например, Ala или Ser) в положении 18 может повысить эффективность по отношению как к рецептору GLP-1, так и к рецептору глюкагона. Остатки в положениях 27, 28 и 29 нативного глюкагона, как было показано, обеспечивают значительную селективность по отношению к рецептору глюкагона. Замены по одному, двум или всем трем из этих положений в последовательности нативного глюкагона могут увеличить эффективность и/или селективность по отношению к рецептору GLP-1 без существенного снижения эффективности по отношению к рецептору глюкагона. Конкретные примеры включают Leu в положении 27, Arg в положении 28 и Ala в положении 29. 28-Arg может быть особенно предпочтительным при наличии отрицательно заряженной аминокислоты (например, Glu) в положении 24, с которой он может образовывать внутримолекулярный мостик, который может увеличивать влияние на эффективность по отношению к рецептору GLP-1. Замена природного остатка Met в положении 27 (например, на Leu, Lys или Glu) также снижает возможность окисления, таким образом увеличивая химическую стабильность соединений согласно настоящему изобретению. Замена природного остатка Asn в положении 28 (например, на Arg или Leu) также снижает вероятность дезамидирования в кислом растворе, таким образом увеличивая химическую стабильность соединений согласно настоящему изобретению. -6- 020537 Эффективность и/или селективность по отношению к рецептору GLP-1 также можно увеличить путем введения остатков, которые могут формировать амфипатическую спиральную структуру, потенциально без значительной потери эффективности по отношению к рецептору глюкагона. Это может быть достигнуто путем введения заряженных остатков в одно или более из положений 16, 20, 24 и 28. Таким образом, все остатки в положениях 24 и 28 могут быть заряженными, все остатки в положениях 20, 24 и 28 могут быть заряженными или все остатки в положениях 16, 20, 24 и 28 могут быть заряженными. Например, остаток в положении 20 может представлять собой His или Arg, в частности His. Остаток в положении 24 может представлять собой Glu, Asp Lys или Arg, в частности Glu. Остаток в положении 28 может представлять собой Arg. Замена одного или обоих природных остатков Gln в положениях 20 и 24 также снижает возможность дезамидирования в кислом растворе, таким образом увеличивая химическую стабильность соединений согласно настоящему изобретению. Соединение согласно настоящему изобретению может содержать С-концевую пептидную последовательность Z из 1-20 аминокислот, например, для стабилизации конформации и/или вторичной структуры пептида-аналога глюкагона и/или для обеспечения большей устойчивости к ферментативному гидролизу пептида-аналога глюкагона, например, как описано в WO 99/46283. Если присутствует, Z представляет собой пептидную последовательность из 1-20 аминокислотных остатков, например, в диапазоне из 1-15, более предпочтительно в диапазоне из 1-10, в частности в диапазоне из 1-7 аминокислотных остатков, например 1, 2, 3, 4, 5, 6 или 7 аминокислотных остатков, например из 6 аминокислотных остатков. Каждый из аминокислотных остатков в пептидной последовательности Z может быть независимо выбран из Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu (2,4 диаминомасляной кислоты), Dpr (2,3-диаминопропановой кислоты) и Orn (орнитина). Предпочтительно аминокислотные остатки выбраны из Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr и Orn, более предпочтительно только из Glu, Lys и Cys. Вышеупомянутые аминокислоты могут находиться либо в D-, либо в L-конфигурации, но предпочтительно находятся в L-конфигурации. Особенно предпочтительными последовательностями Z являются последовательности из четырех, пяти, шести или семи последовательных остатков лизина (т.е. Lys3, Lys4, Lys5, Lys6 или Lys7), в особенности пяти или шести последовательных остатков лизина. Другие примеры последовательностей Z приведены в WO 01/04156. B качестве альтернативы С-концевой остаток последовательности Z может представлять собой остаток Cys. Такой остаток может способствовать модификации (например, ПЭГилированию) указанного соединения. B таких вариантах реализации длина последовательность Z может, например, составлять только одну аминокислоту (т.е. Z = Cys) или длина может составлять две, три, четыре, пять, шесть или даже более аминокислот. Другие аминокислоты, таким образом, служат спейсером между пептидом X и концевым остатком Cys. Пептидная последовательность Z имеет не более 25% идентичности по последовательности с соответствующей последовательностью участка IP-1 ОХМ человека (который имеет последовательность LysArg-Asn-Arg-Asn-Asn-lle-Ala). "Процент (%) идентичности последовательности аминокислот" данной пептидной или полипептидной последовательности по отношению к другой полипептидной последовательности (например, IP-1) рассчитывают как процент аминокислотных остатков в данной пептидной последовательности, которые совпадают с соответствующими аминокислотными остатками в соответствующей последовательности указанного другого полипептида при выравнивании двух последовательностей относительно друг друга при введении пробелов для оптимального выравнивания в случае необходимости. Значения % идентичности могут быть определены с помощью WU-BLAST-2 (Altschul et al., Methods in Enzymology, 266:460480 (1996)). WU-BLAST-2 использует несколько параметров поиска, большинство из которых установлены в виде значений по умолчанию. Регулируемые параметры устанавливают с помощью следующих значений: интервал перекрывания = 1, доля перекрываний = 0,125, порог слова (Т) = 11. Значение % идентичности по последовательности аминокислот рассчитывают как количество совпадающих идентичных остатков, определенных с помощью WU-BLAST-2, деленное на общее количество остатков эталонной последовательности (при этом пробелы, введенные WU-BLAST-2 в эталонную последовательность с целью максимального счета выравнивания, не учитывают), умноженное на 100. Таким образом, при оптимальном выравнивании Z с 8 аминокислотами из IP-1 он имеет не более двух аминокислот, которые идентичны соответствующим аминокислотам IP-1. Одна или несколько боковых цепей аминокислот в соединения согласно настоящему изобретению может быть конъюгирована с липофильным заместителем. Липофильный заместитель может быть ковалентно связан с атомом боковой цепи аминокислоты или в качестве альтернативы может быть конъюгирован с боковой цепью аминокислоты посредством спейсера. Аминокислота может представлять собой часть пептида X или часть пептида Z. Вне связи с какой-либо теорией считается, что указанный липофильный заместитель связывает альбумин в кровотоке, таким образом экранируя соединения согласно настоящему изобретению от ферментативной деградации, что может увеличивать период полужизни соединений. Спейсер, если он присутствует, применяют, чтобы обеспечить промежуток между соединением и указанным липофильным замес-7- 020537 тителем. Липофильный заместитель может быть присоединен к боковой цепи аминокислоты или спейсеру через сложный эфир, сульфонильный эфир, тиоэфир, амид или сульфаниламид. Соответственно, подразумевается, что предпочтительно липофильный заместитель включает ацильную группу, сульфонильную группу, атом N, атом O или атом S, которые являются частью сложного эфира, сульфонильного эфира, тиоэфира, амида или сульфаниламида. Предпочтительно ацильная группа в составе липофильного заместителя образует часть амида или сложного эфира с боковой цепью аминокислоты или спейсером. Липофильный заместитель может включать углеводородную цепь, содержащую от 4 до 30 атомов углерода. Предпочтительно указанный заместитель содержит по меньшей мере 8 или 12 атомов углерода, и предпочтительно он содержит 24 атомов углерода или менее или 20 атомов углерода или менее. Углеводородная цепь может быть линейной или разветвленной и может быть насыщенной или ненасыщенной. Подразумевается, что углеводородная цепь предпочтительно содержит замещающую группу, которая присоединена к боковой цепи аминокислоты или спейсера, например ацильную группу, сульфонильную группу, атом N, атом O или атом S. Наиболее предпочтительно углеводородная цепь замещена ацилом, и, соответственно, углеводородная цепь может быть частью алканоильной группы, например пальмитоила, капроила, лауроила, миристоила или стеароила. Соответственно, липофильный заместитель может иметь формулу, представленную ниже: где "А" может представлять собой, например, ацильную группу, сульфонильную группу, NH, N-алкил, атом O или атом S, предпочтительно ацил; n - целое число от 3 до 29, предпочтительно по меньшей мере 7 или по меньшей мере 11, а более предпочтительно 23 или менее, более предпочтительно 19 или менее. Указанная углеводородная цепь может содержать дополнительный заместитель. Например, углеводородная цепь может дополнительно содержать до трех заместителей, выбранных из NH2, OH и COOH. Если углеводородная цепь содержит дополнительный заместитель, предпочтительно она содержит только один заместитель. B качестве альтернативы или дополнения, углеводородная цепь можеь включать циклоалкан или гетероциклоалкан, например, как показано ниже: Предпочтительно циклоалкан или гетероциклоалкан представляет собой 6-членное кольцо. Наиболее предпочтительно он представляет собой пиперидин. В качестве альтернативы, липофильный заместитель может содержать в основе циклопентанофенантреновый остов, который может быть частично или полностью ненасыщенным или насыщенным. Каждый атом углерода в указанном остове может быть замещен группой Me или OH. Например, липофильный заместитель может представлять собой холил, дезоксихолил или литохолил. Как упоминалось выше, липофильный заместитель может быть конъюгирован с боковой цепью аминокислоты посредством спейсера. Если присутствует, указанный спейсер присоединен к липофильному заместителю и боковой цепи аминокислоты. Спейсер может быть присоединен к липофильному заместителю и боковой цепи аминокислоты, независимо, посредством сложного эфира, сульфонильного эфир, тиоэфира, амида или сульфаниламида. Соответственно, он может содержать два фрагмента, независимо выбранных из ацила, сульфонила, атома N, атома O или атома S. Спейсер может иметь формулу где B и D независимо выбраны из ацила, сульфонила, NH, N-алкила, атома O или атома S, предпочтительно из ацила и NH; предпочтительно n представляет собой целое число от 1 до 10, предпочтительно от 1 до 5. Спейсер может быть дополнительно замещен одним или более заместителем, выбранным из C1-6алкила, С0-6алкиламина, С0-6алкилгидрокси и С0-6алкилкарбокси. В качестве альтернативы, указанный спейсер может содержать два или более повторяющихся звеньев, которые имеют указанную выше формулу. В, D и n выбирают для каждого повторного звена независимым образом. Смежные повторяющиеся звенья могут быть ковалентно связаны друг с другом через их соответствующие группы B и D. Например, группы B и D из смежных повторяющихся звеньев могут в совокупности образовывать сложный эфир, сульфонильный эфир, тиоэфир, амид или сульфаниламид. Свободные звенья B и D с каждого конца спейсера присоединены к боковой цепи аминокислоты и липофильному заместителю, как описано выше. Предпочтительно указанный спейсер содержит пять или менее, четыре или менее или три или менее повторяющихся звеньев. Наиболее предпочтительно спейсер содержит два повторяющихся звена или одно звено. Спейсер (или одно или более повторяющееся звено спейсера, если он содержит повторяющиеся -8- 020537 звенья) может представлять собой, например, природную или неприродную аминокислоту. Подразумевается, что для аминокислот, имеющих функционализированные боковые цепи, B и/или D могут представлять собой фрагмент боковой цепи аминокислоты. Спейсер может быть любой природной или неприродной аминокислотой. Например, спейсер (или одно или более повторяющееся звено спейсера, если он содержит повторяющиеся звенья) может представлять собой Gly, Pro, Ala, Val, Leu, Ile, Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gln, Asn, α-Glu, γ-Glu, Asp, Ser Thr, Gaba, Aib, β-Ala, 5-аминопентаноил, 6-аминогексаноил, 7-аминогептаноил, 8-аминооктаноил, 9-аминононаноил или 10-аминодеканоил. Например, указанный спейсер может представлять собой одну аминокислоту, выбранную из γ-Glu, Gaba, β-Ala и α-Gly. Липофильный заместитель может быть конъюгирован с боковой цепью любой из аминокислот соединений согласно настоящему изобретению. Предпочтительно боковая цепь аминокислоты включает карбокси, гидрокси, тиол, амидные или аминогруппы для образования сложного эфира, сульфонильного эфира, тиоэфира, амида или сульфаниламида со спейсером или липофильным заместителем. Например, липофильный заместитель может быть конъюгирован с Asn, Asp, Glu, Gln, His, Lys, Arg, Ser, Thr, Tyr, Trp, Cys или Dbu, Dpr и Orn. Предпочтительно липофильный заместитель конъюгирован с Lys. Однако любая аминокислота, обозначенная как Lys в формулах, приведенных в настоящем документе, может быть замещена на Dbu, Dpr и Orn, при присоединении липофильного заместителя. Пример липофильного заместителя и спейсера представлен в приведенной ниже формуле: Здесь, Lys из соединения согласно настоящему изобретению (например, из X) ковалентно присоединен к γ-Glu (спейсер) посредством амидной группы. Пальмитоил ковалентно присоединен к спейсеру γ-Glu посредством амидной группы. В конкретном варианте реализации настоящего изобретения соединение включает или состоит из пептида X, имеющего последовательность: В качестве альтернативы или дополнения, одна или более боковая цепь аминокислоты в соединении согласно настоящему изобретению может быть конъюгирована с полимерной группой, например, с целью увеличения растворимости и/или периода полужизни in vivo (например, в плазме крови) и/или биодоступности. Также известно, что такая модификация уменьшает выведение из организма (например, выведение через почки) терапевтических белков и пептидов. Полимерная группа предпочтительно растворима в воде (является амфифильной или гидрофильной), нетоксична и фармацевтически инертна. Подходящие полимерные группы включают полиэтиленгликоль (ПЭГ), гомо- или сополимеры ПЭГ, монометилзамещенные полимеры ПЭГ (МПЭГ) или полиоксиэтилен глицерол (ПОГ). См., например, Int. J. Hematology, 68:1 (1998); Bioconjugate Chem. 6:150 (1995) и Crit. Rev. Therap. Drug Carrier Sys. 9:249 (1992). Другие подходящие полимерные группы включают полиаминокислоты, такие как полилизин, полиаспарагиновую кислоту и полиглутаминовую кислоту (см., например, Gombotz, et al. (1995), Bioconjugate Chem., vol. 6, 332-351; Hudecz, et al. (1992), Bioconjugate Chem., vol. 3, 49-57; Tsukada, et al. (1984), J. Natl. Cancer Inst., vol. 73, 721-729 и Pratesi, et al. (1985), Br. J. Cancer, vol. 52, 841-848). Полимерная группа может быть линейной или разветвленной. Она может иметь молекулярную массу 500-40000 Да, например 500-10000 Да, 1000-5000 Да, 10000-20000 Да или 20000-40000 Да. Соединение согласно настоящему изобретению может содержать две или более такие группы, в этом случае суммарный молекулярный вес всех таких групп, как правило, попадает в диапазоны, указанные выше. Полимерные группы могут быть соединены (посредством ковалентной связи) с амино, карбоксильной или тиоловой группой боковой цепи аминокислоты. Предпочтительными примерами являются тиоловые группы остатков Cys и эпсилон-аминогруппы остатков Lys, и также можно применять карбоксильные группы остатков Asp и Glu. Специалисту в данной области хорошо известны соответствующие способы, которые можно применять для реакции сочетания. Например, ПЭГ фрагмент, несущий метоксигруппу может быть присое-9- 020537 динен к тиоловой группе Cys посредством малеимидной связи с помощью регентов, коммерчески доступны от Nektar Therapeutics AL. Более подробную информацию о подходящих химических группах см. также в WO 2008/101017 и источниках, приведенных выше. Синтез пептидов. Соединения согласно настоящему изобретению можно получить с помощью стандартных способов синтеза, с помощью рекомбинантных систем для экспрессии или любым другим способом, известным в данной области техники. Таким образом, аналоги глюкагона могут быть синтезированы рядом способов, включая, например, следующие способы: (а) синтез пептида твердофазным или жидкофазным способом, последовательно или путем соединения фрагментов, с последующим выделением и очисткой конечного пептида; (б) экспрессия генетической конструкции нуклеиновой кислоты, кодирующей пептид, в клеткехозяине и выделение продукта экспрессии из культуры клеток хозяина или (в) осуществление внеклеточной экспрессии in vitro генетической конструкции нуклеиновой кислоты, кодирующей пептид и выделение продукта экспрессии; или любую комбинацию способов (а), (б) и (в) с получением фрагментов пептида с последующим соединением фрагментов для получения пептида, и выделение пептида. Предпочтителен синтез аналогов согласно настоящему изобретению с помощью твердофазного или жидкофазного синтеза пептидов. Этот аспект рассмотрен в WO 98/11125 и, среди множества других источников, "Principles and practice of solid-phase peptide synthesis". In: Synthetic Peptides (2nd Edition) и примерах, приведенных в настоящем документе. Для рекомбинантной экспрессии фрагменты нуклеиновых кислот согласно настоящему изобретению, как правило, помещают в соответствующие векторы для получения векторов для клонирования или экспрессионных векторов, несущих фрагменты нуклеиновых кислот согласно настоящему изобретению; такие новые векторы также являются частью настоящего изобретения. Векторы могут, в зависимости от цели и типа назначения, представлять собой плазмиды, фаги, космиды, мини-хромосомы или вирусы; кроме того, чистая ДНК, которая только временным образом экспрессируется в определенных клетках, также представляет собой важный вектор. Предпочтительные векторы для клонирования или экспрессионные векторы (плазмидные векторы) согласно настоящему изобретению способны к автономной репликации, тем самым обеспечивая высокую копийность для целей высокого уровня экспрессии или высокого уровня репликации для последующего клонирования. В общих чертах, экспрессионный вектор включает в себя следующие особенности в направлении 5'→3', которые функциональным образом соединены друг с другом: промотор, управляющий экспрессией фрагмента нуклеиновой кислоты изобретения, при необходимости последовательность нуклеиновой кислоты, кодирующей лидерный пептид, обеспечивающий секрецию (во внеклеточную фазу или, где это применимо, в периплазму); фрагмент нуклеиновой кислоты, кодирующий пептид согласно настоящему изобретению, и, при необходимости последовательность нуклеиновой кислоты, кодирующую терминатор. Перечисленные компоненты могут включать в себя дополнительные особенности, такие как селективные маркеры и точки начала репликации. При работе с экспрессионным вектором в штаммахпродуцентах или в клеточных линиях может быть предпочтительно, чтобы вектор был способен интегрироваться в геном клетки-хозяина. Специалисты, хорошо знакомые с соответствующими векторами, способны сконструировать векторы в соответствии с их специфичными требованиями. Векторы согласно настоящему изобретению применяют для трансформации клеток-хозяев для получения соединения согласно изобретению. Такие трансформированные клетки, которые также являются частью настоящего изобретения, могут быть культивируемыми клетками или клеточными линиями, используемыми для размножения фрагментов нуклеиновых кислот и векторов изобретения, или их можно применять для рекомбинантного получения пептидов согласно настоящему изобретению. Предпочтительными трансформированными клетками согласно настоящему изобретению являются микроорганизмы, такие как бактерии (например, виды рода Escherichia (например, Е.coli), Bacillus (например, Bacillus subtilis), Salmonella или Mycobacterium (желательно непатогенные, например, М.Bovis BCG), дрожжи (такие как Saccharomyces cerevisiae) и простейшие. Кроме того, трансформированные клетки могут быть получены из многоклеточного организма, т.е. это могут быть клетки грибов, насекомых, растений или млекопитающих. Для целей клонирования и/или оптимизированной экспрессии предпочтительно, чтобы трансформированная клетка была способна к репликации фрагмента нуклеиновых кислот изобретения. Клетки, экспрессирующие фрагмент нуклеиновой кислоты, являются полезным осуществлением изобретения; их можно применять для мелкомасштабной или крупномасштабной продукции пептида согласно настоящему изобретению. При производстве пептида согласно настоящему изобретению с помощью трансформированных клеток удобно, хотя это и не является существенным, чтобы продукт экспрессии секретировался в культуральную среду. Эффективность. Связывание соответствующих соединений с рецепторами к GLP-1 или глюкагону (Glu) можно использовать как индикатор агонистической активности, но, в целом, предпочтительнее использовать био- 10 - 020537 логический тест, который позволяет оценить внутриклеточный путь передачи сигнала, индуцированный связыванием соединения с соответствующим рецептором. Например, активация рецепторов глюкагона агонистом глюкагона стимулирует образование клеточного циклического АМФ (цАМФ). Сходным образом, активация GLP-1 рецепторов агонистом GLP-1 стимулирует образование клеточного цАМФ. Таким образом, выработку цАМФ в подходящих клетках, экспрессирующих один из этих двух рецепторов, можно использовать для мониторинга активности соответствующих рецепторов. Применение подходящей пары типов клеток, каждый из которых экспрессирует только один тип рецептора, соответственно, можно использовать для определения агонистической активности в отношении обоих типов рецепторов. Специалистам известны подходящие способы анализа; а примеры приведены ниже. Рецепторы к GLP-1 и/или глюкагону могут иметь последовательности рецепторов, как описано в примерах. Например, в тестах можно использовать рецептор к глюкагону человека (глюкагон-R), имеющий первичный регистрационный номер, GI: 4503947 и/или рецептор к глюкагон-подобному пептиду 1 человека (GLP-1R), имеющий первичный регистрационный номер GI: 166795283 (в случаях, где приведены последовательности белка-предшественника, следует понимать, что для анализа необходимо использовать зрелый белок, в котором отсутствует сигнальная последовательность). Значение EC50 можно использовать в качестве численной меры агонистической эффективности данного рецептора. Значение EC50 представляет собой единицу измерения концентрации соединения, необходимой для достижения половины максимальной активности соединения в конкретном анализе. Так, например, соединение с EC50 [GLP-1R] ниже, чем EC50 [GLP-1R] нативного глюкагона, в конкретном анализе может рассматриваться как соединение с более высокой эффективностью связывания c GLP-1R, чем глюкагон. Соединения, описанные в данном документе, как правило, представляют собой двойные агонисты Glu-GLP-1, т.е. они способны стимулировать образование цАМФ при связывании как с рецептором глюкагона, так и с рецептором GLP-1. Стимулирование каждого рецептора можно измерить в независимых тестах, а затем сравнить полученные значения друг с другом. При сравнении значения EC50 рецептора глюкагона (EC50 [глюкагон-R]) со значением EC50 для рецептора GLP-1 (EC50 [GLP-1R]) для данного соединения можно рассчитать относительную селективность глюкагона (в %) для данного соединения как: Относительную GLP-1R селективность также можно рассчитать как: Относительная селективность соединения позволяет сравнить влияние на рецептор GLP-1 или глюкагона с его эффектом на другой рецептор. Например, чем больше относительная селективность соединения относительно GLP-1, тем более эффективно дано соединение по отношению к рецептору GLP-1, по сравнению с рецептором к глюкагону. При использовании тестов, описанных ниже, авторы обнаружили, что относительная селективность GLP-1 в сравнении с глюкагоном человека составляет примерно 5%. Соединения согласно настоящему изобретению имеют более высокую относительную селективность по отношению к GLP-1R, чем глюкагон человека. Таким образом, при конкретном уровне агонистической активности по отношению к рецептору глюкагона соединение будет демонстрировать более высокий уровень агонистической активности GLP-1R (т.е. большую эффективность по отношению к рецептору GLP-1), чем глюкагон. Следует иметь в виду, что абсолютные значения эффективности конкретного соединения по отношению к рецептору к глюкагону и GLP-1 могут быть выше, ниже или приблизительно равны аналогичным значениям для нативного глюкагона человека при условии, что достигается соответствующая относительная селективность к GLP-1R. Тем не менее, соединения согласно настоящему изобретению могут иметь более низкое значение ЕС50 [GLP-1R], чем глюкагон человека. Соединения могут иметь более низкое значение EC50 [GLP-1R], чем глюкагон, сохраняя при этом EC50 [глюкагон-R], которое менее чем в 10 раз выше, чем у глюкагона человека, менее чем в 5 раз выше, чем у глюкагона человека, или менее чем в 2 раза выше, чем у глюкагона человека. Соединения согласно настоящему изобретению могут характеризоваться значением EC50 [глюкагон-R], которое менее чем в 2 раза отличается от аналогичного значения для глюкагона человека. Указанные соединения могут характеризоваться значением EC50 [глюкагон-R], которое менее чем в 2 раза отличается от значения для глюкагона человека, и значением ЕС50 [GLP-1R], которое составляет менее половины от значения для глюкагона человека, менее пятой части от значения для глюкагона человека или менее одной десятой от значения для глюкагона человека. Относительная селективность GLP-1 соединений согласно настоящему изобретению может составлять от 5 до 95%. Например, соединения согласно настоящему изобретению могут иметь относительную - 11 - 020537 селективность 5-20%, 10-30%, 20-50%, 30-70%, или 50-80%, или 30-50%, 40-60,%, 50-70%, или 75-95%. - 12 - 020537 Терапевтическое применение. Соединения согласно настоящему изобретению могут обеспечить перспективный подход для лечения ожирения и метаболических заболеваний, включая диабет типа 2. Сахарный диабет, который часто называют просто как диабет, представляет собой синдром нарушения обмена веществ, обычно вследствие сочетания наследственных и экологических причин, выражающийся в аномально высоком уровне сахара в крови (гипергликемия). Уровень глюкозы в крови находятся под контролем гормона инсулина, производимого бетаклетками поджелудочной железы. Диабет развивается из-за разрушения продуцирующих инсулин панкреатических бета-клеток (при диабете 1 типа) или из-за устойчивости к воздействию инсулина (при гестационном диабете), а затем потери бета-клеток (при диабете 2 типа). Оба типа диабета приводит к гипергликемии, что во многом является причиной острых признаков диабета: чрезмерной выработке мочи, вызывающей компенсационную жажду и увеличение потребления жидкости, ухудшении зрения, необъяснимой потери веса, вялости, а также изменений в энергетическом обмене. Метаболический синдром характеризуется группой метаболических факторов риска у отдельно взятого человека. Они включают в себя абдоминальное ожирение (избыточная жировая ткань вокруг внутренних органов брюшной полости), атерогенную дислипидемию (нарушения жиров в крови, включая высокий уровень триглицеридов, низкий уровень холестерина ЛПВП и/или высокий ЛПНП холестерина, что способствует образованию бляшек на стенках артерий), повышенное кровяное давление (гипертония), резистентность к инсулину и нарушение устойчивости к глюкозе, протромботическое состояние (например, высокий уровень фибриногена и ингибитора активатора плазминогена-1 в крови) и провоспалительное состояние (например, повышенный уровень С-реактивного белка в крови). Индивиды с метаболическим синдромом имеют повышенный риск развития диабета типа 2, а также ишемической болезни сердца и других заболеваний, связанных с другими проявлениями атеросклероза (например, инсульта и заболевания периферических сосудов). Доминирующими основными факторами риска для этого синдрома представляются абдоминальное ожирение, резистентность к инсулину и нарушение толерантности к глюкозе; протромботическое состояние (например, высокий уровень фибриногена и ингибитора активатора плазминогена-1 в крови) и провоспалительное состояние (например, повышенный уровень С-реактивного белка в крови). Вне связи с какой-либо конкретной теорией, считается, что соединения согласно настоящему изобретению действуют как двойные агонисты GluGLP-1. Двойной агонист сочетает в себе действие глюкагона на жировой обмен с влиянием GLP-1 на уровень глюкозы в крови и прием пищи. Соединения согласно настоящему изобретению, таким образом, могут действовать в синергетическом режиме и ускорять устранение излишних жировых отложений, вызвать устойчивое снижение веса и непосредственно снижать аномальный уровень глюкозы до нормального без риска гипогликемии, которая связана с сопутствующим использованием GLP-1 агонистов и сульфонилмочевины. Синергетический эффект двойных агонистов GluGLP-1 может также привести к снижению сердечно-сосудистых факторов риска, таких как высокий уровень холестерина и ЛПНП, а также изменить устойчивость к глюкозе, приведенные факторы могут быть полностью независимы от их влияния на массу тела. Соединения согласно настоящему изобретению можно применять в качестве лекарственного средства для предотвращения увеличения веса, способствующего снижению веса, устранению избыточной массы тела или лечения ожирения (например, контроль аппетита, питания, приема пищи, калорий и/или расхода энергии), в том числе патологического ожирения, а также сопутствующих заболеваний и состояний, включая, но не ограничивая, ожирение, связанное с воспалением, ожирение, связанное с заболеванием желчного пузыря, и ожирение, индуцирующее апноэ сна. Соединения согласно настоящему изобретению можно также применять для лечения метаболического синдрома, резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, артериальной гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца и инсульта. Все эти патологические состояния могут быть связаны с ожирением. Тем не менее, влияние соединений согласно настоящему изобретению на указанные патологические состояния может быть опосредовано в целом или частично через влияние на вес тела или может быть независимым от него. Фармацевтические композиции. Соединения согласно настоящему изобретению или их соли могут быть приготовлены как фармацевтические смеси, пригодные для хранения или введения, которые обычно содержат терапевтически эффективное количество соединения согласно настоящему изобретению или его соли в фармацевтически приемлемом носителе. Терапевтически эффективное количество соединения согласно настоящему изобретению будет зависеть от пути введения, типа млекопитающего, которого лечат, и физических характеристик конкретного рассматриваемого млекопитающего. Эти факторы и их отношение к определению этого количества хорошо известны квалифицированным врачам. Это количество и способ введения могут быть адаптированы для достижения оптимальной эффективности и могут зависеть от таких факторов, как вес, диета, одновременное лечение другими препаратами и других факторов, хорошо известных квалифицирован- 13 - 020537 ным врачам. Для определения размеров доз и режима дозирования, наиболее подходящего для человека, можно руководствоваться результатами согласно настоящему изобретению, которые могут быть подтверждены в тщательно спланированных клинических испытаниях. Эффективная доза и протокол лечения могут быть определены с помощью традиционных средств, начиная с низкой дозы на лабораторных животных, а затем посредством увеличения дозы с параллельным наблюдением эффектов, а также путем систематического изменения режима дозирования. Многочисленные факторы должны рассматриваться врачом при определении оптимальной дозы для данной персоны. Такие соображения известны специалистам. Термин "фармацевтически приемлемый носитель" включает любой из стандартных фармацевтических носителей. Фармацевтически приемлемые носители для терапевтического применения хорошо известны в фармакологии и описаны, например, в Remington's Pharmaceutical Sciences, Mark Publishing Co. (A.R. Gennaro edit. 1985). Например, можно применять стерильный физиологический раствор и фосфатно-солевой буфер при слегка подкисленных или физиологических значениях рН. рН-буферными агентами могут быть фосфат, цитрат, ацетат, трис-(гидроксиметил)аминометан (Трис), N-трис-(гидроксиметил)метил-3-аминопропансульфоновая кислота (TAPS), бикарбонат аммония, диэтаноламин, гистидин, который представляет собой предпочтительный буфер, аргинин, лизин или ацетат или их смеси. Термин в дальнейшем включает любой агент, перечисленный в Фармакопее США для использования у животных, включая человека. Термин "фармацевтически приемлемые соли" относится к солям соединений. Соли включают фармацевтически приемлемые соли, такие как кислотно-аддитивные соли и основные соли. Примеры кислотно-аддитивных солей являются гидрохлориды, цитраты и ацетаты. Примерами основных солей являются соли, где катион выбран из щелочных металлов, таких как натрий и калий, щелочно-земельных металлов, таких как кальций, и ионы аммония + N(R3)3(R4), где R3 и R4 независимо обозначают необязательно замещенный С1-6алкил, необязательно замещенный С2-6алкенил, необязательно замещенный арил или необязательно замещенный гетероарил. Другие примеры фармацевтически приемлемых солей описаны в "Remington's Pharmaceutical Sciences", 17th edition. Ed. Alfonso R. Gennaro (Ed.), Mark Publishing Company, Easton, PA, U.S.A., 1985 и в более поздних изданиях, а также в энциклопедии фармацевтической технологии. "Лечение" представляет собой подход для получения полезных или желаемых клинических результатов. Для целей данного изобретения полезные или желаемые клинические результаты включают, но не ограничиваются перечисленным, облегчение симптомов, уменьшение степени заболевания, стабилизацию (т.е. отсутствие ухудшения) состояния болезни, задержку или замедление прогрессирования заболевания, улучшение или паллиативное лечение болезненного состояния и ремиссию (частичную или полную), независимо от того, обнаружены или не обнаружены. "Лечение" может также означать продление срока жизни по сравнению с ожидаемым сроком жизни при отсутствии лечения. "Лечение" является вмешательством, осуществляемым с целью предотвращения развития или изменения патологии расстройства. Соответственно, термин "лечение" относится как к терапевтическим, так и к профилактическим и предупредительным мерам. К тем, кто нуждается в лечении, относятся носители заболевания, а также те лица, у которых необходимо предотвратить развитие заболевания. Фармацевтические композиции могут быть в форме дозы для однократного введения. B таком виде смесь разделена на единичные дозы, содержащие соответствующие количества активного компонента. Единичная доза может быть подготовлена для упаковки, содержащей дискретные количества препаратов, например пакетик таблеток, капсул и порошков во флаконах или ампулах. Единичная доза может быть также в виде капсул, облаток или таблеток или это может быть соответствующее количество любой из этих упаковочных форм. Упаковка может быть предоставлена в виде разовой дозы в инъекционной форме, например в виде ручки. Смеси могут быть разработаны для любого приемлемого способа и вида введения. Фармацевтически приемлемые носители или разбавители включают те, которые используются в составах, пригодных для перорального, ректального, назального, местного (в том числе защечного и подъязычного), вагинального или парентерального (включая подкожные, внутримышечные, внутривенные, внутрикожные и трансдермальные) введения. Смеси могут быть удобно представлены в форме единичной дозы и могут быть получены любым из способов, хорошо известных в области фармацевтики. Для соединений, описанных в настоящем документе, в особенности подходят подкожные или трансдермальные способы введения. Комбинированная терапия. Соединения согласно настоящему изобретению можно вводить в рамках комбинированной терапии с агентом для лечения сахарного диабета, ожирения или гипертонии. В таких случаях два указанных активных агента можно назначать совместно или по отдельности, как часть одного и того же фармацевтического препарата, или в виде отдельных препаратов. Таким образом, соединение согласно настоящему изобретению (или его соль) можно применять в сочетании с антидиабетическими агентами, включая, но не ограничиваясь приведенными примерами, метформин, сульфонилмочевину, глинид, DPP-IV ингибитор, глитазон или инсулин. B предпочтительном варианте соединения или соли применяют в комбинации с инсулином, DPP-IV ингибитором, суль- 14 - 020537 фонилмочевиной или метформином, особенно с сульфонилмочевиной или метформином, для достижения адекватного контроля гликемии. B еще более предпочтительном варианте соединения или соли согласно настоящему изобретению применяют в комбинации с инсулином или аналогом инсулина для достижения адекватного контроля гликемии. Примеры аналогов инсулина включают, но не ограничиваются перечисленными, Lantus, Novorapid, Humalog, Novomi и ActraphaneHM. Соединение или соль согласно настоящему изобретению можно, кроме того, применять в комбинации с агентами против ожирения, включая, но не ограничиваясь данными примерами, агонист рецептора глюкагон-подобного пептида 1, пептид YY или его аналог, антагонист каннабиноидного рецептора 1, ингибитор липазы, агонист рецептора 4 меланокортина или антагонист концентрирующего гормонального рецептора 1 меланина. Аналог соединения согласно настоящему изобретению или его соль можно применять в комбинации с агентами от гипертонии, включая, но не ограничиваясь данными примерами, ингибитор ангиотензин-превращающего фермента, блокатор рецептора ангиотензина II, диуретики, бета-блокаторы или блокаторы кальциевых каналов. Методы. Общий синтез аналогов глюкагона. Твердофазный синтез пептидов осуществляли как СППС на синтезаторе, оборудованном микроволнами, с использованием стандартной Fmoc стратегии в NMP на полистирольной смоле (TentaGelSRam). HATU вместе с DIPEA в качестве основания использовали в качестве связывающего реагента. Пиперидин (20% в NMP) использовали для снятия защиты. Псевдопролины: Fmoc-Phe-Thr (Psi. Me, Mepro)-OH и Fmoc-Asp-Ser (Psi. Me, Mepro)-OH (приобретены у NovaBiochem) использовали, где это было применимо. Отщепление. Синтезированный пептид отщепляли от смолы путем обработки 95/2.5/2.5% (v/v) TFA/TIS/вода при комнатной температуре в течение 2 ч. Для пептидов с метионином в последовательности использовали смесь 95/5% (v/v) TFA/EDT. Большинство TFA удаляли при пониженном давлении, синтезированный пептид осаждали, промывали диэтиловым эфиром и высушивали до постоянной массы при комнатной температуре. Очистка синтезированного пептида путем ВЭЖХ. Синтезированный пептид очищали стандартной обратной фазовой ВЭЖХ на рабочей станции PerSeptive Biosystems VISION. Для управления прибором и сбора данных использовали VISION 3,0 программное обеспечение. Пептиды анализировали с использованием масс-спектрометрии и очищали до более чем 90% по оценке с помощью ВЭЖХ. Общий синтез ацилированных аналогов глюкагона. Неочищенный пептид синтезировали, как описано выше для общего синтеза аналогов глюкагона, за исключением, что неочищенный пептид ацилировали по боковой цепи остатка лизина, пока пептид был связан со смолой и полностью защищен по группам боковых цепей, за исключением эпсилон-амина на лизине, который должен быть ацилирован. Лизин, который должен быть ацилирован, вводили с помощью Fmoc-Lys (ivDde)-OH. N-конец пептида защищали группой Boc с использованием Вос2О в NMP. B то время как пептид был связан со смолой, защитную группу ivDde избирательно отщепляли при помощи 2% гидразин гидрата в NMP. Незащищенная боковая цепь лизина сначала связывается со спейсерной аминокислотой, как Fmoc-Glu-OtBu, с которой снимали защиту пиперидином и ацилировали жирными кислотами с использованием стандартной методологии связывания пептида, как описано выше. Наоборот, гистидин на N-конце может быть включен в начало, как Boc-His (Boc)-OH. Отщепление от смолы и очистку осуществляли, как описано выше. Анализ стабильности пептида. Аналоги глюкагона инкубировали в виде твердых соединений при 40°С и растворяли в виде растворов в 0,1 М водной HCl (2 мг/мл). Растворы инкубировали при 40°C. Оставшиеся интактными аналоги глюкагона измеряли путем ОФ-ВЭЖХ путем интеграции УФ-сигнала при 220 нм. Процент оставшихся интактными аналогов глюкагона представляет собой меру относительной стабильности. Твердые и растворенные соединения глюкагона перед анализом разводили в растворителях для ВЭЖХ до концентрации 0,2 мг/мл и анализировали в соответствующих временных точках. - 15 - 020537 Таблица 1 Параметры аналитической ВЭЖХ Получение клеточных линий, экспрессирующих глюкагон и GLP-1 рецептор человека. кДНК, кодирующую рецептор глюкагона человека (глюкагон-R) (первичный регистрационный номер Р47871) и рецептор глюкагон-подобного пептида 1 человека (GLP-1R) (первичный регистрационный номер Р43220) клонировали из клонов кДНК ВС104854 (MGC: 132514/Image: 8143857) или ВС112126 (MGC: 138331/IMAGE: 8327594) соответственно. ДНК, кодирующую рецептор глюкагона или GLP-1R, амплифицировали способом ПЦР с использованием праймеров, в состав которых входят концевые сайты рестрикции для субклонирования. К 5'-концу праймера дополнительно присоединяли близкую к консенсусу последовательности Козака для обеспечения эффективной трансляции. Отсутствие ошибок в ДНК, кодирующей глюкагон-R и GLP-1R, проверяли путем секвенирования ДНК. ПЦР-продукты, кодирующие глюкагон-R или GLP-1R, субклонировали в экспрессионный вектор млекопитающих, содержащий ген устойчивости к неомицину (G418). Экспрессионные векторы млекопитающих, кодирующие глюкагон-R или GLP-1R, трансфицировали в HEK-293 путем стандартного способа трансфекции с фосфатом кальция. Через 48 ч после трансфекции клетки высевали для ограничения разбавления клонирования и отбирали на культуральной среде с 1 мг/мл G418. Три недели спустя 12 выживших колоний, клетки которых экспрессировали рецептор глюкагона и GLP-1R, собирали, размножали и применяли в анализе по определению эффективности в отношении к рецептору глюкагона и GLP-1R, как описано ниже. Для анализа профиля соединений был выбран один клон, экспрессирующий рецептор глюкагона, и один клон, экспрессирующий GLP-1R. Анализ эффективности по отношению к рецептору глюкагона и рецептору GLP-1. Клетки HEK-293, экспрессирующие рецептор глюкагона человека или рецептор GLP-1 человека, высевали в количестве 40000 клеток на лунку в 96-луночные микротитровальные планшеты, покрытые 0,01% поли-L-лизином, и выращивали в течение 1 дня в культуре в 100 мкл культуральной среды. B день анализа культуральную среду удаляли и клетки промывали однократно 200 мкл буфера Tyrode. Клетки инкубировали в 100 мкл буфера Tyrode, содержащего возрастающие концентрации тестовых пептидов, 100 мкл IBMX и 6 мМ глюкозу, в течение 15 мин при 37°С. Реакцию останавливали добавлением 25 мкл 0,5 М HCl, инкубировали на льду в течение 60 мин. Содержание цАМФ оценивали при помощи набора FlashPlatecAMP от Perkin-Elmer. EC50 и относительную эффективность по сравнению с эталонными соединениями (глюкагон и GLP-1) оценивали путем программного совмещения с кривой. Липолиз в первичных адипоцитах крыс. Эффект аналогов глюкагона на липолиз исследовали на первичных культурах адипоцитов крыс. Адипоциты выделяли из эпидидимальной жировой ткани, полученной от нормальных молодых половозрелых крыс Sprague-Dawley. Куски жира измельчали и инкубировали на шейкере (220 об/мин) с коллагеназой (1 мг/мл) в буфер Кребса-Рингера, содержащего 4% BSA (KRB-BSA) в течение 60 мин при 37°С. Суспензию фильтровали через нейлоновый фильтр (размер пор 160 мкм), фильтрат центрифугировали при 200×g в течение 3 мин. Среду под верхним плавающим слоем адипоцитов удаляли пастеровской пипеткой. Адипоциты промывали 3 раза в KRB-BSA буфере, ресуспендировали и центрифугировали. Адипоциты ресуспендировали в KRB-BSA буфере, смешивали и инкубировали на шейкере с тестовыми соединениями в 96-луночных глубоких планшетах (50000 клеток/лунку) в общем объеме 1 мл при 37°C в течение 60 мин. Планшеты оставляли на льду в течение не менее 10 мин после инкубации с последующим центрифугированием при 200×g в течение 3 мин. 300 мкл буфера из-под слоя адипоцитов помещали в 96-луночные глубокие планшеты. Этот процесс повторяли еще два раза, затем объединяли 3 экстракта, собранные от каждой культуры. Глицерин, образовавшийся в результате липолиза в культурах адипоцитов, измеряли путем добавления реагента свободного глицерина (200 мкл) к аликвотам экстракт адипоцитов (25 мкл), инкубировали при комнатной температуре в течение 15 мин и измеряли оптическую плотность при 540 нм. - 16 - 020537 Оральный тест на толерантность к глюкозе (ОТТГ) у мышей db/db. У мышей db/db Dbu, не получавших корм в течение ночи, брали первичные образцы крови (уровень глюкозы в крови натощак) перед введением (интраперитонеально) наполнителя (ацетатный буфер, 20 мМ уксусная кислота, 250 мМ маннитол, рН 5,0) или тестируемого соединения ZP2669 (SEQ ID NO: 4) (45 нмоль/кг). B ходе эксперимента мышам не давали корм во избежание эффекта смешения с потребляемым кормом. Через 15 мин мышам перорально вводили глюкозу (1 г/кг в 5 мл/кг) и измеряли уровень глюкозы в крови при t=30 мин, t=60 мин, t=120 мин и t=240 мин. Измеряли разницу по сравнению с базовым уровнем глюкозы (t=0) для каждого момента времени и определяли площадь под кривой AUC0-240 мин. Статистический анализ значений AUC путем однофакторного дисперсионного анализа и апостериорного анализа Даннетта проводили с помощью программы GraphPad Prism версии 4. Различия рассматривали как статистически значимые при р<0,05. Потребление корма у нормальных мышей. За неделю до исследования мышам C57Bl/6 (8 недель) (N=9-12 животных в каждой группе) вводили путем ежедневных инъекций (подкожно) 0,2 мл наполнителя и адаптировали мышей к условиям эксперимента путем их взвешивания дважды в неделю. За один день до начала эксперимента мышей разделяли на группы со схожими значениями массы тела (МТ). Группам мышей, не получавших корма в течение ночи, вводили (10 мкл раствора тестируемого соединения/г МТ, подкожно) PYY3-36 (30 нмоль/кг) (внутренний положительный контроль), глюкагон (500 нмоль/кг) и ZP2669 (SEQ ID NO: 4) (500 нмоль/кг) или наполнитель. Через 1 ч мышам давали предварительно взвешенный корм, оценивали потребление корма путем взвешивания оставшегося корма после 1 ч и рассчитывали значения относительно массы тела (мг пищи/кг МТ). Статистический анализ данных по потреблению корма путем однофакторного дисперсионного анализа и апостериорного анализа Даннетта проводили с помощью программы GraphPad Prism версии 4. Различия рассматривали как статистически значимые при р<0,05. Влияние 28-дневного лечения мышей с алиментарным ожирением (DIO) с помощью агониста ZP2669 (SEQ ID NO: 4) на массу тела и содержание холестерина в плазме. За четыре недели до медикаментозного лечения самцов мышей C57Bl/6 (7 недель)) (N=10-12 животных в каждой группе) сажали на диету с высоким содержание жиров (HFD) и устанавливали им цикл дня и ночи при 2000/0800 ч. Экспериментальных животных подготавливали к лечению путем ежедневных инъекций (п/к) по 0,1 мл наполнителя и адаптировали их к условиям эксперимента путем взвешивания дважды в неделю перед введением лекарственного препарата. За день до начала эксперимента мышей разделяли на группы со схожими значениями массы тела (МТ) и на следующий день группам мышей вводили (дважды в день, п/к) ZP2669 (SEQ ID NO: 4) (500 нмоль/кг) или наполнитель (ацетатный буфер). ZP2669 (SEQ ID NO: 4) вводили в изотоническом ацетатном буфере (рН 4,8; 2,5 мкл/г МТ). Контрольной группе мышей, не страдающих ожирением, которых содержали на обычном рационе, вводили наполнитель согласно схеме, указанной для группы мышей DIO. Массу тела измеряли ежедневно и с учетом массы тела вводили мышам дозы пептида на протяжении всего исследования. Животные не получали корм в течение ночи перед умерщвлением. Образцы крови глаза (0,6 мл ЭДТА) собирали на следующее утро непосредственно перед смещением шейных позвонков. Образцы плазмы крови хранили при температуре -80°C перед анализом на содержание холестерина, ЛПВП и ЛПНП с использованием коммерчески доступных наборов. Прирост массы тела рассчитывали для каждого животного, вычитая значение его массы в момент начала лечения. Эффект лечения на прирост массы тела и содержание холестерина оценивали с помощью 2-факторного дисперсионного анализа с повторными измерениями и апостериорного теста Бонферрони с использованием программы GraphPad Prism версии 4. Различия рассматривали как статистически значимые при р<0,05. Результаты. Пример 1. Стабильность пептида. Таблица 2 Данные по выходу пептида после стресса, полученные путем ОФ-ВЭЖХ Данные по инкубации в стрессирющем растворе HCl приведены в табл. 2. Как аналог, так и глюкагон оказались стабильными в течение 5 недель при температуре 40°C, выход составил более 90% чистоты. Однако данные по кислотной деградации соединений указывают на то, что аналог глюкагона почти в 4 раза более стабилен, по сравнению с нативным глюкагоном. - 17 - 020537 Пример 2. Эффективность по отношению к рецепторам глюкагона и GLP-1. Таблица 3 Значения EC50 аналогов глюкагона по отношению к рецепторам глюкагона и GLP-1 Соединения, обозначенные "*", представляют собой неочищенные пептиды со степенью чистоты менее 90%. Значения ЕС50 скорректированы для степени чистоты 50%. Изо-Glu (Palm), конъюгированный с остатком лизина, представлен на фиг. 6. - 18 - 020537 Пример 3. Анализ липолиза. Таблица 4 Стимуляция липолиза в первичных культурах адипоцитов крыс (более подробную информацию см. в разделе "Методы") Агонист GLP-1, эксендин-4 не оказывал влияния на липолиз в первичных культурах адипоцитов крыс, в отличие от глюкагона и ОХМ. ZP2667 оказался в 8 раз эффективнее, чем глюкагон, и в 240 раз эффективнее, чем ОХМ, тогда как ZP2669 (SEQ ID NO: 4) оказался сопоставим по эффективности с глюкагоном, и в 40 раз эффективнее, чем ОХМ. Эффективность ZP2668 (SEQ ID NO: 5) была того же порядка, что и для ОХМ. Тот факт, что 4-недельное лечение мышей DIO с помощью ZP2669 (SEQ ID NO: 4) вызывало значительное снижение отложения жира, соответствует наблюдаемому эффекту (табл. 4) на липидный обмен липолиза в первичных культурах адипоцитов. Пример 4. Влияние на толерантность к глюкозе в оральном тесте у мышей db/db. ZP2669 (SEQ ID NO: 4) достоверно (Р<0,01) повышал толерантность к глюкозе, измеренную в ходе ОТТГ у страдающих диабетом мышей db/db (фиг. 1). ZP2669 (SEQ ID NO: 4) усиливал толерантность к глюкозе на 77,1% при 45 нмоль/кг. Пример 5. Влияние на потребление корма у мышей. Животные, которым вводили наполнитель, потребляли 0,033±0,001 г корма на 1 г массы тела в течение первого часа (фиг. 2). PYY(3-36) демонстрировал аноректический эффект, как ожидалось на основании предыдущих результатов. ZP2669 (SEQ ID NO: 4) (500 нмоль/кг) значительно (Р<0,05) снижал потребление корма в течение первого часа после инъекции пептида (фиг. 2). Глюкагон не влияет на рацион питания. Пример 6. Влияние подкожного введения на прирост массы тела у мышей с алиментарным ожирением (DIO). ZP2669 (SEQ ID NO: 4) снижал прирост массы тела до уровня, наблюдаемого при кормлении обычным кормом (фиг. 3). Прирост массы тела был статистически значимо (Р<0,05) снижен, по сравнению с группой, получавшей наполнитель. Пример 7. Влияние на ЛПНП и ЛПВП. Эксендин-4 представляет собой очень эффективный агонист GLP-1R, но он не оказывает влияния на Glu-R и не демонстрировал эффекта в анализе липолиза на адипоцитах крыс, описанного выше. Кроме того, эксендин-4 не влияет на концентрацию в крови общего холестерина, ЛПВП, ЛПНП или соотношение ЛПВП/ЛПНП (фиг. 4, 5) В отличие от этого, лечение мышей DIO с помощью ZP2669 (SEQ ID NO: 4) оказывало значительное влияние на концентрацию в крови холестерина ЛПНП (Р=0,0006), а также на соотношение ЛПВП/ЛПНП (Р=0,0005), по сравнению наполнителем (фиг. 4, 5). - 19 - 020537 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее формулу где R1 представляет собой Н, С1-4алкил, ацетил, формил, бензоил или трифторацетил; R2 представляет собой ОН или NH2; X представляет собой пептид, который имеет формулу I или отличается от формулы I не более чем в четырех из следующих положений, при этом, если присутствует отличие от формулы I: остаток в положении 2 выбран из Aib, D-Ser; остаток в положении 12 выбран из Leu, Arg, Dpu, Dpr, Orn; остаток в положении 16 выбран из Arg, His, Lys, Glu, Asp; остаток в положении 17 выбран из Arg, Leu, Dpu, Dpr, Orn; остаток в положении 20 выбран из Gln, Lys, Arg, Glu, Asp; остаток в положении 21 представляет собой Glu; остаток в положении 24 выбран из Gln, Leu, Ala, Lys, Arg, Asp; остаток в положении 27 выбран из Met, Cys, Lys, Arg, Glu; остаток в положении 28 выбран из Asn, Ser, Lys, Glu, Ala, Leu, Asp и остаток в положении 29 выбран из Thr, Glu, Lys; Z отсутствует или представляет собой пептидную последовательность из 1-20 аминокислотных остатков, выбранных из группы, включающей Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr и Orn, или его фармацевтически приемлемая соль. 2. Соединение, имеющее формулу где R1 представляет собой Н, С1-4алкил, ацетил, формил, бензоил или трифторацетил; R2 представляет собой ОН или NH2; X представляет собой пептид, который имеет формулу I или отличается от формулы I не более чем в пяти из следующих положений, при этом, если присутствует отличие от формулы I: остаток в положении 2 выбран из Aib, D-Ser; остаток в положении 16 выбран из Arg, His, Lys, Glu; остаток в положении 17 представляет собой Arg, Leu, Dpu, Dpr, Orn; остаток в положении 20 выбран из Gln, Lys, Arg, Glu, Asp; остаток в положении 21 представляет собой Glu; остаток в положении 24 выбран из Gln, Leu, Ala, Lys, Arg, Asp; остаток в положении 27 выбран из Met, Cys, Lys, Arg, Glu; остаток в положении 28 выбран из Asn, Ser, Lys, Glu, Ala, Leu, Asp и остаток в положении 29 выбран из Thr, Glu, Lys; Z отсутствует или представляет собой пептидную последовательность из 1-20 аминокислотных остатков, выбранных из группы, включающей Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr и Orn, или его фармацевтически приемлемая соль. 3. Соединение по п.1, где X отличается от формулы I не более чем в четырех из следующих положений, при этом, если присутствует отличие от формулы I: остаток в положении 2 выбран из Aib, D-Ser; остаток в положении 16 выбран из Arg, His, Lys, Glu, Gly; остаток в положении 24 выбран из Gln, Leu, Ala, Lys, Arg; остаток в положении 27 выбран из Met, Cys, Lys, Arg, Glu; остаток в положении 28 выбран из Asn, Ser, Lys, Glu, Ala, Leu и остаток в положении 29 выбран из Thr, Glu, Lys. 4. Соединение по любому из предыдущих пунктов, отличающееся тем, что X содержит одну или более из следующих комбинаций остатков: - 20 - 020537 5. Соединение по п.2, отличающееся тем, что X включает одну из следующих комбинаций остатков: 6. Соединение по п.1, отличающееся тем, что X имеет последовательность: 7. Соединение по п.2, отличающееся тем, что X имеет последовательность: или 8. Соединение по любому из предыдущих пунктов, отличающееся тем, что R1 представляет собой - 21 - 020537 Н. 9. Соединение по любому из предыдущих пунктов, отличающееся тем, что R2 представляет собой NH2. 10. Соединение по любому из предыдущих пунктов, отличающееся тем, что Z имеет не более 25% идентичности по последовательности с соответствующим участком последовательности IP-1 оксинтомодулина человека, имеющего последовательность Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala. 11. Соединение по любому из предыдущих пунктов, отличающееся тем, что Z содержит Cys в качестве остатка на С-конце. 12. Соединение по любому из пп.1-9, отличающееся тем, что Z отсутствует. 13. Соединение по любому из предыдущих пунктов, отличающееся тем, что одна или более боковая цепь аминокислоты в соединении, например в пептиде X, конъюгирована с липофильным заместителем или полимерной группой. 14. Соединение по п.13, отличающееся тем, что X имеет последовательность 15. Нуклеиновая кислота, кодирующая соединение по любому из предыдущих пунктов. 16. Экспрессионный вектор, содержащий нуклеиновую кислоту по п.15. 17. Клетка-хозяин, включающая нуклеиновую кислоту по п.15 или экспрессионный вектор по п.16. 18. Фармацевтическая композиция, содержащая соединение по любому из пп.1-14, в смеси с фармацевтически приемлемым носителем. 19. Применение соединения по любому из пп.1-14 для получения лекарственного средства для предотвращения увеличения веса, стимуляции снижения веса или для лечения патологического состояния, вызванного или ассоциированного с избыточной массой тела или ожирением, в том числе патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением, или для лечения резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. 20. Применение нуклеиновой кислоты по п.15 для получения лекарственного средства для предотвращения увеличения веса, стимуляции снижения веса или для лечения патологического состояния, вызванного или ассоциированного с избыточной массой тела или ожирением, в том числе патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением, или для лечения резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. 21. Применение экспрессионного вектора по п.16 для получения лекарственного средства для предотвращения увеличения веса, стимуляции снижения веса или для лечения патологического состояния, вызванного или ассоциированного с избыточной массой тела или ожирением, в том числе патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением, или для лечения резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. 22. Применение клетки-хозяина по п.17 для получения лекарственного средства для предотвращения увеличения веса, стимуляции снижения веса или для лечения патологического состояния, вызванного или ассоциированного с избыточной массой тела или ожирением, в том числе патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением, или для лечения резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. 23. Применение соединения по любому из пп.1-14 для предотвращения увеличения веса, стимуляции снижения веса или для лечения патологического состояния, вызванного или ассоциированного с избыточной массой тела или ожирением, в том числе патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением, или для лечения резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. 24. Применение нуклеиновой кислоты по п.15 для предотвращения увеличения веса, стимуляции снижения веса или для лечения патологического состояния, вызванного или ассоциированного с избыточной массой тела или ожирением, в том числе патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением, или для лечения резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. 25. Применение экспрессионного вектора по п.16 для предотвращения увеличения веса, стимуляции - 22 - 020537 снижения веса или для лечения патологического состояния, вызванного или ассоциированного с избыточной массой тела или ожирением, в том числе патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением, или для лечения резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. 26. Применение клетки-хозяина по п.17 для предотвращения увеличения веса, стимуляции снижения веса или для лечения патологического состояния, вызванного или ассоциированного с избыточной массой тела или ожирением, в том числе патологического ожирения, воспалительного процесса, связанного с ожирением, заболевания желчного пузыря, связанного с ожирением, апноэ сна, индуцированного ожирением, или для лечения резистентности к инсулину, нарушения толерантности к глюкозе, сахарного диабета 2 типа, гипертензии, атерогенной дислипидемии, атеросклероза, артериосклероза, ишемической болезни сердца или инсульта. Фиг. 1 Фиг. 2 - 23 - 020537 Фиг. 3 Фиг. 4 - 24 - 020537 Фиг. 5 Фиг. 6 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2 - 25 -