Методы синтеза алкенов
реклама
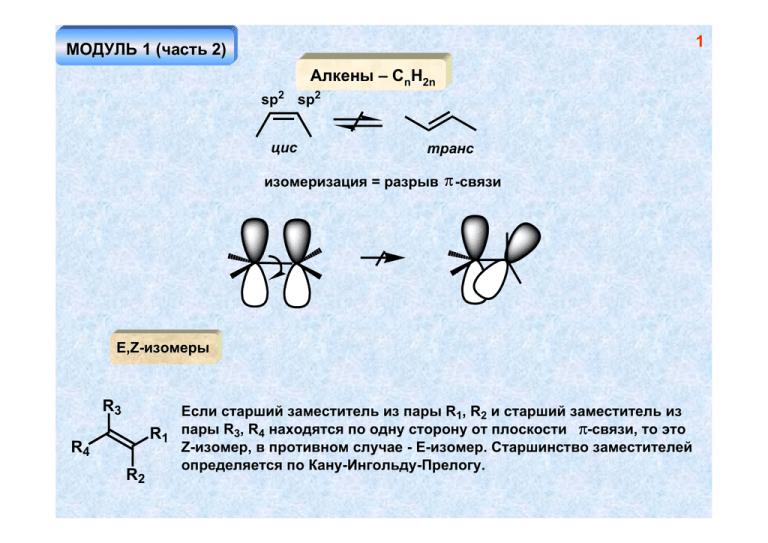
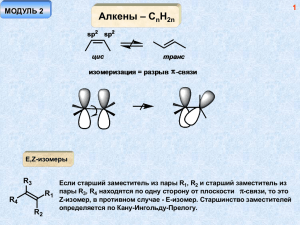
1 МОДУЛЬ 1 (часть 2) Алкены – СnH2n sp2 sp2 цис транс изомеризация = разрыв π -связи E,Z-изомеры R3 R4 R2 Если старший заместитель из пары R1, R2 и старший заместитель из R1 пары R3, R4 находятся по одну сторону от плоскости π-связи, то это Z-изомер, в противном случае - Е-изомер. Старшинство заместителей определяется по Кану-Ингольду-Прелогу. 2 Методы синтеза алкенов 1. Дегидрогалоидирование основание NaOEt + Cl OEt 1 - продукт элиминирования 2 - продукт замещения 2 1 Увеличение силы основания и повышение температуры реакции увеличивает выход 1 за счет снижения выхода 2 NaOH Cl EtOH > > Правило Зайцева: В реакции элиминирования в большей степени образуется более замещенный алкен (он более устойчив). Транс-изомера обычно образуется больше, чем цисизомера. А почему? 3 Cl NaOEt + + Соотношение изомеров транс- > цис- может быть связано с большей термодинамической выгодностью первого в том случае, если реакция проводится в условиях обратимости (обратимое отщепление-присоединение). Cl несвязывающее вандерваальсовское взаимодействие Для протекания реакции элиминирования, как правило, необходима такая конформация молекулы, в которой уходящие группы находятся в одной плоскости и связи направлены в противоположные стороны (антиперипланарное расположение)…. более устойчивая конформация H Cl H H H H H H H Cl H Cl Содержание более устойчивой конформации выше, чем и определяется соотношение продуктов в отсутствие равновесия! H Br H Ph H Br H H H Ph NaOEt Ph Ph Br диастереомеры Br Br H H H Ph H NaOEt H H Ph Ph Ph Br диастереомеры дают разные продукты! (конфигурационный контроль реакции) 4 5 Правило Гофмана: При термолизе четвертичных аммонийных оснований преимущественно образуются менее замещенные алкены. t N > -N(CH3)3 HO- 2. Дегидратация спиртов OSO3H t H2SO4 I2 t OH KHSO4, t (Al2O3, 400o) > H+ t > 6 + H < OH + - H+ H+ OH2 - H2O A B A, B - карбокатионы, В - устойчивее, чем А Превращение А в В – катионоидная перегруппировка, происходит всегда, когда существует возможность образования более устойчивого катиона из менее устойчивого! Ряд устойчивости карбокатионов: третичный > вторичного >> первичного Причина устойчивости алкильных карбокатионов – гиперконьюгация – сопряжение связывающей орбитали сигма-связи С-Н с вакантной р-орбиталью, приводящее к уменьшению величины заряда на катионном центре за счет перераспределения заряда на атомы водорода (делокализация заряда). сопряжение σ -р 7 Гиперконьюгация вакантная р-орбиталь H sp H sp2 H 3 H H H H H Первичный карбокатион. Состояние гибридизации атома углерода sp2 H H H Устойчивый третичный карбокатион возможность р- σ сопряжения с тремя связями С-Н H 8 Ряд устойчивости катионов, связанной с различными угловыми напряжениями < < < Малоустойчивый, хотя и третичный катион – невозможность реализации n,p-сопряжения (орбитали ортогональны) Другой, еще более эффективный способ стабилизации карбокатионного центра – р- π -сопряжение и р-n-сопряжение (донорный мезомерный эффект заместителя) р-π−сопряжение π-система как мезомерный донор электронов H2C H C CH2 H2C аллильный катион H C CH2 9 H H H H H2C H C CH2 H2C H C CH2 аллильный катион CH2 CH2 CH2 бензильный катион CH2 10 p-n-сопряжение гетероатом с неподеленной парой электронов - сильный мезомерный донор O O A B более значимая структура В - у каждого атома октет электронов Перегруппировки карбокатионов OH2 H H CH2 CH3 - H2O H H H А миграция атома водорода с парой электронов, образующих связь С-Н, к карбокатионному центру - гидридный сдвиг Первичные алкильные катионы (например, А) настолько неустойчивы, что не образуются вовсе. В данном случае гидридный сдвиг происходит одновременно с отщеплением молекулы воды. CH3 OH2 -H2O A H H H синхронный процесс миграция метильной группы OH H+ -H+ - H2O вторичный катион третичный катион > 11 12 В то же время... OH2 OH H2SO2 (разб.) -H+ - H2O более устойчивая конформация неустойчивая конформация 2 1 3 H H3C H CH3 CH3 4 С2-С3 OH CH3 CH3 H3C H3 C 1:1 С2-С1 H H (CO2H)2 t + 10 : 1 иной механизм реакции 13 OH H+ этот процесс не идет неустойчивый первичный катион! - H2O H+ OH2 - H+ H миграция связи С-С гибридизация sp2, валентный угол ~ 90o гидридный сдвиг этот процесс не идет неустойчивый, хотя и третичный катион! 14 3. Дегалоидирование Zn Cl или Mg цис-элиминирование (син-элиминирование) Cl H H Cl Cl мезоформа H Zn Zn H Cl Cl d,l-форма 15 4. Восстановление алкинов H2 Pd/BaSO2 "отравленный катализатор" цис-изомер Na NH3 (ж.) 2NH3 +e -2NH2транс-изомер более устойчивый транс-дианион 5. Восстановление низковалентным титаном O 2 O TiCl4 RMgX O TiCl4 RMgX 6. Крекинг алканов (смесь продуктов) CnH2n+2 500-700o алюмосиликаты алканы + алкены 16 Свойства алкенов π-разрыхляющая орбиталь π* p-орбиталь p-орбиталь π-связывающая орбиталь π Электрофил – частица, способная принять пару электронов (кислота Льюиса) Нуклеофил – частица, способная отдать пару электронов (основание Льюиса) 17 Возможность взаимодействия алкена с электрофилом E + E+ π-комплекс E катион (σ-комплекс) связывающее взаимодействие вакантной орбитали электрофила с занятой (связывающей) π-орбиталью алкена Невозможность взаимодействия алкена с электрофилом (запрет по симметрии) Взаимодействие занятой орбитали нуклеофила с вакантной (p*-разрыхляющей) 18 орбитальюалкена не дает выигрыша в энергии - связывающее взаимодействие равно антисвязывающему. Поэтому простые алкены не реагируют с нуклеофилами! связывающее взаимодействие антисвязывающее взаимодействие изменение орбиталей при введении акцепторного заместителя Х π* X связывающее взаимодействие антисвязывающее взаимодействие π* X π X π диссимметрия НСМО обсуславливает возможность нуклеофильного присоединения 19 Реакции электрофильного присоединения Nu E E E+ + R R R или R Nu- E π-комплекс E R R катион (σ-комплекс) E E или Nu продукты переходное состояние (активированный комплекс) промежуточный продукт (катион) энергия активации продукт присоединения координата реакции 20 Простейший электрофил - протон а. Галогеноводороды X HX H продукт присоединения (по правилу Марковникова) XH+ H+ H вторичный катион H неустойчивый первичный катион (не образуется) X = I, Br, Cl, F Правило Марковникова: Электрофильное присоединение к алкенам происходит через стадию образования более устойчивого катиона 21 Правило Марковникова! более устойчивый катион образуется быстрее! XHX X основной продукт реакции или X- X Первая стадия – присоединение протона, является лимитирующей, поэтому реакционная способность изменяется в следующем ряду: 22 HBr > HCl > HF HI к алкенам не присоединяется вследствие обратимости реакции (равновесие смещено в сторону исходных соединений) CH3 Cl Cl H CH3 Cl HCl Сl- HCl CH3 Cl H CH3 Cl H H более устойчивый катион CH3 Cl Более замещенная кратная связь (большее число донорных алкильных заместителей) более реакционноспособна по отношению к электрофилу, поскольку, к тому же, образует более устойчивый (более замещенный) катион. < < < < вторичный катион третичный катион < 23 Образование карбокатиона означает возможность протекания перегруппировок! H HBr H Br - Br гидридный сдвиг H Вода, спирты - вода δ+ δ H OH - + δ спирты RO H δ с алкенами не реагируют (нет свободных протонов) Реакция происходит в присутствии сильных кислот, например, серной R ROH H+ ROH O R = Н, алкил Н+ - катализатор (не расходуется!) OR H - H+ 24 Серная кислота OSO3H HSO4- H2SO4 кислый алкилсульфат Галогены (Cl2, Br2) Фторирование алкенов только с разрывом связей С-С (образование CF4), реакция с иодом не происходит. Br Br2 H H Br2 H Br H H Br H -Brπ-комплекс H B r H H Br H бромониевый катион поляризация связи Br-Br H Br большой размер атома брома H позволяет ему эффективно координироваться с обоими атомами углерода бромониевый катион 25 Стереоспецифическое электрофильное транс-присоединение брома к алкену (цис-бутену-2) H Br H Br Br H H H H Br Br - H H Br энантиомеры, образуются в равных количествах (рацемат) Br H - Br нуклеофильная атака равновероятна по двум направлениям Br H H Br H Br d,l-форма Br 26 Br Br2 Br HH H Br H H H Br Br - Br H Br Br H H H Br H H Br Br- нуклеофильная атака равновероятна по двум направлениям Br мезоформа 27 Br Br2 Br + Br Br2 H2 O Br d,l-форма (рацемат) H2O OH OH + Br -H + Br Br d,l-форма (рацемат), трео-форма Аналогично происходит реакция с хлором. С иодом алкены не реагируют, реакция с фтором происходит со взрывом, продукт электрофильного присоединения выделить невозможно 28 в. Другие электрофилы типа А+Бδ+ δ δ+ δδ- δ + δ+ δ NO Cl H H Br CN HO Br δ+ δ - H A B I N3 Hg(OCOCH3)2 A A A H H -B B B рацемат (трео-форма) B- H δ+ δ - A A B -B- H + - H H H A A H H H + H H B- H B B рацемат (эритро-форма) 29 В случае несимметричных алкенов присоединение происходит по правилу Марковникова δ+ δ - A B -B A B A A - B- A Структура 1 более значима,чем 2 положительный заряд на вторичном атоме углерода. Поэтому присоединение нуклеофила идет по этому положению. A 1 2 Ацетоксимеркурирование CH3CO2H = AcOH Hg(OAc)2 HgOAc HgOAc - H+ AcOH H3O+ OAc AcOH 1.NaBH4 OH 2. HO- 30 Hg(OAc)2 OCH3 NaBH4 OCH3 HgOAc CH3OH CH3OH H+ Преимущества ацетоксимеркурирования по сравнению с кислотно-катализирумым присоединением воды (спиртов) – реакция происходит по тому же направлению, но без образования карбокатионов, способных, в частности, перегруппировываться, и вступать в другие реакции. Реакция происходит стереоселективно. H3O+ OH 1. Hg(OAc)2, AcOH 2. NaBH4 3. HO-, H2O OH 31 Реакция Принса H OH OH H2O H OH H+ CH2O OH - H+ H3O+ CH2O OCH2 OH O O устойчивый катион! Взаимодействие алкенов с алканами H+ H + + H+ = AlCl3, BF3, H2SO4, HF и т.д. - 32 Синтез Реппе H CO, H2 H2C CH2 Co2+, t, p O OH Cl Cl Cl H Cl AlCl3 Cl Cl Cl AlCl3 -AlCl4- AlCl4-AlCl3 электрофил Cl 33 Реакции окисления Цис-гидроксилирование (Вагнер) CH2 KMnO4 CH2 HO- O O CH2 Mn CH2 O- O H2C H2C O Mn O OH HO- O O- - H2O MnO2 KMnO4 OH гликоль HOOH OH цис-гликоль (мезоформа) Качественная реакция на алкены HO H H OsO4 H2O2 H OH H H OH H OH цис-гидроксилирование (направление атаки реагента равновероятно "сверху и снизу") d,l-форма (рацемат) 34 R2 R1 R2 Pb(OAc)4 R3 R1 R2 OAc HR 3 > R1 OAc транс- R2 + R1CO2H O R3 R2 KMnO4 H+ R1 R3 H OAc OAc цис- OsO4 + O R1 R3 H2O2, NaIO4 H Cr6+, H+ O MnO4-, R2 O + H O R3 O2 / Ag Эпоксидирование 35 O или RCO3H эпоксид (оксиран) RCO3H + H2 O RCO2H + H2 O2 O O H O -RCO2H O R синхронный процесс сохранение геометрии Транс-гидроксилирование H O O RCO2H R=H H2O2 .. O H OH OH -H+ OH2 OH H 36 транс-гидроксилирование OH O RCO3H H3O+ OH d,l-форма Озонолиз R2 R1 O3 O O O R3 R1 O O R3 R2 O R2 O R1 R3 O R3 O озонид R1 мольозонид Zn H2O H2O H2O2 O O R1CHO + R 2 R2 R3 восстановительное расщепление R1CO2H + R 2 окислительное расщепление R3 37 O O OH LiAlH4 + OH (NaBH4) O Реакции восстановления Каталитическое гидрирование а. Гетерогенный катализ RCH=CHR1 H2 катализатор RCH2CH2R1 реакция происходит при комнатной температуре и нормальном давлении катализатор = Pt, Pd, Ni-Ренея H2 цис-присоединение, мезоформа Pt H H H H катализатор цис-присоединение 38 б. Гомогенный катализ RhCl3 + PPh3 (Ph3P)3RhCl катализатор Уилкинсона условия гидрирования - комнатная температура, атмосферное давление цис-присоединение скорость гидрирования: менее замещенные алкены селективно гидрируются быстрее более замещенных RuCl(PPh3)3, RuHCl(PPh3)3 и RuCl2(PPh3)3 = М M H2 MH2 H H M MH2 H H M H H H -MH2 цис-присоединение H 39 в. Диимид N2H4 R1 R H2O2 / Cu2+(Fe3+) или никель Ренея R1 R диимид (NH)2 N2H4 или никель Ренея H H R1 R1 R R цис-присоединение мезоформа 40 Герберт Браун, нобелевская премия, 1950 г. г. Гидроборирование NaBH4 BF3.OEt2 B2H6 [BH3] присоединение воды "против правила Марковникова" H δ- B HO- δ+ RCO2H 3B BH2 BH цис-присоединение триалкилборан + B(OCOR)3 O H H2O2 2 BH3 3 OH O R H цис-присоединение "водорода" 41 Синхронные процессы- реакции циклоприсоединения N N O CH2N2 hν .. CH2s Cl Cl .. CCl2s RCO3H + 42 Радикальные реакции алкенов Радикальное присоединение Br HBr HBr Br ROOH R H только HBr! RO ROOH цепной радикальный процесс RO + HBr Br Br ROH + Br HBr Br - Br вторичный радикал Cl CCl3 CCl4 SR RSH RO RO COCl2 RO Cl COCl 43 Радикальное замещение по аллильному положению X2 . 2X hν X . первичный радикал, неустойчив, не образуется X2 hν . X X2 вторичный радикал, более устойчив, может образоваться ! очень устойчивый аллильный радикал, продукт термодинамического контроля, поскольку его образование связано с разрывом связи С-Н в аллильном положении . -X X X продукт радикального присоединения . X2 -X . делокализация спиновой плотности в аллильном радикале . X Cl2 Cl 300o Cl N O O N-хлорсукцинимид NH3, O2 CN акрилонитрил аллильное хлорирование цепной радикальный процесс O2 катализатор окислительный аммонолиз Изомеризация алкенов 500o Al2 O3 более замещенные алкены более устойчивы OOH 44 45 hν π* π* hν π π транс-изомер более устойчив Метатезис Cat H2C * CH2 + H2C H2C CD2 Cat * + H2C CD2 CH2 * Cat = MoO3/Al2O3; Re2O7/Al2O3; WCl5/EtAlCl2/EtOH Cl Ph3P Ru CHR Cl R. Grubbs, 1992 г M CHR металлокарбен Cat? M 46 CH2 M M + H2C R R CH2 R M CHR R M R R M + R R Σ R + R WO3/SiO2 R + HC 2 CH2 + предшественник изопрена R 47 M _ M M M M CH2 _ HC 2 CH2 [W] CH2 n O Ph O O [Ru] + O Ph _ O O R1 M R2C CR1 R1C [Mo, W] R1 R2 CR1 + R2 C CR2 48 Полимеризация алкенов 1. Гетеролитическая (катионная и анионнная) катионная полимеризация H+ n полиизобутилен Полимеризация идет «голова к хвосту» 49 Катионная полимеризация происходит только в случае возможности образования устойчивого карбокатиона! H+ Ph Ph n Ph анионная полимеризация Bu Bu CN CN δBu CN CN устойчивый анион + Li δ Bu C N Bu n CN CN CN полиакрилонитрил (орлон) делокализация заряда 50 2. Радикальная полимеризация H2C CH2 H2 H2 C C F2C CF2 F2 F2 C C H2 H C C Cl полиэтилен n n n тефлон поливинилхлорид Cl инициаторы полимеризации - источник радикалов: O NC O Ph Ph O перекись бензоила N N O CN азобисизобутиронитрил 51 «Псевдоживая полимеризация» N O N + O R активный алкильный радикал + N R O устойчивый нитроксильный радикал R R R R R N N O O R 52 3. Координационная полимеризация AlEt3 + TiCl4 + H+ HML3 катализаторы Циглера-Натта (нобелевская премия, 1963) R HML3 R - δ R R R δ+ L3M n n атактические полимеры изотактические полимеры синдиотактические полимеры n ML3 R R ML3 n 53 Качественные реакции (алканы, циклоалканы, алкены) нет эффекта Br2 / H2O (бромная вода) обесцвечивание (медленно) обесцвечивание (быстро) нет эффекта KMnO4 / HO-, H2 O нет эффекта обесцвечивание, выпадение бурого осадка MnO2 54 Диены H2C сопряженный диен изолированный диен C CH2 кумулированный диен Методы получения а. 1,3-диены 1. Синтез бутадиена по Лебедеву EtOH MgO-ZnO 400-500o 2. Синтез Реппе H2 CH2O Cu+ HO OH Ni OH H3PO4 (CH2)4 t OH NaPO3 O t тетрагидрофуран (ТГФ) 55 3. Реакция Принса O OCH2+ CH2O -H+ H+ O OH 2 4. Cu+ H2 NH4Cl Pd/BaSO4 t Al2O3/Cr2O3/CuO t 5. Дегидрирование Аллен – синтез и гидратация Br2 H+ Br Br Br2 Br Br EtO- Br 300o Br H2C C аллен CH2 H3O+ CH3 более устойчивый катион!!! H H2O -H+ O Zn 56 Сопряженные диены (1,3-диены) MO бутадиена разрыхляющие π-орбитали (вакантные) π2* π* π π1* π2 π1 этен π* π связывающие π-орбитали (заполненные) этен Сближение электронных уровней в результате сопряжения приводит к более длинноволновому поглощению в УФ-области этилен 187 нм бутадиен-1,3 217 нм гексатриен-1,3,5 268 нм октатетраен-1,3,5,7 304 нм сопряжение затрудняет вращение вокруг одинарной связи С-С s-транс-изомер s-цис-изомер 57 Электрофильное присоединение к сопряженным диенам E E+ E+ E E аллильный катион не образуется Nu- Nu- E E Nu Nu 1,2-присоединение 1,4-присоединение энергия активации обратной реакции энергия активации прямой реакции исходные соединения продукты термодинамического контроля (1,4-присоединение) продукты кинетического контроля (1,2-присоединение) 58 Присоединение брома Br Br Br 80% Br Br Br2 Br2 t < 0o t = 40o 20% Br Br Br 20% 80% 40o Присоединение HBr HBr Б Br HBr катион А устойчивее, чем Б! А Br - кинетический контроль BrBr термодинамический контроль 59 Радикальное присоединение происходит преимущественно по типу 1,4-присоединения (термодинамический контроль) Br Br2 Br2 Br Br hν -Br Br Восстановление H2 Pd восстановление только одной связи невозможно (результат сопряжения - изолированная кратная связь восстанавливается легче сопряженной) Na NH3 (ж.) транс-изомера больше, чем цис-, изолированные кратные связи в этих условиях не восстанавливаются Синхронные процессы. Реакция Дильса-Альдера Y Y + X диен Z Y Z Z T X T T X Отто Дильс Курт Альдер Нобелевская премия, 1950 г. диенофил Реакции происходят с высокой стереоселективностью d,l-форма 60 мезоформа реакция не происходит закрепленная s-транс-конформация диена 61 В реакцию могут вступать гетеродиены и гетеродиенофилы. При этом гетеродиенофилы менее реакционноспособны, чем обычные алкены. Гетеродиены обычно являются активными диенофилами + O O O O диен O + O диенофил N + N N N + CN 62 Процесс контролируется орбитальной симметрией НСМО НСМО возможные типы взаимодействия ВЗМО ВЗМО диен диенофил Возможные типы связывающего взаимодействия в переходном состоянии ВЗМО диена НСМО диена ВЗМО алкена НСМО алкена 63 В случае взаимодействия ВЗМО диена с НСМО алкена (наиболее распространенный вариант), донорные заместители в диене и акцепторные в алкене ускоряют реакцию. В случае акцепторно-замещенного диена и донорно-замещенного алкена реализуется взаимодействие НСМО диен и ВЗМО алкена. Невозможность димеризации этилена Связывающее взаимодействие равно антисвязывающему ВЗМО Реакция запрещена по симметрии! алкена НСМО алкена Реакции, запрещенные по симметрии термически, могут происходить фотохимически через возбужденное состояние F F2C CF2 + F2C CF2 hν F F F F F F F CH2 2 C CH2 аллен hν + Алкины могут выступать в качестве диенофилов; диины и енины не могут выступать в качестве диенов (не достигается требуемая для реакции s-цис-конформация) O + O не могут выступать в роли диена Электроциклические реакции ВЗМО конротаторный путь ВЗМО триена дисротаторный путь 64 65 Полимеризация диенов (анионная, радикальная, координационная) Радикальная полимеризация R R R R изопрен R менее устойчив, не образуется R более устойчивый радикал 66 R + R R Z-изомер - гуттаперча n Е-изомер - каучук (катализатор Циглера-Натта) 67 Вулканизация Sn Sn n S8 n Sn n n Sn Анионная полимеризация резина, эбонит Bu Bu BuLi Bu Bu более устойчивый анион, он и образуется результат не отличается от катионной полимеризации Bu n 68 Na + n Ph Ph бутадиен-стирольный каучук ("буна-S") стирол Координационная полимеризация диенов позволяет проводить процесс стереоселективно! Радикальная полимеризация хлорпрена Cl Cl Bu RO Cl RO Cl RO Cl Bu более устойчивый радикал, он и образуется Cl Bu n Cl Терпены 69 + лимонен O OH карен пинен ментол камфора 70 Алкины CnH2n-2 Методы получения 1. Гидролиз карбидов CaC2 H2O HC 2. Крекинг CH Mg2C3 O2 CH4 H2O + H2 O 1400o O2 C 2H 6 1200 + H 2O o 3. Синтез из элементов (Бертло) C + H2 дуга 4. Из алкенов X2 R1CH=CHR2 EtOR1CH-CHR2 X X R1 t R2 + диен 71 5. Из дигалогенидов X X EtO-, t R1 (NaNH2) R1 Свойства 1. СН-кислотность (ацетилениды) HC + H+ EtO EtOH C + H+ CH HC NH3 NH2 + H+ CH3MgI HC C MgI HC - CH4 CH + NaOH K = 10-16 HC CH HC K = 10-26 K = 10-35 NaNH2 -NH3 HC C Na + H2O кислотность: CH4 << NH3 < HC CH << H2O C Na 72 Реактив Толленса – качественная реакция на терминальные алкины [Cu+] HC C Cu R CH Ag(NH3)2OH HC C Ag В аналогичных условиях образуются нерастворимые ацетилениды меди (I) и ртути (I) Реакции ацетиленидов как метод построения углеводородного скелета HC C RX R CH NaNH2 HC C R1X R R1 O 1. 2. H2O R R 1 R R1 RX, RX1 - первичные (вторичные) алкилгалогениды HO реакция Фаворского ряд активности: RI > RBr > RCl BuLi (2 моля) R1X (1 моль) -20о R R R1 R R1 1. BuLi R2 R 2. R2X, -20o 3. H2O Реппе CH2O HO OH Cu+ Реакции электрофильного присоединения X H R CH R CH HX R CH2 винильный катион XR CH2 73 74 Низкая устойчивость винильного катиона – результат отсутствия факторов, стабилизирующих его вакантная sp2-гибридная орбиталь вакантная р-орбиталь 120o R R sp sp2 X X R CH HX + - CH2 малоустойчивый катион HX = галогеноводород CH3 H X R R R X XR CH2 X X R CH3 CH3 устойчивый катион 75 Низкая устойчивость винильного катиона - причина меньшей реакционной способности алкинов по сравнению с алкенами в реакциях электрофильного присоединения Следовательно: а. Первая стадия присоединения НХ к алкинам происходит медленнее, чем вторая. б. При наличии в составе молекулы несопряженных двойной и тройной углерод-углеродных связей электрофильное присоединение происходит в первую очередь по двойной связи. HX (1моль) X X HX (1моль) образование сопряженной диеновой системы Присоединение HBr против правила Марковникова HBr R R R Br R R Br2 Br R Br2 R R 76 Br Br Br R Br Br Реакция Кучерова (синтез кетонов) R OH H3O+ Hg2+ O R R присоединение воды по правилу Марковникова Присоединение воды «против правила Марковникова» (синтез альдегидов) HBR2 R1 H2O2 R1 цис-присоединение R= BR2 O OH - HO R1 AcOH R1 H R1 77 Другие электрофилы OCOCH3 R1CO2H OCOCH3 Hg2+ ROH OH H2O HO- n виниловый эфир Hg2+ поливинилацетат OR поливиниловый спирт SR RSH SR простой виниловый эфир n RSH BF3 R Cl AsCl2 HCN AsCl3 CuCl2/NH3 люизит HgCl2 RO- t,p CN акрилонитрил CO + EtOH Ni(CO)4 Cl HgCl OEt OR единственый пример нуклеофильного присоединения к алкинам (виниловые эфиры) O Реппе этилакрилат 78 Реакции восстановления NaBH4, Ni(OAc)2, H2N Na H2 Pd/BaSO2 NH3 (ж.) транс-изомер NH2 цис-изомер H2 Pt H2 Ni/ZnCl2 1. HBR2 2. RCO2H «Полимеризация» 3 C 400o Ph3 PNi(CO)2 + другие продукты мезитилен 79 4 циклооктатетраен Ni(CN)2 AlCl3 гексаметилбензол Дьюара AlEt3+TiCl4 2 R Cu+ NH4Cl R R Cu+ NH3/O2 R R H2 Pd/BaSO4 R R 80 Cl H2, Pd/BaSO4 HCl O OH H3O+ HCO2H/H2O2 Hg2+ RCO3H HO O CuCl, NH3 O2 Несимметричные диины (реакция Ходкевича) R R NaOBr R 0o R1 Br R1 Cu пиридин 81 Окисление R1CO2H + RCO2H MnO4- R1 R H2O, t MnO4o pH 7, 0 1. O3, 2. H2O Ацетилен-алленовая перегруппировка R EtONa, t или NaNH2 (0.1 M), t R C NaNH2 (изб.) t В обоих направлениях реакция идет в условиях термодинамического контроля интернальный алкен термодинамически выгоднее терминального, солеобразование же сдвигает равновесие в сторону соли - ацетиленида! R O R O R1 82 Механизм реакции C -H + + + H+ - KOH/EtOH или кат. кол-во NaNH2, t - перемещение в середину цепи избыток NaNH2, t - перемещение на конец цепи KOH/EtOH, t 170o C NH K+ H3C(H2C)5 (CH2)5CH3 NH2 20o, 5 мин., затем H2O (CH2)11CH3 В ИК-спектре несимметричных алкинов характерная полоса колебаний тройной связи находится при 2100 см-1 83 Ароматические соединения 1825 г. Фарадей открыл бензол 1865 г. Кекуле предложил современную структуру бензола 3 C2H4 H2 3 C2H6 + 89.4 ккал Pt H2 + 52.9 ккал Pt Q1 - Q2 = 36.5 ккал/моль - энергия сопряжения 1. O3 2. Zn/H2O O 2 O O O O 1. O3 2. Zn/H2O + O O + 2 O 84 1. O3 2 2. Zn/H2O O O O + 2 O O + 3 O O + O O O O 1. Br2 2. EtONa, t O O O O hν бензол Дьюара 85 Молекулярные орбитали бензола узел узел 86 Правило Хюкеля: Ароматическими являются циклические, плоские, сопряженные π- системы, содержащие 4n+2 электрона. Циклические, плоские, сопряженные π- системы, содержащие 4n электрона, называются антиароматическими. Бензол – ароматическое соединение с n = 1 (6 π-электронов) Один из признаков ароматичности – наличие анизотропного вличния ароматической системы на положение сигналов протонов, присоединенных к этой системе. H H 10 π-электронов неароматическое соединение (не может быть плоским!) 10 π-электронов ароматическое соединение (гомоароматика) δ = 7.26 м.д. δ CH2 = -0.56 м.д. δ C-H = 7.2 м.д. 87 аннулен[14] аннулен[18] Циклобутадиен - плоская сопряженная система с 4 π-электронами антиароматическая структура (бирадикал) Br EtO- O O hν -263 oC аргон EtO- -240 oC 2 C2H2 88 циклооктатетраен - был бы антиароматическим, если бы был плоским, но он не плоский, устойчивое соединение, неароматика + 2 - 2e + 2e 2- K 6 π -электронов 10 π -электронов O 89 O тропон - высокий дипольный момент H O O H O O + трополон - симметричная молекула O O А высокий дипольный момент (структура А - ароматическая) Ph Ph Ph OH Ph HClO4 - H2O Ph ClO4Ph 90 ароматический катион антиароматический анион неароматический радикал (малая устойчивость вследствие неблагоприятных валентных углов) аллильная система стабилизирует частицы в примерно одинаковой степени Cl Fe(CO)5 Fe2(CO)9 Cl Fe(CO)3 сопоставимая эффективность делокализации разноименного заряда в ионах 91 - H+ циклопентадиен неароматическое соединение циклопентадиенильный анион - ароматическое соединение (6 π-электронов) плоский циклопентадиенильный катион - антиароматическое соединение (4 π -электрона) _ высокий дипольный момент молекул + 92 Гетероароматичность X X X = О (фуран), S (тиофен), NH (пиррол) 6 π -электронов Ph N Ph пиридин 6 π -электронов O ClO4Ph перхлорат трифенилпирилия Полициклические ароматические соединения _ нафталин + азулен - высокий дипольный момент 93 антрацен фенантрен коронен. 24 π-электрона (4n), но ароматическое соединение - две независимые π-системы H H H H бензо[b]пирен H H H H H H H H H H H H H H H H H H H кекулен H Два сигнала в спектре ПМР кекулена – при -2.7 м.д. (6Н) и 12.0 м.д. (18Н) 94 Методы получения 1. Выделение из каменноугольной смолы после коксования угля (1600о без доступа кислорода) 2. Прямая перегонка нефти или крекинг нефти (нефтепродуктов) Pt, 300o или Cr2O3/Al2O3, t 3. Синтез из алкинов C2H2 R C 400o R (PPh3)2Ni(CO)2 Реппе R R R R R R R AlEt3/TiCl4 Циглер R R R 95 R O Pt H2SO4 + R R R Реакции ароматического электрофильного замещения E E+ + E+ π-комплекс H E H E E σ-комплекс H H E 96 Nu H -H+ Nu- E H+ E E π-комплекс E лимитирующая стадия E промежуточный продукт (σ-комплекс) π-комплекс π-комплес координата реакции 97 Протонирование (дейтерообмен) PhH D2SO4 C6D6 PhD реакция неселективная Галоидирование AlCl3 Cl2 Cl Cl Cl+ AlCl4- AlCl3 электрофил H Cl+ PhH - AlCl4- Fe PhCl -HAlCl4 HCl + AlCl3 катализатор (не расходуется, берут HAlCl4 PhH Cl 0.1 М) X2 Fe X2 PhX X = Cl, Br FeX3 катализатор (кислота Льюиса) PhH I2/HNO3 или ICl PhI 98 Алкилирование (реакция Фриделя-Крафтса) PhH CH3Cl PhCH3 AlCl3 + δ H3C Cl толуол AlCl3 катализатор, используется 0.1 М δ AlCl3 электрофил Cl PhH H AlCl3 H Cl AlCl3 - AlCl4- Катион (электрофил) можно генерировать и по-другому: OH H+ H+ или OH 99 лимитирующая стадия OH PhH Ph H+ H3O+ t Реакция обратима лимитирующая стадия - распад σ-комплекса Кинетический изотопный эффект E H C6H6 E+ -H D C6D6 + PhE E KH/KD <1 E+ + -D C6D5E лимитирующая стадия распад σ-комплекса 100 Ацилирование (реакция Фриделя-Крафтса) R O AlCl3 RCOCl R H R O Cl AlCl3 R O PhCOR AlCl3 HAlCl4 R O Ph R PhCOR HCl + AlCl3 O O AlCl3 R H2O AlCl3 катализатор, но его требуется 1 моль O O электрофил AlCl3 AlCl3 -HAlCl4 H HCOCl не существует! O AlCl4- COR RCOCl PhH O R O AlCl3 R R RCO2AlCl3электрофил При ацилировании ангидридами карбоновых кислот 1 моль AlCl3 расходуется на образование электрофила, и ещё один моль связывается в комплекс с продуктом реакции - кетоном. Общий расход катализатора - 2 моля. PhH RCO2H HF PhCOR O O PhCOR Zn/Hg H3O + RCO2H 101 PhH POCl3, PCl3, ZnCl2 PhCH2R 1. N2H4 2. HO - PhCOR синтез н-алкилбензолов Кижнер-Вольф Клеменсен O O O Zn/Hg PhH AlCl3 CO2-AlCl2 H3O+ Ph HF Ph CO2H O Pt, t Zn/Hg H3O+ тетралон O нафталин тетралин COCl O Ph CO2H O Ph O AlCl3 Ph COCl O PhH AlCl3 O фталид 102 Синтез ароматических альдегидов (реакция формилирования) Гаттерман CO, HCl PhH AlCl3, CuCl PhCHO CO + HCl AlCl3 [HCOCl] Гаттерман-Кох PhH HCN, HCl ZnCl2 PhCH=NH H3O+ PhCHO HCl HCN ZnCl2 NH HC Cl Взаимодействие с альдегидами Реакция хлорметилирования CH2O H+ CH2OH электрофил CH2O PhH HCl ZnCl2 PhCH2OH LiAlH4 Cl- H+ PhCH2 PhCH2Cl PhCH3 селективный синтез толуола 103 Взаимодействие с альдегидами OH H+ RCHO электрофил R H PhH OH RCHO H+ Ph H+ R -H2O PhH Ph R -H+ Ph R Ph Cl PhCl Cl CCl3CHO H2SO4 ДДТ CCl3 1,5-3 млн. человек в год погибает от малярии 104 Сульфирование, сульфохлорирование O S PhH H S O O H2SO4/SO3 ± H+ t электрофил SO3 PhH O O- O HSO3Cl t H3O+ t PhSO3H PhH реакция обратима, вторая стадия - лимитирующая, присутствует кинетический изотопный эффект PhSO2Cl PhH PhSO2Ph PhH SCl2 AlCl3 SO2Cl2 AlCl3 Нитрование O HNO3 + H2SO4 NO2+ + H2O + HSO4 электрофил H2O N O- PhSCl KNO3 H2SO4 PhH HNO3 H2SO4 105 для малоактиных субстратов O Ac2O + HNO3 PhNO2 O NO2 ацетилнитрат - нитрующий реагент для активных субстратов, в том числе для неустойчивых в кислых средах + NO2 BF4- Реакции электрофильного замещения, протекающие только с очень активными ароматическими субстратами: OH OH HO- CHCl3 PhOH HO- Реймер-Тимман CHO CHCl2 CHCl3 HO- CCl2 дихлоркарбен - электрофил N HO Ph PhN2+ N N CO2- CO2, p,t HOКольбе-Шмидт азосочетание Ph PhOH OH N Ph соль фенилдиазония N N OH PhOH 1. POCl3 / ДМФА - 2. HO , H2O O N Вильсмайер-Хаак OHC POCl3 C H ДМФА 106 O Cl2OP O N C H Cl2OP N C H электрофил OPOCl2 PhOH POCl3 / ДМФА N N HO- - OPOCl2- OHC Кольбе-Шмидт O OH HO OH OH OH CO2 H+ NaNO2 H3O+ ON OH H 2O NaOH CO2-Na+ 107 Реакция замещенных производных бензола с электрофилами (влияние заместителя) X X X H орто- H H X X X X E E E пара- E+ E E H H E X X X H мета- E H H H E E Выводы: 108 1. В случае электрофильной атаки в орто- и пара-положения положительный заряд оказывается на атоме углерода, связанном с имеющимся в кольце заместителе. При атаке в мета-положение заряд на этот атом углерода не попадает. 2. Донорные заместители стабилизируют сигма-комплексы, образующиеся в результате электрофильной атаки в орто- и пара-положения. Акцепторные заместители напротив – в наибольшей степени дестабилизируют сигма-комплексы, образующиеся в результате атаки в орто- и пара-положения. 3. Предпочтительными направлениями электрофильной атаки в случае донорно-замещенных производных бензола являются орто- и пара-. В случае акцеторного заместителя атака преимущественно происходит в мета-положение. 4. Донорные заместители повышают устойчивость σ-комплекса и, следовательно, реакционную способность замещенных бензолов, акцепторные заместители наоборот – снижают. Донорные заместители – алкил (индуктивный эффект), фенил, гетероатомы, несущие неподеленную пару электронов (мезомерный эффект). орто-пара-ориентанты заместители "первого рода":алкил, арил, OH, OR, NH2, NR2 , NHCOR, галоген 109 X X E E H Ph H E E H H мета-ориентанты заместители "второго рода": CN, CO2H, CO2R, CHO, NO2, SO3H, NR3+ Заместители «первого рода» активируют кольцо к реакциям электрофильного замещения (за исключением галогенов) по сравнению с бензолом. Заместители «второго рода» кольцо дезактивируют. При наличии более одного заместителя, обладающих разным и несогласованным действием, направление реакции определяется донорным заместителем. В случае нескольких донорных заместителей направление реакции определяется заместителем с большим эффектом. Пара-замещение обычно преобладает над орто-замещением, и тем в большей степени, чем больше объем заместителя и/или электрофила (стерический фактор) 110 CH3 CH3 CH3 NO2 NO2 E+ E NO2 > согласованное влияние заместителей E Cl Cl согласованное влияние заместителей + E HO3S HO3S E OH OH OH E+ CF3 OH E E >> + CF3 CF3 CF3 E несогласованное влияние заместителей 111 E+ E стерический фактор OCH3 OCH3 E+ OCH3 > E NHCOCH3 E NHCOCH3 NHCOCH3 E+ >> NO2 NO2 E E NO2 112 Реакции электрофильного замещения, которые могут протекать только с ароматическими субстратами, не менее реакционно-способными, чем хлорбензол: 1. Реакции Фриделя-Крафтса (алкилирование, ацилирование) 2. Реакции с карбокатионами, генерируемыми тем или иным способом 3. Реакция хлорметилирования 4. Реакции формилирования (Гаттермана и Гаттермана-Коха) 5. Кислотно-катализируемые реакции с альдегидами Реакции нитрования, сульфирования, хлорирования и бромирования могут происходить с практически любыми ароматическими субстратами Выводы: 1. Практически сложно провести селективно реакцию алкилирования (реакционная способность продукта выше, чем у исходного бензола). 2. Реакции ацилирования и формилирования могут приводить только к продуктам монозамещения (реакционная способность продукта гораздо ниже, чем у исходного бензола). 113 Обратимость реакции алкилирования PhH CH3Cl PhCH3 t CH3Cl + AlCl3 AlCl3 AlCl3 кинетический контроль термодинамический контроль H H H H PhCH3 CH3Cl + AlCl3 H H H H H H самый устойчивый σ-комплекс -H+ Разделение смеси ксилолов 114 H+ AlCl3 обогащение смеси мета-изомером основной изомер H2SO4 t H3 O + SO3H кристаллизация более высокоплавкого пара-изомера OH CH3OH CH3Cl Al2O3, t AlCl3 AlCl4устойчивая соль 115 Использование защитных групп в электрофильном ароматическом замещении PhCH3 CH3COCl > AlCl3 COCH3 COCH3 OH H+ H3O+ t CH3COCl AlCl3 практически единственный изомер COCH3 единственный изомер 116 PhCH3 HNO3 CH3COCl NO2 NO2 SO3 H2SO4 AlCl3 + H2SO4 H3O + t HNO3 HO3S практически единственный изомер H2SO4 HO3S NO2 единственный изомер 117 Электрофильное замещение в ряду нафталина H E H E H E атака в α-положение менее значимые резонансные структуры E+ H H атака в β-положение E E менее значимые резонансные структуры Более устойчивый сигма-комплекс образуется при атаке в альфа-положение. Если реакция необратима, то основным является продукт замещения в альфаположении. Если реакция обратима и проводится в условиях термодинамического контроля, образуется продукт замещения в бета-положение. 118 H X H дестабилизирующее взаимодействие в случае α-атаки O O CH3COCl CH3COCl AlCl3 CS2 AlCl3 PhNO2 HNO3 NO2 H2SO4 100o SO3H SO3H H+ 160o 119 Br H Br Br2 H Br- без катализатора Br Br H t -HBr H Br 1,4-присоединение O O O AlCl3 O CO2H 1. Mg/Hg H3O+ 2. HF (ж.) 3. Mg/Hg H3O+ 4. Pt, -2H2 фенантрен 120 O O O CO2H O PhH Ph AlCl3 P 2O5 Pt t O O антрахинон антрацен X X 8 X X2 t 9 7 10 6 1 5 4 X = Cl, Br 2 3 9-Х-фенантрен Br 5 Br2 t 6 3 7 2 8 CH3COONO2 H2SO4 Br 10 121 4 9 1 Br SO3H SO3H t H+ NO2 Реакции гидрирования и восстановления PhH H2 Pt (Pd) H2 Pt (Pd) тетралин декалин 122 H2 Pt (Pd) легко происходит присоединение одного моля водорода, далее - аналогично бензолу 123 Восстановление по Берчу X X X EtOH -EtO- Na NH3 (жид.) EtOH H H H X X или H X EtOH -EtO- или H H H H X = акцептор Na NH3 (жид.) EtOH +e или H H X X Na NH3 (жид.) EtOH Х = донор X X X Na 124 Na NH3 (жид.) EtOH NH3 (жид.) EtOH X = акцептор Х = донор Реакции окисления O O O O2 KMnO4 V2O5 HO-, t малеиновый ангидрид кролик CO2H CO2H X O O O2 V2O5 6+ + (Cr ,H ,t) O фталевый ангидрид Х = донор X O2 V2O5 (Cr6+,H+,t) Х = акцептор X O O H2O CO2H CO2H O O 125 CrO42- O антрахинон O CO2H O CrO42- CrO42- HO2C дифеновая кислота фенантренхинон Реакции Дильса-Альдера CN AlCl3 + CN t CN CN 126 CN + CN CN CN O O O O + O F Mg Br триптицен 127 π-комплексы O2N CN NC NC NO2 CN O2N Свойства алкилбензолов Cl Cl Cl Cl2 Ph R hν Ph Ph R R Ph R R =H устойчивый бензильный радикал R R R R PhCCl3 128 PhCH2Cl PhCHCl2 PhCCl3 HOH2O Ca(OH)2 H2O H2SO4 H2O, t PhCH2OH PhCH2R PhCHO MnO4HO-, t (O2, Co2+) (H2Cr2O7) PhCO2H PhCO2H CO2H CO2H O2 O2 Co2+ Co2+ CO2H CO2H O2 O2 Co2+ Co2+ O O2 Co2+ 129 CO2H KMnO4, HO-,t Al2O3/Cr2O3 t Кумольный способ получения фенола и ацетона OOH O2 H+ Co2+ кумол Ph O H2O PhO Ph O OH2 -H+ - H2O гидроперекись кумила H PhO OH OH - PhOH фенол OH O -H+ ацетон OH H+ 130 Окисление хлорметильной (метильной) группы в альдегидную 1. уротропин Соммле 2. H3O+ MnO2 PhCH2Cl PhCHO H2 O N O NH3 S CrO2Cl2 PhCH3 Этар N N CH2O N ДМСО уротропин ДМСО CrO3 Ac2O/AcOH Ди- и триарилуглеводороды Cl Cl PhH AlCl3 Ph 1. Cl2, hν Ph Pd/BaSO4 Ph - 2. EtO 1,2-дифенилэтан H2 Ph Ph Ph цис-стильбен транс-стильбен 1. Br2 2. EtO-, t Ph Ph толан трифенилметан Ph3CH CHCl3 AlCl3 Ph CH2Cl2 PhH 131 дифенилметан AlCl3 Ph CCl4 AlCl3 Ph Ph Ph Na Ph3CCl Ph Ph Ph Na [Ph3CCl] -Cl Гомбер М. 1905 г Ph - Ph3C Ph Ph Ph Ph Ph Ph раствор трифенилметильный анион (радикал) Ph Ph в твердом состоянии трифенилметильный катион PhI Cu 132 Ph-Ph Ульман дифенил Ориентация электрофильного замещения X Х - акцептор Х - донор и др. ПАС флуорофоры N поглощение эмиссия Ph O Ph POP Измерение величины βактивности (радиоуглеродный метод датировки)