Клиническое значение и трудности диагностики латентной HBV
реклама

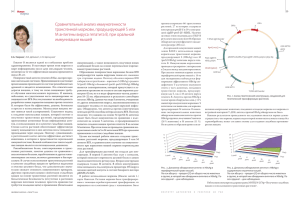
Клиническое значение и трудности диагностики латентной HBV-инфекции. ООО «НПО «Диагностические системы», 2015г Латентная HBV инфекция Низкий уровень репликации HBV, сниженный синтез и экспрессия вирусных антигенов. Адекватный ответ иммунной системы, ингибирующее воздействии других вирусов (HCV, HDV, HIV) Репликация вируса не подавлена, но не выявляется современными тестсистемами вследствие мутаций, изменяющих структуру его основных детерминант Occult hepatitis B virus infection. Латентное течение инфекции. Клинический случай № 1 Пациент, мужчина, 20 лет, не злоупотребляющий алкоголем. Поступил в стационар с признаками асцита. Результаты обследования: Билирубин - 41 моль/л, АлАТ – 131 МЕ/л, АсАТ- 194 МЕ/л, щел. фосфатаза - 125 МЕ/л, сывороточный альбумин - 20 г/л, протромбиновое время - 12.5 с. (кон-ль:10с.), сывороточно-асцитический градиент альбумина-3 г/л, АФП – 50,4 нг/мл. HBsAg – отриц. Анти-НСV – отриц. антиHBs – отриц. антиHBcor M,G – отриц. УЗИ брюшной полости показало: эхоструктура паренхимы печени грубая (неравномерно повышенная эхогенность). При эндоскопии верхнего отдела ЖКТ никаких изменений выявлено не было. С помощью ПЦР выявлена ВГВ-ДНК 8×104 копий/мл. Окончательный диагноз: цирроз печени. Al-Mahtab M., Khan M., Rahman S. Department of Hepatology, Bangabandhu Sheikh Mujib Medical University, Dhaka, Bangladesh Клинический случай № 2 Пациент, мужчина, 19 л., не злоупотребляющий алкоголем. Поступил в стационар с синдромом желтухи. При обследовании обнаружили гепатоспленомегалию. Анализ крови: гемоглобин: 14 г/дл, лейкоциты: 7000, общий холестерол – 180 мг/дл, LDL – 125 мг/дл, триглицерид – 45 мг/дл и HDL=40 мг/дл. Билирубин – 82 ммоль/л, АлАТ – 71 МЕ/л, АсАТ – 64 МЕ/л, щел. фосфатаза – 185 МЕ/л, сывороточный альбумин – 35 г/л протромбиновое время – 16 c. (control: 12 sec.). АФП – 15,8 нг/мл. HBsAg – отриц. Анти-HCV – отриц. Анти-HBc – отриц. Анти-HBs – положит. Проведенная биопсия позволила диагностировать фиброз печени. С помощью ПЦР выявлена ВГВ-ДНК 4×107 копий/мл. Окончательный диагноз: цирроз печени с портальной гипертензией. Al-Mahtab M., Khan M., Rahman S. Department of Hepatology, Bangabandhu Sheikh Mujib Medical University, Dhaka, Bangladesh Больные латентной HBV инфекцией могут быть источниками вируса и вызывать развитие посттрансфузионного гепатита у реципиентов крови и донорских органов, особенно печени. Выявление мутантных форм HBsAg: Актуальное направление развития диагностики гепатита В «Мутантные формы Гепатита B могут возникать у пациентов под воздействием иммунного ответа или лечения. Мутантные формы, которые возникают в иммунодоминантных эпитопах HBsAg, позволяют вирусу размножаться при наличии нейтрализующего иммунного ответа. В некоторых тест-системах мутантные формы HBsAg определяются как ложно-негативные. Изучение реактивности тест-систем с мутантными формами вируса Гепатита B – ключ к установлению правильного алгоритма тестирования на вирус Гепатита B» Paul F. Coleman* *Abbott Laboratories, Abbott Park, Illinois, USA По материалам CDC (Центра по контролю и профилактике заболеваний, г. Атланта, США). ПЕРВИЧНАЯ СТРУКТУРА «А» ДЕТЕРМИНАНТНЫ HBsAg, ОПРЕДЕЛЯЕМАЯ ГЕНОТИПОМ ВИРУСА, СУБТИПОМ HBsAg И «ESCAPE» МУТАНТАМИ HBsAg консервативные генотипо-специфические вариабельные вакцино-индуцированные субтипо-специфические УНИВЕРСАЛЬНАЯ СТРАТЕГИЯ ВАКЦИНАЦИИ ПРОТИВ ГЕПАТИТА В Новорожденные – Вакцинация всех новорожденных детей (независимо от наличия у их матерей HBsAg) — основа целенаправленных мероприятий в регионах со средним и высоким уровнем эндемичности гепатита В. Лица из групп высокого риска инфицирования вирусом гепатита В – Их вакцинация является обязательным компонентом универсальной программы вакцинации. К ним относятся: медицинские работники, выпускники и учащиеся медицинских институтов и училищ, больные отделений хронического гемодиализа, семейное окружение больных хроническим гепатитом В и вирусоносителей, дети интернатов, наркоманы, больные венерическими заболеваниями, сотрудники пенитенциарных учреждений. Рекомбинантные вакцины, зарегистрированные и разрешенные к применению в России: Engerix B производства фирм «Смит Кляйн Бичем»(Бельгия) и «Биомед» (Бельгия-Россия)(adr) Rec-HbsAg производства Республики Куба Recombivax НВ производства фирмы «Мерк Шарп и Доум»(США) Комбиотех производства «Комбиотех –ЛТД»(Россия) (ayw) Euvax производства Республики Корея Соответствие нейтрализующих антител к HBsAg дикого и мутантного типа Оккультная (латентная) HBV-инфекция • 2004 HBV ДНК “+” HBsAg “-” с/без антиHBs[1] • 2006 HBV ДНК (тк. печени) “+” HBV ДНК (кровь) “-” HBsAg “-” [2] • 2008 HBV ДНК “+” HBsAg “-” (кровь/тк. печени)[3] • 2009 HBV ДНК “+” в низкой концентрации (≤200 МЕ/мл) [4] • 2010 HBV ДНК “+” в тк. печени, HBsAg “-” [5] • 2010 Присутствие HBV ДНК в тк. печени (в некоторых случаях в сыворотке крови) HBsAg “-” Два варианта оккультного ГВ: • серопозитивный (HBcorAb ± HBsAb) • серонегативный (Ab не выявляются) [6] [1] Allain JP, Transfus Clin Biol, 2004 Feb; 11(1):18-25, [2] Carreno V., World J Gastroenterol,2006, [3] Carreno V. et al, Rev Med Vir, 2008, May-Jun; 18(3): 139157, [4] EASL, Management of CHB, Journ of Hepatology, 50(2009), 227-242, [5] Gerlich WH et al,, Dig Dis. 2010;28(1): 116-25, [6] Raimondo G. et al, Pathol Biol; 2010;Mar 18 Актуальной проблемой современной медицинской науки являются исследования по усовершенствованию существующих вакцин для профилактики вирусного гепатита В. Оккультный гепатит В Разработка новых высокочувствительных лабораторных тестов для выявления HBsAg дает нам новые возможности для изучения этой проблемы «ДС-ИФА-HBsAg-0,01» ИММУНОФЕРМЕНТНАЯ ТЕСТСИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ HBsAg С ПОВЫШЕННОЙ ЧУВСТВИТЕЛЬНОСТЬЮ, равной 0,01 МЕ/мл 14 Минимальные требования CTS (Common Technical Specification – Общие технические условия), и количество образцов, на которых была аттестована система ДС-ИФА-HBsAg-0,01 Prüflabor für In-vitro Diagnostika beim Paul-Ehrlich-Institut (PEI-IVD) Paul-Ehrlich-Straße 51-59 Results D-63225 Langen Sensitivity Seroconversion To assess early seroconversion sensitivity of the DS-EIAHBsAg-0,01 and for completion of the CTS study, 31 commercial seroconversion panels were investigated. The results of the individual panels are given in Appendix 1 Table 6 Part A and Part B. Results were compared to data available at PEI of further state of the art CE-marked HBsAg assays listed in Table 3. The DS-EIA-HBsAg-0,01 detected 8 panels (PHM 914, PHM 927, PHM 928, PHM 934, 6272, 6273, 6274 and 11011) reactive in the same bleed as the most sensitive assay from Table 3. Ten panels (PHM 925, PHM 926, PHM 929, PHM 931, PHM 933, 6275, 11000, 11012«ДС-ИФА-HBsAg-0,01» and 11016) were detected one- bleed earlier,чувствительный 11 panels (PHM 916,тест, PHM Таким11009, образом, наиболее 930, 6271, 6279, 11001, 11002, 11003, 11006, 11007, 11008, 11017) two bleeds earlier and который когда-либо тестировался в институте Пауля-Эрлиха. В среднем «ДСtwo panels (PHM 919 and PHM 932) even three bleeds earlier than any other HBsAg assay ИФА-HBsAg-0,01» определяли HBsAg на 5 дней раньше, чем самый for which comparative data was are чем summarized in Table 4. In чувствительный тест и available. в целом Comparative на 14 днейresults раньше наименее Table чувствительный. 4 assays 1-21 are ranked according to their sensitivity. For each panel the DS-EIA-HBsAg0,01 results are compared the earliest detection by any of the assays. Taken together the results demonstrate that the DS-EIA-HBsAg-0,01 is by far the most sensitive HBsAg test investigated at the Paul-Ehrlich-Institut (Fig. 1). On average the DS-EIAHBsAg0,01 detected HBsAg 1.35 bleeds (or 5.0 days) earlier than the most sensitive assay and onaverage 3.32 bleeds (or 14.1 days) earlier than the least sensitive assay. Evaluation Report for DS-EIA-HBsAg-0,01 Manufacturer: Diagnostic Systems Ltd. 22 Yablonevaya 603093 Nizhniy Novgorod Russian Federation Dr. Heinrich Scheiblauer Phone: +49 6103 777018 Fax: +49 6103 771234 E-mail: schhe @pei.de КАКИЕ ГАРАНТИИ ДАЕТ СЕ-СЕРТИФИКАЦИЯ ТЕСТ-СИСТЕМ ДЛЯ ВЫЯВЛЕНИЯ HBsAg? 1. ПОЛУЧЕНИЕ СЕРТИФИКАТА ISO 13485 2. ПОЛУЧЕНИЕ СЕРТИФИКАТА ГАРАНТИИ КАЧЕСТВА НА РАЗРАБОТКУ ТЕСТ-СИСТЕМ И СЕРТИФИКАТА ЭКСПЕРТИЗЫ РАЗРАБОТКИ ИЗДЕЛИЯ. 3. ПОЛУЧЕНИЕ СЕРТИФИКАТА НА СЕРИЮ СПАСИБО ЗА ВНИМАНИЕ! www.npods.ru 19