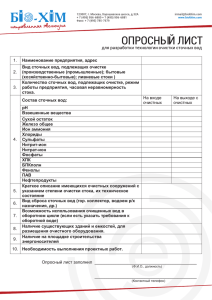
Жилинский В.В. ЭЛЕКТРОХИМИЧЕСКАЯ ОЧИСТКА СТОЧНЫХ
реклама

Учреждение образования «БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ» Жилинский В.В. ЭЛЕКТРОХИМИЧЕСКАЯ ОЧИСТКА СТОЧНЫХ ВОД И ВОДОПОДГОТОВКА КОНСПЕКТ ЛЕКЦИЙ для студентов специальности 1-48 01 04 «Технология электрохимических производств» Минск 2013 1 Содержание 4 Введение 1. КЛАССИФИКАЦИЯ И СВОЙСТВА ПРИРОДНЫХ И СТОЧНЫХ ВОД 6 1.1. Природные воды 6 1.1.1. Характеристика источников водоснабжения 6 1.1.2. Качество природных вод 8 1.2. Состав и классификация загрязнений природных вод 10 1.3. Основные показатели качества воды 11 1.3.1. Органолептические показатели качества воды 11 1.3.2. Общие физико-химические показатели качества воды 12 1.3.3. Микробиологические показатели качества воды 21 1.4. Сточные воды 25 1.4.1. Состав и свойства производственных сточных вод 26 1.4.2. Методы очистки сточных вод 27 1.4.3. Технологические воды гальванических производств 29 2. ЭЛЕКТРОДИАЛИЗ В ЭЛЕКТРОХИМИЧЕСКОЙ ОЧИСТКЕ СТОЧНЫХ СТОЧНЫХ ВОД И ВОДОПОДГОТОВКЕ 35 2.1. Теоретические основы электродиализа 39 41 2.1.1. Ионообменные мембраны 2.1.2. Теория массопереноса в электродиализной ячейке 45 2.2. Основные технологические параметры процессов электродиализной очистки сточных вод 50 2.3. Использование электродиализного метода для обессоливания и концентрирования растворов 53 2.4. Электродиализ отработанных растворов гальванических производств 55 2.5. Методы и способы интенсификации электродиализных процессов 56 2.5.1. Конструкционные решения 57 2.5.2. Использование нестационарных токовых режимов 63 70 2.6. Расчет электродиализатора 2.6.1. Методика расчета установки циркуляционного типа 70 2.6.2. Методика расчета установки прямоточного типа 75 2.6.3. Расчет объема газа в приэлектродных камерах 78 2.7. Экономическая и экологическая оценка электродиализной обработки водных сред 79 2.7.1. Очистка сточных вод гальванических производств 80 2 2.7.2. Опреснение природных вод 81 2.7.3. Нейтрализация и переработка сбросных рассолов опреснителей 83 2.8. Электродиализ для электрокорректорекции рН 84 3. ЭЛЕКТРОФЛОТАЦИЯ 88 4. ИОНООБМЕННАЯ ВОДОПОГОТОВКА И ОЧИСТКА СТОЧНЫХ ВОД 93 4.1. Основные понятия из теории ионного обмена 93 4.2. Ионообменная очистка сточных вод 102 5. ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ КОМПОНЕНТОВ СТОЧНЫХ ВОД 113 6. ЭЛЕКТРОХИМИЧЕСКОЕ ОБЕЗЗАРАЖИВАНИЕ ПРИРОДНЫХ И СТОЧНЫХ ВОД 118 6.1. Хлорирование воды в системах водоснабжения 131 7. ИЗВЛЕЧЕНИЕ ЦВЕТНЫХ МЕТАЛЛОВ ИЗ СТОЧНЫХ ВОД 138 МЕТОДОМ ПРЯМОГО ЭЛЕКТРОЛИЗА 147 8. ЭЛЕКТРО- И ГАЛЬВАНОКОАГУЛЯЦИЯ 8.1. Теоря коагуляции 147 8.2. Электрркрагуляция 153 8.3. Электрокоагуляционная очистка сточных вод 158 8.4. Гальванокоагуляция 167 174 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ 3 Введение К важнейшим проблемам современного сообщества, связанным с развитием промышленности и сельскохозяйственного производства, энергетики и коммунального хозяйства, относятся комплексное использование и охрана водных ресурсов. Рост водопотребления, возросшие требования к качеству воды обусловливают строительство новых систем и сооружений водоснабжения, расширение и реконструкцию существующих. При поступлении сточных вод в природные содержание минеральных солей в последних непрерывно возрастает, что усугубляет дефицит пресной воды . В связи сэтим основным направлением охраны окружающей среды от промышленных отходов должна быть разработка безотходных и малоотходных технологических процессов. Эта задача стратегическая и рассчитана на длительный период. В настоящее время наиболее распространенным методом решения этой проблемы является разработка эффективных очистных установок для улавливания и переработки различных отходов . Среди всего разнообразия производственных сточных вод выделены сточные воды, образующиеся на предприятиях металлообработки и машиностроения. Эти производства являются значительными потребителями водных ресурсов, забирающими из водных источников около 12 % свежей воды от общего расхода промышленностью страны. Около половины этого количества расходуется на нужды гальванического производства. Оценки количества солей тяжелых металлов, сбрасываемых в России со сточными водами гальванических производств, противоречивы . Однако в целом они свидетельствуют о серьезном загрязнении природной среды и расточительном отношении к ресурсам. Так, по данным в гальванотехнике в среднем полезно используется 30-40 % цветных металлов, от 5 до 10 % кислот и щелочей и только 2-3 % воды. Помимо прочего, эти производства выбрасывают много токсичных шламов, образующихся при частичном обезвреживании сточных вод, переработка которых требует значительных затрат. Гальванопроизводства имеют специфические особенности в использовании воды, свои источники ее загрязнения и, следовательно, требуют разработки и внедрения своих конкретных технологических решений проблемы очистки воды с целью ее комплексного использования. Существенным резервом в осуществлении этих мероприятий является использование электрического тока в технологии очистки сточных вод, при котором происходит прямое превращение электрической энергии в энергию химических реакций, протекающих в растворе с большой скоростью. В настоящее время методы электрообработки получили развитие как эффективные и прогрессивные в технологии очистки воды. Установки по 4 реализации этих методов достаточно компактны, высокопроизводительны, процессы управления и эксплуатации сравнительно просто автоматизируются. Кроме того, электрообработка, при правильном сочетании ее с другими способами, позволяет успешно очищать сточные воды от ряда примесей различного состава и дисперсности. Позитивным является так же и то, что при этом, как правило, не увеличивается солевой состав очищаемой воды и нередко исключается образование осадков или значительно уменьшается их количество. Все это обеспечивает в ряде случаев существенные преимущества электрохимических методов перед традиционными методами обработки воды. Увеличение количества и мощности источников электроэнергии, значительные успехи в области конструктивных разработок электролизеров, появление новых электротехнических материалов, в том числе малоизнашивающихся, стойких к анодной поляризации электродов, позволяют предполагать, что установки, действующие на основе принципов воздействия электрофизических и электрохимических факторов, найдут широкое применение в технологии водоподготовки и локальной очистки промышленных сточных вод. 5 1. КЛАССИФИКАЦИЯ И СВОЙСТВА ПРИРОДНЫХ И СТОЧНЫХ ВОД 1.1. Природные воды 1.1.1. Характеристика источников водоснабжения Вода - самое распространенное в природе вещество, на ее долю приходится около 71 поверхности Земли. Вода представлена в литосфере, гидросфере, на суше в виде подземных вод, ледников, озер, почвенных вод, рек. В земной атмосфере содержится по различным оценкам 14,5-15 тыс. км3 воды, что составляет 0,0005 общего запаса свободной воды. Казалось бы, о каком дефиците воды может идти речь? Количество пресной воды оценивается в 35 млн. км3. Ежегодно на земную поверхность выпадает примерно 120 тыс. км3 пресной воды в виде дождя, снега, града. Однако существует несколько причин, обусловивших возникновение "водного голода". Подавляющая часть пресной воды является труднодоступной для людей, т.к. она в основном находится в полярных ледниках и водоносных слоях под землей. Другой причиной дефицита воды является неравномерность распределения водных ресурсов по земной поверхности. Запас пресных поверхностных вод по России составляет около 30 тыс. км3, а потребление - 4270 км3 в год, что на одного человека в среднем составляет 29 тыс. м3 в год, тогда как в мире - 8,1 тыс. м3 в год. По Волгоградской области на одного человека приходится 2,05 тыс. м3 в год. Природные воды по своему составу весьма разнообразны. В состав воды входят соли - в виде ионов, молекул и комплексов, органические вещества - в молекулярных соединениях и в коллоидном состоянии, газы - в виде молекул и гидратированных соединений, диспергированные примеси, гидробионты (планктоны, бентос, нейстон, пагон), бактерии, вирусы. Таким образом, природная вода представляет собой сложную, постоянно изменяющуюся систему, содержащую минеральные и органические вещества, находящиеся во взвешенном, коллоидном и истинно растворенном состоянии, а также газы. В большинстве случаев природная вода имеет атмосферное происхождение - дождевая вода. Наиболее свободной от примесей является вода в атмосфере. Она содержит газы и сравнительно небольшое количество примесей, образующихся при растворении в ней твердых частиц (пыли) в атмосфере. Состав грунтовых, озерных, речных, морских и океанских вод может изменяться в широких пределах в зависимости от состава почв, пород, растительного мира, с которыми вода контактирует. Например, вода океанов содержит около 3,5 % растворенных веществ; Черного моря -1,6%, а Балтийского - 0,6 %. Количество взвешенных веществ в поверхностных водоисточниках изменяется от 101 до 104 мг/л. Содержание солей в речных водах достигает 1500 мг/л и более (для южных рек); органических веществ 6 180 мг/л и более (для северных рек). В воде озер содержание солей варьируется от 30 мг/л (Ладожское озеро) до 6000 мг/л (Иссык-Куль) и выше, а количество органических веществ достигает 100 мг/л и более. Разнообразен ионный состав воды. Так, главные составляющие морской воды - ионы С1- (55 %) и Na+ (30,6 %), а также катионы: Mg2+ (3,7 %), Са2+ (1,16 %), К+ (1,1 %); анионы: (SO4)2- (7,7 %), НСО3- (0,4 %), Вr- (0,2 %). В грунтовых и родниковых водах находятся главным образом ионы + Са2 , Mg2+, НСО3-, C1-, SO42-, Na+, а также Fe2+, Mn2+ и другие. В состав речных вод входят те же ионы, но НСО3~ содержится в меньшем количестве, так как гидрокарбонаты кальция и магния разлагаются с выделением углекислого газа. Из газов в природной воде растворены О2, N2, CO2, иногда H2S и NH3. Кислород и азот попадают в воду при растворении из воздуха, сероводород и аммиак обычно образуются в результате гниения органических веществ. В отличие от поверхностных, подземные воды отличаются небольшим количеством органических веществ, и, значит, содержанием минеральных солей. Подземные воды часто имеют значительную жесткость и повышенное содержание железа, марганца, фтора. Таким образом, природные воды сильно различаются как по общему содержанию растворенных солей, так и по относительному содержанию различных ионов. Это различие может существенно отражаться на свойствах воды, важных для той или другой области ее применения: промышленности, бытовых нужд, науки и техники. Оно сильно влияет, в частности, на корродирующее действие воды, т.е. на характер и интенсивность процессов коррозии металлов, бетона и некоторых природных каменных материалов. В табл. 1.1 приведена классификация примесей воды, основанная на их фазовом состоянии и дисперсности, и методы их удаления для соответствия ГОСТ 2874-82 "Вода питьевая". В жизнедеятельности человека природная вода находит широкое применение в промышленности, быту, науке и технике, поэтому выбраны определенные требования к ее качеству. 7 Таблица 1.1 Классификация примесей воды и методы их удаления Система Группа, размер частиц дисперсной фазы, см Характеристика примесей Методы удаления I 10 -10-4 Взвеси (суспензии и Механическое безреагентное разделение. эмульсии, Окисление хлором, озоном и др. Адгезия обусловливающие на гидроксидах алюминия или железа, а мутность воды, а также также на зернистых и высокодисперсных микроорганизмы и материалах. Флотация суспензий и планктон) эмульсий. Адгезия флокулянтами. Бактерицидное воздействие на патогенные микроорганизмы и споры. Электрофильтрация и электроудерживание микроорганизмов II 10-5-10-6 Коллоидные растворы Диализ, ультрафильтрация. Окисление и высокомолекулярные хлором, озоном и др. Адгезия на соединения, гидроксиде алюминия или железа, а также окисляемость и на высокодисперсных глинистых цветность воды, а материалах. Коагуляция коллоидных также вирусы систем. Агрегация высокомолекулярными флокулянтами катионного типа. Вирулицидное воздействие. Электрофорез и электродиализ III 10-6-10-7 Аэрация, эвапорация, десорбция газов и Молекулярные летучих органических соединений при растворы (газы, аэрировании. Окисление хлором, оксидом растворимые в воде хлорa(IV), озоном, перманганатом калия. органические Адсорбция на активированных углях и вещества, придающие других материалах. Экстракция ей запахи и привкусы) органическ. растворителями. Ассоциация молекул. Биохимическое разложение. Поляризация в электрическом поле IV 10-7-10-8 Ионные растворы Гиперфильтрация. Перевод ионов в (соли, кислоты, малодиссоциированные соединения. основания, придающие Фиксация ионов на твердой фазе ионитов. воде минерализоСепарация ионов при различном фазовом ванность, кислотность состоянии воды. Перевод ионов в или щелочность) малорастворимые соединения. Микробное выделение ионов металлов. Использование подвижности ионов в электрическом поле. -2 Гетерогенная Гомогенная 1.1.2. Качество природных вод Для определения качества воды проводят физические, химические, бактериологические, биологические и технологические анализы в наиболее характерные для данного водоисточника периоды времени года. Число и объем анализов качества воды зависит от ее назначения. В зависимости от 8 целевого назначения к качеству воды предъявляют определенные требования, согласно которым ее можно классифицировать для: хозяйственно-питьевых целей, охлаждения, нужд паросилового оборудования, технологических нужд промышленности, нужд сельского хозяйства (рис. 1.1). Рис. 1.1. Классификация вод по целевому назначению • • • • • • • Вследствие антропогенного воздействия природная вода загрязняется различными веществами, что приводит к ухудшению ее качества. Следует выделить следующие тенденции в изменении качества природных вод под влиянием хозяйственной деятельности людей : - снижение рН пресных вод в результате их загрязнения серной и азотной кислотами из атмосферы, увеличение содержания в них сульфатов и фосфатов; - понижение концентрации ионов кальция, магния, кремния в подземных и речных водах вследствие вымывания и растворения подкисленных дождевыми водами карбонатных и других горных пород; повышение содержания в природных водах ионов тяжелых металлов, прежде всего Pb, Cd, As, Zn, а также фосфатов (> 0,1 мг/л), нитритов и др.; - повышение содержания солей в поверхностных и подземных водах (примерно на 30-50 мг/л в год) в результате их поступления со сточными водами из атмосферы и за счет смыва твердых отходов; - повышение содержания в водах органических соединений, прежде всего биологически стойких (ПАВ, пестицидов, продуктов их распада и других токсичных веществ); - снижение содержания кислорода в природных водах, прежде всего в результате повышения его расхода на окислительные процессы, связанные с эвтрофикацией водоемов, с минерализацией органических соединений, а также вследствие загрязнения поверхности водоемов гидрофобными веществами и сокращения доступа кислорода из атмосферы; - снижение прозрачности воды в водоемах; 9 • потенциальная опасность загрязнения природных вод радиоактивными изотопами химических элементов. Вода для хозяйственно-питьевых вод должна быть безвредна для здоровья человека, иметь хорошие органолептические показатели и быть пригодной для использования в быту. Показатели качества хозяйственнопитьевой воды регламентированы ГОСТ 2874-82 "Вода питьевая", а также . Требования, предъявляемые к качеству воды для производственных нужд, весьма разнообразны и по отдельным показателям в зависимости от ее целевого использования могут быть более жесткими, чем по ГОСТ 287482. Например, в воде, используемой в пивоварении, должны отсутствовать сульфаты, содержание железа не более 0,1 мг/л; в воде для изготовления фотобумаги не должно быть марганца, железа, кремнекислоты и ограничено содержание хлоридов. В зависимости от характера использования природная вода проходит различные этапы обработки, главными из которых являются водоочистка и водоподготовка. Водоочистка заключается в удалении из воды растворенных и взвешенных примесей, а также бактерий, растительных и животных микроорганизмов. Водоподготовка состоит в обработке воды для приведения ее качества в соответствии с требованиями потребителя. При водоподготовке производят стабилизацию воды. Например, обеспечение постоянной концентрации СаСО3, хлорирование, фторирование (для питьевых целей), умягчение, опреснение и обессоливание (см. подразд. 1.1.3). Для обессоливания примесей, кроме реагентных методов, применяют ионный обмен и электродиализ, а для соленых вод (солесодержание 33,5 г/л) обратный осмос. Для научных исследований, в медицине, при производстве полупроводниковых деталей и в ряде других областей требуется хорошо очищенная вода. Как правило, для этих нужд используют дистиллированную воду с удельной электропроводностью 10-6 Ом-1 · см-1. Особо чистую воду получают перегонкой в кварцевой аппаратуре (с удельной электропроводностью 5 · 10-8 Ом-1 · см-1) - прямым синтезом из кислорода и водорода. 1.2. Состав и классификация загрязнений природных вод В природных водах, которые чаще всего используются для водоснабжения, содержатся: • во взвешенном состоянии - глинистые, песчаные, гипсовые и известковые частицы, а также микроорганизмы и планктон, придающие воде мутность (размер этих частиц от 10–3 до 10–5 см); • в коллоидном состоянии – различные вещества органического происхождения, кремнекислота, гидроксид железа (Ш), а также вирусы (Коллоидные примеси воды – это мельчайшие частицы, раз10 мером от 10–5 до 10–6 см, которые не задерживаются обычными фильтрующими материалами и не осаждаются под действием силы тяжести); • в виде молекулярных растворов – газы (азот, кислород, углекислый газ и др.), растворимые в воде органические вещества, придающие ей запахи и привкусы (размер частиц от 10–6 до 10–7 см); • в виде ионных растворов – минеральные соли, кислоты, основания, придающие воде минерализованность, кислотность или щелочность (размер частиц менее 10–7 см ). Химический состав природных вод подразделяется на пять групп: главные ионы, содержащиеся в наибольшем количестве (натрий Na+, кальций Са2+, магний Mg2+, калий K+, хлориды Cl-, сульфаты SO42-, гидрокарбонаты HCO3-, карбонаты CO32-); растворенные газы (азот N2, кислород О2, углекислый газ СО2, метан СН4, сероводород H2S и др.); биогенные элементы (соединения фосфора, азота, кремния), наличие которых в воде способствует развитию микроорганизмов; микроэлементы (соединения всех остальных химических элементов), их концентрация в воде не превышает 1 мг/л; органические вещества. 1.3. Основные показатели качества воды 1.3.1. Органолептические показатели качества воды К числу органолептических показателей относятся те параметры качества воды, которые определяют ее потребительские свойства, т.е. свойства, непосредственно влияющие на органы чувств человека (обоняние, осязание, зрение). Мутность воды вызвана присутствием взвешенных и коллоидных частиц органического и неорганического происхождения. Выражается в мг/л. Мутность отрицательно влияет не только на внешний вид воды. Взвешенные вещества являются средой для роста и размножения микроорганизмов, снижают эффективность обеззараживания воды (препятствуют прохождению УФ-лучей, замедляют процессы окисления). Поэтому перед дезинфекцией воды, нужно удалить взвешенные вещества (провести коагулирование и фильтрование). Во многих случаях коагулянт необходимо добавлять даже в чистую и прозрачную на первый взгляд воду, так как она может содержать мельчайшие коллоидные частицы, не видимые при дневном свете, однако хорошо заметные в луче прожектора. Цветностью называют показатель качества воды, характеризующий интенсивность окраски воды. Определяется цветность путем сравнения окраски испытуемой воды с эталонами и выражается в градусах платиновокобальтовой шкалы. 11 Цветность воды обусловливается, в основном, присутствием окрашенных органических веществ (главным образом соединений гуминовых и фульвовых кислот, входящих в состав живых и растительных организмов и являющихся продуктами их жизнедеятельности или распада), жиров, соединений трехвалентного железа и некоторых других металлов. Зимой содержание органических веществ в природных водах минимальное, в то время как весной в период половодья и паводков, а также летом в период массового развития водорослей - "цветения" воды - оно повышается. Подземные воды, как правило, имеют меньшую цветность, чем поверхностные. При массовом развитии водорослей из группы протококковых вода приобретает светло-зеленую окраску, диатомитовых – зеленовато-бурую, перидиниевых – темно-бурую, синезеленых – изумрудно-зеленую. Высокая цветность воды является тревожным признаком, свидетельствующим о ее неблагополучии. Наличие органических веществ приводит к возникновению посторонних запахов, вызывает резкое снижение концентрации растворенного в воде кислорода, замедляет процессы водоочистки (требует большего количества химикатов). Некоторые органические соединения, вступая в химические реакции с хлором, способны образовывать опасные для здоровья человека вещества (летучие хлорорганические соединения – ЛХС). Привкусы и запахи могут быть как естественного (обусловленные присутствием в воде железа, марганца, сероводорода), так и искусственного (хлорирование воды) происхождения. Выражаются в баллах.Возникновение запахов в воде часто объясняется развитием водорослей, плесени и грибков, которые в процессе жизнедеятельности продуцируют в воду специфические органические ароматические вещества. 1.3.2. Общие физико-химические показатели качества воды Водородный показатель рН – показатель степени щелочности или кислотности воды. От величины рН во многом зависит качество воды. Степень кислотности или щелочности воды определяется соотношением концентраций водородных Н+ и гидроксильных ОН- ионов. Тщательно очищенная от посторонних примесей вода обладает определенной, хотя и незначительной, электрической проводимостью, заметно возрастающей с повышением температуры. Учитывая, что при комнатной температуре на ионы диссоциирует лишь одна из примерно 108 молекул воды, концентрацию нераспавшихся молекул воды можно считать равной общей концентрации молекул воды. При равенстве концентраций ионов Н+ и ОН- в чистой воде (без примесей) при t = 250С концентрация каждого из этих ионов составляет: [Н+] = [ОН-] = 1 х 10-7 моль/л. В этом случае раствор нейтральный. Если концентрация Н+-ионов больше 1 х 10-7, реакция раствора кислая. Наоборот, 12 при увеличении концентрации ОН—-ионов содержание Н+-ионов становится меньше 1 х 10-7, и раствор приобретает щелочную реакцию. Так как между концентрациями [ Н+ ] и [ ОН- ] существует обратная зависимость, то реакция среды характеризуется обычно концентрацией Н+-ионов. Чтобы не оперировать с дробными числами, вместо концентрации Н+-ионов пользуются ее отрицательным логарифмом – водородным показателем рН (где р –символ отрицательного логарифма). Отсюда растворы с рН = 7 имеют нейтральную реакцию, при рН > 7 – щелочную и при рН < 7 – кислую. Очень часто показатель рН путают с такими параметрами, как кислотность и щелочность воды. Важно понимать разницу между ними. рН отражает степень кислотности или щелочности среды, в то время как кислотность и щелочность характеризуют количественное содержание в воде веществ, способных нейтрализовать соответственно щелочи и кислоты. В зависимости от уровня рН можно условно разделить воды на несколько групп: Таблица 1.2. Группы вод Группа вод сильнокислые воды кислые воды слабокислые воды нейтральные воды слабощелочные воды щелочные воды сильнощелочные воды Величина рН <3 3-5 5 - 6.5 6.5 - 7.5 7.5 - 8.5 8.5 - 9.5 > 9.5 Влияние водородного показателя рН на качество воды. pH - один из важнейших рабочих показателей качества воды, во многом определяющих характер происходящих в ней химических и биологических процессов. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды. Постоянный контроль уровня рН очень важен для обеспечения надлежащего качества воды в плавательных бассейнах, так как его повышение или понижение может не только сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий. Например, в диапазоне значений рН от 7,0 до 8,0 происходит снижение активности хлора с 75% до 23%. При повышенном значении рН происходит выпадение известкового осадка, вода приобретает неприятный запах, способна вызывать раздражение глаз и кожи у купающихся. Если значение рН понижено, металлическим деталям угрожает коррозия, а материалам и швам плиточного покрытия - разрушение. Добавление в воду различных химических веществ может привести к изменению уровня рН. Так, например, гипохлорит натрия («Хлорин жид13 кий») обладает высокой щелочностью и вызывает рост рН. Дихлоризоцианурат натрия («Гранухлор») имеет реакцию, близкую к нейтральной, а трихлоризоциануровая кислота («Пермахлор») – кислую. Как правило, значение рН воды (особенно жесткой) имеет тенденцию повышаться. Коагулирование, хлорирование и нагревание воды сопровождаются выделением газов угольной кислоты (СО2), что, как правило, и приводит к увеличению водородного показателя. При этом необходимо дозировать кислоту (кислую соль) для его регулирования. Однако, если вода очень мягкая, проблемой может являться низкий уровень рН. В этом случае добавляются щелочные реагенты. При увеличении рН воды с высокой карбонатной жесткостью вода вначале мутнеет и приобретает молочно-белую окраску. Известковые отложения могут наблюдаться и в загрузке фильтра, что приводит к некачественной фильтрации воды. Поэтому контроль рН жесткой воды должен быть особенно тщательным. При существенном понижении рН известковый осадок не образуется; однако, из-за высокой концентрации свободной угольной кислоты, возрастает агрессивность воды. Вследствие химических или электрохимических реакций возможна коррозия металлических элементов конструкции и разрушение материалов и швов. Для питьевой воды оптимальным считается уровень рН в диапазоне от 6 до 9, для воды в плавательных бассейнах более жесткие требования - 7,2 – 7,6 (идеально – от 7,2 до 7,4). Кислотностью называют содержание в воде веществ, способных вступать в реакцию с гидроксид-ионами (ОН-). В природных водах кислотность в большинстве случаев зависит только от содержания свободного диоксида углерода (СО2). Также на кислотность влияют гуминовые и другие слабые органические кислоты и катионы слабых оснований (ионы аммония, железа, алюминия). Щелочность воды выражается суммой концентраций гидроксильных ионов (ОН-) и анионов слабых кислот (гидрокарбонатов HCO3- и карбонатов CO32-). Поскольку в большинстве природных вод преобладают карбонаты, то обычно различают гидрокарбонатную и карбонатную щелочность. В редких случаях, при рН>8.5 возникает гидратная щелочность. В воде щелочность должна поддерживаться на уровне 80 – 150 мг/л. Растворенные газы – углекислота, сероводород, кислород – при определенных условиях придают воде коррозийные свойства по отношению к металлам и бетонам. Угольная кислота (углекислота), ее формы содержания в воде и влияние на качество воды. Углекислота присутствует во всех природных водах от нескольких мг/л (поверхностные воды) до сотен мг/л (подземные воды). В зависимости от рН воды углекислота содержится в ней в виде: 14 свободной углекислоты, представляющей собой растворенный в воде газ СО2, полусвязанной углекислоты (бикарбонат-ионов HCO3-), связанной углекислоты (карбонат-ионов CO32-). Рис. 1.2. Диаграмма устойчивости углекислоты Как видно из диаграммы, при рН < 4,5 бикарбонат-ионы в воде отсутствуют и вся углекислота находится в виде углекислого газа, а при рН = 8,4 – только в виде бикарбонатных ионов. При рН > 10,5 в воде присутствуют только карбонатные ионы. Обычно питьевая вода (рН от 6 до 9) и вода в бассейнах (рН от 7,2 – 7,6) не содержат карбонатов. Содержащиеся в воде углекислый газ, карбонатные и бикарбонатные ионы связаны углекислотным равновесием: Н2О + СО2 ⇔ Н2СО3 ⇔ Н+ + HCO3- ⇔ CO32- +2Н+ При повышении рН равновесие сдвигается в сторону образования карбонат-ионов, а при понижении рН – в сторону образования Н2СО3. Вода, у которой свободная углекислота, гидрокарбонат- и карбонат-ионы находятся в равновесии, называется стабильной. При сдвиге равновесия в сторону образования свободной углекислоты вода становится агрессивной, при этом повышается ее коррозионная активность. При сдвиге равновесия в сторону образования карбонат-ионов выпадает в осадок слаборастворимый карбонат кальция. В водных растворах углекислых соединений наблюдается динамическое равновесие, описываемое реакцией 2HCO3- ⇔ CO32- + СО2 + Н2О, из которой следует, что для поддержания в растворе определенной концентрации бикарбонатных ионов необходимо присутствие некоторого (равновесного) количества свободной углекислоты СО2р. Если в воде содержание свободной углекислоты больше, чем соответствующее состоянию равновесия, то часть свободной углекислоты будет взаимодействовать с карбонатом кальция, переводя его в гидрокарбонат с большей растворимостью СО2 + Н2О + CaCO3 ⇔ Ca(HCO3)2 15 Этот избыток свободной углекислоты над равновесной, взаимодействующей с карбонатом кальция, называется агрессивной углекислотой, которая растворяет карбонат кальция, разрушающе воздействует на бетон, катализирует ход электрохимической коррозии металла. Повышение содержания в воде бикарбонатов влечет за собой необходимость увеличения равновесной углекислоты, поэтому очевидна вероятность присутствия агрессивной углекислоты в мягких водах в большей степени, чем в жестких. По мере роста солесодержания воды уменьшается количество свободной углекислоты, необходимой для поддержания углекислотного равновесия. Следовательно, при одинаковом содержании свободной углекислоты вода с большей минерализацией будет более агрессивной. Следует отметить, что при осуществлении коагулирования примесей воды происходит порой значительное нарушение углекислотного равновесия воды, так как при введении 1 мг безводного коагулянта образуется 0,8 мг свободной углекислоты. Стабильность - один из основных технологических показателей качества воды. Она характеризуется соотношением содержания различных форм углекислоты. Вода считается стабильной, если при контакте ее с поверхностью бетона последний не растворяется под действием агрессивной СО2 и на нем не отлагаются карбонаты из-за пересыщения воды карбонатом кальция. Жесткость определяется суммарным содержанием в воде солей кальция и магния.Различают следующие типы жёсткости воды: • общая жёсткость; • карбонатная жёсткость (называемая также временной жёсткостью); • некарбонатная жесткость (называемая также постоянной жесткостью). Карбонатная жесткость обусловлена содержанием в воде карбонатных (при рН>8.4) и бикарбонатных солей кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния. Некарбонатная жесткость обусловлена кальциевыми и магниевыми солями серной, соляной, кремниевой и азотной кислот, при кипячении не устраняется (постоянная жесткость). Сумма карбонатной и некарбонатной жесткости определяет общую жесткость. В мировой практике используется несколько единиц измерения жесткости: • один немецкий градус составляет 10 мг/л СаО; • один французский градус - 10 мг/л СаСО3; 16 • один американский градус - 1 мг/л СаСО3; • один английский градус - 10 мг СаСО3 в 0,7 л воды. В России в качестве единицы жесткости воды используется граммэквивалент на кубический метр (г-экв/м3). 1 г-экв/м3=1мг-экв/л=1мг-экв/дм3. Соотношение единиц жесткости представлено в следующей таблице 1.3.: Таблица 1.3. Соотношение единиц жесткости воды (мг-экв/л) 1.000 Немецкий градус, do 2.804 Единицы жесткости воды Французский Американский o градус, f градус 5.005 50.045 Английский градус 3.511 При известных концентрациях кальция и магния в воде, выраженных в мг/л, зная атомные массы и валентность этих веществ, общую жесткость в мг-экв/л можно вычислить по формуле: [ Mg2+ ] [ Са2+ ] Жобщ = ------------ + -----------20,04 12,16 Жесткость природных вод не является вредной для здоровья человека, а скорее наоборот, так как кальций способствует выводу из организма кадмия, отрицательно влияющего на сердечно-сосудистую систему. Однако повышенная жесткость делает воду непригодной для хозяйственно-бытовых нужд. Жесткость ограничивается в питательной воде котлов (до 0,05 – 0,1 мг-экв/л), так как соли кальция и магния образуют накипь на стенках котлов, что приводит к снижению их экономичности, а иногда к авариям. При повышении рН и нагревании воды с высокой карбонатной жесткостью в ней выпадает осадок - карбонат кальция. Мягкая вода с жесткостью менее 2 мг-экв/л и низкой щелочностью может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное коррозионное воздействие на водопроводные трубы. Кроме того, такая вода имеет низкую буферную емкость, т.е. даже небольшое количество применяемого средства для корректировки рН этой воды может вызвать существенное изменение водородного показателя. Поэтому применение средств корректировки рН для улучшения качества мягкой воды требует особой осторожности. В первые несколько недель после облицовки бассейна плиткой, строительный раствор, содержащий известь, повышает щёлочность воды, а соответственно и уровень рН. Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ. Этот параметр 17 также называют общим солесодержанием, так как растворенные в воде вещества находятся именно в виде солей. К числу наиболее распространенных относятся неорганические соли (в основном бикарбонаты, хлориды и сульфаты кальция, магния, калия и натрия), кроме того в воде в растворенном состоянии находится и небольшое количество органических веществ. Уровень солесодержания в питьевой воде обусловлен качеством воды в природных источниках и варьируется в разных регионах в зависимости от геологических условий. По степени минерализации природные воды можно разделить на следующие категории: Таблица 1.4. Категории природных вод Категория вод Ультрапресные Пресные Воды с относительно повышенной минерализацией Солоноватые Соленые Воды повышенной солености Рассолы Минерализация, г/л < 0.2 0.2 - 0.5 0.5 - 1.0 1.0 - 3.0 3 - 10 10 - 35 > 35 По органолептическим показаниям СанПиНом рекомендован верхний предел минерализации питьевой воды - 1г/л (=1000 мг/л). Окисляемость является параметром, позволяющим оценить общее загрязнение воды органическими веществами. Окисляемость обусловливается присутствием в воде органических и некоторых неорганических примесей (железо (П), сульфиты, сероводород), способных взаимодействовать с окислителями. Выражается этот показатель в миллиграммах кислорода, пошедшего на окисление этих веществ, содержащихся в 1 л воды (мгО2/л). Величина окисляемости природных вод может варьироваться в широких пределах: от долей миллиграммов до десятков миллиграммов О2 на литр воды. Поверхностные воды имеют более высокую окисляемость (а значит более "богаты" органикой) по сравнению с подземными. Окислительно-восстановительный потенциал (ОВП), называемый также редокс-потенциал (от английского RedOx - Reduction/Oxidation), характеризует степень активности электронов в окислительновосстановительных реакциях, т.е. реакциях, связанных с присоединением или передачей электронов. Значение окислительно-восстановительного потенциала выражается в милливольтах и может иметь как положительное, так и отрицательное значение. В природной воде значение Rx колеблется от - 400 до + 700 мВ, что определяется всей совокупностью происходящих в 18 ней окислительных и восстановительных процессов. Величина Rx позволяет делать некоторые общие выводы о химическом составе воды. В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в природных водах: Окислительная характеризуется значениями Rx > + (100 - 150) мВ, присутствием в воде свободного кислорода, а также целого ряда элементов в высшей форме своей валентности (Fe3+, Mo6+, As5-, V5+, U6+, Sr4+, Cu2+, Pb2+). Ситуация, наиболее часто встречающаяся в поверхностных водах. Переходная окислительно-восстановительная определяется величинами Rx от 0 до + 100 мВ, неустойчивым геохимическим режимом и переменным содержанием сероводорода и кислорода. В этих условиях протекает как слабое окисление, так и слабое восстановление целого ряда металлов. Восстановительная характеризуется значениями Rx < 0. Типична для подземных вод, где присутствуют металлы низких степеней валентности (Fe2+, Mn2+, Mo4+, V4+, U4+), а также сероводород. Окислительно-восстановительный потенциал зависит от температуры и взаимосвязан с рН. При обработке воды для бассейнов редокс-потенциал является одним из основных параметров контроля качества воды, так как позволяет оценить эффективность ee обеззараживания (служит критерием для определения степени окисляющего и обеззараживающего действия средств дезинфекции). Для иллюстрации можно привести таблицу зависимости продолжительности жизни бактерии Е. coli от величины редокспотенциала. Таблица 1.5. Зависимость продолжительности жизни бактерии Е. coli от величины редокс-потенциала ОВП, мВ Время жизни E. coli, мин. 167 6 1,7 0,2 0,05 450 - 500 500 - 550 550 - 600 700 - 750 750 - 800 Так как результаты измерения зависят от значения рН, существуют различные минимальные значения редокс-потенциала, которые нужно соблюдать при обеззараживании пресной воды: при рН= 7,0 –7,3 750 мВ; при рН= 7,3 –7,6 770 мВ; для морской воды эти значения снижаются на 50 мВ. Железо и марганец. Избыток в воде железа и марганца вызывает ее окраску и неприятный вкус, а также причиняет неудобства в быту. Длитель19 ное употребление человеком воды с повышенным содержанием железа может привести к заболеваниям печени, увеличивает риск инфарктов, негативно влияет на репродуктивную функцию организма, а избыток в питьевой воде марганца вызывает заболевания костной системы. Высокие концентрации железа и марганца, как правило, содержатся в подземных водах (из колодцев или скважин). Присутствие в воде железа и марганца может способствовать развитию в трубах и теплообменных аппаратах железистых и марганцевых бактерий, продукты жизнедеятельности которых вызывают уменьшение сечения, а иногда и их полную закупорку. Содержание железа в воде питьевого качества не должно превышать 0,3 мг/л, марганца – 0,1 мг/л. Хлориды в количестве > 150 мг/л вызывают коррозию металла, в том числе нержавеющей стали. Содержание в питьевой воде и воде бассейнов хлоридов не должно превышать 350 мг/л. При концентрациях свыше 500 мг/л вода имеет солоноватый привкус. Сульфаты в количестве > 250 мг/л оказывают разрушающее воздействие на бетон. Содержание в питьевой воде и воде бассейнов сульфатов не должно превышать 500 мг/л. Азот поступает в воду из воздуха, при разложении органических остатков, а также восстановлении соединений азота денитрофицирующими бактериями. Нитраты образуются в результате расщепления мочевины и соединений, содержащих азот. Иногда присутствуют в грунтовых водах в регионах с развитым сельским хозяйством. Нитраты являются питательной средой для микроорганизмов. Их концентрация в воде не должна превышать 45 мг/л. Фосфаты могут присутствовать в воде открытых бассейнов при интенсивном внесении удобрений в почву. Они являются питательной средой для микроорганизмов. Концентрация фосфора в воде более 0,01 мг/л приводит к усиленному росту водорослей. Медь в питьевой воде в концентрациях свыше 1 мг/л вызывает гепатит и анемию, а воду бассейна может окрасить в сине-зелёный или тёмный цвет, при этом на стенках бассейна образуются трудно удаляемые пятна. Общее содержание хлора в воде складывается из суммы связанного активного хлора со слабым дезинфицирующим эффектом и свободного активного хлора с высокими бактерицидными свойствами. Обеззараживание воды хлором или хлорсодержащими препаратами производится такими дозами, чтобы после полного окисления органических веществ во всех водных участках постоянно регистрировался избыток свободного активного хлора в количестве. 1.3.3. Микробиологические показатели качества воды 20 Через воду передаются многие бактериальные инфекции, а также некоторые заболевания вирусной природы. На процесс их размножения бактерий влияют температура воды, солнечное излучение, наличие в воде биогенных элементов – азота и фосфора.Некоторые бактерии в неблагоприятных жизненных условиях образуют споры, которые могут сохраняться в жизнеспособном состоянии в течение сотен лет. При попадании в благоприятные условия споры прорастают и бактерии начинают вновь размножаться. Безопасность питьевой воды в эпидемическом отношении определяется ее соответствием нормативам по микробиологическим и паразитологическим показателям, представленным в таблице 1.6. Таблица 1.6. Бактериологические и паразитологические показатели Показатели Термотолерантные колиформные бактерии Общие колиформные бактерии2) Общее микробное число2) Колифаги3) Споры сульфитредуцирующих клостридий4) Цисты лямблий3) Единицы измерения Число бактерий в 100 мл1) Нормативы Отсутствие в 300мл Число бактерий в 100 мл1) Отсутствие в 300мл Число образующих колонии бактерий в 100 мл Число бляшкообразующих единиц (БОЕ) в 100 мл Число спор в 20 мл Не более 50 Число цист в 50 л Отсутствие Отсутствие Отсутствие Примечания: 1. При определении проводится трехкратное исследование по 100 мл отобранной пробы воды. 2. Превышение норматива не допускается в 95% проб, отбираемых в точках водоразбора наружной и внутренней водопроводной сети в течение 12 месяцев, при следующих условиях: количество исследуемых проб не менее 100 за год. Превышение допускается в единичных на не 2-х последовательно отобранных пробах в одной и той же точке. Уровень загрязнения при этом - не более 2 КОЕ (колоний образующих единиц) бактерий семейства Enterobacteriaceae в 100мл (коли-индекс не более 6). 3. Определение проводится в системах водоснабжения из поверхностных и подземных источников перед подачей воды в распределительную сеть, а также колифагов - и в распределительной сети. 4. Определение проводится при оценке эффективности технологии обработки воды. Таблица 1.7. Органолептические показатели Показатель Запах Привкус Цветность Мутность Единицы измерения Нормативы Балл Балл градус Pt-Co шкалы ЕМФ (единицы мутности по формазину) 2 2 20 2,6 21 мг/л (по каолину) 1,5 Таблица 1.8. Общие физико-химические показатели качества воды Показатель Единицы измерения ПДК Водородный показатель Общая минерализация (солесодержание) Жесткость общая Окисляемость перманганатная Температура Окислительно-восстановительный потенциал Щелочность единицы рН мг/л мг-экв/л мг/л о С мВ 6-9 1000 7.0 5.0 - мг-экв/л - Таблица 1.9. Предельно допустимые концентрации основных неорганических веществ в питьевой воде Вещество Алюминий (Al) Азот аммонийный (NH3 и NH4+) Барий (Ba) Бериллий (Be) Бор (B) Железо (Fe) Кадмий (Cd) Калий (K) Кальций (Ca) Кремний (Si) Литий (Li) Магний (Mg) Марганец (Mn) Медь (Cu) Молибден (Mo) Мышьяк (As) Натрий (Na) Никель (Ni) Нитраты (NO3) Нитриты (NO2) Ртуть (Hg) Свинец (Pb) Селен (Se) Серебро (Ag) Сероводород (H2S) ПДК мг/л 0.5 Показатель Класс опасвредности ности с.-т. 2 - - - 0.1 0.0002 0.5 0.3 0.001 10.0 0.03 0.1 1.0 0.25 0.05 200.0 0.1 45.0 3.0 0.0005 0.03 0.01 0.05 0.03 с.-т. с.-т. с.-т. орг. с.-т. с.-т. с.-т. орг. орг. с.-т. с.-т. с.-т. с.-т. орг. орг. с.-т. с.-т. с.-т. с.-т. орг.зап. 2 1 2 3 2 2 2 3 3 2 2 2 3 3 2 1 2 2 2 4 22 Стронций (Sr) Сульфаты (SO42-) Фосфор (P) Фториды (F-) Хлор, в том числе: - остаточный свободный - остаточный связанный Хлориды (Cl-) Хром (Cr3+) Хром (Cr6+) Цианиды (CN-) Цинк (Zn) 7.0 500.0 0.0001 1.5 0.3-0.5 0.8-1.2 с.-т. орг. с.-т. с.-т. орг. орг. 2 4 1 2 3 3 350.0 0.5 0.05 0.035 5.0 орг. с.-т. с.-т. с.-т. орг. 4 3 3 2 3 В данной таблице приведены показатели, характеризующие предельно допустимые концентрации (ПДК) основных неорганических веществ, влияющих на качество воды. Прочерк означает, что данный параметр не нормируется. ПДК – максимальные концентрации, при которых вещества не оказывают прямого или опосредованного влияния на состояние здоровья человека (при воздействии на организм в течение всей жизни) и не ухудшают гигиенические условия водопотребления. Лимитирующий признак вредности вещества, по которому установлен норматив: «с.-т.» - санитарно-токсикологический, «орг» - органолептический (изменяет запах воды, придает воде окраску, вызывет образование пены, образует пленку на поверхности воды, придает воде привкус, вызывает опалесценцию*). * Опалесценция - рассеивание света, при котором видны мельчайшие частицы. Классы опасности вещества: 1 класс – чрезвычайно опасные; 2 класс – высокоопасные; 3 класс – опасные; 4 класс – умеренно опасные. Знание класса опасности загрязняющих веществ крайне важно, так как они могут обладать кумулятивным эффектом. Это означает, что несколько особо вредных веществ, даже если содержание каждого из них не превышает предельно допустимой концентрации (ПДК), могут в совокупности сделать воду опасной. То есть вода, формально удовлетворяющая нормам по всем отдельным параметрам, в целом может оказаться не пригодной для питья. Поэтому при обнаружении в питьевой воде нескольких химических веществ, относящихся к 1 и 2 классам опасности и нормируемых по санитарнотоксикологическому признаку вредности, определяют сумму отношений фактических концентраций каждого из них к величине его ПДК. Эта сумма не должна превышать единицу. Расчет ведется по формуле: С2факт СNфакт С1факт ---------- + ------------ + …….. + -----------С1доп С2доп СNдоп 23 ≤ 1, где С1, С2, СN – концентрации в воде химических веществ 1 и 2 класса опасности: фактическая (факт.) и допустимая (доп.). Например, анализ воды показал содержание алюминия - 0,4 мг/л и лития – 0,02 мг/л. Подставив эти значения в формулу 0,4 0,02 ----- + ------ = 1,47 > 1, 0,5 0,03 определяем, что данная вода для питья не пригодна. Таблица 1.10. Содержание вредных химических веществ, поступающих и образующихся в воде в процессе ее обработки в системе водоснабжения Показатель ПДК, мг/л Обеззараживающие вещества Хлор - остаточный свободный - остаточный связанный Озон (остаточный) Побочные продукты обеззараживания Хлороформ (при хлорировании) Формальдегид (при озонировании) Полиакриламид Активированная кремневая кислота (по Si) Полифосфаты Остаточные количества алюминий- и железосодержащих коагулянтов Показатель Класс вредности опасности 0,3-0,5 орг. 3 0,8-1,2 0,3 орг. орг. 3 - 0.2 0,05 с.- т. с.- т. 2 2 2,0 10 3,5 См. показатели Al и Fe с.-т. с.-т. орг. 2 2 3 При одновременном присутствии в воде свободного и связанного хлора их общая концентрация не должна превышать 1,2 мг/л. 1.4. Сточные воды К концу нынешнего тысячелетия человечество вплотную столкнулось с проблемой загрязнения вод. Чистая вода становится поистине дефицитнейшим веществом. И это происходит несмотря на, казалось бы, огромные запасы водных ресурсов на Земле. Однако распределение пресной воды по поверхности далеко неравномерное, причем многие ее резервуары сильно загрязнены. Главной причиной истощения водных ресурсов является сброс неочищенных промышленных и сельскохозяйственных стоков в источники чистой воды. По прогнозам на 2000-й год мировое водопотребление на промышленные и бытовые нужды составит более 20000 км3/год, что приведет к такому же увеличению объема поступающих в океан загрязненных вод. 24 От загрязнений больше всего страдают водные объекты промышленно развитых стран. Так, ежегодно с промышленными стоками в реку Рейн попадает 3150 т хрома, 1520 т меди, 12300 т цинка, 70 т ртути, 350 т мышьяка, а всего более 24 млн. т вредных веществ: твердых отходов, минеральных солей, нефтепродуктов. Масштабы современной хозяйственной деятельности, бурное развитие техногенной цивилизации в сложных рыночных отношениях при спаде производства в регионах - все это привело к глобальному экологическому кризису в России. В плане производства отходов мы не отстаем от индустриально развитых стран. В России ежегодно образуется более 80 млн. т отходов. В Волгу только в районе Волгограда ежегодно сбрасывается более 200 млн. м3 сточных вод, из которых около 33 млн. м3 без очистки и 170 млн. м3 недостаточно очищенных. На рис. 1.3 показана диаграмма, характеризующая рост водопотребления и сброса неочищенных сточных вод. По источникам загрязнения сточные воды делят на: промышленные, бытовые и ливневые. Бытовые воды почти полностью разрушаются биологически. Но промышленные стоки зачастую не могут очищаться биологическим путем. Большинство из таких отходов являются ядами для микроорганизмов. Поэтому радикальным решением проблемы сохранения природных ресурсов, в т.ч. и водной среды, от влияния промышленности является создание и внедрение безотходных и безводных технологических процессов. Добиться исключения сброса в водные объекты загрязняющих веществ с промышленными сточными водами в настоящее время можно за счет разработки и поэтапного внедрения оборотных, вплоть до полностью замкнутых, систем водопользования отдельных производств. Рис. 1.3. Диаграмма недопотребления и сброса неочищенных сточных вод (не считая атмосферных сточных вод) - водопотребление; - водоотведение 1.4.1. Состав и свойства производственных сточных вод 25 Производственные сточные воды, использованные в технологическом процессе, можно разделить на следующие группы: 1) загрязненные преимущественно минеральными примесями (предприятия металлургические, машиностроительные, рудои угледобывающей промышленности; заводы по производству удобрений, кислот, строительных изделий и материалов и др.); 2) загрязненные преимущественно органическими примесями (предприятия мясной, рыбной, молочной, пищевой, целлюлозно-бумажной, химической, микробиологической промышленности, заводы по производству пластмасс, каучука и др.); 3) загрязненные минеральными и органическими примесями (предприятия нефтедобывающей, нефтеперерабатывающей, нефтехимической, текстильной, легкой, фармацевтической промышленности; заводы по производству сахара, консервов, бумаги и др.). Производственные сточные воды различаются по физическим свойствам загрязняющих их органических продуктов, например, по температуре кипения: менее 120-250 °С и выше 250 °С. По степени агрессивности их разделяют на: слабоагрессивные (слабокислые с рН = 66,5 и слабощелочные с рН = 8-9), сильноагрессивные (сильнокислые с рН < 6 и сильнощелочные с рН > 9) и неагрессивные (с рН = 6,5-8). По составу сточные воды могут быть весьма различными. Основной вклад в его формирование вносит вид перерабатываемого сырья. Некоторые показатели производственных сточных вод отдельных предприятий, приведенные в табл. 1.11, свидетельствуют о широком диапазоне колебаний состава этих вод. Таблица 1.11. Физико-химические показатели состав сточных вод некоторых предприятий Показатель Металлургический комбинат Фабрика ПОШ Содержание, мг/л плотного остатка 600 33500 1200 - 1000 взвешенных веществ азота аммонийного 500 2800 210 170 12 - 10 20 - - 1 - 5 40 - - 10-150 10 - 7800 20 - - фосфатов нефтепродуктов жиров 26 КрасильГальванино-отделочческое ная фабпроизводрика ство машиностроительного завода Производство синтетического волокна ПАВ - - 100 10 15 100 - 20 300 1 - 17800 250 - 800 ХПК 50 44000 600 - 600 рН 8,0 9,5 9,0 3,5-9,0 8,0 тяжелых металлов БПКполн На промышленных предприятиях вода зачастую не входит в состав продукции, а используется, как правило, на охлаждение (на некоторых производствах до 90 %), для транспортировки и растворения различных реагентов и примесей, для промывки промежуточной и готовой продукции. 1.4.2. Методы очистки сточных вод Перед сбросом в водоем сточные воды подвергают очистке на городских очистных сооружениях, а промышленные сточные воды - еще и на локальных очистных сооружениях. Количество сточных вод, выпускаемых в водные объекты, определяется при помощи предельно допустимого сброса (ПДС), который устанавливается с учетом предельно допустимых концентраций (ПДК) веществ в местах водопользования, ассимилирующей способности водного объекта и оптимального распределения массы сбрасываемых веществ между водопользователями, сбрасывающими сточные воды. Производственные сточные воды в зависимости от вида загрязняющих веществ и их концентрации, а также от количества сточных вод и мест их образования отводятся несколькими самостоятельными потоками. Целесообразность разделения или объединения отдельных потоков сточных вод является одним из наиболее важных вопросов, от правильного решения которого зависят сметная стоимость строительства и расходы на эксплуатацию очистных сооружений, надежность охраны водоемов от загрязнения и рентабельность основного производства. Для промышленных сточных вод, прошедших локальные очистные сооружения и поступающих для совместной очистки с бытовыми стоками на городские сооружения биохимической очистки, также предъявляются определенные требования. Так, при расчете остаточных концентраций загрязнений в производственных стоках, руководствуются следующими требованиями (табл. 1.12): Таблица 1.12 Требования, предъявляемые к сбросу производственных сточных вод в городскую канализацию Вещество Эффективность удаления на очистных сооружениях, % Концентрация, максимально допустимая для биологической очистки, мг/л 1 2 3 27 Аl3+ - 5 Fe2+ 80 5 Жиры 70 50 Cd2+ 60 0,1 Cu2+ 80 0,5 Ni2+ 50 0,5 Фенол 95 15 Cr3+ 80 2,6 Zn2+ 70 1 As3+ 50 0,1 Рb2+ 50 0,1 Со2+ 50 1 А также: а) допустимое содержание органических веществ, оцениваемое по * БПК5 , должно определяться расчетом. При этом ВПК производственных сточных вод не должна вести к превышению ВПК вод, поступающих на городские очистные сооружения, принятой при проектировании этих сооружений; б) допустимые концентрации загрязняющих веществ, удаляемых на очистных сооружениях города, должны определяться с учетом условий сброса очищенных сточных вод в водный объект. На разных предприятиях применяются различные методы очистки сточных вод. Применение тех или иных методов осуществляется на основании экспериментальных исследований натурального или модельного стока, на основании регламента производства. В табл. 1.13 приведены основные методы очистки производственных сточных вод в зависимости от их состава и концентрации загрязняющих веществ. Таблица 1.13 Рекомендуемые методы очистки производственных сточных вод Концентрация загрязняющих веществ, мг/л Методы очистки сточных вод, содержащих вещества преимущественно органические с температурой кипения, °С <120 1-500 500-5000 120-250 Биологический, химический, сорбционный преимущественно неорганические >250 Химический, сорбционный Механический, химический, сорбционный Химический Химический, Сорбционный, (озонирование, сорбционный, жидко-фазное хлорирование), экстракционный, окисление с Механический, сорбционный, выпаривание 28 сорбционный, жидко-фазное окисление с биологической доочисткой, сжигание в печах жидко-фазное окисление с биологической доочисткой, сжигание в печах биологической доочисткой, сжигание в печах Химический, экстракционный, жидкофазное окисление с биологической доочисткой, сжигание в печах Механический, выпаривание, сброс в водоем, захоронение в земле, сушка в кипящем слое Экстракционный, жидкофазное окисление с различными методами доочистки, сжигание в печах То же * БПК - биохимическая потребность в кислороде, мг/л - содержание кислорода, потребляемого на биохимическое окисление органических веществ в процессе жизнедеятельности аэробных бактерий. Определяется за 20 суток - БПК2о, или часто БПКполн и за 5 суток - БПК5 1.4.3. Технологические воды гальванических производств Основными источниками происхождения сточных вод предприятий машиностроения и металлообработки являются гальванические и другие производства, связанные с химической и электрохимической обработкой металлов, литейное и окрасочное производства, холодная обработка металлов резанием, а также мойка металлоизделий, в частности, после их расконсервации. Вода в цехах гальванопокрытий расходуется на приготовление электролитов, обезжиривающих и травильных растворов, на промывку деталей, охлаждение ванн и выпрямителей тока. Основной водопотребляющей операцией является промывка изделий, от эффективности которой зависит качество и надежность гальванопокрытий. Образующиеся при этом промывные сточные воды, а также отработанные концентрированные технологические растворы поступают в канализационную сеть промышленных предприятий. В результате многолетней практики сложился следующий подход к решению проблемы очистки сточных вод указанных производств: раздельное отведение локальных стоков с учетом специфики загрязняющих компонентов с последующей их обработкой химреагентами. Применение системы водоотведения предусматривает обработку отдельно цианосодержащих, хромсодержащих и фторосодержащих сточных вод с дальнейшей нейтрализацией их вместе с кислыми и щелочными сточными водами, загрязненными ионами тяжелых металлов. 29 Сбросы отработанных растворов электролитов по объему составляют 2-3 % от общего количества сточных вод, а по общему содержанию сбрасываемых загрязнений достигают 50-80 %. Залповый характер таких сбросов нарушает режим работы очистных сооружений, приводит к безвозвратным потерям ценных материалов. Необходимость сброса концентрированных растворов в гальванике определяется следующими факторами: накоплением в электролитах посторонних органических и неорганических веществ, продуктов деструкции (разложения) некоторых компонентов (например, блескообразователей), а также механических примесей, шлама или необратимых дисперсий типа эмульсий и суспензий; нарушением соотношения основных компонентов гальванических ванн; выработкой в растворах электролитов отдельных веществ с одновременным накоплением продуктов реакции, замедляющих скорость основных процессов. Практически все сбросы гальванического производства имеют ярковыраженную биологическую активность и способны вызывать неблагоприятные последствия. Степень токсичности и опасности различных веществ неодинакова и может быть оценена по предельно допустимым концентрациям (ПДК), учитывающим, наряду с токсичностью, их кумулятивные свойства, т.е. способность накапливаться в организме. ПДК по ионам Сr3+ и Сr6+ в сеть бытовой канализации составляют 2,7 и 0,1 мг/л соответственно, в водоемы хозяйственно-питьевого водопользования - 5,0 и 0,1 мг/л, в водоемы рыбохозяйсвенного водопользования - 0,1 мг/л и отсутствие ионов Сr6+. Важной характеристикой поведения и миграции металлов и других загрязнений в водоемах является их фазовое состояние. Обычно в природных водах ионы меди, цинка, никеля находятся в растворенной форме, а свинца, хрома и кадмия - во взвешенном состоянии. Отсюда следует, что попавшие в водоем медь, цинк и никель будут переноситься на значительные расстояния от места сброса и длительное время находиться в водной среде, а свинец, хром и кадмий будут накапливаться в донных отложениях вблизи места сброса. Выбор метода очистки зависит от состава и режима поступления сточных вод, концентрации загрязнений, необходимости и возможности повторного использования очищенной воды. Современная унифицированная технология регенерации электролитов и очистки промывных вод должна предусматривать: • - максимально быстрое и 100 %-ное извлечение ценных компонентов; • - получение в качестве конечного продукта регенерации и очистки промывных вод концентрированных растворов извлекаемых металлов и технической воды, пригодных для повторного использования в гальванотехнике; 30 •- применение высокопроизводительного оборудования, отвечающего требованиям современного производства, и, прежде всего, встроенного в состав автоматизированных гальванических линий (АГЛ); • - включение регенерации в технологический процесс с целью создания безотходной технологии. Существенный резерв в решении этих задач имеют электрохимические методы. В табл. 1.14 приведены основные методы очистки и регенерации сточных вод, содержащих ионы тяжелых металлов (ИТМ). На машиностроительных производствах электрохимическая очистка сточных вод представлена следующими процессами: электролиз отработанных растворов с выделением тяжелых металлов; электролиз отработанных растворов с применением нейтральных и ионоселективных мембран; электрокоагуляция; электрофлотация; электрохимическое регулирование рН. Особенность этих методов состоит в возможности отказа от реагентов, которые становятся все более дефицитными, а также компактности установок, непрерывности процессов и более легкой их автоматизации. На рис. 1.3 представлена более подробная классификация электрохимических методов обработки воды. Таблица 1.14 Методы, применяемые для очистки и обезвреживания жидких отходов АГЛ Метод Реагентный Электрокоагуляция Область применения Для стоков разных объемов с различной концентрацией загрязнений Преимущества 1. Очистка до ПДК. 2. Возможность Недостатки 1. Невозможность использования воды в обороте из-за очистки повышенного отдельных стоков солесодержания. и их смеси. 3. Легко поддается 2. Большие площади под шламоотвалы. автоматизации. 3. Сложность в 4. Стабильность эксплуатации процесса очистки Для стоков с часовым 1. Очистка до ПДК. расходом до 100 м3/ч 2. Очищенная вода и концентрацией используется в хрома до 200 мг/л обороте. 3. Исключение расхода реагентов. 4. Незначительные площади под 31 1. Значительный расход металла на растворимые аноды. 2. Пассивация анодов. 3. Невозможность очистки концентрированных стоков без их разбавления оборудование Электродиализ Обратный осмос и ультра-фильтрация Рекомендуется применять в качестве локальной очистки стоков от отдельных видов покрытий. Количество обрабатываемых стоков зависит от производительности электродиализатора. Очищаются стоки с различной концентрацией 1. Очистка до ПДК. 1. Значительный расход электроэнергии. 2. Очищенная вода и регенерированные 2. Необходимость Рекомендуется применять в качестве локальной очистки стоков от отдельных видов покрытий. Очищаются стоки с различной концентрацией 1. Очистка до ПДК. 2. Возврат вещества используются повторно. 3. Установки малогабаритны и просты в управлении 3. 4. 5. 6. 7. Ионный обмен Биохимический метод 1. Наличие концентрационной поляризации. очищенной воды в оборот. 2. Нестойкость ацетатцеллюлозных Регенерация мембран в агрессивных растворенных средах. веществ. Незначительный 3. Выход из строя мембран в результате расход закупоривания пор электроэнергии. осадком после Компактность концентрирования установок. Простота эксплуатации. Легко автоматизируется Для всех видов стоков при раздельном или совместном отведении с часовым расходом до 500 м3/ч и концентрацией до 400 мг/л. Для очистки электролитов от примесей 1. Очистка до ПДК. 2. Очищенная вода Для смеси хромосодержащей и бытовых стоков с концентрацией Сrб+ 1. Очистка до ПДК. 2. Незначительный используется повторно. 3. Возможность очистки смешанных стоков. 4. Возможность селективного выделения веществ из воды расход электроэнергии. 32 предварительной очистки стоков от механических и органических примесей 1. Необходимость предварительной очистки стоков от механических примесей, масел, жиров и др. органических примесей. 2. Высокие требования к герметичности оборудования. 3. Образование элюатов, требующих дополнительного обезвреживания. 4. Дефицитность ионообменных смол 1. Необходимость поддержания температуры, концентрации хрома и до 200 мг/л 3. Простота эксплуатации биомассы в определенных пределах. 2. Невозможность регенерации хрома. 3. Необходимость применения дефицитных реагентов Рис. 1.4. Классификация электрохимических методов обработки воды Следует отметить процесс электрокоагуляции, получивший распространение в последнее время. Этот метод позволяет во многих случаях не только извлечь из сточных вод загрязняющие вещества, но и вернуть очищенные воды в производство для повторного их использования. При электрокоагуляции удаление ионов тяжелых металлов происходит за счет повышения рН воды и образования гидроксидов железа и других металлов. С целью предотвращения пассивации и зашламления электродов рядом исследователей предложены различные способы: механические скребки и щетки для снятия отложений, наложение однородного переменного тока различной частоты или магнитного поля и засыпка магнитных материалов в межэлектродное пространство, применение импульсного и асимметричного электрического тока, использование вращающихся электродов . Однако эти меры эффективны в отдельных конкретных случаях для относительно постоянного состава сточных вод. Более надежным приемом можно считать поддержание в межэлектродном объеме условий, предотвращающих образование мало- или нерастворимых 33 соединений . Авторами изучена возможность очистки многокомпонентных сточных вод производства печатных плат гальванохимическим методом. В качестве загрузки аппарата использовали стальную и медную стружку. Анализируя литературные данные, следует отметить, что метод электрокоагуляции в последние годы довольно бурно внедряется в производство. Тем не менее, создание бессточной технологии гальванопокрытий предполагает комбинирование в едином комплексе различных методов очистки. Кроме того, для регенерации концентрированных растворов этот метод экономически невыгоден из-за образования большого количества осадков. 34 2. ЭЛЕКТРОДИАЛИЗ В ЭЛЕКТРОХИМИЧЕСКОЙ ОЧИСТКЕ СТОЧНЫХ СТОЧНЫХ ВОД И ВОДОПОДГОТОВКЕ Одной из важнейших технологических операций, имеющих большое значение для многих отраслей промышленности, является разделение. Среди известных методов разделения важная роль принадлежит мембранным методам. Мембранные методы разделения используются в химической и нефтехимической промышленности, в микробиологии, в фармацевтической промышленности и в других областях народного хозяйства. Особенно широко эти методы применяются для обессоливания и очистки сточных вод. Электродиализ – процесс удаления из растворов ионизированных веществ путем переноса их через мембраны в поле постоянного электрического тока. Процесс электродиализа широко используется для опреснения воды, а в последнее время его начинают изучать для локальной очистки промышленных сточных вод, в частности, обсуждается возможность организации локальных систем очистки промывных вод от отдельных видов гальванических покрытий. Электродиализ является разновидностью электролиза и основан на явлении избирательного переноса ионов через полупроницаемые ионообменные мембраны под действием постоянного электрического тока. К преимуществам электродиализа относят возможность очистки стоков от растворенных примесей до уровня ПДК, возврат очищенной воды и регенерированных веществ в производство. Электродиализные установки характеризуются также относительной простотой и малогабаритностью. К недостаткам применения электродиализных схем относят повышенный расход электроэнергии на переработку стоков и необходимость их тщательной предварительной очистки от механических и органических загрязнений перед подачей в электродиализатор. Так, содержание взвешенных веществ в исходной воде не должно превышать 2 г/м3, железа и марганца – 0,05 г/м3, цветность воды не должна быть выше 20 град, а окисляемость – 5 г/м3 О2. Несоблюдение мер по предварительной очистке сточных вод приводит к следующим неблагоприятным последствиям в ходе электродиализа: – взвешенные частицы способны осаждаться в камерах и вызывать повышенную поляризацию мембран; – при работе электродиализатора возможно образование твердой фазы на поверхности мембран вследствие электрокоагуляции коллоидных частиц; – необратимое накопление в мембранах поливалентных ионов, имеющих малую подвижность, приводит к «отравлению» мембран, т.е. к снижению их электрической проводимости. 35 Принципиальная схема П предсттавлена на н рис. 2.1. работы ы электрродиализн ной установки Рисс. 2.1. При инципиалльная схем ма включеения элекктродиали изатора: 1–4 – электродиаализные ап ппараты; 5 – уголььный филльтр; 6 – механически ий фильтрр Как праавило, уххудшениее парамеетров рааботы эллектродиализной К устаноовки в осн новном сввязано с изменени и ием свойств мембрран, прежд де всего с увелличением м их элеектрическкого сопротивлен ния. Ростт сопроти ивления мембрран можеет происхходить из-за и вып падения на н поверхности мембран м карбон натов калльция или и гидрокссида магн ния (при обработке о е жестких х вод), а также из-за электрофореетическогго осаждеения коллоидных ччастиц. В коллоидном состоянии в сточной воде могуут находи иться соед динения железаа, марган нца, креемнекислооты и др., д хараактеризуеемые вел личиной -2 электррокинетич ческого потенциал п ла (дзета– –потенци иала) до 110 вольтта. Знак зарядаа частиц зависит от их пррироды и от значения рН Н раствор ра. Так, органи ические веществва чащее всего имеют отрицаательный заряд поверххности, соединени с ия металллов в ки ислой срееде – пооложителььный, в щелоч чной – отррицательн ный. У Указанны ые трудн ности прри испол льзовании и мембрран привводят к сущесттвенномуу сокращ щению сррока их службы ы. Для аанионооб бменных мембрран в неккоторых случаях с н наблюдал лась полн ная потеря емкостти после 300 дн ней работы ы. О Основным ми меероприяти иями, обеспечи ивающими и длиттельную работооспособноость элекктродиали изных усстановок,, являются: подкисление исходн ной воды ы или периодич п ческая заамена поолярности и электр родов в аппараате; пери иодическоое резкоее изменен ние скоррости вод ды в тех х частях устаноовки, гд де образууется оссадок; промывка п а мембраан кислотой с послед дующим их и перевоодом в наатриевую форму. 36 Электрод Э диализныее аппарааты (рис. 2.2) конструирруются по п типу фильтрр-пресса и состояят из череедующихся обессооливающи их и расссольных камер,, образовванных пррокладкам ми-рамкаами из ди иэлектрикка и отдееленных друг от о друга ионообме и енными мембранам м ми Рамки электрод диализны ых камер изготаавливают из поолиэтилен на, парон нита, резины, полливинилх хлорида, полипрропиленаа толщиной 1–3мм м. Каналы ы для под двода и оотвода иссходной воды и рассолла образууются прроштампо ованными и в рамкках отвер рстиями. Сжати ие рамок и мембраан осущеествляетсяя торцевы ыми плиттами с по омощью стяжны ых болтоов, гидраввлически их и винттовых дом мкратов. Катод и анод с изолиррованным ми токооподводам ми монттируютсяя в торцевых плитах электрродиализаатора. Вн нутри раамок укл ладываютт гофриррованную ю сетку, котораая дистан нционируеет мембрааны и слу ужит турб булизаторром потокка. Д разделения прространсттв в осно Для овном исп пользуютт мембран ны типа МК-400, МК-40Л Л, МА-400, МА-41,,Ма-41ИЛ Л, МК-1000, МА-100. Их оссновные физико-химичееские хаарактерисстики приведены п ы в ссоответстввующих специаальных иззданиях. Рис. 2.2. Элекктродиали изный апп парат (раззрез): 1 – штуцер; 2 – токоподвоод; 3 – изоолятор; 4 – прижим мная плитта; 5 – проокладка; 6 – эллектроднаая рамка; 7 – электтрод; 8 – дистанцио д онирующ щая сетка; 9 – катионоообменнаая мембраана; 10 – анионооб а бменная м мембрана. В качеестве а анодов использзуют П ПТА, гррафит, ОРТА, диокси идмарган нцевые, диоксидолловянные аноды. Как катооды прим меняется углероодистая или леггированнаая сталь, никели ированнаяя сталь, титан, исполььзуют сеттчатые стальные илли титано овые элекктроды. Э Электрод диализныее установвки выпусскаются на н произвводительн ность от 3 25 до 1000 м / сутки. с Наапример: – аппаратт произвоодительноостью 25 м3/сутки состоит с и из 128 кор рпусных рамок из вини ипласта с мембрранами МК-100 М и МА-100, устано овка из 37 четырех аппаратов рассчитана на опреснение воды с солесодержанием от 3– 6 до 0,8–1 г/кг; – ЭДУ – 1000 (1000 м3/сутки) состоит из двух пакетов по 301 мембране МКК и МАК с лабиринтно-сетчатыми прокладками. Электродиализная обработка ведется при следующих условиях: рН – 4–9; концентрация загрязнений – 0,1–5,0 г/л; плотность тока – 80–180 А/м2; скорость потока – 30 – 45 м3/ч; температура – 18–30оС. При этом необходимо отметить, что степень концентрирования рассола во многом зависит от способа подачи растворов в электродиализатор и конструкции аппарата. В частности, подача обрабатываемой жидкости и отвод получаемых при работе электродиализной установки растворов, может быть организован по циркуляционной или комбинированной схеме. Комбинированная схема предполагает работу контура обессоливания по прямоточной варианту, а контура концентрирования – по циркуляционному. При этом на выходе из электродиализатора имеются три потока: обессоленный (дилюат); концентрированный (рассол); смешанный (из анодной и катодной камер). Концентрированный сток направляется в сборник рассола, откуда возвращается в рассольный тракт для дальнейшего концентрирования. При этом в конструкции электродиализатора должна быть предусмотрена замкнутая схема непрерывной циркуляции рассола до достижения требуемой степени концентрирования. При превышении допустимого для данного состава сточных вод содержания веществ в рассольных камерах, все в большей степени становятся возможными процессы диализа, осмоса и электроосмоса, снижающими эффективность электродиалиаза по причинам, заключенным в самой сути этих процессов. Диализ – это диффузионный процесс переноса растворенного вещества через мембрану за счет разности концентраций растворенного вещества по разные стороны разделительной мембраны. Поскольку практически всегда концентрация растворенных веществ в рассольных камерах выше, чем в камерах обессоливания, то поток растворенных веществ через мембраны должен быть направлен противоположно потоку мигрирующих ионов, а это снижает массоперенос и, соответственно, эффективность электродиализа. Осмос является процессом переноса через мембрану растворителя из области с меньшей активностью растворенных веществ в область с большей их активностью. Перенос растворителя из камер обессоливания в камеры концентрирования приводит к разбавлению рассола, снижению производительности и повышении удельного расхода энергии в процессе электродиализа. Электроосмос заключается в переносе через мембраны молекул растворителя, захватываемых мигрирующими ионами, и приводит к тем же 38 отрицательным результатам, что и процесс осмоса. 2.1. Теоретические основы электродиализа В основе метода мембранного электролиза лежит явление переноса ионов через ионообменные мембраны под действием электрического тока. Ионообменные мембраны отличаются от традиционно применяемых в электрохимии пористых перегородок тем, что с их помощью обеспечивается преимущественный перенос одноименно заряженных ионов. Через идеальную катионообменную мембрану осуществляется перенос только катионов, через анионообменную - только анионов. В реальных условиях мембраны переносят ионы обоих зарядов, поскольку не обладают идеальной селективностью. Принцип мембранного электролиза можно рассмотреть на примере двухкамерного мембранного электролизера, изображенного на рис. 2.3. Рис. 2.3. Принципиальная схема мембранного электролизера Анодное и катодное пространства электролизера разделены ионообменной (катионообменной) мембраной, практически непроницаемой для газов и жидкостей в отсутствии электрического тока. В анодном пространстве имеются анионы (А1), катионы (К1), растворитель (S1), недиссоциирующее соединение (N1). В катодном пространстве находятся соответствующие компоненты раствора А2, К2, S2, N2. Под действием электрического тока катион К1 перемещается через катионообменную мембрану к катоду, захватывая при этом растворитель S1. Катион К2 может перемещаться в катодную камеру только за счет диффузии, направление электрического поля этому движению препятствует. Анионы А1 и А2,недиссоциированные соединения N1 и N2, растворитель S2 через мембрану практически не переносят. 39 За счет электродных реакций в анодном пространстве электролизера происходит образование продукта окисления О и возможно выделение газа G1. В катодном пространстве образуется продукт восстановления R и возможно выделение газа G2. Если продукт окисления О в анодной камере является катионом, он также может переноситься через мембрану в катодную камеру. Аналогично можно рассмотреть и двухкамерный мембранный электролизер с анионообменной мембраной, обеспечивающей перенос анионов и предотвращающей перенос катионов. Направленное движение одних компонентов раствора и надежное отделение других позволяет осуществлять процессы в одном технологическом аппарате с высокой избирательностью (селективностью) и достигать достаточную чистоту целевых продуктов. Многие процессы, осуществляемые путем мембранного электролиза, не имеют аналогов. Широкое распространение получил специфический вид мембранного электролиза - электродиализ, осуществляемый, как правило, в многокамерных мембранных электролизерах, в которых электроды размещаются только в крайних камерах. Схема наиболее распространенного электродиализатора с чередующимися катионообменными и анионообменными мембранами приведена на рис. 2.4. Рис.2.4. Принципиальная схема электродиализного аппарата: 1 - рассольная камера; 2 - дилюатная камера; 3 - отвод анолита; 4 - анод; 5 – приэлектродная камера; 6 - катод; 7 - отвод католита; 8 - прокладки турбулизатора процессе электродиализа за счет направленного потока ионов образуются два потока: разбавленный по концентрации электролита раствор и концентрированный раствор. При электродиализе наблюдается главным образом изменение ионного состава жидкостей, а электродные реакции, протекающие в крайних камерах, играют вспомогательную роль. 40 2.1.1. Ионообменные мембраны Ионообменные мембраны, используемые при электролизе, различаются по функциональному назначению, составу полимерной пленки, конструкции. По функциональному назначению мембраны могут быть катионообменными, анионообменными и биполярными. По составу полимерной пленки - гомогенными и гетерогенными. Гетерогенная мембрана представляет собой смесь ионита и связующего, в котором ионит не образует сплошную фазу. Пленка гомогенной мембраны выполняется из ионообменного материала, образующего сплошную фазу. Как правило, гетерогенные мембраны из-за неоднородной структуры (наличие гелевых, инертных и промежуточных участков) имеют более низкие электрохимические характеристики (рис. 2.14). Рис. 2.5. Схематическое изображение многофазной структуры ионита [122]: 1 - гелевые участки, содержащие полимерные цепи с гидратированными фиксированными ионами, заряд которых компенсируется гидратированными противоионами и коионами; 2- межгелевые промежутки, заполненные равновесным нейтральным раствором; 3 - гидрофобные участки, включающие скопление полимерных цепей без ионогенных групп (4) и (или) инертный связующий материал (полиэтилен) (5) В зависимости от способа получения и назначения ионообменника в нем может преобладать любой тип неоднородности: физическая или химическая, макро- или микронеоднородность. В одних случаях эта неоднородность специально формируется в процессе синтеза (например, макропористые иониты, грануляторы, гетерогенные мембраны), в других она возникает самопроизвольно (например, гелевые иониты, гомогенные 41 мембраны). Неоднородность ионитов оказывает существенное влияние на многие физико-химические свойства ионообменных материалов и их эксплуатационные характеристики, а также на механизм массопереноса. В ионообменных мембранах имеются следующие ионообменные группы: SO3-, COO-, SeO2-, -РО3Н2, -N+≡, N≡, HN≡, -N+(CH3)3, -N+(R)3, -NH2, =NCH3 и др. В зависимости от степени диссоциации кислотной или основной группы мембраны могут быть сильнокислотными, слабокислотными, сильноосновными и слабоосновными. Сила кислотной или основной группы существенно зависит от состава полимера. По конструкции ионообменные мембраны могут быть одно-, двух-, трех- и многослойными, а также с переменным составом по толщине одного или нескольких слоев. Для повышения механической прочности полимерные пленки можно наносить на пористую основу, армировать тканями, сетками или волокнами из полимерных, углеграфитовых и металлических материалов, упрочнять путем образования объемной структуры в теле полимерной мембранной пленки при введении второго полимера. Поверхность или обе поверхности мембраны могут быть подвергнуты химической или физической обработке с целью изменения их электрохимических, сорбционных, адгезионных и других характеристик. По улучшению физико-химических свойств мембран ведутся широкие исследования их селективности и регенерации. Характеристики некоторых отечественных мембран приведены в табл. 2.7. К основным свойствам ионоселективных мембран относятся высокая избирательная проницаемость и электрическая проводимость, малая скорость диффузии электролита, низкая осмотическая проницаемость, достаточная химическая и механическая прочности, однородное качество и малая степень набухания . Важнейшим параметром мембран является селективность, то есть способность мембраны пропускать определенный вид ионов. Селективность катионообменных мембран, как правило, ниже, чем анионообменных, для которых селективность достигает величины 0,95-0,99. Существует, однако, еще несколько частных определений селективности. Например, различают селективность по отношению к ионам определенного знака заряда - перенос противоионов и коионов; селективность по отношению к определенному сорту противоионов при конкурентном переносе нескольких сортов противоионов; селективность по отношению к ионам с определенной величиной заряда. Количественно селективность определяется числами переноса (ЧП) ионов через мембрану. В свою очередь, имеется большое число различных определений чисел переноса, что связано с различием экспериментальных методов их определения и способами обработки полученных данных. 42 Таблица 2.1. Свойства гетерогенных ионообменных мембран Показатель 1. Марка ионита Тип мембран МК-40 МК-40Л КУ-2 - КУ-2 МА-41Л ЭДЭ-10П АВ-17 -N+(R)3 N= N≡ N (CH3)3, + 2. Функциональная группа -SO3 3. Содержание ионита, % 65 60 55 60 1300 1200 1200 1200 3,8±0,4 2,0±0,5 4. Прочность при разрыве в набухшем состоянии, Па, не менее -SO3 - МА-40 5. Полная обменная емкость по 0,1н. HCl (NaOH), мг-экв/г 2,6±0,3 2,5 ±0,5 6. Электросопротивление удельное в 0,6 н. NaCl, Ом-1, не более Ом , не более 220 260 240 450 7. Число переноса в 0,010,2 н. NaCl, доли, не менее 0,98 0,97 0,94 0,96 капрон лавсан 8. Армирующая ткань капрон лавсан Наиболее часто используемыми понятиями являются: 1) электромигационное ЧП ; 2) эффективное ЧП Ti, равное отношению количества электричества, переносимого через мембрану в стационарных условиях ионами i-го сорта к общему количеству электричества, переносимого через мембрану, когда нет ограничений на градиенты концентраций и давления : zi·ji·F T= i (2.1) -2 -1 где ji- - плотность потока частиц i, моль·см ·с . Ti является величиной, удобной для практического использования, т.к. эффективность процесса электродиализа (выход по току) η при обессоливании определяется выражением η = 1 – (1– Tк ) – (1 – Ta) (2.2) где Тк и Та - эффективные числа переноса катионов и анионов через соответствующие мембраны; 3) электрометрическое ЧП, tie определяется экспериментально по значениям мембранных потенциалов или ЭДС ячейки, содержащей обратимые электроды и растворы I и II с разной концентрацией 43 электролита по обеим сторонам от мембраны. Если не учитывать поправку на перенос воды, то получаем значения кажущихся чисел переноса: E ti,appe= Emax (2.3) где Етах - ЭДС ячейки с идеальной мембраной, RT a’’ Етах=-2 ln ’ a F (2.4) здесь а - активность электролита. Другой, не менее важной технологической характеристикой мембран является электропроводность. Электропроводность мембран, особенно гетерогенного типа, зависит не только от состава мембраны, но и от концентрации внешнего раствора. Причем поведение электропроводности мембраны в зависимости от концентрации раствора аналогично поведению электропроводности раствора: так же, как и для раствора, зависимость проходит через максимум. Увеличение электропроводности связано с ростом количества внедренных в объем мембраны переносчиков заряда, а последующее уменьшение электропроводности, по-видимому, связано с обезвоживанием мембран в концентрированных растворах. Между электропроводностью и селективностью существует определенная функциональная связь. Приводятся данные, что с ростом эквивалентной доли одного из противоионов в растворе, содержащем, по меньшей мере, два сорта противоионов, наблюдается уменьшение электропроводности и селективности мембраны. Отношение плотности тока к концентрации раствора является одной из величин, играющих существенную роль при проектировании электродиализных систем. Это соотношение, как мера использования токонесущей способности раствора, сохраняется сравнительно постоянным для широкого диапазона значений плотности постоянного тока. Очень большая величина указанного отношения свидетельствует о недостатке ионов для переноса желаемого тока. Это явление, наблюдаемое на границе раздела мембраны с раствором, называется поляризацией. К основным эффектам, проявляющимся при поляризации, относятся: 1) возникающая разность концентраций вызывает увеличение мембранных потенциалов и общего сопротивления раствора, что приводит к увеличению расхода энергии, необходимой для переноса единицы заряда; 2) уменьшается выход по току, а, следовательно, возрастает расход энергии, необходимой для получения единицы продукта; 3) при высокой поляризации в разбавленных растворах начинается "разложение" воды, что вызывает снижение выхода по току, увеличение омических потерь, а также изменение рН среды у поверхности мембран. 44 Производительность электродиализаторов ограничивается концентрационной поляризацией мембран и феноменом предельного тока. Поэтому актуально создание методов борьбы с концентрационной поляризацией, основанных на электроосмосе второго рода, формировании развитой неустойчивости, нестационарных процессах. 2.1.2. Теория массопереноса в электродиализной ячейке Первые работы по исследованию свойств ионообменных мембран и разработке теоретических основ многокамерного электродиализа опубликованы в первой половине нашего столетия. Отечественные разработки по электродиализу начаты в 1930-1935 гг. И.И. Жуковым. Попытки решения задач электромассопереноса через ионообменные мембраны вначале опирались на предположения о гомогенном строении материалов ионитов, допускающие постоянство кинетических параметров в толще мембраны и др. Однако в последние годы разработаны методы решения, учитывающие неоднородное строение ионитов. Наличие в ионообменных мембранах распределенных по объему фиксированных ионогенных групп приводит к зависимости от координат потенциальной энергии подвижных ионов. Минимальной энергией противоион обладает, находясь непосредственно у ионогенной группы; коион, напротив, в этом положении имеет максимальную потенциальную энергию. Поэтому перенос ионов по объему ионита сопряжен с преодолением ряда потенциальных барьеров. Под влиянием тепловых флуктуации отдельные противоионы могут приобрести достаточную энергию для отрыва от фиксированной группы и выхода из потенциальной ямы. При этом образуются свободная фиксированная группа (ионная вакансия) и "внедренный" ион. Таким образом, движение ионов в ионообменном материале по своему механизму напоминает движение ионов в кристалле. В то же время набухшие ионообменные мембраны содержат большое количество воды, что обеспечивает, по сравнению с кристаллами, аномально высокую степень диссоциации противоионов. Во многих мембранах отмечается также аномально высокая подвижность ионов водорода (в катионообменных) и гидроксила (в анионообменных). Основываясь на представлениях о структуре ионита, сделано утверждение, что наиболее вероятными в ионообменных материалах являются три механизма переноса ионов: вакансионный, эстафетный и сольватационный. В любом случае перенос ионов в мембране представляется, как совокупность скачков через некоторые потенциальные барьеры, что позволяет отождествлять элементарный акт переноса заряда и массы в мембране с протеканием элементарного акта химической реакции и воспользоваться для описания переноса частиц теорией абсолютных скоростей реакции. 45 Мы рассмотрим теорию массопереноса в электродиализной ячейке, исходя из стационарных условий процесса и однородного характера ионообменной мембраны. На рис. 2.6. представлена электродиализная ячейка. Средняя расчетная плотность тока по длине пути определяется выражением L iср= ∫i(l)dl/L, 0 (2.5) где l - общая длина пути потока. Связь площади мембраны FM, требуемой для достижения нужной степени деминерализации ΔС, пропускной способности установки Qуст и средней плотности тока iср определяется, согласно закона Фарадея, как FQуст·ΔC FM= η·iср (2.6) где F - число Фарадея; η - выход по току, т.е. эффективность использования тока с целью "переброски" иона через мембрану. Рис. 2.6. Расчетная схема процесса деминерализации в электродиализной ячейке: LI - расстояние от входа в ячейку до i-ой точки; Δ1 - приращение длины: dq - толщина дилюатной камеры; dp - толщина рассольной камеры; т - ширина потока Выход по току можно определить по отношению количества соли j, перешедшему с одной стороны мембраны на другую, к количеству прошедшего электричества, пропорциональному i, 46 η= j·F i (2.7) Количественно поток ионов определяется из потоков в растворе и мембране. Например, для катионообменной мембраны он может быть рассчитан как i·t+ j=Δj+ =Z+·j+F (2.8) где Δj+ - убыль катионов на отдающей стороне мембраны. Общую площадь мембран FM и пропускную способность установки представим в следующем виде: FM=m·L·nM, Qуст= V·m·da·nяч, (2.9) где пм - число мембран, V - скорость протекания дилюата, т - ширина потока, da - расстояние между мембранами, пяч - число ячеек. Подставив в выражение (2.7) уравнения (2.9), получим: FVdqΔC L= η·iср (2.10) Плотность тока распределяется по длине ячейки в зависимости от содержания дилюата и рассола в соответствии с законом Ома. Значение средней плотности тока, учитывающее конструктивные параметры ячеек и прикладываемое напряжение uяч-2 iср= 1 ( Cпр dq+ dq XN RT F lnXN +(δa/χa+δк/χк)χNaCl ) λ[1+0,02(T-290)] (2.11) где uяч- падение напряжения; XN - безразмерная величина, определяемая отношением концентраций рассола и дилюата в конце пути потока в аппарате, равна Kc + β(1-Y) XN= Y (2.12) 47 β - коэффициент массопереноса; Y- степень опреснения воды; N- число ступеней опреснения; Спр - концентрация раствора, соответствующая точке поляризации; φ, χ - толщина и удельная электропроводность соответствующих мембран; λ - эквивалентная электропроводность раствора; T - температура. Ранее указывалось, что при определенных условиях протекания электрохимического процесса, в т.ч. электродиализного, может возникнуть концентрационная поляризация, появление которой связано с величиной плотности тока. Однако из экономических соображений целесообразно проводить электролиз при высоких плотностях тока (уменьшается площадь мембран (2.7), поэтому необходимо знать критические условия массопереноса в электродиализной ячейке, обусловленные появлением поляризации. Возникновение концентрационной поляризации, т.е. критических условий, на границе раздела мембраны с раствором вследствие разности чисел переноса ионов в растворе и мембране определяют как iкр ZFD = Спр (t-t)δкр (2.13) где D - коэффициент диффузии (иона, электролита); t -t- разность чисел переноса Z - валентного иона в мембране и растворе соответственно; δ, φ критическая толщина диффузного слоя. Формула (2.13) описывает условия, при которых концентрация раствора в непосредственной близости к мембране равна нулю. В правой части уравнения содержатся два параметра δкр и D, которые определяются гидродинамикой процесса и зависят от конструктивных и технологических условий. Для упрощения дальнейших расчетов примем, что коэффициент диффузии D в пределах диффузионного слоя постоянный и равен коэффициенту молекулярной диффузии. Для определения максимальной толщины диффузного слоя (с учетом выражений (2.6), (2.7), (2.9)) предложена следующая формула. h 0,5 -0,5 δкр = KL(D/v)1/3(Idq)0,25[v(l)] ·Vср , dq (2.14) и тогда критическая плотность тока ZFCпр·D iкр= (t-t)K1(D/v)1/3(l·dq)0,25[v(1h/dq)]0,5·Vср-0,5 (2.15) 48 где К1 - постоянная, определяемая конфигурацией перемычки; Vср- средняя скорость протекания жидкости (дилюата); v - кинематическая вязкость раствора; l - расстояние между соседними перемычками-турбулизаторами; h - высота сжатого сечения dq (см. рис. 2.7). Рассмотрим единичный элемент лабиринтно-сетчатой прокладки, включающей участки "свободного" l и "сжатого" а сечения. Рис. 2.7. Схема лабиринтно-сетчатой прокладки: 1 - перемычкитурбулизаторы; 2 - элемент; 3 - мембраны; 4 - прокладка На участках элемента возникают четыре вида гидравлических сопротивлений, которые обусловливают общее гидравлическое сопротивление потоку в ячейке без учета распределенной системы. Гидравлические сопротивления на участках между перемычкамитурбулизаторами и в пределах самой перемычки влияют на общие потери напора на "свободном" и "сжатом" участках. Применив формулу ДарсиВейсбаха для рассматриваемого примера, получим V2 0,5 (1/Kэк -1) A l Hдл= ]· · [ 1+ Kэк (1 – h/dq)3 2g ReH 4R (2.16) где А - коэффициент, зависящий от формы поперечного сечения; ReH - число Рейнольдса, рассчитанное по гидравлическому радиусу канала R, ReH= 4VR/v; Кэк - коэффициент экранирования, Кэк = 1/(1+(a/l)), зависит от типа прокладок. Гидравлические сопротивления на участках с внезапным расширением и сжатием потока обусловливают потери напора на местные сопротивления в рассольных и дилюатных камерах 66,8 1/ξ-1 2 1 V2 2 Hм.с.=[ , +ψ(( ) +( -1) )]× Re(h’)5 h’ h’·E 2g (2.17) где Re - число Рейнольдса, рассчитанное как 49 2Vdq , h’ = 1 - h , ψ= Re при Reкр = 7000 h’·Reкр v dq Тогда общие потери напора в элементе прокладки складываются из Нэл=Нмс+Ндл, (2.18) а потери напора по всей длине пути тока L в электродиализной ячейке равны Н = пНэл, (2.19) где п - число элементов прокладки по всей длине пути потока L, п = 2L/(l+a) (здесь l - расстояние между перемычками на одной стороне мембраны, а - длина перемычки (рис. 2.16). Re= 2.2. Основные технологические параметры процессов электродиализной очистки сточных вод Важнейшим показателем процесса электрохимической очистки сточных вод является удельный расход электроэнергии, т.е. расход электроэнергии, необходимый для достижения требуемой степени очистки единицы объема. Удельный расход электроэнергии постоянного тока определяется по формуле: I·τ·Eобщ W= Q (2.20) где W - удельный расход электроэнергии, Вт-ч на 1 л или кВт-ч на 1 м3 стока; I- ток, А; τ - продолжительность электродиализа, ч; Еобщ - напряжение на электродиализаторе, В; Q - объем сточной жидкости, обрабатываемый за время t, л или м3. Для снижения удельного расхода электроэнергии необходимо по возможности исключить протекание побочных процессов, чтобы практически все количество электричества It расходовалось на получение целевого продукта, т.е. чтобы выход по току основной электродной реакции был равен или близок к 100 %. Общее напряжение на электродиализаторе Eобщ можно представить в виде следующей суммы Еобщ=φa +φк +ηa +ηк + Еэл + Ек + Еконт + Ем , (2.21) где φа и φк - равновесные потенциалы анода и катода; ηa и ηк перенапряжение на аноде и катоде; Еэл - падение напряжения на преодоление электрического сопротивления электролита (в случае многокамерного электродиализатора); Еа и Ек - падение напряжения в 50 анолите и католите; Еконт - падение напряжения в контактах, подводящих ток к электродам; Ем - падение напряжения в мембране. Равновесные потенциалы электродов (φа и φк) определяются протекающими на них реакциями, зависят от состава и температуры анолита и католита. Для расчетов обычно принимают равными 1-1,5 В. Величины перенапряжения электродных реакций (ηа и ηк) зависят от плотности тока, материала электродов, состояния их поверхности, состава электролита, температуры электролиза и обычно не превышают 1В. Падение напряжения в электролите Еэл, зависит от состава и концентрации электролита, конструкции рамок и прокладок, количества ячеек (см. подразд. 2.6.2). Потери напряжения в анолите и католите (Еa и Ек) зависят от конструкционного исполнения электродных камер, материала электродов, динамического режима и плотности тока. Для наиболее распространенного случая, когда плоские электродные поверхности расположены параллельно друг другу, потери напряжения определяются по формуле E = i·ρ·l·k (2.22) где i - плотность тока, А/см ; ρ - удельное сопротивление электролита, Ом·см; l - расстояние между электродом и мембраной, см; k - коэффициент увеличения удельного сопротивления электролита в следствие газонаполнения (> 1). Газонаполнение электролита определяется соотношением скоростей образования газовых пузырьков и удаления их из раствора. Оно возрастает с увеличением плотности тока, высоты электродов, при уменьшении расстояния между электродами, увеличении вязкости раствора. Существуют формулы для расчета электропроводности при различном газонаполнении [135]. Падение напряжения в мембране Ем складывается из собственного омического сопротивления мембраны и мембранного потенциала. Последний обычно не превышает 10 мВ, поэтому для двух- и трехкамерных установок может не учитываться. Омическое падение напряжения на мембране составляет 0,2-1,0 В и определяется составом и температурой растворов, конструкцией ячеек, плотностью тока. Падение напряжения в металлических проводниках и контактах Еконт зависит от их конструкции и обычно не превышает 0,1 В. Таким образом, напряжение на электролизере зависит главным образом от плотности тока, материала электродов, состава раствора, температуры, конструкции электродиализатора. Выбор оптимальных режимов работы электродиализатора 2 51 Удельные затраты электроэнергии, поток ионов через мембраны и степень концентрирования кислоты и щелочи связаны прямой пропорциональностью, а эффективность использования тока, капитальные затраты и затраты на замену мембран обратно пропорциональны плотности тока. Следовательно, для каждого конкретного случая существует определенное оптимальное значение плотности тока. Широкому распространению электродиализа препятствуют относительно высокие затраты электроэнергии. По имеющимся литературным данным, эти затраты изменяются в пределах от 1 до 1500 кВт·ч/м3. Выход по току (эффективность тока) зависит от свойств мембран и оценивается соотношением: FD η = 1 –(t- + t+)i (2.23) где t- и t+ - числа переноса ионов в соответствующих мембранах; F - число Фарадея; D - коэффициент диффузии. Для отдельной камеры выход по току может быть определен по формуле: 26,8·V(Cн - Cк) η= i·S·τ (2.24) где 26,8 - количество ампер-часов, необходимых для переноса 1г-экв вещества; V - объем камеры, м; Сн и Ск - начальная и конечная концентрации обрабатываемого раствора, г-экв/м3; τ - продолжительность процесса, ч. Обменная производительность мембран по удаляемому иону, г/м2 ч П= (Cн - Cк)V S·τ (2.25) При анализе имеющейся литературы по вопросу влияния различных факторов на технико-экономические показатели при электродиализе вод все действующие факторы условно можно разделить на три группы, зависящие от 1) конструкции аппарата, 2) условий проведения процесса и 3) природы раствора. К первой группе относятся: тип аппарата, межмембранное расстояние, конструкции рамок, материал электродов, тип используемых мембран. Ко второй группе относятся: гидродинамическая обстановка в камерах аппарата, плотность и форма тока. Третья группа факторов: состав электролита, вид ионов, переносимых через мембрану, разность концентраций в камерах электролизера. 52 Традиционно совершенствование электродиализаторов связывается с оптимизацией межмембранного расстояния и формы сепаратора, турбулизующего поток жидкости в канале. Анализ влияния остава раствора, природы растворенного вещества, а также свойств мембран и механизма транспорта ионов содержится в фундаментальных работах, в которых приводятся уравнения, связывающие величины падения напряжения на мембране с интенсивностью потока ионов и индивидуальными характеристиками ионов и мембран. При сравнении процессов электродиализа с постоянной и переменной полярностями электродов пришли к выводу, что периодическое изменение полярности способствует снижению образования осадков. Использование других форм тока, отличных от постоянного, позволяет снизить затраты электроэнергии, увеличить обменную производительность и селективность мембран. 2.3. Использование электродиализного метода для обессоливания и концентрирования растворов Электродиализный метод обессоливания воды и выделения ценных продуктов развивается в двух основных направлениях: увеличение производительности установок наряду с совершенствованием конструкций и оптимизацией технологических режимов; разработка селективных процессов, обеспечивающих, выделение ионов определенного вида или получение новых химических соединений. Перспективной областью применения мембран в электрохимическом синтезе является производство хлора и щелочи. Распространению электродиализа способствует и тот факт, что использование ионообменных материалов позволяет получать соединения высокой степени чистоты. Были проведены исследования на лабораторных установках, из которых следует, что применение интенсивной турбулизации потока воды позволило значительно расширить пределы экономического использования электродиализной технологии обессоливания до получения остаточного солесодержания в воде 20-50 мг/л, при этом энергозатраты составляют 1,5 кВт-ч/м3. В таблице 2.2 приведены основные направления использования этого метода. Как правило, очистка растворов осуществляется в камерах обессоливания при одновременном повышении концентрации электролита в камерах концентрирования. Исключением являются процессы концентрирования органических соединений с добавкой соли. В этом случае процесс осуществляется за счет переноса воды через мембрану с ионами соли. Процессы ионного обмена протекают при подаче в электролизер исходных растворов различного ионного состава, а процессы фракционирования - за счет различной подвижности ионов в фазе мембраны. 53 Таблица 2.2 Основные направления электродиализа и примеры их реализации Очистка Очистка от солей растворов и водных смесей органических соединений неэлектролитов и их и веществ: сывороток, аминокислот, витаминов, вакцин, вирусов, крови, растворов, суспензий, молока, сахара, патоки и полупродуктов их производства, соков, эмульсий латексов, фотографических эмульсий, целлюлозной пульпы, черного щелока. Очистка от солей глицерина, органических кислот, мономеров, полупродуктов органического синтеза. Очистка молока от радиоактивных элементов. Получение особо чистых веществ очисткой от солей Очистка вод и водных растворов электролитов Обессоливание растворов электролитов. Получение питьевой или технической воды из морской. Опреснение солоноватых вод. Очистка радиоактивных сточных вод. Деминерализация сточных вод (производств аммиачной селитры, гальванических, травильных, бытовых). Предварительная очистка воды для теплоэнергетических установок Концентрирование растворов Получение поваренной соли и других солей из морской воды. Концентрирование сточных вод, содержащих ценные компоненты, в частности, редкие и драгоценные металлы, для последующего их извлечения. Концентрирование растворов солей урана, например, тетрафторида урана; сбросных карбонат-сульфатных растворов, азотной кислоты. Концентрирование растворов электролитов перед выпаркой. Концентрирование радиоактивных вод. Концентрирование недиализируемых соединений, например, глюкозы, органических кислот с добавлением к ним соли Реакции ионного обмена Получение кислот и щелочей из солей, например, NaOH и муравьиной кислоты из формиата натрия, золя кремниевой кислоты из силиката натрия, бромистоводородной кислоты и аммиака из бромида аммония, кристаллической лимонной кислоты. Реакции двойного обмена типа АВ + CD → AD + СВ, например, получение NaOH из НС1 и гидроксида кальция, приготовление фотографических эмульсий на основе AgBr, получение аминокапроновой кислоты из ее хлоргидрата, гидролиз солей в растворах полиэлектролитов. Регенерация кислоты из кислых травильных растворов. Минерализация дистиллата. Корректировка рН растворов, в том числе водорастворимых лаков Процессы фракционирования Отделение многовалентных катионов от одновалентных. Разделение однозарядных катионов, например, К+ от Na+. Разделение белковых гидролизаторов на аминокислотные фракции. Разделение аминокислот. Изменение ионного состава жидкостей, например, увеличение отношения Са : Na в молоке. Отделение амфотерных катионов от неамфотерных 54 2.4. Электродиализ отработанных растворов гальванических производств Метод электродиализа целесообразно применять для очистки стоков после процессов гальванических покрытий. Это дает возможность не только повторно использовать очищенную воду и регенерированные кислоты, но и утилизировать сконцентрированные вещества. Конструктивные особенности электродиализаторов подробно освещены в соответствующей литературе, там же содержатся сведения об основных принципах компоновки оборудования. Предложен метод регенерации серно- и солянокислых растворов путем электролиза с применением ионообменных мембран. Электродиализ проводился в трехсекционной ячейке с титановыми вращающимися катодами и свинцовыми анодами при катодной плотности тока 30-35 А/дм2, анодной плотности тока 20-25 А/дм2, температуре ≤ 35 °С и напряжением на электродах 7-12 В. Продолжительность регенерации 1 м3 раствора составляла 10 ч и расход электроэнергии 2500 кВт-ч. Из 1 м3 отработанных травильных растворов (ОТР) получены 95 кг электрохимически чистого железа и 170 кг серной кислоты. Предложен способ регенерации солянокислых растворов, содержащих соединения железа. Растворы, содержащие 100-200 г/л хлористого железа и 20-80 г/л соляной кислоты, подвергаются электродиализу в пятисекционных аппаратах, разделенных на секции анионообменными (МА-40Л) и катионообменными (МК-40Л) мембранами, имеющими вращающиеся титановые катоды и свинцово-сурьмянистые аноды. При межэлектродном расстоянии 10 см продолжительность регенерации составляла 10-11 ч. Раствор после регенерации содержит 20-30 г/л хлористого железа. Из 1 м3 раствора, содержащего 20 г/л соляной кислоты и 200 г/л хлористого железа, можно получить 60 кг 60 %-ной НС1 и 80 кг железа. Широкому внедрению электродиализа для регенерации ОТР препятствует малая интенсивность процесса, относительно высокие эксплуатационные затраты, связанные с большим расходом электроэнергии и необходимостью применения коррозионностойких материалов. Поэтому в области интенсификации процесса электродиализа с применением мембран ведутся широкие исследования. Изучено влияние различных технологических параметров (начальная концентрация ионов в растворе, скорость потока, температура и др.) на выделение меди из отработанных растворов травления и химического меднения, а также промывных медноаммиачных вод. Метод электродиализа можно применять и для регенерации хромсодержащих растворов. Это способствует, во-первых, охране окружающей среды от загрязнения ионами хрома, т.к. с помощью 55 электродиализа достаточно эффективно проводится обессоливание растворов до 90 %. Во-вторых, использование электродиализа позволяет утилизировать ценные компоненты, например, соли тяжелых металлов, возвращая их в технологический процесс. Среди других достоинств электродиализного метода очистки сточных вод необходимо отметить возможность создания систем оборотного водоснабжения, простоту технологической схемы, компактность, возможность создания аппаратов с различной производительностью. Несмотря на очевидные теоретические преимущества, метод электродиализа пока не получил широкого распространения в отечественной гальванотехнике. Это объясняется тем, что серийно выпускаемые электродиализаторы имеют большое межмембранное расстояние (2мм), что ведет к увеличению их размеров, росту омических потерь, а также снижению удельной производительности аппаратов. Этот недостаток удалось преодолеть разработкой ряда установок, содержащих в межмембранном пространстве зерна ионитов или ионообменные волокна. Новые перспективы интенсификации процесса дают возможность использования "запредельных" плотностей тока, природа которых еще ждет окончательного выяснения. Другой недостаток метода заключается в наличии определенных требований к обрабатываемым растворам, которые вызваны возможностью осадкообразования в камерах и отравления мембран. 2.5. Методы и способы интенсификации электродиализных процессов Недостатком электродиализа, прежде всего, является малая интенсивность (как в случае всех электрохимических процессов, протекающих в диффузионной области). Производительность электродиализатора пропорциональна его токовой нагрузке. Однако бесконечно увеличивать силу тока нельзя, так как при соответствующем увеличении плотности тока выход получаемого продукта резко падает. Кроме того, при плотности тока выше предельной начинают идти побочные процессы, мешающие нормальному протеканию основной реакции. Высокая плотность тока снижает ресурсные характеристики работы мембран. Потому актуально создание методов борьбы с концентрационной поляризацией, основанных на электроосмосе второго рода, формировании развитой неустойчивости, нестационарных процессах. Как уже отмечалось выше, одним из основных направлений развития электродиализного обессоливания воды и выделения ценных компонентов является увеличение производительности установок, наряду с совершенствованием конструкций аппаратов и оптимизацией 56 технологического режима. Поэтому остановимся более подробно на некоторых конструктивных особенностях электродиализных установок. 2.5.1. Конструкционные решения В СССР был освоен серийный выпуск электродиализных установок ЭОУ НИИПМ-25-2; ЭДУ-50; ЭДУ-400х2; передвижной опреснительной электродиализной установки СЕХО-П, которая широко используется для опреснения вод солончаковых источников в восточных районах Казахстана, а также установок ЭДУ-100; ЭДУ-1000x2; ЭДУ-400-4, используемых для подготовки воды парогенераторов типовых электростанций. Однако использование этих аппаратов для регенерации промывных вод гальванопроизводств не представляется возможным в основном по двум причинам: во-первых, аппараты рассчитаны на высокое содержание минеральных солей, в то время как минерализация промывных вод существенно ниже; во-вторых, мембраны МА-40 химически неустойчивы в хром-содержащих растворах. Хотя для регенерации промывных вод гальванопроизводств необходимы отличные от обессоливающих электродиализные установки, инженерные решения в их аппаратурном оформлении могут быть достаточно общими. В связи с этим нам представляется целесообразным рассмотреть обзор конструкций электродиализных аппаратов, применяемых для обессоливания воды. Наиболее распространенной конструкцией из вышеперечисленных аппаратов являются аппараты фильтр-прессного типа. Электродиализатор фильтр-прессного типа (рис. 2.8.) состоит из двух электродных камер: катодной камеры (1) и анодной камеры (2), между которыми зажат пакет чередующихся катионитовых и анионитовых мембран (3) и (4). Со стороны анода (5) крепится анионообменная мембрана, а со стороны катода (6) катионообменная. Мембраны фиксируются при помощи специальных рамок (7), изготовленных из материала, не проводящего электрический ток. Пространство, заключенное в рамке между анионитовой и катионитовой мембранами, образует камеры концентрирования и обессоливания. Камера, в которой со стороны анода располагается анионообменная мембрана, является обессоливающей, следующая за ней - камера концентрирования. Аппараты такого типа имеют достаточно сложную схему питания растворами. Существует несколько схем: параллельная, последовательная и комбинированная. Последняя включает в себя элементы параллельной и последовательной схем. Показанный на рис. 2.8. аппарат имеет параллельную схему питания. 57 Рис. 2.8. Эскиз электродиализного аппарата фильтр-прессного типа: 1 катодная камера; 2 - анодная камера; 3 - катионообменная мембрана; 4 анионообменная мембрана; 5 - анод; 6 - катод; 7 - рамка; 8 - турбулизатор Более сложной является последовательная схема, так как для практической ее реализации в рамках аппарата высверливаются дополнительные отверстия, расположенные в строго определенном порядке, по которым раствор подается в камеры электродиализатора. Предотвращение прогиба мембран и турбулизация потока жидкости в камерах аппарата достигается введением сепараторов-турбулизаторов различной конструкции. Параметры процесса во многом определяются типом используемых рамок: лабиринтно-листовые, рамочно-сепараторные, струнные. Анализ различных типов рамок выполнен Гребенюком, его основные результаты представлены в табл. 2.3. Вследствие определенных конструктивных особенностей разделительной прокладки, она играет роль турбулизатора, тем самым в заметной степени снижает поляризационные эффекты на границах мембрана-раствор. 58 Таблица 2.3. Основные показатели процесса электродиализа с использованием различных типов рамок Тип прокладки Показатель Рамочно-сепараторная; лабиринтно-листовая Струнная Мембранное расстояние 0,75-1 0,2-0,3 Коэффициент полезного использования мембран 0,6-0,7 0,9 Коэффициент увеличения сопротивления камер 1,6 1,2 Исходная концентрация соли в растворе, г/л 1,35 1,35 Конечная концентрация соли в растворе, г/л 0,75 0,75 0,7 0,9 6,0 8,0 кВт·ч/м3 2,35 0,94 кВт·ч/кг соли 4,0 1,70 Площадь мембран, м2 0,84 1,44 Плотность тока, А/м 2 Скорость движения жидкости вдоль мембраны, см/с Расход электроэнергии: Основным направлением интенсификации процесса электродиализа является увеличение рабочей плотности тока, а следовательно, производительности аппарата при тех же капитальных затратах. Однако такой путь имеет ограничения, связанные с концентрационной поляризацией мембран, которая при значительном увеличении плотности тока ведет к снижению выхода по току из-за непроизводительного расхода энергии на перенос ионов среды. Подщелачивание раствора ведет к осадкообразованию на мембранах, которое сначала приводит к увеличению затрат электроэнергии, а далее - к выводу электродиализатора из рабочего состояния. Введение в межмембранное пространство специальных перемешивающих приспособлений - турбулизаторов - позволяет повысить эффективность электродиализатора при обессоливании растворов. Наибольшее распространение получили турбулизаторы лабиринтного, сеточного типа и выполненные в виде гофрированной пластины. В настоящее время наибольшее предпочтение отдается турбулизаторам сеточного типа. Их использование позволяет расширить пределы экономичного использования электродиализной технологии вплоть до получения остаточного солесодержания воды 5-6 мг/л (исходная концентрация соли в воде 15 г/л). Интенсивной турбулизации потока жидкости можно добиться, используя барботаж. Воздушное перемешивание в камере обессоливания 59 позволяет увеличить коэффициент массопереноса в 5÷10 раз, причем при этом достигается высокая равномерность перемешивания по всей длине рабочей камеры. Важно отметить и тот факт, что интенсивное перемешивание растворов воздухом значительно сокращает осадкообразование на мембране, а также снижает затраты энергии. Так как турбулизаторы экранируют часть рабочей поверхности мембран и тем самым ухудшают технико-экономические показатели процесса, использование барботажа в этих целях является достаточно перспективным. Поскольку метод электродиализа относится к энергоемким процессам, то важными являются мероприятия, направленные на снижение расхода электроэнергии. Например, снижение расхода энергии происходит за счет устранения воздушных пробок в камерах концентрирования или за счет уменьшения утечек тока. Весьма интересной является конструкция многокамерного электродиализного аппарата фильтр-прессного типа, отличающаяся от известных конструкций аппаратов тем, что в качестве фиксаторов расстояния между мембранами используются струны, расположенные взаимно параллельно в каждой камере и взаимно перпендикулярно в любых двух соседних камерах (рис. 2.9.). Рис. 2.9. Фильтр-прессный электродиализатор с прокладкой струнного типа: 1 - анионобменная мембрана; 2 - катинообменная мембрана; 3 - прокладка струнного типа Исследования показали, что аппараты этого типа достаточно надежны в работе, а использование тонких струн уменьшает расстояние между мембранами, что делает аппарат более экономичным. В табл. 2.4. приведены результаты исследований Лысенко, проведенных на опытных аппаратах, которые наглядно иллюстрируют преимущества электродиализаторов со струнными прокладками. 60 Таблица 2.4. Технические данные электродиализаторов со струнными прокладками Технические данные Марки электродиализаторов ЭДС-Л ЭДС-84 ЭДС-200 Число мембран 1-20 84 200 Число камер обессоливания 1-10 40 100 Размер мембран 195x75 400x400 146x460 Межмембранное расстояние 0,15-1,0 0,3 0,3 Шаг между струнами, мм 2-4 3 3 Коэффициент увеличения сопротивления 1,12-1,48 1,2 1,2 0,72 0,9 0,9 Тi-МnО2 Тi-МnО2 Графит Коэффициент полезного использования мембран Материал анода С целью упрощения конструкций и монтажа аппарата был предложен аппарат безрамочной конструкции. Роль камер обессоливания и камер концентрирования играют канавки (рис. 2.10.), заранее вырезанные на поверхности мембран. Канавки могут быть вырезаны с одной стороны мембран во взаимно перпендикулярном направлении или с обеих сторон только катионо- или только анионообменных мембран также во взаимно перпендикулярных направлениях. Рис. 2.10. Расположение профилированных мембран в электродиализаторе безрамочной конструкции Для обессоливания низкоминерализованной воды достаточно эффективно могут работать насадочные электродиализаторы, которые отличаются от обычных тем, что в камеру обессоливания, в которой максимальное сопротивление раствора, вводится определенное количество гранулированного ионита (чаще смесь катионита и анионита заданного состава). 61 Гранулы ионита достаточно эффективно перемешивают раствор и тем самым устраняют явление поляризации мембран, а также увеличивают электропроводность раствора, что позволяет получать дистиллированную воду. Использование насадочных электродиализаторов в некоторых случаях бывает эффективнее, чем использование струнных аппаратов. Об этом свидетельствуют данные работы, представленные в таблице 2.5. Таблица 2.5. Затраты электроэнергии на обессоливание в насадочном и струнном электродиализаторах [207] Электродиализаторы Типовой Расход электроэнергии W, кВт·ч/м3 при изменении удельного сопротивления, кОм·см Расход электроэнергии W, кВт·ч/кг (при снижении солесодержания, г/л) 1,4-2,9 1,0-0,3 8,0-7,0 8,0-6,2 С насадкой 1,2 11,5 2,5 3,7 Струнный 3,3 13,1 3,0 3,9 Одним из важнейших преимуществ электродиализного способа очистки и регенерации стоков является возможность автоматизации процесса. Автоматизации процесса электродиализа уделяется большое внимание. Предложено несколько устройств, позволяющих автоматически регулировать плотность тока. Электродиализ разбавленных растворов (С < 0,005 моль/л) имеет свои особенности. Применение обычных конструкций аппаратов, успешно работающих в области более высоких концентраций, оказывается неэффективным: перенос ионов соли снижается в большей степени, чем происходит уменьшение их концентрации; выход по току резко падает вследствие интенсивной диссоциации воды; происходит сдвиг рН обессоливаемого раствора (обычно он становится кислым); уменьшается степень обессоливания раствора. Усилиями многих исследователей, направленными на уменьшение межмембранного расстояния в электродиализных аппаратах, использование в мембранных каналах активных (ионопроводящих) сепараторов и ионообменных насадок, мембран с физически или химически модифицированной поверхностью, а также благодаря использованию на практике новых приемов интенсификации массопереноса в мембранных системах были созданы достаточно эффективные электродиализаторы для глубокого обессоливания растворов электролитов. Такие аппараты расширили область использования электродиализа вплоть до получения деионизированной воды с удельным сопротивлением 1-10 МОм·см, однако скорость процесса все же остается недостаточной. 62 Анализ показывает, что уменьшение межмембранного расстояния улучшает технико-экономические показатели (увеличивается степень обессоливания и уменьшается омическое сопротивление мембранного канала), а использование сепараторов позволяет увеличить массо-перенос в 5-7 раз. Однако уменьшение толщины мембранного канала и расстояния между прерывателями потока до долей миллиметра приводит к резкому увеличению вязкостных сил по сравнению с силами инерции, усилению влияния "пристеночных" эффектов, поэтому попытки интенсификации массопереноса путем введения в канал геометрических вставок, возмущающих поток (турбулизация, прерывание, закручивание потока), в каналах толщиной h < 0,3 мм становятся неэффективными. Поэтому ряд авторов предлагают дополнительные приемы интенсификации, заключающиеся в использовании таких явлений, как электроконвекция, гравитационная конвекция и экзальтация предельного тока. В заключение раздела отметим некоторые моменты, которые, по нашему мнению, важны при разработке и конструировании электродиализных аппаратов. При выборе материала электрода необходимо учитывать химические свойства среды, в которой предполагается работа электрода (при выборе оксидных электродов необходимо, чтобы оксид металла обладал электронной проводимостью). Ионообменные мембраны должны обладать высокой селективностью и электропроводностью, малой скоростью свободной диффузии, низкой осмотической проницаемостью, достаточно высокой химической и механической прочностью, стабильностью размеров. Рамки прокладок в аппаратах фильтр-прессного типа должны обеспечивать минимальное расстояние между мембранами, а турбулизаторы в достаточной степени перемешивать поток жидкости при минимальном экранировании мембран. При разработке конструкции аппарата необходимо учитывать возможность его автоматизации. В последнее время уделяется внимание использованию для интенсификации электродиализа других форм тока, отличных от постоянного. Например, проведение электродиализа на импульсном униполярном токе позволяет снизить затраты электроэнергии в 3-5 раз, увеличить обменную производительность мембраны в 2-4 раза. По всей видимости, это связано с особенностью влияния импульсного униполярного тока на механизм транспорта ионов в мембране и растворе. Рассмотрим некоторые особенности ведения электродиализа в нестационарном токовом режиме. 2.5.2. Использование нестационарных токовых режимов В современных научных исследованиях электрохимических процессов и технологий электрохимических производств все большее 63 внимание уделяется применению переменного электрического тока различных параметров. При протекании переменного тока в электрохимической системе создаются условия для осуществления более широкого класса различных электрохимических реакций в растворах, на электродах и межфазной границе электрод-электролит, электролит-мембрана, детального исследования механизма этих реакций в системе. Большие перспективы применения переменного тока различной формы открываются для процессов водоподготовки, где особенности протекания переменно-токовых процессов дают возможность создания эффективных технологий. Требования к охране окружающей среды выдвинули на первый план задачу разработки безреагентных методов глубокого обессоливания воды. Существующая в настоящее время система подготовки воды для энергетических установок с использованием ионообменных смол не удовлетворяет современным требованиям, несмотря на свойственные ей низкие энергетические затраты за счет процессов, исключающих изменение фазового состояния воды при очистке. Задача разделения близких по свойствам редких элементов - одна из центральных задач аналитической химии и химической технологии. Перспективным методом является разделение с использованием мембран, однако на постоянных токах он имеет малый коэффициент разделения. Это связано с ограничениями плотности тока, а также ресурсными характеристиками мембран. Одним из преимуществ мембранного разделения является проведение процесса без фазовых превращений. Влияние переменного тока на селективность мембран обратного осмоса впервые рассмотрено в работе [234], в которой изучалось влияние частоты и плотности переменного тока на разделение водных растворов NaCl, СаС12, и сахарозы. Для улучшения селективности мембран разделение проводилось при частоте 5-10 Гц и плотности тока (5-10)х10-4 А/см2, хотя в этом режиме селективность падает вдвое, но зато не происходит быстрого разрушения мембран. Описан [196] способ разделения ионов (Na+-Ca2+, Сl--ОН-) в электродиализаторе в результате проведения процесса на переменном токе. Установка для разделения включала электродиализатор со средней камерой, отделенной от электродных объемов ионоселективными мембранами МК-40 и МА-40. На электроды, расположенные в электродных камерах, напряжение подавалось от генератора низких частот типа ГЗ-16. Коэффициент разделения определялся по формуле Ci/Cj K= ’ ’ C i/C j (2.26) 64 где Ci, Cj - концентрации разделяемых ионов в исходном растворе; C’i/C’j- концентрации разделяемых ионов в растворе-носителе. Полученные результаты приведены в табл. 4.4. Таблица 2.6. Экспериментальные данные процесса разделения ионов Система ионов Частота, Гц Концентрация ионов в раствореносителе, М Са2+ Na+ OH- Коэффициент разделения Cl- Постоянный ток 2+ + 1,2 Ca /Na 0 10 OH-/Cl- 0 - 100,8 - - 10-0,4 - 105,1 101,2 10-3,9 - - Полное Переменный ток 2+ + Ca /Na - OH /Cl - 0,1 0,5 0 - 100,4 - 0 10 0,1 -"- Представлены результаты сравнительных исследований по эффективности удаления хрома из сточных вод путем электролиза этих вод с использованием двух электродов из железа при различных режимах проведения электролиза: на постоянном токе и импульсном токе с прямоугольной формой импульсов. Изучено влияние рН на процесс электролиза. Установлено, что режим электролиза практически не влияет на эффективность удаления хрома из сточных вод, но в случае постоянного тока (особенно при рН ≤ 5) наблюдается выход ионов железа в воду, а именно концентрация ионов железа приблизительно в 10 раз выше, чем при импульсном электролизе. Однако авторы получили хорошие результаты на импульсном токе по регенерации хромсодержащих промывных вод (ХПВ) с содержанием Сr6+ до 12 г/л. Максимальная скорость очистки (62 % по ионам Сr6+) была достигнута в однокамерном электролизере на свинцовых электродах при более коротких импульсах тока (20-50 мс); она практически не зависит от концентрации ионов хрома в ХПВ. Скорость очистки ХПВ тем выше, чем больше в ней ионов хрома. Предложен оптимальный режим регенерации, а также материал электродных пар. Ряд работ посвящен применению асимметричного переменного тока в диапазоне частот 1-1010 Гц. Представляет интерес изучение влияния различной частоты на поведение ионов. Отмечено, что при проведении процессов электроосаждения и мембранного разделения элементов на асимметричном переменном токе лучшие результаты получены на соответствующих для каждого элемента "резонансных частотах". Численное значение резонансных частот для электроосаждения на переменном асимметричном токе вычисляется по формуле 65 f= K n·A (2.27) где f- частота асимметричного переменного тока, Гц; п - валентность осаждаемого элемента; А - атомный вес осаждаемого элемента; К - предельная резонансная частота разряда (или ионизации), равная 95519 Гц. Проведенные исследования по электродиализному разделению ионов на основе резонансных частот асимметричного переменного тока позволили установить, что селективность разделения ионов выше на инертных пористых мембранах (диаметр пор до 20 мкм), чем на ионоселективных типа МК-40 и МА-40. Сделан вывод, что резонансная частота прямо пропорциональна валентности, в то время как при электроосаждении сплавов она имеет обратную зависимость. По мнению авторов, это объясняется тем, что при электроосаждении иону металла нужно участвовать в акте разряда количество раз, кратное валентности иона, т.е. с увеличением валентности время контакта с поверхностью должно быть больше. В случае же разделения на мембране, когда процесс происходит в двойном электрическом слое, для преодоления его толщины необходима определенная скорость, которая будет выше у иона с большей валентностью. Однако применение асимметричного переменного тока для очистки сточных вод электродиализом недостаточно эффективно. Это связано с наличием импульсов обратной полярности, что снижает степень защиты мембраны от разрушения. С целью повышения скорости, степени и селективности очистки сточных вод и технологических растворов гальванических производств от ионов тяжелых металлов предлагается вести электродиализ этих растворов на импульсном униполярном токе с прямоугольной формой импульсов (рис. 2.11) и скважностью1 импульсов от 2 до 10. Проведение электролиза в данном режиме позволяет в моменты токовых толчков импульсов значительно увеличить рабочую плотность тока в импульсе (jmax) jmax = jср·Q (2.28) где jср - среднее значение плотности импульсного тока; Q - скважность импульсов. 66 Рис. 2.11. Форма импульсного униполярного тока с прямоугольными импульсами Различают мгновенную плотность тока j(t) - значение в любой момент времени, периода; максимальную jmax - наибольшее значение в любой момент времени, для прямоугольной формы импульсов определяется по формуле (2.28); среднюю jср за период Т 1 jср= ∫t0 j(t)dt T (2.29) и действующее значение 1 ∫t0 j2(t)dt j= T (2.30) Для стационарных режимов электролиза j(t)= jср= j Характерное отличие влияния импульсного тока обусловлено также процессами, протекающими в паузу и его сверхвысокими амплитудами. Импульсами прямого тока принято считать основные "рабочие" импульсы электролиза. Однако в каждый момент действия прямых импульсов процесс протекает иначе, чем на постоянном токе. При импульсном электролизе, помимо фарадеевской составляющей тока, появляется составляющая, обусловленная перезарядом емкости электрода, влияющая на степень использования тока в процессе электролиза. Следует отметить, что прерывистый характер импульсного тока и ведение электролиза при достаточно высоком значении jср обусловливают высокие мгновенные значения тока в импульсах, и, следовательно, разряд ионов при более отрицательных значениях по сравнению с режимами на постоянном токе. Использование импульсного тока для питания электролизеров позволяет кроме плотности тока регулировать частоту и скважность импульсов. В результате существенно расширяется возможность оптимизации электродиализного процесса в целом. Изменением величины скважности можно регулировать соотношение времени действия градиента напряжения электрического поля и снижения градиента концентраций в мембране. Однако увеличение 67 скважности более 10 приводит к возрастанию скоростей побочных процессов: на катоде - выделение водорода, на аноде - кислорода. В результате снижается эффективность полезного использования электроэнергии в процессе разделения ионов. Каждый ион обладает массой, размерами и зарядом, определяющими скорость его движения в среде под действием электрического поля (подвижность иона). В отсутствие электрического поля ионы находятся под влиянием теплового движения молекул. При возникновении электрического поля между электродами на беспорядочное тепловое движение накладывается направленное перемещение ионов к электродам; например, катионов - к катоду. Катионы (также как и анионы) в растворе не вполне свободны. Согласно теории сильных электролитов, они окружены ионной атмосферой, в которой индуцируется заряд, противоположный по знаку центральным ионам. Двигаясь к катоду, катион будет как бы "покидать" свою ионную атмосферу. Сместившись от центра ионной атмосферы, катион начинает формировать новые ее слои в направлении своего движения. С противоположной стороны, наоборот, происходит рассеивание ионной атмосферы, покинутой движущимся ионом. Процессы формирования и уничтожения ионной атмосферы не происходят мгновенно из-за инертности системы. Поэтому движение катиона вызывает постоянное, но несколько отстающее рассеивание ионной атмосферы с противоположной стороны, в "покинутой" части которой будет преобладать отрицательный заряд, тормозящий движение катиона к катоду. Такое тормозящее действие деформированной ионной атмосферы называется эффектом релаксации (или асимметрии). Суммарный заряд ионной атмосферы противоположен по знаку заряду центрального иона. Навстречу ему движутся ионы ионной атмосферы, несущие с собой сольватирующие их молекулы растворителя. Это создает дополнительное торможение движению иона, вызванное как бы увеличением вязкости среды, электрофоретический эффект. Рассмотренное движение ионов происходит при наложении постоянного электрического поля. При наложении переменного тока движение каждого из ионов происходит в двух противоположных направлениях попеременно. Причем так же возникают оба эффекта, тормозящих движение ионов к электродам. Использование импульсного тока однополупериодного выпрямления (без обратного импульса) определенной частоты, которая совпадает с частотой колебаний удаляемого иона, находящегося на границе раствормембрана (явление "резонанса"), позволяет увеличить скорость движения иона настолько, что на его пути не успевает формироваться стационарная ионная атмосфера, таким образом, снижается релаксационное торможение. Отсутствие ионной атмосферы уменьшает и электрофоретический эффект (рис. 2.12). 68 Рис. 2.12. Схема движения ионов при наложении импульсного тока определенной частоты для извлекаемого иона Дальнейший перенос осуществляется в фазе мембраны. Движение ионов в мембране определяется в основном соотношением их размеров и плотностью среды. При внедрении в фазу мембраны ион преодолевает некоторый энергетический барьер, и дальнейшее передвижение иона можно рассматривать как скачкообразное перемещение от одной функциональной группы к другой, также связанное с преодолением потенциального барьера. Естественно, что ионы, лишенные ионной атмосферы и получившие дополнительное ускорение за счет "резонанса", будут гораздо быстрее преодолевать указанные энергетические барьеры. В результате, анализируя работу ионообменной мембраны в электродиализном процессе, следует учитывать два основных потока ионов через мембрану: 1) движение прямого потока, зависящего от природы ионита и диффундирующего иона и определяемого в основном градиентом приэлектродного потенциала, который, в свою очередь, влияет на последовательность разряда ионов; 2) обратный поток коионов, определяемый концентрационным градиентом ионов в мембране. Использование импульсного тока различной частоты позволяет регулировать количественный и качественный состав прямого и обратного потока, а наличие пауз между импульсами, где напряженность электрического поля падает, позволяет снизить концентрационный градиент ионов в мембране и примембранном слое. 1 Скважность, Q - отношение длительности периода к длительности импульса, Q = 69 T tu 2.6. Расчет электродиализатора При проектировании электродиализных установок необходимо выполнить технологический расчет. Исходными данными для проектирования и расчета являются: 1) назначение установки; 2) полезная пропускная способность; 3) характеристика водоисточника; 4) полный физико-химический и бактериологический анализ исходной воды. Основной задачей расчета электродиализной опреснительной установки является определение напряжения и силы тока, подводимого к электродам, а также площади мембран и их количества. 2.6.1. Методика расчета установки циркуляционного типа Рассмотрим пример расчета опреснительной циркуляционного типа. Исходные данные для расчета: - производительность установки, Q = 240 м3/сут =10 м3/ч; - минерализация (солесодержание), S = 2230 мг/л; - концентрация катионов: мг/л Са 2+ Mg Na 2+ + ∑ установки мг-экв/л 220,4 5,5 243,0 10,0 402,5 17,5 865,9 33,0 183,0 3,0 667,0 15,5 514,1 14,5 1364,1 33,0 - концентрация анионов: HCO3SO4 Сl ∑ - 2- - солесодержание опресненной воды, S0= 1000 мг/л; - коэффициент выхода по току, η = 0,85-0,98 - при деминерализации пресных вод; η = 0,8-0,85 - солоноватых; η = 0,7 - при опреснении морской воды; - оптимальная плотность тока, i = 0,0085 А/см2; - падение напряжения на электродах, Е = 4-6 В; - стандартные размеры мембран (сухих), а х в х δ = 142 х 45 x 0,03 см; - коэффициент экранирования мембран в зависимости от типа корпусных рамок, Кэ = 0,60-0,80; 70 - расстояние между мембранами (перемычками), d = 0,08-0,12см; коэффициент увеличения электрического сопротивления камеры в зависимости от типа сетки-сепаратора, Ку = 0,34-0,71; - удельное электрическое сопротивление мембран, ρк= ρа= 30 Ом·см2; - эквивалентное расстояние между мембранами dэ = 0,08-0,12см; - ширина прохода воды в камере В1 = 360-470 см; - площадь электрода fэл = 0,32 м2; - мощность двигателей рабочих насосов Nд = 0,73 кВт и их число N=2шт. Ионную силу раствора определяем по формуле μ = 0,5∑Ci·Zi2 (2.31) где Сi - молярная концентрация иона, мг-экв/л, zi - заряд иона. μ = [2(5,5 + 10,0 +15,5) + 0,5(17,5 + 14,5 + 3,0)]·10-3 =0,079 Среднее солесодержание, мг/мг-экв S Еc= , Sк,а (2.32) где Sк,а - сумма катионов (или анионов), мг-экв/л. 2230 Ec= =67,4 мг/мг-экв. 33,0 Коэффициент допустимого концентрирования солей в рассольных камерах 19μ·10-4 . Kc= [Ca2+]·[SO42-] (2.33) -4 19·0,079·10 ≈4,5. Kc= 2,75·10-3·7,75·10-3 Количество солей, удаляемое за 1 час для снижения общего солесодержания воды, г-экв/ч S0 Sy= Q(Sк) Ec (2.34) 1000 Sy = 10(33,0)= 168 г-экв/ч 67,4 Количество электричества, которое нужно пропустить через электродиализную установку для удаления из воды солей, А·ч 26,8·Sy I·t= , η 71 (2.35) где I - сила тока, А; t - время, ч. I·t= 26,8·168 0,87 = 5175 А·ч Площадь мембраны, см2 Fм = I·t i (2.36) где i - плотность тока, определяется в зависимости от стоимости мембран и электроэнергии, А/см2. 5175 =61·104 см2 Fм = 0,0085 Площадь одной мембраны (нетто), см2 Fн = Кэ·а·в (2.37) 2 FH=0,75 · 5000 = 3750 см . Необходимое число парных мембран, шт Fм n= Fн (2.38) 4 61·10 ≈ 160 шт п= 3750 Число камер, шт n n k= m (2.39) где m - число параллельно действующих электролизеров. 160 =160 шт. nk 1 Принимается один электродиализный аппарат рамочного типа с закладной сеткой-турбулизатором. Удельная электропроводность опресняемой воды в начале цикла, Ом1 ·см-1 χH = Skβ/γ (2.40) где β - показатель степени, зависит от отношения содержания сульфатионов к количеству анионов: 72 [SO42-] 0,02-0,2 0,2-0,4 0,4-0,6 0,6-0,8 0,8-1,0 β 0,94-0,92 0,92-0,895 0,895-0,87 0,87-0,84 0,84-0,81 γ - коэффициент, зависящий от состава воды, определяется по известному значению удельной электропроводности исходной воды при t = 18 °С; ориентировочно γ = 8300. χH =33,00,905 / 8300 = 0,38·10-2 Ом-1·см-1. В конце цикла So β χк=( ) /γ Ec (2.41) 1000 0,905 ) /8300 =0,188·10-2 Ом-1·см-1. χк=( 67,4 Для рассола при Кс, кратной его концентрации, удельная электропроводность равна χp = (SK·KC)β /γ, (2.42) 0,905 -1 -1 χp = (33,0 · 4,5) / 8300 = 0,017 Ом ·см . Внутреннее электрическое сопротивление в начале цикла одной камеры электролизера (дилюатной и рассольной), Ом 1 RH = (d (1 + Ky)/χH + d (1 + Ky)/χP + ρk + ρa) FH (2.43) 1 0,12·(1 + 0,54) 0,12·(1 + 0,54) ( + +30+30)= 1,8·10-2 Ом RH = 3 -2 3,75·10 0,38·10 0,017 В конце цикла 1 (d (1 + Ky)/χH + d (1 + Ky)/χP + ρk + ρa) RK = FH (2.44) RH = 1 3 ( 0,12·(1 + 0,54) -2 + 0,12·(1 + 0,54) +30+30)= 1,8·10-2 Ом 3,75·10 0,188·10 0,017 Среднее электрическое сопротивление одной камеры, Ом RK + RH 1,8·10-2 + 5,0·10-2 = 3,4·10-2 Ом Rср 2 2 Мембранный потенциал в начале, середине и конце цикла, В CP ) EM = 0,1lg ( CД 73 где СР и СД соответственно. (2.45) - концентрация солей в рассоле и дилюате В начале цикла - EMср = 0,1lg ( в середине – EMср = 0,1lg ( 2·4,5 2·4,5 1,5 в конце цикла - EMк = 0,1lg ( 2 ) = 0,065 В ) = 0,078 В 2·4,5 ) = 0,095 В 1 Напряжение на установке, необходимое для поддержания расчетной плотности тока, В U = I · FH · n · Rcp+E + 2nEMср (2.46) 3 -2 U = 0,0085 · 3,75·10 · 160 · 3,4·10 + 4 + 2 · 160 · 0,078 ≈ 203 В. При этом напряжении плотность тока, А/см2 U - (E + 2nEM) j= FHnR (2.47) где ЕM и R берутся в начале и конце цикла. Плотность тока в начале цикла 203 - (4 + 2·160·0,065) 2 jн= 3 -2 = 0,0173 A/см 3,75·10 ·160·1,8·10 в конце 203 - (4 + 2·160·0,095) 2 jк= 3 -2 = 0,0056 A/см 3,75·10 ·160·1,8·10 Тогда в среднем за цикл 0,0173 + 0,0056 = 0,00116 A/см2 jср= 2 Расчетная плотность тока составит 0,0085 А/см2. Деполяризующая скорость движения воды и рассола в камерах электролизера, см/с B · j1/p υД= 1/p C · dЭ (2.48) где В и p - параметры, зависящие от конструкции камеры, типа турбулизатора-сепаратора, соотношения коэффициентов диффузии растворенных в воде солей и ее температуры, принимаются равными 2,5 и 0,67 соответственно; 74 С - средняя концентрация растворенных солей в опресняемой воде в конце цикла, г-экв/л. 2,5 · 0,00561,495 υД= = 5,6 см/с 0,021,495 · 0,081 Производительность циркуляционных насосов для перекачки опресняемой воды и рассола, м3/ч ан = т · п · d · В1 - vД (2.49) -3 -2 3 3 ан =1 · 160 · 1,2·10 · 0,42 · 5,6·10 м /с=16,2 м /ч. Расход тока на опреснение воды, кВт jср ·FH · U · m Wэ= 1000 0,0116 · 3,75·103 · 203 · 1 =13 кВт Wэ= 1000 Расход тока на перекачку дилюата и рассола, кВт WП=NД · N (2.51) WП=0,73·2 = 1,46 кВт. Общий расход тока на опреснение воды, кВт/м3 WЭ + WП W= Q (2.52) W= 13 + 1,46 10 2.6.2. Методика расчета установки прямоточного типа - Используем исходные данные из раздела 2.6, а также: температура исходной воды 17 °С; толщина дилюатной (рассольной) камеры d = 0,12 см; скорость протекания воды в ячейке V= 20 см/с; толщина прокладки лабиринтно-сетчатой dq = 0,12 см; длина пути потока (лабиринта) L = 304 см; длина канальца распределения 1p = 1 см; диаметр распределительного коллектора Dk = 2 см. Степень опреснения исходной воды S0 1000 Y= = = 0,448 S 2230 (2.53) Ионная сила раствора μ = 0,079. 75 Среднее солесодержание Ес = 67,4 мг/мг-экв. Коэффициент допустимого концентрирования Кс = 4,5. Концентрация солей в рассоле может быть доведена до Ес · Кс == 67,4 · 4,5 = 303,3 мг/мг-экв. Необходимое солеудаление Sy = 168 г-экв/ч. Количество электричества, необходимое для удаления рассчитанного количества солей, I · t= 5175 А·ч. Отношение концентраций рассола и дилюата в конце длины пути потока в аппарате по формуле (2.92’) 4,5 + 1·(1 – 0,448) = 11,28 XN = 0,448 Ширина потока воды в прокладке аппарата, см 0,9 · FM m= L Kэ + 4lp + 4Dk . (2.54) 0,9 · 5000 m = 304 +4·1+4·2 = 10,1 см 0,75 Число дилюатных камер или число рабочих ячеек из формулы (2.9) 240 · 11,57 = 115 шт nяч = 20 · 0,12 · 10,1 где 11,57 - коэффициент пересчета расхода из м3/сут в см3/с. Рабочая площадь катионообменных (анионообменных) мембран в аппарате, см2 FM = Fн·nяч =3750 · 115 =431250 см2 = 43,1 м2. Принимаем аппарат АЭ-25 с пропускной способностью до 25 м3/ч. Определяем эквивалентную электропроводность исходной воды по формуле: 0,38·10-2 -1 2 -1 λ= -3 = 115,1 Ом · см · г-экв 0,033·10 Толщина диффузионного слоя по формуле (2.13) при К1 = 5,6 и D= -5 1,5·10 см2/с, см δкр =5,6(1,5·10-5 · 10-2)1/3(1,5 · 0,12)0,25 · [10-2 · 0,6]0,5 · 20-0,5 = 3,38·10-3см. Критические условия работы электродиализатора определяем по формуле (2.12), принимая (t-t) = 0,5 по экспериментальным данным 76 iкр = 96500 · 1,5·10-5 = 856,5 А · см · г-эв-1 -3 0,5 · 3,38·10 Cпр Падение напряжения на одну электродиализную ячейку аппарата из формулы (2.11) uхч = 2 · 0,12 + +856,5 ( 0,12 11,28 8,31 · 209 +( 96500 0,03 0,0029 ln 11,28 + + 0,03 0,036 ) ·52·10-4 115,1 · (1 + 0,02(290 - 290)) ) = 1,8 B где удельная электропроводность мембран определяется либо -4 -1 -1 экспериментально, либо расчетом [13]; χNaCl = 52 · 10 Ом · см . Напряжение на аппарате, необходимое для поддержания средней плотности тока в ячейке, по формуле U = nяч · uяч + E, (2.55) U = 115·1,8 + 4 = 211В. Средняя концентрация дилюата по длине, мг-экв/л Cн – Ck Ccp = ln Ck Cн (2.56) 2,23 – 1,00 Ccp = (2.11) 1,00 = 1,53 мг-экв/л. 2,23 Средняя плотность тока в ячейке при Спр = S = 2,23 г/л по формуле 1,8 – 2 i= 1 2,23 0,12 + ( 0,12 11,28 +( ln 8,31 · 290 ln11,28 96500 0,03 0,0029 + 0,03 0,036 115,1 · [1 + 0,02(290 - 290)] 77 = 189 А/м2 ) ·52·10-4 ) = 1,8 B Потери напора в камере (дилюатной или рассольной) по формуле (2.15) НДЛ = 1 · 1,5 [ 1- 0,5 + (1/0,75 - 1) 3 ]· 202 = 9,6·10-3 см 480 4·0,03 0,75 0,5 2·9,8 Потери напора в местных сопротивлениях в камере (дилюатной или рассольной) по формуле (2.16) 66,8 1/0,645 – 1 2 1 202 2 = 1,06 см HM.C.= [ +0,137 ( ( ) +( -1) )]× 480 · 0,55 0,5 0,5 · 0,674 2 · 9,8 Полные потери напора в камере с использованием формул (2.17) и (2.18) H= 2 · 304 (1,06 + 0,0096) = 442 см 1,5 Расход электроэнергии на обработку воды в электродиализной установке: на деминерализацию по формуле (6.20) 0,0189 · 3,75 ·103 · 211 · 1 Wэ = = 14,95 кВт 1000 на подачу дилюата и рассола в электродиализный аппарат по формуле 2,72 · Hн · Q Wп = ηнас · ηД (2.57) где Hн - напор, развиваемый насосом, м; ηнас - КПД насоса; ηД - КПД электродвигателя; 2,72 · 15 · 10 Wп = 2 = 1360 =1,36 кВт 0,6 · 1,0 суммарный расход электроэнергии на обработку 1 м3 воды по формуле (2.52) составляет 14,95 + 1,63 W= = 1,63 кВт ч/м3 10 2.6.3. Расчет объема газа в приэлектродных камерах Объем газа в м3 рассчитываем согласно уравнения МенделееваКлайперона 78 V= n·R·T P (2.58) где п - число молей выделившегося газа; R - универсальная газовая постоянная; Т- абсолютная температура; Р - давление. Подставим в уравнение (6.28) постоянные величины для нормальных условий V = 1,26 ·10-7 · i · t С учетом растворимости газов в воде, для водорода можно записать L - 1,82 · 10-6), VH2 = 2(1,26 ·10-7 · i · fэл UД (2.59) где L - длина пути, который проходит раствор, L = 3,0-3,8 м. 3,8 VH2 = 2(1,26 ·10-7 · 85 · 0,32 - 1,82 · 10-6) = 4,6 · 10-4 м3 0,056 Предел взрывоопасности водородно-воздушной смеси составляет от 4 до 74 %. Таким образом, минимальное время τmin, с, для образования взрывоопасной водородно-воздушной смеси для здания объемом Vзд, м3, (при отсутствии вентиляции) будет равно Vзд τmin = или τmin = 0,3Vзд VH2 (2.60) По нормам охраны труда в химической промышленности производство определяется как взрывоопасное категории А или Б, если взрывоопасная газовоздушная смесь образуется в объеме, превышающем 5 % свободного объема помещения за время не более 1 ч. 2.7. Экономическая и экологическая оценка электродиализной обработки водных сред В последние десятилетия мембранные методы (электродиализ и обратный осмос) обработки водных сред развиваются быстрыми темпами. Опреснители строятся не только для целей коммунального, но и для промышленного водоснабжения городов, промышленных регионов и даже стран. Электродиализ хотя и в меньшей степени, чем обратный осмос, занимает определенное место среди других опреснительных методов. 79 Известно, что самые совершенные методы очистки сточных вод не позволяют полностью освободиться от всех веществ, и в водах остается 1020 % наиболее стойких загрязнений. Современные очистные сооружения на коммунальных и большинстве промышленных предприятий, основанные на традиционных методах механической и биологической очистки, практически не снижают солесодержания в сточных водах. Опреснение наиболее эффективно решает задачи обессоливания и очистки сточных, а также других минерализованных вод. 2.7.1. Очистка сточных вод гальванических производств Целесообразность внедрения метода электродиализа в технологию очистки промывных сточных вод гальванического производства базируется на высокой экономической и экологической эффективности затрат по сравнению с традиционными методами. Основными критериями эффективности разработки и внедрения процесса очистки и регенерации промывных сточных вод являются: - снижение капитальных вложений на строительство и реконструкцию централизованных очистных сооружений; - фактическое ресурсосбережение, экономия материалов, реагентов, топлива и электроэнергии, а также трудозатрат; - предотвращение ущерба от загрязнения окружающей среды; - эффектом, связанным с предотвращением безвозвратных потерь цветных металлов. Фактическая экономия процесса электродиализа обусловливается регенерацией либо утилизацией извлекаемого компонента. При электродиализе хромсодержащих сточных вод предусматривается возврат очищенной воды в производство, образующиеся продукты электролиза, в частности, раствор серной кислоты с ионами Сr6+ - анолит - в дальнейшем применим для корректировки электролитов хромирования и растворов хроматирова-ния. Медь осаждается на катоде в виде губчатого, легкоснимающегося осадка. Раствор сульфата железа - католит - может быть использован в качестве компонента электролита железнения, в кристаллическом виде - как реактив, содержащий ионы железа (II), в качестве протравы в строительстве и сельском хозяйстве. Экономическое обоснование инженерных мероприятий по охране водных ресурсов от загрязнений может быть связано с определением предотвращающего ущерба, который наносится окружающей среде попаданием загрязненных сточных вод в водоемы и почву. Экономический ущерб от загрязнения водных ресурсов можно выразить определенной суммой капитальных и текущих затрат, поэтому в качестве критерия оценки ущерба используют приведенные затраты. Приведенные затраты (П), представляющие собой сумму текущих (эксплуатационных) затрат (С) и 80 единовременных (капитальных) вложений (К), сведенных к одинаковой годовой закономерности в соответствии с установленным нормативным коэффициентом эффективности Ен = 0,12, определяются по формуле П = С + Ен · К. (2.61) Например, основные затраты на внедрение электродиализного (первый вариант) вместо существующего реагентного (второй вариант) метода очистки хромсодержащих промывных сточных вод: капитальные вложения составляют К = Коб+Ктр+Кмр, (2.62) где Коб - стоимость оборудования, Ктр- стоимость трубопроводов, Кмр- монтажные работы (20 % от Ктр). 2.7.2. Опреснение природных вод Опреснение воды долгое время было весьма дорогостоящим производственным процессом. Поэтому оно раньше применялось преимущественно на судах, а затем и на суше для обеспечения водой особо ответственных потребителей. Но по мере совершенствования технологии и снижения стоимости опресненной воды область ее применения расширялась. Кроме мембранных методов - электродиализа (ЭД) и обратного осмоса (ОО), применяемых для опреснения солоноватых вод (минерализацией 2-5 г/л), для опреснения морской воды используют преимущественно дистилляцию. Мы остановимся лишь на основных показателях. В основу методики подсчета технико-экономических показателей электродиализных установок положены типовые методики и рекомендации по расчету экономической эффективности. Порядок расчета аналогичен приведенному в подразд. 2.7.1. Экономичность опреснительных процессов во многом зависит от расхода энергии. Расход энергии в электродиализном методе, как отмечалось ранее, прямо пропорционален солесодержанию исходной воды и складывается из расхода электроэнергии на собственно опреснение и работу насосов (2.52). На практике расход энергии намного выше теоретически рассчитанного по закону Фарадея. Это обусловлено рядом причин: неполной селективностью мембран, обратной диффузией электролита из рассольных камер в дилюатные, необходимостью преодоления омических сопротивлении растворов, мембран и протекания электродных процессов, утечками тока, бесполезным переносом ионов в связи с поляризацией и др. Поэтому вводят величину - выход по току. Большое влияние на расход энергии оказывают плотность тока, размер и число камер, кратность рециркуляции растворов, толщина мембран и др. Существующие способы снижения стоимости процесса электродиализа 81 сводятся к нахождению оптимальной плотности тока как фактора, определяющего все основные затраты. При подходе к определению оптимальной плотности тока для серийных циркуляционных установок сохраняется основной принцип ее нахождения - по минимальной себестоимости обессоливания воды. С другой стороны, возможен другой критерий оптимальности, а именно максимальная эффективность внедрения. В табл. 2.7 и 2.8 представлены типичные для данного опреснительного процесса затраты энергии методами дистилляции, электродиализа и обратного осмоса при опреснении солоноватых вод на отечественных и зарубежных установках. Таблица 2.7. Затраты энергии на отечественных установках, МДж/м3 Производительность установки, тыс. м3/сут Метод Электродиализ, Sн= 5 г/л Sн= 2г/л Дистилляция 1 4 20 40 100 64,0 50,6 41,2 38,8 35,8 39,2 31,6 25,9 24,6 23,0 1342 789 474 406 377 Таблица 2.8. Затраты энергии на зарубежных установках, МДж/м Производительность установки, тыс. м3/сут Метод 1 4 20 40 100 Электродиализ, SH = 5г/л 53,0 44,4 37,7 36,0 34,6 SH = 2г/л 34,8 29,2 25,1 24,3 23,6 SH =5г/л 38,6 32,3 28,1 26,8 26,0 SH = 2г/л 27,3 22,6 19,2 18,6 17,6 Обратный осмос, Из данных таблиц видно, что для опреснения солоноватых вод менее энергоемкими являются мембранные методы. Область энергетически выгодного применения ЭД лежит в более малых концентрациях, а ОО - в более высоких (рис. 2.13). Добиться более глубокого обессоливания можно комбинированием методов ОО и ЭД. Так как о действующих крупных ОО установках авторам не удалось обнаружить технико-экономических проработок, то рассмотрим сравнение методов ЭД и дистилляции. Структура капитальных и эксплуатационных затрат на опреснение методами дистилляции и электродиализа хорошо иллюстрируется цифрами, полученными Колодиным и приведенными в табл. 2.7, а основные экономические показатели (в ценах 1990 года) - данными табл. 2.8. 82 Рис. 2.13. Изменение относительной стоимости опреснения воды электродиализом (1) и обратным осмосом (2) в зависимости от начальной минерализации Нужно отметить, что приведенные показатели и структура капитальных и эксплуатационных затрат на отечественных опреснителях соответствуют ценам прошлого десятилетия. На сегодняшний день цены на топливо и промышленное оборудование повысились. Однако в целом общую тенденцию можно проследить. Так, с увеличением производительности дистилляционных установок с 1 до 100 тыс. м3/сут удельные капитальные вложения уменьшаются в 5-6 раз, себестоимость - в 2,5-3 раза и приведенные затраты - в 3-3,5 раза. Для электродиализных установок эти показатели соответственно снижаются в 1-1,5, 2-2,3 и 1,5-2 раза. Нужно также отметить, что дистилляционные опреснители малой производительности (до 4 тыс. м3/сут) почти в 4 раза дороже электродиализных, и лишь на крупных станциях мощностью 100 тыс. м3/сут капитальные вложения и них почти равны, но себестоимость опреснения воды на ЭД при этом в 2,7 раза дешевле. Поэтому опреснение солоноватых вод экономически выгоднее производить электродиализом. 2.7.3. Нейтрализация и переработка сбросных рассолов опреснителей Любая опреснительная установка (ОУ) извлекает из соленой воды только пресную воду, оставляя прежнее количество солей в отходящих рассолах, где концентрация их увеличивается. Поэтому любая ОУ будет наносить урон окружающей среде, различающийся только масштабом и размером загрязнения. Технология обессоливания воды будет в том случае совершенной, если будут эффективно взаимно связаны обе функции 83 обессоливающая и природоохранная, когда отходящие рассолы будут нейтрализоваться или перерабатываться, как в рассмотренном примере. Существуют несколько методов переработки рассолов. Рассмотрим коротко их основные характеристики. 1. Химическая переработка. В результате получается полезная химическая продукция и обеспечивается достаточно эффективная защита окружающей среды. Применяется на крупных ОУ. 2. Глубоководный выпуск рассола в море (либо в поверхностные водоемы). Применяется на ОУ, расположенных на побережье или вблизи от моря, где имеются благоприятные глубины для выпуска, а сооружение завода по переработке рассола экономически нецелесообразно. 3. Термическое обезвреживание или упаривание рассола до сухих солей. Применяется в промышленности для обработки промстоков. 4. Сброс в пруды-испарители. Способ применим в условиях пустыни или южных районов, где суммарное испарение превышает 600 мм/год. 5. Закачка рассола в поглощающие скважины. Применяется при благоприятных геологических условиях вблизи городов, где свободных земель для прудов нет. Приведенные методы в основном применяются на практике. Однако однозначных рекомендаций по выбору того или иного метода для конкретных условий нет. Поэтому в этом направлении продолжаются широкие исследования. Основной недостаток вышеперечисленных методов связан с тем, что соли, находящиеся в сбросовых водах, рассеиваются в природной зоне, вводя в нее элемент нестабильности. Со временем подобное вмешательство может спровоцировать экологические катаклизмы. Наиболее экологичными технологиями являются методы очистки сточных вод, когда растворенные вещества извлекаются из воды с последующим возвратом так же, как и очищенной воды, в производственный цикл. 2.8. Электродиализ для электрокорректорекции рН Принцип работы электрокорректора рН (рис. 2.14) заключается в том, что исходная вода подается в анодные камеры, где за счет образования из воды на аноде кислорода происходит ее подкисление, а часть воды, попадающая в катодные камеры через диафрагму подщелачивается за счет образования в катодном пространстве ионов ОН–. Отвод католита и анолита осуществляется раздельно. 84 Рис. 2.14. Схемаа электроокорректо ора рН: 1 – катодны ые камеры ы; 2 – анод дные кам меры; 3 – диафрагм д ма; 4 – каттоды; 5 – аноды; 6 – подвод дящий коллеектор; 7 – система отвода католита; 8 – отвод д анолита;; 9,10 – сб борные каррманы; 11 – изолирующие пластины п ы; 12 – отвверстия п подачи вод ды в аноодные кам меры. При расч П чете электтрокорректора рН Н исходны ыми данн ными высступают расход д воды Qж, плотн ность токка на элеектродах i и конц центрацияя ионов тяжелы ых металллов CMe . П испоользовани При ии электроокорректора в схеемах очисстки сточн ных вод его оссновное назначени н ие – довед дение знаачения рН Н потока до велич чины рН гидраттообразоввания присутств п ующих в расттворе иоонов мееталлов. Необхходимая для д этого концентррация щеелочи Сщ, г-экв/м3, оцениваается из соотноошения: Сщ = ∑ Сi ΔCщ + (ррН к − рН нач н ) ΔС рН , (2.63) нтрация ионов и мееталла в растворе, р личество где Сi – концен г/м3; Δ Сщ – кол щелоч чи в г-эквв, необхоодимое для д осажд дения 1 г ингред диентов тяжелых т 85 металлов; ΔСрН – среднее количество щелочи, необходимое для изменения рН раствора на единицу, г-экв/м3; рНк – конечное значение рН раствора, определяемое по наибольшему значению рН гидратообразования металла, находящегося в исходной воде; рН нач – начальное значение рН обрабатываемой воды. При сложном составе сточных вод наиболее оптимальное конечное значение рН составляет 8,5-9,0 единиц. Количество щелочи, необходимое для выделения 1 г ионов в виде гидроксидов изменяется в пределах 0,03 до 0,06 г-экв. Для оборотной воды изменение ее рН на единицу требует количества щелочи, равного 0,4-0,5 г-экв/м3. Количество щелочи Qщ, г-экв/ч, необходимое для обработки всего потока Qж, м3/ч, составит: Qщ = CщQж (2.64) Необходимое для получения в катодных камерах такого количества щелочи удельное количество электричества Qv, А · ч/м3,составит: Qv = QедQщ , QудQк (2.65) где Qуд – удельное изменение щелочности в г-экв/м3, при пропускании через раствор Qед электричества, ровного одному А · ч/м3; Qк – расход католита, м3/ч. Удельное изменение щелочности зависит от общего солесодержания и составляет: Солесодержание,г/м3 Qуд, г-экв/м3 50 0,17–0,28 300 0,36–0,53 500 0,58–0,7 2000 0,85–0,94 Количество сточной воды, обрабатываемой в катодных камерах, составит Qк = α Qж, (2.66) где α – коэффициент, показывающий долю исходной воды от общего расхода, обрабатываемой в катодных камерах, α = 0,10–0,12. Рабочая поверхность катодов или анодов S, м2, без учета степени перфорации составит: S= Qv ⋅ Qк , i 86 (2.67) где i – рабочая плотность тока , при солесодержании 70-200 г/м3 составляет 25–30 А/м2, при солесодержании 200–500 – 30–50 А/м2. Требуемое число катодов и анодов nк = na = S , bh (2.68) где b и h – соответственно ширина и высота электродов, м. Расстояние между соседними перфорированными катодами (см. рис. 2.14) принимается равным около 20мм, между анодами – 40-50 мм, толщина катодов 2–3 мм, рекомендуемая ширина электродов – 0,7–0,9 м, высота – 0,5–0,7 м. Величина рН воды, выходящей из анодной камеры составит: pH a = pH нач − Qщ , (1 − α)QK уд (2.69) где Куд – удельное количество кислоты, необходимое для снижения рН анолита на единицу, для оборотной воды составляет 0,4-0,6 г-экв/м3, при использовании для промывки деталей воды из подземных источников 0,9– 1,1 г-экв/м3. 87 3. ЭЛЕКТРОФЛОТАЦИЯ Флотация применяется для очистки производственных сточных вод, содержащих поверхностно-активные вещества, нефть, нефтепродукты, масла, волокнистые частицы. Процесс заключается в образовании в толще воды газовых пузырьков (чаще воздушных), прилипании частиц к поверхности раздела газовой и жидкой фазы, всплывании этих комплексов на поверхность обрабатываемой сточной жидкости и удаление образовавшегося пенного слоя. Применение того или иного способа флотации зависит от состава сточных вод, необходимой степени очистки. Наиболее широко применяется напорная флотация, позволяющая обрабатывать сточные воды с начальной концентрацией загрязнений до 4–5 г/л и более. Процесс выделения из жидкости взвешенных частиц путем их флотации газовыми пузырьками, получаемыми при электролизе воды, называют электрофлотацией. Использование электролиза воды для получения газовых пузырьков при очистке сточных вод флотацией по сравнению с другими способами аэрации имеет следующие преимущества: – высокая степень дисперсности газовых пузырьков и относительная чистота их поверхности, что обеспечивает эффективность прилипания пузырьков к взвешенным частицам; – возможность плавного регулирования скорости процесса путем изменения степени насыщения жидкости пузырьками газа в широких пределах; – отсутствие вращающихся частей в электрофлотационных аппаратах (что гарантирует надежность их работы), интенсивного перемешивания обрабатываемой жидкости и перетирания содержащихся в них взвешенных частиц; – возможность флотации раздельно пузырьками водорода или пузырьками кислорода, что в первом случае гарантирует отсутствие процессов окисления в обрабатываемой жидкости, а во втором, наоборот, их повышенную окислительную активность; – простота изготовления электрофлотационного аппарата и несложность его обслуживания. Простейший электрофлотационный аппарат (рис. 3.1) представляет собой сосуд, внутри которого расположены электроды. Причем, процесс электрофлотации протекает более эффективно, если электроды расположены горизонтально (рис. 3.2), так как в этом случае создаются лучшие условия для насыщения газом всего объема обрабатываемой жидкости. 88 Рис. 3.1. Схема однокамерной электрофлотационной установки: 1 – корпус; 2 – электроды. Рис. 3.2. Горизонтальный электрофлотатор: 1 – впускная камера; 2 – электроды; 3 скребок; 4 – шламоприемник; 5 – патрубок пуска осадка Метод электрофлотации основан на адгезии высокодисперсных пузырьков водорода и кислорода, образующихся при электролизе воды, к взвешенным частицам нерастворимых соединений. Газовые пузырьки, всплывая в объеме очищаемой жидкости, взаимодействуют с твердыми частицами, в результате этого происходит их взаимное слипание, т. е. образование агрегатов из твердых частиц с прилипшими пузырьками. Плотность образующихся агрегатов из взвешенных частиц иприлипшими к ним пузырьками меньше плотности воды, что обуславливает их транспорт на поверхность жидкости и накопление там в виде пенопродукта, который периодически удаляется механическим способом. Для того чтобы выделить ионы тяжелых и цветных металлов из жидкости их необходимо вначале перевести в труднорастворимые соединения, например, связать в виде гидроксидов, сульфидов, фосфатов и т. д. В табл. 3.1. представлены некоторые данные по значениям рН гидратообразования ионов металлов, наиболее часто встречающимся в 89 гальванотехнической практике в сточных водах. Таблица 3.1 Изменение свойств гидроксидов металлов в зависимости от состава раствора Ион металла Ni 2+ Zn 2+ Cu 2+ Pb 2+ Sn 2+ Cr 3+ Cd 2+ Fe 2+ Fe 3+ рН образо- Произведевания ние раств. ПР Ме(ОН)2 Растворимость, м/л рН мин раств. рН* 8,7 ·10-19 2 ·10 -17 5,6· 10 -20 2,8 ·10 -16 5 ·10 -26 5,4 ·10 -31 2.,4 ·10 -13 1,6 ·10 -14 1.1 ·10 -36 6 ·10 -7 1 ·10 -6 2,4· 10 -7 4 ·10 -6 2,3· 10 -9 1,2 ·10 -8 3,5 ·10 -5 1,6 ·10 -5 4,5 ·10 -10 10,2 9,2 9,0 9,4 --------8,5 11,0 10,5 8,0 6,1-8,0 6-7 6-7 6-8 3-5 5-6 7-8 5-8 3-6 Раств. при рН*, м/л 5 ·10–7 1 ·10–6 1 ·10–8 1 ·10–6 --------5 ·10–7 10–8 10–7 10–10 ПДК, мг/л 10 -2 10 -2 10 -2 10 -1 2 0,5 5 10-3 0,5 0,5 Анализ представленных в таблице данных показывает, что величина рН гидратообразования металлов изменяется в широком диапазоне, и при комнатной температуре (при t= 25оС) в зависимости от концентрации металла может быть оценена по формуле: pHMe(OH)2 = lg ПРMe(OH)2 − lg KH2O − lg aMez+ + 3 (3.1) Экспериментальные иссследования показывают, что в присутствии различных анионов (компоненты электролита) наблюдается смещение рН гидратообразования в сторону больших значений рН вследствие образования комплексных соединений. Кроме того, растворимость гидрооксидов повышается в присутствии фоновых солей и с ростом температуры, в то время как избыток ОН–понижает растворимость на порядок. Наличие комплексобразователей приводит к росту растворимости гидроксидов металлов и переводу их в комплексные соединения.С другой стороны, на практике отмечается низкая остаточная концентрация металлов в ионной форме вследствие эффекта их сорбции оксигидратами компонентов жидкости. Важное влияние на эффективность извлечения гидроокисей металлов окзывает рН среды. Согласно диаграмме Пурбе, большинство металлов характеризуется некоторым значением рН*, соответствующим минимальной растворимости их гидроксидов. Соответственно, если рН < рН*, в растворе наряду с гидроокисью металла присутствуют ионы металла Zn2+, Cd2+ и др., при рН > рН*, комплексные ионы ZnO22-, FeO22-, PbO22- и др. Таким образом, выбор значения рН для проведения процесса электрофлотации гидроксидов имеет решающее значение для эффективной 90 очистки. Важная роль в процессе электрофлотации принадлежит и состоянию поверхности гидроксида, т. е. строению двойного электрического слоя на его поверхности и положению соотвественно точки нулевого заряда. Степень извлечения гидроксидов металлов зависит от природы гидроксида, рН раствора, природы анионов и катионов и составляет 95-99%. Так, например, в присутствии ионов кальция, магния, хлорид-ионов, хлоратионов наблюдается снижение эффективности процесса флотации гидроксида кадмия. Флотационный процесс при концентрации 50-200 мг/л осуществляется за 2-3 мин (процесс отстаивания протекает несколько часов). Затраты энергии при электрофлотации составляют 0,1-0,3 кВт·ч /кг гидроксидов (электролиз и электродиализ 1-3 кВт·ч/кг). Электрофлотация может быть использована в процессах локальной очистки воды как от одного иона, так и в процессах, где в воде содержатся два и более вида ионов. Для очистки 150 м3/сутки требуется блок из двух электрофлотаторов, которые занимают площадь 2 м2 и имеют высоту 1,5 м. Для повышения степени очистки и умягчения воды в сточную воду вводят раствор щелочного реагента, содержащий фосфат-ионы, что приводит к образованию труднорастворимых соединений – гидроксифосфатов металлов Me3OH(PO4)n, растворимость которых меньше, чем растворимость соответствующих гидроксидов металлов. Фосфатированием достигается также большая стабильность воды, снижение ее коррозионного воздействия на металлические трубопроводы. 3− Кроме того, ионы ортофосфата PO4 и гидроксила OH–, имеющие отрицательный электрический заряд, обеспечивают нейтрализацию положительного электрического заряда частиц гидроксида металла, что позволяет инициировать процесс флокуляции, т. е. укрупнения частиц путем изменения сил межфазного взаимодействия. Увеличение размера частиц улучшает их способность к процессу флотации. Достигаемая при этом степень очистки от взвешенных частиц составляет 99,85–99,98 %. Глубокая очистка позволяет не прибегать к ионообменному умягчению. При использовании электрофлотатора жесткость воды снижается до 0,05-0,1 г-экв/м3, содержание тяжелых металлов – до 0,05–0,1 г/м3, органических примесей – до 30–50 г О2/м3 (по показателю ХПК). Использование нерастворимых анодов из титана с депассивирующим активным покрытием из смеси оксидов титана и рутения обеспечивает высокое качество очистки и не приводит к вторичному загрязнению очищаемых стоков продуктами разрушения анодов. В последнее время к использованию предлагаются установки, которые содержат камеру флотации и расположенный рядом с ней фильтр с загрузкой легче воды. Газонасыщение очищаемой воды осуществляется в смежно размещенном электрореакторе, который посредством 91 распределительной системы соединяется с камерой флотации. При плотностях тока 100-300 А/м2 степень насыщения жидкости пузырьками составляет 0,04–0,13 %, в некоторых конструкциях электрофлотатора может достигать 0,5–1,0 %. Размер пузырьков водорода зависит от краевого угла смачивания и кривизны поверхности электрода и составляет 20-100 мкм. Оптимальное значение плотности тока 200–260 А/м2. При расчете электрофлотатора определяющим является расход жидкости Qж, м3/ч, и время пребывания раствора в объеме электрофлотатора tобр. При заданных параметрах Qж и tобр полезный объем флотатора Vпол, м3, составит: Vпол = Qжtобр . (3.2) Для расчета необходимой площади поперечного сечения Fэлф, м2, используется соотношение F= Qж , v ⋅ 3600 (3.3) где v – скорость движения жидкости, м/с, которая выбирается в диапазоне 0,013-0,01. Высота электрофлотатора Hэлф, м, соответственно составит: H элф = Wпол . Fэлф (3.3) Оценку правильности принятых соотношений размеров можно провести по величине гидравлической нагрузки q, м 3 / м 2 ⋅ ч , которая в общем случае должна составлять 1,4–1,8 и которая определяется q= . 92 Qж . Fэлф 4. ИОНООБМЕННАЯ ВОДОПОГОТОВКА И ОЧИСТКА СТОЧНЫХ ВОД 4.1. Основные понятия из теории ионного обмена Ионообменная обработка сточных вод и электролитов гальванического производства основана на явлении избирательного обратимого обмена ионами между двумя фазами – фазой ионита и электролитом. Ионитами называются вещества, которые имеют в своем составе способные к ионизации (диссоциации) функциональные группы, связанные с жестким каркасом из органических или неорганических компонентов. Первоначально явления ионного обмена изучались на природных объектах – глинах, песках, природных цеолитах, затем были синтезированы неорганические иониты на основе алюмосиликатов и органические полимерные иониты. В настоящее время наибольшее технологическое применение находят синтетические органические ионообменники (ионообменные смолы). Это высокомолекулярные соединения, углеводородные радикалы которых образуют пространственную сетку (каркас, или матрицу) с фиксированными на ней ионообменными функциональными группами. Каркасом R синтетического ионообменника является сшитый полимер, например продукт сополимеризации стирола и дивинилбензола (рис. 4.1). ––CH2—CH—CH2—CH— ––CH2—CH—CH2—CH— Катионит 1 2 – Анионит 2 1 + SO3 Na CH2N+Me3Cl– —CH—CH2—CH—CH2—CH—CH2— —CH—CH2—CH—CH2—CH—CH2— 3 3 SO3–Na+ CH2N+Me3Cl– Рис. 4.1. Структура ионообменных смол на основе сополимеров стирола и дивинилбензола 1 – полимерная матрица (каркас); 2 – противоион; 3 – анкерный ион Функциональная группа состоит из закрепленного на матрице анкерного иона и противоиона. В качестве примеров функциональных 93 групп и соответствующих ионообменных материалов можно привести следующие: 1) для катионообменников (в Н-форме): – SO3H (сульфополистирольные смолы); – CO2H (карбоксилированные полиметакрилаты); – PO3H2 (полиалкилфосфонаты); 2) для анионообменников (в ОН-форме): – аммониевые основания –NR2Н(OH) (полистиролчетвертичное аммониевое основание); – аминогруппы различной степени замещения –NH3(OH), =NH2(OH), ≡NH(OH). В качестве противоионов могут выступать любые катионы (для катионитов) или анионы (для анионитов). Ионит в таком состоянии называется ионитом в солевой форме. Пример: сульфокатионит КУ-2 в Na-форме – R–SO3Na, где R – обозначение углеводородного каркаса; –SO3– – анкерный ион функциональной группы; Na+ – противоион. Величина рН электролита, при которой происходит обмен ионами, зависит от константы диссоциации ионообменных групп смолы. Сильнокислотные катиониты и сильноосновные аниониты позволяют проводить процесс при любом рН, а слабокислотные катиониты работают в щелочных и нейтральных средах, так как в кислых средах диссоциация функциональной группы подавлена. Слабоосновные аниониты пригодны для обработки кислых сред. Процесс обмена ионами между фазой ионита и электролитом можно рассматривать как обратимую химическую реакцию R–SO3B + А+ ↔ R–SO3А + B+ (4.1) Константа равновесия этой условной реакции, характеризующая глубину протекания процесса сорбции, может быть записана следующим образом: a (А)i a (B+ ) , K= a (A + ) a (B)i (4.2) где a(A)i, a(B)i – соответственно активности ионов А, B в ионите; a(B+), a(A+) – соответственно активности ионов А, B в электролите. Как и любая константа химического равновесия, константа равновесия ионного обмена зависит от температуры и природы взаимодействующих веществ (их термодинамических параметров). Следовательно, даже для одного и того же ионита степень сорбции различных ионов к моменту наступления состояния равновесия будет различной. 94 Функциональную взаимосвязь равновесной активности иона в ионите и равновесной активности иона в электролите (при постоянных температуре и давлении) называют изотермой ионного обмена. Изотермы обмена изображаются в безразмерных координатах dA′′ – dA, где dA′′ – эквивалентная доля иона А в фазе ионита; dA – эквивалентная доля иона А в электролите. Для расчета эквивалентных долей рассматриваемого иона в растворе и в ионите нужно определить равновесные активности всех ионов, способных к участию в реакции ионного обмена. Для разбавленных растворов активности можно заменить на концентрации, в фазе ионита концентрации приводятся в молях на 1 г ионита: dA = z (A)C (A + ) n ∑ zC j ; или d A′′ = z (A)C (A)i j =1 n ∑ zC ′′j , (4.3) j =1 где z(A) – заряд иона; C(A+), C(A)i – концентрации ионов в электролите и ионите соответственно; n ∑ zC j , j =1 n ∑ zC ′′ j =1 j – суммы эквивалентных концентраций ионов, участвующих в обменной реакции для электролита и ионита, соответственно. Отношение dA′′ dA называют коэффициентом распределения иона А при сорбции KрА. При KрА < 1 ионит обеднен, а при KрА > 1 обогащен компонентом А по сравнению с раствором в состоянии равновесия. Если в растворе содержится не один, а несколько ионов, например А и С, то селективность ионита оценивается коэффициентом селективности (избирательности) KА,С, равным отношению коэффициентов распределения конкурирующих ионов: K A,C = K рА K рС . (4.4) При KА,С < 1 ионит селективен к иону С; при KА,С > 1 избирательно сорбируется ион А. Как правило, ионы с большим зарядом обладают большей селективностью. Например, для катионов Me+ < Me2+ < Me3+ < Me4+ Более точно оценить селективность можно по общему ряду селективности. Например, для сильнокислотных сульфокатионитов: Li+ < H+ < Na+ < UO22+ < NH4+ < K+ < Cs+ < Mg2+ < Zn2+ < Co2+ < Cu2+ < < Ni2+ < Ca2+ < Cr3+ < Ag+ < Pb2+ < Ce3+ < La3+ < Ba2+ < Tl+ 95 В литературе приводятся ряды селективности для катионитов другого типа и для анионитов. Разработаны, но находят ограниченное применение иониты, которые содержат ионогенные группы, имеющие высокое сродство к одному или к определенной группе ионов, а также амфолиты, в определенных условиях выступающие либо как катионит, либо как анионит. В каркас амфолитов внедрены как катионообменные, так и анионообменные функциональные группы. Интересным приемом, позволяющим повысить степень сорбции иона и достичь более высоких степеней обессоливания раствора, является объединение в одну загрузку катионитов и анионитов в Н- и OH-формах. В процессе сорбции катионов и анионов выделяющиеся противоионы связываются в молекулу воды и равновесие ионного обмена смещается в сторону продуктов сорбции. Такие смеси целесообразно использовать при доочистке вод и глубокой деминерализации растворов. Они находят ограниченное применение вследствие сложности регенерации комбинированной загрузки. Очевидно, максимальное количество вещества поглощается ионитом по достижении системой равновесного состояния. В действительных проточных ионообменных установках такое состояние недостижимо, однако нужно создавать условия для приближения состояния процесса сорбции к равновесному. Время достижения состояния равновесия зависит от скорости процесса сорбции и определяет время контакта ионита с раствором в реальных ионообменных аппаратах, а следовательно, и их конструктивные особенности. Не рассматривая подробно вопросы кинетики ионного обмена, ограничимся качественным анализом происходящего. Процесс ионного обмена может быть представлен в виде нескольких последовательных стадий: 1) перенос ионов А к ионообменной функциональной группе: – перенос ионов из ядра потока жидкости к внешней поверхности диффузионного слоя; – диффузия ионов через диффузионный слой к поверхности ионита; – переход иона через границу раздела фаз в зерно смолы; – диффузия ионов внутри зерна к ионообменной функциональной группе; 2) химическая реакция обмена А – В; 3) перенос иона В от функциональной группы в объем раствора. Химическая реакция ионного обмена происходит быстро и не ограничивает суммарную скорость процесса. Скорость обмена определяется диффузией в жидкости либо в зерне ионита. При низких концентрациях вещества (менее 0,003 моль/л) лимитирующим является процесс диффузии 96 ионов через пленку жидкости (пограничный диффузионный слой), при концентрациях ≈0,1 моль/л скорость процесса зависит от скорости диффузии ионов внутри зерна (гелевая кинетика). Таким образом, ускорить процесс ионного обмена можно, оптимизируя следующие факторы: гидродинамический режим течения жидкости, концентрации активных ионов, состав и структуру зерен ионита. Основными характеристиками ионитов являются: – обменная емкость; – селективность; – механическая прочность; – осмотическая стабильность; – химическая стабильность; – температурная устойчивость; – гранулометрический (фракционный) состав. Обменная емкость – важнейшая характеристика ионита. Различают следующие виды емкостных характеристик: полная, статическая и динамическая обменная емкость. Полная обменная емкость (ПОЕ) определяется числом функциональных групп, способных к ионному обмену, в единице массы или объема воздушно-сухого (или набухшего) ионита (моль-экв/г или мольэкв/л). Она является постоянной величиной, которую указывают в паспорте ионита, и не зависит от концентрации или природы обменивающегося иона. ПОЕ может изменяться (снижаться) из-за термического, химического или радиационного воздействия. В реальных условиях эксплуатации ПОЕ уменьшается со временем вследствие старения матрицы ионита, необратимого поглощения ионов-отравителей (органики, железа и т. п.), которые блокируют функциональные группы. Статическая (равновесная) обменная емкость (СОЕ) находится как число молей эквивалентов иона, сорбированных единицей массы или объема воздушно-сухого (или набухшего) ионита к моменту наступления равновесия реакции обмена. Единицы измерения те же, что и для ПОЕ – моль-экв/г или моль-экв/л. СОЕ зависит от вида и концентрации ионов в электролите, рН, отношения объемов ионита и раствора при измерениях. Очевидно, эта величина меньше ПОЕ вследствие термодинамических особенностей процесса сорбции определенного вида иона и неравнодоступности функциональных групп в объеме гранул ионита. Именно эта величина необходима для проведения расчетов технологических процессов. Динамическая обменная емкость (ДОЕ), или емкость до «проскока», – важнейший показатель в процессах водоподготовки. Для иллюстрации физического смысла этого понятия следует рассмотреть работу простейшей ионообменной колонки (ионитового 97 фильтра), которая изображена на рис. 4.2, а и представляет собой цилиндрический корпус 1, в котором при помощи перфорированных пластин 2 удерживается загрузка ионита 3. L 2 τ2 > τ1 Cτ 2 (А + ) Сτ1 (H + ) I II 1 Сτ 2 (H + ) III 3 а б Cτ 2 (А + ) C0(А+) C Рис. 4.2. Простейшая ионообменная колонка (а) и распределение концентраций ионов в электролите по длине колонки (б): 1 – корпус; 2 – перфорированные перегородки; 3 – ионит Обрабатываемый поток с исходной концентрацией сорбируемого иона С (А ) подается в верхнюю часть колонки и проходит через слой ионита. Если ионит находился в Н-форме, то в результате обмена в потоке раствора снижается содержание ионов А+ и эквивалентно возрастает содержание ионов Н+ (согласно реакции (4.1)). В процессе работы колонки в объеме загрузки можно выделить три зоны (рис. 4.2, а): 1) ионит, полностью насыщенный сорбируемым ионом (мертвая зона) – область I; 2) зона реакции, или фронт обмена – область II; 3) ионит в Н-форме, находящийся в контакте с раствором, который не содержит сорбируемые ионы – область III. Распределение эквивалентных концентраций ионов А+ и Н+ в колонне в процессе сорбции (в моменты времени τ1 и τ2, причем τ2 > τ1) изображено на рис. 4.2, б. В процессе сорбции фронт обмена спускается все ниже и ниже и по истечении некоторого времени τпр достигнет выхода из колонки – наблюдается «проскок» ионов. Это происходит, как правило, задолго до полного насыщения ионита. Количество ионов, сорбированных за это время ионитом, отнесенное к единице его массы или объема, называется динамической обменной емкостью. 0 + 1 98 Рассмотрим зависимость концентрации ионов в фильтрате от времени сорбции (рис. 4.3). С III II IV 0 С (А) I П S τп τ Рис. 4.3. Зависимость концентрации ионов в фильтрате от времени сорбции Если скорость протока электролита постоянна, величины на оси Х пропорциональны объему раствора, пропущенному через ионит за время сорбции. В течение небольшого начального промежутка времени (область I) на выходе не фиксируются ни ионы А+, ни ионы Н+, так как происходит вытеснение воды, заполнявшей промежутки между зернами ионита. Далее концентрация продуктов обмена – ионов Н+ – резко возрастает, достигая значения исходной концентрации сорбируемых ионов. Эта концентрация остается постоянной (область II) до тех пор, пока фронт обмена не достигнет нижних частей колонки. Этот момент времени соответствует точке «проскока» сорбируемых ионов в фильтрат. Количество поглощенных ионов, эквивалентное площади прямоугольника П (произведение концентрации исходного раствора на его объем, пропущенный через колонку до точки «проскока»), отнесенное к объему ионита, называется динамической обменной емкостью (ДОЕ). В типовых процессах водоподготовки ДОЕ обычно не превышает 0,4–0,7 ПОЕ. В области III концентрация ионов А+ повышается до уровня, соответствующего концентрации ионов в исходном растворе, и эквивалентно снижается концентрация ионов Н+. Далее (область IV) концентрации растворов на входе и на выходе колонки равны, ионит не работает, так как достигается его полное насыщение и «проскок» ионов в фильтрат составляет 100%. Количество поглощенных ионов, соответствующее полному насыщению ионита, равно сумме ДОЕ и площади заштрихованной фигуры 99 над S-образной кривой рисунка 3. Это количество называется полной динамической обменной емкостью (ПДОЕ). Динамическая обменная емкость зависит от характеристик ионита и условий фильтрации, т. е. от конструкции установки и скорости протока. Следовательно, эти же параметры определяют длительность работы ионообменной колонны (ионитового фильтра) до регенерации. Подробно эта взаимосвязь, а также основы выбора и расчета схемы ионообменных установок приводятся в учебно-методическом пособии [1]. Селективность – способность избирательно сорбировать ионы из растворов сложного состава. Селективность зависит от типа ионогенных групп, числа поперечных связей матрицы ионита, размера пор и состава раствора. Для большинства ионитов селективность невелика, однако разработаны специальные образцы, имеющие высокую способность к извлечению определенных ионов. Механическая прочность показывает способность ионита противостоять механическим воздействиям. Иониты проверяются на истираемость в специальных мельницах или по весу груза, разрушающего определенное число частиц. Все полимеризационные иониты имеют высокую прочность. У поликонденсационных она существенно ниже. Увеличение степени сшивки полимера повышает его прочность, но ухудшает характеристики ионного обмена. Осмотическая стабильность. Наибольшее разрушение частиц ионитов происходит при изменении характеристик среды, в которой они находятся. Поскольку все иониты представляют собой структурированные гели, их объем зависит от солесодержания, рН среды и ионной формы ионита. При изменении этих показателей объем зерна меняется. Если набухший ионит перенести в какой-либо концентрированный раствор, то вследствие осмотических явлений вода (растворитель) будет переходить в электролит. Влагосодержание, а следовательно, и объем зерна ионита будет уменьшаться. Однако это изменение происходит не одновременно, а по мере выравнивания концентраций в «новом» растворе по объему зерна. Поэтому внешний слой сжимается или расширяется быстрее, чем ядро частицы; возникают большие внутренние напряжения и происходит откалывание верхнего слоя или раскалывание всего зерна. Это явление называется «осмотический шок». Каждый ионит способен выдерживать определенное число циклов таких изменений характеристик среды. Это называется его осмотической прочностью, или стабильностью. Наибольшее изменение объема происходит у слабокислотных катионитов. Наличие в структуре зерен ионита макропор увеличивает его рабочую поверхность, ускоряет процесс изменения объема частицы и дает возможность «дышать» отдельным слоям. Поэтому лучшей осмотической стабильностью обладают сильнокислотные катиониты макропористой структуры, худшей – слабокислотные катиониты. 100 Осмотическая стабильность определяется как количество целых зерен, отнесенное к общему первоначальному их числу, после многократной (150 раз) обработки навески ионита попеременно в растворе кислоты и щелочи с промежуточной отмывкой обессоленной водой. Химическая стабильность. Все иониты обладают определенной стойкостью к растворам кислот, щелочей и окислителей. Все полимеризационные иониты имеют большую химическую стойкость, чем поликонденсационные. Катиониты более стойки, чем аниониты. Среди анионитов слабоосновные устойчивее к действию кислот, щелочей и окислителей, чем сильноосновные. Температурная устойчивость катионитов выше, чем анионитов. Слабокислотные катиониты работоспособны при температуре до 130°С, сильнокислотные типа КУ-2-8 – до 100–120°С, а большинство анионитов – не выше 60°С, максимум 80°С. При этом, как правило, Н- или ОН-формы ионитов менее стойки, чем солевые. Фракционный состав. Синтетические иониты полимеризационного типа производятся в виде шарообразных частиц размером в диапазоне от 0,3 до 2,0 мм. Поликонденсационные иониты выпускаются в виде дробленых частиц неправильной формы размером 0,4–2,0 мм. Стандартные иониты полимеризационного типа имеют размер от 0,3 до 1,2 мм. Средний размер полимеризационных ионитов составляет от 0,5 до 0,7 мм (рис. 4.4). Коэффициент размерной неоднородности не превышает величины 1,9. Этим обеспечивается приемлемое гидравлическое сопротивление слоя. Число гранул 2 1 300 600 900 1200 d, мкм Рис. 4.4. Фракционный состав ионитов: 1 – обычный ионит; 2 – моносферный ионит Процесс обработки растворов в ионитовых фильтрах периодического действия различной конструкции складывается из следующих основных последовательно выполняемых операций: фильтрование (сорбция), взрыхление фильтрующего слоя, регенерация ионита, отмывка. Взрыхление 101 фильтрующего слоя преследует цель снижения гидравлического сопротивления загрузки и удаления расколотых зерен ионита. Регенерация ионитов – процесс, обратный процессу сорбции, возвращает ионит в исходное состояние, обеспечивая его многократное использование. Регенерация катионитов проводится, как правило, растворами сильных кислот (HCl, H2SO4) с концентрацией ≈5 н., для анионитов применяют ≈3 н. сильные основания (NaOH). Регенерат содержит в сконцентрированном виде все компоненты, сорбированные ионитом в рабочий период, и может быть направлен на утилизацию ценных компонентов (например, селективное извлечение ионов металла) либо на станцию обезвреживания стоков. Отмывка ионита от кислоты или щелочи (от регенерирующего раствора) проводится с целью обеспечения нормального режима сорбции для первых порций растворов, поступающих на ионитовый фильтр в следующем сорбционном цикле. Создавая различные схемы движения потоков через ионообменные смолы, можно реализовать: – утилизацию Cu, Ni, Ag и др. из промывных вод и других низкоконцентрированных стоков при содержании их менее 0,1 моль/л; – глубокую деминерализацию сточных вод предприятия и возврат их в производство; – умягчение воды для питания паросиловых установок; – снижение солесодержания на станциях водоподготовки; – обезвреживание растворов сорбцией токсичных компонентов с последующим их концентрированием и нейтрализацией; – концентрирование локальных стоков гальванических операций и возврат их в производство; – регенерацию или очистку рабочих электролитов за счет селективной сорбции примесных катионов или анионов ионитами, химически инертными в обрабатываемом растворе. Описание конструктивных особенностей аппаратов, примеры организации технологических схем обработки растворов приводятся в пособии [1] и другой справочной и специальной литературе. 4.2. Ионообменная очистка сточных вод Очистка сточных вод на ионообменных установках основана на способности ионообменных материалов (смол) при контакте с растворами осуществлять обмен подвижными противоионами, закрепленными в фазе ионита, на эквивалентное количество ионов раствора. Для создания систем замкнутого водоснабжения гальванических производств необходимо постоянное удаление солей, поступающих из технологических процессов. Среди известных способов обессоливания: 102 дистилляция, электродиализ, обратный осмос (гиперфильтрация), ионный обмен – при больших расходах сточных вод и содержании солей до 2-3 г/л (что наиболее характерно для сточных вод гальванических производств) наиболее реально применение последнего. При этом процесс обессоливания позволяет одновременно подвергать воду очистке от ионов металлов и других токсичных примесей. Технология ионообменной очистки сточных вод гальванических производств реализуется в нескольких вариантах: 1. Локальная очистка промывных вод, сбрасываемых от отдельных технологических процессов, с утилизацией извлекаемых компонентов в этих же процессах и использованием воды в обороте; (например, ионообменное концентрирование никеля из сточных вод никелирования с возвратом в технологический цикл сульфата никеля или хромирования с переработкой элюатов на хромовую кислоту или утилизацией в процессах пассивирования); 2. Очистка общего потока промывных сточных вод от токсичных примесей с последующим обезвреживанием элюатов вместе с отрабатанными электролитами и использование воды в обороте; 3. Очистка отдельных категорий сточных вод с последующим их обессоливанием для возврата в производство и обработка элюатов. В условиях существующих систем водоотведения и канализирования на действующих предприятиях наиболее рациональным является третий вариант, так как реализация первого требует создания сложных систем трубопроводных сетей. Второе направление вызывает необходимость двухступенчатого анионирования всех сточных вод с использованием слабо- и сильноосновных анионитов, стойких к окислителям. Внедрение установок с такой технологией усложняет систему обезвреживания элюатов с многократным подщелачиванием и подкислением их, что ведет к перерасходу реагентов и увеличивает сброс абсолютного количества солей. При больших объемах сточных вод процесс ионообменной очистки осуществляется в аппаратах, которые называют ионитными фильтрами. При небольших объемах сточных вод процесс очистки может осуществляется в ионообменных колонках. Конструктивное исполнение ионитных фильтров может быть различным, но все они унифицированы по геометрическим размерам и по различным дополнительным устройствам и вспомогательной аппаратуре. Все ионитные фильтры классифицируются по следующим признакам: – по обмениваемому иону на катионитные, анионитные, фильтры смешанного действия (осуществлена одновременная загрузка катионита и анионита); – по фракционному составу на насыпные и намывные; – по способу проведения регенерации на параллельно-точные, противоточные, ступенчато-противоточные ****; 103 – по технологическому применению на фильтры 1, 2 ,3 и т.д. ступеней. **** При параллельно – точном способе регенерации обрабатываемую воду и регенерационный раствор пропускают в одном и том же направлении, при противоточном – в противоположных направлениях, ступенчато - противоточный способ регенерации применяют в схемах, предусматривающих обработку воды на фильтрах различных ступеней. *** Регенерацию фильтров смешанного действия проводят после разделения ионообменных смол на катионит и анионит. Конструктивно ионитные фильтры состоят из корпуса, нижнего и верхнего дренажно-распределительного устройств, трубопроводов, арматуры, устройств для отбора на анализ проб воды (рис. 4.5). Рис. 4.5. Фильтр ионитный параллельно-точный 2-й ступени ФИПаП2,6-0,6: 1 – подвод исходной и отмывочной воды; 2 – отвод обработанной воды; 3 – подвод регенерационного раствора; 4 – подвод взрыхляющей воды; 5 – гидрозагрузка фильтрующего материала; 6 – гидровыгрузка фильтрующего материала; 7-отвод регенерационного раствора, отмывочной воды и первого фильтрата; 8 – отвод взрыхляющей воды Корпус представляет собой цилиндр с приваренными к нему 104 эллиптическими днищами – верхним и нижним. Корпус фильтра снабжается двумя люками: верхний предназначен для загрузки ионита и осмотра и ремонта верхнего дренажно-распределительного устройства, а нижний – для монтажных работ внутри фильтра и ремонта нижнего дренажнораспределительного устройства. Верхнее дренажно-распределительное устройство служит для подачи в фильтр и равномерного распределения по площади поперечного сечения обрабатываемой воды и регенерационного раствора. Оно представляет собой вертикально расположенный отрезок трубы- коллектора 1, изготовленной из полиэтилена и заглушенной снизу. В отверстия коллектора вставлены радиально расположенные перфорированные трубылучи, наружные концы которых заглушены и прикреплены к внутренней поверхности корпуса фильтра. Лучи расположены так, чтобы их отверстия были направлены кверху. Нижнее дренажно-распределительное устройство предназначено для сбора и отвода из фильтра обрабатываемой воды и регенерационного раствора, а также для равномерного распределения по площади поперечного сечения взрыхляющей воды. По способу регенерации бывают фильтры с внутренней и наружной регенерацией (ФИСВР и ФИСНР). Чаще используют ФИСВР. В процессе регенерации ионит взрыхляется потоком воды снизу вверх для устранения слеживаемости ионита. Для фильтров смешанного действия перед регенерацией происходит разделением ионита на катионит (нижний слой) и анионит (верхний слой). Это возможно вследствие различной плотности катионообменных и анионообменных смол. Регенерационные растворы в этом случае пропускают одновременно или поочередно. При обработке больших объемов сточных вод используют ионитные фильтры со следующими техническими характеристиками: диаметр – 10003400 мм, площадь фильтрования – 0,785- 9,1 м 2 , высота слоя ионита – 2 2,5 м, объем ионита – 1,6 – 22,75 м3 . Технология очистки сточных вод с использованием ионообменных установок зависит от состава сточных вод. Если в воде присутствует несколько катионов или анионов системы рассчитываются как однокомпонентные по наименее сорбируемым ионам. Расчетная концентрация принимается равной суммарной концентрации катионов и анионов. Емкость ионита при расчете принимается равной емкости по наименее сорбируемым ионам. Перед подачей воды на ионообменную очистку вода предварительно должна пройти механическую и адсорбционную очистку до уровня: содержание взвешенных веществ не должно превышать 8 мг/л, величина ХПК не должна быть более 8 мг/л. В зависимости от ионного состава сточных вод реализуется различная система ионообменной очистки сточных вод. Так, очистка от ионов двух- и трехвалентных ионов при малом содержании ионов щелочных металлов и 105 аммония, анионов сильных кислот осуществляется по одноступенчатой схеме с последовательным фильтрованием через катионит и анионит. При этом могут использоваться аниониты типа АН-18-10П, АН-251, АВ-17, стойкие к окислительному действию указанных ионов. Если требуется очистка от анионов слабых кислот, то схема анионирования содержит анионитные фильтры первой (с низкоосновным анионитом) и второй (с высокоосновным ионитом) ступеней. При большом содержании в очищаемой воде ионов щелочных и двух – и трехвалентных металлов требуется двухступенчатое последовательное катионирование. Если требуется получение особо чистой воды или стабилизация значения рН, то последней ступенью ИО выступает или устанавливается вместо АН-фильтра фильтр смешанного действия (ФСД). Дополнительно схема содержит устройства для механической очистки сточных и для удаления из сточных вод углекислого газа. Для определения наименее сорбируемых ионов построен ряд селективности по энергиям вытеснения ионов друг другом. Для сильнокислотного катионита КУ-2-8 (функциональная сульфогруппа) он выглядит следующим образом: H+ < Na+ < NH4+ < Mg2+ < Zn2+ < Co2+ <Cu2+ <Cd2+ < Ni2+ < Ca2+ < Pb2+ < Ba2+ < Sr2+ Сильнокислотные катиониты (универсальные) – катиониты, способные диссоциировать в широком диапазоне рН. Аниониты, обладающие высокой степенью ионизации – высокоосновные аниониты. Для катионитов, содержащих карбоксильную и фосфорнокислую группу(катиониты типа КБ и КФ), ряд селективности следующий: Zn2+ > Cu2+ >Ni2+ >Cd 2+ >Sr2+ >Ba2+ >Li + >Na+ >K+ >Rb+ >Cs+ Селективность сильноосновных ионитов (например, содержащих аммониевые группы, уменьшается в ряду: АВ-17) SO42- > I- > NO3- > CrO4 2- > Br- > Cl- > FСлабоосновные аниониты проявляют повышенную селективность к иону гидроксила: OH– > SO42- > CrO4 2- > NO3- > Br- > Cl- > FПроцесс очистки воды в ионитных фильтрах складывается из следующих последовательно осуществляемых стадий: фильтрование (ионообменная сорбция), взрыхление фильтрующего слоя, регенерация, 106 отмывка. Один из основных параметров процесса ионообменной очистки является скорость фильтрования. При ее выборе нужно принимать во внимание следующие обстоятельства: – увеличение скорости фильтрования повышает производительность процесса, но уменьшает время работы ионитного фильтра (происходит более быстрое исчерпание емкости); – увеличение скорости фильтрования приводит к росту гидравлического сопротивления слоя ионита и снижению экономичности процесса. При расчете стадии ионного обмена рекомендуется принимать следующие технологические данные: – скорость фильтрования (υф, м/ч) для катионитного фильтра 1 ступени – 10-20; – скорость фильтрования для H - катионитного фильтра 1 ступени – 10-20; –Na – катионитный фильтр 2 ступени – около 40; –H – катионитный фильтр 2 ступени – около 30; – OH – анионитный фильтр 1 ступени – 20; – OH – анионитный фильтр 2 ступени – 30. Скорость фильтрования на 2 ступени может быть выше, поскольку содержание загрязнений в воде, поступающей на 2 ступень ниже. При заданной производительности Qж, м3/ч, на стадии проектирования вначале рассчитывается общая требуемая площадь фильтрования: Fф = Qж vф (4.5) где Fф – общая площадь фильтрования, м2; vф – скорость пропускания обрабатываемой жидкости, м/ч. Зная общую площадь фильтрования и характеристики стандартных фильтров: площадь фильтрования f, м2; диаметр фильтра d, м, определяется количество фильтров nф, находящихся в работе на данной ступени ионообменной очистки: nф = Fф f . С учетом количества выбранных действительная скорость фильтрования vф': vф′ = 107 Qж fn (4.6) фильтров уточняется (4.7) Для выбранного типа ионообменной смолы со значением рабочей кг-экв/м3, становится возможным определение емкости Ераб, продолжительности работы фильтра t, ч, до проскока концентраций: t= H сл Eраб vф′ ∑ Co (4.8) где H – высота рабочего слоя ионита в фильтре, обычно 1,5–2,5м; ∑Cо – суммарная концентрация загрязнений, кг–экв. Если ионитный фильтр работает до полного исчерпания обменной емкости, в расчетах необходимо использовать значение полной обменной емкости. При заданном времени работы фильтра до проскока концентраций можно решать нескольку иную задачу, а именно: определить необходимые геометрические размеры ионитного фильтра, при применении которого будут достигнуты требуемые параметры очистки. Для этого, зная количественный состав обрабатываемой жидкости и ее расход, используя соотношение Wионита = t ⋅ Qж ⋅ ∑ Cо E раб , (4.9) где Wионита – объем загрузки ионообменного материала, м3, необходимый для достижения требуемой степени очистки. Исходя из объема ионита, можно оценить высоту его слоя: H сл = Wионита Fф . (4.10) Необходимую площадь фильтрования при этом рассчитывают из основного уравнения расхода: Fф = Qж . vф (4.11) С другой стороны Fф = πd2 4 , откуда может быть определен диаметр d, м, ионитного фильтра. 108 (4.12) Соотношение между высотой слоя ионита, диаметром ионитного фильтра и площадью его поперечного сечения необходимо оценить на основании имеющихся практических или экспериментальных параметров ведения процесса. Для успешного проведения стадии регенерации необходима стадия взрыхления слоя ионита, которая осуществляется путем подачи воды с определенной интенсивностью по схеме «снизу-вверх» и которая преследует цель перевести ионит во взвешенное состояние и обеспечить вынос мелких фракций ионообменной смолы. Расход воды на взрыхление слоя ионита Vвзр, м3 на регенерацию, рассчитывают по уравнению: Vвзр = fitвзр ⋅ 60 1000 , (4.13) где i – интенсивность взрыхления, л/м2 · с; tвзр – продолжительность взрыхления, мин. Для большинства применяемых на стадии ионообменной очистки материалов интенсивность взрыхления составляет около 3 л/м2·с. Продолжительность взрыхления tвзр в зависимости от физико-химических характеристик ионообменного материала изменяется в пределах 3–15 мин (для КУ-2, АВ-17,АН-31 – 3 мин, для сульфоугля – 15 мин). Для расчета стадии регенерации применяется следующая последовательность. Исходя из удельных норм расхода 100% реагента вначале подсчитывают его количество на одну регенерацию (кг/регенерацию): m = fHb , (4.14) где b – удельная норма расхода 100% реагента, кг/м3 ионообменной смолы. В зависимости от ступени ионообменной очистки и формы, в которой находится ионообменный материал, удельные нормы изменяются следующим образом: Ионитный Na-К, фильтр I ступень 6,0 b Na-К, сульфоуголь 45 Н-К, 1ст 25 Н-К, 2ст 50 ОН-А, 1 ст 50 ОН-А, 2 ст 120 В общем случае, расход регенерационного раствора составляет 2,5-3,0 г-экв / г-экв сорбированных ионов. Поскольку для приготовления регенерационных растворов используют технические реагенты с определенной долей основного вещества, то необходим пересчет на количество технического реагента, который может быть выполнен в соответствии с уравнением: 109 mт.р. = mn ⋅ 100 ω , (4.15) где ω – массовая концентрация технического реагента (для NaCl – 93%, для H2SO4 – 92%, для NaOH – 42%). Расход воды для приготовления раствора необходимой концентрации составит: VH 2O = m ⋅ 100 , ω р.р-ра ρ р.р-ра (4.16) где ρр.р-ра – плотность регенерационного раствора, кг/м3. Поскольку скорость пропуска регенерационного раствора составляет около 5 м/ч, то время пропускания можно оценить из соотношения: tр.р-ра = Vр.р-ра vр.р-ра (4.17) Основным препятствием на пути широкого применения ионообменного метода очистки сточных вод является высокая стоимость ионообменных материалов и проблема утилизации элюатов, т.е. растворов, получаемых на стадии регенерации. При решении «проблемы элюатов» ионообменный метод с экологической точки зрения наносит вред окружающей среде, так как с элюатами может сбрасываться в несколько раз больше солей, чем их содержится в обрабатываемых стоках. Это обусловлено тем, что для достижения необходимой степени регенерации ионитов требуется расход регенерирующих агентов в 2-3 раза больший теоретического количества. Одно из направлений решения указанных выше проблем – использование комбинации методов, например ионный обмен – электролиз. Однако стадия электролиза также предъявляет свои требования к содержанию компонентов в составе элюатов. Поэтому в каждом конкретном случае сочетание отмеченных методов требует подбора оптимальных технологических параметров. Так, например, для извлечения меди предлагается использовать катионит КБ-4П-2 в натриевой форме по схеме двухступенчатого катионирования. Для регенерации катионита применяют раствор, содержащий 1,5 кмоль/м3 серной кислоты. Стадия регенерация осуществляется с порционным отбором раствора в следующей последовательности: – 1 порция содержит 0,75 объема регенерационного раствора на один 110 объем загруженного катионита, получаемая концентрация по ионам меди составляет 45-60 г/л (в пересчете на CuSO4 – 170-240 г/л), такой раствор может быть использован для корректировки гальванических ванн; – 2 порция, получаемая пропусканием 0,5 объема/объем загруженного катионита, содержит в своем составе 20 г/л ионов Cu2+ и около 60 г/л H2SO4 и может быть подвергнута обработке методом электролиза с целью извлечения в компактной форме металлической меди; – 3 порция в объеме 0,75 регенерационного раствора на 1 объем загруженного катионита содержит до 140 г/л H2SO4 и около 2–3 г/л Cu2+. Переработка такого раствора не оправдана экономически, поэтому содержание H2SO4 доводится до 150 г/л и полученный раствор используется при проведении последующей регенерации. При утилизации никеля последовательность операций составляет: фильтрацию для удаления механических примесей, сорбционную очистку от ПАВ, ионообменную сорбцию никеля, регенерацию катионита и фильтрацию от ионитовой пыли и последующий электролиз элюатов. При механической фильтрации используют намотанный полипропилен с порами диаметром 2-10 мкм. На стадии сорбции применяется катионит КУ-1 в Na+–форме. Использование катионита в Н+–форме более эффективно, но в процессе регенерации получаются более кислые элюаты, которые труднее подвергать электролитическому извлечению никеля. Скорость пропускания раствора – 0,5 м3/м2 ч при использовании емкости до проскока. При этом ДОЭ составляет 60 г/л набухшей ионообменной смолы. Для эффективной ионообменной очистки содержание ионов никеля в исходном растворе не должно превышать 0,75 г/л. Регенерация осуществляется раствором сульфата натрия концентрацией 50 г/л. При скорости регенерации 0,25-0,5 м3/м2 ч степень извлечения составляет 90%. На стадию электролиза поступает раствор, содержащий 4,75-5,25 г/л сульфата никеля и 30-35 г/л сульфата натрия. Электролиз проводят при плотности тока 0,66 А/дм2, температуре около 600С и рН 2,0-2,2 единицы. Для извлечения анионов кислот применяются аниониты с различными функциональными группами. При этом бораты хорошо сорбируются на АН31, фосфаты – на АВ-17. Показатель ДОЭ составляет 2,06 мг-экв/г сухой смолы по боратам, 3,67 мг-экв/г сухой смолы по фосфатам. Скорость фильтрования достигает до 3 м/ч, скорость десорбции – 1.5 м/ч. Концентрация боратов 1,5-3,0 %, фосфатов – 2,5-4,0%. Методы ионообменной очистки с использованием анионитов АВ-17 и АН-18 позволяют удалять шестивалентный хром до любой заданной концентрации. Десорбция хрома при этом не более 70-80 % при 5-6 кратном расходе щелочи против теоретического количества. Из-за повышенного содержания избыточной щелочи утилизация образующихся элюатов затруднена. Был разработан способ селективного извлечения хроматов на слабоосновном анионите АН-251 в сульфатной форме. Это смола обладает 111 высокой динамической емкостью и селективностью к бихромат-ионам, что позволяет при ее регенерации получить относительно чистые и концентрированные фракции элюатов с содержанием хрома (VI) до 30 г/л. Такие растворы можно использовать в технологических процессах гальванических производств (пассивирование). Для утилизации элюатов предлагается также использовать регенерационные растворы на основе азотной кислоты для катионитовых фильтров и водные растворы аммиака для регенерации анионитовых фильтров. Это позволяет, основываясь на свойствах цветных металлов в аммиачной среде образовывать растворимые комплексы типа [Ме(NH3)4]2+, отделять их от выпадающих в щелочной среде гидроксидов железа, кальция, магния, хрома (III). При разрушении аммиакатных комплексов осаждаются гидроксиды цветных металлов, которые могут быть использованы в качестве сырься для предприятий цветной металлургии. Осветленный же раствор подвергается упариванию. Выкристаллизовавшийся нитрат аммония утилизируется как удобрение. Осадок, отделяемый на первой стадии, может применяться при изготовлении строительной керамики. 112 5. ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ КОМПОНЕНТОВ СТОЧНЫХ ВОД Процессы электрохимической обработки стоков разработаны для очистки от токсичных неорганических примесей (цианиды, роданиды, амины, сульфиды), а также для удаления трудноокисляющихся органических соединений (спирты, нитросоединения, азокрасители, меркаптаны и др.). В процессах электрохимического окисления вещества, находящиеся в сточных водах, полностью распадаются с образованием СО2, NH3 и воды или образуют более простые и нетоксичные вещества, которые можно удалять другими методами. В качестве анодов используют нерастворимые материалы: графит, магнетит, оксиды свинца, марганца, рутения, иридия, которые в индивидуальном виде или в смеси с диоксидом титана наносят на титановую основу (ОРТА и др.). Достаточно редко, ввиду дороговизны материала, применяют платину или платинированный титан (ПТА). Катоды изготавливают из материалов, обеспечивающих длительный срок службы: молибден, графит, нержавеющая сталь, а также другие стали, покрытые молибденом, вольфрамом или их сплавами. Процесс проводят в электролизерах различного конструктивного исполнения: с разделением электродных пространств и без разделения. Реакции электрохимического окисления и восстановления включают в себя широкий круг процессов – от осаждения металлов до сложных превращений, лежащих в основе органического синтеза. Механизмы анодного окисления и восстановления, следовательно, и продукты реакции, зависят от материала электродов, температуры и состава электролита (кислотности среды, наличия посторонних веществ ионного или молекулярного типа (ингибиторов, катализаторов и др.)). Рассмотрим наиболее распространенные реакции окисления неоргинических веществ в отсутствии компонентов, влияющих на ход процесса. В таких условиях окисление может происходить либо при непосредственном электродном разряде частицы, либо при окислении ее в объеме электролита активными формами кислорода, образующимися на аноде при окислении молекул воды или ионов ОН–: (5.1) 4OH- – 4e → 2H2O +O2. – Аммиак (NH3), нитриты (NО2 ), сероводород (Н2S) в анодной камере разрушаются в соответствии с реакциями: 2NН3 – 6е → N2 + 6Н+, (5.2) – NО2 +2ОН – 2е → NО3 + Н2О, (5.3) + Н2S – 2е → S + 2Н (при рН < 7). (5.4) В нейтральных и щелочных средах сульфиды окисляются, как правило, до сульфат–анионов. 113 Сточные воды, содержащие цианиды, образуются на предприятиях машиностроения, черной и цветной металлургии, химической промышленности и др. В состав вод кроме простых цианидов (KCN, NaCN) входят комплексные соединения цинка, меди, никеля, других металлов, концентрация которых колеблется от 10 до 600 мг/л, при рН сточной воды 8–12. Эти комплексы достаточно устойчивы и затрудняют реагентную очистку стоков. Схема установки для электрохимической очистки сточных вод от цианидов приведена на рис. 5.1. Рис. 5.1о. Схема установки электрохимической очистки сточных вод от цианидов соединений:1 - усреднитель: 2 — бак для приготовления раствора хлорида натрия: 3 — электролизер; 4 - источник постоянного тока Цианид-ионы (СN–) или комплексные ионы цианидов ([Сu(CN)3]2–, [Zn(CN)4]2–, [Сu(CN)4]2– и др.) в процессе анодной обработки распадаются с образованием неустойчивых цианат-анионов: СN– +2ОН– – 2е → CNO– + Н2O, (5.5) 2– – + – [Сu(СN)3] + 6ОН – 6е → Сu + 3CNO + 3Н2О, (5.6) 2– + – CNO + 2H2O → СО3 + NН4 . (5.7) – Электрохимическое окисление CNO может быть проведено с образованием безопасных продуктов: 2СNO– + 4ОН– – 6е → 2СО2+ N2 + 2Н2О. (5.8) Роданид–ионы разрушаются по схеме: СNS– + 10ОН– – 8е → СNО– + SO42– + 5Н2О. (5.9) Сведения по анодному окислению различных органических веществ позволяют определить возможность применения электрохимического способа для глубокой деструкции трудноокисляемых органических соединений. При переходе электронов из органических соединений на анод обычно возрастает число и кратность кислородсодержащих связей (С-О, N- 114 О, S-O и т.п.), либо уменьшается число водородсодержащих связей (С-Н, NН, S-Н и т.п.), например: RСНО → RСООН; (5.10) R2СНСНR2 → R2С=СR2. (5.11) Разрушение формальдегида (НСНО), метилового спирта (СН3ОН), карбамида ((NН2)2СО) происходит до нетоксичных веществ в соответствии со следующими реакциями: НСНО + 2Н2О – 4е → СО32– + 6Н+; (5.12) 2– + СН3ОН + 2Н2О – 6е → СО3 + 8Н ; (5.13) + (NН2)2СО + Н2О – 6е → N2 + СО2 + 6Н . (5.14) – Образующиеся в ходе реакций промежуточные продукты (НСОО и др.) также разлагаются: НСОО– + Н2О – 2е → СО32- + 3Н+. (5.15) Деструкция фенолов при анодной обработке происходит с образованием неопасного продукта – малеиновой кислоты: С6Н5ОН +16ОН– – 16е → НО2ССН=СНСО2Н (цис)+2СО2+5Н2О. (5.16) На анодах с высоким перенапряжением выделения кислорода могут образовываться пассивирующие пленки полифенола, промежуточными продуктами окисления также могут быть бензохиноны, окрашивающие раствор в коричневый цвет, и др. При полном окислении фенолов конечными продуктами являются углекислый газ и вода. Интенсификации процесса окисления способствует введение в обрабатываемую воду хлорид–ионов. При этом к рассматриваемым выше реакциям выделения кислорода, а также адсорбции и окисления компонентов электролита добавляется реакция окисления хлорид–ионов. В сильнокислых средах на аноде образуется газообразный хлор, который выделяется в атмосферу, оказывая слабое активирующее действие на обрабатываемую воду: 2Cl- – 2e- → Cl2. (5.17) В слабокислой, нейтральной и щелочной средах хлор диспропорционирует с образованием, в зависимости от рН, хлорноватистой кислоты или гипохлорит–аниона: (5.18) Cl2 + H2O → HClO + HCl, (5.19) HClO + OH → H2O + ClO . При продолжительном электролизе таких растворов образуются соединения хлора с более высокими степенями окисления: (5.20) 12ClO- + 6H2O – 12e → 4HClO3 + 8HCl + 3O2. Тогда, как термин «активный хлор» включает в себя молекулярный и атомарный хлор, хлорноватистую кислоту и гипохлориты. Соотношение содержания различных форм хлора в воде в зависимости от рН приведены на рис. 5.2. 115 Рис. 5.2. Соотношение различных форм хлора в воде в зависимости от рН В чистых растворах реакция разложения гипохлоритов сопровождается образованием хлоратов, причем образование кислорода в результате разложения HClO термодинамически менее вероятно, чем такой же процесс разложения ClO–. Наиболее активны области с близким содержанием хлорноватистой кислоты и гипохлорит–иона, для которых характерен процесс: (5.21) ClO- + HClO → 2[O] + 2Cl- + H+. Например, окисление фенолов в присутствии хлоридов в сточной воде протекает по схеме: 2Cl- – 2e- → Cl2. Cl2 + H2O → HClO + HCl, (5.22) HClO + OH- → H2O + ClO-, + ClO + HClO → 2[O] + 2Cl + H , C6H5OH + 14[O] → 6CO2 + 3H2O. В этом случае процесс окисления характеризуется меньшими затратами электроэнергии и более высокими скоростями. Электродный материал должен обеспечивать высокий выход по току окисления хлоридов. Достаточно эффективно работает графит, хотя гораздо лучшими характеристиками обладают оксидные электродные материалы на титановой основе, например, ОРТА. C другой стороны разрушение цианидов в присутствии хлоридов может протекает с участием активного хлора. В упрощенном виде реакции можно записать так: 2Cl– – 2e- → Cl2, (5.23) СN– + Cl2 + 2ОН– → CNO– + 2Cl– + Н2O, 116 2СNO– + 4ОН– +3Cl2 → 2СО2+ N2 + 6Cl- + 2Н2О. В растворах после обработки остается остаточный активный хлор в концентрациях до 300 мг/л, который должен быть удален на последующих стадиях очистки воды. Катодное восстановление применяют для удаления из сточных вод ионов тяжелых металлов с получением осадков и дальнейшей их утилизацией, а также для перевода загрязняющего компонента в менее токсичные соединения или в легковыводимую из воды форму (осадок, газ). Катодное восстановление металлов происходит по схеме: (5.24) Men+ + ne → Me. При этом, чем ниже концентрация иона металла и выше кислотность среды, тем меньше выход по току целевого продукта и, соответственно, выше удельные энергозатраты на обработку сточных вод. Очистку сточных вод от ионов Hg2+, Pb2+, Cd2+, Cu2+ проводят на катодах, состоящих из смеси угольного и сернистого порошков в соотношении C:S от 80:20 до 20:80 при рН < 7 и плотности тока 2,5 А/дм2. Осаждение этих ионов происходит в виде нерастворимых сульфидов или гидросульфидов, отделяемых механически. Катодное восстановление соединений шестивалентного хрома до соединений Cr (III) эффективно в растворах с содержанием исходного компонента не менее 1 г/л, оптимальное значение рН равно 2, катодная плотность тока 0,2–2 А/дм2. При этом на катоде протекает следующая реакция: Cr2O 72− + 14H+ + 6e– → 2Cr3+ + 7H2O. (5.25) Примером реакции, обеспечивающей удаление загрязнения в газовую фазу, является очистка от нитрата аммония. При восстановлении нитрата аммония на графитовом электроде он превращается в нитрит аммония, который разлагается при нагревании до элементарного азота: (5.26) NH4NO3 + 2H+ + 2e → NH4NO2 + H2O, (5.27) NH4NO2 → N2 + 2H2O. Катодное восстановление органических соединений заключается в снижении числа и кратности кислородсодержащих связей (С-О, N-О, S-O и т.п.), либо увеличении числа водородсодержащих связей (С-Н, N-Н, S-Н). Это наблюдается при катодном восстановлении альдегидов и кетонов до спиртов и углеводородов. Потеря атома галогена снижает токсичность галогензамещенных органических веществ: (5.28) R–H + H+ + 2e → R–H + Cl–. Повышенную токсичность органических соединений связывают с наличием в молекуле амино-, нитрогрупп, которые при восстановлении теряют токсичные свойства. 117 6. ЭЛЕКТРОХИМИЧЕСКОЕ ОБЕЗЗАРАЖИВАНИЕ ПРИРОДНЫХ И СТОЧНЫХ ВОД Обеззараживание – очистка воды от бактериальных и вирусных загрязнений, приводящих к развитию инфекционных заболеваний. Основные методы обеззараживания воды – хлорирование, обработка ультрафиолетовым излучением и озонирование. Для обеззараживания воды хлорированием на водоочистных комплексах используют хлорсодержащие реагенты (хлор, диоксид хлора, хлорную известь, гипохлориты кальция и натрия и др.). Бактерии, находящиеся в воде, погибают вследствие окисления веществ, входящих в состав протоплазмы клеток. Обеззараживанию подвергается вода, уже прошедшая стадии механической фильтрации, коагуляции, осветления и обесцвечивания, т. е. вода, не содержащая частиц, на поверхности или внутри которых могут находиться возбудители инфекционных заболеваний, оставаясь вне воздействия обеззараживающего средства. Применяемые в технологии очистки воды методы обеззараживания обычно классифицируются на четыре группы: • термические; • с помощью сильных окислителей; • олигодинамия (воздействие ионов благородных металлов); • физические (с помощью ультразвука, радиоактивного излучения, ультрафиолетовых лучей и др.). Из перечисленных методов наиболее широко применяют методы второй группы, а также технологию ультрафиолетового (УФ) обеззараживания, которые всесторонне исследованы на практике и утверждены в законодательном порядке. В качестве окислителей используют хлор, диоксид хлора, озон, йод, марганцевокислый калий, пероксид водорода, гипохлорит натрия и кальция. Из перечисленных окислителей на практике отдают предпочтение хлору, озону, гипохлориту натрия. По данным ВОЗ, уже в 1970-х годах структура заболеваемости двух третей населения земного шара свидетельствовала о явном преобладании инфекционных заболеваний, обусловленных загрязнением водоёмов. Практически во всех типах сточных вод содержатся патогенные микроорганизмы – возбудители таких заболеваний как холера, дизентерия, брюшной тиф, паратиф А и В, сальмонеллёзы, вирусные гепатиты А и Е, полиомиелиты 1-3 типов, энтеровирусные и аденовирусные заболевания, амебиоз, лямблиоз, лептоспироз, бруцеллёз, туляремия, гельминтозы, кампилбактериозы. Болезни, вызываемые этими микроорганизмами, различны и в неблагоприятных случаях могут приводить к серьёзным последствиям для человека. Для здоровья людей и охраны природы обеззараживание является самой важной стадией обработки питьевой воды и очищенных сточных вод. 118 Так, например, согласно немецким стандартам по степени опасности воды делятся на 5 классов: - в воде отсутствуют токсические вещества, вредные для здоровья и придающие воде привкусы и запахи; - вода имеет привкус, запах и окраску; - вода содержит небольшое количество вредных веществ; - вода содержит ядовитые или очень ядовитые, канцерогенные или радиоактивные вещества; - вода содержит возбудителей инфекционных заболеваний. В Республике Беларусь микробиологическое качество сбрасываемых сточных вод регламентируется следующими показателями (СанПиН № 107-2003): - вода не должна содержать возбудителей инфекционных заболеваний; - коли-индекс в сточных водах не должен превышать 1000 Кл./л; - содержание колифагов (БОЕ) должно быть не более 1000 БОЕ/л; - для сточных вод, используемых в открытых системах промышленного водоснабжения, коли-индекс должен составлять не более 100 Кл./л, индекс колифагов – не более 100 БОЕ/л. При анализе материалов, характеризующих эффективность обеззараживания на очистных сооружениях по очистке сточных вод, их работа оценивается как удовлетворительная, когда 85 % проб за каждый 30-дневный период не превышают указанные нормативы. Современные станции очистки сточных вод в значительной мере освобождают воду не только от механических и химических загрязнений, но и от патогенной микрофлоры. Однако, даже самые высокоэффективные очистные сооружения не обеспечивают обеззараживание сточных вод без специальных устройств для обеззараживания. Вместе с тем, в ряде случаев изза отсутствия, малой мощности и неэффективной работы очистных сооружений происходит сброс в водные объекты неочищенных или недостаточно очищенных сточных вод. Зачастую на очистных сооружениях системы обеззараживания воды вовсе отсутствуют. Методы, применяемые для обеззараживания питьевых и очищенных сточных вод (СВ) условно можно разделить на следующие основные группы: - химические (применение различных соединений хлора, озона, перекиси водорода и др.); - физические (термические, с использованием различных излучений, электрические, электромагнитные); - физико-химические (флотация, коагуляция, электрофильтрование, сорбция); - обеззараживание в условиях искусственных и естественных биоценозов. 119 Эффективность применения каждого метода и затраты на его реализацию зависят от общего содержания органических и концентрации взвешенных веществ в обрабатываемой воде, температуры и рН, начальной концентрации бактерий и вирусов. Каждый из методов характеризуется определённой интенсивностью воздействия на обрабатываемую воду – дозой реагентов или излучений. Среди химических методов обеззараживания в настоящее время наиболее распространённым является хлорирование. Хлорирование – наиболее экономичный метод обеззараживания. В практике используется газообразный хлор Cl2, диоксид хлора ClO2, гипохлорит натрия NaClO и гипохлорит кальция Ca(ClO)2, а также хлорные агенты, получаемые методом электролиза на месте потребления. Хлорная известь и гипохлорит кальция в настоящее время применяются незначительно и только для обеззараживания малых объёмов воды, т.к. обеззараживание с использованием этих хлорсодержащих соединений попутно сопровождается загрязнением обрабатываемой воды различными веществами. Из хлорсодержащих дезинфектантов в настоящее время широко используется диоксид хлора (преимущественно для обеззараживания питьевых вод), обладающий сильными окислительными свойствами, которые обуславливают его довольно высокую бактерицидную и вирулицидную активность по сравнению с другими хлорактивными соединениями. При обработке воды ClO2 процент оставшихся жизнеспособных клеток бактерий на порядок меньше, чем при применении хлора в той же концентрации при одинаковом времени контакта. Высокий антимикробный эффект ClO2 проявляется в дозах от 0,1 до 0,5 мг/дм3, в зависимости от концентрации взвешенных веществ. Однако увеличение загрязнённости воды органическими соединениями во взвешенном и растворённом состояниях уменьшает инактивирующее действие диоксида хлора и для более надёжного обеззараживания воды требуется повышение дозы реагента в 2-4 раза. Недостатками применения ClO2 при обработке воды является, с одной стороны, образование побочных продуктов - хлоритов и хлоратов, по данным ВОЗ отнесённым к метгемоглобинобразующим соединениям, с другой стороны, сложность и дороговизна получения диоксида хлора, его взрывоопасность. Несмотря на высокую эффективность в отношении патогенных бактерий, отсутствие после обработки повторного роста этих бактерий, хлорирование при дозе остаточного хлора 1,5 мг/дмЗ не обеспечивает необходимой эпидемической безопасности в отношении вирусов, цист простейших и лямблий. Известно существование хлоррезистентной микрофлоры: хлорустойчивых форм E.coli, Pseudoтoпodaceae, Klebsiellae, Рrоtеае, относящихся к условнопатогенным и патогенным микроорганизмам - являющихся стабильными контаминантами городских систем водоснабжения и водоотведения. 120 Негативным свойством хлорирования является также образование хлорорганических соединений: тригалогенметанов, хлорфенолов, пнитрохлорбензолов, хлораминов, а также диоксидов, образующихся при взаимодействии природных фенольных соединений, находящихся в воде, с хлором, вводимым в неё. Хлорорганические соединения, по данным многочисленных исследователей, по отношению к человеку обладают высокой токсичностью, мутагенностью и канцерогенностью. Недавно выделены и идентифицированы новые соединения, такие как хлордибензопарадиоксины, фураны, обладающие высокой токсичностью к живым организмам, источниками загрязнения которыми являются промышленные производства, предприятия бытового обслуживания населения (химчистки), использующие продукцию хлорорганических производств. Диоксины и фураны являются биологически неокисляемыми веществами и не подвергаются очистке на действующих в настоящее время коммунальных и промышленных очистных сооружениях. Существенным недостатком хлорирования (особенно для крупных и средних очистных сооружений) является необходимость обеспечения высокой степени безопасности и надёжности хлорного хозяйства. В последние годы поднимается вопрос о необходимости полного отказа от хлорирования сточных вод при их очистке. Согласно СанПиН 2.1.2.12-33-2005 «Гигиенические требования к охране поверхностных вод от загрязнения» сточные воды, сбрасываемые в водоёмы, содержащие возбудителей инфекционных заболеваний бактериальной, вирусной и паразитарной природы, опасные по эпидемическому критерию, должны быть обеззаражены, а количество остаточного хлора в них не должно превышать 1,5 мг/дмЗ. Но даже небольшое количество остаточного хлора, как показали исследования, проведённые в МосводоканалНИИпроекте, токсично для фауны водоёмов и приводит к практически полному прекращению процессов их самоочищения. Беспокойство, вызванное повышенной токсичностью следов остаточного хлора и хлораминов, привело к принятию многими штатами США в конце 1970-х гг. требований, ограничивающих остаточную концентрацию хлора до 0,1 мг/дмЗ. В настоящее время известны методы обеззараживания воды, сочетающие лучшие свойства известных дезинфектантов (хлора, диоксида хлора, озона). К таким методам относится технология обеззараживания воды раствором смеси оксидантов, вырабатываемой, например, в электролизных установках АКВАХЛОР. Однако при применении этой технологии следует учитывать описанные выше негативные стороны, свойственные входящим в состав смеси дезинфицирующим агентам. Кроме соединений хлора, в практике обезвреживания сточных вод могут быть использованы соединения брома и йода, обладающие окислительной активностью. 121 Высокими окислительными свойствами обладают межгалоидные соединения. Химическое поведение хлорида брома в воде сходно с поведением хлора. ВгСl в течение миллисекунд реагирует с водой, образуя гипобромовую кислоту, которая быстро соединяется с аммиаком, образуя при этом бромамины. Они далеко превосходят хлорамины в бактерицидной и противовирусной активности. В настоящее время препараты брома применяются для обеззараживания воды плавательных бассейнов, йод в качестве самостоятельного средства используется для обеззараживания воды в замкнутых системах, в частности, в системе жизнеобеспечения космических станций. Несмотря на перспективность использования соединений брома и йода для обеззараживания сточных вод, они не нашли широкого применения, с одной стороны, из-за высокой стоимости, с другой стороны – из-за возможности образования йод- и бромпроизводных, обладающих токсичным действием и отдалёнными эффектами. Наиболее распространённым химическим методом обеззараживания с использованием соединений кислорода является озонирование. Основателем технологии озонирования является Франция, которая в 1997 г. отметила столетие эффективного использования озона в водоподготовке. Расширяется применение 0з в качестве окислителя вместо Сl2 при обработке питьевой воды и промышленных сточных вод в США и Японии. В США получило распространение применение озона на сооружениях доочистки сточных вод после их биохимической очистки. Озон обладает более сильным бактерицидным, вирулицидным и спороцидным действием. Благодаря высокому окислительному потенциалу озон вступает во взаимодействие со многими минеральными и органическими веществами, разрушает клеточные мембраны и стенки, окислительно-восстановительную систему бактерий и их протоплазму, приводя к инактивации микроорганизмов. Обработка сточных вод озоном на заключительном этапе позволяет получить более высокую степень их очистки, обезвредить различные токсичные соединения. Однако, как показывают данные большинства исследователей, для инактивации вирусов в сточной воде требуются значительно более высокие дозы озона, чем для тех же микроорганизмов в чистой воде. Обеззараживание сточных вод озоном целесообразно применять после её очистки на фильтрах или после физико-химической очистки, обеспечивающей снижение содержания взвешенных веществ не менее чем до 3-5 мг/дм3 и БПКполн до 10 мг/дм3. Принципиальные трудности при обеззараживании озоном связаны с образованием токсичных побочных продуктов, низкой растворимостью озона в воде, его собственной высокой токсичностью и взрывоопасностью. Сведения по токсичности продуктов озонолиза органических соединений в воде весьма ограничены и противоречивы, т.к. идентифицирована только 122 небольшая их часть. Озонирование сточных вод может способствовать вторичному росту микроорганизмов, вследствие образования биоразлагаемых органических соединений в воде, являющихся доступными источниками углерода для бактерий. Кроме химического воздействия, озон проявляет себя и в качестве флокулянта, что позволяет применять его уже на стадии механической обработки воды для коагулирования взвешенных частиц. На белорусском рынке появилась отечественная ПАВ-озонная технология - технология очистки сильно- и среднезагрязнённых вод, сочетающая одновременно три процесса: окисление, коагулирование и флотацию. Сущность технологии заключается в тонкой флотации загрязнений озоновоздушной смесью. Данная схема внедрена на очистных сооружениях г. Могилёва для доочистки и обеззараживания биологически очищенных сточных вод перед сбросом в р. Днепр. При колебании в широких пределах концентрации взвешенных веществ и БПК в сточной воде, поступающей на обработку методом ПАВозонной технологии, снижается степень очистки по аммонийному и нитратному азоту, ионам тяжёлых металлов, нефтепродуктам. Расходование значительной части озона на взаимодействие с взвешенными веществами и продуктами их окисления, сказывается на глубине окисления загрязнений, свойственных сточной воде химической промышленности, эффекте обеззараживания. В то же время при использовании озона на больших станциях водоподготовки и водоочистки возникают проблемы технического и экономического характера, потребность в больших производственных площадях. Значительные эксплуатационные расходы при работе станции озонирования определяются, главным образом, высокой энергоёмкостью процесса синтеза озона (12-22 кВт.ч/кг производимого озона), вспомогательного оборудования (суммарное потребление электроэнергии станцией достигает 30-40 кВт.ч/кг озона и более), а также значительными затратами на содержание обслуживающего персонала. Вторым по распространённости после озона кислородсодержащим реагентом является перманганат калия. Этот реагент взаимодействует с органическими и неорганическими веществами, что препятствует его дезинфицирующему действию, в результате оно оказывается намного ниже, чем у хлора и озона. В настоящее время возрос интерес и к пероксиду водорода, как обеззараживающему агенту, обеспечивающему осуществление экологически чистых процессов без образования токсичных продуктов, как при обработке сточной воды, так и питьевой воды. Однако установлено, что Н202 оказывает инактивирующее действие на бактерии только в довольно высоких концентрациях. Такие дозы приводят как к высоким затратам на обеззараживание, так и к сбросу сточных вод с повышенным содержанием пероксида водорода, для которого установлены жёсткие предельно допустимые концен123 трации: 0,1 и 0,01 мг/дм3 в водоёмах культурно-бытового и рыбохозяйственного назначения, соответственно. Анализ литературных данных показывает на отсутствие опыта применения перманганата калия и перекиси водорода на коммунальных очистных сооружениях в странах СНГ. Из щелочных реагентов ограниченное применение для обеззараживания сточных вод нашла известь. Известкование применяется обычно в сочетании с удалением аммонийного азота из сточных вод отдувкой. Необходимый гигиенический эффект при обработке сточных вод достигается при использовании больших доз реагентов, что сопровождается образованием огромного количества осадка. Этот факт, также как и сравнительно медленное действие на микрофлору, существенно ограничивает применение известкования и делает его неприемлемым для использования на средних и крупных станциях. Мало распространённым реагентом является перуксусная кислота. Опытно-промышленные испытания в Англии показали её достаточно низкую эффективность, до сих пор этот метод не нашёл промышленного внедрения. К химическим методам обеззараживания следует отнести и использование металлов, обладающим олигодинамическим эффектом, прежде всего ионов серебра и меди. Бактерицидностью обладает ряд соединений меди, которые находят применение для обеззараживания сточной воды, борьбы с биологическими обрастаниями в системах оборотного водоснабжения, предотвращении цветения воды в широком диапазоне концентраций (> 3-500 мг/дм3). Комбинируя различные дезинфектанты, можно как усиливать их действие при одновременном снижении концентрации, так и получать дополнительные эффекты. Стоимость обработки воды при этом, как правило, снижается. Установлено, что для интенсификации обеззараживающего действия хлора его используют совместно с ионами металлов, при этом наблюдается синергетический эффект, что даёт возможность сократить продолжительность обработки воды в 5-10 раз. Комплексное использование Н2О2 с ионами Cu (II) в качестве катализатора разложения перекиси водорода позволяет активизировать процесс обеззараживания воды при снижении необходимых доз реагентов при обработке воды. Из физических методов обеззараживания наибольшее применение нашёл ультрафиолетовый (УФ) метод обработки. Ультрафиолетом (УФ) называют невидимую глазом часть спектра электромагнитных волн, имеющих энергию большую, чем у видимого фиолетового света. УФ-излучение охватывает диапазон с длиной волны от 100 до 400 нм. Колебания с длиной волны от 100 до 200 нм называют жёстким или вакуумным ультрафиолетом. Их энергии может хватать на разрушение органических молекул. Колебания с длиной волны от 200 до 400 нм генерируются в специальных ртутных или 124 ксеноновых лампах и широко применяются для обеззараживания воды и воздуха от различных микроорганизмов. Создание мощных источников излучения, новые конструктивные решения УФ-установок, снабжённых чувствительными датчиками, позволяющими измерять и контролировать интенсивность излучения в обрабатываемой воде и обеспечивать автоматическое регулирование интенсивности в зависимости от качества обрабатываемой воды, сделали этот метод конкурентоспособным, сравнимым по стоимости с хлорированием. Начиная с 1980-х годов эта технология интенсивно развивается для водоочистки и водоподготовки питьевых и сточных вод. УФ-установки обеззараживания воды выпускаются огромным числом изготовителей за рубежом и не менее чем 10 в РФ. Их производительность колеблется от литров в час для бытовых систем, устанавливаемых «под мойку», до нескольких тысяч м3/ч для городских систем. В настоящее время только в Северной Америке более 1500 муниципалитетов используют УФ облучение для обеззараживания очищенных СВ. Крупнейшая в мире УФстанция, производительностью более 1 млн. м3/сут., расположена в г. Калгари (Канада). Ожидается, что в ближайшие 10 лет около 25 % сточных вод в США будут обеззараживаться ультрафиолетом. Технология УФ обеззараживания СВ начала активно применяться и в России. Обеззараживаемая ультрафиолетом вода должна иметь достаточную прозрачность, поскольку в загрязнённых водах интенсивность проникания УФ-лучей быстро затухает. Степень влияния мутности и цветности воды на эффект обеззараживания УФ-лучами оценивается по коэффициенту пропускания (поглощения) воды в ультрафиолетовой области. В зависимости от качества обрабатываемой воды, её назначения, колеблются дозы УФ-излучения. Опыт эксплуатации промышленных УФсистем на различной воде показал, что приемлемыми с эксплуатационной и энергетической точек зрения являются воды с содержанием взвешенных частиц не более 30 мг/дм3, цветностью не более 500-600 град., содержанием железа не более 2-3 мг/дм3. Эти характеристики определяют границу конкурентоспособности УФ-технологии обеззараживания. Обработка воды ультрафиолетовым излучением относится к числу безреагентных, физических методов водоподготовки. Различают два метода облучения ультрафиолетом – импульсное, с широким спектром волн, и постоянное, в выбранном диапазоне волн. Обеззараживающим (бактерицидным) эффектом обладает только часть спектра УФ-излучения в диапазоне волн 205-315 нм при максимальной эффективности в области 260±10 нм. Обеззараживающий эффект УФизлучения в первую очередь обусловлен происходящими под его воздействием фотохимическими реакциями в структуре молекул ДНК и РНК, приводящими к их необратимым повреждениям. Кроме того, действие ультрафиолетового излучения вызывает нарушения в структуре мембран и кле- 125 точных стенок микроорганизмов. Всё это в конечном итоге приводит к их гибели. Эффективность обеззараживания воды (доля погибших под действием УФ облучения микроорганизмов) пропорциональна интенсивности излучения (мВт/см2) и времени его воздействия (с). Произведение этих двух величин называется дозой облучения (мДж/см2) и является мерой бактерицидной энергии, сообщённой микроорганизму. Минимальная доза УФоблучения, регламентируемая методическими указаниями Минздрава РФ (64) для обеззараживания питьевой воды, – 16 мДж/см2. Она обеспечивает снижение содержания патогенных бактерий в воде не менее чем на 5 порядков, а по индикаторным бактериям на 2-6 порядков. Такая доза снижает содержание вирусов на 2-3 порядка. Фотохимические процессы практически не зависят от рН и температуры воды, незначительно зависят от её химического состава. Наличие взвесей должно обязательно учитываться при выборе режима работы, поскольку они экранируют загрязнения и поглощают часть излучения. В НИИ гигиены им. Ф. Ф. Эрисмана (РФ) были проведены исследования влияния обобщённых показателей качества воды (цветность, мутность, окисляемость, ХПК, БПК) на эффективность УФ-обеззараживания. Показано, что колебания состава речной воды в диапазоне: цветность – 20-50 градусов, мутность – 1-30 мг/л, перманганатная окисляемость – 6-14 мг О2/л, ХПК – 29-63 мг/л, БПК – 5-10 мг/л не влияют на дозу облучения, необходимую для достижения нормативных показателей по коли-индексу и ОМЧ. Опыт работы НПО «ЛИТ» (РФ) на промышленной установке показано, что и при мутности 145 мг/л и коли-индексе 3000000 после УФ-облучения достигается отсутствие колиформных бактерий. Важнейшим качеством УФ-обработки воды является отсутствие изменения её физических и химических характеристик даже при дозах, намного превышающих практически необходимые. Широкая распространенность метода УФ-обеззараживания воды объясняется такими его достоинствами, как: • универсальность и эффективность воздействия на различные микроорганизмы в воде; • экологичность, безопасность для жизни и здоровья человека; • невысокие эксплуатационные расходы; • простота обслуживания установок. Серьёзным недостатком УФ-обеззараживания является отсутствие последействия, т. е. очищенная вода может вновь загрязняться на последующих стадиях обработки или транспортировки. УФ-облучение воды убивает микроорганизмы, но клеточные стенки бактерий, грибов, белковые фрагменты вирусов остаются в воде. При использовании такой воды в качестве питьевой желательно удалять их с помощью тонкой фильтрации. 126 В методических указаниях (64) в качестве требований указывается, что УФ-установки обеззараживания воды должны комплектоваться: датчиками измерения интенсивности УФ-излучения в камере обеззараживания; системой автоматики, сигнализирующей о снижении минимальной поглощённой дозы; счётчиками времени наработки ламп и индикаторами их исправности; пробоотборниками и системой очистки кварцевых чехлов. Стоимость этих устройств достаточно высока и их применение на установках малой производительности резко увеличивает их цену. Поскольку эти указания не носят обязательного характера, большинство производителей ограничиваются рекомендацией смены ламп при наработке ими гарантийного ресурса. На коммунальных установках подготовки питьевой воды необходимо обеспечивать их полную комплектацию. Количество ламп в установке зависит от её производительности, предназначения, типа и качества обрабатываемой воды. Длина корпуса определяется типом применяемых ламп. Поскольку для зажигания ртутных ламп необходимо создание специальных условий, все установки содержат пускорегулирующее устройство, а крупные – специальный блок управления и контроля. Для обеспечения высокой надёжности работы, учитывая незначительное энергопотребление ламп, предпочитают их эксплуатацию при постоянном горении. Ресурс ламп составляет 6000-10000 часов. Затем лампы заменяют. Очистка кварцевых труб осуществляется либо механическим способом, либо химической промывкой. Возможны различные варианты расположения УФ-установок на сооружениях очистки воды, как в начале, так и в конце технологической цепочки водоподготовки. Выбор оптимального места определяется по результатам технологических исследований на конкретных очистных сооружениях. Учитывая, что действие УФ-излучения ограничивается объёмом аппарата, для большинства случаев обработку воды целесообразно проводить в конце процесса, перед её подачей потребителю. Эффективность УФ-обеззараживания воды может быть дополнительно повышена путём сочетания с другими методами обеззараживания и с физическими воздействиями. Так, одновременная обработка воды кавитацией или ультразвуком и ультрафиолетом, введение малых доз озона после УФобработки позволяют сократить необходимую дозу облучения и гарантировать полное обеззараживание воды даже при наличии взвесей. Введение незначительных доз активного хлора обеспечивает эффект последействия, т. е. отсутствие повторного обсеменения воды. Аналогичный эффект даёт обработка воды серебром, медью, йодом. Жёсткое УФ-излучение в области 100–200 нм вызывает образование озона из молекул растворённого в воде кислорода и непосредственно воздействует на молекулы органических соединений. При использовании мощных импульсных ксеноновых ламп это создаёт возможность глубокой фото- 127 химической очистки воды от загрязнения нефтепродуктами, пестицидами, токсическими и мутагенными циклическими органическими соединениями. Установки, в которых совмещено воздействие кавитации и УФизлучения, типа «Лазурь» разработаны в АО «Сварог». В них материалом чехлов для УФ-ламп вместо кварцевого стекла служит так называемый «Супрасил», который пропускает жёсткое УФ-излучение с длиной волны 180 нм. Кавитация приводит к образованию микропузырьков воздуха, которые образуются на микрозагрязнениях воды, таких, как пылинки и микробы. При «схлопывании» пузырьков возникают большие перепады давления, которые уничтожают микробы. Одновременно в этих пузырьках под действием УФ-излучения образуются активные радикалы, которые эффективно уничтожают микрофлору и окисляют органику в воде. При этом весь объём воды обрабатывается ультрафиолетом. По мнению разработчиков, такое тройное воздействие много эффективнее простой раздельной обработки облучением и кавитацией. В Республике Беларусь имеется опыт эксплуатации установок по УФобеззаражива-нию сточных вод. На очистных сооружениях Мозырьского нефтеперерабатывающего завода производительностью 54 тыс. м3/сут., осуществляющих очистку сточных вод НПЗ и хозяйственно-бытовых стоков в 2003 г. была внедрена технология УФ-обеззараживания биологически очищенных сточных вод. По результатам лабораторных исследований, за период эксплуатации комплекса промышленного УФ-обеззараживания (2003-2006 г.г.) большинство проб по числу общих колиформных бактерий, колифагов соответствовали необходимым требованиям (40, 41). При использовании УФ-обеззараживания необходимо учитывать все факторы, влияющие на процесс обеззараживания. В настоящее время накоплен обширный материал по воздействию УФ-излучения на различные виды микроорганизмов, которые по устойчивости к ультрафиолету располагаются в ряд: вегетативные бактерии > вирусы > бактериальные споры > цисты простейших. При этом установлено, что УФ-излучение действует на вирусы намного эффективнее, чем хлор. Безреагентный и экологически чистый УФ метод обработки в сравнении с озонированием требует в 2 раза меньше капиталовложений и в 5 раз меньше эксплуатационных затрат. Это связано с небольшими затратами электроэнергии (в 3-5 раз меньшими, чем при озонировании); отсутствием необходимости в специальном обслуживающем персонале; с отсутствием организации специальных мер безопасности. УФ-облучение, в отличие от окислительных технологий, не меняет химический состав воды. Степень УФ-обеззараживания не линейно, а экспоненциально растёт с увеличением дозы УФ-излучения, поэтому незначительное увеличение УФ-мощности при заданном расходе обрабатываемой воды в несколько раз повышает степень обеззараживания. Многочисленные исследования показали отсутствие 128 вредных эффектов после облучения воды даже при дозах, намного превышающих практически необходимые. На протяжении последних 30 лет в России ведутся разработки электроимпульсных методов обеззараживания жидкостей, основанных на осуществлении высоковольтного разряда в жидкости. Импульсный разряд в жидкости способствует возникновению кавитационных явлений, гипохлорит-ионов, активных радикалов, а также УФ-излучения из канала разряда. Несмотря на достаточно длительную историю изучения данного метода обеззараживания, его реализация до сих пор не вышла из стадии стендовых испытаний. Другие физические методы обеззараживания, такие как обработка воды ускоренными электрическими зарядами, электрическими разрядами малой мощности, переменным электрическим током, магнитная обработка, термообработка, обработка ультразвуком, микрофильтрование, радиационное обеззараживание используются редко из-за высокой энергоёмкости или сложности аппаратуры, а также из-за не изученности образующихся в процессе обработки воды соединений. Многие из них находятся на стадии чисто научных разработок. В настоящее время ведётся разработка считающихся перспективными окислительных технологий, охватывающих обширный диапазон физических и химических методов, способных удалять из воды примеси до очень низких концентраций. Сюда относятся методы: УФ+О3, УФ+Н2О2, УФ+О3+Н2О2 и др. С помощью этих методов ожидается достиже-ние очень высокой эффективности обеззараживания, обусловленной синергетическим эф-фектом, т.е. взаимоусилением отдельных воздействий от каждого из применяемых средств. Современные методы обеззараживания с применением окислителей, излучений недостаточно эффективно инактивируют вирусы, споровые формы, цисты простейших, для удаления которых рекомендуется сочетать процессы обеззараживания с процессами снижения мутности - коагуляцией, отстаиванием, фильтрацией. Удаление из воды микроорганизмов, в частности цист гельминтов и крупнейших бактерий, относящихся к грубодисперсным примесям, достигается чаще всего осаждением и фильтрованием. Вирусы и бактерии малого размера, относящиеся к мелкодисперсным примесям воды, могут быть переведены в грубодисперсную фазу коагуляцией и флокуляцией, с последующим осаждением полученных агломератов фильтрацией. В отношении вирусов наиболее эффективным является метод фильтрования. По данным исследований, проведённых на водопроводных станциях Франции в течение двух лет, вирусы удаляются на 77-99 % при использовании песчаных фильтров с размером частиц 0,5-0,6 мм, высотой фильтрующего слоя 50-70 см и скоростью фильтрования 5 м/ч. 129 Совместное применение коагулянтов (40-50 мг/дмЗ) и флокулянтов (1 мг/дмЗ) усиливает эффект удаления вирусов. Степень удаления из воды вирусов повышается от 55-60 % до 80-90 %, если в воду добавляют катионные флокулянты, и не изменяется при добавлении анионных флокулянтов. Присутствие неионогенных ПАВ значительно снижает эффективность удаления вирусов. Установлено, что инактивация вирусов в воде может произойти и в процессе устранения жёсткости. Все физико-химические и сорбционные методы сами по себе или в сочетании не обеспечивают необходимого уровня очистки воды от микроорганизмов. Только сочетание их с химическими дезинфектантами или физическими методами обеззараживания позволяет достигнуть необходимых результатов. Экологами для обеззараживания сточных вод предлагается использовать естественные биоценозы, в частности, биопруды, где обеззараживание происходит за счёт природного ультрафиолета и альгофлоры. Установлено, что свободноплавающее на поверхности растение, такое как ряска, хорошо растёт на СВ свиноводческих комплексов, городских СВ. Обеззараживание СВ птицефабрик возможно при прохождении сточной жидкости через серию рыбоводно-биологических прудов с адаптированным альгологическим комплексом из диатомовых, зелёных и протококковых водорослей. В Узбекистане разработана эффективная биотехнологическая очистка СВ свиноферм, птицефабрик и др. производств путём культивирования в них высшего водного растения - пистии телорезовидной. Установлено, что пистия способна интенсифицировать процессы бактериального очищения воды от органических веществ, и является хорошим антагонистом сапрофитных и кишечных бактерий. Однако вce эти виды воздействий крайне слабы и имеют сезонный характер. Даже в летний период биопруды со временем пребывания в них воды 30 суток дают сокращение количества БГКП только на 99 %, что недостаточно для выполнения требований санитарных органов. Методы обеззараживания в естественных биоценозах могут быть использованы только для небольших объёмов. Анализ зарубежного и отечественного опыта обеззараживания воды показал, что в настоящее время интенсивно разрабатываются экологически более чистые и безопасные методы обеззараживания воды, альтернативные хлорированию. Многие из числа известных методов находятся пока на стадии научных разработок, лабораторных и производственных испытаний, внедряются на небольших очистных сооружениях. Реально работающими технологиями, прошедшими поверку на очистных сооружениях, являются озонирование и УФ-облучение. Однако при сопоставлении этих методов обеззараживания предпочтение всё же отдано УФ-облучению по следующим соображениям. Озон об- 130 ладает сильным дезинфицирующим действием в отношении бактерий и вирусов, характеризующихся высоким окислительным потенциалом. Побочными продуктами озонирования являются альдегиды, кетоны, карбоновые кислоты, фенолы и другие гидроксилированные и аллоратические ароматические далеко не безвредные соединения. Кроме того, частичная деструкция органических соединений приводит к их трансдеформации в биоразлагаемую форму. Они, являясь питательным субстратом, могут вызвать размножение микроорганизмов в водоёме, что в конечном итоге приводит к снижению санитарной надёжности воды. УФдезинфекция же, в силу физико-химического механизма обеззараживания, не вызывает образования побочных продуктов и может быть отнесена к экологически чистым методам дезинфекции. Существенное значение имеет и то обстоятельство, что этот метод отличается более низкими эксплуатационными расходами. Перспективным направлением повышения эффективности обеззараживания воды в мировой практике является применение на завершающей стадии очистки воды ультрафильтрационных мембран, позволяющих удаление всех видов микробиологического загрязнения, а также применение новых дезинфектантов, как, например, препарат «Дезавид» (ООО «Адекватные технологии», г. Москва, РФ), представляющий собой органический полимер с высокими бактерицидными свойствами. Однако, возможность применения этих технологий в системах ВВ РК требует дополнительного рассмотрения и изучения. Обеспечить надёжный уровень подавления патогенной микрофлоры можно только лишь при тщательном соблюдении рекомендованного регламента обработки. На территории СНГ наибольший опыт применения обеззараживания сточных вод накоплен в России. 6.1. Хлорирование воды в системах водоснабжения Хлорирование обычно включает в себя несколько стадий: приготовление раствора хлорсодержащего реагента, дозирование его в обрабатываемую воду, обеспечение необходимого времени контакта и последующее дехлорирование (удаление остаточного активного хлора). Хлорирование воды в системах водоснабжения производится, как правило, с применением жидкого хлора. Для станций производительностью до 3000 м3/сутки допускается применение хлорной извести или гипохлорита кальция в виде двутретьосновной соли (ДТСГК). В целях установления рабочей дозы хлора для хлорирования, опытным путём производится определение эффекта обеззараживания воды и количества остаточного активного хлора, которое зависит от величины хлорпоглощаемости воды. Выбранная для обеззараживания воды рабочая доза хлора должна обеспечивать надлежащий бактерицидный эффект, т.е. количество кишеч131 ных палочек в обработанной воде должно быть не более 3 в 1 л, общее число бактерий - не более 100 в 1 мл после контактного периода воды с хлором (не менее 30 мин.). Содержание остаточного хлора при этом должно быть не менее 0,3 и не более 0,5 мг/л. При хлорировании воды некоторых источников, преимущественно открытых, могут возникнуть затруднения, связанные с необходимостью получения надлежащего эффекта обеззараживания и в то же время соответствия воды гигиеническим требованиям в отношении органолептических свойств (запаха и вкуса). В таких случаях должен применяться тот или иной из специальных приёмов обеззараживания, к которым относятся следующие: а) двойное хлорирование, т.е. введение хлора предварительно до очистных сооружений во всасывающие водоводы 1-го подъёма (обычно в дозах 3-5 мг/л) и окончательно после фильтров (обычно в дозах 0,7-2 мг/л); используется при высокой цветности исходной воды, при повышенном содержании в ней органических веществ и планктона; б) хлорирование с преаммонизацией, т.е. введение в воду аммиака или его солей непосредственно перед введением хлора (обычно при соотношениях доз аммиака и хлора 1:4, 1:10). При этом обеззараживание обеспечивается за счёт связанного хлора (хлораминов). Этот метод используется для предупреждения специфических запахов, возникающих после обработки воды хлором. При преаммонизации контакт воды с хлором должен быть не менее 1 часа; в) перехлорирование, т.е. введение заведомо высоких доз хлора (до 10-20 мг/л) с последующим связыванием избытка хлора (дехлорирование сернистым газом или активированным углём); применяется в случаях вынужденного использования водоисточников, бактериальное загрязнение которых превышает установленный предел, т.е. среднее количество кишечных палочек составляет более 10000 в 1 литре проб воды, взятой в точке водозабора (20). Кроме того, применяется во избежание появления хлорфенольного запаха при наличии в исходной воде фенолов; г) хлорирование послепереломными дозами, т.е. с учётом точки перелома на кривой остаточного хлора; при этом обеззараживание воды производится свободным хлором, который значительно эффективнее связанного хлора (хлораминов); применяется главным образом в случаях высокого бактериального загрязнения исходной воды; д) использование двуокиси хлора также может быть рекомендовано для повышения эффективности обеззараживания и предупреждения специфических запахов в воде. Электрохимический метод получения гипохлорита натрия (NaСlO) основан на получении хлора методом электролиза раствора хлорида натрия (NaС1) и его взаимодействии со щелочью в одном и том же аппарате - электролизёре. На аноде идёт разряд ионов хлора: 132 2Сl– – 2е– = С12. (6.1) Выделяющийся хлор растворяется в электролите (NaС1) с образованием хлорноватистой и соляной кислот: Cl2 + H2O = НС1O + НС1. (6.2) На катоде происходит разряд молекул воды: 2Н2O + 2е = 2ОН– + Н2. (6.3) Эта реакция ведет к защелачиванию прикатодного пространства. Вследствие перемешивания анолита с католитом происходит взаимодействие хлорноватистой кислоты со щелочью с образованием гипохлорита натрия: НСlO + NaОН = NaСlO + Н2O. (6.4) Если всё количество щелочи, образующееся на катоде, будет поступать к аноду, то процесс электролиза протекает лишь с образованием гипохлорита натрия. Получающийся гипохлорит натрия диссоциирует с образованием ионов СlO–, которые способны к дальнейшему анодному окислению с образованием хлорат-иона СlO3–: 6СlO– +6OН– – 6е = 6Н2O + 4С1– +2СlO3– +1,5О2. (6.5) – Концентрация ионов СlO значительно влияет на дальнейший ход электролиза. Ионы СlO– разряжаются при существенно меньших потенциалах анода, чем ионы Сl– , поэтому уже при незначительных концентрациях гипохлорита натрия на аноде начинается разряд ионов Сl– и СlO–. Получаемый раствор гипохлорита натрия довольно стоек и может долгое время храниться без заметного разложения при соблюдении следующих факторов: • низкая температура (не более 20°С); • исключение действия света; • отсутствие ионов тяжелых металлов; • значение водородного показателя рН не менее 10. Разряд ионов Сl– приводит к образованию гипохлорита натрия с равномерно увеличивающейся концентрацией, а разряд ионов СlO– уменьшает его концентрацию. При достаточной длительности электролиза скорости этих двух действий станут одинаковыми и дальнейший рост концентрации образующегося гипохлорита натрия прекратится. Поэтому задачей получения гипохлорита натрия является воплощение процесса электролиза в таковых условиях, при которых равновесная концентрация гипохлорита натрия наступала бы как можно позже. Разумеется, что этим условиям будут благоприятствовать все причины, облегчающие разряд ионов Сl– и затрудняющие разряд ионов СlO–. Факторы, влияющие на процесс электролиза раствора хлорида натрия: 133 1. Концентрация растворов хлоридов. Увеличение концентрации хлоридов приводит к сдвигу равновесный потенциал хлора в электроотрицательную сторону и снижению его перенапряжения выделения. Но увеличение концентрации раствора NaС1 ведет к росту расхода поваренной соли на 1 кг гипохлорита натрия. Поэтому концентрацию раствора хлорида натрия выбирают в зависимости от требуемой концентрации гипохлорита натрия. Поскольку для практического использования пригодны разбавленные растворы гипохлорита (до 2 мольэкв/л), применять концентрированные исходные растворы хлорида натрия экономически нецелесообразно. Обычно электролизу подвергают растворы, содержащие 50 – 100 г/л NaCl, а в некоторых случаях – морскую воду (17-60 г/л). 2. Температурный режим. Температура раствора поддерживается в пределах 20 – 25 °С. Ее повышение снижает выход по току вследствие увеличения доли тока на выделение кислорода за счет уменьшения его перенапряжения. Кроме того, увеличивается скорость побочной реакции образования хлората и уменьшается растворимость хлора в электролите. 3. Анодная плотность тока. Выход по току гипохлорита возрастает с возрастанием анодной плотности тока, т.к. в этих условиях затрудняется доступ ионов СlO– к аноду. При совсем малых плотностях тока на аноде будет выделяться кислород, потом при достижении равновесного потенциала выделения хлора начнется совместное выделение кислорода и хлора, причем с ростом плотности тока выход хлора по току будет возрастать. При плотностях тока около 1000 А/м2 на выделение кислорода будет расходоваться всего несколько процентов тока. 4. Гидродинамический режим электролиза. Если прианодный слой электролита не нарушается, то в нем накапливается слабо диссоциированная хлорноватистая кислота, а образование гипохлорита натрия происходит на неком расстоянии от анода. В этом случае ионы СlO– могут поступать к аноду из глубины раствора лишь благодаря диффузии и электропереносу, поэтому при отсутствии перемешивания прианодного слоя в растворе может накапливаться гипохлорит натрия более высокой концентрации, чем это соответствует началу разряда ионов СlO–. В связи с этим для увеличения концентрации СlO– нужно избегать механического перемешивания раствора. 5. Электродные материалы. К анодам современных электролизеров для производства гипохлорита натрия предъявляются следующие требования: - анод должен обеспечивать наименьшее перенапряжение при выделении на нем целевого продукта; - материал анодов должен быть достаточно стойким к средам и условиям процесса, он должен легко поддаваться обработке для изготовления анодов любой формы; 134 - аноды должны изготавливаться из доступного и дешевого материала; - конструкция анодов должна способствовать быстрому удалению с поверхности и из межэлектродного пространства пузырьков хлора с целью уменьшения газонаполнения электролита и снижения его электрического сопротивления; Наиболее распространенным анодным материалом для производства гипохлорита натрия долгое время оставался искусственный графит (МПГ, ПГ и др.). Его достоинства – доступность и относительную дешевизна. Основной недостаток – окислительное разрушение графита, приводящее к загрязнению электролита и необходимости периодической замены электродного блока. В последние годы для электролиза хлорита натрия начали интенсивно применять малоизнашиваемые аноды (МИА). Такие аноды выполняют из титана, покрытого электрохимически активным слоем, содержащим металлы группы платины или их оксиды. Обладая вентильными свойствами (т. е. под действием анодного тока на поверхности металла образуется прочная защитная пленка, предохраняющая его от анодного растворения и коррозии), титан не разрушается при анодной поляризации в порах активного слоя. Он хорошо подвергается любой механической обработке, сварке, штамповке, резке, сверлению и т.д. Оптимальным сочетанием свойств МИА обладают ОРТА – оксиднорутениево-титановые аноды, представляющие собой смесь оксидов рутения и титана в массовом соотношении 30:70, нанесенную на титановую подложку. По сравнению с графитовыми для ОРТА характерно меньшее перенапряжение при разряде ионов хлора (на 0,1-0,15 В). Эти электроды практически не разрушаются в процессе работы, время непрерывной эксплуатации в хлоратных и гипохлоритных электролизерах - 1 год. Графитовые же аноды в хлоратных и гипохлоритных электролизерах работают не более 3-4 месяцев. МИА не загрязняют электролит, обеспечивая при этом постоянство межэлектродного расстояния в течение всего рабочего пробега электролизера. Это также снижает напряжение электролизера на 0,25-0,30 В за счет уменьшения потерь в электролите и диафрагме. Применение ОРТА позволяет значительно интенсифицировать процесс электролиза за счет повышения плотности тока, при том же расходе электроэнергии, так как допустимая плотность тока на ОРТА превосходит плотность тока на графитовых анодах на 750-1000 А/м2. Несмотря на широкое внедрение неразрушаемых анодов в промышленность, исследования в этой области продолжаются. Они связаны, главным образом, с удешевлением этих анодов за счет сокращения и полного исключения применения благородных и дефинитных металлов, продлением срока службы неразрушаемых анодов, расширением областей 135 их применения, а также упрощением технологии изготовления новых анодов. В частности, предложены различные составы анодно-активной массы для нанесения на рабочую поверхность основы, в качестве которой остается титан и его соединения с некоторыми легирующими добавками. К ним относятся композиции из вольфрама, тантала и железа или их соединений с бором; оксидов олова и сурьмы, составляющих промежуточный слой в сочетании с рабочим слоем из оксидов марганца или свинца; ниобия, никеля, меди или титана; кислородсодержащих соединений палладия — кобальта, палладия — хрома или палладия — родия; смеси оксидов марганца, железа, кобальта и никеля с электропроводящими частицами олова и других металлов; карбида титана и диоксида свинца и др. Получение гипохлорита натрия электролизом производят в периодическом или непрерывном режимах. При периодическом режиме работы исходный раствор соли заливают в непроточный электролизер, проводят электролиз до достижения требуемой концентрации гипохлорита натрия, затем раствор сливают в бак-накопитель, откуда его дозируют в обрабатываемую жидкость. Проточный режим предусматривает непрерывную обработку раствора соли в одном или нескольких последовательно соединённых электролизерах с одновременным дозированием его в обрабатываемую воду. Однако установки с таким режимом работы не получили широкого распространения из-за значительных потерь активного хлора и трудностей в эксплуатации. Дальнейшее развитие метода направлено на снижение удельного расхода соли при получении 1 кг активного хлора, предотвращение отложений солей жесткости на электродах, регулирование температурного режима электролиза с целью его оптимизации. Серийно выпускаются установки для прямого электролиза «Поток» с анодами из диоксида рутения и катодами из титана, которые чередуются с зазором между пластинами 3 мм. Установка состоит из электролизера, блока питания и замкнутого кислотного контура. Электролизер выполнен в форме параллелепипеда, внутри которого размещен пакет электродов. Кислотный контур предназначен для периодической промывки аппарата 35%-ным раствором кислоты для борьбы с катодным солеотложением. При одноразовом проходе под давлением обрабатываемой воды снизу вверх в межэлектродном пространстве электролизера обеспечивается её обеззараживание, величина остаточного хлора в воде через 30 мин контакта составляет 0,3-0,5 мг/л. В табл. 6.1. приведены параметры работы установки «Поток». Таблица 6.1 Параметры установки «Поток» 136 Параметры Значения параметров при содержании хлоридов в исходной воде, мг/л 20...50 3 Доза хлора, г/м Коэффициент выхода хлора по току: 0,2 0,4 0,6 0,8 Напряжение, В Анодная плотность тока, А/м Межэлектродное расстояние, мм 50...100 100...200 1 Производительность, м3/ч, 5...7 8...10 9...11 8...9 11...13 14...16 11...12 15...17 20...23 14...16 20...24 28...32 8...11 6...8 4...6 80...100 3...5 Ещё одной разработкой является установка «Аквахлор». Установка «Аквахлор» позволяет на месте потребления из раствора хлорида натрия получить два продукта - хлор и каустическую соду в необходимом количестве в любое время. Поскольку свежеполученный хлор содержит небольшое количестов других оксидантов (диоксид хлора, озон), то побочные продукты хлорирования в воде, такие например как хлороформ, не образуются. Установка «Аквахлор» - малогабаритный генератор хлора и раствора каустической соды, соединенный с хлоратором. Применение такой установки позволяет отказаться от жидкого хлора, достигнуть полной безопасности процесса обеззараживания воды, повысить эффективность процесса обеззараживания воды, уменьшить до минимума потребление соли и электроэнергии, получить два полезных продукта. 137 7. ИЗВЛЕЧЕНИЕ ЦВЕТНЫХ МЕТАЛЛОВ ИЗ СТОЧНЫХ ВОД МЕТОДОМ ПРЯМОГО ЭЛЕКТРОЛИЗА Электролизеры для извлечения ионов цветных металлов из сточных вод, растворов ванн улавливания и отработанных электролитов, относятся к нестандартному оборудованию и, как правило, представляют собой открытые или со съемной крышкой резервуары, в которых размещаются: катоды, аноды, в необходимых случаях разделительные полупроницаемые диафрагмы или мембраны (рис. 7.1 – 7.4). Электролизеры снабжаются системой подачи и распределения электролита и системой отвода прошедшего технологическую обработку раствора. Движение обрабатываемой жидкости в электролизере может осуществляться в горизонтальной либо вертикальной плоскости. Выбор способа подачи раствора зависит от рабочих характеристик стадии электролиза и должен оцениваться с позиций сложности организации ведения процесса, его экономичности, соответствия поставленным техническим задачам. Рис. 7.1. Диафрагменный электролизер для обработки сточных вод: 1 – корпус; 2 – катодный блок; 3 – нерастворимые аноды; 4,5 – подающий трубопровод с системой распределения электролита по катодным камерам; 6 – сливной карман; 7 – штуцер для слива обработанного раствора; 8 – штуцер для слива раствора из анодных пространств;9 – катодный шинопровод; 10 – анодный шинопровод; 11, 12 – крышка с патрубком подсоединения к местной вентиляции При извлечении ионов цветных металлов в присутствии ионов хлора (наиболее часто встречающийся компонент в составе растворов для нанесения покрытий) возникает необходимость разделения анодного и катодного пространств с целью свести к минимуму возможность образования на аноде газообразного хлора за счет окисления хлорид–ионов. 138 В этом случае обрабатываемый раствор, из которого на катоде извлекаются ионы металлов в виде металлического осадка, с помощью распределительной системы подается в нижнюю часть катодного блока, по обеим сторонам которого размещаются катионообменные мембраны (рис. 7.1). По мере заполнения катодного пространства раствор переливается в сливной карман, откуда и отводится в буферную (приемную) емкость. Процесс обработки растворов может осуществляться в циркуляционном режиме или при непрерывной подаче обрабатываемой сточной воды в катодные блоки. В зависимости от выбранного режима работы рассчитывается токовая нагрузка и подбирается необходимое дополнительное оборудование. При извлечении ионов меди, цинка из цинкатных растворов, олова необходимость разделения электродных пространств практически отсутствует, поэтому конструктивное исполнение электролизеров несколько упрощается и может быть таким, как представлено на рис. 7.2. Рис. 7.2. Электролизер для извлечения металлов из отработанных растворов и растворов ванн улавливания: 1 – корпус; 2 – футеровка; 3 – катод; 4 – нерастворимый анод; 5 – анодные шины; 6 – катодный шинопровод; 7 – штуцер для слива обработанного раствора; 8, 9 – штуцеры для слива раствора из корпуса электролизера; 10, 11 – система подачи и распределения электролита; 12 – крышка; 13 – патрубок для присоединения к сборному воздуховоду При электрохимической регенерации растворов хроматирования (пассивирования) цинковых покрытий могут применяются электролизеры, представленные на рис. 7.3–7.4. 139 Рис. 7.3. Электролизер для регенерации растворов хроматирования: 1 – корпус; 2 – катоды; 3 – анодная камера; 4 – анодный блок для закрепления ионообменных мембран; 5 – катодное пространство; 6 – анодный шинопровод; 7 – катодные шинопроводы; 8, 9 – подвод тока к катодным шинам; 10, 11 – трубопроводы для ввода раствора в анодную камеру; 12 – сливной карман; 13 – штуцер для слива раствора из анодных камер; 14 – штуцер для слива раствора из катодных камер; 15 – крышка; 16 – воздуховод для подсоединения к местной вытяжной вентиляции 140 Рис. 7.4. Электролизер для регенерации растворов хроматирования многокамерный: 1 – корпус; 2 – анодная камера; 3 – катод; 4 – штуцер для ввода раствора; 5 – штуцер для слива раствора из анодных камер; 6 – штуцер для слива раствора из катодных камер; 7 – крышка; 8 – воздуховод для подсоединения к местной вытяжной вентиляции Регенерируемый раствор из ванны хроматирования подается центробежным насосом в анодные камеры электролизера. Процесс электрохимической регенерации основан на электроокислении ионов хрома(III) до хрома(VI). Ионы цинка, накапливающиеся в процессе хроматирования, удаляются через катионообменные мембраны в катодные камеры электролизера, где восстанавливаются до металла. В зависимости от требуемой производительности электролизер оснащается одним (рис. 7.2) или несколькими (рис. 7.3) электродными блоками. Для разделения электродных пространств применимы катионообменные мембраны, химически стойкие в хромсодержащих средах. 141 Рис. 7.5. Схема электролизера с углеграфитовыми катодами: 1 – катод; 2 – мембрана; 3 – анод В качестве катодов в электролизерах для электроэкстракции ионов цветных металлов чаще всего используют пластины из углеродистой, нержавеющей стали или титана. Целесообразно исходную поверхность отполировать для лучшего отделения образующегося металлического осадка. Толщина электродов составляет 1–3 мм. При извлечении ионов цветных металлов их сточных вод и при необходимости достижения глубокой степени проработки растворов возможно применение катодов из профилированной титановой сетки, которая в зависимости от способа изготовления имеет эквивалентную толщину 5–30 мм. В ряде процессов находят применение титановые стружечные электроды, изготовленные методом прессования. Для извлечения никеля, меди, олова, цинка и ионов благородных металлов предлагаются к применению электроды из металлизированного пенополиуретана или углеграфитовые волокнистые материалы (УВМ). Среди УВМ, используемых в качестве катодных материалов, различают нетканые материалы (войлоки) и тканые. При этом тканые УВМ по сравнению с неткаными обладают более высокой стойкостью к различного рода механическим деформациям, что, потенциально, позволяет создавать на их основе разнообразные конструкции аппаратов для обработки сточных вод. Вместе с тем, боковая поверхность моноволокон нетканых УВМ более доступна для электрохимических процессов, контролируемых диффузией и сопровождаемых образованием новой фазы. Поэтому реакционная поверхность нетканых УВМ значительно больше реакционной поверхности тканых материалов, и при необходимости значительной интенсификации электрохимических процессов более предпочтительны электроды из нетканых углеродистых материалов. При использовании УВМ в качестве катодов они закрепляются в катодном блоке и электролизер работает в проточном режиме при прокачивании раствора сквозь углеграфитовые материалы (рис. 7.5). Некоторые характеристики углеграфитовых волокнистых материалов 142 приведены в таблице 7.1. Таблица 7.1. Структурные и электрохимические характеристики УВМ r·10–6 rж·10–4 Sэх Sж χ*, См/м ε 2 м м /кг Тканые УВМ ТГН–2М 5,0 3,0 222 60 26 63/210 0,79 ТВШ 4,6 2,0 290 148 74 16/40 0,91 ТГН 4,3 3,0 310 91 26 4,3/13 0,83 ЛВИК–95 6,0 2,0 222 90 39 26/87 0,83 ЛГ–50 3,8 2,2 292 59 22,5 2,5/9 0,77 Нетканые УВМ ВГН–50 6,0 – 185 195 – 130/260 0,92 ВИНН–250 4,5 – 296 470 – 10/40 0,96 НТМ–200 5,0 – 267 359 – 7/40 0,96 НТМ–100 5,4 – 247 339 – 3/12 0,96 КНМ 6,1 – 218 240 – 0,9/3 0,96 Обозначения: r – средний радиус волокна; rж – радиус жгута; S – удельная бокова я поверхностьматериала; Sэх – удельная реакционная поверхность; Sж – удельная боковая поверхность жгутов; χ* – удельная электропроводность материала, в числителе – в свободном состоянии, в знаменателе – при сжатии материала в два раза; ε – пористость. Материал S Особенностью процессов электроэкстракции металлов из сточных вод и отработанных электролитов является необходимость применения нерастворимых анодов, круг которых относительно невелик и их выбор определяется составом подвергаемой электрохимической обработке сточной воды. Определяющим для использования того или иного вида нерастворимого анода является присутствие в растворе хлорид – и фторидионов. Так, в присутствии в растворе хлорсодержащих соединений, к применению в качестве нерастворимого анода пригодны металлооксидные окиснорутениевотитановые аноды (ОРТА), аноды ОКТА (окиснокобальтнотитановые) или ТДМА (титановая основа с активным поверхностным покрытием смесью изоморфных оксидов титана, рутения, марганца и кобальта). В этих же условиях возможно применение электродов из углеграфита. Однако низкая коррозионная и механическая стойкость графита в условиях образования на аноде газообразных продуктов электролиза не позволяет рекомендовать такие электроды для широкого применения. Кроме того, при выборе материала электрода нужно принимать в расчет и каталитическую активность материала анода по отношению к реакции выделения хлора. В сернокислых средах приемлемым анодным материалом выступают свинец или аноды из электролитически осажденного на титановую основу диоксида свинца. При выборе конструктивного исполнения электролизера и при подключении электродов необходимо принимать во внимание следующие 143 обстоятельства. Электроды (катоды и аноды) должны завешиваться на медных или латунных стержнях, концы которых закрепляются на катодных или анодных шинах, укладываемых на изоляторах вдоль бортов ванн. Аноды из углеграфитовых материалов (в виде плит) могут устанавливаться на дно электролизера, футерованное материалом–диэлектриком. Сечение токоподводов и электродных шин рассчитывается на максимальную токовую нагрузку. Если расчетная токовая нагрузка составляет более 3000А или возникает необходимость отведения большого количества образующихся газообразных продуктов электролиза, то рекомендуется устанавливать несколько электролизеров, снабженных автономными источниками питания. При конструктивном расчете электролизера расстояние между соседними анодом и катодом следует принимать в пределах 40–50 мм (если больших расстояний не требуется вследствие особенностей протекающих реакций). При использовании для разделения электродных пространств ионообменных мембран, закрепляемых в мембранном блоке, расстояние между электродами соответственно увеличивается на ширину электродного блока (см. рис. 7.1, 7.5). Рабочая длина электрода может составлять 0,7–0,9 м при ширине 0,5– 0,7м. Если не предусмотрена механизированная загрузка–разгрузка электродов в электролизере, то габаритные размеры электродов следует подбирать из условия, чтобы масса электрода вместе с осажденным металлом не превышала 50 кг. При проектировании электролизера для электроэкстракции металлов из обработанных растворов и сточных вод в качестве исходных данных следует заложить следующие параметры: – объемный расход подвергаемой обработке жидкости Qж, м3/ч; – начальная и конечная концентрация по ионам извлекаемого металла, соответственно Снач и Скон, кг/м3; – в качестве исходного параметра может применяться степень превращения, которая оценивается по уравнению α= Снач − Скон С = 1 − кон ; Снач Снач (7.1) – габаритная ( катодная или анодная) плотность тока i, А/м2; – средний выход по току ВТср, доли единицы, при изменении концентрации от Снач до Скон; – промежуток времени τ, ч, в течение которого будет осуществляться процесс электролиза. Приступая к расчету габаритных размеров электролизера, вначале определяется токовая нагрузка I, A, общая анодная Sан и катодная Sкат, м2, 144 поверхности и далее оцениваются габаритные размеры электродов. Необходимая токовая нагрузка определяется по формуле: Qж (Cнач − Cкон ) , qМе ВТ срτ I= (7.2) где qМе – электрохимический эквивалент осаждаемого металла, г/А · ч. Общая катодная поверхность определяется из формулы Sкат = I i (7.3) Рабочая поверхность единичного катода при его длине l, м и ширине b, м, при условии двухсторонней работы составит: ′ = 2lb Sкат (7.4) Количество катодов nкат в составе электролизера nкат = Sкат Sкат = ′ Sкат 2lb (7.5) Для обеспечения двухсторонней работы катодов в процессе электролиза количество анодов должно быть на один больше, т. е. nан = nкат + 1 (7.6) В некоторых случаях задаваясь габаритными размерами катодов и их количеством, можно определить токовую нагрузку, которую будет потреблять электролизер и рассчитать время процесса электроэкстракции, и затем оценить его с позиций допустимости по технологическим соображениям. Если электролизер для электрохимической обработки встроен непосредственно в технологическую линию, то необходимая для его работы токовая нагрузка будет определяться количеством компонента, вносимого в ванну улавливания за единицу времени и извлекаемого посредством электролиза: I= g вн qВТτ (7.7) где gвн – количество извлекаемого компонента, кг/ч, численно определяется количеством вещества, вносимого в ванну непроточной промывки с 145 деталями и технологическим спутником, кг/ч. При такой схеме работы электролизера токовая нагрузка измеряется небольшими величинами, и, как правило, в составе электролизера достаточно одного катода и двух анодов. Габаритные размеры электролизера рассчитываются по следующим соотношениям. Длина Lэ, м, должна определяться из соотношения: Lэ = 2nкlк-а + lуз (7.8) где lк-а – расстояние между анодом и катодом, м; lуз – установочный технологический зазор, который в большинстве практических случаев составляет около 0,07 м. Такой зазор необходим для удобства замены крайних электродов при выходе их из строя и для проведения профилактических осмотров и работ. Ширина электролизера Вэ, м, будет определяться соотношением следующих размеров: Bэ = bк + 2lуз , (7.9) где bк – ширина катода, м. Габаритная высота электролизера Hэ, м, должна рассчитываться с учетом объема занимаемого электродами или электродными блоками и объема раствора, подаваемого в корпус электролизера в единицу времени. Для изготовления корпуса электролизера и его основных узлов используют полимерные материалы или футерованную углеродистую сталь. Использование других металлических материалов существенно повышает стоимость электролизера и снижает технико-экономические показатели процесса извлечения ионов цветных металлов методом электролиза. 146 8. ЭЛЕКТРО- И ГАЛЬВАНОКОАГУЛЯЦИЯ 8.1. Теоря коагуляции Коагуляция - это слипание частиц коллоидной системы при их столкновениях в процессе теплового движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции образуются агрегаты - более крупные (вторичные) частицы, состоящие из скопления мелких (первичных). Первичные частицы в таких агрегатах соединены силами межмолекулярного взаимодействия непосредственно или через прослойку окружающей (дисперсионной) среды. Коагуляция сопровождается прогрессирующим укрупнением частиц и уменьшением их общего числа в объеме дисперсионной среды (в нашем случае - жидкости). Слипание однородных частиц называется гомокоагуляцией, а разнородных - гетерокоагуляцией. Рис. 8.1. Строение мицеллы a) x >0.03; б) x = 0; А - адсорбционный слой; Б-диффузионный слой; I-ядро Производственные сточные воды в большинстве случаев представляют собой слабоконцентрированные эмульсии или суспензии, содержащие Коллоидные частицы размером 0,001 - 0,1 мкм, мелкодисперсные частицы размером 0,1 - 10 мкм, а также частицы размером 10 мкм и более. 147 В процессе механической очистки из сточных вод достаточно легко удаляются частицы размером 10 мкм и более, мелкодисперсные и коллоидные частицы практически не удаляются. Таким образом, сточные воды многих производств после сооружений механической очистки представляют собой агрегативно устойчивую систему. Для их очистки применяют методы коагуляции; агрегативная устойчивость при этом нарушается, образуются более крупные агрегаты частиц, которые удаляются из сточных вод механическими методами. Методы коагуляции широко распространены для очистки сточных вод предприятий химической, нефтехимической, нефтеперерабатывающей, целлюлозно-бумажной, легкой, текстильной и других отраслей промышленности. Эффективность коагуляционной очистки зависит от многих факторов: вида коллоидных частиц; их концентрации и степени дисперсности; наличия в сточных водах электролитов и других примесей; величины электрокинетического потенциала. В сточных водах могут содержаться твердые (каолин, глина, волокна, цемент, кристаллы солей и др.) и жидкие (нефть, нефтепродукты, смолы и др.) частицы. Коллоидные частицы, представляющие собой совокупность большого числа молекул вещества, содержащегося в сточной воде в диспергированном состоянии, при перемещении прочно удерживают покрывающий их слой воды. Обладая большой удельной площадью поверхности, коллоидные частицы адсорбируют находящиеся в воде ионы преимущественно одного знака, значительно понижающие свободную поверхностную энергию коллоидных частиц. Ионы, непосредственно прилегающие к ядру, образуют слой поверхностно-ядерных ионов, или так называемый адсорбционный слой. В этом слое может находиться также небольшое число противоположно заряженных ионов, суммарный заряд которых, однако, не компенсирует заряда поверхностно-ядерных ионов. В связи с тем, что на границе адсорбционного слоя создается электрический заряд, вокруг гранулы (ядра с адсорбционным слоем) образуется диффузионный слой, в котором находятся остальные противоположно заряженные ионы, компенсирующие заряд гранул. Гранула вместе с диффузионным слоем называется мицеллой. На рис. 1 показано изменение напряженности электрического поля мицеллы. Потенциал на границе ядра термодинамический потенциал (x-потенциал) - равен сумме зарядов всех поверхностно-ядерных конов. На границе адсорбционного слоя потенциал уменьшается на величину, равную сумме зарядов находящихся в адсорбционном слое противоположно заряженных ионов. Потенциал на границе адсорбционного слоя называется электрокинетическим потенциалом (x-потенциал). На частицы коллоидов действуют диффузионные силы, и частицы стремятся равномерно распределяться во всем объеме жидкой фазы. Наличие у частиц электрических зарядов одного знака вызывает их 148 взаимное отталкивание. Одновременно между коллоидными частицами имеются молекулярные силы взаимного притяжения, которые проявляются лишь при небольших расстояниях между частицами. При снижении электрического заряда частиц, т. е. при уменьшении x-потенциала, силы отталкивания уменьшаются и становится возможным слипание частиц процесс коагуляции коллоида. Силы взаимного притяжения между коллоидными частицами начинают преобладать над электрическими силами отталкивания при x-потенциале системы менее 0,03 В. При x-потенциале, равном нулю, коагуляция проходит с максимальной интенсивностью, состояние коллоидной системы в этом случае носит название изоэлектрического состояния, а величина рН называется изоэлектрической точкой системы. Одним из методов снижения x-потенциала коллоидной системы является увеличение концентрации в воде электролитов. Способность электролита вызывать коагуляцию коллоидной системы возрастает с увеличением валентности коагулирующего иона, обладающего зарядом, который противоположен заряду коллоидных частиц. Соотношение коагулирующей способности одно-, двух- и трехвалентных ионов приблизительно 1:30:1000. При коагуляции хлопья образуются сначала за счет части взвешенных частиц и коагулянта или только коагулянта. Образовавшиеся хлопья последнего сорбируют вещества, загрязняющие сточные воды и, осаждаясь вместе с ними, очищают воду. Основным процессом коагуляционной очистки производственных сточных вод является гетерокоагуляция - взаимодействие коллоидных и мелкодисперсных частиц сточных вод с агрегатами, образующимися при введении в сточную воду коагулянтов. При использовании в качестве коагулянтов солей алюминия и железа в результате реакции гидролиза образуются малорастворимые в воде гидроксиды железа и алюминия, которые сорбируют на развитой хлопьевидной поверхности взвешенные, мелкодисперсные и коллоидные вещества и при благоприятных гидродинамических условиях оседают на дно отстойника, образуя осадок. Образующиеся в процессе гидролиза серную и соляную кислоты следует нейтрализовать известью или другими щелочами. Нейтрализация образующихся при гидролизе коагулянтов кислот может также протекать за счет щелочного резерва сточной жидкости. В целях уменьшения расходов коагулянтов процесс коагуляции следует осуществлять в диапазоне оптимальных величин рН. Для очистки производственных сточных вод применяют различные минеральные коагулянты. 1. Соли алюминия. Процесс коагуляции солями алюминия рекомендуется проводить при значениях рН=4,5. В результате применения 149 сульфата алюминия степень минерализации воды увеличивается. Алюминат натрия, оксихлорид алюминия, полихлорид алюминия, алюмокалиевые и алюмоаммонийные квасцы имеют меньшую стоимость и дефицитность, чем сульфат алюминия. 2. Соли железа. Применение процесса коагуляции оптимально при рН>9. Гидроксид железа - плотные, тяжелые, быстро осаждающиеся хлопья, что является несомненным преимуществом его применения. 3. Соли магния. Хлорид магния; сульфат магния. 4. Известь. 5. Шламовые отходы и отработанные растворы отдельных производств. Хлорид алюминия (производство этилбензола), сульфат двухвалентного железа (травление металлов), известковый шлам и др. Количество коагулянта, необходимое для осуществления процесса коагуляции, зависит от вида коагулянта, расхода, состава, требуемой степени очистки сточных вод и определяется экспериментально. Образующиеся в результате коагуляции осадки представляют собой хлопья размером от нескольких микрометров до нескольких миллиметров. Рыхлая пространственная структура хлопьев осадка обусловливает их высокую влажность - до 96-99,9%. Плотность хлопьев осадка составляет обычно 1,01-1,03 т/м3. Для обесцвечивания высококонцентрированных и интенсивно окрашенных вод расходы коагулянтов достигают 1-4 кг/м3; объем осадка, получающегося в результате коагуляции, достигает 10-20 % объема обрабатываемой сточной воды. Значительный расход коагулянтов, большой объем получающегося осадка, сложность его обработки и последующего складирования, увеличение степени минерализации обрабатываемых сточных вод не позволяют в большинстве случаев рекомендовать коагуляцию как метод самостоятельной очистки. Коагуляционный метод очистки применяется в основном при небольших расходах сточных вод и при наличии дешевых коагулянтов. Расширению оптимальных областей коагуляции (по рН и температуре) способствуют флокулянты, повышающие плотность и прочность образующихся хлопьев, снижающие расход коагулянтов, повышающие надежность работы и пропускную способность очистных сооружений. Процесс очистки сточных вод методом коагуляции или флокуляции включает приготовление водных растворов коагулянтов или флокулянтов, их дозирование, смешение со всем объемом сточной воды, хлопьеобразование, выделение хлопьев из нее. В реагентное хозяйство на очистных сооружениях входят склады для хранения коагулянтов. В настоящее время широко применяется так называемое мокрое хранение коагулянтов (в виде раствора или кускового продукта в концентрированном растворе) в баках и резервуарах (рис. 8.2), располагаемых внутри или вне здания. Емкости, размещаемые вне здания, 150 следует утеплять. Растворение коагулянтов в воде осуществляется в растворных баках с устройствами для барботажа сжатым воздухом интенсивностью 4-5 л/с на 1 м2 площади колосниковой решетки. Применяются также баки с лопастными и пропеллерными мешалками для растворения соответственно зернистых и кусковых материалов (размером не более 20 мм). Из растворных баков растворы коагулянтов перекачивают в расходные баки, а оттуда дозируют в обрабатываемую воду с помощью дозаторов различных конструкций. Коагулянты вводят в обрабатываемую сточную воду обычно в виде 1-10 %-ных растворов, а флокулянты - в виде 0,1-1 %-ных растворов. Коагулянты смешивают с обрабатываемой сточной водой в смесителях, продолжительность пребывания воды в которых составляет 1-2 мин. Применяют перегородчатые, дырчатые, шайбовые и вертикальные смесители, а также механические с пропеллерными или лопастными мешалками. Трубопроводы или лотки, отводящие воду из смесителей в камеры хлопьеобразования и осветлители со взвешенным осадком, рассчитывают на скорость движения сточной воды 0,8-1 м/с и продолжительность ее пребывания в них не более 2 мин. После смешения сточных вод с коагулянтами начинается процесс образования хлопьев, который происходит в камерах хлопьеобразования. Эти камеры могут быть водоворотные, перегородчатые, вихревые, а также с механическим перемешиванием. Водоворотные камеры хлопьеобразования представляют собой цилиндр, в верхнюю часть которого из смесителя вводится сточная вода с вращательной скоростью на выходе из сопла 2-3 м/с. В нижней части камеры перед выходом в отстойник находятся гасители вращательного движения воды. Продолжительность пребывания воды в камере 15- 20 мин. Перегородчатые камеры могут быть горизонтальными п вертикальными. В горизонтальной камере (рис. 3) сточная вода протекает по нескольким последовательно соединенным коридорам. Перемешивание осуществляется за счет восьми - десяти поворотов. Коридоры устраиваются таким образом, чтобы скорость движения воды в первом была 0,2- 0,3 м/с, а в последнем - 0,1 м/с. Продолжительность пребывания воды в перегородчатых камерах 20-30 мин. Высота камеры определяется высотой отстойника, а ширина коридоров составляет не менее 0,7 м. Вихревая камера хлопьеобразования представляет собой конический или цилиндрический расширяющийся кверху резервуар с нижним впуском сточной воды со скоростью 0,7-1,2 м/с. Угол наклона стенок камеры к горизонту около 70°. Скорость восходящего потока сточной воды на уровне выпуска 4-5 м/с, продолжительность пребывания воды в камере 6-10 мин. 151 В камерах хлопьеобразования с лопастными мешалками продолжительность пребывания воды 20-30 мин, а скорость движения воды 0,15-0,2 м/с. Рис. 8.2. Баки для мокрого хранения коагулянта. 1- кусковой коагулянт; 2, 3, 4- подача соответственно воды, пара и сжатого воздуха; 5- насос для перекачки раствора в расходные баки; 6выпуск в канализацию; 7- подача воды для смывания воды. сточной воды производится Последующее осветление горизонтальных, радиальных и вертикальных отстойниках. в Рис 8.3. Перегородчатая камера хлопьеобразования с горизонтальным движением обрабатываемой сточной воды. 1, 2-отводной канал сточной воды и осадка; 3,4- шиберы соответственно для отключения части коридоров камеры и выпуска осадка. 152 Наиболее целесообразной является двухступенчатая схема отстаивания сточных вод. На I ступени осуществляется простое отстаивание в отстойнике без коагулянта, на II ступени-обработка сточных вод коагулянтами и флокулянтами с последующим отстаиванием в отстойнике. Если в производственных сточных водах концентрации взвешенных веществ, способных к агрегации, не превышает 4 г/л, то применяют осветлители со взвешенным слоем осадка. В осветлителях происходят три основных процесса: смешение, коагуляция и осветление сточных вод. Обрабатываемая в осветлителях сточная вода проходит снизу вверх через слой ранее выделившегося шлама с такой скоростью, при которой взвешенные частицы не уносятся из зоны взвешенного осадка. При движении сточной воды через взвешенный слой увеличивается эффект задержания мелких суспензированных частиц. Осветлители проектируются круглыми (диаметр до 15 м) или прямоугольными в плане, площадь осветлителя не должна превышать 150 м2. Для обеспечения нормальной работы осветлителя сточную воду после смешения с коагулянтами направляют в воздухоотделитель, где она освобождается от пузырьков воздуха, выделяющихся в результате реакций. В течение 1 ч допускается колебание температуры не более чем на 1°С, а расхода - не более чем на 10 %. Резкие колебания скорости движения воды не допускаются. Величина восходящей скорости потока в зоне осветления зависит от концентрации взвешенных веществ. Так, при обработке сточных вод сульфатом алюминия при содержании взвешенных веществ до 400 мг/л расчетная скорость восходящего потока Vрасч=0,8-1 мм/с, 400-1000 мг/л. Vpac = 1-1,1 мм/с, 1000-2500 мг/л - Vрас = 1,1-1,2 мм/с. Высота слоя взвешенного осадка принимается равной 1,5-2,5 м; высота защитной зоны от верха осадкоотводящих окон или труб до лотков для сбора осветленной воды 1-1,5 м; низ осадкоприемных окон или кромка осадкоотводящих труб располагается на расстоянии 1,5-1,75 м выше перехода наклонных стенок осветлителя в вертикальные; угол наклона к горизонту нижних частей стенок осветлителей и осадкоуплотнителей принимается не менее 450. Избыток шлама, накапливающегося в осветлителе, перетекает под действием разности плотностей осветленной воды и взвешенного слоя в осадкоуплотнитель (осветлители с естественным отсосом шлама) либо отсасывается вследствие разностей уровней отбора воды из рабочей камеры и уплотнителя (осветлитель с принудительным отсосом избытка шлама). Осветлители второй конструкции работают эффективнее. 8.2. Электрркрагуляция Процесс электрокоагуляции можно разделить на следующие стадии: 153 1) генерация ионов-коагулянтов анодным растворением металла (наиболее распространенные металлы – железо и алюминий). В сильнокислых средах возможна катодная генерация ионов алюминия; 2) миграция ионов металла в объем раствора и их гидролиз либо образование других малорастворимых соединений; 3) взаимодействие ионов металла и продуктов их гидролиза с компонентами раствора с образованием соединений сложного состава, в том числе и восстановительное взаимодействие ионов Fe2+ c токсичными соединениями хрома (VI); 4) совместная коагуляция коллоидных частиц раствора и генерированного коагулянта; 5) сорбция органических веществ и эмульгированных загрязнений активной поверхностью коагулирующей системы. Эффективность обработки в случае электрокоагуляции выше вследствие дополнительных электрохимических и физико-химических процессов: – электрофорез и электродное разрушение коллоидов; – катодное восстановление растворенных в стоках органических и неорганических веществ или их химическое восстановление, а также образование катодных осадков металлов; – флотация твердых эмульгированных частиц обрабатываемой сточной воды пузырьками газообразного водорода, выделяющегося на катоде. Процессы, которые протекают при электрокоагуляционной обработке минерализованных сточных вод с одновременным обезвреживанием соединений хрома (VI) в общем виде можно представить следующим образом. Анодный процесс в отсутствии пассивации: Fe → Fe2+ + 2e–. (8.1) Катодные процессы: 2H+ + 2e– → H2; (8.2) + – 3+ Cr2O72− + 14H + 6e → 2Cr + 7H2O; (8.3) Меn+ + ne– → Me. (8.4) В приэлектродных областях и объеме электролита: 4Fe2++ O2 + 4Н+ → 4Fe3+ + 2H2O; (8.5) Fe3+ + 3H2O → Fe(OH)3↓ + 3H+; (8.6) при pH < 5,5 + 2+ 3+ 3+ Cr2O72− +14Н +6Fe → 2Cr + 6Fe + 7H2O; 154 (8.7) при pH > 5,5 Cr2O72− + 7Н2О + 6Fe(OH)2 → 2Cr(OH)3↓ + 6Fe(OH)3↓ + 2OH⎯. (8.8) Подщелачивание прикатодного пространства вследствие интенсивного выделения водорода может привести к образованию гидроксидов металлов и пассивации катода. Достоинства электрокоагуляции – компактность установок, малая чувствительность к изменениям условий проведения очистки (температуре, рН среды), получение утилизируемого в производстве стройматериалов шлама. К недостаткам следует отнести возможность глубокой пассивации электродов гидроксосоединениями железа и других металлов, необходимость применения различных реагентов для доочистки стоков, сложность электротехнического оборудования, значительный расход листового металла и необходимость грузоподъемных устройств для замены электродов, большой расход (до 16 кВт/ч на 1 м3 очищаемого стока) электроэнергии, невозможность извлечения из шлама тяжелых металлов изза высокого содержания железа, необходимость предварительного разбавления стоков до суммарной концентрации ионов тяжелых металлов ≈100 мг/л. Пассивация анодов и катодов, устраняемая механически при гальванокоагуляции, в случае электрокоагуляционных процессов значительно снижает технологичность метода. Возрастает напряжение на электролизере и затраты электроэнергии, снижается выход по току целевого процесса и его эффективность. Пассивация части анодной поверхности приводит к увеличению плотности тока на активных частях анода и его неравномерному растворению. Разрастание оксидных пассивирующих слоев в областях с невысокой скоростью протока электролита в межэлектродном зазоре может вызвать короткое замыкание в электродном блоке, так как оксиды железа обладают электронной проводимостью. Предотвращение возможности пассивации требует введения в обрабатываемый поток активирующих добавок, например хлорида натрия. При этом рекомендуется поддерживать в стоке соотношения анионов, указанные в табл. 8.1. 155 Таблица 8.1 Рекомендуемые соотношения количества анионов в обрабатываемой воде, обеспечивающие устойчивую растворимость анодов Концентрация Cr (VI), мг/дм3 При отсутствии пассивирующих анионов Менее 100 Cl− 1 SO 24 − + Cl − 1 = ; = 1 Cr 6+ 4 Cr 6 + Более 100 Cl − 1 = 6+ 1 Cr При наличии в стоке пассивирующих анионов SO24− + Cl− 16 = − − 2− 3− 1 NO2 + NO3 + CO3 + PO4 К физическим методам предотвращения пассивации относятся ультразвуковая очистка электродов, механическая вибрация, встряхивание, реверсный режим токовой нагрузки, высокая скорость движения воды в межэлектродном пространстве, подвижные (вращающиеся) электроды и др. Они обеспечиваются конструктивными особен-ностями аппаратовэлектрокоагуляторов. Для ускорения процесса окисления соединений железа и, соответственно, достижения более глубокой степени очистки раствора при сокращении времени обработки стоков, усиления флотационного эффекта и оптимизации гидродинамического режима работы аппаратов электрокоагуляции целесообразно осуществлять продувку рабочего объема сжатым воздухом. Электрокоагуляционную очистку целесообразно применять при исходной концентрации Cr (VI) в сточных водах не более 150 мг/дм3 и исходном солесодержании не более 300 мг/дм3. Низкое исходное солесодержание рН, а также близкий к нейтральному рН, приводят к повышенному напряжению на электролизере (даже без пассивации анодов) и большим расходам электроэнергии на обработку стоков. В ходе электролиза рН стока увеличивается, прирост может составить 1–4 единицы. Оптимальные значения рН зависят от соотношения концентраций ионов тяжелых металлов и концентрации хрома(VI) (табл. 5.2). При этом суммарная концентрация тяжелых металлов не должна превышать 100 мг/дм3, а концентрация каждого из них 30 мг/дм3. Таблица 8.2 Оптимальные значения рН хромсодержащих стоков Концентрация Cr (VI), мг/дм3 При наличии Zn2+, Cu2+ При наличии Ni2+, Cd2+ Менее 20 6–7 6–7 20–50 5–6 6–7 50–150 4–6 5–6 156 Полнота восстановления хрома (VI) зависит от интенсивности растворения железных анодов, которая определяется количеством пропущенного электричества. Теоретический расход электричества на восстановление 1 г Cr (VI) составляет 3,08 А·ч и рассчитывается исходя из количества электричества, затрачиваемого на растворение 1 г металлического железа (0,96 А·ч/г), и количества железа, необходимого для восстановления 1 г Cr (VI) (3,2 г (Fe2+)/г (Сr6+), в соответствии со следующим уравнением реакции: + 2+ 3+ 3+ Cr2O72− + 14Н + 6Fe → 2Cr + 6Fe + 7H2O⎯. (8.9) При обработке сточных вод, в которых содержание обезвреживаемого хрома значительно превышает содержание ионов других тяжелых металлов, высокая степень очистки по всем видам примесей достигается при расходе электроэнергии и анодов в количествах, соответствующих содержанию Cr (VI). Если соединения хрома практически отсутствуют, высокая степень очистки может быть достигнута при исходной величине рН сточных вод, близкой к величине рН начала гидратообразования соответствующих гидроксидов металлов (табл. 8.3), а также при условии перевода в раствор определенного количества железа (табл. 8.4). Таблица 8.3 Значения величины рН осаждения гидроксидов металлов при их исходной концентрации 0,01 моль/дм3 и остаточная концентрация ионов металлов при рН 8,5–9,0 рН начала осаждения рН полного осаждения рН начала растворения Остаточная концентрация, мг/дм3 Mn(OH)2 8,8 10,4 14,0 1,8–2,0 Fe(OH)2 7,5 9,7 13,5 0,3–1,0 Fe(OH)3 2,3 4,1 14,0 0,3–0,5 Zn(OH)2 6,4 8,0 10,5 0,10–0,05 Cr(OH)3 4,9 6,8 12,0 0,10–0,05 Ni(OH)2 7,7 9,5–10,0 – 0,25–0,75 Al(OH)3 4,0 5,2 7,8 0,1–0,5 Cd(OH)2 8,2 9,7–10,5 – 2,5 Cu(OH)2 5,5 8,0–10,0 – 0,10–0,15 Формула гидроксида 157 Таблица 8.4 Удельные расходы железа и электричества на очистку стоков от ионов тяжелых металлов методом электрокоагуляции Расход железа, г/г удаляемого металла Теоретический расход электричества, А ⋅ ч/г удаляемого металла Цинк (Zn2+) 2,5–3,0 2,30–2,88 Медь (Cu2+) 3,0–3,5 2,88–3,36 Кадмий (Cd2+) 4,0–4,5 3,84–4,32 Никель (Ni2+) 5,5–6,0 5,30–5,75 Металл Метод электрокоагуляции можно использовать для очистки сточных вод от нефтепродуктов, масел, жировых загрязнений. Конструкции аппаратов электрокоагуляции, а также возможные технологические схемы обработки сточных вод широко представлены в соответствующей литературе. 8.3. Электрокоагуляционная очистка сточных вод В настоящее время электрокоагуляционный метод используется для очистки сточных вод от суспензий, эмульсий и коллоидов, основу которых составляют нефтепродукты, жиры и масла от операций мойки и обезжиривания деталей. Возможно также удаление ионов тяжелых металлов, анионов хромовой кислоты, неорганических солей и водорастворимых ионо- и неионогенных органических веществ. В общем случае для реализации процесса электрокоагуляционной очистки сточных вод необходим набор соответствующего оборудования. Один из вариантов технологической схемы этого метода для очистки воды от ионов тяжелых металлов приведен на рис. 8.4. Рис. 8.4. Схема электрокоагуляционной установки: 1 – усреднитель; 2– бак для приготовления раствора; 3 — источник постоянного тока; 4 – электрокоагулятор; 5 – отстойник; 6 – аппарат для обезвоживания осадка 158 Как следует из приведенной схемы, сточная вода вначале поступает в резервуар-усреднитель 1, где происходит повышение рН обрабатываемой воды до необходимой величины. Чаще всего в промышленные стоки приходиться добавлять кислоту, например, 10% раствор H2SO4. В зависимости от состава сточных вод в некоторых случаях для предотвращения пассивации анодов и повышения электропроводности сточной воды в поток инжектируется 5% NaCl. После обработки воды в электрокоагуляторе 5, она самотеком поступает в горизонтальный отстойник 6. Туда же из емкостей или с помощью насоса подается 10% раствор NaOH для достижения рН гидратообразования присутствующих в сточной воде ионов. Для ускорения осаждения образующихся гидроксидов металлов добавляется также флокулянт (чаще всего полиакриламид, хотя в последнее время предложены и другие вещества–флокулянты). Основным элементом такой схемы являются электрокоагуляторы. Электрокоагуляторы – это электролизеры с растворимыми анодами, конструкция которых зависит от состава загрязнений в сточной воде, экономичности процесса, способа подачи загрязненной воды и способа удаления отходов. Предлагаются к использованию электрокоагуляторы прямоугольные, цилиндрические, барабанные, насыпные (стружечные) и т.д. Принцип работы электрокоагулятора любого типа основан на анодном растворении металла, последующем гидролизе образующихся при анодном растворении соединений с образованием гидрооксидов, способствующих коагуляции (укрупнению) диспергированных в воде частиц и ускорению их процессе отстаивания. В качестве анодного материала в электрокоагуляционной очистки используется сталь или алюминий. Конструктивно коагуляторы с пластинчатыми электродами представляют собой прямоугольный резервуар, изготовленный из синтетических материалов (например, полипропилена) или футерованных ими. В обязательном порядке электрокоагулятор должен оборудоваться вытяжными устройствами для удаления образующихся при электролизе газов. Схема типовой электрокоагуляционной установки приведена на рис. 8.5. 159 Рис. 8.5. Компонов Р К вка промы ышленной электроокоагуляц ционной устаноовки: 1 – электроодный блоок, 2 – усттройство загрузки электрод дных пакетоов; 3 – двуутавр; 4 – агрегат выпрямит в тельный; 5, 9–12 – вентили;; 6 – рабочаая площад дка; 7 – воздуховооды; 8 – веентиляторр центроб бежный В корпуссе размеещают паакеты пл лоских плластинчаттых элекктродов, располложенныхх вертикаально и параллельн п но друг другу. д Прри этом сттальные пласти ины закррепляютсяя на об бщей рам ме и под дключаю ются череез одну соотвеетственноо к анодной и каттодной шинам. Рекомеендуется придеррживатьсся следую ющих разм меров плаастин: длина – 0,66–1,0м; ширина ш – 0,3–0,66м; толщ щина – от о 3 до 6мм; 6 маттериал – Ст3, Стт4, масса одного электрродного блока б не должна д прревышатьь 50кг. Д Движени е потокка сточн ных вод д в электрокоаггуляторе вдоль поверххности эллектродны ых пласттин осущ ществляетсся либо в вертиккальном, либо в горизоонтальном м направвлении. Для Д равн номерногоо распределения обрабаатываемоой воды в электроокоагуляторе или в отдельн ных его секциях предуссматриваю ют прием мные и сборные камеры. Прриемные ккамеры оттделяют от рабочего р прострранства дырчаты ыми пеерегородкками, которые к рассчи итывают как расп пределитель высо окого соп противлеения (отн ношение суммаарного сечения отверстий й в пер регородкаах к об бщему сечению с электррокоагуляятора состтавляет боолее 0,3). Э Электрок коагуляторы с заасыпными и стружеечными анодами имеют различ чное кон нструктиввное исп полнениее, каждое из ни их имееет свой преим мущества и недосстатки. Схемы С электроко э оагуляторров такогго типа предсттавлены на н рис. 8.66. 160 Рис. 8.6. Принципиальные схемы конструкций электрокоагуляторов с «засыпными» элеткродами типа ЭКЗЛ: 1 – корпус; 2 – засыпной анод; 3 – катод; 4 – анодный токоподвод; 5 – разделительные сеткн; 6 – подвод стока и сжатого воздуха; 7 – подвод сжатого воздуха Растворимым аноды для процесса электрокоагуляции должны отвечать следующим требованиям: – растворяться количественно с образованием гидроксидов металлов, которые обладают сорбционными и коагуляционными свойствами. Таким требованиям отвечают электроды из алюминия марок А00, АМг, АМц и др. Наиболее распространенные конструкционные сплавы типа Д16, хотя и плакированы алюминием повышенной чистоты (толщина плакированного слоя 0,1-0,3мм) в своей основе содержат до 5% меди, которая образует на поверхности анода трудноудаляемые основные соли, препятствующие дальнейшему анодному растворению металла; – растворяться с образованием переходной формы акваионов, обладающих восстановительными свойствами. Примером таких анодов являются стальные из сталей марки Ст. 3. Переходя в раствор в виде гидратированного двухвалентного иона, они способны химически восстанавливать ионы Cr(VI) до трехвалентного состояния, окисляясь до Fe3+, и далее совместно гидролизуются, образуя осадок, обладающий сорбционными и коагуляционными свойствами. Общим недостатком электрокоагуляционного метода является относительная нестабильность процесса вследствие пассивации анодов и повышенного шламообразования. Поэтому в процессе работы рекомендуется периодически изменять полярность электродов. Кроме того, 161 нельзя допускать поступления на обработку стоков при рН<3, т.к. в этом случае наблюдается химическое растворение железа и не происходит образования и коагуляции гидроокисей Cr(OH)3 и Fe(OH)3. При появлении пассивной пленки процессом управляют по данной технологии обычно регулированием диапазона величины тока путем повышения напряжении на электродах. Для активации поверхности анодов осуществляется периодическая перемена полярности электрического тока посредством его реверсирования с помощью источника питания. При уменьшении плотности тока ниже порогового значения и невозможности компенсировать его рост дальнейшим увеличением напряжения в ряде случаев в обрабатываемую воду вводят раствор поваренной соли для повышения электропроводности очищаемой воды и активации поверхности электродов. Однако при некоторых режимах электролиза во время протекания анодного процесса пассивная шламовая пленка успевает уплотняться и депассивирующее действие обратной (катодной) составляющей тока недостаточно для разрушения образовавшейся на поверхности электрода плотной окисной пленки. Для устранения таких недостатков применяется нестационарный электролиз К оптимальным условиям электрокоагуляционной очистки относят: рН при обработке эмульгированных стоков в пределах 3,5-4,0 (при рН < 8 процесс коагуляции протекает в объеме аппарата); интервал плотностей тока 0,2-2 А/дм2 (уточняется в зависимости от гидродинамического режима и природы образующихся дисперсий), потенциал анода не должен превышать 0,45-0,6 В; скорость протока жидкости должна составлять 1-10 мм/с. Присутствие в растворе поверхностно-активных веществ приводит к ухудшению очистки от ионов тяжелых металлов, поскольку ПАВ преимущественно адсорбируются на частицах гидроокиси железа или алюминия. В присутствии органических ПАВ скорость седиментации снижается с 0,3 до 0,15-0,12 мм/с. Для стружечных электрокоагуляторов степень плотности стружечной засыпки должна составлять 3,5-7,0 см2/см3 . При очистке электрокоагуляционным методом сточных вод от ионов хрома рН должен составлять 4,5–5,5, при удалении ионов никеля – 6,5–7,5, меди – 4–6. Для улучшения процесса укрупнения образующихся частиц в раствор рекомендуется добавлять вещества-флокулянты. Для технологического расчета электрокоагулятора необходимы следующие исходные данные: – расход сточных вод Qж, м3/ч; – исходное содержание масел или ионов тяжелых металлов Сисх, кг/м3 ; – удельный расход электричества на обработку сточных вод, qуд, А · ч/м3 ; – допустимая анодная плотность тока, iан, А/м2. 162 Работа электрокоагулятора может быть организована в непрерывном или периодическом режиме . Для электрокоагулятора периодического действия необходимо придерживаться следующей последовательности расчета. Принимая время очистки (цикла) tц, ч, состоящим из времени обработки tобр, ч, и времени налива и слива жидкости tнап, ч: tц = tобр + tнап, (8.10) определяем объем раствора Vр-ра, подаваемого в электрокоагулятор: Vр-ра = Qжtц. (8.11.) Количество электричества Q, А · ч, необходимое для обработки рассчитанного по уравнению (8.12) объема раствора оценим из соотношения: Q = qуд Vр-ра . (8.12) Сила подаваемого на шины электрокоагулятора тока I, А, составит: I= Q tобр . (8.13) Исходя из принятой анодной плотности тока iан, А/м2, общая анодная поверхность Sан, м2, будет определяться как Sан = I iан . (8.14) При заданной толщине пластин δ, мм, (обычно5–6мм), суммарный объем электродов Wэл-д, м3, составит: Wэл-д = Sан δ·10–3 (8.15) Масса электродов Мэл-д, кг, определиться по соотношению: Мэл-д = Sан ρмат, (8.16) где ρмат – плотность материала электродов, кг/м3. Масса одного блока Мбл не должна превышать 50 кг, поэтому в составе необходимое количество электродных блоков nбл электрокоагулятора: 163 nбл = M эл-д . M бл (8.17) Общий объем жидкости в межэлектродном пространстве всех электродных блоков Vмэл-д, м3, составит: Vмэл-д = Sанb·10–3, (8.18) где b – межэлектродное расстояние, обычно принимается около 20мм. Объем одного электродного блока Wбл, м3, необходимо рассчитывать из соотношения: Wбл = Vэл-д + Vмэл-д nбл (8.19) Условно принимая форму блока кубической, определим длину его ребра lбл, м: lбл = (Wбл)1/3. (8.20) Тогда число электродов в одном блоке n нужно рассчитать по формуле: n= lбл δ +b (8.21) Следовательно, электродный блок будет состоять из n/2 анодов и n/2 катодов. Для определения габаритных размеров электрокоагулятора применяется следующий подход. Для расчета внутренней длины Lэл-к, м, используется соотношение: Lэл-к = nбл lбл + (nбл+1)lуст, (8.22) где lуст – зазор между электродными блоками, необходимый для монтажа– демонтажа электродных блоков, проведения профилактических работ и т.д. Необходимая рабочая ширина Bэл-к, м, составит: Bэл-к = lбл +2l уст (8.23) По высоте верхней кромки электродов объем жидкости, м3 Vк.элд = Lэл-к Bэл-к (lбл + lуст ) – Wэл-д . 164 (8.24) Исходя из этого высота слоя жидкости над электродами: hн.элд = Vр-ра − Vк.элд Lэл-р Bэл-р . (8.25) И тогда общая высота слоя жидкости Hж, м, в электрокоагуляторе будет определяться соотношением следующих величин: Hж = lбл + lуст + hн элд (8.26) С учетом необходимости размещения пеносгонного устройства высота аппарата Hэл-к, м, составит (8.27). Hэл-к = Hж + (0, 2–0,25 ) Для электрокоагулятора непрерывного действия сохраняется такая же последовательность проведения расчета. Однако в электрокоагуляторах непрерывного действия не допускается проскок жидкости вне межэлектродного пространства. Поэтому отсутствуют установочные зазоры между боковыми стенками и крайними электродами. Выпускаемое малыми сериями применительно к разрабатываемым проектам очистных сооружений оборудование для электрокоагуляционной очистки имеет производительность по обрабатываемой жидкости 8–20 м3/ч. Электродные блоки таких установок могут комплектоваться железными, алюминиевыми анодами или их комбинацией в зависимости от характеристик сточных вод. Таблица 8.5. Технические характеристики электрокоагуляционных установок Наименование показателя Производительность ячейки, м3/ч Количество ячеек, шт. рабочих резервных Рабочее напряжение, В Рабочая плотность тока, А/дм2 Расстояние между электродами, мм Длина рабочей части электродов, м Суммарная анодная поверхность рабочей ячейки, м2 Потребляемая мощность, кВт Габаритные размеры, м Масса установки, кг Скорость протекания обрабатываемой воды между электродами, м / с Время контакта обрабатываемой воды с поверхностью электродов, с 165 Производительность, м3/ч 8 20 4 4 2 2 6-12 0,2-1,0 6 0,75 4,5 5 5 6-12 0,2-1,0 6 0,75 4,5 12,8 1,2×0,94×1,38 780 38,4 2,25×0,94×1,39 1600 0,02-0,03 0,02-0,03 25-35 25-35 Применительно к процессам очистки сточных вод от всех форм хрома методика расчета может быть несколько видоизменена с учетом наработанных практических данных. Так, например, для расчета количества электричества, необходимого для восстановления хрома, применимо соотношение Q= mп q удγ ВТ Fe , (8.28) где mп – масса превращаемых ионов хрома (VI) в единице объема, мг/м3; qуд – удельные затраты электричества, qуд = 10 Кл/мг, определяется как величина, обратная электрохимическому эквиваленту хрома в реакции его электровосстановления); γ – коэффициент, учитывающий влияние физикохимических свойств раствора на характер протекающих электрохимических реакций в объеме потока; ВТFe – выход по току в реакции анодного растворения железа, доли единицы, зависит от исходного солесодержания и рН обрабатываемой воды. Соотношения между приведенными величинами представлены в табл. 8.6. Таблица 8.6. Соотношение рН и выхода по току рН ВТFe γ 2,0 1,0 1,1 3,0 0,9 1,11 4,0 0,8 1,12 5,0 0,7 1,14 6,0 0,6 1,16 7,0 0,5 1,2 8,0 0,4 1,3 Масса превращаемого в единице объема продукта mп , мг/м3, в свою очередь зависит от степени превращения и эффекта превращения: mп = Сисх αп − Cкон , (8.29) где Сисх – исходное содержание всех форм хрома, мг/м3; αп– степень превращения; Скон – остаточное содержание хрома, не может превышать предельно допустимый уровень и составляет до 0,001 мг/л. В свою очередь степень превращения αп ионов шестивалентного хрома оценивают из соотношения: αп = 1 − ССrнач(VI ) кон СCr (VI ) (8.30). где ССrнач(VI ) – содержание ионов хрома (VI) в промывной воде, мг/м3; С Cr (VI ) – кон 166 содержание ионов хрома (VI) в обработанной воде, мг/м3 Далее определяется сила тока I, А, в цепи электрокоагулятора по формуле: I= Q ⋅ Qж , 3600 (8.31) где Q – удельные затраты электричества, Кл/м3 (см. формулу 4.19); Qж – объем обрабатываемой сточной воды, м3/ч. Геометрические размеры электродов (площадь Sэлд, м2, объем Wэлд, м3) и их количество nэлд рассчитывают используя соотношения (8.32– 8.34): Q ⋅ Qж , 3600iан S δ Wэлд = элд , 1000 S элд . nэлд = 2 hэлдbэлд Sэлд = (8.32) (8.33) (8.34) где iан – рабочая анодная плотность тока, А/м2; δ – толщина стальныхпластин, мм; hэлд – высота электродов, мм; bэлд – ширина электродов, мм. При этом толщина пластин δ составляет 6–8 мм, высота электродов hэлд принимается в пределах 0,5–1,2м, ширина электродов bэлд – в пределах от 0,2 до 0,8 м. Число электродов не должно превышать 30-40. Габаритные размеры электрокоагулятора определяются как указано выше. 8.4. Гальванокоагуляция Метод гальванокоагуляции основан на электрохимической обработке сточных вод под действием электрического тока короткозамкнутого гальванического элемента (гальванопары), который возникает при переменном контакте электропроводных материалов, имеющих различные электрохимические потенциалы. Наиболее распространенными и эффективными материалами являются Al (Е0 = –1,662 В), Fe (Е0 = –0,44 В), Сu (Е0 = +0,337 В) и углерод С (графит) (Е0 = +0,36 В). В процессе работы гальванокоагуляционного аппарата продукты анодного растворения скрапа (железной или алюминиевой стружки) и продукты их физико-химического взаимодействия с компонентами очищаемого раствора в виде суспензии выносятся из аппарата с 167 обработанным стоком и отфильтровываются. Растворение железных анодов с образованием Fe2+ предоставляет дополнительные возможности методу и позволяет обезвреживать стоки, содержащие до 200 мг/дм3 Сr (VI). Являясь разновидностью электрохимических способов очистки сточных вод, этот метод выгодно отличается от других простотой аппаратурного оформления, невысокой чувствительностью к изменениям состава обрабатываемых стоков, незначительными требованиями к квалификации обслуживающего персонала. Более того процесс осуществляется практически без введения химических реагентов и подачи постоянного тока на электроды. Важным преимуществом данного способа является также возможность его применения в растворах различного количественного и качественного состава, так как поверхностная пассивация электродов механически устраняется в процессе работы установки. Наряду с очевидными достоинствами, метод характеризуется определенными недостатками, среди которых можно выделить необходимость доочистки обработанных вод перед дальнейшим использованием или сбросом, большой объем осадка и сложность его обезвоживания. В основе принципа гальванокоагуляции лежат те же физикохимические процессы, которые составляют сущность методов обработки стоков солевыми коагулянтами или электрокоагуляции. Ионы железа или алюминия являются сильными коагулянтами, которые нарушают устойчивость коллоидных частиц, присутствующих в обрабатываемом растворе. В процессе гидролиза эти ионы образуют гидроксосоединения сложного состава и пространственной структуры, способные сорбировать вещества и частицы разной природы: от мелкодисперсных механических загрязнений до органических компонентов и ПАВ. Коагуляция и уплотнение гидроксосоединений приводит к образованию пульпы – смеси малорастворимых веществ различной степени дисперсности и химического состава, отделяемой от очищаемого потока фильтрованием. Поскольку растворимость гидроксосоединений Fe3+ значительно ниже растворимости таковых у Fe2+ (например, ПР(Fe(OH)3) = 2,79 · 10–39, ПР((Fe(OH)2) = 4,87 · 10–17), для более полной очистки стока необходимо добиваться окисления железа (например, кислородом воздуха). Отличие гальванокоагуляции от электрокоагуляции заключается в том, что ионы-коагуляторы Fe2+ (или Al3+) образуются в результате растворения анодов за счет создания гальванопары «стальные стружки (алюминий) – графит (отходы меди)». Рассмотрим основные реакции, происходящие в гальванокоагуляторе при обработке хромсодержащих стоков, не касаясь вопросов, подробно изложенных в теоретических сведениях к лабораторной работе № 8. Химический и электрохимический (коррозионный) механизм 168 саморастворение железа в аэрируемых водных средах. Саморастворение железа в водных средах представляет собой сложный процесс, механизм которого зависит от рН электролита и может быть представлен цепью последовательных стадий. В соответствии с механизмом, предложенным Хойслером, растворение протекает по схеме Fe + OH– ↔ Fe(OH) адс + e–; Fe(OH)адс + Fe → Fe(FeOH)адс; Fe(FeOH)адс + OH– → Fe(OH)адс + (FeOH)+ + 2e– ; (FeOH)+ + H+ → Fe2+ + H2O. (8.35) (8.36) (8.37) (8.38) Электрохимическая двухэлектронная стадия является замедленной, в реакции принимает участие катализатор (FeOH)адс, который образует активированный комплекс с железом и гидроксид-ионами. Кинетическая схема окисления железа в щелочном растворе Кабанова-Бурштейна-Фрумкина также предполагает растворение с образованием промежуточных кислородсодержащих адсорбированных частиц (8.39) Fe + OH– → Fe(OH)адс + e–; – – Fe(OH)адс + OH ↔ FeOадс + H2O + e ; (8.40) − – (8.41) FeOадс + OH → HFe O 2 ; (8.42) HFe O −2 + H2O → Fe(OH)2 ; Процесс растворения сопровождается пассивацией анодной поверхности. Для анализа возможности активного расвторения анода следует воспользоваться диаграммой Пурбе для железа, в упрощенном виде представленной на рис. 8.6. Рис. 8.6. Диаграмма Пурбе для железа 169 На этой диаграмме не учтены возможности образования малорастворимых соединений типа фосфатов, силикатов, оксосоединений и др. Очевидно, пассивирующие слои могут состоять: – из смешанных гидроксосоединений железа разной степени гидратации: (8.43) Fe2+ + 2OH– → Fe(OH)2, 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3, (8.44) Fe(OH)3 → FeOOH + H2O, (8.45) 2Fe(OH)3 → Fe2O3 + H2O, (8.46) nFe(OH)2 + mFe(OH)3 → nFeO · mFe2O3 · xH2O(ржавчина) . (8.47) – солей, образующихся в результате взаимодействия продуктов растворения железа с анионами электролита: FeF2, Fe3(PO4)2 и др.; – осадков более электроположительных металлов, образующихся по реакции контактного вытеснения: (8.48) Cu2+ + Fe → Cu + Fe2+ . Присутствие в обрабатываемых растворах сильных окислителей (например, хромат- и бихромат-анионов, нитратов, нитрит-анионов) значительно увеличивает склонность анодов к пассивации за счет ускорения процесса окисления Fe2+ → Fe3+ с образованием оксидов, а также за счет образования пассивирующих хроматных пленок, включающих ионы железа и хрома в разных степенях окисления, анионы электролита. Поскольку гальванокоагуляция – гетерогенный процесс, сокращение активной поверхности резко снижает скорость растворения железа. Поэтому для механического обновления поверхности процесс ведут при непрерывном перемешивании загрузки в аппарате. Продукты пассивации железа, удаляемые с поверхности механически, практически не растворяются в обрабатываемом растворе и входят в состав гальванокоагуляционной пульпы. При содержании хроматов свыше 200 мг/дм3 пассивацию поверхности устранить не удается и эффективность гальванокоагуляции резко падает. Cопряженные процессы электрохимического восстановления деполяризаторов. В водных средах деполяризаторами катодного процесса короткозамкнутого коррозионного элемента Fe–С могут быть ионы H+ при рН ≤ 4 и растворенный в стоках кислород O2: 2H+ + 2e– → H2; (8.49) + – O2 + 4H + 4e → 2H2O; (8.50) – – О2 + 2Н2О + 4е → 4ОН . (8.51) Для процесса с кислородной деполяризацией характерна замедленность стадии переноса кислорода к катодным участкам загрузки. Это обусловлено малой концентрацией кислорода в электролитах вследствие плохой его растворимости в воде и водных растворах, 170 значительно уменьшающейся с увеличением солесодержания, поэтому на катодных участках возможно восстановление других деполяризаторов, например, катионов некоторых металлов (Ni2+, Cu2+): Cu2+ + 2e– → Cu. (8.52) Интенсивное осаждение этих металлов на катоде гальванопары так же, как и анодная пассивация, может быть причиной снижения эффективности гальванокоагуляционной обработки. Поэтому содержание цветных металлов в стоках, поступающих на гальванокоагуляцию, ограничено величиной ≈150 мг/дм3. Небольшие количества таких осадков эффективно удаляются с поверхности стружек и графита за счет механического истирания. Активными деполяризаторами являются окислительные анионы и катионы: (8.53) Cr2 O 72− + 14H+ + 6e– → 2Cr3+ + 7H2O; рН < 5,5 (8.54) Cr O 24− + 4Н2O + 3e– → Cr(OH)3 + 5OH–; pH > 5,5 3+ – 2+ (8.55) Fe + e → Fe Катодный процесс (реакции 8.49-55) приводит к защелачиванию обрабатываемого стока, что облегчает образование осадка. Коагуляция мелкодисперсных и коллоидных примесей очищаемых стоков соединениями железа (алюминия). Положительно заряженные коагулянты нейтрализуют отрицательный заряд, окружающий коллоидные частицы и другие мелкодисперсные примеси, что нарушает их устойчивость. Механизм процесса коагуляции аналогичен механизму, реализуемому при обработке сточной воды солями железа и алюминия. Однако по сравнению с реагентным коагулированием при гальванокоагуляции не происходит обогащения воды сульфатами и хлоридами, содержание которых в воде лимитируется как при сбросе очищенных сточных вод в водоемы, так и при повторном использовании в системах промышленного водоснабжения. Окислительно-восстановительные реакции в объеме раствора. Образующиеся в результате растворения анодного скрапа соединения двухвалентного железа окисляются кислородом воздуха, растворенным в электролите: 4Fe2++ O2 + 4Н+ → 4Fe3+ + 2H2O; 4Fe2++ O2 + 2Н2O → 4Fe3+ + 4OH– ; 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3; 4Fe(OH)2 + О2 → 4FeOOH + 2H2O; 4Fe2++ O2 + 8OH⎯ → 4FeOOH↓ + 2H2О; (8.56) (8.57) (8.58) (8.59) (8.60) В нейтральных растворах хорошо коагулируемые хлопья темнозеленого цвета Fe(OH)2 окисляются до Fe(OH)3 бурого цвета. Для окисления 1 мг Fe2+ требуется 0,143 мг растворенного кислорода. В водопроводной воде с температурой 15°С содержится 10 мг/дм3 кислорода. Такого 171 количества кислорода достаточно для окисления 70 мг/л двухвалентного железа в трехвалентное. Однако в промышленных стоках растворенного кислорода очень мало, в связи с чем при их очистке возникает необходимость в дополнительном насыщении стоков кислородом воздуха. При гальванокоагуляционном методе очистки эта проблема решается самим устройством гальванокоагулятора. Например, в традиционной конструкции – барабанном гальванокоагуляторе – при вращении аппарата вокруг продольной оси загрузка попеременно то погружается в обрабатываемый раствор, то поднимается над раствором, насыщая его воздухом. Соединения железа (II) способствуют восстановлению хрома (VI) до хрома (III) при рН < 5,5: Cr2 O 72− + 14Н+ + 6Fe2+ → 2Cr3+ + 6Fe3+ + 7H2O; (8.61) при pH > 5,5: Cr O 24− + 4Н2О + 3Fe(OH)2 → Cr(OH)3 + 3Fe(OH)3 + 2OH⎯. (8.62) Образование в объеме очищаемого раствора твердой фазы. Состав шлама, образующегося в результате гальванокоагуляционной очистки, колеблется в следующих пределах (масс.%): железо – 30–60; медь – 0,25– 2,2; цинк – 0–0,12; никель – 0,01–0,3; хром – 0,43–1,75. Основная масса шлама имеет размер частиц 0,01–0,05 мкм. Рентгенографический фазовый анализ показывает, что основу гальванокоагуляционного шлама составляет магнетит Fe3O4 (FeO · Fe2O3), гематит α-Fe2O3 и лепидокрокит γ-FeOOH. В осадке также определяются ферриты цветных металлов, имеющие структуру магнетита, сульфиды железа, кремнезем SiO2, а также рентгеноаморфное вещество, образующееся за счет механического разрушения графита в процессе гальванокоагуляции. Перечисленные выше оксосоединения железа – продукт частичной или полной дегидратации гидроксосоединений железа, образующихся по вышеприведенным реакциям (8.40–60). Ферриты цветных металлов – солеподобные соединения гипотетической железистой кислоты HFeO2, в которой ионы водорода замещены ионами металлов. В образовании ферритов тяжелых металлов участвуют только ферромагнитные оксидные и гидроксидные формы железа, имеющие кубическую кристаллическую структуру типа шпинели (MgO · Al2O3). При шпинельной ферритизации в этих соединениях происходит замещение атома железа атомом тяжелого (цветного) металла: Fe(OH)2 + 2Fe(OH)3 → FeО · Fe2O3 + 4H2O; Zn2+ + 2Fe(OH)3 → ZnO · Fe2O3 + 2H2O + 2H+; 2Cr(OH)3 + Fe(OH)2 → FeO · Cr2O3 + 4H2O. 172 (8.63) (8.64) (8.65) Способность металлов к совместному осаждению с гидроксосоединениями железа и ферритообразованию усиливается в ряду Cd < Zn < Co < Ni < Cu Степень очистки с образованием ферромагнитных продуктов повышается при обработке стоков, содержащих одновременно ионы нескольких металлов, по сравнению с обработкой индивидуальных стоков, а также при увеличении рН и температуры обрабатываемых стоков. Явления дегидратации и ферритообразования увеличивают степень очистки сточных вод и улучшают фильтруемость стоков после гальванокоагуляции. Основные области применения гальванокоагуляционного метода – обезвреживание хромсодержащих сточных вод и очистка стоков от ионов тяжелых металлов. Наиболее эффективное извлечение меди, цинка, хрома (VI) и хрома (III) из стоков в виде сернокислых растворов наблюдается при pH исходной сточной воды 2,5–2,7, причем медь и трехвалентный хром эффективно извлекаются в широком диапазоне исходных концентраций – от 50 до 250 мг/дм3, а обезвреживание шестивалентного хрома – до 200 мг/дм3. Извлечение цинка и никеля наиболее эффективно при низких концентрациях – до 50 и 100 мг/дм3, соответственно. При гальванокоагуляции расход железа составляет 0,2–1 кг на 1 м3 очищенной сточной воды в зависимости от pH. В результате на 1 м3 очищенных стоков образуется до 1,5 кг железосодержащих отходов. Для глубокой очистки сточных вод рассматриваемый способ используют в сочетании с последующей обработкой стоков известковым молоком и многоступенчатой очисткой от взвешенных частиц. Подробное описание конструктивных особенностей оборудования, технологических схем обработки стоков приводится в соответствующей литературе. 173 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ 1. Лаптев И.Д. Экологические проблемы. М.: Мысль, 1982. - 112 с. 2. Новиков Ю.В., Сайфутдинов М.М. Вода и жизнь на Земле. М.: Наука, 1981.-134 с. 3. Никитин Д.П., Новиков Ю.В. Окружающая среда и человек. - М.: Высш. шк., 1980.-120 с. 4. Ласкорин Б.Н., Громов Б.В., Цыганков А.П., Сенин В.Н. Безотходная технология в промышленности. М.: Стройиздат, 1986. - 160 с. 5. Родионов А.И., Клушин В.И., Торочешников И.С. Техника защиты окружающей среды: учеб. для вузов 2-е изд., перераб и доп. М.: Химия, 1989. – 512 с. 6. Смоляг Н.Л. Основы технологического расчета оборудования для ресурсосберегающих технологий: учеб.-метод. пособие. Мн.: БГТУ, 2007. – 110 с. 7. Яковлев С.В., Краснобородько И.Г., Рогов М.С. Технология электрохимической очистки воды. Л.: Стройиздат, 1987. – 312 с. 8. Когановский А.М. и др. Очистка и использование сточных вод в промышленном водоснабжении. М.: Химия, 1983. – 288 с. 9. Гибкие автоматизированные гальванические линии: справочник / под общ. ред. В. Л. Зубченко. М.: Машиностроение, 1989. – 672 с. 10. Экологически безопасное гальваническое производство / под ред. В.Н. Кудрявцева. М.: Глобус, 1998. – 302 с. 11. Слесаренко О.А., Жарский И.М. Ресурсосбережение: лабораторный практикум по дисциплине «Основы ресурсосбережения в электрохимических технологиях» для студентов специальности 1–48 01 04 «Технология электрохимических производств». Мн.: БГТУ, 2009.– 90 с. 12. Методы очистки производственных сточных вод: справ. пособие / под ред. А. И. Жукова. М.: Стройиздат, 1977. – 204 с. 13. Фрог Б.Н., Левченко А.П. Водоподготовка: учебн. пособие для вузов. М.: Издательство МГУ, 1996. – 680 с. 14. Водоснабжение. Проектирование систем и сооружений: учебное пособие: в 3 томах; т. 2 / под общ. ред. М.Г. Журбы. М.: Издательство АСВ, 2004. – 496 с. 15. Громогласов А.А., Копылов А.С., Пильщиков А.П. Водоподготовка: процессы и аппараты. М.: Энергоатомиздат, 1990. – 272 с. 16. Водоподготовка: справочник / под ред. С.Е. Беликова. М.: Аква-Терм, 2007. – 240 с. 17. Родионов А.И., Клушин В.Н., Торочешников Н.С. Техника защиты окружающей среды. - М.: Химия, 1989. - 512 с. 18. Соболевская Г.Г., Гребенок В.Д., Махно А.Г. Методы очистки сточных вод гальванических производств / Матер, сем. "Охрана окружающей 174 среды от отходов гальванического производства" - М.: изд-во МДНТП, 1990. - С. 22 - 24. 19. Тимофеева С.С. Современное состояние технологии регенерации и утилизации металлов сточных вод гальванических производств// Химия и технология воды, 1990. - Т. 12, № 3. 20. Гринберг Д.М., Будрейко Е.Н. Малоотходные и ресурсосберегающие процессы в гальванике / Матер, сем. - М., 1988. - С. 17. 21. Гребенок В.Д. Электродиализ. Киев: Техника, 1976. - 136 с. В.Н. Обработка воды электродиализом. 22. Смагин М.:Стройиздат,1986.172 с. 23. Беспамятное Г.П., Кротов Ю.А. Предельно допустимые концентрации химических веществ в окружающей среде. Справочник. Л.: Химия, 1985. - 528 с. 24. Когановский A.M., Клименко Н.А., Левченко Т.М. и др. Очистка и использование сточных вод в промышленном водоснабжении. М.: Химия, 1983. - 288 с. Л.А. Теоретические основы и технологии 25. Кульский кондиционирования воды. Киев: Наук, думка, 1983. - 528с. 26. Мусаелян СМ. Природно-экономическая оценка водообеспеченности Волгоградской обл. / Поволжский экологический вестник. Вып. 4: Комитет по печати, 1997. 27. Кульский Л.А. Основы химии и технологии воды. Киев: Наук, думка, 1991.-561 с. 19. Кульский Л.А., Гребенок В.Д., Савлук О.С. Электрохимия в процессах очистки воды. Киев: Техника, 1987. -223 с. 20. Когановский A.M. Адсорбция и ионный обмен в процессах водоподготовки и очистки сточных вод. Киев: Наук. думка, 1983. - 240 с. 21. Кульский Л.А., Строкач П.П Технология очистки природных вод. Киев: Наук, думка, 1986. 22. Николадзе Г.И. Технология очистки природных вод. М: Высш. шк., 1987.-479 с. 23. Отведение и очистка поверхностных сточных вод. - Л.: Стройиздат, Ленинград, отд., 1990-224 с. 24. Жуков А.И., Монгайт И.Л., Родзиллер И.Д. Методы очистки производственных сточных вод: Справоч. пособие. - М.: Стройиздат, 1977. 204 с. 25. Методические основы оценки и регламентирование антропогенного влияния на качество поверхностных вод / Под ред. А.В. Караушева. Л., 1987. - 285 с. указания по применению правил охраны 26. Методические поверхностных вод от загрязнения сточными водами. - М., 1982. 175 27. Яковлев С.В., Швецов В.Н., Скирдов И.В. и др. Биологическая очистка производственных сточных вод. Процессы, аппараты и сооружения. М.: Стройиздат, 1985.-208 с. 28. Яковлев С.В., Карелин Я.А. и др. Очистка производственных сточных вод. М.: Стройиздат, 1985. - 335 с. 29. СанПин охраны поверхностных вод от загрязнения сточными водами. № 4630-88. - М.: Минздрав СССР, 1988.- 86 с. 30. Сахаев В.Г., Щербицкий Б.В. Справочник по охране окружающей среды. Киев: Будiвельник, 1986. - 152 с. 31. Справочник по очистке природных и сточных вод / Л.Л. Пааль, Я.Я. Кару, Х.А. Мельдер, Б.Н. Репин. - М.: Высш. шк., 1994. - 336 с. 32. Красавцев Г.Т. и др. Рациональное использование и защита водных ресурсов в черной металлургии. М.: Металлургия. 1989. 33. Гордин М.В., Манусова Н.Б., Смирнов Д.Н. Оптимизация химикотехнологических систем очистки промышленных сточных вод. Л.: Химия, 1977. - 176 с. 34. Макаров В.М., Беличенко Ю.П. и др. Рациональное использование и очистка воды на машиностроительных предприятиях. М.: Машиностроение, 1988. 35. Робинсон Р., Стоке Р. Растворы электролитов. М.: Изд-во иностр. лит., 1963. -64с. 36. Антропов Л.И. Теоретическая электрохимия. М.: Высш. шк., 1984. 512 с. 37. Дамаскин Б.Б., Петрий О.А. Основы теоретической электрохимии. М.: Высш. шк., 1978.-239 с. 38. Яворский Б.М., Детлаф А.А.Справочник по физике М.: Наука, 1964. 848с. 39. Дамаскин Б.Б., Петрий О.А. Введение в электрохимическую кинетику. М.: Высш. шк., 1983.-416 с. 40. Скорчелетти В.В. Теоретическая электрохимия. Л.: Химия, 1970. 608 с. 41. Эрдей-Груз Г. Явления переноса в водных растворах. М.: Мир,1976.595 с. 42. Мищенко К.П., Полторацкий Г.М. Термодинамика и строение водных и неводных растворов электролитов. М.: Химия, 1976. 43. Феттер К. Электрохимическая кинетика. М.: Химия, 1967. -856 с. 44. Измайлов Н.Н. Электрохимия растворов. М.: Химия, 1976. 45. Рогов В.М., Филипчук В.Л. Электрохимическая технология изменения свойств воды. Львов: Выща шк., 1989. - 128 с. 46. Озеров A.M., Кривцов А.К., Хамаев В.А., Фомичев В.Г. Нестационарный электролиз. - Волгоград: Ниж.-Волж. кн. изд-во, 1972. - 160 с. 176 47. Костин Н.А., Кублановский B.C., Заблудовский В.А. Импульсный электролиз. -К.: Наук, думка, 1989. - 168 с. 48. Винник А.Ф., Бойко А.В., Слюсарская Т.В. Некоторые вопросы теории и практики импульсного электролиза / Прикл. электрохимия: Теория, технология и защитные свойства гальванических покрытий // Казанский хим.-технол. ин-т . - Казань, 1991. - С. 31 - 35. 49. Вурдова Н.Г. Особенности процесса электродиализа в условиях импульсного питания ячейки. В сб.: Градостроительство, Волгоград, ВолгГАСА. 1996. - С. 81 - 82. 50. Патент 20832268 Россия, В 01 D 13/02. Способ очистки электролита хромирования/ Вурдова Н.Г., Фомичев В.Т.// Бюл. изобр., 1997. 51. Николаев Н.И. Диффузия в мембранах. М.: Химия, 1980. - 232 с. 52. Хванг С.-Т., Каммермайер К. Мембранные процессы разделения. М.: Химия, 1981.-464с. 53. Электрохимическое обессоливание морской и минерализованной вод. М.: Изд-во НИИТЭХИМ. Апрель, 1986. - 128с. 54. Технологические процессы в применении мембран / Под. ред. Р.Е. Лейси. - М.: Мир, 1976. 55. Гнусин Н.П., Гребенок В.Д., Певницкая М.В. Электрохимия ионитов. Новосибирск: Наука, 1972. - 200 с. 56. Шапошник В.А. Кинетика электродиализа. Воронеж: Изд-во Воронежск. ун-та, 1989.-174 с. 57. Мазанко А.Ф, Камарьян Г.М., Ромашин О.П. Промышленный мембранный электролиз. М.: Химия, 1989. - 237 с. 58. Ионитовые мембраны, грануляторы, порошки: Каталог. М.: Изд-во НИИТЭХИМ. 1977.-44 с. 59. Озергин А.Н. и др. // Высокомол. соед. Т.28, 1986. - С. 2303 - 2307. 60. Eisenberg H.L. Perfluorinated Ionomer Membranes. ACS Washington. 1982.- V.I80. -P. 15. 61. Тимашев С.Ф. //Докл. АН СССР. - 1985.- Т. 283. - С. 930 - 936. 62. Mouritz K.A., Hopfinger A.J. II J. Modern aspects of electrochem. - 1982. V.14. - P. 425 - 433. 63. Николаев Н.И., Курганова Е.В., Чувилева Г.Г. Основные пути развития электрохимических процессов с использованием ионообменных мембран //Хим. промышленность. - 1980. - № 4. - С. 245 - 248. 64. Sarradzin J. Le developpement industriel contemporain des membranes exchangeuses dliones. Bull, union Phys., 1986. - 80, № 688. - P. 1427 1447. 65. Gronovski A.A., Yeager A.L. Factors which affect the permselectivity of Nation membranes in chlor-alcali ellectrolysis // J. Electrochem. Soc., 1991.- 138, № 9. - P. 2690 -2697. 177 66. Гребенок В.Д., Чеботарева Р.Д. и др. Свойства и применение ионитовых мембран к однозарядным противоионам // Химия и технология воды. - 1987. - 9, № 5. - С. 395 - 405. 67. Меньшаков Н.М., Кубасов В.Л., Кришталик Л.И. Исследование электрохимических свойств катионитовой мембраны гомогенного типа // Электрохимия. - 1981.-Т. 12, №2. -С. 275-278. 68. Гнусин Н.П., Кононенко Н.А., Паршиков С.Б. Электроперенос соли через структурно неоднородные ионообменные мембраны // Там же. 1993.Т.29, № 6. - С. 757 - 763. 69. Пономарев М.И., Шендрик О.Р., Жиганас Л.Х. Получение, свойства и применение зарядселективных мембран для опреснения жестких вод //Ионоселективные мембраны и электромембр. пр-сы. М., 1986. -С.91101. 70. Meares P. Ion membranes: principles, production and processes / Ion Exchange: Sci. and Techol.: Proc. NATO Adv. Study Inst., Troja, July 1426, 1985. - Dordrecht e. a., 1986.-P. 529-558. 71. Kobuchi Y., Doi K., Hawada F., Shnozuka ./V./Нихо кайсуй гаккайси, Bull. Soc. Sea Water Sci. Jap., 1987. - 41, № 1. - P. 47 - 50. 72. Дубяга В.П. и др. Полимерные мембраны. М.: Химия, 1981. - 287 с. 73. Лебедев К.А., Никоненко В.В., Заболоцкий В.И. Селективность ионообменных мембран. Теоретический анализ чисел переноса ионов в мембранных системах //Электрохимия. - 1987. - Т.23, №4.-С.501; №5. - С. 601. 74. Заболоцкий В.И., Ельникова Л.Ф. и др. Прецизионный метод измерения чисел переноса ионов в ионообменных мембранах // Там же. - 1987. - Т. 23, № 12. - С. 1626. 75. Гнусин Н.П., Березина Н.П. и др. Физико-химические принципы тестирования ионообменных мембран // Там же. - 1996. - Т. 32, № 2. С. 173. 76. Ионообменные мембраны в электродиализе: Сборник статей под ред. К.М. Салдадзе. Л.: Химия, 1970. - 287с. 77. Коковкин В.В., Хаманн К.Х. О природе потенциометрической селективности ионообменных нафионовых мембран // Электрохимия. - 1998. - Т. 34, № 5. - С. 480-486. 78. Бобрешова О.В., Кулинцов П.Н., Аристов И.В., Балавадзе Э.М. Влияние гидростатического давления на селективность ионообменных мембран //Там же. -1996.-Т. 32, №2-с.183. 79. Гребенюк В.Д., Стрижак Н.П., Мельник А.Ф. Физико-химические свойства зарядселективных мембран и поведение их при электродиализе гумус-содержащих растворов // Химия и технология воды.-1993.-Т.15,№1. -С.56. 80. Заявка 18495 Японии, 1986, МКИ С 02 F 01/76. 178 81. Новое в технологии соединений фтора: Пер. с япон. / Под ред. Исикавы М.: Мир, 1984.-592с. 82. Soda to Enso., 1987.-V.38, №1.-P.10-26. [Проспект, доклад по мономерам]. 83. Пат. 4423157 США, МКИ В 01 J 47/52. 84. Пат. 2718307 ФРГ, МКИ С 08 J 5/22. 85. Заявка 172673, Европа, МКИ С 25 В 1/16. 86. Шельдешов Н.В., Заболоцкий В.И., Ганыч В.В. Влияние нерастворимых гидроксидов металлов на скорость реакции диссоциации воды на катионообменной мембране // Электрохимия.1994. - Т.ЗО, №12. - С. 1458. 87. Рожкова М.В., Шапошник В.А., Стрыгина И.П., Артемова Л.В. Разделение катионов с разным зарядом при электродиализе с использованием комплексообразователя // Там же. - 1996. - Т. 32, № 2. - С. 261. 88. Заболоцкий В.А., Шельдешов Н.В., Орел И.В., Лебедев К.А. Определение чисел переноса через мембрану методом её гидродинамической изоляции // Там же. -1997.-Т. 33, № 10.-С. 1150. 89. Пономарев М.И. Мембранное разделение смесей // Химия и технология воды. -1998.-Т. 20, № 1.- С. 76-83. 90. Гребенюк В.Д., Мазо А.А. Обессоливание воды ионитами. М.: Химия, 1980.-254с. 91. Аширов А. Ионообменная очистка сточных вод, растворов и газов. Л.: Химия, 1983.-295 с. 92. Волжинский А.И., Константинов В.А. Регенерация ионитов: Теория процесса и расчет аппаратов. Л.: Химия, 1990. - 238 с. 93. Якименко Л.М. Электродные материалы в прикладной электрохимии. М.: Химия, 1977.-264 с. 94. Жук А.П., Щербакова Н.Б. и др. Малоизнашиваемые аноды и применение их в электрохимических процессах. // Тез. докл. V Всесоюз. совещ. М.: ЦПНХО им. Д.И. Менделеева, 1984. - С. 26. 95. Слипченко А.В., Максимов В.В., Кульский Л.А. Современные малоизнашивающиеся аноды и перспективы развития электрохимических технологий водообработки //Химия и технология воды. - 1993. - Т. 15, № 3. - С. 180-231. 96. Никитина О.А., Топоров Б.А. Регенерация хромсодержащих вод в гальванотехнике // Энергосберегающие и малоотходные технологии в гальваническом пр-ве / Матер. краткосрочн. сем. Л., 1988. - С. 37 - 40. 97. Буравлев Е.П., Стогний B.C. Проблемы мониторинга водного бассейна // Химия и технология воды. - 1993. - Т. 15, № 7, 8. - С. 56. 98. Кокотов Ю.А., Пасечник В.А. Равновесие и кинетика ионного обмена. Л.: Химия, 1970. - 336с. 179 99. Заболоцкий В.И., Лебедев К.А. Электромассоперенос через неоднородные мембраны. Концентрационная зависимость коэффициентов диффузных противоионов и коионов // Электрохимия. - 1989. -Т. 25, 37. - С. 905. 100.Жолковский Э.К. Запредельный ток в системе ионитовая мембрана – раствор электролита // Электрохимия. - 1987. - Т. 23, № 2. - С. 180. 101.Заболоцкий В.И., Никоненко В.В. Электродиализ разбавленных растворов электролитов. Некоторые теоретические и прикладные аспекты // Там же. - 1996. -Т. 32, № 2. - С. 246. 102.Физика электролитов. Процессы переноса в твердых электролитах и электродах. М.: Мир, 1978. - 462 с. 103.Никольский Б.П., Мартенова Е.А. Ионоселективные электроды. Л.: Химия, 1980.-240 с. 104.Голованчиков А.Б., Козловцев В.А., Карипов А.Г. Электрохимическая регенерация ионитов. // Некоторые вопросы промэкологии и химтехнологии. Волгоград: Изд-во ВолгГТУ, 1995. - 124 с. 105.Мищук Н.А., Тахистов П.В. Массоперенос через ионообменные волокна в условиях электроосмоса второго ряда // Химия и технология воды. - 1993. - Т. 15, № 11-12. - С. 707. 106.Листовничий А.В. Влияние диссоциации воды на строение области пространственного заряда вблизи поверхности мембран // Докл. АН УССР, сер. Б. - 1989. -№ 2. - С. 42 - 46. 107.Мищук Н.А. Диссоциация воды и электрохимические явления второго ряда // Химия и технология воды. - 1989. - Т. 11, № 12. - С. 1067. 108.Гнусин Н.П., Борисов Н.П. Предельное состояние на границе ионообменной мембраны и раствора. В сборнике: Электрохимия ионитов. Кубанский гос. ун-т. - Краснодар, 1974. - С. 3 - 13. 109.Балавадзе Э.М., Бобрешова О.В., Кулинцов П.И. Концентрационная поляризация в процессе электродиализа и поляризационные характеристики ионоселективных мембран // Успехи химии. - 1988. 57, № 6. - С. 1031 - 1041. 110.Высоцкий С.П., Копылова С.Н. Влияние напряжения и скорости потока на перенос ионов в электродиализаторе // Химия и технология воды. -1987. - Т.З, №4. - С.317 - 321. 111.Пономарев М.И., Шендрик О.Р., Гребенюк В.Д. и др. Опреснение воды электродиализом в импульсном режиме // Химия и технология воды. - 1989. - 11, № 1. - С. 58. 112.Смирнов Д.Н., Генкин В.Е. Очистка сточных вод в процессах обработки металлов. - М.: Металлургия, 1989. - 196 с. 113.Gorindan K.R., Nazayanan P.К. Bench scale studies of demineralysation by electrodialysis. Proc. 7th Int. Symp. Fresh Water Sea. Amsterdam, 1980, №2, Athens, 1980. - P. 59. 180 114.Заболоцкий В.И., Никоненко В.В. Перенос ионов в мембранах. М.: Наука, 1996. - 392 с. 115.Foster P.A., Rowe M.J., Farrar J.B. Ed. polarity reversal or not? / Proc. 46th Int. Water Conf., Pittsburgh. Pa, Nov. 4-7, - Pittsburgh, Pa, s.a., p. 330339. Discuss, p. 340 - 341. 116.Гребенюк В.Д. Тез. докл. Всесоюзн. совещ. 14-16 апр. г. Батуми. М.: НИИТЭ-ХИМ, 1976. - С. 22. 117.Высоцкий С.П., Парыкин B.C. Исследование технологических характеристик с сепараторами типа лабиринта и плетеных сеток // Химия и технология воды. -1985. - Т. 5, №1. - С. 85-89. 118.А.с. 929146 СССР, МКИ 3 В 01 D 13/02. Электродиализатор / Истошин Т.Н. и др. // Бюл. изобр. № 19, 1982. 119.Гнусин Н.П., Заболоцкий В.И. и др. Эффект экранирования ионообменных мембран инертными сепараторами при электродиализе // Ж. прикл. химии. -1979. - Т. 52, № 6. - С. 1053-1058. 120.Подобаев Н.И. Электрохимия. - М.: - Просвещение, - 1977. - 105 с. 121.Яковлев С.В., Краснобородько И.Г., Рогов В.М. Технология электрохимической очистки воды. - Л.: Стройиздат, - 1987. - 312 с. 122.Брык М.Т., Заболоцкий В.И., Атаманенко И.Д., Дворкина Г.А. Структурная неоднородность ионообменных мембран в набухшем рабочем состоянии и методы ее изучения // Химия и технология воды. - 1989. - Т. 11, № 6. - С. 491-497. 123.Великая Л.П., Генкин В.Е. Электрохимическая очистка сточных вод от фторидов с использованием стальных электродов // Научные исследования в области физ.-хим. очистки промышленных сточных вод. - М., 1989. - С. 9-12. 124.Генкин В.Е. Научные исследования в области физ.-хим. очистки промышленных сточных вод // Сб. научных трудов Всесоюз. комплекс, науч.-иссл. и кон-структ.-технол. ин-т водоснабжения, канализации, гидротехнических сооружений и инж. гидрогеологии. М.- 1989. - 38 с. 125.Алексеев М.И., Краснобородько И.Г., Баймашев Ю.Н. Очистка сточных вод автономных объектов // Водоснабжение и санитарная техника. - 1990. - №3. -С.19-21. 126.Матов Б.И. Электрофлотация. Новое в очистке жидкостей. Кишинев, Картя молдовеняскэ, - 1971. - 48с. 127.Справочник по электрохимии / Под ред. A.M. Сухотина. Л.: Химия, 1981. -488с. 128.Патент Япония 57-180479, 1982. 129.Малоизнашивающиеся аноды и их применение в электрохимических процессах // Тез. докл. 5-го Всесоюз. совещания. - М., 1984. - С. 61 76. 181 130.Фиошин М.Я., Смирнова М.Г. Электросинтез окислителей. - 2-е изд. перераб. и доп.-Л.: Химия. - 1981.-212 с. 131.Металловедение / А.И. Самохоцкий, М.Н. Кунявский, Т.М. Кунявская и др. - М.: Металлургия, 1990. - 416 с. 132.Физико-химические свойства графита и его соединений / И.Г. Черный и др. - Киев: Наук, думка. - 1990. - 200 с. 133.Жуков А.П., Малахов А.И. Основы металловедения и теории коррозии. - М.: 1991. - 168 с. 134.Якименко Л.М. Производство хлора, каустической соды и неорганических хлорпродуктов. М.: Химия, 1974. 135.Краткий справочник физико-химических величин / Под ред. А.А. Равделя, А.Н. Пономаревой. 8-е изд., перераб. - Л.: Химия, 1983. - 231 с. 136.Кизим Н.Ф., Зорин М.Ю., Добрыднев Н.В. Влияние различных факторов на расход электроэнергии при электродиализе хромсодержащих р-ров. //Изв. ВУЗов СССР. Химия и химическая технология, 1979. - Т. 22, № 10. - С. 1263 - 1266. 137.Савина А.С. Влияние распределения плотности тока в электродиализаторе на глубокое обессоливание воды // Теория и практика электрохим. пр-сов и экологические аспекты их использования: Тез. докл. Всесоюз. н.-пр. конф. 10-13 сент. 1990. - Барнаул, 1990. - С. 236. 138.Сенявин ММ., Смагин В.Н. Теоретические основы деминерализации пресных вод. М.: Наука, 1975. - 128 с. 139.Dukhin S, Mishuk N. Intensifikation of electrodialysis based on electroosmosis of second kind III. Membr. Sci., 1993. - V. 79. - P. 199-210. 140.Selvey C., Reiss H. Ion transport in inhomogeneous ion exchange membranes // Ibid., 1985. - V. 23. - P. 11-27. 141.A.c. 150743 СССР, МКИ 4 В 01 D 13/02. Способ обессоливания воды / Медведев И.Н., Лебедев В.А. и др. (СССР) // Бюл. изобр. - 1989, № 34. 142.Вурдова Н.Г. Нестационарный электродиализ в процессах водоочистки и водоподготовки // Очистка природных и сточных вод: Межвуз. сб. научи, трудов. - Ростов-н/Д. Изд-во РГАС, 1997. - С. 79 80. 143.Патент 21045168, МКИ 6 С 02 F 1/463. Способ электрокоагуляционной очистки сточных вод / Фомичев В.Т., Дырова Е.А., Рыгалова Н.С. // 1998. 144.Staude E., Schmidt W. Zur Anwendeung der Electrodialyse auf die Trennung von Schwermetall - Komlexen. "Forschungsber Landes Wordlein - Westfalen", 1981. -№ 3078, v. 1,525.-P. 1-52. 145.Bergner D. Reducation of by-product formation in alkali chloride membrane electrolysis // J. ApLL. Electrochem., 1990.- 20, № 5. - P. 716 722. 182 146.Заявка 55-36711, Япония, 1980. 147.A.c. 1685481 СССР, МКИ 5 В 01 D 61/00. Способ очистки аминокислот / Письменский В.Ф., Заболоцкий В.И., Сеничева М.И. // Бюл. изобр.- 1991, № 39. 148.Basta N. Use electrodialytic membranes for waste recovery / Chem. eng., 1986. - 93, № 5. - P. 42 - 43. 149.Патент ФРГ 2505735, 1975. 150.Краснобородько И.Г. Деструктивная очистка сточных вод от красителей. Л.: Химия, 1988.- 192с. 151.ИлляшикЛ.П. и др. Непрерывная электрохимическая регенерация отработанного хромсульфатного травильного раствора // Тез. докл. научно-техн. конф. Применение прогрессивных методов и оборудования для очистки сточных вод и бессточной технологии в производстве. - Кишинев, 1982. - С. 160-161. 152.Кругликов С.С., Афросина И.О. и др. Влияние некоторых факторов на процесс электрохимической переработки отработанных медноаммиачных травильных растворов // Тр. ин-та ВНИИ ВОДГЕО: Технология физико-химической очистки пром. сточных вод. Аналитический контроль процессов очистки. - М., 1990. 153.Ивахно С.Ю., Губин А.Ф., Лисовский В.Б. Регенерация медноаммиачных растворов травления печатных плат методом мембранной экстракции / Теория и практика электрохимических процессов и экологические аспекты их использования // Тез. докл. Всес. научно-практич. конф. 10-13 сент.1990. - г. Барнаул, 1990. - С. 228. 154.А.с. 915876 СССР, МКИ 3 В 01 D 13/02. Способ регенерации отработанного раствора медного травления / Вайнштейн И.С., Шульгин В.Г., Сикора Ю.В. (СССР) / Бюл. изобр. - 1982, № 12. 155.Kin T. Materials Science of Syntetic Membranes ACS, Washington. 1985. - P.365-405. 156.Кизим Н.Ф., Зорин М.Ю. Регенерация гальванического производства методом 157.электродиализа// Матер, науч.-технич. конф. 12-20 апр. 1982г., с. 9297. Деп. в ВИНИТИ, № 5808- 82 деп. 158.Кизим Н.Ф., Ларьков А.П., Шарова Е.Ю. Электродиализная регенерация хром-содержащих растворов // Журн. прикл. химии. 1987. - 60, № 4. - С. 949-952. 159.Кизим Н.Ф., Зорин М.Ю. Регенерация промывных вод гальванического производства методом электродиализа // Матер. науч.-техн. конф. 12-20 апр. 1982г., с.97-100. Деп. в ВИНИТИ, № 5808-82 деп. 183 160.Бушков В.Н. Электрохимическое извлечение никеля из промывных растворов гальванических производств // Электрохимия в решении проблем экологии. -Новосибирск, 1990. - С. 69-74. 161.Бармина С.В., Ковязина Л.И. и др. Закономерности электродиализа растворов, моделирующих промывные воды после никелирования // Кировский политехнический ин-т. - Киров, 1991.- 21 с. 162.Гребенюк В.Д., Жигинас Л.Х. Электрохимическая очистка воды// Химия и технология воды. - 1998. - 20, № 3. - С. 152-163. 163.Шишкина С.В. и др. Применение ионообменных мембран для электродиализной очистки сточных вод гальванических цехов: Тез. док. науч.-техн. конф. "Прогрессивные технологии электрохимической обработки металлов и экология гальванического производства". - Волгоград, 1990. - С .98-99. 164.Кирдун В.А. Применение электродиализа в оборотных системах водоснабжения. В кн.: Замкнутые и оборотные системы водоснабжения / Сб. науч. трудов ВНИИ ВОДГЕО. - М., 1986. - С. 3335. 165.Itoi S., Nakamura I. Water Desalination by Electrodialisise // Chem. Economy Eng. Rev., 1978. - V.10, №1 (113). - P. 29-40. 166.Дытнерский Ю.И., Савкин А.Е. и др.// Теоретические основы химической технологии, 1981. - № 3. - С. 221 -226. 167.Staude E., Schmidt W. Zur Anwendeung der Electrodialyse auf die Trennung von Schwermetallkomplexen. "Forschungsber Landes WordleinWestfalen", 1988. -№ 3078, v. 1,525. P. 1-52. 167.Тезиков Н.И. и др. Тез.докл. Всесоюз. науч. совещ. 14-16 апр. г. Батуми. - М.: НИИТЭХИМ, 1976. - С. 91. 168.Кононов Ю.А., Орлов А.Ю., Минский Г.С. Тез.докл. Всесоюз. науч. совещ. 14-16 апр. г. Батуми. - М.: НИИТЭХИМ, 1976. - С. 36. 169.Смагин В.Н., Дробот Г.К., Чукин В.А. Тез.докл. Всесоюз. науч. совещ. 14-16 апр. г.Батуми. - М.: НИИТЭХИМ, 1976. - С. 111. 170.Лебедев В.Ю., Дьяченко A.M., Белая Г.В. Исследование технологических режимов электродиализных модулей в промышленной схеме обессоливания // Ионоселективные полимерные мембраны и их применение в технологии: Тез. докл. Всесоюз. конф. Черкассы, 1980. - С. 71-72. 171.Найденко В.В., Губанов Л.Н., Чернышева В.И. Технология очистки промышленных сточных вод. Электродиализ. - Горький: ГИСИ, 1980. - 36с. 172.Shah P.J., Scamehorn J.N. Use of electrodialysis to deionize acidic wastewater streams // Ind. and Eng. Chem. Res. -1986. -26, N2. - V.269277. 173.Патент ФРГ 2505735, 1978. 184 174.Гребенюк В.Д., Пенкало И.И., Чалая Л.М.//Химия и технология воды. - 1986. - 8, № 2. - С. 76-78. 175.Masuda F.Y. //J. Appl. Electrochem. 1986. - V. 16. - P. 317-331. 176.Chatterjice S.N. //Chem. Age of India. - 1896. - V. 37, № 3. - P. 188-194. 177.Ульянкина Г.С., Крашенинникова А.А. Производство едкого калия: Обзорн. инф. ГОСНИИхлорпроект, М.: НИИТЭХим. - 1987. 178.Бондарь В.В., Пономарев В.В., Гребенюк В.Д. // Химия и технология воды. - 1986.- 8, №4. - С. 15-18. 179.Высоцкий С.П. Влияние удельного потока ионов через мембраны электродиализных аппаратов на эффективность обессоливания воды // Электростанции . -1978. - № 7. - С. 42-44. 180.Пилипенко А.Т., Гребенюк В.Д., Мельник Л.А. и др. // Докл. АН УССР. - 1991. - 320, № 4. - С. 926-930. 181.Савельев В.А. и др. Исследование предельной плотности тока при электродиализной очистке сточных вод / Синтез и исследование эффективности химикатов для полимерных материалов: Тез. докл. 8 Всесоюз. н-т конф., Тамбов, 1986. - Тамбов, 1986. - С. 164-165. 182.Шендрик О.Р., Пономарев В.В., Теселкин В.В, Гребенюк В.Д. Получение и свойства катионитовых мембран, модифицированных электро-осажденным слоем дисперсного ионита // Химия и технология воды. - 1985. - 7, № 4. - С. 29-32. 183.Белобаба А.Г., Певницкая М.В. II Изв. СО АН СССР, сер. хим. наук. 1988. - №1. - С. 113-118. 184.Певницкая М.В. Интенсификация массопереноса при электродиализе разбавленных растворов//Электрохимия. -1992- 28, №11. - С.17081715. 185.Харкац Ю.И. О механизме возникновения запредельных токов на границе мембрана-раствор электролита // Там же. - 1985. - 21, № 7. С. 974-977. 186.Мокрое А.А., Жолковский Э.К. Электродиализ в запредельном режиме // Докл. АН УССР. Б.-1988.-№ 10.-С. 47-51. 187.Мищук Н.А. Нестационарная концентрационная поляризация ионообменных мембран // Химия и технология воды. - 1993. - 15, № 7, 8. С. 501-508. 188.Remaneau M., Montfort M. Purification et possibilities le separation des acides amines par 'electrodialiyse // Analysis. - 1988. - V. 16. - P. 221. 189.Elmidaoui A., Molenat J., Gavach C. Competitive diffusion of hydrochloric acid and sodium chloride through an acid dialysis membrane // J. Membr. Sci. - 1991. - V. 55,-P. 79-98. 190.Лиао Л., ван Сэндвийк А. и др. Регенерация хлористого водорода в процессах электролитического выделения металлов из хлоридов в ячейках мембранного типа //Электрохимия. -1996. - 32, №2. - С.293296. 185 191.Веселевич Л.М., Кругликов С.С. и др. Электрохимический метод регенерации отработанных травильных растворов / Тез. докл. н-т конф.: Прогрессивные технол. эл. хим. обработки металла и экология гальв. пр-ва. - Волгоград, 1990. - С. 98-99. 192.Кизим Н.Ф., Ларьков А.П., Шарова Е.Ю. Электродиализная регенерация хром-содержащих растворов // Ж. прикл. химии. - 1987.Вып. 60, № 4. - С. 949-952. 193.А.с. 1274713 СССР, МКИ 4 В 01 D 13/02. Способ очистки сточных вод травильного производства / Иванов П.В., Смирнов О.В. и др. // Бюл. изобр. -1986, №45. 194.А.с. 653306 СССР, МКИ 2 В 01 D 13/02. Способ регенерации отработанных кислых травильных растворов / Игнатов И.И., Дубровская Г.Е. и др. // Бюл.изобр. - 1979, №11. 195.Пилипенко А. Т., Гороновский И. Т., Гребенюк В.Д. и др. Комплексная переработка шахтных вод. - Киев: Техника, 1987. - 183 с. 196.А.с. 1042770 СССР, МКИ 3 В 01 D 13/02. Способ разделения ионов // Динкель В.Г., Кулаков М.В. // Бюл.тзобр. - 1983, № 35. 197.Карлин Ю.В., Kponomoe B.H. Электродиализное разделение Na+ и Са2+ в импульсном токовом режиме //Электрохимия. -1995. -31,№5. С.517-521. 198.Якименко Л.М. Производство водорода, кислорода, хлора и щелочей. М.: Химия ,1981. - 280 с. 199.Ялова А.Я. и др. Использование электродиализа для обработки регенерационных стоков водоподготовительных установок // Теплоэнергетика. - 1986. - № 12. - С. 45-60. 200.Tomita A. Salt chlor-alkali plant in Kuwait by all-membrane process // Bui. Soc. Sea Water Sci. Jap. - 1988. - V. 42. - P. 28. 201.Бушков В.Н. Электрохимическое извлечение никеля из промывных растворов гальванических производств // Электрохимия в решении проблем экологии. - Новосибирск, 1990. - С. 69-74. 202.Патент 54-43183. Япония, 1979. 203.Takahashi В., Arikawa Y., Teracko Y. Air bubble cleaning type electrodialuzer and its high temperature procese / Hitachi Rev., 1979. V.28,N6. -P.317-322. 204.A.c. 721466 СССР. МКИ В 01 D. Многокамерный электродиализатор / Гребенюк В.Д. и др.// Опубл. 22.05.73. 205.Лысенко Л.В. Автореф. ...канд. хим. н. - Киев, 1975. - 20 с. 206.А.с. 721466 СССР. МКИ 3 В 01 D. Многокамерный электродиализатор / Гнусин Н.П. и др. // Опубл. 21.11.82. 207.Писарук В.И., Гребенюк В.Д., Вржосек Н.И. Исследование работы насадочного электродиализатора с близкорасположенными мембранами / Электрохимия ионитов. Куб. гос. ун-т, Краснодар, 1979. - С. 114-121. 186 208.Заболоцкий В.И. Физико-химические основы электромембранных процессов: дисс. ...д-ра хим. наук. Краснодар, 1987. - 522 с. 209.Zabolotsky V.I., Nikonenko V.V., Pismenskaya N.D. Intensification of electrodialysis by coupling effects // ICOM'93: The Intern, congr. On membrane processes. - Heidelberg, 1993. -V.I, sect. 10. 210.Патент 2033850. Россия. МКИ В 01 D 13/02. Электродиализатор / Заболоцкий В.И., Никоненко В.В. и др. // Бюл. изобр. № 12. - 1995. 211.Гребенюк В.Д., Пономарев М.И. Электромембранное разделение смесей. - Киев: Наук, думка, 1992. - 183 с. 212.Kedem О. Reduction of polarization in electrodialysis by ionconductiong spacers //Desalination. - 1975. - V. 16. - P. 105-108. 213.Патент 8271106. Россия. МКИ 3 В 01 D 13/02. Многокамерный электродиализатор / Истошин Г.Н., Гнусин Н.П., Заболоцкий В.И. // Опубл. 07.01.81. 214.Sonin A., Isaacson M. Optimization of flow design in forced flow electrochemical systems with special application to electrodialysis // Industr. and Eng. Chem. -1974. -V. 3. -P. 241-248. 215.Leitz F., Marinic L. Enhanced mass transfer in elektrochemical cells using turbulence promoters // J. Appl. Electrochem. - 1977. - V. 7. - P. 473-484. 216.Лебедь Н.Г., Шаповалов С.В. Результаты исследования влияния макровихрей на процесс опреснения // Труды Николаевск, кораблестр. ин-та. - 1977. - № 146. - С. 20-23. 217.Праслов Д.Б., Шапошник В.А. Диффузионные пограничные слои ионообменных мембран// Электрохимия. - 1991. - 27, № 3. - С. 415417. В.И., Письменская Н.Д., Письменский В.Ф. 218.Заболоцкий Интенсификация массо-переноса и эффект экранирования поверхностей массообмена инертными сетчатыми сепараторами в тонких щелевых каналах // Там же. - 1990. - 26, № 3. -С. 278-287. 219.Strock A., Hutin D. Mass transfer and pressure drop perfomance of turbulence promoters in elektrochemical cells // Electrochem. acta. - 1981. - V. 26, № 1. - P. 127-137. В.В., Заболоцкий В.И., Письменская Н.Д. 220.Никоненко Негидродинамическая интенсификация электродиализа разбавленных растворов электролитов // Электрохимия. - 1991. - 27, № 10. - С. 12361244. 221.Заболоцкий В.И., Письменская Н.Д., Никоненко В.В. Исследование электродиализного обессоливания разбавленного раствора электролита в мембранных каналах // Там же. - 26, № 6. - С. 707-713. 222.Bette A., Toporoff Th. // Z. phys. Chem. - 1914. - № 88. - P. 868. 223.Manecke G. //Z. phys. Chem. - 1952. - № 210. - P. 1-193. 224.Гельферих Ф. Иониты. М.: Изд-во иностр. лит., 1962. - 490 с. 187 225.Gluckauf E., Watts R. The Donnan law and its application to ion-exchange polymers // Proc. Roy. Soc. London. - 1962. - V. 268. - P. 339-349. 226.Мищук Н.А. Нестационарная концентрационная поляризация ионообменных мембран // Химия и технология воды. - 1993. - 15, № 7, 8.501. 227.Заболоцкий В.И., Лебедев К.А. Электромассоперенос через неоднородные мембраны // Электрохимия. - 1989. - 25, № 7. - С. 905. Н.П. Электромассоперенос через неоднородные 228.Гнусин ионообменные мембраны // Электрохимия. - 1998. - 34, № 9. - С. 973. А.Н., Лебедев В.А. и др. Интенсификация 229.Диденко электрохимических процессов на основе несимметричного переменного тока. В кн.: Интенсификация электрохимических процессов / Сб. науч. трудов. - М.: Наука, 1988. - С. 189-214. 230.Высоцкий С.П., Пятериков В.В. и др. // Пром. энергетика. - 1981. - № 1. - С. 37-40. 231.Бобринская Г.А., Мазо А.А. II Химия и технология воды. - 1981. - № 2. - С. 163-166. 232.Гнусин Н.П., Гребенюк В.Д. Электрохимия гранулированных ионитов. - Киев: Наук. думка, 1972. - 180 с. 233.А.с. 1171428 СССР. МКИ 4 С 02 F 1/46. Способ электрохимической очистки воды /Диденко А.Н., Чижов А.Н. и др.//Бюл. изоб. - 1985, № 29. 234.Дытнерский Ю.И., Савкин А.Е. и др. // Теор. основы хим. технол. 1981. - № 3. -С. 221-226. 235.А.с. 1006385 СССР, МКИ 3 С 02 F 1/46. Способ обезжелезивания воды / Захватов Г.И., Поленов Л.Ф., Никитин Ю.В. // Бюл. изобр. 1983, №11. 236.Марков Л.Е., Образцов С.В. Применение нестационарных методов в электрохимии // Тр. Томск. политех, ин-та. - Томск, 1988. - С. 81. 237.А.с. 912663 СССР. МКИ 3 С 02 F 1/46. Способ очистки сточных вод от ионов тяжелых металлов / Ковалев В.В., Банд М.И. // Бюл. изоб. 1982. - № 10. 238.Kikuchi Y., Kubota N. [Сравнительное изучение удаления хрома из сточных вод путем электролиза постоянным и импульсным током с использованием железных электродов] Water Purification and Liquid Waste Treatment, Jupan. - 1986. -V. 27, №2. - P. 95-100. 239.Городовых В.Е., Образцов С.В., Каплин А.А. Методы глубокой электрохимической очистки воды на переменном асимметричном токе // Матер. н-п конф. Методы исследования в химии и хим. технологии. - Томск, 1986. - С. 88-96. 240.А.с. 139884 СССР, МКИ 3 В 02 D 1/46. Способ разделения ионов / Медведев И.Н., Лебедев В.А. // Бюл. изоб. - 1988, № 20. 241.Заявка 2601256. Франция, 1988. 188 242.Дытнерский Ю.И., Еременко М.Г., Моргунова Е.П. Использование асимметричного переменного тока для мембранного разделения растворов // Хим. промышленность. - 1988. - № 8. - С. 473-474. 243.А.с. 1590095 СССР, МКИ 5 В 02 D 1/46. Способ разделения смеси ионов / Крохов В.В., Благосклонова Т.Н. // Бюл. изоб. - 1990, № 3. 244.ТУ 6-05-211-1031-88. Мембраны гетерогенные ионообменные марки МК-40Л, МА-40Л. 245.Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. М.: Химия, 1984.-448с. 246.Лурье Ю.Ю. Справочник по аналитической химии. 6-е изд. М.: Химия, 1989. - 446 с. 247.Котик Ф.И. Ускоренный контроль электролитов. Справочник. - М.: Машиностроение, 1978. - 191 с. 248.Кожинов В.Ф. Очистка питьевой и технической воды. Примеры расчета. - М.: Машиностроение, 1971. - 363 с. 249.Справочник по свойствам, методам анализа и очистки воды / Л.А.Кульский, И.Т.Гороновский, А.М.Когановский и др. - Киев: Наук. думка, 1980. - 680 с. 250.СанПин 2.1.4.559-96. Питьевая вода. Гигиенические требования к качеству воды. Централизованных систем питьевого водоснабжения. Контроль качества. 251.СанПин 2.1.7.573-96. Требования к качеству сточных вод и их осадков, используемых для орошения и удобрения. 252.Яковлев С.В., Карелин Я.А., Ласков Ю.М. Водоотведение и очистка сточных вод. - М.: Стройиздат, 1996. 253.Ласкорин Б.Н., Громов В.В. и др. Проблемы развития безотходных производств. - М.: Стройиздат, 1981. - 207 с. 254.Мазо А.А., Степанов С.В. и др. Оценка экологической целесообразности способов обработки воды // Водоснабжение и сан. техника. - 1988. - № 6. - С. 24-25. 255.Мазо А.А., Гребенюк В.Д. Экологические проблемы очистки воды // Химия и технология воды. - 1993. - 15, № 11, 12. - С. 745-766. 256.Мазо А.А., Степанов СВ., Кичигин В.И. Экологические показатели способов обезвреживания хромсодержащих сточных вод и электролитов // Водн. ресурсы. - 1991. - № 3. - С. 201-204. 257.Багров О.Н. Системы полного оборотного водоснабжения в цветной металлургии. - М.: Металлургия, 1978. - 143 с. 258.Алферова Л.А., Нечаев А.П. Замкнутые системы водного хозяйства промышленных предприятий, комплексов и районов. - М.: Стройиздат, 1984. - 217 с. 259.Ковицкая А.А. Предотвращение загрязнения мембран осадками малорастворимых соединений // Химия и технология воды. - 1990. - Т. 12, № 9. - С. 811-819. 189 260.Колодин М.В. Экономика опреснения воды. - М.: Наука, 1985. - 128 с. 261.Львович М.И. Мировые водные ресурсы и их будущее. - М.: Мысль, 1974.-488 с. 262.Львович М.И. Защита вод от загрязнения. - Л.: Гидрометеоиздат, 1977. - 167 с. 263.Малышев В.В. Цена и экономический эффект от использования новой техники. -Л.:ЛДНТП, 1989.-24 с. рекомендации по оценке экологической 264.Методические эффективности технологических процессов. -Л., 1987. 265.Методика (основные положения) определения экономической эффективности использования в народном хозяйстве новой техники, изобретений и рац. предложений. - М., 1986. 266.Рекомендации по расчету экономической эффективности научнотехнических мероприятий в области очистки природных и сточных вод. - М.: Изд.ВНИИ ВОДГЕО, 1979.-306 с. 267.Schmoldt H., Strathmann H., Kaschemekat J. Desalination of seawater by an electrodialysis - reverse osmosis hybrid system // Desalination. - 1986. V. 38. - P. 567-582. 268.Глобальные экологические проблемы на пороге XXI века / Матер. науч. конф., посвящ. 85-летию акад. А.Л. Яншина. - М.: Наука, 1998. 301 с. 269.А.с. 1548159 СССР, МКИ 4 С 02 F 1/46. Способ электрокоагуляционной очистки сточных вод // Оводов А.И., Жданов И.А., Кузнецов Б.Д. // Бюл. изобр. -1990. - № 9. 270.Craps R., Van der Poorten C. Rotating cylinder electrode reactor / Mol. Res. Div. Rept..-1987.-№602.-P. 104-105. 271.Назарян MM., Ефимов В.Т. Электрокоагуляторы для очистки промышленных стоков. - Харьков: Выща шк., 1983. - 144 с. 272.Никулин С.Л., Смирнов Е.М. и др. Гальванохимическая очистка сточных вод производства печатных плат // Технология физ.-хим. очистки пром. сточных вод. Тр. ин-та ВНИИ ВОДГЕО. - М., 1990. 273.Гибкие автоматизированные гальванические линии / Справочник под ред. В.Л.Зубченко. - М.: Машиностроение, 1989. - 672 с. 274.Шульц ММ., Стефанова O.K. Электродные свойства ионообменных мембран и механизм переноса заряда в них. 1. Закономерности, отвечающие преобладанию в мембране одного из возможных механизмов переноса // Вестник ЛГУ. Физика. Химия. - 1971. - № 1, вып. 4. - С. 22-29. 275.Шульц М.М., Стефанова O.K. Электродные свойства ионообменных мембран и механизм переноса заряда в них. 4.1. Закономерности, отвечающие смешанному (сольватационно-вакансионному) механизму переноса заряда // Там же . -1972.-№ 4. - С. 80-87. 190 276.Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ. М.: Химия, 1974. - 592 с. 277.Глесстон С., Лейднер К., Эйринг Г. Теория абсолютных скоростей реакций. М.: Изд-во иностр. лит., 1948. 191