Регистрация ЛС в России Процесс регистрации
реклама
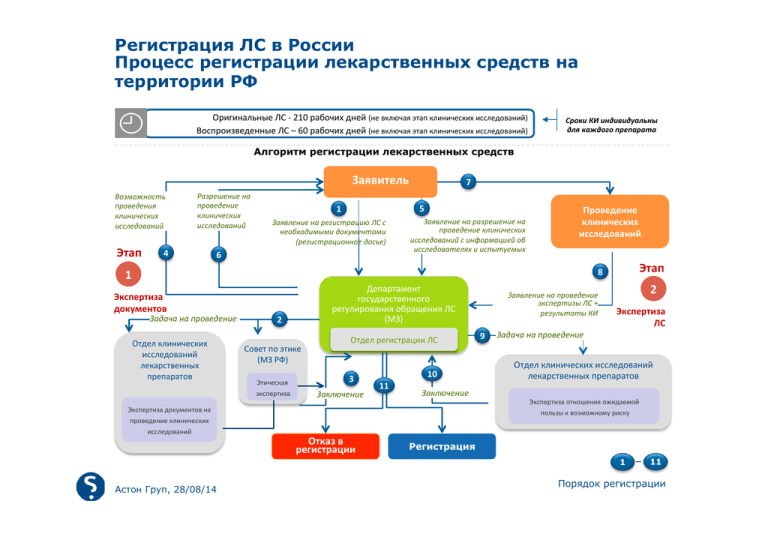
Регистрация ЛС в России Процесс регистрации лекарственных средств на территории РФ Оригинальные ЛС -­‐ 210 рабочих дней (не включая этап клинических исследований) Воспроизведенные ЛС – 60 рабочих дней (не включая этап клинических исследований) Сроки КИ индивидуальны для каждого препарата Алгоритм регистрации лекарственных средств Заявитель Возможность проведения клинических исследований Этап Разрешение на проведение клинических исследований 4 7 5 1 Заявление на регистрацию ЛС с необходимыми документами (регистрационное досье) 6 Заявление на разрешение на проведение клинических исследований с информацией об исследователях и испытуемых Проведение клинических исследований Этап 8 1 Экспертиза документов Задача на проведение Отдел клинических исследований лекарственных препаратов Экспертиза документов на проведение клинических исследований Департамент государственного регулирования обращения ЛС (МЗ) 2 Совет по этике (МЗ РФ) Этическая экспертиза Отдел регистрации ЛС 3 Заключение Отказ в регистрации 10 11 Заключение Заявление на проведение экспертизы ЛС + результаты КИ 9 2 Экспертиза ЛС Задача на проведение Отдел клинических исследований лекарственных препаратов Экспертиза отношения ожидаемой пользы к возможному риску Регистрация 1 Астон Груп, 28/08/14 11 Порядок регистрации Регистрация ЛС в России Необходимость проведения клинических исследований при регистрации ЛС n При государственной регистрации препарата проведение клинических испытаний на территории РФ является обязательным условием Ключевые особенности, связанные с проведением КИ Регистрация оригинального препарата: • обязательно проведение КИ на территории России или включение страны в многоцентровое исследование препарата (для каждого регистрируемого показания) Регистрация дженерика: • обязательно проведение КИ эквивалентности на территории России (в ФЗ не указано, какая эквивалентность , терапевтическая или био-, требует подтверждения в КИ) • если дженерик регистрируется раньше или одновременно с оригинальным препаратом на территории ФР, он регистрируется по процедуре, предусмотренной для оригинальных ЛС • если регистрируется дженерик МНН, обращающегося на территории РФ более 20 лет – проведения КИ не требуется Установлены сроки регистрации ЛС: • для оригинальных препаратов - 210 рабочих дней • для дженериков - 60 рабочих дней В сроки регистрации не включены сроки проведения КИ, продолжительность которых не фиксирована Экспертиза оценки пользы/риска ЛС так же является неотъемлемым этапом регистрации ЛС на территории РФ Астон Груп, 28/08/14 21 Регистрация ЛС в России Размеры государственной пошлины при осуществлении государственной регистрации лекарственных препаратов (начало) № 1 2 Действия уполномоченного федерального органа исполнительной власти, связанные с осуществлением государственной регистрации лекарственных препаратов Проведение экспертизы документов для получения разрешений на проведение клинических исследований лекарственного препарата для медицинского применения и этической экспертизы при обращении за государственной регистрацией лекарственного препарата Проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения при его государственной регистрации Стоимость RUR 75 000 225 000 3 Проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата, разрешенного для медицинского применения на территории Российской Федерации более двадцати лет, при государственной регистрации лекарственного препарата 30 000 4 Проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении которого проведены международные многоцентровые клинические исследования, часть из которых проведена на территории Российской Федерации, при государственной регистрации лекарственного препарата 225 000 5 Проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для ветеринарного применения при его государственной регистрации 150 000 6 Подтверждение государственной регистрации лекарственного препарата для медицинского применения 100 000 7 Подтверждение государственной регистрации лекарственного препарата для ветеринарного применения 50 000 Астон Груп, 28/08/14 22




