Лекция 5. Химическая связь (часть 2)
реклама
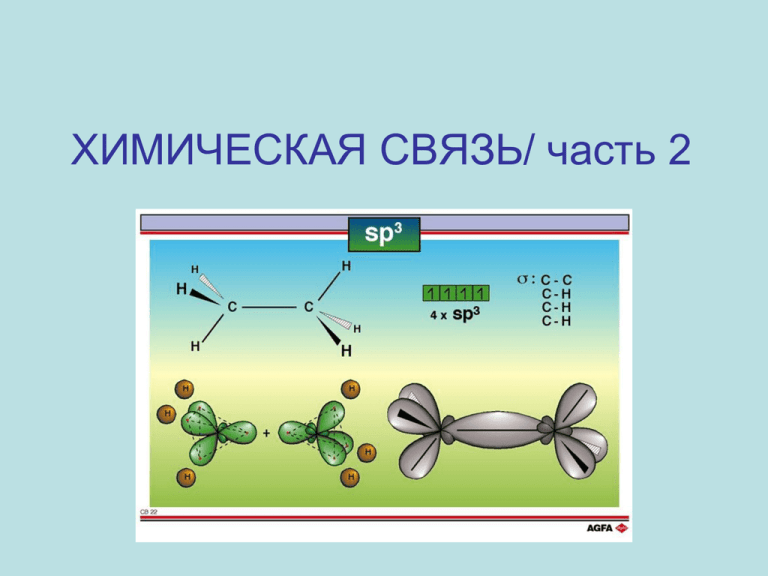
ХИМИЧЕСКАЯ СВЯЗЬ/ часть 2 Свойства ковалентной связи (КС) полярность, насыщаемость, направленность Неполярная КС образуется при взаимодействии атомов одинаковых химических элементов: H2, F2, N2, O2 … Полярная КС образуется при взаимодействии атомов различных химических элементов: HF, NO, BN … Насыщаемость: максимальное число КС, образуемых атомом, определяется числом его валентных АО. 2 Связь между типом связи и разницей электроотрицательности атомов 3 Направленность КС Молекулы и ионы с КС имеют определѐнное геометрическое строение, что объясняется направленностью КС. Геометрическое строение молекул и ионов объясняется гибридизацией АО. 4 Теория гибридизации Гибридизация – это выравнивание разных АО по форме и энергии. 5 sp – гибридизация АО Строение молекулы BeCl2 2s 2p Be … Ве*… тип гибридизации АО(Ве): sp Cl Cl Строение молекулы: линейное, угол – 180о 6 sp2 - гибридизация Строение молекулы BF3 Валентные электроны атома B …2s22p1 7 8 sp3 - гибридизация Строение молекулы СН4. Валентные электроны атома С …2s22p2 9 10 Форма молекулы этана 11 Форма молекулы этилена 12 Форма молекулы ацетилена 13 Типы гибридизации и строение молекул Тип гибридизации Строение молекулы Валентный угол sp линейное 180о sp2 плоский треугольник 120о sp3 тетраэдр 109,28о sp3d тригональная бипирамида 120о, 90о sp3d2 октаэдр 90о 14 15 Типы гибридизации и строение молекул 16 17 Теория Гиллеспи (Метод ОЭПВО) ОЭПВО – отталкивание электронных пар валентных оболочек. Теория описывает строение молекул (ионов), атомы которых имеют неподелѐнные (несвязывающие) ē пары. Связывающей называется такая пара ē, которая образует связь между двумя атомами. Несвязывающая пара ē принадлежит только одному центральному атому и не принимает участия в образовании химической связи. 18 Молекула: СCl4 Число несвязывающих ē пар: 0 Валентный угол: 109,28о Строение молекулы: NH3 1 107о H2O 2 104,5о 19



