Влияние норэпинефрина на функцию почек у пациентов с
реклама

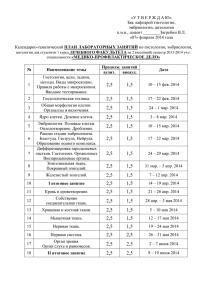
Влияние норэпинефрина на функцию почек у пациентов с сепсисом и без сепсиса* Jacques Albanese, MD; Mark Leone, MD; Franck Garnier, MD; Aurelie Bourgoin, MD; Franсois Antonini, MD; and Claude Martin, MD, FCCP Цель исследования: оценить влияние сосудосуживающего действия норэпинефрина на функцию почек у пациентов с сепсисом и без сепсиса. Дизайн исследования: открытое проспективное исследование. База: отделение интенсивной терапии клинической больницы. Пациенты: четырнадцать пациентов с септическим шоком и двенадцать неинфицированных пациентов с черепно-мозговой травмой (по шкале Глазго < 8). Лечение: проводили инфузию норэпинефрина с целью увеличения индекса общего сосудистого сопротивления (SVRI) и повышения среднего артериального давления (МАР) > 70 мм рт. ст. в группе пациентов с сепсисом и церебрального перфузионного давления (СРР) > 70 мм рт. ст. в группе пациентов с черепно-мозговой травмой. Определение показателей и результаты: МАР и SVRI увеличились в обеих группах (p < 0,001), СРР увеличилось в группе пациентов с черепно-мозговой травмой (p < 0,001). Сердечный индекс не изменился в обеих группах. Инфузия норэпинефрина восстановила диурез у 12 из 14 пациентов с сепсисом (р < 0,001), снизила уровень креатинина крови (р < 0,001) и увеличила клиренс креатинина (р < 0,001) через 24 часа. Диурез и показатели функции почек в группе пациентов с черепно-мозговой травмой не изменились. Выводы: с учётом ограничений данного исследования установлено, что норэпинефрин вызывает сужение сосудов у пациентов с сепсисом и пациентов без сепсиса. Норэпинефрин положительно влияет на функцию почек у пациентов с сепсисом и не влияет на данные показатели у пациентов без сепсиса с нормальной функцией почек. (CHEST 2004;126:534-539) Ключевые слова: почка; норэпинефрин; почечный кровоток; сепсис; шок Сокращения: ARF = острая почечная недостаточность; Сcreat = клиренс креатинина; СРР = церебральное перфузионное давление; ICP = внутричерепное давление; МАР = среднее артериальное давление; PАОP = давление заклинивания легочной артерии; RBF = почечный кровоток; RVR = почечное сосудистое сопротивление; Screat = креатинин крови; SVRI = индекс общего периферического сосудистого сопротивления; Ucreat = креатинин мочи; UF = диурез Пациенты с септическим шоком имеют гемодинамический синдром, который характеризуется системной гипотензией, несмотря на интенсивное проведение инфузионной терапии.1 С целью противодействия * Отделение Анестезиологии и Интенсивной Терапии, Центр Травматологии, Университетская клиника Марселя, Марсельский медицинский институт, Марсель, Франция. Рукопись получена 31 июля 2003 г, редакция утверждена11 февраля 2004 г. Воспроизведение данной статьи запрещено без письменного разрешения Американской коллегии врачей-специалистов по заболеваниям грудной клетки (e-mail: [email protected]). Адрес для корреспонденции: Claude Martin, MD, FCCP, De´partement d’Anesthe´sie et de Re´animation, CHU Nord, 13915 Marseille cedex 20, France; e-mail: [email protected] 534 системной вазодилатации применяют сосудосуживающие препараты, например, норэпинефрин, которые способствуют восстановлению должного уровня МАР.2-6 Вторичные повреждения головного мозга, возникающие после черепно-мозговой травмы, крайне опасные.7,8 Одной из основных задач лечения является поддержание церебрального перфузионного давления (СРР) > 70 мм рт.ст.9,10 Таким образом, может быть рекомендовано использование сосудосуживающих препаратов, таких как норэпинефрин.8,11 Удивительно, но висцеральные эффекты катехоламинов у пациентов с черепно-мозговой травмой изучены недостаточно. В клинических ситуациях, когда не наблюдается сепсиса или септического шока и отсутствует системная вазодилатация, существует потенциальная опасClinical Investigations in Critical Care ность негативного воздействия на почечный кровоток, что не отмечается у пациентов с сепсисом. Мы предположили, что норэпинефрин может проявлять различные эффекты при наличии или отсутствии сепсиса, как это было показано на обычных собаках и в состоянии эндотоксемии.12 Цель данного исследования заключалась в оценке влияния норэпинефрина на функцию почек, когда препарат назначается для увеличения среднего артериального давления (МАР) и индекса общего сосудистого сопротивления (SVRI) пациентам с сепсисом и увеличения СРР пациентам с черепно-мозговой травмой. МАТЕРИАЛ И МЕТОДЫ Данное исследование было одобрено Этическим Комитетом нашего института и получено информированное согласие ближайших родственников. ВЫБОР ПАЦИЕНТОВ В течение 16 месяцев обследовали 14 пациентов (10 мужчин и 4 женщины, средний [SD] возраст, 51 ± 12 лет) с септическим шоком. Эти пациенты поступили в отделение интенсивной терапии на 16 коек Больницы Норд Университетской клиники Марселя. Ни один пациент не был исключен из исследования. В соответствии с критериями согласительной конференции по вопросам сепсиса и органной недостаточности, проведенной Американской коллегией врачей-специалистов по заболеваниям грудной клетки/Ассоциацией интенсивной терапии,1 септический шок был определён как гипотензия, вызванная сепсисом, которая сохраняется несмотря на адекватную инфузионную терапию, с клиническими признаками гипоперфузии или органной дисфункции (т.е. олигурия < 30 мл/ч, лактат-ацидоз и изменение психического статуса при отсутствии приёма седативных препаратов). Сепсис определялся при наличии двух или более признаков: температура тела > 38°C или < 36°C; ЧСС > 90 уд/ мин; частота дыхания > 20/мин или необходимость проведения искусственной вентиляции легких; содержание лейкоцитов > 12000 клеток/мкл или 4000 клеток/мкл. Причинами септического шока были бактериальная пневмония (10 пациентов) и перитонит (4 пациента). За этот же период обследовали 12 пациентов (9 мужчин и 3 женщины; средний возраст 32 ± 9 лет) с черепно-мозговой травмой (по шкале Глазго < 8). Эти пациенты не имели других травматических повреждений, кроме черепно-мозговой травмы и были указаны медицинским персоналом как пациенты без инфекции. Они также не имели синдрома потери соли. ОБЩИЕ ПОДДЕРЖИВАЮЩИЕ МЕРЫ Все пациенты с септическим шоком получали антибиотики широкого спектра действия, обычно ß-лактамы и аминогликозиды. Ванкомицин добавляли при подозрении на наличие метициллин-резистентного www.chestjournal.org стафилококка. Пациенты не получали стероидных гормонов. Все пациенты с септическим шоком требовали проведения искусственной вентиляции лёгких в результате развития гипоксемии. Острая пневмония была обнаружена у 10 пациентов, респираторный дистресс-синдром взрослых у остальных пациентов. Дыхательный объем, частоту дыхания и фракцию вдыхаемого кислорода устанавливали для поддержания РаО2 > 70 мм рт. ст. Перед включением в исследование все пациенты с черепно-мозговой травмой проходили лечение в соответствии с рекомендациями по интенсивной терапии черепно-мозговой травмы.8 Для седации использовали комбинацию мидазолама (0,03-0,06 мг/кг/час) и суфентанила (0,2-0,4 мкг/кг/час), искусственную вентиляцию лёгких проводили в режиме поддержания РаСО2 35-38 мм рт. ст. и SatO2 > 95%. Внутричерепное давление (ICP) измеряли с помощью интрапаренхиматозного электромагнитного катетера с датчиком на конце (Codman; Raynham, MA), соединённого с прикроватным монитором и откалиброванным на «ноль». Церебральное перфузионное давление (СРР) рассчитывали как разность МАР – ICP. Эпизоды внутричерепной гипертензии купировали, если они длились более 5 минут в отсутствии болевого раздражителя. При подъёме ICP (более 25 мм рт. ст.) или снижении СРР (менее 70 мм рт.ст.) использовали ступенчатый подход: (1) стабилизация гемодинамики; (2) максимальный подъём головы 30°; (3) медикаментозная седация (т.е. суфентанил и мидазолам); (4) искусственная вентиляция лёгких с контролируемой гипервентиляцией (РаСО2 32-35 мм рт. ст.); (5) осмотерапия маннитолом (0,25-1 г/кг, внутривенно) или раствором NaCl 23,4% (30 мл внутривенно за 20 мин); (6) назначение барбитуратов (т.е. тиопентал) или пропофола до подавления очагов активности (ЭЭГ). Всем пациентам с повышенным ICP проводили транскраниальное допплеровское ультразвуковое исследование для оценки скорости кровотока в средней мозговой артерии и определения тактики лечения. КОНТРОЛЬ И КОРРЕКЦИЯ ГЕМОДИНАМИКИ Осуществляли контроль гемодинамики у всех пациентов с септическим шоком и черепно-мозговой травмой: гемодинамические показатели и газовый состав артериальной крови определяли с помощью артериального катетера (Arrow International; Reading, PA), катетера легочной артерии для измерения уровня кислорода (Swan-Ganz, 7,5 F; Baxter Edwards Critical; Irvine, CA), что позволяло непрерывно регистрировать функциональное состояние сердца и измерять обычные гемодинамические составляющие (т.е. среднее давление в легочной артерии, давление в правом предсердии и давление заклинивания лёгочной артерии [РАОР]), также использовали пульсоксиметр (Oxinet N-7500; Nellcor; Hayward, CA). Частота сердечных сокращений и внутрисосудистое давление измеряли непрерывно (Merlin; Hewlett-Packard; PaloAlto, CA). SVRI рассчитывали по формуле: (МАР – CVP)/CI×80. CHEST / 126 / 2 / AUGUST, 2004 535 Таблица 1. Гемодинамические показатели после инфузии норэпинефрина у пациентов с септическим шоком и черепно-мозговой травмой* Показатель MAP, мм рт. ст. HR, уд/мин CI, л/мин/м2 PAOP, мм рт. ст. SvO2, % ICP, мм рт. ст. CPP, мм рт. ст. SVRI, дин•сек/см5•м2 Пациенты с септическим шоком (n = 14) До НЭ НЭ + 2 час НЭ + 24 час 51 ± 3 79 ± 7† 76 ± 8† 116 ± 11 118 ± 15 113 ± 16 4,7 ± 0,2 5,0 ± 0,4 4,9 ± 0,7 12 ± 1 13 ± 1 11 ± 2 73 ± 4 70 ± 6 69 ± 9 703 ± 127 1,250 ± 133† Пациенты с черепно-мозговой травмой (n = 12) До НЭ НЭ + 2 час НЭ + 24 час 81 ± 7 98 ± 3† 101 ± 5† 91 ± 10 87 ± 13 86 ± 11 4,3 ± 0,4 5,2 ± 1 5,0 ± 1 10 ± 2 9 ± 1 10 ± 1 72 ± 3 75 ± 6 74 ± 8 18 ± 6 19 ± 7 20 ± 7 62 ± 7 79 ± 6† 80 ± 7† 1,275 ± 93 1,407 ± 63† 1,420 ± 73† 1,211 ± 127† *Данные представлены в виде средних значений ± SD. HR = частота сердечных сокращений; CI = сердечный индекс; SvO2 = венозная сатурация; NE = норэпинефрин. †р < 0,001. Пациенты с септическим шоком и низкой преднагрузкой, которую оценивали по РОАР, получали инфузионную терапию коллоидами (6% гидроксиэтиловый крахмал) и кристаллоидами (раствор Рингера-лактата) до достижения уровня РАОР 12-15 мм рт.ст. У всех пациентов после проведения инфузионной терапии сохранялся шок с олигурией и МАР ≤ 60 мм рт. ст. Тогда начинали введение норэпинефрина в дозе 0,5 мкг/кг/ мин с увеличением по 0,3 мкг/кг/мин до максимальной дозы 5,0 мкг/кг/мин. Целью терапии было достижение и поддержание МАР ≥ 70 мм рт.ст., сатурации смешанной венозной крови кислородом ≥ 70%. Инфузию норэпинефрина продолжали до устранения септического шока или смерти пациента. Лечение пациентов с черепно-мозговой травмой проводили в соответствии с протоколом нашего отделения (т.е. достижение СРР 70 мм рт. ст.). Норэпинефрин применяли, если необходимое СРР не достигали с помощью инфузионной терапии при значениях РАОР 12 мм рт. ст. ОЦЕНКА ФУНКЦИИ ПОЧЕК Всем пациентам был установлен постоянный мочевой катетер. Мочу собирали в урометр. Забирали пробы мочи для определения клиренса креатинина (Ccreat) за 24 часа и одновременно проводили забор проб крови для определения уровня креатинина (Screat). Уровень креатинина в моче (Ucreat) и Screat измеряли с помощью автоматического анализатора с использованием метода Jaffe. Полученные значения Ucreat (мг/дл), диурез (UF) (мл/мин) и Screat (мг/дл) использовали для вычисления Ccreat (мл/мин) по формуле: Ccreat = (Ucreat × UF)/Screat. В качестве контроля использовали значение Ccreat, определённое за день до установки катетера для измерения ICP. У пациентов с сепсисом контрольное значение Ccreat рассчитывали по формуле (Cockcroft and Gault13) Ccreat = ([140 мл/ мин – возраст] × вес )/(72 × Screat) (на 15% меньше у женщин), где возраст в годах, вес тела (кг). Все указанные значения клиренса креатинина были верны для площади поверхности тела, полученной при делении вычисленной площади поверхности тела на 1,73 м2. 536 СТАТИСТИЧЕСКИЙ АНАЛИЗ Данные представлены в виде средних значений ± SD. Использовали парный t тест Стьюдента или анализ колебаний. Уровень р < 0,05 был выбран для отклонения нулевой гипотезы. РЕЗУЛЬТАТЫ Средняя максимальная доза норэпинефрина составляла 1,3 ± 0,3 мкг/кг/мин для пациентов с септическим шоком и 0,3 ± 0,1 мкг/кг/мин для пациентов с черепно-мозговой травмой. Семь пациентов с септическим шоком и 11 пациентов с черепно-мозговой травмой были выписаны из стационара. Изменения показателей гемодинамики представлены в табл. 1. Увеличение МАР и SVRI наблюдали в обеих группах. СРР увеличилось в группе пациентов с черепно-мозговой травмой. SVRI увеличился в обеих группах (табл. 1). В группе пациентов с септическим шоком восстановление нормального перфузионного давления сопровождалось увеличением диуреза (табл. 2). В этой группе у 10 пациентов диурез увеличился более чем на 50 мл/ч в течение первого часа после нормализации МАР. Через три часа диурез восстановился ещё у двух пациентов. Олигурия сохранялась у двух пациентов Таблица 2. Диурез до и во время терапии норэпинефрином* Показатель До НЭ, мл/час Пациенты с септическим 14 ± 13 шоком (n = 14) Пациенты с черепно-мозговой 97 ± 11 травмой (n = 12) Диурез НЭ + 2 час, мл/час НЭ +24 час, мл/час 121 ± 87† 2,450 ± 1,237† 117 ± 13 1,845 ± 121 *Данные представлены в виде средних значений ± SD. †р < 0,001. Clinical Investigations in Critical Care Клиренс креатинина (ml/sec/1,73 m2) Креатинин (mmol/L) Пациенты с септическим шоком (n = 14) До НЭ НЭ + 24 часа До НЭ НЭ + 24 часа Клиренс креатинина (ml/sec/1,73 m2) Креатинин (mmol/L) Пациенты с черепно-мозговой травмой (n = 12) До НЭ НЭ + 24 часа До НЭ НЭ + 24 часа Рис. 1. Screat и Сcreat во время лечения норэпинефрином (НЭ). * p < 0,01 по сравнению с исходными значениями. с септическим шоком, несмотря на дополнительное назначение низких доз допамина и фуросемида. Увеличение диуреза наблюдалось в течение всего времени исследования (табл. 2) и сопровождалось снижением уровня Screat (p < 0,001) и увеличением Сcreat (p < 0,001) (рис. 1). В группе пациентов с черепно-мозговой травмой норэпинефрин не оказал влияния на диурез во время исследования (табл. 2). В течение 24 часов после начала инфузии норэпинефрина не было отмечено никаких изменений Screat и Сcreat по сравнению с исходными показателями (рис. 1). ОБСУЖДЕНИЕ Норэпинефрин вызывает сужение сосудов в различных областях (например, кожа) и может изменять висцеральный кровоток, в частности, почечный кровоток (ПК), что нарушает функцию органа. Учитывая высокий риск развития острой почечной недостаточности (ОПН) у пациентов с септическим шоком, многие врачи избегают применения норэпинефрина. В экспериментальных исследованиях на крысах было показано, что норэпинефрин вызывает ишемию и является причиной ОПН.14 Однако не ясно, действительно такое снижение висцеральной перфузии, связанное www.chestjournal.org с вазоконстрикцией, возникнет при сепсисе, который характеризуется значительной вазодилатацией в результате гипореактивности гладкомышечных α-адренергических рецепторов или увеличенной продукции оксида азота.15,16 Основные данные, полученные в настоящем исследовании, поддерживают гипотезу о том, что сужение сосудов, вызванное норэпинефрином в дозе, которая приводит к увеличению МАР и SVRI, по-разному влияет на функцию почек при наличии или отсутствии сепсиса. При нормальном состоянии гемодинамики (т.е. нормальном МАР, сердечном индексе, SVRI и РАОР) назначение норэпинефрина в дозе, повышающей МАР на 20%, не влияет на диурез или клубочковую фильтрацию. Напротив, если у пациентов с сепсисом существует значительная вазодилатация (т.е. низкий SVRI и высокий сердечный индекс) и необходимо введение норэпинефрина для поддержания перфузионного давления в тканях, это сопровождается восстановлением диуреза, снижением Screat и увеличением Сcreat. Положительное влияние норэпинефрина у пациентов с сепсисом подтверждено несколькими клиническими исследованиями.17-23 Дозы норэпинефрина, используемые в нашей работе, различались для двух исследуемых групп. Дозы, используемые для лечения пациенCHEST / 126 / 2 / AUGUST, 2004 537 тов с черепно-мозговой травмой, были аналогичные дозам, которые рекомендуются для таких пациентов в литературе.8-11 Более высокие дозы норэпинефрина требовались для лечения пациентов с септическим шоком, что связано со снижением активности α-адренергических рецепторов. Гипореактивность сосудов у таких пациентов была подробно описана, установлено, что она вызвана высоким уровнем циркулирующих сосудорасширяющих медиаторов, например, оксида азота.15,16 Предполагалось, что различие в дозах норэпинефрина, используемых для лечения пациентов с сепсисом и без сепсиса, может существенно подействовать на МАР. Мы не думаем, что такое различие в дозировке оказало существенное влияние на результаты данного исследования, так как значительное изменение МАР и SVRI наблюдали в обеих группах. У всех пациентов был достигнут сосудосуживающий эффект. При неправильном использовании норэпинефрин может вызвать ОПН в результате сужения сосудов почек.14 Однако этот эффект был отмечен только при введении норэпинефрина непосредственно в почечную артерию (несистемно) в соответствующих клинических дозах.14-17,24 Кроме того, в эксперименте на животных было показано, что дозы норэпинефрина, которые приводили к развитию ОПН, были существенно выше доз, используемых в клинической практике. Напротив, наши результаты согласуются с данными Аnderson et al.,25 которые вводили ненаркотизированным собакам норэпинефрин в дозе от 0,2 до 0,4 мкг/ кг/мин и обнаружили, что почечный кровоток увеличивался и почечное сосудистое сопротивление (RVRs) снижалось.25 Данная почечная вазодилатация не была связана с предшествующим лечением индометацином, пропранололом или ингибиторами ангиотензин превращающего фермента. Однако эфферентная симпатическая блокада пентолиниумом прекращала почечную вазодилатацию, связанную с введением норэпинефрина. Исследователи предположили, что главной причиной такого эффекта может быть увеличение системного артериального давления, что, в свою очередь, снижает симпатический тонус почек. Такой вывод согласуется с мнением Zhang et al.,26 которые в эксперименте обнаружили, что норэпинефрин не вызывал снижения почечного кровотока у собак с эндотоксемией. В превосходном исследовании, проведенном на собаках, Bellomo et al.,12 показали, что в состоянии эндотоксемии, норэпинефрин увеличивал почечный кровоток и почечное перфузионное давление. Благодаря перекрестному характеру исследования, авторам удалось продемонстрировать, что при нормальном состоянии циркуляции, норэпинефрин не вызывал роста почечного кровотока, несмотря на увеличение МАР. Исследователи объясняют это тем, что в состоянии эндотоксемии сосудистая система почек является гипореактивной. Приём норэпинефрина ещё больше снижал сосудистое сопротивление почек, а также уменьшал критическое давление закрытия почечных сосудов, в сочетании эти эффекты приводили к росту почечного кровотока с постоянным перфузионным давлением.12 Schaer et al.,27 также описали действие норэпинеф538 рина на функцию почек у собак. Они обнаружили, что несмотря на увеличение почечного сосудистого сопротивления, почечный кровоток прогрессивно увеличивался при увеличении дозы норэпинефрина до 1,6 мкг/кг/мин. Фактором, ограничивающим данное исследования, было базовое МАР 151 мм рт. ст., инфузия норэпинефрина приводила к повышению МАР до 200 мм рт. ст. Таким образом, эти данные имеют минимальное клиническое значение, однако они дают важную информацию о том, что пока поддерживается сердечный индекс, увеличение МАР в результате действия норэпинефрина не вызывает отрицательного влияния на функцию почек. Вывод из экспериментальной литературы заключается и в том, что в состоянии эндотоксемии инфузия норэпинефрина, направленная на увеличение МАР, положительно влияет на функцию почек и это связано с положительным влиянием на почечное сосудистое сопротивление, почечный кровоток и почечное перфузионное давление. Нет доступных исследований, посвящённых измерению почечного кровотока или почечного сосудистого сопротивления. Однако многие исследования17-23 подтверждают предположение о том, что норэпинефрин увеличивает диурез и Сcreat у пациентов с септическим шоком. У пациентов с гипотензией и гиповолемией (например, при геморрагическом шоке) норэпинефрин и другие сосудосуживающие препараты оказывают негативное воздействие на почечную гемодинамику. Несмотря на повышение артериального давления, почечный кровоток не увеличивается, а почечное сосудистое сопротивление растёт, что было продемонстрировано в эксперименте на собаках.28 Ишемия почек усиливается, что было подтверждено данными, которые показали существенное снижение парциального давления кислорода в тканях почек.28 Однако в литературе содержится мало информации о влиянии норэпинефрина на функцию почек у пациентов с черепно-мозговой травмой. Несмотря на недостаток информации, в руководствах рекомендуется применять инфузию катехоламинов8-10 для поддержания необходимого церебрального перфузионного давления у пациентов с черепно-мозговой травмой. Наши результаты подтверждают утверждение о том, что инфузия норэпинефрина для увеличения среднего артериального давления у пациентов с черепно-мозговой травмой без признаков сепсиса не оказывает негативного влияния на функцию почек, когда введение норэпинефрина начинали после проведения инфузионной терапии. Это положение имеет исключительную важность, так как гиповолемия играет главную роль в развитии ОПН как при сепсисе, так и при гиповолемическом шоке, следовательно, восстановление и поддержание нормоволемии до и во время терапии норэпинефрином является основным способом лечения. У пациентов с гипердинамическим септическим шоком ситуация иная. Основной причиной снижения диуреза, предположительно, является низкое перфузионное давление в почечных клубочках. Поскольку норэпинефрин оказывает более сильное влияние на сопротивление эфферентных артериол и увеличиваClinical Investigations in Critical Care ет фракцию фильтрации, то нормализация почечного сосудистого сопротивления эффективно восстанавливает выделение мочи. Важность этого положения при назначении норэпинефрина была показана Schaer et al.27 Таким образом, при лечении норэпинефрином сердечный индекс должен быть нормальным или повышенным для поддержания нормального почечного кровотока. У пациентов с септическим шоком лечение норэпинефрином направлено на восстановление сопротивления сосудов до нормального значения. Вероятно, будет разумным поддерживать уровень SVRI с помощью норэпинефрина несколько ниже нормы, чтобы предотвратить избыточный сосудистый спазм. Это может быть опасно для работы сердца, так как вазоконстрикция и, следовательно, увеличение постнагрузки оказывают стресс на миокард. Если левый желудочек сердца способен увеличивать свою сократительную способность только в ограниченной степени, ударный объём сердца может снизиться, соответственно, снизится минутный объём и доставка кислорода. Это также может быть опасно для почек, поскольку избыточная вазоконстрикция может усиливать ишемию почек. При наличии опасений относительно риска, связанного с использованием катетера легочной артерии,29 введение норэпинефрин следует титровать по МАР для достижения МАР в диапазоне от 65 до 70 мм рт. ст. или выше у пациентов пожилого возраста или пациентов с подтверждённым или предполагаемым атеросклеротическим поражением сосудов. В данном исследовании мы предположили, что норэпинефрин может по-разному оказывать влияние на пациентов с сепсисом и без сепсиса. Действительно, у наших пациентов с сепсисом при назначении норэпинефрина удалось добиться увеличения МАР (т.е. увеличения диуреза и снижения Screat). Возможно, такое положительное воздействие обеспечивалось увеличением почечного кровотока и скорости клубочковой фильтрации. Эти эффекты не наблюдались в контрольной группе (т.е. у пациентов без сопутствующего изменения гемодинамического статуса). Однако в рамках настоящего исследования, норэпинефрин не оказывал негативного влияния на функцию почек у пациентов с черепно-мозговой травмой без сепсиса. Одним из ограничений данной работы является наблюдение небольшого числа пациентов. Мы сосредоточились на изучении изменений гемодинамики и показателей работы органов, были получены чёткие и достоверные данные, но для подтверждения наших результатов необходимо проведение дальнейших исследований. Один из вопросов, требующий обсуждения, заключается в эмпирическом использовании аминогликозидов при лечении пациентов с септическим шоком. Действительно, эти препараты могут нарушать функцию почек, особенно у пациентов со сниженным внутрисосудистым объёмом. С другой стороны, аминогликозиды представляют большой интерес с точки зрения их эмпирического применения в интенсивной терапии. Это быстродействующее и надёжное антибактериальное средство, кроме того, отмечается низкая резистентность к аминогликозидам в палатах интенсивной тераwww.chestjournal.org пии. С точки зрения этих преимуществ, потенциальная токсичность может быть сведена к минимальной, для чего необходимо строго контролировать концентрацию препарата в плазме крови (пиковый и промежуточный уровень). В нашем учреждении, как и в других, такой контроль, а также использование схемы назначения аминогликозидов один раз в сутки позволяет сохранять уровень нефротоксичности не выше 5%,30 и функция почек всегда восстанавливается.31 Последний вопрос, который нам хотелось бы затронуть заключается в том, что в нашем руководстве по лечению пациентов с черпно-мозговой травмой указано целевое центральное перфузионное давление ≥ 70 мм рт. ст. Последние данные показали, что, вероятно, существует некий оптимальный диапазон, который зависит от возраста и следует ориентироваться на значения от 60 до 70 мм рт. ст., чем на значение ≥ 70 мм рт. ст. Таким образом, низкие дозы сосудосуживающих препаратов, включая норэпинефрин, могут использоваться в будущем.32 Кроме того, в данном исследовании четырём пациентам вводили гипертонические растворы для лечения повышенного внутричерепного давления (маннитол двоим пациентам; гипертонический солевой раствор двоим пациентам). Никакого воздействия на функцию почек отмечено не было. В заключение, с учётом ограничений данного исследования в отличие от пациентов без нарушений гемодинамического статуса, вазоконстрикция, вызванная норэпинефрином, сопровождалась положительным влиянием на функцию почек. После восстановления среднего артериального давления (МАР) увеличился диурез и вырос клиренс креатинина (Ccreat). СПИСОК ЛИТЕРАТУРЫ 1. Bone R.C., Balk R.A., Cerra F.B., et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis: the ACCP/SCCM Consensus Conference Committee; American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992;101:1644–1655. 2. Schreuder W.O., Schneider A.J., Groeneveld A.B.J., et al. Effect of dopamine vs norephinephrine or dopamine for the treatment of hyperdynamic septic shock? Chest 1989; 95:1282–1288. 3. Martin C., Papazian L., Perrin G., et al. Norepinephrine or dopamine for the treatment of hyperdynamic septic shock. Chest 1993;103:1826–1831. 4. Dasta J.F. Norepinephrine in septic shock: renewed interest in an old drug. DICP 1990; 24:153–156. 5. Martin C., Viviand X., Leone M., et al. Effects of norepinephrine on the outcome of septic shock. Crit Care Med 2000;28:2758– 2765. 6. Mayer J., Skelton J., Mills L. Norepinephrine: effect in normal subject; use in treatment of shock unresponsive to other measures. Ann J Med 1953;15:330–343. 7. ChesnutR.M. Secondary brain insults after head injury: clinical perspectives. New Horiz 1996; 3:366–375. 8. Bullock R.N., Chesnut R.M., Clifton G., et al. Guidelines for the management of severe head injury. Eur J Emerg Med 1996;2:109–127. 9. RosnerM.J., Rosner S.D., Johnson A.H. Cerebral perfusion pressure: management protocol and clinical results. J Neurosurg1995;83:949–962. 10. MyburghJ.A., Lewis S.B. Goal-directed therapy in neurotrauma. In: Vincent J.L., ed. Yearbook of intensive care and emergency medicine. Berlin, Germany: Springer Verlag,1996; 716–730. CHEST / 126 / 2 / AUGUST, 2004 539 11. Ract C., Vigue´ B. Comparison of the cerebral effects of dopamine and norepinephrine in severely head-injured patients. Intensive Care Med 2001;27:101–106. 12. Bellomo R., KellumJ.A., Winiewski S.R., et al. Effects of norepinephrine on the renal vasculature in normal and endotoxemic dogs. Am J RespirCrit Care Med 1999;159:1186– 1192. 13. Cockcroft D.W., Gault M.H. Prediction of creatinine clearance from serum creatinine. Nephron 1976;16:31–37. 14. Cronin R.A., Erickson M., De Torrente A., et al. Norepinephrineinduced acute renal failure: a reversible ischemic model of acute renal failure. Kidney Int 1978;14:187–190. 15. Schott C.A., Gray G.A., Stoclet J.C. Dependance of endotoxininduced vascular hyporeactivity on extracellular L-arginine. Br J Pharmacol 1993;108:38–43. 16. Lilbourn R.O., Gross S.S., Jubran A., et al. N-methyl-Larginine inhibits tumor necrosis factor-induced hypotension: implications for the involvement of nitric oxide. Proc Natl Acad Sci USA 1990;87:3629–3632. 17. Bellomo R, Di Giantomaso D. Noradrenaline and the kidney: friends or foes? Crit Care 2001; 5:294–298. 18. Desjars P., Pinaud M., Potel G., et al. A reappraisal of norepinephrine therapy in human septic shock.Crit Care Med 1987;15:134–137. 19. Meadows D., Edwards J.D., Wilkins R.G., et al. Reversal of intractable septic shock with norepinephrine therapy. Crit Care Med 1988;16:663–666. 20. Martin C., Eon B., Saux P., et al. Renal effects of norepinephrine used to treat septic shock patients. Crit Care Med 1990;18:282– 285. 21. Desjars P., Pinaud M., Bugnon D., et al. Norepinephrine therapy has no deleterious renal effects in human septic shock. Crit Care Med 1990;18:1048–1049. 22. RudisM.I., Basha M.A., Zarowitz B.J. Is it time to reposition vasopressors and inotropes in sepsis? Crit Care Med 1996;24:525–537. 23. Redl-Wenzel E.M., Armbruster C., Edelmann G., et al. The effects of norepinephrine on hemodynamics and renal function in severe septic shock states. Intensive Care Med 1993;19:151– 154. 24. Cronin R.E., De Torrente A., Miller P.D., et al. Pathogenic mechanisms in nearly norepinephrine induced acute renal failure: functional and histological correlates of protection. Kidney Int 1978;14:115–125. 25. Anderson W.P., KornerP.I., Selig S.E. Mechanisms involved in the renal responses to intravenous and renal artery infusions of noradrenaline in conscious dogs. J Physiol 1981; 321:21–30. 26. Zhang H., Smail N., Cabral A., et al. Effects of norepinephrine on regional blood flow and oxygen extraction capabilities during endotoxemic shock. Am J Respir Crit Care Med 1997;155:1965–1971. 27. SchaerG.L., Fink M.P., Parillo J.E. Norepinephrine alone versus norepinephrine plus low-dose dopamine: enhanced renal blood flow with combination pressor therapy. Crit Care Med 1985;13:492–496. 28. Mills L.C., Moyer J.H., Handley C.A. Effects of various sympathomimetic drugs on renal hemodynamics in normotensive and hypotensive dogs. Am J Physiol 1960;198:1279–1285. 29. Practice guidelines for pulmonary artery catheterization. Anesthesiology 2003;99:988–1014. 30. Bartal C., Danon A., Schlaeffer F., et al. Pharmacokinetic dosing of aminoglycosides: a controlled trial. Ann J Med 2003;114:194–198. 31. Buijk S.E., Mouton J.W., GyosensI.C., et al. Experience with a once-daily dosing program of aminoglycosides in critically ill patients. Intensive Care Med 2002;28:936–942. 32. Cerebral perfusion pressure. Crit Care Med 2003;31:S447– S449. working with you everyday