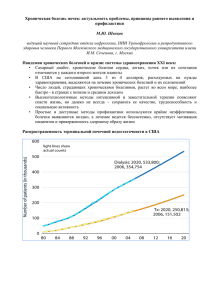
ГБОУ ВПО ИГМУ Министерства здравоохранения России
advertisement

Министерство здравоохранения Иркутской области Государственное бюджетное образовательное учреждение высшего профессионального образования «Иркутский государственный медицинский университет Министерства здравоохранения России» (ГБОУ ВПО ИГМУ Министерства здравоохранения России) Л.Ю.ХАМНУЕВА, Г.М. ОРЛОВА, Е.А. ХАНТАКОВА, Л.С. АНДРЕЕВА Сахарный диабет и почки Пособие для врачей Иркутск 2012 УДК 616.379-008.64-06 ББК 54.15 Х 18 Рекомендовано ЦКМС ГБОУ ВПО «Иркутский государственный медицинский университет Министерства здравоохранения России» Протокол_____ от __________ 2012г Авторы: Л.Ю. Хамнуева – доктор мед. наук, заведующая кафедрой эндокринологии и клинической фармакологии ГБОУ ВПО ИГМУ Министерства здравоохранения России Г.М. Орлова – доктор мед. наук, заведующая кафедрой госпитальной терапии ГБОУ ВПО ИГМУ Министерства здравоохранения России Е.А. Хантакова - ассистент кафедры эндокринологии и клинической фармакологии ГБОУ ВПО ИГМУ Министерства здравоохранения России Л.С. Андреева – канд. мед. наук, доцент кафедры эндокринологии и клинической фармакологии ГБОУ ВПО ИГМУ Министерства здравоохранения России Рецензенты: Козлова Наталья Михайловна – заведующая кафедрой факультетской терапии ГБОУ ВПО ИГМУ Министерства здравоохранения России, доктор медицинских наук; Сараева Наталья Орестовна – профессор кафедры госпитальной терапии ГБОУ ВПО ИГМУ Министерства здравоохранения России, доктор медицинских наук. Хамнуева Л.Ю., Орлова Г.М., Хантакова Е.А., Андреева Л.С. Сахарный диабет и почки: пособие для врачей/ Л.Ю. Хамнуева, Г.М. Орлова, Е.А. Хантакова, Л.С. Андреева; ГБОУ ВПО ИГМУ Министерства здравоохранения России. - Иркутск, 2012.- 55с. В пособии представлены современные данные об этиологии, патогенезе, диагностике и клинических проявлениях диабетической нефропатии. Подробно обсуждаются вопросы лечения и профилактики диабетической нефропатии с учетом современных алгоритмов и рекомендаций. Освещена проблема мочевой инфекции у больных сахарным диабетом, рассмотрены методы диагностики и тактика лечения мочевой инфекции при сахарном диабете. Пособие предназначено для врачей, интернов, ординаторов. © Хамнуева Л.Ю., Орлова Г.М., Хантакова Е.А., Андреева Л.С. 2012 © ГБОУ ВПО ИГМУ Министерства здравоохранения России, 2012 2 Оглавление 1 2 3 4 Введение Специфические и неспецифические поражения почек при сахарном диабете Патогенез диабетической нефропатии Классификация диабетической нефропатии Критерии хронического заболевания почек 5 6 7 8 Клинические проявления диабетической нефропатии Диагностика диабетической нефропатии Принципы лечения диабетической нефропатии в зависимости от ее стадии 22 Анемический синдром как осложнение диабетической нефропатии 29 29 31 32 34 Нарушение фосфорно-кальциевого обмена при диабетической нефропатии Целевые значения уровня кальция, фосфора и ПТГ Принципы лечения ВГПТ при 3-5-й стадиях ХБП Принципы лечения ВГПТ и дефицита витамина Д активными метаболитами витамина Д и его аналогами Показания к паратиреоидэктомии при ВГПТ 10 Инфекции мочевой системы у больных сахарным диабетом Основные клинические формы мочевых инфекций у больных сахарным диабетом Лечение мочевой инфекции Клинические примеры 11 Ситуационные задачи Эталоны ответов к ситуационным задачам 12 Тестовый контроль Эталоны ответов к тестовому контролю 13 7 11 11 14 17 20 Показания к началу заместительной почечной терапии у больных сахарным диабетом Методы диализной терапии Коррекция гипергликемии у больных, получающих заместительную почечную терапию Патогенез анемии Диагностика анемии Лечение почечной анемии 9 5 6 Рекомендуемая литература 3 23 26 35 36 37 39 39 40 43 46 47 49 51 53 54 Список сокращений АГ – артериальная гипертензия АТ – ангиотензин БРА – блокаторы рецептров к ангиотензину ВГПТ – вторичный гиперпаратиреоз ГД - гемодиализ ГНГ – глюконеогенез ДПП-4 – дипептидилпептидаза-4 ДН – диабетическая нефропатия ДНП – диабетическая нейропатия ДР – диабетическая ретинопатия иАПФ – ингибитор ангиотензинпревращающего фермента ИМТ – индекс массы тела ИР – инсулинорезистентность ИЛ-1β - интерлейкин-1-бета МАУ – микроальбуминурия НАК – недостаточность артериального кровотока НТГ – нарушенная толерантность к глюкозе ПГТТ – пероральный глюкозотолерантный тест ПД – перитонеальный диализ ПСП – пероральные сахаросгижающие препараты ПТГ – паратиреоидный гормон ПУ - протеинурия РААС - ренин-ангиотензиновая система РОД – ренальная остеодистрофия рч ЭПО – рекомбинантный человеческий эритропоэтин СД – сахарный диабет СЖК – свободные жирные кислоты СКФ – скорость клубочковой фильтрации СМ – сульфонилмочевина ССЭ – средства, стимулирующие эритропоэз ФНО-α - фактор некроза опухолей-альфа ХБП – хроническая болезнь почек ХЕ – хлебная единица ХПН – хроническая почечная недостаточность ЭПО - эритропоэтин 4 Введение Сахарный диабет занимает одну из драматических страниц мировой медицины как заболевание, связанное с высоким уровнем человеческих и экономических затрат. По определению экспертов ВОЗ, «сахарный диабет - проблема всех возрастов и народов», что обусловлено его широкой географическо распространенностью, исключительно быстрым ростом заболеваемости, ранней инвалидизацией больных трудоспособного возраста и высокой смертностью от осложнений, которые, раз возникнув, постепенно прогрессируют, существенно снижая качество жизни и сокращая ее продолжительность. В последние годы практически во всех странах мира отмечается неуклонный рост заболеваемости и распространенности сахарного диабета, что позволило зарубежным авторам квалифицировать эти процессы как новую эпидемию неинфекционного характера конца XX - начала XXI века - эпидемию диабета. Согласно оценке экспертов Всемирной Организации Здравоохранения (ВОЗ), если в настоящий момент в мире насчитывается около 170 млн. больных сахарным диабетом, что составляет 2-3% от всего населения планеты, то к 2025 году их количество достигнет 380 млн. человек. Не менее остро стоит эта проблема и в России, где также отмечается рост патологии, при этом более 70% больных находятся в состоянии хронической декомпенсации сахарного диабета, независимо от его типа. Диабетическая нефропатия - тяжелое микрососудистое осложнение СД, приводящее в конечном итоге своего развития к терминальной почечной недостаточности. По данным крупнейших почечных регистров на долю диабетической нефропатии приходится от 21,7 до 32,4% всех случаев терминальной хронической почечной недостаточности. Частота выявления диабетической нефропатии имеет линейную зависимость по отношению к длительности диабета: по различным данным при длительности диабета до 10 лет доля больных с диабетической нефропатией составляет 5-6%, до 20 лет – 25 - 30%, до 30 лет – 35 - 40%. 5 СПЕЦИФИЧЕСКИЕ И НЕСПЕЦИФИЧЕСКИЕ ПОРАЖЕНИЯ ПОЧЕК ПРИ САХАРНОМ ДИАБЕТЕ Диабетическая нефропатия (ДН) представляет собой специфическое поражение почек при СД, сопровождающееся формированием узелкового или диффузного гломерулосклероза, приводящего к потере фильтрационной и азотвыделительной функций почек и гибели больных от терминальной почечной недостаточности (уремии). История детального изучения ДН началась не так давно - в середине 20-х годов XX столетия, после широкого внедрения в клиническую практику инсулинотерапии. До этого времени диабетическому поражению почек не придавали большого значения, так как больные, как правило, не доживали до терминальной стадии нефропатии, умирая от кетоацидотических ком (при СД 1типа) или сердечно-сосудистых осложнений (при СД 2 типа). Только в послевоенные годы, когда широкое внедрение инсулинотерапии позволило существенно увеличить продолжительность жизни больных СД (прежде всего, больных СД 1 типа) клиницисты столкнулись с новой проблемой - эпидемией ДН у лиц молодого возраста. Смертность от «диабетической» уремии в молодом возрасте достигла 50%. В середине ХХ столетия продолжительность жизни больного СД 1 типа с момента развития заболевания не превышала 12–15 лет. Поражение почек при СД представлено широким спектром, в котором наибольшее клиническое значение имеют диабетический гломерулосклероз, пиелонефрит и инфекция мочевыводящих путей, атеросклеротический нефросклероз, гипертонический нефросклероз. Эти изменения связаны в первую очередь с особенностями метаболических нарушений при СД с характерными микромакроангиопатиями, склонностью к инфекционным осложнениям и повышенным риском сердечно-сосудистой патологии. Поражение почек и мочевыделительных путей при СД. 1. Специфические поражения почек (собственно диабетическая нефропатия): диффузный гломерулосклероз, узелковый гломерулосклероз (Киммельстила-Уилсона). 2. Неспецифические поражения почек и мочевыделительных путей − Инфекционные: бактериурия, пиелонефрит, карбункул почки, абсцесс почки, папиллярный некроз. − Сосудистые: атеросклеротический нефросклероз, гипертонический нефросклероз. − Токсические: при введении контрастных веществ, злоупотребление ненаркотическими анальгетиками. − Нейрогенные: атония мочевого пузыря. − Иммуновоспалительные: гломерулонефрит, интерстициальный нефрит. − Опухолевые: паранеопластические нефропатии. − Мочекаменная болезнь. Особенности поражения почек при СД 2 типа могут быть обусловлены морфологическими изменениями возрастного характера, такими как склероз мелких почечных артерий и артериол (особенно эфферентных) с гиперперфузией 6 мозгового слоя и уменьшением корковой фракции, фиброз интерстиция мозгового слоя, очаговый гломерулосклероз. Снижение фильтрационной функции связывают с уменьшением коркового кровотока (на 10% каждое десятилетие) и прогрессированием гломерулосклероза так, что к 80 годам общее количество клубочков уменьшается почти вдвое. Благоприятным фоном нарушений почечной гемодинамики служат снижение иммунной реактивности, нарушение уродинамики (гипокинезия мочеточников, мочевого пузыря, аденома предстательной железы), гипертоническая болезнь, гиперлипидемия с установленным ―нефротоксическим‖ действием липидов. Даже умеренно выраженные воздействия дисметаболизма, создаваемого СД, могут декомпенсировать почку у лиц пожилого возраста. При СД прослеживается зависимость частоты ДН от длительности заболевания, тем не менее, течение и клинические проявления ДН при СД 2 типа несколько отличаются от поражения почек при СД 1 типа. Характерная для ранних стадий ДН у больных СД 1 типа гиперфильтрация, т.е. высокая скорость клубочковой фильтрации (более 140 мл/мин), не всегда выявляется у больных СД 2 типа, что, вероятно, связано с выраженностью склеротических изменений в почечной ткани уже в дебюте заболевания у последних. Микроальбуминурия у больных СД 1 типа является важнейшим предвестником клинической стадии ДН, у больных СД 2 типа этот показатель в большей степени связан с развитием сердечно-сосудистой патологии (55-60% больных СД 2 типа с микроальбуминурией погибают от инфаркта миокарда или инсульта и лишь 3-5% - от уремии. Особенностью структурных изменений почек при СД 2 типа является большая, чем при СД 1 типа, выраженность тубулоинтерстициальных изменений (атрофия канальцев, фиброз интерстиция) и гиалиноз артериол, что свидетельствует в пользу участия в развитии и прогрессировании ДН ишемического повреждения почек. Ишемия проводит к «сморщиванию» (уменьшению в объеме) почек, что отличает «терминальную» почку больного СД 2 типа от сохранившей нормальные размеры «терминальной» почки при СД 1 типа. Ишемия почки у больных СД 2 типа развивается вследствие более выраженного атеросклероза почечных сосудов. ПАТОГЕНЕЗ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ С морфологической точки зрения различают два основных вида поражений почечных клубочков при СД – узелковый и диффузный гломерулосклероз. Чаще наблюдается диффузный гломерулосклероз (интракапиллярный), который прогрессирует довольно медленно и редко приводит к хронической почечной недостаточности (ХПН). Морфологические изменения при этой форме имеются по всей почке. Вторая форма, узелковая, наблюдается, как правило, уже с самого начала заболевания диабетом (чаще СД 2 типа) и быстро прогрессирует с развитием диабетических гломерулокапиллярных микроаневризм, расположенных на пе7 риферии или в центре клубочка, суживающих или полностью закупоривающих просвет капилляров. Наряду с изменениями клубочковых капилляров наблюдаются поражения артериол с утолщением интимы, отложением в межкапиллярном пространстве (мезангиум клубочков) липидов и белков, способствующих развитию склеротических изменений, приводящих к окклюзии клубочков (увеличенный в объеме мезангий начинает сдавливать сосудистую сеть клубочков), атрофии почечных канальцев и нарушению фильтрационной функции почек. Поражения касаются как приносящего, так и выносящего сосудов, что особенно характерно для диабета. В настоящее время известны еще не все факторы риска развития и прогрессирования ДН и эта проблема привлекает большое количество исследователей. Однако роль многих факторов, запускающих этот сложный процесс, уже установлена и достаточно подробно изучена. Доказана роль следующих 2 групп факторов, участвующих в развитии ДН, которые тесно переплетены и взаимосвязаны друг с другом: метаболические: гипергликемия, гиперлипидемия; гемодинамические: внутриклубочковая гипертензия, артериальная гипертензия. Гипергликемия является пусковым метаболическим фактором в развитии диабетического поражения почек. В отсутствие гипергликемии изменения почечной ткани, характерные для СД, не выявляются. Известно, что прогрессирование ДН от стадии микроальбуминурии до стадии протеинурии находится в прямой зависимости от качества контроля гликемии. Повреждающее воздействие гипергликемии на сосуды клубочков, изменяющее их структуру и функцию, связывают с активацией некоторых биохимических процессов, к которым относят: неферментное гликозилирование белков почечных мембран, изменяющее их структуру и функцию; полиоловый путь обмена глюкозы, приводящий к накоплению в тканях осмотически активного сорбитола; прямое токсическое воздействие глюкозы на ткань почек, приводящее к активации фермента протеинкиназы С, повышающей проницаемость почечных сосудов; активация окислительных реакций, способствующих образованию большого количества свободных радикалов, обладающих цитотоксическим действием. Неферментное гликирование белков – это реакция между глюкозой и лизиновыми аминокислотными остатками циркулирующих или структурных белков, не требующая присутствия специфических ферментов Продукты необратимого гликирования образуются в организме достаточно быстро (несколько месяцев), после чего даже идеальная компенсация СД не способна устранить присутствия этих продуктов, что объясняет прогрессирование сосудистых осложнений СД даже при хорошей компенсации заболевания. Как правило, на стадии протеинурии уже отсутствует зависимость между темпом 8 снижения СКФ, повышением креатинина крови и уровнем гликированного гемоглобина. Гипергликемия оказывает повреждающее действие на структуры почечной ткани в результате активации метаболизма глюкозы по полиоловому пути, в результате чего, нарушаются механизмы внутриклеточной осморегуляции, ведущие к отеку ткани. В условиях гипергликемии активируется протеинкиназа С, которая регулирует сосудистую проницаемость, клеточную пролиферацию, активность тканевых факторов роста, синтез вещества базальной мембраны. Гиперлипидемия - другой метаболический фактор прогрессирования ДН, также приводящий к изменению структуры почечных мембран и прогрессированию гломерулосклероза. Помимо повреждения клубочка, липиды, профильтровавшиеся в первичную мочу могут вызывать повреждения клеток почечных канальцев, что связано с метаболизацией липидов нефроцитами, ведущей к выбросу лизосомальных ферментов и цитотоксическому эффекту. Окисленные и гликированные ЛП, инфильтрируя мезангий и сосудистую стенку, вызывают гиперпродукцию факторов роста и цитокинов, тем самым, ускоряя развитие склеротических процессов. Кроме того, отложившиеся в почечной ткани ЛП могут связывать отрицательно заряженные гликозаминогликаны в базальной мембране клубочка, тем самым, нейтрализуя еѐ отрицательный заряд и повышая проницаемость для белков. Внутриклубочковая гипертензия является ведущим гемодинамическим фактором прогрессирования ДН. Установлено, что причиной развития внутриклубочковой гипертензии является высокая активность почечной ренинангиотензиновой системы (РААС), а именно гиперактивность ангиотензина II. В основе нарушений внутриклубочковой гемодинамики лежит дисбаланс тонуса между приносящей и выносящей артериолами, приводя к повышению интрагломерулярного давления и гиперфильтрации. Длительное воздействие гидравлического пресса внутри капилляров клубочков, в конечном итоге приводит к повышению проницаемости базальной мембраны капилляров клубочков для белков, липидов и других компонентов плазмы. C течением времени этот процесс приводит к полной окклюзии клубочков почек, нарушению процесса фильтрации мочи с развитием гипофильтрации, нарастанием азотемии и появлением симптомов уремической интоксикации. До недавнего времени РААС рассматривали как классическую гормональную систему. За последние годы получены научные доказательства параллельного функционирования гуморальной (эндокринной) и тканевой (аутокриннопаракринной) ренин-ангиотензин-альдостероновых систем. Плазменная, общая для организма РААС играет роль «скорой» помощи, например при кровотечении, падении АД, остром инфаркте миокарда и др. острых ситуациях. Локальная РААС, функционирующая в органах-мишенях, прежде всего в сердце, почках, мозге, сосудах, периферической мускулатуре, под воздействием основного эффектора РААС - ангиотензина (AT) II на ангиотензиновые рецепторы первого типа стимулирует пролиферацию клеток и процессы, получившие название ре9 моделирования органов и тканей. При этом гипертрофия и пролиферация гладкомышечных клеток периферических сосудов сопровождаются развитием АГ. В почках хроническая активация локальной РААС (увеличение продукции AT II и альдостерона) сопровождается развитием клубочковой гипертензии с последующей гибелью клубочков, постепенным снижением фильтрации и ростом протеинурии, потерей электролитов, снижением диуреза и появлением признаков хронической почечной недостаточности. Поэтому, при назначении ингибиторов ангиотензин-превращающего фермента (иАПФ) рассчитывают не столько на гипотензивный и диуретический эффект, связанный с блокадой плазменной РААС, сколько на органопротекторные свойства иАПФ, проявляющиеся при их длительном применении (первые эффекты появляются через 3-4 недели) и связаны с блокадой РААС на тканевом уровне. По мере прогрессирования ДН от стадии ПУ до стадии ХПН ключевую роль играет также артериальная гипертензия. Артериальная гипертензия самый мощный фактор прогрессирования почечной патологии, по силе своего повреждающего воздействия превосходящий влияние метаболического фактора (гипергликемии и гиперлипидемии). При СД резко возрастает активность процессов свободно-радикального окисления в почках, печени, мозговой ткани, легких, сердечной мышце и других органах. Гипергликемия провоцирует избыточное образование свободных радикалов, что может играть роль в развитии ДН. Вышеперечисленные факторы отражают традиционную невоспалительную природу поражения почек при СД. В настоящее время поиск предикторов неблагоприятного течения нефропатии, в дополнение к уже известным, интенсивно продолжается, так как традиционные подходы к лечению ДН не всегда приводят к желаемому результату. В связи с этим встает вопрос о поиске дополнительных механизмов развития ДН и методов ее лечения. За последние годы проведены исследовательские работы, которые дополнили патогенез ДН с учетом процесса воспаления. Предполагается важная роль цитокинов в инициации и прогрессировании нефропатии. Большой интерес сегодня вызывает применение метода молекулярно-генетического анализа в комплексном обследовании больных СД, изучаются генетические маркеры предрасположенности к ДН. Научный интерес представляет С677Т полиморфизм гена метилентетрагидрофолатредуктазы (МТГФР). Этот ген ассоциирован с повышением в плазме гомоцистеина, обладающим эндотелиотоксичным действием. Было установлено, что гомозиготное носительство С677Т полиморфизма гена МТГФР (ТТ генотип) определяет генетическую предрасположенность к ДН при СД 1 типа. В развитии ДН отводится также роль изменениям в системе коагуляции крови, т.е. изменениям уровней тромбомодулина и ингибитора тканевого активатора плазминогена, а также нарушение реологических свойств крови в виде агрегации эритроцитов (замедление кровотока, «сладж» - феномен). 10 Таким образом, в патогенезе ДН принимают участие сочетание различных факторов: метаболических, гемодинамических, иммунологических, генетических, которые тесно взаимосвязаны между собой. КЛАССИФИКАЦИЯ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ В настоящее время во всем мире известна общепринятая классификация стадий ДН, разработанная C.E. Mogensen в 1983 году: 1 – стадия гиперфункции, 2 – стадия начальных структурных изменений почек, 3 - стадия начинающейся ДН (МАУ), 4 – стадия выраженной ДН (ПУ), 5 – стадия уремии. Первые 3 стадии не могут быть выявлены при общем рутинном обследовании больного СД, т.е. относятся к доклиническим стадиям, характеризуются бессимптомным течением и, что является парадоксальным в этой ситуации – только эти стадии могут быть обратимыми. Именно в этот период своевременное назначение лекарственных препаратов позволяет существенно затормозить дальнейшее прогрессирование ДН. В России в 2000 г. Минздрав РФ утвердил классификацию ДН, включающую три стадии развития этого осложнения. стадию микроальбуминурии стадию протеинурии с сохранной азотвыделительной функцией почек стадию хронической почечной недостаточности (ХПН) При тщательном контроле гликемии и нормализации внутрипочечной гемодинамики и объема почек, возможны стабилизация и замедление прогрессирования ДН. Появление же протеинурии указывает на значительный деструктивный процесс в почках, при котором около 50-75% клубочков уже склерозировано, а морфологические и функциональные изменения приняли необратимый характер. С этого времени СКФ прогрессивно снижается на 1 мл/мин в месяц или около 10 мл/мин в год, что приводит к конечной стадии почечной недостаточности через 7-10 лет с момента появления протеинурии. Критерии хронического заболевания почек Неудовлетворенное результатами лечения диализом в США и озабоченное необходимостью повышения его эффективности, в 1995 г. американское нефрологическое сообщество учредило группу экспертов, обозначенную как Инициатива Качества Исходов Диализа (Dialysis Outcome Quality Initiative, сокращенно DOQI), повсеместно известную в настоящее время как ДОКИ. Перед группой была поставлена задача разработки практических рекомендаций по важнейшим аспектам лечения терминальной ХПН. В 2002 г. в Американском журнале болезней почек (American Journal of Kidney Diseases) - и на сайте в Интернет (www.kidney.org/professionals) был опубликован новый раздел Рекомендаций ДОКИ, названный Рекомендациями по хроническим болезням почек. Инициативная группа при этом была переименована в К/ДОКИ, что означает Инициатива Качества Исходов Болезней Почек (Kidney Disease Outcome Quality Initiative). Рекомендация K/DOQI гласит, что любая болезнь почек диагностируется на основании симптоматики, характерной для почечного повреждения и данных 11 о функциональном состоянии почек. Далее необходимо выяснить диагноз заболевания, оценить его тяжесть, выявить сопутствующую патологию и оценить риск развития как терминальной стадии ХПН, так и сердечно-сосудистой патологии. Заболевание почек рекомендуется считать хроническим, если его признаки прослеживаются в течение трех и более месяцев. Общими критериями хронического заболевания почек являются структурные или функциональные изменения, выявляемые по патологии в анализах мочи и/или крови либо по данным морфологического или визуализирующего исследований. При наличии одного из указанных признаков показатель СКФ диагностического значения не имеет. В то же время при снижении СКФ ниже 60 мл/мин/1,73 м2 следует диагностировать хроническое заболевание почек, даже если его другие признаки при этом отсутствуют. Важным шагом на пути совершенствования помощи нефрологическим больным является единый унифицированный подход к оценке тяжести заболевания почек с учетом необходимости разработки единых терапевтических подходов, характер которых в значительной мере определяется стадией болезни. Стадия 1 стадия 2 стадия 3 стадия 4 стадия 5 стадия Табл. 1. Классификация стадий хронического заболевания почек СКФ* Характеристика (мл/мин/1,73 м2) Повреждение почек с нормальной или повы≥ 90 шенной СКФ Повреждение почек с начальным снижением 60-89 СКФ Умеренное снижение СКФ 30-59 15-29 Выраженное снижение СКФ < 15 (или лечение Почечная недостаточность диализом) * СКФ, рассчитанная по формулам Кокрофта-Голта или MDRD. Формулировка диагноза ДН после принятия в Российской Федерации классификации ХБП При выявлении у больного СД мироальбуминурии или протеинурии будет ставиться диагноз с уточнением стадии ХБП (в зависимости от СКФ): ДН, стадия микроальбуминурии, ХБП 1 (2, 3 или 4) ДН, стадия протеинурии, ХБП 2 (3 или 4) При выявлении у больного СД снижения СКФ <60 мл/мин/ 1.73 м2, в отсутствие других признаков поражения почек (мироальбуминурии, протеинурии) будет ставиться диагноз: ХБП 3, 4 12 ХБП 5 (лечение заместительной почечной терапией) Показатель СКФ 90 мл/мин/1,73м2 принят авторами рекомендаций KDOQI, 2002 как нижняя граница нормы. В Рекомендациях подчеркивается, что показатель СКФ является лучшим общим показателем уровня функции почек, т.к. при хронических нефропатиях снижение СКФ отражает уменьшение массы действующих нефронов, то есть является показателем сохранности массы функционирующей почечной паренхимы. Методы оценки скорости клубочковой фильтрации Одна из методологически наиболее корректных формул, полученная по данным измерений, выполненных у 236 пациентов, была предложена в 1976 г. Кокрофтом и Голтом. Согласно этой формуле КФ может быть рассчитана: Для мужчин (норма 90-150 мл/мин): 1,23 х [(140 — возраст (годы)) х масса тела (кг)] СКФ = ----------------------------------------------------------------креатинин крови (мкмоль/л) Для женщин (норма 90-130 мл/мин): 1,05 х [(140 — возраст (годы)) х масса тела (кг)] СКФ = ---------------------------------------------------------------креатинин крови (мкмоль/л) В последние годы все большее признание получает уже упоминавшаяся выше формула MDRD (Modification of Diet in Renal Disease Study), согласно которой: СКФ = 6,09 × (креатинин сыворотки в ммоль/л)-0,999 × (возраст)-0,176 × 0,762 (для женщин) × (мочевина сыворотки в ммоль/л)-0,17 × (альбумин сыворотки в г/л) 0,318. В этой формуле при измерении уровня креатинина в крови в мг/дл и определении вместо мочевины азота мочевины величина коэффициента 6,09 заменяется на 170. В последнее время увеличивается количество исследований, демонстрирующих, что сбор суточной мочи для измерения СКФ не более (а часто менее) надежен, чем расчеты с использованием приведенных формул. Состояния, при которых расчет СКФ по предлагаемым формулам ненадежен и может потребоваться ее измерение, включают: 1. крайние значения возраста и размеров тела; 2. тяжелую белково-энергетическую недостаточность или ожирение; 3. заболевания скелетных мыщц; 4. пара- или тетраплегию; 5. вегетарианскую диету; 6. быстро меняющуюся функцию почек; 13 7. состояния перед назначением препаратов с выраженным нефротоксическим эффектом. Кроме того, расчет СКФ по формулам существенно менее надежен в 1 -2-й стадиях нефропатий, когда возможны гиперфильтрация и гипертрофия действующих нефронов, что и поддерживает нормальный уровень суммарной КФ. У детей рекомендуется оценивать КФ по формуле Шварца (1976): СКФ (мл/мин) = 0,55 х рост/креатинин сыворотки крови или по формуле Кунахана-Баррата (1976): СКФ (мл/мин/1,73 м2) = 0,43 х рост/креатинин сыворотки. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ В литературе подробно описаны морфологические изменения почек на самых ранних этапах развития ДН: гипертрофия клубочков, дистрофические изменения клубочковых и канальцевых клеток, склероз стенки капилляров. Данные изменения развиваются уже в начале развития диабета, т. е. на стадии нормоальбуминурии. Поэтому большое значение имеет изучение и раннее выявление прогностических факторов, которые определяют риск развития ДН, разработка методов ранней профилактики и методов медикаментозной коррекции доклинических стадий ДН. Стадия микроальбуминурии. Это единственная обратимая стадия ДН, которая характеризуется отсутствием клиники и является бессимптомной (латентная стадия). Лабораторно она проявляется высокой СКФ и повышенным почечным кровотоком, отсутствием белка в общеклинических рутинных анализах мочи, нормальным или чуть повышенным уровнем АД. Отличительная черта этой стадии заключается в появлении так называемой микроальбуминурии (МАУ). Микроальбуминурией называют состояние, которое характеризуется повышенной экскрецией с мочой альбумина (в пределах 30 - 300 мг/сут или 20-200 мкг/ мин). При СД 1 типа МАУ появляется обычно не ранее чем через 3 - 5 лет от начала заболевания, при СД 2 типа может быть выявлена при первом обращении больного к врачу. У здоровых лиц экскреция альбумина с мочой колеблется и не превышает 30 мг/сут. Ежедневные колебания в показателях экскреции альбумина как у здоровых лиц, так и у больных СД составляют около 40%. В этой связи для выявления истинной МАУ необходимы многократные измерения этого показателя за период в несколько недель (как правило, это трехразовое измерение). Если у больного диабетом выявляется МАУ, то при отсутствии должного лечения существует высокая вероятность того, что в дальнейшем показатель экскреции альбумина с мочой будет постоянно повышаться в темпе, соответствующем примерно 15% в год, что в конечном итоге приводит к появлению протеинурии через 8 - 10 лет. Установлено, что при появлении МАУ начинается постепенное повышение уровня АД, не всегда улавливаемое рутинными одноразовыми измерениями. Это обстоятельство было документировано в исследованиях с применением су14 точного мониторирования АД. Такие исследования позволили установить, что в среднем уровень АД у больных с МАУ превышает таковой у больных с нормоальбуминурией на 10-15%. Установлено, что с момента появления МАУ уровень АД начинает повышаться приблизительно на 3% в год. Микроальбуминурия является не только предвестником развития клинически развернутой стадии ДН, но и связана с высоким риском развития сердечнососудистых осложнений у этих больных. Стойкая компенсация углеводных нарушений, а также применение препаратов, нормализующих почечную гемодинамику и биохимический состав базальных мембран клубочков почек, могут остановить патологический процесс в почках на стадии МАУ. Именно поэтому так важно своевременно диагностировать раннюю доклиническую стадию ДН. Стадия протеинурии. Появление постоянной протеинурии, выявляемой в общеклинических анализах мочи, свидетельствует о наступлении развернутой стадии ДН. При этом экскреция альбумина с мочой превышает 200 мкг/мин или 300 мг/сут, а экскреция белка в рутинных исследованиях мочи превышает 0,5 г/сут. Протеинурия обычно выявляется через 15 - 20 лет от начала СД. С момента появления протеинурии у больных начинается неуклонное снижение СКФ в среднем на l мл/мин в месяц, что приводит к развитию терминальной почечной недостаточности приблизительно через 5 - 7 лет от момента появления протеинурии. Увеличение протеинурии до 3,5 г/сут и более может привести к развитию нефротического синдрома, включающего в себя помимо высокой протеинурии также гипоальбуминемию, гиперхолестеринемию, повышение артериального давления и появление гипоальбуминемических отеков вплоть до анасарки. Протеинурическая стадия ДН характеризуется нарастанием тяжести и других микро- и макрососудистых осложнений сахарного диабета: ретинопатии, нейропатии, ишемической болезни сердца. Частота ретинопатии у больных с протеинурией достигает практически 100%. При этом в 70% выявляются наиболее тяжелые стадии диабетической ретинопатии - препролиферативная и пролиферативная, влекущие за собой потерю зрения. ДН стадии протеинурии необратима. К моменту ее появления 50% клубочков склерозировано и не функционирует. На этой стадии возможно лишь замедлить прогрессирование ДН до стадии уремии. Стадия уремии. На этой стадии фильтрационная функция почек продолжает неуклонно снижаться, приводя к нарастанию концентрации в крови токсических азотистых шлаков. Биохимическими маркерами сниженной СКФ являются повышение креатинина и мочевины сыворотки крови, гиперкалиемия и гиперфосфатемия. Снижение СКФ происходит за счет прогрессирующей окклюзии почечных клубочков, морфологически определяемой как тотальный диффузный или узелковый гломерулосклероз. Однако объем почек даже на этой стадии может оставаться нормальным или умеренно сниженным за счет того, что изначально почки были резко увеличены в размерах. На стадии ХПН может отмечаться снижение протеинурии, что является неблагоприятным прогностическим 15 признаком, говорящим о прогрессирующей окклюзии почечных клубочков. Терминальная стадия поражения почек характеризуется неудержимым ростом уровня АД, иногда приобретающим неуправляемый характер. На этой стадии присоединяется выраженная задержка жидкости с развитием отечного синдрома, даже при отсутствии гипоальбуминемии. К клиническим признакам ХПН могут присоединиться симптомы сердечной недостаточности. Состояние может осложниться развитием отека легких. На стадии ХПН, как правило, резко прогрессируют и другие микро- и макрососудистые осложнения сахарного диабета: − 100% больнх с ХПН имеют диабетическую ретинопатию, из них 80% - пролиферативную стадию ретинопатии, приводящую к полной потере зрения у 30-40% больных. − все больные с ХПН имеют периферическую полинейропатию, которая усугубляется при уремии вследствие присоединения специфического уремического поражения нервных волокон. − усугубляется автономная нейропатия, проявляющаяся ортостатической гипотензией в положении стоя при выраженной гипертензии в положении лежа, что осложняет подбор адекватной дозы антигипертензивных репаратов. − прогрессирует нейропатическое и ишемическое поражение нижних конечностей, приводящее к развитию глубоких незаживающих язв стоп. На стадии уремии присоединяются специфические симптомы, характерные для больных с выраженной потерей фильтрационной функции почек, к ним относятся: − почечная анемия, как правило, нормохромная и нормоцитарная, развивающаяся вследствие нарушенного синтеза эритропоэтина в почках. − почечная остеодистрофия - поражение скелета и мягких тканей, развивающееся вследствие нарушения фосфорно-кальциевого обмена. Для ХПН характерна гиперфосфатемия и гипокальциемия, которая, стимулируя секрецию паратгормона, приводит к гиперплазии пара щитовидных желез и развитию вторичного гиперпаратиреоза. Гиперпаратиреоз обнаруживается еще при умеренном снижении СКФ до 60-40 мл/мин. При более выраженном падении фильтрационной функции почек до 40-20 мл/мин развиваются признаки остеомаляции. Основные клинические симптомы остеодистрофии - боли в костях и мышечная слабость, возможно развитие патологических переломов, компрессия позвонков. − уремическая интоксикации (при снижении СКФ менее 10 мл/мин) – зуд, тошнота, рвота, явления метаболического ацидоза. Кроме специфических изменений в почках, при СД часто наблюдаются их воспалительные заболевания. В моче таких больных определяется бактериурия, которая протекает бессимптомно или с клинической картиной пиелонефрита. Гнойный пиелонефрит у больных сахарным диабетом встречается в виде апостематозного нефрита, абсцесса или карбункула почек. Нередко присоединяется цистит. Этому способствует не только наличие глюкозурии (среда для размно16 жения микробов), но и автономная нейропатия, приводящая к синдрому неполного освобождения мочевого пузыря. Инфекция почек может вести к образованию абсцесса или карбункула почки, который может протекать с клинической картиной холецистита, аппендицита, панкреатита и т.д. Септический характер температурной кривой и относительная резистентность к антибиотикотерапии, несмотря на отсутствие типичного болевого синдрома (автономная нейропатия), являются индикаторами возможного абсцесса или карбункула почки. Ультразвуковое исследование в части случаев помогает установить правильный диагноз, а оперативное лечение спасает жизнь больным. Помимо этого, при сахарном диабете встречается гидронефроз, обусловленный ―атоническим‖ (нейрогенным) мочевым пузырем. Таким образом, для диагностики диабетической нефропатии необходимо проведение лабораторных исследований, указанных в таблице. ДИАГНОСТИКА ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ Наиболее ранним и достоверным методом диагностики ДН является тест на микроальбуминурию (МАУ). Под термином ―микроальбуминурия‖ понимают экскрецию альбумина с мочой в низких количествах (от 30 до 300 мг/сут). Такое количество белка не определяется при традиционном рутинном исследовании мочи, в связи с чем, самая ранняя стадия ДН может быть не диагностирована. Табл. 2. Обязательные и дополнительные методы исследования Обязательные методы исследования Дополнительные методы исследования 1. Микроальбуминурия (МАУ), предпочтено 1. Дуплексное ультразвуковое исв утренней порции мочи следование почек и почечных 2. Протеинурия (в общем клиническом анасосудов лизе мочи и в моче собранной за сутки) 2. Ангиография почечных сосудов 3. Осадок мочи для диагностики стенозирующе4. Креатинин, мочевина, калий сыворотки го процесса, эмболии сосудов и 5. Расчет СКФ др. Табл. 3. Диагностические показатели альбуминурии Альбуминурия Диагностические Концентрация Соотношение показатели альУтренняя За альбумина в альбумин / креатинин буминурии порция сутки моче (мг/л) мочи (мг/ммоль) (мкг/мин) (мг) Нормоальбумину<2,5 (мужчины) <20 <30 <20 рия <3,5 (женщины) Микроальбумину2,5-25,0 (мужчины) 20-199 30-299 20-199 рия* 3,5-25,0 (женщины) Протеинурия* ≥200 ≥300 ≥200 >25 *Микроальбуминурия и протеинурия считаются доказанными при наличии двух положитеных результатов в течение 1 месяца 17 Табл. 4. Алгоритм скрининга диабетической нефропатии Исследовать протеинурию (ПУ) в общем анализе мочи (при отсутствии сочевой инфекции), исследовать креатинин сыворотки крови для рассчета СКФ ПУ нет ПУ есть Тест на МАУ МАУ нет СКФ>60 Скрининг МАУ, креатинин крови для рассчета СКФ 1 раз в год МАУ есть СКФ<60 СКФ>60 СКФ<60 СКФ>60 СКФ<60 ХБП 3-4 консультация нефролога ДН стадии МАУ, ХБП 1-2 ДН стадии МАУ, ХБП 3-4 ДН стадии протеинурии, ХБП 1-2 ДН стадии протеинурии, ХБП 3-4 Лечение СКФ<15 ХБП 5 Выбор ЗПТ Табл. 5. Группы риска диабетической нефропатии (показан ежегодный скрининг ДН с определением МАУ и СКФ) Категории больных Больные СД 1, заболевшие в раннем детском и постпубертатном возрасте Больные СД 1, заболевшие в пубертат возрасте Начало скрининга Через 5 лет от дебюта СД далее ежегодно Сразу при постановке диагноза, далее — ежегодно Сразу при постановке диагноза, далее — ежегодно Больные СД 2 Беременные на фоне СД или больные гестационным СД 1 раз в триместр 18 Табл. 6. Мониторинг в зависимости от стадии диабетической нефропатии Стадия ДН Параметры контроля Частота определений Микроальбу- НbА1с 1 раз в З мес. минурия Альбуминурия 1 раз в 6 мес. АД Ежедневно (домашний мониторинг) Креатинин и мочевина сыворот- 1 раз в год ки СКФ 1 раз в год Липиды сыворотки 1 раз в год при нормальных значениях; 1 раз в 3мес. при лечении статинами Гемоглобин 1 раз в год Железо сыворотки Ферритин сыворотки Насыщение трансферрина железом С-реактивный белок ЭКГ + нагрузочные тесты, Рекомендации кардиолога Эхо-КГ Глазное дно Рекомендации окулиста Осмотр стоп При каждом посещении врача Протеинурия, НbА1с 1 раз в 3 мес. ХБП 3 (или Протеинурия 1 раз в 6 мес. ХБП 3 без АД Ежедневно (утро — вечер) других приКреатинин и мочевина сыворот- 1 раз в 6 мес. знаков пора- ки жения почек) СКФ 1 раз в 6 мес Альбумин сыворотки 1 раз в 6 мес. Липиды сыворотки 1 раз в 6 мес. при нормальных значениях, 1 раз в 3 мес. при значении статинами Гемоглобин 1 раз в 6 мес. (чаще – в начале Железо сыворотки лечения средствами, стимуФерритин сыворотки лирующими эритропоэз, и Насыщение трансферрина желе- препаратами железа) зом С-реактивный белок ЭКГ+ нагрузочные тесты, Эхо- Рекомендации кардиолога КГ Глазное дно Рекомендации окулиста 19 Исследование автономной и сенсорной нейропатии Осмотр стоп Протеинурия, НbА1с ХБП 4 (или Протеинурия ХБП 4 без АД других приКреатинин, мочевина и калий знаков пора- сыворотки жения почек) СКФ Альбумин сыворотки Кальций плазмы (общий и ионизированный), фосфор Липиды сыворотки Гемоглобин Железо сыворотки Ферритин сыворотки Насыщение трансферрина железом С-реактивный белок Паратгормон Денситометрия ЭКГ+ нагрузочные тесты, Эхо-КГ Глазное дно Рекомендации невролога При каждом посещении 1 раз в 3 мес. 1 раз в месяц Ежедневно (утро, вечер) 1 раз в 1 мес. (чаще в начале лечения иАПФ или БРА). 1 раз в месяц 1 раз в месяц 1 раз в 3 месяца 1 раз в 3 месяца 1 раз в 3 месяца (1 раз в мес. при начале лечения средствами, стимулирующими эритропоэз, и препаратами железа) 1 раз в 3 месяца 1 раз в год Рекомендации кардиолога Рекомендации окулиста Осмотр стоп При каждом посещении врача Консультация невролога Маркеры вирусных гепатитов 1 раз в 6 мес. 1 раз в 6 мес. ПРИНЦИПЫ ЛЕЧЕНИЯ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ В ЗАВИСИМОСТИ ОТ ЕЕ СТАДИИ Табл.7. Лечение диабетической нефропатии на различных стадиях Стадия ДН Принципы лечения Микроальбуминурия, Достижение индивидуальных целевых значений ХБП 1-3 HbA1c Умеренное ограничение животного белка (не более 1,0 г/кг массы тела в сутки) Ингибиторы АПФ или БРА как препараты выбора Комбинированная АГ-терапия для достижения целевого АД Гликозаминогликаны (сулодексид) при отсутствии противопоказаний 20 Протеинурия, ХБП 1-3 ХБП 4 Коррекция дислипидемии Коррекция анемии Избегать применения нефротоксических средств (аминогликозиды, нестероидные противовоспалительные препараты) Осторожность при проведении рентгеноконтрастных исследований Достижение индивидуальных целевых значений HbA1c Ограничение животного белка (не более 0,8 г/кг массы тела в сутки) Ингибиторы АПФ или БРА как препараты выбора Комбинированная АГ-терапия для достижения целевого АД Гликозаминогликаны (сулодексид) при отсутствии противопоказаний (доказательства недостаточны) Коррекция дислипидемии Коррекция анемии (средства, стимулирующие эритропоэз, препараты железа) Избегать применения нефротоксических средств (аминогликозиды, нестероидные противовоспалительные препараты) Осторожность при проведении рентгеноконтрастных процедур Контроль статуса питания Достижение индивидуальных целевых значений HbA1c Ограничение животного белка (0,7 - 0,8 г/кг массы тела в сутки) Ингибиторы АПФ или БРА как препараты выбора; уменьшение дозы при СКФ<30 мл/мин/1,73м2 Комбинированная АГ-терапия для достижения целевого АД Коррекция гиперкалиемии Коррекция дислипидемии Коррекция нарушений фосфорно-кальциевого обмена Коррекция анемии (средства, стимулирующие эритропоэз, препараты железа) Избегать применения нефротоксических средств (аминогликозиды, нестероидные противовоспалительные препараты) Осторожность при проведении рентгеноконтраст21 ХБП 5 ных процедур Контроль статуса питания Гемодиализ Перитонеальный диализ Трансплантация почки Табл.8. Сахароснижающие препараты, допустимые к применению на различных стадиях ХБП ПРЕПАРАТЫ СТАДИЯ ХБП Метформин 1-2 Глибенкламид (в т. ч. микронизированный) 1-2 Гликлазид и гликлазид МВ 1-4 Глимепирид 1-3 Гликвидон 1-4 Глипизид и глипизид ГИТС 1-4 Репаглинид 1-4 Натеглинид 1-3 Пиоглитазон 1-4 Росиглитазон 1-4 Ситаглиптин 1-3 Вилдаглиптин 1-3 Саксаглиптин 1-4 Эксенатид 1-3 Лираглутид 1-3 Акарбоза 1-2 Инсулины 1-5 Примечания: - При ХБП 4 требуется снижение дозы препарата. - При ХБП 5 нет противопоказаний к применению препаратов инсулина. Необходимо помнить о повышении риска развития гипогликемии у больных на инсулинотерапии по мере прогрессирования заболевания почек от ХБП 1-2 до 3-5, что требует редукции дозы инсулина. Данных о применении других сахароснижающих препаратов на терминальной стадии поражения почек недостаточно. Показания к началу заместительной почечной терапии у больных сахарным диабетом В общей популяции больных с терминальной ХПН вопрос о начале заместительной почечной терапии принято рассматривать при снижении СКФ меньше 15 мл/мин и/или наличии симптомов уремии, отсутствии возможности контролировать объемный статус или АД, прогрессивном ухудшении нутриционных показателей. У больных СД в связи с более тяжелым соматическим состоянием (вследствие наличия микро- и макрососудистых осложнений, диабетической 22 нейропатии, хронической инфекции мочевыводящих путей) показания к началу диализной терапии нередко возникают раньше. Показания к началу заместительной почечной терапии у больных СД и ХПН СКФ < 15мл/мин/1,73м2 Калий сыворотки > 6,5 мэкв/л Тяжелая гипергидратация с риском развития отека легких Нарастание белково-энергетической недостаточности Еще до наступления терминальной стадии ХПН необходимо выбрать метод заместительной почечной терапии (ГД или ПД), который будет применен в дальнейшем конкретному больному. Существуют абсолютные и относительные показания и противопоказания для того или иного вида диализа. Среди абсолютных противопоказаний для ГД - на первом месте стоит отсутствие возможности формирования безопасного постоянного сосудистого доступа. Для перитонеального диализа абсолютным противопоказанием является наличие активных воспалительных заболеваний желудочно-кишечного тракта или тяжелая ишемическая болезнь кишечника. Во всех остальных случаях выбор вида диализной терапии должен быть индивидуальным. Методы диализной терапии Гемодиализ — это очищение крови от токсических веществ, накапливаемых при уремии, путем диффузии через полупроницаемую мембрану диализатора. Необходимы специальные аппараты для гемодиализа. Ультрафильтрация (УФ) представляет собой фильтрацию безбелковой части плазмы через полупроницаемую мембрану под действием гидростатического давления. Процедуру обычно проводят одновременно с ГД или без ГД (изолированная УФ). Гемофильтрация — это способ очищения путем конвекционного переноса растворенных в плазме крови веществ (т.е. вместе с потоком воды) через полупроницаемую мембрану под действием гидростатического давления. Используются специальные гемофильтры. Гемодиафильтрация (ГДФ) — это метод очищения крови, в котором сочетаются гемодиализ и гемофильтрация. Перитонеальный диализ (ПД) — метод диализа, при котором в качестве полупроницаемой мембраны используется брюшина пациента. Очищение крови достигается путем диффузии токсических веществ из капилляров брюшины в диализирующий раствор по осмотическому градиенту. Для введения диализирующего раствора в брюшную полость имплантируется специальный катетер. Подготовка к диализной терапии у больных СД должна быть плановой и начинаться на додиализной стадии ХПН (при креатинине сыворотки крови 150200 мкмоль/л). Эта подготовка должна вестись совместно эндокринологомдиабетологом и нефрологом. До начала ЗПТ всех пациентов необходимо обследовать на предмет выявления вирусного гепатита (В и С) и, по возможности, провести их вакцинацию. Регулярно больной посещает кардиолога, окулиста, 23 невролога, кабинет диабетической стопы (при необходимости). Частота проведения исследований на додиализной стадии ХПН отмечена в таблице. Табл.9. Необходимые исследования у больных сахарным диабетом на додиализной стадии ХПН Мониторирование НвА1с Уровень АД Протеинурия (за сутки) СКФ Креатинин, мочевина, калий сыворотки крови Кальций плазмы: общий и ионизированный Паратгормон Общий Нb крови Липидный спектр крови ЭКГ (ЭХО-КГ, нагрузочные тесты) Глазное дно Осмотр стоп Консультация невролога Маркеры гепатита Частота исследований 1 раз в 3 месяца Ежедневно (утро-вечер) 1 раз в месяц 1 раз в месяц 1 раз в месяц (чаще - при начале лечения АПФ-ингибиторами) 1 раз в месяц 1 раз в 6 мес. 1 раз в месяц (чаще - при начале лечении эритропоэтином) 1 раз в 3 месяца По рекомендациям кардиолога (не реже 1 раза в 3 мес.) По рекомендации окулиста (не реже 1 раза в 3 мес.) При каждом посещении врача 1 раз в 6 месяцев 1 раз в 6 месяцев Хорошая предиализная подготовка больного СД соответствует следующим клинико-лабораторным показателям: НвА1с 7,0 – 7,5% отсутствие гипергидратации уровень АД < 140/90 мм.рт.ст. Нb крови - 120 г/л альбумин сыворотки > 35 г/л калий сыворотки < 5 ммоль/л кальций сыворотки 2.3 - 2.5 ммоль/л фосфор сыворотки < 1,6 ммоль/л произведение кальций х фосфор плазмы < 4,4 (ммоль/л) стабилизация сосудистых изменений на глазном дне 24 При таких показателях во много раз повышается выживаемость больных СД на диализе. Однако, следует учитывать как социальные, так и медицинские аспекты предстоящей диализной терапии. Табл. 10. Преимущества и недостатки гемодиализа, перитонеального диализа и трансплантации почки у больных сахарным диабетом Вид диализа Преимущества Недостатки Риск для больных с прогрессируюОчень эффективен щими заболеваниями сердца Частое медицинское наЧасто возникает необходимость во блюдение в диализном множественных сосудистых достуцентре пах. Гемодиализ Нет потери белка с диали- Риск ишемии руки затом Высокая частота гипотензии во время Меньше необходимость в сеанса гемодиализа ампутации конечностей Преддиализная гиперкалиемия Склонность к гипогликемии. Хорошая сердечнососуди- Перитониты, инфекция выходного стая толерантность. отверстия, тоннельная инфекция неНет необходимости в арте- сколько чаще, чем у больных без СД. рио-венозном доступе. Потеря белка с диализатом Хороший контроль калия в Осложнения, связанные с повышениПеритонеальплазме. ем внутрибрюшного давления (усуный диализ Хороший контроль глюко- губление гастропареза, грыжи, подзы, особенно, при интрапе- текание диализата и т.д.) ритонеальном введение Неудобная программа для помощниинсулина, менее выражен- ка, если в нем есть необходимость ная гипогликемия. (например, при слепоте). Необходимость оперативного вмешаПолное излечение от по- тельства. чечной недостаточности на Риск отторжения трансплантата. период функционирования Трудность обеспечения метаболичетрансплантата. ского контроля при приеме стероидТранспланта- Стабилизация ретинопа- ных препаратов. ция почки тии. Высокий риск инфекционных осложОбратное развития поли- нений вследствие приема цитостатинейропатии. ков. Лучшая реабилитация. Повторное развитие диабетического Лучшая выживаемость. гломерулосклероза в трансплантированной почке. 25 В качестве серьезных преимуществ ПД следует отметить также и более продолжительную сохранность остаточной функции почки, а следовательно: более высокий уровень гемоглобина и более высокий клиренс веществ, играющих роль в патогенезе уремии (конечных продуктов гликозилирования, средних молекул. Неоспоримым достоинством ПД является и то, что его можно применять у пациентов живущих далеко от диализного центра или больных с ограниченной подвижностью. В то же время ПД может быть не успешен у «неуправляемых» пациентов (non-compliance), которые не выполняют рекомендации врача или недостаточно мотивированы в необходимости лечения диализом. В этом случае гемодиализ предпочтительней, как метод, проведение которого зависит от медицинского персонала, а не от самого больного. ПД может быть не совсем адекватен как метод экстренной помощи при далеко зашедшей уремии. В этих случаях целесообразно начало лечения с экстракорпоральных методов, с возможным продолжением, в последующем лечения перитонеальным диализом. Серьезным недостатком ПД является и то, что выживаемость его методики ниже выживаемости методики гемодиализа. Кроме того, перитонеальный диализ менее эффективен в регуляции внеклеточного объема жидкости, вследствие чего у больных сохраняется некоторая гипергидратация. Необходимо отметить, что применение стандартных глюкозосодержащих растворов для перитонеального диализа несет в себе риск гиперлипидемии и, как следствие, более быстрой прогрессии атеросклероза. И наконец, в условиях ПД может быть затруднен контроль ультрафильтрации. Коррекция гипергликемии у больных, получающих заместительную почечную терапию Все больные СД (включая больных СД 2 типа) на предиализной стадии ХПН, как правило, уже получают инсулинотерапию. Это связано с тем, что длительное течение СД 2 типа (более 10 лет) до развития ХПН истощает инсулинсекреторную способность поджелудочной железы и приводит к потребности в полной заместительной терапии инсулином, как и у больных СД 1 типа. При развитии терминальной стадии ХПН потребность в инсулинотерапии у больных СД изменяется и может либо повышаться, либо снижаться. Повышение потребности в инсулине возникает вследствие усиления инсулинорезистентности периферических тканей на фоне уремической интоксикации, а также вследствие сопутствующих атерогенной дислипидемии, анемии, воспалительных осложнений. Уменьшение потребности в инсулине сопряжено с угнетением активности почечной инсулиназы, участвующей в деградации эндогенного и экзогенного инсулина, с нарушением питания больного (уремическая анорексия, частая рвота), а также с потерей глюкозы с диализатом во время сеансов ГД. В то же время при проведении адекватного диализа и устранении уремической интоксикации, достижении «сухого веса» и улучшении питания больного потребность в инсулине вновь может повыситься. Больным СД, получающим лечение ГД и имеющим сопутствующие тяжелые сосудистые осложнения (ИБС, синдром диабетической стопы, диабетическая ретинопатия), рекомендуется перевод на ин26 тенсивную схему инсулинотерапии человеческими генноинженерными инсулинами (или аналогами инсулина). Эффективный контроль гликемии у больных СД, получающих лечение ГД, представляет собой достаточно сложную задачу. У таких пациентов уровень гликемии в течение суток не стабилен и может колебаться от значений более 1520 ммоль/л перед диализом до гипогликемических эпизодов (менее 3,3 ммоль/л) во время и после диализа. Гипергликемия у больных СД на гемодиализе имеет свои особенности. В состоянии анурии отсутствует механизмы выведения глюкозы с мочой (глюкозурии), освобождающие организм от высокого содержания глюкозы. Развивается гиперосмолярное состояние, сопровождаемое выраженной жаждой, прибавкой веса за счет накапливаемой жидкости, гипергидратацией, что может осложняться отеком легких. Гипогликемия (гликемия < 3,3 ммоль/л) гораздо более опасна для больных СД на гемодиализе, чем умеренная гипергликемия. Гипогликемия способна вызвать гемодинамические, реологические и неврологические нарушения. Опасность гипогликемии усугубляется тем, что у больных длительно болеющих СД уже в предиализной стадии ХПН развивается автономная нейропатия - потеря способности распознавать гипогликемию. У них отсутствуют клинические предвестники гипогликемии: потливость, головокружение, тремор, чувство голода, тахикардия и др., что приводит к развитию гипогликемической комы. Развитие интрадиализной гипогликемии связано не только с нарушением привычного режима питания в день диализа, но и с потерями глюкозы во время диализа. Установлено, что во время диализа теряется до 100 г глюкозы. Для предупреждения гипогликемических состояний во время диализа у больных СД используют диализат, содержащий до 10-12 ммоль/л глюкозы. Целевые значения уровня гликемии у больных СД на ГД зависят от многих факторов. Так в начале проведения ГД, при наличии выраженных сердечнососудистых осложнений, у одиноких пожилых пациентов следует придерживаться уровня гликемии 8-12 ммоль/л. Такая гипергликемия, как правило, не сопровождается выраженной жаждой и не приводит к гипергидратации в междиализные дни. В дальнейшем, в случае хорошей обучаемости и комплаентности пациента и при стабилизации других сосудистых осложнений диабета, уровень целевых значений гликемии может быть приближен к оптимальным (6-9 ммоль/л). Целевой уровень НbА1с у больных СД на диализе: ▪ <7,5% у молодых больных без выраженных сердечно-сосудистых осложнений; ▪ 7,5 - 8,0% у больных с тяжелой формой ИБС или ДР Динамику НвА1с у больных СД на диализе при необходимости можно оценивать 1 раз в 4-6 недель (т.е. чаще, чем у недиализных больных), поскольку период жизни эритроцитов у больных с ХПН в 2 раза меньше, чем у больных с сохранной функцией почек. 27 Контроль АД у больных СД на диализе. Целевой уровень АД не отличается от рекомендованного для всей популяции диализных больных в целом (120/80-140/90 мм. рт. ст.). Могут быть использованы ингибиторы АПФ или БРА (одна из целей – достижение кардиопротекции) блокаторы кальциевых каналов, бета – блокаторы, агонисты имидазолиновых рецепторов и др. Почечная анемия у больных СД на диализе. Целевой уровень гемоглобина крови: 11,0 г/дл. Лечение анемии осуществляется средствами, стимулирующими эритропоэз (эпоэтин-альфа, эпоэтин-бета, дарбэпоэтин-альфа, метоксиполиэтиленликоль эпоэтин-бета) и препаратами железа (пероральными и парентеральными). Особенности питания больных на диализе. При начале гемодиализа диета больных претерпевает существенные изменения. Прежде всего, это касается белкового компонента пищи. Если на додиализном этапе больным рекомендовали резкое ограничение употребления животного белка (до 0,5 г/ кг массы тела, т.е. не более 35-40 г белка в сутки), то после начала гемодиализной терапии белковый рацион расширяется до 1 -1,3 г/кг массы тела, Из общего количества белка 75% должно приходиться на белок животного происхождения (мясо, рыба, птица, молочные продукты). Только животный белок восполняет дефицит всех незаменимых аминокислот, потеря которых усугубляется при проведении гемодиализа. Общая калорийность пищи должна составлять при гемодиализе не менее 2500 ккал. В то же время сохраняются ограничения по употреблению легкоусвояемых углеводов (сахар, мед, конфеты, другие сладости), за исключением случаев развития гипогликемических состояний. При перитонеальном диализе происходит значительная потеря белка (в основном - альбумина) с диализатом. Поэтому количество белка, которое должно поступать с пищей несколько выше, чем при лечение ГД: 1,5-1,8 гр/кг веса в сутки. Снижение аппетита, которое часто бывает у этих пациентов, объясняют не только гастропарезом, но и абсорбцией глюкозы из диализирующего раствора. Поэтому целесообразно использовать пищевые белковые добавки (соевые изоляты). Оптимальными являются безфосфорные смеси, с достаточным содержанием калия. Для коррекции дислипидемии и профилактики сердечно-сосудистых осложнений сохраняются ограничения в отношении жирной пищи, содержащей насыщенные жирные кислоты (сливочное масло, майонез, сыр). Предпочтение отдается ненасыщенным жирам (растительное масло). При наличии артериальной гипертонии количество соли (хлорида натрия) ограничивают до 1-2 г/сутки (с учетом как добавляемой в процессе приготовления пищи, поваренной соли, так и соли содержащейся в готовых продуктах). Потребление калия не должно превышать 2 г/сутки при гемодиализе. При перитонеальном диализе - ограничений по потреблению калия нет (при условии использования стандартных безкалиевых диализирующих растворов). Суточное потребление жидкости зависит от диуреза и рассчитывается как сумма диуреза за предыдущие сутки + 400-600 мл. 28 Соблюдение вышеуказанных рекомендаций позволяет больным не превышать допустимой прибавки массы тела в междиализный период при ГД, составляющей 1,5 – 2,0 кг. При лечении диализом необходимо восполнять дефицит практически всех витаминов (группы В, С, Е, D, фолиевой кислоты), за исключением витамина А, концентрация которого при ХПН увеличивается вследствие повышения в крови ретинолсвязывающего белка. Экономические аспекты диабетической нефропатии Лечение больных СД с терминальной стадией почечной недостаточности требует колоссальных затрат. В США стоимость лечения 1 больного на гемодиализе составляет 40 - 45 тыс. $ в год. Используя ту же сумму денег, возможно провести: скрининг на микроальбуминурию у 4000 больных СД или провести терапию ингибиторами АПФ в течение года 400 больным СД на стадии МАУ, что в 50% случаев позволит полностью остановить прогресрование нефропатии или провести терапию ингибиторами АПФ в течение года 200 больным СД на стадии протеинурии, что позволит приостановить прогрессирование ДН и ее переход в стадию ХПН у 50% больных АНЕМИЧЕСКИЙ СИНДРОМ КАК ОСЛОЖНЕНИЕ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ Одним из наиболее тяжелых и грозных осложнений у больных СД на фоне развивающейся ДН является анемия. При ДН анемия развивается гораздо раньше и протекает значительно тяжелее, чем у больных с заболеваниями почек другой этиологии. Установлено, что у больных СД 1 типа с ДН при длительности диабета более 10 лет частота развития анемии увеличивается и встречается практически у каждого третьего больного. Патогенез анемии Развитию анемии при СД могут способствовать множество причин, т.е. этот процесс является мультифакториальным. К наиболее частым причинам относят дефицит витамина В12 и фолиевой кислоты, аутоиммунную патологию, хронические кровопотери, гипотиреоз, злокачественные новообразования, прием некоторых лекарственных препаратов. Весомой причиной анемии у больных СД служит дефицит железа, обусловленный различными экзогенными и эндогенными факторами. При СД наблюдается высокая агрегационная активность эритроцитов и глубокие структурные нарушения их мембран, приводящие к изменениям физических, биохимических и морфофункциональных свойств клеток. Развивающиеся структурные изменения эритроцитов наблюдаются у больных с 1 и 2 типом диабета. Пусковым моментом служит хроническая гипергликемия, запускающая процессы окислительного стресса и приводящая к развитию синдрома эндогенной интоксикации. 29 Ведущей причиной развития нефрогенной анемии у больных СД на фоне прогрессирования ДН является снижение продукции и активности эритропоэтина (ЭПО), продуцируемого перитубулярными интерстициальными клетками (эпоцитами) коры почек вследствие развития тубулоинтерстициального фиброза. ЭПО - это гормон гликопротеиновой природы, который состоит из цепи 165 аминокислот и карбоангидратной части, активно гликозилированный и относящийся к суперсемейству цитокинов. Синтез основного количества ЭПО (85 – 95%) происходит главным образом в почках, незначительная часть (около 5 – 15%) образуется в печени. Частота встречаемости анемии, связанной с недостатком ЭПО выше у больных СД 1 типа и дебют анемии можно наблюдать уже при нормальных значениях креатинина сыворотки. Отмечено влияние половой принадлежности больных на выраженность нефрогенной анемии. Установлено, что у больных с ДН женского пола частота встречаемости анемии выше, чем у больных мужского пола, но при выраженном снижении СКФ (ХБП 4-5 стадии) половые различия в развитие анемии уже не фиксируются. Так называемый «функциональный» дефицит ЭПО (отсутствие повышения уровня гормона в сыворотке в ответ на снижение уровня Hb) у больных с ДН в большинстве случаяхформируется при снижении СКФ<60 мл/мин. Нередко снижение продукции ЭПО можно наблюдать у больных с ДН еще до снижения почечной функции. По-видимому, это объясняется особенностью развития ДН, при которой дисфункция тубулоинтерстиция развивается значительно раньше снижения СКФ. Поэтому, развитие анемии при СД, обусловленной недостаточной продукцией ЭПО может служить ранним маркером ДН. В исследовании, проведенном Шестаковой М.В. с соавт. показано, что у больных СД при нормальных значениях СКФ анемия регистрировалась в 24,5% случаях; при умеренном снижении СКФ ее частота увеличивалась до 44,8-54,2%; при СКФ<15-29 мл/мин анемия наблюдалась у 85,7% больных. У больных СД установлена прямая зависимость уровня Hb с величиной СКФ. Таким образом, поражение тубулоинтерстиция формируется задолго до снижения СКФ и диагностику анемического синдрома у больных СД можно отнести к ранним маркерам ДН. Развитие анемии сопровождается рядом изменений, которые существенно снижают качество жизни больных СД: снижается трудоспособность, толерантность к умственным и физическим нагрузкам. Наряду с этими эффектами, развитие анемии при СД является угрожающим состоянием, т.к. ее наличие ассоциируется с развитием и прогрессированием микро- и макрососудистых осложнений. Хроническая анемия оказывает негативное влияние на сердечнососудистую систему за счет инициирования таких процессов, как развитие диастолической дисфункции и гипертрофии миокарда, увеличение частоты сердечных сокращений. Доказана прямая зависимость степени тяжести анемии с гипертрофией миокарда левого желудочка. Анемия является фактором риска гипертрофии левого желудочка наравне с такими факторами как АГ и СД, также она 30 может стать пусковым моментом развития и прогрессирования сердечной недостаточности, значительно утяжеляя ее течение. Являясь инициатором сердечно-сосудистых осложнений, анемия параллельно способствует прогрессированию почечной недостаточности. В результате развития хронической гипоксии, обусловленной анемией, происходит повреждение различных почечных структур, при этом в первую очередь страдает тубулоинтерстиций. Более того, стало известно, что анемия в таких органах как сердце и почки стимулирует процессы пролиферации и фиброзирования. В различных исследованиях показано, что при назначении заместительной терапии рчЭПО у больных наблюдалось снижение скорости прогрессирования ХПН. Анемический синдром у больных СД повышает риск развития и прогрессирования ретинопатии и нефропатии. Установлено, что у больных СД 1 типа анемия увеличивает риск прогрессирования ДН до стадии ХПН в 3,3 раза. Риск развития тяжелой формы ретинопатии у больных СД повышается более чем в 5,3 раза при уровне гемоглобина менее 12 г/дл. Высокая скорость прогрессирования ретинопатии наблюдается у больных диабетом с анемией даже на фоне нормального АД. Опираясь на вышеперечисленные факты можно сделать вывод, что развитие анемии у больных СД представляет собой важную проблему для врача любого профиля. Своевременная диагностика и лечение анемии у больных с ДН позволит значительно снизить скорость развития и прогрессирования микро- и макрососудистых осложнений, значительно улучшить самочувствие и качество жизни больных. Диагностика анемии Для диагностики анемии у больных ДН и уточнения ее тяжести проводится лабораторное обследование, включающее клинический анализ крови с определением концентрации Hb (при возможности количества ретикулоцитов, уточнение процента гипохромных эритроцитов, содержания Hb в ретикулоците), определение запасов железа (ферритин, трансферрин с расчетом его насыщения) и наличия системного воспаления (С-реактивный белок). Перед установлением диагноза анемии почечного генеза, при возможности необходимо исключить наиболее вероятные причины развития анемии, не связанные с нарушением выработки эндогенного ЭПО (постгеморрагические, вследствие нарушения кроветворения различной этиологии, гемолитические). Почечная анемия наиболее часто сопровождается развитием железодефицитной анемии (ЖДА). Развитие ЖДА связано с нарушением обмена железа из-за его недостатка в пище, нарушения всасывания в кишечнике, кровопотерь в кишечном тракте, обильных менструаций. При ЖДА выявляется микроцитарная, гипохромная анемия с гипопролиферацией со стороны ретикулоцитов, снижение уровня сывороточного железа и ферритина. Критерии диагностики анемии у населения, принятые ВОЗ еще в 1968 г., не претерпели изменений до настоящего времени (Hb<13,0 г/дл у мужчин и 12,0 г/дл у женщин). Для больных ХБП, в числе и ДН, разработаны критерии 31 диагностики анемии, которые рекомендованы в различных ведущих руководствах по ведению больных ХБП и анемией. Табл. 11. Критерии диагностики анемии при ХБП Европейские рекомендаРоссийские национальРекомендации, принятые ции – EBPG Anemia ные рекомендации (2006) в США – NKF-K/DOGI Guidelines (2004) Anemia Guidelines (2006) Hb<13,5 г/дл у муж- Hb<13,5 г/дл у муж- Hb<13,5 г/дл у мужчин; чин; чин; Hb<12,0 г/дл у муж- Hb<12,0 г/дл у муж- Hb<12,0 г/дл у женчин старше 70 лет; чин и женщин старше щин 70 лет; Hb<11,5 г/дл у женщин Hb<11,5 г/дл у женщин Лечение почечной анемии Лечение почечной анемии, обусловленной дефицитом синтеза ЭПО, с использованием эритропоэз-стимулирующими средствами (ЭСС) стало возможным около 20 лет назад. Революционнымсобытием стало получение рекомбинантного человеческого ЭПО (рч-ЭПО) методами генной инженерии. В настоящее время разработаны, широко и эффективно применяются различные эпоэтины. Табл. 12. Современные средства, стимулирующие эритропоэз Название препарата Разрешенный способ Кратность введения введения Эпоэтин-α (Eprex) п/к, в/в в/в (п/к только в 1-3 раза в неделю специальных шприцах) Эпоэтин-β (Recormon) п/к, в/в 1-3 раза в неделю Эпоэтин-дельта (Dynepo) п/к, в/в 1-3 раза в неделю (не зарегистрирован в России) Дарбепоэтин α (Aranesp) п/к или в/в 1 раз в 1-2 нед. Метоксиполиэтиленгликоль п/к или в/в 1 раз в 2-4 нед. эпоэтин-β (Mircera) Основной причиной снижения ответа на лечение препаратами рч-ЭПО является дефицит запасов железа в организме. Лечение больных с почечной анемией препаратами железа должно проводиться до и на фоне терапии ССЭ. Для повышения уровня Hb крови на 1,0 г/дл необходимо примерно 150 мг железа. Основные показатели обмена железа в организме должны быть определены до начала лечения анемии препаратами рч-ЭПО и регулярно мониторироваться в ходе лечения (1 раз в 3 мес.). 32 Табл. 13. Основные рекомендуемые показатели обмена железа у больных, получающих ЭСС Показатель Минимальное значение Целевое значение на фоне лечения рч-ЭПО Ферритин сыворотки, Не менее 100 200-500 мкг/л Не менее 200 у пациентов на гемодиализе Насыщение трансферри≥20 30-50 на железом, % Количество гипохромных Не менее 10 Менее 2,5 эритроцитов, % Содержание Hb в ретикуБолее 29 ~ 35 лоцитах, пг/в клетке В ведущих международных рекомендациях по тактике лечения анемии у больных ХБП принято, что лечение ЭСС необходимо начинать при снижении Hb менее 11 г/дл. При этом верхний уровень повышения уровня Hb на фоне терапии рчЭПО был установлен в пределах 12-13 г/дл. Больным СД, особенно с заболеванием периферических сосудов, до получения подтвержденных данных не рекомендовалось превышать значение Hb более 12 г/дл. В 2007 г. было выпущено дополнение к последним рекомендациям NKF K/DOQI по лечению анемии при ХБП – NKF K/DOQI Update of Hb Target, где были определены целевые значения Hb у больных ХБП, получающих ЭСС, уже в пределах 11-12 г/дл и не выше 13 г/дл (максимальный уровень). В соответствии с недавно полученными результатами исследования TREAT (Trial to Reduce Cardiovascular Events With Aranesp Therapy) претерпела изменение и тактика Европейской рабочей группы по анемии (Anemia Working Group of European Renal Best Practice - ERBP). Основные позиции ERBP, дополняющие последние рекомендации NKF K/DOQI заключаются в следующем: необходима особая осторожность при лечениии анемии ЭСС больных СД 2 типа с ХБП, особенно перенесших инсульт, у которых возможно начало терапии ЭСС при снижениии Hb менее 10 г/дл с достижением более низких целевых значений Hb – в пределах 10-12 г/дл; у больных СД с ИБС или после перенесенного инсульта преимуществами лечения ЭСС являются снижение необходимости проведения коронарной реваскуляризации и гемотрансфузий, но необходимо учитывать возможность увеличения риска развития повторного инсульта, который во многом зависит от выбранного целевого уровня Hb и дозы ЭСС; большое значение имеет привлечение пациента к подробному обсуждению всех преимуществ, возможных рисков при лечении ЭСС и учет его мнения в принятии совместного решения о приемлемом для него уровне Hb; 33 необходимо обсуждение преимуществ и рисков возможных гемотрансфузий при снижении уровня Hb, особенно для пациентов, настороенных на трансплантацию почки; у больных ХБП, имеющих в анамнезе злокачественные новообразования, лечение ЭСС должно начинаться с низких доз, с учетом риска рецидива опухоли и связанную с ним смерть больного; лечение ЭСС должно начинаться осторожно для предотвращения высокой вариабельности значения Hb и при достаточных запасах железа в организме. Таким образом, высокая распространенность, тяжесть анемии при ДН и ее раннее развитие предполагают проведение мероприятий, направленных на своевременное ее выявление, уточнение причины и при необходимости начало лечения ЭСС. При этом в выборе целевого уровня Hb и дозы ЭСС особо важен индивидуальный подход к каждому больному с учетом сопутствующих сердечно-сосудистых и онкологических заболеваний, возможных положительных и отрицательных сторон терапии, особенно у больных СД 2 типа. В тактике лечения анемии ЭСС значение имеют постепенное повышение уровня Hb, поддержание его стабильного целевого уровня, т.е. предупреждение большой амплитуды колебания Hb для профилактики ее отрицательного воздействия на организм больного. НАРУШЕНИЕ ФОСФОРНО-КАЛЬЦИЕВОГО ОБМЕНА ПРИ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ При ХПН нарушаются все звенья регуляции фосфорно-кальциевого обмена. Уже при снижении СКФ до 60 мл/мин (II-III стадия ХБП) обнаруживается тенденция к гиперфосфатемии вследствие уменьшения фильтрационного заряда и компенсаторно повышается продукция ПТГ, индуцирующего фосфатурию. При дальнейшем ухудшении функции почек гиперфосфатемия становится постоянной и одновременно из-за деструкции почечной ткани и снижения активности α1-гидроксилазы уменьшается продукция кальцитриола и развивается гипокальциемия. Гиперфосфатемия, гипокальциемия и дефицит активных метаболитов витамина Д индуцируют развитие ренальной остеодистрофии (РОД), клинически проявляющейся болью в костях, миопатией, патологическими переломами и метаститической кальцификацией. Выделяют три основных типа РОД с принципиально различными методами лечения: I. Высокообменное заболевание скелета: Вторичный гиперпаратиреоз (ВГПТ) Фиброзный остеит II. Низкообменное заболевание скелета: Остеомаляция Адинамическое заболевание скелета 34 Смешанный тип, сочетающий ВГПТ с нарушением минерализации костной ткани. Уровень ПТГ в сыворотке начинает повышаться уже на ранних стадиях дисфункции почек (СКФ≤60 мл/мин), и по мере прогрессирования ХПН появляются клинические симптомы РОД, ухудшающие качество жизни больных, чреватые скелетными нарушениями и сердечно-сосудистыми осложнениями, определяющими в конечном итоге прогноз больных. В этой связи принципиально важной является ранняя профилактика нарушений минерального обмена, целью которой является поддержание показателей кальция и фосфора сыворотки в нормальных пределах. III. Целевые значения уровня кальция, фосфора и ПТГ Табл. 14. Целевые значения уровня кальция, фосфора и ПТГ Общий кальций (Са) 2,10-2,37 ммоль/л Фосфор (Р) 1,13-1,78 ммоль/л Произведение Са на Р 4,5-5,5 ммоль/л Интактный ПТГ (иПТГ) 150-300 пг/мл Уровень кальция и фосфора, как видно из табл. 14, не отличаются от нормального, а несколько повышенные значения иПТГ облегчают ремоделирование скелета. У больных, получающих гемодиализ, показатели обмена кальция и фосфора также должны находиться в пределах указанных значений. Превышение этих значений сопровождается увеличением смертности пациентов на диализе. Табл. 15. Предполагаемый адекватный уровень ПТГ для разных стадий ХБП Стадия ХБП СКФ мл/мин Интактный ПТГ, пг/мл 1, 2 60 и выше Ниже 70 3 30-59 35-70 4 15-29 71-150 5 Ниже 15 151-300 Поддержание целевых значений достигается назначением препаратов кальция, фосфатбиндеров, восполнением дефицита кальцитриола, использованием кальцимиметиков. Эти же препараты применяются для консервативного лечения ВГПТ. 35 Принципы лечения ВГПТ при 3-5-й стадиях ХБП Коррекция гиперфосфатемии: 1. Ограничивать потребление фосфора (гипофосфатная диета) до 800-1000 мг/сут при гиперфосфатемии, а также при повышении ПТГ более целевых значений. 2. Если диетические ограничения неэффективны – назначают фосфатсвязывающие препараты (ФСП). Наиболее распространены и доступны ФСП на основе Са (кальцийсодержащие ФСП). В России наиболее часто применяется карбонат кальция, реже – ацетат кальция. Суточная доза кальция (в пересчете на кальций-элемент) не должна превышать 2000 мг. При тенденции к гиперкальциемии, выраженной кальцификации сосудов препаратом выбора является При уровне фосфора в крови более 2,26 ммоль/л (7 мг/дл) возможно проведение короткого курса (4 недели) ФСП на основе алюминия (алмагель) с последующим переводом на другие ФСП, также следует рассмотреть вопрос о более частом проведении диализа или увеличении длительности сеанса, препаратом длительного применения следует считать севеламер (ренагель), назначаемый в дозе 800-1600 мг 3-4 раза в день Коррекция уровня кальция: 1. При тенденции к гиперкальциемии или ее постоянном присутствии: Уменьшить или отменить ФСП на основе кальция (если пациенты таковые получали) Уменьшить дозы или отменить препараты витамина Д или его активные метаболиты (если пациенты таковые получали) Если гиперкальциемия сохраняется и после отмены вышеуказанных препаратов на фоне высокого ПТГ – провести УЗИ околощитовидных желез и рассмотреть вопрос о третичном гиперпаратиреозе. лечебная тактика – назначение цинакальцета HCL (Мимпара), при неэффективности или непереносимости – паратиреоидэктомия. При гиперкальциемии на фоне низкого ПТГ (подозрение на адинамическую костную болезнь) – снижение концентрации кальция в диализате до 1,5-2,0 ммоль/л на 3-4 недели. 2. При тенденции к гипокальциемии – Са ниже 2,1 ммоль/л (8,4 мг/дл) – назначать терапию, направленную на повышение Са в крови, в случаях: При клинических симптомах гипокальциемии (парестезии, судороги, ларингоспазм, бронхоспазм, положительные симптомы Хвостека или Труссо) При повышении ПТГ выше целевых значений на фоне гипокальциемии. 36 Лечение гипокальциемии: соли кальция (карбонат кальция) в дозе до 2000 мг в день (в пересчете на кальций-элемент), активные метаболиты витамина Д (дозы подбираются индивидуально). Принципы лечения ВГПТ и дефицита витамина Д активными метаболитами витамина Д и его аналогами В настоящее время в России зарегистрированы и применяются перорально кальцитриол – 1,25(ОН)2Д3 (Рокалтрол, Остеотриол) и аналог активного метаболита витамина Д – αОНД3 альфакальцидол (перорально Альфа Д3-Тева, Этальфа; внутривенно - Этальфа). Наряду с обязательным определением Са, Р, ПТГ, для определения степени недостаточности витамина Д желательно определить уровень в крови витамина Д (25ОНД). При 3-4-й стадии ХБП допускается коррекция недостаточности витамина Д эрго-кальциферолом (нативным витамином Д2). При уровне витамина Д более 30 нг/мл и повышении ПТГ выше целевых значений при отсутствии гиперкальциемии и гиперфосфатемии проводят терапию активными метаболитами витамина Д или их аналогами, например, альфакальцидилол (альфаД3 Тева) или парикальцитол (Земплар), при повышении уровня кальция и/или фосфора в крови препаратом выбора должен быть цинакальцет (Мимпара). При повышении ПТГ более 70 пг/мл (3-я стадия) или более 110 пг/мл (4-я стадия), при уровне Са менее 2,4 ммоль/л, а фосфора – менее 1,5 ммоль/л начальная доза альфакальцидола или кальцитриола внутрь составляет 0,25 мкг ежедневно. Контроль Са и Р один раз в 1 мес, ПТГ – один раз в 3 мес. Титрация дозы в зависимости от уровней Са, Р и ПТГ. В практической деятельности нечасто удается назначать высокие дозы альфакальцидола или кальцитриола, необходимые для адекватного снижения ПТГ, из-за гиперфосфатемии или возникновения гипокальциемии. В начале терапии, особенно при увеличении доз, желательно мониторировать уровни Са и Р 1 раз в 2 недели. При снижении ПТГ ниже целевых значений дозы альфакальцидола или кальцитриола снижают в 2 раза. Минимальная доза – 0,25 мкг через день. Такая же тактика – при возникновении гиперкальциемии, дополнительно уменьшают дозы кальцийсодержащих ФСП. При гиперфосфатемии – строгий контроль диеты, при возможности увеличение доз ФСП, при неэффективности – снижение дозы альфакальцидола или кальцитриола. 37 Табл. 16. Определение степени дефицита витамина Д и рекомендуемые дозы витамина Д2 при 3-4-й стадии ХБП Уровень 25ОНД Степень дефициДоза витамина Длительность в крови, нг/мл та витамина Д Д2 терапии [нмоль/л] <5 [12] Тяжелый дефицит 50000 МЕ в неде6 мес. витамина Д лю внутрь 12 недель, затем 1 раз в месяц или 500000 МЕ в/м однократно 5-15 [12-37] Легкий дефицит 50000 МЕ в неде6 мес. витамина Д лю внутрь 4 недели, потом 1 раз в месяц 16-30 [40-75] Недостаточность 50000 МЕ 1 раз в 6 мес. витамина Д месяц внутрь Принципы подбора доз альфакальцидола (кальцитриола) при ВГПТ на фоне ХПН На додиализной стадии ХПН оптимальные уровни ПТГ зависят от степени снижения СКФ. Подбор адекватной дозы альфакальцидола или кальцитриола следует начинать с 0,25 мкг в день, контролируя содержание Са и фосфора в крови 1 раз в 2 недели на первом месяце лечения, повышая дозы на 0,75 мкг в неделю. Затем контроль Са и фосфора можно осуществлять 1 раз в 1-3 мес, потом – 1 раз в 3 мес. Измерение ПТГ и активности щелочной фосфатазы рекомендовано через 3 мес, потом, при стабилизации дозы – 1 раз в 6 мес. Очент важно не допустить гиперфосфатемии, контролируя содержание фосфатов в диете и при необходимости добавляя к терапии фосфорсвязывающие препараты (карбонат или ацетат кальция, ренагель). Табл. 17. Рекомендуемые начальные дозы активных метаболитов витамина Д в зависимости от уровня ПТГ, кальция и фосфора ПТГ, Са, мг/дл Р, мг/дл Са×Р, Доза кальцитриопг/мл [ммоль/л] [ммоль/л] мг/дл ла/альфакальцидола из расчета [пмоль/л] [ммоль/л] 3 раза в неделю 300-600 <9,5 [2,37] <5,5 [1,78] <55 [4,5] п/о 0,5-1,5 мкг [33-66] в/в 0,5-1,5 мкг 600-1000 <9,5 [2,37] <5,5 [1,78] <55 [4,5] п/о 1,0-4,0 мкг [66-110] в/в 1,0-3,0 мкг >1000 <10 [2,5] <5,5 [1,78] <55 [4,5] п/о 3,0-7,0 мкг [110] в/в 3,0-5,0 мкг 38 Лечение агонистами кальций-чувсвительного рецептора (кальцимиметиками) – цинакальцетом HCL (Мимпара) При неэффективности активных метаболитов витамина Д, невозможности достичь адекватного уровня ПТГ из-за гипекальциемии, гиперфосфатемии, при развитии резистентности к активным метаболитам витамина Д и их аналогам (чаще она наблюдается при уровне ПТГ более 1000 пг/мл) назначается агонист кальций-чувсвительного рецептора – цинакальцет HCL (Мимпара). Препарат назначают при отсутствии гипокальциемии в начальной дозе 30 мг 1 раз в день ежедневно. Мониторирование Са, Р, ПТГ – 1 раз в месяц. При отсутствии гипокальциемии и недостаточном снижении ПТГ увеличивают дозу на 30 мг 1 раз в 1 месяц. Максимальная доза – 180 мг 1 раз в день. Возможные побочные эффекты: тошнота, рвота, редко – гипокальциемия. Минимальный курс лечения – 6 мес. Лечение Мимпарой можно комбинировать с ФСП и альфакальцидолом или кальцитриолом. При неэффективности комбинированной терапии решается вопрос о паратиреоидэктомии. Показания к паратиреоидэктомии при ВГПТ: При ВГПТ с рентгенологическими костными проявлениями и гиперплазией ОЩЖ хирургическое вмешательство показано при наличии одного из перечисленных ниже дополнительных симптомов: Постоянно повышенный уровень Са в сыворотке крови Рост величины произведения Са×Р в сыворотке крови до 6,5-6,9 ммоль/л и выше в сочетании с прогрессирующей кальцификацией мягких тканей, несомтря на жесткое ограничение потребления фосфата Прогрессирующее поражение скелета, вызванное гиперпаратиреозом Постоянный, мучительный, не поддающийся обычным методам лечения зуд, связанный с гиперпаратиреозом Кальцифилаксия ИНФЕКЦИИ МОЧЕВОЙ СИСТЕМЫ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ Инфекции мочевой системы (мочевые инфекции) подразделяются на инфекции верхних и нижних мочевыводящих путей. К первым относится пиелонефрит, ко вторым – уретрит, цистит и др. И те, и другие инфекции могут быть осложненными и неосложненными. Осложненные инфекции возникают у больных с различными обструктивными уропатиями, а также при применении инструментальных, хирургических методов диагностики и лечения, и у больных с серьезными сопутствующими заболеваниями, снижающими системный и локальный иммунитет. Таким образом, мочевые инфекции у больных сахарным диабетом относятся к осложненным. 39 Основные клинические формы мочевых инфекций у больных СД По данным Kasinath B.S. et al. (1983), частота мочевых инфекций у больных сахарным диабетом достигает 40%, что почти в 3 раза выше, чем в общей популяции. Это связано с тем, что у больных сахарным диабетом действуют не только факторы риска развития мочевых инфекций, характерные для общей популяции, но и специфические факторы, имеющиеся только у пациентов с сахарным диабетом. К общим факторам риска относятся: пожилой возраст, первичные заболевания почек и мочеполовой системы (нефролитиаз доброкачественная гиперплазия предстательной железы, различные структурные аномалии мочевыводящих путей, урологические манипуляции и др. Специфические факторы риска – это длительная глюкозурия, нейрогенная дисфункция мочевого пузыря, снижение иммунного ответа. Стоит напомнить, что мочевые инфекции чаще обнаруживаются у женщин. Этому способствуют анатомо – физиологические особенности мочеполовой сферы у женщин (короткая и широкая уретра, близость половых путей и прямой кишки и др.). Увеличение частоты мочевых инфекций с возрастом объясняется, в первую очередь, у мужчин – формированием доброкачественной гиперплазии предстательной железы, у женщин – развитием атрофических процессов в уретре и влагалище вследствие возрастного дефицита эстрогенов. Атрофия эпителия уретры сопровождается снижением кровоснабжения, уменьшением колонизации лактобациллами, активацией роста кишечных бактерий, кокковой флоры, что предрасполагает к частым рецидивам бактериальных инфекций. Длительная глюкозурия способствует развитию мочевой инфекции, поскольку глюкоза является оптимальной питательной средой для размножения бактерий. Автономная нейропатия мочевого пузыря – осложнение сахарного диабета, заключающееся в нарушении иннервации мочевого пузыря, - приводит к застою мочи, способствует развитию пузырно – мочеточникового рефлюкса, возникновению инфекции и распространению ее в верхние отделы мочевой системы. Наиболее важными изменениями в иммунной системе у больных сахарным диабетом являются: уменьшение продукции и активности ключевых факторов иммунной защиты (Т – лимфоцитов, фагоцитоза и др.); нарушение системной и локальной иммунной защиты под влиянием различных осложнений сахарного диабета, в т.ч. диабетической нефропатии; снижение иммунного ответа вследствие нейрогуморальных нарушений. Результатом этих изменений является высокая частота развития мочевых инфекций и стертость клинической симптоматики воспаления. У больных сахарным диабетом нередко клинические симптомы воспаления становятся заметными, когда инфекционный процесс в мочевой системе уже значительно выраженный. Все эти факторы, способствующие развитию и прогрессированию мочевых инфекций, должны быть выявлены и учтены при определении лечебной тактики. Ведущими возбудителями мочевых инфекций у больных сахарным диабетом являются грамотрицательные микроорганизмы, первое место среди кото40 рых занимает Escherichia coli. Кишечная палочка является этиологическим фактором 75% случаев мочевых инфекций на фоне сахарного диабета. Около 15 – 20% случаев пиелонефрита вызываются другими представителями семейства Enterobacteriaceae: Klebsiella spp., Proteus spp., Enterobacter spp., а также неферментирующими грамотрицательными бактериями (Pseudomonas spp.). Реже возбудителями мочевых инфекций могут быть грамположительные кокки, среди которых наиболее тяжелые формы пиелонефрита с формированием кортикальных абсцессов вызывает Staphylococcus aureus, а также грибы. Нередко встречаются mixt – инфекции. Вид возбудителя, вызывающего развитие пиелонефрита, в значительной степени зависит от пути распространения инфекции. Наиболее частый путь инфицирования почек – восходящий, из нижних мочевых путей. В этих случаях роль этиологического фактора играют грамотрицательные бактерии семейства Enterobacteriaceae и неферментирующие бактерии, такие как Pseudomonas aeruginosa. При гематогенном пути распространения инфекции из очага, расположенного за пределами мочевой системы, основным возбудителем является Staphylococcus aureus. Мочевые инфекции у больных сахарным диабетом нередко протекают скрыто, малосимптомно. Однако в условиях отсутствия своевременной и адекватной терапии течение мочевой инфекции может измениться, приобрести ярковыраженный, нередко генерализованный, характер. В связи с высокой частотой малосимптомных форм необходимо активное выявление инфекции. Рекомендуется не реже 3 раз в год производить общий анализ мочи и/или пробу Нечипоренко. Тщательное обследование необходимо в следующих ситуациях: пожилой возраст больных, резкое неожиданное ухудшение показателей гликемии, наличие кетоацидоза, у беременных в критический период 22-28 недель. Рассмотрим основные клинические формы мочевых инфекций у больных сахарным диабетом. Бессимптомная бактериурия – выявление бактерий в моче более 105 КОЕ/мл при отсутствии клинических и других лабораторных признаков инфекции. Литературные данные о частоте бессимптомной бактериурии у больных сахарным диабетом довольно однотипны и свидетельствуют об обнаружении бессимптомной бактериурии в среднем у 20% больных сахарным диабетом. Так, при обследовании 636 женщин с сахарным диабетом бессимптомная бактериурия выявлена у 26% по сравнению с 6% в контрольной группе. Не столь однозначно мнение разных исследователей о клинико – прогностическом значении бессимптомной бактериурии и показаниях к антибактериальной терапии. Суммируя результаты различных исследований, можно сказать, что большинство авторов считает бессимптомную бактериурию фактором риска развития клинически выраженных мочевых инфекций у больных сахарным диабетом 2 типа, но не у больных сахарным диабетом 1 типа. Однако при любом типе диабета бессимптомная бактериурия ассоциирована с быстрым развитием и прогрессированием почечной недостаточности. В связи с этим некоторые исследователи рекомендуют назначать антибактериальную терапию при выявлении бессимптомной 41 бактериурии. Так, по данным Хопельмана А. и соавт. (2000), клинически выраженный пиелонефрит развился у 27% пациентов сахарным диабетом, не получавших антибактериальную терапию при выявлении бессимптомной бактериурии, и у 2% больных, леченных антибиотиками. Другие исследователи не видят необходимости назначать антибиотики при бессимптомной бактериурии, так как по их данным, антибактериальная терапия бессимптомной бактериурии на фоне сахарного диабета не снижает частоту развития клинически выраженных мочевых инфекций и их осложнений. Пиелонефрит – осторе или хроническое микробное воспаление, локализующееся в чашечно – лоханочном комплексе и интерстициальной ткани почек. Диагностика пиелонефрита у больных сахарным диабетом не отличается от общепринятых правил и основывается на обнаружении следующих симптомов: Клинических: боль в пояснице одно- или двухсторонняя без иррадиации или с иррадиацией «по ходу мочеточника», по медиальной поверхности бедра; повышение температуры тела, часто с ознобом; дизурические расстройства, связанные с вовлечением в воспалительный процесс нижних мочевых путей (частое болезненное мочеиспускание, ложные позывы и т.д.); Лабораторных: лейкоцитурия (общий анализ мочи – больше 6, у женщин – больше 10 в поле зрения; проба Нечипоренко – больше 4000 в 1 мл); бактериурия (больше 105 КОЕ/мл); Ультразвуковых и/или рентгенологических: деформация, расширение чашечно – лоханочного комплекса при хроническом заболевании. Важно помнить, что проведение рентгеноконтрастного исследования при активном воспалении крайне нежелательно, так как чревато резким ухудшением гемодинамики и уродинамики, развитием острой почечной недостаточности. Наряду с малосимптомными формами пиелонефрита, характеризующимися лабораторными симптомами и слабовыраженными клиническими проявлениями, у больных сахарным диабетом возможны тяжелые формы гнойно – деструктивного пиелонефрита, сопровождающиеся выраженной интоксикацией, нередко ведущие к сепсису, бактериотоксическому шоку. Гнойный пиелонефрит – это абсцесс почки, карбункул почки, апостематозный нефрит. В зарубежной литературе чаще употребляется термин «гнойные заболевания почек» или «ренальные и периренальные абсцессы». Патогенетические основы гнойных заболеваний разные: абсцесс почки развивается при окклюзии оттока мочи по канальцам и собирательным трубочкам, карбункул почки является результатом гематогенного распространения микроорганизмов из очага инфекции, расположенного за пределами мочевой системы. Нередко в основе развития карбункула лежит инфаркт почки вследствие тромбоза мелкого почечного сосуда, а возбудителем является Staphylococcus aureus. Апостематозный пиелонефрит – тяжелая некротизирующая форма острого множественно – очагового бактериального нефрита – сопровождается образованием мелких интраренальных абсцессов. При инфекции грамотрицательными микроорганизмами, вызывающими ферментацию глюкозы и/или лактозы с образованием кислоты и газа в условиях ише42 мии почечной ткани, развивается эмфизематозный пиелонефрит. В этих случаях в паренхиме почки обнаруживается наличие газа. Особенности клинической картины пиелонефрита у больных сахарным диабетом следующие: Чаще, чем в общей популяции, имеет место двустороннее поражение почек; Лихорадка может отсутствовать даже при тяжелых формах заболевания, это связано с развитием диабетической автономной полинейропатии; Нередко у больных с длительным течением сахарного диабета (более 15 лет) обнаруживается бессимптомная пиурия (лейкоцитурия); Несмотря на патогенетические отличия, различные формы гнойного пиелонефрита имеют сходную клиническую картину. К типичным лейкоцитурии и бактериурии присоединяется гематурия; В 15% случаев течение пиелонефрита осложняется развитием острой почечной недостаточности; При эмфизематозном пиелонефрите возможно обнаружение крепитации при пальпации поясничной области, выделение пузырьков воздуха из уретры во время или после мочеиспускания. Малосимптомное течение пиелонефрита, иногда предшествующее «пожару» - развитию тяжелого гнойно – деструктивного процесса, нередкое отсутствие лихорадки может привести к поздней диагностике заболевания, несвоевременному началу адекватной терапии. Поэтому главное правило – при курации больного сахарным диабетом иметь «настороженность» в отношении мочевой инфекции, и при малейшем подозрении осуществлять комплексное обследование. Лечение мочевой инфекции Лечение больного сахарным диабетом с активной мочевой инфекцией представляет сложную задачу. Имеет место «синдром взаимного отягощения». Инфекция в почке ведет к нарастанию ацидоза и усугублению инсулиновой недостаточности. А нарушение углеводного обмена, расстройство микроциркуляции ухудшают течение гнойной инфекции. И устранять надо одновременно и мочевую инфекцию, и декомпенсацию сахарного диабета. При назначении антибактериальной терапии необходимо учитывать следующие факторы: Препараты для лечения мочевых инфекций должны обладать высокой бактерицидной активностью против грамотрицательных возбудителей (при гематогенном инфицировании - против Staphylococcus aureus) и создавать высокую концентрацию в моче и в паренхиме почек; Антимикробная терапия на фоне сахарного диабета должна проводиться длительно: острый цистит – не менее 7 дней, острый пиелонефрит или хронический пиелонефрит в стадии обострения – не менее 14 дней, гнойный пиелонефрит – не менее 4 недель; 43 Целесообразно проводить бактериологическое исследование мочи до начала лечения антибиотиками и после курса терапии; Обязательно необходимо контролировать функцию почек до лечения, в период применения антибиотиков и после завершения терапии. Доза антибиотиков должна корректироваться с учетом уровня креатинина крови и скорости клубочковой фильтрации; Отсутствие положительной динамики через 72 часа после начала адекватной антимикробной терапии свидетельствует о высоком риске гнойных осложнений и требует всестороннего анализа клинической ситуации и лечебной тактики с участием специалиста – уролога. Выбор антибактериальной терапии осуществляется с учетом предполагаемого или известного возбудителя, тяжести заболевания, функции почек (таблица). Табл. 18. Выбор антибактериальной терапии при мочевой инфекции у больных сахарным диабетом Мочевая инфекция Острый цистит Острый пиелонефрит Основные возбудители E. coli, Proteus spp., Klebsiella spp., Enterococcus spp. E. coli, Proteus spp., Klebsiella spp., Enterococcus spp., P. aeruginosa Апостематозный нефрит E. coli, Proteus spp., Klebsiella spp., P. aeruginosa Кортикальный абсцесс (карбункул) S. aureus Кандидозный цистит Candida spp. Препараты выбора* Норфлоксацин 0,4 г внутрь каждые 12 часов, Ципрофлоксацин 0,5 г внутрь каждые 12 часов Ципрофлоксацин 0,5 г в/в каждые 12 часов, Левофлоксацин 0,5 г в/в каждые 24 часа, Амоксициллин/клавунат 0,625 в/в каждые 8 часов Альтернативные препараты* Амоксициллин/клавунат 0,625 внутрь каждые 8 часов Цефтриаксон 2 г в/в каждые 24 часа, Цефотаксим 1 г в/в каждые 6 часов, Цефоперазон/сульбактам 4 г в/в каждые 12 часов, Ампициллин 2 г в/в каждые 6 часов + амикацин 15 мг/кг в/в каждые 24 часа Ципрофлоксацин 0,5 г в/в Цефтриаксон 2 г в/в кажкаждые 12 часов, дые 24 часа, Левофлоксацин 0,5 г в/в Цефоперазон/сульбактам 4 каждые 24 часа, г в/в каждые 12 часов, Амоксициллин/клавунат Цефепим 2г каждые 12 ча0,625 в/в каждые 8 часов, сов, Ампициллин/сульбактам 3 Имипенем 0,5г каждые 6 г каждые 6 часов часов, Ампициллин 2 г в/в каждые 6 часов + амикацин 15 мг/кг в/в каждые 24 часа Оксациллин 2 г в/в или в/м Цефазолин 2 г в/в каждые каждые 4 часа 8 часов, Ванкомицин 15 мг/кг в/в каждые 12 часов Флуконазол 0,2 г внутрь в Амфотерицин В 0,3 мг/кг первые 24 часа, далее 0,1 г в/в однократно каждые 24 часа в течение 4 дней 44 Эмфизематозный E. coli, пиелонефрит, Proteus spp., цистит Klebsiella spp., Enterococcus spp. Амоксициллин/клавунат Цефтриаксон 2 г в/в каж2,2 г внутрь каждые 8 чадые 24 часа, сов, Цефоперазон/сульбактам 4 Имипенем 0,5г каждые 6 г в/в каждые 12 часов, часов, Цефепим 2г каждые 12 чаЦипрофлоксацин 0,5 г в/в сов, каждые 12 часов, Ампициллин 2 г в/в кажЛевофлоксацин 0,5 г в/в дые 6 часов + амикацин 15 каждые 24 часа мг/кг в/в каждые 24 часа *- дозы рассчитаны для пациентов с нормальной почечной функцией. Лечение цистита при условии хорошей компенсации сахарного диабета проводится в амбулаторных условиях. Основные антибиотики – фторхинолоны внутрь. Активный пиелонефрит у больного сахарным диабетом – показание для стационарного лечения. Препаратами выбора являются фторхинолоны, цефалоспорины 3 поколения и аминогликозиды. Последняя группа препаратов применяется редко из-за высокого риска нефротоксических осложнений. Лечение тяжелых форм пиелонефрита требует комбинированной терапии 2-3 антибиотиками. Как правило, антибактериальная терапия в первые дни осуществляется парентерально, затем переходят на пероральный прием. Так, известна последовательная (ступенчатая) схема применения фторхинолонов: первые дни внутривенно (например, пефлоксацин - абактал 0,4 г 2 раза в сутки), после ликвидации лихорадки – внутрь (абактал 0,4 г 2 раза в сутки). Основанием для прекращения антибактериального лечения является исчезновение клинических симптомов болезни, нормализация анализа мочи, отсутствие бактериурии при повторном посеве мочи. Лечение апостематозного нефрита, абсцесса почки, карбункула почки проводят в условиях урологического стационара, при необходимости интенсивную антибиотикотерапию сочетают с адекватным хирургическим вмешательством (чрескожное или открытое дренирование абсцесса, декапсуляция почки и др.). Основным методом лечения эмфизематозного пиелонефрита является нефрэктомия в сочетании с интенсивной антибактериальной терапией. При лечении больного с активным пиелонефритом необходимо следить за тем, чтобы не допустить выраженной дегидратации организма. Дегидратация, а также одновременный прием диуретиков могут усиливать нефротоксические эффекты антибактериальных средств и снижать функцию почек. Некоторые микроорганизмы размножаются и проявляют свою активность в специальных условиях. Так, Proteus выделяет токсины, ощелачивающие мочу и создающие благоприятную для него среду обитания. Поэтому если установлена протейная этиология пиелонефрита, то обязательно подкисление мочи (кислые минеральные воды, ягодные морсы, прием ацетилсалициловой или аскорбиновой кислоты и др.). Медикаментозная терапия дополняется фитосредствами. Цель фитотерапии – усилить антимикробное воздействие антибиотиков, осуществить т.н. функциональную гимнастику почек, при которой за счет диуретического эффек45 та происходит механическое удаление микробов, слущенного эпителия, клеток, участвовавших в воспалении, с мочой, своеобразная санация мочевых путей. После купирования активного пиелонефрита фитосредства используются в качестве основного компонента противорецидивного лечения. Наиболее часто используются плоды можжевельника, клюквы, брусники, шиповника, земляники, листья черной смородины, брусники, укропа, спорыша, петрушки, цветки василька, шишки хмеля и др. Хорошо изучено благотворное влияние фитопрепарата «Канефрон» (золототысячник, любисток розмарин), обладающего диуретическим, противовоспалительным, спазмолитическим действием. При длительном сохранении активности процесса в качестве противорецидивного лечения используют антимикробные препараты в малых дозах постоянно или по роторной схеме (10 дней каждого месяца). С этой целью может быть рекомендован септрин (бисептол) по 0,48 г перед сном. Профилактика мочевых инфекций включает в себя санаторно – курортное лечение на курортах с минеральными водами (Аршан, Дарасун, Кука, Трускавец, Ессентуки, Карловы Вары и др.). Клинические примеры Клинический пример №1. Больная Л, 54 года. Сахарным диабетом болеет в течение 8 лет без стойкой компенсации. Заболела остро 2 недели назад Боли в правой поясничной области, правой половине живота, повышение температуры тела до 38,2о, озноб. Лечилась дома нестероидными противовоспалительными препаратами и настоями трав. К врачу обратилась лишь после усиления болей в правой поясничной области. Общий анализ крови выявил выраженный сдвиг лейкоцитарной формулы влево (палочек 15%), ускорение СОЭ (45 мм/час). Моча темного цвета, при анализе: 1010, белок 0,132 г/л, лейкоциты сплошь, эритроциты 10-15 в поле зрения Креатинин крови 180 мкмоль/л. При ультразвуковом исследовании выявлено опухолевидное образование в правой почке, расположенное подкапсульно. Заподозрен кортикальный абсцесс. Назначена комбинированная антибактериальная терапия (цефтриаксон 2г в/м + абактал 0,4 г 2 раза в сутки внутривенно). Хирургическое удаление абсцесса. Клинический пример №2. Больная К., 69 лет. Сахарный диабет впервые выявленный. В течение двух лет часто возникали дизурические расстройства: рези при мочеиспускании. К врачам не обращалась. В течение последнего месяца испытывает умеренные боли в правых отделах живота. Боли усилились 2 дня назад. Вызвала «Скорую помощь», была доставлена в стационар с диагнозом: острый аппендицит. Однако обследование в приемном отделении обнаружило: Общий анализ крови: Нв 84 г/л, Л 4,75 х 109 /л без сдвига лейкоцитарной формулы, СОЭ 54 мм/час. Общий анализ мочи: белок 0,49 г/л, Л сплошь. Креатинин крови 285 мкмоль/л. УЗИ: В верхнем и среднем сегменте правой почки лоцируется паренхиматозной плотности неоднородное образование с полициклическим контуром 3х4см. 46 Интенсивная антибактериальная терапия, успешное хирургическое лечение абсцесса. Клинические примеры демонстрируют высокий риск развития гнойных форм пиелонефрита при отсутствии своевременного и адекватного лечения. В обоих случаях тяжелое течение пиелонефрита осложнилось почечной недостаточностью. СИТУАЦИОННЫЕ ЗАДАЧИ: №1 Задание 1: Больной Р., 35 лет. Страдает сахарным диабетом 12 лет. Получает Протафан в 800 ― 12 ЕД и в 2200 ― 14 ЕД, а также Актрапид перед завтраком ― 8 ЕД, обедом ― 10 ЕД, ужином ― 6 ЕД. В анамнезе гипогликемические состояния, самоконтроль нерегулярный. Пять лет назад начал отмечать снижение зрения, онемение, боли в нижних конечностях, около года назад появились пастозность голеней, отечность лица, особенно по утрам, повышение АД. Объективно: Рост - 170 см, вес - 62 кг. Отечность век, голеней, стоп. Пульс - 70 уд/мин. Тоны сердца ритмичные, приглушены, АД - 180/110 мм. рт. ст. Нижний край печени выступает из-под края реберной дуги - на 4 см. Дополнительно: Гликемия натощак – 12 ммоль/л, постпрандиальная-11 – 15 ммоль/л. ОАМ: уд. вес – 1013, белок- 0,125 г/л, эритроциты- 10 – 12 п/з, лейкоциты- 12 в поле зрения. СКФ: по Кокрофту-Голду - 53 мл/мин. По MDRD – 37,7. Осмотр окулиста. Глазное дно: вены расширены, извиты, многочисленные микроаневризмы, различной величины интраретинальные кровоизлияния. Новообразованных сосудов нет. Вопросы: 1. Какие дополнительные исследования необходимо выполнить. 2. Оцените результат следующего исследования и дайте свое заключение: БИОХИМИЧЕСКИЙ АНАЛИЗ Параметр Общий белок Альбумин Общий билируГлюкоза бин Мочевина Креатинин Холестерин Триглицериды АЛТ ACT Результат 47 28 11.8 5.0 3.2 0.24 8,6 2.8 24 30 Ед.нзм. Рефер.пределы Ком-рий г/л г/л мкмоль/л ммоль/л ммоль/л ммоль/л ммоль/л ммоль/л мЕ/л мЕ/л 47 60-82 32-50 3.4-20.5 3.5-6.0 2.5-9.0 0.05-0.14 3.6-6.0 0.4-1.8 0.0-60 10-42 3. Сформулируйте правильно и обоснуйте предварительный диагноз. №2 Больной Б., 36 лет. Болеет сахарным диабетом в течение 20 лет. Два года назад начал отмечать резкое снижение зрения, онемение, боли в нижних конечностях, около года назад появились пастозность голеней, отечность лица, головные боли, повышение АД до 220/120 мм рт ст. В последнее время беспокоят частые гипогликемические состояния. Уменьшилась суточная доза вводимиго инсулина. Объективно: Рост - 170 см, вес - 62 кг. ИМТ = ? Бледность кожных покровов. Отечность век, голеней, стоп. Пульс - 98 уд/мин. Тоны сердца ритмичные, приглушены, АД - 180/110 мм. рт. ст. Нижний край печени выступает изпод края реберной дуги - на 4 см. Осмотр стоп: кожа бледная, сухая, язвенных дефектов нет, пульсация на a. dorsalis pedis ослаблена с обеих сторон, в области подошвенных поверхностей стоп массивные участки гиперкератозов, трещины. Температурная чувствительность снижена, болевая – снижена, вибрационная – 6 баллов справа, 4 балла – слева. Данные обследования: ОАК: эритроциты –3,0 , Hb – 98 г/л (130 – 160), лейкоциты – 7,06, тромбоциты – 311 (150 – 400), СОЭ – 35 мм/час (1 – 10). Биохимический анализ крови: общий белок –54 г/л (60 – 82), альбумин – 30 г/л (32-50); общий билирубин – 16,1 мкмоль/л (3,4 – 20,5), креатинин –0,19 ммоль/л (0,05 – 0,14), мочевина – 16,5 ммоль(2,5 – 9,0), АЛТ – 45 (0-60), АСТ – 33 (10-42); ионизированный кальций 1,195 ммоль/л (1,12-1,32); калий – 5,6 ммоль/л (3,5-4,5). Липидограмма: общий холестерин –7,7 ммоль (< 4,5), триглицериды –1,9 ммоль/л (< 1,7), ЛПВП – 0,9 ммоль/л (> 1,0), ЛПНП – 5.8 ммоль (< 2,6), ЛПОНП – 1.1 ммоль/л (< 0,9), КА – 5,6 (2,5-3,5). ОАМ: с/ж, прозрачная, реакция кислая, удельный вес – 1018, белок – 1,46 г/л, эпителиальные клетки – неб-е к-во, лейкоциты- 1-3-2 в поле зрения, эритроциты –4-4-7 в п/зр. СКФ: по Кокрофту-Голду - 53 мл/мин. По MDRD – 37,7. HbA1c : 14,0% (< 7.0). СКС: 17,2-3,1-4,5-18,5-2,9-9,0 ммоль/л. ЭКГ: ритм синусовый, ЧСС 80 ударов/мин. Нормальное положение ЭОС. УЗС брюшной полости: Заключение: Умеренные диффузные изменения в печени. ЭХО – признаки хронического холецистита. Структурные неспецифические изменения в почках. Невролог: Энцефалопатия сочетанного генеза. Диабетическая сенсомоторная полинейропатия, дистальный тип. Окулист: Глазное дно - диски зрительного нерва розовые, границы четкие, макулярная область - не изменены, множественные микроаневризмы на концевых отделах капилляров, интраретинальные геморрагии в межсосудистых зонах. По периферии новообразованные сосуды. 48 Вопросы: 1. Охарактеризуйте изменения мочи. Какую стадию диабетической нефропатии Вы поставите? 2. С чем связаны частые гипогликемические состояния у данного больного? 3. Сформулируйте правильно и обоснуйте предварительный диагноз. 4. Какие дополнительные исследования необходимо выполнить. 5. Какое лечение осложнений сахарного диабета Вы можете предложить больному. Эталоны ответов к ситуационным задачам Задача №1: 1. ОАК, б/х крови (в т.ч. уровень креатинина), уровень калия, натрия, суточная гликемия, HbA1c, СКФ, липидограмма, проба Нечипоренко, суточная протеинурия, осмотр стоп, осмотр невролога, нефролога. 2. Гиперазотемия (повышенный уровень креатинина), гипопротеинемия, гиперхолестеринемия – вероятно у пациента почечная недостаточность. 3. Сахарный диабет 1 типа. Диабетическая препролиферативная ретинопатия обоих глаз. ХБП 3 стадии. Диабетическая нефропатия (стадия протеинурии). Симптоматическая артериальная гипертензия III степени, риск 4 (СД, гиперхолестеринемия). ХСН 1. ФК 1. 1 тип выставлен на основании возраста, тяжелое течение на основании осложнений, декомпенсация – уровень гликемии. Диабетическая препролиферативная ретинопатиия обоих глаз – на основании описания глазного дна. ХБП 3 стадии. Диабетическая нефропатия (стадия протеинурии) – наличие белка в моче, повышения креатинина. Симптоматическая артериальная гипертензия III степени, риск 4 (СД, гиперхолестеринемия), ХСН 1, ФК 1 – повышение артериального давления. Эталон ответа к задаче №2: 1. По ОАМ - белок – 1,46 г/л – можно расценить как изолированную протеинурию, по биохимическому анализу повышение мочевины и креатинина – это диабетическая нефропатия (стадия протеинурии). Учитывая СКФ по MDRD – 37,7 - это 3 стадия ХБП. 2. Частые гипогликемические состояния связаны с тем, что при почечной недостаточности необходимая доза инсулина может значительно снижаться – феномен Заброды (снижение потребности в инсулине и развитие спонтанных гипогликемий на фоне прогрессирования ХПН), это связано с тем, что при почечной недостаточности действие фермента инсулиназа (фермент, присутствующий в печени и почках; отвечает за расщепление инсулина в организме) уменьшается, и инсулин вводимый пациентом не распадается. 49 3. Сахарный диабет 1 типа. Диабетическая полинейропатия, сенсомоторная форма, дистальный тип. Диабетическая пролиферативная ретинопатия обоих глаз. ХБП 3 стадия: диабетическая нефропатия (стадия протеинурии). Артериальная гипертензия 3 степень, риск 4 (СД), ХСН 0 ФК 0. Анемия легкой степени. 4. Диагноз выставлен на основании: учитывая молодой возраст пациента 36 лет, болеет СД с 16 лет, гликированный гемоглобин 14 %, уровень гликемии 17,2-3,1-4,5-18,5-2,9-9,0 ммоль/л – свидетельствует о том, что у пациента сахарный диабет 1 типа. Стадия протеинурии т.к. по ОАМ - белок – 1,46 г/л – можно расценить как изолированную протеинурию. Учитывая СКФ по MDRD – 37,7 - это 3 стадия ХБП. 5. Лечение осложнений: 1. ХБП 3 стадии. Диабетическая нефропатия (стадия протеинурии): Ограничение животного белка не более 0,8 г/кг массы тела в сутки. Ингибиторы АПФ (или БРА) – под контролем СКФ и уровня калия. Достижение индивидуальных целевых значений гликированного гемоглобина (гликированный гемоглобин < 7%). Комбинированная антигипертензивная терапия: иАПФ или БРА + тиазидоподобные диуретики (индапамид), блокаторы кальциевых каналов. Статины (под контролем АЛТ, АСТ, КФК) длительно, с титрацией дозы по данным липидограммы в динамике. После уточнения показателей железа сыворотки, ферритина сыворотки, насыщения трансферрина железом решение вопроса о назначении препаратов железа и лекарственных средств, стимулирующих эритропоэз. Избегать применения нефротоксических препаратов (аминогликлозиды, НПВС). Коррекция гиперкалиемии. Возможно назначение (под контролем коагулограммы, состояния глазного дна, не сочетать с дезагрегнантами): Сулодексида 2,0 в/м № 15 – 20, затем по 1 капсуле 2 р/сут 2 мес 2 р/год. 2. Пролиферативная ретинопатия: выполнение лазеркоагуляции сетчатки. Снижение гликемии нужно выполнять очень медленно!!! 50 ТЕСТОВЫЙ КОНТРОЛЬ: 1. Лечение диабетической нефропатии на стадии микроальбуминурии включает обязательное назначение (3 ответа): а) ингибиторы АПФ только при повышенном АД б) ингибиторы АПФ не зависимо от уровня АД в) ограничение белка в диете г) ограничение соли д) диета богатая белком и микроэлементами 2. Для диабетической нефропатия стадии протеинурии характерно (3 ответа): а) наличие стойкой протеинурии б) отеки в) повышение артериального давления г) болевой синдром 3. Диабетическая нефропатия стадии микроальбуминурии характеризуется (2 ответа): а) наличием протеинурии выше 0,3 г/л б) снижением фильтрационной функцией почек в) нормальным артериальным давлением г) отсутствием отеков д) наличием отеков на ногах 4. Какой из предложенных критерией является важнейшим для диагностики нефротического синдрома? (1 ответ): а) отеки б) сывороточный альбумин ниже 30 г/л в) суточная протеинурия более 3,5 г г) гиперхолестеринемия д) гиперкоагуляция 5. Развитие нефрогенной анемии сопровождается (3 ответа): а) снижением трудоспособности б) снижением толерантности к умственным и физическим нагрузкам в) прогрессированием почечной недостаточности г) бессимптомным течением д) не влияет на трудоспособность 6. О хронической болезни почек можно говорить при сохранении симптомов почечной болезни (1 ответ): а) более 3 мес. б) более 1 мес. 51 в) более 3 недель. 7. Препараты выбора (из указанных) при лечении активного пиелонефрита (1 ответ): а) полусинтетические пенициллины б) фторхинолоны в) макролиды г) тетрациклины 8. Какие варианты поражения почек являются типичными для сахарного диабета? (2 ответа) а) хронический пиелонефрит б) диабетическая нефропатия в) сосочковый некроз г) поликистоз почек д) острая уратная блокада. 9. Какие препараты не следует назначать при пиелонефрите в стадии ХПН (1 ответ): а) аминогликозиды б) цефтриаксон в) ципрофлоксацин г) полимиксины д) амоксициллин 10. Укажите основную причину анемии при ХПН (1 ответ): а) железодефицит б) дефицит вит В-12 и фолиевой кислоты в) хронический гемолиз г) уменьшение синтеза эритропоэтина д) хроническая интоксикация алюминием 11. Выделите противопоказания к лечению эритропоэтином (2 ответа): а) абсолютный дефицит железа б) выраженная гипотония в) гемохроматоз г) трудноконтролируемая гипертензия 12. Укажите методы профилактики уремического гиперпаратиреоза (3 ответа): а) обогащение диеты фосфором б) обогащение диеты кальцием в) применение фосфор-связывающих препаратов г) применение кальцитриола д) применение тиреокальцитонина 52 Эталоны ответов к тестовому контролю: № ВОПРОСА 1 2 3 4 5 6 7 8 9 10 11 12 ВАРИАНТ ОТВЕТА Б, В, Г А, Б, В В, Г Б А, Б, В А Б А, Б А Г А, Г Б, В, Г 53 РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА ОСНОВНАЯ: 1. Эндокринология. Национальное руководство: руководство. / Под ред. И.И. Дедова, Г.А. Мельниченко. – М.: ГЭОТАР-Медиа, 2008. – 1072 с. ДОПОЛНИТЕЛЬНАЯ: 1. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. - /Под редакцией Дедова И.И., Шестаковой М.В. Издание пятое, дополненное. 5-й выпуск. М., 2011. 2. Аметов А.С. Сахарный диабет 2 типа. Проблемы и решения. – М. : ГЭОТАРМедиа, 2011. – 704 с. 3. Бондарь И.А. Почки при сахарном диабете: патоморфология, патогенез, ранняя диагностика, лечение : Монография / И.А. Бондарь, В.В. Климонтов, И.П. Рогова, А.П. Надеев. – Новосибирск : Изд-во НГТУ, 2008. – 272 с. 4. Дедов И.И., Шестакова М.В. Сахарный диабет: диагностика, лечение, профилактика. – М.: ООО Изд-во «МИА», 2011. – 808 с. 5. Дедов И.И., Шестакова М.В. Сахарный диабет: острые и хронические осложнения. – М.: ООО Изд-во «МИА», 2011. – 480 с. 6. Шестакова М.В., Дедов И.И. Сахарный диабет и хроническая болезнь почек. – М.: ООО «Медицинское информационное агентство», 2009. – 482с. 54 УДК 616.379-008.64-06 ББК 54.15 Х 18 Рекомендовано ЦКМС ГБОУ ВПО «Иркутский государственный медицинский университет Министерства здравоохранения России» Протокол_____ от __________ 2012г Авторы: Л.Ю. Хамнуева – доктор мед. наук, заведующая кафедрой эндокринологии и клинической фармакологии ГБОУ ВПО ИГМУ Министерства здравоохранения России Г.М. Орлова – доктор мед. наук, заведующая кафедрой госпитальной терапии ГБОУ ВПО ИГМУ Министерства здравоохранения России Е.А. Хантакова - ассистент кафедры эндокринологии и клинической фармакологии ГБОУ ВПО ИГМУ Министерства здравоохранения России Л.С. Андреева – канд. мед. наук, доцент кафедры эндокринологии и клинической фармакологии ГБОУ ВПО ИГМУ Министерства здравоохранения России Рецензенты: Козлова Наталья Михайловна – заведующая кафедрой факультетской терапии ГБОУ ВПО ИГМУ Министерства здравоохранения России, доктор медицинских наук; Сараева Наталья Орестовна – профессор кафедры госпитальной терапии ГБОУ ВПО ИГМУ Министерства здравоохранения России, доктор медицинских наук. Хамнуева Л.Ю., Орлова Г.М., Хантакова Е.А., Андреева Л.С. Сахарный диабет и почки: пособие для врачей/ Л.Ю. Хамнуева, Г.М. Орлова, Е.А. Хантакова, Л.С. Андреева; ГБОУ ВПО ИГМУ Министерства здравоохранения России. - Иркутск, 2012.- 55с. В пособии представлены современные данные об этиологии, патогенезе, диагностике и клинических проявлениях диабетической нефропатии. Подробно обсуждаются вопросы лечения и профилактики диабетической нефропатии с учетом современных алгоритмов и рекомендаций. Освещена проблема мочевой инфекции у больных сахарным диабетом, рассмотрены методы диагностики и тактика лечения мочевой инфекции при сахарном диабете. Пособие предназначено для врачей, интернов, ординаторов. © Хамнуева Л.Ю., Орлова Г.М., Хантакова Е.А., Андреева Л.С. 2012 © ГБОУ ВПО ИГМУ Министерства здравоохранения России, 2012 55