ИЗУЧЕНИЕ МЕХАНИЗМОВ ВЛИЯНИЯ ПОВЕРХНОСТНО
реклама
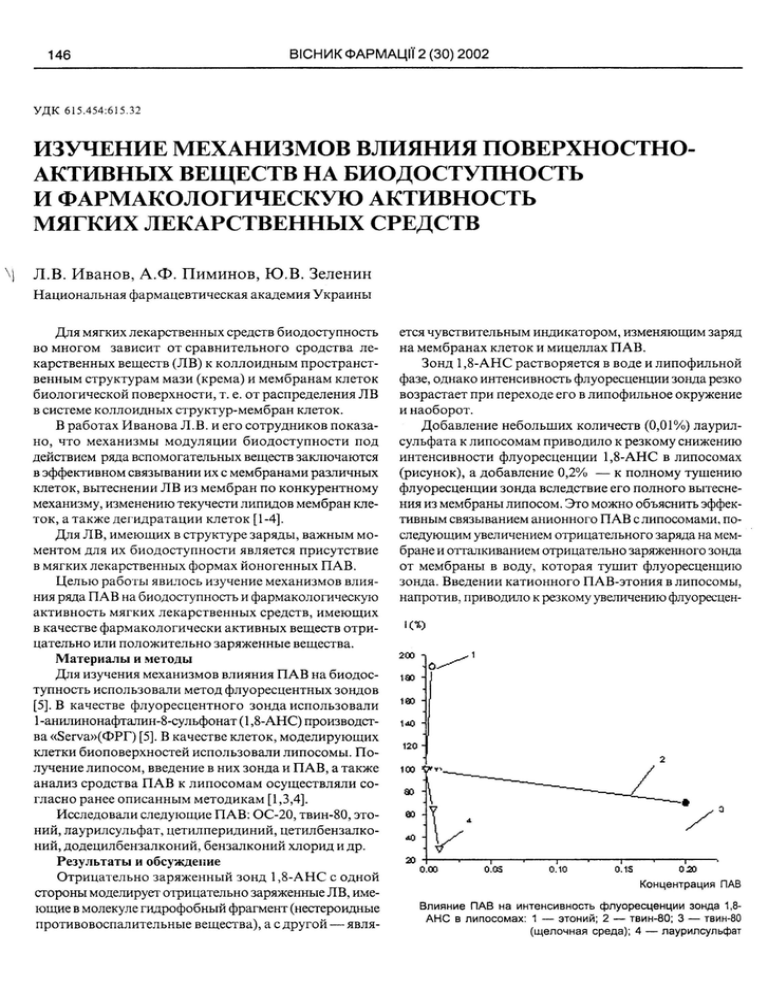
146 ВЮНИК ФАРМАЦИ 2 (30) 2002 У Д К 615.454:615.32 ИЗУЧЕНИЕ МЕХАНИЗМОВ ВЛИЯНИЯ ПОВЕРХНОСТНОАКТИВНЫХ ВЕЩЕСТВ НА БИОДОСТУПНОСТЬ И ФАРМАКОЛОГИЧЕСКУЮ АКТИВНОСТЬ МЯГКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ Л.В. Иванов, А.Ф. Пиминов, Ю . В . Зеленин Национальная фармацевтическая академия У к р а и н ы Д л я мягких лекарственных средств биодоступность во м н о г о м зависит от с р а в н и т е л ь н о г о сродства ле­ карственных веществ (ЛВ) к к о л л о и д н ы м пространст­ венным структурам мази (крема) и м е м б р а н а м клеток биологической поверхности, т. е. от распределения Л В в системе коллоидных структур-мембран клеток. В работах И в а н о в а Л .В. и его сотрудников показа­ но, что механизмы м о д у л я ц и и биодоступности под действием ряда вспомогательных веществ заключаются в эффективном связывании их с мембранами различных клеток, вытеснении Л В из м е м б р а н по конкурентному механизму, изменению текучести липидов мембран кле­ ток, а также дегидратации клеток [1-4]. Для Л В , имеющих в структуре заряды, важным мо­ ментом для их биодоступности является присутствие в мягких лекарственных формах йоногенных П А В . Целью работы явилось изучение механизмов влия­ ния ряда ПАВ на биодоступность и фармакологическую активность мягких лекарственных средств, имеющих в качестве фармакологически активных веществ отри­ цательно или положительно заряженные вещества. Материалы и методы Для изучения механизмов влияния П А В на биодос­ тупность использовали метод флуоресцентных зондов [5]. В качестве флуоресцентного зонда использовали 1-анилинонафталин-8-сульфонат (1,8-АНС) производст­ ва «Serva»(OPr) [5]. В качестве клеток, моделирующих клетки биоповерхностей использовали липосомы. П о ­ лучение липосом, введение в них зонда и П А В , а также анализ сродства П А В к л и п о с о м а м осуществляли со­ гласно ранее описанным методикам [1,3,4]. Исследовали следующие П А В : ОС-20, твин-80, этоний, лаурилсульфат, цетилперидиний, цетилбензалконий, додецилбензалконий, бензалконий хлорид и др. Результаты и обсуждение Отрицательно з а р я ж е н н ы й зонд 1,8-АНС с одной стороны моделирует отрицательно заряженные ЛВ, име­ ющие в молекуле гидрофобный фрагмент (нестероидные противовоспалительные вещества), а с другой — явля­ ется чувствительным индикатором, изменяющим заряд на мембранах клеток и мицеллах П А В . Зонд 1,8-АНС растворяется в воде и липофильной фазе, однако интенсивность флуоресценции зонда резко возрастает при переходе его в липофильное окружение и наоборот. Добавление небольших количеств (0,01%) лаурилсульфата к липосомам приводило к резкому снижению интенсивности флуоресценции 1,8-АНС в липосомах (рисунок), а добавление 0,2% — к полному тушению флуоресценции зонда вследствие его полного вытесне­ ния из мембраны липосом. Это можно объяснить эффек­ тивным связыванием анионного П А В с липосомами, по­ следующим увеличением отрицательного заряда на мем­ бране и отталкиванием отрицательно заряженного зонда от мембраны в воду, которая тушит флуоресценцию зонда. Введении катионного ПАВ-этония в липосомы, напротив, приводило к резкому увеличению флуоресцен- 200 -I 0.00 0.0S 0.10 0.1S 020 Концентрация ПАВ Влияние ПАВ на интенсивность флуоресценции зонда 1,8АНС в липосомах: 1 — этоний; 2 — твин-80; 3 — твин-80 (щелочная среда); 4 — лаурилсульфат КЛ1Н1ЧН1АСПЕКТИ ВИВЧЕННЯ ТА ВПРОВАДЖЕННЯ НОВИХ М'ЯКИХ ЗАСОБ1В ции зонда в мембране (см. рисунок) вследствие уве­ личения положительного заряда мембраны и увеличения связывания отрицательно заряженного зонда с липосомами. Уменьшение флуоресценции в присутствии твин-80 связано с вытеснением зонда из мембраны молекулами ПАВ. Н а м и проведены эксперименты, в которых опреде­ лялась флуоресценция зонда отдельно в липосомах, в растворе исследуемого П А В , а также в их смеси (липо­ сомы и ПАВ). П р и этом флуоресценция зонда в липосо­ мах была п р и н я т а за 100%. Исходя из д а н н ы х , представленых в таблице сле­ дует, что введение зонда в водные р а с т в о р ы П А В при­ водит к заметному изменению интенсивности флуорес­ ценции, о с о б е н н о в случае й о н о г е н н ы х П А В . Т а к , в растворе этония флуоресценция зонда б ы л а п р а к т и ­ чески такая же высокая, как и в л и п о с о м а х , что сви­ детельствует об эффективном взаимодействии зонда с катионным П А В . Высокое сродство зонда н а б л ю д а л о с ь к додецилбензалконию, цетилперидинию и бензалконию хлорида с различной д л и н о й а л к и л ь н о г о хвоста. Н а и л у ч ш е е взаимодействие зонда с молекулой бензалкония хлорида происходило при длине а л к и л ь н о й цепи С и это де­ монстрировало тонкие механизмы влияния заряда, раз­ меров и структуры как молекулы Л В , так и пространст­ венных коллоидных структур на распределение заря­ женных молекул Л В в мягких лекформах. Интенсивность флуоресценции 1,8-АНС в растворе лаурилсульфата была низкой, что указывает на слабое взаимодействие зонда с молекулами лаурилсульфата вследствие электростатического отталкивания молекул. А н а л и з д а н н ы х п о к а з а л (таблица), что хорошее сродство к липосомам наблюдалось для нейоногенного П А В — п р е п а р а т а ОС-20, лаурилсульфата натрия и бен­ залкония хлорида (наибольшее сродство для бензалко­ ния хлорида с длиной алкильной цепи С ) . Этоний, додецилбензалконий и цетилбензалконий имели неболь­ шое сродство к липосомам. Исходя из этого, можно определить несколько меха­ низмов влияния П А В на биодоступность: увеличение биодоступности за счет изменения заряда мембран под действием йоногенных П А В , увеличение биодоступнос­ ти вследствие переноса Л В н а м е м б р а н ы с п о м о щ ь ю П А В (ОС-20) и вытеснение Л В из мембран молекулами ПАВ. Способность П А В увеличивать сродство Л В к мем­ бранам м о ж н о использовать не т о л ь к о для увеличения биодоступности Л В , но и для увеличения антимикроб1 4 14 Вещество (ПАВ) Флуоресценция зонда в системе: ЛИПОСОМЫ+ вещество (%) 147 Флуоресценция зонда в растворе ПАВ (%) Этоний 190 102 Дб 193 110 Цб 205 113 БХ-12 228 150 БХ-14 200 185 БХ-16 190 130 ОС-20 95 98 Твин-80 112 13 Лаурил­ сульфат 31 10 ных свойств и противовоспалительного действия мазей при их местном применении. Х о р о ш е й иллюстрацией этого являются данные о влиянии лаурилсульфата нат­ рия и ОС-20 на увеличение диаметов зон задержки роста Staphylococcus aureus 209 Р эмульсиями, содержащими 1% н и т а з о л а и с т а б и л и з и р о в а н н ы м и 5% с м е с и различных э м у л ь г а т о р о в [6]. Полученные результаты, а также данные о механиз­ мах влияния неводных гидрофильных растворителей на д е г и д р а т а ц и ю клеток и а н т и м и к р о б н у ю активность [1,3,4] б ы л и н а м и и с п о л ь з о в а н ы при создании кремов гомеопатического действия, в к о т о р ы х состав вспомо­ гательных веществ (ПЭО-400, пропиленгликоль, нейоногенные и йоногенные П А В и др.) автономно обеспе­ чивал н е о б х о д и м о е п р о т и в о о т е ч н о е и бактерицидное действие. ВЫВОДЫ 1. М е т о д о м флуоресцентных зондов изучены меха­ низмы взаимодействия ряда нейоногенных и йоногенных П А В с липосомами, а также механизмы взаимодействия П А В с флуоресцентной м о д е л ь ю (зонд 1,8-АНС) ле­ карственных веществ, имеющих в молекуле отрицатель­ ный заряд. 2. П о к а з а н о , что зонд 1,8-АНС эффективно взаимо­ действует с к а т и о н н ы м и П А В , некоторыми нейоногенными П А В и слабо взаимодействует с анионными. 3. М е х а н и з м ы увеличения биодоступности и фар­ макологической активности заряженных Л В могут быть связаны с изменением заряда мембран клеток биологи­ ческих поверхностей п о д действием йоногенных П А В и со с п о с о б н о с т ь ю н е к о т о р ы х П А В переносить Л В на мембраны. ЛИТЕРАТУРА 1. Влияние состава двухкомпонентныхрастворителей на биологические мембраны /Иванов Л.В., Ляпунов И. А., ЦымбалЛ.В. и др. // Хим.-фармац. ж.—1986.—№ 12.— С. 1437-1443. 148 ВЮНИК ФАРМАЦИ 2 (30) 2002 ЦымбалЛ.В. и др. // Хим.-фармац. ж.—1986.—№ 12.— С. 1437-1443. 2. Иванов Л. В. Изучение кинетики дегидратации клеток эритроцитов под действием ряда гидрофильных неводных растворителей//Фармаком.—1998.—№5.-— С. 43-46. 3. Иванов Л. В. Изучение взаимодействия некоторых гидрофильных неводных растворителей с биомембранами различных клеток методами спиновых и флуоресцентных зондов // Фармаком.— 1999.— № 2.— С. 45-47. 4. Иванов Л. В., Орлова И. Н. Биофармацевтические исследования, направленные на оптимизацию состава, свойств и пути введения лекарственных препаратов //В сб.: «Технология и стандартизация лекарств».— Т. 2.— X., 2000.— С. 558-615. 5. Владимиров Ю.А., Добрецов Г.Е. Флуоресцентные зонды в исследовании биологических мембран.— М.: Наука,— 1980.—320 с. 6. Исследование эмульсионных лекарственных форм. И. Лиофобные эмульсии. /Ляпунов Н.А., Иванов Л.В., Чернобай Ю.В. и другие //Хим.-фармац. журн.— 1985.— № 3.— С. 214-219. У Д К 615.322:615.276 ИЗУЧЕНИЕ МОДУЛИРУЮЩЕГО ВЛИЯНИЯ ДЕЙСТВУЮЩИХ ВЕЩЕСТВ ЛЯДВЕНЦА РОГАТОГО НА РАЗЛИЧНЫЕ СТАДИИ И КОМПОНЕНТЫ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА i О.И. Набока, Л.Н. Воронина, В.Н. Ковалев, В.В. Король, Л.Г. Савченко, J Л.В. Галузинская Национальная фармацевтическая академия У к р а и н ы Цель исследования. В настоящее время отмечается тенденция к более ш и р о к о м у и с п о л ь з о в а н и ю лекарст­ венных средств растительного происхождения. Фитохимическое изучение т р а в ы лядвенца р о г а т о ­ го (Lotus corniculatus L.) семейства бобовых (Fabaceae), проведенное на кафедре фармакогнозии Н Ф А У , позво­ лило выявить в ее составе высокое содержание полифенольных соединений, представленных ф е н о л к а р б о н о в ы м и кислотами, ф л а в о н о и д а м и , к у м а р и н а м и . Л и п о фильная фракция содержит хлорофиллы, токоферолы, каротиноиды, жирные кислоты [1]. Широкий спектр биологической активности указан­ ных фитокомпонентов, а также сведения эмпирической медицины послужили основанием для эксперименталь­ ного изучения влияния действующих веществ некоторых экстрактов (сухого и густого) лядвенца рогатого на фор­ мирование фаз экссудации и пролиферации в условиях их моделирования. Методы и результаты исследований Антиэксеудативное действие изучали на модели каррагенинового отека задней конечности белых крыс мас­ сой 180-230 г. Ф л о г о г е н н ы й агент (1% р а с т в о р к а р р а генина) вводили с у б п л а н т а р н о в объеме 0,1 м л [4]. Суммарный полифенольный экстракт лядвенца ро­ гатого (Locorin) в дозах 25, 50, 100 мг/кг и п р е п а р а т сравнения ортофен ( Е Д =8 мг/кг) вводили per os за 1 час до инъекции флогистика. Развитие отека регистрировали в «пиковый» момент каррагенинового воспаления - через три часа после на­ чала эксперимента [3]. Влияние препаратов лядвенца р о г а т о г о н а репаративные процессы в очаге повреждения изучали на мо­ дели линейных резаных ран. Наркотизированным белым крысам массой 230-280 г в области спины делали линей­ ный разрез, швы накладывали на расстоянии 10 мм один от другого [5]. В течение 5 последующих дней животным наносили на раневую поверхность мази на основе дейст­ вующих веществ лядвенца р о г а т о г о (Lotus) в различ­ ных концентрациях - 1 % и 3%. В качестве основных объектов исследования исполь­ зовали в о д н у ю (В - 1% и В - 3%) и хлороформенную (X - 1 % и X - 3%) вытяжки лядвенца рогатого на мазевой гидрофильно-гидрофобной основе. О д н о в р е м е н н о исследовали в а н а л о г и ч н о м опыте р а н о з а ж и в л я ю щ е е действие мази календулы 10%, на­ шедшей ш и р о к о е применение для лечения различных видов р а н [2]. Д а н н ы е экспериментов свидетельствуют об ингибир о в а н и и экссудативных проявлений в очаге карраге­ нинового воспаления экстрактом лядвенца рогатого по 50


