Гипогликемии и сахарный диабет 2 типа: влияние на прогноз
реклама
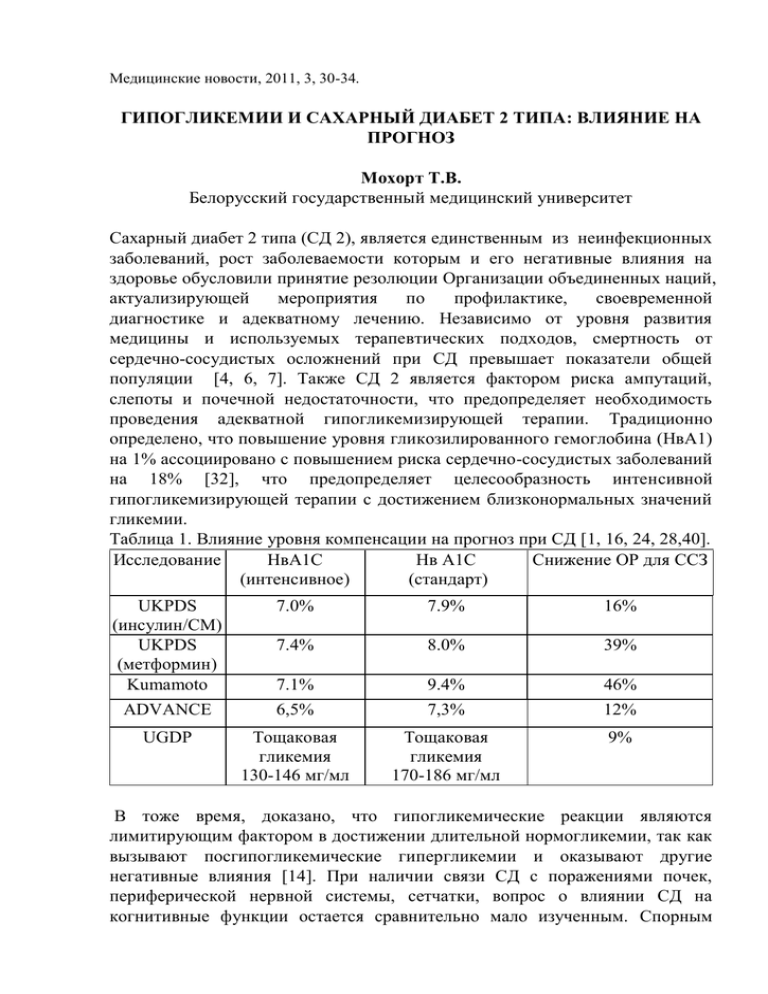
Медицинские новости, 2011, 3, 30-34. ГИПОГЛИКЕМИИ И САХАРНЫЙ ДИАБЕТ 2 ТИПА: ВЛИЯНИЕ НА ПРОГНОЗ Мохорт Т.В. Белорусский государственный медицинский университет Сахарный диабет 2 типа (СД 2), является единственным из неинфекционных заболеваний, рост заболеваемости которым и его негативные влияния на здоровье обусловили принятие резолюции Организации объединенных наций, актуализирующей мероприятия по профилактике, своевременной диагностике и адекватному лечению. Независимо от уровня развития медицины и используемых терапевтических подходов, смертность от сердечно-сосудистых осложнений при СД превышает показатели общей популяции [4, 6, 7]. Также СД 2 является фактором риска ампутаций, слепоты и почечной недостаточности, что предопределяет необходимость проведения адекватной гипогликемизирующей терапии. Традиционно определено, что повышение уровня гликозилированного гемоглобина (НвА1) на 1% ассоциировано с повышением риска сердечно-сосудистых заболеваний на 18% [32], что предопределяет целесообразность интенсивной гипогликемизирующей терапии с достижением близконормальных значений гликемии. Таблица 1. Влияние уровня компенсации на прогноз при СД [1, 16, 24, 28,40]. Исследование НвА1C Нв A1C Снижение ОР для ССЗ (интенсивное) (стандарт) UKPDS (инсулин/СМ) UKPDS (метформин) Kumamoto 7.0% 7.9% 16% 7.4% 8.0% 39% 7.1% 9.4% 46% ADVANCE 6,5% 7,3% 12% UGDP Тощаковая гликемия 130-146 мг/мл Тощаковая гликемия 170-186 мг/мл 9% В тоже время, доказано, что гипогликемические реакции являются лимитирующим фактором в достижении длительной нормогликемии, так как вызывают посгипогликемические гипергликемии и оказывают другие негативные влияния [14]. При наличии связи СД с поражениями почек, периферической нервной системы, сетчатки, вопрос о влиянии СД на когнитивные функции остается сравнительно мало изученным. Спорным вопросом является степень вклада различных факторов (гипергликемии, сосудистой патологии, гипогликемии, инсулинорезистетности) в развитие когнитивной дисфункции при СД. И, наконец, определено негативное влияние гипогликемичеких эпизодов на сердечно-сосудистый прогноз. Целевой уровень НвА1с, согласно действующего консенсуса Европейской ассоциации по изучению диабета и Американской диабетической ассоциации, составляет менее 7.0% (при нормальных значениях менее 6,0%). При этом указывается, что у пациентов с сердечно-сосудистой патологией или наличием в анамнезе гипогликемических эпизодов, целевой уровень НвА1с менее 7,5%, а у пациентов «низкого риска» без сердечно-сосудистой патологии и гипогликемических эпизодов – менее 6,0%. Аргументом для разграничения целевых показателей компенсации СД является повышение риска сердечно-сосудистых событий, ассоциированного с достижением низких значений НвА1с [26]. Изучение влияния гипогликемических эпизодов началось с начала клинического использования инсулинотерапии и продолжается до настоящего времени. В 1922г. при начале использования инсулинотерапии было определено, что «пациенты свободны от кетоацидоза, но не свободны от сахара» и было доложено о снижении памяти и внимания при проведении когнитивного тестирования. По данным последних исследований подтверждено, что острая гипогликемия провоцирует психологические нарушения, вызывающие сердечно-сосудистые кризы и гематологические нарушения посредством активации симпато-адреналовой системы и дисрегуляции гормональной системы, направленных на протекцию повреждения мозга. При этом гемодинамические и гематологические нарушения, развивающиеся на фоне эндотелиальной дисфункции, характерной для СД, повышают риск локальных очагов тканевой ишемии и манифестных сосудистых событий, а сосудистые повреждения включают гемореологические нарушения, активацию лейкоцитов, вазоконстрикцию, активацию провоспалительных цитокинов и медиаторов воспаления [37]. По мнению Nordin C Гипогликемические эпизоды являются доказанным фактором риска развития острых сердечно-сосудистых катастроф, что свидетельствует о необходимости компенсации гликемии без гипогликемических эпизодов для снижения рисков сердечно-сосудистой летальности. Есть мнение о проаритмогенном влиянии гипогликемических реакций за счет непосредственного влияния гипогликемии и катехоламиновых реакций, вызывающих гипокалиемию и др. нарушения [27]. По данным Veterans Affairs Diabetes Trial (VADT) определено, что выраженные гипогликемические реакции при СД 2 являются одним из основных предикторов инфаркта миокарда, мозгового инсульта и смерти от всех причин [16]. По данным ACCORD (Action to Control Cardiovascular Risk in Diabetes) Отправным моментом для планирования крупномасштабного многоцентрового рандомизировнного 2х-факториального исследования являлось поддержание компенсации сахарного диабета с обеспечением уровня гликозилированного гемоглобина (НвА1с) менее целом 6,5%, так как в патогенезе ангиопатий, протекающих в поражением как мелких, так и крупных сосудов, доказана первоочередная роль гипергликемии. В итоге исследование ACCORD, в котором наблюдались 10 251 пациентов высокого риска с СД 2 типа рандомизированных на группы интенсивного (НвА1с менее 6%) и традиционного (НвА1с 7,0-7,9%) гликемического контроля с различной интенсивностью контроля АД и липидного профиля, было прекращено досрочно. Причиной досрочного прекращения исследования ACCORD явилась высокая смертность в группе интенсивного лечения (257 смерти, средний HbA1c 6.4% против 203 смертей, средний HbA1c 7.5% в группе традиционного лечения, т.е. 54 избыточные смерти в группе интенсивной терапии) [30]. Рис. 1. Частота регистрации гипогликемических эпизодов по результатам исследования ACCORD в зависимости от метода терапии Углубленный анализ результатов этого исследования свидетельствует, что количество зарегистрированных эпизодов гипогликемии, требующих медицинской помощи, было значимо выше в группе интенсивного гликемического контроля (10.5% vs (3.5%) (независимо от количества зарегистрированных эпизодов) [19]. Так, 1 гипогликемический эпизод в группе интенсивного контроля был зарегистрирован у 7,8% пациентов против 2,5% в группе сравнения, а от 3 до 5 эпизодов - у 0,8% и 0,2% пациентов соответственно. При анализе общего показателя смертности отмечено, что в общей группе пациентов СД 2 у пациентов без гипогликемических эпизодов он составил 1,2% в год, а при наличии гипогликемий – 3,3% в год. Более того, в обеих ветвях исследования смертность была выше в подгруппах с зарегистрированными гипогликемическими эпизодами (2,8% vs 1,3% в год в группе интенсивного контроля и 4,9% vs 1,1% в год с группе стандартного контроля). Т.о. смертность была выше у пациентов с зарегистрированными гипогликемическими эпизодами независимо от терапевтической стратегии. При оценке риска определено, что риск смерти оказался выше в группе интенсивной гипогликемизирующей терапии у лиц без зарегистрированных гипогликемических эпизодов, в то время как в группе стандартной терапии смертность была максимальной у пациентов с зафиксированными гипогликемиями [19]. Таким образом, сделано заключение, что именно гипогликемии определяют повышение риска негативных кардиальных исходов. В тоже время в исследовании ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation trial), построенное по схожему дизайну, не было зафиксировано повышения риска инфаркта миокарда, инсульта, смерти от макроваскулярных событий и смерти от всех причин в группах стандартной и интенсивной тарпии (НвА1с 6,5% при последнем визите). При этом в качестве гипогликемизирующего агента в группе интенсивной терапии использовался гликлазид МВ, что обеспечило крайне редкую регистрацию выраженных гипогликемических эпизодов (0,007 против 0,004 событий на 1 пациента в год, p<0,001) и, тем не менее, не привело к достоверному снижению риска сердечно-сосудистых макрососудистых событий и кардио-васкулярной смертности. Таким образом, результаты исследования ADVANCE также не подтвердили значимой роли снижения НвА1с менее 7,0% для достижения снижения риска сердечнососудистых событий и летальных исходов, остающихся основной причиной смерти пациентов с СД 2 [1]. В исследовании NICE-SUGER также продемонстрировано, что поддержание более жесткого контроля гликемии (целевой уровень 4,5-6,1ммоль/л) в условиях отделений неотложной терапии сопровождалось увеличением показателя смертности [35]. Факт связи СД и внезапной смерти подтвержден в различных исследованиях, позволяющих сделать заключение, что СД является независимым фактором риска внезапной смерти и причиной пролонгации интервала QT [10, 29]. С другой стороны, при СД значимо повышается риск кардиомиопатий, в патогенезе развития которых имеют значение митохондриальная дисфункция, активация оксидации жирных кислот и др. патологические процессы, активность которых находится в зависимости от активности клеточного метаболизма и нарушений утилизации глюкозы, сопутствующих гипогликемическим эпизодам. Следствием кардиомиопатиии является развитие нарушений сократительной способности миокарда, усугубляющейся в условиях метаболических нарушений и дефицита макроэргов. Cуществует аргументированная точка зрения, свидетельствующая о том, что при СД регистрируется удлинение интервала QT на электрокардиограмме, определяющее повышение чувствительности миокарда к аритмогенным воздействиям, включая перегрузку кальцием [10, 27] Именно перегрузка кальцием, обусловленная снижением активности Na-K АТФазы в этой ситуации определяет изменения в саркоплазме и миоплазме, приводящие к нарушениям соотношения внутриклеточного натрия и кальция и формирования электрогенных импульсов в миокарде. С другой стороны, механизм экзоцитоза инсулина связан с блокадой калиевых каналов (особенно Ikr и Iks), сопровождается нарушением формирования электрических импульсов. Механизм активации секреции инсулина заключается в селективной стимуляции специфических рецепторов на поверхности β-клетки поджелудочной железы, закрытии АТФ-зависимых калиевых каналов (К+АТФ-каналов), деполяризации мембраны клетки, открытии кальциевых каналов и накоплении ионов кальция в клетке с последующим экзоцитозом инсулина. Приведенные факты объясняют потенциальный механизм влияния СД 2 на сердечно-сосудистый прогноз, так как блокада АТФ-зависимых калиевых каналов в различных тканях, в том числе клетках миокарда и гладкомышечных клетках и открытие кальциевых каналов при наличии избыточной секреции инсулина и инсулинорезистетности могут быть причиной исходной перегрузки кальцием. В тоже время, влияние гипогликемии на повышение риска сердечных аритмий в настоящее время не подтверждено в клинических исследованиях [27]. Изучение роли гипогликемии в повышении риска смерти от сердечнососудистой патологии осложняется отсутствием специфических анатомоморфологических маркеров гипогликемии и тем фактом, что при появлении острых кардиальных болей пациент не всегда определяет уровень гликемии и/или фиксирует постгипогликемическую гипергликемию. Именно перечисленные факторы ограничивают возможности проведения анализа уже имеющихся исследований и осложняют формирование дизайна исследования, способного доказать или опровергнуть влияние гипогликемий на риск развития аритмий. Биологические эффекты гипогликемии, определяющие риск сердечнососудистых событий, включают котринсулярный ответ на гипогликемию, включающий избыточную секрецию катехоламинов и соответствующие кардиальные адренэргические эффекты, включая повышение риска аритмий сердца. В настоящее время проаритмогенный эффект гипогликемии, который реализуется в развитие желудочковых аритмий и внезапную смерть, подтвержден как электрофизиологическими так и клиническими исследованиями. С учетом вышеприведенных фактов, Американская ассоциация диабета опубликовала данные, что поскольку более половины американцев имеют уровень НвА1с 7%, а бенефиции жесткого контроля сомнительны, целевой уровень НвА1с должен составлять менее 7,0% и может быть определен с учетом оценки риска гипогликемических эпизодов и сердечно-сосудистого прогноза. Для пациентов «низкого риска» без кардиальной патологии целевой уровень НвА1с составляет менее 6,0%, а у лиц «высокого риска» с сердечно-сосудистыми заболеваниями в анамнезе и зарегистрированными гипогликемическими эпизодами, целевой уровень НвА1с должен составлять менее 7,5% [2]. Вторым важнейшим фактором, ограничивающим снижение уровня НвАс до нормальных значений, является наличие связи гипогликемий, когнитивных нарушений и деменции (или постгипогликемической энцефалопатии) [17, 20, 31, 36]. Определено, что индекс гипогликемий нарастает с длительностью СД более 6 лет, при этом у пациентов выраженные гипогликемии ассоциированы с высоким риском деменции. В 2009 году опубликованы результаты наблюдения за когортой 16 667 пациентов с СД 2, наблюдавшейся в течение 27 лет с регистрацией гипогликемических эпизодов [39]. Хотя бы 1 гипогликемический эпизод был зарегистрирован у 8,8%. При оценке связи гипогликемических эпизодов и риска деменции определено, что повторные эпизоды гипогликемии повышают риск деменции. Атрибутивный риск деменции между лицами без гипогликемических эпизодов и с зарегистрированными эпизодами составил 2,39% в год [39]. Многочисленные публикации свидетельствуют, что при СД 2 отмечаются снижение скорости психомоторных реакций, нарушение функции лобной доли, снижение вербальной памяти, комплексные моторные нарушения, визуальные задержки, снижение внимания и др. [ Когнитивные и нейрональные нарушения при СД могут быть обусловлены прямым влиянием ятрогенных гипогликемий (глюкоза менее 3 ммоль/л), другими метаболическими нарушениями (метаболический компонент деменции), нарушениями перфузии мозговой ткани (сосудистый компонент деменции), ассоциации с депрессивными состояниями и другими факторами. Для доказательства клеточных нарушений в эксперименте на крысах вызывалась острая гипогликемия и проводилась оценка функции гиппокампа с использованием мониторинга постсинаптического потенциала и уровня никотин-амид-аденин-динуклеотида (НАДФ) методом флуоресценции. Результаты свидетельствуют о снижении функции гиппокампа slice center и влиянии гипогликемии на память.[5, 8, 13, 23, 25]. Доказано, что острые и повторные гипогликемии снижаю уровень гликогена в церебеллуме, коре и гипоталамусе на 50% по сравнению с нормальными значениями. После острой гипогликемии уровень гликогена возвращается к нормальным значениям через 6 часов, а при повторных гипогликемиях возращение уровня гликогена происходит через 24 часа, что связывают с нарушением контррегуляторных механизмов компенсации гиперинсулинемических гипогликемий [30]. Есть мнение, что гипогликемия инициирует программированную гибель или повреждение нейронов за счет биоэнергетической дисфукнции мозга [3, 34, 38, 39]. Таким образом, гипогликемические эпизоды оказывают негативное влияние на течение СД не только с позиций сложности достижения компенсации, но вызывают повышение риска острых сердечно-сосудистых событий и когнитивных нарушений. Сердечно-сосудистые события увеличивают вероятность летального исхода, а когнитивные нарушения приводят к снижению качества жизни, обусловливают сложности в обеспечении компенсации СД и инициируют развитие микрососудистых осложнений, также определяющих негативный прогноз [9, 12, 15]. Приведенные факты диктуют необходимость использования в лечении СД 2 препаратов с низким риском гипогликемических реакций. Считается, что в 75% случаев смерть при СД 2 является результатом сердечно-сосудистых событий (инфаркта миокарда, аритмии сердца или инсульта), причиной которых может явиться гипогликемический эпизод. Исходя из вышесказанного, лечение СД 2 должно планироваться с учетом выбора гипогликемизирующих препаратов, гарантирующих низкий риск гипогликемических эпизодов [18, 33]. Согласно действующего консенсуса между Европейской ассоциацией по изучению диабета и Американской диабетологической ассоциацией по лечению СД 2 в качестве препаратов первой линии рекомендуется назначение метформина. Использование в качестве препарата первого выбора инсулинсетитизатора метформина обосновано патогенетическим влиянием на инсулинорезистетность и низким риском гипогликемических эпизодов [11]. Препаратами второй линии являются секретагоги производные сульфонилмочевины и препараты инсулина. Действующие рекомендации определяют целесообразность использования препаратов, обеспечивающих низкий риск гипогликемических эпизодов, поэтому в качестве рекомендуемых производных сульфонилмочевины определены гликлазид и глимепирид, а в качестве препаратов инсулина пролонгированного действия предпочтение должно быть отдано беспиковым аналогам инсулина гларгину и детемиру. Следует отметить, что, несмотря на риск гипогликемий при использовании глибенкламида, в течение многих лет ведутся дискуссии о наличии «антиаритмического эффекта» у глибенкламида, объясняемого прямым влиянием препарата на кардиомиоциты, что подтверждается рядом исследований [21, 22]. Рис.2. Риск гипогликемических эпизодов при СД 2 по данным исследования СONTROL (годичный показатель гипогликемии) 4,5 4 3,5 3 2,5 2 1,5 1 0,5 0 4,2 3,2 0,6 VADT ACCORD ADVANCE Тем не менее, на рис.2. приведены результаты сравнения регистрации годичного показателя гипогликемии, свидетельствующего о наиболее низком риске гипогликемических эпизодов при использовании стратегии, базирующейся на назначении преимущественно гликлазида МВ, свидетельствующие о минимальной частоте регистрации гипогликемических эпизодов. Полученные данные позволяют оптимизировать выбор инсулиновых секретагогов с позиций минимизации риска гипогликемий. В настоящее время достаточно широко используются пролонгированные аналоги инсулина гларгин и детемир, обеспечивающие значимо более низкую частоту гипогликемических реакций в течение суток и ночных по сравнению с использованием пролонгированного инсулина (нейтрального протамина Хагедорна). В тоже время, ряд гипогликемизирующих препаратов (ингибиторы альфа-глюкозидазы, тиазолидиндионы, инкретины и ингибиторы дипептидил-пептидазы 4, амилин) с низким риском гипогликемических эпизодов отнесены вышеназванным консенсусом к препаратам второй линии в связи с отсутствием доказательств негликемических эффектов, реализующихся снижением риска развития микро-и макрососудистых осложнений. В настоящее время наиболее перспективными классами гипогликемизирующих препаратов считаются инкретины (экзенатид, лираглютид), так как позволяют обеспечить достижение целевых уровней компенсации у максимального количества пациентов, при отсутствии гипогликемических эпизодов и в связи с наличием доказательств крадио- и нейропротективных эффектов. Использованная литература: 1. ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes//NEJM, 2008; 358:2560-2572. 2. American Diabetes Association. Standards of medical care in diabetes // Diabetes Care, 2010, 33: (Suppl 1): S 1-61. 3. Amiel SA, Dixon T, Mann R, Jameson K// Hypoglycaemia in Type 2 diabetes // Diabet Med, 2008;25(3):245-54. 4. Antman EM, Tanasijevic MJ, Thompson B et al //Cardiac-specific troponin I levels to predict the risk of mortality in patients with acute coronary syndromes //NEJM, 1996;335(18):1342-1349. 5. Auer RN. Hypoglycemic brain damage //Metab Brain Dis, 2004;19:169–175. 6. Balkau B, Simon D Survival in people with type 2 diabetes as a function of HbA(1c) // Lancet, 2010; 375(9713):438-440. 7. Balkau B.New diagnostic criteria for diabetes and mortality in older adults. DECODE Study Group. European Diabetes Epidemiology Group //Lancet, 1999; 353(9146):68-69. 8. Boyle PJ. Alteration in brain glucose metabolism induced by hypoglycaemia in man // Diabetologia, 1997; 40 Suppl 2:S69–S74. 9. Bragd J, Adamson U, Bäcklund LB et al Can glycaemic variability, as calculated from blood glucose self-monitoring, predict the development of complications in type 1 diabetes over a decade? //Diabetes Metab, 2008; 34:612616. 10. Brown DW, Giles WH, Greenlung KJ et al Impaired fasting glucose, diabetes mellitus, and cardiovascular disease risk factors are associated with prolonged QTc duration. Results from Third National Health and Nutrition Examination Survey// J Cardiovasc Risk, 2001; 8: 227-233. 11. Cheng AY, Fantus IG. Oral antihyperglycemic therapy for type 2 diabetes mellitus // CMAJ, 2005;172:213-226. 12. Christopher TK, Elizabeth R. Seaquist Cognitive Dysfunction and Diabetes Mellitus //Endocr Rev, 2008; 29(4): 494–511. 13. Cryer PE. Hypoglycemia, functional brain failure, and brain death //J Clin Invest, 2007;117(4):868–870. 14. Cryer PE. Hypoglycaemia: the limiting factor in the glycaemic management of Type I and Type II diabetes// Diabetologia, 2002; 45:937–948. 15. Cox DJ, Kovatchev BP, Gonder-Frederick LA et al Relationships between hyperglycemia and cognitive performance among adults with type 1 and type 2 diabetes//Diabetes Care, 2005; 28:71–77. 16. Duckworth W, Abraira C, Moritz T et al Glucose control and vascular complications in veterans with type 2 diabetes// NEJM, 2009; 360(2):129-139. 17. Frier BM Hypoglycaemia and cognitive function in diabetes// Int J Clin Pract, 2001; Suppl.; (123):30-37. 18. Gerstein HC, Miller ME, Byington RP et al Effects of intensive glucose lowering in type 2 diabetes // NEJM, 2008; 358:2545–2559. 19. Ismail-Beigi F, Craven T, Banerji MA et al ACCORD trial group. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial // Lancet, 2010; 376(9739):419-430. 20. Jacobson AM, Musen G, Ryan CM et al Long-term effect of diabetes and its treatment on cognitive function // NEJM, 2007; 356:1842–1852. 21. Koltai M et al The Role of hypoglycemic sulfphonureas in arrhythmias contributing to the mortality in acute myocardial ischemia // Acta Physiol Hung, 1990, 75; c175-176. 22. Lomuscio A Vergani D, Marano L, Castagnone M, Fiorentini C.et al Effects of Glibenclamide on ventricular fibrillation in non-insulin-dependent diabetics with acute myocardial infarction // Coronary Artery Disease, 1994; 5:767-771. 23. Matthew PS, Christopher J et al Effects of Relative Hypoglycemia on LTP and NADH Imaging in Rat Hippocampal Slices // Brain Res, 2007; 1165: 30–39. 24. Meinert CL, Knatterud GL, Prout TE, Klimt CR. A study of the effects of hypoglycemic agents on vascular complications in patients with adult-onset diabetes. II. Mortality results//Diabetes, 1970; 19 (Suppl 2):789-830. 25. Miyamoto E. Molecular mechanism of neuronal plasticity: induction and maintenance of long-term potentiation in the hippocampus //J Pharmacol Sci, 2006;100: 433–442. 26. Nathan DM, Buse JB, Davidson MB, et al.: Management of hyperglycaemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: update regarding the thiazolidinediones // Diabetologia, 2008; 51: 8–11. 27. Nordin C The case for hypoglycemia as a proarrhythmic event: basic clinical evidence // Diabetologia, 2010; 53: 1552-1561. 28. Ohkubo Y, Kishikawa H, Araki E et al Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with noninsulin-dependent diabetes mellitus: a randomized prospective 6-year study // Diabetes Res Clin Pract, 1995; 28(2):103-117. 29. Pearson EC, Woolsey RL QT prolongation and torsades de pointes among methadrone users: report to the FDA spontaneous reporting system // Drag Saf, 2005; 14: 747-753. 30. Pfeffer MA ACCORD(ing) to a Trialist //Circulation, 2010; 122(8): 841 - 843. 31. Ryan CM, Williams TM, Finegold DN, Orchard TJ. Cognitive dysfunction in adults with type 1 (insulindependent) diabetes of long duration: effects of recurrent hypoglycaemia and other chronic complications // Diabetologia, 1993; 36(4):329– 334. 32. Selvin E, Marinopoulos S, Berkenblit G et al Meta-analysis: glycosylated hemoglobin and cardiovascular disease in diabetes mellitus // Ann Intern Med, 2004;141(6):421-431. 33. Skyler JS, Bergenstal R, Bonow RO et al American Diabetes Association; American College of Cardiology Foundation; American Heart Association. Intensive glycemic control and the prevention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA Diabetes Trials: a position statement of the American Diabetes Association and a Scientific Statement of the American College of Cardiology Foundation and the American Heart Association // J Am Coll Cardiol, 2009; 53(3): 298-304. 34. Suh SW, Hamby AM, Swanson RA. Hypoglycemia, brain energetics, and hypoglycemic neuronal death // Glia, 2007; 55(12):1280–1286. 35. The NICE-SUGER study investigators Intensive vs conventional glucose control in critically ill patients // NEJM, 2009; 360: 1283-1297. 36. Warren RE, Frier BM Hypoglycaemia and cognitive function //Diabetes Obes Metab, 2005; 7(5):493-503. 37. Wright RJ, Frier BM. Vascular disease and diabetes: is hypoglycaemia an aggravating factor? // Diabetes Metab Res Rev, 2008; 24(5):353-363. 38. Wright AD, Cull CA, Macleod KM, Holman RRJ UKPDS73.//Diabetes Complications, 2006; 20(6):395-401. 39. Whitmer RA, Karter AJ, Yaffe K et al Hypoglycemic Episodes and Risk of Dementia in Older Patients with Type 2 Diabetes Mellitus// JAMA, 2009; 301(15): 1565–1572. 40. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33) // Lancet, 1998; 352:837–853. Рис.2. Риск гипогликемических эпизодов при СД 2 по данным исследования СONTROL (годичный показатель гипогликемии) 4,5 4 3,5 3 2,5 2 1,5 1 0,5 0 4,2 3,2 0,6 VADT ACCORD ADVANCE

