Технологическая карта урока по теме: «Аммиак»
реклама
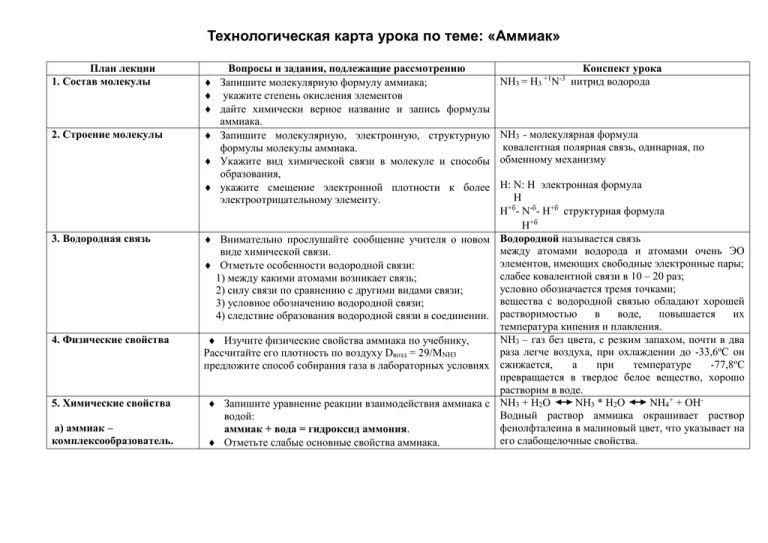
Технологическая карта урока по теме: «Аммиак» План лекции 1. Состав молекулы 2. Строение молекулы Вопросы и задания, подлежащие рассмотрению Запишите молекулярную формулу аммиака; укажите степень окисления элементов дайте химически верное название и запись формулы аммиака. Запишите молекулярную, электронную, структурную формулы молекулы аммиака. Укажите вид химической связи в молекуле и способы образования, укажите смещение электронной плотности к более электроотрицательному элементу. 3. Водородная связь Внимательно прослушайте сообщение учителя о новом виде химической связи. Отметьте особенности водородной связи: 1) между какими атомами возникает связь; 2) силу связи по сравнению с другими видами связи; 3) условное обозначению водородной связи; 4) следствие образования водородной связи в соединении. 4. Физические свойства Изучите физические свойства аммиака по учебнику, Рассчитайте его плотность по воздуху Dвозд = 29/МNН3 предложите способ собирания газа в лабораторных условиях 5. Химические свойства Запишите уравнение реакции взаимодействия аммиака с водой: аммиак + вода = гидроксид аммония. Отметьте слабые основные свойства аммиака. а) аммиак – комплексообразователь. +1 -3 NH3 = H3 N Конспект урока нитрид водорода NH3 - молекулярная формула ковалентная полярная связь, одинарная, по обменному механизму Н: N: Н электронная формула Н Н+б- N-б- Н+б структурная формула Н+б Водородной называется связь между атомами водорода и атомами очень ЭО элементов, имеющих свободные электронные пары; слабее ковалентной связи в 10 – 20 раз; условно обозначается тремя точками; вещества с водородной связью обладают хорошей растворимостью в воде, повышается их температура кипения и плавления. NH3 – газ без цвета, с резким запахом, почти в два раза легче воздуха, при охлаждении до -33,6оС он сжижается, а при температуре -77,8оС превращается в твердое белое вещество, хорошо растворим в воде. NH3 + H2O NH3 * H2O NH4+ + OHВодный раствор аммиака окрашивает раствор фенолфталеина в малиновый цвет, что указывает на его слабощелочные свойства. б) аммиак- восстановитель Запишите уравнение реакции взаимодействия аммиака с соляной кислотой Аммиак + соляная кислота = хлорид аммония, Рассмотрите механизм реакции. Отметьте особенности иона аммония и образование ковалентной полярной связи по донорно-акцепторному механизму. NH3 + HCL = NH4CL Хлорид аммония Механизм реакции H - H H / Cl + H + С.о. N = -3 Ковалентность N = 4 N – донор H Ковалентная полярная связь по донорноакцепторному механизму H H Cl- H + H - акцептор Запишите уравнение реакции горение аммиака: аммиак + кислород = азот + вода Составьте электронный баланс к этому уравнению. N-3H3+1 + O20 = N20 + H2+1O-2 2N-3 2 6 -6 e- N20 восстановитель окисление О20 +4e- 2O-2 12 окислитель восстановление 3 4 4N-3 + 3O20 2N20 + 6O-2 4NH3 + 3O2 = 2N2 + 6H2O Запишите уравнение реакции каталитического окисления аммиака: аммиак + кислород = оксид азота (II) + вода. Составьте электронный баланс к этому уравнению. N-3H3+1 + O20 = N+2O-2+ H2+1O-2 4 5 N-3 -5 e- N+2 восстановитель окисление 20 О20 +4e- 2O-2 окислитель восстановление 5 4 4N-3 + 5O20 4N+2 + 10O-2 4NH3 + 5O2 = 4NO + 6H2O 6. Получение аммиака Запишите уравнение реакции получение аммиака: а) в промышленности (дайте классификацию реакции по всем известным признакам и предложите оптимальные условия проведения реакции); б) в лаборатории (отметьте способы распознавания аммиака). а) в промышленности кат 2NH3 + Q 3H2 + N2 Р соединения, экзотермическая, гомогенная, обратимая, окислительно-восстановительная, каталитическая. б) в лаборатории NH4+ + OH- = NH3 + H2O Собирание - в перевернутую кверху дном пробирку. Распознавание: а) по запаху; б) по посинению влажной лакмусовой бумажки в) по появлению белого дыма от поднесенной стеклянной палочки, смоченной HCl конц. 7. Применение аммиака 8. Реши задачи 9. Домашнее задание Изучите применение аммиака по учебнику, Применение: подготовьте устный рассказ и составьте краткую 1) в холодильных установках; 2) в медицине; схему 3) для производства азотной кислоты, солей аммония; 4) как удобрение. 1) При синтезе аммиака промышленном способом азот объемом 56 л. (н.у.) прореагировал с водородом взятом в избытке. Массовая доля выхода аммиака составила 50%. Рассчитайте объем и массу полученного аммиака. 2) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой? 3) Какой объем кислорода потребуется для сжигания 34 г. аммиака? Запиши домашнее задание в дневник. п. 25, упр. 1-6(устно),7-8(письменно), повторить конспект.

