e Катион Na+ K+,Rb+,Cs+ Li+ Mg2+ Ca2+ Ba2+ Cu2+ Sr2+
реклама
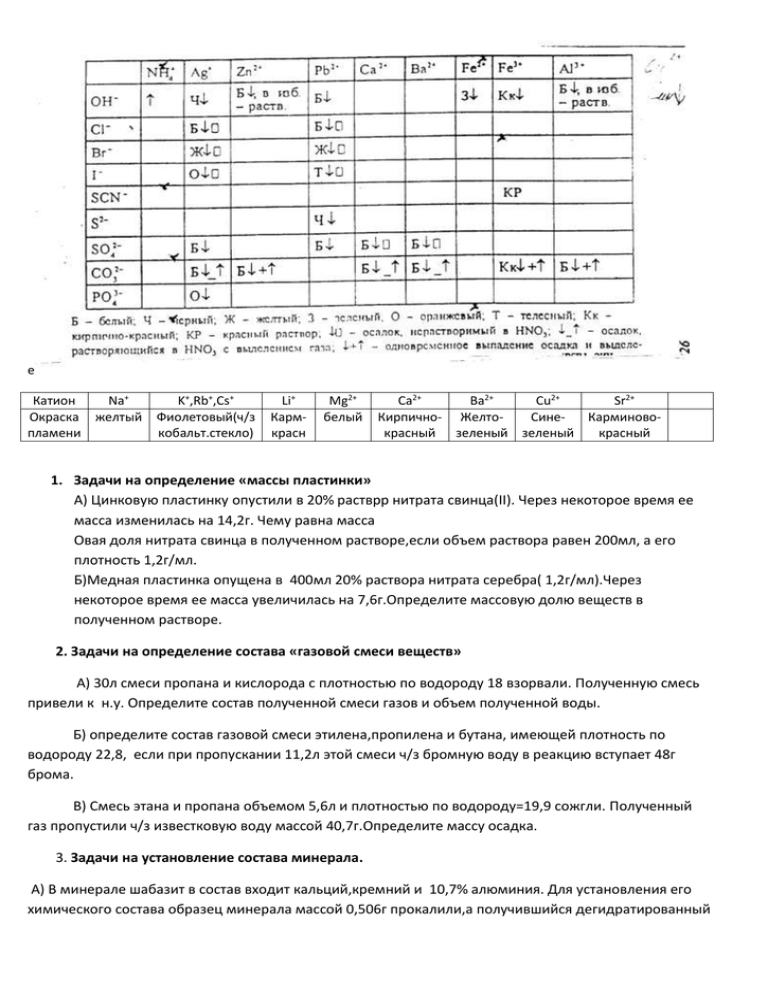
e Катион Окраска пламени Na+ желтый K+,Rb+,Cs+ Фиолетовый(ч/з кобальт.стекло) Li+ Кармкрасн Mg2+ белый Ca2+ Ba2+ Cu2+ Sr2+ Кирпично- ЖелтоСинеКарминовокрасный зеленый зеленый красный 1. Задачи на определение «массы пластинки» А) Цинковую пластинку опустили в 20% растврр нитрата свинца(II). Через некоторое время ее масса изменилась на 14,2г. Чему равна масса Овая доля нитрата свинца в полученном растворе,если объем раствора равен 200мл, а его плотность 1,2г/мл. Б)Медная пластинка опущена в 400мл 20% раствора нитрата серебра( 1,2г/мл).Через некоторое время ее масса увеличилась на 7,6г.Определите массовую долю веществ в полученном растворе. 2. Задачи на определение состава «газовой смеси веществ» А) 30л смеси пропана и кислорода с плотностью по водороду 18 взорвали. Полученную смесь привели к н.у. Определите состав полученной смеси газов и объем полученной воды. Б) определите состав газовой смеси этилена,пропилена и бутана, имеющей плотность по водороду 22,8, если при пропускании 11,2л этой смеси ч/з бромную воду в реакцию вступает 48г брома. В) Смесь этана и пропана объемом 5,6л и плотностью по водороду=19,9 сожгли. Полученный газ пропустили ч/з известковую воду массой 40,7г.Определите массу осадка. 3. Задачи на установление состава минерала. А) В минерале шабазит в состав входит кальций,кремний и 10,7% алюминия. Для установления его химического состава образец минерала массой 0,506г прокалили,а получившийся дегидратированный образец массой 0,398г нагрели с избытком плавиковой кислоты, при этом выделилось 89,6мл тетрафторида кремния(н.у).Определите состав минерала. Б) Минерал ковелин используют как сырье для получения меди и содержит 80% сульфида меди(II) и 20% примесей,не реакгирующих с водородом.При реакции гидрида магния с водой выделилось 25л водорода(320С, 1Атм).какое количество ковелина можно восстановить указанным количеством вводорода,если для полного протекания реакции требуется 20% избыток водорода по сравнению со стехеометрическим. 4. Задачи на «химическое равновесие» А) Реакция протекает по уравнению СО(г) + Сl2(г) ↔СОСl2(г)Начальные концентрации СО и Сl2 равны 0,28 и 0,8 моль/л соответственно. Равновесная концентрация СО равна 0,08моль/л.Вычислите константу химического равновесия. Б) Химическо равновесие гомогенной системы А+В↔С+Д установилось при концентрациях 9,8,6 и 12моль/л соответственно.После установления химического равновесияконцентрацию вещества С уменьшили до 0.Вычислите новые равновесные конценттрации веществ после смещения равновесия. 5. Задачи на определение неизвестного металла А) оксид некоторого двухвалентного металла растворили в соляной кислоте, затем к полученному раствору добавили раствор карбоната натрия и получили 3,2г осадка. Осадок отфильтровали и растворили в соляной кислоте, получив о,75л газа при стандартных условиях и t=150С. Определите металл. Стружку металла А сожгли в ток воздуха, получившийся продукт реакции содержит 72,4% А, Этот продукт растворили в избытке 50%-ой азотной кислоты. Полученный при растворении нитрат прокалили на воздухе до окончания реакции. Образовался оксид, содержащий примерно 70% А. Определите металл А, напишите все уравнения. Напишите три разных уравнения реакций металла с азотной кислотой. Как в промышленности получают этот металл? Б) 6.Задачи на «смеси веществ» А) Смесь цинка и оксида неизвестного двухвалентного металла массой 32г обработали избытком водного раствора едкого кали, а выделившийся при этом газ сожгли и получили 7,2г воды.Нерастворившийся в щелочи осадок отделили, промыли водой и растворили в 25,21мл соляной кислоты плотностью 1,19г/мл(36,5%).Определите,оксид какого металла находился в смеси, и расчитайте массовую долю оксида. Б) Смесь цинковых и железных опилок массой 23,75г обработали 219,3 мл 19,6%-ного раствора серной кислоты(р=1,14г/мл). Для нейтрализации избытка кислоты потребовалось 100мл раствора гидрокарбоната калия с концентрацией 2 моль/л.Определите массовые доли металлов в исходной смеси и объем газа(н.у), выделившегося при растворении металлаов. 7.Качественные задачи. А) В пяти склянках находятся растворы следующих веществ: хлорида натрия, соляной кислоты, карбоната натрия, хлорида бария и сульфата натрия.Не используя другие реактивы определите где чтто находится. Б) В пяти пронумерованных бюксах находятся кристаллические вещества: хлорид бария, хлорид магния, хлорид свинца(II), хлорид цинка, хлорид марганца(II) и хлорид натрия. Используя воду, растворы серной кислоты и щелочи определите, где какая соль находится. В) В бюксах находятся кристаллические вещества: нитрат свинца, хлорид марганца, хлорид аммония, карбонат аммония, фосфат кальция, сульфат магния, карбонат цинка, сульфат алюминия, р-р метилоранжа, вода и растворы кислоты и щелочи. Определите состав бюксов. 8. ОВР 9.Задачи на «газовые законы» Стандартные условия 1Атм=101325Па=760мм.рт.ст R=8,314 кДж/моль 10С=273К 1 моль=6,02*1023 частиц 1мм.рт.ст=133,3 Па А) Смесь гелия и аргона массой 5г занимает объем 10л при 250С и 1Атм.Определите состав смеси в процентах по массе. Б) В сосуд емкостью 5,6л поместили 75г карбоната кальция. Сосуд закрыли и нагрели до 400 0С до полного разложения соли. Определите давление в сосуде при этой температуре. 10. Задачи на знание физических свойств веществ (с использованием отвлекающих данных) А) Соль А термически разлагается с образованием оксида Б двухвалентного металла, который содержит 80% металла, бесцветного газа В и бурого газа Г.Оксид Б при восстановлении водородом при нагревании образует растворимое в азотной кислоте вещество Д.При растворении Д в азотной кислоте образуется раствор соли А и выделяется газ Г, объемом 100мл при 200С и давлении 2Атм. Определите вещ-ва А-Д.Вычислите массу исходной соли А. Б) Соль А при взаимодействии с раствором нитрата серебра образует осадок белого цвета и окрашивает пламя в желтый цвет. При взаимодействии конц. Серной кислоты с солью А при нагревании образуется газ Б, который растворили в воде. Раствор полученного вещ-ва В полностью реагирует с 52,2г оксида Г, содержащего 63,21% четырехвалентного металла Д с получением газа Е, способного обесцветить влажную окрашенную ткань. Определите вещ-ва А-Е. Вычислите кол-во исходной соли А и объем газа Б (н.у). 11. Задачи на молярную концентрацию А) Смешали равны объемы (по 0,5л) 0,5М растворов сульфата меди и гидроксида калия. Какие ионы и какой молярной концентрации останутся в растворе ч/з 10 мин? Б) К трем порциям 0,1М раствора серной кислоты объемом 20мл прилили: а) 10мл 0,4М раствора гидроксида калия, б) 80мл 0,025М раствора гидроксида натрия, в) 30 мл 0,25М раствора гидроксида калия. Рассчитайте молярные концентрации продуктов в каждом случае. Укажите рН-среды растворов. 12.Задачи на термохимические расчеты. 13.Задачи на кинетику. 14. Задачи смешанного типа 15. Ряды превращений. Желаю успеха во всех начинаниях!!!

