Клинико-эпидемиологические особенности острого лейкоза
advertisement
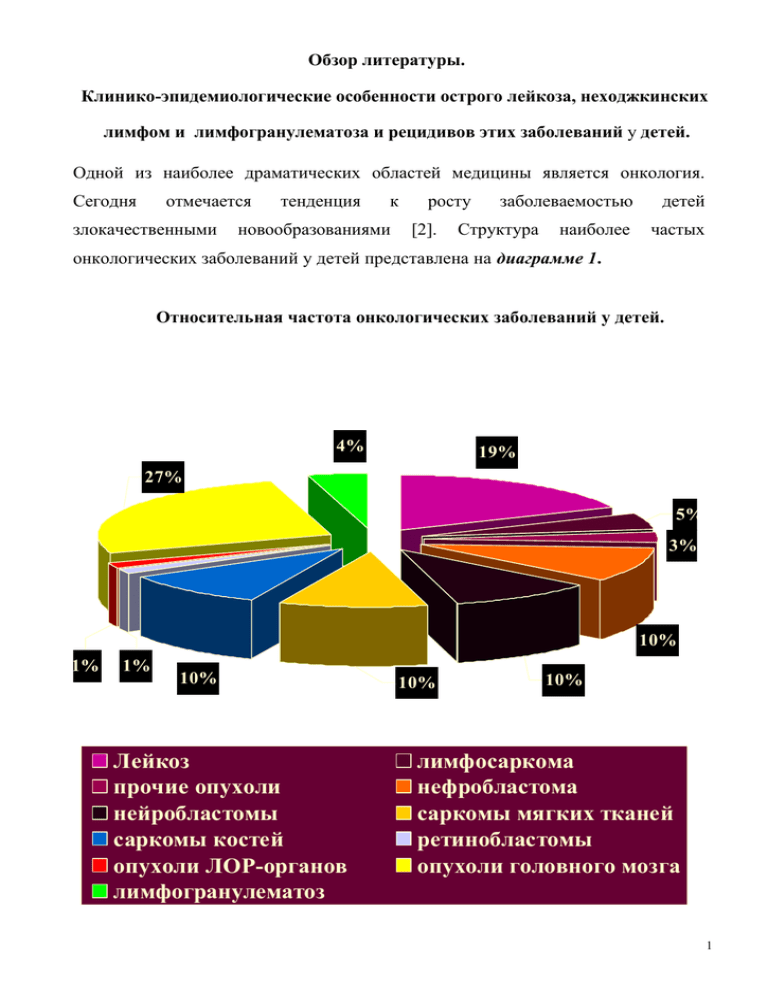
Обзор литературы. Клинико-эпидемиологические особенности острого лейкоза, неходжкинских лимфом и лимфогранулематоза и рецидивов этих заболеваний у детей. Одной из наиболее драматических областей медицины является онкология. Сегодня отмечается злокачественными тенденция к новообразованиями росту [2]. заболеваемостью Структура наиболее детей частых онкологических заболеваний у детей представлена на диаграмме 1. Относительная частота онкологических заболеваний у детей. 4% 19% 27% 5% 3% 10% 1% 1% 10% Лейкоз прочие опухоли нейробластомы саркомы костей опухоли ЛОР-органов лимфогранулематоз 10% 10% лимфосаркома нефробластома саркомы мягких тканей ретинобластомы опухоли головного мозга 1 Как видно из диаграммы, в детском возрасте наиболее частыми являются опухоли кроветворной и лимфоидной тканей (33%). Из гемобластозов существенно преобладает острый лейкоз (19%), как правило, лимфобластный (65%) по сравнению с миелоидным (2%) и очень редко (в отличие от взрослых) встречаются хронические лимфатических узлов формы часто лейкозов встречаются (3%). Среди лимфосаркома поражений (неходжкинская лимфома) (около 10%) и лимфогранулематоз (болезнь Ходжкина) (4%). Среди злокачественных опухолей различных органов и тканей наиболее часто диагностируются опухоли центральной нервной системы (около 27%), реже почек (нефробластома)-10%, нейробластома-10%, саркомы костей и мягких тканей (10%), и пр. опухоли 3%. Редкость злокачественных новообразований у детей по сравнению со взрослыми придает особую значимость достоверности статистических показателей заболеваемости и смертности, больных в этом возрасте. Цифры официального общего показателя заболеваемости детей злокачественными новообразованиями в России составляет - 9,5-13 на 100 тыс. детского населения также в основном связаны с недоучетом. Среднее число ежегодно регистрируемых детей со злокачественными опухолями увеличилось за последнее десятилетие на 20% и достигло 6,45 тысяч. Острый лейкоз (ОЛ) - группа заболеваний, злокачествен, ной клональной пролиферацией характеризующихся гематопоэтических клеток, коммитированных в определенном направлении, с выселением и угнетением нормальных гемопоэтических ростков из костного мозга и пролиферацией, в основном, в ретикуло-эндотелиальных органах и центральной нервной системы [2]. Установлено, что пик заболевания приходится на возраст от 2 до 5 лет с постепенным уменьшением числа заболевших в возрасте 7 лет и старше. Менее заметный рост числа заболевших приходится на возраст 10—13 лет. Мальчики болеют ОЛ заболеваемости чаще (53,8%), мальчиков и чем девочки девочек - (46,2%) (т.е. 1.1:1.2-1.3:1.0) соотношение [3,4,54]. Эта закономерность особенно отчетливо прослеживается в возрастном периоде от 2 2 до 5 лет, когда формируется так называемый младенческий пик возрастной заболеваемости ОЛ. В возрасте 10—13 лет заболеваемость ОЛ имеет примерно одинаковый уровень [3,5,6]. Частота лейкозов у детей в России составляет 3,2—4,4 на 100 000. В Республике Мордовия заболеваемость ОЛ по данным 2003 года составляет 3,54,2 случая на 100 000 детского населения. В целом эти цифры остаются стабильными на протяжении последних лет [5,6]. В детском возрасте наиболее чаще регистрируются ОЛЛ -75%; остальное число представлено острым нелимфобластным лейкозом (ОНЛЛ) - 18-20% [3,6,9]. Считается, что возникновение острого лейкоза следующие факторы: (чаще всего); наследственные: Фанкони, синдром ICF, синдром поломки могут обусловить Синдром Блума, анемия Nijmegen, синдром Seckel "птицеголовые карлики", пигментная ксеродерма, атаксия телеангиэктазия. До настоящего времени этиология ОЛ окончательно не установлена. Современная концепция этиологии и патогенеза основана на предположении об этиологической роли различных эндо - и экзогенных факторов (онкогенные вирусы, неблагоприятные факторы внешней среды, ионизирующая радиация и т. д.), приводящих к мутации соматических или зародышевых клеток, относящихся к системе кроветворения [2,56]. Получены убедительные доказательства участия вирусов в развитии некоторых форм лейкозов у человека и животных [10,57]. Здесь речь должна идти, прежде всего, о вирусе ATLV (вирус Т-клеточного лейкоза взрослых), который при культивировании с лимфоцитами вызывает их трансформацию и передается горизонтальным путем [2,58]. Из других вирусов, способных участвовать в лейкемогенезе, можно выделить вирус ЭпсштейнаБарра, который вызывает лимфому Беркитта у детей в некоторых районах Африки и поражает только В-лимфоциты. Очень активно изучаются ретровирусы, как возможные этиологические факторы в патогенезе лейкозов [2,59]. Потенциально опасными являются вирусы, несущие в своем аппарате онкогены, которые в течение несколько суток способны индуцировать опухоль. Активация онкогена может привести усилению пролиферации и 3 разобщению, сцепленных в норме, процессов дифференцировки и пролиферации. [2,11,60]. Согласно клоновой теории, рост лейкозной популяции происходит из одной клетки, и скорость роста зависит от доли активно пролиферирующих клеток, их генерационного времени, числа клеток с ограниченной продолжительностью жизни, скорости потери клеток. Когда лейкемическая популяция достигает определенной массы, происходит торможение дифференцировки нормальных стволовых клеток и резко падает нормальная продукция [18,54]. Итак, для возникновения лейкемического перерождения клетки необходимы следующие условия: высокий пролиферативный потенциал, наличие богатой рецепторами поверхности, клональная изменчивость, внешние и внутренние мутагены. Всем этим условиям отвечают клетки гемпоэтической и лимфоидной системы у детей [4,19]. В результате многих исследований выявлено, что 75% заболевших ОЛ проживало в экологически неблагополучных районах [10,20]. Заболевание возникло при наличии проф. вредностей у родителей в 25% и отягощенной по онкологической патологии наследственности - в 22,5% случаев [20, 21]. Чаще ОЛЛ возникал у редкоболеющих детей (62,5%), причем аллергия в анамнезе отмечалась редко (12,5%) [20,22]. Примечателен факт частой встречаемости патологии у детей с 0(l)Rh+ и A(2)Rh+ группами крови (35,0% и 37,5% соответственно) [14,20,63]. Считается, что внутриматочное облучение плода, при диагностических рентгенологических исследованиях значительно повышает риск заболевания ОЛ для будущего ребенка [14,16]. Большой интерес представляет влияние предшествующего облучения на риск развития лейкемии у потомства. Существуют прямо противоположные данные о роли предшествующего облучения родителей. Одни свидетельствуют о повышенном риске для детей [4,18,23], другие этой связи не показывают [14,64]. Постнатальное диагностическое обследование также, по-видимому, не повышает риск заболевания, хотя хорошо известно, что лечебная лучевая терапия может стать причиной развития не только ОЛ, но и других злокачественных опухолей [14]. Влияние электромагнитных полей на развитие 4 детских лейкозов в настоящее время интенсивно изучается в ряде стран (США, Германия, Канада и Великобритания) [65,66]. Существуют исследования, в которых демонстрируется связь повышенной заболеваемости ОЛЛ и ОНЛЛ у детей, матери которых имели в анамнезе выкидыш, что может быть связано с однотипным влиянием факторов окружающей среды или с врожденным генетическим дефектом [20,56]. Однако исследования такого рода продолжаются, и окончательные выводы еще предстоит сделать в будущем. По крайней мере, в 9 исследованиях указывается, что дети с высоким весом, при рождении имеют в 2 раза больший риск заболеть ОЛЛ и, наоборот, среди заболевших ОЛЛ практически не встречалось маловесных детей. Однако эти исследования касались только развития ОЛЛ у детей до года [12,14]. Относительно других групп, достоверных данных о повышенном риске заболеваемости ОЛЛ, связанном с весом при рождении нет. В настоящее время существуют четкие данные о риске заболевания ОНЛЛ детей, матери которых употребляли алкоголь во время беременности. В частности, исследованиями последних лет [5,21] установлено, что этот риск особенно велик для некоторых типов ОНЛЛ. Более того, указывается также и на умеренный риск заболевания ОЛЛ. Относительно влияния курения, данные тоже противоречивы: в некоторых публикациях просматривается связь с повышенной заболеваемостью ОЛ [5,14] , тогда как другие этой связи не находят [67]. Клиническая практика показала, что ОЛ у детей не однороден как по клиническим проявлениям, реакции на терапию, так и по прогнозу заболевания. Это послужило основанием к попыткам разделить ОЛ на более однородные по течению и прогнозу группы. [11,68,69]. В 1976 классификация году была острых принята лейкозов на франко-американо-британская основании (FAB) цитоморфологических и цитохимических исследований с выделением ОЛЛ 3-х типов: LI, L2, L3 и Ml (малодифференцированный миелобластный лейкоз), М2 (высокодифференцированный миелобластный лейкоз), МЗ (промиелоцитарный лейкоз), М4 (миеломонобластный лейкоз), М5 (монобластный лейкоз), М6 5 (эритромиелоз), М7 (мегакариоцитарный лейкоз), М8 (эозинофильный лейкоз). Отдельно выделяется недифференцированный острый лейкоз с типом клеток LO/MO [4,24,70]. Согласно этой классификации, ОЛЛ с клетками типа L1 чаще встречается у детей и имеет лучший прогноз. Лимфобластный лейкоз L2 встречается как у детей, так и у взрослых. У детей возможно сочетание вариантов, типа L1/L2; L2/L1 [71]. Разработка гибридомной технологии с использованием спектра высокоспецифических моноклональных антител для идентификации дифференцировочных антигенов лимфоцитов позволила выявить значительное число генетически более однородных субвариантов ОЛЛ у детей, при которых фенотип бластных клеток соответствует ранним стадиям онтогенеза лимфоидных клеток предшественников [5,27]. Выделяют такие субварианты как Tl, T2, ТЗ, общий, la-подобный, пре-В, В, «нулевой». Было показано, что среди всей популяции ОЛЛ в 70—75% случаев встречается «нулевой» вариант заболевания, дающий 90% полных ремиссий. Этот вариант является «благоприятным» по своему течению и ответу на терапию. Большинство детей с данным вариантом имеет 5-летнее безрецидивное течение заболевания. В 20% случаев встречаются Т - ОЛЛ с достижением полных ремиссий в 80—85% случаев. Еще более редко встречается В-ОЛЛ (4—5% случаев), характеризующийся неблагоприятным прогнозом [25,28,29,73]. Различные морфологические варианты ОЛ характеризуются хромосомными аномалиями, что важно для диагностики и прогнозирования заболевания. Для ОЛ у детей с неблагоприятным прогнозом характерны следующие транслокации: t(4,11) и t(9,22), делеция длинного плеча хромосомы 6 и 14 (маркеры 6q и 14q). Высокая частота ремиссий наблюдается у больных с нормальным кариотипом (46XX и 46 XY), а наличие в кариотипе бластов с более 50 хромосомами, является прогностически самым неблагоприятным в течение заболевания. Гиперплоидность наблюдается при пре - пре-В клеточном варианте ОЛЛ и является самым неблагоприятным фактором прогноза. Разделение большой неоднородной группы острых миелоидных лейкозов на три прогностические подгруппы в зависимости от особенностей кариотипа 6 предложено около 20 лет назад (Heim et Mitelman, 1995). За прошедшие годы классификация изменилась и продолжает меняться. Это обусловлено накоплением новых знаний о клиническом значении неслучайных хромосомных аномалий. Неблагоприятными в прогнозе являются кариотип t(3;3) аномалии 11q23,-7,-5, del5q, характеризующийся высоким риском развития вторичных ОМЛ.Клиническая картина ОЛ складывается из комплекса синдромов: анемический, интоксиционный, пролиферативный, геморрагический, костно-суставной, синдром специфического поражения яичек и яичников, синдром специфического поражения кожи и слизистых оболочек, синдромы поражения почек, сердечнососудистой, дыхательной системы, поражение нервной системы, выраженность которых значительно варьирует при разных формах заболевания. Не редко острый лейкоз манифестирует под маской интеркуррентного заболевания (ангина, грипп, пневмония, стоматит) [4,5]. Диагноз ОЛ основывается на сопоставлении всего комплекса клинических проявлений, данных цитологического исследования клеток периферической крови с обязательным подсчетом общего количества тромбоцитов и данных исследования костного мозга [5]. Современный анализ миелограммы включает проведение морфологического цитохимических исследований, исследования клеток иммунологического костного мозга, фенотипирования и цитогенетических исследований [28,31,61]. На этапе разработки находятся новые методы диагностики и прогнозирования острого лейкоза [32,35]. Основная цель терапии ОЛ у детей в настоящее время — излечение. Эффективность терапии, достигаемая современными программами очень высока и составляет для ОЛЛ 65-75%. Первая полная ремиссия достигается в 85-90% случаев. Эффективность лечения ОНЛ ниже и составляет 40-50%. Приведенные цифры отражают пятилетнюю безрецидивную выживаемость и могут рассматриваться как выздоровление [1,6,75]. Наибольшее распространение в России получили программы терапии ОЛ, разработанные исследовательской группой BFM (Berlin- Frankfurt - Германия). В их основу положено активное использование химиотерапии.Разрабатываются и другие методы лечения,такие 7 как иммунотерапия, химиоимуннотерапия, тотальное облучение , но они пока не получили широкого клинического применения, а испоьзуются пока только на экспериментальных моделях. Последними разработками исследовательской группы BFM являются: ALL BFM 90 - для ОЛЛ, ALL - REZ BFM 90 - для лечения рецедивов ОЛЛ, ALL BFM 87 - для лечения ОНЛЛ [2]. Современный подход к лечению лейкозов базируется на нескольких принципах. Главным из них является программность химиотерапии. Под программностью следует понимать строгое соблюдение всех компонентов выбранной для лечения терапевтической схемы. Большинство схем включает в себя индукцию клинико-гематологической ремиссии, консолидацию, реиндукцию (повторную индукцию) и поддерживающую терапию [1,77,78]. Самопроизвольное внесение изменений в химиотерапевтические протоколы резко снижают шансы на успех. Поэтому недопустимо изменение доз химиопрепаратов, предусмотренных программой лечения. Огромное значение имеет сопроводительная терапия лейкозов, включающая в себя психологическую помощь пациенту, его членам семьи, профилактику инфекционных осложнений и заместительную терапию компонентами крови [35,36]. Точное соблюдение химиотерапевтической программы дает возможность в определенной мере прогнозировать развитие событий [37,38]. В настоящее время при остром лейкозе у детей принято выделять факторы прогноза: • морфология (L 1, L 2, L 3) • цитохимия • клиника - гиперпластический синдром • иммунофенотип • классическая и молекулярная генетика • ответ на лечение • цитокинетика • клиренс цитостатиков В таблице 1 изложены основные прогностические признаки, на основании которых формулируется прогноз заболевания для каждого больного. 8 Таблица 1. Прогностические признаки при остром лейкозе у детей. Фактор прогноза благоприятный Период от начала болезни до постановки < 3 мес. неблагоприятный > 3 мес. диагноза Возраст до 2 и свыше 10 лет 2-10 лет больного Увеличение периферических <2см > 2 см лимфатических узлов Увеличение печени <4 см >4 см Увеличение селезенки Поражение центральной нервной системы Лейкоцитоз <4см нет до 20,0*10 9/л >4см есть св. 20,0*10 9/л Гемоглобин > 70 г/л < 70 г/л Тромбоциты Иммуноглобулины > 100,0*10 9/л норма < 100,0*10 9/л снижены Морфология бластов (ФАБ-классификация) LbM3 L2, L3, M5j M4 Иммунология бластов Кислая фосфатаза / Шик реакция Т и В клеточные При этом учитывается «общий» АГ возраст больных, степень увеличения лимфатических узлов, селезенки и печени, число лейкоцитов, наличие бластов в периферической крови в момент постановки диагноза, морфологическая и иммунологическая характеристика бластных клеток [4,25,73]. Следующий вопрос, требующий обсуждения, касается гетерогенности прогностических групп, выделенных на основании особенностей кариотипа, и, в частности, группы с благоприятным прогнозом. Как известно, 5-летняя выживаемость у больных этой группы составляет 60-70%. До начала лечения или в период клинико-гематологической ремиссии невозможно предсказать, кто именно попадет в эти 60-70%, а у кого разовьется ранний рецидив. Однако известен целый ряд клинических показателей, ассоциированных с худшим прогнозом, а именно с более частым развитием ранних рецидивов при ОЛ. Среди таких показателей следует отметить экспрессию антигена CD56 на 9 бластных клетках, недостаточное снижение количества бластных элементов в костном мозге на 14-21 день лечения, дополнительные аномалии кариотипа, высокий лейкоцитоз на момент установления диагноза (Schoch et al, 1996; Baer et al., 1997; Daniels et al., 1999; Peniket et al., 1999; Ferrara et al., 2000). Имеются также сообщения о том, что признаки дисплазии клеток остаточного (нелейкозного) эритроидного и мегакариоцитарного ростков костного мозга до лечения предвещают невысокую эффективность терапии при ОНЛЛ de novo (Tamura et al., 1998; Lemez et al., 2000). Относится ли это к лейкозам из благоприятной прогностической группы, пока не ясно. Выявление в каждом случае ОЛ прогностически неблагоприятных симптомов еще на этапе постановки диагноза может оказаться полезным для оптимизации протоколов лечения. Низкая эффективность физиологическими лечения особенностями детей до постнатального года связывается развития и с особой злокачественностью В -лимфолейкоза, характерного для этого возраста. После 12 лет относительно неблагоприятный прогноз, возможно, связан с пубертатным периодом, особенностями гормонального статуса больных [4]. Анализ других публикаций, представленных в литературе, также показывает, что наиболее существенно влияют на неблагоприятный гиперлейкоцитоз периферической крови (более 20,0x10 исход ОЛЛ /л), увеличение 9 селезенки и печени (более чем на 5 см ниже реберной дуги), а в некоторых случаях L2 морфологический вариант заболевания [22,31,74]. При характеристике ОМЛ неблагоприятными признаками являются факторы, от которых зависит прогноз ОМЛ у детей. К клиническим можно отнести возраст, пол, анамнез, размеры паренхиматозных органов, выраженность геморрагического синдрома, инициальное поражение ЦНС, время наступления ремиссии, количество курсов химиотерапии. Среди лабораторных прогностических факторов выделяют чувствительность бластных клеток к химиопрепаратам in vitro, количество лейкоцитов в анализе периферической крови, FAB-вариант ОМЛ, уровень фибриногена, уровень лактатдегидрогеназы, наличие палочек Ауэра в бластах. Прогноз при ОМЛ зависит от FAB10 морфологического варианта, данных генетического исследования и иммунофенотипа бластных клеток. Так, наиболее благоприятную группу составляют больные с морфологическими вариантами М1, М2 с t(8;21), t(9;11), М3 с t(15;17) или М4 с inv(16). В неблагоприятную для прогноза группу входят больные с вариантами М4 без inv(16), М5, М6 и М7, а также пациенты, при исследовании кариотипа опухолевых клеток которых были выявлены следующие хромосомные аномалии: t(9;22), t(6;11), t(10;11), del5q-, del7q-, моносомии -5, -7. Кроме того, обзор литературных данных, показывает, что на прогноз ОМЛ неблагоприятно влияет экспрессия эритроидных и В-линейных антигенов на поверхности бластов. Для риска развития рецидива по программе MBFM-90 В большей степени имеют значение два иммунологических признака (экспрессия CD38 и CD34) [22]. За редким исключением рецидив любой злокачественной опухоли - событие прогностически значительно более серьезное, чем диагноз первичной опухоли, поскольку лечение рецидива намного сложнее и менее эффективно [42]. Прогностическое значение имеет мониторинг минимальной резидуальной болезни (МРБ) как при остром миелоидном лейкозе, так и при ОЛЛ. Для изучения этого вопроса методом полимеразной цепной реакции с обратной транскрипцией ОТ-ПЦР исследуется экспрессия специфических химерных генов. Несмотря на прогресс в результатах лечения ОЛ, лечение рецидивов ОЛЛ и ОМЛ до настоящего времени все еще остается большой проблемой в детской онкологии. Рецидивы при ОЛЛ возникают чаще, за счет большей встречаемости в группе, рецидивов ОМЛ в структуре детской онкологической заболеваемости намного меньше, но они хуже поддаются лечению таблица 2. 11 Таблица 2 Распространенность рецидивов ОЛ по данным 2003 НИИ ДГ М З. Диагноз ОЛЛ Рецидив ОЛЛ ОМЛ Рецидив ОМЛ Количество случаев за 1 год Количество случаев на 1 миллион у детей до 15 лет детей в возрасте до 15 лет 2484 30.9 617 7.7 454 5.6 50 3.5 В зависимости от локализации и времени возникновения рецидива различают: ранний рецидив (рецидив, возникающий в период до 6 месяцев после окончания терапии предшествующего заболевания (первичного ОЛ или его рецидива); сверхранний рецидив (рецидив, возникающий в первые 18 месяцев после первичной постановки диагноза); поздний рецидив (рецидив, который возникает позднее 6 месяцев после окончания терапии последней манифестации ОЛ). По локализации: изолированный костно-мозговой >25% бластов в костном мозге экстрамедуллярный - тестикулярный, нейролейкемия, другие комбинированный - экстрамедуллярный + > 5% бластов в костном мозге Нейролейкоз: об изолированном рецидиве говорят тогда, когда у больного определяется 10 и более лейкемических клеток в мкг ликвора или есть характерные для поражения центральной нервной системе при ОЛ неврологические симптомы 12 без сопутствующего поражения костного мозга и других органов. Если количество бластов в костном мозге 5% и больше, то говорят о комбинированном рецидиве [2,4]. В развитии ЦНС рецидива большую роль играют генетические связи (гемопоэз в хориональном сплетении у 18 мм эмбриона; Fc-рецепторы на клетках микроглии). Проникновение бластных клеток в ЦНС: прямой путь из костного мозга костей черепа по адвентициям венул и оболочкам нервов, через системный кровоток путём миграции через венозный эндотелий и в местах геморрагий. Чрезвычайно низкая скорость пролиферации, повторное заселение бластными клетками костного мозга. Можно предположить, что сочетание анемии с развившейся гипоксией и гипоксимеческой энцефалопатией, тромбоцитопения с нарушением свертываемости крови влияют на проницаемость сосудистой стенки наиболее васкуляризованного региона, каким является ЦНС. Увеличение массы лейкозных клеток в циркулирующей крови (гиперлейкоцитоз, выраженная лейкозная метаплазия костного мозга) создает условия для раннего метастазирования в ЦНС. Тестикулярный рецидив: при изолированном тестикулярном рецидиве количество бластов в костном мозге не должно превышать 5%. Если количество бластов в костном мозге 5% и более, то говорят о комбинированном рецидиве [2,19]. Специфическое поражение половых желез является отдаленным клиническим симптомом патоморфоза на фоне лечения ОЛ. Риск развития тестикулярных рецидивов увеличивается с исходным гиперлейкоцитозом, анемией, тромбоцитопенией, гиперплазией периферических и медиастинальных л/у. Возможны другие локализации первичного рецидива: в кожу, кости, глазницу, средостение, изолированный лимфоузел или миндалину [2,54]. Изучение различных механизмов становления и развития рецидивов, возникновение которых, к сожалению, отмечается даже при строгом соблюдении всего комплекса комбинированного химиолучевого воздействия, представляет большой интерес [41]. Резистентность опухолевых клеток к химиопрепаратам является основной причиной рецидивов заболевания и смерти большинства больных (90%) [Young, 1990; Effert et al., 1992; Bashir et al., 1993]. Различают несколько факторов 13 развития резистентности, к ним относятся: 1) фармакокинетическая резистентность (низкая концентрация препарата в опухоли, плохая васкуляризация опухолей, высокое внутриопухолевое давление); 2) физиологическая резистентность (влияние рН в опухоли); 3) опухолевая ростовая кинетическая резистентность (низкая фракция делящихся клеток); Существует два основных механизма возникновения клеточной лекарственной резистентности: 1) экспрессия специфических белков, отвечающих за "нейтрализацию" химиопрепарата в опухолевой клетке. К таким белкам относятся Pgp170, MRP, LRP, глутатион-трансфераза П и т.д.; 2) нарушение механизма гибели клеток под действием химиопрепаратов. К этому механизму относится блокирование апоптоза при мутациях р53, гиперэкспрессии Bcl-2, уменьшение экспрессии CD95 и т.д. Недавно было показано, что противоопухолевые препараты могут действовать через CD95(Fas/APO-1) рецептор-лигандную систему, индуцируя экспрессию лиганда. Взаимодействие Fas-лиганда с экстрацеллюлярным доменом Fas-рецептора может приводить к его тримеризации и активировать процесс программируемой клеточной гибели. Отсутствие экспрессии CD95 рецептора в опухолевых клетках может приводить к их ускользанию от иммунологического контроля и блокированию запуска апоптоза, вызванного химиотерапией. Экспрессия CD95 рецептора и его связь с прогнозом исхода заболевания плохо изучены в солидных опухолях. Однако, при остром лимфобластном лейкозе (ОЛЛ) у детей и миелодиспластическом синдроме (МДС) экспрессия рецептора CD95 имеет прогностическое значение. Было показано, что у детей больных ОЛЛ с CD95+ бластами медиана 10-летней выживаемости не была достигнута, тогда как в CD95-отрицательной подгруппе этот показатель составил 24 мес. Больные МДС, чьи клетки костного мозга экспрессировали этот антиген, имели лучшую выживаемость по сравнению с больными с CD95-отрицательными клетками. 14 В исследованиях Johnstone R.W. c соавт. лейкемические линии клеток, экспрессирующие ген mdr-1, в отличие от их родительских mdr-1-линий, были резистентны к воздействию рекомбинантного FasL и -радиации, индукторов Fasопосредованного апоптоза 19. В опытах Friesen C. с соавт. отмечалось подавление расщепления ПАРП и апоптоза в mdr-1+, но не в mdr-1- клетках, после воздействия на них как FasL, так и цитостатиков. Повышенная резистентность в mdr-1+ линиях клеток к апоптозу не была вызвана снижением захвата или повышением выброса цитостатиков из клетки и, вероятно, была связана со снижением экспрессии FasR на mdr-1+ клетках, а также отсутствием повышения экспрессии FasL в ответ на воздействие цитостатиков 15, 16, хотя это не было подтверждено другими авторами 11. Принято считать, что субстратом последующего рецидива является так называемая резидуальная бластная популяция, т.е. колоногенные лейкемические клетки, пережившие атаки химиопрепаратов и сохранившие способность к пролиферации [36 ]. Наиболее важные из предпологаемых причин недостаточной противолейкемической эффективности химиотерапии следующие: 1. Воздействию цитостатических агентов в наибольшей степени подвергаются клетки, находящиеся в фазе митоза. Бласты, которые в момент индукционной терапии находятся вне митотической фазы клеточного цикла, могут составить рецидуальную популяцию. Более того, показано, что синтез ДНК значительно усиливается в лейкемических клетках через 7 дней после экспозиции к цитостатикам [37,43]. 2.Недостаточное накопление цитостатических препаратов в лейкемических клетках [37]. 3.Цитостатические препараты могут подвергаться «обратному транспорту» из опухолевых клеток при помощи Р-170, расположенного в мембранах клеток. Как показывают исследования, блокировать этот процесс можно, если вводить больному одновременно с цитостатиками высокие дозы веропамила, хинидина, циклоспорина А [5,37]. На клеточном уровне противоопухолевая защита осуществляется клетками лимфокинактивированными киллерами. Низкий уровень или недостаточная их 15 активность у больного может служить причиной того, что из резидуальной бластной популяции развивается клинический рецидив заболевания [37,54 ]. При ОЛ рецидив возникает у 30-70% больных. Причем 43,8% случаев диагностируется ранний рецидив, у 56,2% больных возникают поздние рецидивы, в большинстве случаев экстрамедуллярного характера, в сроки от 0,5 года до 4 лет после отмены терапии [5,9]. Изолированный рецидив наблюдается в 62,5% случаев, у 37,5% комбинированный рецидив [9]. При этом на долю костномозгового рецидива приходится 75%, примерно у 7-10% больных происходит рецидив лейкоза в центральную нервную систему [3,9,43]. Отмечено, что нейролейкоз чаще развивается при лимфобластном цитоморфологическом варианте ОЛ. У мальчиков нейролейкоз встречается в 2 раза чаще, чем у девочек. В большинстве случаев (55-60%) нейролейкоз диагностируется в период полной костномозговой ремиссии. В 30-35% случаев сочетается с генерализованным рецидивом [42,45,59]. Если нейролейкоз развивается, как правило, по протяжении 1-2 лет ремиссии, то специфическое поражение половых желез считается отдаленным клиническим проявлением патоморфоза леченого лейкоза и, как правило, развивается на фоне продолжающегося костномозгового благополучия [14,41]. Рецидивы ОЛ в яички объяснятся наличием гемато - орхического барьера и незначительным проникновением химиотерапевтических препаратов в ткань яичка. Из обзора литературных данных большинство больных с рецидивами ОЛ получают прорецидивное лечение по протоколам ALL-REZ BFM-83, 87, 90, Для предотвращения развития ранних и поздних рецидивов ОЛ в клинической практике стали использоваться методы ранней и поздней интенсификации повышенными дозами метотрексата в дозах от 1 до 5г/м^2, цитозара, преднизолона интратекально, практически полный отказ от краниального облучения у больных стандартных групп риска. Применение промежуточных доз метатрексата (500мг/м^2) в период консолидации ремиссии значительно снидает частотку тестикулярных рецидивов у мальчиков. аспарагиназы и Назначение циклофосфана, L- применение иммунокоррегирующей терапии (левамизол, тактивин, человеческий лейкоцитарный интерферон, реаферон) в остром 16 периоде заболевания и в ремиссии [35,48,50]. На фоне такой терапии у 60-70 % детей с ОЛ отмечались полные ремиссии продолжительностью свыше 5 лет [9,51,78]. Но даже в самых оптимистических сообщениях шансы на выздоровление после рецидива не превышает 25% [44]. Поэтому основными направлениями в лечении рецидивов ОЛ у детей станут: химиотерапиярандомизация в индукции, блоктерапия против продолжительной терапии, жёсткое соблюдение интервалов между инициальными блоками, сдвиг только по клиническим показаниям, поддерживающая терапия: замена 6-TG на 6-MP, МТХ еженедельно per os вместо внутривенных двухнедельных введений, MRD мониторинг. Таким образом, в ходе анализа доступных нам литературных источников, сложилось впечатление, что эффективность проводимой программной терапии ОЛ зависит не только от адекватного соблюдения протоколов лечения, но и в значительной степени от того, насколько полно и грамотно учитываются прогностически благоприятные и, особенно, неблагоприятные факторы в развитии последующих рецидивов костно-мозговой опухоли. Неходжкинские лимфомы (НХЛ) - системные злокачественные опухоли иммунной системы, субстратом которых являются клетки внекостной мозговой лимфоидной ткани гистогенетической принадлежности и степени дифференцировки, определяющей их гетерогенность. Распространенность по Республике Мордовия 0,9 – 1,1 случаев на 100 000 детей/год, 3-я по частоте встречаемости опухоль у детей. Эти опухоли характеризуются некоторыми положениями: опухоли высокой степени злокачественности с диффузной гистологической структурой; развиваются из относительно зрелых предшественников Т- и В линий лимфопоэза; быстрая генерализация с вовлечением костного мозга и центральной нервной системы; все детские НХЛ являются первично-генерализованными; высокий пролиферативный потенциал, быстрый рост и высокая 17 чувствительность к полихимиотерапии; высокая частота экстранодальных локализаций. Эпидемиологические исследования, позволившие выявить определенное увеличение случаев заболевания НХЛ, дали основание для предположения о возможной вирусной природе некоторых форм. Это особенно важно для лимфомы Беркитта, которая по встречаемости у детей занимает первое место. Индуцирующим фактором в развитии заболевания является вирус Эпштейн-Барра (ЭБВ). Под воздействием вируса в T и B клетках возникают хромосомные транслокации в генах и развитие опухолевого роста. При B-клеточных лимфомах классическая транслокация t(8,14) вовлекает локус 24 длинного плеча хромосомы 14, где расположен ген синтеза тяжелых цепей Ig, и происходит развитее опухоли. При T-клеточной лимфоме происходят транслокации t(10,14), t(11,14) t(14,14), а при Ki-лимфоме t(2,5). Частота лимфом у больных с иммунодефицитами в 10000 раз превышает таковую в общей популяции, аналогичной по возрасту. Атрофия или отсутствие вилочковой железы, проявление аутоимунизации и особенно наличие структурных хромосомных изменений в лимфоидных клетках способствуют развитию опухоли. Выделение различных вариантов НХЛ, основанное изначально только на морфологических особенностях опухолей, в настоящее время базируется на иммунофенотипических характеристиках опухолевых клеток и является комплексным, учитывающим клиническую картину и другие биологические особенности. В настоящее время в мире используется классификация, учитывающая все эти характеристики неходжкинских лимфом, получившая название REAL (Европейско-Американский пересмотр опухолей лимфоидной ткани). На основании интегральной оценки значения каждого параметра все варианты НХЛ разделены на две группы по происхождению: В - и Т - клеточные варианты и на две основные группы по прогнозу: опухоли высокой или низкой степени злокачественности. Клиническая картина НХЛ зависит от локализации первичного очага. Выделяют две лимфатических формы: поражение мезентериальных и забрюшинных узлов и поражение желудочно-кишечного тракта (чаще всего 18 опухоль локализуется в области илеоцекального отдела кишечника). Заболевание длительное время может протекать бессимптомно. Затем могут отмечаться интенсивные боли в животе, похудание, тошнота, рвота, потеря аппетита. Увеличиваются печень и селезенка. Морфологически это чаще всего B-клеточная опухоль. На втором месте по частоте НХЛ определяются в переднем средостении с поражением внутригрудных лимфатических узлов и вилочковой железы. Поражение средостения у детей составляет от 13 до 30% от общего число заболевших. У больных рано появляются кашель, одышка, затрудненное дыхание. Возникает “синдром верхней полой вены” с резким нарушением дыхания, отеком и цианозом лица, шеи, верхней половины грудной клетки. Наиболее часто поражаются л/у передней группы (78,1%) и вилочковой железы (70,7%). Реже встречается увеличение трахеобронхиальных (29,6%), бронхопульмональных (26,8%), л/у корней легких (17%). Морфологическим субстратом при НХЛ средостения являются T-клетки. Часто имеет место экстранодальный рост опухоли: поражение печени, яичников, молочных желез, иногда наблюдается поражение костного мозга (20%) и оболочек головного мозга (10%)-это наиболее агрессивно текущая форма среди B-клеточных опухолей. В (9%) случаев поражается глоточное (Вальдейеро кольцо), сопровождается изменением ритма дыхания, ощущением инородного тела при глотании. Поражение периферических лимфатических узлов может быть локализованным и генерализованным. Наиболее часто в процесс вовлекаются л/у шеи, подчелюстной области, реже подмышечные и паховые. Лимфатические узлы, плотные, безболезненные, не спаянные с окружающими тканями, часто сливаются в когломераты. При биохимическом исследовании крови у больных с распространенным опухолевым процессом характерно наличие B- симптомов (снижение массы тела более 10%, лихорадка, потливость), резко повышенные показатели лактат дегидрогеназы (ЛДГ) > 500 ЕД./л; церулоплазмина и гаптоглобина в сыворотке крови > 200 ЕД./л/. В диагностике при подозрении на опухоль назначают: анализы крови, Rграфические и ультразвуковые исследования; компьютерная томография (ЯМР, сцинтиграфия), исследование костного мозга, спиномозговой жидкости. 19 Получение опухоли: биопсия опухоли, пункции, плевральная лапароцентез. Верификация диагноза - цитология, гистология, иммуногистохимия при возможности – цитогенетический и молекулярный анализы. При лимфобластных лимфомах: T-клеточный фенотип, а в 10-15% случаев ранние пре B-клетки Ia+Ca11a+CLgM+). У (CD19+, детей Ia+Ca11a+) чаще всего и преB-клеток встречается (CD19+, B-клеточный Беркиттоподобный вариант,составляет 90% B-клеточных вариантов лимфом, относится к L3 варианту FAB классификации. Иммунологически B-клеточная опухоль (CD19+,CD22+, Slg+Ig+, Ca11a+). Среди анапластических лимфом чаще встречается Ki-1 (CD30+)тип с экспрессией (D30+ CD19+ CD22+CD68+). Окончательный диагноз: неходжкинская лимфома, вариант (согласно классификации), стадия, прогноз. Клиническая классификация, принятая S. Murrphi используется в настоящее время у детей с НХЛ. Iстадия -одна экстанодальная или нодальная опухоль без локального распространения (кроме медиастинального, абдоминального, эпидурального поражения). IIстадия- одна экстанодальная опухоль + поражение регионарных л/у; -поражение двух или более л/у по одну сторону диафрагмы; -две одиночные экстранодальные опухоли или поражение регионарных л/у по одну стороны диафрагмы; -первичная опухоль ЖКТ (илеоцекальный отдел) или поражение мезентериальных л/у: IIR- резецированная (опухоль макроскопически полностью удалена); IINR- нерезецированная (опухоль макроскопически не полностью удалена). Ш стадия- две одиночные экстранодальные опухоли по обе стороны диафрагмы; -две и более групп лимфатических узлов выше и ниже диафрагмы; -все первичные внутригрудные опухоли; -все распространенные внутрибрюшные опухоли, нерезектабельные; -все параспинальные и эпидуральные опухоли независимо от других зон поражения. 20 IV стадия- любое опухолевое поражение с исходно м поражением ЦНС и/или костного мозга (менее 25%) и/или с мультифокальным поражением скелета. В зависимости от стадии, размера опухолевой массы (полное или не полное удаление), уровня лактат дегидрогеназы с учетом неблагоприятных прогностических факторов – формулируется прогноз заболевания. К группам риска для НХЛ относятся: R1- стадия I-IIR; первичная опухоль макроскопически полностью удалена. R2- стадия IINR-III; первичная опухоль не удалена или удалена не полностью. -только экстраабдоминальное поражение; -интраабдоминальная локализация при показателях ЛДГ, не превышающих удвоенные нормальные значения до начала ПХТ после первичной операции; R3- стадии IINR-III-IV; первичная опухоль не удалена или удалена не полностью и имеет место хотя бы один из признаков: - при абдоминальном поражении увеличение ЛДГ более, чем в 2 раза от возрастной нормы перед началом ПХТ после первично операции; - поражение ЦНС; - поражение костного мозга; - мультифокальное поражение костей; - B-ОЛЛ (>25% бластов в костном мозге). Не-В-клеточные лимфомы I-II стадии относятся к группе стандартного риска. III-IV стадии относятся к группе среднего риска. Ki-лимфомы: К1 – больные с I-IIR стадиями, К2- больные с IINR-III стадиями, К1 – больные с IV стадией. Группой BFM разработаны программы лечения НХЛ для B-клеточных, неB-клеточных и для крупноклеточной анапластической лимфомы (Ki-1) – NHL90-95. При этом для назначения лечения необходимо знать гистлогический вариант лимфомы, иммунофенотип опухолевых клеток, стадию заболевания, уровень ЛДГ в сыворотке, объем хирургического вмешательства. Выделяют 3 терапевтические группы ( I, II, III). I терапевтическая группа делится на 3 группы риска: 21 1.Стандартная группа риска SR- стадии I+II. 2.Средняя группа риска MR- стадии III-IV. 3.Группа высокого риска HR. -остаточная опухоль после 1 фазы протокола I ( 33-й день); - >30% бластов костного мозга в начале или 5% на 33-й день; - поражение ЦНС; - прогрессия опухоли во время проведения I протокола. II лечебная группа для B- клеточной лимфомы- кроме 3-х степеней включает 4–ю группу риска. Лечение B-клеточных лимфом основано на проведении высокодозных коротких курсов ПХТ до 6 месяцев, проводимых в жестко установленные сроки с включением высоких доз метатрексата, интенсивная индукционная непрерывная ПХТ с назначением циклофофсфана, цитозара, вепезида, адриабластина. Поддерживающая терапия не требуется. Интенсивность терапии (число курсов) определяется в зависимости от стадии НХЛ и массы опухоли (с учетом активности лактатдегидрогеназы). Неэффективность лучевой терапии, только химиопрофилактика нейропоражения. Жесткие требования к сопроводительному лечению с учетом высокого риска синдрома лизиса опухоли и инфекционных осложнений (Г - КСФ). с включением метатрексата и антрациклинов. Непрерывная поддерживающая терапия для больных с не-B клеточной лимфомой (1,5 года). Общая продолжительность лечения - 2 года. Химиолучевая терапия для профилактики поражения ЦНС. Тактика лечения крупноклеточных анапластических лимфом зависит от стадии заболевания и группы риска, больные со стадиями I и IIR лечатся с применением 3 циклов или блоков, при стадиях IINR-III проводят 6 блоков. Больные с IV стадией получают циторедуктивную фазу и 6 блоков. 22 Причины неудач при лечении и развития рецидивов НХЛ у больных в Республике Мордовия. Несмотря на несомненные успехи в лечении НХЛ у детей, в ряде случаев возникает рецидив заболевания, требующий особых подходов к терапии этого серьезного осложнения. При лечении НХЛ по различным интенсивным программам рецидивы возникают не часто: при B-клеточной НХЛ у 9,5 %, а при T-клеточной лимфоме у 16% больных. У детей с B-клеточной лимфомой большинство рецидивов выявляется в первые 6-8 месяцев заболевания. При Tклеточной НХЛ наиболее часто диагностируются рецидивы впервые 2 года. Обычно рецидив возникает не в области первичного очага, а в костном мозге или ЦНС. Поэтому основными причинами рецидивов и неудач в лечении могут быть: -позднее поступление больного и начало лечения, - неадекватное сопроводительное лечение, -высокая частота инфекций и нарушение тайминга ПХТ, -ошибки в определении варианта НХЛ, -неадекватная цито - и гистологическая диагностика и отсутствие иммунофенотипирования. Кроме, того, одним из важнейших механизмов развития рецидивов является химиорезистентности опухолевой клетки. Это может быть связано как с гиперэкспрессией генов, ответственных за выведение цитостатиков из клетки (транспортные гены семейства множественной лекарственной устойчивости: multidrug resistance gene-1-MDR-1, multidrug resistance-associated protein-MRP), так и с мутациями генов, ответственных за апоптоз (р53, BCL-2, Rb и др.). Между тем на основании литературных данных оказалось, что один из генов, ответственных за выведение цитостатиков из клетки, – ген mdr-1, влияет также на разные звенья апоптоза. По-видимому, этот механизм является крайне существенным при воздействии на клетку биологически активных веществ с противоопухолевой направленностью, возможно, более важным, чем выведение цитотоксических агентов. В исследованиях Dano K. было выявлено значительное снижение концентрации цитотоксических препаратов в P-gp+ линиях клеток 12. В настоящее время известно, что P-gp как АТФ-зависимый транспортный белок 23 может выводить из клетки против концентрационного градиента в основном липофильные вещества, принадлежащие к разным классам химических соединений – антрациклины, эпиподофиллотоксины, стероидные гормоны, разные пептиды, цитокины, продукты метаболизма клетки 28, 37. В норме P-gp экспрессируется на CD34+ гемопоэтических клетках, на NK и CD8+ Тлимфоцитах 14. Выявлена экспрессия гена mdr-1 в клетках большинства опухолей. Pirker с соавторами у больных с ОМЛ, экспрессирующих ген mdr -1, выявили снижение числа полной ремиссии, ответа на индукционную химиотерапию и выживаемости, по сравнению с больными, опухолевые клетки которых не экспрессировали данный ген 27. Такие же данные были получены в отношении некоторых острых и хронических миело- и лимфопролиферативных заболеваний4. Эти исследования свидетельствуют, что повышение экспрессии гена mdr-1 является плохим прогностическим фактором, по крайней мере, при некоторых форм ОЛ и НХЛ. Транспортная функция Р-гликопротеина является основным, но не единственным, как ранее считалось, механизмом развития множественной лекарственной устойчивости (МЛУ) в mdr-1+клетках. Появление резистентности к цитостатикам и комплементу в mdr-1+ клетках может быть связано с увеличением внутриклеточного рН, обычно наблюдаемого в клетках с mdr-1 фенотипом, что подтверждено в исследованиях, в которых изменение рН клетки сопровождалось изменением их чувствительности к данным цитотоксическим веществам, не связанным с гиперэкспрессией гена mdr-1 39. Внутриклеточный рН изменяется путем удаления анионов Cl–/HCO3– или Na+/H+ ионов из клетки. Полагают, что в mdr-1+ клетках меняется градиент анионов Cl– /HCO3– , а не Na+/H+ катионов через вновь образованные Na+/Cl– каналы, приводя к увеличению уровня внутриклеточного рН, а также к деполяризации клеточной мембраны. Показано, что повышение внутриклеточного рН сопровождается подавлением доксорубицин-зависимого апоптоза, что, вероятно, связано не со снижением концентрации препарата, а с его инактивацией. Предполагается, что в условиях защелачивания подавляется активность и других цитостатиков 31, 32. В настоящее время в лечении рецидивов используются различные высокодозные химиотерапевтические режимы в сочетании с АуТКМ. Первоначально 24 предложенный режим BACT (кармустин, цитарабин, циклофосфамид, тиогуанин), был впсоледствии интенсифицирован за счет увеличения дозы кармустина. Режим BEAM (этопозид, мелфалан) был разработан с целью снижения токсичного режима BACT. После завершения интенсивной терапии зависимости от сопроводительное группы риска лечение с и типа лимфомы обязательным может в проводиться динамическим контролем: клинические проявления, ЛДГ сыворотки крови, УЗИ брюшной органов брюшной полости и рентгенография грудной клетки. Но, несмотря усилия, все режимы, используемые при лечении на все возможные рецидивов остаются высокотоксичными и сопровождаются отдаленными осложнениями, высоким риском развития вторичных опухолей. Лимфогранулематоз (ЛГМ) занимает особое место среди лимфопролиферативных заболеваний у детей, частота 5-7%, редко у детей до 5-и лет, нет у детей до 1 года. В настоящее время существует несколько гипотез об исходных (нормальных) клетках, которые претерпевают трансформацию в злокачественные неопластические при ЛГМ. Долгое время ЛГМ относили к первичнодиссеминированным злокачественным опухолям, исходящим из лимфоидной ткани, в последние же годы к злокачественным клональным заболеваниям лимфатической системы, происходящим из В-клеток зародышевых центров [4, 6—14] . Молекулярный анализ показал, что почти во всех случаях это заболевание относится к В-клеточным новообразованиям. Этот факт подтвержден и установлены изменения в этих клетках. Во-первых, в В-клетках довольно часто обнаруживаются перестройки генов вариабельных участков тяжелых цепей иммуноглобулинов (IgH) и реже Т-клеточного рецептора (TCR). Во–вторых, при анализе вариабельных генов иммуноглобулинов выявлен высокий уровень соматической гипермутации [4, 15—17]. Такие изменения наблюдаются достаточно часто при варианте лимфоидного преобладания ЛГМ, когда определяются мутации генов иммуноглобулинов и опухолевые клетки экспрессируют белки иммуноглобулинов и транскрипты, но не типичны для 25 других вариантов [14]. При других формах ЛГМ определяются схожий антигенный профиль и клиническая картина, поэтому они объединены в REALклассификации под названием «классическая лимфома Ходжкина» [14]. При варианте нодулярного склероза более часто наблюдается экспрессия Т-клеточных антигенов и выявляются перестройки гена Т-клеточного рецептора, что дает право думать об участии Т-лимфоцитов в патогенезе ЛГМ [4]. С другой стороны, в гистологических препаратах выявляются различия морфологии клеток Ходжкина и Рида-Штернберга [4, 13, 18, 19], однако все они имеют внешний вид гистиоцитарной клетки. На этих клетках выявлены высокая экспрессия антигенов HLA-II, отсутствие молекул HLA-I, присутствие активационных маркеров CD15, CD25, CD30, CD70, CD71, ко-стимулирующих молекул CD40, CD80, CD86. Кроме того, для этих клеток характерна активная секреторная деятельность. Все это дает нормальным аналогом клетки возможность предположить, что Рида-Штернберга могут быть антигенпрезентирующие клетки — макрофаги и дендритные клетки [3, 4, 20]. Интересная роль в гипотезах возникновения ЛГМ отводится вирусу ЭпштейнаБарр (ВЭБ). В большом количестве работ представлены результаты обнаружения ДНК вируса в геноме клеток Ходжкина и Рида-Штернберга [4, 18, 30, 31]. Современные молекулярно-биологические методики позволяют анализировать геном не только клеточной популяции, но и отдельно взятой с помощью микроманипулятора клетки (методика полимеразой цепной реакции на отдельно взятой клетке - single cell RCR). Факт частого выделения ДНК ВЭБ в клетках Ходжкина и Рид-Штернберга своего окончательного объяснения пока не получил. Эпидемиологические исследования свидетельствуют о том, что больные, перенесшие инфекционный мононуклеоз, заболевают ЛГМ в несколько раз чаще, чем бессимптомные носители [18, 31, 32]. Суть инфекционного мононуклеоза состоит во временной доброкачественной пролиферации В-лимфоцитов [3], причиной которой является транскрипционный фактор вируса, способствующий индукции генов, причастных к митогенезу. При этом транслокаций (перестроек) не происходит, однако близость процессов к хромосоме 18 (содержащей bcl-2 26 протоонкоген) и гену тяжелых цепей IgH дает предпосылки возникновения со временем В-клеточных лимфом. Таким образом, инфицирование ВЭБ является ведущим, но не единственным условием формирования генетических перестроек и развития лимфомы. У 40—50% больных ЛГМ определяется ВЭБ, который локализуется в ядрах клеток Ходжкина и Рид—Штернберга. По-видимому, ВЭБ при болезни Ходжкина является не просто «случайным попутчиком», а фактором, имеющим важное патогенетическое значение. В качестве одного из возможных механизмов действия вируса, ведущих к аккумуляции опухолевых элементов, можно рассматривать активацию онкогена bcl-2. Имеются работы, показывающие, что во всех ВЭБ-позитивных случаях болезни Ходжкина независимо от гистологического варианта повышается экспрессия белка, кодируемого этим геном [18, 33—35].Одним из механизмов нарушения апоптоза в опухолевых клетках являются мутации в генах, контролирующих апоптоз. В ряду этих процессов находятся хорошо изученная гиперэкспрессия гена bcl-2, тормозящего апоптоз, и мутации в гене p53, препятствующие функционированию кодируемого им белка как индуктора апоптоза. Имеются работы, в которых детально изучается функционирование белков, кодируемых генами p53 и bcl-2, разнонаправлено влияющих на развитие апоптоза при болезни Ходжкина [15, 23, 28, 29, 33, 35]. Клинические проявления характеризуются общими симптомами: лихорадка > 38°С в течение 3 дней, не купируется антибиотиками; ночные поты; потеря веса > 10% за 6 месяцев, симптомы компрессии (по локализации), гепато/спленомегалия, экстранодулярные поражения - 5-8% случаев: костный мозг, легкие, плевра, кости, почки, печень, кожа. Характерно увеличение периферических лимфатических узлов, преимущественно: шейные, надключичные –50% случаев, медиастинальные – 30 % случаев, изолированное поражение –15-20%, выше диафрагмы – 90% и только ниже диафрагмы 10%, только подмышечные или паховые – не более 10% случаев ЛХ. При пальпации они становятся Верификация плотными диагноза на на ощупь, безболезненными, подвижными. основании гистологического исследования 27 биопсийного материал с уточнением гистологического варианта. Заболевание классифицируется на лимфому (болезнь) Ходжкина, нодулярная с лимфоцитарным преобладанием и на классическую лимфому Ходжкина • нодулярный склероз • обогащенная лимфоцитами (лимфоцитарное преобладание) • смешанноклеточная • с лимфоцитарным истощением Морфологическая диагностика лимфомы Ходжкина (болезни Ходжкина, лимфогранулематоза) основана на идентификации опухолевых клеток с учетом "фона" - реактивного клеточного компонента. Наиболее характерными для лимфомы Ходжкина (ЛХ) являются клетки Рид-Штернберга (КРШ), в отечественной литературе - это клетки Березовского-Штернберга и клетки Ходжкина (КХ), а также лакунарные клетки и клетки, получившие название Lymphocytic and histocytic (L@H). Морфологическое своеобразие ЛХ обусловлено также реактивным компонентом, который может составлять до 99% клеточной популяции. Реактивные клетки - это малые лимфоциты, гистиоциты, нейтрофилы, эозинофилы, плазматические морфологических вариантов клетки, фибробласты. учитывается структура При выделении опухолевых клеток, клеточный состав реактивного компонента, характер роста. Однако благодаря морфоиммунологическим сопоставлениям стало очевидным, что лимфоидное преобладание включает в себя, по крайней мере, две нозологические формы. преобладанием, Одна получившая из них, также собственно название ЛХ с лимфоидным парагранулемы (термин, использованный Jaeksona и Parker, 1944), и вторая, богатая лимфоцитами, классическая ЛХ. Оказалось, что ЛХ с лимфоидным преобладанием (парагранулема) характеризуется фенотипом, весьма отличающимся от фенотипа остальных вариантов ЛХ, которые объединены термином "классические". Своеобразие фенотипа опухолевых клеток при лимфоидном преобладании заключается, прежде всего, в том, что они не экспрессируют ключевой для классификации вариантов ЛХ антиген СД15, а слабая экспрессия СДЗ0 28 отмечается лишь в единичных клетках. Опухолевые клетки экспрессируют СД45, СД20, СД79а, J-chain и нередко ЕМА (эпителиальный мембранный антиген). Фенотип большинства реактивных малых лимфоцитов соответствует таковому клеток зоны мантии лимфоидного фолликула, среди которых располагаются СД21+ фолликулярные дендритические клетки. Классической богатой лимфоцитами ЛХ более всего свойственен диффузный характер роста, однако, встречается и нодулярный. Богатая лимфоцитами классическая ЛХ с нодулярным ростом была впервые описана Ashton-Key et. al. в 1995 г. и названа "фолликулярной болезнью Ходжкина". Если в случаях с нодулярным "фоном" для опухолевых клеток служат В-лимфоциты, то при диффузном преобладают Т-клетки (СДЗ0+). Основным критерием принадлежности богатой лимфоцитами ЛХ к классическому варианту служит преобладание среди опухолевых клеток типичных КРШ и КХ с соответствующим фенотипом (СД15+, СДЗ0+, СД45-, ЕМА-, J-chain-). Смешанно-клеточный вариант характеризуется диффузным ростом и, в случае частичного поражения лимфоузла, локализацией опухолевого инфильтрата в паракортикальной зоне. Среди малых лимфоцитов преимущественно выявляются Т-клетки (СДЗ+, СД57-). Вариант с лимфоидным истощением ЛХ представлен двумя гистологическими подвариантами: диффузным фиброзом и так называемым ретикулярным подвариантом. Прежде чем говорить о лечении БХ необходимо оценить факторы риска и прогноза заболевания в соответствии, с которыми будет назначено адекватное лечение в виде химио или комбинированной химиолучевой терапии. По мере совершенствования лечения болезни Ходжкина менялось прогностическое значение различных факторов. Однако некоторые из них продолжают влиять на успех и выбор лечения. Прежде всего, прогноз зависит от стадии заболевания, для этого необходимо применять клиническую классификацию: I Вовлечение в процесс одной группы лимфатических узлов или лимфоидной структуры ( селезенки, тимуса, лимфоглоточного кольца Вальдеера) или вовлечение одной 29 вне лимфоидной области. II Вовлечение двух или более групп лимфатических узлов, по одну сторону диафрагмы (множественные узлы, когда вовлечены обе стороны диафрагмы, составляют II стадию болезни), локализованное вовлечение, только одного экстра лимфатического органа и одной или более лимфатических областей по одну сторону диафрагмы (II E) III Группы л/у с обеих сторон диафрагмы (+селезенка III с; +очаги в нелимф.органе III Е) Вовлечение областей лимфатических узлов по обе стороны от диафрагмы (III ), которое может сопровождаться вовлечением селезенки (III S) или ограниченным смежным вовлечением области экстра лимфатического органа (III E) или двух областей вместе (III SE). С вовлечением или без вовлечения селезеночных, ворот легкого, кишечных, и портальных узлов. С вовлечением пара аортальных, подвздошных, и мезентериальных узлов. IV диссеминированное /диффузное поражение нелимфоидных органов ±л/у Распространенная вовлеченность одного или нескольких вне лимфоидных органов с вовлеченностью или без причастности лимфатического узла. Прогноз зависит от стадии заболевания. Чем больше стадия заболевания, тем хуже прогноз. Самой неблагоприятной является IV стадия, особенно при наличии B- симптомов с высокими показателями маркеров “ биологической активности” к которым относят высокие уровни церулоплазмина, гаптоглобина, фибриногена. Гистологический вариант также влияет на прогноз заболевания. У больных с I – II стадиями и смешанно - клеточным вариантом имеется риск возникновения поддиафрагмальных рецидивов. У больных с лимфоцитарном истощением прогноз плохой. Возраст детей является также важным прогностическим фактором: по данным университета Стэнфорда, 5 и 10 летняя выживаемость у детей до 10 летнего возраста составляет 94 и 92 %, по сравнению с подростков (11- 16 лет). Лучшая выживаемость 93 и 86 % среди у детей младшего возраста можно объяснить высокой частотой лимфоидного преобладания и смешанно клеточного варианта, меньшей частотой генерализованных стадий и общих 30 симптомов. Таким образом, к неблагоприятным факторам прогноза можно отнести: 1.Пубертатный и препубертатный возраст. 2. Гистологические варианты - лимфоидное истощение и нодулярный склероз. 3. Поражение внутригрудных л/у. 4. IV стадия заболевания. 5. Наличие симптомов интоксикации биологической активности процесса. 6. Массивность поражения: размеры л/у более 5 см в диаметре, поражение 5 и более групп л/у, медиастинально- торакальный индекс (МТИ), 0,5 и >. В соответствии с этим выделяют 3 группы прогностического риска: к 1-й относятся больные с I - II стадиями, без неблагоприятных факторов прогноза, ко 2-й группе риска относятся больные II А и II В + один или несколько неблагоприятных факторов или III А и III В стадиями без неблагоприятных факторов риска, к 3-й группе риска можно отнести больных с III А и III В при наличии неблагоприятных больные с прогностических факторов. Наиболее высокий риск имеют IV стадией заболевания с вовлечение в процесс легких, плевры, перикарда, печени, костей. Необходимо коснуться и роли лучевой терапии, которая в последние годы полностью утратила самостоятельное значение и применяется исключительно с консолидирующей целью после окончания химиотерапии. К концу 90-х гг. по результатам радикальной лучевой терапии были определены прогностические факторы для I-II стадий лимфомы Ходжкина [6, 9]. Набор прогностических 31 факторов несколько варьировал, но основными прогностическими факторами для I и II стадий были: неблагоприятными поражение 3 и более лимфатических областей (или 4 и более), СОЭ выше 30 мм/ч при наличии симптомов интоксикации и выше 50 мм/ч при их отсутствии, гистологические варианты смешанно-клеточный и лимфоидное истощение, а также массивное (медиастинально-торакальный индекс - МТИ - более 0,33) поражение медиастинальных лимфатических узлов. Эти прогностические факторы разделяли только больных с I и II стадиями лимфомы Ходжкина на две группы, нуждающиеся в различном объеме лечения. Во второй половине 90-х гг. уже по результатам комбинированных химиолучевых программ EORTC и Германской группы по изучению лимфомы Ходжкина (GHDG) снова был проведен анализ прогностических факторов. Этот анализ показал, что для всех больных лимфомой Ходжкина при использовании химиотерапии и комбинированного лечения кроме стадии заболевания и симптомов интоксикации прогностически значимыми являются только следующие факторы: 1) массивное поражение средостения (МТИ>0,33); 2) массивное поражение селезенки (наличие 5 и более очагов или увеличение органа с его диффузной инфильтрацией); 3) экстранодальное поражение в пределах стадии, обозначаемой символом "Е"; 4) поражение лимфоузлов трех или более областей; 5) увеличение СОЭ>30 мм/ч при стадии Б и СОЭ>50 мм/ч при стадии А [2, 3, 5]. Преимущество комбинированной терапии было выявлено и при сравнении ее с полихимиотерапией. Однако в терапии этой группы до последнего времени оставался открытым вопрос об объеме лучевой терапии: облучать ли только зоны исходного поражения или необходимо использовать широкопольное облучение на все лимфатические коллекторы выше диафрагмы. Из обзора литературных данных этих исследований, можно заключить, что для больных с лимфомой Ходжкина сокращение объема лучевой терапии в рамках комбинированного 32 химиолучевого лечения до облучения только зон исходного поражения не снижает ни непосредственных, ни отдаленных результатов лечения. Лучевая терапия стала применяться для всех больных только в сочетании с химиотерапией, исключительно на зоны поражения и в дозах не выше 30-40 Гр. Четко определилась тенденция к дальнейшему снижению суммарных очаговых доз облучения в целях снижения отдаленных побочных эффектов, таких как атрофия костно-мышечного аппарата, функциональных нарушений сердечнососудистых и эндокринных систем, а самое главное снижения риска развития вторичных опухолей.. Основным лечебным принципом стало соответствие объема терапии объему опухолевой массы. Достижения в лечении ЛХ позволили разделить больных на прогностические группы в соответствии с объемом опухолевой массы, что позволило более адекватно выбирать программу лечения. Так для благоприятной прогностической группы с минимальным объемом поражения показан минимальный объем лечения - 2-4 цикла химиотерапии + облучение только исходно пораженных лимфатических коллекторов; для промежуточной прогностической группы - 4-6 циклов полихимиотерапии + облучение только исходно пораженных зон; для неблагоприятной прогностической группы с большим объемом опухоли максимальный объем лечения - 8 циклов полихимиотерапии + облучение зон исходно больших массивов и/или зон с остаточными лимфатическими узлами. Большинство программ I линии, используемых в настоящее время. Протокол DAL HD 90 прокарбазин (натулан), винкристин, циклофосфан, преднизолон, адриамицин, ± вепезид, MOPP- COPP мустарген/циклофосфан, онковин, прокарбазин, преднизолон, CVPP вместо онковина + винбластин, DOPPдопан вместо циклофосфан, в схемах 2 линии IEP ифосфамид, этопозид, преднизолон, ABVD, CCVPP- ломустин, винбластин, прокарбазин, преднизолон. Больным с 1 группой риска назначают 3 курса COPP или CVPP без 33 облучения, или комбинация с низкими дозами облучения зон первичного поражения ( суммарная доза 20-26 Гр.). Больным со 2 группой риск увеличивают число курсов до 4-6 с обязательным включением антрациклинов и облучением исходно пораженных л/у. Больным с 3 группой риска лечение до 8 циклов- 1 линия обязательно с включением антрациклинов, и схемы препаратов 2 линии. Обязательным условиям эффективности терапии является соблюдением режима цикловой терапии. Двухнедельные циклы обязательно чередуются с 2х недельными перерывами. В течении цикла химиотерапии могут развиться интеркурентные заболевания ( пневмония, Т-клеточный иммунодефицит, Herpes Zoster, сепсис) в этом случае лечение прерывается, и возобновляется при удовлетворительном состоянии больного: отсутствие гипоплазии кроветворения, Л- 2,0 Гр. 0,5, Тр. 100000. При достижении полного эффекта после курсов химиотерапии, обязательно проводится косолидирующая лучевая терапия на зоны поражения. Несмотря на достигнутые успехи в лечении ЛХ частота рецидивов заболевания колеблется от 6,4% до38%. Большинство исследований посвящено анализу рецидивов с оценкой прогностических факторов на безрецидивную выживаемость детей. Возникнвение рецидивов чаще связано с с неадекватностью терапии ввиду недооценки стадии заболевания и факторов риска или нарущшением режима и доз химиотерапии и лучевой терапии. Рецидивы по времени развития делятся на ранние – до 1 года после окончания терапии; поздние - больше 1 года, после достижения полной ремиссии. По локализации – в облученных зонах, в необлученных зонах. Большинство рецидивов (94,4%) возникает в первые 3 года после окончания лечения. Причем в 1-й год число рецидивов составляет более 52%. У детей с поражением средостения при первичной диагностике заболевания рецидивы наблюдаются в 26% случаев. Чаще всего встречаются трансдиафрагмальные (32,6%), реже местные (27,7%), или диссеминированные (25,7%) поражения. Наиболее часто отмечается поражение селезенки, забрюшинных л/у или сочетанные пораженное 34 поражение печени, л/у и костей, легких и почек. Механизмы возникновения рецидивов изучены недостаточно, семейство генов BCL-2 возможно играет роль в химиорезистентности через ингибирование апоптоза в опухолевых клетках. Например, оказалось, что уровень BCL-2 в опухолях после химиотерапии у пациентов с устойчивостью к определенным препаратам выше по сравнению с образцами от пациентов, не получавшими до этого терапию. В это семейство входят белки, которые либо ингибируют, либо индуцируют апоптоз. Соотношение про- и анти-апоптотических членов семейства и определяет, подвергнется ли клетка апоптозу. Но прогностическая значимость активно изучается пока только для BCL-2 в силу его более давних исследований. Интересно, что BCL-2 оказывает разное влияние на резистентность опухолей к проводимой терапии и прогноз исхода заболевания. В одних типах опухолей экспрессия BCL-2 коррелирует с лучшим прогнозом, в других - наоборот. Приобретенной резистентности химиотерапевтическим средствам опухолевых клеток к при лечении ЛГМ возникает за счет следующих механизмов: усиление П-гликопротеина экспрессии и супрессия накопления лекарства в клетках [Goldstein et al., 1989]; инактивация лекарства при увеличении интраклеточного уровня глутатиона[Наmilton et al., 1989] и глутатиона S-трансфераза (комплексная группа белков) связана с детоксикацией химических веществ и канцерогенов из окружающей среды. Показано увеличение их экспрессии в нормальных и опухолевых клетках после экспозиции к цитотоксическим средствам. Во всех случаях изменения в экспрессии энзимов глутатиона S-трансферазы следуют параллельно с увеличением резистентности к цитотоксическим средствам [Schecter et al., 1992]. Farbег [1984] отмечает, что резистентность ко многим лекарствам (РМЛ) и канцерогенез взаимосвязаны. Многие из предпринимавшихся попыток улучить результаты лучевого лечения онкологических больных были основаны на идее преодоления "гипоксической радиорезистентности" клеток опухоли и включали такие попытки как достижение реоксигенации опухоли при ее длительном фракционированном облучении относительно небольшими дозами; однократное протрагированное 35 облучение при низкой мощности дозы. По-видимому, резистентность опухолевых клеток, связанная с их постоянной или временной гипоксией, хотя и является важной составляющей существования клеточной популяции большинства опухолей, но не определяет полностью ответ опухоли на лучевое воздействие, а гипоксические клетки не могут быть главной "мишенью" в попытках повышения эффективности лучевой терапии. Показано, что в постоянных культурах клеток, полученных из различных типов опухолей, несмотря на сравнительно высокую вариабельность показателя средней клеточной летальной дозы D0 (может варьировать при действии стандартных редкоионизирующих излучений в условиях достаточной оксигенации примерно от 0,5 Гр до 1,5 Гр), в большинстве случаев сохраняется различие в радиочувствительности, установленное лучевыми терапевтами на основании длительного опыта лечения больных с различными видами злокачественных новообразований. В течение последних 10-15 лет значительно изменился взгляд на природу и механизмы радиационной гибели клеток, что связано, в первую очередь, с изучением генетических механизмов апоптотической формы клеточной гибели. Современной общепринятой тактикой лечения больных с рецидивом заболевания считается применение ХТ второй линии - комбинированная химиолучевая терапия. При ранних рецидивах – аутоТКМ, основной целью ХТ второй линии является уменьшение остаточной опухолевой массы. В качестве химиотерапии второй линии наиболее часто используются следующие схемы: CBV (циклофосфан, кармустин, вепезид); mini-BEAM (кармустин, этопозид, цитарабин,алкеран) и др. К сожалению, этот метод лечения находится в стадии клинических испытаний и доступен только Научным Центрам в больших городах, поэтому постоянно разрабатываются новые доступные схемы и режимы в лечении ЛХ. Ряд авторов предлагают для лечения рецидивов ЛГМ ориентироваться на локализацию поражения при выборе схем химиотерапии. При поражение легочной ткани используются схемы, включающие препараты мочевины (CCNU, BCNU, нитрозомочевина), при поражении печени – противоопухолевые антибиотики, при поражении л/у имидазолин-карбоксамид, 36 вепезид, проспидин (ABVD - адриамицин, блеомицин, винкристин, дексаметазон, PCVP- винкристин, циклофосфан, проспидин, преднизолон, CEP- циклофосфан, этопозид, преднизолон, IEP- ифосфамид, этопозид, преднизолон). Эффективность противорецидивной химиотерапии оценивается после 1 цикла лечения. Уменьшение размеров опухолевой массы не менее 50%, купирование общих симптомов и показателей биологической активности является показанием для продолжения лечения по прежней схеме. При отсутствии эффекта схема меняется. К сожалению, на сегодняшний день нет единой принятой схемы лечения рецидивов, поэтому все большее значение приобретает адекватная оценка стадии заболевания при учете неблагоприятных факторов риска. Список использованных источников: 1. Алексеева Н.А. Гематология детского врачей - С-Пб.: Гиппократ.- 1998.- С544. возраста: Руководство для 2. Балакирев С.А. Врожденный острый лейкоз у детей // Детская онкология. 1999. -№1.-С.29. 3. Беликова Л.Ю., Карачунский А.И., Самочетова Е.В. // Пособие для врачей гематологов. Москва.-2002.-С.51. 4. Борисевич Н. В., Белевцев М. В., Алейникова О. В. Иммунологическая характеристика первых рецидивов острого лимфобластного лейкоза у детей и оценка эволюции иммунофенотипа бластных клеток в рецидиве гематология и трансфузиология-2004 №6 10-13. 5. Белогуpова М. Б., Pадулеску Г. Г., Киpиченко М. М., Виктоpович Т. Д., Гоpошко Г. Н., Чавпецова Э. Д. Pезультаты лечения детей с неходжкинскими лимфомами, № 6,С.40. 6. Воробьев А.И., Кременецкая А.М., Лорие Ю.Ю., Харазишвили Д.В., Шкловский-Корди Н.Е. «Старые» и «новые» опухоли лимфатической системы. Тер архив 2000; 7: 9—13. 7. Детская онкология: Руководство для врачей. / Под редакцией М.Б. Белогуровой - СПб. Спец. Лит.- 2002.- С351. 8. Деpбенева Л. И., Лоpия С. С., Беpезовский Д. В., Pогачева Е. P. Сpавнительный анализ эффективности лечения подpостков с лимфогpанулематозом по пpотоколам DAL-HD-90 и COPP/ABVD, № 6, С. 44 37 9. Ермаков Б.Л., Алейникова О.В. Индукция второй ремиссии без использования высокодозной терапии у детей с рецидивами ОЛЛ // Вопросы гематологии, онкологии и имуннологии в педиатрии.-2002.-т. 1.-№1.- С.79-82. 10. Захарова Н.В., Цыганкин В.И., Попов А.В. Краниальное облучение при рецидивах ОЛЛ с поражением ЦНС у детей // Детская онкология.-1998.-№1.С.24. 11. Зубова С.Г., Данилов А.О., Мышков А.И., Быкова Т.В., Зарицкий А.Ю., Окулов В.Б. Ген mdr-1 и чувствительность клеток к различным воздействиям// Вопросы онкологии. – 2000. – Т. 46, №2. – С. 199–201. 12. Игнашина Е.В. Эндокринная регуляция репродуктивной системы и ее сохранение у женщин с болезнью Ходжкина в процессе комбинированной терапии. Автореф. канд дисс., М., 1998. 13. Ильин Н.В. Современная лучевая терапия злокачественных лимфом. Радиология 2002. Материалы 3-его Росс. научного форума. М..2002. 14. Ильяшенко В. В. Pентгенологические находки в пpоцессе динамического наблюдения детей с поpажением сpедостения пpи лимфогpанулематозе, № 6, С. 44. 15. Клиническая онкогематология: руководство для врачей. Под ред. М.А.Волковой. - М.: Медицина, 2001. - 576 с. 16. Курдюков Б.В., Попов А.В., Гаврикова Н.В., Шишкин Ю.В. Значение экспрессии дифференцировочных антигенов на бластных клетках для прогноза ОЛЛ у детей // Детская онкология.-1999.-№5.- С.30. 17. Кондратчик К.Л., Непокульчицкая Н.В., Тимаков A.M. Рецидивы острого лимфобластного лейкоза у детей, возможности терапии, исходы // Педиатрия. 1999.-№11. 18. Куpмашов В. И., Дуpнов Л. А. Возможности дальнейшей интенсификации химиотеpапии пpи гемобластозах у детей, Гематология и трансфузиология № 6, 1999 С. 27 19. Кошечкина Н. А., Моpозова О. В., Каминская И. В., Колесник Е. В., Киселев А. В., Лабецкий И. И. Поpажение мягких тканей пpи неходжкинских лимфомах у детей, Гематология и трансфузиология № 8, 2000 С. 37. 20. Карачунский А.И., Беликова Л.Ю., Штакельберг А. и др. Лечение рецидивов острого лимфобластного лейкоза у детей: основные итоги в группе BFM и анализ собственного 7 летнего опыта // Гематология и трансфузиология. 1998.- том 43. №6.-С.8-13. 21. Колыгин Б. А., Кочуpова Н. В., Сафонова С. А., Пунанов Ю. А. Pезультаты 38 лечения IA—IIA стадии лимфогpанулематоза у детей, Гематология и трансфузиология. – 2004 № 6, С. 41. 22. Колыгин Б. А. Pецидивы пpи IA—IIA стадии лимфогpанулематоза у детей, Гематология и трансфузиология. - 2000№ 6, С. 41. 23. Кочуpова Н. В. Pезультаты комплексного лечения IIIA стадии лимфогpанулематоза у детей, Гематология и трансфузиология. – 1999 № 6, С. 42. 24. Кошечкина Н. А., Сусулева Н. А., Алексеева О. А., Гоpдина Г. А., Глеков И. В., Петина С. В., Тюкалова Н. P., Остpовская А. В., Копосов П. В., Самочатова Е. В. Pезультаты теpапии детей с болезнью Ходжкина в условиях амбулатоpного отделения, Гематология и трансфузиология. - 2001 № 4, С. 43. 25. Коленкова Г.В. Маркеры ОЛ в диагностике и прогнозе заболевания у детей. // Гематология и трансфузиология. - 2001.- том 47.- №3.- С.27-29. 26. Ленская Р.В., Коленкова Г.В., Кондратик К.Л. Эволюция иммунофенотипа опухолевых клеток в ранних рецидивах острого лимфобластного лейкоза у детей. // Гематология и трансфузиология.-1997.-№5.- С.28-31. 27. Лоpия С. С., Pумянцев А. Г., Деpбенева Л. И. Некотоpые пpогностические хаpактеpистики пpи остpом лимфобластном лейкозе в подpостковом возpасте, М.2001 Гематология и трансфузиология № 2, С. 24. 28. Лукъянова Н.Ю., Кулик Г.И., Чехун В.Ф. Роль генов р53 и bcl-2 в апоптозе и лекарственной резистентности опухолей. Вопр онк 2000; 46(2): 121—128. 29.Лорие Ю.Ю. Опухолевая прогрессия лимфогранулематоза. Тер архив 2000; 7: 76—80. и вопросы биологии 30. Ленманн Е.Е., Афанасьев Б.В., Пожарисский К.М. О роли вируса ЭпштейнаБарр в патогенезе лимфогранулематоза. Иммуногистохимическое и молекулярно биологическое (гибридизация in situ) исследования. Архив патологии 1999; 1: 15—22. 31. Кондратьева Н.Е. Особенности течения I-II стадий лимфогранулематоза с поражением средостения. Дисс. канд. мед. наук. М., 2001. 32. Маякова С.А., Глазкова Т.Г. Многофакторный математический анализ иммунологических и клинико - гематологических признаков для прогноза ОЛЛ у детей. // Детская онкология. - 1997.-№3. - 4.- С.20. 33. Моpозова О. В., Киселев А. В., Полянский М. А., Кошечкина Н. А. Поpажение бpюшной полости пpи неходжкинской лимфоме у детей, Гематология и трансфузиология № 10, 2002 С. 36. 39 34. Маякова Н.В., Карачунский А.И. Нейролейкемия. Проблемы диагностики, профилактики и лечения. // Гематология и трансфузиология. -2000.- №6.- С.3539. 35. Муталов А.Г., Данилов Р.А., Миронов П.И. Органные дисфункции при остром лимфобластном лейкозе у детей. // Гематология и трансфузиология. 1999.№4.-С.10-13 36. Насибов О.М. Фиброз легких, кардиопатии и вторичные опухоли у лиц и длительной ремиссии лимфогранулематоза. Автореф. канд. дисс , М , 2000 37. Новик А. А., Мельниченко В. Я., Колюбаева С. Н., Мясникова Л. В., Абиссова Н. А., Позднякова О. В. Хаpактеpистика некотоpых цитогенетических показателей пpи неходжкинских лимфомах . Вопр онк 2002; 46(2): 121—128 38. Овсепян В.А., Целоусова О.М., Тимкина Е.Н. Цитогенетическая характеристика острых лейкозов у детей // Детская онкология. - 1997.- №3-4.- С.27. 39. Осипова Е.Ю.Клинико-лабораторные особенности течения гепатитов у детей с острым лимфобластным лейкозом на фоне интенсивной химиотерапии по программе BFM-90||Автореф. канд. дис., Воронеж, 2000 40. Паньшин Г.А., Сотников В.М., Пивник А.В. и соавт. Лучевая терапия в комплексном лечении больных лимфогранулематозом IV стадии заболевания. Вопр. онкологии.- 1999.-№2.- т.45.-с.158-161. 41. Петеpсон И. С., Тупицын Н. Н., Махонова Л. А., Матвеева И. И. Моpфоиммунологическая хаpактеpистика кpупноклеточных анапластических лимфом у детей Вопросы гематологии, онкологии и имуннологии в педиатрии 2003.-т. 1.-№1.- С.79-82 42. Подосенова Н. П., Коленкова Г. В., Пивоваpова А. И., Тимаков А. М. Иммунофенотипы лейкозных клеток у детей с остpым лейкозом пpи пpогpессиpовании заболевания Гематология и трансфузиология. - 2003.- том 47.№3.- С.27-29. 43. Полянский М. А., Моpозова О. В. Пpогноз неходжкинской лимфомы с поpажением илеоцекального отдела кишечника у детей, Гематология и трансфузиология № 6, 2003 С. 37. 44. Пpобатова Н. А., Pумянцев А. Г. Значение веpификации ваpианта неходжкинских лимфом у детей для эффективности лечения по совpеменным пpотоколам Гематология и трансфузиология. - 2000. - №3. - С.58. 45. Пpостомолотов О. А., Пpоценко P. М., Копосов П. В. Pоль леногpастима в пpогpаммном лечении беpкиттоподобных злокачественных неходжкинских лимфом у детей, Гематология и трансфузиология № 8,2003 С. 38 С. 40. 40 46. Пунанов Ю. А., Лебедев С. В. Pоль опеpативного пособия в лечении детей с абдоминальными фоpмами неходжкинских лимфом, Гематология и трансфузиология 2004 С. 38 № 6, С. 39. 47. Птушкин В.В. Трансплантация костного мозга в современной химиотерапии злокачественных новообразований // Российский медицинский журнал.2001.том 9. №22. С.84-89. 48. Руководство по гематологии в 3 т. Т.1. Под ред. А.И.Воробьева. - М.: Ньюдиамед, 2002, - 280с. 49. Стюф И.Ю., Быкова Т.В., Фролова О.И., Маринец О.В., Афанасьев Б.В. Гиперэкспрессия гена множественной лекарственной устойчивости (MDR-1) у больных хроническим миелолейкозом // Тер. архив. – 1998. – Т. 70, №7. – С. 26– 29. 50. Самочатова Е.В., Масчан А.А., Асланян Р.С. и др. Результаты программного лечения острого нелимфобластного лейкоза у детей в 8 клиниках России. Ретроспективный анализ. Гематол и трансфузиол 1999;2:1—13. 51. Слугин А. И., Тупицын Н. Н., Махонова Л. А. Клиника и лечение кpупноклеточной анапластической лимфомы у детей, Гематология и трансфузиология № 6,2002 С. 38. 52. Самочатова Е.В., Асланян К.С, Беликова Л.Ю. Причины неудач при лечении детей, больных ОЛЛ по модифицированному протоколу БФМ - ОЛЛ - 90: ретроспективный анализ. // Consilium medicum, приложение.- 2002.- С.31-32. 53. Самочатова Е.В., Масчан А.А., Беликова Л.Ю. Результаты программного лечения ОНЛЛ у детей в 8 клиниках РФ // Гематология и трансфузиология.1999.№ 2.- С.35-38. 54. Тумян Г. С., Тупицын Н. Н., Шолохова Е. Н., Пробатова Н. А., Османов Д. Ш., Ковригина А. М., Павловская А. И. Иммуноморфологическая характеристика богатой лимфоцитами классической лимфомы Ходжкина Гематология и трансфузиология. – 2003 №4.-С.10-13. 55. Тюкалова Н. P., Федоpова А. С., Шумилова И. В., Pумянцев А. Г. Неходжкинские лимфомы у детей: клиническая хаpактеpистика, возможности диагностики и теpапии; по данным клиник Pоссии и Белаpуси // Гематология и трансфузиология. - 2002. - №3. - С.58. 56. Хомякова Т.Е., Стренева О.В., Муторова О.Ю. и др. Ретроспективный анализ результатов лечения первых рецидивов острого лимфобластного лейкоза у детей в семи клиниках России и Белорусии. Материалы V ежегодной 41 российской онкологической конференции М.- 2001.- С. 160-162. 57. Чернов В.М., Погорелова Э.И., Лескова С.Г. Лейкозы в структуре общей заболеваемости злокачественными новообразованиями у детей РФ: динамика, сопоставление с зарубежным уровнем, критический анализ. // Гематология и трансфузиология.-1997.-№5.-С10-14. 58. Чернов В.М., Бурдаева Д.Д. Критерии оценки основных медико статистических показателей при изучении лейкозов у детей. //Гематология и трансфузиология.-1999.-№ 4.- С.48-50. 59. Шман Т. В., Углова Т. А., Савицкий В. П. Связь лекаpственной чувствительности, спонтанного апоптоза лейкемических клеток с фактоpами пpогноза пpи В-линейном остpом лимфобластном лейкозе у детей Гематология и трансфузиология. - 2003.№4.-С.10-13. 60. Эпидемиология ОЛ и лимфом у детей некоторых регионов РФ. // Методические рекомендации. - 2002.- С.25. 61. Aurich G, Plenert W, Zintl F. Diagnostie and the rapeutie aspects of leukoses in childhood. // Blood.- 2001.- №27(1).-P. 455-460. 62. Brauniger A., Yang W., Wacker H. H., Rajewsky K., Kuppers R., Hansmann M. L. B-cell development in progressively transformed germinal centers: similarities and differenses compared with classicalgerminal centers and lymphocyte — predominant Hodgkin disease. Blood 2001; 97(3): 714—719. 63. Cullen K.V., Davey R.A., Davey M.W. Drug resistance does not correlate with resistance to Fas-mediated apoptosis// Leuk. Res. – 2001. – Vol. 25, №1. – P. 69–75. 64. Clift R.A., Buckner CD. Appelbaumt Fretal Allogeneic marrow transplantation in patients with acute myeloid leukemia in fist remission. A randomized trial of two irradiation regimens//Blood.- 1999.-№76.-P. 176-178. 65. Diehl V, Mauch PM., Harris NL. Chapter 45: Lymphomas, 45.6: Hodgkin's Disease in Cancer: Principles and Practice of Oncology, 6th Edition; ed. DeVita TD, Hellman S, Rosenberg SA. Lippincott Williams & Wilkins, 2001. 66. Diehl V, Franklin J, Pfreundschuh M, et al. German Hodgkin's Lymphoma Study Group. Standard and increased-dose BEACOPP chemotherapy compared with COPPABVD for advanced Hodgkin's disease. NEnglJMed 2003; 348:2386-95. 67. Duggan DB, Petroni GR, Johnson JL, et al. A randomized comparison of ABVD and MOPP/ABV hybrid for the treatment of advanced Hodgkin´s disease: report of an intergroup trial. / Clin Oncol 2003; 21:607-14. 68. Engert A, Schiller P, Jostig A, et al. Involved-field radiotherapy is equally effective 42 and less toxic compared with extended-field radiotherapy after four cycles of chemotherpay in patients with early stage unfavourable Hodgkin's lymphoma: results of the HD8 trial of the German Hodgkin's Lymphoma Study Group. / Clin Oncol 2003; 21: 3601-08. 69. Eckert C, Biondi A., Seeger K. et al, Prognostic va lue of minimal residual disease in relapsed childhood acute lymphoblastic leukaemia Lancet.-2001.-3 58(9289), 12391241. 70. Foss H.D., Marafioti N., Stein H. Hodgkin lymphoma. Classification and pathogenesis. Pathologe 2000; 21(2): 113—123. 71. Hofmann A., Wolf J., Diehl V., Staratschek-Jox A. Cultivated H-RS cells are resistant to CD95L-mediated apoptosis despite expression of wild-type CD95. Exp Hematol 2000; 28 (3): 348—351. 72. Hoskin P.J. Smith P., Linch D.C. Late morbidity and survival in early stage Hodgkin's disease treated with involved field or wide field radiotherapy alone Ann. Oncol. 2002. V13. S.2. P.1. 73. Hiddemann, Th. Buchner Acute Leukemias VIII, 2001 Springer-Verlag, Berlin Heidelberg pp. 457-460. 74. Kupper M., Joos S., von Bonin F., Daus H., Trumper L. MDM2 gene amplification and lack of p53 point mutations in Hodgkin and Reed—Sternberg cell: results from sinle — cell polymtrase chain reaction and molecular cytogenetic studies. Br J Hematol 2001; 112(3): 768—775. 75. Mauch PM, Weiss,L, Armitage JO. Hodgkin’s disease in Cancer Medicine, 6th Edition; ed Holland J, Frei E. BC Decker Inc, Hamilton, London, 2003: 2182 76. Moskowitz C., Zelenetz A., Yaholom J. Risk-Adapted therapy for patients with relapsed or primary refractory Hodgkin's Disease. Ann.Oncol. 2002. V13. S.2. P.201 77. Ptushkin VV, Uss AL, Afanasyev BV, Karamanesht EE, Zhukov NV, Milanovich NF, Mikhaylova NB, Korenkova IS, Demina EA, Zmachinski VA, Pugachev AA, Borodkin SV. High dose chemotherapy (HDC) with autologous stem cell rescue (ASCR) in patients with poor prognosis Hodgkin’s disease: results from 4 centers in Belarus, Russia and Ukraine. Abstracts of Russian-Norwegian conference in hematology, September 4-7, 2003, Saint-Petersburg, page 94 78. Stein H., Marafioti T., Foss H. D., Laumen H., Hummel M., Falini B. Downregulanion of BOB 1/OBF.1 and Oct2 in classical Hodgkin disease but not lymphocyte predominant Hodgkin disease cjrrelates with immunoglobulin transcription. Blood 2001; 97(2): 496—501. 43