Аннотация к работе "Фотоионохромные производные 1-феноксиантрахинона: синтез, структура, свойства", автор: Мартьянов Т.П.
advertisement

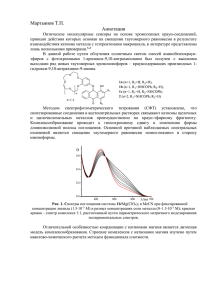
Аннотация к работе "Фотоионохромные производные 1-феноксиантрахинона: синтез, структура, свойства", автор: Мартьянов Т.П. Фотоуправляемые ионофоры (ФУИ) представляют интересный класс оптических молекулярных сенсоров, структура которых содержит фотохромный фрагмент, способный под действием света подвергаться значительным структурным изменениям, и ковалентно связанный с ним ионофорный фрагмент, селективно связывающий катионы металлов или другие частицы. Необходимым условием дизайна таких ионофоров является влияние фотоиндуцированных структурных изменений на устойчивость комплексов ионофорной части молекулы. ФУИ могут быть использованы для разработки фотоуправляемой экстракции, фоторефрактивных и фоточувствительных ионопроводящих материалов. Последние могут применяться в электрографии. К настоящему времени в дизайне ФУИ было использовано несколько типов обратимых фотореакций, таких как геометрические фотоизомеризации диарилэтиленов, азобензола и тиоиндиго, валентные фотоизомеризации спиросоединений и хроменов, фотоциклизация дигетарилэтенов и др. Однако, отсутствуют примеры синтеза ФУИ на основе обратимого фотоарилотропного перехода, характерного для пери-арилокси-пара-хинонов. Преимущества такого фотохромного процесса заключаются в большом диапазоне цветовых изменений, высоких квантовых выходах и достаточной термической стабильностью фотоформы. Цель работы – путем экспериментального исследования оценить потенциальные возможности полиэфирных производных 1-фекоксиантрахинона для использования в качестве фотоуправляемых ионофоров и компонентов фотоионохромных материалов. Для выполнения поставленной цели планировалось выполнить следующие задачи: - синтезировать новые полиэфирные производные 1-феноксиантрахинона; - экспериментально исследовать фотохимические и комплексообразующие свойства полученных лигандов с целью установления корреляций структура-свойство; - изучить взаимовлияние процессов комплексообразования и валентной фотоизомеризации. Синтез был осуществлен в две стадии. На первом этапе по стандартной методике нуклеофильно замещали атомы хлора в дихлорантрахиноне 1. Далее замещали одну феноксигруппу на алкоголят монометилового эфира тетраэтиленгликоля (МЭТ) в присутствии гидрида натрия в ТГФ. В синтезе использовали производное тетраэтиленгликоля, а не краун-эфирное производное, так как стоимость последнего существенно выше, и МЭТ в качестве ионофорного фрагмента достаточно, чтобы продемонстрировать принцип действия и перспективность таких ФУИ. Установлено, что все целевые соединения 3 обладают фотохромизмом (рис. 1). С помощью методов глобального анализа спектрофотометрических данных были определены спектры поглощения фотоформ и квантовые выходы прямой и обратной реакций фотопереноса фенильной группы антрахинонов 3 в ацетонитриле. Для феноксиантрахинона с расположением полиэфирной цепи в 8-положении 3c квантовый выход был оценен с большой погрешностью, поскольку при облучении фотоформа подвергалась деструкции, и наблюдалось появление новой ДПП в области 440 нм с разгоранием оранжевой флуоресценции. Наиболее вероятно, что продуктом деструкции является полиэфирное производное 1-гидроксиантрахинона. В результате 2+ комплексообразования соединений 3a,b с ионами Ca квантовый выход пара-анафотоизомеризации понижается, а ана-пара-фотоизомеризации – несколько повышается. Комплекс 3c·Ca2+ не обладает фотоактивностью. Добавление перхлората кальция к ацетонитрильному раствору смеси фотоизомеров 3c приводит к смещению фоторавновесия в сторону исходного пара-хинона. 1.0 3a фотостационарное состояние 3a (365 нм) D 0.8 0.6 0.4 0.2 0.0 300 400 500 / нм 600 Рис. 1 Эволюция спектра поглощения при стационарном облучении соединения 3a в MeCN (CL = 1104 М, кювета 1 см) светом с = 365 нм и интенсивностью 2.5110–9 моль·см2·с1. Комплексообразование изучали методом глобального анализа данных спектрофотометрического титрования (СФТ) с использование процедуры параметрического матричного моделирования. Добавление перхлоратов щелочных и щелочноземельным металлов к ацетонитрильным растворам лигандов 3 (пара-хиноидная форма) приводит к батохромному сдвигу длинноволновой полосы поглощения, что свидетельствует о комплексообразовании с акцепторной частью хромофорного фрагмента (рис. 2). Также был проведен рентгеноструктурный анализ монокристалла комплекса 3c·NaClO4, который подтверждает связывание катиона карбонильным атомом кислорода антрахинонового фрагмента (длина связи 2.33 Å). Помимо констант устойчивости пара-хиноидной формы лигандов 3a,b с ионами Na+, Ca2+, были также измерены константы устойчивости ана-хиноидной формы. В результате фотопереноса фенильной группы устойчивость кальциевых комплексов с лигандами 3a,b повышается в 3 раза. Предположительно миграция фенильной группы приводит к росту величины отрицательного заряда на карбонильном атоме кислорода, находящемся в пери-положении к полиэфирной цепи. В результате проделанной работы были синтезированы полиэфирные производные 1-феноксиантрахинона, изучена их фотохимия и комплексообразование с катионами металлов. Установлено, что координация 1,4- и 1,5-замещенных лигандов с катионами металлов приводит к понижению квантовых выходов пара-ана-фотоизомеризации и повышению ана-пара-фотоизомеризации. При этом миграция фенильной группы в свою очередь приводит к повышению константы устойчивости. Комплекс 1,8-замещенного антрахинона 3c с катионом кальция фотоинертен. Добавление Ca(ClO4)2 к раствору смеси фотоизомеров 3c приводит к изомеризации ана-хинона в исходный пара-хинон.