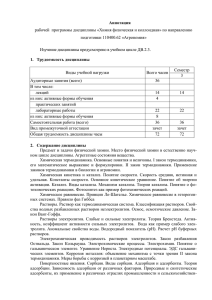
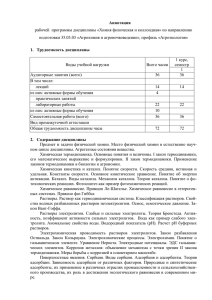
Document 755471
advertisement

МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ – МСХА имени К.А. ТИМИРЯЗЕВА» (ФГБОУ ВПО РГАУ - МСХА имени К.А. Тимирязева) Факультет почвоведения, агрохимии и экологии Кафедра физической и органической химии УТВЕРЖДАЮ: Проректор по организации и развитию учебной деятельности проф. ____________ С.В. Золотарев “____”______________2012 г. РАБОЧАЯ ПРОГРАММА УЧЕБНОЙ ДИСЦИПЛИНЫ Модуль «Химия» Модульная дисциплина «ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ» для подготовки бакалавров по профилю «Охотоведение» ФГОС ВПО 3-го поколения Направление 020400.62 «Биология» Курс 2 Семестр 3 Москва, 2012 Составители: Белопухов С.Л., д.с.х.н., к.х.н., профессор Семко В.Т., к.т.н., доцент (ФИО, ученая степень, ученое звание) «__» ________ 2012г. Рабочая программа предназначена для преподавания дисциплины блока Б2.В.ОД.4 студентам очной формы обучения Программа составлена в соответствии с требованиями ФГОС ВПО по направлению подготовки 020400.62 «Биология», утверждённого приказом Министерства образования и науки Российской Федерации от «04» февраля 2010 г. № 101 и зарегистрированного в Минюсте РФ «25» февраля 2010г. № 16504 и примерной учебной программы дисциплины «Физическая и коллоидная химия». Программа обсуждена на заседании кафедры физической и органической химии Зав. кафедрой Белопухов С.Л., д.с.-х.н., к.х.н., профессор (ФИО, ученая степень, ученое звание) ______________ (подпись) «__» ________ 2012г. Рецензент: Бочкарев А.В., к.х.н., доцент _______________ (ФИО, ученая степень, ученое звание) Проверено: Начальник отдела менеджмента качества образования (подпись) ______________ Л.А. Ефимова (подпись) Начальник отдела разработки и обеспечения образовательных программ УМУ ______________ Л.М. Сашина (подпись) 2 Согласовано: Декан зооинженерного факультета, д.с.х.н., профессор Юлдашбаев Ю.А. __________________ (ФИО, ученая степень, ученое звание) (подпись) «__» ________ 2012г. Программа обсуждена на заседании Ученого совета зооинженерного факультета, протокол № ______ Секретарь ученого совета зооинженерного факультета Боронецкая Л.В., к.с-х.н, _________________ (подпись) «__» ________ 2012г. Программа принята учебно-методической комиссией по направлению подготовки «Биология» протокол № ______ Председатель учебно-методической комиссии Маловичко Л.В., д.б.н., профессор «__» ________ 2012г. Заведующий выпускающей кафедрой Блохин Г.И., д.с.-х.н., профессор «__» _______ 2012г. Начальник УИТ _______________М.Ю. Гладких (подпись) Отдел комплектования ЦНБ _______________Е.А. Комарова (подпись) Копия электронного варианта получена: Начальник отдела поддержки дистанционного обучения УИТ ______________ И.Н. Батура (подпись) 3 Содержание АННОТАЦИЯ .......................................................................................................... 5 1. ЦЕЛИ ОСВОЕНИЯ ДИСЦИПЛИНЫ ............................................................... 5 2. МЕСТО ДИСЦИПЛИНЫ В УЧЕБНОМ ПРОЦЕССЕ .................................... 5 3. КОМПЕТЕНЦИИ ОБУЧАЮЩЕГОСЯ, ФОРМИРУЕМЫЕ В РЕЗУЛЬТАТЕ ОСВОЕНИЯ ДИСЦИПЛИНЫ ............................................................................... 5 4. СТРУКТУРА И СОДЕРЖАНИЕ ДИСЦИПЛИНЫ ...................................... 9 4.1 РАСПРЕДЕЛЕНИЕ ТРУДОЁМКОСТИ ДИСЦИПЛИНЫ ПО ВИДАМ РАБОТ ПО СЕМЕСТРАМ (МОДУЛЯМ) ........................................................................................ 9 4.2 СОДЕРЖАНИЕ ДИСЦИПЛИНЫ .......................................................................... 9 4.3 ЛАБОРАТОРНЫЕ/ПРАКТИЧЕСКИЕ/СЕМИНАРСКИЕ ЗАНЯТИЯ ........................... 11 4.4 ПЕРЕЧЕНЬ ВОПРОСОВ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ ДИСЦИПЛИНЫ .. 13 4.5 КУРСОВЫЕ РАБОТЫ (ПРОЕКТЫ)/ КОНТРОЛЬНЫЕ РАБОТЫ/ РАСЧЁТНОГРАФИЧЕСКИЕ РАБОТЫ/ УЧЕБНО-ИССЛЕДОВАТЕЛЬСКИЕ РАБОТЫ / РЕФЕРАТЫ .... 14 5. ОБРАЗОВАТЕЛЬНЫЕ ТЕХНОЛОГИИ ......................................................... 16 6. ОЦЕНОЧНЫЕ СРЕДСТВА ДЛЯ ТЕКУЩЕГО КОНТРОЛЯ УСПЕВАЕМОСТИ И ПРОМЕЖУТОЧНОЙ АТТЕСТАЦИИ ПО ИТОГАМ ОСВОЕНИЯ ДИСЦИПЛИНЫ ............................................................................. 17 6.1 ОЦЕНОЧНЫЕ СРЕДСТВА ТЕКУЩЕГО КОНТРОЛЯ УСПЕВАЕМОСТИ И СФОРМИРОВАННОСТИ КОМПЕТЕНЦИЙ ................................................................. 17 6.2 ПРИМЕРНЫЙ ПЕРЕЧЕНЬ ВОПРОСОВ К ЭКЗАМЕНУ ПО ДИСЦИПЛИНЕ ............... 18 7. УЧЕБНО-МЕТОДИЧЕСКОЕ И ИНФОРМАЦИОННОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ .................................................................................................... 20 7.1 ОСНОВНАЯ ЛИТЕРАТУРА ................................................................................ 20 7.2 ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА .................................................................... 20 7.3 МЕТОДИЧЕСКИЕ УКАЗАНИЯ, РЕКОМЕНДАЦИИ И ДРУГИЕ МАТЕРИАЛЫ К ЗАНЯТИЯМ ............................................................................................................ 21 7.4 ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ И ИНТЕРНЕТ-РЕСУРСЫ................................... 21 8. МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ .... 22 9. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ СТУДЕНТАМ ПО ОСВОЕНИЮ ДИСЦИПЛИНЫ .................................................................................................... 23 ВИДЫ И ФОРМЫ ОТРАБОТКИ ПРОПУЩЕННЫХ ЗАНЯТИЙ ...................................... 23 10. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПРЕПОДАВАТЕЛЯМ ПО ОРГАНИЗАЦИИ ОБУЧЕНИЯ ПО ДИСЦИПЛИНЕ ......................................... 24 4 Аннотация Дисциплина «Физическая и коллоидная химия» является составной частью математического и естественнонаучного цикла (Б2) и занимает одно из ведущих мест среди фундаментальных дисциплин. Студенты получают основы знаний законов химии, включая законы химической термодинамики, химической кинетики, электрохимии, явлений, происходящих на границе раздела фаз, в коллоидных системах, высокомолекулярных соединениях, что позволит применять полученные знания при проведении научных исследований в биологических системах различных уровней организации, изучении процессов их жизнедеятельности, в биологических, биоинженерных, биомедицинских, природоохранных технологиях. Трудоемкость дисциплины 2 зач. ед., форма контроля – зачет. Ведущие преподаватели: доктор сельскохозяйственных наук, кандидат химических наук, профессор Белопухов Сергей Леонидович, кандидат химических наук, доцент Немировская Ирина Борисовна, кандидат технических наук, доцент Семко Владимир Трофимович, кандидат биологических наук, доцент Старых Светлана Эдуардовна, кандидат биологических наук, доцент Шнее Т.В. 1. Цели освоения дисциплины Цель дисциплины – формирование теоретических основ и умений по физической и коллоидной химии. Задачами дисциплины являются: - изучение законов химической термодинамики и химической кинетики, закономерностей протекания химических, физико-химических, электрохимических и коллоидно-химических процессов в биологических системах различных уровней организации, - овладение методиками и методами исследования физико-химических свойств растворов, коллоидных систем и высокомолекулярных соединений, - ознакомление с основами электрохимических процессов, окислительновосстановительными реакциями, определение окислительновосстановительного потенциала в биологических системах, - формирование представлений о роли коллоидных систем, высокомолекулярных соединений и их свойствах в биологических объектах, почвах, - изучение факторов, влияющих на образование и устойчивость коллоидных систем, - изучение физико-химических свойств высокомолекулярных соединений. 2. Место дисциплины в учебном процессе Дисциплина «Физическая и коллоидная химия» включена в обязательный перечень ФГОС ВПО, в математический и естественнонаучный цикл дисциплин вариативной части. Реализация в дисциплине «Физическая и коллоидная 5 химия» требований ФГОС ВПО, ООП ВПО осуществляется в соответствии с Учебным планом по направлению 020400.62 Биология, профилю подготовки «Охотоведение». Предшествующими курсами, на которых непосредственно базируется дисциплина «Физическая и коллоидная химия» являются: «Физика», «Математика», «Неорганическая химия», «Аналитическая химия», «Органическая химия». Курс «Физическая и коллоидная химия» является основополагающим для изучения следующих дисциплин: «Биология», «Физиология человека и животных», «Биоэкология», «Биохимия», «Физико-химические методы анализа». Особенностью дисциплины является ее направленность на реализацию студентами полученных знаний в практической деятельности, формировании современного мировоззрения о процессах, постоянно и периодически происходящих в биологических системах, на основе современных знаний и законов физической и коллоидной химии, понимании возможностей и механизмов влияния (управления) на процессы (реакции), протекающие в агросфере. 3. Компетенции обучающегося, формируемые в результате освоения дисциплины Изучение учебной дисциплины «Физическая и коллоидная химия» направлено на формирование у обучающихся общекультурных (ОК) и профессиональных (ПК) компетенций, представленных в таблице 1. 6 Таблица 1 Требования к результатам освоения учебной дисциплины № п/п Индекс компетенции 1. ОК-6 2. ПК-15 Содержание компетенции (или её части) Использует в познавательной и профессиональной деятельности базовые знания в области математики и естественных наук, применяет методы математического анализа и моделирования, теоретического и экспериментального исследования В результате изучения учебной дисциплины обучающиеся должны: знать основные понятия и законы физической и коллоидной химии, физикохимические свойства неорганических и органических соединений, законы термодинамики и кинетики, физикохимические, коллоиднохимические свойства почв, удобрений, воды, других химических веществ, методики расчетов физико-химических параметров уметь воспринимать, обобщать и анализировать информацию, полученную из разных источников, по физико-химическим, электрохимическим процессам, происходящим в почве и растении, рассчитывать и оценивать физико-химические и коллоидно-химические параметры и характеристики, используя законы химической термодинамики и кинетики, электрохимии, использовать математические модели для расчета физикохимических характеристик Способен эксплуатировать признаки, параметры, фи- использовать знания фисовременную аппаратуру и зико-химические свойства зико-химических свойств оборудование для выпол- неорганических и оргавеществ в лабораторной нения научнонических соединений, и производственной владеть ставить цель и организовывать её достижение, уметь пояснить свою цель и выбирать пути достижения, систематизировать методы решения задач, описывать результаты, формулировать выводы, прогнозировать развитие ситуаций, изменение состояния параметров системы или элементов, результаты эксперимента классифицировать объекты, системы, самостоятельно формулируя основания для класси- исследовательских полевых и лабораторных биологических работ коллоидных систем и высокомолекулярных соединений, связи между ними и изменения в процессе проведения анализа методы, средства, приёмы, алгоритмы, способы расчета физикохимических и коллоиднохимических свойств соединений, изменения их при изменении внешних условий практике, выбирать необходимые приборы и оборудование, выбирать способы и законы, критерии для решения практических задач фикации; организовывать планирование и проведение анализа описывать результаты, формулировать выводы 8 4. Структура и содержание дисциплины 4.1 Распределение трудоёмкости дисциплины по видам работ по семестрам (модулям) Общая трудоёмкость дисциплины составляет 3 зач.ед. (108 часов), их распределение по видам работ семестрам представлено в таблице 2. Таблица 2 Распределение трудоёмкости дисциплины по видам работ по семестрам (модулям) Трудоёмкость Вид учебной работы в т.ч. по семестрам зач. ед. Общая трудоёмкость дисциплины по учебному плану Аудиторная работа: лекции (Л) лабораторные работы (ЛР) Самостоятельная работа (СРС) самостоятельное изучение разделов контрольные работы (Кр) консультации (К) самоподготовка (проработка и повторение лекционного материала и материала учебников и учебных пособий, подготовка к лабораторным и практическим занятиям, коллоквиумам, рубежному контролю и т.д.) Вид контроля: 3 1,5 1,5 час. №3 108 108 54 18 36 54 36 4 4 54 18 36 54 36 4 4 10 10 зачет 4.2 Содержание дисциплины Раздел 1. «Химическая термодинамика » Предмет и содержание курса физической химии. Значение физической химии. Химическая термодинамика. Первое начало термодинамики. Внутренняя энергия, теплота и работа. Теплоты процессов при постоянном объеме и давлении. Энтальпия. Закон Гесса. Следствия из закона Гесса. Теплоты образования и сгорания. Стандартные теплоты. Зависимость теплового эффекта от температуры. Уравнения Кирхгофа. Второе начало термодинамики, его математическое выражение. Энтропия. Статистическое истолкование понятия энтропии. Связь энтропии с термодинамической вероятностью. Применение второго начала термодинамики к изобарно-(изохорно-) изотермическим процессам. Энергия Гиббса, энергия Гельмгольца. Определение направления процесса и условий равновесия. Третье начало термодинамики (постулат Планка). Вычисление абсолютной энтропии. Раздел 2. «Химическая кинетика» Кинетика. Скорость реакции. Константа скорости. Уравнение Аррениуса. Прямая реакция. Обратная реакция. Закон действующих масс. Порядок реакции по веществам. Общий порядок реакции. Элементарные реакции. Молекулярность реакции. Реакции нулевого порядка. Реакции первого порядка. Реакции второго порядка. Период полураспада. Правило Вант-Гоффа. Уравнение Аррениуса. Температурный коэффициент. Энергия активации. Катализ. Фотохимические реакции. Раздел 3. «Растворы» Общая характеристика растворов. Идеальные растворы. Законы Рауля. Отклонение от закона Рауля. Термодинамика растворов. Диаграмма давление-состав. Диаграмма кипения. Осмос. Осмотическое давление. Уравнение Вант-Гоффа. Роль осмоса в биологических системах. Понятие рН растворов. Буферные системы и их свойства. Буферная емкость. Определение рН потенциометрическим методом. Роль буферных систем в биологических объектах. Раздел 4. «Электрохимия» Растворы электролитов. Теория электрической диссоциации Аррениуса. Основные положения теории сильных электролитов Дебая и Хюккеля. Активность, коэффициент активности. Зависимость коэффициента активности от ионной силы. Электропроводность растворов. Удельная и эквивалентная электропроводность, зависимость от концентрации. Закон независимости движения ионов. Подвижность ионов. Практическое применение метода электропроводности. Электродные процессы. Гальванические элементы. Возникновение потенциала на границе раздела фаз. Строение двойного электрического слоя. Уравнение Нернста для электродного потенциала. Гальванический элемент. Термодинамический вывод уравнения для электродвижущей силы (ЭДС). Электроды 1-го, 2-го рода, редокс-электроды. Стандартный потенциал. Типы гальванических элементов: химические и концентрационные. Практическое использование метода потенциометрии. Раздел 5. «Поверхностные явления» Поверхностная энергия. Сорбционные процессы. Адсорбция на границе твердое тело-газ. Уравнение Фрейндлиха. Теория мономолекулярной адсорбции. Адсорбция на границе твердое тело-раствор. Типы адсорбентов. Иониты. Тепловые эффекты при адсорбции. Адсорбция на границе раствор-газ. Поверхностно-активные вещества. Уравнение Гиббса. Правило Траубе. Уравнение Шишковского. Строение монослоев. Адсорбционное понижение твердости. Раздел 6. «Свойства дисперсных систем» Основные особенности коллоидного состояния. Классификация дисперсных систем. Образование двойного ионного слоя. Правило Фаянса-ПаннетаПескова. Электрокинетические явления. Строение двойного электрического слоя. Электрокинетический потенциал и его определение. Строение мицеллы. Молекулярно-кинетические и оптические свойства коллоидных систем. Броуновское движение. Диффузия. Седиментационное равновесие. Опалесценция. Ультрамикроскопия. Эффект Тиндаля. Диализ. Электродиализ. Факторы устойчивости коллоидных систем. Расклинивающее давление. Концентрационная и нейтрализационная коагуляция. Коагуляция электролитами. Кинетика коагуляции. Структурообразование в дисперсных системах. Вязкость свободно10 дисперсных систем. Связно-дисперсные системы. Структурная вязкость. Гели. Тиксотропия. Факторы, влияющие на переход молекулярной формы в мицеллярную. Солюбилизация. Раздел 7. «Высокомолекулярные соединения и их растворы» Высокомолекулярные соединения (ВМС), особенности строения их молекул. Гибкость молекул. Эластичность и пластичность полимеров. Вулканизация. Агрегатное состояние. Растворы высокомолекулярных соединений. Растворение полимеров. Сольватация молекул. Ассоциация молекул в растворах полимеров. Особенности осмотического давления и вязкости у растворов полимеров. Методы определения молекулярной массы. Набухание. Степень. Кинетика набухания. Давление набухания. Студни. Таблица 3 Тематический план учебной дисциплины Наименование разделов и тем дисциплин (укрупнёно) Аудиторная работа Л ПЗ ЛР Всего Внеаудито рная работа СР Раздел 1 «Химическая термодинамика» Раздел 2 «Химическая кинетика» Раздел 3 «Растворы» Раздел 4 «Электрохимия» Раздел 5 «Поверхностные явления» Раздел 6 «Свойства дисперсных систем» Раздел 7 «Высокомолекулярные соединения и их растворы» Всего за 3 семестр 14 12 18 12 12 18 4 2 2 2 2 4 4 4 8 4 4 6 8 6 8 8 8 10 15 2 6 6 72 18 36 54 Итого по дисциплине 108 18 36 54 4.3 Лабораторные/практические/семинарские занятия Таблица 4 Содержание лабораторного практикума и контрольных мероприятий № п/п 1. № раздела № и название лабораторных/ практических/ семинарских занятий с указанием контрольных мероприятий Раздел 1. (Химическая термодинамика) Лабораторная работа № 1. Тема Термохимия. Закон Гесса. Опре(Применение деление тепловых эффектов хизаконов термических реакций. модинамики) Лабораторная работа № 2. Определение энтропии реакции, энергии активации. Вид контрольного мероприятия защита лабораторных работ, тестирование защита лабораторных работ, тестирование, Кол-во часов 4 2 2 11 № п/п № раздела № и название лабораторных/ практических/ семинарских занятий с указанием контрольных мероприятий Вид контрольного мероприятия Кол-во часов коллоквиум 2. Раздел 2. (Химическая кинетика) Тема Лабораторная работа № 3. Кине(Скорость хи- тика химических реакций в растворах. мических реакций и равно- Лабораторная работа № 4. Химическое равновесие. Закон дейвесие) ствующих масс. 3. Раздел 3. (Растворы) Лабораторная работа № 5. Тема Растворы. Исследование свойств (Физикобуферных и небуферных систем. химические методы иссле- Лабораторная работа № 6. Определение рН потенциометридования расческим методом в биологических творов) объектах 4. Раздел 4. (Электрохимия) Лабораторная работа № 7. Тема (Практическое Определение электродных потенциалов и концентрации ионов применение в растворах методом измерения законов элек- электродвижущих сил трохимии) Лабораторная работа № 8. защита лабораторных работ, тестирование защита лабораторных работ, тестирование защита лабораторных работ, тестирование защита лабораторных работ, тестирование, коллоквиум защита лабораторных работ, тестирование защита лабора- Электрическая проводимость и ее торных работ, использование для анализа растестирование, творов электролитов 4 2 2 8 4 4 4 2 2 коллоквиум 5. Раздел 5. (Поверхностные явления) Лабораторная работа № 9. Тема Поверхностные явления и ад(Явления на границе разде- сорбция. Лабораторная работа № 10. ла фаз) Иониты и ионный обмен 6. Раздел 6. (Свойства дисперсных систем) Лабораторная работа № 11. Тема Коллоидные системы, их образо(Коллоидные вание и свойства Криоскопия и системы и их эбуллиоскопия. свойства) Лабораторная работа № 12. Коагуляция лиофобных и лиофильных коллоидных растворов защита лабораторных работ, тестирование защита лабораторных работ, тестирование защита лабораторных работ, тестирование защита лабораторных работ, тестирование, коллоквиум 4 2 2 6 3 3 12 № п/п 7. № и название лабораторных/ практических/ семинарских занятий с указанием контрольных мероприятий № раздела Раздел 7. (Высокомолекулярные соединения и их растворы) Лабораторная работа № 13. Тема (Высокомоле- Химические и физикохимические свойства растворов кулярные совысокомолекулярных соединеединения и их ний. свойства) Лабораторная работа № 14. Определение изоэлектрической точки гидрофильного золя вискозиметрическим методом Вид контрольного мероприятия Кол-во часов 6 защита лабораторных работ, тестирование 3 защита лабораторных работ, тестирование, коллоквиум 3 ВСЕГО 36 4.4 Перечень вопросов для самостоятельного изучения дисциплины Таблица 5 Перечень вопросов для самостоятельного изучения дисциплины № п/п 1. 2. 3. 4. 5. 6. № раздела и темы Раздел 1 Тема 1. Первый закон термодинамики Тема 2. Второй закон термодинамики Раздел 2 Тема 1. Кинетика химических реакций Раздел 3 Тема 1. Законы Рауля Перечень рассматриваемых вопросов для самостоятельного изучения Кол-во часов 8 Теплоты процессов при постоянном объеме и давлении. Уравнения Кирхгофа. Статистическое истолкование понятия энтропии. Связь энтропии с термодинамической вероятностью. Применение второго начала термодинамики к изобарно-(изохорно-) изотермическим процессам. 4 4 6 Молекулярность реакции. Реакции нулевого порядка. Реакции первого порядка. Реакции второго порядка. Период полураспада. Законы Рауля. Отклонение от закона Рауля. Термодинамика растворов. Диаграмма давление-состав. Тема 2. Уравне- Уравнение Вант-Гоффа. Осмос. Осмотичения Вант-Гоффа ское давление. Роль осмоса в биологических системах. Раздел 4 Тема 1. Электро- Удельная и эквивалентная электропроводпроводность ность, зависимость от концентрации. Закон независимости движения ионов. Подвиж- 6 8 4 4 8 4 13 № п/п 7. 8. 9. 10 11 12 13 № раздела и темы Перечень рассматриваемых вопросов для самостоятельного изучения ность ионов. Практическое применение метода электропроводности. Тема 2. Элек- Возникновение потенциала на границе раздетродные процес- ла фаз. Строение двойного электрического сы слоя. Уравнение Нернста для электродного потенциала. Гальванический элемент. Раздел 5 Тема 1. Сорбци- Адсорбция на границе твердое тело-раствор. онные процессы Типы адсорбентов. Иониты. Тепловые эффекты при адсорбции. Тема 2. Практиче- Уравнение Шишковского. Строение моноское применение слоев. Адсорбционное понижение твердости. адсорбции Раздел 6 Тема 1. Электро- Строение двойного электрического слоя. кинетические яв- Электрокинетический потенциал и его опреления деление. Строение мицеллы. Тема 2. Устойчи- Расклинивающее давление. Концентрационвость коллоидных ная и нейтрализационная коагуляция. Коагусистем ляция электролитами. Кинетика коагуляции. Раздел 7 Тема 1. Строение Особенности строения их молекул. Гибкость ВМС молекул. Эластичность и пластичность полимеров. Вулканизация. Агрегатное состояние. Тема 2. Растворы Ассоциация молекул в растворах полимеров. ВМС Особенности осмотического давления и вязкости у растворов полимеров. Методы определения молекулярной массы. Набухание. Степень. Кинетика набухания. Давление набухания. ВСЕГО Кол-во часов 4 8 4 4 10 6 4 6 3 3 54 4.5 Курсовые работы (проекты)/ контрольные работы/ расчётнографические работы/ учебно-исследовательские работы / рефераты Примеры тестов: 1. Укажите правильную формулировку закона Гесса: а) тепловой эффект химической реакции, проводимой при V=const, или Р=const, зависит от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути проведения реакции; б) тепловой эффект химической реакции зависит только от начального и конечного состояний вещества, но не зависит от пути проведения реакции; в) тепловой эффект химической реакции зависит от вида и состояния исходных веществ и конечных продуктов; 14 г) тепловой эффект химической реакции зависит от агрегатных состояний, в которых находятся исходные и конечные продукты. 2. Каким методом можно определить водяное число калориметра? а) необходимо определить через спираль, помещенную в калориметр, определенное количество электрического тока; б) необходимо провести в калориметре любую химическую реакцию; в) необходимо нагреть калориметр до определенной температуры; г) необходимо количественно провести в калориметре химическую реакцию с известным тепловым эффектом и по полученному значению t0 рассчитать водяное число. 3. Какие условия приняты в термохимии за стандартное состояние? а) состояние чистого вещества при Р = 1 атм.; б) состояние чистого вещества при Р = 1 атм и t = 250 С в соответствующем для данных условий агрегатном состоянии; в) состояние чистого вещества при t = 250 С; г) Состояние чистого вещества при Р = 1 атм и t = 250 C, находящегося в виде пара. 4. Чему равен тепловой эффект химической реакции при Р = const? а) Qp = Rln V2/V1 б) Qp = U + PV - TS в) Qp = RT/nFlga г) Qp = H 5. Какие реакции пригодны для термохимических измерений? а) реакции, дающие продукты неопределенного состава; б) реакции, идущие медленно; в) реакции, которые проходят быстро и до конца и образуют продукты вполне определенного состава; г) реакции, протекающие обратимо. 6. Чему равен тепловой эффект реакции при V = сonst? а) Qv = dU + PV б) Qv = dU + A в) Qv = U г) Qv = dU + nRT 7. До каких пор может протекать самопроизвольный процесс в изолированной системе? а) пока система не достигнет стандартного состояния; б) пока энтропия системы не достигнет максимального для данных условий значения; 15 в) пока внутренняя энергия не достигнет максимального для данных условий значения; г) в изолированной системе самопроизвольный процесс вообще не может протекать. 8. Почему Qv химических реакций не зависит от пути проведения реакций, а только от состояния начальных веществ и конечных реакций? а) потому что Qv измеряется при условии V = const; б) потому что в ходе химической реакции, проводимой при V = const, не совершается работы расширения газа; в) потому что Qv представляет собой изменение внутренней энергии вещества в ходе химической реакции, проводимой при V = const, а запас внутренней энергии определяется только состоянием вещества; г) потому что химические реакции, проводимые при V = const, всегда являются самопроизвольными. 9. Укажите правильное определение стандартной энтальпии химической реакции: а) стандартная энтальпия химической реакции представляет собой разность между стандартными энтальпиями образования продуктов реакции и исходных веществ; б) это разность между стандартными энтальпиями образования исходных веществ и продуктов реакции; в) стандартная энтальпия химической реакции представляет собой сумму стандартных энтальпий сгорания исходных и конечных веществ; г) стандартная энтальпия химической реакции представляет собой изменение внутренней энергии исходных веществ в ходе реакции. 10. Какие реакции пригодны для термохимических измерений? а) реакции, идущие медленно; б) реакции, которые проходят быстро и до конца, и образующие продукты вполне определенного состава; в) реакции, дающие продукты неопределенного состава; г) реакции, протекающие обратимо. 5. Образовательные технологии Таблица 6 Применение активных и интерактивных образовательных технологий № п/п 1. Тема и форма занятия Химическая кинетика Наименование используемых активных и интерактивных образовательных технологий Кол-во часов ЛР Оценка влияния температуры, концен- 4 трации и давления на скорость химической реакции и равновесие в системе жидкость - жидкость, газ - жид16 № п/п 2. 3 Тема и форма занятия Наименование используемых активных и интерактивных образовательных технологий Кол-во часов кость, твердое тело – жидкость и твердое тело – газ с применением программы Simulink Физико-химические ЛР Разработка способов влияния на кол4 свойства дисперсных лоидно-химические свойства в почсистем венных растворах с применением программы Simulink Физико-химические ЛР Применение компьютерного модели4 свойства растворов рования для оценки влияния рН среды, высокомолекулярных температуры, состава системы на соединений устойчивость и физико-химические свойства растворов высокомолекулярных соединений Всего: 12 Общее количество часов аудиторных занятий, проведённых с применением активных и интерактивных образовательных технологий составляет 12 часов (25% от аудиторных занятий). 6. Оценочные средства для текущего контроля успеваемости и промежуточной аттестации по итогам освоения дисциплины 6.1 Оценочные средства сформированности компетенций текущего контроля успеваемости и Система рейтингового учёта знаний и навыков студентов Интервал оценки Лекции 0-2 Посещение Лабораторные рабо- 0-2 ты Тесты 0-5 Ответы на занятиях 3-5 Защита лаборатор3-5 Текущая ных работ оценка знаний Устные сообщения, и навыков заранее подготовлен- 10-15 ные Теоретическая кон10-30 ференция Круглый стол 0-20 Итоговая оценка знаний Экзамен 3-5 Оцениваемый параметр 9 27 Рейтинговая оценка (баллы) 0-18 0-72 0-54 14 4-5 0-70 12-25 14 42-70 Повторность 84-240 2-3 20-45 1 10-30 1 3 0-20 9-15 9-35 17 и навыков вопроса Дифференциация итоговой оценки 5 - 250-347 (автомат) Дифференциация итоговой оценки 5 - 270-347 4 – 230-270 (после круглого стола) Дифференциация итоговой оценки 5 - 300-347 4 - ≥ 230-270 3 – 200-230 (после экзамена) Отработки лабораторных занятий проводятся в течение семестра. Выполнение тестирования, защита лабораторных работ, сдача коллоквиумов проводится в течение семестра до начала сессии. 6.2 Примерный перечень вопросов к экзамену по дисциплине 1. Система и внешняя среда. Изолированная, закрытая, открытая системы. Внутренняя энергия системы. 2. Первое начало термодинамики. Изменение внутренней энергии при постоянном объеме и давлении. Функция состояния. Энтальпия. Связь между энтальпией и внутренней энергией. Тепловые эффекты химических реакций. Закон Гесса. 3. Второе начало термодинамики. Энтропия изолированной, закрытой и открытой систем. Свободная энергия Гиббса и свободная энергия Гельмгольца. Свободная энергия и направление химических реакций. Энтропия и термодинамическая вероятность. Статистическая интерпретация энтропии. 4. Агрегатные состояния вещества. Реальные газы. Уравнение Ван-дерВаальса. 5. Химическая кинетика, порядок и молекулярность реакций. Энергия активации. Уравнение Аррениуса. Методы определения энергии активации. Скорость гомогенных химических реакций. Кинетические кривые. Константа скорости. 6. Гомогенный и гетерогенный катализ. Принцип действия катализаторов. Ферментный катализ и его особенности. 7. Химическое равновесие. Закон действия масс для обратимых процессов. Константа химического равновесия. Условия смещения равновесия. Принцип Ле-Шателье. 8. Фотохимические реакции. Закон фотохимической эквивалентности. Закон Эйнштейна и квантовый выход. 9. Уравнение состояния идеального газа. Парциальное давление. Закон Дальтона. Кинетическая теория газов. Скорость молекул и закон распределения скоростей. Осмотическое давление. Закон Вант-Гоффа. 10. Теория электролитической диссоциации. Электролитическая диссоциация воды. Шкала кислотности по отношению к воде. Ионное произведение воды. Понятие рН и использование его в агрономии. Ионная сила растворов, активность, коэффициент активности электролитов. Потенциометрическое определение рН. 18 11. Активность и ее отличие от аналитической концентрации. Определение активности растворов методом ЭДС. 12. Буферные системы, буферная ёмкость. Буферные растворы, их состав и механизм действия. Слабые электролиты. Константа электролитической диссоциации. Закон разведения. 13. Понижение температуры замерзания и повышение температуры кипения растворов в зависимости от их концентраций. 14. Основное уравнение электропроводности для растворов сильных электролитов. Удельная электрическая проводимость. 15. Электроды первого и второго рода. Уравнение Нернста. Способы определения потенциала, возникающего на электроде. Электродные процессы. Возникновение потенциала на границе раздела фаз. Гальванический элемент. Окислительно-восстановительные электроды и цепи. Определение окислительно-восстановительных потенциалов. 16. Диффузионные потенциалы. Нормальные потенциалы и ряд напряжений. Концентрационные цепи. Закон независимости движения ионов. 17. Изменение давления насыщенного пара над растворителем и над раствором в зависимости от температуры. Первый закон Рауля. 18. Электрокинетические свойства коллоидных систем. Электрофорез и электроосмос. Термодинамический, электрокинетический потенциал. 19. Поверхностно-активные вещества. Смачивание и его мера. Значение смачивания при действии пестицидов для борьбы с сорняками, вредителями и болезнями. Поверхностно-инактивные вещества. 20. Строение мицеллы лиофобных коллоидных растворов. 21. Электрокинетический (дзета) потенциал. Условия его возникновения в мицелле гидрофобного коллоида? Как связана агрегативная устойчивость с величиной электрокинетического потенциала коллоидных систем? 22. Методы получения и очистки коллоидных систем. Кинетическая и агрегативная устойчивость коллоидных систем. Нарушение устойчивости гидрофобных коллоидов. Правило значности и валентности. 23. Молекулярно-кинетические свойства коллоидных систем: броуновское движение, диффузия. Осмос в коллоидных системах. 24. Обменная адсорбция. Адсорбция на твёрдых поверхностях. Уравнение Фрейндлиха, уравнение Ленгмюра. Адсорбция в почвах. 25. Вязкость коллоидных растворов. Зависимость вязкости растворов ВМС от рН. Уравнение Эйнштейна и Думанского. Зависимость вязкости гидрофобных и гидрофильных коллоидов от концентрации. 26. Процесс набухания гелей высокомолекулярных соединений. Виды набухания. 27. Коагуляция лиофобных коллоидных растворов электролитами. 28. Сопоставление свойств лиофобных коллоидов и растворов высокомолекулярных соединений. 29. Растворы полиэлектролитов. Образование гелей и студней. 30. Диализ, ультрафильтрация, седиментация и центрифугирование коллоидных систем. 19 31. Классификация дисперсных систем. Основные особенности коллоидного состояния вещества. Факторы устойчивости коллоидных систем. 32. Специфические особенности растворов ВМС, их отличие от лиофобных коллоидных растворов. Нарушение устойчивости растворов ВМС. 33. Гидрофильные и гидрофобные поверхности. Смачивание и его мера. 34. Поверхностное натяжение. Адсорбция на поверхности растворов. Уравнение Гиббса. 35. Истинные, коллоидные растворы, сравнение их химических и физикохимических свойств. 36. Оптические свойства коллоидных систем. Эффект Тиндаля. 37. Осмотическое давление. Зависимость осмотического давления от концентрации растворов. 7. Учебно-методическое и информационное обеспечение дисциплины 7.1 Основная литература 1. Хмельницкий Р.А. Физическая и коллоидная химия.- М.: АльянС.- 2009.400с. 2. Физическая и коллоидная химия. Лабораторный практикум// С.Л. Белопухов, Т.В. Шнее, С.Э. Старых и др. – М.: Изд-во РГАУ-МСХА имени К.А. Тимирязева.-2009.- 230 с. 3. Белопухов С.Л., Глазко В.И., Старых С.Э., Будажапова М.Ж. Химический словарь. Физическая, коллоидная и нанохимия.- М.: Изд-во РГАУМСХА имени К.А. Тимирязева, 2010, 248 с. 4. Горшков В.И., Кузнецов И.А. Основы физической химии.- 3-е изд.-М.: БИНОМ. Лаборатория знаний, 2006.- 407 с. 5. Щукин Е.Д. Коллоидная химия, 3-е изд. перераб. и доп., М.: Высшая школа, 2004, 455 с. 6. Тютюнькова М.В., Белопухов С.Л., Сюняев Н.К., Анфилов К.Л. Химия агросферы, 2012, М.: Изд-во РГАУ-МСХА имени К.А. Тимирязева, 232с. 7.2 Дополнительная литература 1. Зимон А.Д. Физическая химия, М.: Агар, 2006, 320 с. 2. Еремин В.В., Лунин В.В. и др. Основы физической химии. Теория и задачи. М.: Экзамен, 2005, 400 с. 3. Березин Б.Д., Ломова Т.Н. Реакции диссоциации комплексных соединений. 2007, Институт химии растворов РАН, М.: Наука, 2007, 278 с. 4. Ершов Ю.А. Коллоидная химия, М.: ГЭОТАР-Медиа, 2012, 352 с. 5. Зимон А.Д., Павлов А.Н. Коллоидная химия наночастиц, М.: Научный мир, 2012, 224 с. 6. Химическая энциклопедия, в 5-ти томах, М.: Изд-во Советская энциклопедия, 1988. 20 7. Журнал физической химии. 8. Коллоидный журнал. 7.3 Методические указания, рекомендации и другие материалы к занятиям 1. При подготовке к лабораторно-практическим занятиям использовать рекомендации к лабораторным работам Лабораторного практикума «Физическая и коллоидная химия» (2009). 2. При проведении лабораторных работ необходимо строго соблюдать правила техники безопасности при работе в химической лаборатории, указания преподавателей и лаборантов кафедры. 3. Оформление лабораторных работ рекомендуется проводить в Рабочей тетради, выпускаемой ежегодно для студентов, по дисциплине Физическая и коллоидная химия. 7.4 Программное обеспечение и Интернет-ресурсы программное обеспечение: 1. Программа ChemLab – для проведения виртуальных химических экспериментов. 2. Программа MathLab – для моделирования влияния условий химических реакций, катализаторов и ингибиторов на выход продуктов при проведении экспериментов, расчет термодинамических параметров. 3. Программа Statistica – для анализа экспериментальных данных, визулизации полученных результатов, статистическая обработка результатов. базы данных, информационно-справочные и поисковые системы: Scifinder - поиск методик синтеза, литературный и патентный поиск по химии, SPRESIweb - литературный и патентный поиск, поиск по части молекулы и т.п. eMolecules - поиск соединений в комбинаторных базах данных, ChemExper - поиск соединений в различных базах данных, Chemnbase.narod.ru - базы данных по химии, Acros organics - поиск в каталогах, SyntheticPages - Интерактивная база данных химических методик, ISI's Reaction Citation Index (RCI) – база данных по химическим реакциям, PubSCIENCE - доступ к аннотациям статей в 1790 журналах, полнотекстовый поиск, PrePRINT Network - доступ к 340 000 препринтов на 1500 сайтах, Six NMR spectral and physical property databases from Advanced Chemistry Development (ACD) – данные по физико-химическим свойствам соединений, Cambridge Crystallographic Data Centre – поисковая система по свойствам веществ в базе Cambridge Structural Database, ChemSource – Интернет – ресурс по разделам химии, 21 NIST Chemistry WebBook – данные по термохимическим свойствам, энтальпии образования, энтропии более 15 000 химических соединений, ChemFinder Databases Search поисковая система по 100 химическим сайтам, The WWW chemical structures database - содержит более чем 2250 структур, ссылки на оригинальные страницы Сети. Структурный и субструктурный поиск, поиск по формуле, по названию и др. X-ray crystallography database – база данных по кристаллографии (Indiana University Molecular Structure Center), БАЗА ДАННЫХ "ХИМИЯ" Всероссийского института научной и технической информации (ВИНИТИ) - Доступны следующие базы данных, содержащие информацию в области химии: Химия, Физико-химическая биология, Коррозия и защита от коррозии, Металлургия, Охрана окружающей среды, Обзоры. Библиотека – содержит данные Химического факультета МГУ им. М.В. Ломоносова, Case Western Reserve University(CWRU) – база данных в области естественных наук и технологий Chemical Physics Preprint Database – база данных по физической химии, MDL Information Systems – информационно-поисковая система для ученых в области естественных наук и химии, MDL Drug Data Report (MDDR) - база данных, содержащая более 100,000 соединений (MDL Information System Inc.) AntiBase 2.0 – база данных по более чем 20 000 природных веществ еlibrary.ru – электронная библиотека, содержит статьи из более 30 000 журналов, Rambler, Yandex, Google – поисковые системы. 8. Материально-техническое обеспечение дисциплины 8.1 Требования к аудиториям (помещениям, местам) для проведения занятий Для чтения лекций проведения семинарских занятий необходима аудитория, оснащенная компьютером, мультимедийной техникой, интерактивным экраном-доской. 8.2 Требования к специализированному оборудованию Для проведения лабораторного практикума по дисциплине «Физическая и коллоидная химия» необходима специализированная химическая лаборатория, оборудованная столами для проведения химических опытов, вытяжкой с приточной и вытяжной вентиляцией. В лаборатории необходимо иметь: дистилляторы (типа АДЭа-10, АДЭа-25) , кондуктометры (типа АКП-02, АНИОН- 4120, АНИОН-4150, МАРК-603, HANNA), иономеры (типа рН-011МП, рХ-150, 22 АНИОН-4101), вискозиметры (типа ВПЖ-1, ВПЖ-2), приборы для измерения поверхностного натяжения (Тензиометр типа К6, К9), калориметры (типа С2000), поляриметры (типа СМ-3, П-161М), рефрактометры (типа ИРФ-464, ИРФ-470, АЛР-3), приборы для проведения электрофореза (типа КАПЕЛЬ103М), потенциометры (типа ИПЛ-101, ИПЛ-111), аналитические весы (типа ВЛ-210, ВЛ-210), технические весы (ВМ-510), термостаты (жидкостные серии Т-2, Т-3), термометры (ртутные, цифровые типа ТЦ-1200), спектрофотометры (типа КФК-3, ЭКСПЕРТ-003), пламенные фотометры (ФПА-378, ФПА-354, ФПА-22), оптические микроскопы (типа Микмед-6, ПОЛАМ РП-1), соответствующую химическую посуду и химические реактивы. 8.3 Требования к программному обеспечению учебного процесса № п/п Наименование раздела учебной дисциплины (модуля) 1 Раздел 2 «Химическая кинетика» MathLab/ ChemLab расчетная 2 Раздел 6 «Свойства дисперсных систем» MathLab/ ChemLab расчетная Раздел 7 «Высокомолекулярные соединения и MathLab/ ChemLab их растворы» расчетная 3 Наименование программы Тип программы Автор Mathlab Inc./Model Science Software Mathlab Inc./Model Science Software Mathlab Inc./Model Science Software Год разработки 2007/2005 2007/2005 2007/2005 9. Методические рекомендации студентам по освоению дисциплины При изучении дисциплины студенту необходимо посещать лекции, лабораторно-практические занятия, выполнить лабораторные работы и защитить их, пройти тестирование, сдать коллоквиумы по соответствующим разделам. При самостоятельной работе и подготовке к выполнению лабораторных работ в рабочих тетрадях необходимо в разделе теоретическая часть кратко записать основные понятия, законы, формулы данного раздела, размерности всех величин в системе СИ. При выполнении лабораторной работы тщательно вести записи результатов. Особое внимание обратить на применение определяемых величин для изучения и описания объектов агросферы. Внимательно изучить теоретическую и практическую часть к Лабораторному практикуму по физической и коллоидной химии. Виды и формы отработки пропущенных занятий Студент, пропустивший занятия, обязан выполнить лабораторные работы, сдать тесты, сдать коллоквиум по пропущенной теме. Студент, пропустивший лекцию, обязан написать реферат по теме лекции и сдать преподавателю на следующем занятии (лекции). 23 10. Методические рекомендации преподавателям по организации обучения по дисциплине Проведение лекций и семинарских занятий в интерактивной форме, анализ конкретных ситуаций и принятие решений на основе результатов по физико-химическим характеристикам биологических объектов. Оргдеятельностные игры с целью выработки инновационного решения проблемы (задачи) в рамках одного из разделов дисциплины, например, при разборе темы по коррозионно-электрохимическим процессам, протекающим при хранении и переработке продукции сельскохозяйственного производства. Полученное решение должно быть оптимальным и реализуемым. Необходимо использовать методы групповой работы для получения нестандартных, оперативных, новых решений. На основе выработанного решения составляются проект и программа его внедрения. Проектные методы при изучении разделов по термодинамике, кинетике и химического равновесия, электрохимическим процессам с использованием математических программ SIMULINK пакета MathLab. Использование деятельностного подхода. Продуктивное обучение. Использование метода Кейс-стади на семинарских занятиях по изучаемым разделам, в частности, при изучении разделов по коллоидной химии и высокомолекулярным соединениям. Программу разработали: Белопухов С.Л., д.с.х.н., к.х.н., профессор _______________________ (подпись) Семко В.Т., к.т.н., доцент _______________________ (подпись) 24