УТП химия 8
advertisement
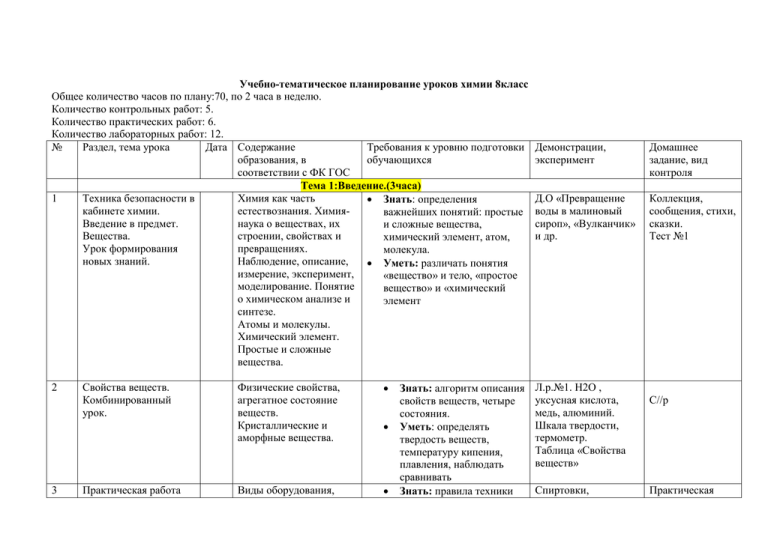
Учебно-тематическое планирование уроков химии 8класс Общее количество часов по плану:70, по 2 часа в неделю. Количество контрольных работ: 5. Количество практических работ: 6. Количество лабораторных работ: 12. № Раздел, тема урока Дата Содержание Требования к уровню подготовки образования, в обучающихся соответствии с ФК ГОС Тема 1:Введение.(3часа) 1 Техника безопасности в Химия как часть Знать: определения кабинете химии. естествознания. Химияважнейших понятий: простые Введение в предмет. наука о веществах, их и сложные вещества, Вещества. строении, свойствах и химический элемент, атом, Урок формирования превращениях. молекула. новых знаний. Наблюдение, описание, Уметь: различать понятия измерение, эксперимент, «вещество» и тело, «простое моделирование. Понятие вещество» и «химический о химическом анализе и элемент синтезе. Атомы и молекулы. Химический элемент. Простые и сложные вещества. 2 3 Свойства веществ. Комбинированный урок. Практическая работа Физические свойства, агрегатное состояние веществ. Кристаллические и аморфные вещества. Виды оборудования, Знать: алгоритм описания свойств веществ, четыре состояния. Уметь: определять твердость веществ, температуру кипения, плавления, наблюдать сравнивать Знать: правила техники Демонстрации, эксперимент Домашнее задание, вид контроля Д.О «Превращение воды в малиновый сироп», «Вулканчик» и др. Коллекция, сообщения, стихи, сказки. Тест №1 Л.р.№1. Н2О , уксусная кислота, медь, алюминий. Шкала твердости, термометр. Таблица «Свойства веществ» Спиртовки, С//р Практическая №1. Приемы обращения с лабораторным оборудованием. 1 2 3 правила обращения с ними. Лабораторная посуда. Нагревательные устройства. Правила безопасной работы в химической лаборатории. Проведение химических реакций при нагревании. безопасности при работе в школьной лаборатории; названия лабораторной посуды и оборудования. Уметь: правильно пользоваться лабораторным оборудованием. пробиркодержатели, штативы, таблицы по т/б. работа. Тема 2.Химические элементы и вещества в свете атомно-молекулярного учения.(14 часов) Чистые вещества и смеси. Чистое вещество, Л.р. №2. Знать : отличие чистых Комбинированный урок. гомогенные и Fe+песок+ веществ и смесей, гетерогенные смеси, деревянные опилки. С/р способы разделения примеси. Способы Магниты, смесей. разделения смесей. Уметь: готовить фильтры, фильт.+бумажки, Природные смеси: стаканы. правильно фильтровать, воздух, природный выпаривать. газ, нефть, природные воды. Практическая работа №2. Работа со Спиртовки, смесь Знать: способы разделения Способы разделения спиртовкой, соли с песком, Практическая смесей. смесей. отстаивание, фильтр, бумажки. работа Уметь: обращаться со выпаривание. Чашки для спиртовкой, готовить выпаривания, фильтры, Фильтровать. воронки, штативы. Выпаривать. Физические и химические Физические и Л.р.№3. Знать: определения явления. химические явления, Парафин, щипцы, физических и химических Комбинированный урок. химические реакции, тигли, спиртовки, явлений. признаки и условия кислота, мел, BaCl2, и Уметь: выявлять признаки химических реакций, Na2SO4. физических и химических обратимые и Мел, ступка, щелочь, явлений, различать типы необратимые изменения. Экзо и эндотермические реакции. Атом, молекула, химический элемент, химические соединения, металлы, неметаллы. 4 Атомы. Молекулы. Химические элементы. Формы существования химических элементов. Простые и сложные вещества. 5 Состав веществ . Закон постоянства состава. Химические формулы . Урок объяснения нового материала. Атомно-молекулярное учение в химии. Урок-обобщение знаний. Качественный и количественный состав молекулы, индекс, коэффициент. Учение, теория. Масса атома. Относительная атомная и молекулярная масса. Атомная единица массы. Массовая доля элементов в соединении. Урок объяснения нового материала. Масса атома, а.е.м., относительные и истинные массы атомов и молекул. Массовая доля элементов. 6 7 реакций по поглощению и выделению энергии фенолфталеин, кислота, таблица. Л.р.№4. Моделирование моделей молекул различных веществ. Модели молекул веществ, знаки химических элементов. ПСХЭ карточки Формулы веществ. Тест КМ О4, воронка, большая мензурка. Конспект. Знать: определение атом, молекула, химический элемент, знаки 22 химических элементов, общие физические свойства металлов и неметаллов. Уметь: отличать простые и сложные вещества, атом, молекула, металл, неметалл. Знать: Формулировку закона состава веществ, понимать и записывать формулы. Уметь: Определять состав веществ по формуле. Знать: Отличие атомов от молекул. Уметь: Формулировать основные положения теории. Знать: Отличие истинной и относительной массы атомов и молекул. Уметь: По ПСХЭ находить относительную атомную массу и вычислять молекулярные массы и массовые доли элементов в соединениях. Д.о, модели атомов С, Н, О и других элементов. 8 9 10.1 1 12 13 Что показывают химические знаки и формулы. Расчеты по формулам. Комбинированный урок. Периодическая система химических элементов Д.И.Менделеева. Качественный и количественный состав . Массовые доли элементов. Периодическая система химических элементов Д.И.Менделеева. Комбинированный урок. Валентность химических элементов. Определение валентности по формуле. Составление формул по валентности. Урок получения новых знаний. Количество вещества . Моль единица количества вещества. Молярная масса . Молярный объем. Комбинированный урок. ПСХЭ, структура, период, группа, подгруппа. Язык химии. Валентность: постоянная, переменная, правило четности и нечетности, высшая, низшая. Моль. Молярная масса. Постоянная Авогадро. Обобщение и систематизация знаний по теме: «Химические элементы и вещества в Повторение и систематизация знаний по изученной теме. Знать: Определение химической формулы, что она показывает. Уметь: Определять качественный и количественный состав молекул, находить процентный состав. ПСХЭ задачи ПСХЭ, портрет Знать: 22 знака химических Д.И.Менделеева. элементов. Уметь: Определять положение Х.Э. в ПСХЭ. ПСХЭ Знать: Определение валентности. Уметь: По ПСХЭ определять валентность, составлять формулы по валентности, определять валентность по формуле. Знать: Определение моль. Уметь: Определять молярную массу, проводить вычисления по формулам. Сообщение о Д.И.Менделееве. с/р Д.О.: Количество вещества в 1моль. Таблица: «Основные химические формулы», «Что такое молярная масса» Подготовка к контрольной. 14 1 2 свете атомномолекулярного учения» Урок актуализации знаний. Контрольная работа № 1 по Контроль знаний по теме «Первоначальные изученной теме. химические понятия». Тема 3. Химические реакции. Закон сохранения массы веществ.(8 часов) Сущность химической Химическая реакция. Знать: Определение и Таблица: «ЗСМ». реакции и признаки их Условия и признаки Прибор с весами. признаки химической протекания. Закон химической реакции. реакции. ЗСМ. Роль М.В.Л. в сохранения массы веществ. Понятие о скорости открытии закона. Комбинированный урок. химической реакции. Уметь: отличать химические Катализаторы. реакции от физических Сохранение массы явлений. Объяснять ЗСМ . веществ при реакции. Уравнение химических реакций. Урок получения новых знаний. Уравнения химических реакций, коэффициенты. 3 Составление уравнений реакций. Урок- практических упражнений. Уравнения химических реакций. Таблица: «Уравнения Знать: на основе какого реакций» закона составляются уравнения. Почему они так называются. Уметь: составлять уравнения и расставлять коэффициенты. Уметь: составлять уравнения реакций. Контрольная работа. Сообщение о М.В.Л. 5-6 7 8 Типы химических реакций. Проведение химических реакций в растворах. Комбинированный урок. Обобщение материала по теме: «Химические реакции, закон сохранения массы веществ». Контрольная работа №2 по теме «Химические реакции». 1 Растворы. Растворимость веществ. Получение кристаллов солей. Комбинированный урок. 2-3 Способы выражения концентрации растворов. Урок формирования новых знаний. Практическая работа№3. «Приготовление растворов 4 Реакции разложения, соединения, замещения, обмена. Понятия о химическом анализе и синтезе. Проведение химических реакций в растворах. Знать: классификацию химических реакций по числу и составу исходных и полученных веществ. Уметь: отличать типы реакций, проводить химические реакции в растворах, записывать уравнения реакций. Обобщение и систематизация знаний по изученной теме. Контроль знаний по изученной теме. тест Л.р.№6. Fe+CuCl2?NaOH+HCl Подготовиться к контрольной работе. Тема 4. Вещества в окружающей нас природе. (4 часа) Растворы- вид смеси, Знать: определение растворитель, растворов, виды растворов. растворимость, Уметь: находить растворимое растворитель и растворимое вещество, виды вещество, выращивать растворов. кристаллы. Получение кристаллов, солей. Массовая доля Знать: виды концентраций. вещества в растворе. Уметь: проводить вычисления по формулам. Приготовление растворов заданной Л.р.№5. Малахит, спиртовки, Са(ОН)2 Знать: основные формулы. Уметь: проводить расчеты и Карточки, тесты. Контрольная работа Образцы растворов, кристаллов. Домашняя практическая работа Растворы с различной процентной концентрацией. Решение задач Различные вещества, мензурки, весы, Практическая работа заданной концентрации. Взвешивание веществ». 1 концентрации. простые операции: Проведение расчетов взвешивание веществ, массовой доли растворение. растворимости вещества в растворе. Тема 5. Понятие о газах. Воздух. Кислород .Горение. (7 часов) Особенности газообразного Агрегатное Знать: Особенности состояния веществ. состояние веществ, газообразных веществ. Закон Авогадро. закон Авогадро, Уметь: Объяснять свойства Объемные отношения газов молярный объем газов их строения, при х.р. Комбинированный газов. Объемные крист.решеток. урок. отношения . стаканы, стеклянные палочки. Модели веществ. Крист.решеток, насос, мяч. 2 Воздух- смесь газов. Комбинированный урок. Состав воздуха как природной смеси. Знать: Состав воздуха. Уметь: Определять состав воздуха. Д.О. Прибор, фосфор, вода. Таблица: «Состав воздуха»; «Состав вдыхаемого и выдыхаемого воздуха». Сообщение: Презентация о кислороде. 3-4 Кислород – элемент и простое вещество. Комбинированные уроки. Простое вещество, химич.элемент, оксид, окисление, тепловой эффект, экзотермич. Реакции, горение, катализатор. Д.О. Кислород в подушке. P; S; Fe, свеча, известковая вода. Л.Р. № 7 H2O2, MnO2, лучинка, спиртовки, стеклянные пластинки, трубки Подготовка к проверочной работе.. тест Получение газообразующих Знать: Физические и химические свойства кислорода. Уметь: Составлять уравнения реакций, отличать понятие «вещество» и «элемент» , отобрать и защитить найденный материал. Знать: Из чего получают, как собирают газы. КМnO4, спиртовки , трубки, Подготовка к контрольной 5 Пр.р.№ 4.Получение и изучение свойств 6 7 1 2-3 4 5 кислорода. веществ. Обобщение знаний по теме : «Кислород.Воздух.Горение ». Актуализация знаний по теме. Уметь: Обращаться со спиртовкой и другими приборами, проводить опыты, пользоваться различными веществами, определять кислород. Знать: Состав воздуха, свойства кислорода. Уметь: Составлять уравнения реакций, определять тип реакций. Контр.работа № 3 по теме Проверка знаний по «Кислород.Воздух.Горение теме. ». Тема 6. Основные классы неорганических соединений. (10 часов) Оксиды, их классификация, Важнейшие Знать: Признаки свойства. бинарные классификации оксидов , их Комбинированный урок. соединения. свойства. Классификация , Уметь: Сравнивать, характеристика составлять уравнения химических свойств. реакций. Индикаторы. Основания и кислоты Классы химических Знать: Определение кислот, гидроксиды основных и соединений. оснований. кислотных оксидов. Уметь: Находить их и Комбинированный урок. составлять формулы, пользоваться табл.растворимости. Соли, состав, Название солей. Знать: Определение солей. номенклатура. Уметь: Составлять формулы Комбинированный урок. солей и называть их. Химические св-ва Кл-ция оснований, Знать: Определение оснований. их химические оснований, щелочей, их чашки,известковая вода, лучинки. работе. Сост.опоры, кластеры «Кислород, воздух». Опоры: «Кислород», карточки, тесты Опоры: «Кислород», карточки, тесты Контр.работа № 3 Л.р.№ 8 CaO+H2O фен-иы CИО+ H2O ДО: SO2+ H2O Р2О5+H2O лакмус Л.Р. № 9 к-ты, индикаторы.Щелочи. Нераств.осн. Табл. Раств-ти. Образцы солей. Л.Р.№ 10 NaOH+HCl карточки, тесты Комбинированнй урок. свойства. 6 Химические свойства кислот. Электрохимический ряд напряжений металлов. 7 Химические свойства солей. Химические свойства основных классов сое-ний. 8 Амфотерность Амфотерный 9 10 1 Обобщение знаний о классах неорг. Соединений. Контр.р.№ 4 по теме «Классы химических соединений». Состав атома. Изотопы. Химич.элемент. Классификация в-в, названия, свойства оксидов, оснований, кислот, солей. свойства. Уметь: Определять по табл.растворимости нераств.основания и щелочи, составлять уравнения реакций, обращаться с веществами. Знать: Особенности кислот,их св-ва. Уметь: Составлять уравнения реакций, проводить хим.эксперемент. Знать: Свойства солей. Уметь: Составлять уравнения реакций , проводить хим.эксперимент. Знать: Определение и св-ва амфот. соединений. Уметь: Определять амфот. соед. По положению элементов в ПСХЭ. Знать: Классы хим.соединений, их сойства. Уметь: Составлять формулы и записывать уравнения реакций. NaOH+Cu SO4 Ca(OH)2+CO2 Д.О. Cu(OH)2+ NaOH- индикаторы Л.Р. № 11 HCl+ инд.бум. HCl+Mg ,Zn, Cu HCl+MgO HCl+NaOH--BaCl2+H2SO4 Л.Р.№ 12 Na2SO4+BaCe2 CuCe2+Fe Л.О. ZnCe2+NaOH Zn(OH)2+NaOH Zn(OH)2+HCe Сообщение о строении атомов. Проверка знаний по теме. Тема 7. Строение атомов (2 часа) Ядро( протоны, Знать: Хар-ку элементар. нейтроны) и Частиц, входящих в состав Подготовка к к.р. Контр.р.№ 4 Д.О. Образование сообщение Комбинированный урок. электроны. Изотопы.Химич.эле мент. 2 1 2 3 атома. Физический смысл порядкового номера элемента.Определение «Изотопы, химич- элемент». Уметь: Определять состав атомов по положению элемента в ПСХЭ. Знать: Физический смысл номера периода, группы. Уметь: Записывать схемы строения атомов, их состав. Строение электронных оболочек атомов первых 20 элементов ПСХЭ. Тема 8.Переодический закон и ПСХЭ Д.И. Менделеева.(4 часа) Открытие периодического История открытия Знать: смысл понятия закона. Свойства периодического «периодичность» химических элементов и их закона , формулировку П.З, периодические изменения. закономерности закономерности изменения Урок объяснения нового изменения свойств свойств элементов в малых материала. элементов в периодах и главных пределах малых подгруппах. периодах и главных подгрупп. Периодическая система Периоды: малые и Знать: определение и химических элементов. большие. характеристику периодов и Урок объяснения нового Группы: главные и групп. материала. побочные. Уметь: характеризовать Закономерности химические элементы на изменения свойств основе положения в ПСХЭ. элементов в группах и подгруппах Состояние электронов в атоме.Урок объяснения нового материала. Характеристика элементов на Уметь: характеризовать химические элементы на оболочек. Модели атомов элементов.Таблица «Строение атомов» Подготовить презентацию сообщение о Д.И.М. ПСХЭ. Презентация учащихся и учителя. ПСХЭ Таблицы «характеристика Подготовиться к основе положения их в ПСХЭ и строения их атомов. 4 Контрольная работа №5 по теме: «Строение атомов. П.З.» 1 Химические связи атомов. Ионная связь. Степени окисления. Урок объяснения нового материала. 2 3 1-2 Тема 9. Строение вещества.( 3 часа) Химическая связь, Знать: особенности строения особенности ионных атомов металлов и соединений. Ионы. неметаллов, их свойства. Катионы, анионы. Уметь: составлять схемы строения ионных соединений, отличать их от других соединений. Ковалентная(полярная и Ковалентная связь. Знать: признаки неполярная) связь. Электроотрицательн ковалентных соединений, их ость. свойства. Уметь: составлять схемы образования ковалентных соединений, отличать их от ионных. Кристаллическое состояние Типы Знать: зависимость свойств вещества. кристаллических вещества от типа решеток( атомная, кристаллической решетки. ионная, Уметь: определять тип молекулярная, кристаллической решетки в металлическая). зависимости от свойства вещества. Тема 10. Химические реакции в свете электронной теории.( 4 часа) ОкислительноКлассификация Знать: определение о.в.р, восстановительные реакций по окислителя восстановителя. реакции. изменению степеней Уметь: отличать о.в.р от Объяснение нового окисления нео.в.р, разбирать реакции с химических элементов». Тесты, карточки. контрольной работе. Тесты, карточки. Контрольная работа №5 Модель ионной кристаллической решетки. Вещества с ионной связью: соли, основные оксиды, основания. Д. Вещества с ковалентной связью H2O, HCL, O2,H2. Д. Модели решеток. Самостоятельная работа материала. 3 4 Обобщение и систематизация знаний по теме: «строение вещества. Химические реакции в свете электронной теории.» Контрольная работа по теме: «строение вещества. Химические реакции в свете электронной теории». 1 Водород- химический элемент, простое вещество. 2 Пр.р. № 6 Получение и исследование свойств водорода. 3 Вода- оксид водорода. Комбинированный урок. элементов. Окислитель. Восстановитель. Актуализация знаний о строении веществ и химических реакциях. Проверка знаний по теме. точки зрения окислениявосстановления. Знать: виды связей. Особенности о.в.р. Уметь: составлять схемы образования ионных и ковалентных соединений разбирать реакции с точки зрения окисления восстановления. Тема 11. Водород. Вода. Галогены.(7 часов) Физические и Знать: Физические и химические свойства химические свойства, , получение и получение Н2. применение Уметь: Отобрать материал и водорода защитить сообщение презентацию Получение, Знать: Из чего получают собирание, водород, способы собирания , распознавание св-ва водорода. водорода. Уметь: Обращаться с приборами, доказывать наличие водорода. Ков.полярная связь. Знать: Строение и св-ва Вода, ее свойства. воды.Значение воды в жизни Растворимость человека. веществ в воде. Уметь:Записывать Круговорот воды в уравнения реакций и Контрольная работа Прибор для получения газов. Смесь : Н2+О2- 2:1 СuO. спиртовка Сообщение презентация о воде, водороде и др. Приборы для получения газов, НСl , Zn, чашки , спиртовки Пр.р. № 6 Сообщение презентация. Na, CaO, SO2, прибор для электролиза воды. 4. 5 6 7 8 Галогены –т химические элементы и простые вещества. природе. Характеристика элементов главных подгрупп.Свойства неметаллов. Хлороводород.Соляная кислота и ее соли.Изучение нового .материала. Свойства кислот.Качественная реакция на хлоридион Обобщение материала по теме: «Водород.Вода.Галогены». Подготовка к итоговому тестированию. Итоговое тестирование за курс 8 класса. Анализ итогового тестирования. Актуализация знаний по теме. Повторение материала по пройденному курсу. Проверка знаний. Подведение итогов года. разбирать их с т.з. о-в Знать: Закономерность изменения св-в элементов гл.подгрупп, их св-ва. Уметь: Составлять схемы строения атомов.Записывать уравнения реакций . Разбирать их с т.з.о-в. Знать : свойства кислот NaCl+AgNO3 Уметь:Составлять уравнения реакций и разбирать их с т.з о-в Знать: Основные химические понятия. Уметь: Составлять формулы и уравнения реакций. Разбирать их с т.з. о-в. До: Сl2, Вr2,J2, Cu Л.р.№ 13 HCl, Zn , MgO , NaOH Тесты, карточки Тесты, карточки Итоговое тестирование Учебно-тематическое планирование уроков химии 9 класс Общее количество часов по плану: 70, 2 часа в неделю. Количество контрольных работ: 5. Количество практических работ: 6. Количество лабораторных работ: 15. № Раздел, тема урока Дата Содержание Требования к уровню подготовки Демонстрации, образования, в обучающихся эксперимент соответствии с ФК ГОС I. Повторение вопросов курса неорганической химии за 8 класс (3 часа) 1. Инструктаж по Бытовая химическая Знать: правила обращения с Таблицы по технике безопасности. грамотность. Правильное горючими, токсичными и Т.Б. Бытовая химическая обращение с горючими, взрывоопасными веществами. грамотность токсичными и Уметь: противодействовать их взрывоопасными воздействию. веществами. Знать: классификацию веществ, их определение, свойства. Простые и сложные Уметь: составлять формулы Повторение. вещества. веществ, записывать уравнения Классы химических реакций. Карточки соединений, их Основные классы «Простые и свойства. органических соединений. сложные вещества» 2. Повторение. Периодический закон в свете строения атома. ПЗ и ПСХЭ Д.И.Менделеева. Группы и периоды. Строение атома. Закономерности изменения свойств элементов в группах Знать: современную формулировку ПЗ, структуру ПСХЭ, изменение свойств элементов и их соединений в группах и периодах. Уметь: определять состав атома ХЭ, распределять электроны по электронным оболочкам, объяснять ПСХЭ Домашнее задание, вид контроля Составить кластер по теме: «Вещества» Хар-ка элементов и периодах. 3. 1. 2. 3. Повторение. Виды химических связей. Электролиты. Неэлектролиты. Электролитическая диссоциация. ТЭД. Урок изучения нового материала. Л.р. Диссоциация кислот, солей и оснований. Урок изучения нового материала. Степень ЭД. Сильные и слабые электролиты. Урок изучения нового материала. 4.5 Л.р. Реакции ионного . обмена. Комбинированный физический смысл №ХЭ, группы, периода. Химическая связь. Знать: причины возникновения Виды химических связей: связей. ковалентная (полярная, Уметь: отличать ионные и неполярная), ионная. ковалентные соединения, составлять схемы образования Типы кристаллических веществ с различной связью, решеток: атомная, объяснять зависимость свойств молекулярная, ионная. веществ строением кристаллических решеток. II. Электролитическая диссоциация (14 часов) Электролиты. Знать: определения электролиты и неэлектролиты, ЭД, основные Неэлектролиты. положения ТЭД. Уметь: объяснять механизм ЭД, ЭД кислот, щелочей и солей записывать уравнения ЭД. в водных растворах. Знать: определения классов Ионы, катионы и анионы. соединений в свете ТЭД. Уметь: составлять уравнения ЭД Реакции ионного обмена. кислот, солей и оснований. Знать: определения СД, зависимость СД от различных факторов. Уметь: по таблице растворимости различать сильные и слабые электролиты. Знать: условия протекания реакций ионного обмена. Уметь: составлять уравнения Таблица «Виды Подготовиться связей». к С.р. Модели крист. решеток Вещества с ионной и ковалентной связью Прибор для проверки электропровод ности веществ. Таблица «ЭД» П.3,4,5 Упр.3,4 Стр.23 тест Л.р. №1 HCl, NaOH, индикаторы П.6 Упр.1 С/р. Прибор для работы с электрическим током. Вещества: NaCl, Уксусная кислота, вода Л.р №2 Набор веществ П.7 Упр.1 Стр.35 П.8 Упр.1 с/р урок 6. Л.р. Кислоты в свете ТЭД. Комбинированный урок 7. Л.р. Основания в свете ТЭД. Комбинированный урок 8. Л.р. Соли в свете ТЭД. Комбинированный урок 9. Л.р. Амфотерные гидроксиды. Комбинированный урок 10. Генетическая связь между классами неорганических соединений. Повторение и обобщение по теме «ТЭД» Урок повторения. 11. П.р.№1 Решение экспериментальных реакции и разбирать их в свете ТЭД. Знать: определение, свойства и классификацию кислот. Уметь: обращаться с кислотами, проводить реакции, записывать и разбирать реакции с т.з. ТЭД. Знать: определение, свойства и классификацию оснований. Уметь: обращаться со щелочами, записывать уравнения р-ций, разбирать реакции с т.з. ТЭД. Знать: определение и классификацию свойства солей в свете ТЭД. Уметь: проводить эксперимент, разбирать реакции с т.з. ТЭД. Знать: определение амфотерности, свойства амфотерных соединений. Уметь: определять амфотерные соединения по положению элемента в ПСХЭ, составлять уравнения реакций. Знать: свойства классов, соединений. Уметь: составлять уравнения реакций, разбирать их в свете ТЭД. Знать: признаки хим.реакций. Уметь: обращаться с веществами, Л.р.№3 Набор веществ П.9 Упр.3 Л.р.№4 Набор веществ П.10 Упр.3 конспект Л.р.№5 Набор веществ П.11 Упр.2 конспект Л.р.№6 Набор веществ П.10 Упр. конспект Таблицы «Металлов, неметаллов, переходных элементов» Цепочки превращений Инструкции, реактивы Подготовиться к К.р. Подготовиться к П.р.№1. задач по теме: «ТЭД» 12. К.р. по теме: «ТЭД» записывать уравнения реакций, разбирать их в свете ТЭД. Проверка знаний по теме: «ТЭД» 13. Решение задач на 14. избыток и недостаток 1. Л.р. Скорость химических реакций. Зависимость скорости от условий протекания реакции. 2. Л.р. Химическое равновесие. Принципы ЛеШателье. Решение задач по термохимическим уравнениям. Обобщение материала по теме: «Химические реакции в свете Т.химии» К.р. по теме: «Химические реакции 3. 4. (5) 5. Уметь: записывать условия реакций, вычислять количество вещества, определять избыток и недостаток, решать пропорции. Карточки К.р. Алгоритмы, карточки Решить две задачи III. Химические реакции в свете теорий химии (5часов), (6часов) Понятие о скорости реакции. Знать: определение скорости, Л.р.№7 формулу скорости, факторы, Перекись Катализаторы. влияющие на нее. водорода, Уметь: объяснять зависимость оксид Mn (2), Химическое равновесие. скорости от факторов. CuO, H2SO4, Д.о, мел, Условия смещения кислота, Cu, равновесия. Mg Знать: классификацию реакций. Л.р.№8 Уметь: определять направление BaCl2, H2SO4, смещения равновесия в Na2CO3, HCl, зависимости от условий. NaOH Знать: классификацию реакций. Задачники Уметь: решать задачи. Проверка уровня усвоения знаний по теме. Карточки П.2. Конспект. П.2 Конспект Две задачи. Подготовиться к К.р. К.р. в свете Т.химии» 1. (2) IV. Положение элементов неметаллов в ПСХЭ. Особенности строения атомов. Распространение в природе. Физические и химические свойства в свете ТЭД и О-В. Комбинированный урок. Неметаллические элементы и их важнейшие химические элементы (31 час), (33 ч.) Формирование Знать: положение неметаллов в Д.о. Образцы представления э-тов ПСХЭ, физические и химические неметаллов неметаллов в ПСХЭ, свойства неметаллов, изменения зависимость строения их свойств неметаллов в группах и атомов и свойств от периодах. положения в ПСХЭ. Уметь: записывать схемы строения атомов, делать выводы о свойствах, Нахождение в природе. составлять уравнения реакций, разбирать их в свете О-В. Применение. П.12,13 Дописать У.р. Конспект Характерные реакции на ионы. 2. Кислородные и водородные соединения неметаллов. Генетическая связь. 3. Аллотропия. Кислород. Озон. 4. Общая характеристика элементов главной Знать: классификацию веществ. Уметь: составлять формулы оксидов, кислот, водородных соединений неметаллов, пользуясь ПСХЭ, осуществлять генетические цепочки. Знать: определение аллотропии, свойства кислорода и озона. Уметь: объяснять явление аллотропии. Д.о. Образцы кислот, оксидов, неметаллов П.14 упр.4 Ген.цепочки Д.о. Электрофорная машина, разрядник П.16 Схема Знать: физический смысл номера элементы, группы, периода, закономерности изменения свойств ПСХЭ, образцы веществ- П.15 Таблица подгруппы VI группы, их значение. 5. 6. 7. 8. неметаллов. Уметь: составлять схемы строения атомов, сравнивать, делать выводы. Знать: физические и химические свойства серы. Уметь: записывать уравнения реакций и разбирать их в свете О-В. Сера. Аллотропия серы. Химические свойства, применение и распространение в природе. Л.р. Водородные соединения серы. Сульфиды. Л.р. Кислородные соединения серы. Сульфаты. Сульфиты. Лекарственные препараты (химия и здоровье) Особые свойства концентрированной серной кислоты. Повторение и обобщение знаний по теме: «Элементы главной подгруппы VI группы». 9. П.р.№2 Решение экспериментальных задач по теме: «Элементы главной подгруппы VI группы». 10. К.р.№3 по теме: Знать: свойства кислот. Уметь: распознавать сульфиды, записывать уравнения реакций. Знать: свойства кислотных оксидов и кислот, проблемы, связанные с применением лекарственных препаратов Уметь: определять сульфаты и сульфиты. Знать: особенности кислоты, Т.б. Уметь: пользоваться кислотой. Знать: свойства серы и ее соединений. Уметь: записывать уравнения реакций, разбирать их в свете ТЭД и О-В. Знать: Характерные реакции на кислоты, щелочи, сульфаты, сульфиты, сульфиды. Проверка уровня усвоения неметаллов Д.о. Сера. Модели аллотропных изменений серы Л.р.№9 Сульфид+ соль меди Л.р.№10 Na2SO3, HCl, Na2SO4, H2SO4, BaCl2 П.16 упр.4-6, *8 Д.о. Сахар. Кислота, лучинка, термометр П.20 Уравнения реакций. П.18 упр.6 П.19-20 Уравнения реакций. Подготовиться к П.р. Инструкции. Набор веществ П.р. Подготовиться к К.р. Тесты, К.р.№3 «Элементы главной подгруппы VI группы». 11. Общая хар-ка элементов главной подгруппы V группы. 12. Азот. Строение атомов и молекул. Свойства, применения. 13. Л.р. Аммиак, строение молекул, физические и химические свойства, применение, получение. Соли аммония. 14. П.р.№3 Получение аммиака. 15. Кислородные соединения азота. Азотная кислота. Азотистая кислота. знаний по теме. карточки Знать: закономерности изменения свойств элементов в группах. Уметь: объяснять причину изменения свойств, составлять схему строения атомов. Знать: свойства азота. Уметь: объяснять применение зависимости от свойств веществ, записывать уравнения реакции. Знать: виды связей, химические свойства и способы получения газов. Уметь: отличать аммиак от других газов, записывать уравнения реакции, определять ионы аммония. Знать: лабораторный способ получения аммиака, его собирания, свойства, характерную реакцию на ионы аммония. Уметь: обращаться с приборами, реактивами, записывать уравнения реакции Знать: свойства оксидов и кислот. Уметь: составлять уравнения реакции ПСХЭ П.21 Сообщения. Презентации. Таблица «Состав воздуха» П.22 Упр.4-6 Д.о. колба с аммиаком. Опыт «Фонтан» HCl, NH4OH. Л.р.№11 тв. Гидроксид кальция, хлорид аммония Инструкции, набор веществ П.23 Подготовиться к П.р. П.р.№3 Повторить материал Д.о. HNO3, NaOH, CaCO3, CuO П.24-25 Уравнения реакций. 16. Особые свойства азотной кислоты. Знать: отношение кислоты к металлам. Уметь: составлять уравнения реакции и разбирать их в свете О-В. Знать: особенности нитратов. Уметь: отличать нитраты от других соединений, разбирать реакции в свете О-В. Знать: свойства, аллотропию фосфора, свойства оксида, фосфорной кислоты, характерную реакцию на фосфаты. Уметь: составлять уравнения реакции и разбирать их в свете О-В, уметь отличать фосфаты от других солей. Знать: классификацию удобрений, их состав, характерные реакции. Уметь: отличать минеральные удобрения. Знать: характерные реакции на ионы NO3-, NH4, SO4,K. Уметь: решать экспериментальные задачи, определять состав веществ. 17. Л.р. Нитраты. Круговорот азота в природе. 18. Фосфор и его соединения. Фосфаты. 19. Л.р. Питание растений. Минеральные удобрения. 20. П.р.№4 Определение минеральных удобрений. 21. К.р.№4 Элементы главной подгруппы V группы. 22. Общая хар-ка элементов главной подгруппы IV группы. Углерод. Аллотропия углерода. Проверка уровня усвоения знаний по теме. Д.о. HNO3, медь, белок П.25 Уравнения реакций. Таблица. Л.р.№12 Угольки, KNO3, уголь Д.о. Фосфор, P2O5, H3PO4 П.25 упр.4,5, *9 Л.р.№13 Образцы удобрений Подготовиться к П.р. Инструкции, набор реактивов Карточки Знать: особенности изменения свойств элементов в группах. Уметь: объяснять изменения свойств строением атомов, прогнозировать свойства э-тов, объяснять аллотропию углерода. Д.о. Уголь, фионит, графит, сажа, CuO, модели кристаллическ их решеток П.26 *6 П.27 упр.5 П.р.№4 Подготовиться к К.р. Сообщения. Презентации П.28-30 Уравнение реакции 23. Кислородные соединения углерода. Карбонаты. Круговорот углерода в природе. Д.о. Прибор для получения газов, мрамор, кислота, Ca(OH)2 П.31-33 Схема 24. П.р.№5 Получение оксида углерода (IV) и изучение его свойств. Знать: св-ва угарного и углекислого газов, угольной кислоты, Т.Б. при отравлении CO и CO2. Уметь: отличать карбонаты (мел, мрамор, известняк) от других солей. Знать: способы получения и собирания углекислого газа в лаборатории, характерную реакцию. Уметь: обращаться с реактивами. Инструкции, набор веществ 25. Кремний и его соединения. Силикатная промышленность. Химические вещества как поделочные и строительные материалы Знать: свойства кремния, оксида кремния, кремниевой кислоты, способы получения стекла, цемента, области применения мела, мрамора, известняка Уметь: отличать силикаты от других солей, подбирать и защищать материал. Д.о. Образцы стекла, цемента, фарфора. «Коллекция кремния и его соединений». Силикат, кислота Д.о. Образцы орг. веществ Сообщения, презентации «Стекло. Фарфор. Цемент» П.34 упр.5-7 26. Введение в органическую химию. Теория А.М.Бутлерова. Классификация органических веществ. 27. Углеводороды. Природные источники углеводородов. Представления о полимерах на примере полиэтилена Первоначальные сведения о строении, классификации, свойствах, значении органических веществ. Знать: определение органической химии, веществ, основные положения Теории А.М.Бутлерова Метан, этан, этилен Знать: гомологический ряд алканов, состав и значение нефти, природного газа, полиэтилена Д.о. Нефть. Перегонка нефти. Макет. Таблицы, коллекции. Изготовление П.35 Коллекции органических веществ. П.36 Гомологически й ряд алканов 28. Кислородсодержащие органические вещества. Знать: классификацию кислородсодержащих органических веществ, формулы метанола, этанола, глицерина, уксусной и стеариновой кислот. Уметь: определять принадлежность органических веществ к классам орг. соединений. Знать: значение белков, жиров, углеводов для жизни человека, уксусная кислота, поваренная сольконсерванты пищевых продуктов Уметь: правильно использовать их в питании и приготовлении пищи 29. Химия и пища. Биологически важные орг. вещества: белки, жиры, углеводы. Их калорийность. Консерванты пищевых продуктов 30. Обобщение материала по теме: « Неметаллы главной подгруппы IV группы. Органические вещества» 31. К.р.№4 по теме: « Неметаллы главной подгруппы IV группы. Органические вещества» 1. Л.р. Положение металлов в ПСХЭ. Актуализация знаний по теме: «Неметаллы» моделей Д.о. Образцы спиртов, карбоновых кислот. Модели молекул Д.о. Белки, жир, углеводы.Табл ица «Калорийность веществ», «Строение белков», «Формулы белков» Знать: св-ва неметаллов, кислотных оксидов, кислот, солей. Уметь: объяснять св-ва э-тов строением атомов, записывать уравнения реакций, разбирать их в свете ТЭД и О-В. Проверка уровня усвоения знаний по теме. П. 42-43 П. 44-46 Сообщения Подготовиться к К.р. Тесты. Карточки К.р.№4 Сообщения о значении металлов. V. Положение металлов в ПСХЭ. Особенности Металлы (8 часов) Знать: значение металлов, свойства, особенности строения Д.о. Образцы металлов и П. 47-48 Коллекция 2. 3. Строение атомов и кристаллических решеток. Металлическая связь. Значение. Свойства. Способы получения металлов. Понятие о металлургии и коррозии металлов. Химическое загрязнение окружающей среды и его последствия Металлы главных подгрупп и их соединения. 4. Металлы побочных подгрупп. Железо и его соединения. 5. Обобщение материала по теме «Металлы» 6. П.р.№6 Решение строения атомов. Зависимость свойств от строения атомов и кристаллических решеток. Способы получения металлов. Металлургия. Важнейшие сплавы металлов. Химические св-ва металлов и их соединений. Химическое загрязнение окружающей среды и его последствия атомов, кристаллических решеток. Уметь: находить металлы в ПСХЭ, составлять схемы строения атомов, прогнозировать свойства металлов и их соединений. Знать: основные способы получения металлов, что такое «металлургия», «коррозия металлов» и меры ее предупреждения Уметь: прогнозировать последствия загрязнения окружающей среды Знать: особенности строения и свва металлов главных подгрупп, химические св-ва их соединений. Уметь: доказывать амфотерность соединений алюминия Знать: особенности св-в железа и его соединений. Уметь: отличать соединения Fe (2), Fe (3). Актуализация знаний по теме: «Металлы» сплавов. Модели кристаллическ их решеток «Металлы и их сплавы» Д.о. Образцы чугуна, стали, металлических руд. Макеты доменной и мартеновской печей. П.49 Д.о. Образцы металлов главных подгрупп. Л.р.№14 AlCl3, NaOH, HCl Л.р.№15 FeSO4, K3[Fe(CN)6], Fe2(SO4)3, NH4CNS П.50-52 Уравнения реакций Знать: особенности строения и свва металлов и их соединений. Уметь: составлять схемы строения атомов, прогнозировать свойства металлов и их соединений, разбирать реакции в свете окисления-восстановления. Знать: характерные реакции на П.54 упр.3 Подготовиться к П.р. Инструкции, Подготовиться экспериментальных задач по теме: «Металлы» 7. К.р. по теме: «Металлы» Проверка уровня усвоения знаний по теме. 8. Химия и жизнь. Человек в мире веществ, материалов и химических реакций. металлы. Уметь: определять соединения металлов, осуществлять генетические превращения. Знать: значение химии в повседневной жизни человека. набор реактивов к К.р. Карточки Уметь: безопасно использовать вещества в повседневной жизни. Коллекции веществ. Сообщения. Сообщения «Химия и жизнь» Презентации Учебно- тематическое планирование уроков химии в 10 классе Всего по плану: 35 часов (из них 1ч – резерв) Раздел, количество часов Предмет органической химии. Объяснение нового материала. Теория строения органических соединений А.М. Бутлерова. Классификация органических соединений. Комбинированный урок. Дата Содержание образования, в соответствии с ФК ГОС Требования к уровню подготовки обучающихся Повторение основных вопросов. Введение. (3 часа) Роль и значение Знать: определение органической химии в органической химии; системе естественных наук. особенности органических Особенности органических веществ. Определения веществ и причины их изомер, гомолог. многообразия. Научные методы познания веществ и химических явлений. Моделирование химических прцессов. Тема 1. Строение органических соединений.(4 часа ) Основные положения ТХС. Знать: понятия изомер и Валентность. Углеродный гомолог; основные скелет. Структурные положения ТХС. формулы. Уметь: составлять структурные формулы органических веществ, их изомеров и гомологов. Классификация по строению Знать: основные классы углеродного скелета; по ОС. наличию функциональных Уметь: определять групп. Простейшие принадлежность вещества представители основных к определенному классу классов ОС. веществ. Демонстрации, эксперимент Шаростержневые модели молекул. Медиапректор, презентация «Органическая химия» Вид контроля §1, составить формулы С5Н12, С5Н10 Шаростержневые §2, составить модели молекул, изомеры. мультимедиапроектор, презентация «Теория строения А.М. Бутлерова» Плакаты «Классификация органических веществ» § 3, доделать упр.1 Номенклатура органических соединений. Объяснение нового материала. Контрольная работа №1 «Строение органических веществ». Контроль знаний. Уметь: давать названия Плакат «Основы органическим веществам номенклатуры ОВ» различных классов; составлять структурные формулы по названиям. ----- Урок контроля изученного материала по Теме 1. Основы номенклатуры органических соединений, правила названия ОС. §4, назвать вещества, написать формулы (в тетради) Контрольная работа Тема 2. Углеводороды и их природные источники (9 часов ) Вывод молекулярной формулы по массовой доле элементов. Объяснение нового материала. Решение задач. Отработка знаний и умений. Практическая работа №1 «Качественный анализ органических соединений» Урок-практикум. Алканы. Комбинированный урок. Решение задач на вывод молекулярной формулы по массовой доле элементов и относительной плотности вещества по другому веществу. Отработка умений в решении задач на вывод молекулярной формулы ОС. Правила работы в лаборатории. Качественный анализ веществ. Строение, номенклатура, изомерия, физические свойства и алканов и их применение. Знать: алгоритм решения задач данного типа; понятие относительная плотность одного газа по другому. Уметь находить простейшую и истинную формулы органических веществ. Уметь выводить молекулярные формулы ОВ по массе продуктов сгорания. Уметь выполнять химический эксперимент по получению веществ или распознавать органические вещества. Знать: определение и общую формулу алканов, гомологический ряд, основные физические и ------ Задачи в тетради ------ Задачи в тетради. ------ Практическая работа Образцы алканов: гексан, парафин, хлорметан. §6, задание в тетради. Алкены. Комбинированный урок. Строение, номенклатура, изомерия, физические свойства и алкенов и их применение. Алкины. Комбинированный урок. Строение, номенклатура, изомерия, физические свойства и алкинов и их применение. химические свойства, применение. Уметь: составлять структурные формулы алканов, их изомеры и гомологи; записывать реакции замещения, разложения и горения. Знать: определение и общую формулу алкенов, гомологический ряд, основные физические и химические свойства, применение. Уметь: составлять структурные формулы алкенов, их изомеры и гомологи; записывать реакции с участием алкенов. Знать: определение и общую формулу алкинов, гомологический ряд, основные физические и химические свойства, применение. Уметь: составлять структурные формулы алкинов, их изомеры и гомологи; записывать реакции с участием алкинов. Таблица «Строение этилена»; Презентация «Алкены»; мадиапроектор. Шаростержневые модели молекул. § 7, задание в тетради. Таблица «Строение ацетилена»; Медиапроектор, презентация «Алкины»; Шаростержневые модели молекул. § 8, задание в тетради (составить изомеры С5Н8) Алкадиены и каучуки. Комбинированный урок. Ароматические углеводороды. Комбинированный урок. Природные источники углеводородов. Строение, номенклатура, изомерия, физические свойства и алкинов и их применение. Практическое значение диеновых УВ с сопряженными связями. Строение, номенклатура, изомерия, физические свойства и аренов и их применение. Природный и попутные нефтяные газы. Нефть. Каменный уголь. Их Знать: определение и общую формулу алкадиенов, гомологический ряд, основные физические и химические свойства, применение; строение и свойства натурального и синтетического каучуков. Уметь: составлять структурные формулы алкадиенов, их изомеры и гомологи; записывать реакции с участием алкадиенов. Знать: определение и общую формулу алкадиенов, гомологический ряд, основные физические и химические свойства, применение; строение и свойства натурального и синтетического каучуков. Уметь: составлять структурные формулы алкадиенов, их изомеры и гомологи; записывать реакции с участием алкадиенов. Знать: основные природные источники УВ – каменный уголь, нефть, газ; их состав, Коллекция «Каучуки», Шаростержневые модели молекул. § 9, задание в тетради. тестирование Таблица «Бензол»; Презентация «Бензол», медиапроектор. § 10, задание в тетради. Образцы нефти, каменного, бурого углей, антрацита. §5, конспект в тетради, подготовка к Урок-семинар. нахождение в природе, переработка и применение. основные переработки. Контрольная работа №2 «Углеводороды». Контроль изученного материала по теме №2 способы Образцы различных марок бензина, керосин. Коллекции «Каменный уголь», «Нефть и её переработка» --------- тестированию. Контрольная работа Урок контроля знаний. Тема 3. Кислородсодержащие соединения (9 часов) Спирты. Объяснение нового материала. Практическая работа №2 «Свойства спиртов». Урок-практикум. Строение, номенклатура, изомерия, получение, применение. Изучение физических и химических свойств спиртов на примере этилового и амилового спиртов. Знать: определение и общую формулу спиртов, виды изомерии, основы номенклатуры, способы получения спиртов. Уметь: Записывать структурные формулы спиртов, давать названия спиртам по международной и тривиальной номенклатуре, записывать реакции получения спиртов. Уметь: делать выводы о закономерностях в изменении физических свойств спиртов; проводить качественную реакцию на многоатомные спирты, реакции каталитического окисления спиртов, Образцы муравьиного и этилового, изоамилового спиртов. § 11, составить изомеры С5Н12О Оборудование, необходимое для выполнения работы. Практическая работа Фенолы. Объяснение нового материала. Строение, номенклатура, изомерия, получение, применение фенолов. Альдегиды и кетоны. Комбинированный урок. Строение, номенклатура, изомерия, получение, применение альдегидов и кетонов. записывать соответствующие уравнения реакций. Знать: определение и общую формулу фенолов, виды изомерии, основы номенклатуры, способы получения; правила техники безопасности при работе с фенолом. Уметь: Записывать структурные формулы фенолов, давать названия спиртам по международной и тривиальной номенклатуре, записывать реакции получения фенола. Знать: определение и общую формулу альдегидов и кетонов, виды изомерии, основы номенклатуры, способы получения. Уметь: Записывать структурные формулы спиртов, давать названия альдегидам и кетонам по международной и тривиальной номенклатуре, записывать реакции получения альдегидов и кетонов. Фенол кристаллический, раствор в холодной и горячей воде. § 12, задание в тетради. Образец муравьиного альдегида, таблица «Строение альдегидов» § 13, получить возможными способами пропаналь и бутанон -2. Карбоновые кислоты. Объяснение нового материала. Практическая работа №3 «Карбоновые кислоты». Урок-практикум. Сложные эфиры. Жиры. Строение, номенклатура, изомерия, получение, карбоновых кислот. Изучение физических и химических свойств карбоновых кислот практически. Строение, номенклатура, изомерия, получение, сложных эфиров и жиров. Знать: определение и общую формулу карбоновых кислот, виды изомерии, основы номенклатуры, способы получения. Уметь: Записывать структурные формулы спиртов, давать названия карбоновым кислотам по международной и тривиальной номенклатуре, записывать реакции получения кабоновых кислот. Уметь: проводить химические реакции, характеризующие свойства кислот; делать выводы о закономерностях изменения физических свойств с изменением строения. Знать: определение, общую формулу, основы номенклатуры и способы получения сложных эфиров и жиров. Роль эфиров и жиров в живой природе. Уметь: Составлять структурные формулы сложных эфиров, их изомеров, называть Образцы различных карбоновых кислот: муравьиная, уксусная, масляная, стеариновая. Д.О. получение уксусной кислоты из ацетата натрия. § 14, подг-ся к пр.р.№2. Оборудование и вещества, необходимые для проведения практической работы. Практическая работа Д.О. Синтез этилового эфира уксусной кислоты. § 15, написать реакции синтеза различных эфиров и жиров. Повторение «Кислородсодержащие соединения» Урок обобщения и систематизации знаний по теме №3. Контрольная работа №3 «Кислородсодержащие соединения» вещества по научной и тривиальной номенклатуре. Записывать реакцию этерификации – синтеза эфиров; записывать реакции синтеза жиров из глицерина и высших карбоновых кислот. Систематизация и Основные классы ----обобщение знаний по теме кислородсодержащих «Кислородсодержащие соединений, их общие соединения», решение формулы и определения, расчетных задач. основы номенклатуры, способы получения и химические свойства. Уметь: записывать уравнения реакций в виде цепочек превращения, решать расчетные химические задачи. --- Контроль знаний по теме №3 Подг-ся к контр.раб. Контрольная работа Урок контроля знаний. Тема 4. Углеводы. (4 часа) Углеводы. Объяснение нового материала. Урокпрактикум. Классификация, нахождение в природе, качественные реакции на некоторые углеводы. Знать: классификацию углеводов, распространение в природе и роль в живой клетке; общую формулу, качественное определение Л.О. Качественное § 20, конспект определение глюкозы в учить, подг-ся к яблочном соке, тесту. гидролиз крахмала. Образцы различных углеводов, презентация Полисахариды. Особенности строения крахмала и целлюлозы. Практическая работа №4 «Углеводы». Урок-практикум Контрольная работа № 4 «Углеводы». Изучение качественных реакций глюкозы и крахмала, гидролиз крахмала на практике. глюкозы и крахмала в продуктах. Уметь записывать формулы углеводов, реакции гидролиза дии полисахаридов. Знать : сходство и различия в строении и свойствах крахмала и целлюлозы. Уметь записывать уравнения реакций с участием данных веществ, решать расчетные химические задачи. Уметь определять глюкозу и крахмал среди выданных веществ, записывать уравнения соответствующих реакций. Контроль знаний по теме 4. «Углеводы». Коллекции: «Хлопок», «Изготовление вискозного волокна» § 20-21, доделать таблицу в тетради. Оборудование и вещества, необходимые для выполнения работы. Практическая работа --- Контрольная работа Урок контроля знаний. Тема 5. Азотсодержащие органические соединения.(5часов) Аминокислоты. Объяснение нового материала. Строение, номенклатура, изомерия, получение и нахождение в природе аминокислот. Роль в живой клетке. Знать: определение, общую формулу, основы номенклатуры и способы получения аминокислот. Роль а/к в живой природе. Уметь: Составлять структурные формулы а/к, их изомеров, называть Образец глицина. Презентация «Аминокислоты», мультимедиа. § 25, задание в тетради. вещества по научной и тривиальной номенклатуре. Белки. Нуклеиновые кислоты. Комбинированный урок. Генетическая связь между классами органических соединений. Урок отработки умений и навыков. Контрольная работа «Итоговая». Урок контроля знаний. Химия и здоровье. Урок-семинар. Строение, номенклатура, изомерия, получение и нахождение в природе белков. Роль в живой клетке. Химия и пища: калорийность белков, жиров, углеводов Строение, номенклатура, изомерия, получение и нахождение в природе н/к. Роль в живой клетке. Генетические цепочки превращений различных классов органических веществ. Взаимосвязь органических и неорг-х веществ. Знать: структуры белка, качественные реакции на белок. Уметь: записывать реакции синтеза и гидролиза белка, определять калорийность пищи Знать строение, н/к, принцип комплементарности. Л.О. Качественные реакции на белок. § 26. Таблица «Нуклеиновые кислоты» § 27 Знать: генетическую Таблица «Генетическая взаимосвязь между связь…» классами различных органических веществ. Уметь: записывать реакции получения и химических свойств веществ различных классов. --- Контроль знаний за курс органической химии. Лекарства, ферменты, гормоны, минеральные воды. Знать: роль ферментов и Мультимедиа, гормонов в живом презентации учителя и организме; лекарства и учащихся. проблемы, связанные с их применением. Задание в тетради. тесты Контрольная работа, тесты Химия в повседневной жизни. Моющие и чистящие средства. Соблюдение правил безопасной работы со средствами бытовой химии. Знать действие моющих и чистящих средств, активное вещество в их составе. Планирование уроков по химии в 11 классе Всего по плану: 35 часов, ( 1час - резерв) Контрольных работ: 3 Лабораторных работ-6 Практических работ: 3 № Раздел. количество часов 1. Атом – сложная частица. Комбинированный урок. 2. Электронные конфигурации атомов. Комбинированный урок. 3. Периодический закон и периодическая система химических элементов. Урок-лекция. Да та Содержание образования, в соответствии с ФК ГОС Требования к уровню подготовки обучающихся Демонстрации, эксперимент Вид контроля ПСХЭ, таблицы «Строение атома», презентация «Строение атома», мультимедиа, ноутбук. Знать основные закономерности ПСХЭ, Таблицы заполнения энергентических «Распределение элекртронов подуровней электронами. Уметь составлять электронные поуровням». формулы атомов. § 1, вычислить кол-во протонов, электронов, нейтронов в атомах.. Тема 1. Строение атома (4 часа) Ядро и электронная оболочка. Знать: современные представления Электроны, протоны и нейтроны. о строении атома, важнейшие Макромир и микромир. Дуализм химические понятия: «химический частиц микромира. элемент», «изотопы». Уметь определять состав и строение атома элемента по положению в ПС. Электронные конфигурации атомов химических элементов. Электронно-графические формулы атомов элементов. Электронная классификация элементов: s-, p-, d-, fсемейства. Строение оболочек атомов переходных элементов Предпосылки создания ПЗ. Работы предшественников Менделеева. Открытие Д.И.Менделеевым ПЗ. Горизонтальная, вертикальная и диагональная закономерности. Знать смысл и значение ПЗ, горизонтальные и вертикальные закономерности и их причины. Уметь давать характеристику элемента на основании его § 3, составить электроннографические формулы атомов ПСХЭ, § 5, презентация конспект в «ПЗ и ПСХЭ тетради. Д.И. Менделеева», положения в ПС. 4. Обобщение и систематизация знаний. Комбинированный урок. 5, Химическая связь. 6 Комбинированный урок. 7. Теория строения органических соединений А.М. Бутлерова. Комбинированный урок. медиапроектор, ноутбук. Систематизация материала по Знать закономерности изменения ПСХЭ теме «ПЗ». Гуманистический свойств химических элементов в подход к изучению темы. ПС, физический смысл порядкового номера элемента, номера периода и группы с точки зрении строения атома. Уметь характеризовать ХЭ на основании ег7о положения в ПС. Тема 2. Строение вещества. (5 часов) Ионная хим. связь и ионные Знать классификацию типов Модели кристаллические решетки. химической связи и характеристики кристаллических Ковалентная хим. связь и ее решеток каждого из них. классификация по механизму Уметь характеризовать свойства различных образования, вещества, зная тип его веществ; электроотрицательности, по кристаллической решетки; по таблицы «Типы способу перекрывания формуле вещества определять тип химической электронных орбиталей, по связи, предсказывать вид связи». кратности. Кристаллические кристаллической решетки. решетки веществ с ковалентной связью Водородная связь и её разновидности. Металлическая связь. Единая природа химических связей. Разные виды связи в одном веществе. Предпосылки теории строения Знать основные положения теории Презентация органических соединений. Бутлерова. Понятия «изомер», «Теория Основные положения ТХС «гомолог», «гомологический ряд»; Бутлерова», Бутлерова. Изомерия. Значение медиапроектор, виды изомерии. теории в современной Уметь составлять структурные ноутбук. органическоц и общей химии. формулы гомологов и изомеров, Диалектические основы общности давать названия веществам. § 5, тетрадь. § 6, таблицу в тетради выучить. §8, привести примеры на каждый вид изомерии, назвать вещества. закона Периодичности Менделеева и ТХС Бутлерова. 8. Полимеры органические и неорганические. Комбинированный урок. 9. Дисперсные системы и растворы. Урок-лекция. 10 Контрольная работа №1 «Строение вещества». Урок контроля знаний. Основные понятия химии ВМС: мономер, полимер, структурное звено, степень полимеризации, средняя молекулярная масса. Способы получения полимеров: пластмасс, эластомеров, волокон. Наиболее широко распространенные полимеры. Причины многообразия веществ. Аллотропия. Знать Основные понятия химии ВМС: мономер, полимер, структурное звено, степень полимеризации, средняя молекулярная масса. Способы получения полимеров: пластмасс, эластомеров, волокон. Наиболее широко распространенные полимеры. Уметь записывать уравнения реакций полимеризации и поликонденсации. Коллекции «Полимеры», «Волокна». Презентация « ВМС» § 9, мини рефераты по теме «Полимеры» . Определение и классификация дисперсных систем. Истинные и коллоидные растворы. Взвеси, золи, гели. Специфические свойства коллоидных систем, эффект Тиндаля. Знать Классификацию дисперсных систем, классификацию коллоидных растворов, роль дисперсных систем в живой и неживой природе; отличительные признаки коллоидных и истинных растворов. § 10, записи в тетради. Основные темы. ---- Презентация «Дисперсные системы». Образцы различных однородных и неоднородных дисперсных систем, золей, гелей, истинных растворов. ----- понятия пройденной Контрольна я работа Тема 3. Химические реакции. (6 часов) 11 Классификация химических реакций в органической и неорганической химии. Комбинированный урок. 12 Скорость химических реакций. Комбинированный урок. 13 Обратимость реакций. Комбинированный урок. Классификация химических реакций: по числу и составу реагирующих веществ; по изменению степеней окисления; по тепловому эффекту; по направлению; по участию катализатора; по фазовому составу. Бытовая химическая грамотность, химическое загрязнение окружающей среды Скорость гомогенных и гетерогенных реакций. Влияние различных факторов на скорость химической реакции: природы и концентрации реагирующих веществ, температуры, катализатора, площади соприкосновения. Обратимые и необратимые химические реакции. Химическое равновесие. Условия смещения химического равновесия. Принцип Ле-Шателье. Закон действующих масс для равновесных систем. Знать какие процессы называются химическими реакциями, в чем их суть. Уметь устанавливать принадлежность конкретных реакций к различным типам по признакам классификации. Презентация «Типы химических реакции», ноутбук, проектор. § 11, охарактериз овать реакции по известным признакам классификац ии. Знать понятие «скорость химической реакции», факторы, влияющие на скорость химреакции. Уметь решать расчетные задачи с применением понятия скорость химической реакции. Д.О. Зависимость скорости реакции от концентрации и температуры. § 13, задача в тетради. Знать понятие «химическое равновесие», условия его смещения. Уметь определять смещение равновесия в зависимости от изменения условий. Д.О. 1. Влияние §14, концентрации на индивидуаль смещение ные задания. равновесия (реакция между роданидом калия и хлоридом железа(III)), 2. Влияние давления на смещение равновесия (взаимодействие углекислого газа 14 Электролитическая диссоциация. Реакции ионного обмена. Комбинированный урок. 15 Окислительновосстановительные реакции. Комбинированный урок. 16 Контрольная работа №2 «Химические реакции». Электролиты и неэлектролиты. Электролитическая диссоциация. Сильные и слабые электролиты. Качественные реакции на некоторые ионы. Условия протекания реакций ионного обмена до конца. ОВР. Окислитель и восстановитель. Составление ОВР методом электронного баланса и методом полуреакций. Влияние среды на протекание ОВР. Основные положения изученной темы. с гидроксидом натрия) . Портрет ЛеШателье. Д.О. Примеры реакций ионного обмена, происходящие с образованием осадка, воды, газа. Знать определения «электролит», «неэлектролит», условия протекания реакций ионного обмена до конца. Уметь составлять уравнения диссоциации кислот, щелочей, солей; записывать уравнения реакций ионного обмена в молекулярной, полной и сокращенной ионной форме. Знать понятия «окислитель», ____ «восстановитель», «окисление», «восстановление»; отличия реакций ионного обмена от ОВР. Уметь составлять уравнения ОВР методом электронного баланса и методом полуреакций. ___ ____ § 15, индивидуаль ные задания. Индивидуал ьные задания. К/р Урок контроля знаний. Тема 4. Вещества и их свойства. (14 часов) 17 Классификация и номенклатура неорганических соединений. Комбинированный урок. Простые и сложные вещества. Оксиды, их классификация; гидроксиды (основания, кислородсодержащие кислоты, амфотерные гидроксиды); кислоты их классификация; соли, их Знать важнейшие классы неорганических соединений. Уметь определять принадлежность веществ к различным классам неорганических соединений; уметь составлять формулы веществ Д.О. Образцы веществ различных классов. Таблицы «Классификаци § 17, назвать вещества и составить формулы. классификация. Комплексные соединения. 18 Металлы и их свойства. Комбинированный урок. 19 Коррозия металлов. Комбинированный урок. 20 Общие способы получения металлов. Положение металлов в ПСХЭ. Металлическая связь. Общие физические свойства металлов. Химические свойства металлов. Электрохимический ряд напряжения металлов. Значение и роль металлов в природе. Коррозия: причины, механизмы протекания, способы предотвращения. Виды коррозии. ОВР, протекающие при коррозии. Общие способы получения металлов: пиро-, гидро-, электрометаллургия Комбинированный урок. 21 Урок упражнение по теме «Металлы». Решение задач и упражнений. Комбинированный зачет. 22 Неметаллы и их свойства. Благородные газы. Положение неметаллов в ПСХЭ. Конфигурация внешнего электронного слоя неметаллов. Простые вещества неметаллы: строение, физические свойства. Аллотропия. Химические свойства. Благородные газы. Комбинированный урок. различных классов по названиям. я веществ». Знать основные свойства металлов Коллекция «Металлы и и особенности их строения. Уметь характеризовать свойства сплавы» металлов по их положению в ПСХЭ. § 18, индивидуаль ные задания. Знать причины коррозии, её виды и способы защит. Уметь составлять уравнения ОВР, происходящих при химической и электрохимической коррозии. Знать основные способы получения металлов. Уметь составлять соответствующие уравнения реакций. Д.О. Опыты по коррозии металлов и защите от неё. § 18, задание в тетради. --- § 18, индивидуаль ные задания. Уметь записывать уравнения реакций, характеризующих свойства металлов. Знать положение металлов в ПСХЭ, особенности их строения; их окислительные и восстановительные свойства. Примеры аллотропии. --- Тест, с/р. Д. Образцы некоторых неметаллов. § 19, записи в тетради. 23 Оксиды неметаллов. Комбинированный урок. Важнейшие оксиды, соответствующие гидроксиды и водородные соединения неметаллов. Зависимость свойств кислот от свойств оксида неметалла. 24 Кислоты. Кислоты в свете протолитической теории. Строение, номенклатура, классификация и свойства органических и неорганических кислот. Важнейшие представители этого класса. Общее представление о промышленном способе получения химических веществ (на примере серной кислоты) 25 Проверочная работа №1 Контроль знаний «Неметаллы». по теме Знать Изменения кислотных свойств оксидов и гидроксидов в периодах и группах, химические свойства оксидов. Уметь записывать уравнения реакций, характеризующие общие свойства кислотных оксидов и гидроксидов. Знать классификацию, строение, номенклатуру, и свойства органических и неорганических кислот; особенности свойств азотной, серной, муравьиной и уксусной кислот. Уметь записывать уравнения реакций, подтверждающие свойства данных веществ. --- Д.О. Горение сыеры и фосфора в кислороде с последующим растворением продуктов горения в воде. Д.О. Взаимодействие серной, соляной и уксусной кислот с металлами, основными и амфотерными оксидами, основаниями, солями. --- § 19, тетрадь. § 20, уравнения в тетради. Проверочна я работа Контроль знаний. 26 Основания.Соли. Комбинированный урок. Строение, свойства, классификация органических и неорганических оснований, солей.. Растворимые и нерастворимые основания. Важнейшие представители класса. Взаимное влияние атомов в молекуле анилина. Химические вещества в строительстве, полиграфии, живописи, скульптуре и Знать классификацию, номенклатуру оснований, особенности органических оснований и солей. Уметь характеризовать свойства оснований, записывать соответствующие уравнения реакций. Д.О. § 21, Взаимодействие уравнения в щелочей с тетради. растворами кислот, солей, с металлами. архитектуре. 27 Амфотерные органические и неорганические соединения. Комбинированный урок. 28 Генетическая связь между классами органических и неорганических соединений. Амфотерность оксидов и гидроксидов переходных металлов и алюминия: взаимодействие с кислотами и щелочами. Амфотерность аминокислот. Знать понятие «амфотерность» Уметь составлять уравнения реакций, хар-щих химические свойства амфотерных соединений. Генетические ряды металла и неметалла. Единство мира веществ. Знать важнейшие свойства изученных классов органических и неорганических веществ. Уметь осуществлять цепочки превращений, характеризующие генетическую связь веществ различных классов. Знать основы номенклатуры и ____ классификации органических и неорганических веществ. Знать важнейшие свойства изученных классов соединений. -- ---- Комбинированный урок. 29 Обобщение и систематизация знаний. Систематизация материала по теме «Вещества и их свойства» Комбинированный урок. 30 Контрольная работа № 3 «Металлы и неметаллы». Контрол знаний по теме «Металлы и неметаллы» Д.О. Взаимодействие гидроксидов алюминия и цинка с кислотой и щелочью. Таблица «Генетическая взаимосвязь между классами веществ». § 22, записи в тетради. Индивидуаль ные задания. Подготовка к контрольной работе. Контрольна я работа Урок контроля знаний. Тема 5. Химический практикум (4 часа) 31 Практическая работа №1 «Получение газов и изучение их свойств» Урок-практикум. Правила техники безопасности при выполнении данной работы, при работе с едкими, горючими и токсичными веществами Знать основные способы получения Мрамор, соляная и собирания газов в лаборатории. кислота, перманганат калия, цинк, Практическ ая работа 32 Практическая работа №2 «Решение экспериментальных задач по неорганической химии» Урок-практикум. Практическая работа №3 «Решение экспериментальных задач по органической химии». 34 Повторение материала по курсу химии 33 35 Резерв. Правила техники безопасности при выполнении данной работы, проведение химических реакций в растворах и при нагревании карбид кальция, этанол, серная кислота (конц.). Знать качественные реакции на ----ионы неорганических веществ Правила техники безопасности при выполнении данной работы Законы общей и неорганической химии Знать качественные реакции ---органических веществ. Практическ ая работа Практическая работа тест
