Текстовый материал для учащихся
реклама

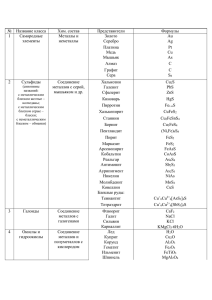
Материал для учащихся по теме «В загадочном мире волшебных камней» 8 класс. К настоящему времени известно около 500000 неорганических веществ, которые в зависимости от состава подразделяются на простые и сложные вещества. Простые вещества (их всего около 400),в свою очередь, делятся на металлы (литий, натрий, калий, магний, кальций, алюминий, медь, серебро, золото, цинк, ртуть, титан, ванадий, хром, вольфрам, марганец, железо, кобальт, никель, платина и многие другие) и неметаллы (водород, бор, углерод, кремний, азот, фосфор, кислород, сера, фтор, хлор, бром, иод, гелий, неон и некоторые другие). При комнатной температуре (200С) все металлы, за исключением ртути, твердые вещества. Они хорошо проводят тепло и электрический ток, имеют характерный металлический блеск. Большинство металлов вытесняют водород из кислот, а наиболее активные – и из воды. Среди неметаллов есть газы, жидкости и твердые вещества. Большинство неметаллов не имеют металлического блеска, не проводят тепло и электрический ток. Некоторые простые вещества по внешнему виду напоминают металлы (например, имеют металлический блеск), а по некоторым свойствам (хрупкость, плохая теплопроводность) – неметаллы. Их иногда называют металлоидами. Часто они являются полупроводниками. К числу металлоидов относят галлий, германий, мышьяк, сурьму, селен, теллур. Сложные неорганические вещества подразделяют на оксиды, кислоты, основания и соли (схема 1). Оксиды – это бинарные соединения, в состав которых обязательно входит кислород. Большинство оксидов реагируют либо с кислотами, либо с щелочами с образованием соли и воды. Оксиды, реагирующие с щелочами, называют кислотными оксидами. Любому кислотному оксиду соответствует кислота, которую в большинстве случаев можно получить взаимодействием оксида с водой. Оксиды, реагирующие с кислотами, называют основными, так как каждому такому оксиду соответствует основание. Основания состоят из атомов металла, соединенных с гидроксогруппами. Число гидроксогрупп в составе основания равно валентности металла. Растворимые основания называют щелочами. Их растворы едки и мылки на ощупь, они изменяют окраску индикаторов. Щелочи можно получить при взаимодействии активного металла или его оксида с водой. Все основания вступают в реакцию с кислотами (реакция нейтрализации), а щелочи еще и с кислотными оксидами, а в случае выпадения осадка – и с растворами солей. Кислоты состоят из атомов водорода, способных замещаться нам металл, и кислотных остатков. Кислоты имеют кислый вкус, изменяют окраску индикаторов, реагируют с активными металлами, основными оксидами и основаниями. Все эти реакции приводят к образованию солей. В определенных случаях кислоты реагируют с солями. Соли состоят из атомов металла и кислотных остатков, их можно рассматривать как продукт замещения водорода кислоты на металл или гидроксогрупп основания на кислотный остаток. Соли вступают в реакции замещения: более активный металл вытесняет менее активные из растворов солей. Наиболее важное свойство солей – их способность вступать в реакции обмена с другими солями, растворами кислот и щелочей. Реакции обмена протекают, если в результате образуется осадок, газ или вода. Схема1. Вещества различных классов генетически взаимосвязаны. Зная, к какому классу относится данное вещество, можно заранее предсказать его свойства и некоторые области применения. Первую в химии классификацию элементов и их соединений дал великий шведский ученый Йенс Берцелиус. Минерал — это природное соединение химических элементов, образовавшееся естественным путем, без вмешательства человека. Это своего рода здание, построенное из определенных кирпичиков в различных количествах, но не беспорядочная куча этих кирпичей, а именно постройка по определенным законам природы. Но мы хорошо можем понять, что из одних и тех же кирпичей, даже взятых в одном и том же количестве, можно построить разные здания. Так, один и тот же минерал может в природе встречаться в самых различных видах, хотя по существу он остается всё тем же химическим соединением. Таблица. Классификация минералов по химическому составу с формулами № Название класса 1 Самородные элементы 2 Сульфиды (синонимы названий: Хим. состав Металлы и неметаллы Соединение металлов с серой, мышьяком и др. с металлическим блеском желтые – колчеданы; с металлическим блеском серые – блески; с неметаллическим блеском – обманки) 3 Галоиды (галогениды) Соединение металлов с галогенами 4 Оксиды и гидроксиды Соединение металлов и полуметаллов с кислородом Представители Золото Серебро Платина Медь Мышьяк Алмаз Формулы Au Ag Pt Cu As С Графит Сера С S8 Халькозин Галенит Сфалерит Cu2S PbS ZnS Киноварь HgS Халькопирит CuFeS2 Пентландит (Ni,Fe)9S8 Пирит Марказит Арсенопирит Кобальтин Реальгар Антимонит Аурипигмент Никелин Молибденит Ковеллин FeS2 FeS2 FeAsS CoAsS As4S4 Sb2S3 As2S3 NiAs MoS2 CuS Флюорит Галит Сильвин Карналлит Лед Куприт Корунд Гематит Ильменит Шпинель Хромит Магнетит Рутил Касситерит Пиролюзит CaF2 NaCl KCl KMgCl36H2O H2O Cu2O Al2O3 Fe2O3 FeTiO3 MgAl2O4 FeCr2O4 FeFe2O4 TiO2 SnO2 MnO2 5 Манганит Псиломелан Колумбит Танталит Вольфрамит Брусит Гидраргиллит Диаспор Гётит Гидрогётит Кварц Опал MnO(OH) BaMn2+Mn94+O203H2O (Fe,Mn)Nb2O6 (Fe,Mn)Ta2O6 (Fe,Mn)WO4 Mn(OH)2 Al(OH)3 AlOOH FeOOH FeOOHnH2O SiO2 SiO2nH2O Оливин Циркон Гранаты: Гроссуляр Андрадит Уваровит Альмандин Спессартин Пироп Титанит (сфен) Топаз Дистен Ставролит Каламин Везувиан Эпидот Берилл Кордиерит Турмалины: Шерл Дравит Эльбаит Диоптаз Эвдиалит Пироксены: Энстатит Гиперстен Диопсид Геденбергит Авгит Эгирин Жадеит Сподумен Пироксеноиды: Волластонит Родонит (Fe,Mg)2[SiO4] Zr[SiO4] Силикаты и Соли алюмосиликаты: кремниевой кислоты Островные силикаты Цепочечные силикаты Ca3Al2[SiO4]3 Ca3Fe2[SiO4]3 Ca3Cr2[SiO4]3 Fe3Al2[SiO4]3 Mn3Al2[SiO4]3 Mg3Al2[SiO4] CaTi[SiO4]O Al2[SiO4](Fe,OH)2 Al2[SiO4]O FeAl4[SiO4]2O2 Zn[Si2O7](OH)2H2O Ca10(Mg,Fe)2Al4[SiO4]5[Si2O7]2(OH)4 Ca2(Fe,Al)Al2[SiO4][Si2O7]O(OH) Be3Al2[Si6O18] (Mg,Fe)2Al2[SiAlO18] (Na,Ca)Fe3(Al,Fe)6[Si6O18][BO3]3(OH,F)4 NaMg3(Al,Fe)6[Si6O18][BO3]3(OH,F)4 Na(Li,Al)3Al6[Si6O18][BO3]3(OH,F) Cu6[Si6O18] 6H2O (Na,Ca)9(Zr,Ti,Mn)[Si3O9][Si9O24](OH)3 Mg2[Si2O6] (Mg,Fe)2[Si2O6] CaMg[Si2O6] CaFe[Si2O6] (Ca,Na)(Mg,Fe2+,Fe3+,Al)[(Si,Al)2O6] NaFe3+[Si2O6] NaAl[Si2O6] LiAl[Si2O6] Ca3[Si3O9] CaMn4[Si5O15] Амфиболы: Тремолит Актинолит Роговая обманка Арфведсонит Силикаты и алюмосиликаты слоистой структуры Глаукофан Рибекит Астрофиллит Серпентин Каолинит Галлуазит Тальк Пирофиллит Слюды: Ca2Mn5[Si4O11]2(OH)2 Ca2Fe5[Si4O11]2(OH)2 (Ca,Na)(Mg,Fe)4(Al,Fe)[(Si,Al)4O11]2(OH) 2 Na(Ca,Na)(Fe2+,Mg2+,Fe3+,Al2+) [(Al,Si)4O11]2(OH,F)2 NaNaMg2Al2 [Si4O11]2(OH,F)2 NaNaFe22+Fe23+ [Si4O11]2(OH,F)2 K3(Fe,Mn)7Ti2 [Si4O12]O2(OH)5 Mg6[Si4O10](OH)8 Al4[Si4O10](OH)8 Al4[Si4O10](OH)84H2O Mg3[Si4O10](OH)2 Al2[Si4O10](OH)2 Мусковит Флогопит Биотит KAl2[Si3AlO10](OH,F)2 KMg3[Si3AlO10](OH,F)2 K(Fe,Mg)3[Si3AlO10](OH,F)2 Лепидолит Гидрослюды: KLi1.5Al1.5 [Si3AlO10](OH,F)2 (Mg,Fe2+,Fe3+)3 [(Si,Al)4O10](OH)24H2O (K, H2O) (Fe3+,Al,Fe2+,Mg) 2 [Si3AlO10](OH)2nH2O Монтмориллонит (Al, Mg)2[Si4O10](OH)24H2O Бейделлит Al2[(Si,Al)4O10](OH)24H2O Нонтронит (Fe,Al)2[(Si,Al)4O10](OH)24H2O Хризоколла Cu4[Si4O10](OH)24H2O Вермикулит Глауконит Каркасные алюмосиликаты Палыгорскит Чароит Пеннин Клинохлор Прохлорит Шамозит Тюрингит Фельдшпатиды: Нефелин Канкринит Содалит Лазурит Гельвин Лейцит Анальцим Mg2Al2 [Si8O20](OH)28H2O K2NaCa5 [Si12O30](OH,F)3H2O (Mg,Al)6 [Si3,5 Al0,5O10](OH)8 (Mg,Al)6 [Si3AlO10](OH)8 (Mg,Fe,Al)6 [Si2,5 Al1,5O10](OH)8 (Fe2+,Mg,Fe3+)6[Si3AlO10](OH)8 (Fe2+,Mg,Fe3+Al)6[Si2Al2O10](OH,O)8 Поллуцит Полевые шпаты: K-Na п.ш: Санидин Ортоклаз Cs1-nNan [Si2AlO6]nH2O KNa3[SiAlO4]4 Na6Ca2 [SiAlO4]6 [CO3,SO4] (OH)2 Na8[SiAlO4]6Cl2 Na2Ca2 [SiAlO4]6Cl2 (SO4,S,Cl2) (Mn2+)4[SiBeO4]3S K[Si2AlO6] Na[Si2AlO6]H2O (K,Na)[Si3AlO8] (K,Na)[Si3AlO8] Микроклин Плагиоклазы: Альбит Анортит 6 Бораты 7 Карбонаты 8 Нитраты Соли азотной кислоты 9 Сульфаты Соли серной кислоты 10 Фосфаты, арсенаты, ванадаты Соединения металлов с бором Соли угольной кислоты Соли фосфорной, мышьяковой и ванадиевой кислот (K,Na)[Si3AlO8] Na[Si3AlO8] Ca[Si2AlO8] Цельзиан Данбурит Датолит Аксинит Скаполит: Мариалит Мейонит Цеолиты: Натролит Сколецит Ломонтит Шабазит Гейландит Десмин Морденит Котоит Людвигит Гидроборацит Кальцит Родохрозит Сидерит Смитсонит Магнезит Арагонит Церуссит Доломит Малахит Азурит Натриевая (чилийская) селитра Тенардит Ангидрит Целестин Барит Англезит Ярозит Ba[Si2AlO8] Ca[Si2B2O8] Ca2[Si2B2O8(OH)2] Ca2(Fe,Mn)Al2[Si4BO15(OH)] Гипс Халькантит Ca[SO4]2H2O Cu[SO4] Монацит (Ce, La…)[PO4] Апатит Пироморфит Амблигонит Ca5[PO4]3(F,Cl,OH,O) Pb5[PO4]3Cl LiAl[PO4]F Na4[Si3AlO8]3Cl Ca4[Si2Al2O8]3 (Cl,CO3,SO4) Na2[Si3Al2O10] 2H2O Ca[Si3Al2O10] 3H2O Ca[Si4Al2O12] 4H2O (Ca,Na2)[Si4Al2O12] 6H2O Ca[Si7Al2O18] 6H2O (Ca,Na2)[Si7Al2O18] 7H2O (Na2,Ca)[Si10Al2O24] 7H2O Mg3[BO3]2 (Mg,Fe2+)2Fe3+[BO3]O2 Ca,Mg[B2BO4(OH)3]23H2O Ca[CO3] Mn[CO3] Fe[CO3] Zn[CO3] Mg[CO3] Ca[CO3] Pb[CO3] CaMg[CO3]2 Cu2[CO3](OH)2 Cu3[CO3]2(OH)2 Na[NO3] Na2[SO4] Ca[SO4] Sr[SO4] Ba[SO4] Pb[SO4] KFe33+[SO4]2(OH)6 Вивианит Эритрин Аннабергит Скородит Бирюза Fe3[PO4]28H2O Co3[AsO4]28H2O Ni3[AsO4]28H2O Fe[AsO4]2H2O Cu(Al,Fe)6[PO4]4(OH)84H2O