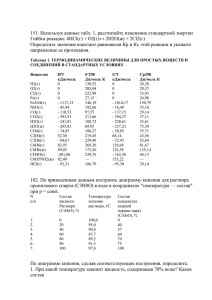
Н.Н.БОГДАШЕВ ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ КУРС ЛЕКЦИЙ ЧАСТЬ I. ФИЗИЧЕСКАЯ ХИМИЯ Пятигорск 2002 ББК 24.5 УДК: 541.1 (042.4) Р е ц е н з е н т ы: 1. Доцент кафедры физической и коллоидной химии Пятигорской государственной фармацевтической академии, кандидат фармацевтических наук Л.П.Мыкоц. 2. Преподаватель кафедры аналитической химии Пятигорской государственной фармацевтической академии, кандидат химических наук А.Б.Дмитриев Автор: доктор фармацевтических наук Н.Н.Богдашев Курс лекций по физической и коллоидной химии. Часть I - Физическая химия. Для студентов фармацевтических ВУЗов. Редакционный совет: Председатель - проф. Е.Н.Вергейчик, проф. В.Г.Беликов, проф. В.И.Погорелов, проф. Ю.Г.Пшуков, проф. М.Д.Гаевый, проф. Д.А.Муравьева, доц. В.В.Гацан, доц. Б.И.Литвяк, В.В.Карпова, Т.М.Браташова. 2 ОГЛАВЛЕНИЕ Стр. Предисловие . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Принятые обозначения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Основные физические константы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. 9 . 11 . .12 ВВЕДЕНИЕ 1. Предмет физической химии, её место среди естественнонаучных дисциплин и значение для фармации, медицины и биологии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 Краткий исторический очерк развития физической химии . . . 3. Методы физической химии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .13 . .16 . 18 I. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА ГЛАВА 1. Общие сведения из термодинамики. Нулевое и первое начала термодинамики . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.1. Краткий исторический очерк . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2. Основные понятия и величины . . . . . . . . . . . . . . . . . . . . . . . . . 1.3. Нулевое начало термодинамики . . . . . . . . . . . . . . . . . . . . . . . . . 1.4. Первое начало термодинамики . . . . . . . . . . . . . . . . . . . . . . . . . . 1.5. Энтальпия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ГЛАВА 2.1. 2.2. 2.3. 2.4. 2.4.1. 2.4.2. 2.5. 2.6. 2.7. 2.8. 2.9. 2.10. 2. Термохимия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Термохимия, её задачи и значение . . . . . . . . . . . . . . . . . . . . . . . Краткий исторический очерк . . . . . . . . . . . . . . . . . . . . . . . . . . . Калориметрические измерения . . . . . . . . . . . . . . . . . . . . . . . . . . Тепловой эффект химической реакции . . . . . . . . . . . . . . . . . . . Соотношение между тепловыми эффектами реакций при постоянном объёме и при постоянном давлении . . . . . . . . . . . . .. Тепловые эффекты, используемые при термохимических измерениях и вычислениях . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Стандартные состояния. Стандартные условия . . . . . . . . . . . . Термохимические уравнения . . . . . . . . . . . . . . . . . . . . . . . . . . . Закон Гесса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгоффа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Теплота растворения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Теплота нейтрализации . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .21 . .22 . .22 . .27 . .27 . .29 . .32 . .32 . .32 . .33 . .34 . .35 . .36 . .37 . .38 . .39 . .43 . .46 .49 ГЛАВА 3. Второе и третье начала термодинамики 3 Второе начало термодинамики . . . . . . . . . . . . . . . . . . . . . . . . . . Статистический характер второго начала термодинамики . . . . Обратимые и необратимые процессы. Самопроизвольные и несамопроизвольные процессы . . . . . . . . . . . . . . . . . . . . . . . . Факторы интенсивности и экстенсивности (ёмкости) . . . . . . . . Термодинамическая вероятность системы . . . . . . . . . . . . . . . . Энтропия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Энтропия со статистической точки зрения . . . . . . . . . . . . . . . . . Энтропия с термодинамической точки зрения . . . . . . . . . . . . . . Расчёт изменения энтропии для различных процессов . . . . . . . Изотермическое расширение идеального газа . . . . . . . . . . . . . . Изотермические фазовые переходы (плавление, кипение, сублимация) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Неизотермический физический процесс (нагревание или охлаждение тела) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Химические реакции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Третье начало термодинамики. Постулат Планка. Абсолютная энтропия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Энергия Гельмгольца. Энергия Гиббса. Критерий достижения химического равновесия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Свободная и связанная энергия . . . . . . . . . . . . . . . . . . . . . . . . . . Максимальная работа процесса и химическое сродство . . . . . . Уравнение максимальной работы (уравнение Гиббса Гельмгольца) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.1. 3.1.1. 3.2. 3.3. 3.4. 3.5. 3.5.1. 3.5.2. 3.6. 3.6.1. 3.6.2. 3.6.3. 3.6.4. 3.7. 3.8. 3.9. 3.10. 3.11. II. 4.5.2. 4.5.3. 4.6. 4 . .52 . .53 . .54 . .55 . .55 . .56 . .58 . .58 . .59 . .59 . .60 . .60 . .62 . .65 . .66 . .67 ХИМИЧЕСКОЕ РАВНОВЕСИЕ ГЛАВА 4.1. 4.2. 4.3. 4.4. 4.4.1. 4.4.2. 4.5. 4.5.1. . .50 . .52 4. Термодинамика химического равновесия Химическое равновесие . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Краткий исторический очерк . . . . . . . . . . . . . . . . . . . . . . . . . . . Константа равновесия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Расчёты с применением констант равновесия . . . . . . . . . . . . . . Определение направления протекания обратимых реакций . . . Расчёт равновесного выхода продуктов реакции . . . . . . . . . . . Факторы, влияющие на равновесие. Принцип Ле-Шателье Брауна . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Влияние на равновесие начального состава реакционной смеси. Уравнение изотермы химической реакции . . . . . . . . . . ... Влияние температуры на равновесие. Уравнения изобары и изохоры химической реакции . . . . . . . . . . . . . . . . . . . . . . . . . . . Влияние на равновесный выход изменения объёма и давления реакционной смеси . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Способы вычисления констант равновесия . . . . . . . . . . . . . . . . . .70 . .71 . .72 . .75 . .75 . .76 . .77 . .78 . .81 . .82 . .83 4.7. III. Химическое равновесие в гетерогенных системах . . . . . . . . . . . .86 ФАЗОВОЕ РАВНОВЕСИЕ ГЛАВА 5. Термодинамика фазового равновесия Краткий исторический очерк . . . . . . . . . . . . . . . . . . . . . . . . . . . Фазовые переходы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Основные понятия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Правило фаз . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Общее условие фазового равновесия. Химический потенциал . .88 . .89 . .90 . .91 . .92 ГЛАВА 6. Фазовые равновесия в однокомпонентных системах 6.1. Связь между давлением и температурой фазовых переходов. Уравнение Клапейрона . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.1.1. Процесс кипения. Уравнение Клаузиуса – Клапейрона . . . . . . 6.2. Физико-химический анализ. Фазовые диаграммы . . . . . . . . . . 6.3. Диаграмма состояния воды . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .94 . .98 .100 .101 5.1. 5.2. 5.3. 5.4. 5.5. ГЛАВА 7. Фазовые равновесия в двухкомпонентных системах. Растворы неэлектролитов 7.1. Растворы. Основные понятия . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.2. Значение растворов для фармации . . . . . . . . . . . . . . . . . . . . . . 7.3. Концентрация. Способы выражения концентрации . . . . . . . . . 7.4. Двухкомпонентные растворы летучих жидкостей. Закон Рауля 7.5. Отклонения от закона Рауля . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.6. Первый закон Коновалова . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.7. Диаграммы кипения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.8. Второй закон Коновалова . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.9. Правило рычага . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.10. Перегонка бинарных жидкостных смесей . . . . . . . . . . . . . . . . . 7.11. Разделение азеотропных смесей . . . . . . . . . . . . . . . . . . . . . . . . . 7.12. Ограниченно растворимые жидкости . . . . . . . . . . . . . . . . . . . . 7.13. Диаграммы растворения. Правило Алексеева . . . . . . . . . . . . . . 7.13.1. Системы с верхней критической температурой растворения . . 7.13.2. Системы с нижней критической температурой растворения . . . 7.13.3. Системы с верхней и нижней критическими температурами растворения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.14. Растворы нелетучих веществ. Коллигативные свойства растворов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.15. Понижение температуры замерзания растворов. Криометрия . 7.16. Повышение температуры кипения растворов. Эбулиометрия . 7.17. Осмос . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.17.1. Осмотическое давление . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .105 .107 .107 .110 .113 .116 .117 .119 .121 .123 .125 .127 .128 .129 .132 .133 .134 .135 .139 .140 .142 5 7.17.2. 7.17.3. 7.18. 7.19. 7.20. 7.20.1. 7.20.2. 7.20.3. 7.21. Осмометрия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Значение осмотических явлений . . . . . . . . . . . . . . . . . . . . . . . . Несмешивающиеся жидкости . . . . . . . . . . . . . . . . . . . . . . . . . . . Перегонка с водяным паром . . . . . . . . . . . . . . . . . . . . . . . . . . . . Диаграммы плавления. Термический анализ . . . . . . . . . . . . . . . Системы, состоящие из неизоморфных веществ . . . . . . . . . . . . Системы, состоящие из веществ, образующих химические соединения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Системы, состоящие из веществ, образующих твёрдые растворы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Правило рычага для конденсированных систем . . . . . . . . . . . . ГЛАВА 8. Фазовые равновесия в трёхкомпонентных системах. Экстракция 8.1. Третий компонент в двухслойной жидкой системе. Закон распределения Нернста . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8.2. Жидкостная экстракция . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . IV. .143 .144 .147 .148 .150 .151 .156 .160 .162 .164 .165 ЭЛЕКТРОХИМИЯ ГЛАВА 9. Электрохимия. Растворы электролитов. Кондуктометрия 9.1. Предмет электрохимии и её значение для фармации, медицины и биологии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..... 9.2. Краткий исторический очерк . . . . . . . . . . . . . . . . . . . . . . . . . . . 9.3. Коллигативные свойства растворов электролитов . . . . . . . . . . . 9.4. Буферные растворы. Буферная ёмкость . . . . . . . . . . . . . . . . . . . 9.5. Электрическая проводимость растворов. Закон Кольрауша . . . 9.6. Кондуктометрические измерения . . . . . . . . . . . . . . . . . . . . . . . . 9.6.1. Прямая кондуктометрия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9.6.2. Кондуктометрическое титрование . . . . . . . . . . . . . . . . . . . . . . . ГЛАВА 10.1. 10.2. 10.3. 10.4. 10.5. 10.6. 10. Электродные процессы и электродвижущие силы Основные понятия и величины . . . . . . . . . . . . . . . . . . . . . . . . . Электроды первого и второго рода. Газовые электроды . . . . . . Термодинамика гальванического элемента . . . . . . . . . . . . . . . Формула записи гальванического элемента . . . . . . . . . . . . . . . Уравнение Нернста . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Контактный и диффузионный потенциалы . . . . . . . . . . . . . .. . .171 .171 .172 .174 .176 .182 .182 .183 .187 .190 .194 .197 .198 .202 ГЛАВА 11. Потенциометрические измерения 11.1. Потенциометрия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .204 11.2. Потенциометрическое измерение рН растворов. Ионометрия . .204 6 Потенциометрическое определение концентрации . (активности) ионов. Концентрационные гальванические .207 элементы . . . . Определение констант равновесия электрохимических реакций. Окислительно-восстановительные электроды и гальванические элементы . . . . . . . . . . . . . . . . . . . . . . . . . . . . .211 11.3. 11.4. V. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ ГЛАВА 12. Формальная и молекулярная кинетика 12.1. Предмет химической кинетики и её значение для фармации, медицины и биологии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12.2. Краткий исторический очерк . . . . . . . . . . . . . . . . . . . . . . . . . . . 12.3. Кинетическая классификация химических реакций. Порядок и молекулярность реакции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12.4. Скорость химической реакции. Время полупревращения . . . . . 12.5. Закон действующих масс. Константа скорости . . . . . . . . . . . . . 12.6. Расчёт констант скорости для реакций различных порядков . . 12.6.1. Реакции первого порядка . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12.6.2. Реакции второго порядка . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12.7. Определение порядка реакции . . . . . . . . . . . . . . . . . . . . . . . . . . 12.8. Механизмы химических реакций . . . . . . . . . . . . . . . . . . . . . . . . 12.9. Влияние температуры на скорость реакции . . . . . . . . . . . . . . . 12.9.1. Правило Вант-Гоффа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12.9.2. Теория активных столкновений. Уравнение Аррениуса . . . . . . 12.10. Теория переходного состояния. Активированный комплекс . . 12.11. Гетерогенные реакции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .215 .217 .217 .220 .222 .224 .224 .228 .231 .232 .233 .234 .235 .238 .242 ГЛАВА 13. Катализ 13.1. 13.2. 13.3. 13.4. 13.5. 13.6. 13.7. 13.7.1. 13.7.2. 13.7.3. 13.8. Основные понятия. Значение катализа для медицины, фармации и биологии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Краткий исторический очерк . . . . . . . . . . . . . . . . . . . . . . . . . . . Виды катализа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Механизм действия катализаторов . . . . . . . . . . . . . . . . . . . . . . . Гомогенный катализ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Гетерогенный катализ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Теории гетерогенного катализа . . . . . . . . . . . . . . . . . . . . . . . . . . Мультиплетная теория . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Теория активных ансамблей . . . . . . . . . . . . . . . . . . . . . . . . . . . . Электронная теория . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ингибиторы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .244 .245 .245 .247 .247 .249 .251 .251 .253 .254 .259 7 VI. ФОТОХИМИЯ ГЛАВА 14.1. 14.2. 14.3. 14.4. 14.5. 14. Фотохимические реакции Значение фотохимических реакций . . . . . . . . . . . . . . . . . . . . . . Первичные и вторичные фотохимические процессы . . . . . . . . Законы фотохимии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Фотохимическая эффективность . . . . . . . . . . . . . . . . . . . . . . . . Фотосенсибилизация . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .256 .257 .258 .259 .260 Использованная литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Предметный указатель . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .261 .263 8 ПРЕДИСЛОВИЕ Настоящее издание представляет собой изложение курса лекций по физической химии, читаемого автором на протяжении последних 15 лет студентам Пятигорской государственной фармацевтической академии. Физическая химия является фундаментальной научной дисциплиной, описывающей общие закономерности протекания химических реакций и некоторых других видов взаимодействия веществ. Законы, закономерности, правила и положения физической химии, а также выводы, к которым они приводят, лежат в основе химических и биохимических реакций в природе, а также технологических процессов в химической и фармацевтической промышленности. Поэтому знание основ физической химии необходимо провизорам широкого специальностей - профиля, а также химикам-аналитикам, специалистам технологам смежных химического и фармацевтического производства, производства веществ, используемых в парфюмерии, косметике, в быту, биологам, биохимикам, экологам, фармакологам и др. Учебный план по специальности “Фармация” предусматривает очень небольшое количество лекционных часов по физической химии, поэтому автор в настоящей книге старался изложить программный материал по возможности кратко и доступным языком, но вместе с тем достаточно строго, на современном научном уровне. Цель данного издания - сформировать у студента целостное восприятие физической химии, как естественнонаучной и мировоззренческой научной дисциплины, показать её связь с деятельностью биологических систем, а также с химико-технологическими процессами, как в лаборатории, так и в промышленности. Большое число иллюстрирующих материал примеров, взятых из биологии, биохимии, фармакологии, должно заинтересовать студента и облегчить понимание всей совокупности химических, физико9 химических и биохимических процессов в природе, а также в какой-то степени природы и механизма действия лекарственных и биологически активных веществ. В соответствии со спецификой фармацевтической специальности некоторые разделы физической химии, имеющие большее значение, изложены более подробно (например, “Химическое равновесие”, “Фазовое равновесие”), другие - более кратко. Те разделы, которые достаточно подробно изучаются в смежных курсах физики, общей химии, аналитической химии, биохимии, также изложены по возможности более кратко или вообще опущены. В данном “Курсе лекций” использована модульная система изложения с сохранением традиционной последовательности разделов физической химии. В связи с тем, что материал, входящий в каждый раздел, представляет собой единое целое, в книге отсутствует деление на лекции. Законы и правила, а также впервые вводимые термины для облегчения их нахождения выделены шрифтом. Мелким шрифтом набран тот материал, который не входит в программу, но может расширить представления читателя и в какойто мере облегчить восприятие основного материала. Автор выражает глубокую благодарность всем сотрудникам Пятигорской государственной фармацевтической академии и в особенности сотрудникам кафедры физической и коллоидной химии ПГФА, чьи советы, критические замечания и помощь были использованы при подготовке курса лекций и написании настоящего издания, искреннюю признательность рецензентам за кропотливый анализ рукописи и за конструктивные замечания перед подготовкой к печати. Автор с признательностью и благодарностью примет все отзывы, замечания и пожелания. 10 ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ: A - энергия Гельмгольца a - термодинамическая активность C - 1) молярная концентрация; 2) теплоёмкость; 3) вариантность системы E - 1) энергия; 2) электродный потенциал; 3) электродвижущая сила; E* - энергия активации e - элементарный заряд e - электрон F - 1) число Фарадея; 2) сила f - 1) коэффициент активности 2) осмотический коэффициент G - энергия Гиббса H - энтальпия i - изотонический коэффициент проводимость K - 1) константа равновесия; 2) коэффициент распределения 3) число независимых компонентов k - 1) константа скорости 2) константа Больцмана L - удельная теплота фазового перехода M - молярная масса m - 1) масса 2) моляльная концентрация Me – металл N - молярная концентрация эквивалента NA - число Авогадро n - количество вещества (в молях) p - давление Q - количество теплоты R - универсальная газовая постоянная S - энтропия Т - температура t - время V - 1) объём 2) разведение X - мольная (молярная) доля U – внутренняя энергия системы v - скорость реакции W - термодинамическая вероятность w – работа z - заряд иона - степень диссоциации удельная электрическая - эквивалентная электрическая проводимость эквивалентная электрическая проводимость при бесконечном разведении - химический потенциал - 1) геометрическая константа; 2) осмотическое давление - число ионов в одной молекуле - плотность - 1) фотохимическая эффективность 2) число фаз в системе - объёмная доля - массовая доля 11 ОСНОВНЫЕ ФИЗИЧЕСКИЕ КОНСТАНТЫ: Элементарный заряд е 1,602101019 Кл Число Авогадро NA 6,022521023 моль1 Число Фарадея F 96487 Кл/моль-экв Константа Больцмана k 1,38041023 Дж/К Универсальная газовая постоянная R 8,314 Дж/мольК = = 1,98725 кал/мольК = = 0,082057 латм/мольК 12 ВВЕДЕНИЕ 1. Предмет физической химии, её место среди естественнонаучных дисциплин и значение для фармации, медицины и биологии Для современного естествознания наряду с углублением специализации характерно взаимопроникновение различных областей науки, которое привело к появлению пограничных научных дисциплин со смешанными - двойными и даже тройными - названиями: биохимия, биофизика, биоорганическая химия, математическая лингвистика и т. п. Даже из этого краткого перечисления видно, что значительная часть этих наук возникла и развивается на стыке химии, физики и биологии. Одной из таких наук является и физическая химия. Физическая химия является теоретической основой других химических дисциплин - общей, неорганической, органической, аналитической химии. Все направления современной биологии, а также медицина и фармация широко используют подходы и методы физической химии. Без знания её основ невозможно глубокое понимание и плодотворное развитие технологии лекарств, физико-химических методов анализа фармацевтических препаратов, биохимии, фармакологии, токсикологии и других специальных фармацевтических дисциплин. Интенсивно развивающееся в последнее время учение о количественной связи “структура - активность” применительно к фармакологическому действию лекарств основывается главным образом на различных физико-химических закономерностях, лежащих в основе механизмов проникновения лекарственных веществ в организм, доставки их к определенным органам, взаимодействия с биологическими субстратами различного уровня организации, а также выведения их из организма. 13 Физическая химия - наука, изучающая химические явления и устанавливающая их общие закономерности на основе физических подходов и с использованием физических экспериментальных методов. Предметом физической химии является изучение двух главных групп вопросов: изучение свойств веществ в зависимости их от химического состава и строения и от условий существования; изучение химических реакций и других форм взаимодействия между веществами или частицами в зависимости от их химического состава и строения, а также от условий, при которых происходит процесс. Физическую химию можно рассматривать как совокупность преимущественно количественных методов, прилагаемых к изучению и описанию различных химических проблем. Исследователь в области физической химии старается предсказать возможность, направление и глубину протекания химических процессов, исходя из определённых физических моделей, законов и правил. Физическая химия - не только теоретическая дисциплина. Знание её законов позволяет понять сущность химических процессов и сознательно выбирать наиболее благоприятные условия для их практического осуществления. Её законы лежат в основе природных и промышленных процессов, например, различных технологий синтеза химических и в том числе лекарственных веществ. Содержание курса физической химии обычно делится на следующие основные разделы: Учение о строении вещества; Химическая термодинамика и термохимия; Учение о химическом равновесии; Учение о фазовом равновесии; 14 Учение о растворах; Электрохимия; Химическая кинетика и учение о катализе; Фотохимия. Так как учение о строении вещества достаточно подробно излагается в курсах физики и общей химии, в нашем курсе этот раздел рассматриваться не будет. Кроме того, в него не включаются некоторые темы, изучаемые на практических занятиях. Профессия провизора охватывает многие виды деятельности, непосредственно связанные с физической химией и физико-химическими методами анализа. Ниже приведены некоторые наиболее важные из таких взаимосвязей: Деятельность провизора Промышленное производство лекарственных веществ Соответствующие разделы физической химии или физико-химические методы анализа Учение о химическом равновесии, химическая кинетика и катализ Извлечение лекарственных веществ из растительного и животного сырья Учение о фазовом равновесии, (экстрагирование), учение о растворах, учение о диффузии Приготовление лекарственных препаратов и лекарственных форм Свойства дисперсных систем, фазовые равновесия, поверхностные явления, свойства растворов и др. Фазовые и химические равновесия, растворы, термический анализ Физико-химические методы анализа: оптические - спектрофотометрия, фотоколориметрия, нефелометрия, турбидиметрия и т. д.; электрохимические - потенциометрическое, кондуктометрическое, амперометрическое титрование, полярография и т.д. хроматографические - адсорбционная, распределительная хроматография, колоночная, тонкослойная, бумажная, электрофоретическая хроматография и др. Кинетика, катализ, фотохимия Определение физической совместимости лекарственных веществ Анализ лекарственных веществ в субстанции, в лекарственных формах, в природных объектах, в экстрактах Определение и продление сроков годности лекарственных препаратов Выбор способа введения лекарств в Учение о растворах (осмос, взаимная организм человека растворимость веществ), учение о фазовом равновесии (экстракция, распределение, 15 Деятельность провизора Соответствующие разделы физической химии или физико-химические методы анализа диффузия), кислотно-основный катализ, кинетика, свойства дисперсных систем Исследование поведения лекарственных Диффузия, свойства гелей, свойства поверхвеществ в организме ностно--активных и высокомолекулярных веществ, кинетика, учение о растворах, учение о химическом равновесии и др. Знание физической химии необходимо также и биологу широкого профиля, биохимику, врачам всех специальностей. Еще И.М.Сеченов сравнил живую клетку с миниатюрной физико-химической лабораторией, это представление совершенно справедливо и сейчас. Врач и фармаколог в своей работе постоянно сталкиваются с физико-химическими процессами, протекающими в организме как здорового, так и больного человека, поэтому они обязаны иметь определённый минимум знаний в этой области. 2. Краткий исторический очерк развития физической химии Основоположником физической химии является великий русский учёный М.В.Ломоносов. В 1751 - 54 г.г. в Петербургском академическом университете он прочитал первый в истории курс физической химии, а в 1752 начал писать первый учебник "Введение в истинную физическую химию", где дал определение этой новой для того времени дисциплины: "Физическая химия есть наука, дающая объяснение на основании физических начал и опытов тому, что происходит при смешении тел вследствие химических операций. Она может быть названа также химической философией..." М.В.Ломоносов создал и первую в России химическую лабораторию, где не только читались лекции, но и были организованы лабораторные работы для студентов. К концу ХVIII началу XIX в. относится ряд основополагающих исследований в об- * М.В.Ломоносов. Полное собрание сочинений. В 10 т. М.- Л.- Изд-во АН СССР, 1950. - Т.2, С.461. 16 ласти термохимии (А.Л.Лавуазье и П.Лаплас, 1782), электрохимии (Л.Гальвани, 1789, А.Вольта, 1800), химического сродства и равновесия (К.Л.Бертолле, 1801). В 1-й половине XIX в. получили широкое распространение атомистические представления (Д.Дальтон, Ж.Л.Гей-Люссак, А.Авогадро, Й.Я.Берцелиус). В 1824 г. вышла в свет основополагающая для термодинамики работа С.Карно "Размышление о движущей силе огня». Благодаря работам Г.Дэви и М.Фарадея были открыты количественные законы электролиза (М.Фарадей, 1830) и значение электрических сил в образовании химических соединений, что заложило основы электрохимии. В тот же период Г.И.Гессом (1840) открыт закон “постоянства сумм тепла” - основной закон термохимии. Примерно с середины XIX в. начинается классический период развития физической химии, когда сформировался круг вопросов, изучаемых ею, а накопленные экспериментальные факты позволили установить главные законы, и правила. В это время появляются работы Ю.Р.Майера, Дж.П.Джоуля, Р.Э.Клаузиуса, В.Томсона (Кельвина), Г.Гельмгольца, Л.Больцмана, в которых получила развитие термодинамика, блестяще обобщённая в конце XIX в. Дж.У.Гиббсом и Я.Вант-Гоффом. В России впервые после М.В.Ломоносова курс физической химии был введён в 1865 г. Н.Н.Бекетовым в Харьковском университете. С этого времени физическая химия постоянно включается в программы университетов и других высших и средних учебных заведений. В 60-х годах XIX в. Д.И.Менделеевым открыт основной закон химии периодический закон, а А.М.Бутлеровым была создана теория химического строения. Эти два великих открытия окончательно превратили химию из науки описательной в науку, способную предсказывать свойства вновь получаемых веществ, то есть дали химии возможность вести целенаправленный поиск и синтез веществ. В те же годы интенсивно развиваются учение о химическом равновесии и кинетика химических реакций благодаря открытию К.М.Гульдбергом и П.Вааге закона действующих масс, работам Н.Н.Бекетова, Н.А.Меншуткина, Я.Вант-Гоффа, С.Аррениуса, А.Л.Ле-Шателье. Развивается теория растворов и фазовых равновесий (Д.И.Менделеев, Ф.М.Рауль, Д.П.Коновалов), теория электролитической диссоциации (Н.Н.Каяндер, С.Аррениус, В.Оствальд). На рубеже XIX и XX веков были сделаны многие открытия, имеющие принципиальное значение для учения о строении вещества: открытие электрона (Дж.Дж.Томсон и Э.Вихарт), квантовой природы света (М.Планк), открытие 17 А.Беккерелем радиоактивности. Создается теория гальванического элемента (В.Нернст). Появляются первые работы по хроматографии (М.С.Цвет). С 1910-х годов XX в. начинается современный период развития физической химии. Его начало ознаменовано открытием Э.Резерфордом ядра атома, разработкой им планетарной модели строения атома, а также созданием Н.Бором первой количественной теории строения атома водорода (1913). На её основе, а также на основе квантовой теории М.Планка разработана квантовая механика (Л.де Бройль, В.Гейзенберг, А.И.В.Зоммерфельд, 1920-е гг.) теория химической связи (Г.Н.Льюис и др.). Возникают теория строения растворов электролитов (П.Дебай, Э.Хюккель, 1923) и теория строения двойного электрического слоя (О.Штерн, А.М.Фрумкин, 1924). В это же время интенсивно развиваются учение о катализе (В.Н.Ипатьев, П.Сабатье, С.В.Лебедев, А.А.Баландин, Н.И.Кобозев), физико-химический анализ (Н.С.Курнаков), исследование адсорбции и поверхностных явлений (И.Лэнгмюр, Г.Фрейндлих), разрабатываются новые методы исследования (полярография, инфракрасная и ультрафиолетовая спектроскопия, рентгенография, электрофорез, хроматография), учение о цепных реакциях (Н.Н.Семёнов), фотохимия и радиационная химия. В послевоенные годы появляются новые методы исследования - спектроскопии ядерного магнитного резонанса (ЯМР), электронно-парамагнитного резонанса (ЭПР), комбинационного рассеяния света (КРС), мёссбауэровская; методы кругового дихроизма, вращающегося электрода. Развиваются новые направления - квантовая химия, химия высоких энергий, математическое моделирование химических процессов (компьютерная химия) и др. 3. Методы физической химии Кроме многочисленных химических и физических экспериментальных методов, о которых пойдёт речь в дальнейшем изложении курса, в физической химии используются и теоретические методы исследования, среди которых можно выделить: 1) квантово-механический (квантово-химический), 18 2) термодинамический (в том числе с применением статистической термодинамики), 3) кинетический. Квантово-механический метод, основанный на современной теории строения атома, находит наибольшее применение в учении о строении молекул, о химической связи, о строении твёрдого тела и жидкости, в исследованиях количественной взаимосвязи “структура - свойство” и “структура - химическая и биологическая активность” Термодинамический метод базируется на использовании наиболее общих законов природы - принципов термодинамики. Метод основан на феноменологическом подходе, который позволяет формулировать закономерности физико-химических процессов, не затрагивая их механизма и природы действующих сил. Общая и химическая термодинамика являются основой таких разделов физической химии, как учение о химическом сродстве и химическом равновесии, учение о фазовом равновесии, теория растворов, электрохимия. Статистическая термодинамика основана на применении к рассматриваемой системе, состоящей из очень большого числа частиц, законов теории вероятности. Этот метод используется главным образом в кинетической теории газов. Достоинством термодинамического метода является то, что при его применении не обязательно знание детального строения и состава исследуемого объекта, а также механизма изучаемого процесса. Вполне достаточным оказывается знание начальных и конечных параметров состояния исследуемой системы. При этом выводы о принципиальной возможности того или иного процесса, о глубине его протекания, о параметрах системы при установившемся равновесии и т. п. могут быть рассчитаны с помощью относительно небольшого числа экспериментально определённых термодинамических данных. 19 Кинетический метод основан на изучении протекания химических процессов во времени. В отличие от термодинамического метода при кинетических исследованиях требуется детальное знание механизма процесса. Кинетический метод используется при изучении скорости различных химических и биохимических процессов, при выяснении числа и последовательности промежуточных стадий, а также природы образующихся на каждой стадии промежуточных продуктов. 20 I. Х И М И Ч Е С К А Я Т Е Р М О Д И Н А М И К А ГЛАВА 1 ОБЩИЕ СВЕДЕНИЯ ИЗ ТЕРМОДИНАМИКИ. НУЛЕВОЕ И ПЕРВОЕ НАЧАЛА ТЕРМОДИНАМИКИ В изучении большинства разделов физической химии мы будем использовать термодинамический метод. Химическая термодинамика изучает законы, которым подчиняются энергетические превращения, сопровождающие химические процессы, Она позволяет определить возможность, направление и предел протекания химических реакций при различных условиях. Теоретической базой химической термодинамики являются начала (законы) термодинамики и их следствия, которым придается форма, наиболее удобная для решения химических проблем. Законы термодинамики являются обобщениями многочисленных наблюдений и выполняются независимо от конкретной природы образующих систему тел. Доказательством правильности их является то, что все выводы, к которым они приводят, находят подтверждение на опыте. Поэтому закономерности и соотношения между физическими величинами, к которым приводит термодинамика, имеют универсальный характер. Чтобы подчеркнуть своеобразие законов термодинамики, заключающееся в их всеобщем характере и в том, что они являются постулатами (т. е. не могут быть математически выведены из каких-либо экспериментальных данных), их принято называть принципами или началами термодинамики. 21 1.1. Краткий исторический очерк Первые работы, относящиеся к термодинамике, появляются к началу и середине XVIII в., когда М.В.Ломоносов разрабатывает корпускулярную теорию теплоты (1744) и формулирует закон сохранения вещества и движения (1748). В 1770 Дж.Блэк и Ирвин открывают теплоёмкость тел; в 1770 - 80-е гг. А.Л.Лавуазье и П.Лаплас проводят калориметрические исследования; в 1777 г. К.В.Шееле проводит первые наблюдения теплового излучения. В 1807 г. Т.Юнг вводит понятие “энергия”. В 1824 г. опубликована основополагающая работа С.Карно "Размышление о движущей силе огня". В 1840-х гг. Г.И.Гесс проводит термохимические исследования и открывает закон, носящий его имя. В 1842 - 43 в работах Ю.Р.Майера и Дж.П.Джоуля сформулировано первое начало термодинамики. В 1862 г. Р.Э.Клаузиус впервые применяет термодинамику к химическим явлениям. Он же в 1865 г. вводит в термодинамику понятие энтропии. В результате работ Р.Э.Клаузиуса, У.Томсона (Кельвина), Дж.Максвелла, В.Ф.Нернста и других учёных было сформулировано второе начало термодинамики. К 1870 - 1900-м г.г. относятся классические работы И.Д.Ван-дер-Ваальса, А.Л.ЛеШателье, Дж.У.Гиббса, Г.Л.Ф.Гельмгольца, Л.Больцмана, Я.Вант-Гоффа, в которых сформулирован основной круг вопросов, входящих в химическую термодинамику, выведены основные уравнения и предложены многие правила и законы. В ХХ в. после работ Дж.У.Гиббса, К.Каратеодори, П.Дебая, М.Планка, А.Эйнштейна, М.Борна развивается статистическая и релятивистская термодинамика; ведутся работы по термодинамике открытых систем и необратимых процессов (И.Р.Пригожин и др.) 1.2. Основные понятия и величины Неотъемлемым свойством материи является движение. Общая количественная мера движения и взаимодействия всех видов материи энергия Е (от греч. - действие, деятельность). Одним из фундаментальных законов природы является закон сохранения энергии: Энергия не возникает из ничего и не исчезает, она может только переходить из одной формы в другую в эквивалентных количествах. В 22 соответствии с различными видами движения материи рассматривают разные виды энергии (механическая, электромагнитная, химическая и т. п.). Размерность энергии в системе СИ - Дж (джоуль). Термодинамическая система конкретный - объект термодинамического исследования, мысленно обособляемый от окружающей среды. Это совокупность макроскопических тел, которые могут взаимодействовать друг с другом и с внешней средой - обмениваться с ними энергией и веществом. Термодинамическая система состоит из столь большого числа структурных частиц, что её состояние можно характеризовать макроскопическими параметрами: плотностью, давлением, концентрацией веществ, температурой и др. Термодинамические системы (или, для краткости, просто системы) могут быть классифицированы по различным признакам: по состоянию: равновесные и неравновесные; по взаимодействию с окружающей средой (или с другими системами): открытые (могут обмениваться со средой и энергией, и веществом), закрытые (могут обмениваться только энергией) и изолированные (не могут обмениваться ни веществом, ни энергией); по числу фаз: однофазные (гомогенные, однородные) и многофазные (гетерогенные, неоднородные); по числу компонентов (химических веществ, входящих в их состав): однокомпонентные и многокомпонентные. Внутренняя энергия рассматриваемой системы U - сумма всех видов энергии движения и взаимодействия частиц (молекул, атомов, ионов, радикалов и др.), складывающих систему - кинетической энергии хаотического движения молекул относительно центра масс системы и потенциальной энергии Составляющие внутренней взаимодействия энергии - молекул друг поступательная с другом. Uпост (энергия 23 поступательного движения частиц, например молекул газов и жидкостей), вращательная Uвр (энергия вращательного движения частиц, например, вращения молекул газов и жидкостей, атомов вокруг химических -связей), колебательная Uкол (энергия внутримолекулярного колебательного движения атомов и энергия колебательного движения частиц, находящихся в узлах кристаллической решётки), электронная Uэл (энергия движения электронов в атомах и молекулах), ядерная энергия Uя и др. В понятие внутренней энергии не входят кинетическая и потенциальная энергия системы в целом. Размерность СИ внутренней энергии Дж/моль или Дж/кг. Абсолютное значение внутренней энергии не может быть вычислено с помощью уравнений термодинамики. Можно лишь измерить её изменение в том или ином процессе. Однако для термодинамического рассмотрения это оказывается достаточным. Состояние системы - совокупность физических и химических свойств, характеризующих данную систему. Оно описывается параметрами состояния - температурой Т, давлением р, объёмом V, концентрацией С и др. Каждому состоянию системы кроме определённого значения параметров отвечает также определённое значение некоторых величин, зависящих от параметров и называемых термодинамическими функциями. Если изменение термодинамической функции не зависит от пути процесса, а определяется только начальным и конечным состоянием, такая функция называется функцией состояния. Например, внутренняя энергия является функцией состояния, поскольку её изменение в каком-либо процессе может быть вычислено как разность между конечным и начальным значениями: U = U2 U1 . К функциям состояния относятся характеристические функции, совокупность которых может достаточно полно охарактеризовать состояние системы (внутренняя энергия, энтальпия, энтропия, энергия Гиббса и т. п.). 24 Термодинамический процесс - это любое изменение в системе, сопровождающееся изменением параметров. Движущей силой процессов являются факторы - неравномерность значения тех или иных параметров (например, температурный фактор, обусловленный различными значениями температуры в разных частях системы). Процесс, идущий при постоянном давлении, называется изобарным, при постоянном объёме - изохорным, при постоянной температуре - изотермическим, при постоянном количестве теплоты - адиабатическим. Теплообмен - самопроизвольный необратимый переход энергии в форме теплоты от тела с большей температурой к телу с меньшей температурой при их непосредственном контакте. Движущая сила теплообмена - разность температур тел, участвующих в теплообмене. Теплота - форма беспорядочного (“теплового”) движения образующих тело частиц (молекул, передаваемой при атомов и др.). теплообмене, Количественной служит мерой количество энергии, теплоты Q. Размерность СИ количества теплоты - Дж. Наряду с джоулем часто используется и внесистемная единица теплоты - калория (кал). 1 кал = 4,184 Дж. Часто вместо термина “количество теплоты” в качестве синонима употребляется выражение “теплота”. Работа - форма передачи энергии от одной системы к другой, связанная с действием против внешних сил и осуществляемая при упорядоченном, направленном перемещении системы или отдельных её составных частей. Количественной мерой энергии, передаваемой при работе, служит количество работы w. Размерность СИ работы - Дж. Вместо термина “количество работы” часто как синоним употребляется выражение “работа”. Количество работы и количество теплоты в общем случае не являются функциями состояния, так как их значение определяется видом процесса, в результате которого система изменила свое состояние. Исключениями 25 являются работа расширения и тепловой эффект химической реакции. Сам термин “термодинамика” происходит от греческих слов thermos (теплота) и dynamos (работа), так как эта наука основана на изучении баланса теплоты и работы в системах при различных процессах. Теплоёмкость С - отношение количества теплоты, поглощаемой телом при нагревании, к изменению температуры, вызываемому этим поглощением. Различают истинную и среднюю, молярную и удельную, изобарную и изохорную теплоёмкость. Истинная теплоёмкость - отношение бесконечно малого количества теплоты к бесконечно малому изменению температуры: Сист= dQ/dT средняя теплоёмкость - отношение макроскопического количества теплоты к изменению температуры в макроскопическом процессе: С= Q/T . По физическому смыслу средняя теплоёмкость представляет собой количество теплоты, необходимое для нагревания тела на 1 градус (1оС или 1К). Теплоёмкость единицы массы вещества - удельная теплоёмкость (размерность СИ - Дж/кгК). Теплоёмкость моля вещества - молярная (мольная) теплоёмкость (размерность СИ - Дж/мольК). Теплоёмкость, измеренная при постоянном объёме - изохорная теплоёмкость СV; теплоёмкость при постоянном давлении - изобарная теплоёмкость СP. Между СP и СV существует соотношение (для одного моля идеального газа): СP = СV + R где R - универсальная газовая постоянная. Температура Т - степень нагретости тела, определяемая распределением молекул и других частиц по скоростям кинетического 26 движения и степенью заселённости высших энергетических уровней молекул. В термодинамике принято использовать абсолютную температуру, отсчитываемую от абсолютного нуля, которая всегда положительна. Размерность СИ абсолютной температуры – К (кельвин), численно равный градусу шкалы Цельсия. 1.3. Нулевое начало термодинамики Состояние термодинамического равновесия - состояние системы, не изменяющееся во времени и не сопровождающееся переносом через систему вещества или энергии. Такое состояние характеризуется, прежде всего, равенством температуры всех частей системы. Существование одинаковой температуры для всех частей системы, находящейся в равновесии, иногда называют нулевым началом термодинамики. Оно может быть сформулировано и так: Все части системы, находящейся в термодинамическом равновесии, имеют одну и ту же температуру. В соответствии с этим законом для характеристики состояния равновесия нескольких систем можно дать следующий постулат: если система А находится в термодинамическом равновесии с системой В и с системой С, то системы В и С тоже находятся в равновесии друг с другом. 1.4. Первое начало термодинамики Впервые данный принцип был сформулирован Ю.Р.Майером в 1842 г., а в 1845 г. он был экспериментально проверен Дж.П.Джоулем путём установления эквивалентности теплоты и работы. Первое начало (как и другие законы термодинамики) является постулатом. Его справедливость доказывается тем, что ни одно из следствий, к которым оно приводит, не 27 находится в противоречии с опытом. Этот принцип является универсальным законом, и ряд его следствий имеет большое значение для физической химии и для решения различных производственных задач. В химии первое начало термодинамики рассматривается как закон сохранения энергии для химических процессов, сопровождающихся тепловыми явлениями. Оно лежит в основе большинства уравнений химической термодинамики. Этому закону соответствует математическое выражение U = Q w, которое может быть передано такой формулировкой: 1. В любом процессе изменение внутренней энергии U = U2 U1 какойлибо системы равно количеству сообщённой системе теплоты Q минус количество работы w, совершённой системой. (Символ означает разность между конечным и исходным значениями функций состояния, изменение которых не зависит от пути процесса, и, следовательно, он неприменим к теплоте и работе). Для бесконечно малых изменений математическое выражение первого начала следует записать так: dU = Q w (где d - знак дифференциала, - знак бесконечно малого изменения величины). Существуют и другие формулировки 1-го начала термодинамики, которым соответствуют свои способы записи математического выражения. Для химии из них наиболее важны следующие: 2. В любой изолированной системе общий запас энергии сохраняется постоянным. Т.е. при Q = 0 и w = 0 U = const и U = 0 3. Если система не совершает работы, то любое изменение внутренней энергии осуществляется только за счёт поглощения или выделения 28 теплоты. Т.е. при w = 0 U = Q Отсюда следует, что тепловой эффект процесса QV, измеренный при постоянном объёме (например, в герметично закрытом калориметрическом сосуде, не поддающемся расширению), численно равен изменению внутренней энергии: QV = U. 4. Если система не получает и не отдаёт теплоты, то совершаемая ею работа производится только за счёт убыли внутренней энергии. Т.е. при Q = 0 U = - w или w = U Отсюда следует, что невозможно создать вечный двигатель 1-го рода, то есть механизм, бесконечно долго производящий работу без притока энергии извне. 1.5. Энтальпия Большинство химических процессов, как в природе, так и в лаборатории, и в промышленности протекает не при постоянном объёме, а при постоянном давлении. При этом часто из различных видов работы совершается только один - работа расширения, равная произведению давления на изменение объёма системы: w = рV. В таком случае уравнение первого начала термодинамики можно записать в виде U = Qр рV 29 или Qр = U + рV (индекс Р показывает, что количество теплоты измеряется при постоянном давлении). Заменяя изменения величин на соответствующие разности, получаем: Qp = U2 U1 + p (V2 V1) откуда Qp = (U2 + pV2) (U1 + pV1) или Qp = (U + pV) 2 (U + pV) 1 = H2 H1 Так как p и V - параметры состояния, а U - функция состояния, то сумма U + рV = Н тоже является функцией состояния. Эта функция называется энтáльпией. Таким образом, теплота, поглощаемая или выделяемая системой в процессе, идущем при постоянном давлении, равна изменению энтальпии: Qp = H. Между изменением энтальпии и изменением внутренней энергии системы существует взаимосвязь, выражаемая уравнениями Н = U + nRT или U = Н nRT, которые можно получить с использованием уравнения Менделеева Клапейрона pV = nRT , откуда pV = nRT. Величины Н различных процессов относительно легко измеряются с помощью калориметрических установок, работающих при постоянном давлении. Вследствие этого изменение энтальпии находит широкое 30 применение при термодинамических и термохимических исследованиях. Размерность СИ энтальпии - Дж/моль. Следует помнить, что абсолютное значение энтальпии, как и внутренней энергии, не может быть вычислено с помощью уравнений термодинамики. Но для химической термодинамики и для термохимии необходимы главным образом изменения энтальпии в каких-либо процессах. 31 ГЛАВА 2 ТЕРМОХИМИЯ 2.1. Термохимия, её задачи и значение Термохимия - раздел химической термодинамики, занимающийся определением тепловых эффектов химических реакций и установлением их зависимости от различных условий. В задачу термохимии входит также измерение теплоёмкостей веществ и теплот фазовых переходов (в том числе процессов образования и разбавления растворов). Данные термохимии используются в теоретической химии и применяются на практике для расчётов эффективности химической аппаратуры (лабораторных и заводских установок), оптимальных режимов процессов (в том числе синтеза лекарственных веществ); при изучении биохимических и биофизических процессов. 2.2. Краткий исторический очерк Еще М.В.Ломоносов в своей программе физико-химических исследований придавал большое значение изучению характера теплового эффекта, которым сопровождается процесс растворения. Существенный вклад в разработку калориметрии внес Г.В.Рихман. На основе его работ в дальнейшем были даны определения важнейших физических величин - единицы количества теплоты (калории) и теплоёмкости вещества. Первый калориметр изобрел Дж.Блэк. С его помощью он в 1759 - 63 г.г. провел первые измерения теплоёмкости веществ и теплот испарения и плавления. Он же впервые указал на разницу между количеством теплоты и температурой. На основе работ Дж.Блэка и других исследователей А.Л.Лавуазье и П.Лаплас сконструировали ледяной калориметр, с помощью которого в 1782 - 83 гг. измерили удельную теплоёмкость многих жидких и твёрдых тел, а также теплоту растворения серной кислоты, теплоты горения угля и серы. Для последующего развития термохимии 32 исключительное значение имело их заключение о том, что теплота химической реакции величина, характерная для образования каждого данного соединения. Из исследователей, работавших после А.Лавуазье и П.Лапласа, следует отметить П.Дюлонга и А.Пти, открывших в 1818 г. закон теплоёмкости твёрдых тел; С.Депре (1824) и в особенности Х.П.Ю.Ю.Томсена и П.Э.М.Бертло, в 1867 г. сформулировавших правило, согласно которому всякий простой или сложный химический процесс сопровождается тепловым эффектом и в системе взаимодействующих веществ наиболее вероятен тот процесс, который протекает с наибольшим выделением теплоты («принцип Бертло – Томсена»). Хотя впоследствии выяснилось, что этот принцип неверен, он оказал большое влияние на развитие термохимии и термодинамики. Как самостоятельная наука термохимия выделилась после работ петербургского академика Г.И.Гесса, с 1830 по 1850 г. проведшего ряд разнообразных, но построенных по единой продуманной системе калориметрических исследований, обогативших науку важнейшими выводами и закономерностями, и открывшего основной закон термохимии закон Гесса. В дальнейшем большой вклад в развитие термохимии внесли Р.Бунзен, В.Ф.Лугинин, вместе с П.Э.М.Бертло сконструировавший калориметрическую бомбу, и создавший в 1891 г. первую в России термохимическую лабораторию при Московском университете и др. В 1858 - 59 гг. Г.Р.Кирхгофф открывает основные законы теплового излучения и зависимости теплоты процесса от температуры. 2.3. Калориметрические измерения Основным экспериментальным методом термохимии является калориметрия. Количество теплоты, выделяемой или поглощаемой в химической реакции, измеряется с помощью прибора, называемого калориметром (термин предложен А.Л.Лавуазье и П.Лапласом в 1780). Конструкции калориметров разнообразны продолжительностью изучаемого процесса, и определяются областью температур, характером при и которых производятся измерения, количеством измеряемой теплоты и требуемой точностью. Современные калориметры работают в диапазоне температур от 0,1 до 3500 К и позволяют измерять количество теплоты с точностью до 102%. Существуют калориметры, работающие при постоянном давлении или при постоянном объёме (“калориметрические бомбы”). Наиболее точные результаты дают калориметры с 33 адиабатической оболочкой, препятствующие теплообмену между калориметрическим сосудом и окружающей средой. Калориметрические измерения позволяют рассчитывать чрезвычайно важные величины - тепловые эффекты химических реакций, теплоты растворения, энергии химических связей. Значения энергий связи обусловливают реакционную способность химических соединений, а в ряде случаев и фармакологическую активность лекарственных веществ. Однако калориметрическим измерениям поддаются не все химические реакции и физико-химические процессы, а только те, которые удовлетворяют двум условиям: 1) процесс должен быть необратимым и 2) процесс должен протекать достаточно быстро, чтобы выделяющаяся теплота не успевала рассеяться в окружающей среде. 2.4. Тепловой эффект химической реакции Тепловой эффект реакции - это количество теплоты, выделенной или поглощённой термодинамической системой при протекании в ней химической реакции при условии, что данная система не совершает никакой работы, кроме работы расширения, а температура продуктов реакции равна температуре исходных веществ. Процессы, при которых теплота выделяется системой, называются экзотермическими; процессы, при которых теплота системой поглощается эндотермическими. Количеству теплоты, выделяемому системой в экзотермическом процессе, придают знак " ", а поглощаемому системой - " + ". Тепловой эффект химической реакции, измеренный при постоянном объёме, обозначается Ur, при постоянном давлении - Нr. Тепловым эффектам фазовых переходов (плавления, кипения, возгонки, полиморфных переходов), а также растворения приписываются соответствующие индексы. Одной из основных задач физической химии является выяснение движущей силы химических процессов, т. е. причины, заставляющей вещества вступать друг с другом в химическое взаимодействие (проявлять химическое сродство). В начальный период развития химии принималось, 34 что главной причиной химического сродства является выделение теплоты в ходе химической реакции (принцип Бертло – Томсена). И хотя впоследствии оказалось, что экзотермический тепловой эффект не является единственной движущей силой процесса, всё же так называемый энтальпийный фактор, связанный с ним, играет большую роль в инициировании реакции и в её направлении. 2.4.1. Соотношение между тепловыми эффектами реакций при постоянном объёме и при постоянном давлении Ранее мы уже выяснили, что тепловой эффект процесса при постоянном объёме равен Qv = U , а при постоянном давлении Qp = Н = U + w . Значит, можно принять, что Qp = Qv + w . Если в системе не совершается никакой работы, кроме работы расширения, то: Qp = Qv + pV = Qv + p(V2 V1) . Согласно уравнению Менделеева - Клапейрона pV = RTn и, значит, Qp = Qv + RTn где n – изменение числа молей газообразных веществ, участвующих в реакции, которое рассчитывается как разность стехиометрических коэффициентов в её уравнении: n = ni прод ni исх Таким образом, соотношение между теплотами процесса, протекающего при V = сonst и при р = const, зависит от изменения числа молей газообразных веществ в ходе реакции. Если реакция идет с 35 увеличением числа молей, т. е. n 0, то и Qp Qv и наоборот. В том случае, когда n = 0, тепловые эффекты Qp и Qv равны друг другу. (При вычислении n учитываются стехиометрические коэффициенты только газообразных веществ, так как изменение давления заметным образом влияет на систему только в том случае, когда в ней имеется газовая фаза,). 2.4.2. Тепловые эффекты, используемые при термохимических измерениях и вычислениях Поскольку для термохимических измерений пригодны только те процессы, которые протекают достаточно быстро и необратимо, наибольшее значение для термохимии имеют следующие тепловые эффекты, удовлетворяющие этим условиям: теплоты сгорания, теплоты образования и теплоты растворения. Теплотой сгорания Hс (от combustion - сгорание) называется тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов соответствующих элементов. Размерность СИ теплоты сгорания - Дж/моль. Для органических соединений вообще и, в частности, для лекарственных веществ органической природы теплотой сгорания называется тепловой эффект реакции полного сгорания данного соединения до углекислого газа, воды и других соответствующих продуктов. Причём, в соответствии с определением теплового эффекта (см. п. 2.4) продуктом сгорания должна считаться жидкая вода, а не её пар. Если в соединение входят атомы галогенов, например, Cl, и азота, то этими продуктами являются соответственно Cl2 и N2. Теплоты сгорания высших оксидов элементов, а также кислорода равны нулю. Значение теплот сгорания для медицины и биологии можно показать на примере глюкозы: C6H12O6 + 6O2 = 6CO2 + 6H2O + Hr 36 Экспериментально определённое значение теплоты сгорания глюкозы равно Hr = Hс = 2808 кДж/моль. Такое большое количество энергии объясняет высокую клеточную активность глюкозы при аэробном дыхании. При анаэробной ферментации основной реакцией является гликолиз, при котором глюкоза разрушается до молочной кислоты. Теплота сгорания молочной кислоты равна 321,21 кДж/моль. Таким образом, при анаэробном потреблении глюкозы выделяется только 2166 кДж/моль, что говорит о более высокой интенсивности аэробного обмена по сравнению с гликолизом и о его биологической прогрессивности. Теплота образования Hf (от formation - образование) - это тепловой эффект реакции образования данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию соответствующих элементов при данных температуре и давлении. Размерность СИ теплоты образования Дж/моль. Теплоты образования простых веществ в виде наиболее термодинамически устойчивых аллотропных модификаций (за исключением фосфора), равны нулю. Теплоты образования многих соединений, а также атомов и ионов определены с большой точностью. Однако измерения их связаны с трудностями как калориметрических измерений, так и получения чистых веществ. Так как теплоты сгорания и теплоты образования измеряются, как правило, при постоянном давлении, их значения равны соответствующим изменениям энтальпии. Поэтому в литературе часто можно встретить выражения "энтальпия сгорания" и "энтальпия образования". 2.5. Стандартные состояния. Стандартные условия Чтобы облегчить табулирование данных и расчёты по ним, приняты определённые стандартные состояния и стандартные условия, для которых и приводятся справочные значения. За стандартные состояния принимаются: для газов - идеальный газ при давлении 1 атм, для твёрдых веществ - характерное кристаллическое 37 состояние при 1 атм, а для простых веществ - наиболее устойчивая аллотропная модификация (например, графит для углерода, ромбическая сера - для серы). Стандартное состояние растворённого вещества выбирается применительно к решаемым задачам. Часто удобно за стандартное принять состояние предельно разбавленного раствора, при котором коэффициент активност данного вещества в растворе равен единице. Стандартные условия, как правило, включают в себя только нормальное атмосферное давление - 1 атм = 101325 Па. Температура, строго говоря, не входит в число стандартных условий, но для удобства справочные данные приводят к так называемой “выбранной” температуре 298 К (25оС). То, что термохимическая или термодинамическая величина приведена для стандартного состояния, отмечается знаком « о »: Hоf ; Hoс ; Uо и т. д. Со стандартными условиями не следует путать нормальные условия (р = 1 атм и Т = 0 оС.= 273 К). 2.6. Термохимические уравнения В термохимии принят свой способ записи уравнений химических реакций, сопровождающихся тепловыми эффектами. Термохимические уравнения реакций отличаются от обычных химических уравнений следующим: в них обязательно указываются тепловой эффект и агрегатное состояние всех веществ, участвующих в реакции. (При необходимости указывается аллотропная модификация или кристаллографическое строение). Кроме того, допускается использование дробных стехиометрических коэффициентов, которые указывают не число молекул, а число молей веществ, взаимодействующих с одним молем интересующего нас в данный момент вещества. Например, термохимическое уравнение для реакции сгорания графита до угарного газа записывается так: 38 С(графит) + 1/2 О2 (г) = CO (г) + Hr ; Hr = 110, 54 кДж/моль 2.7. Закон Гесса В 1840-х г.г. Г.И.Гесс сформулировал фундаментальный закон термохимии, названный им "законом постоянства сумм тепла": Когда образуется какое-либо химическое соединение, то при этом всегда выделяется одно и то же количество тепла независимо от того, происходит ли образование этого соединения непосредственно или же косвенным путём и в несколько приёмов. В современных трактовках закон звучит так: 1. Если из данных исходных веществ можно получить заданные конечные продукты разными путями, то суммарная теплота процесса на одном каком-либо пути равна суммарной теплоте процесса на любом другом пути. 2. Тепловой эффект химической реакции не зависит от пути процесса, а зависит только от вида и свойств исходных веществ и продуктов. 3. Тепловой эффект ряда последовательных реакций равен тепловому эффекту любого другого ряда реакций с теми же исходными веществами и конечными продуктами. Например, водный раствор хлорида аммония (NH4Claq) может быть получен из газообразных аммиака и хлороводорода и жидкой воды (aq) следующими двумя путями: I. 1) NH3(г) + aq = NH3aq + H1 (H1 = 34,936 кДж/моль); 2) HCl(г) + aq = HClaq + H2 (H2 = 72,457 кДж/моль); 3) NH3aq + HClaq = NH4Claq + H3 (H3 = 51,338 кДж/моль); H = H1 + H2 + H3 = 34,936 72,457 51,338 = = 158, 749 кДж/моль II. 1) NH3(г) + HCl(г) = NH4Cl(т) + H4 (H4 = 175,100 кДж/моль); 2) NH4Cl(т) + aq = NH4Claq + H5 (H5 = + 16,393 кДж/моль); H = H4 + H5 = 175,100 + 16,393 = 158,707 кДж/моль. 39 Как видно, тепловой эффект процесса, проведённого по пути I, равен тепловому эффекту процесса, проведённого но пути II (разность в 0,42 кДж/моль, составляющая 0,026 % от абсолютного значения, вполне укладывается в погрешность эксперимента). Еще один пример. Сгорание графита до СО2 можно осуществить двумя путями: I. С(т) + О2 (г) = СО2 (г) + Н1 (Н1 = 393,505 кДж/моль); II. C(T) + 1/2 O2 (г) = CO(г) + H2 (H2 = 110,541 кДж/моль); CO(г) + 1/2 O2 (г) = СО2 (г) + Н3 (Н3 = 282,964 кДж/моль); И в этом случае H = H2 + H3 = 110,541 + (282,964) = 393,505 кДж/моль. Это равенство тепловых эффектов можно наглядно изобразить диаграммой уровней энтальпии: С + О2 110,53 кДж/моль СО +1/2 О2 393,51 кДж/моль 282,98 кДж/моль СО2 Рис. 2.1. Диаграмма уровней энтальпии для реакции взаимодействия С с О2. Так как измеряя тепловые эффекты реакций при постоянном давлении мы, по существу, измеряем изменение энтальпии в ходе реакции, а энтальпия 40 является функцией состояния, то, следовательно, закон Гесса утверждает что тепловой эффект реакции является функцией состояния. Благодаря этому закон Гесса позволяет вычислять тепловые эффекты многих реакций с помощью относительно небольшого количества справочных данных по теплотам сгорания и образования химических веществ, а кроме того - рассчитывать тепловые эффекты и таких реакций, которые вообще не поддаются прямому калориметрированию, например, С(т) + 1/2 O2 (г) = СО(г)). Это достигается применением следствий закона Гесса. 1 следствие (закон Лавуазье Лапласа): Тепловой эффект разложения сложного вещества на более простые численно равен, но противоположен по знаку тепловому эффекту образования данного сложного вещества из данных более простых. Например, теплота разложения карбоната кальция (кальцита) на оксид кальция и углекислый газ CaСО3 (T) = СO2 (г) + CaO(т) + Н1 равна + 178,23 кДж/моль. Значит для образования одного моля СаСО3 из СаО и СО2 выделится то же количество энергии: CaO (T) + CО2 (T) = CaСО3 (T) + H2 (H2 = 178,23 кДж/моль). 2 следствие: Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разность между их тепловыми эффектами равна тепловому эффекту реакции перехода от одного начального состояния к другому начальному. Например, если известны тепловые эффекты реакций сгорания алмаза и графита: С(гр) + О2 = CO2 393,51 кДж/моль С(алм) + О2 = CO2 395,39 кДж/моль можно вычислить тепловой эффект перехода из одного аллотропного видоизменения в другое: С(гр) С(алм) + Hаллотропн Hаллотропн = 393,51 (395,39 ) = +1,88 кДж/моль 3 следствие: Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разность между 41 их тепловыми эффектами равна тепловому эффекту реакции перехода из одного конечного состояния к другому конечному. Например, пользуясь этим следствием можно рассчитать тепловой эффект реакции сгорания углерода до СО: С(гр) + О2 CO2 393,505 кДж/моль CO + 1/2 O2 CO2 282,964 кДж/моль С(гр) + 1/2 O2 CO + Hr Hr = 393,505 (282,964 ) = 110,541 кДж/моль. 4 следствие: Тепловой эффект любой химической реакции равен разности между суммами теплот образования продуктов реакции и исходных веществ (с учётом стехиометрических коэффициентов в уравнении реакции): Hr = (niHf i) прод (niHf i) исх Например, тепловой эффект реакции этерификации СН3СООН(ж) + С2Н5ОН(ж) = СН3СООС2Н5(ж) + Н2О(ж) + Hr равен: Hr = (Hf СН3СООС2Н5 +Hf Н2О) (Hf СН3СООН +Hf С2Н5ОН) = = (479,03 285,83) (484,09 276,98) = 3,79 кДж.. 5 следствие: Тепловой эффект любой химической реакции равен разности между суммами теплот сгорания исходных веществ и продуктов реакции (с учётом стехиометрических коэффициентов в уравнении реакции): Hr = (niHc i) исх (niHc i) прод Например, тепловой эффект реакции этерификации, приведённой в предыдущем примере, равен: Hr = (Hс СН3СООН +Hс С2Н5ОН) (Hс СН3СООС2Н5 +Hс Н2О) = = (874,58 1370,68) (2246,39 0) = 1,13 кДж. (Расхождение результатов объясняется различной точностью приводимых в справочниках термохимических данных). 2.8. Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгоффа 42 Всё вышесказанное о тепловых эффектах относилось к изотермическим условиям. Но тепловые эффекты одного и того же процесса, проведённого при разных температурах, отличаются друг от друга. В одних случаях при повышении температуры они уменьшаются по абсолютной величине, в других - увеличиваются. Зависимость теплового эффекта реакции от температуры выражается законом Г.Р.Кирхгоффа (1858): Температурный коэффициент теплового эффекта процесса равен изменению теплоёмкости системы, происходящему в результате процесса. Приведём два вывода уравнения Кирхгоффа, являющегося математическим выражением этого закона: 1. Так как энтальпия является функцией состояния, её изменение в системе при протекании любой реакции равно разности между конечным и начальным значениями: Hr = Hпрод Нисх Нr = Н2 Н1 . или Дифференцируя это выражение по температуре при постоянном давлении, получим: d(Hr) d(H2) d(Hr) ()р = ()p ()p = Cp 2 Cp 1 = Cр r dT dT dT или после разделения переменных d(Hr) = Cр r dT, где Cр r - изменение теплоёмкости системы при протекании в ней химической реакции, равное разности между теплоёмкостью продуктов и теплоёмкостью исходных веществ, взятых с соответствующими стехиометрическими коэффициентами: Cр r = (niСр i) прод (ni Ср i) исх. 43 Интегрирование этого выражения Т2 2 d(Hr) = Cр r dT 1 Т1 даёт: Н2 Н1 = Cр r(Т2 Т1), откуда получаем Н2 = Н1 + Cр r(Т2 Т1) , где Н1 и Н2 изменения энтальпии (тепловые эффекты реакции) при температурах Т1 и Т2 соответственно. 2. Для химической реакции, в общем виде выражаемой уравнением А В, и которая может быть проведена при температуре Т1 с тепловым эффектом Н1 или при температуре Т2 с тепловым эффектом Н2, можно составить диаграмму уровней энтальпии (рис. 2.2): Рис. 2.2. Диаграмма Н2 уровней энтальпии (к выводу Кирхгоффа с использованием закона Гесса) Т2 уравнения А В Т2 Т2 В соответствии с законом Гесса тепловой эффект этой реакции при Т2 Ср А dT Ср В dT равен сумме тепловых эффектов на таком пути: охлаждение исходного Т2 Т1 Т1 44 А В Н1 вещества А от Т2 до Т1; проведение реакции при Т1; нагревание продукта В от Т1 до Т2: Т1 Т2 Н2 = Ср А dT + Н1 + Ср В dT. Т2 Т1 Т1 Т2 Ср А dT на равный ему Ср А dT, получаем Заменяя интеграл Т2 Т1 Т2 Т2 Н2 = Н1 + Ср А dT Ср В dT. Т1 Т1 или Т2 Н2 = Н1 + Ср dT Т1 где Ср r - изменение теплоёмкости системы в ходе химической реакции. Считая, что в небольшом интервале температур теплоёмкость исходных веществ и продуктов реакции остаётся практически постоянной, можно вынести Ср r из-под знака интеграла: Т2 Н2 = Н1 + Ср dT Т1 После интегрирования получаем уравнение Кирхгоффа: Н2 = Н1 + Cр r(Т2 Т1) . В таком виде уравнение Кирхгоффа можно использовать в относительно малом (несколько десятков градусов) интервале температуры. Если же требуется рассчитать тепловой эффект процесса в более широком интервале температуры, то при выводе уравнения следует учитывать зависимость теплоёмкости от температуры, выражаемую уравнениями: Для органических веществ: Ср = а + bТ + сТ2 , Для неорганических веществ: Ср = а + bТ + с`Т2 , 45 где a, b, c и c` - коэффициенты уравнения зависимости теплоёмкости от температуры. При этом уравнение Кирхгоффа после интегрирования приобретет такой вид: Для органических веществ: Н2 = Н1 + а(Т2 Т1) + 1/2b(Т22 Т12) + 1/3c(Т23 Т13); для неорганических веществ: Н2 = Н1 + а(Т2 Т1) + 1/2b(Т22 Т12) + с’(1/Т1 1/Т2). Если же в реакции участвуют одновременно и органические, и неорганические вещества, можно использовать объединённое уравнение: Н2 = Н1 + а(Т2 Т1) + 1/2b(Т22 Т12) + 1/3c(Т23 Т13) + + с’ (1/Т1 1/Т2). Величины a, b, c и c` вычисляются для каждой данной реакции по справочным данным аналогично расчёту Сp. При вычислениях с использованием уравнения Кирхгоффа под Н1 обычно подразумевается стандартный тепловой эффект реакции (Ноr 298) , который можно вычислить с использованием данных, взятых из таблиц термодинамических величин. Соответственно вместо Т1 в уравнение при этом подставляется 298 К. Уравнение Кирхгоффа входит в скрытом виде в уравнения зависимости от температуры и других термодинамических величин (например, изменения энергии Гиббса и константы равновесия химической реакции). 2.9. Теплота растворения Калориметрическими методами экспериментально определяется и такая важная величина, как теплота растворения. Она имеет особое значение для фармации, так как приготовление жидких лекарственных форм связано с растворением, главным образом, твёрдых (порошкообразных) лекарственных 46 веществ, а, следовательно, и с тепловым эффектом, возникающим при этом и достигающим иногда значительных величин. Теплота растворения Нрр или Нs.(от solution - раствор) - тепловой эффект растворения вещества при постоянном давлении. Различают интегральную и дифференциальную теплоту растворения. Теплота растворения 1 моля вещества с образованием т. н. бесконечно разбавленного раствора называется интегральной теплотой растворения. Интегральная теплота растворения зависит от соотношения количеств растворяемого вещества и растворителя и, следовательно, от концентрации образующегося раствора. Тепловой эффект при растворении 1 моля вещества в очень большом количестве уже имеющегося раствора этого же вещества некоторой концентрации (приводящем к бесконечно малому увеличению концентрации) называется дифференциальной теплотой растворения: d(Нрр) Нрр дифф = . dT По физическому смыслу дифференциальная теплота растворения показывает, как изменяется тепловой эффект растворения вещества с увеличением его концентрации в растворе. Размерность СИ теплоты растворения - Дж/моль. Интегральная теплота растворения кристаллических веществ (например, неорганических солей, оснований и т. п.) складывается из двух величин - энтальпии превращения кристаллической решётки вещества в ионный газ (разрушения кристаллической решетки) Нреш и энтальпии сольватации (в случае водных растворов - гидратации) молекул и образующихся из них при диссоциации ионов Нсольв (Нгидр): Нрр = Нреш + Нсольв; Нрр = Нреш + Нгидр Величины Нреш и Нсольв противоположны по знаку (сольватация и гидратация всегда сопровождаются выделением теплоты, тогда как разрушение кристаллической решётки - её поглощением). Так, растворение веществ, обладающих не очень прочной кристаллической решёткой 47 (например, гидроксидов щелочных металлов – NaOH, КОН и т. п.), сопровождается сильным разогреванием образующегося раствора, а хорошо гидратирующихся жидких веществ, не имеющих кристаллической решётки (например, серной кислоты) - ещё бóльшим разогреванием вплоть до вскипания. Напротив, растворение веществ с прочной кристаллической решёткой, таких, как, например, галогениды щелочных и щёлочноземельных металлов KCl, NaCl, CaCl2, идёт с поглощением теплоты и приводит к охлаждению. (Этот эффект используется в лабораторной практике для приготовления охлаждающих смесей). Поэтому знак суммарного теплового эффекта при растворении зависит от того, какое из его слагаемых больше по абсолютной величине. Если известна энтальпия разрушения кристаллической решетки соли, то, измеряя сольватации. теплоту растворения, С другой стороны, можно вычислять измеряя теплоту энтальпию её растворения кристаллогидрата (т. е. гидратированной соли), можно с достаточной точностью вычислить энтальпию разрушения (прочность) кристаллической решётки. Теплота растворения хлорида калия, равная +17,577 кДж/моль при концентрации 0,278 моль/л и 25оС, предложена в качестве термохимического стандарта для проверки работы калориметров. Температурная зависимость теплот растворения, как и тепловых эффектов химических реакций, подчиняется уравнению Кирхгоффа. Когда растворяемое вещество и растворитель химически подобны и при растворении не возникает осложнений, связанных с ионизацией или сольватацией, теплоту растворения можно считать приблизительно равной теплоте плавления растворяемого вещества. В основном это относится к растворению органических веществ в неполярных растворителях. 48 2.10. Теплота нейтрализации Теплотой нейтрализации Ннейтр называется тепловой эффект взаимодействия эквивалента кислоты с эквивалентом основания. Размерность СИ теплоты нейтрализации - Дж/моль. В случае разбавленных растворов сильных оснований и кислот, когда их коэффициенты активности равны или близки к единице, реакция нейтрализации независимо от природы реагирующих веществ будет выражаться одним и тем же уравнением Н+ + ОН = Н2О + Ннейтр При этом для любых сильных кислот и сильных оснований Ннейтр имеет одно и то же значение 55,81 кДж/моль при 25оС (298 К), что можно подтвердить расчётом с использованием теплот образования ионов Н+ и ОН: Нонейтр = НоН2О (НоН+ + НоОН) = = 285,83 (0 230,02) = 55,81 кДж/моль. Это обстоятельство очень важно, так как позволяет с помощью закона Гесса вычислять теплоты диссоциации малорастворимых или слабых кислот и оснований. Как правило, экспериментально измеренные теплоты нейтрализации слабых кислот сильным основанием бывают меньше, чем 55,81 кДж/моль. Разность равна количеству теплоты, затрачиваемой на полную диссоциацию молекул слабой кислоты, т. е. теплоте диссоциации кислоты. Аналогично при нейтрализации растворимого слабого основания сильной кислотой можно определить теплоту диссоциации слабого основания. При взаимодействии друг с другом слабой кислоты и слабого основания тепловой эффект будет в ещё большей степени отклоняться от значения 55,81 кДж/моль. 49 ГЛАВА 3 ВТОРОЕ И ТРЕТЬЕ НАЧАЛА ТЕРМОДИНАМИКИ 3.1. Второе начало термодинамики Первое начало термодинамики позволяет решать многие вопросы, связанные с определением тепловых эффектов, а также с балансом теплоты и работы. Однако оно не может дать ответа на вопрос, почему связанный с переходом энергии процесс протекает именно в данном направлении, а также насколько полно осуществляется превращение одного вида энергии в другой. Нет возможности определить с его помощью и реальные пределы протекания процессов, как химических, так и биологических, т. е. каковы параметры системы при установлении равновесия и как на положение равновесия влияют различные факторы. Ответы на эти вопросы даёт второе начало термодинамики. Как и первое начало, оно является постулатом. Некоторые положения, связанные со вторым началом, были высказаны еще М.В.Ломоносовым и, независимо от него, С.Карно (1824). Окончательно стало понятно, что второе начало термодинамики является одним из наиболее общих законов природы, в середине XIX в. после работ Р.Э.Клаузиуса, У.Томсона (Кельвина) и др. Как и первое начало термодинамики, второе может быть выражено несколькими различными формулировками, каждая из которых дополняет другие: 1. Теплота не может самопроизвольно передаваться от более холодного тела к более горячему. 2. Энергия различных видов стремится перейти в теплоту, а теплота стремится рассеяться. 3. Никакая совокупность процессов не может сводиться к передаче теплоты от холодного тела к горячему, тогда как передача теплоты от горячего тела к холодному может быть единственным результатом процессов (Р.Э.Клаузиус). 4. Никакая совокупность процессов не может сводиться только к превращению теплоты в работу, тогда как превращение работы в 50 теплоту может быть единственным результатом процессов (У.Томсон). 5. Невозможно построить циклически работающую машину, которая превращала бы теплоту в работу, не производя при этом никаких других изменений в окружающих телах (т. н. вечный двигатель второго рода) (В.Оствальд). Исторически сложилось так, что исследования, посвящённые второму началу термодинамики, были связаны с изучением работы тепловых машин. Поэтому иногда может сложиться впечатление, что этот закон применим только к этим механизмам. Однако уже Р.Клаузиусом было показано, что это не так и второе начало термодинамики носит всеобщий характер. Тем не менее, исходным пунктом для многих термодинамических построений являются положения и закономерности, полученные при рассмотрении баланса теплоты и работы тепловых двигателей и, в частности, цикл Карно, достаточно подробно описанный в курсах физики и общей термодинамики. Для необратимого цикла Карно можно записать: Q1 Q2 T1 T2 = = Q1 T1 где Q1 начальный запас теплоты в системе, Q2 – количество теплоты, оставшееся в системе после прохождения в ней какого-либо процесса, T1 и T2 - соответственно начальная и конечная температура системы, коэффициент полезного действия процесса. Это равенство является математическим выражением второго начала термодинамики. 51 3.1.1. Статистический характер второго начала термодинамики Первое начало термодинамики справедливо как для систем, состоящих и из большого числа частиц (макросистем), так и для систем из небольшого числа частиц (микросистем), вплоть до отдельных молекул, атомов и т. д. В отличие от него, второе начало неприложимо к системам, состоящим из малого числа частиц (например, из нескольких молекул). Это связано с тем, что в таких системах исчезает различие между теплотой и работой при перемещении частиц относительно друг друга. Кроме того, исчезает однозначность направления процесса, устанавливаемого вторым началом, и категорическое утверждение о невозможности одного из направлений процесса заменяется оценкой вероятности протекания его в том или ином направлении. В связи с этим второе начало носит статистический характер и относится исключительно к системам из очень большого числа частиц, так как только к таким системам строго применимы законы статистики. 3.2. Обратимые и необратимые процессы. Самопроизвольные и несамопроизвольные процессы Некоторые явления происходят спонтанно (самопроизвольно), другие нет. При этом во многих случаях самопроизвольность тесно связана с необратимостью процессов. Вот некоторые примеры. Горячее тело охлаждается до температуры окружающей среды, но самопроизвольно не становится горячее, чем среда. Реакция нейтрализации между сильной кислотой и щёлочью самопроизвольно приводит к образованию соли и воды, но эта соль, растворённая в воде, самопроизвольно не даст сильной кислоты и щёлочи. Сжигание алмаза приводит к горячей двуокиси углерода, но нагревание или охлаждение СО2 не приводит к образованию из неё алмаза. Все природные процессы самопроизвольны и, как правило, необратимы. Чтобы вернуть систему в первоначальное состояние после протекания в ней спонтанного процесса требуется какое-то воздействие 52 извне. Например, реакция образования молекулярного водорода из атомарного Н(г) + Н(г) = Н2 (г) протекает самопроизвольно с экзотермическим тепловым эффектом. Для того чтобы провести эту реакцию в обратном направлении и вернуть водород в исходное состояние, в систему надо ввести энергию, необходимую для разрыва связи Н—Н. Однако при проведении этого и подобных процессов неизбежно будут вызваны изменения и в каких-то других системах. В рассматриваемом примере - в электрической батарее, питающей дуговой разряд, в котором происходит диссоциация молекул Н2. Вернуть же батарею в исходное состояние можно только за счет каких-то изменений в других системах и т. д. С точки зрения термодинамики процесс называется обратимым только в том случае, если любую часть рассматриваемой системы можно вернуть к исходному состоянию, не вызывая изменений в других системах и (или) в окружающей среде. 3.3. Факторы интенсивности и экстенсивности В ходе термодинамического процесса не только величина работы, но и величина других форм энергии могут рассматриваться как произведение двух величин - фактора интенсивности (“обобщённая сила”) и фактора экстенсивности или ёмкости (“обобщенная координата”). В качестве таких факторов обычно рассматриваются разности значений каких-либо параметров системы, в свою очередь делящихся на экстенсивные (значения которых зависят от количества вещества, например, объём и масса) и интенсивные (значения которых не зависят от количества вещества, например, температура, давление, плотность, концентрация). Движущей силой процесса служит фактор интенсивности, т. е. различие значений какого-либо интенсивного параметра в разных частях системы (разность температур, перепад давлений, разность концентраций и т. п.). При этом самопроизвольный процесс может идти только в сторону усреднения интенсивного параметра. 53 3.4. Термодинамическая вероятность системы Состояние термодинамической системы, как уже говорилось ранее, характеризуется определёнными значениями плотности, давления, температуры и других величин, характеризующих систему. Эти величины определяют состояние системы в целом, то есть её макросостояние. Однако при одной и той же плотности, температуре и т. д. частицы, из которых состоит система, могут находиться в разных местах её объёма и иметь различные значения энергии или импульса. Каждое состояние системы с определённым распределением её частиц по возможным классическим или квантовым состояниям называется микросостоянием. Число микросостояний, реализующих данное макросостояние, или иначе - число способов, которыми может быть реализовано данное состояние системы называется термодинамической вероятностью W. Из определения видно, что W 1. Термодинамическая вероятность может быть равна единице только в одном случае - когда температура системы равна абсолютному нулю и в ней отсутствует тепловое движение. В обычных условиях в системах, с которыми приходится иметь дело на практике, и которые состоят из очень большого числа молекул и других частиц, W намного больше единицы. Для идеальных газов значение W может быть довольно легко рассчитано методами статистической термодинамики, но для жидкостей и твёрдых тел такой расчёт намного более сложен. Самопроизвольные процессы в системе идут в сторону увеличения её термодинамической вероятности. Поэтому величина W может рассматриваться в качестве одного из критериев возможности протекания тех или иных процессов. Однако даже тогда, когда значения W можно вычислить с достаточной точностью, использование их в практических расчётах затруднено выражаются. 54 поистине “астрономическими” числами, которыми они 3.5. Энтропия Одной из главных причин, определяющих направление спонтанного изменения, является рассеяние энергии. Чтобы выяснить, в каком направлении пойдет процесс, надо определить, в каком случае рассеяние энергии будет больше. Для этого необходимо иметь количественную меру рассеяния энергии. Такой мерой является функция, существование которой было открыто Р.Э.Клаузиусом (1865); он же дал ей название "энтропия". Понятие “энтропия” является достаточно сложным для восприятия. В рамках нашего курса мы кратко опишем статистический и термодинамический аспекты энтропии. 3.5.1. Энтропия со статистической точки зрения Рассеяние энергии среди компонентов системы может быть вычислено методами статистической термодинамики. Это приводит к статистическому определению энтропии. Согласно упомянутому ранее положению о том, что направление самопроизвольного изменения соответствует направлению увеличения термодинамической вероятности, можно заключить, что рассеяние энергии, а значит, и энтропия связаны с ней. Эту связь доказал в 1872 г. Л.Больцман. Она выражается уравнением Больцмана S = k lnW , (3.1) где k - константа Больцмана. Согласно статистической точке зрения, энтропия является мерой беспорядка в системе. Это связано с тем, что чем больше в системе участков, в которых имеется пространственное упорядочение в расположении частиц или неравномерное распределение энергии (которое тоже считается упорядочением энергии), тем меньше термодинамическая вероятность. При хаотическом перемешивании частиц, а также при равномерном 55 распределении энергии, энергетическому когда состоянию, частицы нельзя различить термодинамическая по их вероятность, а, следовательно, и энтропия, возрастают. Следует отметить ограниченность статистического подхода, так как он может быть применён к расчётам энтропии только в случае идеальных газов, когда рассеяние распределением энергии можно отождествить молекул, обладающих с пространственным приблизительно одинаковой кинетической энергией. 3.5.2. Энтропия с термодинамической точки зрения Другой путь, который развивает ту точку зрения, что рассеяние энергии может быть связано с количеством теплоты, отдаваемой или получаемой системой в результате теплообмена, приводит к термодинамическому определению энтропии. Для термодинамической системы, совершающей обратимый циклический процесс, в котором система последовательно получает малые количества теплоты Q при соответствующих значениях абсолютной температуры Т, интеграл от "приведённой теплоты" Qобр/T по всему циклу равен нулю: Qобр = 0 Это равенство T Клаузиус получил, (“равенство Клаузиуса”). рассматривая произвольный циклический процесс а b a (рис. 3.1) как сумму очень большого (в пределе - бесконечно большого) числа элементарных циклов Карно. Математически равенство Клаузиуса необходимо и достаточно для того, чтобы выражение Qобр/T в случае идеального газа представляло собой полный дифференциал некой функции состояния S: dS = Qобр/T 56 или TdS = Qобр . (3.2) Отсюда следует, что у термодинамических систем существует особый, неизвестный ранее параметр состояния или термодинамическая функция. р b а Т Рис. 3.1. Циклический процесс в изолированной системе Эта функция и представляет собой энтропию. Поскольку S является функцией состояния, её приращение в циклическом обратимом процессе S = Sb Sa не зависит от пути интегрирования. Для необратимых процессов было доказано, что интеграл приведённой теплоты по полному циклу больше нуля (“неравенство Клаузиуса”): Qнеобр 0, T откуда следует dS Qнеобр/T или TdS Qнеобр. (3.3) TdS Qнеобр. (3.4) Объединяя эти выражения, получим dS Qнеобр/T или Уравнения (3.2) (3.4) являются математическим выражением закона возрастания энтропии: В системе, не получающей энергии извне, самопроизвольные процессы всегда идут с увеличением энтропии, 57 т. е. в направлении достижения наиболее вероятного состояния системы (см. также п. 3.1). Иначе закон возрастания энтропии может быть сформулирован так: Энтропия изолированной системы возрастает в необратимом процессе и остается неизменной в обратимом процессе. Она никогда не убывает. Так как приведённая теплота в обратимом процессе равна нулю, то dS 0 . Интегрируя это выражение, получим S2 S1 0 или S2 S1 . Отсюда следует, что в изолированной (или закрытой) системе самопроизвольные необратимые процессы идут с возрастанием энтропии, а обратимые - без изменения энтропии, т. е. энтропия системы не уменьшается. Закон возрастания энтропии, в свою очередь, является одной из эквивалентных формулировок второго начала термодинамики. Размерность энтропии Дж/мольК.В литературе часто можно встретить и внесистемную размерность - энтропийную единицу (э. е.) - кал/мольК. 3.6. Расчёт изменения энтропии для различных процессов Приведём способы вычисления энтропии для различных физико-химических процессов, которые используются в химической и фармацевтической технологии. Процессы, указанные в разделах 3.6.1 - 3.6.3, относятся, скорее, к теме “Фазовое равновесие”, однако описывающие их уравнения используются и при расчётах химических равновесий, сопровождающихся изменением фазового состава систем.. 3.6.1. Изотермическое расширение идеального газа V2 Работа расширения идеального газа w = pdV с учетом уравнения Менделеева – V1 Клапейрона pV = nRT после интегрирования может быть выражена соотношением 58 V2 p1 w = nRT ln = nRT ln , V1 p2 где n - количество расширявшегося газа (моль). С другой стороны, работа расширения газа в изотермических условиях осуществляется за счёт подвода эквивалентного количества теплоты: w=Q. Объединяя эти два выражения, получаем: а так как S = Q/T, то: Q V2 p1 = nR ln = nR ln T V1 p2 V2 p1 S = nR ln = nR ln V1 p2 3.6.2. Изотермические фазовые переходы (плавление, кипение, сублимация) Для этих процессов изменение энтропии находится из общей формулы S = Q/T . Подставляя вместо Q молярную теплоту фазового перехода Нф.п. (Нпл, Нкип , Нсубл) для n молей вещества получим: Sф.п. = n Hф.п./Tф.п. Где Тф.п. - соответствующая температура фазового перехода (Tпл, Tкип, Tсубл). Если расчёт ведется не на моли, а на массовое количество (например, на килограммы), то вместо молярной теплоты фазового перехода Hф.п подставляется удельная теплота фазового перехода Lф.п (выраженная в Дж/кг), а вместо числа молей - масса вещества m в килограммах: Sф.п. = m Lф.п./Tф.п. 3.6.3. Неизотермический физический процесс (нагревание или охлаждение тела) Для вычисления изменения энтропии системы в неизотермических процессах используется теплоёмкость веществ. Так как Cp = dQ/dT , то dQ = CpdT. Значит, можно записать: 59 dS = dQ/T = Cp dT/T . После интегрирования в небольшом интервале температур (в предположении, что 2 Т2 dT dS = Cp (3.5) T 1 Т1 теплоёмкость вещества при этом практически не изменяется), получаем S = S2 S1 = Cp ln T2 /T1 . 3.6.4. Химические реакции Изменение энтропии в ходе химической реакции Sоr можно рассчитать как разность между суммами энтропий продуктов и исходных веществ, взятых с соответствующими стехиометрическими коэффициентами. Для стандартных условий: Sоr = ( ni Soi) прод (ni So I) исх (Для расчётов берутся абсолютные значения энтропии индивидуальных веществ, а не их изменения, как при вычислении других термодинамических функций. Причины этого будут объяснены при рассмотрении третьего начала термодинамики). 3.7. Третье начало термодинамики. Постулат Планка. Абсолютная энтропия Поскольку энтропия - величина экстенсивная, её значение для вещества при каждой данной температуре Т является суммой значений, соответствующих каждой температуре в интервале от 0 К до Т. Если в уравнении (3.5) принять нижнюю температуру интервала интегрирования равной абсолютному нулю, то 2 Т2 dT dS = Cp . 1 60 0 T Следовательно, зная значение энтропии при абсолютном нуле, с помощью этого уравнения можно было бы получить значение энтропии при любой температуре. Тщательные измерения, проведённые в конце XIX века, показали, что при приближении температуры к абсолютному нулю теплоёмкость любых веществ Ср стремится к нулю: lim Cp = 0 . T0 Это значит, что величина Ср/Т конечна или равна нулю и, следовательно, разность ST S0 всегда положительна или равна нулю. На основании этих рассуждений М.Планк (1912) предложил постулат: При абсолютном нуле температуры энтропия любого вещества в виде идеального кристалла равна нулю. Этот постулат Планка является одной из формулировок 3 начала термодинамики. Его можно пояснить на основе представлений статистической физики: для идеально упорядоченного кристалла при абсолютном нуле температуры, когда тепловое движение частиц отсутствует, термодинамическая вероятность W равна 1. Значит, в соответствии с уравнением Больцмана (3.1), его энтропия равна нулю: S0 = k ln 1 = 0 Из постулата Планка можно сделать вывод о том, что энтропия любого вещества при температурах, отличающихся от абсолютного нуля, является конечной и положительной. В соответствии с этим энтропия является единственной термодинамической функцией состояния, для которой можно определить абсолютное значение, а не только изменение в каком-либо процессе, как в случае других функций состояния (например, внутренней энергии и энтальпии). Из вышеприведённых уравнений следует также, что при температуре, приближающейся к абсолютному нулю, от охлаждаемого тела становится невозможным отнять какие-либо, даже очень малые, количества теплоты изза бесконечно малой теплоёмкости. Иными словами, 61 с помощью конечного числа операций невозможно понизить температуру тела до абсолютного нуля. Это выражение носит название принципа недостижимости абсолютного нуля температуры и наряду с постулатом Планка является одной из формулировок третьего начала термодинамики. (Отметим, что в настоящее время в эксперименте удалось понизить температуру до 0,00001 К). Принцип недостижимости абсолютного нуля температуры связан и с тепловой теоремой В.Нернста (1906), согласно которой при приближении к абсолютному нулю величины Н и G = Н + ТS (G - энергия Гиббса, о которой будет говориться ниже) сближаются, то есть при Т = 0 должно иметь место равенство G = Н. 3.8. Энергия Гельмгольца. Энергия Гиббса. Критерий достижения химического равновесия Любая система (например, сосуд с реакционной смесью), находясь в контакте с источником теплоты, в результате теплообмена будет принимать какое-то количество теплоты. В случае бесконечно малого необратимого процесса это количество теплоты будет равно Q. Увеличение энтропии dS при этом будет больше, чем приведённая теплота: dS Q/T , откуда получаем TdS Q и, следовательно, Q TdS 0 . Если при этом из всех видов работы совершается только работа расширения, то в соответствии с первым началом термодинамики Q > dU + pdV. Значит, dU + pdV TdS 0 62 (3.6) Если при протекании данного процесса не происходит изменения температуры и объём сохраняется постоянным (V = const, Т = const), это выражение переходит в неравенство (dU TdS)V 0 d(U TS)T, V 0 . или Величина U ТS = А называется изохорно-изотермическим потенциалом или свободной энергией при постоянном объёме или энергией Гельмгольца. Часто её называют также и функцией Гельмгольца. Если же процесс проводится при постоянных давлении и температуре (р = const, Т = const), то неравенство (3.6) можно переписать так: d(U + pV TS)T, p 0 или, поскольку U + pV = H, d(H TS)T, p 0 Величина Н ТS = G называется изобарно-изотермическим потенциалом, или свободной энергией при постоянном давлении, или энергией Гиббса (функцией Гиббса). Размерность СИ энергии Гиббса и энергии Гельмгольца - Дж/моль. Таким образом, в необратимых процессах при постоянной температуре энергия Гиббса системы, как и энергия Гельмгольца убывает: (dG)T, p 0 , (dА)T, V 0 . Если же рассматриваемый процесс является обратимым, то в вышеприведённых уравнениях знаки неравенства меняются на знаки равенства: (dG)T, p = 0 , (dА)T,V = 0 . Энергия Гельмгольца термодинамическими функциями и энергия состояния, Гиббса, иначе являются называемыми термодинамическими потенциалами, так как они характеризуют работу, совершаемую системой, учитывая при этом одновременно изменение 63 энтропии (в виде величины TS) и тепловой энергии (U или Н соответственно). Согласно полученным уравнениям энергия Гельмгольца (в изохорных условиях) и энергия Гиббса (в изобарных условиях) являются критерием направления самопроизвольного процесса, а также критерием достижения равновесия. А именно: 1) в самопроизвольном процессе энергия Гиббса G и энергия Гельмгольца А системы уменьшаются. Иными словами, процесс возможен, если для него соблюдается условие G 0 и А 0 . (В случае химических реакций принято считать, что процесс термодинамически возможен, если G 40 кДж/моль, так как эта величина представляет собой минимальную энергию образования химической связи). 2) При равновесии в системе её G и А достигают какого-то минимального значения и дальнейшего уменьшения их не происходит: G = min и А = min, G = 0 и А = 0 . Резюмируя, можно вывести уравнения, характеризующие взаимосвязь энергии Гельмгольца и энергии Гиббса с другими термодинамическими функциями: dА = dU ТdS (3.7) dG = dН ТdS (3.8) После интегрирования уравнений (3.7) и (3.8) получаются выражения, более удобные при практических расчётах: А = U ТS G = Н ТS, или для процессов, идущих при стандартных условиях: Ао = Uо ТSо Gо = Но ТSо. 64 (3.9) Отрицательное значение Gо может быть получено в случае отрицательного значения Но или положительного значения Sо, что означает уменьшение энергии и увеличение неупорядоченности. Если значение TSо по абсолютной величине намного меньше, чем Но, знак Gо будет определяться знаком Но (и наоборот). В любом случае самопроизвольный процесс приводит к минимально возможному значению H TS для системы при постоянных температуре и давлении. Стандартное изменение энергии Гиббса системы в ходе химической реакции Gоr может быть рассчитано с использованием справочных значений Gоf (относящихся к образованию 1 моля данного соединения из простых веществ) по уравнениям: Gоr = (niGоf i) прод (ni Gоf i) исх или, с учётом уравнения (3.9), по стандартным изменениям энтальпии и энтропии в ходе реакции Hоr и TSоr: Gоr = Hоr TSоr Стандартное изменение энергии Гельмгольца системы (3.10) в ходе химической реакции Аоr требуется реже и, как правило, вычисляется по уравнению, устанавливающему взаимосвязь Ао и Gо: Ао = Gо nRT, где n - изменение числа молей газообразных веществ при протекании реакции. 3.9. Свободная и связанная энергия Уравнение (3.9) может быть написано следующим образом: H = G + TS, или, для внутренней энергии и энергии Гельмгольца U = А + TS . 65 Такая форма записи показывает, что тепловой эффект процесса при постоянном давлении H или при постоянном объёме U складывается из двух составляющих. При взаимодействии рассматриваемой системы с другой системой часть энергии, обозначаемая G или А, может быть преобразована в работу. Этой части энергии системы Г.Гельмгольц дал название "свободная энергия". Принято различать свободную энергию при постоянном объёме (А) и свободную энергию при постоянном давлении или свободную энтальпию (G). Другая часть энергии, обозначаемая ТS, не может быть переведена в работу и в ходе процесса рассеивается в окружающей среде в виде теплоты. Эта часть энергии получила название "связанная энергия". 3.10. Максимальная работа процесса и химическое сродство Величина энергии Гиббса и, соответственно, при постоянном объёме энергии Гельмгольца характеризует максимальное количество работы, которое может быть получено при обратимом равновесном процессе. Так как в других процессах рассеяние энергии будет намного бóльшим, то работу, получаемую от системы в обратимом равновесном изохорном процессе, называют максимальной работой: wmax = А При постоянном давлении часть работы будет расходоваться на расширение или сжатие системы (рV), поэтому в изобарных условиях та же система сможет произвести полезной работы меньше, чем wmax на величину рV. Работа, которая может быть совершена системой в обратимом равновесном изобарном процессе, называется максимальной полезной работой: w’max = wmax pV 66 Поскольку между энергией Гиббса и энергией Гельмгольца существует соотношение G = А + pV, можно записать w’max = G. Максимальная и, в особенности, максимальная полезная работа химического процесса может служить мерой способности веществ вступать между собой в химическую реакцию, т. е. мерой химического сродства. В биохимии существует понятие о "макроэргических" соединениях, т. е. таких, при метаболизме которых выделяется значительное количество энергии и происходит соответствующее понижение энергии Гиббса. К числу таких соединений относится АТФ (аденозинтрифосфорная кислота) первичный источник энергии для многих биологических реакций, - от биосинтеза белка и ионного транспорта до сокращения мышц и электрической активности нервных клеток. Энергия, необходимая для проведения всех этих процессов, обеспечивается гидролизом АТФ: АТФ + Н2О АДФ + Фн где Фн - неорганический фосфат. Расчёты показывают, что величина G для этой реакции равна 31 кДж/моль. Значит, при биохимическом превращении 1 моля АТФ высвобождается энергия, достаточная для производства 31 кДж полезной работы. 3.11. Уравнение максимальной работы (уравнение Гиббса Гельмгольца) При рассмотрении свойств функций А и G появляется возможность установить связь между максимальной работой процесса, протекающего равновесно, и теплотой того же процесса, но протекающего в неравновесных условиях. Согласно 1 и 2 началам термодинамики можно записать: Q = U + w 67 w dT w и = ; Q = T. Q T dT Отсюда, принимая w = wmax и помня, что А = wmax , получаем: d(А) d(А) U А T = U А или = . dT dT T Преобразуя, получим для изохорного процесса: d(А) А = U + T ()V dT или Для d(А) wmax = U T ()V dT изобарного процесса можно подобным путём получить аналогичные уравнения: d(G) H G = , dT T (3.11) d(G) w`max = H T ()p dT и d(G) G = H + T ()p dT Все эти выражения представляют собой различные формы записи уравнений Гиббса Гельмгольца, являющихся объединённым математическим выражением первого и второго начал термодинамики. Это фундаментальные уравнения, достоинство которых заключается в том, что они позволяют оценить химическое сродство веществ и определить направление процесса, не прибегая к величине энтропии. В этих уравнениях величины H и U представляют собой тепловые эффекты химических 68 реакций, протекающих необратимо, т. е. проводимых в обычных условиях (в природе или в лаборатории). Вторые слагаемые в правой части уравнений имеют смысл тепловых эффектов тех же реакций, но протекающих обратимо, т. е. в гипотетическом состоянии термодинамического равновесия. Эти тепловые эффекты могут быть вычислены на основании справочных термодинамических данных. В обычных условиях наиболее близкими к термодинамически обратимым процессам являются реакции, идущие в работающих гальванических элементах. Поэтому с помощью уравнений Гиббса - Гельмгольца можно по измеренным значениям электродвижущей силы гальванических элементов, в которых осуществляется интересующая исследователя реакция, вычислять тепловые эффекты химических реакций, а также другие термодинамические величины, и в том числе изменения d(G) T ()p = TS = Qобр ; dT энтропии, так как и d(А) T ()V = TS = Qобр . dT (О взаимосвязи энергии Гиббса и электродвижущей силы гальванических элементов см. п. 10.5). Из уравнений Гиббса Гельмгольца и общего выражения G = Н ТS следует, что d(G) ()p = S. dT 69 II. Х И М И Ч Е С К О Е Р А В Н О В Е С И Е ГЛАВА 4 ТЕРМОДИНАМИКА ХИМИЧЕСКОГО РАВНОВЕСИЯ 4.1. Химическое равновесие В большинстве случаев химические реакции не протекают так глубоко, чтобы реагенты полностью превратились в продукты. Реакции идут до равновесия, при котором в системе имеются как продукты, так и непрореагировавшие исходные вещества, и не наблюдается дальнейшей тенденции к изменению их концентраций. Иногда количество продукта в равновесной смеси настолько превышает количество не вступивших в реакцию исходных веществ, что с практической точки зрения реакция завершается. Практически до конца доходят только такие реакции, при которых как минимум один из продуктов удаляется из сферы реакции (например, выпадает в осадок или выделяется из раствора в виде газа). Но во множестве важных случаев реакционная смесь при равновесии содержит значительные концентрации как продуктов, так и исходных веществ. Химическое равновесие – это термодинамическое равновесие в системе, в которой возможны прямые и обратные химические реакции. Существуют термодинамический и кинетический критерии химического равновесия. С кинетической точки зрения при химическом равновесии скорости всех реакций, идущих в двух противоположных направлениях, равны между собой, поэтому в системе не наблюдается изменения макроскопических параметров, в том числе концентраций реагирующих веществ. С термодинамической точки зрения химическое равновесие характеризуется достижением минимального и не изменяющегося во времени значения энергии Гиббса (или энергии Гельмгольца). 70 Знание основных закономерностей учения о химическом равновесии совершенно необходимо химику-технологу. В промышленности, например, на химико-фармацевтических заводах, бесполезно строить сложные установки для получения тех или иных веществ, если термодинамические расчёты показывают, что реакция имеет тенденцию идти в “неправильном” направлении. Кроме того, при определении экономичности и рентабельности производства необходимо знать, как получить максимальный выход целевого продукта. Подлинный механизм как прямой, так и обратной реакции во многих случаях сложен и часто в деталях или полностью не известен. К счастью для химиков, для того, чтобы получить правильные выводы о протекании химических процессов, нет необходимости знать настоящий механизм реакции. Предсказание направления химической реакции, а также вычисление теоретического равновесного выхода её продуктов и состава равновесной реакционной смеси в зависимости от исходного состава, температуры и давления и является главной задачей учения о химическом равновесии. 4.2. Краткий исторический очерк Обширный фактический материал, накопленный химией к концу XVIII в., был впервые обобщён французским химиком К.Л.Бертолле в новой теории сродства (1803). Согласно его учению, результат химического реакции между веществами “определяется не только энергией сродства этих веществ, но также и количеством, которым они действуют”; “процесс продолжается до тех пор, пока противоположные силы не достигнут состояния равновесия”. До Бертолле естествознание знало лишь равновесие сил в механике и “равновесие теплорода” (Дж. Блэк) в учении о теплоте. После его работ появилось представление и о равновесии при химических реакциях. В 1864 - 67 г. г. исследования равновесия “сил сродства” в обратимых реакциях увенчались первой количественной теорией химического равновесия. Норвежцы П.Вааге и К.М.Гульдберг вводят понятие “действующая масса” (масса в единице объёма) и с его помощью дают простейшую форму закона действующих масс. (Впоследствии Я.Вант- 71 Гофф заменил выражение “действующая масса” термином “концентрация”). Этот закон составил основу учения о равновесии в теоретической химии 1870 - 1880 г.г. Впервые законы термодинамики к химии приложил Р.Э.Клаузиус (1862). В 1882г. к термодинамике химических реакций обращается Г.Гельмгольц. В 1884 г. А.Л.Ле-Шателье устанавливает принцип подвижного равновесия (“принцип Ле-Шателье”). Завершение теории химического сродства - заслуга Я.Вант-Гоффа (цикл работ 1884 - 87 г.г.), предложившего уравнения изохоры и изобары реакции. В дальнейшем в развитии теории химического равновесия участвовали Дж.Гиббс, В.Оствальд, В.Нернст; из русских учёных - А.Н.Щукарев, И.А.Каблуков и др. 4.3. Константа равновесия Произвольную обратимую химическую реакцию можно описать уравнением вида: aA + bB dD + eE В соответствии с законом действующих масс в простейшем случае скорость прямой реакции связана с концентрациями исходных веществ уравнением vпр = kпр САа СВb , а скорость обратной реакции - с концентрациями продуктов уравнением vобр = kобр СDd СEe . При достижении равновесия эти скорости равны друг другу: vпр = vобр Отношение друг к другу констант скорости прямой и обратной реакций будет равно константе равновесия: kпр СDd CЕ e = Kc = , kобр СAa CBb Так как это выражение основано на учёте количества реагентов и продуктов реакции, оно является математической действующих масс для обратимых реакций. 72 записью закона Константа равновесия, выраженная через концентрации реагирующих веществ, называется концентрационной и обозначается Кс. Для более строгого рассмотрения следует вместо концентраций использовать термодинамические активности веществ а = fC (где f - коэффициент активности). При этом речь идёт о так называемой термодинамической константе равновесия аDd аЕe Ка = . аAa аBb При малых концентрациях, когда коэффициенты активности исходных веществ и продуктов близки к единице, Кс и Ка практически равны друг другу. Константа равновесия реакции, протекающей в газовой фазе, может быть выражена через парциальные давления р веществ, участвующих в реакции: рDd рЕe Кр = . рAa рBb Между Кр и Кс существует соотношение, которое можно вывести таким образом. Выразим парциальные давления веществ через их концентрации с помощью уравнения Менделеева - Клапейрона: pV = nRT , откуда p = (n/V)RT = CRT . Тогда для реакции в общем виде после замены парциальных давлений на концентрации получим рDd рЕe СDd(RT) d CЕe(RT) с СDd CЕe(RT) (d + с) Кр = = = . рAa рBb СAa(RT) а CBb(RT) b СAa CBb(RT) (а + b) Откуда СDd CЕe Кр = (RT) (d + с) - (а + b) . СAa CBb 73 Заменяя выражение (d + с) - (а + b) на равное ему n, получим окончательное выражение Кр = Кс(RT)n или Кс = Кр(RT)n , где n - изменение числа молей газообразных веществ в ходе реакции: n = ni прод (г) ni исх (г) ). Если n = 0, т. е. процесс идёт без изменения числа молей газообразных веществ, и Кр = Кс. Например, для реакции гидратации этилена, протекающей в газовой фазе: C2H4 (г) + H2O (г) C2H5OH (г), рС2Н5ОН Кр = рС2Н4 рН2О и СС2Н5ОН Кс = . СС2Н4 СН2О В данном случае n = 1 (1 + 1) = 1. Значит, соотношение между константами может быть выражено таким уравнением: Кр = Кс(RT)1 или Кс = КрRT . Таким образом, зная Кр этой реакции при каждой данной температуре, можно вычислить значение Кс и наоборот. Размерность констант равновесия зависит от способа выражения концентрации (давления) и стехиометрии реакции. Часто она может вызывать недоумение, например, в рассмотренном примере [моль1м3] для Кс и [Па1] для Кр, но в этом нет ничего неверного. При равенстве сумм стехиометрических коэффициентов продуктов константа равновесия будет безразмерной. 74 и исходных веществ 4.4. Расчёты с применением констант равновесия Константы равновесия используются главным образом для получения ответов на следующие вопросы: 1. Должна ли самопроизвольно протекать реакция при определённых условиях? 2. Какова будет концентрация продуктов (равновесный выход) после установления в системе равновесия? 4.4.1. Определение направления протекания обратимых реакций Так как константа равновесия представляет собой отношение констант скорости прямой и обратной реакций, то само её значение говорит о направлении процесса. Так, если константа равновесия больше единицы, то при данных условиях самопроизвольно будет осуществляться прямая реакция, если же она меньше единицы - обратная реакция. В соответствии с принципом Ле-Шателье (см. п. 4.5) положение равновесия может быть смещено при изменении условий, в которых протекает реакция. Поэтому в общем случае можно оценить смещение равновесия при изменении соотношения начальных количеств веществ, участвующих в реакции. Если соотношение концентраций реагирующих веществ в начальный момент обозначить : CDd CЕe = ()нач , CAa CBb то по соотношению Z и Кс можно предсказать направление реакции при заданных условиях эксперимента: при K самопроизвольно протекает прямая реакция; при K самопроизвольно протекает обратная реакция; при = K система находится в равновесии. 75 Чем больше значение константы равновесия отличается от единицы, тем в большей степени равновесие реакции сдвинуто в соответствующую сторону (вправо при К > 1 и влево при К < 1). 4.4.2. Расчёт равновесного выхода продуктов реакции Для расчёта теоретического равновесного выхода продуктов кроме величины константы равновесия необходимо знать исходные концентрации реагентов. Разберём принцип такого расчёта на конкретном примере. Пример: Рассчитать равновесный выход продуктов и состав реакционной смеси при равновесии для реакции этерификации, протекающей в газовой фазе. CH3COOH + C2H5OH CH3COOC2H5 + H2O при р = 1,013.105 Па и Т = 298 К, если исходные концентрации CH3COOH и C2H5OH равны соответственно 1 и 2 моль/л. Константа равновесия реакции Кр = Кс = 4. Решение: Составим таблицу значений числа молей всех веществ, участвующих в реакции (в 1 литре реакционной смеси): в начальный момент при равновесии CH3COOH C2H5OH CH3COOC2H5 H2O 1 моль 2 моль 0 моль 0 моль 1 х моль 2 х моль х моль х моль Так как данная реакция идёт без изменения объёма реакционной смеси, концентрации в уравнении закона действующих масс могут быть заменены числом молей соответствующих веществ. Согласно общему выражению для константы равновесия: ССН3СООС2Н5 СН2О х2 Кр = Кс = = = 4. ССН3СООН СС2Н5ОН (1 х)(2 х) Преобразуем полученное выражение в уравнение: 76 x2 = 4(1 x)(2 x); x2 = 4(2 x 2x + x2); x2 4x2 + 12x 8 = 0; 3x2 12x + 8 = 0. Решая его относительно х, получим: х1 = 3,155 моль; 12 144 438 12 6,93 х1,2 = = ; 23 6 х2 = 0,845 моль. Поскольку из 1 моль CH3COOH и 2 моль C2H5OH нельзя получить более 1 моль этилацетата, x1 отбрасывается, как не удовлетворяющий условию. Значит, теоретический равновесный выход этилацетата будет равен 0,845 моль или 84,5%. Состав реакционной смеси при равновесии будет таким: Этилацетата - 0,845 моль; Уксусной кислоты - 1 0,845 = 0,155 моль; Этилового спирта - 2 0,845 = 1,155 моль Воды - 0,845 моль. 4.5. Факторы, влияющие на равновесие. Принцип Ле-Шателье Брауна При равновесии прямая и обратная реакции точно компенсируют друг друга. Но насколько чувствительна эта компенсация к изменениям условий реакций? Каким способом можно изменить состояние равновесия? Эти вопросы имеют большое практическое значение, если требуется повысить выход полезного продукта реакции, например, лекарственного вещества, или, наоборот, уменьшить выход нежелательного продукта. Если имеется возможность непрерывно выводить продукты из реакционной смеси (раствора) в виде газа или осадка, а также с помощью таких технологических операций, как вымораживание, вымывание и пр., то тем самым реагирующая система может постоянно удерживаться в неравновесном, несбалансированном состоянии. В этих условиях возникает 77 необходимость во все новых количествах реагентов и происходит непрерывное образование продуктов. Такой способ нарушения равновесия в сторону получения желаемого продукта осуществляется без изменения константы равновесия. Но часто можно повысить выход продуктов, увеличивая константу равновесия. Один из способов увеличения константы равновесия - изменение температуры. Так как в большинстве случаев скорости прямой и обратной реакции зависят от Т, константа равновесия тоже проявляет зависимость от температуры. Строго говоря, изменение температуры одновременно изменяет скорость и прямой, и обратной реакции. Но, если повышение температуры ускоряет прямую реакцию в большей степени, чем обратную, то константа равновесия при этом увеличится. Температурная зависимость положения равновесия является одним из примеров общего принципа подвижного химического равновесия, называемого принципом Ле-Шателье (или Ле-Шателье Брауна): Если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие, положение равновесия смещается в такую сторону, чтобы противодействовать эффекту этого воздействия. Принцип Ле-Шателье относится и к другим способам воздействия на равновесие, например, к изменению давления, но он имеет качественный характер. Количественно зависимость константы равновесия реакции от различных факторов выражается уравнениями изотермы, изобары и изохоры химической реакции, выведенными Я.Вант-Гоффом. 4.5.1. Влияние на равновесие начального состава реакционной смеси. Уравнение изотермы химической реакции Максимальная работа реакции, идущей в газовой фазе при постоянных температуре и давлении, является алгебраической суммой работ, совершённых всеми участвующими в реакции веществами при переходе от начальных парциальных давлений к равновесным. 78 Рассмотрим газовую реакцию, выражаемую в общем виде уравнением aA + bB dD + eE. Давление р в системе с помощью уравнения Менделеева - Клапейрона может быть выражено через объём V и температуру T: p = nRT/V , откуда, принимая, что суммарное число молей всех компонентов равно 1, получаем для работы расширения pdV = (RT/V)dV , Так как максимальная полезная работа может быть вычислена при интегрировании выражения: V2 w’max = pdV , V1 получаем V2 RT V2 р2 w’max = dV = RT ln = RT ln = RT(ln р2 ln р1), V1 V V1 р1 где p1 - давление исходной газовой смеси, р2 - равновесное давление. Заменяя ln р1 суммой логарифмов начальных парциальных давлений, а ln p2 - суммой логарифмов равновесных парциальных давлений веществ, получим: w’max = RT [(ln pDdравн + ln pEeравн ln pAaравн ln pBbравн) (ln pDdнач + ln pEeнач ln pAaнач ln pBbнач)], рDd рЕe р Dd р Е e w’max = RT [ln()равн ln()нач], рAa рBb рAa рBb откуда или рDd рЕe w’max = RT [ln Кр ln()нач], рAa рBb (4.1) 79 w’max = Gr , а так как то можно записать: рDd рЕe Gr = RT [ln Кр ln()нач], (4.2) a b рA рB Для процессов, идущих при постоянном объёме, можно получить аналогичные выражения, в которые входит максимальная работа и изменение энергии Гельмгольца в ходе реакции. При этом парциальные давления заменяются начальными концентрациями веществ: СDd СЕe wmax = RT [ln Кс ln()нач], СAa СBb CDd CЕe Ar = RT [ln Кc ln()нач], CAa CBb (4.3) (4.4) Уравнения (4.1) - (4.4), выведенные Я.Вант-Гоффом, называются уравнениями изотермы химической реакции. Они дают возможность определить, в каком направлении и до какого предела может протекать реакция в рассматриваемых условиях при заданном составе реакционной смеси при постоянной температуре. Для стандартных условий, когда исходные парциальные давления (или исходные концентрации или активности) всех веществ-участников реакции равны единице, уравнения изотермы будут выглядеть так: w’max = RT ln Kp ; Gor = RT ln Kp и wmax = RT ln Kс ; Аor = RT ln Kс . 80 (4.5) Отсюда следует, что определяя стандартную величину Gor или Аor для реакции, можно легко вычислить её константу равновесия. (Способ расчёта Gor и Аor был показан в п. 3.8). 4.5.2. Влияние температуры на равновесие. Уравнения изобары и изохоры химической реакции Для вывода уравнения изобары подставим соотношение (4.5) в уравнение Гиббса - Гельмгольца (3.11) d(RT ln Kp) RT ln Kp H = ; dT T Заменим знаки “минус” в обеих частях уравнения на “плюс”: d(RT ln Kp) RT ln Kp + Hr = ; dT T после чего дифференцируем левую часть по температуре: RT dln Kp RT ln Kp + Hr 0 + RT ln Kp + = ; dT T Умножая обе части уравнения на Т и сокращая, получим: RT2 d ln Kp = Hr dT или d ln Kp Hr = (4.6) 2 dT RT Для реакций, идущих в изохорных условиях можно получить аналогичное выражение d ln Kc Ur = dT RT2 (4.7) 81 Уравнения (4.6) и (4.7) тоже были выведены Я.Вант-Гоффом и названы соответственно уравнениями изобары и изохоры химической реакции. Они показывают зависимость константы равновесия химической реакции от температуры. Уравнения изотермы, изобары и изохоры химической реакции в количественной форме отображают принцип подвижного химического равновесия Ле-Шателье Брауна. С их помощью можно рассчитать условия, при которых константа равновесия будет соответствовать увеличению выхода требуемого продукта, например, лекарственного вещества. Если процесс экзотермический (H 0), увеличение температуры будет приводить к уменьшению отношения H/RT2, а значит, и к уменьшению константы равновесия, т. е. в конечном итоге к уменьшению выхода продуктов. В случае эндотермического процесса наблюдается обратная зависимость. 4.5.3. Влияние на равновесный выход изменения объёма и давления реакционной смеси Для реакций, идущих в газовой фазе, об изменении объёма реакционной смеси можно судить по изменению числа молей реагирующих веществ n = ni прод ni исх Возможны три случая, соответствующих различным типам химических реакций: а) n 0 (реакция идет с уменьшением объёма). Например, реакция синтеза аммиака: N2 (г) + 3H2 (г) 2NH3 (г) ; n = 2 (1 + 3) = 2 В соответствии с принципом Ле-Шателье уменьшение объёма (при увеличении давления) будет сдвигать равновесие этой и подобных реакций вправо, а увеличение объёма (при уменьшении давления) - влево. 82 б) n 0 (реакция идет с увеличением объёма). Например, реакция разложения метанола: CH3OH (г) CO (г) + 2H2 (г) ; n = (1 + 2) 1 = 2 В этом случае уменьшение объёма (или увеличение давления) будет сдвигать равновесие влево, а увеличение объёма (при уменьшении давления) - вправо. в) n = 0 (реакция идет без изменения объёма). Например, реакция хлора с бромоводородом: Cl2 (г) + 2HBr (г) Br2 (г) + 2HCl (г) ; n = (1 + 2) (1 + 2) = 0 На выходе продуктов таких реакций изменение объёма (давления) реакционной смеси не сказывается. 4.6. Способы вычисления констант равновесия а) Интегрируя после разделения переменных уравнение изобары (4.6) в предположении, что тепловой эффект реакции мало зависит от температуры 2 Hr 1 R Т2 dT Т1 T2 d ln Kp = получаем Kp 2 Hr 1 1 ln Kp 2 ln Kp 1 = ln = ( ) Kp 1 R Т1 T2 или где Kp 2 Hr Т2 Т1 ln = () , Kp 1 R Т1 T2 Kp 1 и Kp 2 - константы равновесия реакции при температурах Т1 и T2 соответственно; Hr - изобарный тепловой эффект реакции в интервале температуры Т1 T2. 83 С помощью этого уравнения по Hr и одной из Кр (как правило, по стандартному тепловому эффекту Hоr 298, вычисленному по справочным данным, и Кр 1 при температуре Т1 = 298 К) можно вычислить другую константу равновесия Кр 2 при любой другой температуре Т2. С другой стороны, с помощью двух констант равновесия Кр 1 и Кр 2 при двух температурах Т1 и Т2 можно рассчитать средний тепловой эффект реакции. Необходимо помнить, что этот способ вычисления Кр применим в не очень большом интервале температуры, когда зависимостью теплового эффекта от температуры можно пренебречь. Для изохорных условий, например, для реакций, идущих в растворах, можно получить аналогичное выражение, в которое входят константы Kc 2 Ur Т2 Т1 ln = () , Kc 1 R Т1 T2 равновесия Кс и изохорный тепловой эффект Uоr : б) Как было показано ранее, при стандартных условиях имеет место равенство Gor = RT ln Kp . В то же время изменение энергии Гиббса для реакции связано с её тепловым эффектом при постоянном давлении и изменением энтропии уравнением Gor = Hor TSor . Объединяя два этих выражения, получаем RT ln Kp = Hor TSor , откуда следует, что Sor Hоr ln Kp = . R RТ Это выражение называется уравнением Вант-Гоффа. С его помощью по стандартным 84 значениям Hor и Sor, (например, вычисленным по справочным значениям), можно рассчитать константу равновесия реакции для Т = 298 К или для другой температуры, не очень намного отличающейся от 298 К. С другой стороны, если известны значения Kp в некотором небольшом интервале температур, при посредстве уравнения Вант-Гоффа можно графическим способом определить величины Hor и Sor. График зависимости логарифма константы равновесия от 1/T (рис. 4.1) представляет собой прямую линию с отрицательным углом наклона, причем тангенс угла наклона её к оси абсцисс равен Hor/R, а точка пересечения графика с осью ординат дает Sor/R: ln Kp 1/T Рис. 4.1. Зависимость ln Kp 1/T для обратимой реакции Следует помнить, что описанные способы вычисления константы равновесия химической реакции применимы лишь в достаточно узком интервале температуры. Когда разность Т2 Т1 превышает несколько десятков градусов, требуется учитывать зависимость теплового эффекта реакции и теплоёмкости системы от температуры, что приводит к более сложным, но дающим более точные результаты уравнениям. 85 4.7. Химическое равновесие в гетерогенных системах Рассмотренные ранее закономерности относятся, главным образом, к гомогенным реакциям, т. е. к реакциям с участием веществ, находящихся в одном физическом состоянии - в виде газа или в виде раствора. Равновесия, в которых принимают участие вещества, находящиеся в двух или нескольких физических состояниях (например, газ с жидкостью или с твёрдым веществом), называются гетерогенными равновесиями. В качестве примера рассмотрим разложение карбоната кальция CaCO3, используемого в фармации в качестве антацидного средства. Это удобная модель для рассмотрения разложения различных твёрдых веществ, в том числе и лекарственных, идущего с образованием газообразных продуктов: CaCO3 (т) CaO (т) + CO2 (г) В соответствии с законом действующих масс выражение для константы равновесия этой реакции можно написать так: pCaO pCO2 Kр = pCaCO3 Парциальные давления CaO и CaCO3 в газовой фазе, во-первых, очень малы, а во-вторых, остаются практически постоянными в любой момент протекания реакции. Это значит, что пока твёрдые CaCO3 и CaO находятся в контакте с газом, их влияние на равновесие будет неизменным. В этом случае константа равновесия не зависит от количества твёрдой фазы. Можно разделить обе части выражения для константы равновесия на величину pCaO/pCaCO3 и принять, что K’p = pCO2 , где K’p = KppCaC03/pCaO - модифицированная константа равновесия; при этом парциальные давления CaCO3 и CaO входят в величину K’p в неявном виде. Если парциальное давление СО2 над CaCO3, при данной температуре поддерживается меньшим, чем значение K’p, то весь CaCO3 превратится в CaO и CO2; если же парциальное давление pCO2 больше, чем K’p, то весь СaO 86 превратится в CaCO3. Равновесное же парциальное давление CO2, равное K’p при данной температуре, называется давлением диссоциации. При достижении давления СО2 1 атм равновесие в данной реакции сдвигается в сторону диссоциации СаСО3, т. е. разложения карбоната кальция. Приведённая ниже таблица показывает, что это происходит при температуре 897оС: Давление CO2 над CaCO3 Температура, оС Давление, атм 500 9,30105 600 2,42103 700 2,92102 800 0,220 897 1,000 1000 3,871 1100 11,50 1200 28,68 Подобные рассуждения и понятие давления диссоциации могут быть распространены и на другие гетерогенные реакции с участием твёрдых веществ. В том случае, когда лекарственное вещество (в порошке или в таблетках) может реагировать с газами, находящимися в воздухе (H2O, O2, CO2), или разлагаться с их выделением, необходимо следить, чтобы парциальное давление этих газов и паров в атмосфере склада было меньше, чем давление диссоциации (или соответствующая константа равновесия K’p). 87 III. Ф А З О В О Е Р А В Н О В Е С И Е ГЛАВА 5 ТЕРМОДИНАМИКА ФАЗОВОГО РАВНОВЕСИЯ 5.1. Краткий исторический очерк Один из главных физических законов, лежащий в основе кинетической теории газов, - закон Р.Бойля (1662) - Э.Мариотта (1676) был сформулирован во 2-й половине XVII в. В России первые исследования, относящиеся к фазовому равновесию, были выполнены М.В.Ломоносовым, который, изучая свойства растворов, установил, что повышение концентрации растворённого вещества вызывает понижение температуры его замерзания. В начале XVIII в. идут изыскания в области термометрии - создаются различные конструкции термометров и предлагается большое число температурных шкал, из которых наибольшее признание получили шкалы Д.Г.Фаренгейта (1714), Р.А.Реомюра (1730) и, в особенности А.Цельсия (1744). В конце XVIII - начале XIX в. открываются другие главные газовые законы – Ж.А.С.Шарля (1787), Дж.Дальтона (1801 - 09), Ж.Л.ГейЛюссака (1802 - 07), А.Авогадро (1811). В 1834 г. выходит одна из основополагающих для физики и химии работа Б.П.Э.Клапейрона, в которой были даны обобщённое уравнение состояния идеального газа, впоследствии усовершенствованное Д.И.Менделеевым, а также основное уравнение фазового равновесия однокомпонентных систем. В 1848 У.Томсон (Кельвин) вводит абсолютную шкалу температуры. Большой вклад в учение о фазовом равновесии и, в особенности, в теорию растворов в 1850 - 80-х гг. внёс Д.И.Менделеев. Он ввёл понятие критической температуры жидкостей, исследовал явления изоморфизма твёрдых тел, сконструировал пикнометр. Он же создал гидратную теорию растворов, нашёл общее уравнение состояния идеального газа (уравнение Менделеева - Клапейрона). В работах Дж.У.Гиббса 1873 - 1875 гг. открыт фундаментальный закон фазового равновесия - правило фаз. В 1880-е гг. открыты основные законы равновесия в системах “жидкость - пар” (законы Ф.М.Рауля и Д.П.Коновалова). Тогда же Ф.М.Раулем были проведены исследования по связи температуры замерзания и закипания растворов с 88 концентрацией, а Я.Вант-Гоффом открыты закономерности осмотического давления; Д.П.Коноваловым созданы теоретические основы перегонки жидких смесей. Работами Н.С.Курнакова создано новое направление - физико-химический анализ, позволивший проводить систематическое изучение сложных многокомпонентных систем. Современные исследования в области фазового равновесия в основном связаны с анализом свойств многокомпонентных систем и с явлением полиморфизма твёрдых веществ. 5.2. Фазовые переходы Законы и закономерности, изучаемые в данном разделе, являются теоретической основой таких процессов, как экстракция, широко применяемая в фармации для извлечения биологически активных и лекарственных веществ из природного сырья, из растворов при промышленном получении, приготовление растворов и осаждение веществ из них, перегонка, сушка твёрдых веществ и растворителей, физическое взаимодействие веществ в лекарственных формах. Кроме того, учение о фазовых равновесиях необходимо для выяснения причин физической совместимости или несовместимости лекарственных веществ. Фазовые переходы - это переходы вещества из одного фазового состояния в другое при изменении параметров, характеризующих термодинамическое равновесие. Такие широко распространённые процессы, как плавление, кипение, испарение, возгонка (сублимация), растворение, и обратные им (отвердевание, конденсация паров, кристаллизация из растворов), являются фазовыми переходами. К фазовым переходам относятся также полиморфные превращения, т. е. переходы сложных веществ из одного кристаллического состояния в другое, аллотропные переходы твёрдых простых веществ, жидкостная экстракция и ряд других. 89 5.3. Основные понятия Фаза Ф - совокупность частей системы, тождественных по химическому составу и физическим свойствам, находящихся между собой в термодинамическом равновесии и отделённых поверхностями раздела от других частей. Всякая гомогенная система однофазна, т. е. характеризуется отсутствием внутренних поверхностей раздела. Гетерогенная система содержит несколько фаз (как минимум, две). В гетерогенной системе фазы имеются внутренние поверхности раздела (иногда называемые межфазными границами). Фаза - более общее понятие, чем индивидуальное вещество или агрегатное состояние. Во многих случаях одно и то же вещество может находиться в системе в виде различных фаз. Так, жидкая вода в равновесии со льдом и паром образует трёхфазную систему; в системе, состоящей из кристаллов CuSO45H2O, погружённых в насыщенный раствор CuSO4, вода входит в состав и жидкой фазы (раствора), и твёрдой (кристаллов). Простые фазы содержат одно химическое вещество, сложные, например, растворы, состоят из нескольких веществ. Фазовое равновесие - сосуществование термодинамически равновесных фаз, образующих гетерогенную систему. Компонент - индивидуальное химическое вещество, входящее в состав системы. Компонентом считается только то вещество, которое в принципе может быть выделено из системы и может существовать самостоятельно в течение достаточно длительного времени. Например, водный раствор углекислого газа содержит кроме Н2О и СО2 ещё и угольную кислоту Н2СО3. Однако угольная кислота существует только в растворе и не может быть из него выделена. Значит, компонентами данной системы являются только Н 2О и СО2. Не являются компонентами и ионы, образующиеся при диссоциации электролитов в растворах. 90 Число независимых компонентов системы К – это число компонентов, необходимых для создания полного состава системы. Оно равно общему числу компонентов минус число химических реакций, протекающих между ними. Например, для системы, состоящей из карбоната кальция, углекислого газа и оксида кальция, число независимых компонентов равно 2, так как при помещении в замкнутый сосуд любых двух из этих веществ третье появится самопроизвольно из-за протекающей обратимой реакции. 5.4. Правило фаз Наиболее общий закон, описывающий фазовые равновесия, - это правило фаз, являющееся следствием второго начала термодинамики. Правило фаз, открытое Дж.У.Гиббсом в 1876 г., связывает число фаз, находящихся в равновесии, число независимых компонентов и число параметров, необходимых для полного описания системы: Число степеней свободы (вариантность) термодинамической системы, находящейся в равновесии, на которую из внешних факторов влияют только давление и температура, равно числу независимых компонентов минус число фаз плюс два: С=КФ+2 Если состояние системы зависит не от двух внешних факторов, то в общем виде выражение для правила фаз выглядит следующим образом: С = К Ф + n, где n – число факторов, определяющих состояние. Например, на системы, состоящие только из конденсированных (твёрдых или жидких) фаз, давление практически не оказывает влияния, и поэтому для них n = 1. Вариантность системы С может быть представлена как число внешних условий (температура, давление, концентрация и др.), которые экспериментатор может изменять, не изменяя при этом числа фаз в системе. Необходимость таких воздействий на систему связана с интенсификацией 91 желательных процессов (например, ускорение экстракции, растворения и т. п.) или, наоборот, с замедлением нежелательных. Правило фаз показывает, что число степеней свободы возрастает с увеличением числа компонентов и с уменьшением числа фаз системы. В зависимости от состава системы при расчёте по правилу фаз можно получить различные значения вариантности. При С = 0 система называется нонвариантной (или инвариантной); изменение любого параметра состояния приводит к изменению числа фаз. При С = 1 система называется моновариантной; лишь какой-либо один из параметров может быть изменён без изменения числа фаз, находящихся в равновесии. При С = 2 система называется бивариантной, при С = 3 тривариантной. В таких системах без изменения числа фаз, находящихся в равновесии, можно изменять в определённых интервалах соответственно два или три параметра. 5.5. Общее условие фазового равновесия. Химический потенциал Система будет находиться в состоянии фазового равновесия (т. е. ни один из её компонентов не будет переходить из одной фазы в другую) при условии, что химический потенциал каждого компонента во всех фазах является одинаковым. Химический потенциал i-того компонента - это производная энергии Гиббса данного компонента по его количеству вещества: d (G i) i = ()p,T dni Иными словами, химический потенциал i-того компонента равен приращению энергии Гиббса при добавлении одного моля этого компонента к большому объёму системы (настолько большому, что состав системы при этом практически не изменяется) при постоянных температуре и давлении. 92 Химический потенциал - важная термодинамическая функция. С ним связаны такие понятия, как работа расширения идеального и реального газов, активность и коэффициент активности компонентов растворов. На основе химического потенциала того или иного компонента выводятся условия его существования в составе определённой фазы или возможность перехода из одной фазы в другую. Характерным свойством химического потенциала является то, что он равен производной по количеству вещества всех термодинамических функций: d (Gi) d (Hi) d (Ui) d (A) i = ()p,T = ()p,T = ()V,T = ()V,T dni dni dni dni 93 ГЛАВА 6 ФАЗОВЫЕ РАВНОВЕСИЯ В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ 6.1. Связь между давлением и температурой фазовых переходов. Уравнение Клапейрона В однокомпонентных системах, т. е. системах, состоящих из одного вещества, возможны такие фазовые переходы: плавление твёрдого тела и отвердевание жидкости (кристаллизация, “замерзание”), испарение жидкости и конденсация пара в жидкость, возгонка (сублимация) и конденсация пара в твёрдое тело, а также аллотропные и полиморфные переходы (переходы твёрдых веществ из одной кристаллической модификации в другую). Когда две фазы ( и ) чистого вещества в однокомпонентной системе находятся в равновесии, их химические потенциалы при данных температуре и давлении одинаковы: = Если при постоянном давлении изменять температуру или при постоянной температуре изменять давление, то компонент будет переходить из одной фазы в другую. Например, при плавлении льда вода переходит из твёрдой фазы в жидкую, а при кипении воды - из жидкой фазы в паровую. В пределе это может привести к исчезновению одной из фаз. Но если одновременно изменять и температуру, и давление таким образом, чтобы химические потенциалы двух фаз оставались одинаковыми, то в системе попрежнему будут в равновесии находиться обе фазы. Уравнение, показывающее связь между изменениями температуры и давления в однокомпонентной системе при сохранении неизменного числа фаз, вывел Б.П.Э.Клапейрон (1834). При изменении Т и р должно соблюдаться равенство d = d 94 и, значит, dG = dG Поскольку G, как и , зависит только от давления и температуры, можно это dG dG dG dG ()T dp + ()p dT = ()T dp + ()p dT . dp dT dp dT равенство записать в виде: (6.1) Из фундаментального уравнения dU = TdS pdV , полученного из первого начала термодинамики, можно получить соотно- dG dG ()T = V и ()p = S dp dT шения Подставляя их в ранее полученное выражение (6.1), получаем: Vdp SdT = Vdp SdT или dp S S S = = . dT V V T Так как при равновесии G = H TS = 0, S = H /T то и, значит, dp Н = . dT TV Это уравнение - уравнение Клапейрона - применимо ко всем фазовым переходам процессам испарения, возгонки, плавления и обратным им, а также к полиморфным превращениям чистого вещества. Производная dp/dT 95 показывает, как изменяется давление, при котором происходит фазовый переход, при изменении температуры. В качестве H в уравнение подставляется молярная теплота соответствующего фазового перехода - теплота испарения Hисп, теплота плавления Hпл или теплота возгонки Hвозг. В качестве Т - так называемая нормальная температура фазового перехода, т. е., температура кипения Ткип, температура плавления Тпл, или температура возгонки Твозг, измеренная при нормальном атмосферном давлении. V представляет собой разность молярных объёмов данного компонента, находящегося в различных фазах. Например, для процесса кипения это разность молярного объёма пара и молярного объёма жидкости: V = Vп Vж, для процесса плавления - разность молярного объёма жидкости и молярного объёма твёрдого тела: V = Vж Vт, Молярный (или мольный) объём – это объём, занимаемый одним молем вещества; его размерность СИ – м3/моль. При необходимости при расчётах по уравнению Клапейрона вместо молярных объёмов можно использовать удельные. В этом случае в уравнение вместо молярной теплоты фазового перехода следует подставлять удельную теплоту L, выраженную в Дж/кг: Lф. п. = H ф. п./М, где М - молярная масса исследуемого вещества, кг/моль. Удельный объём – это объём, занимаемый одним килограммом вещества. Его размерность СИ – м3/кг. Удельный объём легко вычисляется как величина, обратная плотности. Вывод уравнения Клапейрона можно осуществить и другим способом, например, исходя из уравнения Гиббса Гельмгольца: d(A) Wmax = U T ()V . dT 96 Его можно переписать иначе: d(A) wmax U = dT T dwmax U + wmax = . dT T или, так как A = wmax , Поскольку при фазовом переходе совершается главным образом работа расширения w = pV то d(pV) U + pV Н = = dT T Т или, считая, что разность молярных объёмов в небольшом интервале dp Н V = dT T температуры практически не изменяется, dp Н = . dT TV и окончательно При расчётах по уравнению Клапейрона вычисляется производная dp/dT, знак которой показывет, в каком направлении должно измениться давление с изменением температуры фазового перехода. После интегрирования можно получить уравнение, позволяющее точно вычислить изменение давления, связанное с изменением температуры: 97 p Н Н = или p = T. T TV Tф.п.V В тех случаях, когда требуется узнать, как изменится температура при изменении давления, уравнение преобразуют таким образом: dT TV = . dp Н После интегрирования получают соответственно Т ТV Tф.п V = или Т = р. р Н . Н 6.1.1. Процесс кипения. Уравнение Клаузиуса - Клапейрона Р.Э.Клаузиус показал, как можно упростить уравнение Клапейрона для процесса кипения жидкости или возгонки твёрдого вещества. Это было сделано исходя из предположения, что при давлениях, не намного отклоняющихся от атмосферного, пар подчиняется законам идеальных газов, и что молярным объёмом жидкости Vж по сравнению с молярным объёмом пара Vп практически всегда можно пренебречь. Например, для воды при 100оС Vж пренебрежимо мал по сравнению с Vп (Vп = 30,6 л/моль, а Vж = 0,018 л/моль). Тогда, заменяя V на Vп , получим dp Нисп Нисп = = . dT Tкип(Vп Vж) TкипVп С учетом уравнения Менделеева - Клапейрона (для 1 моля идеального газа) pV = RT будем иметь dp р Нисп = . dT RT2 98 Это дифференциальное выражение можно применять в тех случаях, когда изменения температуры и давления малы. Например, удобно пользоваться следующей формулой для поправок к температуре кипения при колебаниях атмосферного давления: dТ RT2 = . dр р Нисп После разделения переменных dp Нисп dT = р R T2 и интегрирования в предположении, что Hисп не зависит от температуры и давления р2 dp Нисп Т2 R Т1 dT = р1 р T2 получаем p2 Нисп 1 1 ln = ( ) p1 R T1 T2 или Нисп (T2 T1) ln p2 = ln p1 + . R T1 T2 Два последних выражения представляют собой различные формы уравнения Клаузиуса Клапейрона для процесса кипения (оно также применимо и для процесса возгонки). Преимуществом его по сравнению с выведенным ранее уравнением Клапейрона является возможность вычислений без использования величин V. С помощью уравнения Клаузиуса Клапейрона при необходимости можно вычислить и теплоту испарения (или теплоту возгонки), используя значения температуры кипения при различных давлениях. В широких 99 интервалах температуры, когда Hисп зависит от температуры, и свойства паров отличаются от свойств идеальных газов, следует эти отличия учитывать и вносить соответствующие поправки в уравнение. 6.2. Физико-химический анализ. Фазовые диаграммы Изучение зависимости свойств многокомпонентных систем и их фазового состава от внешних факторов производится при помощи физикохимического анализа. Он заключается в изучении фазовых равновесий с помощью диаграмм состояния (фазовых диаграмм), на которых графически изображается состояние гетерогенных систем. (Понятие «физико- химический анализ» не следует путать с понятием «физико-химические методы анализа», которое применяется по отношению к аналитическим методам, связанным с использованием различных приборов - спектрофотометров, поляриметров, фотоколориметров и др.). В основе физико-химического анализа лежат принципы непрерывности и соответствия, введённые Н.С.Курнаковым (1893 - 1902). Согласно принципу непрерывности при непрерывном изменении параметров, определяющих состояние системы (давление, температура, концентрация компонентов), свойства её отдельных фаз изменяются также непрерывно до тех пор, пока не изменится число или характер фаз. При появлении новых фаз или исчезновении существующих свойства системы изменяются скачком. Согласно принципу соответствия каждой фазе или каждой совокупности равновесных фаз на диаграмме состояния соответствует определённый геометрический образ. Диаграмма графическое состояния изображение (иначе всех - фазовая возможных диаграмма) фазовых - это состояний термодинамической системы в пространстве основных параметров состояния – температуры и давления (а для многокомпонентных систем и состава). На 100 диаграммах состояния отображаются линии равновесия, разделяющие фазовые поля. Каждому реально существующему состоянию системы на диаграмме состояния отвечает определённая точка, называемая фигуративной. Если фигуративная точка находится внутри какого-либо фазового поля, это означает, что система, параметры которой соответствуют координатам фигуративной точки, находится в гомогенном (твёрдом, жидком или газообразном) состоянии. Если фигуративная точка находится на линии равновесия, то это значит, что при заданных её координатами параметрах система находится в гетерогенном состоянии, то есть в ней одновременно существуют в равновесии две фазы. В местах пересечения линий равновесия друг с другом имеются точки, отвечающие равновесию трёх или более фаз. В зависимости от вида диаграммы состояния эти точки носят различные названия, о которых будет сказано ниже. Диаграмма состояния однокомпонентных систем обычно строится на плоскости в координатах давление температура. 6.3. Диаграмма состояния воды Рассмотрим диаграмму состояния однокомпонентной системы на примере воды (рис. 6.1). р 1 Ж 1 атм Л о ртр.т. 2 П 3 Тпл Ттр.т Ткип. Т 101 Рис. 6.1. Диаграмма состояния воды Фазовые поля, отвечающие области существования каждой из фаз (твёрдая вода - лёд Л, жидкая вода Ж и водяной пар П), отделены друг от друга линиями равновесия. В данном случае это линии плавления (1), испарения (2) и возгонки или сублимации (3). Каждая кривая равновесия может быть описана уравнением Клапейрона для соответствующего фазового перехода. Вода по сравнению с другими веществами обладает довольно необычными свойствами. В частности, её твёрдая фаза имеет меньшую плотность, чем жидкая. Благодаря этому величина dp/dT для неё отрицательна и линия равновесия “лёд вода” на диаграмме состояния воды имеет наклон в сторону оси давлений (отрицательный наклон). Это обстоятельство сыграло особую роль в возникновении и развитии жизни на Земле, так как благодаря ему зимой лёд находится на поверхности морей, океанов и других водоёмов и экранирует собой жидкую воду, где живые организмы могут пережить холодное время года. Если бы величина dp/dT для воды была положительна, то лёд опускался бы на дно водоёмов и практически заполнил бы их доверху. Как показывают расчёты, тепла, получаемого летом от Солнца, не хватило бы для того, чтобы полностью расплавить лёд, находящийся под слоем воды. Таким образом, Земля была бы круглый год покрыта сплошным ледяным панцирем, и только летом на его поверхности мог бы образоваться тонкий слой жидкости, с наступлением зимы опять превращающийся в лёд. Поэтому живым организмам, даже если бы они смогли возникнуть в таких условиях, было бы невозможно сохраниться, будучи вмороженными в лёд, даже до следующего лета. Для подавляющего большинства химических веществ величина dp/dT имеет положительный знак и для них линия равновесия “твёрдое тело жидкость” на диаграмме состояния имеет наклон в сторону от оси давлений (положительный наклон). Все три линии равновесия сходятся в тройной точке (О), отвечающей равновесному сосуществованию трёх фаз. Тройная точка воды имеет координаты Т = 0,0098оС (273,1598 К), p = 0,0060 атм (607,5 Па). Следует 102 помнить, что одновременное существование в системе трёх фаз, отвечающих различным агрегатным состояниям воды (как и других веществ), при температуре и давлении, отвечающим координатам тройной точки, возможно только при отсутствии других веществ, например, воздуха. Точка пересечения изобары, соответствующей нормальному атмосферному давлению 1 атм (1,013105 Па), с линией плавления 1 отвечает нормальной температуре плавления льда Тпл (0оС или 273,15 К), а точка пересечения её с линией кипения 2 – нормальной температуре кипения воды Ткип (100оС или 373 К). Эти две температуры фазовых переходов являются константами воды и лежат в основе температурных шкал Цельсия и Кельвина. Применяя к рассмотрению воды правило фаз Гиббса, получаем такие значения вариантности системы: а) Для каждого фазового поля: С=КФ+2=11+2=2 Система бивариантна, то есть каждая фаза в отсутствие других может существовать в широкой области температуры и давления, которые можно изменять независимо друг от друга. б) Для линий равновесия: С=КФ+2=12+2=1 Система моновариантна, то есть, если мы задали температуру равновесия между фазами (температуру плавления или температуру кипения), то тем самым должно быть однозначно определено равновесное давление и наоборот. Например, когда мы устанавливаем какое-то произвольное давление, температура кипения сама собой примет строго определённое значение, изменить которое при данном давлении невозможно. То же относится к возгонке, плавлению и обратным им фазовым переходам. в) Для тройной точки: С=КФ+2=13+2=0 103 Система нонвариантна (инвариантна). Иначе говоря, если в однокомпонентной системе в равновесии находятся три фазы, то мы не можем произвольно менять ни один из параметров равновесия даже в малой степени без того, чтобы одна (или две) из фаз не исчезли. 104 ГЛАВА 7 ФАЗОВЫЕ РАВНОВЕСИЯ В ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ 7.1. Растворы. Основные понятия Растворы - это гомогенные смеси переменного состава. Они могут быть газовыми, жидкими или твёрдыми. Обычно термин “раствор”, не содержащий уточнений, относят к жидкой молекулярно-дисперсной системе. Растворы, как правило, термодинамически устойчивы, т. е. длительное время сохраняют свои первоначальные свойства. Все компоненты раствора термодинамически равноценны. Однако обычно среди них принято различать растворитель и растворённые вещества. Причём, в зависимости от природы раствора в понятие “растворитель” может вкладываться различное содержание. Как правило, растворителем называется тот из компонентов, концентрация которого существенно выше концентрации других компонентов. Однако возможен и такой подход, когда растворителем считается тот компонент, который в чистом виде при данных условиях находится в том же агрегатном состоянии, что и раствор. Например, в сиропе, содержащем равные количества воды и сахарозы, за растворитель принимается вода. Вообще же в термодинамике фазовых равновесий для обозначения компонентов, присутствующих в системе соответственно в большем и в меньшем количествах существуют термины “мажорный компонент” и “минорный компонент”. По наличию или отсутствию электролитической диссоциации различают два основных класса растворов низкомолекулярных веществ: растворы электролитов и растворы неэлектролитов. Молекулы (или ионы) в растворах всегда взаимодействуют друг с другом. Важнейшими составляющими такого взаимодействия являются притяжение под действием ван-дер-ваальсовых сил, сольватация, 105 комплексообразование, электростатические взаимодействия. растворение Поэтому и является дисперсионные сложным физико- химическим процессом, а растворы обладают рядом свойств, присущих химическим соединениям. межмолекулярных В зависимости взаимодействий, которые от интенсивности проявляются во многих макроскопических свойствах, растворы подразделяются на идеальные и неидеальные (реальные). Идеальные растворы характеризуются отсутствием взаимодействий (кроме ван-дер-ваальсовых) между молекулами обоих компонентов, обозначаемых А и В.В идеальных растворах силы притяжения между однородными молекулами FАА и FВВ практически равны силам притяжения между разнородными молекулами FАВ. Коэффициенты активности компонентов в идеальных растворах равны 1. Идеальные растворы образуются при смешении компонентов без заметного теплового эффекта. Этим условиям удовлетворяют растворы близких по свойствам веществ, как правило, органических неэлектролитов, например, растворы структурных и оптических изомеров друг в друге, смеси близких углеводородных гомологов и др. Для реальных растворов характерны различные по интенсивности взаимодействия между однородными и разнородными молекулами, которые приводят к образованию различного рода ассоциатов, сольватов и т. п., что в одних случаях затрудняет испарение обоих компонентов, в других затрудняет испарение одного из них и облегчает испарение другого. А как будет показано далее, давление насыщенного пара обусловливает многие практически важные свойства растворов. Коэфициент активности растворённого вещества в реальном растворе отличается от 1, причём для бинарного раствора это отклонение определяет знак неидеальности. Если коэффициент 106 активности больше единицы, неидеальность считается положительной, если меньше единицы, - отрицательной. При образовании неидеальных растворов происходит выделение или поглощение теплоты. 7.2. Значение растворов для фармации Значительная часть лекарственных форм в рецептуре аптек – жидкие. При этом многие из них представляют собой растворы одного или нескольких лекарственных веществ в каких-либо растворителях (по большей части в воде). Сюда относятся инъекционные растворы, глазные, ушные, носовые капли, микстуры, отвары, спиртовые и водно-спиртовые экстракты, вытяжки, настойки, «масла» (растворы в органических растворителях) и др. Знание структуры и свойств растворов открывает возможность управления технологическими процессами химических и фармацевтических производств, а также основными биохимическими реакциями в животных и растительных организмах. Фармацевтический анализ лекарственных препаратов, как в субстанции, так и в препаратах, немыслим без использования самых разнообразных растворов – растворов исследуемых веществ, реагентов, титрантов, индикаторов и др. 7.3. Концентрация. Способы выражения концентрации Относительное содержание компонентов раствора характеризуется концентрацией. Следует помнить, что понятие “концентрация” может быть применено к каждому из компонентов раствора, а не только к растворённому веществу. Более того, исходя из определения концентрации как отношения числа частиц компонента системы, его количества (в моль) или массы к объёму системы, можно говорить и о концентрации чистого вещества. Например, в чистой воде её концентрация составляет 55,555... моль/л. Концентрация i-того компонента в растворе может быть выражена различными способами. Наиболее употребительными из них являются следующие: Массовая доля i - отношение массы данного компонента mi к массе всего раствора (равной сумме масс всех компонентов): mi i = . mi 107 Умножением i на 100 получают массовый процент i-того компонента: i, % = i100. Сумма массовых долей всех компонентов раствора равна 1, а сумма массовых процентов 100%. Объёмная доля i - отношение объёма данного компонента Vi к объёму V раствора: Vi i = . V Часто из-за явления контракции объём раствора не равен сумме объёмов его компонентов. Поэтому V требуется или измерять, или вычислять с помощью массы и плотности раствора. Умножением i на 100 получают объёмный процент i-того компонента: i, % = i 100. В старой литературе можно встретить выражение “градус”, являющееся синонимом объёмного процента. Сумма объёмных долей всех компонентов раствора равна 1, а сумма объёмных процентов - 100%. Молярная (мольная) доля Хi - отношение количества вещества данного компонента ni, выраженного в моль, к суммарному количеству вещества всех компонентов раствора: ni Хi = . ni Молярная доля является наиболее “естественным” способом выражения концентрации, так как представляет собой, по существу, отношение числа молекул данного компонента к общему числу молекул в растворе. Умножением Хi на 100 получают молярный (мольный) процент i-того компонента: Хi, % = Хi 100. Сумма молярных долей всех компонентов раствора равна 1, а сумма молярных процентов - 100%. Молярная концентрация i-того компонента С - отношение количества вещества данного компонента ni, выраженного в моль, к объёму раствора V: ni Сi = . V 108 Размерность молярной концентрации в системе СИ - моль/м3. Однако в лабораторной практике чаще используется другая размерность - моль/л. В этом последнем случае принято обозначать молярную концентрацию буквой М. Например, 2М раствор - раствор с концентрацией 2 моль/л. Молярная концентрация эквивалента i-того компонента Ni - отношение количества вещества данного компонента, выраженного в молярных массах эквивалента nЭ i Ni = . V nЭ i, к объёму раствора V: Размерность молярной концентрации эквивалента такая же, как и у Сi - моль/м3 или моль/л. В последнем случае принято обозначать молярную концентрацию эквивалента буквой н с точкой. Например, 3н. раствор - раствор с концентрацией 3 моль/л. Молярная концентрация эквивалента может быть вычислена умножением молярной концентрации Сi на число эквивалентов, содержащееся в 1 моль данного компонента. Например, если молярная концентрация серной кислоты в водном растворе равна 1М, то N = 2Сi = 2н. Моляльная концентрация (моляльность) i-того компонента mi выражается отношением количества вещества данного компонента ni, выраженного в моль, к массе растворителя mА: ni mi = . mA Размерность моляльной концентрации в системе СИ моль/кг. Она может быть вычислена с использованием массовых количеств растворённого вещества b и растворителя а, 1000 b mi = , Ма выраженных в граммах, по формуле где М - молярная масса растворённого вещества, 1000 - коэффициент пересчёта массы из г в кг. Моляльность, в отличие от молярной концентрации, не зависит от внешних факторов, например, от изменения объёма и плотности раствора вследствие теплового расширения при повышении температуры. Как правило, она используется тогда, когда требуется точное значение концентрации компонента, не зависящее от температуры, 109 например, при изучении коллигативных свойств растворов, при измерении теплот растворения, при электрохимических измерениях и т. п. 7.4. Двухкомпонентные растворы летучих жидкостей. Закон Рауля В этом разделе мы остановимся на давлении пара компонентов бинарного (двухкомпонентного) раствора. Равновесное давление пара является мерой способности молекул переходить из жидкой фазы в паровую. Эта способность больше при высоких температурах и меньше - при пониженных. Она также снижается при уменьшении числа молекул жидкости, которые могут переходить в пар. Если в растворе половина молекул воды, а половина молекул - какого-либо нелетучего вещества, то давление пара воды над раствором должно быть вдвое меньше, чем над чистой водой. В общем случае если ХА - молярная доля компонента А в растворе и pАо - давление пара чистого вещества А при данной температуре, то давление его пара над раствором pА определяется соотношением pA = ХA poA. Это же справедливо и для второго компонента раствора (В): pВ = ХВ poВ . Эти уравнения являются математическим выражением закона Ф.М.Рауля (1882): Давление пара компонента над раствором пропорционально его молярной доле в растворе. Коэффициентом пропорциональности в этих уравнениях служит давление пара над чистым компонентом poА или poВ. На практике часто бывает удобнее пользоваться другой формой уравнения, связывающей параметры, относящиеся к обоим компонентам. Преобразуя выражение для компонента А, можно получить: ХA = pA/poA или, так как ХA + ХВ = 1, 1 ХA = 1 pA/poA = ХB, 110 откуда poA pA = ХB , poA что соответствует такой формулировке закона Рауля: Относительное понижение давления пара растворителя над раствором численно равно молярной доле растворённого вещества. Разность poA pA называется понижением давления пара растворителя над раствором по сравнению с чистым растворителем, а выражение (poA pA)/poA - относительным понижением давления пара растворителя. Относительное понижение давления пара растворителя не зависит от природы растворителя и поэтому относится к так называемым коллигативным свойствам растворов (свойствам, которые зависят только от концентрации компонентов). Эта формулировка и соответствующее ей математическое выражение наиболее удобны при рассмотрении свойств растворов нелетучих веществ в летучих растворителях. В соответствии с законом Дж. Дальтона (1801): Общее давление пара над раствором равно сумме парциальных давлений компонентов можно записать: p = pA + pB или p = ХA poA + ХB poB Поскольку ХA + ХB = 1, то p = poA (1 ХB) + poB ХB и окончательно p = poA + ХB (pB pA) и p = poB + ХA (pA pB), откуда следует, что полное давление пара над раствором является линейной функцией молярной доли любого его компонента. Закон Рауля справедлив во всей области концентраций только для идеальных растворов. Более того, существует даже такое определение 111 идеальных растворов, как растворов, подчиняющихся закону Рауля. Объяснение этого заключается в том, что если силовые поля всех молекул веществ А и В в растворе одинаковы, то одинаковы и силы притяжения однородных и разнородных молекул (FАА = FВВ = FАВ). При этом число молекул каждого компонента, переходящих в пар, уменьшается пропорционально понижению молярной доли вещества в растворе. Закон Рауля может быть изображен графически в виде диаграммы в координатах “давление - состав” (рис. 7.1). Рис. 7.1. Диаграмма “давление состав” для идеального раствора р р Т = const На таких диаграммах принято слева помещать тот компонент, который о рВ в чистом виде обладает меньшим давлением насыщенного пара. Например, p = pA + pB допустим, что в данном случае это компонент А. Ось абсцисс (ось состава) на таких диаграммах ограниченна; на ней одновременно откладывается pВ = ХВроВ ро А содержание обоих компонентов, обычно в молярных долях или в молярных о pА= ХАр Акомпонентам А и В, процентах. Из точек, соответствующих чистым pA = ÕA pAo А 112 В состав, мол. доли восстанавливаются две оси ординат – оси давлений. Каждая диаграмма строится при заданной постоянной температуре. Точки, отвечающие давлениям насыщенного пара чистых компонентов (роА и роВ), соединяются прямыми линиями с крайними точками оси состава и друг с другом. Две первые линии иллюстрируют повышение парциального давления пара каждого компонента с повышением его молярной доли в растворе в соответствии с законом Рауля. Третья линия является иллюстрацией закона Дальтона и одновременно линейности зависимости общего давления пара от молярной доли любого из компонентов. 7.5. Отклонения от закона Рауля В большинстве случаев реальные растворы подчиняются закону Рауля только при очень малых (не превышающих нескольких молярных процентов) концентрациях одного из компонентов. При концентрациях компонентов, соизмеримых друг с другом, в той или иной степени наблюдаются отклонения от закона Рауля. Эти отклонения проявляются или в увеличении общего давления пара по сравнению с вычисленным по этому закону (положительные отклонения), или в уменьшении его (отрицательные отклонения). Причинами отклонений от закона Рауля являются 1) различие в интенсивности сил притяжения между однородными и разнородными молекулами и 2) изменение размеров частиц, присутствующих в растворах. Если разнородные молекулы взаимодействуют между собой слабее, чем однородные (FАА FАВ FВВ), то вклад каждого компонента в общее давление пара будет больше, чем предсказывается законом Рауля: pA ХApoA и pB ХBpoB . При этом наблюдается положительное отклонение от закона Рауля. Так ведёт себя, например, система ацетон дисульфид углерода. Растворы с положительными отклонениями от закона Рауля образуются, как правило, с поглощением теплоты. 113 В растворах, состоящих из веществ другой природы, притяжение между разнородными молекулами может оказаться сильнее, чем между однородными (FАА FАВ FВВ). Это затрудняет испарение каждого компонента, и общее давление пара над раствором становится меньше, то есть наблюдается отрицательное отклонение от закона (например, в системах вода этанол, ацетон хлороформ): Растворы с pA ХApoA и pB ХBpoB отрицательными отклонениями от закона Рауля образуются, как правило, с выделением теплоты. Изменение среднего размера частиц жидкости происходит в результате ассоциации молекул из-за образования водородных связей или, наоборот, распада ассоциатов на отдельные молекулы или на ассоциаты, содержащие меньшее число молекул. Так, частицы в чистой уксусной кислоте являются димерами (СН3СООН)2, во фтороводородной кислоте - состоят из шести молекул (HF)6, в воде её молекулы объединяются в ассоциаты с ещё бóльшим и, как правило, с различным числом молекул (Н2О)n. При смешении компонентов такие ассоциаты могут распадаться или, наоборот, возникать. Кроме того, часто имеет место сольватация, т. е. образование ассоциатов, содержащих одновременно молекулы растворённого вещества и растворителя, - сольватов или в случае воды - гидратов. Распад ассоциатов приводит к положительным отклонениям от закона Рауля, а их образование к отрицательным. Графическое изображение отклонений представлено на рис. 7.2 и 7.3. Отклонения от закона Рауля могут быть большими или малыми. Малыми считаются такие, когда общее давление пара над раствором любого 114 р р Т = const р р Т = const роВ ро В роА роА А В А В состав, мол. доли состав, мол. доли а б Рис. 7.2. Диаграмма “давление состав” для раствора с малыми положительными (а) и отрицательными (б) отклонениями от закона Рауля. Сплошная линия - теоретическое давление пара, пунктирная - реально наблюдаемое давление. Рис. 7.3. Диаграмма “давление состав” для раствора с большими положительными (а) и отрицательными р р(б) отклонениями от закона Рауля. р р Т = const Т =пара, const Сплошная линия - теоретическое давление роВ роВ 115 пунктирная - реально наблюдаемое давление. состава не превышает давления пара над чистым более летучим веществом (при положительных отклонениях) или не становится меньше давления пара над чистым менее летучим веществом (при отрицательных отклонениях). При больших отклонениях на кривых общего давления пара появляются экстремумы - максимумы в случае положительных отклонений или минимумы в случае отрицательных. 7.6. Первый закон Коновалова Любые жидкости, как чистые, так и смеси, закипают тогда, когда давление пара над ними становится равным атмосферному давлению. Чистые жидкости кипят при постоянной температуре, являющейся характерной константой при каждом данном давлении – при своей температуре кипения Ткип. Это обусловлено тем, что пар над кипящей чистой жидкостью имеет тот же состав и теплота испарения жидкости равна теплоте конденсации пара. Если температура кипения измерена при стандартных условиях, т. е. при нормальном атмосферном давлении, то она называется нормальной температурой кипения данного вещества Токип. Растворы же в большинстве случаев при кипении ведут себя иначе. Так как состав пара над раствором отличается от состава жидкости и к тому же непрерывно изменяется при выкипании жидкой фазы, то кипение происходит не при фиксированной температуре, а в некотором интервале температуры. Это связано с первым законом Д.П.Коновалова (1880 - 81): Насыщенный пар по сравнению с равновесным раствором относительно богаче тем компонентом, добавление которого к системе повышает полное давление пара. Иначе этот закон может быть выражен так: Пар в равновесной бинарной системе по сравнению с жидкостью обогащён легкокипящим компонентом. 116 Первый закон Коновалова носит общий характер и относится ко всем бинарным жидкостным смесям. В соответствии с ним даже первый пузырёк пара, образующийся в начале кипения раствора, содержит большее по равнению с жидкой фазой количество более летучего (низкокипящего) компонента. После выделения этого пузырька жидкий раствор обедняется легкокипящим компонентом и обогащается высококипящим. Это требует подвода дополнительного количества теплоты для поддержания системы в состоянии кипения и, следовательно, слегка повышает температуру кипения. Следующий пузырёк пара тоже обогащён легкокипящим компонентом; жидкость при его образовании снова обогащается менее летучим компонентом и температура кипения вновь слегка повышается. Так происходит до тех пор, пока в пар не перейдёт вся жидкость. Температура её в момент исчезновения последней капли будет значительно выше, чем при начале кипения. 7.7. Диаграммы кипения Равновесие жидкой и паровой фаз может быть отображено на фазовых диаграммах, которые в данном случае называются диаграммами кипения. Типичная диаграмма кипения для идеального раствора или раствора с небольшими отклонениями от закона Рауля представлена на рис. 7.4. Диаграммы кипения строятся в координатах “температура - состав” при заданном постоянном давлении (р = const). Как и в случае диаграмм “давление - состав” на оси абсцисс откладывается состав раствора, обычно в молярных долях или молярных процентах. Слева принято помещать менее летучий или, что то же самое, высококипящий компонент. По оси ординат откладывается температура. Точки на осях ординат, отвечающие температурам кипения каждого компонента (Ткип А и Ткип В), соединяются линией жидкости (ликвидусом) 1 и линией пара 2. Фазовое поле П выше линии пара отвечает гомогенной бивариантной паровой фазе, поле Ж ниже 117 ликвидуса - гомогенной бивариантной жидкой фазе. Фигуративные точки, лежащие на ликвидусе, на линии пара и в заключённом между ними фазовом поле Ж + П, отвечают гетерогенной моновариантной системе, состоящей из кипящей жидкости, находящейся в равновесии с паром. z Т Ткип А Тх ` Т р = const b П d 2 Ж+П Тх c 1 а Ткип В Ж А х` у В х состав, мол. доли Рис. 7.4. Диаграмма кипения бинарной жидкостной смеси, не образующей азеотропа Проследим с помощью диаграммы процесс нагревания с последующим кипением жидкостной смеси с составом х. Нагревание жидкости отображается перемещением фигуративной точки вверх по линии хz. В тот момент, когда фигуративная точка при температуре Тх достигнет ликвидуса (точка а), начинается кипение и появляется первый пузырёк пара. Его состав можно определить с помощью изотермы при Тх: точка её пересечения с линией пара (с) показывает, что пар имеет состав, отображаемый точкой у. Отрезок изотермы, соединяющий точки, лежащие на ликвидусе и на линии пара, называется коннодой (или нодой). Точки, ограничивающие конноду, позволяют определить составы находящихся в равновесии кипящей 118 жидкости и пара. При любой температуре точка пересечения конноды с ликвидусом соответствует составу жидкой фазы, а точка пересечения её с линией пара отвечает составу пара. При дальнейшем нагревании смеси (отрезок аb) всё бóльшая часть жидкости переходит в пар; при этом температура системы всё время повышается. При достижении фигуративной точкой линии пара (точка b) при температуре Тх` в пар переходит последняя капля жидкости. Её состав определяется с помощью конноды bd: точка d отвечает составу х. Дальнейшее нагревание системы (отрезок bz) - это нагревание пара в отсутствие жидкости. Таким образом, кипение жидкости происходит в интервале температур Тх - Тх`, а составы жидкой и паровой фаз при кипении непрерывно изменяются и в конце кипения сильно отличаются от первоначальных. Следует только помнить, что в замкнутом сосуде общий состав системы «жидкость + пар» остаётся постоянным при любой температуре, как ниже точки закипания, так и выше точки окончания кипения. При охлаждении горячего пара (начиная от точки z) в системе будут происходить обратные явления. Когда температура опустится до Тх`, начнётся конденсация пара и появится первая капля жидкости с составом х`. Дальнейшее охлаждение до температуры Тх (отрезок ba) приводит к появлению всё большего количества жидкости в результате непрерывной конденсации пара. Наконец, при температуре Тх исчезает последний пузырёк пара с составом у и кипение заканчивается. Дальнейшее понижение температуры приводит к охлаждению жидкой системы. 7.8. Второй закон Коновалова Второй закон Коновалова, открытый одновременно с первым, относится к бинарным системам, диаграммы состояния которых имеют 119 экстремум на кривой общего давления пара, т. е. к растворам с большими отклонениями от закона Рауля. Он читается так: Экстремумы на кривых полного давления пара (или температур кипения) отвечают такому равновесию раствора и насыщенного пара, при котором составы обеих фаз одинаковы. Согласно второму закону Коновалова на диаграммах кипения “температура состав”, имеющих экстремумы (максимумы при отрицательных и минимумы при положительных отклонениях от закона Рауля), обе кривые - линия пара и линия жидкости должны соединяться в Рис. 7.5. Диаграммы кипения для раствора с большими положительными (а) и отрицательными (б) отклонениями от закона Рауля точке экстремума (рис. 7.5): Т Т Т ликвидусов Т Если через р = const точки касания и рлинии = const пара провести вертикальные линии (пунктир на рис. 7.5 а и б), то эти диаграммы можно Ткип А Т представить как бы составленными кип из Адвух частей, каждая из которых аналогична диаграмме, показанной на рис. 7.4. Ткип В Ткип В 120 А х В состав, мол. доли А х состав, мол. доли В В соответствии со вторым законом Коновалова с раствором, состав которого отвечает точке соприкосновения ликвидуса с линией пара на диаграмме кипения, находится в равновесии пар такого же состава. Состав х таких растворов при испарении не изменяется, и они кипят при постоянной температуре. Такие растворы называются нераздельнокипящими, азеотропными или просто азеотропами. Из известных жидкостей очень многие при смешении друг с другом дают азеотропы. Состав азеотропа и его температура кипения при нормальном атмосферном давлении являются константами; они приводятся в справочных таблицах. Примеры азеотропных смесей: Компоненты Температура кипения, оС A A B B Состав азеотропа, азеотроп масс. % В С минимумом температуры кипения H2O C2H5OH 100 78,3 78,15 95,57 CHCl3 C2H5OH 61.2 78,3 59,3 6,8 С максимумом температуры кипения H2O НCl 100 85 110 20,3 H2O HNO3 100 86 120,5 68 7.9. Правило рычага При количественных расчётах фазовых равновесий нередко возникает задача определить, в каких относительных количествах образуются жидкая и паровая фазы при кипении системы с заданным исходным составом. Для решения этой задачи удобно пользоваться правилом рычага. Рассмотрим правило рычага на диаграмме кипения (рис. 7.6.). Например, имеется жидкая бинарная смесь с составом х. После начала её кипения система разделяется на кипящую жидкость и пар. Их состав 121 определяется, как было показано выше, с помощью конноды, соединяющей линию пара с ликвидусом. z Т Т р = const Ткип А k l Тх m Тх Ткип В А х` х у В состав, мол. доли Рис. 7.6. Правило рычага для бинарной жидкостной смеси, не образующей азеотропа Так, при температуре Тх состав жидкой фазы х`, а состав пара - у. Если проследить перемещение фигуративной точки по вертикальной линии хz, можно увидеть, что чем выше температура и, следовательно, чем больше в системе жидкости и меньше пара, тем короче будет отрезок конноды, упирающийся в линию пара, и тем длиннее отрезок, упирающийся в линию жидкости. Иными словами, длины отрезков, на которые разделяется коннода при каждой данной температуре, обратно пропорциональны массам жидкости и пара: mж lm = (при температуре Тх) mп kl Это соотношение является математическим выражением правила рычага для бинарных систем: Точка, отвечающая составу гетерогенной системы при каждой данной температуре, делит соответствующую конноду на отрезки, длины которых обратно пропорциональны количествам каждой из фаз. 122 7.10. Перегонка бинарных жидкостных смесей Перегонка (иначе - дистилляция) - метод разделения жидких смесей, основанный на различии составов жидкости и образующегося из неё пара. Осуществляется перегонка путём испарения жидкости и отвода образующегося пара с последующей его конденсацией. В фармации перегонка используется для очистки и выделения из смесей растворителей и экстрагентов (дистиллированная вода, этанол, ацетон, уксусная кислота, этиловый эфир, бензин, хлороформ, хлористый метилен и др.) Перегонная установка состоит из обогреваемой ёмкости (“куба”), конденсатора (“холодильника”) и одной или нескольких ёмкостей для конденсата (“приёмников”). На практике принято проводить дистилляцию при постоянном давлении путём повышения температуры кипения жидкостной смеси, хотя в принципе можно перегонять жидкости с помощью уменьшения давления при постоянной температуре. Рассмотрим процесс перегонки с помощью диаграммы “температура - состав” (рис. 7.7). Возьмем жидкую смесь состава х, поместим её в перегонную колбу и станем нагревать. Смесь закипит при температуре, соответствующей достижению фигуративной точкой ликвидуса (точка а). При этой температуре образуется пар состава у. В соответствии с первым законом Коновалова пар богаче более летучим компонентом. Если этот пар отогнать и полностью сконденсировать, то получится жидкость состава у. Оставшаяся в кубе жидкость по сравнению с начальным составом обогащена менее летучим компонентом и поэтому температура её кипения повышается. При продолжении нагревания кубовой смеси с непрерывной отгонкой и конденсацией пара можно добиться того, что в кубовом остатке будет находиться практически чистый менее летучий компонент А. 123 z Т Т р = const Ткип А a b c d Ткип В А х у у` В состав, мол. доли Рис. 7.7. Перегонка бинарной жидкостной смеси, не образующей азеотропа Более летучий компонент В при такой простой перегонке получить в чистом виде нельзя, так как он весь уходит в пар, а затем конденсируется вместе с каким-то количеством высококипящего компонента А. При фракционной перегонке цикл кипения и конденсации повторяется несколько раз. Если конденсат с составом у из последнего примера снова нагреть, его кипение начнётся при температуре, определяемой точкой с. Образующийся пар состава у` (точка d) ещё более обогащён летучим компонентом. Этот пар отгоняется и конденсируется, а затем подвергается новой перегонке и т. д. В результате после многократного фракционирования (отбора порций конденсата - фракций, кипящих при какой-то определённой температуре или в небольшом интервале температуры) и последующей перегонки каждой их них можно получить практически в чистом виде оба компонента. Если для тех или иных целей в лаборатории требуется получать только одну фракцию с заданной температурой кипения, то в перегонный аппарат между кубом и холодильником помещается дефлегматор. Он представляет собой стеклянную трубку с перемычками, образованными тремя - четырьмя соприкасающимися вмятинами в стенках. 124 При прохождении пара по дефлегматору он конденсируется на этих перемычках. В пространстве между вмятинами при этом образуются висячие капли фракций определённого состава. Подбирая опытным путем длину дефлегматора и число перемычек, можно добиться того, что в холодильник будет проходить пар с требуемым составом. В промышленности широко используется такая разновидность фракционной перегонки, как ректификация, разделение жидких смесей в перегонной (ректификационной) колонне. Такая колонна представляет собой увеличенный вариант дефлегматора, причём роль перемычек играют так называемые “тарелки”, т. е. горизонтальные плоскости, перекрывающие просвет колонны. Пар поднимается с нижних тарелок на верхние через патрубки, закрытые колпачками, края которых погружены в жидкость, находящуюся на тарелке. У колпачков двойное назначение: во-первых, они не дают возможности конденсату и пару проникнуть вниз, а во-вторых, заставляют пар пробулькивать (барботировать) сквозь жидкость и оставлять в нём часть, которая имеет тот же состав и температуру кипения, что и конденсат. С помощью специальных кранов с каждой тарелки можно отбирать фракцию с определённым составом и с соответствующей температурой кипения. Избыток накапливающегося на тарелках конденсата может стекать на нижние тарелки через сливные патрубки. Колонна конструируется на основе диаграммы кипения для данной смеси, подлежащей разделению. Число тарелок в колонне равно числу коннод, необходимых для полного разделения смеси (на рис. 7.7 это отрезки аb и cd). Это число “ступенек” называется числом теоретических тарелок. Расстояние между тарелками рассчитывается так, чтобы источник нагрева, расположенный в нижней части колонны, мог обеспечить на каждой тарелке нужную температуру. 7.11. Разделение азеотропных смесей Азеотропные смеси при перегонке ведут себя подобно индивидуальным жидкостям, т. е. они кипят при постоянной температуре и не могут быть разделены на составные части дистилляцией из-за одинакового состава жидкой и паровой фаз. В том случае, когда жидкости, входящие в перегоняемую смесь, образуют азеотроп, ход дистилляции будет зависеть от исходного состава бинарного раствора, но в любом случае из 125 него могут быть выделены только азеотроп и тот из компонентов, который присутствует в избытке по сравнению с составом азеотропной смеси. Азеотропные смеси образуются почти половиной из исследованных бинарных растворов. В связи с этим часто возникает практическая проблема выделения из азеотропов индивидуальных компонентов. В фармации это связано, например, с приготовлением абсолютного этилового спирта из спирта-ректификата (состав см. в п. 7.8), получаемого в промышленности. Для разделения азеотропных смесей используются различные методы: 1) Перегонка при давлении, отличающемся от атмосферного. Поскольку свойства растворов, а, следовательно, и вид диаграммы кипения зависят от давления, то во многих случаях можно подобрать такое давление, при котором данная пара жидких компонентов не образует азеотропа. Если при таком давлении проводить фракционную перегонку, то из смеси можно выделить оба компонента в чистом виде. 2) Химическое связывание. Наиболее часто для выделения из азеотропа мажорного компонента применяется химическое связывание минорного, особенно тогда, когда этот последний не представляет большой ценности. Так, для получения абсолютного (100%-ного) спирта спирт-ректификат обрабатывается водоотнимающими средствами - безводными CuSO4, CaO, BaO и др., - прочно связывающими воду, но химически не реагирующими со спиртом. После такой обработки при длительном нагревании вода связывается соответственно в кристаллогидрат или в гидроксид, При перегонке из смеси отгоняется практически чистый этанол. Так как абсолютный спирт очень гигроскопичен, он должен храниться в условиях, исключающих его контакт с водяными парами. 3) Образование тройных азеотропов. Минорный компонент смеси можно связать вместе с частью мажорного в тройной азеотроп при добавлении третьей жидкости. Например, вода, этиловый спирт и бензол могут образовать тройной азеотроп с составом 74% бензола + 19% этанола + 126 7% воды и с Ткип 65оС. При таком способе к спирту-ректификату добавляется точно рассчитанное количество бензола, достаточное для связывания всей воды. В результате перегонки такой смеси вначале отгоняется весь тройной азеотроп, а в кубовом остатке накапливается практически чистый этиловый спирт. 7.12. Ограниченно растворимые жидкости Если отклонения давления пара раствора от закона Рауля очень велики и превосходят некоторую критическую величину, то в системе, образованной двумя жидкостями, при изменении температуры возникает новое явление расслаивание раствора на две несмешивающиеся жидкие фазы. Чаще всего эти фазы содержат оба компонента, но в разном соотношении. Обычно при начале расслаивания одна из фаз выделяется в виде мельчайших капель, так что система представляет собой эмульсию. При длительном стоянии капли эмульсии сливаются и система разделяется на два слоя. Концентрация каждого компонента в обеих фазах обусловлена взаимной растворимостью жидкостей друг в друге при данной температуре. То есть, такие равновесные фазы, представляют собой насыщенные растворы одного компонента в другом (насыщенный раствор А в В и насыщенный раствор В в А). Они называются сопряжёнными фазами или сопряжёнными растворами. В зависимости от природы веществ с изменением температуры растворимость их друг в друге может или увеличиваться, или уменьшаться. При определённых температурах в таких системах наблюдается разрыв растворимости - интервал концентраций, в котором гомогенный раствор неустойчив и не может образоваться. Жидкости, способные к полному взаимному растворению при одних температурах и к ограниченному смешиванию при других называются ограниченно растворимыми. С ростом температуры в большинстве случаев границы растворимости сближаются, и интервал расслаивания уменьшается. При строго 127 определённой для каждой пары жидкостей температуре, называемой верхней критической температурой сопряжённых фаз становятся растворения (КТР) одинаковыми, и составы система обеих обретает гомогенность. К таким системам относятся, например, смеси вода нитробензол, вода - фенол, вода - анилин. Существуют пáры жидкостей, взаимная растворимость которых увеличивается с понижением температуры (как правило, это смеси воды с различными аминами - например, с триметиламином, а также с коллидинами (триметилпиридинами). В системах, образованных такими жидкостями, наблюдается нижняя КТР. Кроме того, известны системы с двумя КТР - верхней и нижней. В этих системах область ограниченной растворимости жидкостей существует в каком-то определённом интервале температуры. К таким системам относится, например, система вода - никотин. Однако экспериментальное наблюдение двух КТР в этой смеси затруднено, так как это возможно при очень высоких давлениях, позволяющих сохранить систему жидкой при температурах выше 450 К (177оС). Для фармации данные об ограниченной растворимости и о КТР важны при приготовлении многокомпонентных лекарственных форм, содержащих две и более жидкости. Области ограниченной и полной растворимости жидкостей могут быть определены с помощью диаграмм растворения. 7.13. Диаграммы растворения. Правило Алексеева Зависимость взаимной растворимости жидкостей от температуры принято изображать на диаграммах состояния, называемых диаграммами растворения (или растворимости). Каждая такая диаграмма строится координатах “температура - состав” при заданном постоянном давлении. 128 в 7.13.1. Системы с верхней критической температурой растворения Типичная диаграмма растворения для таких систем показана на рис. Рис. 7.8. Диаграмма растворения для системы с верхней критической температурой растворения 7.8. Т y p = const Т Линия akb (линия расслоения) разделяет 1 два фазовых поля: вне k Ткр гомогенных бивариантных систем иТвнутри кр кривой поле 1 - поле кривой поле Т3 2 - поле гетерогенных mмоновариантных систем, состоящих из двух n Т2 сопряжённых фаз. Составы сопряжённых растворов можно определить с 2 помощью коннод, а именно по точкам пересечения q их с линией расслоения. p Т1 Т1 Так, при температуре Т1 коннода pq показывает, что сопряжённые растворы имеют составы p` и q`, а при температуре Т2 - коннода mn отвечает составам m` и n`. Точки p` и m` соответствуют растворам вещества В в веществе А, а А a p` А m` в хВ. Видно, n` b ниже В температура, тем точки n` и q` - растворам чтоq`чем состав, мол. доли больше различие составов сопряжённых фаз. Причём эти составы не зависят 129 от абсолютного содержания компонентов в смеси, а зависят только от температуры. Нагревание системы отображается перемещением фигуративной точки, отвечающей общему составу системы, вверх. Так, например, для системы с общим составом х - движением по линии ху. Пока фигуративная точка находится ниже кривой расслоения, система гетерогенна и состоит из двух фаз. При температуре Т1 система распадается на сопряжённые растворы с составами p` и q`, при температуре Т2 - на растворы с составами m` и n`. По мере повышения температуры составы сопряжённых фаз всё более сближаются друг с другом, и когда фигуративная точка достигает линии расслоения при температуре Т3, они становятся одинаковыми. При этом система становится гомогенной (происходит гомогенизация), так как выше этой температуры наступает полное смешивание компонентов. Температура Т3 называется температурой гомогенизации. Выше Т3 система будет оставаться гомогенной вплоть до температуры, при которой начнётся кипение. Охлаждение, отображаемое движением фигуративной точки вниз по линии ух, сопровождается температуры Т3 (теперь обратными её явлениями. логичнее При назвать достижении температурой гетерогенизации) происходит гетерогенизация - разделение гомогенного раствора на две сопряжённые фазы. Дальнейшее охлаждение (вплоть до отвердевания) приводит к перераспределению компонентов между сопряжёнными растворами таким образом, что их составы всё более отличаются друг от друга. Точка k, находящаяся в максимуме кривой расслоения, отвечает верхней критической температуре растворения Ткр. Выше этой температуры системы с любым соотношением компонентов А и В находятся в гомогенном состоянии. При температурах, лежащих ниже КТР, состояние системы будет зависеть от её состава. Например, при температуре Т1 в области 130 концентрации вещества В от 0 до р` система гомогенна. Если к ней добавить какое-то количество В, то фигуративная точка, передвигающаяся при этом по горизонтальной линии - изотерме Т1 Т1, попадёт в гетерогенную область диаграммы растворения, что отвечает расслоению системы на два сопряжённых раствора с составами p` и q`, причём подавляющая часть системы находится в виде фазы p. Дальнейшее увеличение содержания компонента В в системе приводит к изменению массы каждой из сопряжённых фаз - масса фазы p` уменьшается, а масса фазы q` увеличивается. Составы же обеих фаз остаются неизменными при данной температуре. Когда содержание компонента В в общем составе системы превысит q`, фаза p` исчезает, фигуративная точка выходит в гомогенную область и вновь наступает полная смешиваемость компонентов. Составы сопряжённых растворов и критическая температура растворения находятся между собой в определённой зависимости, которая описывается правилом В.Ф.Алексеева (1876): Середины коннод, соответствующих различным температурам, лежат на одной прямой, идущей от критической точки. С учётом того, что середина конноды отвечает среднему арифметическому из состава сопряжённых растворов, правило Алексеева может быть сформулировано и так: Среднее арифметическое из состава равновесных жидких фаз является линейной функцией температуры; точка пересечения этой линии с кривой расслоения отвечает критической температуре растворения. Если кривая расслоения в области критической температуры растворения не имеет чётко выраженного максимума, КТР может быть определена с помощью правила Алексеева, как показано на рис. 7.9. Как уже говорилось, конноды pq, mn и rs, являющиеся отрезками изотерм соответственно при Т1, Т2 и Т3, позволяют определить составы сопряжённых растворов, находящихся в равновесии при этих температурах: это соответственно p` и q`, m` и n`, r` и s`. Точки a, b и с, являющиеся 131 геометрическими серединами коннод, отражают среднее арифметическое из составов сопряжённых растворов. Как видно, они лежат на прямой линии lk, которая пересекает кривую расслоения в точке максимума, соответствующей КТР. Т p = const Т Ткр k Ткр Т3 r m Т2 Т1 c Т3 s b a p Т2 n q Т1 l А p`m`r` s`n`q` В состав, мол. доли Рис. 7.9. Иллюстрация правила Алексеева на диаграмме растворения для системы с верхней КТР 7.13.2. Системы с нижней критической температурой растворения Типичная диаграмма растворения для таких систем приведена на рис. 7.10. 132 Т Т p = const 2 1 А В состав, мол. доли Рис. 7.10. Диаграмма растворения для системы с нижней критической температурой растворения Как и для систем с верхней КТР, фазовое поле 1 отвечает области гомогенных систем, т. е. полной взаимной растворимости компонентов. Фазовое поле 2 отвечает гетерогенной области, когда в равновесии находятся сопряжённые растворы с определёнными составами. К таким системам тоже приложимо правило Алексеева, с той разницей, что критическая температура определяется по минимуму на кривой расслоения. 7.13.3. Системы с верхней и нижней критическими температурами растворения Типичная диаграмма растворения для таких систем изображена на рис. 7.11. Кривая расслоения представляет собой замкнутую линию, заключающую внутри себя фазовое поле гетерогенных систем 2. Вне кривой находится фазовое поле гомогенных систем, окружающее её со всех сторон. Правило Алексеева применимо и к таким системам, только для определения верхней КТР следует проводить конноды в самой верхней части кривой, а для определения нижней КТР - соответственно в самой нижней. 133 Т Т p = const 2 А 1 В состав, мол. доли Рис. 7.11. Диаграмма растворения для системы с верхней и нижней критическими температурами растворения 134 7.14. Растворы нелетучих веществ. Коллигативные свойства растворов В отличие от рассмотренных выше растворов, состоящих из двух летучих компонентов, растворы нелетучих веществ в летучих растворителях обладают некоторыми особенностями. Так, нелетучее растворённое вещество не вносит заметного вклада в общее давление пара и поэтому пар над таким раствором образован практически одним растворителем. Например, давление пара сахарозы над разбавленным водным раствором равно 1023 атм, что позволяет при практических расчётах его не учитывать. В большинстве случаев в таких растворах имеет место значительное взаимодействие разнородных молекул, благодаря чему наблюдаются существенные отклонения от закона Рауля. Поэтому закон Рауля применим к таким растворам только в области очень малых концентраций растворённого вещества. Из-за неспособности растворённого вещества переходить в пар облегчается разделение компонентов растворов перегонкой или выпариванием при низких температурах. В этом разделе кроме собственно понижения давления пара мы рассмотрим некоторые практически важные свойства растворов нелетучих веществ: повышение замерзания температуры (плавления) и осмос. кипения, Эти понижение свойства температуры обычно называют коллигативными (или коллективными). Это означает, что они связаны только с числом молекул растворённого вещества в системе и не зависят от его природы - химических свойств, размеров и конфигурации молекул и др. Одной из главных причин, обусловливающих коллигативные свойства растворов, является понижение давления пара растворителя над раствором. 135 7.15. Понижение температуры замерзания растворов. Криометрия Хорошо известно, что растворы замерзают при более низкой температуре, чем чистый растворитель. Причиной понижения температуры замерзания (как и повышения температуры кипения) растворов является уменьшение давления пара, что можно проиллюстрировать с помощью диаграммы состояния воды (рис. 7.12). р 2 1 1 атм Тзам Тозам Токип Ткип. Т Рис. 7.12. Понижение давления пара воды над раствором Сплошные линии выражают границы фазовых полей для чистой воды. Напомним, что линия 1 отображает равновесие “жидкость - пар”. После добавления к воде нелетучего растворённого вещества давление пара над раствором (пунктирная линия 2) понижается при любой температуре. Любая жидкость будет замерзать (отвердевать) тогда, когда давление пара над ней сравнивается с давлением пара над твёрдой фазой (в случае воды - надо льдом). Поэтому и температура замерзания раствора Тзам будет меньше, чем температура замерзания Тозам чистого растворителя воды. Ф.М.Рауль (1883) опытным путём установил, что понижение температуры замерзания (иначе - депрессия замерзания) Tзам = Тозам Тзам , вызываемое разными растворёнными веществами, взятыми в одинаковых молярных количествах, одинаково для данного растворителя. Так, для 0,1m 136 водных растворов некоторых веществ наблюдаются следующие температуры затвердевания: Вещество Tзам, oC Пероксид водорода H2O2 0,186 Метиловый спирт CH3OH 0,181 Этиловый спирт C2H5OH 0,183 Сахароза C12H22O11 0,186 Декстроза C6H12O6 0,188 При различных концентрациях растворённых веществ Tзам пропорционально их моляльной концентрации m: Tзам = Ккрm (7.1) Коэффициент пропорциональности Ккр в уравнении (7.1), называемый криоскопической константой, представляет собой молярное понижение температуры замерзания. Эта величина численно равна понижению температуры замерзания раствора, содержащего 1 моль растворённого вещества в 1 килограмме растворителя при условии, что раствор обладает свойствами идеального. Криоскопическая константа является характеристикой растворителя, её величина не зависит от природы растворённого вещества. Моляльная концентрация может быть выражена через массы растворённого вещества (b) и растворителя (а) в граммах (см. п. 7.3): 1000 b m = , Ма где М - молярная масса растворённого вещества (г/моль). Подставляя это выражение в уравнение (7.1), получим 1000 Ккр b Tзам = , Ма 137 Из этого уравнения следует одно очень важное обстоятельство, а именно: зная точный состав разбавленного раствора и измеряя температуры замерзания чистого растворителя и раствора, можно рассчитать молярную массу растворённого вещества: Уравнение 1000 Ккр b М = . (7.2) Tзам а лежит в основе криоскопического (или (7.2) криометрического) метода определения молярной массы веществ по понижению температуры замерзания их растворов. Криометрический метод находит широкое применение в лабораторной практике, в том числе и в фармации. Принцип его заключается в следующем. Вначале измеряется температура плавления (или замерзания) точной навески а выбранного растворителя. Затем к растворителю добавляется точная навеска исследуемого вещества b и измеряется температура плавления полученной смеси (или температура замерзания, если вещество, выбранное в качестве растворителя, имеет низкую температуру плавления). Навеска растворённого вещества должна быть намного меньше, чем навеска растворителя, чтобы раствор получился разбавленным. Полученное значение Tзам подставляется в уравнение (7.2) и с его помощью вычисляется молярная масса исследуемого вещества. В простейшем случае в качестве растворителя может быть взята дистиллированная вода. Однако из-за малого значения криоскопической константы и низкой температуры замерзания, требующей применения криостатов или специальных охлаждающих смесей, вода применяется лишь для приблизительной оценки молярной массы веществ. Как правило, в особенности при изучении сложных органических веществ с большой молярной массой, в качестве растворителей выбираются другие вещества. При этом особое значение имеет камфора с её большой криоскопической константой. Главным условием для криометрического 138 определения является полная растворимость исследуемого вещества в выбранном растворителе. Ниже приведены криоскопические константы некоторых веществ (при нормальном атмосферном давлении): Тпл оС Криоскопическая Вещество константа Ккр Вода 0 1,86 Бензол 5,5 5,12 Уксусная кислота 16,8 Циклогексан Камфора 3,90 6,5 20 178,5 39,7 Криоскопический метод используется и для определения чистоты веществ. Это основано на том, что присутствие даже небольшой примеси снижает температуру плавления образца исследуемого вещества. Поэтому в химии (а также и в фармации) одним из критериев чистоты вещества является достижение максимальной температуры плавления, не возрастающей более после дополнительных операций очистки. Ещё одно важное применение криоскопического эффекта - приготовление охлаждающих смесей. При определённом соотношении воды (или снега) и некоторых неорганических солей можно получить низкие температуры, удерживающиеся в течение достаточно длительного времени. Например, смесь, состоящая из 100 г снега и 143 г CaCl26Н2О, позволяет получить температуру 55оС. В районах с холодным климатом в воду, используемую в автомобильных радиаторах, для предотвращения её замерзания зимой добавляются антифризы такие вещества как спирт, глицерин или этиленгликоль. Лёд, намёрзший на проезжей части дорог и на тротуарах, легко плавится, когда его посыпают поваренной солью или золой, что тоже основано на криоскопическом эффекте. Следует только помнить, что 139 неумеренное применение в этих целях соли может вызвать засоление близлежащих водоёмов и почв на их берегах и, как следствие, экологические нарушения. 7.16. Повышение температуры кипения растворов. Эбулиометрия Кипение растворов, как и чистых жидкостей, начинается при температуре, соответствующей достижению общего давления пара, равного атмосферному. Из рассмотрения диаграммы состояния воды (рис. 7.12), следует, что в случае раствора это достигается при более высокой температуре, чем в случае чистой воды. Как и понижение температуры замерзания (плавления), повышение температуры кипения растворов по сравнению с чистым растворителем Ткип = Ткип Токип пропорционально моляльной концентрации растворенного вещества: Ткип = Кэm где Кэ - эбулиоскопическая (эбулиометрическая) константа или молярное повышение температуры кипения. Она численно равна повышению температуры кипения раствора, содержащего 1 моль растворенного вещества в 1 килограмме растворителя при условии, что раствор обладает свойствами идеального. Эбулиоскопическая константа, как и криоскопическая, является характеристикой растворителя, и её величина не зависит от природы растворённого вещества. Повышение температуры кипения раствора может быть использовано для расчёта молярной массы растворённого вещества эбулиометрическим (эбулиоскопическим) методом по уравнению (7.3), подобному тому, которое используется в криометрии. Обозначения в уравнении (7.3) аналогичны обозначениям, использованным в уравнении (7.2). 1000 Кэ b М = . Tзам а 140 (7.3) Эбулиоскопический метод заключается в следующем. Сначала определяется температура начала кипения точной навески жидкости, выбранной в качестве растворителя. Температура кипения измеряется в момент появления первых пузырьков пара. Затем к растворителю добавляется точная навеска исследуемого вещества (как и при криоскопическом методе, небольшая, чтобы раствор был разбавленным) и измеряется температура начала кипения полученного раствора. Полученное по разности значение Tкип подставляется в уравнение (7.3) и с его помощью вычисляется молярная масса исследуемого вещества. Следует отметить, что из-за меньших значений эбулиоскопических констант по сравнению с криоскопическими значения Tкип для одного и того же раствора оказываются меньше, чем значения Tзам. Кроме того, если при криометрических измерениях природа растворённого вещества не сказывается на результатах, при эбулиометрии можно исследовать только практически нелетучие вещества, не искажающие общую картину давлением своих паров. Однако даже в случае практически полной собственной нелетучести растворённого вещества, какая-то его часть при кипении механически выбрасывается в пар поднимающимися пузырьками. Это приводит к увеличению ошибки определения и значительно сужает область применения эбулиометрии. Водные растворы кипят при более высокой температуре, чем вода, и это обстоятельство следует учитывать при практической деятельности, например, при стерилизации растворов, при приготовлении пищи и т. п. Из-за эбулиоскопического эффекта попавшие на кожу кипящие растворы, особенно концентрированные (например, рассолы, сиропы, а также молоко), могут вызвать гораздо более тяжёлые ожоги и повреждения, чем кипящая вода. 7.17. Осмос Осмос - явление самопроизвольного перехода растворителя через полупроницаемую мембрану, разделяющую два раствора или раствор и чистый растворитель. Причиной осмоса является различие химических потенциалов растворителя по обе стороны полупроницаемой мембраны и стремление системы к выравниванию его концентрации в растворах, находящихся по обе стороны полупроницаемой мембраны. Явление осмоса впервые было описано в 1748 г. французским исследователем Нолле. Первые количественные измерения осмоса были 141 осуществлены в 1877 г. немецким ботаником В.Пфеффером. На этих измерениях была основана теория осмотического давления, созданная позднее Я.Вант-Гоффом. Явление осмоса можно продемонстрировать следующим образом. Для опыта необходимо изготовить сосуд, дно которого заменено полупроницаемой мембраной. Полупроницаемая мембрана – это перегородка или плёнка с мельчайшими порами, через которые могут диффундировать молекулы растворителя и не могут молекулы или ионы растворённого вещества. Если такой сосуд с раствором какого-либо вещества поместить в другой сосуд, заполненный чистым растворителем, как показано на рис. 7.13, то можно заметить, что через некоторое время уровень жидкости во внутреннем сосуде 1 повысится, а во внешнем 2 - понизится. Аналогичное явление будет наблюдаться и тогда, когда во внешнем сосуде находится не чистый растворитель, а раствор того же вещества, что и во внутреннем сосуде, но с меньшей концентрацией. При осмосе растворитель всегда диффундирует в сторону раствора с большей концентрацией растворённого вещества. Прибор, схематическое устройство которого показано на рис. 7.13, называется осмометром. В качестве мембран для осмометров используют различные природные и искусственные пленки (пергамент, плавательный пузырь рыб, целлофан и др.). Мембраны могут быть и неорганической природы, например, из тонких пластин неглазурованного фарфора, в порах которого осаждают гексацианоферрат (II) меди Cu2Fe(CN)6. Такие мембраны достаточно прочны и могут выдерживать высокие давления. Верхняя часть внутреннего сосуда осмометра обычно делается в виде узкой трубки, для того, чтобы поднятие уровня жидкости было более заметным. Для измерения высоты поднятия на трубку наносятся деления в виде вертикальной шкалы. 142 1 2 Рис. 7.13. Иллюстрация осмотического эффекта 7.17.1. Осмотическое давление Высота поднятия жидкости во внутреннем сосуде осмометра не зависит от природы растворённого вещества, но зависит от его концентрации и от температуры, а именно: чем больше концентрация вещества и чем выше температура, тем выше поднимается уровень жидкости. Осмос продолжается не бесконечно, через какое-то время он останавливается. Если мембрана разделяет два раствора с различной, но не намного отличающейся концентрацией, осмос будет идти до практически полного выравнивания концентрации каждого из компонентов по обе стороны мембраны. Если же мембрана разделяет раствор и чистый растворитель или два раствора с сильно отличающимися концентрациями, осмос остановится из-за того, что ему будет препятствовать гидростатическое давление поднимающегося столба жидкости. При остановке осмоса в системе наступает динамическое равновесие, характеризующееся равенством скоростей диффузии растворителя через мембрану в обоих направлениях. Вообще осмос можно приостановить любым давлением, направленным противоположно ему. Очевидно, что давление, необходимое для остановки осмоса, равно по величине тому давлению, которое оказывают при диффузии через мембрану молекулы растворителя. Это избыточное гидростатическое давление, 143 возникающее в результате осмоса, называется осмотическим давлением. Осмотическое давление обозначается буквой ; размерность его в системе СИ - Па, но на практике часто используется и внесистемная единица атм. Если два раствора обладают одинаковым осмотическим давлением, их называют изотоническими. Когда осмотические давления растворов различны, тот раствор, у которого осмотическое давление больше, называется гипертоническим, тот у которого оно меньше - гипотоническим. В 1887 г. Я.Вант-Гофф вывел уравнение, связывающее осмотическое давление раствора неэлектролита с его концентрацией: = CRT (7.4) где С - молярная концентрация растворённого вещества. Кажущееся сходство между этим уравнением и уравнением состояния идеального газа pV = nRT первоначально привело Вант-Гоффа к предположению о том, что осмотическое давление - результат ударов молекул растворённого вещества (ведущих себя так же, как молекулы в газовой фазе), о полупроницаемую мембрану. Позже выяснилось, что это объяснение ошибочно. И хотя многое в природе осмоса до сих пор ещё не ясно, все же твёрдо установлено, что осмос - результат неравенства химического потенциала растворителя по обе стороны полупроницаемой мембраны. 7.17.2. Осмометрия Так как молярная концентрация С представляет собой число молей вещества n, содержащееся в литре раствора, а n в свою очередь равно массовому количеству вещества m, делённому на его молярную массу: n = m/М , 144 то осмометрические измерения можно использовать для определения молярной массы растворённого вещества. Подставляя это значение С в (7.4) : m = RT, M и решая его относительно М, получаем уравнение m M = RT, лежащее в основе осмометрического метода определения молярной массы растворённого вещества. Для низкомолекулярных неорганических и органических соединений осмометрический метод обычно не дает преимуществ по сравнению с другими методами, например, с криометрическим. Однако в случае высокомолекулярных веществ, как правило, образующих растворы с очень малыми молярными концентрациями, осмометрия оказывается достаточно чувствительной и полезной. Именно при помощи этого метода Адером в 1925 г. была впервые достоверно определена молярная масса гемоглобина, равная 68000, что впоследствии было подтверждено при помощи других физико-химических методов. 7.17.3. Значение осмотических явлений Осмос играет важную роль в растительных и животных организмах, способствуя оводнению клеток и межклеточных структур. Оболочки клеток представляют собой полупроницаемые мембраны. Если клетки, например, эритроциты, поместить в дистиллированную воду, то из-за осмоса, направленного внутрь клеток (эндоосмос), они довольно быстро увеличиваются в размерах. В конце концов это приводит к тому, что клетки разрываются, так как оболочки не выдерживают развивающегося внутри них давления. Такое явление в общем случае носит название лизис, а в случае эритроцитов - гемолиз. Если же клетки поместить в концентрированный 145 раствор какой-либо нейтральной соли, например, NaCl, то наблюдается, наоборот, выход воды из клеток наружу (экзоосмос), приводящий к их сморщиванию (плазмолизу). И лизис, и плазмолиз приводят к гибели клеток. Человеческий организм, как и организмы животных и растений, характеризуется гомеостазом ряда физико-химических показателей внутренней среды, в том числе и осмотического давления крови. При температуре 37оС осмотическое давление крови, лимфы, тканевых жидкостей человека составляет 7,4 7,8 атм (7,5 7,9105 Па). Колебания внутри этого интервала обусловлены индивидуальными особенностями. Постоянство осмотического давления в организме называется изоосмией. Поддерживается осмотическое давление на нужном уровне выделением избыточного количества воды почками, лёгкими, кожей (с потом) или, наоборот, задержкой воды в организме при её недостатке. Нарушение изоосмии оказывается губительным для организма гораздо раньше, чем наступает плазмолиз или лизис клеток. Снижение осмотического давления введением больших избытков воды или в результате интенсивной потери солей, например, с потом, вызывает рвоту, судороги, затемнение сознания и т. п., вплоть до гибели организма. Повышение же осмотического давления при введении больших количеств солей приводит к перераспределению воды в тканях, к их общим и местным отёкам (в тяжёлых случаях называемым “водянкой”). Осмотическое давление жидкостей организма обусловлено суммарной концентрацией растворённых в них веществ, как низкомолекулярных (органических и неорганических), так и высокомолекулярных. Вклад растворённых в плазме крови белков в её осмотическое давление называется онкотическим давлением. Оно обычно составляет 0,25 0,4 атм и, несмотря на малую величину, играет значительную роль в регуляции диффузии воды из крови в прилегающие ткани и обратно. 146 Хотя в организме есть механизм, поддерживающий изоосмию, тем не менее, местные изменения осмотического давления (например, в случае введения в организм неизотонированных растворов при внутривенных вливаниях, при введении глазных капель и т. п.) могут вызывать отрицательные, часто необратимые явления. В медицине и фармации растворы обычно считаются изотоническими, гипер- и гипотоническими по отношению к плазме крови. В организм человека и животных в лечебных целях можно вводить в больших количествах изотонических только изотонические инъекционных растворы. растворов следует При чётко приготовлении выдерживать концентрацию лекарственного вещества в соответствии с уравнением (7.4), или в качестве растворителя применять специальные изотонические растворы, часто называемые физиологическими растворами. Простейший из них - 0,9 %-ный (0,15 М) раствор хлорида натрия. Так как инъекционные и инфузионные растворы, глазные, ушные, носовые капли и другие жидкие лекарственные формы во многих случаях содержат более двух компонентов, при их приготовлении следует учитывать так называемую осмолярную концентрацию - суммарную молярную концентрацию всех компонентов раствора независимо от их природы. Если в состав раствора входят электролиты, при вычислении осмолярной концентрации следует учитывать вклад в осмотическое давление образующихся при диссоциации ионов, как будет показано далее при рассмотрении коллигативных свойств растворов электролитов. В клинической практике применяются и гипертонические растворы, например, внутривенные при лечении глаукомы или в виде гипертонических повязок для очищения гнойных ран. Существенную роль явление осмоса играет в действии слабительных средств (глауберова соль Na2SO410H2O, горькая соль MgSO4, фенолфталеин и т. п.). Оно основано на том, что ионы SO42 и органические анионы, 147 содержащиеся в них, своим воздействием на стенки кишечника препятствуют всасыванию ионов натрия, а это вызывает значительный осмотический отток воды из крови в просвет кишечника. Широко известно использование гипертонических растворов для консервирования пищевых продуктов. В рассолах и сахарных сиропах повышенное осмотическое давление вызывает плазмолиз и, как следствие, гибель попавших в них микроорганизмов. 7.18. Несмешивающиеся жидкости Если взаимная растворимость жидкостей очень мала или практически отсутствует, то взаимодействие разнородных молекул очень мало, и они практически не препятствуют испарению друг друга. В результате парциальное давление пара каждого компонента над смесью близко к давлению пара над чистой жидкостью, а полное давление пара равно сумме давлений двух чистых жидкостей при этой температуре и подчиняется закону Дальтона р = poA + poB . Следует особо подчеркнуть такое обстоятельство: несмотря на то, что несмешивающиеся жидкости, помещённые в один сосуд, образуют из-за различия в плотности двухслойную систему, тем не менее, пар жидкости, находящейся в нижнем слое, может проходить сквозь верхний слой. При перемешивании равновесие “жидкость - пар” устанавливается быстрее, но и без перемешивания система приходит к такому же равновесию, только для этого требуется большее время. Это следует учитывать при работе с ртутью, например, при хранении её в лабораториях под слоем воды. В соответствии с вышесказанным ртутные пары способны проходить сквозь воду. При этом если не приняты меры для герметизации сосуда, их содержание в воздухе может превысить предельно допустимую концентрацию. По этой же причине металлическую ртуть (например, из разбитого термометра) и растворы, содержащие соли ртути, нельзя выливать в канализацию. Капли ртути, лежащие в 148 предохранительном сифоне под водопроводной раковиной или в канализационных трубах, будут насыщать воздух лаборатории или жилого помещения ртутными парами. 7.19. Перегонка с водяным паром Температура кипения смеси двух взаимно нерастворимых жидкостей ниже температур кипения отдельных компонентов. Состав пара при этом не зависит от общего состава смеси, т. е. от соотношения масс компонентов. Многие вещества при нагревании разлагаются при температурах, не достигающих их температуры кипения. Поэтому для их очистки нельзя использовать такой достаточно эффективный метод, как перегонка (простая или фракционная). Однако подобные нелетучие жидкости могут быть переведены в пар при температуре, более низкой, чем их Ткип, при совместном кипении с какой-либо несмешивающейся с ними более летучей жидкостью. (Эти жидкости, кроме того, не должны химически взаимодействовать друг с другом). Это обстоятельство лежит в основе перегонки с водяным паром. Перегонка с водяным паром - совместная перегонка с водой практически нерастворимых в ней веществ. В фармации и в парфюмерной промышленности этот вид перегонки используется для получения в чистом виде высококипящих органических веществ и, в особенности, при выделении из растительного сырья эфирных масел - розового, лавандового, пихтового, эвкалиптового и др. Относительные количества двух жидкостей в паре, а, следовательно, и в конденсате по закону Дальтона определяются давлениями их насыщенных паров: poA nA = , poB nB где n - число молей компонента. Подставляя вместо n равные им величины: 149 mA mB nA = и nA = MA MB получаем poA MA mA = poB MB mB или, принимая, что А - это вода, а В - перегоняемый с водяным паром компонент k, mН2О poН2О MН2О = , mk pok Mk (7.5) где МН2О и Мk - молярные массы воды и перегоняемого компонента; poН2О и pok - давления пара воды и перегоняемого компонента. Давление пара воды poН2О при температуре кипения смеси обычно берётся из справочных таблиц, а давление пара перегоняемого компонента pok вычисляется по закону Дальтона: pok = p - poН2О, где р - атмосферное давление. Так как в правой части уравнения (7.5) стоит отношение давлений пара, то р, poН2О и pok могут быть выражены в любых единицах - Па, атм или мм рт. ст. Отношение mH2O/mк характеризует количество водяного пара, необходимое для перегонки единицы массы перегоняемого вещества, и называется коэффициентом расхода пара. Обычно используемая размерность этого коэффициента - кг/кг. Его значение будет тем меньше, чем выше давление насыщенного пара перегоняемого вещества и чем больше его молярная масса. Перегонку с водяным паром можно производить и под вакуумом для еще большего снижения температуры кипения смеси. Пример: Рассмотрим перегонку с водяным паром камфоры C10H160 при получении её из древесины камфорного дерева. Тпл камфоры 178оС, Ткип 150 208оС, т. е. для её расплавления и тем более для кипения требуется очень высокая температура и соответственно большой расход энергии. Если кипятить смесь воды и стружек камфорного дерева при температуре 95оС и при атмосферном давлении 1,013105 Па, то общее давление пара над смесью будет складываться из давления паров воды при этой температуре (84525 Па) и камфоры (1,013105 84525 = 16775 Па). Вычисляем коэффициент расхода пара: mН2О poН2О MН2О 84525 18 = = = 0,596 mê p o ê Mê 16775 152 То есть для получения 1 кг камфоры необходимо затратить 0,596 кг водяного пара, а с 1 кг водяного пара можно перегнать 1/0,596 = 1,678 кг камфоры. 7.20. Диаграммы плавления. Термический анализ При охлаждении двухкомпонентных систем до определённой температуры начинается их отвердевание, то есть в жидкости появляется твёрдая, как правило, кристаллическая фаза. Отвердевание смесей происходит не при какой-то постоянной и строго определённой температуре, как в случае индивидуальных жидкостей, а в некотором интервале температуры. Диаграмма состояния системы, отображающая равновесие твёрдых и жидких фаз, называется диаграммой плавления (или диаграммой плавкости). Подобную диаграмму обычно получают на основе кривых охлаждения расплавленной смеси, показывающих зависимость температуры от времени. Метод исследования физико-химических процессов и химических превращений, происходящих в системе в условиях программируемого изменения температуры, называется термическим анализом. 7.20.1. Системы, состоящие из неизоморфных веществ 151 Простейшим типом бинарной системы, состоящей из твёрдых и жидких фаз, является система, в которой компоненты - неизоморфные соединения - полностью смешиваются в жидком состоянии и совершенно не смешиваются в твёрдом состоянии, т. е. не образуют смешанных кристаллов. При охлаждении такого раствора из него выделяются только простые твёрдые фазы, состоящие из кристаллов чистых компонентов. К системам такого рода относятся смеси многих органических веществ, в том числе и лекарственных. Рассмотрим термический анализ неизоморфной смеси. Кривые охлаждения и диаграмма плавления такой смеси представлены на рис. 7.14. Т А В х1 х2 Т хэ Т р = const 1 Тпл А Тпл А Тх1 ликвидус Тпл В Тх2 Тпл В 2 Тэ 3 Э солидус время А Тэ 4 х1 хэ х2 В состав Рис. 7.14. Кривые охлаждения (слева) и диаграмма плавления (справа) двухкомпонентной неизоморфной смеси Когда охлаждается жидкость, состоящая из одного компонента, например, А, график зависимости температуры от времени - кривая охлаждения - имеет почти постоянный наклон. Если охлаждение производится достаточно медленно, то можно заметить, что при достижении температуры кристаллизации (совпадающей с температурой плавления этого 152 вещества при нагревании, - Тпл А) на кривой охлаждения появляется горизонтальный участок («ступенька»). Эта остановка на кривой охлаждения имеет своей причиной выделение теплоты в процессе отвердевания жидкости (теплоты кристаллизации). Этой теплоты достаточно для того, чтобы компенсировать отвод теплоты от системы в окружающую среду и поддерживать температуру смеси постоянной. При этом в исследуемой системе при Тпл А находятся в равновесии кристаллы А и расплавленный компонент А. После того, как вся жидкость закристаллизуется, температура системы вновь начинает понижаться, чему соответствует третий, наклонный участок кривой охлаждения. Если охлаждение проводится просто выдерживанием системы, например, пробирки с расплавленным веществом, на воздухе, то температура твёрдого вещества будет понижаться, пока не достигнет комнатной. Аналогично будет вести себя при охлаждении и любое другое чистое жидкое (расплавленное) вещество, например, обозначенное на рис. 7.14 как В. Отличие кривых охлаждения разных веществ состоит, главным образом, в положении горизонтального участка, отвечающего температуре кристаллизации (температуре плавления). Для вещества В это Тпл В. Ещё одно различие в кривых охлаждения веществ связано с их теплоёмкостью. Чем больше теплоёмкость вещества, тем медленнее оно будет отдавать теплоту при охлаждении и, значит, наклон кривой к оси времени будет больше. В отличие от индивидуальных веществ охлаждение жидкой смеси двух компонентов А и В (раствора или расплава) будет отличаться значительными особенностями. Соответственно и вид кривых охлаждения смесей будет сильно отличаться от таковых для индивидуальных веществ. Рассмотрим охлаждение смеси с составом х1 с преобладанием компонента А. Из-за криоскопического эффекта отвердевание смеси начнётся при более низкой температуре, чем Тпл А. При этом из расплава в виде кристаллов выделяется 153 избыточный (мажорный) компонент А. Из-за различия составов твёрдой и жидкой фаз выделяющейся теплоты кристаллизации недостаточно для поддержания постоянной температуры смеси. Поэтому при температуре, соответствующей появлению первого кристалла А, Тх1, на кривой охлаждения появляется не горизонтальный участок, а излом. Наклон кривой охлаждения изменяется, отражая замедление процесса охлаждения. Это замедление обусловлено, кроме выделения теплоты кристаллизации вещества А, еще и постепенным обогащением расплава компонентом В, приводящим в соответствии с криоскопическим эффектом к всё большему понижению температуры отвердевания смеси. При достижении определённого соотношения компонентов А и В в жидкой фазе, называемого эвтектическим, химические потенциалы обоих компонентов становятся равными друг другу, и начинается одновременная кристаллизация А и В. Выделяющаяся теплота кристаллизации обоих веществ компенсирует отвод теплоты в окружающую среду и поддерживает температуру смеси постоянной. На кривой охлаждения это отображается появлением горизонтального участка при температуре Тэ, называемой температурой эвтектики или эвтектической температурой. После полного перехода компонентов в твёрдую фазу продолжается охлаждение смеси кристаллов А и В, которому соответствует нижний наклонный участок кривой охлаждения. При рассматривании затвердевшей смеси под микроскопом можно заметить, что выпадающие в первую очередь кристаллы находившегося в избытке компонента А имеют более крупные размеры. Они вкраплены в смесь мельчайших кристалликов А и В, образующихся при кристаллизации эвтектической смеси. Подобным образом ведут себя при охлаждении любые смеси данных компонентов, отличающиеся по составу от эвтектической смеси. Их кривые охлаждения, в общем, будут отличаться друг от друга только положением излома, соответствующего появлению первого кристалла. Чем ближе состав 154 смеси к эвтектическому, тем при более низкой температуре он будет появляться. Если в первоначальном составе исследуемого расплава преобладает компонент В, например, х2, то в первую очередь из расплава будут выпадать кристаллы В. Первый из них появится при температуре Тх2. Жидкая фаза при этом обогащается компонентом А. После выделения в виде кристаллов всего избыточного по сравнению с эвтектическим составом количества В жидкий расплав будет кристаллизоваться при постоянной температуре Тэ. После полного отвердевания эвтектической смеси твёрдая система будет представлять собой более крупные кристаллы В, вкраплённые в мелкие кристаллы А и В, образующиеся, как было сказано выше, при кристаллизации эвтектики. Последний, наклонный участок кривой охлаждения отвечает охлаждению твёрдой смеси. Смесь веществ с составом хэ, равным эвтектическому, при нагревании и охлаждении ведёт себя подобно индивидуальным компонентам. Её плавление и отвердевание происходят при постоянной, строго определённой для каждой данной пары веществ температуре эвтектики Тэ. При этом в отличие от смесей другого состава твёрдая эвтектика и её жидкий расплав имеют одинаковый состав. Кривая охлаждения эвтектической смеси подобна кривым охлаждения индивидуальных веществ: на ней имеются два наклонных участка, отвечающих охлаждению соответственно жидкой и твёрдой эвтектик и горизонтальный участок, отвечающий кристаллизации эвтектики при температуре Тэ. Длина горизонтальных участков на кривых охлаждения всех типов пропорциональна количеству вещества, взятому для исследования. Температуры появления новых фаз, найденные с помощью кривых охлаждения, используются для построения диаграммы плавления рассматриваемой системы. Для этого получают кривые охлаждения для обоих чистых компонентов и для большого числа их смесей различного состава. Температуры, отвечающие горизонтальным участкам и изломам на 155 этих кривых, переносят на диаграмму “температура - состав”. При соединении нанесённых точек линиями получается диаграмма плавления (рис. 7.14, справа). На диаграмме плавления смеси рассматриваемого типа имеются четыре фазовых поля: 1 - поле гомогенных бивариантных жидких расплавов (или растворов); 2, 3 и 4 - поля гетерогенных моновариантных систем. Поля 2 и 3 соответствуют областям существования находящихся в равновесии жидких расплавов различного состава с кристаллами вещества А (поле 2) или с кристаллами вещества В (поле 3). Поле 4 - поле гетерогенных систем, состоящих из двух твёрдых фаз - кристаллов А и кристаллов В. Линии, выходящие из точек, соответствующих Тпл А и Тпл В, и отделяющие поле 1 от полей 2 и 3, называются линиями ликвидуса. Горизонтальная линия (изотерма), отвечающая температуре эвтектики Тэ, и отделяющая поле 4 от полей 2 и 3, называется линией солидуса. Две ветви ликвидуса сходятся в точке Э, лежащей на солидусе, - эвтектической точке, отвечающей составу эвтектической смеси (или, иначе, эвтектики). Система в состоянии, отображаемом эвтектической точкой, инвариантна. Эвтектическая смесь не является одной фазой или химическим соединением, хотя и ведет себя при плавлении и отвердевании подобно индивидуальному веществу. Твёрдые эвтектики или, иначе, эвтектические сплавы обладают рядом особых свойств, которые широко используются на практике. Так, металлические сплавы эвтектического состава обладают повышенной механической прочностью. Если одним из компонентов исследуемой смеси является вода, а другим - неорганическая соль, то в таком случае эвтектическая точка называется криогидратной точкой. Затвердевшие водные растворы солей эвтектического состава (криогидраты) используются в качестве уже упоминавшихся охлаждающих смесей. 156 В фармации термический анализ используется для рационального подбора состава лекарственных смесей. В первую очередь это относится к определению физической совместимости или несовместимости лекарств. Твёрдые, и в том числе порошкообразные лекарственные вещества считаются физически несовместимыми, если эвтектическая температура их смесей лежит ниже комнатной или близка к ней. Смеси таких веществ через какое-то время после приготовления самопроизвольно подплавляются и теряют сыпучесть. Во многих случаях возможно даже их расплывание, затрудняющее или делающее невозможными такие операции, как взвешивание, дозировка, упаковка, таблетирование и т. п. У физически совместимых смесей Тэ должна быть намного выше комнатной. При подборе состава мазей и суппозиториев (у которых температура плавления должна совпадать с температурой человеческого тела) также следует ориентироваться на эвтектическую температуру образующейся смеси. Высокая дисперсность кристаллов эвтектической смеси лекарственных веществ, полученной из расплава, способствует лёгкости растворения их как в условиях лаборатории, так и при попадании в желудочно-кишечный тракт. 7.20.2. Системы, состоящие из веществ, образующих химические соединения Системы такого рода образуются многими неорганическими веществами, например, солями (в особенности галогенидами). а) Соединения, плавящиеся конгруэнтно Если вещества А и В могут образовать между собой устойчивое твёрдое химическое соединение, плавящееся без разложения (конгруэнтно), ликвидус на диаграмме плавления будет иметь максимум, как показано на рис. 7.15 (точка С). 157 Состав этого соединения может быть определён по положению максимума над осью состава, который должен быть выражен в молярных долях. Для подавляющего большинства веществ, образующих конгруэнтно плавящиеся соединения, длины отрезков АD и DB относятся друг к другу, как малые числа (1 : 1, 1 : 2, 1 : 3, 2 : 3 и т. д.), показывающие число молекул каждого из них, входящее в соединение. В данном примере отрезки АD и DB равны друг другу. Это говорит о том, что вещества А и В входят в соединение в эквимолярных количествах и его состав, отвечающий хАВ, может быть выражен формулой АВ. Температура плавления этого соединения равна Тпл АВ. 1 Т Тпл АВ Тпл А р = const Т Тпл В С Тпл АВ 4 Тэ 1 2 Э1 хэ1 5 Тэ 2 3 6 А Э2 D хАВ 7 хэ2 В состав Рис. 7.15. Диаграмма плавления системы с химическим соединением, плавящимся конгруэнтно На диаграмме плавления такого типа имеется 7 фазовых полей: 1 - поле гомогенных жидких систем; 2, 3, 4 и 5 - поля гетерогенных систем; 6 и 7 поля гетерогенных твёрдых систем, состоящих из кристаллов соединения АВ и кристаллов А (поле 6) или кристаллов В (поле 7). Гетерогенные системы, отвечающие полям 2, 3, 4 и 5 состоят из жидких двухкомпонентных расплавов и кристаллов одного из веществ (в поле 2 это кристаллы вещества 158 А, в поле 5 - кристаллы В, а в полях 3 и 4 - кристаллы химического соединения АВ). Вертикальная линия CD, проведённая через максимум, делит фазовую диаграмму на две части, которые можно рассматривать как отдельные диаграммы (каждую со своей эвтектикой Э1 и Э2, составы которых отображаются точками хЭ1 и хЭ2, а эвтектические температуры равны соответственно ТЭ1 и ТЭ2). Во многих случаях вещества А и В могут образовывать между собой два или более химических соединения. На их диаграммах плавления это отображается появлением на ликвидусах соответствующего числа максимумов. б) Соединения, плавящиеся инконгруэнтно Встречаются системы, в которых компоненты образуют неустойчивые химические соединения, разлагающиеся при плавлении (плавящиеся инконгруэнтно). Такие соединения проявляют себя изломом на линии ликвидуса, как показано на рис. 7.16 (точка D, называемая перитектической точкой). Т у р = const ТплАВ2 Т D Тэ w Э А время Т z хэ х А2В х В состав Рис. 7.16. Диаграмма плавления (слева) и кривая охлаждения (справа) системы с химическим соединением, плавящимся инконгруэнтно 159 Состав этого соединения может быть выражен формулой А2В; он определяется точкой хА 2В. Это соединение может существовать только в твёрдом виде; выше температуры Тпл А 2В оно разлагается на А и В. Если общий состав системы лежит в интервале хА 2В В, её кривые охлаждения будут иметь достаточно сложный вид. Например, для системы с составом х охлаждение выражается перемещением фигуративной точки на диаграмме плавления по линии ух. Ему соответствует кривая охлаждения, показанная на рис. 7.16 справа. При охлаждении до температуры, соответствующей точке D, начинается кристаллизация компонента В, что выражается появлением верхнего излома на кривой охлаждения. Когда температура снизится до ТплАВ2, начинается образование соединения А2В, и на кривой охлаждения появляется верхний горизонтальный участок. Соединение А2В будет продолжать выпадать из расплава вплоть до эвтектической температуры Тэ. При этом в равновесии находятся три фазы: расплав, вещество В и соединение А2В. В соответствии с правилом фаз система в этом случае является инвариантной. Это означает, что при изменении одного из параметров (при рассматриваемом охлаждении это температура) неизбежно должен измениться фазовый состав системы. И действительно, с выпадением всё большего числа кристаллов А2В ранее выпавшие кристаллы В растворяются. Это поддерживает концентрацию В в расплаве при охлаждении постоянной. Таким трёхфазным системам отвечает фазовое поле ЭСwz, а на кривой охлаждения - средний наклонный участок. При температуре Тэ состав расплава становится равным эвтектическому и начинается кристаллизация эвтектики (нижний горизонтальный участок на кривой охлаждения). Нижний наклонный участок соответствует охлаждению системы, состоящей из двух твёрдых фаз - кристаллических В и А2В. 160 7.20.3. Системы, состоящие из веществ, образующих твёрдые растворы Твёрдые растворы - однородные системы переменного состава, состоящие из двух или более компонентов. Различают твёрдые растворы внедрения и растворы замещения. В твёрдых растворах внедрения частицы (молекулы, атомы или ионы) одного компонента располагаются в пространстве между узлами кристаллической решётки другого компонента. Такие растворы получаются из веществ, молекулы или атомы которых значительно отличаются по размерам и химическим свойствам, например, при растворении в металлах неметаллов - водорода, углерода, азота, бора. В твёрдых растворах замещения, которые образуются близкими по химическим свойствам и размерам частиц веществами (например, такими металлами, как золото и медь, золото и серебро или многими солями кислородсодержащих кислот), частицы одного компонента замещают в узлах кристаллической решётки частицы другого компонента. Вещества, которые могут образовывать смешанные кристаллы (“твёрдые растворы”), называются изоморфными. Как и в случае жидких растворов, при образовании твёрдых растворов возможно проявление как ограниченной растворимости компонентов (с образованием так называемых бертоллидов), так и неограниченной. Рассмотрим диаграмму плавления и кривые охлаждения систем с неограниченной растворимостью компонентов в твёрдом состоянии, как имеющих наибольшее значение для фармации. Диаграмма состояния такой системы (рис. 7.17) не имеет точки эвтектики. На ней имеются три фазовых поля: 1 - поле гомогенных бивариантных жидких систем (расплавов); 2 - поле гетерогенных моновариантных систем, состоящих из кристаллов твёрдого раствора, находящихся в равновесии с расплавом; 3 - поле гомогенных бивариантных систем, состоящих из кристаллов твёрдого раствора. 161 Рассмотрим охлаждение системы с составом х, отображаемое перемещением фигуративной точки по линии СDEF. Выше температуры Т1 происходит охлаждение расплава. На кривой охлаждения этому соответствует верхний наклонный участок. Когда температура понижается до Т1, фигуративная точка достигает ликвидуса (точка D), из расплава начинают выделяться кристаллы твёрдого раствора, причём их состав, как и состав равновесной жидкости, по мере уменьшения температуры непрерывно изменяется. Т р = const 1 Т1 ликвидус Т2 Т3 k С Т D ТплВ l Т m 2 ТплА E солидус 3 А время F у х z В состав Рис. 7.17. Диаграмма плавления системы с неограниченной растворимостью компонентов (слева) и кривая охлаждения (справа) Эти составы можно определить по точкам пересечения изотермы с ликвидусом и солидусом. Например, при температуре Т1 расплав имеет состав у, а твёрдый раствор - z. Расплав по сравнению с кристаллами твёрдого раствора всегда обогащён более легкоплавким компонентом. При охлаждении до Т3 (точка Е) исчезает последняя капля жидкости. Области температур Т1 Т3 на кривой охлаждения отвечает средний наклонный участок. Его наклон меньше, чем верхнего и нижнего участков, так как охлаждение смеси замедляется из-за выделения теплоты кристаллизации. 162 Ниже температуры Т3 (отрезок EF) идет постепенное охлаждение образовавшегося твёрдого раствора, отображаемое на кривой охлаждения нижним наклонным участком. 7.21. Правило рычага для конденсированных систем Для любых равновесных гетерогенных систем, содержащих жидкие и твёрдые фазы, относительные количества этих фаз могут быть, как и в случае систем “жидкость - пар” рассчитаны по правилу рычага: Фигуративная точка, отвечающая суммарному составу системы при каждой данной температуре, делит конноду на отрезки, обратно пропорциональные количеству этих фаз. Для систем, компоненты которых образуют смешанные кристаллы (рис. 7.17), соотношение масс твёрдой и жидкой фаз определяются подобно тому, как это делается для жидкой и паровой фазы с помощью диаграммы кипения. Например, при температуре Т2: mж lm = mтв kl Для систем из компонентов, плавящихся конгруэнтно, по правилу рычага можно определить соотношение массы одного из компонентов (mA или mB) и массы расплава (рис. 7.18). Например, при температуре Т1 для системы с общим составом х: mА lm = , mж kl а для системы с общим составом у mВ no = . mж op Для систем, состоящих из компонентов, образующих химическое соединение (рис. 7.15), в фазовых полях 3 и 4 можно аналогичным образом определить соотношение масс жидкого расплава и химического соединения. 163 Т Т Т1 Т1 k А l m n х o p у В состав Рис. 7.18. Правило рычага для систем с эвтектикой 164 ГЛАВА 8 ФАЗОВЫЕ РАВНОВЕСИЯ В ТРЁХКОМПОНЕНТНЫХ СИСТЕМАХ. ЭКСТРАКЦИЯ 8.1. Третий компонент в двухслойной жидкой системе. Закон распределения Нернста В смеси двух чистых жидкостей, нерастворимых друг в друге, образуется два жидких слоя. На практике одним из компонентов чаще всего бывает вода, а другим - какой-либо органический растворитель (например, диэтиловый эфир, сероуглерод, тетрахлорметан и др.). За некоторыми исключениями органические растворители имеют меньшую плотность, чем вода, поэтому нижний слой в двухфазной системе, как правило, бывает водным, а верхний - органическим. Если в такую систему добавить третье вещество (третий компонент), растворимое в обеих жидкостях, то после установления равновесия этот третий компонент распределится между обоими слоями, образуя растворы с различной концентрацией. Отношение концентраций третьего компонента в обеих фазах называется коэффициентом распределения и обозначается К: С1 К = . (8.1) С2 Коэффициент распределения не зависит от абсолютного содержания в системе всех трёх её компонентов и зависит только от температуры. Приведённое уравнение является математическим выражением закона распределения, выведенного В.Нернстом (1890): Распределение каждого из растворённых веществ между двумя фазами определяется индивидуальным коэффициентом распределения, величина которого не зависит от присутствия других веществ. Для растворов, не являющихся идеальными, концентрации в математическом выражении закона должны быть заменены активностями: 165 а1 К = . а2 В зависимости от природы растворителя растворённый неэлектролит может присутствовать в нём в виде отдельных молекул или в виде ассоциатов. Ассоциаты, т. е. относительно неустойчивые группы - димеры, тримеры и т. п., - образуются, как правило, за счёт водородных связей. Их присутствие заметно влияет на свойства растворов, а, значит, и на величину коэффициента распределения. При наличии ассоциации уравнение для коэффициента распределения приобретает вид: С1 К = , (8.2) n С2 где n - отношение молярных масс растворённого вещества в верхнем и в нижнем слоях (иначе - его степень ассоциации). Уравнения (8.1) и (8.2) и закон распределения лежат в основе одного из важнейших технологических процессов - жидкостной экстракции. На этом законе основан также один из широко применяемых методов исследования и анализа - распределительная хроматография. 8.2. Жидкостная экстракция Принцип жидкостной экстракции заключается в следующем. Если к раствору какого-либо вещества (например, к водному раствору иода) прилить некоторое количество несмешивающейся с водой органической жидкости, способной растворять это вещество (например, диэтилового эфира), то третий компонент будет самопроизвольно переходить через поверхность раздела фаз, т. е. распределяться между двумя жидкими слоями. Движущей силой распределения является разность значений химического потенциала этого третьего компонента по обе стороны межфазной границы. Поэтому распределение заканчивается и равновесие наступает тогда, когда химический потенциал распределяющегося компонента (в нашем примере - 166 иода) примет одинаковые значения в обеих жидких фазах. Переход третьего компонента через поверхность раздела фаз можно рассматривать как извлечение (экстракцию) его вторым растворителем. Растворитель, с помощью которого производится извлечение третьего компонента из первоначального раствора, называется экстрагентом, третий компонент (в нашем примере это иод) - экстрагируемым веществом. Образовавшийся после установления равновесия раствор экстрагируемого вещества в экстрагенте называется экстрактом, а обеднённый экстрагируемым веществом раствор в той жидкости, из которой велась экстракция, - рафинатом. Жидкостная экстракция применяется для выделения веществ из растворов, где они присутствуют в очень малых количествах. Например, иод, содержащийся в попутных водах буровых скважин, можно экстрагировать эфиром или сероуглеродом. В фармацевтической практике экстракция применяется для выделения из растительного сырья эфирных масел, алкалоидов, витаминов, антибиотиков и других лекарственных веществ. В качестве экстрагентов в фармации используют хлороформ, хлористый метилен, этилацетат, амилацетат, эфир, бензол и другие растворители. При рассмотрении уравнения (8.1) можно заметить, что значение коэффициента распределения будет зависеть от того, какой из равновесных растворов будет обозначен индексом 1, а какой - индексом 2. Если С1 равновесная концентрация экстрагируемого вещества в растворе, подвергающемся экстрагированию, а С2 - равновесная концентрация его в экстрагенте, то величина К будет принимать значения между 0 и 1. Причём, чем меньше значение К, тем бóльшая часть третьего компонента перейдёт в экстракт, и, значит, тем эффективнее будет процесс экстракции. Если же равновесную концентрацию экстрагируемого вещества в растворе, из которого идёт экстрагирование, обозначить С2, а равновесную концентрацию его в экстрагенте - С1, то величина К будет больше 1. В этом случае процесс 167 экстракции будет тем эффективнее, чем больше значение К. Эффективность экстракции принято выражать степенью извлечения , представляющей собой отношение массы экстрагируемого вещества, перешедшей в экстракт mэ, к его первоначальной массе m0 в растворе, из которого велась экстракция: mэ = . m0 Степень извлечения может быть выражена в долях и в процентах. Найдём количественные соотношения для экстракции для случая K 1 при отсутствии ассоциации или диссоциации экстрагируемого вещества. Пусть имеется V1 литров исходного раствора и V2 литров экстрагента. Если исходный раствор содержал m0 граммов вещества, то после установления равновесия в водном растворе останется m1, а в экстракт перейдёт mэ граммов экстрагируемого вещества. Так как m э = m 0 m 1, можно записать: m1 m0 m 1 С1 = и С2 = . V1 V2 Следовательно: m1 V2 К = . V1 (m0 m1) Решая это уравнение относительно m1, получим К = m1V2 / V1(m0 m1); m1V2 = KV1(m0 m1); m1V2 = KV1m0 KV1m1; m1V2 + KV1m1 = KV1m0; m1(KV1 + V2) = m0KV1 и окончательно KV1 m1 = m0 KV1 + V2 168 или V1 m1 = m0 . 1 + V2 /KV1 (8.3) По этому уравнению можно рассчитать количество вещества в граммах, остающегося в рафинате после однократной экстракции. Количество вещества экстрагируемого из раствора (mэ), определяется по разности mэ = m0 m1 или по уравнению, которое получается при замене m1 на равное ему значение: KV1 mэ = m0 m0 , KV1 + V2 откуда KV1 V1 mэ 1 = m0 (1 ) или mэ 1 = m0 (1 ). (8.4) KV1 + V2 1 + V2 /KV1 После первой операции экстрагирования в рафинате остаётся какое-то количество неизвлечённого вещества m1 = m0 – mэ. Проводя повторное экстрагирование из этого раствора таким же объёмом экстрагента V2, получим выражение для количества экстрагированного вещества: KV1 mэ 2 = m1 (1 ) KV1 + V2 Объединяя экстракты, получим, что суммарное количество извлечённого вещества равно mэ = mэ 1 + mэ 2. Заменяя mэ 1 на его значение из уравнения (8.4) и m1 на соответствующее выражение из уравнения (8.3), получим для суммарного количества вещества, извлечённого при двух экстракциях: KV1 n mэ = m0 [1 ( ) ]. KV1 + V2 При многократной экстракции одинаковыми объёмами экстрагента формулы для количества вещества, остающегося в рафинате и перешедшего в экстрагент, примут вид соответственно: KV1 n mn = m0 ( ) KV1 + V2 и 169 KV1 n mý = m0 [1 ( ) ]. KV1 + V2 где n - число операций экстрагирования. Расчёты показывают, что вещество извлекается полнее, если имеющийся объём экстрагента использовать не целиком, а разделить его на несколько частей для повторных экстракций, а затем объединить все экстракты. Такая многократная экстракция носит название дробной. Несмотря на увеличение числа операций, неизбежно вызывающее возрастание продолжительности процесса, дробная экстракция позволяет получать намного бóльшие степени извлечения, т. е. увеличивать выход продукта. Зная необходимую степень извлечения, можно рассчитать n - число операций экстрагирования, необходимое для её достижения. В химической технологии, в том числе в заводской технологии лекарств, часто используется другое представление о коэффициенте распределения, при котором принимается, что K 1. В этом случае масса вещества, остающегося в рафинате, вычисляется по формуле V1 n m1 = m0 ( ) , V1 + KV2 а масса вещества. переходящего в экстракт – V1 n mэ = m0 [1 ( ) ]. V1 + KV2 170 IV. Э Л Е К Т Р О Х И М И Я ГЛАВА 9 ЭЛЕКТРОХИМИЯ. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. КОНДУКТОМЕТРИЯ 9.1. Предмет электрохимии и её значение для фармации, медицины и биологии Электрохимия - раздел физической химии, изучающий физико-химические свойства ионных систем (растворов, расплавов или твёрдых электролитов), а также явления, происходящие на поверхностях раздела фаз с участием заряженных частиц - ионов и электронов. Современная теоретическая электрохимия включает два раздела: ионику и электродику. Ионика рассматривает свойства однофазных систем - твёрдых электролитов, их растворов и расплавов как при равновесии, так и в неравновесных условиях. Электродика изучает электрохимические явления на поверхности раздела двух фаз, а именно строение поверхности раздела, а также термодинамику и кинетику электрохимических процессов, протекающих на поверхности электродов. Законы электрохимии лежат в основе многих широко распространённых методов исследования и анализа (потенциометрия, кондуктометрия, полярография, амперометрия и др.). В химической и фармацевтической промышленности при получении многих веществ используются электролиз и электросинтез (например, электросинтезом получается глюконовая кислота - сырьё для синтеза применяемого в медицинской практике глюконата кальция). Химические источники тока гальванические элементы, аккумуляторы - настолько широко используются, что без них уже невозможно представить практически ни одной области деятельности человека. 171 В медицинской практике используются физиотерапевтические электрохимические методы, например, электрофорез, или приборы, в частности, электрокардиостимуляторы. Электрические явления заключаются в перемещении зарядов в направлении от точки с большей потенциальной энергией к точкам с меньшей потенциальной энергией. Они происходят и в живых организмах. С ними связано прохождение импульсов по нервным волокнам и синапсам, возникновение биопотенциалов в работающих сердце и мозге, на регистрации которых основаны такие диагностические методы, как электрокардиография и электроэнцефалография. У некоторых представителей животного мира, главным образом, у рыб (электрический сом, электрический угорь, электрический скат) развились особые электрические органы, служащие им в качестве средств защиты и добывания пищи. 9.2. Краткий исторический очерк Электрохимия возникла на рубеже XYIII и XIX вв. благодаря работам Л.Гальвани и А.Вольта, в результате которых был создан первый химический источник тока - “вольтов столб”. Используя химические источники тока, Г.Дэви в начале XIX в. осуществил электролиз многих веществ. В середине века благодаря работам М.Фарадея были открыты законы электролиза. В 1887 г. С.Аррениус сформулировал основы теории электролитической диссоциации. В 20-х гг. XX в. эта теория была дополнена П.Дебаем и Э.Хюккелем, которые учли электростатическое взаимодействие между ионами. В дальнейшем на основе теории Дебая - Хюккеля были развиты представления о механизме электропроводности электролитов (Л.Онсагер, 1926 г.). Во второй половине XIX в. благодаря работам В.Нернста, Дж.Гиббса и Г.Гельмгольца были установлены основные термодинамические отношения электрохимии. Представления о строении границы между электродом и раствором, на которой образуется двойной электрический слой, были развиты Г.Гельмгольцем (1879), Ж.Гуи (1910) и О.Штерном (1924). Фундаментальный вклад в развитие учения о кинетике электродных процессов внесли М.Фольмер, Т.ЭрдеиГруз и школы А.Н.Фрумкина и Я.Гейровского. 9.3. Коллигативные свойства растворов электролитов 172 Растворы электролитов обнаруживают значительные отклонения от законов для идеальных растворов, касающиеся давления насыщенного пара, понижения температуры замерзания и повышения температуры кипения. Причём эти отклонения бывают намного выше, чем у растворов неэлектролитов с такой же молярной или моляльной концентрацией. Причиной этого является то, что в растворах электролитов молекулы частично или полностью ионизированы, и, следовательно, частиц, определяющих коллигативные свойства, в них больше, чем в растворах неэлектролитов. Например, для 0,01М раствора NaCl наблюдаемые осмотическое давление и понижение температуры замерзания в 2 раза больше, чем для раствора сахарозы с такой же концентрацией, поскольку каждая молекула хлорида натрия диссоциирует на два иона. В случае не полностью диссоциированных электролитов зависимость между изменением коллигативных свойств и числом ионов, образующихся при ионизации одной молекулы, сложнее, однако она существует и выражается с помощью так называемого изотонического коэффициента Вант-Гоффа. Изотонический коэффициент i вводится в уравнения, описывающие коллигативные свойства растворов электролитов: = iCRT , Tзам = iКкрm, Ткип = iКэm. Его значение всегда больше 1. Физический смысл изотонического истинное число частиц растворённого вещества i = число частиц растворённого вещества до диссоциации коэффициента выражается следующим соотношением: 173 Если раствор содержит n молекул слабого электролита и если степень диссоциации, то число недиссоциированных молекул будет равно n(1 ), а число ионов в растворе при равновесии - n, где - число ионов, образующихся при диссоциации одной молекулы. С учётом этого выражение для коэффициента Вант-Гоффа можно записать в следующем виде: n(1 ) + n i = = 1 + n или i = 1 + ( 1). (9.1) Таким образом, зная степень диссоциации электролита, можно вычислить его изотонический коэффициент, а с помощью изотонического коэффициента можно рассчитывать коллигативные свойства и предсказывать поведение растворов слабых электролитов. Уравнение (9.1) после преобразования к виду i1 = 1 может лечь в основу независимого метода определения степени диссоциации электролитов. Экспериментально измеряя осмотическое давление, депрессию замерзания или повышение температуры кипения раствора исследуемого электролита и раствора неэлектролита с одинаковыми концентрациями, можно вычислить изотонический коэффициент, используя отношения: эл Tзам эл Tкип эл i = = = . неэл Tзам неэл Tкип неэл А зная i, можно по уравнению (9.1) вычислить степень диссоциации электролита. Так, для бинарного слабого электролита (молекулы которого распадаются на 2 иона) в разбавленном растворе = i 1. В случае полностью диссоциированных (“сильных”) электролитов при высоких концентрациях в растворе происходят явления ассоциации, 174 приводящие к образованию ионных пар, тройников, кластеров и т. д. В результате этого осмотическое давление в таких растворах меньше, чем рассчитанное по включающему в модифицированному себя изотонический уравнению коэффициент. Вант-Гоффа, Для описания осмотических свойств таких растворов в химии, а также в фармации применяется осмотический коэффициент , равный отношению экспериментального найденного осмотического давления к тому давлению, которое имело бы место при отсутствии ассоциации и других эксп = . теор взаимодействий в растворе: Отсюда можно найти соотношение между осмотическим и i = . изотоническим коэффициентами: 9.4. Буферные растворы. Буферная ёмкость Буферные растворы широко используются в химии для создания и поддержания требуемого значения рН. Буферными называются растворы, содержащие протолитическую систему, обладающие определённым рН и способные поддерживать его практически постоянным при введении в раствор сильной кислоты или сильного основания. Эта способность, называемая буферным действием, проявляется в зависимости от состава раствора. В качестве компонентов протолитической системы выступают донор протонов - слабая кислота и акцептор протонов – сопряжённое основание. Величина, характеризующая способность буферного раствора сопротивляться действию кислоты или 175 основания, называется буферной ёмкостью и обозначается . Она измеряется количеством сильного основания или кислоты, которые необходимо добавить к 1 литру буферного раствора, чтобы изменить его рН на единицу. Изменение рН зависит не от абсолютного количества добавленной сильной кислоты (или сильного основания), а от соотношения их числа молей и числа молей слабого основания (или слабой кислоты) в буферном растворе. Следовательно, буферной ёмкостью называется количество молярных масс эквивалента сильной кислоты (или сильного основания), которое надо добавить к 1 литру буферного раствора, чтобы изменить его рН на единицу. Вычислить значение по экспериментальным данным можно по формуле N Vх 1000 N Vх = [моль/л] = [ммоль/л] , Va Va где Vх - объём раствора сильной кислоты (сильного основания) с молярной концентрацией эквивалента N, Va - объём буферного раствора, взятый для определения. Буферная ёмкость одного и того же раствора по отношению к сильной кислоте и к сильному основанию, как правило, различна, что зависит от соотношения компонентов буферного раствора: где СНА СНА СА = 2,303 , СНА + САи СА- - концентрации соответственно слабой кислоты и её аниона (сопряжённого основания) в буферном растворе. Так как в процессе метаболизма в организме постоянно образуются продукты кислотного характера (например, HCl в желудочном соке), необходим механизм поддержания постоянного значения рН. Сохранение постоянства реакции среды биологических жидкостей обеспечивается наличием буферных систем, обладающих значительной буферной ёмкостью. 176 В организме человека особенно большую роль играют белковая, бикарбонатная и фосфатная буферные системы крови. Примерно 75 % всей буферной ёмкости крови обеспечивается гемоглобин-оксигемоглобиновой буферной системой. Благодаря этим системам рН крови поддерживается на уровне 7,36 7,40, рН желудочного сока - около 2 и т. д. Буферные свойства клеточных и межклеточных сред приводят к быстрой нейтрализации попавших на кожу небольших количеств кислоты или щелочи. Нарушение рН внутренних сред организма, сопровождающееся ацидозом («закислением») или алкалозом («защелачиванием»), может привести к тяжёлым заболеваниям и даже к смерти. Другие свойства буферных растворов и вообще растворов электролитов, а также теории, описывающие их строение, в данном курсе не излагаются, так как входят в программы курсов общей и аналитической химии. 9.5. Электрическая проводимость растворов. Закон Кольрауша Материалы, способные проводить электрический ток, называются проводниками. Принято различать две основные группы проводников: проводники с электронной проводимостью (проводники первого рода) и с ионной проводимостью (проводники второго рода). Проводники первого рода - это, главным образом, металлы, а также некоторые неметаллы, например, углерод (графит); проводники второго рода - растворы и расплавы электролитов. В отличие от проводников первого рода в проводниках второго рода при прохождении электрического тока происходят химические изменения. Далее речь пойдёт, в основном, о проводниках второго рода растворах электролитов, имеющих наибольшее значение для кондуктометрических и потенциометрических измерений и исследований в химии и в фармации. 177 При наложении на раствор электролита внешнего электрического поля сольватированные ионы, до того хаотично перемещавшиеся в результате теплового движения, начинают двигаться направленно - катионы к отрицательно заряженному электроду, а анионы - к положительно заряженному. Скорость этого направленного движения прямо пропорциональна приложенному напряжению и обратно пропорциональна сопротивлению среды. Абсолютная скорость движения иона v, выраженная в системе СИ в м2/Вс, представляет собой расстояние в метрах, проходимое ионом за 1 с при градиенте потенциала, равном 1 В/м (В – вольт): v = ez/R где e - элементарный электрический заряд; z - заряд иона; R - электрическое сопротивление среды. Важнейшей характеристикой растворов электролитов является их электрическая проводимость (или иначе – электропроводность). Общая электрическая проводимостей, переносимого проводимость складывается обусловленных соответственно долями из катионной количества катионами и и ионной электричества, анионами. Эти доли электричества называются числами переноса. Электрическая проводимость представляет собой величину, обратную электрическому сопротивлению R. Количественно электрическая проводимость растворов электролитов может быть охарактеризована удельной и эквивалентной проводимостью. Удельная электрическая проводимость в системе СИ определяется как проводимость плоскопараллельными 1 м3 раствора, электродами заключённого площадью в 1 между м2 двумя каждый и находящимися на расстоянии 1 м друг от друга. Иными словами, численно равна силе тока, создаваемого ионами, содержащимися в указанном объёме, при напряжении на электродах U = 1 В. Она может быть также определена как величина, обратная удельному сопротивлению раствора : = 1/. 178 Размерность СИ удельной электрической проводимости - Ом1м1. Однако в лабораторной практике часто используется другая размерность - Ом1см1, соответствующая такому физическому смыслу: проводимость 1 см3 раствора, заключённого между двумя плоскопараллельными электродами площадью в 1 см2 каждый и находящимися на расстоянии 1 см друг от друга, при напряжении на электродах, равном 1 В. Удельная проводимость зависит от природы электролита и природы растворителя. С ростом температуры она увеличивается, хотя и нелинейно. Зависимость от концентрации носит более сложный характер, а именно: при малых концентрациях проводимость возрастает из-за увеличения числа ионов в объёме раствора, а при больших может в какой-то степени снижаться, что связано с образованием ионных пар по причине уменьшения расстояния между ними и, как следствие, увеличения электростатического притяжения (рис. 9.1). С Рис. 9.1. Зависимость удельной электрической проводимости растворов электролитов от концентрации Удельная проводимость характеризует свойства раствора, но не свойства электролита. Чтобы более наглядно отразить влияние на электрическую проводимость свойств электролита, было введено понятие эквивалентной электрической проводимости. Эквивалентная электрическая проводимость в системе СИ определяется как проводимость объёма раствора (м3), содержащего 179 молярную массу эквивалента растворённого вещества, и заключённого между двумя плоскопараллельными электродами площадью в 1 м2 каждый и находящимися на расстоянии 1 м друг от друга, при напряжении на электродах, равном 1 В. Размерность СИ эквивалентной проводимости Ом1м2моль1. При практических измерениях используется и другая размерность - Ом1см2моль 1,, соответствующая такому физическому смыслу: проводимость объёма раствора (см3), содержащего молярную массу эквивалента растворённого вещества, и заключённого между двумя плоскопараллельными электродами площадью в 1 см2 каждый и находящимися на расстоянии 1 см друг от друга. Между эквивалентной и удельной проводимостями существует взаимосвязь, выражаемая уравнениями = или где =V, (9.2) С С - концентрация электролита, моль/м3; V - разведение, V = 1/C, м3/моль. Термин “разведение” не следует путать с термином “разбавление”. Разведение - это объём раствора, в котором содержится 1 моль или 1 молярная масса эквивалента электролита, тогда как под разбавлением подразумевается доливание растворителя к раствору, приводящее к уменьшению концентрации. При использовании в вычислениях концентрации, выраженной в моль/л, и и , выраженных соответственно в Ом1см2моль 1 и Ом1см1, в уравнение (9.2) вводится пересчётный коэффициент 1000: 1000 = или = 1000V, (9.2) С Как и удельная, эквивалентная проводимость зависит от природы электролита и растворителя, от температуры и концентрации. Но зависи- 180 мость от концентрации носит другой характер, а именно: с увеличением концентрации её величина уменьшается, как показано на рис. 9.2. При очень малых концентрациях (т. е. при очень больших разведениях) Рис. 9.2. Зависимость эквивалентной электрической проводимости растворов электролитов от концентрации эквивалентная проводимость стремится к какому-то определённому для каждого данного электролита значению, называемому эквивалентной электрической проводимостью при бесконечном разведении (иначе предельной эквивалентной проводимостью). Предельная эквивалентная электрическая проводимость является одной из важнейших характеристик электролита. Она представляет собой гипотетическую эквивалентную проводимость бесконечно разбавленного раствора, в котором отсутствуют С межионные взаимодействия. В соответствии с законом Ф.В.Г.Кольрауша (1879): В бесконечно разбавленном растворе ионы движутся независимо один от другого, величина может быть вычислена как сумма предельных ионных электрических проводимостей (подвижностей ионов): = к + а (9.3) где к и а - подвижность катиона и аниона соответственно. 181 Подвижность ионов связана с абсолютной скоростью их движения v выражением к = Fvк и к = Fvк . где F - число Фарадея. Подвижности ионов или ионные проводимости, являющиеся характерными электрохимическими константами, приводятся в справочных таблицах. Их значения зависят от природы ионов, но в большинстве случаев они лежат в пределах 40 80 Ом1см2моль1. Однако обращает на себя внимание аномально высокая подвижность ионов водорода (точнее, гидроксония), равная 349,8 и гидроксид-аниона, равная 199,2 Ом1см2моль1 при 25оС. Такие значения Н+ и ОН обусловлены тем, что движение иона гидроксония Н3О+ под действием электрического поля происходит не только в результате непосредственной миграции их в среде, но и по особенному механизму. Ион водорода притягивается к кислородному атому дипольной молекулы, ближайшей к нему. При этом из-за возникновения между ними водородной связи образуется ион гидроксония. Один из атомов водорода этого иона, соответствующим образом ориентированный, отрывается от гидроксония и соединяется водородной связью с другой молекулой воды, лежащей ближе к отрицательному электроду. Таким образом, происходит “перескакивание” ионов водорода от одной молекулы воды к другой, в результате чего у поверхности электрода оказывается совсем не тот ион водорода, который начал движение при включении электрического тока, а другой (см. рис. 9.3, слева).. При таком механизме движения ионам водорода не нужно преодолевать механическое сопротивление среды, что и приводит к их высокой подвижности. Направление движения ионов Н+ и Н3О+ + Н О Н+ О Н Н Н + Направление движения ионов ОН О Н+ ОН Н Рис. 9.3. «Эстафетный» механизм движения ионов Н+ и ОН 182 Гидроксид-ионы перемещаются по подобному механизму, но в противоположном направлении (рис. 9.3, справа). При соединении с молекулой воды они образуют с ней ковалентную связь, более прочную, чем водородная. И так как на разрыв этой связи требуется больше энергии, движение ионов ОН несколько затруднено по сравнению с ионами Н+, и их подвижность примерно в 1,5 раза меньше. 183 9.6. Кондуктометрические измерения Кондуктометрия - совокупность электрохимических методов исследования и анализа, основанных на измерении удельной электрической проводимости растворов электролитов, которая зависит от их концентрации. Достоинствами высокая кондуктометрии точность, простота являются высокая чувствительность, методик, возможность исследования окрашенных и мутных растворов, доступность аппаратуры, а также возможность автоматизации анализа. Вместе с тем, поскольку измеряется общее сопротивление (общая проводимость) раствора, помещаемого в ячейку, при кондуктометрических измерениях требуется тщательная очистка реактивов. Используемые приборы - кондуктометры различных конструкций, в основе которых лежит известная схема моста Уитстона. Ячейка для измерения проводимости тоже может иметь различное устройство и размеры, но общим требованием является применение инертных электродов, изготовляемых обычно из платинированной платины. Платинирование, т. е. покрытие электродов слоем порошка тонкодисперсной платины (“платиновой черни”), нужно для увеличения эффективной площади поверхности электродов. Различают прямую кондуктометрию и кондуктометрическое титрование. 9.6.1. Прямая кондуктометрия При прямой кондуктометрии на основе электрической проводимости раствора определяют различные характеристики растворённых веществ. Этим методом можно определять степень и константу диссоциации электролита, измерять концентрацию растворённого вещества, в том числе и растворимость малорастворимых соединений и др. 184 Перед началом измерительной ячейки измерений Кя, необходимо что делается определить при помощи константу измерения сопротивления эталонного раствора R (обычно это 0,2 М раствор KCl): Кя = RKCl KCl , где KCl - удельная электрическая проводимость раствора KCl при данной температуре (берётся из справочника). Примером прямого кондуктометрического определения служит определение степени и константы диссоциации слабого электролита . Вначале измеряется сопротивление исследуемого раствора R, после чего вычисляется его удельная проводимость: = Кя /R Степень диссоциации можно рассчитать по отношению = / (9.4) причём вычисляется из удельной проводимости по уравнению (9.2), а - по закону Кольрауша (9.3). Подставляя (9.4) в уравнение закона разведения В.Ф.Оствальда (1888): 2 С К = , 1 (9.5) получим 2 С К = . ( ) (9.6) С помощью уравнений (9.5) и (9.6), зная концентрацию слабого электролита С, можно вычислить его константу диссоциации. Подробные описания других кондуктометрических методик приводятся в многочисленных руководствах и практикумах. 9.6.2. Кондуктометрическое титрование Кондуктометрическое титрование - метод определения концентрации вещества, основанный на изменении удельной проводимости раствора при титровании. Изменение связано с изменением концентраций ионов с 185 различной подвижностью, происходящим при химических реакциях в титруемом растворе. Кондуктометрическое титрование можно проводить в окрашенных или мутных растворах. При нём не следует опасаться перетитровать раствор, более того, для нахождения точки эквивалентности это даже необходимо. Кривые титрования, представляющие собой зависимость от объёма V титранта, добавляемого к исследуемому раствору, имеют излом в точке эквивалентности, причём форма кривых зависит от природы титранта и титруемого вещества. При кондуктометрическом титровании наиболее широко используются реакции кислотно-основного взаимодействия. При этом возможны следующие типичные случаи. 1) Титрование раствора сильной кислоты раствором сильного основания. Кривая титрования имеет вид, показанный на рис. 9.4, а. а б в V, мл Рис. 9.4. Кривые кондуктометрического титрования а – сильной кислоты сильным основанием, б – слабой кислоты сильным основанием, в – смеси сильной и слабой кислот сильным основанием 186 При постепенном добавлении к раствору кислоты (например, HCl) раствора основания (например, NaOH) концентрация ионов водорода уменьшается из-за связывания их гидроксид-ионами с образованием воды. Одновременно в растворе появляются ионы Na+, концентрация которых всё время увеличивается. Как было показано в п. 9.5, подвижность ионов Н + намного больше подвижности ионов Na+. Поэтому проводимость раствора заметно уменьшается вплоть до точки эквивалентности, при которой достигается минимальное значение . После связываания всех ионов Н+, когда в титруемом растворе появляются всё новые ионы ОН, а вместе с ними и ионы Na+, проводимость начинает увеличиваться. Благодаря этому на кривой титрования в точке эквивалентности появляется излом. По его положению определяется точный объём титранта, пошедший на титрование. Следует обратить внимание на то, что наклон второй ветви кривой титрования менее крут, чем первой, так как подвижность ионов ОН меньше, чем подвижность ионов Н+. При титровании раствора основания раствором кислоты соотношение наклонов ветвей кривой будет обратным. 2) Титрование раствора слабой кислоты раствором сильного основания. Кривая титрования имеет вид, показанный на рис. 9.4, б. В этом случае при добавлении раствора сильного основания (например, NaOH) к раствору слабой кислоты (например, СН3СООН) концентрация ионов водорода вплоть до точки эквивалентности будет оставаться практически постоянной, так как титруются только свободные ионы Н+, возникающие при диссоциации слабой кислоты. Проводимость при этом будет несколько возрастать за счёт увеличения концентрации ионов Na+. После достижения точки эквивалентности зависимость проводимости от объёма титранта будет иметь такой же характер, как и предыдущем случае. 2) Титрование смеси растворов сильной и слабой кислот раствором сильного основания. Общий вид кривой титрования показан на рис. 9.3, в. Из-за присутствия в растворе сильной кислоты диссоциация слабой подавляется и вначале в реакцию нейтрализации будут вступать только ионы 187 водорода, принадлежащие сильной кислоте. После того, как вся она будет оттитрована, начнётся диссоциация и последующая нейтрализация слабой кислоты и на кривой титрования появится первый излом, отвечающий объёму титранта, необходимому для полной нейтрализации сильной кислоты. Далее кривая титрования подчиняется тем же закономерностям, что и в случае 2. На практике ветви кривых титрования могут получаться нелинейными, что связано с разбавлением раствора при добавлении титранта. Во избежание этого следует применять растворы титранта, значительно концентрированные, чем титруемые растворы (обычно в 10 раз). 188 более ГЛАВА 10 ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ 10.1. Основные понятия и величины Величина электрического заряда Q, перемещаемого из одной точки пространства в другую, измеряется в кулонах. Кулон (Кл) равен электрическому заряду, проходящему через поперечное сечение проводника при силе тока 1 ампер за время 1 с (1 Кл = 1 Ас). Разность потенциальной энергии единичных зарядов в двух различных точках пространства измеряется в вольтах (1 В = 1 Дж/Кл). Для того, чтобы между двумя точками пространства возник электрический ток, между ними напряжение, равное работе электрического единичного положительного должно существовать поля заряда из одной по точки некоторое перемещению в другую. В электростатическом поле эта работа не зависит от пути, по которому перемещается заряд; при этом напряжение совпадает с разностью потенциалов точек. Если же рассматривается напряжение не в потенциальном поле, а в каком-либо теле (проводнике) или в системе из нескольких проводников, то работа переноса заряда зависит от пути. В этом случае напряжение равно электродвижущей силе Е. Электронопроводящие фазы (металлы или полупроводники), контактирующие с ионными проводниками (растворами электролитов, которые в электрохимии часто называют просто электролитами), называются электродами. Различают обратимые и необратимые электроды. На обратимых электродах протекают обратимые окислительно- восстановительные реакции. При перемене направления электрического тока меняется на противоположное и направление реакции. При этом независимо от направления тока в приэлектродном пространстве присутствуют одни и те же ионы (или молекулы). На необратимых электродах при изменении 189 направления тока происходят реакции, приводящие к образованию ионов или молекул, отличающихся от тех, которые присутствовали в приэлектродном пространстве до этого. Примером обратимого электрода служит медь в растворе, содержащем ионы Cu2+. При прохождении тока в противоположных направлениях идут реакции Cu2+ + 2e Cu0 и Cu0 Cu2+ + 2e. То есть, можно сказать, что на медном электроде при этом протекает обратимая реакция Cu0 Cu2+ + 2e. Та же медь, помещённая в раствор кислоты, будет необратимым электродом, так как при различных направлениях тока на её поверхности будут протекать реакции, не являющиеся обратимыми по отношению друг к другу: Cu2+ + 2e Cu0 и 2Н+ + 2e Н2. Обратимые электроды, соединённые друг с другом металлическим проводником, образуют цепь. В цепи также должен иметься контакт между растворами электролитов, осуществляемый с помощью т. н. электролитических мостиков или ключей. Цепь может состоять из одной или из нескольких гальванических (электрохимических) ячеек, в каждую из которых входят ионопроводящий электролит и два разнородных электрода. Иногда электрод вместе с контактирующим с ним электролитом называют полуэлементом. В зависимости от того, как работает электрохимическая ячейка, она будет иметь различное название. Если ячейка служит для получения электрического тока за счёт протекающей в ней окислительновосстановительной реакции, то она называется химическим источником тока (ХИТ) или гальваническим элементом (ГЭ). Если же через ячейку пропускается электрический ток от внешнего источника, приводящий к электрохимическим превращениям в ней, т. е. к электролизу, она называется электролизёром. Электрохимические реакции, протекающие в электролизёре или в гальваническом элементе, представляют собой окислительно-восстановительные реакции, которые осуществляются таким образом, что процессы 190 окисления и восстановления разделены в пространстве. При электролизе или при работе гальванического элемента через границу, отделяющую электрод от электролита, проходят электроны. Электрод, отдающий электроны в раствор, и на поверхности которого происходит реакция восстановления, принято называть катодом, а электрод, принимающий электроны из раствора, и на поверхности которого идет реакция окисления, - анодом. Таким образом, в гальваническом элементе катод заряжается положительно, а анод – отрицательно. В электролизёре, наоборот, анод заряжается положительно, а катод - отрицательно. Термодинамические свойства электрода могут быть описаны с помощью электродного потенциала, определяемого как работа, необходимая для переноса единичного заряда (электрона) из бесконечно удалённой точки контактирующего раствора электролита на поверхность электрода. Наиболее принятой в настоящее время теорией, объясняющей возникновение скачка потенциала на поверхности раздела “металл раствор”, является сольватационная теория электродного потенциала. Её основы были высказаны Л.В.Писаржевским (1912 - 14), затем были развиты Н.А.Изгарышевым и другими исследователями. Согласно этой теории скачок потенциала на границе “металл - раствор” обусловлен двумя процессами: 1) диссоциацией атомов металла на ионы и электроны внутри металла; 2) сольватацией ионов металла, находящихся на поверхности, при соприкосновении с раствором. Сольватированные ионы выходят в раствор. Поверхность металла при этом заряжается отрицательно. Положительно заряженные ионы металла электростатическими силами удерживаются вблизи поверхности раздела фаз, образуя так называемый двойной электрический слой. Подробнее строение двойного электрического слоя будет рассмотрено в курсе коллоидной химии. 191 Разность электрических потенциалов двух электродов при отсутствии тока называется электродвижущей силой (э. д. с. или ЭДС) Е гальванического элемента. Измерение ЭДС можно использовать для получения термодинамических величин и, наоборот, с помощью термодинамических величин, найденных другим путём, можно рассчитать ЭДС, так как эта величина зависит от константы равновесия окислительновосстановительной реакции, протекающей в гальваническом элементе. 10.2. Электроды первого и второго рода. Газовые электроды Пластинка или проволока из металла, погружённая в раствор, содержащий ионы этого металла, представляет собой обратимый электрод первого рода. Примером такого электрода является описанный выше обратимый медный электрод. В общем виде формула электрода 1-го рода записывается так: Ме Меz+ (а), где Ме - металл электрода, Меz+ - ион металла с зарядом z+, а - активность иона в растворе. Вертикальная черта обозначает поверхность раздела между металлом и раствором. На поверхности обратимых электродов 1-го рода происходит обратимая реакция, в общем виде выражаемая уравнением Ме0 Меz+ + zе. Например, для медного электрода: формула - Cu Сu2+ (а), электродная реакция - Cu0 Cu2+ + 2е. Электроды второго рода состоят из металла, покрытого слоем малорастворимого соединения этого металла, погружённого в раствор, содержащий анионы этого соединения. Малорастворимым соединением может быть какая-либо соль, а также оксид или гидроксид. Формула электрода 2-го рода в общем виде выглядит так: 192 Ме МеAn; An z (а) , где An – анион, а электродная реакция - МеAn + zе Ме0 + Anz . Электроды 2-го рода обладают высокой стабильностью, которая позволяет поддерживать значение их электродного потенциала с высокой точностью в течение очень длительного времени. Поэтому они используются в лабораторных и промышленных электрохимических установках в качестве электродов сравнения. Электрод сравнения это такой электрод, по отношению к которому измеряется потенциал другого электрода в каких-либо электрохимических устройствах. Электроды сравнения применяются, например, в рН-метрах, в установках для потенциометрического титрования, в полярографах и т. п. Для того, чтобы данный электрод можно было использовать в качестве электрода сравнения, необходимо поддерживать строго определённую концентрацию ионов, участвующих в электродной реакции на его поверхности. В лабораторной практике наиболее часто из электродов 2-го рода применяются хлоридсеребряный и каломельный электроды. Хлоридсеребряный электрод (ХСЭ) представляет собой серебряную проволоку, покрытую слоем хлорида серебра и помещённую в пробирку, заполненную раствором хлорида калия. Как правило, используется насыщенный раствор, так как в нём концентрация KCl, а следовательно, и ионов Cl, от которых зависит потенциал электрода, самопроизвольно поддерживается постоянной при частичном испарении раствора или при колебаниях влажности воздуха. Для контакта с исследуемым раствором дно пробирки делается не сплошным, а в виде узкой оттянутой трубки (капилляра), обычно заполненной асбестом. Формула хлоридсеребряного электрода: AgAgCl; Cl (a), электродная реакция, протекающая на нём: 193 АgCl + e Аg0 + Cl. Потенциал этого электрода с насыщенным раствором KCl (т. н. насыщенного хлоридсеребряного электрода) при 25 оС равен +0,222 В. Ещё одним электродом сравнения является каломельный электрод. Он представляет собой пробирку, на дне которой находится металлическая ртуть. На поверхность ртути помещается слой пасты, состоящей из тонко измельченной каломели Hg2Cl2, смешанной с металлической ртутью и с хлоридом калия. Поверх каломельной пасты наливается раствор хлорида калия. Для осуществления электрического контакта используется платиновая проволока, изолированная от каломельной пасты и от раствора хлорида калия. Обычно она впаивается в дно пробирки. Для контакта раствора хлорида калия с исследуемым раствором к пробирке припаивается тонкая стеклянная трубка с оттянутым кончиком, которая тоже заполнятся раствором KCl (“капилляр Луггина”). Формула каломельного электрода: Hg | Hg2Cl2; Cl-(a) или с отображением платинового ввода Pt | Hg | Hg2Cl2; Cl-(a), протекающая на нём электродная полуреакция: Hgo + Cl(a) 1/2 Hg2Cl2 + e, Каломельные электроды применяются в основном в трёх различных вариантах: с насыщенным (“насыщенный каломельный электрод”, НКЭ), нормальным и децинормальным растворами KCl в качестве электролита. Потенциалы этих электродов измерены с большой точностью. При T = 25оС они равны: Из всех НКЭ + 0.2415 В, 1н. KCl + 0.2812 В, 0,1н. KCl + 0.3341 В. электродов сравнения наиболее стабильное значение потенциала позволяет получить именно каломельный электрод. Его потенциал может сохраняться неизменным в течение многих лет. Поэтому 194 каломельные электроды, в особенности НКЭ, применяются для высокоточных (прецизионных) измерений. При работе с каломельным электродом следует соблюдать меры предосторожности, так как металлическая ртуть вредна для здоровья. Кроме того, следует следить за тем, чтобы платиновый ввод не соприкасался с каломельной пастой, что приводит к искажениям в работе электрода. В газовых электродах элементом, участвующим в электродной реакции окисления - восстановления, является какой-либо газ (водород, кислород, хлор и др.). Наиболее распространённым из них и важным для практики является водородный электрод. Рассмотрим устройство и принцип действия газовых электродов на его примере. Водородный электрод представляет собой пластинку из платинированной (т. е. покрытой слоем тонкодисперсной платины чёрного цвета - “платиновой черни”) платины, погружённой в раствор кислоты. В принципе возможно использование любой кислоты, но на практике чаще всего используется серная из-за её малой летучести. Через раствор кислоты снизу пропускается газообразный водород, «омывающий» поверхность платины. Мельчайшие пузырьки водорода задерживаются пористой поверхностью платиновой черни и обездвиживаются. Избыток водорода удаляется в атмосферу. В таком электроде электрохимически активным элементом является молекулярный водород, а платина служит только токопроводящей подложкой. Формула водородного электрода: Pt H2 ; H+ (a), электродная реакция, протекающая на нём: 1/2 H2 H+ + e. Водородный электрод, активность ионов H+ в котором равна 1 моль/л, называется нормальным водородным электродом. Нормальный водородный электрод, в котором поддерживается давление газообразного Н2, равное 1 атм, называется стандартным водородным электродом. 195 Стандартный водородный электрод, точнее его потенциал, играет большую роль в электрохимии. Дело в том, что потенциал любого отдельно взятого электрода не может быть измерен экспериментально. Измерить можно только электродвижущую силу гальванического элемента, составленного из двух электродов. Точкой отсчёта при измерениях ЭДС, а значит, и электродных потенциалов, является потенциал стандартного водородного электрода при 25оС, условно принятый равным нулю. Все электродные потенциалы, приводимые в справочных таблицах, строго говоря, являются значениями разности потенциалов данного электрода и стандартного водородного электрода. Хорошо известный ряд напряжений металлов составлен на основании этих разностей потенциалов. Водородный электрод может использоваться и в качестве электрода сравнения. При этом необходимо следить за постоянством поддержания давления Н2 и концентрации ионов Н+ в электролите. Водородный электрод представляет собой довольно громоздкую установку, в которую входит баллон с редуктором для поддержания нужного давления водорода (или в простейшем варианте аппарат Киппа). Газообразный водород взрывоопасен, поэтому при работе с ним следует соблюдать меры предосторожности. Кроме того, несмотря на низкую летучесть серной кислоты, концентрация её в растворе при работе с установкой всё-таки изменяется из-за уноса с водородом как самой H2SO4, так и в особенности воды в виде паров. Следует также помнить и об опасности работы с серной кислотой. По указанным причинам в обычной лабораторной практике водородный электрод используется редко. 10.3. Термодинамика гальванического элемента Рассмотрим гальванический элемент, состоящий из водородного и хлоридсеребряного электродов (рис. 10.1). Растворы, в которые погружены электроды, должны быть приведены в соприкосновение, например, с помощью трубки 1, заполненной раствором (обычно - раствором KCl), или полоски фильтровальной бумаги, пропитанной им. 196 Когда оба электрода соединяются каким-либо проводником (внешней цепью 2), в проводнике появляется электрический ток, который может быть зарегистрирован гальванометром 3, включённым во внешнюю цепь. При этом в элементе протекает электрохимическая реакция. Молекулы газообразного водорода отдают электроны платине и превращаются в ионы водорода, а ионы серебра из AgCl вступают в реакцию с электронами, поступающими по проводнику, и образуют металлическое серебро. Возникновение разности электрических потенциалов между электродами обусловлено тем, что Н2 с большей лёгкостью отдает электроны в присутствии H+, чем Cl в присутствии ионов Ag+. 2 3 2 Ag Pt AgCl 1 Н2, р 4 KCl; а2 Н2SO4; а1 Рис. 10.1. Схема гальванического элемента, составленного из водородного (слева) и хлоридсеребряного (справа) электродов Реакции, идущие на электродах данного гальванического элемента, выражаются такими уравнениями Анод: 1/2 H2o (p) = H+ (a1) + e Катод: AgCl + e = Ago + Cl (a2) 197 Объединяя эти два уравнения (“уравнения полуреакций”), получим суммарное уравнение реакции, протекающей в работающем гальваническом элементе: 1/2 H2o (p) + AgCl = Ago + H+ (a1) + Cl (a2). Направление реакции в гальваническом элементе можно изменить на противоположное, если к электродам приложить внешнее напряжение, большее по величине, чем равновесное значение его ЭДС. Тогда реакции на электродах пойдут в обратном направлении: водородный электрод станет катодом, а хлоридсеребряный - анодом. В этом случае уравнения реакций будут выглядеть так: Катод: H+ (a) + e = ½ H2o(p) Анод: Ago + Cl(a) = AgCl + e Суммарное уравнение реакции: Ago + H+ (a) + Cl- (a) = ½ H2o (p) + AgCl При снятии внешней ЭДС, которая приводит разрядившийся элемент в рабочее состояние, он вновь будет способен генерировать электрический ток вплоть до того момента, когда весь хлорид серебра восстановится в металлическое серебро. Гальванический элемент, полностью восстанавливающий свои свойства при наложении внешней противоположно направленной ЭДС, называется обратимым. Если в рассматриваемом элементе водородный электрод заменить, например, на цинковый, то такой новый элемент при замыкании внешней цепи тоже сможет давать ток, так как металлический цинк способен отдавать электроны по реакции: Zn0 = Zn2+ + 2e. Однако при наложении внешней ЭДС в этом элементе на катоде будут восстанавливаться не ионы Zn2+, а ионы Н+ (поскольку цинк в ряду напряжений стоит левее водорода). Поэтому данный элемент не может вернуться в первоначальное состояние. Такой элемент и другие, ведущие себя подобным 198 образом, называются необратимыми. Необратимые гальванические элементы являются одноразовыми. Примерами одноразовых необратимых элементов могут служить широко распространенные элементы типа элемента Лекланше, используемые в бытовых электрических приборах (часах, магнитофонах, радиоприёмниках, детских игрушках, микрокалькуляторах и т. п.). Обратимые гальванические элементы, применяемые в быту, промышленности, на транспорте, носят название аккумуляторов. Следует помнить, что если в одной и той же жидкой среде, содержащей электролиты, находятся различные металлы, то всегда имеется возможность создания гальванической пары, что приводит к электрохимической коррозии за счет растворения более электрохимически активного металла. Например, по этой причине происходит коррозия трамвайных рельсов во влажной почве или разрушение стальных искусственных зубов при наличии во рту золотых и т. д. 10.4. Формула записи гальванического элемента Объединяя друг с другом различные полуэлементы в произвольных сочетаниях, можно получать гальванические элементы. Формулы элементов составляются из формул отдельных электродов. При составлении формулы ГЭ следует соблюдать правило, согласно которому справа записывается более положительный полуэлемент. Так, рассмотренный ранее водородно-хлоридсеребряный гальванический элемент можно записать следующей формулой: () Pt | H2 (p); H+(a) || Cl-(a); AgCl |Ag (+), где одиночные вертикальные линии обозначают поверхности раздела фаз, а двойная вертикальная линия в первом приближении обозначает контакт двух растворов. (На самом деле она показывает, что в данном ГЭ приняты меры к уменьшению диффузионного потенциала, о чём будет сказано ниже). . Ещё один пример формула медно-цинкового элемента Даниэля Якоби, состоящего из цинкового электрода, погружённого в раствор, содержащий ионы Zn2+ (чаще всего это раствор сульфата цинка), и медного 199 электрода, погружённого в раствор, содержащий ионы Cu2+ (обычно это раствор сульфата меди): () Zn | Zn2+(a1) || Cu2+(a2) | Cu (+). При рассмотренном способе записи формулы ГЭ отображается только внутренняя цепь, состоящая из электродов и растворов электролитов. Полная формула требует отображения и внешней цепи, состоящей из проводников, соединяющих электроды: () Cu |Zn | Zn2+(a1) || Cu2+(a2) | Cu (+). Помещённый в левой части этой формулы символ Cu показывает, что внешняя цепь состоит из медных проводников. (По причинам, рассмотренным ниже, весь монтаж следует выполнять проводниками из одного и того же металла. При этом получается так называемый “правильно разомкнутый элемент”). Строго говоря, электродвижущая сила представляет собой разность потенциалов на концах (полюсах) именно правильно разомкнутого элемента. 10.5. Уравнение Нернста Для произвольной обратимой реакции, протекающей в гальваническом элементе aA bB изменение энергии Гиббса может быть выражено уравнением изотермы химической реакции: aBb G = RT (ln Ka ln ) aAa или aBb G = RT ln Ka RT ln . aAa 200 Так как при стандартных условиях RT ln Ka = Gо, можно записать (заменяя знаки на противоположные): aBb G = Gо + RT ln , (10.1) a aA где аА и аВ - активности (эффективные концентрации) ионов, относительно которых обратимы электроды в растворах. Поскольку энергия Гиббса реакции равна её максимальной полезной работе: G = w’max, а эта работа в свою очередь есть электрическая работа, совершаемая гальваническим элементом, то можно записать такие равенства, связывающие G и электродвижущую силу E: w’max = G = neFE; G E = , neF (10.2) и при стандартных условиях: w’оmax = Gо = neFEо; где Gо Eо = , (10.3) neF ne - число электронов, принимающих участие в электрохимической реакции, F - число Фарадея (F 96500 Кл/моль), E0 - стандартная ЭДС (определяемая при давлении 1 атм, активности всех ионов 1 моль/л и температуре 25oC). Тогда, заменяя в уравнении (10.1) соответствующие величины равными им из уравнений (10.2) и (10.3), получим уравнения В.Нернста для расчёта электродвижущей силы гальванического элемента (1881 г.): RT aBb Е = Ео ln , neF aAa (10.4) или 201 RT aAa Е = Ео + ln , (10.5) b neF aB В уравнении Нернста аА представляет собой активность ионов, участвующих в восстановлении на катоде, а аВ - активность ионов, участвующих в окислении металла анода. Например, для элемента Даниэля Якоби, в котором идет реакция: Zn0 + Cu2+ = Zn2+ + Cu0 уравнение Нернста будет выглядеть так: RT aCu2+ aZn Е = Е + ln neF aZn2+ aCu или, поскольку активности меди и цинка в виде металлов равны 1, о RT aCu2+ Е = Е + ln . neF aZn2+ Данное уравнение можно также записать в виде: о RT RT о Е = Е Cu2+/Cu + ln aCu2+ Е Zn2+/Zn + ln a Zn2+ , (10.6) neF neF о о где Е Cu2+/Cu и Е Zn2+/Zn - стандартные электродные потенциалы меди и о цинка. В этом уравнении стандартная ЭДС принимается равной разности стандартных электродных потенциалов. Выражения RT ЕCu2+/Cu = Е Cu2+/Cu + ln aCu2+ neF о (10.7) и RT ЕZn2+/Zn = представляют собой ЕоZn2+/Zn + ln a Zn 2+ уравнения neF Нернста для (10.8) расчёта электродных потенциалов меди и цинка. В общем виде уравнение Нернста для расчёта электродных потенциалов выглядит так: 202 RT ЕMez+/Ме = Е Mez+/Ме + ln aMez+ (10.9) neF где Е Mez+/Ме - потенциал электрода, изготовленного из металла Ме при о активности ионов этого металла Меz+, равной aMez+, Ео Mez+/Ме - стандартный электродный потенциал, измеренный относительно стандартного водородного электрода при a Mez+ = 1 моль/л. Значения стандартных электродных потенциалов приводятся в справочных таблицах. Из уравнений (10.6) (10.8) следует, что выражение для электродвижущей силы элемента Даниэля Якоби может быть записано в виде Е = ЕCu2+/Cu ЕZn2+/Zn . Так как медный электрод является более положительным, а цинковый более отрицательным, то Е = Е+ Е . (10.10) Выражение (10.10) справедливо для всех гальванических элементов. Оно является математическим выражением правила: Электродвижущая сила гальванического элемента равна разности между электродными потенциалами более положительного и более отрицательного электродов. При расчётах с соблюдением этого правила значение ЭДС должно всегда получаться положительным. Если в уравнении Нернста заменить натуральный логарифм десятичным и подставить значения всех констант, то для температуры 25оС = 298 К получим: RT 8,314298 0,0591 ln a Mez+ = 2,303 lg a Mez+ = lg a Mez+ neF ne96500 ne При этом уравнение Нернста для ЭДС может быть записано в виде 0,0591 aAa Е = Ео + lg , ne aBb а для электродного потенциала - (10.11) 203 0,0591 Е Mez+/Ме = Е Mez+/Ме + lg a Mez+ (10.12) ne Уравнения (10.11) и (10.12) иногда называют уравнениями Петерса или о Нернста Петерса. При очень малых концентрациях, когда активность ионов в приэлектродных растворах практически равна концентрации, величину aMez+ можно заменить на CMez+, где С - молярная (или, чаще, моляльная концентрация). В этом случае уравнения Нернста записываются в виде RT СAa Е = Ео + ln neF CBb и RT Е Mez+/Ме = Е Mez+/Ме + ln C Mez+ neF и называются уравнениями Тюрина (или Нернста - Тюрина). о Уравнения Нернста являются фундаментальными уравнениями термодинамики гальванического элемента. 10.6. Контактный и диффузионный потенциалы Практически измеренное точное значение ЭДС обычно отличается от теоретически рассчитанного по уравнению Нернста на некоторую малую величину, которая связана с разностями потенциалов, возникающими в месте контакта различных металлов (“контактный потенциал”) и различных растворов (“диффузионный потенциал”). Контактный потенциал (точнее, контактная разность потенциалов) связан с различным значением работы выхода электрона для каждого металла. При каждой данной температуре он является постоянным для данного сочетания металлических проводников гальванического элемента и входит в ЭДС элемента как постоянное слагаемое. 204 Диффузионный потенциал возникает на границе между растворами различных электролитов или одинаковых электролитов с различной концентрацией. Его возникновение объясняется различной скоростью диффузии ионов из одного раствора в другой. Диффузия ионов обусловлена различным значением химического потенциала ионов в каждом из полуэлементов. Причем её непрерывного изменения скорость изменяется концентрации, а во значит, времени и . из-за Поэтому диффузионный потенциал имеет, как правило, неопределённое значение, так как на него влияют многие факторы, в том числе и температура. При обычных практических работах значение контактного потенциала сводят к минимуму применением монтажа проводниками, изготовленными из одного и того же материала (обычно меди), а диффузионного потенциала использованием специальных устройств, называемых электролитическими (солевыми) мостиками или электролитическими ключами. Они представляют собой трубки различной конфигурации (иногда снабженные кранами), заполненные концентрированными растворами нейтральных солей. У этих солей подвижности катиона и аниона должны быть приблизительно равны друг другу (Например, KCl, NH4NO3 и т. п.). В простейшем случае электролитический мостик может быть изготовлен из полоски фильтровальной бумаги или асбестового жгутика, смоченных раствором KCl. При использовании электролитов на основе неводных растворителей в качестве нейтральной соли обычно применяется хлорид рубидия. Достигнутыми в результате принятых мер минимальными значениями контактного и диффузного потенциалов обычно пренебрегают. Однако при электрохимических измерениях, требующих большой точности, контактный и диффузионный потенциалы следует учитывать. То обстоятельство, что в данном гальваническом элементе имеется электролитический мостик, отображается двойной вертикальной чертой в его формуле, стоящей в месте контакта двух электролитов. Если же 205 электролитический мостик отсутствует, то в формуле ставится одиночная черта. 206 ГЛАВА 11 ПОТЕНЦИОМЕТРИЧЕСКИЕ ИЗМЕРЕНИЯ 11.1. Потенциометрия Потенциометрия - электрохимический метод исследования и анализа, основанный на определении зависимости между равновесным электродным потенциалом и термодинамической активностью (концентрацией) компонентов, участвующих в электрохимической реакции. Математически эта зависимость описывается уравнением Нернста. При потенциометрических измерениях составляют гальванический элемент с индикаторным (измерительным) электродом и электродом сравнения и измеряют ЭДС этого элемента. Различают прямую потенциометрию и потенциометрическое титрование (последнее здесь не описывается, так как излагается в курсе аналитической химии). 11.2. Потенциометрическое определение рН растворов. Ионометрия Для провизора из методов прямой потенциометрии наибольшее значение имеет потенциометрическое определение рН растворов. Рассмотрим принцип этого метода. Основной частью лабораторного рН-метра является датчик, состоящий из индикаторного (измерительного) электрода, опущенного в исследуемый раствор, и электрода сравнения (чаще всего хлоридсеребряного). Если в качестве измерительного электрода используется водородный электрод, то датчик представляет собой гальванический элемент, рассмотренный в п. 10.3: () Pt | H2 (p); H+(a) || Cl-(a); AgCl |Ag (+). Электродвижущая сила этого элемента, если пренебречь контактным и диффузионным потенциалами, равна разности между потенциалами хлоридсеребряного ЕХСЭ и водородного ЕН+/Н2 электродов: 207 Е = ЕХСЭ ЕН+/Н2 В соответствии с уравнением Нернста потенциал водородного электрода будет равен (при 25оС): ЕН+/Н2 = 0,0591 lg aH+ или, так как рН = lg aH+ ЕН+/Н2 = 0,0591 рН. Отсюда Е = ЕХСЭ + 0,0591 рН и, следовательно, Е ЕХСЭ рН = (11.1) 0,0591 Как уже было отмечено, потенциал хлоридсеребряного электрода в насыщенном растворе KCl при 25оС равен + 0,222 В. Значит, Е = + 0,222 (0,0591 рН), откуда получаем Е 0,222 рН = (11.2) 0,0591 То есть, измеряя ЭДС рассмотренного гальванического элемента, можно вычислить рН раствора, контактирующего с водородным электродом. В том случае, если вместо хлоридсеребряного электрода используется насыщенный каломельный электрод (НКЭ), потенциал которого равен + 0,2415 В, расчёт Е 0,2415 рН = 0,0591 рН ведется по уравнению: Использование водородного электрода по указанным выше причинам в обычной лаборатории, в том числе и в аптеке, неудобно, поэтому в лабораторных рН-метрах в качестве индикаторного электрода применяют стеклянный электрод. 208 Стеклянный электрод состоит из специального сосуда, в котором находится хлоридсеребряный электрод, погруженный в раствор HCl с определённой концентрацией. Дно сосуда, имеющее форму тонкостенного шарика, представляет собой мембрану из специального стекла, содержащего ионы лёгких щелочных металлов (лития или натрия), способные обмениваться с находящимися в растворе ионами водорода. Стеклянный шарик электрода погружается в исследуемый раствор, с которым при помощи электролитического мостика соединяется хлоридсеребряный электрод сравнения. Получается гальванический элемент с формулой. Ag | AgCl ; Cl, H+ | стеклянная мембрана | исследуемый р-р || ХСЭ. Экспериментально найдено, что потенциал стеклянного электрода изменяется с изменением активности водородных ионов таким же образом, как и потенциал водородного электрода, то есть на 0,0591 В на единицу рН при 25оС. Таким образом, стеклянный электрод является заменителем водородного электрода. Поэтому значение рН исследуемого раствора при измерениях с помощью рН-метра, в котором установлен стеклянный электрод, может быть вычислено с помощью уравнений (11.1) или (11.2). Измерение ЭДС и пересчёт её в единицы рН осуществляется высокочувствительным вольтметром (потенциометром). Для измерения ЭДС и рН нельзя пользоваться обычным вольтметром. Для этого необходимо применять прибор с большим входным сопротивлением, в результате чего через прибор протекает настолько малый ток, что измеряемая величина представляет собой не напряжение на электродах, а электродвижущую силу элемента. Разработаны электронные схемы и на их основе сконструированы достаточно компактные приборы, которые позволяют измерять значение рН с точностью до 0,001 единицы рН. Однако для практических целей достаточна точность 0,01 единицы рН, которую дают обычные лабораторные приборы. Перед измерением рН стеклянный электрод 209 обязательно калибруется по буферным растворам с известными значениями рН. Стеклянный электрод получил наиболее широкое распространение среди различных электродов, применяемых для определения рН растворов. На него не действуют окислители и восстановители, он с трудом подвергается отравлению. Однако длительное пребывание в сильнощелочных средах, в которых происходит растворение стекла, может вывести его из строя. Состав стекла, из которого изготавливается шарик, подбирается таким образом, что из всех ионов, имеющихся в растворе, в ионном обмене на поверхности стекла участвуют только ионы Н+. Поэтому стеклянный электрод является примером ионоселективного электрода, потенциал которого зависит только от концентрации ионов водорода в исследуемом растворе. Присутствие других ионов на его потенциал не влияет. В лабораториях, в том числе при исследованиях по аналитической и фармацевтической химии, фармакологии и др., применяются и другие ионоселективные электроды, которые в составе специальных приборов (иономеров) позволяют быстро измерять активности отдельных ионов и соответствующие им величины, например, рNa, pCl, pCO2 и др., а также коэффициенты активности ионов. 11.3. Потенциометрическое определение концентрации (активности) ионов. Концентрационные гальванические элементы Одна из важнейших задач в химической, в особенности аналитической, практике определение концентрации компонентов раствора. При этом часто возникает проблема определения очень малых концентраций, вплоть до таких, которые намного ниже, чем предел обнаружения обычных методов количественного анализа, как физико-химических (фотоколориметрия, потенциометрическое 210 титрование и др.), так и в особенности титриметрических. Такие измерения связаны, например, с определением растворимости и произведения растворимости малорастворимых веществ или с определением константы устойчивости комплексных соединений. Решить эти задачи помогает использование потенциометрических измерений с помощью так называемых концентрационных гальванических элементов (или иначе, концентрационных цепей). В соответствии с уравнением Нернста (10.9) концентрация (активность) электролита, контактирующего с электродами гальванического элемента, оказывает непосредственное влияние на электродные потенциалы. Иными словами, электрод из одного и того же металла, помещённый в растворы с различной концентрацией ионов, относительно которых он обратим, приобретёт различный электродный потенциал. Следовательно, можно создать элемент, электроды которого идентичны и погружены в растворы одного и того же электролита, но с различной концентрацией концентрационный гальванический элемент. Рассмотрим подобный концентрационный элемент, составленный из двух цинковых электродов, находящихся в контакте с растворами соли цинка различной концентрации. Формула такого элемента: () Zn | Zn2+ (а1 = 0,01M) || Zn2+ (а2 = 1M) | Zn (+) 1 2 Электрод 1, опущенный в раствор с меньшей концентрацией ионов Zn2+, для установления равновесия выделяет в раствор большее число ионов и поэтому заряжается более отрицательно, чем электрод 2, находящийся в растворе с большей концентрацией ионов. При замыкании внешней цепи электрод 1 будет растворяться, выделяя в раствор ионы Zn2+, а на электроде 2 будет идти восстановление ионов цинка. При этом ионы Zn2+ (а вместе с ними и содержащиеся в растворе анионы) будут проходить через полупроницаемую мембрану (или солевой мостик) из приэлектродного пространства более отрицательного электрода в сторону более 211 положительного электрода. Этот процесс прекратится, когда концентрации электролитов в обоих приэлектродных пространствах станут равными друг другу. Согласно уравнению Нернста ЭДС этого элемента равна 0,0591 0,0591 о Е = Е Zn2+/Zn + lg a Zn2+ (2) Е Zn2+/ Zn + lg a Zn2+ (1) = 2 2 0,0591 aZn2+ (2) 0,0591 1 = lg = lg = 0,0591 В. 2 a Zn2+ (1) 2 0,01 о Видно, что в окончательной формуле для расчёта ЭДС отсутствуют значения стандартных электродных потенциалов и стандартной ЭДС. Это говорит о том, что электродвижущая сила концентрационного ГЭ не зависит от природы электрода и ионов, относительно которых он обратим, и определяется только соотношением концентраций (активностей) ионов в приэлектродных электролитах. Таким образом, в концентрационном элементе работа электрического тока при замыкании самопроизвольного внешней выравнивания цепи получается концентрации в результате электролитов, контактирующих с двумя электродами. Суммарный химический процесс в концентрационном элементе отсутствует, так как на катоде и на аноде идут противоположные электродные полуреакции (соответственно восстановление Zn2+ + 2e Zn0 и окисление Zn0 Zn2+ + 2e). Для замедления самопроизвольного выравнивания концентраций путём диффузии полуэлементы разделяются полупроницаемой мембраной. ЭДС концентрационных ГЭ, как правило, имеет небольшие значения. Поэтому при измерении их ЭДС существенное значение приобретает диффузионный потенциал, который удаётся свести к минимуму или практически устранить с помощью включения в цепь какого-либо другого электрода (например, каломельного) или применения солевого мостика. 212 Концентрационные элементы могут быть использованы для точных определений концентраций (активностей) солей, в том числе в очень разбавленных растворах, а также для измерения растворимости малорастворимых солей. Пример: Рассчитать концентрацию хлорида серебра в насыщенном растворе и его произведение растворимости. Для такого определения можно составить гальванический элемент из двух серебряных электродов, один из которых опущен в исследуемый насыщенный раствор AgCl, а другой - в раствор нитрата серебра с известной концентрацией (например, 01 М): () Ag | AgNO3 (0,1 M) || AgCl (x) | Ag (+) 1 2 ЭДС этого элемента будет равна: 0,0591 aAg+ (2) Е = lg 1 aAg+ (1) Коэффициент активности AgNO3 при данной концентрации равен 0,82, отсюда его активность: aAgNO3 = 0,10,82 = 0,082 М. Измеренная ЭДС этого элемента равна 0,2243 В и, значит, 0,082 Е = 0,2243 = 0,0591 lg , a Ag+ (1) откуда: 0,0591 lg 0,082 0,2243 lg aAg+ (1) = = 4,8809 0,0591 и aAg+ (1) = 10 4,8809 = 1,31529105 моль/л. Так как AgCl - электролит, молекула которого состоит из одного катиона и одного аниона, и при таких малых активностях концентрация практически равна активности, то можно принять СAgCl = aAgCl . Зная концентрацию ионов, можно рассчитать произведение растворимости AgCl: ПР = aAg+ aCl = (1,31529105)2 = 1,731010 (моль/л)2. Удобно пользоваться концентрационными элементами и при оценке степени диссоциации комплексных соединений и расчёте их констант устойчивости. 213 Говоря о концентрационных ГЭ, следует упомянуть ещё одно практически важное обстоятельство. Если какой-либо металлический предмет контактирует с раствором электролита, в котором имеется градиент концентрации (то есть концентрация электролита в различных участках объёма раствора неодинакова), то на этом предмете могут возникать катодные и анодные участки, что приведет к электрохимической коррозии металла. Это часто наблюдается в случае металлических деталей со сложной конфигурацией, работающих в плохо перемешиваемых водных или неводных растворах электролитов. 11.4. Определение констант равновесия электрохимических реакций. Окислительно-восстановительные электроды и гальванические элементы Все электроды, на которых происходят реакции с участием электронов, представляют собой окислительно-восстановительные системы. Однако принято в особую группу выделять электроды, в потенциалопределяющих реакциях которых материал электрода не участвует. Такие электроды, как правило, состоят из инертного металла с электронной проводимостью (например, платины или золота), погружённого в раствор, содержащий ионы с различной степенью окисления. Называются они окислительно-восстановительными (или редокс) электродами. В общем виде формула редокс-электрода и уравнение электродной полуреакции реакции записываются так: Ox ; Red | Pt Ox + ne Red где Ox - окисленная форма, Red - восстановленная форма. К редокс-электродам относятся в первую очередь электроды, у которых Ox и Red представляют собой ионы, содержащие химические элементы в различных степенях окисления, причем электродная реакция состоит в изменении их степени окисления. Например, системам Sn4+; Sn2+ | Pt и MnO4; MnO42 | Pt соответствуют электродные реакции: Sn2+ Sn4+ + 2e 214 MnO42 MnO4 + e Возникновение потенциала окислительно-восстановительного электрода может быть рассмотрено в общих чертах с тех же позиций, что и для электродов, обратимых относительно катиона. Потенциал редокс-электрода определяется также по уравнению Нернста: RT aOx ЕOx,Red = Е Ox,Red + ln neF a Red o где E Ox,Red - стандартный окислительно-восстановительный потенциал, aOx и о a Red - активности соответственно окисленной и восстановленной форм, участвующих в суммарной электрохимической реакции. Комбинируя электроды, друг можно с другом получать окислительно-восстановительные окислительно-восстановительные гальванические элементы. Например, элемент () Pt | AsO2 ; AsO43 || Ce4+; Ce3+ | Pt (+), в котором при замыкании внешней цепи в приэлектродных пространствах идут такие полуреакции: AsO2 + 2H2O 2e AsO43 + 2H+ Ce4+ + e Ce3+ (окисление, анод) (восстановление, катод) и суммарная реакция: AsO2 + 2H2O + 2Ce4+ AsO43 + 2H+ + Ce3+ . Для этой реакции, проводимой в стандартных условиях, когда активности всех ионов равны друг другу и равны 1М, в соответствии с уравнением Нернста и уравнением изотермы химической реакции можно записать: RT Е = ln Кa neF С другой стороны, стандартная ЭДС может быть рассчитана как о разность стандартных окислительно-восстановительных потенциалов: E0 = Eo+ Eo = EoCe4+/Ce3+ EoAsO43+/AsO2- = 1,44 0,56 = 0,88 В. 215 Зная значение ЭДС, можно вычислить константу равновесия данной реакции: RT ln Кa = E0 neF или 0,0591 lg Кa = 0,88, 2 откуда 0,88 2 lg Кa = = 29,780033 30 0,0591 и, следовательно, Ka = 1030. Такая большая величина константы равновесия говорит о том, что равновесие в реакции настолько сильно сдвинуто вправо, что реакция идет практически до конца и может быть использована в аналитических целях (например, для цериметрического определения солей мышьяка). Результирующее выражение для вычисления константы равновесия электрохимических реакций выглядит так: Kр Ka = 10Еn / 0,0591. Таким образом, измеряя или вычисляя по справочным стандартным значениям окислительно-восстановительных потенциалов ЭДС редоксэлементов, можно рассчитывать константы равновесия соответствующих окислительно-восстановительных реакций и делать выводы о глубине их протекания. С использованием таких данных были разработаны методики окислительно-восстановительного фармацевтической практике титрования, применяемые (перманганатометрия, в броматометрия, нитритометрия, цериметрия и др.). Разумеется, с помощью метода ЭДС можно вычислять константы равновесия и связанные с ними величины, например, Go, ТS, не только для реакций, протекающих в окислительно-восстановительных, но и в любых других гальванических элементах. 216 217 V. Х И М И Ч Е С К А Я К И Н Е Т И К А И К А Т А Л И З ГЛАВА 12 ФОРМАЛЬНАЯ И МОЛЕКУЛЯРНАЯ КИНЕТИКА 12.1. Предмет химической кинетики и её значение для фармации, медицины и биологии Химическая кинетика - это учение о скоростях и механизмах химических реакций. В соответствии с этим определением целью исследования в химической кинетике является: 1) экспериментальное определение скорости реакции и установление её зависимости от таких параметров, как концентрация реагирующих веществ, температура, присутствие катализатора; и 2) установление механизма реакции, то есть числа стадий, из которых она состоит, и природы образующихся на каждой из этих стадий промежуточных веществ. Этим кинетика отличается от термодинамики, которая, не вдаваясь в механизм процесса, исследует влияние на него различных факторов и на этой основе делает вывод о принципиальной возможности или невозможности процесса, но ничего не говорит о его скорости. Ни в одно уравнение термодинамики не входит время. Поэтому, получая с помощью термодинамических методов заключение о том, при каких условиях данная реакция пойдёт в нужном направлении, каковы будут при этом характеристики равновесия (и в первую очередь теоретический равновесный выход продуктов), исследователь не имеет никакой информации о времени, которое требуется для достижения равновесия. Время протекания одних химических реакций может измеряться годами и даже тысячелетиями, других - при тех же условиях - минутами или секундами, третьих - долями секунды (реакции, идущие с «взрывной» скоростью). Выяснение того, какова будет скорость реакции при данных 218 условиях и есть ли возможность влияния на эту скорость чрезвычайно важны для практических целей, как в лаборатории, так и в химическом и в фармацевтическом производстве. Если необходимые реакции, например, синтез лекарственного вещества, протекают слишком медленно, их стремятся ускорить. Если же нежелательные реакции, например, разложение лекарственных веществ, коррозия оборудования, инструментов и т. п., протекают слишком быстро, то их необходимо замедлять. Ускорение или замедление реакций может быть достигнуто различными способами: изменением концентрации реагентов, изменением параметров реакции (температура, концентрация реагентов и др.), применением катализаторов или ингибиторов, а также одновременным воздействием всех или некоторых из перечисленных факторов. Знание провизором-технологом законов химической кинетики позволяет добиваться наиболее высокой производительности аппаратов при получении синтетических лекарственных веществ, а также установления и продления сроков годности лекарственных препаратов. В биологии и медицине законы химической кинетики дают возможность проникнуть в мир биохимических реакций, идущих в живом организме, разобраться во всех тонкостях их протекания, как на тканевом, так и на клеточном уровне. Именно кинетические методы были использованы для выяснения деталей таких сложных процессов, как, например, биосинтез белка, цикл трикарбоновых кислот и многие другие. Лекарственные вещества, введённые в организм, претерпевают в нём различные химические превращения, преобразуясь в результате метаболизма в соединения с различной фармакологической и биологической ролями. Проникновение лекарственных веществ в организм и их поведение в нём, а также выявление фармакологический промежуточных эффект, изучается продуктов, оказывающих специальными медицинскими 219 дисциплинами - фармакологией, фармакокинетикой и фармакодинамикой, широко использующими кинетические методы исследования. 12.2. Краткий исторический очерк Первые систематические исследования скорости химических реакций выполнил Н.А.Меншуткин в 70-х гг. XIX в. В 1884 г. Я.Вант-Гофф в общем виде сформулировал кинетические закономерности протекания простых моно-, би- и тримолекулярных реакций. Толчком установление к дальнейшему С.Аррениусом (1889) развитию химической зависимости скорости кинетики простых послужило реакций от температуры и роли в химических реакциях активных молекул. М.Боденштейн (1899) показал справедливость представлений Вант-Гоффа и Аррениуса для элементарных реакций в газовой фазе. Развитие этих представлений с использованием статистической физики и квантовой механики привело к созданию Г.Эйрингом и М.Поляни в 30-х гг. XX в. теории активированного комплекса. В конце XIX - начале XX вв. большое внимание уделялось изучению также и сложных реакций. Перекисная теория окисления Баха Энглера (1897), учение о сопряжённых процессах окисления Лютера Шилова (1903) установили важную роль в кинетике сложных реакций природы промежуточных веществ. Изучение промежуточных веществ было стимулировано открытием обычных (М.Боденштейн, 1913) и разветвлённых (Н.Н.Семенов, С.Хиншелвуд, 1920-е гг.) цепных реакций. Было установлено, что промежуточные вещества представляют собой, как правило, активные частицы - свободные атомы и радикалы, обладающие высокой реакционной способностью. 12.3. Кинетическая классификация химических реакций. Порядок и молекулярность реакции С точки зрения химической кинетики реакции могут быть классифицированы по таким признакам: по механизму различают реакции простые, в которых имеет место только одно превращение, и сложные. К сложным относятся параллельные, сопряжённые, последовательные, цепные, обратимые реакции, т. е. такие, механизм которых включает промежуточные вещества. 220 более одной стадии и различные по условиям протекания реакции подразделяются на гомогенные (когда все вещества, участвующие в реакции и исходные, и продукты, находятся в одном фазовом состоянии в газовой фазе или в растворе) и гетерогенные (когда химическое превращение идёт на поверхности раздела различных фаз). по молекулярности (или иначе, по числу молекул или других частиц атомов, ионов, радикалов, одновременно взаимодействующих друг с другом и подвергающихся химическому превращению в одном элементарном акте) простые реакции и стадии сложных реакций подразделяются на мономолекулярные, бимолекулярные и тримолекулярные. В мономолекулярных превращению в элементарном акте подвергается одна молекула. Это значит, что мономолекулярными являются реакции разложения (например, H2O2 H2O + O) или изомеризации. В бимолекулярных реакциях превращению в элементарном акте подвергаются две молекулы, например, C2H4 + H2O C2H5OH. Большинство химических реакций или стадий являются бимолекулярными. В тримолекулярных реакциях в элементарном акте участвуют три молекулы, например, 2NO + Cl2 2NOCl. Тримолекулярные реакции встречаются очень редко. Все известные тримолекулярные реакции идут в газовой фазе с участием NO или CO. Реакции более высокой молекулярности неизвестны. по порядку. Порядком реакции по данному веществу называется показатель степени при концентрации этого вещества в кинетическом уравнении для данной реакции v = k CaA CbB . Например, реакция 2NO + О2 2NO2, для которой v = k С2NO CO2 , 221 является реакцией второго порядка по NO и рекцией первого порядка по O2. Сумма показателей степени при концентрациях всех исходных веществ называется общим или суммарным порядком реакции. Как правило, его значение не превышает 3. Различают реакции первого, второго, третьего, а также дробного и нулевого порядка. Для простых реакций порядок - целочисленная величина, совпадающая с молекулярностью. Но, по большей части, порядок и молекулярность не совпадают друг с другом. Например, скорость бимолекулярной реакции инверсии сахарозы С12Н22О11 + Н2О С6Н12О6 + С6Н12О6 сахароза глюкоза фруктоза при достаточно высокой концентрации воды не зависит от концентрации Н 2О и уравнение закона действующих масс для неё должно быть записано так: v = k Ссахарозы Порядок её, как по сахарозе, так и суммарный, является первым. Эта реакция может быть названа псевдомономолекулярной или реакцией псевдопервого порядка. Несовпадение порядка с молекулярностью наблюдается и в случае газофазных реакций, когда химическое превращение лимитируется физическим процессом передачи энергии от молекулы к молекуле при столкновении. Так, мономолекулярный распад ряда соединений при низком давлении является реакцией 2 порядка (псевдобимолекулярная реакция). Для сложных реакций порядок может быть выражен дробным числом, что связано с различным порядком каждой отдельной стадии. Встречаются реакции, скорость которых не зависит от концентрации реагентов и постоянна во времени (например, реакции, идущие на границе соприкосновения двух несмешивающихся или ограниченно растворимых жидкостей). Такие реакции называются реакциями нулевого порядка. 222 Из сказанного следует, что порядок реакции не может быть предсказан по уравнению реакции, а в каждом отдельном случае должен определяться экспериментально по зависимости скорости реакции от концентрации данного вещества при постоянной концентрации всех остальных веществ. Порядок реакции является одной из важнейших кинетических характеристик. 12.4. Скорость химической реакции. Время полупревращения Скорость реакции v - это её интенсивность, выраженная количественно. Она определяется числом молекул, реагирующих в единицу времени в единице объёма. Так как это число эквивалентно изменению количества какого-либо вещества (исходного или продукта), то можно записать: dn v = , Vdt где V - реакционный объём; dn/dt - изменение количества вещества (моль) в единицу времени. Или, принимая n/V = С, dС v = , dt (12.1) где С - концентрация. Различают истинную (мгновенную) скорость реакции, которая определяется как бесконечно малое изменение концентрации за бесконечно малое время, что математически выражается уравнением (12.1), и среднюю скорость, которая определяется как изменение концентрации за всё время протекания реакции или за какой-либо интересующий экспериментатора отрезок времени: С С2 С1 vср = = , dt t2 t1 (12.2) 223 где С1 и С2 концентрации исследуемого вещества, наблюдаемые соответственно начальный и конечный в моменты времени t1 и t2. Из уравнений (12.1 и 12.2) следует, что если скорость реакции определяется по одному из исходных веществ, разность С2 С1 будет иметь отрицательный знак, а если по одному из продуктов - то положительный. Скорость реакции всегда положительна, поэтому при вычислении её по исходным веществам в уравнениях (12.1) и (12.2) оставляется знак минус, при вычислении по продуктам - знак плюс. В общем случае следует различать скорость реакции в целом и скорость реакции по данному веществу. Например, рассмотрим реакцию синтеза аммиака N2 + 3H2 2NH3 . Совершенно очевидно, что убыль концентрации водорода в единицу времени втрое превышает убыль концентрации азота, а скорость образования аммиака вдвое больше скорости расходования N2 и в 1,5 раза меньше скорости расходования Н2. Следовательно, скорость реакции по азоту не равна скорости по водороду и скорости по аммиаку. Размерность скорости химической реакции в соответствии с определением [концентрация/время]. В системе СИ это моль/м3.с, в обычной лабораторной практике используют также размерности моль/лс или моль/лмин. В каждом конкретном случае размерность скорости реакции может быть выражена различными единицами в зависимости от самой скорости. Так, например, для реакций разложения лекарственных веществ или коррозии металлов в качестве единицы времени обычно выбирается год, а для реакций, идущих с очень большой скоростью, например, взрывов, реакций нейтрализации и т. п. - доли секунды (милли-, микросекунда и т. д.). Общая скорость сложной реакции зависит от скорости самой медленной из её стадий (лимитирующая стадия). 224 Скорость химических реакций, за исключением реакций нулевого порядка, с течением времени не остаётся постоянной, а замедляется. Причём это замедление носит нелинейный характер, т. е. чем больше времени прошло с начала реакции, тем медленнее она протекает. Средняя скорость за всё время протекания реакции часто бывает очень трудно или даже невозможно определить экспериментально, что связано со сложностью фиксации момента, в который прореагирует последняя молекула одного из исходных веществ. Поэтому в качестве ещё одной кинетической характеристики реакций было введено понятие времени полупревращения t1/2 (в случае реакций разложения называемого также временем полураспада или периодом полураспада). Время полупревращения t1/2 - это время, за которое прореагирует половина взятого для реакции исходного вещества. В отличие от средней скорости за полное время протекания время полупревращения определяется довольно просто и с высокой точностью, что можно проиллюстрировать рис. 12.1. С С0 С0/2 t1/2 время Рис. 12.1. Зависимость концентрации реагирующих веществ от времени. С0 - начальная концентрация исходного вещества, t1/2 - время полупревращения 12.5. Закон действующих масс. Константа скорости 225 В основе учения о химической кинетике лежит её основной постулат, который под названием “закон действующих масс” был открыт К.М.Гульдбергом и П.Вааге в 1864 - 67 г. г. (В некоторых учебниках можно встретить ошибочное выражение “закон действия масс”, которого следует избегать. К.М.Гульдберг и П.Вааге термином “действующая масса” обозначили то понятие, которое сейчас общепринято называют концентрацией. Термин “концентрация” был введён Я.Вант-Гоффом в 90-х годах XIX в.). В современной формулировке закон читается так: Скорость химической реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ (имеющихся в данный момент времени), возведённых в некоторые степени. Эти степени не всегда соответствуют стехиометрическим коэффициентам при формулах этих веществ в уравнении реакции, что было проиллюстрировано в п. 12.3. Например, для произвольной реакции aA + bB = dD + eE, когда соотношение концентраций исходных веществ и продуктов близко к соотношению их стехиометрических коэффициентов, математическое выражение закона действующих масс будет выглядеть так: v = k CaA CbB (12.3) где CA и CB - концентрации исходных веществ А и В в данный момент времени; а и b - стехиометрические коэффициенты при формулах веществ А и В в уравнении реакции; k - коэффициент пропорциональности, называемый константой скорости данной реакции при данной температуре. Уточнение о том, что показатели степени при концентрациях реагентов не обязательно совпадают со стехиометрическими коэффициентами, связано с упомянутым выше (п. 12.3) несовпадением порядка и молекулярности реакций. Оно становится понятным, если вспомнить, что показатель степени в уравнении (12.3) представляет собой порядок реакции, который может не 226 соответствовать стехиометрии уравнения реакции и должен для каждого данного случая определяться экспериментально. Поэтому, если соотношения концентраций исходных веществ значительно отличаются от стехиометрии реакции, то степени при концентрациях в уравнении закона действующих масс должны быть соответствующим образом изменены. Константа скорости k численно равна скорости реакции в стандартном состоянии, то есть при концентрациях всех реагентов, равных 1 в выбранной системе единиц. Она количественно характеризует реакционную способность веществ в элементарной реакции при данной температуре в данной среде. В случае сложных реакций, в особенности гетерогенных, константа в уравнении закона действующих масс называется коэффициентом скорости или эффективной величиной, константой физический смысл скорости и является эмпирической которой определяется конкретным механизмом реакции. 12.6. Расчёт констант скорости для реакций различных порядков Наибольшее практическое значение для фармации имеют реакции 1-го и 2-го порядков. Этим порядкам подчиняется подавляющее большинство реакций синтеза и разложения лекарственных веществ, а также реакций, используемых при различных методиках анализа. 12.6.1. Реакции первого порядка Для произвольной реакции 1-го порядка вида А продукты реакции уравнение закона действующих масс выглядит так: dС v = = kC , dt 227 dС k dt = C где С - концентрация вещества А. После разделения переменных это уравнение можно интегрировать в интервалах = 0 t, и С0 Сt: t Ct dС k dt = , 0 C0 C получая при этом k (t t0) = (ln Ct ln C0) или k (t t0) = ln C0 ln Ct , откуда, принимая t0 = 0, получаем окончательное кинетическое уравнение для расчёта константы скорости реакции первого порядка: 1 С0 k = ln . (12.4) t Ct где С0 - начальная концентрация исходного вещества; Ct - концентрация, измеренная в момент времени t. Из этого уравнения следует, что константу скорости реакции 1-го порядка можно определить графически, если построить график зависимости ln С от времени. При этом тангенс угла наклона графика равен k (рис. 12.2). Строя график зависимости ln С от t для неизвестной реакции и получая при этом прямую линию, подобную изображённой на рис. 12.2, можно убедиться в том, что реакция имеет первый порядок. Константа скорости может быть определена и без построения графика, а именно, как среднее арифметическое из величин, полученных при расчёте по уравнению (12.4) для нескольких текущих концентраций исходного вещества, экспериментально измеренных в различные моменты времени. Так как в уравнение (12.4) входит отношение начальной и текущей концентраций, то в принципе оно может быть заменено отношением любых 228 ln С t Рис. 12.2. Зависимость ln С t для реакции первого порядка других величин, пропорциональных концентрации (например, углов вращения плоскости поляризации реакционной смеси или её оптической плотности и т. п.), а сама концентрация может быть выражена любыми способами. Часто при вычислениях используют не концентрацию, а количество вещества в молях. Тогда расчётное уравнение для константы скорости будет выглядеть так: 1 а k = ln , (12.5) t ах где а - начальное число молей исходного вещества, x - число молей его, прореагировавшее к моменту времени t. С помощью уравнений (12.4) и (12.5) могут быть вычислены (если известна константа скорости) и другие важные кинетические характеристики, например, время полупревращения какой-либо реакции или, что представляет особый интерес для фармации, срок годности лекарственных препаратов. Время полупревращения (t1/2) реакции удобно вычислять с помощью преобразованного уравнения (12.5): 1 а t = ln . k ах 229 Принимая х = а/2, получим: 1а 1 0,693 t1/2 = ln = ln 2 = , (12.6) k а а/2 k k Это же выражение можно получить, используя уравнение (12.4) и принимая Ct = C0/2 . Из уравнения (12.6) следует, что время полупревращения реакции первого порядка не зависит от начальной концентрации вещества. То есть для уменьшения концентрации, например, от 1 до 0,5 М потребуется ровно столько же времени, сколько для уменьшения концентрации от 0,001 до 0,0005 М. Из уравнения (12.6) следует также, что по экспериментально найденному значению t1/2 можно вычислить константу скорости реакции: Реакции реакции, разложения идущие в 0,693 k = . t1/2 многих лекарственных растворах, являются веществ, реакциями особенно первого или псевдопервого порядка, поэтому срок годности их тоже может быть рассчитан по кинетическому уравнению (12.5). Согласно действующей нормативной документации лекарственный препарат считается годным к употреблению, если содержание лекарственного вещества в нём отвечает требованиям соответствующей фармакопейной статьи. Принимая, что в свежеприготовленном препарате количество наиболее быстро разлагающегося вещества а = 100%, а допустимый процент разложения лекарственного вещества равен х, можно, зная константу скорости разложения данного вещества при температуре его хранения, по уравнению 1 100 t = ln . k 100 х вычислить ориентировочный срок его годности. 230 12.6.2. Реакции второго порядка Это самый распространенный тип реакций, которые могут протекать по схемам или 1) А + В продукты реакции 2) 2А продукты реакции Скорость таких реакций может быть описана такими уравнениями закона действующих масс: dС v = = kCACB , dt для 1-го типа - а для 2-го - Далее мы dС v = = kC2 . dt будем рассматривать, главным образом, реакции, относящиеся к 1-му типу, как наиболее часто встречающиеся. Хотя следует помнить о том, что и реакции 2-го типа довольно широко распространены. В частности, разложение некоторых лекарственных веществ может протекать именно по этому типу. Время, за которое вступает во взаимодействие определённая доля начального количества веществ, в реакциях второго порядка зависит от соотношения начальных концентраций исходных веществ. Поэтому принято рассматривать два возможных случая: 1) C0 A = C0 B и 2) C0 A C0 B. При равных начальных концентрациях исходных веществ можно принять, что C0 A = C0 B = C0. При этом в каждый момент времени будет соблюдаться равенство Ct A = Ct B = Ct . Кинетическое уравнение для данного случая выглядит так: 231 dС v = = kC2. dt Разделяя переменные dС = k dt C2 и интегрируя в интервалах = 0 t, и С0 Сt: t k dt = 0 dС Ct C0 , C2 получаем 1 1 Ct C0 kt = = C0 Ct C0 Ct и окончательно 1 Ct C0 k = (12.7) t C0 Ct Заменяя концентрации на соответствующие количества вещества в моль (C0 = а, Ct = а х, и Ct C0 = х), получим 1 х k = . t а(а х) (12.8) При различных начальных концентрациях исходных веществ, когда C0 A C0 B и Ct A Ct B, интегрирование кинетического уравнения dС v = = k CA CВ dt или dС k dt = CA CÂ даёт выражение 232 1 C0 B Ct A k = ln . (12.9) t (C0 A C0 B) C0 A Ct В Заменяя концентрации на количество вещества (моль), получим 1 b(a x) k = ln . (12.10) t (а b) a(b x) где а и b - соответственно начальное число молей веществ А и В; x количество вещества, прореагировавшее к моменту времени t. График зависимости 1/С от t для реакций второго порядка представляет собой прямую, проходящую через начало координат, с тангенсом, равным k; это означает, что константа скорости реакции второго порядка тоже может Рис. 12.3. Зависимость 1/С t для реакции второго порядка быть определена графически (рис. 12.3): Время полупревращения для реакции второго порядка рассчитывается 1/С с помощью выведенных уравнений по известной константе скорости. Для случая одинаковых начальных концентраций исходных веществ 1 t1/2 = или k C0 для случая различных начальных концентраций 1 t1/2 = , kа t 233 1 1 t1/2 = или t1/2 = . k C0 А C0 В k (а b) То есть, в отличие от реакций первого порядка, в данном случае время полупревращения зависит от начальной концентрации исходных веществ. 12.7. Определение порядка реакции В соответствии с вышеизложенным порядок простой необратимой реакции может быть определён такими способами: 1) Интегральные методы. 1.1) По константам скорости. Процедура состоит в измерении концентрации реагента (или реагентов) в различные моменты времени и в подстановке полученных данных в уравнения для расчёта константы скорости реакции первого и второго порядка, выведенные ранее (а при необходимости и в уравнение для третьего порядка). То уравнение, которое для различных интервалов времени даёт значения константы скорости, характеризующиеся наименьшим разбросом значений, следует считать наиболее правильно отражающим порядок реакции. Если вычисления ни по одному из этих уравнений не дают удовлетворительных результатов (значения константы скорости во всех случаях имеют значительный разброс), то считается, что реакция имеет дробный порядок. В том случае, когда концентрация исходных веществ линейно уменьшатся с течением времени, принимается, что реакция имеет нулевой порядок. 1.2) По времени полупревращения. Метод аналогичен предыдущему, с тем различием, что в этом случае рассчитываются не k, а величины t1/2. 1.3) Графический. По экспериментальным данным строятся графики зависимостей для первого порядка ln C t (см. рис. 12.2), для второго порядка 1/C t (см. рис. 12.3), при необходимости для нулевого порядка C t и для третьего порядка 1/C2 t. Тот график, на котором точки лучше всего укладываются на прямую линию, соответствует порядку реакции. 2) Дифференциальный метод (по Вант-Гоффу, 1884) 234 Уравнение закона действующих масс для исследуемой реакции можно приблизительно записать в виде v = kCn, где n - суммарный порядок реакции. Логарифмируя это выражение, получим уравнение прямой, не проходящей через начало координат: lg v = lg k + nlg C. Построив по экспериментальным данным график зависимости логарифма скорости исследуемой реакции от логарифма концентрации одного из исходных веществ (рис. 12.4), можно определить её порядок как тангенс угла наклона графика к оси абсцисс. При этом от оси ординат отсекается отрезок, равный логарифму константы скорости реакции. lg v tg = n lg k lg C Рис. 12.4. Определение порядка реакции методом Вант-Гоффа 12.8. Механизмы химических реакций Большинство химических реакций являются сложными, то есть они протекают в несколько стадий. Одной из задач кинетики является определение числа и вида промежуточных стадий, потому что только так можно представить, как протекает реакция в целом. Отдельные стадии называются элементарными реакциями. Совокупность элементарных реакций представляет собой механизм суммарной реакции. При рассмотрении механизма говорят о молекулярности каждой из её стадий, которая определяется числом молекул или других частиц – атомов, ионов, радикалов, участвующих в данной элементарной реакции. Отдельные стадии являются моно-, би- или тримолекулярными в зависимости от того, одна, две или три частицы вступают во 235 взаимодействие на данной стадии. Для элементарных реакций молекулярность совпадает с их порядком, но по отношению к суммарной реакции эти термины не являются синонимами. Процесс установления механизма какой-либо реакции нельзя описать кратко, поскольку он связан со многими экспериментальными трудностями. Кинетические данные об изменении концентрации во времени оказываются очень полезными при определении механизма. Некоторые сведения о механизме можно также получить, используя радиоактивные изотопы для определения последовательных состояний различных атомов или молекул в ходе реакции и спектроскопические методы для идентификации промежуточных соединений. Однако подробное рассмотрение сложных реакций и способов установления их механизма не входит в программу нашего курса. 12.9. Влияние температуры на скорость реакции Скорость реакции зависит от многих факторов, в том числе от природы реагирующих веществ, природы среды, концентрации (влияние которой рассмотрено ранее) и др. В ряде случаев, в особенности для цепных реакций, скорость может определяться даже размерами сосуда, в котором она происходит. Однако с теоретической и с практической точек зрения наряду с концентрацией особенно важным является влияние на скорость реакции температуры. Для большинства химических реакций (за исключением тримолекулярных и ферментативных) скорость с ростом температуры увеличивается. В принципе это влияние температуры может быть сопряжено с изменением трёх величин: концентрации реагирующих веществ, константы скорости и порядка реакции. Но концентрация веществ (особенно для реакций в жидкой или твёрдой фазе) с температурой изменяется мало, а если и изменяется, то, как правило, в сторону уменьшения; изменение же порядка реакции под влиянием температуры - довольно редкое явление. Вследствие этого в химической кинетике изменение скорости реакции под влиянием 236 температуры в первую очередь связывается с изменением константы скорости реакции. 237 12.9.1. Правило Вант-Гоффа Наглядное представление о зависимости скорости химических реакций от температуры даёт правило Вант-Гоффа, согласно которому при повышении температуры на 10 градусов скорость реакции увеличивается в 2 4 раза. Это правило первоначально было установлено для реакций, протекающих в растворах при невысоких температурах, а затем было распространено и на другие реакции. Оно связано с понятием температурного коэффициента скорости реакции kT+10 = , kT где kT и kT+10 - константы скорости исследуемой реакции при какой-то данной температуре Т и при температуре, превышающей Т на 10 градусов. При температурах, близких к комнатной, для большинства газовых реакций и реакций в растворах 3. Использование величины позволяет приближённо оценить изменение скорости реакции при некотором увеличении температуры на 10n градусов, причем число n может быть как целым, так и дробным: где v1 и v2 v2 kT + 10n = = n, v1 kT - скорости одной и той же реакции при температурах соответственно Т и Т + 10. При очень высоких и очень низких температурах правило Вант-Гоффа не выполняется. 238 12.9.2. Теория активных столкновений. Уравнение Аррениуса Количественная зависимость константы скорости реакции от температуры была впервые предложена тоже Я.Вант-Гоффом (1887) в виде уравнений изохоры и изобары химической реакции (см. п. 4.5.2). Эта идея была развита С.Аррениусом (1889), который открыл, что температурную зависимость скорости многих реакций можно описать уравнением: k = АеЕ*/RT где k - константа скорости, e - основание натуральных логарифмов, R универсальная газовая постоянная, T – температура, А - предэкспоненциальный множитель, Е* - энергия активации реакции. Чтобы выяснить физический смысл величин А и Е*, входящих в уравнение Аррениуса, следует сначала познакомиться с основными положениями теории активных соударений (столкновений) (С.Аррениус и Я.Вант-Гофф; 1880-е г.г.): 1) Химическое взаимодействие между молекулами возможно только при их столкновении. 2) Не каждое столкновение молекул приводит к химическому взаимодействию, т. е. является результативным или, по терминологии Аррениуса, активным. Существует некий энергетический барьер, преодолеть который и вступить во взаимодействие может лишь часть молекул, причём, как правило, это очень малая часть от их общего числа в системе. 3) Причиной, обусловливающей существование энергетического барьера, является взаимное отталкивание электронных оболочек молекул при их сближении. Когда две частицы удалены друг от друга на очень большое расстояние, между ними нет никакого взаимодействия и потенциальная энергия такой системы равна нулю. При меньших расстояниях между частицами они притягиваются друг к другу, и потенциальная энергия системы понижается. При дальнейшем уменьшении расстояния 239 становятся заметными силы отталкивания электронных оболочек молекул и потенциальная энергия резко возрастает. Поэтому для сближения частиц до расстояния, на котором начнется перераспределение электронов на их орбиталях (т. е. химическое взаимодействие), частицы должны обладать достаточно большим запасом кинетической энергии. Силы отталкивания между частицами и представляют между собой так называемый потенциальный или энергетический барьер, а химическое взаимодействие возможно только в том случае, если сталкивающиеся молекулы способны преодолеть его. 4) Для того, чтобы молекулы могли при столкновении преодолеть энергетический барьер, они должны двигаться навстречу друг другу с достаточно большой скоростью. Для достижения этой необходимой скорости нужна определённая энергия, называемая энергией активации. Энергия активации Е* это избыток энергии активных молекул по сравнению с неактивными, или иначе, энергия, которой должны обладать молекулы, чтобы иметь возможность вступить во взаимодействие. Размерность СИ энергии активации - Дж/моль. 5) Чем больше энергия активации реакции, тем больше энергетический барьер, и тем меньшее число молекул способно его преодолеть. Поэтому, чем больше Е*, тем медленнее идёт реакция. 6) С повышением температуры увеличивается скорость теплового движения молекул, поэтому доля активных молекул возрастает. Иными словами, при повышении температуры происходит термическая активация, приводящая к увеличению скорости реакции. Возвращаясь к уравнению Аррениуса, отметим, что величина eЕ*/RT (“экспонента”) равна доле активных молекул, обладающих избыточной энергией Е* для вступления в химическое взаимодействие, а коэффициент А (предэкспоненциальный множитель) равен полной частоте соударений между молекулами реагирующих веществ в реакционном объёме. Логарифмируя уравнение Аррениуса, получим уравнение прямой, не проходящей через начало координат: 240 E* ln k = ln A . RT Построив по экспериментальным данным график зависимости ln k от 1/T (т. н. “аррениусовскую зависимость”), можно вычислить энергию активации изучаемой реакции по тангенсу угла наклона, который в этом случае равен Е*/R (рис. 12.5). ln k tg = Е*/R 1/T Рис. 12.5. Аррениусовская зависимость и энергия активации Дифференцируя логарифмическую форму уравнения Аррениуса по температуре, получим уравнение, подобное уравнению изобары (изохоры) Вант-Гоффа: d ln k E* = dT RT2 Интегрирование его в пределах k1 k2 и Т1 Т2 приводит к уравнению k2 E* 1 1 ln = ( ) k1 R T2 T1 или иначе k2 E* Т2 Т1 ln = ( ) , (12.11) k1 R T1 T2 где k1 и k2 - константы скорости данной реакции при температурах T1 и T2 соответственно. 241 С помощью уравнения (12.11), также называемого уравнением Аррениуса, можно вычислить константу скорости k2 при заданной температуре Т2, если известны значения константы скорости k1 при температуре Т1 и энергия активации реакции Е*. Кроме того, это уравнение позволяет вычислить энергию активации реакции по значениям двух констант скорости при различных температурах: R T1 T2 k2 E* = ln . Т2 Т1 k1 Таким образом, в соответствии с теорией активных соударений повышение температуры увеличивает скорость химических реакций потому, что при этом возрастает доля активных молекул, способных преодолеть потенциальный барьер при столкновении. 12.10. Теория переходного состояния. Активированный комплекс Расчёты показывают, что для многих химических реакций, если они протекают по механизму непосредственного превращения молекул исходных веществ в продукты, энергии, сообщаемой молекулам при термической активации, недостаточно для преодоления энергетического барьера. Иными словами, при таком механизме энергия активации даже при очень высоких температурах настолько велика, что реакции не должны протекать с заметной скоростью. Тем не менее, химические реакции и в природе, и в промышленных и лабораторных установках идут и часто идут очень быстро. Следовательно, одной теории активных столкновений недостаточно для объяснения причин протекания и механизмов реакций. В 1930-х г.г. Э.Вигнером, М.Поляни, Г.Эйрингом и М.Эвансом была создана теория, позволяющая объяснить протекание реакций при малых тепловых скоростях молекул. Она носит название теории переходного состояния (или теории абсолютных скоростей реакций). Основные положения этой теории: 242 1) Взаимодействие молекул не сразу приводит к образованию молекул продуктов. Вначале образуется т. н. “переходное состояние” или активированный комплекс. 2) Активированный комплекс представляет собой неустойчивое образование, в которое входят все атомы столкнувшихся и вступивших во взаимодействие молекул. Время жизни активированного комплекса очень мало; оно измеряется малыми (миллионными, десятимиллионными и т. д.) долями секунды. Расстояния между атомами в активированном комплексе несколько больше, чем в обычных молекулах, поэтому для его образования требуется дополнительная энергия. 3) Энергия активации в связи с этим рассматривается как энергия, необходимая для образования активированного комплекса. 4) Через какое-то время после возникновения активированный комплекс распадается с образованием молекул продуктов; при этом выделяется энергия. 5) Выделяющаяся при распаде активированного комплекса энергия может полностью или частично затрачиваться на активацию других молекул исходных веществ. Наглядное представление о протекании реакции во времени в соответствии с теорией переходного состояния может дать энергетический профиль реакции, например, экзотермической (рис. 12.6). По оси ординат откладывается энергия системы Е, а ось абсцисс - это так называемая координата реакции. Среднему запасу энергии теплового движения молекул исходных веществ соответствует уровень Еисх , энергии, запасаемой в активированном комплексе - уровень ЕАК . Тогда разность ЕАК Еисх равна величине энергетического барьера, который должны преодолеть молекулы для того, чтобы вступить во взаимодействие энергия активации. Наглядное представление о нём даёт кривая, соединяющая уровни Еисх и ЕАК. Высота энергетического барьера зависит от природы реагирующих веществ, 243 энергии, необходимой для образования активированного комплекса (энергии активации), а также от средней энергии теплового движения молекул Еисх. Е ЕАК Е* Еисх Нr Епрод ход реакции Рис. 12.6. Энергетический профиль экзотермической реакции При повышении температуры уровень Еисх поднимается, величина энергетического барьера становится меньше и во взаимодействие может вступить большее число молекул. Это и служит причиной ускорения реакции с повышением температуры. При понижении температуры, наоборот, уровень Еисх опускается и величина энергетического барьера возрастает, что приводит к уменьшению скорости реакции. При распаде активированного комплекса с образованием молекул продуктов выделяется энергия, которой соответствует разность ЕАК Епрод, где Епрод - средний запас энергии молекул продуктов. Часть этой выделяющейся энергии, равная разности ЕАК Еисх, пойдёт на активацию новых молекул исходных веществ, а избыток Еисх Епрод выделится в окружающую среду в виде экзотермического теплового эффекта реакции Нr. Для эндотермических реакций энергетический профиль выглядит несколько иначе (рис. 12.7). Видно, что в этом случае энергетический 244 уровень Еисх ниже, чем уровень Епрод . В результате этого энергии ЕАК Епрод , выделяющейся при распаде активированного комплекса, недостаточно для того, Е ЕАК Е* Епрод Нr Еисх ход реакции Рис. 12.7. Энергетический профиль эндотермической реакции чтобы вызвать активацию новых молекул реагирующих веществ. Поэтому для продолжения реакции необходим подвод энергии извне, в виде эндотермического теплового эффекта. Существование активированного комплекса подтверждается экспериментальными данными. Так, например, для одной из несложных модельных реакций взаимодействия атома водорода с молекулой водорода Н2 + Н Н + Н2, значение энергии активации близко к 36,8 кДж/моль. Если бы реакция шла через стадию полной диссоциации молекул Н2, а не через стадию образования активированного комплекса Н2Н, то потребовалась бы энергия активации 435,1 кДж/моль. 12.11. Гетерогенные реакции 245 Химические реакции, идущие на поверхностях раздела фаз гетерогенные реакции - протекают с рядом особенностей, которые связаны, главным образом, с локализацией места взаимодействия между молекулами. К таким реакциям относится очень большое число процессов и, в первую очередь, реакции с участием твёрдых веществ - двух твёрдых веществ друг с другом (т. н. топохимические реакции), твёрдого вещества с газом или с компонентами раствора, в которое оно погружено. Возможны гетерогенные реакции и на поверхностях раздела между двумя жидкими фазами. Поскольку такие лекарственные формы, как, например, смешанные порошки, таблетки, суспензии, эмульсии представляют собой гетерогенные системы, в них возможно протекание гетерогенных реакций указанных типов, что приводит к разложению лекарственных веществ, к изменению физических свойств, к потере потребительных качеств и товарного вида. Большинство биохимических реакций также идёт на поверхностях раздела, имеющихся в различных структурах организма, т. е. является гетерогенными. Поэтому выяснение деталей протекания указанных процессов очень важно для биохимии Гетерогенные процессы, и медицины, происходящие в особенности при фармакологии. растворении таблеток, порошков, кристаллизации из растворов имеют большое значение для фармации, в особенности для технологии лекарств. Гетерогенными являются и электрохимические, и каталитические реакции с участием твёрдых катализаторов. Кроме химических реакций возможны и гетерогенные физико-химические процессы, например, растворение кристаллов и кристаллизация из растворов, адсорбция и десорбция и др. По сравнению с гомогенными реакциями на общую скорость гетерогенного процесса будут влиять такие дополнительные факторы, как: 1) доставка реагентов к поверхности и 2) удаление продуктов реакции от 246 поверхности. Поэтому большинство гетерогенных процессов включает в себя следующие обязательные стадии: 1) доставка реагентов к поверхности 2) химическое взаимодействие на поверхности 3) удаление продуктов от поверхности Довольно часто, особенно при реакциях на твёрдых поверхностях, за стадией доставки следует стадия адсорбции молекул реагирующих веществ на поверхности (иногда - с определённой ориентацией), а перед стадией удаления продуктов - стадия десорбции. 1-я и 3-я стадии осуществляются с помощью диффузии реагентов и продуктов, и значит, их скорость будет определяться диффузионными характеристиками как самих реагирующих веществ, так и среды, в которой они находятся. Скорость 2-й стадии будет зависеть от нескольких факторов от природы веществ, от энергии активации реакции, от концентрации реагентов в приповерхностном слое, каталитических свойств поверхности, иногда от ориентации молекул на твёрдой поверхности и т. д. Суммарная продолжительность процесса будет определяться скоростью самой медленной (лимитирующей) стадии. Если доставка реагентов и отвод продуктов осуществляются быстрее, чем собственно химическое превращение, то лимитирующей стадией является химическая. В таком случае принято говорить, что гетерогенная реакция идет с химическим (или с кинетическим) контролем. Если же химическое превращение идет быстрее, чем подвод реагентов (или отвод продуктов), то лимитирующей стадией является соответствующий процесс диффузии, и тогда принято говорить о гетерогенном процессе с диффузионным контролем. ГЛАВА 13 КАТАЛИЗ 247 13.1. Основные понятия. Значение катализа для медицины, фармации и биологии Если энергия активации реакции высока, то лишь небольшая доля сталкивающихся молекул имеет энергию, достаточную для того, чтобы произошла реакция, а если она низка, то реагирует большая часть молекул, и поэтому константа скорости будет большой. Из этого следует, что если каким-либо образом снизить энергию активации, то реакция будет протекать быстрее. И наоборот - при повышении энергии активации реакция будет замедляться. Добиться снижения Е* можно с помощью катализа. Катализ - это изменение скорости или возбуждение химической реакции веществами (катализаторами), которые участвуют в реакции, но не входят в состав конечных продуктов. Катализатор может многократно участвовать в какой-либо промежуточной стадии химической реакции, и обычно его количество значительно меньше, чем количество реагентов. Реакции в присутствии катализаторов называются каталитическими. Различают положительный катализ (ускорение реакции) и отрицательный катализ или ингибирование (замедление реакции). Однако термин "катализ", как правило, относят к положительному катализу. Изменение скорости данной реакции при введении в реакционную смесь катализатора характеризуется каталитической активностью. Мерой её может быть увеличение константы скорости, уменьшение энергии активации т. п. Катализ играет огромную роль в химической промышленности, в том числе при синтезе лекарственных веществ. Многое в природе катализа еще не ясно, но, тем не менее, следует помнить, что различные примеси в лекарственных веществах могут вызвать каталитические реакции их разложения или превращения, что подразумевает необходимость тщательной очистки. Подобную роль могут играть и стенки сосудов, особенно металлических, в которых хранятся лекарственные вещества. Для замедления 248 подобных процессов каталитического разложения, а также фотолиза применяют ингибиторы, антиоксиданты и др. Огромно значение катализа в процессах, протекающих в живых организмах под действием биологических катализаторов - ферментов (ферментативный катализ). 13.2. Краткий исторический очерк Природными катализаторами - ферментами при изготовлении алкогольных напитков и уксуса, сыроварении, хлебопечении, выделке кож и т. д. люди пользовались еще в глубокой древности. Первые научные сообщения и катализаторах неферментной природы появляются в ХVIII веке. Так, было описано каталитическое ускорение реакций этерификации (К.В.Шееле, 1782), дегидратации (Дж.Пристли, 1778), гидролиза полисахаридов (К.С.Кирхгоф, 1811). Термин "катализ" был предложен в 1835 г. Й.Я.Берцелиусом. В учении о катализе большой вклад был внесён русскими химиками М.Г.Кучеровым (1871 - открытие реакции гидратации ацетилена в присутствии серной кислоты и ртутных солей), М.М.Зайцевым (1877- восстановление различных органических соединений над платиной), Н.А.Меншуткиным (1877 - реакции этерификации), А.М.Бутлеровым, Д.И.Менделеевым, Н.Н.Зининьм, Н.Д.Зелинским. Учение о катализе нашло дальнейшее развитие в исследованиях таких видных ученых, как П.Сабатье, В.Н.Ипатьев, А.А.Баландин, Н.И.Кобозев и др. 13.3. Виды катализа Существует такая классификация видов катализа: По агрегатному состоянию принято различать гомогенный катализ, при котором реагирующие вещества, продукты реакции и катализатор находятся в одной фазе, обычно жидкой или газовой, и гетерогенный катализ, при котором реагирующие вещества и продукты находятся в одной фазе, обычно жидкой или газообразной, а катализатор - в другой, обычно в твёрдой. Существует также гетерогенно-гомогенный катализ, при котором 249 реакция, начинаясь на поверхности катализатора, продолжается в объёме жидкой или газовой фазы. По химической природе катализатора различают кислотно-основный катализ, при котором реакции протекают в присутствии кислот или оснований, катализ на металлах, катализ на оксидах и т. д. Особую группу каталитических процессов составляют реакции ферментативного катализа. Для некоторых реакций катализатором может служить их собственный продукт. Такие реакции называются автокаталитическими. По избирательности действия. Во многих случаях один и тот же катализатор может изменять скорость нескольких возможных между данными реагирующими веществами катализ), но и существует широко реакций (неспецифический применяется на практике избирательный (или специфический) катализ, когда катализатор из многих возможных в данной реакционной смеси реакций "выбирает" одну. Это используется, например, для синтеза стереорегулярных полимеров. Высочайшей избирательностью обладают биологические катализаторы ферменты. По физическому состоянию твёрдого катализатора различают катализ на компактных металлах, когда катализатор представлен каким-либо одним металлом в различной степени раздробленности (дисперсности); катализ на носителях, когда катализатор-металл напыляется тонким слоем на какой-либо инертный носитель (фарфор, асбест, активированный уголь); катализ на смешанных катализаторах, когда катализатор представляет собой смесь порошков различных металлов, оксидов или других веществ. 250 13.4. Механизм действия катализаторов Единой теории катализа до настоящего времени нет. Однако накопленный экспериментальный материал позволяет сделать заключение о том, что катализатор способен входить в состав промежуточного соединения (активированного комплекса). При этом снижается энергия активации и происходит ускорение как прямой, так и обратной реакции. Важно понимать, что катализатор не может вызвать термодинамически невозможный процесс. Более того, катализатор не смещает химического равновесия, а лишь ускоряет его достижение. О том, что катализатор участвует в химической реакции, говорит, например, то, что физическое состояние катализатора в ходе реакции может существенно изменяться. Так, крупнокристаллический диоксид марганца, катализирующий распад бертолетовой соли, после реакции превращается в мелкий порошок. В принципе это изменение степени дисперсности может отразиться на каталитической активности, но в небольшой степени. Поэтому под неизменяемостью катализатора в ходе реакции имеют в виду постоянство его количества и химического состава до и после реакции. 13.5. Гомогенный катализ Многие реакции в газовой фазе носят отчётливо выраженный каталитический характер. Таковы, в частности, процессы, катализатором которых является молекулярный иод. Например, скорость реакции разложения диэтилового эфира C2H5OC2H5 C2H6 + CH4 + CO в присутствии иода увеличивается по сравнению с некаталитическим пиролизом примерно в 10 000 раз. В данном случае это связано с изменением механизма реакции. Первичный процесс заключается в расщеплении молекулы эфира под действием иода и в образовании в качестве 251 промежуточных соединений иодэтана, иодида водорода и уксусного альдегида: C2H5OC2H5 + J2 CH3CH2J + HJ + CH3CHO Вторичные процессы, приводящие к образованию продуктов реакции, заключаются в образовании этана с регенерацией катализатора: CH3CH2J + HJ C2H6 + J2 и в распаде уксусного альдегида: CH3CHO CH4 + CO По сравнению с некаталитической реакцией (Е* = 216,73 кДж/моль) в этой каталитической реакции энергия активации снижается до 74,475 кДж/моль. Гомогенно-каталитические реакции особенно распространены при проведении процессов в жидкой фазе. В большинстве случаев при этом приходится встречаться с кислотно-основным катализом. К таким процессам относятся ускоряющиеся под действием водородных ионов реакции этерификации и гидролиза сложных эфиров, инверсии сахарозы и т. п. (кислотный катализ). И в этих реакциях роль катализатора (ионов Н+) формально сводится к снижению энергии активации. В некоторых случаях кислотно-основного катализа катализатором являются ионы ОН, иногда недиссоциированные молекулы слабых кислот и оснований. В общем, можно сказать, что кислотно-основный катализ основан на протолитическом взаимодействии между катализатором и реагирующим веществом, как правило, не обладающим ярко выраженными кислотными или основными свойствами. Для реакций, протекающих по механизму кислотно-основного катализа, характерно то, что они не сопровождаются разрывом электронных пар в реагирующих веществах. К гомогенному катализу можно отнести и переваривание жидкой пищи в желудке под действием желудочного сока. С.Аррениусом было установлено, что каталитическое действие кислот может быть усилено добавлением в реакционную смесь нейтральных солей, не имеющих общих 252 анионов с кислотой (первичный солевой эффект), или имеющих такие общие анионы (вторичный солевой эффект). Природа солевых эффектов пока неясна. 13.6. Гетерогенный катализ На практике наиболее часто встречаются два типа гетерогенного катализа, при которых катализатор находится в твёрдой фазе: 1) процессы с реагирующими веществами в жидкой фазе; 2) процессы с реагирующими веществами в газовой фазе. Твёрдые катализаторы при этом могут иметь самую различную химическую природу (металлы, оксиды и др.) Реакция, как правило, происходит на границе раздела фаз, то есть на поверхности катализатора. Как и в случае других гетерогенных реакций, каталитический процесс состоит из нескольких стадий. Но, поскольку процессы адсорбции в гетерогенном катализе играют чрезвычайно важную роль, таких стадий имеется как минимум, пять: 1) подвод (диффузия) реагирующих веществ к поверхности катализатора; 2) адсорбция их молекул (иногда с определённой ориентацией); 3) реакция на поверхности катализатора; 4) десорбция продуктов; 5) отвод (диффузия) продуктов реакции от поверхности. Как правило, действие катализатора проявляется на 2-й, 3-й (в особенности) и на 4-й стадиях. Важным свойством твёрдых катализаторов является уже упоминавшаяся избирательность (специфичность) действия, под которой понимается способность ускорять одну из нескольких возможных в данной реакционной смеси реакций. Например, из смеси СО с Н2 ("водяной газ") в зависимости от природы катализатора и от условий могут получаться различные продукты: 1) CO + 3H2 СH4 + H2O Ni; Т = 240 - 260 oC 2) CO + 2H2 CH3OH 253 Cu; повышенное давление 3) CO + H2 смесь олефинов и парафинов + Н2О Co Причины избирательного действия катализаторов могут быть различными, причём многие из них пока не выяснены. Часто для придания большей избирательности, повышения термической стойкости и механической прочности, а также для повышения активности катализаторы применяют не в виде чистых веществ, а в виде сложных многокомпонентных систем. Наиболее интересны три типа таких катализаторов: смешанные, на носителях и промотированные. Смешанные катализаторы, как правило, представляют собой смесь двух или нескольких оксидов, например Al2O3 + ThO2 ; Al2O3 + Cr2O3 ; CoO + MgO. Состав этих катализаторов можно изменять, и активность их часто зависит от состава. Катализаторы на носителях представляют собой какое-либо инертное по отношению к данной реакции вещество, на которое нанесён различными способами (напылением, осаждением из раствора, пропиткой раствором соли с последующим восстановлением металла и т. п.) катализатор. Обычно катализ на носителях применяется с целью удешевления производственного процесса, так как в качестве катализаторов часто используются достаточно дорогие металлы - никель, кобальт, платина, золото и др. Промотированные катализаторы - катализаторы с добавлением промотóров, то есть веществ, которые сами по себе не обладают каталитическими свойствами по отношению к данной реакции, но увеличивают активность используемого катализатора. Некоторые добавки могут вызвать не промотирование, а обратный эффект "отравление" катализатора, то есть снижение его каталитической активности. Такие добавки называются каталитическими ядами. Их 254 действие объясняется хемосорбцией на поверхности катализатора или другим блокирующим механизмом. Необходимо помнить, что разложение лекарственных веществ – тоже химическая реакция, которая может катализироваться различными твёрдыми веществами, находящимися с ними в контакте. В качестве таких нежелательных катализаторов могут выступать неудалённые при очистке примеси непрореагировавших исходных веществ или побочных продуктов, сопутствующие вещества, а в особенности - материалы упаковки, главным образом, металлы. Поэтому для продления срока годности лекарств немаловажными факторами являются тщательная очистка их от примесей и подбор неактивного в каталитическом отношении материала упаковки. 13.7. Теории гетерогенного катализа По мере накопления опытных данных о гетерогенных каталитических реакциях неизбежно встает вопрос о природе и строении активной поверхности катализатора. Тот факт, что для отравления катализатора вполне достаточно ничтожно малого количества каталитического яда, а также что каталитическая активность практически не изменяется при напылении катализатора на носитель (где он присутствует в виде очень небольших частичек, часто коллоидных размеров), говорит о существовании на поверхности катализатора каких-то активных центров. Эти активные центры, на которых собственно и идет каталитический процесс, должны занимать, по-видимому, очень малую часть общей поверхности катализатора, а остальная часть её при этом остается инертной. Природа активных центров может быть различной (выступы на поверхности, определённые участки кристаллической структуры и т. д.), но несомненно, что она играет весьма существенную роль в процессе каталитического превращения. 255 Различные теории катализа по-разному интерпретируют понятие активного центра и роль этих центров в каталитическом действии. Рассмотрим некоторые из них. 13.7.1. Мультиплетная теория В 1929 году А.А.Баландиным впервые были высказаны положения мультиплетной теории: 1) Активный центр представляет собой совокупность определённого числа адсорбционных центров, расположенных на поверхности катализатора в геометрическом соответствии со строением молекулы, претерпевающей превращение (принцип геометрического или структурного соответствия). Согласно теории Баландина, таким активным каталитическим центром является участок поверхности катализатора с определённой кристаллической структурой, на котором расстояния между центрами атомов соответствуют расстояниям в адсорбирующихся и превращающихся молекулах. Активный центр, состоящий из двух атомов, был назван дублетом, из трёх - триплетом, из четырёх - квадруплетом, из шести атомов - секстетом. Общее название активного центра, состоящего из нескольких атомов - мультиплет. 2) При адсорбции реагирующих молекул на активном центре образуется мультиплетный комплекс, в результате чего происходит перераспределение связей, приводящее к образованию продуктов реакции. Таким образом, мультиплетная теория ставит геометрическую структуру реагирующих на поверхности катализатора молекул в прямую зависимость от геометрического расположения адсорбционных центров. Это может объяснить причины специфичности каталитического действия. Например, реакция дегидрирования циклопарафинов CH3 CH3 + 3 Н2 CH3 1,2-диметилциклогексан 256 CH3 о-ксилол катализируется металлами, кристаллизующимися в кубических гранецентрированных или гексагональных решётках, так как только на октаэдрических гранях первой и на базопинакоидах второй встречается расположение атомов решётки, соответствующее строению шестичленных циклов. Однако из таких металлов катализаторами являются только те, у которых расстояние между центрами атомов в решетке лежит в пределах от 2,77108 см (Pt) до 2,48108 см (Ni). Так, каталитически активны Рd (2,74108 см), Ir (2,70108 см), Rh (2,68108 см), Сu (2,56108 см), а кристаллографически аналогично построенные Тh (3,60108 см), Аg и Аu (2,88108 см) при дегидрировании шестичленных колец каталитически неактивны. В 1935 году А.А.Баландин включил в мультиплетную теорию принцип энергетического соответствия, согласно которому энергия активации катализируемой реакции зависит и от энергии связи между катализатором и мультиплетным активированным комплексом (а не только от энергии связи между составными частями реагирующих молекул). Отсюда следует, что чем больше сродство катализатора к адсорбирующимся исходным веществам, тем заметнее снижается энергия активации катализируемой реакции. 13.7.2. Теория активных ансамблей Эта теория была создана Н.И.Кобозевым (1939). Она наиболее подходит для описания катализа на носителях. Согласно Н.И.Кобозеву поверхность носителя (активированный уголь, асбест, пемза и т. п.) имеет блочное строение, то есть состоит из отдельных участков - блоков, которые отделены друг от друга дефектами поверхности, например, микротрещинами, включениями примесей и т. п. Эти поверхностные блоки представляют собой области свободной миграции атомов нанесённого металла, способных перемещаться по их поверхности в 257 результате теплового движения. При попадании на такой блок определённого числа атомов (зависящего от условий нанесения), они в результате миграции способны образовать активный центр, названный Н.И.Кобозевым активным ансамблем, на котором и происходит каталитическое превращение. Активный ансамбль состоит из нескольких атомов, являющихся как бы двухмерным зародышем кристаллической решётки. Если его геометрическое строение соответствует строению молекул реагирующих веществ, то они способны адсорбироваться на нём и вступать в каталитическую реакцию. Другие положения теории Н.И.Кобозева в основном совпадают с положениями мультиплетной теории. 13.7.3. Электронная теория В основе электронной теории, разработанной С.З.Рогинским и Ф.Ф.Волькенштейном (1940), лежит положение о том, что на поверхности катализатора имеются нескомпенсированные валентности, обусловленные свободными или слабосвязанными электронами, присутствующими в его кристаллической структуре. Адсорбция реагирующих молекул происходит с участием этих нескомпенсированных валентностей катализатора, благодаря чему связи внутри молекул ослабляются настолько, что они, по сути дела, представляют уже свободные атомы или радикалы. Продукты реакции образуются при взаимодействии этих атомов или радикалов, находящихся в непосредственной близости друг к другу. Эта теория довольно хорошо описывает катализ на переходных металлах, у которых имеется незавершённая d-электронная оболочка. 13.8. Ингибиторы Ингибиторы - это вещества, замедляющие протекание реакций. Как и катализаторы, они обладают специфичностью действия. Возможны такие механизмы действия ингибиторов: 258 1) взаимодействие с промежуточными продуктами с образованием соединений, малоактивных в последующих реакциях (поэтому ингибиторы особенно эффективны в случае цепных реакций); 2) взаимодействие с активными центрами катализаторов (отравление); 3) блокирование активных центров катализаторов (когда, не занимая активных центров, ингибиторы препятствуют подходу к поверхности катализатора реагирующих веществ). Во многих случаях использование ингибиторов приносит большую пользу, например, при защите металлов от коррозии, при продлении сроков годности лекарственных препаратов и пищевых продуктов с использованием ингибиторов-антиоксидантов. На ингибировании различных внутриклеточных реакций болезнетворных микроорганизмов, приводящем к угнетению их роста или размножения, основано фармакологическое действие некоторых лекарственных веществ, например, сульфаниламидов. В других случаях ингибирование реакций может иметь отрицательное значение. Так, ингибированием действие многих ферментативных биологических реакций в ядов организме. связано с Случайное попадание веществ, являющихся ингибиторами, в реакционные аппараты приводит к замедлению химических реакций, а часто и к полному отравлению катализатора, что требует его замены. 259 VI. Ф О Т О Х И М И Я ГЛАВА 14 ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Кроме рассмотренной термической активации возможна и другая активация молекул - фотохимическая. При термической активации атомы и молекулы участвуют в реакции в их основных электронных состояниях. Фотохимические реакции осуществляются лишь после перевода молекул исходных веществ в электронно-возбуждённое состояние под воздействием электромагнитного излучения. Таким образом, фотохимические реакции это реакции, происходящие только при наличии электромагнитного излучения в широком интервале энергий - от видимого и ультрафиолетового света до рентгеновских и -лучей. Таким образом, фотохимия это - раздел химической кинетики, занимающийся поведением электронно-возбужденных молекул. В зависимости от системы и от условий, в которых происходит фотовозбуждение, такая молекула может участвовать в нескольких различных процессах. Она может потерять свою избыточную энергию при соударении с другой молекулой без химического взаимодействия (при этом выделяется теплота); возбужденная молекула может вернуться в основное состояние, испустив фотон, т. е. путём флуоресценции или фосфоресценции. Наконец, она может претерпеть химическое превращение, например, изомеризацию, ионизацию, диссоциацию на атомы или радикалы. 14.1. Значение фотохимических реакций В биологии известно несколько фотохимических процессов, имеющих чрезвычайно большое значение для жизнедеятельности как отдельных организмов, так и биосферы в целом. В первую очередь среди таких 260 процессов следует назвать фотосинтез. Кроме того, чрезвычайно важными являются фотохимия зрения, фотохимия синтеза витаминов, например, витамина D в человеческой коже, фотохимия загара и др. Фотохимическая реакция разложения галогенидов серебра лежит в основе фотографического процесса. Существуют фотохромные материалы, способные изменять цвет или прозрачность под действием света, что используется, в частности, для фотохимической записи информации или для изготовления солнцезащитных очков. Фотохимические реакции используются и в химической промышленности, например, при синтезе капролактама или при фотополимеризации метилметакрилата в производстве органического стекла. Для фармации фотохимические реакции важны в первую очередь постольку, поскольку свет может вызывать деструкцию (фотолиз) многих лекарственных препаратов. Разложению под действием света подвержены и многие другие вещества и материалы - древесина, бумага, краски, пластмассы и т. д. В химии достаточно широко используется люминесцентный метод анализа, основанный на изучении спектров излучения, испускаемого возбужденными молекулами исследуемых веществ. 14.2. Первичные и вторичные фотохимические процессы Фотохимические реакции подразделяются на первичные и вторичные процессы, происходящие соответственно на световых или темновых стадиях. Первичные процессы связаны с поглощением молекулами кванта световой энергии - реакционноспособных фотона, что может промежуточных привести соединений, к образованию которые затем участвуют во вторичных процессах, имеющих термическую природу и не требующих воздействия света или другого излучения 261 Проиллюстрировать первичные и вторичные процессы можно на примере разложения иодида водорода. В отсутствие света происходит термическая реакция 2HJ H2 + J2 Если же на систему действует свет подходящей длины волны, то идут следующие процессы: HJ + h H + J фотохимическая реакция, первичный процесс H + HJ H2 + J термические реакции; J + J J2 вторичные процессы Хотя конечные продукты превращений в химическом и в фотохимическом процессах совпадают, механизмы этих процессов различны. 14.3. Законы фотохимии Известны следующие законы фотохимии: Закон Гроттгуса Дрейпера (К.И.Д.Гроттгус - 1818; Дж.У.Дрейпер 1842): Фотохимическое изменение может произвести только тот свет, который поглощается данным веществом. (Обычно это тот свет, цвет которого является дополнительным к цвету вещества, вступающего в фотохимическую реакцию. Так, красные лучи поглощаются зелёными веществами, жёлтые – синими и т. д.). Закон Бунзена - Роско (Р.Бунзен совместно с Г.Роско - 1857): Степень химического превращения пропорциональна времени воздействия света. В настоящее время этот закон считается следствием закона Штарка Эйнштейна. Закон фотохимической эквивалентности Штарка Эйнштейна (И.Штарк - 1908, А.Эйнштейн - 1912): Каждый фотон, поглощённый веществом на первичной (световой) стадии, вызывает изменение только одной молекулы. 262 В соответствии с законом Штарка Эйнштейна при поглощении одного фотона образуется одна электронно-возбуждённая молекула. Однако на темновых стадиях подвергаться химическому превращению будет число молекул, в общем случае отличающееся от числа возбуждённых. С одной стороны не все возбуждённые молекулы могут вступить в химическую реакцию (например, из-за того, что испустят фотон и потеряют способность к превращению). С другой стороны, при цепных реакциях один поглощённый фотон может инициировать длинную цепь превращений, т. е. вызовет превращение большого числа молекул. 14.4. Фотохимическая эффективность Отношение числа подвергшихся химическому превращению молекул к числу поглощённых фотонов называется фотохимической эффективностью или квантовым выходом фотохимической реакции Ф. Квантовый выход может быть выражен и через мольные величины: nпрод = nф где nпрод - число молей образовавшихся продуктов, nф число поглощённых эйнштейнов (единица “эйнштейн”, названная в честь А.Эйнштейна, равна 1 молю (6,021023) фотонов). В случае фотохимических реакций, протекающих в газовой фазе по цепному механизму, Ф может быть намного больше единицы. Для реакций в растворах из-за конкурентного действия фотофизических процессов, при которых возможно испускание фотона или передача возбуждения молекулам растворителя, не принимающим участия в реакции, Ф может быть меньше единицы. 263 14.5. Фотосенсибилизация Фотохимическая эффективность может быть повышена введением в реакционную среду фотосенсибилизаторов. Фотосенсибилизаторы - это вещества, молекулы которых способны возбуждаться при поглощении квантов света, но которые сами в последующих химических превращениях не участвуют. Роль фотосенсибилизаторов заключается в передаче возбуждения другим молекулам при столкновениях с ними. Такие фотосенсибилизированные реакции возможны в том случае, когда молекулы реагирующих веществ сами не способны подвергаться фотохимической активации. Чаще всего применение сенсибилизаторов требуется тогда, когда молекулы реагирующих веществ способны поглощать кванты света с энергией, не совпадающей по величине с энергией, необходимой для образования активированного комплекса. Поэтому фотосенсибилизатор должен поглощать свет с другой, более соответствующей данной реакции длиной волны. Эффективные сенсибилизаторы почти не расходуются при протекании реакции и, таким образом, могут рассматриваться в качестве своеобразных “катализаторов“ фотохимических реакций. Наиболее известным фотосенсибилизатором является хлорофилл, чья роль при фотосинтезе заключается в поглощении квантов красного света на световой стадии и передаче возбуждения через ряд переносчиков молекулам воды на темновых стадиях. В химической технологии фотосенсибилизированные реакции применяются, например, при получении стильбенов, при разложении пероксидов, нитритов и других окислителей. Фотосенсибилизирующими свойствами обладают многие соединения, относящиеся к классу кетонов, а также 2.5-дифенил-оксазол, 1,4-бис-2-(5фенилоксазол)бензол и др. Поэтому при изготовлении лекарственных форм следует помнить, что содержащиеся в них вещества с этими или подобными структурами могут инициировать реакции фотохимического разложения. 264 ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА Ахметов Б.В., Новиченко Ю.П., Чапурин В.И. Физическая и коллоидная химия. Л.: Химия, 1986. - 320 с.: ил. Болдырев А.И. Физическая и коллоидная химия. М.: Высшая школа, 1983. 408 с.: ил. Волков В.А., Вонский Е.В., Кузнецова Г.И. Химики. Биографический справочник. Киев: Наукова думка, 1984. - 735 с., ил. Гамеева О.С. Сборник задач по физической и коллоидной химии. М.: Высшая школа, 1980. – 191 с. Герасимов Я.И. и др. Курс физической химии: В 2 Т.- М.: Химия, 1969. - Т.1. - 1969. - 592 с.; Т.2. - 1973. - 624 с. Глазов В.М. Основы физической химии. - М.: Высшая школа, 1981. - 456 с. Голиков Г.А. Руководство по физической химии. М.: Высшая школа, 1988. 383 с. Гордон А., Форд Р. Спутник химика. - Пер. с англ. - М.: Мир, 1976. – 541 с. Горшков В.И., Кузнецов И.А. Физическая химия. - М.: Изд-во МГУ, 1986. 264 с. Даниэльс Ф., Олберти Р. Физическая химия. М.: Мир, 1978. - 645 с. Джуа М . История химии. М.: Мир, 1975. – 477 с. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии: В 2-х томах. - Пер. с англ. - М.: Мир, 1982. Т.1 - 652 с., ил.; Т.2 - 620 с., ил. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. М.: Высшая школа, 1990. - 487 с.: ил. Зайцев О.С. Общая химия. М.: Химия, 1990. - 352 с.: ил. Казанская А.С., Скобло В.А. Расчеты химических равновесий. - М.: Высшая школа, 1974. - 288 с., ил. Киреев В.А. Курс физической химии. М.: Химия, 1978. - 775 с. Киреев В.А. Краткий курс физической химии. М.: Химия, 1978. - 624 с., ил. Кнорре Д.Г., Крылова Л.Ф., Музыкантов В.С. Физическая химия. - М.: Высшая школа, 1990. - 416 с.: ил. Красовский И.В., Вайль Е.И., Безуглый В.Д. Физическая и коллоидная химия. Киев: Вища школа, 1983. - 352 с. Краткий справочник физико-химических величин. Под ред. Равделя А.А. и Пономаревой А.М.. Л.: Химия, 1983. – 231 с. Краткий справочник физико-химических величин. Под ред. Мищенко К.П. и Равделя А.А.- Л.: Химия, 1974. – 200 с. Ленский А.С. Введение в биоорганическую и биофизическую химию. М.: Высшая школа, 1989. - 256 с.: ил. Менковский М.А., Шварцман Л.А. Физическая и коллоидная химия. М.: Химия, 1981. - 296 с.: ил. Николаев Л.А. Физическая химия. - М.: Высшая школа, 1979. - 371 с. 265 Общая химия (Биофизическая химия. Химия биогенных элементов). Под ред. Ершова Ю.А. и др. М., "Высшая школа", 1993. - 560 с.: ил. Полинг Л., Полинг М. Химия. М.: Мир, 1978. – 683 с. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л.: Химия, Ленингр. отд., 1978. – 392 с. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М.: Высшая школа, 1975. - 255 с.: ил. Слейбо У., Персонс Т. Общая химия: Пер. с англ. - М.: Мир, 1979. - 550 с., ил. Слесарев В.И. Химия: Основы химии живого. - СПб: Химиздат, 2000. - 768 с.: ил. Соловьев Ю.И. Очерки по истории физической химии. М.: Наука, 1964. Соловьев Ю.И. История химии в России. М.: Наука, 1985. – 416 с. Стромберг А.Г., Семченко Д.П. Физическая химия. - М.: Высшая школа, 1999. - 527 с.: ил. Фалта Я., Новы Л. История естествознания в датах: Пер. со словац. М.: Прогресс, 1987. - 495 с. Физическая химия в вопросах и ответах. Под ред. К.В.Топчиевой и Н.В.Федорович. - М.: Изд-во МГУ, 1981. - 264 с. Физическая химия. Под ред. Б.П.Никольского. - Л.: Химия, 1987. - 880 с. Физическая химия. Под ред. К.С.Краснова. - М.: Высшая школа, 1982. - 687 с. Физический энциклопедический словарь. Гл. ред. Прохоров А.М. - М.: Сов. энцикл., 1984. – 944 с. Химическая энциклопедия: в 5 т. Ред. колл.: Кнунянц И.Л. (гл. ред.) и др. М.: Сов. энцикл., 1988 - 1992. Химический энциклопедический словарь. Гл. ред. Кнунянц И.Л.- М.: Сов. энцикл., 1983. – 791 с. Хмельницкий Р.А. Физическая и коллоидная химия. М.: Высшая школа, 1988. - 400 с.: ил. Чанг Р. Физическая химия с приложением к биологическим системам. М., "Мир", 1980. - 662 с. Чертов А.Г. Единицы физических величин. - М.: Высшая школа, 1977. – 287 с. Эткинс П. Физическая химия: В 2 Т.- М.: Мир, 1980. - Т.1. - 580 с.: ил.; Т.2. 584 с.: ил. Эткинс П. Порядок и беспорядок в природе: Пер. с англ. - М.: Мир, 1987. 224 с., ил. 266 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ А Азеотропные смеси ......................... 114 разделение ..................................... 118 Азеотропы ........................................ 114 Аккумуляторы .................................. 186 Активация молекул термическая ................................... 225 фотохимическая ............................ 245 Активированный комплекс ............ 227 Активность каталитическая .............................. 233 термодинамическая .................. 36, 69 Активные центры катализатора ..... 240 Активный ансамбль ......................... 242 Ассоциация молекул ....................... 107 Б Буферная ёмкость ............................ 165 Буферное действие .......................... 165 Буферные растворы ......................... 165 Буферные системы крови ............... 166 В Вариантность ..................................... 87 Вероятность термодинамическая ..... 51 Время полупревращения................. 210 реакции второго порядка ............. 219 реакции первого порядка ............. 215 Время полураспада .......................... 210 Второе начало термодинамики ........ 48 Выход квантовый ...................................... 248 продуктов реакции ................... 72, 78 устройство ..................................... 184 формула записи ............................. 186 Гемолиз ............................................. 137 Гетерогенизация ............................... 123 Гомогениязация ................................ 123 Д Давление диссоциации ...................... 82 Двойной электрический слой ......... 179 Дефлегматор ..................................... 117 Диаграмма давление - состав........................... 105 кипения .......................................... 110 плавления (плавкости) .................. 142 растворения ................................... 121 состояния ......................................... 95 воды ............................................... 95 температура - состав ............. 111, 146 уровней энтальпии .......................... 38 фазовая ....................................... 94, 95 Дистилляционная установка ........... 116 Дистилляция ..................................... 116 Доля массовая ......................................... 101 молярная ........................................ 102 объёмная ........................................ 101 Ж Жидкости несмешивающиеся ........................ 139 ограниченно растворимые ........... 120 с верхней КТР ............................ 121 с двумя КТР ................................ 126 с нижней КТР ............................. 125 Г З Гальванический элемент ................. 178 аккумулятор .................................. 186 Даниэля - Якоби .................... 187, 189 концентрационный ....................... 198 необратимый ................................. 186 обратимый ..................................... 185 окислительно-восстановительный (редокс) ....................................... 202 правильно разомкнутый ............... 187 принцип действия ......................... 184 Закон Бунзена - Роско ............................. 247 возрастания энтропии ..................... 55 Гесса ................................................. 36 следствия .......................... 38, 39, 40 Гроттгуса - Дрейпера .................... 247 Дальтона ................................ 105, 139 действующих масс .................. 69, 211 Кирхгоффа ....................................... 40 Кольрауша ..................................... 171 267 Коновалова второй ......................................... 113 первый ........................................ 109 Лавуазье - Лапласа ......................... 38 разведения Оствальда .................. 173 распределения ............................... 155 Рауля .............................................. 103 отклонения ......................... 106, 120 сохранения энергии ........................ 21 термодинамики второй .................. 48 термодинамики нулевой ................ 25 термодинамики первый.................. 26 термодинамики третий................... 48 фотохимической эквивалентности ..................................................... 247 Штарка - Эйнштейна .................... 247 И Изоосмия .......................................... 137 Ингибирование ................................ 233 Ингибиторы ...................................... 243 Ионометрия ...................................... 194 К Калориметрия..................................... 31 Калориметры ...................................... 31 Катализ.............................................. 233 гетерогенный ......................... 234, 237 теории ......................................... 239 гомогенный ........................... 234, 236 кислотно-основный ...................... 235 на металлах............................ 235, 240 на носителях .......................... 235, 242 на смешанных катализаторах ...... 235 неспецифический .......................... 235 отрицательный .............................. 233 положительный ............................. 233 специфический (избирательный) 235 ферментативный ................... 234, 235 Катализаторы ................................... 233 механизм действия ....................... 235 промотированные ......................... 239 Каталитические яды ........................ 239 Компонент .......................................... 86 мажорный ........................................ 99 минорный ........................................ 99 независимый.................................... 86 Кондуктометрическое титрование . 173 268 кривые титрования........................ 174 Кондуктометрия ............................... 172 прямая ............................................ 172 Кондуктометры ................................ 172 Коннода ............................................. 112 Константа кондуктометрической ячейки ...... 173 криоскопическая ........................... 130 равновесия ....................................... 68 концентрационная ....................... 69 способы вычисления ................... 79 термодинамическая ..................... 69 скорости ......................................... 212 реакции второго порядка .......... 216 реакции первого порядка .......... 213 эффективная ............................... 212 эбулиоскопическая ....................... 132 Концентрация ................................... 101 моляльная....................................... 103 молярная ........................................ 102 молярная эквивалента .................. 102 осмолярная..................................... 138 Коэффициент изотонический ............................... 163 осмотический ................................ 164 распределения ............................... 155 расхода пара .................................. 141 скорости ......................................... 212 Кривые охлаждения ......................... 142 Криометрия ............................... 128, 131 Криоскопия ....................................... 131 Л Лизис ................................................. 137 Лимитирующая стадия .................... 232 Линия ликвидуса ............................... 111, 146 пара ................................................. 111 равновесия ....................................... 95 расслоения ..................................... 122 солидуса ......................................... 147 Люминесцентный анализ ................ 246 М Макросостояние ................................. 51 Механизм реакции ........................... 221 Микросостояние ................................. 51 Молекулярность реакции ................ 206 псевдомолекулярность ................. 208 Мост Уитстона ................................. 172 Мультиплет ...................................... 241 Мультиплетный комплекс .............. 241 Н Нода................................................... 112 Нулевое начало термодинамики ...... 26 О Объём молярный ......................................... 91 удельный.......................................... 91 Онкотическое давление .................. 138 Осмометрия ...................................... 136 Осмос ................................................ 133 Осмотическое давление растворов неэлектролитов ........... 135 П Первое начало термодинамики ........ 27 Перегонка ......................................... 116 простая ........................................... 117 ректификация ................................ 118 с водяным паром ........................... 140 фракционная .................................. 117 Перегонная установка ..................... 116 Период полураспада ........................ 210 Плазмолиз ......................................... 137 Подвижность ионов ......................... 171 Полуэлемент ..................................... 178 Порядок реакции.............................. 207 второй ............................................ 207 дробный ......................................... 208 методы определения ..................... 219 нулевой .......................................... 208 первый............................................ 207 по данному веществу ................... 207 псевдопорядок............................... 208 суммарный..................................... 207 третий ............................................. 207 Постулат Планка ................................ 58 Потенциал диффузионный .............................. 192 контактный .................................... 192 химический...................................... 87 Потенциометрическое определение констант равновесия..................... 201 концентрации (активности) ионов ..................................................... 197 рН растворов ................................. 194 pH-метры .................................... 194 Потенциометрия ............................... 194 Правило Алекссева ....................................... 124 Вант-Гоффа.................................... 222 рычага для диаграмм кипения ............... 114 для диаграмм плавления ........... 153 фаз..................................................... 86 Преходное состояние ....................... 227 Принцип Бертло - Томсена ............................. 31 геометрического соответствия .... 240 Ле-Шателье - Брауна ................ 73, 74 непрерывности ................................ 94 соответствия .................................... 95 энергетического соответствия ..... 241 Проводники ...................................... 166 второго рода .................................. 166 первого рода .................................. 166 Промоторы ........................................ 239 Процент массовый ........................................ 101 молярный ....................................... 102 объёмный ....................................... 102 Процесс необратимый ................................... 50 несамопроизвольный ...................... 50 обратимый ....................................... 50 самопроизвольный .......................... 50 Процесс термодинамический ........... 23 адиабатический ............................... 23 изобарный ........................................ 23 изотермический ............................... 23 изохорный ........................................ 23 Р Работа .................................................. 24 процесса максимальная .................. 63 процесса максимальная полезная .. 63 расширения ...................................... 28 Равновесие термодинамическое ........................ 25 фазовое ................................. 84, 86, 87 269 в двухкомпонентных системах .. 99 в однокомпонентных системах .. 89 в трёхкомпонентных системах . 154 химическое ...................................... 67 Разведение ........................................ 170 Растворитель ...................................... 99 Растворы ............................................. 99 буферные ....................................... 165 гипертонические ........................... 136 гипотонические ............................. 136 идеальные .............................. 100, 105 изотонические ....................... 136, 138 коллигативные свойства .............. 104 неэлектролитов ............................... 99 коллигативные свойства ........... 127 реальные ........................................ 100 сопряжённые ................................. 120 твёрдые .......................................... 151 физиологические .......................... 138 электролитов ................................. 161 коллигативные свойства ........... 162 Рафинат ............................................. 157 Реакции автокаталитические ...................... 235 бимолекулярные ........................... 207 гетерогенные ......................... 206, 230 гомогенные .................................... 206 каталитические ............................. 233 мономолекулярные ....................... 207 обратимые ....................................... 72 простые .......................................... 206 с диффузионным контролем........ 232 с химическим (кинетическим) контролем ................................... 232 сложные ......................................... 206 тримолекулярные.......................... 207 фотохимические............................ 245 вторичные ................................... 246 первичные .................................. 246 экзотермические ........................... 228 эндотермические ........................... 229 Ректификационная колонна ............ 118 Ряд напряжений металлов .............. 183 С Система термодинамическая ............ 22 классификация ................................ 22 270 параметры ........................................ 23 Скорость реакции ............................. 209 зависимость от концентрации ..... 211 зависимость от температтуры...... 222 мгновенная ..................................... 209 мстинная ........................................ 209 Смеси азеотропные ................................... 114 веществ, образующих твёрдые растворы ..................................... 151 веществ, образующих химические соединения.................................. 148 плавящиеся инконгруэнтно ...... 149 плавящиеся конгруэнтно........... 148 изоморфных веществ .................... 152 неизоморфных веществ ................ 142 охлаждающие ................................ 132 эвтектические ................................ 145 Солевой мостик ................................ 192 Солевой эффект вторичный ...................................... 237 первичный...................................... 237 Спирт этиловый абсолютный ................................... 119 ректификат ..................................... 119 Сроки годности лекартвенных препаратов ..................................... 216 Стадия световая .......................................... 246 темновая ......................................... 246 Стандартное состояние ..................... 35 Стандартные условия ........................ 35 Степень ассоциации ..................................... 156 диссоциации кондуктометрическое определение .................................................. 173 извлечения ..................................... 157 Т Температура........................................ 25 абсолютная ...................................... 25 гетерогенизации ............................ 123 гомогенизации ............................... 123 кипения нормальная ................................. 109 кристаллизации ............................. 144 критическая растворения ............. 120 фазового перехода .......................... 89 нормальная ................................... 91 эвтектическая ................................ 145 Теория абсолютных скоростей реакций .. 227 активных соударений ................... 224 гетерогенного катализа активных ансамблей .................. 242 мультиплетная ........................... 240 электронная ................................ 242 переходного состояния ................ 226 Тепловая теорема Нернста................ 59 Тепловой эффект при постоянном давлении.............. 33 при постоянном объёме ................. 33 химической реакции ....................... 32 экзотермический ............................. 32 эндотермический ............................ 32 Теплоёмкость ..................................... 24 зависимость от температуры ......... 43 изобарная ......................................... 25 изохорная ......................................... 25 истинная .......................................... 24 молярная .......................................... 25 средняя ............................................. 25 удельная ........................................... 25 Теплообмен ........................................ 24 Теплота ............................................... 24 возгонки (сублимации) .................. 91 гидратации (сольватации) .............. 45 испарения ........................................ 90 кристаллизации ............................. 144 нейтрализации ................................. 46 образования ..................................... 35 плавления ........................................ 90 разрушения кристаллической решётки......................................... 44 растворения ..................................... 44 дифференциальная ...................... 44 интегральная ................................ 44 сгорания ........................................... 34 фазового перехода молярная ....................................... 90 удельная ........................................ 91 Термический анализ ........................ 142 Термодинамика законы (начала) ............................... 20 статистическая ................................ 19 химическая....................................... 20 Термохимия ........................................ 30 Точка криогидратная ............................... 147 перитектическая ............................ 150 тройная ............................................. 97 фигуративная ................................... 95 эвтектическая ................................ 147 Третье начало термодинамики ... 57, 58 У Уравнение Аррениуса .............................. 223, 226 Больцмана .................................. 53, 58 Вант-Гоффа для осмотического давления ...................................... 136 Гиббса - Гельмгольца ..................... 64 изобары ............................................ 77 изотермы .......................................... 74 изохоры ............................................ 77 Кирхгоффа ....................................... 40 для большого интервала температуры .............................. 43 для малого интервала температуры .............................. 43 Клапейрона ...................................... 89 Клаузиуса - Клапейрона ................. 92 Нернста .......................................... 187 для ЭДС ...................................... 189 для электродного потенциала ... 190 Нернста - Петерса ......................... 191 Нернста - Тюрина ......................... 191 Уравнение экстракционное для количества вещества остающегося в рафинате .............. 158 переходящего в экстракт .............. 159 Уравнения реакций термохимические ........................................................... 36 Ф Фаза ..................................................... 85 Фазовое поле ...................................... 95 Фазовые переходы ....................... 85, 86 Фазы сопряжённые .......................... 120 Факторы .............................................. 23 интенсивности ................................. 51 271 экстенсивности ............................... 51 Физико-химический анализ .............. 94 Физическая совместимость лекарств ........................................................ 147 Фотолиз ............................................. 246 Фотосенсибилизация ....................... 248 Фотосинтез ............................... 245, 249 Фотохимическая эффективность ... 248 Фотохимия ........................................ 245 Фракция ............................................ 117 Функции термодинамические .......... 23 состояния ......................................... 23 характеристические ........................ 23 Х Химическая кинетика ...................... 204 Химические источники тока .......... 178 Химическое равновесие гетерогенное .................................... 81 Химическое сродство ........................ 63 Ч Числа переноса................................. 167 Э Эбулиометрия .......................... 132, 133 Эбулиоскопия................................... 133 Эвтектика .......................................... 147 Эвтектический состав...................... 145 Экзоосмос ......................................... 137 Экстрагент ........................................ 156 Экстрагируемое вещество .............. 156 Экстракт ............................................ 156 Экстракция ....................................... 156 дробная .......................................... 159 Электрическая проводимость ......... 166 удельная ......................................... 167 эквивалентная ............................... 169 при бесконечном разведении ... 170 Электрический заряд ....................... 177 Электрическое напряжение .................................... 177 сопротивление ............................... 167 Электрод анод ................................................ 178 водородный ................................... 182 нормальный ................................ 183 стандартный ............................... 183 272 второго рода .................................. 180 каломельный............................... 181 хлориджсеребряный .................. 181 газовый ........................................... 182 измерительный .............................. 194 индикаторный................................ 194 ионоселективный .......................... 197 катод ............................................... 178 окислительно-восстановительный (редокс) ....................................... 201 первого рода .................................. 179 сравнения ............................... 180, 194 стеклянный .................................... 196 Электродвижущая сила ... 177, 179, 191 Электродный потенциал ................. 178 сольватационная теория ............... 179 стандартный .................................. 190 Электроды ......................................... 177 необратимые .................................. 177 обратимые ...................................... 177 Электролизёр .................................... 178 Электролитический ключ ................ 192 Электролитический мостик ............ 192 Электропроводность ................ 166, 167 Электрохимическая цепь................................................. 178 Электрохимическая цепь внешняя .................................. 184, 187 внутренняя ..................................... 187 Электрохимическая ячейка ............. 178 Электрохимия ................................... 161 ионика ............................................ 161 электроодика ................................. 161 Энергетический барьер ................... 224 Энергетический профиль реакции . 228 Энергия ............................................... 21 (функция) Гельмгольца .................. 59 (функция) Гиббса ............................ 60 активации ....................................... 224 внутренняя ....................................... 22 свободная ......................................... 63 связанная .......................................... 63 Энтальпия ........................................... 28 Энтропия ............................................. 52 изменение в ходе химической реакции ........ 57 при физических процессах ......... 55 273 Н.Н.БОГДАШЕВ КУРС ЛЕКЦИЙ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ. Часть I - ФИЗИЧЕСКАЯ ХИМИЯ. (учебное пособие) Технический редактор Браташова Т.М. Подписано в печать “____”___________2002 г. Формат___________. Бумага кн.-журнальная. Печать ротапринтная. Усл. печ. л. 11,7. Уч.-изд. л. 11,7. Тираж экз. Заказ _______. Пятигорская государственная фармацевтическая академия 357532 г. Пятигорск, пр. Калинина, 11 274 Для заметок 275 Для заметок 276





![1) Для понижения концентрации [Fe ] до 10](http://s1.studylib.ru/store/data/004531731_1-c9f9271cd2d1cf918ee273e513a5f409-300x300.png)