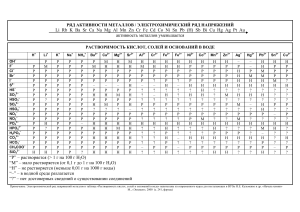
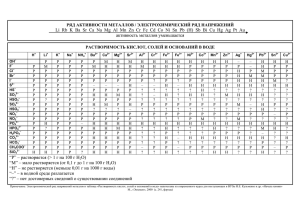
«Свет – вечно натянутая пружина, приводящая в действие механизм земной жизни». (Роберт Майер) Фотосинтез Химические свойства металлов обусловлены способностью их атомов легко отдавать электроны с внешнего энергетического уровня, превращаясь в положительно заряженные ионы. Fe 0 n+ Me - ne → Me — В химических реакциях металлы способны отдавать электроны, т.е. быть восстановителями, проявлять в образовавшихся соединениях только положительную степень окисления. Задание 1. Заполнение таблицы на протяжении урока Химические свойства металлов С чем именно реагирует Особенности взаимодействия Уравнение химической реакции 1. Взаимодействие металлов с неметаллами Горение магния в кислороде t 2Mg + О2 = 2MgО Задание 1. Заполнение таблицы на протяжении урока Химические свойства металлов С чем именно Особенности взаимодействия реагирует Кислород О2 Уравнение химической реакции 1.Взаимодействие металлов с неметаллами Практически все металлы взаимодействуют с 2Mg0 + O20 кислородом, образуя оксиды. 2Mg+2O-2 Николай Николаевич Бекетов (1827 – 1911) Электрохимический ряд активности металлов Активность металлов уменьшается Li Rb K Ba Sr Ca Na Mg Al Mn вытесняют водород Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt не вытесняют водород Au 2. Взаимодействие металла с водой Электрохимический ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn H2 Sb Cu Hg Ag Pt не вытесняют водород активные металлы 0 Pb +1 +1 0 2Na + 2H2O → 2NaOH + H2↑ Восстановитель Окислитель Au Демонстрационный опыт Определение среды раствора NaOH с помощью индикатора фенолфталеина. 3. Взаимодействие металлов с разбавленными кислотами Электрохимический ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 кроме HNO3 + Ме0 до водорода → Cu Hg Ag Pt Au водород из кислот не вытесняют вытесняют водород из кислот кислота Sb соль растворима в воде + H2 ↑ Лабораторный опыт «Взаимодействие цинка с соляной кислотой» Электрохимический ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Ход работы: поместите в пробирку 2-3 гранулы цинка и прилейте к нему раствор разбавленной соляной кислоты Уравнение химической реакции: Au 4. Взаимодействие металлов с растворами солей Электрохимический ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au взаимодействуют с растворами солей 0 +1 +2 0 Cu + 2AgNO3 = Cu(NO3)2 + 2Ag Взаимодействие меди с нитратом серебра Нитрат серебра (AgNO3) Серебро (Ag) Медь (Cu) 5. Взаимодействие металлов с оксидами Электрохимический ряд активности металлов Li Rb K Ba Sr 0 Ca Na Mg Al Mn Zn +3 Cr Fe Co Ni Sn +3 Pb H2 Sb Cu Hg Ag Pt 0 2Al + Fe2O3 = Al2O3 +2Fe + Q Оксид железа (III) Оксид алюминия Алюминотермия – это процесс восстановления металлов из их оксидов с помощью металлического алюминия при высоких температурах. Au 5. Взаимодействие металлов с оксидами Вспышка термитной смеси Неметаллы Вода Металлы Кислоты Соли Оксиды Электрохимический ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au Проверка таблицы Химические свойства металлов С чем именно реагирует Кислород О2 Вода H2O Соляная кислота HCI Особенности Уравнение химической взаимодействия реакции 1.Взаимодействие металлов с неметаллами Практически все металлы взаимодействуют с 2Mg0 + O20 2Mg+2O-2 кислородом, образуя оксиды. 2.Взаимодействие металла с водой Активный металл легко 2Na0 + 2H+12O 2Na+1OH + реагируют с водой с H0 2 выделением водорода и образованием щелочи. 3.Взаимодействие металлов с кислотами Металлы, стоящие в ряду Zn0 + 2H+1CI = Zn+2CI2 + H20 напряжения до водорода, будут вытеснять его из растворов разбавленных кислот. выделением водорода и образованием щелочи. Проверка таблицы 3.Взаимодействие металлов с кислотами Соляная Металлы, стоящие в ряду Zn0 + 2H+1CI = Zn+2CI2 + H20 кислота HCI напряжения водорода, Химическиедо свойства металлов будут вытеснять его из С чем именно растворов Особенности Уравнение химической разбавленных реагирует реакции кислот.взаимодействия 4. Взаимодействиеметаллов металла сс неметаллами растворами солей 1.Взаимодействие Нитрат серебра Более активный металл Cu0 + 2Ag+1NO3 = Cu+2(NO3)2 + Кислород О2 Практически все металлы 0 0 AgNO3 взаимодействуют с 2Mg0 + O2Ag 2Mg+2O-2 способен вытеснить менее кислородом, образуя оксиды. активный из раствора солей. 2.Взаимодействие металла с водой 5. Взаимодействие металла с оксидами Вода H2O Активный металл легко 2Na0 + 2H+12O 2Na+1OH + Оксид железа Более активный металл 0 реагируют с водой с 0 +3 H 2 (III) Fe2O3 способен вытеснить менее 2Al + Fe2 O3 Al2+3O3 + 2Fe0 выделением водорода и активный металл из его +Q образованием щелочи. оксида, в условиях 3.Взаимодействие металлов с кислотами нагревания твердых 0 +1 +2 0 Соляная Металлы, стоящие в ряду Zn + 2H CI = Zn CI + H 2 2 реагентов кислота HCI напряжения до водорода, будут вытеснять его из растворов разбавленных Задание 2. Дописать уравнения возможных химических реакций. Определить какое именно химическое свойство металла проявляется в ходе реакции. 1) Na + CI2 → 2) Fe + CuSO4 → 3) Ca + H2O → 4) Mg + HCI → 5) CaCO3 + Cr →