Практикум по физической химии
реклама

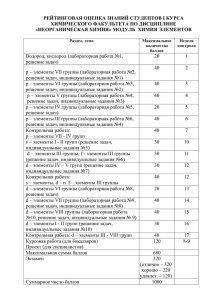
«Практикум по физической химии» Лабораторная работа № 1 «Определение удельной интегральной теплоты растворения соли» 1. Цель работы и описание колориметра. 2. Что такое интегральная теплота. 3. Какие три временных интервала необходимо определить графически. 4. Какие виды теплоемкостей Вы знаете. 5. Дайте определение удельной интегральной теплоты растворения. Лабораторная работа № 2 «Определение теплоты нейтрализации» 1. Цель работы и описание колориметра. 2. Что такое теплота нейтрализации. 3. Каковы концентрации реагентов? 4. Приведите полный расчет теплоты нейтрализации для данной реакции с учетом теплот растворения реагентов. 5. В чем заключается смысл метода смешения? 6. Дайте определения теплотам образования, нейтрализации, растворения? 7. Почему ΔΗ нейтрализации зависит от природы реагирующих веществ? Лабораторная работа № 3 «Определение теплоты реакции окисления при использовании эквивалентных количеств реагентов» 1. Цель работы и описание колориметра. 2. Что такое теплота окисления и единицы измерения в СИ? 3. Какие реагенты, и в каких концентрациях используют в данной работе? 4.Зависят ли энтальпии растворенных веществ от концентрации? Ответ поясните. 5. В каком случае образующийся углекислый газ (в реакции окисления щавелевой кислоты) будет находиться в газообразном состоянии? Лабораторная работа № 4 «Определение теплоты реакции окисления при использовании избыточного количества одного из реагентов» 1. Цель работы и описание колориметра. 2. Как определить константу прибора? 3. Напишите основную реакцию работы. 4. Какой из реагентов надо взять в избытке для определения теплоты окисления? 5. Зависят ли энтальпии растворенных веществ от концентрации? Ответ поясните. 6. Переведите единицы измерения теплового эффекта (кал/моль) в систему измерения Дж/моль? 7. Какие теплоты химических реакций могут быть определены непосредственно в калориметре? Лабораторная работа № 5 «Изучение равновесия жидкость–пар в двойных жидких системах» 1. Цель работы и описание установки. 2. Порядок работы на установке. 3. Как определяют состав пара? 4. Что называется фазой, компонентом, степенью свободы? 5. Какой раствор называется идеальным, перечислите основные признаки? 6.Чем обуславливаются положительные и отрицательные отклонения от закона Рауля? Приведите примеры. 7. Какой закон Вревского определяет зависимость изменения состава равновесного пара над жидкостью одинакового состава от изменения температуры? 8. Сколько степеней свободы у системы, если точка заданного состава находится вне кривых, на кривой и в точке максимума? Лабораторная работа № 6 «Определение коэффициента распределения иода между органическими и неорганическими растворителями» 1. Цель работы и описание лабораторного оборудования. 2. Чем титруют органический и неорганический слои смеси? 3. Для чего при титровании добавляют воду? 4. Зачем при титровании прибавляется вода? Имеет ли значение количество прибавленной воды? 5. Как необходимо вести процесс экстрагирования, чтобы достигнуть полноты извлечения экстрагируемого вещества определенным объемом растворителя? Лабораторная работа № 7 «Изучение химического равновесия в растворах при помощи метода распределения» 1. Цель работы и описание лабораторного оборудования. 2. Чем титруют органический слой пробы? 3. Каковы временные интервалы отбора проб? 4. Какому из законов, относящихся к газам, закон распределения аналогичен? 5. Чем объясняется отклонение от закона распределения? Лабораторная работа № 8 «Изучение равновесия гомогенной реакции в растворах титриметрическим методом» 1. Цель работы и способы приготовления основных растворов. 2. Каковы временные интервалы отбора проб. 3. Что такое метод титриметрии. 4. Каковы термодинамические и молекулярно- кинетические признаки равновесного состояния? 5. От чего зависит Кр и Кс реакций? 6. Каковы термодинамические и молекулярно- кинетические признаки равновесного состояния? 7. От чего зависит Кр и Кс реакций? Лабораторная работа № 9 «Определение коэффициента распределения вещества между двумя различными растворителями» 1. Цель работы и описание лабораторного оборудования. 2. Каковы исходные концентрации уксусной кислоты? 3. Чем титруют водный слой смеси? 4. В чем физический смысл закона распределения? 5. Каковы оптимальные условия экстрагирования и как влияет добавка различных веществ на этот процесс? Лабораторная работа № 10 «Изучение взаимной растворимости жидкостей методом построения фазовой диаграммы системы фенол-вода» 1. Цель работы и основные процентные концентрации смеси. 2. Какие температурные интервалы необходимо исследовать? 3.Что такое температура гомогенизации и как она определяется? 4. Какие возможны типы бинарных жидких растворов с ограниченной растворимостью? 5. В чем состоит правило прямой линии Алексеева и его практическое значение? 6. Что такое нижняя и верхняя критические температуры? Лабораторная работа № 11 «Определение молекулярной массы методом эбуллиоскопии» 1. Цель работы и описание эбуллиоскопа. 2. Как определить цену деления термометра Бекмана? 3. Каковы временные интервалы отбора проб? 4. Как определить константу прибора. 5. От чего зависит изотонический коэффициент Вант-Гоффа? 6. Как зависит давление насыщенного пара раствора от концентрации нелетучего растворенного вещества при данной температуре? 7. Какие существуют методы определения молекулярных масс неэлектролитов? 8. Каково должно быть давление пара жидкости при ее кипении? 95. Зависит ли эбуллиоскопическая постоянная от природы растворенного вещества? Лабораторная работа № 12 «Изучение взаимной растворимости в трехкомпонентной системе» 1. Цель работы и основная лабораторная посуда. 2. Как определить содержание исходных компонентов? 3. Основные принципы построения треугольника Гиббса. 4. Как изображается состав трехкомпонентной системы по методу Гиббса и по методу Розебома? 5. Что такое конноды? 6. Приведите теоретическое обоснование процесса экстрагирования. Лабораторная работа № 13 «Изучение скорости реакции иодирования ацетона» 1. Цель работы и основная лабораторная посуда. 2. Перечислите основные концентрации исходных веществ. 3. Как рассчитать концентрацию выделившегося ацетона? 4. Зависит ли скорость реакции йодирования ацетона от концентрации йода? 5. Почему реакцию йодирования ацетона можно назвать автокаталитической? 6. Каким еще физико-химическим методом можно было бы контролировать скорость реакции йодирования ацетона? 7. Как зависят константы скорости реакций разных порядков от единиц, в которых выражены концентрации? Лабораторная работа № 14 «Изучение скорости разложения пероксида водорода газометрическим методом» 1. Цель работы и подробное описание установки. 2. Как проверить установку на герметичность? 3. В какой момент эксперимента надо включить секундомер и почему? 4. Перечислите координаты графиков, необходимых для расчетов кинетических параметров. 5.Каким методом можно контролировать скорость реакции разложения пероксида водорода? 6. Изменится ли константа скорости при замене одного катализатора на другой? Лабораторная работа № 15 «Изучение скорости гидратации уксусного ангидрида методом электропроводности» 1. Цель работы и описание принципа работы электрохимической ячейки. 2. Как определяют константу электрохимической ячейки? 3. Что называется электропроводностью, перечислите единицы измерения электропроводности? 4. Перечислите известные Вам виды электропроводностей, с указанием единиц измерения. 5. Выведите уравнение константы скорости первого порядка (через сопротивление). Лабораторная работа № 16 «Изучение кинетики реакции гидратации уксусного ангидрида колориметрическим методом» 1. Цель работы и описание прибора ФЭК (фотоэлектроколориметра). 2. Какие концентрации растворов надо приготовить? 3. В каких координатах строят калибровочный график? 4. Для чего необходимо построить калибровочный график? 5. Перечислите методы определения порядка реакций. Приведите примеры. 6. Почему для изучения скорости взаимодействия уксусного ангидрида с водой не применяют титриметрические методы? Лабораторная работа № 17 «Изучение кинетики окисления тиомочевины красной кровяной солью в щелочном растворе колориметрическим методом» 1. Цель работы и описание основного лабораторного оборудования. 2. Напишите основную химическую реакцию процесса. 3. Какие концентрации необходимо приготовить для опыта? 4. Укажите формулу для нахождения константы скорости, порядка реакции. 5. В каких случаях используют метод стационарных концентраций? 6. Почему в данной работе можно колориметрировать только растворы малых концентраций? 7. Какой порядок имеет окисление тиомочевины щелочным раствором гексацианоферрата (III) по тиомочевине, гексацианоферрату (III) и гидроксильным ионам? Ответ поясните. Лабораторная работа № 18 «Изучение реакции второго порядка методом электропроводности» 1. Цель работы и описание принципа работы электрохимической ячейки. 2. Как определить константу электрохимической ячейки? 3. Напишите основную реакцию опыта. 4. Укажите вывод уравнения константы скорости реакции второго порядка. 5. Укажите размерность константы скорости реакции второго порядка. 6. Приведите примеры реакций второго порядка. Лабораторная работа № 19 «Измерение электропроводности раствора сильного электролита и определение коэффициента электропроводности» 1. Цель работы и описание принципа работы электрохимической ячейки. 2. Каковы концентрации сильного электролита, необходимые для эксперимента? 3. В каких координатах необходимо построить график? 4. Для чего вводится величина константы прибора φ? Какой смысл имеет эта величина? 5. Как изменяется эквивалентная электропроводность сильных электролитов с увеличением разбавления? Лабораторная работа № 20 «Определение растворимости труднорастворимых соединений методом электропроводности» 1. Цель работы и описание принципа работы электрохимической ячейки. 2. Почему необходимо фильтровать только через осадок? 3. Что называется удельной электропроводностью? 4. Почему при определении электропроводности необходимо использовать дистиллированную воду? 5. Приведите основные термодинамические характеристики реакции, укажите формулы и размерность величин. 6. Для чего необходимо фильтрование через осадок, нанесенный на фильтр? Лабораторная работа № 21 «Измерение ЭДС элемента Якоби-Даниэля» 1. Цель работы и описание элемента Якоби-Даниэля. 2. Каковы концентрации раствора меди? 3. Запишите уравнение Нернста для элемента Якоби-Даниэля. 4. Приведите схему элемента Якоби-Даниэля. 5. Как заряжен цинковый электрод по отношению к медному электроду? Лабораторная работа № 22 «Определение ионного произведения воды Kw методом ЭДС» 1. Цель работы и описание элемента Якоби-Даниэля. 2. Каковы концентрации раствора меди? 3. Запишите уравнение Нернста для элемента Якоби-Даниэля. 4. Приведите схему элемента Якоби-Даниэля. 5. Как заряжен цинковый электрод по отношению к медному электроду? Лабораторная работа № 23 «Определение произведения растворимости труднорастворимой соли методом ЭДС» 1. Цель работы и описание рН-метра. 2. Как провести калибровку рН-метра по буферным растворам? 3. Что такое стеклянный электрод? 4. Опишите строение стеклянного электрода. 5. Какими преимуществами обладает стеклянный электрод? 6. Скачок потенциала на внутренней поверхности стеклянной мембраны имеет постоянную величину? Лабораторная работа № 24 «Измерение электропроводности раствора слабого электролита и расчет константы диссоциации» 1. Цель работы и описание принципа работы электрохимической ячейки. 2. Какой концентрации необходимо приготовить серию растворов слабого электролита? 3. Что называется степенью диссоциации? 4. Как изменяется эквивалентная электропроводность слабых электролитов с увеличением разбавления? 5. Можно ли при определении электропроводности использовать постоянный ток? Ответ поясните. Лабораторная работа № 25 «Определение коэффициента активности сильного электролита методом ЭДС» 1. Цель работы и описание рН-метра. 2. Как рассчитать коэффициент активности сильного электролита? 3. Какова серия концентраций соляной кислоты\7 4. Приведите классификацию электродов. 5. В каких случаях активность и молярная концентрация равны? 6. Можно ли к сильным электролитам применять закон разведения Оствальда? 3) Промежуточная аттестация Вопросы для подготовки к зачету (5 семестр) 1. Какие виды систем существуют. 2. Как изменяется свободная энергия системы при понижении температуры. 3. Чем определяется равновесное состояние системы. 4. Чем отличается лабильное состояние от метастабильного. 5. Почему поведение термодинамических коэффициентов вблизи абсолютного нуля важно для неорганической химии. 6. Что такое число степеней свободы термодинамической системы. 7. Что такое эвтектическая кристаллизация. 8. В чем различие фазовых переходов первого и второго рода. 9. Опишите последовательность выделения кристаллической фазы в случае, когда состав жидкости не соответствует составу эвтектики. 10. Для какой цели нужно знать диаграмму состояния системы. 11. Сформулируйте правило фаз Гиббса. Какие фазовые переходы могут быть в однокомпонентной системе. Вопросы для подготовки к зачету 1. Перечислите основные методы определения порядка реакции. 2. Чем отличается молекулярность от порядка реакции. 3. Формулы для нахождения константы скорости нулевого, первого, второго порядка реакции. 4. Что такое ферментативный катализ? Опишите основные уравнения, кинетические кривые, применение. 5. Способы определения энергии активации. 6. Перечислите основные виды гальванических элементов.Составьте уравнения Нернста для свинцового, хлор- серебряного и кадмиеваого электродов. 7. Что такое электрод сравнения. 8. Какие виды электропроводности существуют? Укажите единицы измерения. 9. Опишите основные теории Аррениуса и Дебая- Хюккеля. 10. Напишите основные приближения Дебая-Хюккеля. 11. Перечислите основные способы защиты от коррозии металла. 12. Укажите основные причины возникновения коррозии. 12.