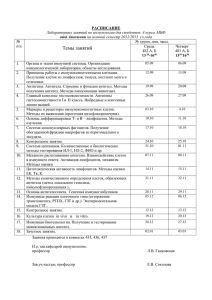
Задания и таблицы по вирусологии Задание 1. "Тканевые культуры, используемые в вирусологии" Название Пример Достоинства Близость к условиям Первичные Клетки почки in vivo, высокая культуры клеток обезьяны чувствительность ко многим вирусам Постоянные (линии) клеток Клетки HeLa (человек), клетки Vero (почка африканской зеленой обезьяны) Клеточные культуры насекомых Клетки Sf9 из яичников насекомого Spodoptera frugiperda Высокая скорость роста, низкая стоимость поддержания Клетки эмбриона курицы Высокая чувствительность к многим вирусам, возможность изучения вирусной патогенности Эмбриональные культуры клеток Неограниченный срок жизни, возможность стандартизации экспериментов Недостатки Назначение Ограниченный срок жизни, сложность получения и поддержания Изучение цикла размножения вирусов, выделение и идентификация вирусов Модификации клеток из-за трансформации, потенциальное отсутствие некоторых рецепторов Массовое производство вирусов, тестирование антивирусных препаратов, фундаментальные исследования Производство Специфичность рекомбинантных некоторых вирусов белков, изучение к клеткам вирусов, насекомых инфицирующих насекомых Этические и практические сложности в получении, изменчивость между партиями Выделение и типирование вирусов, исследование вирусной патогенности 2. Питательные среды, солевые и диспергирующие растворы, используемые при культивировании клеточных культур. Название Пример Состав Требования Назначение (использование) Солевые растворы Физиологический раствор Раствор Ханка Ионы Na+, K+, Ca2+, Mg2+, Cl−, HCO3−, SO42−, глюкоза Буфер PBS (фосфатносолевой буфер) Буфер PBS Натрия фосфат, калия фосфат, натрия хлорид, калия хлорид Стерильность, изотоничность Поддержание осмотического баланса клеток, промывка клеток Стерильность, Промывка клеток буферная емкость перед процедурами, такими как фиксация или окрашивание Питательные среды Минимальные среды DMEM (Dulbecco's Аминокислоты, витамины, Сбалансированность Культивирование Modified Eagle минералы, глюкоза питательных широкого Medium) веществ, спектра стерильность клеточных линий Обогащенные среды RPMI-1640 Аминокислоты, витамины, Сбалансированность Культивирование минералы, глюкоза, питательных требовательных к дополнительные ростовые веществ, питанию клеточных факторы стерильность линий Диспергирующие растворы Энзиматические Трипсин-EDTA Трипсин и ЭДТА Стерильность, Диссоциация растворы (этилендиаминтетраацетат) определенная клеточных агрегатов, активность подготовка клеток к посеву Неэнзиматические Версен (EDTA) ЭДТА Стерильность, Мягкая диссоциация растворы (этилендиаминтетраацетат) концентрация ЭДТА клеточных агрегатов без использования трипсина ЗАДАНИЕ 2. Сводная таблица по культивированию вирусов Способы Название Достоинства Недостатки индикации вируса Лабораторные животные Куриные эмбрионы Клеточные культуры Изучение патогенеза Оценка иммунного ответа Низкая стоимость Высокая чувствительность к некоторым вирусам Визуализация изменений Стандартизация Высокая чувствительность и специфичность Наблюдение в реальном времени Этические ограничения Высокая стоимость Риск биобезопасности Способы идентификации вируса Клинические признаки Серологические Уровень антител тесты Маркерные технологии Изоляция вируса Патологические Ограниченный спектр Серологические изменения вирусов методы Гемагглютинационный Технические сложности Секвенирование тест Специализированное ПЦР оборудование Цитопатический эффект Секвенирование Риск контаминации Иммунофлуоресценция Иммунохимические Ограниченный срок методы жизни клеточных линий Задание 3.1 1. Название единицы Обозначение Определение БОЕ Количество вируса, необходимое для вызова цитопатического эффекта в 50% клеточных культур ООЕ Количество вируса, способное вызвать образование опухоли в 50% испытуемых животных ГАЕ Количество вируса, необходимое для агглютинации определенного объема эритроцитов Биологическая озаряющая единица Опухолевая озаряющая единица Гемагглютинирующая единица Биологический объект (материал) для определения Действие вируса Клеточные культуры Вызывает цитопатический эффект Лабораторные животные Вызывает образование опухоли Раствор эритроцитов Вызывает агглютинацию эритроцитов 2. Название единицы Инфекционная доза, вызывающая инфекцию у 50% популяции Летальная доза, вызывающая смерть у 50% популяции Эмбриональная инфекционная доза, вызывающая смерть или поражение 50% эмбрионов Эмбриональная летальная доза, вызывающая смерть 50% эмбрионов Тканевая культурная инфекционная доза, вызывающая цитопатический эффект в 50% культур Обозначение Тест-объект Действие вируса ИД50 Животные, клеточные культуры Определение количества вирусных частиц, необходимых для инфицирования 50% испытуемой популяции Животные Определение количества токсина или вируса, необходимого для вызова смерти у 50% испытуемой популяции ЛД50 ЭИД50 Определение количества вируса, необходимого для инфицирования или вызова поражения у 50% эмбрионов Эмбрионы птиц птиц ЭЛД50 Определение минимального количества токсина или вируса, необходимого для вызова смерти у 50% инфицированных Эмбрионы птиц эмбрионов птиц ТЦД50 Клеточные культуры Определение количества вируса, необходимого для вызова цитопатического эффекта в 50% культур клеток Задание 3.2 Для расчета титра вируса по методу Рида-Меча (Reed-Muench) в ИД50, необходимо выполнить следующие шаги: 1. Определить разведение, при котором инфекция происходит в 50% случаев. Это сделать не всегда возможно непосредственно, поэтому используют интерполяцию между двумя разведениями, где процент заболеваемости пересекает 50%. 2. Рассчитать процент заболеваемости для каждого разведения. 3. Использовать формулу Рида-Меча для расчета ИД50: ИД50=D+(P−Nd) Где: D — разведение, непосредственно перед тем, где заболеваемость превышает 50%, d — интервал между разведениями (в нашем случае логарифмический интервал, обычно 10), P — процент заболевших в более концентрированном разведении, N — процент заболевших в менее концентрированном разведении. Давайте сначала рассчитаем процент заболеваемости для каждого разведения, усреднив результаты четырех вариантов эксперимента. Процент заболеваемости по разведениям следующий: 10-1: 100% 10-2: 100% 10-3: 100% 10-4: 95.83% 10-5: 75% 10-6: 58.33% 10-7: 29.17% 10-8: 8.33% 10-9: 0% 10-10: 0% 1. Применение формулы Рида-Меча: Формула Рида-Меча для расчета ИД50: ИД50=D+(d⋅(50−N)/P−N) Где D — логарифм разведения непосредственно перед пересечением 50% (в нашем случае -5, соответствует 10^-5), d — интервал между разведениями (1, поскольку это логарифмическая шкала), P — процент заболевших в более концентрированном разведении (75% для 10^-5), N — процент заболевших в менее концентрированном разведении (58.33% для 10^-6). 2. Расчет: Подставляем значения в формулу для вычисления точного значения ИД50. Переходим к расчету: Подробный расчет ИД50 вируса по методу Рида- Меча дает значение приблизительно 10−5.5. Это означает, что разведение вируса, при котором ожидается инфекция 50% тестируемой популяции мышей, приближено к 10−5.5, находясь между 10−5 и 10−6, но ближе к последнему. В расчете были использованы следующие шаги: Использованы разведения 10-5 и 10-6, между которыми процент заболеваемости пересекает 50%. Применена формула Рида- Меча, где D равно -5 (логарифм разведения перед пересечением 50%), d равно 1 (интервал между разведениями на логарифмической шкале), P равно 75% (процент заболевших для разведения 10^-5), и N равно 58.33% (процент заболевших для разведения 10-6). Полученное значение ИД50, 10−5.5, указывает на концентрацию вируса, при которой ожидается инфицирование 50% популяции испытуемых животных. Формула Кербера Формула Кербера используется для определения летальной дозы (LD50), но ее также можно адаптировать для определения инфекционной дозы (ID50). Формула выглядит следующим образом: LD50=D+( d×(S−0.5)/ X1−X2) где: D — десятичный логарифм минимального разведения, вызывающего смертность, d — интервал между разведениями (в нашем случае это 1, так как разведения идут через десятичный логарифм, т.е., 10, 100, 1000 и т.д.), S — сумма процентов смертности, начиная с наименьшего разведения, не вызывающего смертность, до разведения, где наблюдается полная смертность, X1 — процент смертности при разведении D, X2 — процент смертности при предыдущем разведении. Подготовка данных В нашем случае, данные проценты заболеваемости (инфекции) для каждого разведения уже были рассчитаны. Мы имеем проценты инфекции от разведения 10−1 до 10−10, начиная с 100% инфекции до 0%. Расчеты 1. Найдем разведение D, непосредственно перед тем, где заболеваемость падает ниже 100%. 2. Определим S как сумму процентов заболеваемости от этого разведения до последнего, где наблюдается инфекция. 3. Рассчитаем 1X1 и 2X2. Используя эти данные, мы можем рассчитать ID50 по формуле Кербера. Произведем эти шаги. Подробный расчет по формуле Кербера приводит нас к следующим шагам и результатам: 1. Определение D: Мы начинаем с разведения, где наблюдается изменение в проценте заболеваемости, от 100% к меньшему значению. В нашем случае, это разведение 10−1010−10, где =10D=10, потому что мы идем от более высокого к меньшему разведению. 2. Определение S: Сумма процентов заболеваемости с 10−110−1 до 10−1010−10, исключая крайние точки, где инфекция начинает и прекращается быть 100%, составляет 4.625. 3. Определение 1X1 и 2X2: 1X1 — процент заболеваемости на разведении D (0%), 2X2 — процент заболеваемости на следующем разведении после D (где мы предполагаем 100%, так как это за пределами наших измерений). 4. Интервал d: Так как интервал между разведениями постоянен и равен 1 на логарифмической шкале, d=1. Таким образом, подставляя эти значения в формулу Кербера: LD50=10+(1× (4.625−0.5)0−1) =5.875LD50=10+(0−11× (4.625−0.5)) =5.875 Такое значение предполагает, что истинная летальная (или инфекционная) доза, при которой ожидается, что 50% популяции будет заражена, лежит между разведениями 10−610−6 и 10−710−7, но ближе к первому, что согласуется с предыдущими наблюдениями. Сравнение методов Метод Кербера дал оценку ИД50 на уровне разведения 10−610−6, что указывает на близкое разведение, при котором ожидается заражение 50% популяции. Формула Рида- Меча дает более обобщенное представление и предполагает, что ИД50 лежит в пределах аналогичного диапазона, 10−5.5, показывая, как различные методы могут давать сходные оценки, но с разной степенью точности и представления данных. Основные шаги методики РТГА: Подготовка реагентов и образцов: Необходимо подготовить разведения сывороток птиц в физиологическом растворе. Стартовое разведение часто начинают с 1:10, последующие разведения делают вдвое до необходимой концентрации. Подготовка вирусной суспензии: Готовят стандартизированную вирусную суспензию ньюкаслской болезни, активность которой известна. Смешивание сыворотки и антигена: В каждую лунку планшета добавляют разведенную сыворотку и стандартизированный антиген (вирусную суспензию). В контрольные лунки добавляют антиген без сыворотки и сыворотку без антигена для контроля. Инкубация: Планшет инкубируют при комнатной температуре или в термостате при 37°C в течение 30 минут - 1 часа, что позволяет антителам связываться с антигенами. Добавление эритроцитов: После инкубации в каждую лунку добавляют суспензию эритроцитов (например, кур или индюков), которые агглютинируются в присутствии вируса ньюкаслской болезни. Оценка результатов: Через определенное время оценивают результаты на наличие или отсутствие гемагглютинации. Отсутствие агглютинации свидетельствует о наличии антител в сыворотке, которые нейтрализуют вирус и предотвращают агглютинацию эритроцитов. Результат выражают в виде титра антител, который соответствует максимальному разведению сыворотки, при котором еще наблюдается торможение гемагглютинации. Этот метод позволяет не только подтвердить наличие специфических антител в крови птиц, но и количественно оценить их уровень, что имеет важное значение для оценки иммунного статуса популяции птиц и эффективности вакцинации против ньюкаслской болезни. Аргументация: Основа для оценки титра антител: Титр антител представляет собой наивысшее разведение сыворотки, при котором еще обнаруживается реакция агглютинации. Это показывает наличие специфических антител против вируса в крови птицы, способных связываться с вирусными антигенами и предотвратить их взаимодействие с эритроцитами. Высокий титр антител как индикатор защиты: Более высокие титры антител обычно свидетельствуют о лучшем уровне защиты против вирусных инфекций. Это означает, что иммунная система птиц способна эффективно распознавать и нейтрализовать вирус ньюкаслской болезни. Анализ представленных данных: Во всех образцах сыворотки был достигнут максимальный титр антител 1:4056. Это указывает на то, что у всех птиц в выборке был высокий уровень специфических антител против ньюкаслской болезни, что свидетельствует о сильной иммунной защите. Оценка среднего титра антител: Поскольку титр 1:4056 был обнаружен в каждом образце, средний титр антител в группе также составляет 1:4056. Это значение выше, чем обычно требуется для считающейся защитной реакции, что говорит о высокой степени иммунитета. Значение для оценки иммунитета: Высокие титры антител в группе птиц могут быть результатом успешной вакцинации или предыдущего контакта с вирусом, что привело к развитию сильного адаптивного иммунного ответа. Вывод: На основании анализа данных таблицы агглютинации можно сделать вывод, что птицы обладают высоким уровнем специфических антител против ньюкаслской болезни, что указывает на сильный иммунитет и хорошую степень защиты от инфекции. Средний титр антител 1:4056 говорит о высокой напряженности иммунитета в группе, что является положительным результатом для оценки эффективности иммунной защиты птиц. ЗАДАНИЕ 4.1. 1. Что такое люминесценция? Люминесценция — это испускание света материалом, не связанное с его нагреванием. В контексте биологии и медицины это явление часто используется для визуализации или детекции биологических молекул. Люминесценция может быть результатом химических реакций, биологических процессов или физических воздействий и включает в себя такие явления, как флуоресценция, фосфоресценция и биолюминесценция. 2. Принцип работы люминесцентного микроскопа? Люминесцентный микроскоп использует свойство флуоресценции некоторых веществ поглощать свет одной длины волны и излучать свет другой, более длинной длины волны. В микроскопе используются источники света (часто ультрафиолетовые), чтобы возбудить флуоресцентные молекулы в образце. Излучаемый образцом свет собирается объективом микроскопа и через специальный фильтр попадает в окуляр или на детектор, позволяя наблюдать ярко окрашенные структуры на темном фоне. 3. В чем принцип РИФ? Реакция иммунофлуоресценции (РИФ) основана на использовании антител, меченных флуоресцентными красителями, для обнаружения специфических антигенов в образце. При связывании меченных антител с целевым антигеном и возбуждении подходящим светом места связывания становятся видимыми под люминесцентным микроскопом благодаря флуоресценции красителя. 4. Какие существуют варианты РИФ? Существуют два основных варианта РИФ: прямая и непрямая. В прямой РИФ меченые антитела напрямую связываются с целевым антигеном в образце. В непрямой РИФ используются два набора антител: не меченые первичные антитела, специфические к целевому антигену, и меченые вторичные антитела, которые связываются с первичными. Непрямая РИФ позволяет усилить сигнал и повысить чувствительность метода. 5. Как проводят учет реакции? Учет реакции в РИФ обычно проводится под люминесцентным микроскопом путем визуализации и оценки интенсивности флуоресценции. Результаты могут качественно оценивать наличие или отсутствие специфического антигена в образце или количественно, измеряя интенсивность флуоресценции для оценки концентрации антигена. ЗАДАНИЕ 4.2. болезней Иммунологическая диагностика вирусных Наименование реакции Реакция иммунофлуоресценции (РИФ) Аббревиатура РИФ Достоинства Недостатки Компоненты Учет реакции - Высокая специфичность и чувствительность Возможность визуализации антигенов в тканях и клеткахБыстрота получения результатов Необходимость специализированного оборудования (люминесцентный микроскоп) Требует определенного уровня квалификации оператора - Флуоресцентно меченые антителаОбразец (клетки, ткани, биологические жидкости)Буферные растворы для инкубации и промывки Визуализация под люминесцентным микроскопом ЗАДАНИЕ 5.1. Иммуноферментный анализ (ИФА), также известный как ELISA, используется для обнаружения антигенов или антител вирусов, вызывающих болезни животных. ELISA может обнаруживать вирусы, связывая их с специфическими антителами, присоединенными к твердой фазе, а затем с помощью лейбл-антител, создающих цветную реакцию. Этот метод сравним по чувствительности с радиоиммунным анализом и часто доступен в виде коммерческих наборов для быстрого использования в ветеринарных клиниках. Он применяется для диагностики таких заболеваний, как ротавирусы у различных видов животных, паровирус у собак, вирус лейкоза у кошек и других 2.1. Принцип ИФА Иммуноферментный анализ (ИФА) основан на использовании антител, связанных с ферментами, для детекции специфических антигенов или антител в биологических образцах. В результате взаимодействия между антигеном и антителом, меченным ферментом, происходит катализ реакции, которая приводит к появлению цветного, флуоресцентного или люминесцентного продукта, количественно измеряемого с помощью спектрофотометра или флуориметра. 2.2. Методика постановки "сэндвич"-метода ИФА В "сэндвич"-методе ИФА используются два типа антител к одному и тому же антигену: первое антитело фиксируется на твердой фазе (например, на дне лунки планшета), а второе мечено ферментом. После добавления образца содержащего антиген, он связывается с фиксированными антителами. Затем добавляется меченое антитело, формируя "сэндвич": антитело-антиген-меченое антитело. После промывки, чтобы удалить несвязанные компоненты, добавляется субстрат фермента, и происходит реакция, результат которой измеряется колориметрически. 2.3. Методика постановки непрямого метода ИФА В непрямом методе ИФА на твердую фазу наносят антиген. После промывки и блокировки неспецифических связываний к антигену добавляют сыворотку, содержащую специфические антитела. Затем применяют вторичные антитела, меченные ферментом и специфические к первичным. После промывки добавляют субстрат, и интенсивность окрашивания, возникающего в результате катализируемой реакции, служит мерой содержания исследуемых антител. 2.4. Какой вариант используют для титрования антител в сыворотке крови? Ис вв Ди вир ин иде вир ант обр исс ме ин Для титрования антител в сыворотке крови обычно используют непрямой метод ИФА, так как он позволяет определить наличие и количество специфических антител против конкретного антигена. 2.5. Какой вариант используют для идентификации вируса? Для идентификации вируса чаще всего используют "сэндвич"-метод ИФА, поскольку он позволяет специфически обнаруживать и квантифицировать антиген в образце. 3. Разработка 10 тестовых вопросов по теме 1. Что детектирует непрямой метод ИФА? A. Антигены B. Антитела C. Ферменты D. Вирусы Ответ: B 2. Какой компонент используется для визуализации в ИФА? A. Антитела B. Ферменты C. Антигены D. Субстраты Ответ: B 3. В чем преимущество "сэндвич"-метода ИФА? A. Высокая чувствительность B. Низкая стоимость C. Простота методики D. Быстрое проведение Ответ: A 4. Какой метод ИФА используется для обнаружения антигенов? A. Непрямой B. Прямой C. "Сэндвич" D. Конкурентный Ответ: C 5. Какой фермент чаще всего используют в ИФА? A. Алкалиновая фосфатаза B. Глюкозооксидаза C. Лактаза D. Каталаза Ответ: A 6. Что является конечным продуктом реакции в ИФА? A. Антитела B. Антигены C. Цветной продукт D. Фермент Ответ: C 7. Для чего необходимо блокирование неспецифических связываний в ИФА? A. Для увеличения чувствительности B. Для уменьшения фонового сигнала C. Для ускорения реакции D. Для экономии реагентов Ответ: B 8. Какой тип образца можно использовать в ИФА? A. Сыворотка крови B. Моча C. Слюна D. Все перечисленные Ответ: D 9. Какой фактор важен при выборе фермента в ИФА? A. Скорость реакции B. Стоимость C. Стабильность D. Все перечисленные Ответ: D 10. Какой метод ИФА предпочтительнее для детекции низких концентраций антигена? Кроссворд A. Непрямой B. Прямой C. "Сэндвич" D. Конкурентный Ответ: C По горизонтали: 2. Титр - Как называется метод определения концентрации антител в образце крови, используемый для диагностики вирусных заболеваний? 3. Серология - Как называется раздел медицины, занимающийся изучением сыворотки крови и иммунных реакций? 4. Иммуноглобулин - Как называются белки иммунной системы, выполняющие функцию антител? 5. Антиген - Как называется вещество, способное вызвать иммунный ответ организма? 6. ИФА - Какой метод используется для диагностики наличия специфических антител или антигенов, основанный на принципе антиген-антитело? 7. Субстрат - Как называется вещество, которое вступает в реакцию с ферментом, приводя к образованию цветного продукта в иммуноферментном анализе? По вертикали: 1. Элюент - Как называется реагент, используемый для удаления неспецифически связанных компонентов в колонке хроматографии? 2. Маркер - Как называется вещество, используемое в лабораторных тестах как индикатор для обнаружения определенных клеток, белков или микроорганизмов? 3. Вирусология - Как называется наука, изучающая вирусы и вирусные инфекции? 4. Антитела - Как называются специфические белки иммунной системы, образующиеся в ответ на вторжение вирусов или бактерий? 5. Диагностика - Как называется процесс определения наличия заболевания на основе анализа симптомов и лабораторных данных? 6. Конъюгат - Как называется комплекс, состоящий из антитела или антигена, связанного с ферментом или другим маркирующим веществом, используемый в ИФА? 7. Сенситивность - Какой термин обозначает способность диагностического метода обнаруживать заболевание даже при низкой концентрации возбудителя? 8. Фермент - Как называется белок, катализирующий химические реакции в живых организмах, используемый в иммуноферментном анализе для обнаружения антител или антигенов? 5 1 11 4 3 2 8 9 10 6 7 12 14 13 По горизонтали: По вертикали: 2. титр 1. элюент 6. серология 3. маркер 7. иммуноглобулин 4. вирусология 8. антиген 5. антитела 10. ифа 9. диагностика 13. субстрат 11. конъюгат 12. сенситивность 14. фермент Наименование реакции Аббревиатур а Достоинства Недостатки Использовани Компонент Учет ев ы реакции вирусологии Реакция РИФ иммунофлуоресценции Высокая специфичность и чувствительность, возможность визуализации микроорганизмов непосредственно в тканях или клетках Требуется специализированн ое оборудование (флуоресцентный микроскоп), наличие квалифицированно го персонала, быстрая деградация флуоресцентных меток Флуоресцен тные красители, антитела, маркирован ные флуоресцен тными красителями , образцы тканей или клеток Визуальн ый под микроско пом; флуоресц енция указывае т на наличие антигена Для обнаружения вирусных антигенов в клетках или тканях, диагностика инфекционных заболеваний Иммуноферментный анализ Высокая чувствительность и специфичность, возможность автоматизации и обработки большого Может быть дорогостоящим при наличии необходимости в специализированн ом оборудовании, кросс- Антитела (маркирован ные ферментами ), субстраты для ферментов, Колорим етрическ ий анализ изменени я цвета, Для диагностики вирусных инфекций через обнаружение антител или ИФА Наименование реакции Аббревиатур а Достоинства количества образцов, долговременное хранение реактивов Недостатки реактивность с другими белками может привести к ложноположитель ным результатам Использовани Компонент Учет ев ы реакции вирусологии стопфотометр антигенов в реагенты, ия образцах стандарты и крови, контроли, сыворотке или образцы плазме, крови или массовый других скрининг биологическ их жидкостей Задание 6.1. 2.1 Принцип Реакции Диффузионной Преципитации (РДП) является классическим методом в иммунологии для детекции и количественной оценки антигенов и антител в биологических образцах. Этот метод основывается на способности антител связываться с соответствующими антигенами с образованием комплексов, которые могут быть визуализированы в виде преципитатов в геле. Фундаментальные принципы РДП 1. Диффузия: Антитела и антигены, размещенные в разных скважинах агарозного или агарового геля, диффундируют в геле в сторону друг друга. Этот процесс диффузии приводит к их встрече в определенной зоне геля. 2. Формирование комплексов: Когда концентрации антител и антигенов достигают определенного соотношения, они связываются друг с другом, образуя комплексы антигенантитело. Эти комплексы являются нерастворимыми и формируют видимые линии осадка, или преципитаты, в геле. 3. Визуализация: Преципитационные линии могут быть визуально обнаружены непосредственно в геле. Положение, интенсивность и количество этих линий предоставляют информацию о наличии и количестве антител или антигенов в образце. Детальная методика Подготовка геля: Агароза или агар растворяется в буфере и заливается в чашку Петри или на стеклянную плитку для формирования однородного геля. После застывания геля в нем формируют скважины для антигенов и антител. Внесение реагентов: В отдельные скважины вносятся растворы антигенов и антител. Расстояние между скважинами должно быть достаточным для эффективной диффузии, но и не слишком великим, чтобы антитела и антигены могли встретиться в геле. Инкубация: Чашки с гелем инкубируют при комнатной температуре или в холодильнике для замедления процессов, что позволяет антителам и антигенам диффундировать и встречаться в геле. Время инкубации может варьироваться от нескольких часов до нескольких дней в зависимости от системы. Оценка результатов: Преципитационные линии между скважинами указывают на взаимодействие антиген-антитело. По характеристикам этих линий (форма, интенсивность, количество) можно судить о количественном и качественном содержании антигенов и антител. 2.2Реакция диффузионной преципитации (РДП) – это серологический метод, используемый для определения антител или антигенов в образцах. Этот метод основан на принципе диффузии антигенов и антител в агарозном или агаровом геле, в результате чего формируются видимые осадки (преципитаты) в местах их взаимодействия. РДП может быть настроен разными способами в зависимости от исследуемых образцов и целей анализа. Вот несколько основных вариантов постановки РДП: 1. Одномерная РДП: Антитела и антигены диффундируют друг к другу в одном измерении. Это может быть реализовано путем нанесения антитела в лунку, а антигена – на некотором расстоянии в том же слое геля. Преципитационные линии формируются в местах их встречи. 2. Двумерная РДП (Оухтерлони): Это наиболее часто используемый метод, при котором антитела и антигены диффундируют из отдельных лунок в агаре на плоскости. В результате на пересечении диффузионных путей формируются преципитационные линии, характеризующие взаимодействие антигена и антитела. 3. Радиальная иммунодиффузия (Манчини): Антитела равномерно распределены в геле, и антиген вносится в лунку в центре. Преципитационные кольца формируются вокруг лунки при диффузии антигена наружу, и размер кольца пропорционален концентрации антигена. 4. Ракетная электроиммунодиффузия: В этом методе используется электрическое поле для ускорения миграции антигенов через гель, содержащий антитела. Формируемые преципитаты имеют форму "ракет", высота которых пропорциональна концентрации антигена. 5. Иммуноэлектрофорез: Комбинация электрофореза и иммунодиффузии, при которой сначала разделяют смесь антигенов методом электрофореза, а затем проводят диффузию антител в геле для формирования специфических преципитационных линий. 2.3 Постановка реакции диффузионной преципитации (РДП) в чашках Петри является классическим методом иммунологического анализа, который позволяет выявлять взаимодействие антиген-антитело в геле. Вот общая методика проведения РДП в чашках Петри, которая часто используется для метода Оухтерлони, одного из наиболее распространённых вариантов РДП: Материалы и реагенты Чашки Петри Агароза или агар для подготовки геля Буферный раствор для подготовки геля (например, фосфатно-солевой буфер) Антитела и антигены для анализа Пипетки и стерильные кончики Лунчатая ложка или специальный инструмент для создания лунок в геле Подготовка 1. Приготовление геля: Растворите агарозу или агар в буферном растворе и прокипятите смесь для полного растворения. Остудите до 50-60°C и залейте в чашки Петри, чтобы сформировать гель толщиной примерно 3-4 мм. Оставьте гель застывать при комнатной температуре. 2. Формирование лунок: После застывания геля создайте в нём лунки с помощью лунчатой ложки или специального инструмента. Расположение лунок зависит от выбранного метода анализа. Для метода Оухтерлони обычно формируют серию лунок в виде круга или другой конфигурации. Проведение анализа 3. Нанесение образцов: В лунки аккуратно вносите антигены и антитела с помощью пипетки. Убедитесь, что не происходит перекрёстного загрязнения между лунками. 4. Инкубация: Закройте чашку Петри и оставьте её в темном месте при комнатной температуре на 24-48 часов. За это время произойдёт диффузия антигенов и антител в геле и их взаимодействие, что приведёт к формированию преципитационных линий. Анализ результатов 5. Оценка результатов: После инкубации оцените наличие и характер преципитационных линий. Линии преципитации указывают на взаимодействие антигена и антитела, а их отсутствие говорит о неспецифичности или недостаточной концентрации одного из компонентов. Замечания Точность результатов зависит от концентрации антигенов и антител, а также от качества геля и условий инкубации. Можно использовать разные буферы для оптимизации условий диффузии и преципитации. Для повышения чувствительности метода можно использовать окрашивание геля специальными красителями, которые делают преципитаты более заметными. Эта методика является универсальной и может быть адаптирована под различные задачи иммунологического анализа. 2.4 Диагностика бешенства включает в себя использование различных методов, среди которых реакция диффузионной преципитации (РДП) может применяться для выявления специфических антител или антигенов вируса бешенства. Однако более распространёнными методами для диагностики бешенства являются прямая иммунофлуоресцентная реакция (ПИФР) и изоляция вируса в культуре клеток, поскольку они обладают высокой чувствительностью и специфичностью. При использовании РДП для диагностики бешенства особенности могут заключаться в следующем: Специфичность и чувствительность Для выявления антител или антигенов вируса бешенства необходимо использование высокоспецифических реагентов, так как вирус имеет близкородственные варианты, которые могут вызвать перекрёстные реакции. РДП может быть менее чувствительным методом по сравнению с ПИФР или молекулярногенетическими методами, такими как ПЦР. Применение РДП может применяться для дополнительной серологической оценки в комплексе с другими методами, например, для подтверждения наличия антител у животных после вакцинации. В исследовательских целях РДП может использоваться для изучения иммунного ответа на вирус бешенства. Методика Для постановки РДП необходимы агарозный или агаровый гель, специфические антитела и антигены вируса бешенства, а также контрольные образцы. Важно обеспечить строгий контроль за условиями проведения реакции, чтобы минимизировать риск ложноположительных или ложноотрицательных результатов. Безопасность Работа с вирусом бешенства и его антигенами требует строгих мер безопасности и проведения экспериментов в соответствии с биобезопасностью и биозащитой, так как вирус бешенства является высокозаразным и смертельным для человека и животных. Альтернативные методы Помимо РДП, для диагностики бешенства активно используются методы, позволяющие быстро и точно идентифицировать вирус, включая ПИФР, изоляцию вируса, ПЦР, и секвенирование РНК вируса. Таким образом, хотя РДП может найти применение в определённых исследовательских ситуациях при диагностике бешенства, на практике предпочтение отдаётся более чувствительным и специфичным методам. 2.5 Диагностика лейкоза крупного рогатого скота (БЛК), заболевания вирусной этиологии, вызванного вирусом лейкоза крупного рогатого скота (БЛВ), включает в себя ряд серологических и молекулярнобиологических методов. Реакция диффузионной преципитации (РДП) может использоваться в качестве одного из методов для серологической диагностики БЛК, но на практике чаще применяются агарозногелевая иммуноэлектрофорез, иммуноферментный анализ (ИФА), ПЦР и другие более чувствительные и специфичные методы. Всё же, при использовании РДП для диагностики БЛК стоит учитывать следующие особенности: Специфичность и чувствительность Необходимо использование высокоспецифичных антисывороток, способных распознавать антигены вируса лейкоза крупного рогатого скота. РДП может быть менее чувствительным по сравнению с ИФА или ПЦР, что делает её менее предпочтительным методом для ранней диагностики. Применение РДП может использоваться для подтверждения результатов, полученных другими методами, или в качестве дополнительного метода в комплексной диагностике. В основном применяется в исследовательских целях для изучения антигенной структуры вируса или иммунного ответа хозяина. Методика Необходимо обеспечить качественное приготовление геля и использование чистых реагентов для минимизации риска перекрёстных реакций и недостоверных результатов. Важно строго следовать протоколу проведения РДП, включая этапы инкубации и оценку результатов. Безопасность При работе с биологическим материалом от животных, инфицированных БЛВ, необходимо соблюдать меры личной защиты и биобезопасности, чтобы избежать риска распространения инфекции. Альтернативные методы ИФА является одним из основных методов для серологической диагностики БЛК, благодаря высокой чувствительности и специфичности. ПЦР используется для определения РНК или ДНК вируса в крови или тканях животных, позволяя выявить инфекцию на ранних стадиях. Иммунофлуоресценция и биохимические методы также могут применяться для детального исследования вируса и его влияния на организм хозяина. В заключение, хотя РДП может найти применение в диагностике лейкоза крупного рогатого скота, существуют более современные и эффективные методы, предпочтительные для использования в клинической практике и исследованиях. 3. Разработка 10 тестовых вопросов по теме 1. Что такое реакция диффузионной преципитации (РДП)? A. Метод диагностики бактериальных инфекций B. Метод выявления антител или антигенов в образцах C. Метод генетического анализа D. Метод химического анализа веществ Правильный ответ: B 2. Какое вещество обычно используется для создания геля в РДП? A. Глицерин B. Агароза или агар C. Полиакриламид D. Этанол Правильный ответ: B 3. Какой метод РДП включает использование электрического поля для ускорения миграции антигенов или антител? A. Радиальная иммунодиффузия B. Одномерная РДП C. Ракетная электроиммунофорез D. Двумерная РДП (Оухтерлони) Правильный ответ: C 4. В какой метод РДП антитела равномерно распределены в геле, и антиген вносится в центральную лунку? A. Одномерная РДП B. Ракетная электроиммунофорез C. Радиальная иммунодиффузия (Манчини) D. Двумерная РДП (Оухтерлони) Правильный ответ: C 5. Какой метод РДП позволяет анализировать взаимодействие антител и антигенов в двумерном пространстве? A. Ракетная электроиммунофорез B. Радиальная иммунодиффузия (Манчини) C. Двумерная РДП (Оухтерлони) D. Одномерная РДП Правильный ответ: C 6. Какой параметр НЕ является критическим для успешного проведения РДП? A. Концентрация буферного раствора B. Температура инкубации C. Скорость вращения центрифуги D. Концентрация антигена и антитела Правильный ответ: C 7. Для чего в РДП используют окрашивание геля после инкубации? A. Для идентификации типа антител B. Для улучшения видимости преципитационных линий C. Для изменения pH среды D. Для денатурации белков Правильный ответ: B 8. Какое утверждение о двумерной РДП (метод Оухтерлони) является верным? A. Преципитационные линии формируются в трёхмерном пространстве. B. Антитела и антигены мигрируют в геле под воздействием электрического поля. C. Преципитационные линии формируются на пересечении диффузионных путей антигенов и антител. D. Метод используется только для антител. Правильный ответ: C 9. Какой фактор может влиять на формирование преципитационных линий в РДП? A. Цвет геля B. Присутствие ингибиторов ферментов C. Концентрация антигена и антитела D. Время суток Правильный ответ: C 10. Какова основная цель использования РДП в исследованиях и диагностике? A. Определение молекулярной массы белков B. Выявление антител или антигенов в образцах C. Измерение концентрации солей в растворе D. Определение фазы клеточного цикла Правильный ответ: B 5 2 11 7 4 1 3 9 12 8 15 10 6 По горизонтали: По вертикали: 1. антиген 3. гель 2. агароза 4. инкубация 6. лунки 5. ракета 7. серология 9. диффузия 8. буфер 10. антитела 13. иммунитет 11. флуоресценция 12. преципитат 13 14 14. манчини 15. оухтерлони По горизонтали: 1. Вещество, способное вызвать иммунный ответ и взаимодействовать с антителами. 2. Вещество, используемое для создания геля в РДП. 6. Отверстия в геле для внесения реагентов в РДП. 7. Наука о крови, иммунных реакциях и их использовании для диагностики заболеваний. 8. Раствор для поддержания стабильного pH во время эксперимента. 13.Способность организма сопротивляться инфекционным заболеваниям. По вертикали: 3. Полужидкая среда, используемая в РДП для диффузии антител и антигенов. 4. Период времени, в течение которого происходит реакция между антителами и антигенами. 5. Форма преципитата в методе ракетной электроиммунофорез. 9.Процесс пассивного перемещения молекул в среде, лежащий в основе РДП. 10.Белки иммунной системы, специфично связывающиеся с антигенами. 11.Способность вещества излучать свет при возбуждении лазером или другим источником света, используемая в диагностике. 12.Твердое вещество, образующееся в результате серологической реакции. 13.Метод РДП, в котором антитела равномерно распределены в геле. 14.Метод РДП, позволяющий анализировать взаимодействие антител и антигенов в двумерном пространстве. Наименование реакции Аббревиатура Достоинства Недостатки Компоненты Реакция РИФ иммунофлуоресце нции Высокая Антитела, чувствительность и Требует меченные специфичность, флуоресцентный флуоресцентн возможность микроскоп, ыми визуализации высокая красителями антигенов в клетках стоимость, необходимы квалифицированн ые операторы Иммуноферментн ИФА ый анализ Высокая чувствительность специфичность, Требуются и специальные реагенты Учет Использован реакци ие в и вирусологии Оценка под микрос копом на наличи е флуоре сценци и Идентификац ия возбудителей инфекционны х заболеваний, определение клеточных антигенов Антигены Опреде Обнаружение или антитела, ление антигенов и и ферменты, интенс антител к подходит массовых исследований, автоматизация Реакция диффузионной преципитации РДП для оборудование, некоторая подготовка проб Простота и дешевизна, не требует специализированного оборудования субстраты ферментов ивности окраски , которая коррел ирует с количес твом антиген а или антител а в образце различным вирусам, включая ВИЧ, гепатиты и другие вирусные инфекции Относительно Антитела и низкая антигены в чувствительность геле и специфичность, длительное время ожидания результата Визуал ьная оценка образов ания прецип итатны х линий в геле Идентификац ия и типирование вирусов, а также для диагностики различных инфекционны х болезней 7.1. РТГА (реакция торможения гемагглютинации) является классическим методом серологического анализа и широко используется для определения титров антител в сыворотке крови против различных вирусов, в том числе и вируса Ньюкаслской болезни (НБ) у птиц. Ньюкаслская болезнь — это высококонтагиозное вирусное заболевание, поражающее многие виды птиц, и вызывается вирусом Ньюкаслской болезни (Paramyxovirus Avulavirus 1). РТГА используется для определения наличия и количественной оценки антител к гемагглютинину вируса, что важно для диагностики болезни и оценки иммунного статуса популяции птиц. Постановка РТГА для определения титра специфических антигемагглютининов против НБ: 1. Подготовка реактивов и образцов: Используется стандартизованный вирус Ньюкаслской болезни с известной концентрацией гемагглютинина. Сыворотки крови птиц разбавляются в физиологическом растворе для получения серии разведений. 2. Разведение сывороток: Обычно начинают с разведения 1:10, далее последовательно разбавляют в 2 раза до получения необходимого диапазона разведений. 3. Добавление вируса: К каждому разведению сыворотки добавляют одинаковое количество вируса, содержащего 4 единицы гемагглютинина. 4. Инкубация: Смеси инкубируют в течение 30 минут при комнатной температуре для формирования комплексов антитело-антиген. 5. Добавление эритроцитов: К каждому разведению добавляют 1% суспензию эритроцитов кур или других птиц, чувствительных к вирусу НБ. 6. Инкубация с эритроцитами: Смеси инкубируют при комнатной температуре еще 45 минут до 1 часа. 7. Оценка результатов: Результаты оценивают по наличию или отсутствию гемагглютинации. Титр антител определяют как обратное значение наивысшего разведения сыворотки, при котором еще наблюдается торможение гемагглютинации. РТГА позволяет оценить уровень иммунитета у птицы к Ньюкаслской болезни и эффективность проведенной вакцинации. Высокие титры антител свидетельствуют о наличии иммунитета против вируса НБ. 2.1 Принцип реакции торможения гемагглютинации (РТГА) заключается в способности специфических антител, присутствующих в исследуемой сыворотке, блокировать (ингибировать) гемагглютинирующее действие вирусов или других агентов, содержащих гемагглютинин на своей поверхности. Гемагглютинин — это вещество (часто белок), способное вызывать агглютинацию (слипание) эритроцитов. В процессе РТГА вирус, обладающий гемагглютинирующими свойствами, смешивают с разведенными образцами сыворотки крови, которая может содержать антитела к данному вирусу. Если в сыворотке присутствуют специфические антитела, они связываются с гемагглютинином вируса, предотвращая его взаимодействие с эритроцитами. В результате, при добавлении эритроцитов, агглютинация не происходит, что свидетельствует о наличии специфических антител в исследуемом образце. Степень разведения сыворотки, при которой ещё наблюдается торможение гемагглютинации, позволяет определить титр антител в образце. РТГА широко используется в вирусологии для диагностики вирусных инфекций, вакцинации и серологических исследований, включая определение уровня антител против таких заболеваний, как грипп, корь, парагрипп, ньюкаслская болезнь у птиц и многие другие. Этот метод отличается высокой специфичностью и чувствительностью, позволяя обнаруживать даже низкие концентрации антител. 2.2 С помощью реакции торможения гемагглютинации (РТГА) можно идентифицировать широкий спектр вирусов, обладающих способностью к гемагглютинации. Вот некоторые из вирусов, которые часто идентифицируются с помощью этого метода: 1. Инфлюенца (грипп): Вирусы гриппа A, B, и C являются классическими примерами, для идентификации которых используется РТГА. Этот метод позволяет не только подтвердить наличие вируса гриппа в образце, но и определить его подтип. 2. Парагрипп: Вирусы парагриппа также могут быть идентифицированы с помощью РТГА, что важно для диагностики респираторных заболеваний, особенно у детей. 3. Корь: Хотя корь обычно диагностируется с помощью других серологических тестов, РТГА может использоваться для определения титра антител, что важно для оценки иммунного статуса к этому вирусу. 4. Ньюкаслская болезнь: Это заболевание птиц вызывается вирусом, который также может быть идентифицирован с помощью РТГА. Тест часто используется для мониторинга и контроля вспышек среди домашней птицы. 5. Орнитоз (пситтакоз): Возбудителями этой группы заболеваний являются хламидии, но методы, подобные РТГА, также могут использоваться для их диагностики, особенно при оценке антител. 6. Ротавирусы и норовирусы: Несмотря на то что они не вызывают гемагглютинацию в классическом понимании, существуют модификации РТГА, позволяющие определить антитела к этим возбудителям гастроэнтеритов. РТГА является важным инструментом в вирусологии, позволяющим быстро и с высокой чувствительностью определить наличие и титр антител к различным вирусам, что важно как для диагностики, так и для мониторинга иммунного статуса населения или животных к определенным инфекциям. 2.3 Подготовка сыворотки крови к реакции торможения гемагглютинации (РТГА) включает в себя несколько ключевых этапов, чтобы обеспечить точность и надежность результатов. Вот общий план действий для подготовки сыворотки: 1. Сбор образца крови: Кровь берется из вены и собирается в пробирку без антикоагулянта, чтобы позволить формироваться сгустку. 2. Коагуляция: Пробирку с кровью оставляют при комнатной температуре на 30 минут до 1 часа, чтобы обеспечить полную коагуляцию. Это важно для отделения сыворотки от клеточных компонентов и сгустка. 3. Центрифугирование: После коагуляции пробирку центрифугируют при 1000-2000 об/мин (где-то 1500-3000 g) в течение 10-15 минут. Центрифугирование помогает отделить сыворотку от сгустка и клеточного осадка. 4. Сбор сыворотки: Аккуратно отделите сыворотку от сгустка с помощью пипетки и перенесите в чистую, стерильную пробирку. Сыворотку следует обрабатывать асептически, чтобы избежать загрязнения. 5. Разведение сыворотки: Для проведения РТГА сыворотку обычно разводят физиологическим раствором или другим подходящим буфером. Начальное разведение и последующие разведения зависят от предполагаемого уровня антител и целей исследования. Типичные начальные разведения могут начинаться с 1:10, 1:20 и далее удваиваться для получения серии разведений. 6. Хранение: Если анализ сыворотки не будет проведен немедленно, ее можно хранить при 4°C в течение нескольких дней или заморозить при -20°C или ниже для долгосрочного хранения. Избегайте многократного замораживания и оттаивания образцов, так как это может повлиять на стабильность антител. 7. Проверка на ингибиторы гемагглютинации: Иногда сыворотка может содержать естественные ингибиторы гемагглютинации, не связанные с иммунным ответом. Для проверки на их наличие могут быть проведены предварительные тесты с известными гемагглютинирующими агентами. 8. Контрольные образцы: важно включить в анализ положительные и отрицательные контрольные образцы сыворотки для проверки специфичности и чувствительности реакции. Правильная подготовка сыворотки крови к РТГА является критически важной для достижения точных и воспроизводимых результатов, позволяя точно определить наличие и титр антител против конкретных вирусов. 2.4 Методика титрования сыворотки в реакции торможения гемагглютинации (РТГА) используется для определения концентрации специфических антител против вирусов, обладающих свойством гемагглютинации, в исследуемом образце сыворотки. Титр сыворотки показывает её разведение, при котором ещё наблюдается торможение гемагглютинации. Вот основные шаги процесса титрования: 1. Подготовка разведений сыворотки: Исследуемую сыворотку разводят в несколько ступеней, обычно начиная с 1:10 или 1:20 и далее удваивая разведение, например, 1:40, 1:80, 1:160 и так далее. Используют физиологический раствор или соответствующий буфер для разведений. 2. Добавление вируса с известной концентрацией гемагглютинина: К каждому разведению сыворотки добавляют одинаковое количество вируса, содержащего гемагглютинин. Концентрация вируса подбирается таким образом, чтобы в контрольном без антител образце обеспечивалась полная гемагглютинация эритроцитов. 3. Инкубация: Смесь сыворотки и вируса инкубируют в течение определённого времени при комнатной температуре или в холодильнике, чтобы дать возможность антителам связаться с гемагглютинином вируса. 4. Добавление эритроцитов: К каждой пробирке с разведенной сывороткой и вирусом добавляют одинаковое количество эритроцитов (обычно куринных или человеческих, в зависимости от системы). 5. Вторая инкубация: Пробирки снова инкубируют, чтобы дать возможность эритроцитам агглютинироваться в присутствии вируса. 6. Оценка результатов: После инкубации оценивают наличие или отсутствие гемагглютинации в каждой пробирке. Гемагглютинация указывает на отсутствие достаточного количества антител для торможения действия вируса в данном разведении. 7. Определение титра сыворотки: Титром сыворотки считается наивысшее разведение, при котором ещё наблюдается полное торможение гемагглютинации. Это означает, что антитела в сыворотке в этом разведении еще способны блокировать связывание вируса с эритроцитами, предотвращая их агглютинацию. Титр антител в сыворотке является важным показателем для диагностики инфекционных заболеваний и оценки иммунного статуса. Высокий титр антител указывает на наличие иммунитета к конкретному вирусу, в то время как низкий или отсутствующий титр может свидетельствовать об отсутствии иммунитета. 2.5 Реакция торможения гемагглютинации (РТГА) не относится к экспресс-методам диагностики по нескольким причинам, связанным с её характеристиками и требованиями к проведению: 1. Время на подготовку и выполнение: РТГА требует тщательной подготовки, включая подготовку разведений сыворотки, инкубацию смесей сыворотки с вирусом и последующую инкубацию с эритроцитами. Эти шаги занимают значительное время, обычно несколько часов, а иногда и дольше, в зависимости от конкретного протокола. 2. Необходимость специализированного оборудования и реагентов: Для выполнения РТГА требуется ряд специализированных реагентов, включая стандартизированные штаммы вирусов, эритроциты определённого типа, и, в некоторых случаях, специальные инкубаторы для поддержания оптимальных условий инкубации. 3. Требование к квалификации персонала: Интерпретация результатов РТГА может быть сложной и требует высокой квалификации и опыта лабораторного персонала. Оценка степени гемагглютинации или её ингибирования требует определённых навыков и понимания процессов. 4. Отсутствие мгновенных результатов: в отличие от экспресс-тестов, которые могут давать результаты в течение нескольких минут, РТГА требует длительного времени для получения окончательных результатов. Это делает метод менее подходящим для ситуаций, когда необходимо быстро принимать клинические решения. Экспресс-методы обычно характеризуются быстротой получения результатов, простотой выполнения и минимальными требованиями к специализированному оборудованию и обучению персонала. Поэтому, хотя РТГА является ценным и точным методом для определения титра антител и диагностики вирусных инфекций, его нельзя считать экспресс-методом. 3. Тест 1. Что измеряет РТГА? A) Концентрацию вируса в образце B) Титр специфических антигемагглютининов C) Количество эритроцитов в образце D) Активность ферментов вируса Правильный ответ: B 2. Какой образец используется для проведения РТГА? A) Полная кровь B) Сыворотка крови C) Плазма крови D) Моча Правильный ответ: B 3. Каков первый шаг в подготовке сыворотки для РТГА? A) Разведение сыворотки B) Инкубация с вирусом C) Центрифугирование крови D) Добавление эритроцитов Правильный ответ: C 4. Какой компонент необходим для выполнения РТГА? A) Агар B) Вирус, содержащий гемагглютинин C) Антибиотики D) Антитела против эритроцитов Правильный ответ: B 5. Что принимается за титр сыворотки в РТГА? A) Наименьшее разведение, при котором наблюдается агглютинация B) Наивысшее разведение, при котором не наблюдается агглютинация C) Наивысшее разведение, при котором ещё наблюдается торможение гемагглютинации D) Концентрация антигенов в образце Правильный ответ: C 6. Какой индикатор используется для определения результата в РТГА? A) Изменение цвета раствора B) Формирование осадка C) Торможение гемагглютинации D) Появление флуоресценции Правильный ответ: C 7. Какие эритроциты чаще всего используются в РТГА для ньюкаслской болезни? A) Конские B) Человеческие C) Куриные D) Свиные Правильный ответ: C 8. Какова цель добавления эритроцитов в РТГА? A) Для связывания с антителами B) Для индикации гемагглютинации C) Для нейтрализации вируса D) Как источник питательных веществ Правильный ответ: B 9. Как долго обычно инкубируют смесь сыворотки и вируса в РТГА? A) 5 минут B) 30 минут C) 1-2 часа D) 24 часа Правильный ответ: C 10. Почему РТГА не считается экспресс-методом? A) Из-за необходимости специального оборудования B) Из-за длительного времени инкубации C) Из-за сложности интерпретации результатов D) Все вышеперечисленные причины Правильный ответ: D 4.Кроссворд 1 4 3 12 2 5 7 9 11 6 8 10 13 По горизонтали: По вертикали: 1. агглютинация 3. ингибирование 2. центрифуга 4. иммунитет 6. эритроциты 5. титр 8. разведение 7. флюоресценция 11. ньюкасл 9. антиген 10. антитела 12. вирус 13. инкубация По горизонтали: 1. Процесс слипания частиц (например, эритроцитов) под действием агглютининов. 2. Аппарат для разделения смесей путём вращения, используется для отделения сыворотки от форменных элементов крови. 3. Красные кровяные тельца, используемые в РТГА для демонстрации гемагглютинации. 4. Процесс уменьшения концентрации образца добавлением растворителя, ключевой этап при подготовке к РТГА. 5. Вирусное заболевание птиц, вызывающее гемагглютинин, против которого определяют титр антител. По вертикали: 3. Подавление или блокировка биологического процесса, например, действия гемагглютинина антителами. 4. Способность организма сопротивляться инфекциям и болезням благодаря наличию специфических антител. 5. Концентрация вещества в растворе, в контексте РТГА означает наивысшее разведение сыворотки, при котором ещё наблюдается торможение гемагглютинации. 6. Явление излучения света веществом, не связанное с повышением его температуры, может использоваться в некоторых методах диагностики. 7. Вещество, воспринимаемое иммунной системой как чужеродное, и вызывающее иммунный ответ. 8. Белки иммунной системы, специфично связывающиеся с антигенами. 9. Патогенный микроорганизм, вызывающий заболевания у животных и людей. 10. Период времени между добавлением инфекционного агента и началом проявления симптомов болезни, в контексте РТГА — время между смешиванием компонентов реакции и оценкой результата. 5. Анализ представленных данных: Во всех образцах сыворотки был достигнут максимальный титр антител 1:4056. Это указывает на то, что у всех птиц в выборке был высокий уровень специфических антител против ньюкаслской болезни, что свидетельствует о сильной иммунной защите. Оценка среднего титра антител: поскольку титр 1:4056 был обнаружен в каждом образце, средний титр антител в группе также составляет 1:4056. Это значение выше, чем обычно требуется для считающейся защитной реакции, что говорит о высокой степени иммунитета. Значение для оценки иммунитета: Высокие титры антител в группе птиц могут быть результатом успешной вакцинации или предыдущего контакта с вирусом, что привело к развитию сильного адаптивного иммунного ответа. Вывод: На основании анализа данных таблицы агглютинации можно сделать вывод, что птицы обладают высоким уровнем специфических антител против ньюкаслской болезни, что указывает на сильный иммунитет и хорошую степень защиты от инфекции. Средний титр антител 1:4056 говорит о высокой напряженности иммунитета в группе, что является положительным результатом для оценки эффективности иммунной защиты птиц. 7.2. Наименование Аббревиа Достоинств реакции тура а Реакция иммунофлуорес ценции РИФ Высокая чувствитель ность и специфично сть Иммунофермен тный анализ Высокая чувствитель ность и специфично сть, автоматизац ия Реакция диффузионной преципитации ИФА РДП Реакция торможения гемагглютинаци и РТГА Простота выполнения, низкая стоимость Возможност ь качественно йи количествен ной оценки, специфично сть Недостатки Компонен ты Учет реакции Требует флуоресцентны й микроскоп, высокая стоимость Флуоресце нтномеченые антитела Визуализац ия под микроскопо м Требуется специальное оборудование Низкая чувствительнос ть и специфичность Требует гемагглютинир ующий агент, специальные условия для хранения реагентов Антигены, Определени антитела, е ферменты, оптической субстраты плотности Использов ание в вирусолог ии Обнаруже ние специфиче ских антигенов вирусов в клетках и тканях Диагности ка вирусных инфекций, определен ие титров антител Антигены, антитела Идентифи кация вирусных Визуальная антигенов оценка и антител, образования типирован осадка ие вирусов Вирусы, эритроцит ы, сыворотка крови Определен ие титров антител против вирусов, включая вирус гриппа, парагрипп а, ньюкаслск ой болезни Оценка по наличию или отсутствию гемагглюти нации 8.1 Реакция нейтрализации (РН) — это серологический метод, используемый для определения способности антител в сыворотке нейтрализовать биологическую активность антигена, чаще всего вируса. Этот метод широко применяется для диагностики вирусных инфекций и оценки иммунного статуса по отношению к конкретному вирусу. Вот основные шаги постановки РН: 1. Подготовка культуры клеток: Для РН часто используют культуры клеток, которые чувствительны к вирусу. Эти клетки выращивают в лабораторных условиях до достижения нужной конфлюэнтности. 2. Подготовка вируса: Выбирают вирусную суспензию известной концентрации, которая может инфицировать клеточную культуру, вызывая цитопатический эффект (ЦПЭ). 3. Подготовка разведений сыворотки: Исследуемую сыворотку разводят в серии разведений, чтобы оценить её способность нейтрализовать вирус. 4. Смешивание сыворотки с вирусом: Каждое разведение сыворотки смешивают с вирусной суспензией и инкубируют в течение определённого времени, чтобы дать возможность антителам связаться с вирусом и нейтрализовать его. 5. Инкубация с клетками: Полученную смесь сыворотки и вируса добавляют к клеткам. Если сыворотка содержит специфические антитела, они нейтрализуют вирус и предотвратят развитие ЦПЭ. 6. Оценка результатов: После инкубации оценивают состояние клеточной культуры под микроскопом. Отсутствие или снижение ЦПЭ в сравнении с контрольными образцами без сыворотки свидетельствует о наличии специфических нейтрализующих антител в сыворотке. 7. Определение титра нейтрализующих антител: Титр антител определяют как наивысшее разведение сыворотки, при котором ещё наблюдается нейтрализация вируса и предотвращение ЦПЭ. РН позволяет не только определить наличие специфических антител против определённого вируса, но и оценить их функциональную активность, что важно для понимания защитного иммунного статуса организма. Этот метод применяется в исследованиях вакцин, для подтверждения эффективности иммунизации и в серологической диагностике вирусных инфекций. 2.1 Принцип реакции нейтрализации заключается в оценке способности специфических антител, присутствующих в сыворотке крови, нейтрализовать инфекционную активность вируса, предотвращая его способность заражать хозяйские клетки и вызывать цитопатические эффекты (ЦПЭ). Реакция используется для определения наличия и активности антител против конкретных вирусов, что позволяет оценить иммунный ответ на инфекцию или вакцинацию. Основные этапы и принципы реакции: 1. Подготовка образца: Используют сыворотку крови обследуемого индивида, которая потенциально содержит антитела против интересующего вируса. 2. Смешивание с вирусом: Сыворотку смешивают с известным количеством вируса, который может вызвать инфекцию в подходящей системе (например, в культуре клеток). Предоставляется достаточно времени для взаимодействия антител с вирусом, чтобы антитела могли связаться с вирусными частицами и нейтрализовать их. 3. Добавление к клеткам: Смесь сыворотки и вируса затем добавляют к культуре клеток, чувствительных к этому вирусу. Если антитела в сыворотке эффективно нейтрализуют вирус, они предотвратят его связывание и проникновение в клетки, защищая их от инфекции и последующего развития ЦПЭ. 4. Оценка результата: Результат реакции оценивается путем сравнения состояния клеточной культуры после воздействия смеси сыворотки и вируса с контрольными образцами (клетки, инфицированные вирусом без сыворотки, и клетки без воздействия вируса). Нейтрализация вируса антителами приводит к отсутствию или значительному снижению ЦПЭ. Таким образом, реакция нейтрализации демонстрирует функциональную активность антител, способных защитить клетки от вирусной инфекции, и является важным инструментом для оценки иммунитета против вирусных заболеваний. 2.2 Методика титрования сыворотки крови в реакции нейтрализации включает в себя серию шагов, направленных на определение наименьшего разведения сыворотки, способного нейтрализовать определённое количество вируса, предотвращая его цитопатическое действие на культуре клеток. Вот основные этапы методики: 1. Подготовка сыворотки: Сыворотка крови обследуемого субъекта разводится в серии последовательных разведений, чтобы оценить уровень нейтрализующих антител. Разведения могут начинаться, например, с 1:2, 1:4, 1:8 и так далее. 2. Подготовка вирусной суспензии: Готовится суспензия вируса, активность которого известна и стандартизирована. Количество вируса должно быть достаточным для вызова цитопатического эффекта (ЦПЭ) в контрольных клетках без добавления сыворотки. 3. Инкубация сыворотки с вирусом: Каждое разведение сыворотки смешивается с стандартизированным количеством вируса и инкубируется в течение определённого времени. Это позволяет антителам в сыворотке связываться с вирусом и нейтрализовать его. 4. Добавление к культуре клеток: После инкубации смесь сыворотки и вируса добавляют к чувствительной культуре клеток, которая наблюдается на предмет развития ЦПЭ. 5. Инкубация и оценка: Культуры клеток инкубируются в течение необходимого времени, после чего оценивается наличие или отсутствие ЦПЭ. Отсутствие ЦПЭ свидетельствует о том, что вирус был успешно нейтрализован сывороткой в данном разведении. 6. Определение титра нейтрализующих антител: Титр нейтрализующих антител в сыворотке определяется как наивысшее разведение сыворотки, при котором ещё наблюдается нейтрализация вируса (отсутствие ЦПЭ). Это значение указывает на количественную оценку способности антител предотвратить вирусную инфекцию клеток. Методика титрования сыворотки в реакции нейтрализации является важным инструментом для оценки эффективности иммунного ответа против конкретных вирусов, а также для исследования вакцин и изучения механизмов иммунной защиты. 2.3. В реакции нейтрализации индекс рассчитывается с целью количественной оценки эффективности нейтрализующих антител в сыворотке против определённого вируса. Этот показатель помогает определить степень защиты, которую иммунная система может предоставить против вирусной инфекции. Расчёт индекса нейтрализации позволяет: 1. Оценить иммунный ответ: Определение индекса нейтрализации дает возможность оценить силу и качество иммунного ответа на вирус или вакцину. Это особенно важно при оценке эффективности вакцинации. 2. Определить уровень иммунной защиты: Расчет индекса позволяет узнать, достаточно ли высок уровень антител в сыворотке для защиты от конкретной вирусной инфекции. Это важно для принятия решений о необходимости вакцинации или ревакцинации. 3. Сравнить эффективность различных вакцин: Путем измерения индекса нейтрализации можно сравнивать эффективность разных вакцин или методов иммунизации, что важно при разработке и выборе оптимальных вакцинных стратегий. 4. Исследовать вирусные штаммы: Расчёт индекса может помочь в идентификации и сравнении различных вирусных штаммов, включая их способность уклоняться от иммунного ответа. Индекс нейтрализации часто выражается через титр нейтрализующих антител, который представляет собой наивысшее разведение сыворотки, способное ингибировать вирусную инфекцию на определённый процент (например, на 50% или 100%) по сравнению с контролем. Этот показатель служит ключевым индикатором специфической иммунной защиты против вируса. 2.4. Реакция нейтрализации (РН) имеет как достоинства, так и недостатки, которые делают её предпочтительной для определённых исследований и менее удобной для других. Вот основные из них: Достоинства Реакции Нейтрализации: 1. Специфичность: РН способна точно идентифицировать наличие и активность нейтрализующих антител против конкретного вируса, что позволяет оценить специфический иммунный ответ. 2. Возможность качественной и количественной оценки: Метод позволяет не только обнаружить наличие нейтрализующих антител, но и определить их титр, что важно для оценки уровня иммунитета. 3. Важность для оценки вакцин: РН является золотым стандартом для оценки эффективности вакцин, поскольку она позволяет измерить способность индуцированных вакциной антител защитить клетки от вирусной инфекции. 4. Применение в исследованиях: Этот метод используется для изучения механизмов вирусной нейтрализации и разработки новых антивирусных препаратов. Недостатки Реакции Нейтрализации: 1. Трудоёмкость и длительность процедуры: Подготовка клеточных культур, вирусов и проведение самой реакции требует значительных временных и трудовых затрат. 2. Необходимость специализированного оборудования: Для проведения РН требуются клеточные культуры, инкубаторы и оборудование для работы с культурами клеток. 3. Возможность биологического риска: Работа с живыми вирусами и клеточными культурами требует строгих мер биобезопасности. 4. Ограничения по вирусам: РН подходит не для всех вирусов, особенно для тех, которые сложно культивировать в лабораторных условиях или имеют сложные механизмы нейтрализации. 5. Вариабельность: Результаты могут быть подвержены вариабельности из-за различий в чувствительности клеточных линий, условиях культивирования и других факторах. 3.Тест 1. Что определяет реакция нейтрализации? A) Концентрацию вируса в образце B) Присутствие бактериальных антител C) Способность антител нейтрализовать вирус D) Количество эритроцитов в крови Правильный ответ: C 2. Какой компонент НЕ используется в реакции нейтрализации? A) Клеточные культуры B) Нейтрализующие антитела C) Антибиотики D) Вирусная суспензия Правильный ответ: C 3. Для чего необходима инкубация в реакции нейтрализации? A) Для размножения бактерий B) Для позволения антителам связаться с вирусом C) Для увеличения количества эритроцитов D) Для активации антител Правильный ответ: B 4. Какой результат свидетельствует о наличии нейтрализующих антител? A) Рост клеток B) Цитопатический эффект C) Отсутствие цитопатического эффекта D) Изменение цвета среды Правильный ответ: C 5. Что означает титр нейтрализующих антител в реакции нейтрализации? A) Наименьшее количество антител B) Максимальное разведение сыворотки, при котором вирус все еще способен вызывать ЦПЭ C) Минимальное разведение сыворотки, блокирующее ЦПЭ D) Наивысшее разведение сыворотки, при котором антитела ещё способны нейтрализовать вирус Правильный ответ: D 6. Какие факторы могут повлиять на результаты реакции нейтрализации? A) Время инкубации B) Температура инкубации C) Концентрация вируса D) Все вышеперечисленные Правильный ответ: D 7. В каких исследованиях чаще всего применяется реакция нейтрализации? A) Бактериологических B) Вирусологических C) Гематологических D) Биохимических Правильный ответ: B 8. Что НЕ является недостатком реакции нейтрализации? A) Трудоемкость B) Быстрота получения результатов C) Необходимость в специализированном оборудовании D) Биологический риск при работе с вирусами Правильный ответ: B 9. Какой шаг является критическим для успешной реакции нейтрализации? A) Выбор антибиотиков B) Подготовка клеточной культуры C) Разведение сыворотки D) Выбор типа эритроцитов Правильный ответ: B 10.Какова цель расчета индекса в реакции нейтрализации? A) Определение количества бактерий в образце B) Измерение активности антибиотиков C) Оценка эффективности нейтрализующих антител D) Подсчет количества эритроцитов Правильный ответ: C 4.Данные представляют результаты реакции нейтрализации, проведённой с целью определения наличия вируса в исследуемом материале, где использовались две группы: одна с положительной сывороткой (содержащей антитела к вирусу) и вторая с отрицательной сывороткой (не содержащей специфических антител к вирусу). Рассматривались разные разведения вируса, и наблюдалось количество павших животных в каждой группе. Анализируя предоставленные данные, можно заметить, что с увеличением разведения вируса количество павших животных в обеих группах уменьшается, что указывает на уменьшение вирулентности (инфекционной способности) вируса с увеличением его разведения. Важным моментом является то, что в группе с положительной сывороткой наблюдается снижение количества павших животных на более раннем этапе разведения по сравнению с группой с отрицательной сывороткой. Это свидетельствует о наличии и эффективности нейтрализующих антител в положительной сыворотке, которые снижают инфекционность вируса. Ключевые моменты анализа: Начиная с разведения 10^-5, видна разница в количестве павших животных между двумя группами, что указывает на начало действия нейтрализующих антител в положительной сыворотке. Полное отсутствие павших животных в обеих группах начиная с разведения 10^-8 свидетельствует о том, что концентрация вируса стала недостаточной для вызывания заболевания даже в отсутствие нейтрализующих антител (в группе с отрицательной сывороткой). Наличие павших животных только в группе с отрицательной сывороткой при разведении 10^-7 подтверждает эффективность положительной сыворотки в нейтрализации вируса и предотвращении заболевания. На основании этих данных можно сделать вывод о наличии и активности специфических нейтрализующих антител против исследуемого вируса в положительной сыворотке. Эти результаты подчёркивают важность реакции нейтрализации для оценки способности антител защищать организм от вирусных инфекций. 8.2 Наименование реакции Аббревиа Достоинств тура а Недостатки Компонент Учет ы реакции Использова ние в вирусологи и Реакция иммунофлуоресц енции РИФ Обнаружени е специфичес Высокая Требует ких чувствитель флуоресцентны Флуоресцен Визуализаци антигенов ность и й микроскоп, тноя под вирусов в специфичнос высокая меченые микроскопо клетках и ть стоимость антитела м тканях Иммунофермент ный анализ ИФА Высокая чувствитель ность и специфичнос ть, Требуется автоматизац специальное ия оборудование Реакция диффузионной преципитации РДП Реакция торможения гемагглютинаци и РТГА Антигены, антитела, ферменты, субстраты Диагностика вирусных инфекций, Определение определение оптической титров плотности антител Простота выполнения, низкая стоимость Низкая чувствительност ьи Антигены, специфичность антитела Идентифика ция вирусных Визуальная антигенов и оценка антител, образования типирование осадка вирусов Возможност ь качественно йи Вирусы, Требует Определени эритроциты гемагглютиниру Оценка по е титров , сыворотка ющий агент, наличию или антител крови специальные отсутствию против Наименование реакции Аббревиа Достоинств тура а Недостатки Компонент Учет ы реакции количествен условия для ной оценки, хранения специфичнос реагентов ть Реакция нейтрализации РН Возможност ь оценки специфическ ого иммунитета, высокая специфичнос ть Трудоемкость, необходимость специализирова нного оборудования Использова ние в вирусологи и гемагглютин вирусов, ации включая вирус гриппа, парагриппа, ньюкаслско й болезни Вирус, клеточные культуры, сыворотка крови Определени е наличия и активности Отсутствие нейтрализу или ющих снижение антител цитопатичес против кого конкретных эффекта вирусов 9.1 Полимеразная цепная реакция (ПЦР, PCR от англ. Polymerase Chain Reaction) — это мощный метод молекулярной биологии, позволяющий в кратчайшие сроки провести многократное увеличение (амплификацию) конкретных фрагментов ДНК из очень малого количества исходного материала. Этот метод был разработан в 1983 году Кэри Маллисом, за что он был удостоен Нобелевской премии по химии в 1993 году. Принцип работы ПЦР: 1. Денатурация: ДНК нагревается до высокой температуры (около 95°C), что приводит к разделению двойной спирали на две одноцепочечные молекулы. 2. Отжиг (аннелирование): Температура понижается (обычно до 50-65°C), чтобы позволить коротким фрагментам ДНК, называемым праймерами, присоединиться (гибридизоваться) к комплементарным участкам исходной ДНК. 3. Элонгация: Температура снова повышается (обычно до 72°C), что оптимально для работы ДНК-полимеразы, катализирующей синтез новой ДНК. ДНК-полимераза добавляет нуклеотиды к праймерам, синтезируя новые цепочки ДНК, комплементарные исходной матрице. Эти три шага повторяются многократно (обычно 25-35 циклов), в результате чего количество специфических фрагментов ДНК увеличивается в геометрической прогрессии. Применение ПЦР: Диагностика заболеваний: ПЦР используется для обнаружения наличия патогенов в образцах, включая вирусы (например, ВИЧ, гепатиты, SARS-CoV-2) и бактерии. Генетические исследования: Идентификация генетических мутаций, анализ генов, изучение наследственных заболеваний. Криминалистика: Идентификация личности по биологическим образцам, таким как кровь, слюна или волосы. Патернити тесты: Определение биологического родства. Достоинства ПЦР: Высокая чувствительность и специфичность: Можно обнаружить одну молекулу ДНК в образце. Быстрота: Получение результатов возможно в течение нескольких часов. Версатильность: Применимо к широкому спектру образцов и целей исследования. Недостатки ПЦР: Риск контаминации: Очень малые количества ДНК могут быть легко загрязнены, что приведет к ложноположительным результатам. Требует специализированного оборудования: Необходимы термоциклер и другое лабораторное оборудование. Ограниченность по длине амплифицируемых фрагментов: Эффективность амплификации снижается с увеличением размера фрагмента ДНК. ПЦР революционизировала многие аспекты молекулярной биологии и медицинской диагностики, предоставляя быстрый и надежный способ анализа ДНК. 2.1 Принцип ПЦР заключается в экспоненциальной амплификации (многократном увеличении) специфических участков ДНК с помощью циклических температурных изменений, проводимых в присутствии специфических праймеров, ДНК-полимеразы и нуклеотидов. Реакция позволяет получить миллионы копий интересующего фрагмента ДНК из очень малого количества исходного материала, что делает возможным его дальнейший анализ и идентификацию. 2.2. ПЦР-анализ состоит из трех основных этапов, которые повторяются в цикле множество раз (обычно 25-35 циклов): 1. Денатурация: Нагревание смеси до температуры около 95°C приводит к разрыву водородных связей между комплементарными цепями двойной спирали ДНК, в результате чего она расплетается на две одноцепочечные молекулы. 2. Отжиг (аннелирование): Понижение температуры до 50-65°C позволяет коротким одноцепочечным ДНК-праймерам присоединиться к комплементарным участкам целевой ДНК. Праймеры служат стартовыми точками для синтеза новой ДНК. 3. Элонгация: При температуре около 72°C активируется ДНК-полимераза, которая начинает синтез новых ДНК-цепей, добавляя нуклеотиды к праймерам в соответствии с комплементарным участком матрицы. Этот этап приводит к образованию новых молекул ДНК, дублирующих целевой участок. После завершения циклов ПЦР получается значительное количество копий исследуемого фрагмента ДНК, что делает его подходящим для дальнейших анализов, таких как электрофорез, секвенирование или гибридизационные методы. 2.3 Методика выделения ДНК Выделение ДНК — это процесс извлечения ДНК из клеток или тканей в чистом виде для последующего использования в различных биологических и медицинских исследованиях. Этот процесс включает несколько ключевых этапов: 1. Лизис клеток: Используются физические (измельчение, ультразвук), химические (детергенты, например, SDS) или биологические (ферменты, такие как протеаза) методы для разрушения клеточных и ядерных мембран и освобождения ДНК. 2. Удаление белков: Белки удаляются из лизата, часто с использованием протеиназы K и фенолхлороформного экстрагирования, чтобы предотвратить их загрязнение в препарате ДНК. 3. Очистка: ДНК очищается от остатков реагентов, РНК и других нежелательных компонентов с помощью различных методов, включая этаноловое осаждение, колоночную хроматографию или магнитные шарики. 4. Концентрирование и растворение: Полученная ДНК концентрируется, если это необходимо, и растворяется в подходящем буфере, таком как TE (трис-ЭДТА) для длительного хранения. 2.4. Методика амплификации ДНК Амплификация ДНК — это процесс увеличения количества копий определенного участка ДНК и обычно достигается с помощью полимеразной цепной реакции (ПЦР). Этапы амплификации включают: 1. Подготовка реакционной смеси: В неё входят матричная ДНК (целевой участок ДНК), праймеры (короткие одноцепочечные фрагменты ДНК, комплементарные началу и концу амплифицируемого участка), ДНК-полимераза, нуклеотиды (dNTPs) и буфер. 2. Циклы ПЦР: Денатурация: Реакционную смесь нагревают до 94-95°C для разделения двухцепочечной ДНК на одноцепочечные молекулы. Отжиг праймеров: Снижение температуры до 50-65°C позволяет праймерам аннелировать с комплементарными участками матричной ДНК. Элонгация: При температуре около 72°C ДНК-полимераза начинает синтез новых ДНКцепей, добавляя нуклеотиды к праймерам. 3. Анализ амплифицированной ДНК: После завершения ПЦР полученные фрагменты ДНК могут быть проанализированы различными методами, включая гель-электрофорез, секвенирование или гибридизационные анализы. Методика амплификации позволяет получить достаточное количество специфической ДНК для детального анализа, идентификации последовательности, клонирования или других молекулярнобиологических исследований. 2.5.Интерпретация результатов ПЦР включает анализ присутствия или отсутствия амплифицированных продуктов ДНК и, при необходимости, оценку их размера и количества. Это делается обычно с помощью электрофореза в агарозном геле, последующего окрашивания ДНК специфическими красителями (например, бромидом этидия) и визуализации под ультрафиолетовым светом. Результаты можно интерпретировать следующим образом: Присутствие специфического продукта амплификации Положительный результат: На геле видна четкая полоса, соответствующая ожидаемому размеру амплифицированного фрагмента ДНК. Это указывает на присутствие исходной целевой ДНК в образце. Отрицательный контроль: Не должен показывать никаких полос, подтверждая отсутствие контаминации реакционной смеси. Положительный контроль: Должен показывать полосу ожидаемого размера, подтверждая правильность проведения ПЦР и работоспособность всех компонентов реакции. Отсутствие специфического продукта амплификации Отрицательный результат: На геле нет полосы, соответствующей целевому фрагменту, что может указывать на отсутствие исследуемой ДНК в образце или на проблемы в процессе ПЦР (например, неэффективные праймеры, ингибирование полимеразы). Неспецифическая амплификация Неспецифические полосы: Наличие полос в геле, не соответствующих ожидаемому размеру амплифицированного продукта. Это может быть результатом неспецифического отжига праймеров, образования димеров праймеров или загрязнения образца. Количественная ПЦР (qPCR) В количественной ПЦР результаты интерпретируют на основе порогового цикла (Ct), который отражает цикл, в котором уровень флуоресценции превышает фоновый уровень. Меньшее значение Ct указывает на большее количество исходной целевой ДНК в образце. qPCR позволяет не только обнаружить, но и количественно оценить количество ДНК в образце. Особенности интерпретации Важно учитывать качество исходного ДНК-материала, оптимальность условий ПЦР (включая выбор праймеров и условия циклирования) и чистоту реагентов. Любые отклонения могут влиять на точность и специфичность амплификации, а также на интерпретацию результатов. Правильная интерпретация результатов ПЦР требует сравнения с контролями, оценки специфичности амплифицированных продуктов и, при необходимости, последующего подтверждения идентичности продуктов путем секвенирования или других методов молекулярного анализа. 3. тест 1. Что такое ПЦР? A) Метод клонирования ДНК B) Метод для уменьшения количества ДНК C) Метод многократного увеличения определенных участков ДНК D) Метод изменения последовательности ДНК Правильный ответ: C 2. Какой фермент является ключевым в ПЦР? A) Рестриктаза B) Лигаза C) ДНК-полимераза D) РНК-полимераза Правильный ответ: C 3. Что НЕ является компонентом реакционной смеси ПЦР? A) ДНК-праймеры B) ДНК-полимераза C) Аминокислоты D) dNTPs (дезоксирибонуклеотиды) Правильный ответ: C 4. Какой этап ПЦР отвечает за разделение двойной спирали ДНК на одиночные цепи? A) Денатурация B) Отжиг C) Элонгация D) Транскрипция Правильный ответ: A 5. На каком этапе ПЦР праймеры аннелируют с матричной ДНК? A) Денатурация B) Отжиг C) Элонгация D) Репликация Правильный ответ: B 6. Какой метод используется для визуализации продуктов ПЦР? A) Центрифугирование B) Электрофорез в агарозном геле C) Кристаллизация D) Фильтрация Правильный ответ: B 7. Что обозначает термин "амплификация" в контексте ПЦР? A) Разрушение ДНК B) Уменьшение количества ДНК C) Увеличение количества определенного участка ДНК D) Изменение последовательности ДНК Правильный ответ: C 8. Для чего обычно используется ПЦР? A) Для уменьшения количества ДНК в образце B) Для изменения генетического кода организмов C) Для диагностики заболеваний D) Для производства белков Правильный ответ: C 9. Какой параметр НЕ измеряется при количественной ПЦР (qPCR)? A) Пороговый цикл (Ct) B) Размер амплифицированной ДНК C) Концентрация исходной ДНК D) Скорость реакции Правильный ответ: B 10. Что может вызвать неспецифическую амплификацию в ПЦР? A) Точное соответствие праймеров и матрицы B) Слишком низкая температура отжига C) Использование ДНК-полимеразы высокой точности D) Слишком высокая концентрация праймеров Правильный ответ: D 4. 1 2 5 9 3 7 10 4 8 6 По горизонтали: По вертикали: 1. термоциклер 2. маллис 3. флуоресценция 4. амплификация 6. праймеры 5. секвенирование 10. отжиг 7. полимераза 8. квантификация 9. денатурация По горизонтали: 1. Термоциклер - Устройство, используемое для проведения ПЦР, обеспечивающее быструю смену температурных режимов. 2. Флуоресценция - Метод, используемый в количественной ПЦР для обнаружения и количественного определения амплифицированной ДНК. 3. Праймеры - Короткие фрагменты ДНК, специфические к целевому участку, необходимые для начала процесса амплификации. 4. Отжиг - Этап ПЦР, на котором праймеры присоединяются к специфическим участкам матричной ДНК при пониженной температуре. По вертикали: 2. Маллис - Фамилия ученого, который получил Нобелевскую премию за изобретение ПЦР. 3. Амплификация - Процесс многократного увеличения определенного участка ДНК. 4. Секвенирование - Метод, позволяющий определить точную последовательность нуклеотидов в ДНК. 5. Полимераза - Фермент, катализирующий синтез новых ДНК-цепей на этапе элонгации в ПЦР. 6. Квантификация - Процесс определения количества ДНК в образце, часто используется в контексте количественной ПЦР. 7. Денатурация - Этап ПЦР, на котором двойная спираль ДНК разделяется на две отдельные цепи путем нагревания. Вот заполненная таблица для указанных методов, включая ПЦР: Использова ние в Наименование Аббревиат Учет вирусологи реакции ура Достоинства Недостатки Компоненты реакции и Высокая Обнаружени чувствительн е ость и специфичес специфичнос Требует ких ть, флуоресцентны антигенов Реакция визуализация й микроскоп и Флуоресцент Визуализация вирусов в иммунофлуоресце на клеточном специализирова но-меченые под клетках и нции ИФ уровне нные красители антитела микроскопом тканях Иммуноферментн ый анализ ИФА Высокая чувствительн Требуется ость и специальное Антигены, антитела, Диагностика Количествен вирусных ная оценка по инфекций, Наименование реакции Аббревиат ура Достоинства Недостатки Компоненты специфичнос оборудование и ферменты, ть, подходит реагенты субстраты для массовых исследований Реакция диффузионной преципитации РДП Реакция торможения гемагглютинации РТГА Реакция нейтрализации Полимеразная цепная реакция Простота и низкая стоимость Возможность количественн ой оценки, не требует специфическ ого оборудования Учет реакции Использова ние в вирусологи и оптической плотности определение титров антител Низкая чувствительност Антигены, ьи антитела в специфичность геле Визуальная оценка преципитаци и Идентифика ция и типирование вирусов Ограничена вирусами, способными к Вирусы, гемагглютинаци эритроциты, и сыворотка Определени е титров Оценка по антител наличию или против отсутствию вирусов, гемагглютина включая ции грипп Требует культуру клеток и длительное время для анализа Определени е защитного иммунитета против вирусных инфекций, включая Отсутствие оценку цитопатическ эффективно ого эффекта сти вакцин РН Высокая специфичнос ть, позволяет оценить функциональ ную активность антител ПЦР Обнаружени еи Высокая Термоустойч идентифика чувствительн ивая ДНКция ость и Возможность полимераза, Амплификац вирусной специфичнос контаминации, праймеры, ия ДНК, ть, быстрое требует точного dNTPs, специфическ мониторинг получение соблюдения матричная их участков вирусных результатов протоколов ДНК ДНК нагрузок Вирус, клеточные культуры, сыворотка 10.1 Реакция непрямой гемагглютинации (непрямая ГА) — это серологический метод, используемый для обнаружения антител в сыворотке крови, основанный на способности этих антител вызывать агглютинацию (слипание) эритроцитов, которые были предварительно покрыты антигеном. Этот метод широко применяется для диагностики различных инфекционных заболеваний, включая вирусные и паразитарные инфекции, а также для определения титра антител, что позволяет оценить уровень иммунитета к конкретному возбудителю. Принцип реакции 1. Подготовка эритроцитов: Эритроциты покрываются антигеном, специфичным для исследуемого антитела. Это может быть, например, вирусный антиген или антиген паразитов. 2. Добавление сыворотки: К таким обработанным эритроцитам добавляется исследуемая сыворотка. Если в сыворотке присутствуют специфические антитела к данному антигену, они связываются с антигенами на поверхности эритроцитов. 3. Агглютинация: Присутствие агглютинации (слипания эритроцитов) указывает на наличие в сыворотке специфических антител к данному антигену. Отсутствие агглютинации свидетельствует об отсутствии соответствующих антител. Преимущества и недостатки Преимущества: Высокая чувствительность и специфичность метода. Возможность количественной оценки антител путем титрования сыворотки. Простота и доступность для массовых исследований. Недостатки: Необходимость использования специализированных реагентов, включая специфические антигены и обработанные эритроциты. Риск перекрестных реакций, особенно при наличии в сыворотке антител к другим антигенам, похожим на исследуемый. Необходимость в квалифицированном персонале для оценки результатов. Применение Реакция непрямой гемагглютинации используется в клинической практике и исследованиях для: Диагностики инфекционных заболеваний, таких как токсоплазмоз, лейшманиоз, вирусные гепатиты и другие. Оценки эффективности вакцинации путем измерения титра специфических антител перед и после вакцинации. Эпидемиологических исследований для определения уровня иммунитета в популяции к определенным инфекциям. 2.1 Принцип реакции непрямой гемагглютинации (РНГА) состоит в том, что антитела, образующиеся в организме в ответ на воздействие антигена (обычно вируса или бактерии), связываются с антигеном, а затем эти комплексы антител-антигенов связываются с эритроцитами. Конечный результат - образование агрегатов эритроцитов, что приводит к образованию сгустков или отложений 2.2 Отличие между реакцией непрямой гемагглютинации (РНГА) и прямой гемагглютинационной реакцией (РГА) заключается в том, что в РНГА используются антитела к антигенам, которые уже связаны с некоторыми частицами, например, с вирусами, в то время как в РГА антитела добавляются непосредственно к антигену. Таким образом, РГА напрямую измеряет наличие антител к конкретному антигену, в то время как РНГА позволяет обнаружить антитела, которые уже образовали комплексы с антигенами. 2.3. Методика постановки реакции для определения титра антител в сыворотке крови может варьироваться в зависимости от используемого метода, но основные этапы часто включают следующее: 1. Подготовка образцов: Сыворотку крови, содержащую антитела, разбавляют в серийном порядке с использованием буфера или другого разбавляющего раствора. Обычно разбавления производятся в 2-3 раза. 2. Приготовление стандартных образцов: Подготавливают стандартные образцы с известной концентрацией антител, которые используются для построения калибровочной кривой. 3. Подготовка антигена или антигенов: Если реакция проводится с использованием специфического антигена, его также подготавливают в соответствии с протоколом, например, разведением в определенном буфере. 4. Добавление антигена к образцам: Каждому разведенному образцу сыворотки добавляют определенное количество антигена. 5. Инкубация: Образцы инкубируют при определенной температуре и времени, чтобы произошло взаимодействие между антителами в сыворотке и антигенами. 6. Добавление реагента, способного образовывать видимые агрегаты: В зависимости от метода могут использоваться различные реагенты, которые образуют агрегаты или осажденные комплексы, указывающие на наличие антител. 7. Оценка результатов: Результаты оцениваются визуально или с использованием специального оборудования. Обычно регистрируются титры антител в зависимости от последнего разведения, при котором наблюдается видимая реакция. 3.тест 1. Что представляет собой реакция непрямой гемагглютинации (РНГА)? A) Метод определения антител в крови B) Метод определения антигенов в крови C) Метод определения антител, связанных с антигенами, через их взаимодействие с эритроцитами D) Метод определения антител, связанных с антигенами, через их взаимодействие с белками крови 2. Какие антитела обычно используются в РНГА? A) Антитела к конкретным бактериям B) Антитела, связанные с антигенами C) Антитела, не связанные с антигенами D) Антитела к эритроцитам 3. Каким образом осуществляется обнаружение антител в РНГА? A) Через взаимодействие антител с антигенами в крови B) Через образование агрегатов эритроцитов C) Через образование агрегатов антител D) Через образование осажденных комплексов 4. Какой основной результат наблюдается в РНГА? A) Образование агрегатов эритроцитов B) Образование агрегатов антител C) Образование осажденных комплексов D) Образование осажденных комплексов и агрегатов эритроцитов 5. Какие вещества добавляются в РНГА для образования агрегатов эритроцитов? A) Антитела B) Антигены C) Реагенты, способные образовывать видимые агрегаты D) Буферный раствор 6. Что является конечным результатом РНГА? A) Образование агрегатов эритроцитов, вызванное связыванием антител-антигенов B) Образование осажденных комплексов C) Образование агрегатов антител D) Образование агрегатов эритроцитов, вызванное действием антигенов 7. Как оцениваются результаты РНГА? A) Визуально по наличию или отсутствию агрегатов эритроцитов B) Путем измерения концентрации антител C) Путем сравнения цвета образцов D) Путем обнаружения осажденных комплексов 8. Какие компоненты участвуют в реакции непрямой гемагглютинации? A) Антитела B) Антигены C) Эритроциты D) Все вышеперечисленное 9. Для чего часто применяется реакция непрямой гемагглютинации? A) Для обнаружения и определения антител к различным инфекциям, таким как вирусы и бактерии B) Для определения концентрации антигенов в крови C) Для определения концентрации антител в крови D) Для обнаружения и определения антигенов в крови 10. Какие реагенты могут использоваться для образования видимых агрегатов в РНГА? A) Антитела B) Антигены C) Реагенты, способные образовывать видимые агрегаты D) Все вышеперечисленное Правильные ответы: 1. C) Метод определения антител, связанных с антигенами, через их взаимодействие с эритроцитами 2. B) Антитела, связанные с антигенами 3. A) Через образование агрегатов эритроцитов 4. A) Образование агрегатов эритроцитов 5. C) Реагенты, способные образовывать видимые агрегаты 6. A) Образование агрегатов эритроцитов, вызванное связыванием антител-антигенов 7. A) Визуально по наличию или отсутствию агрегатов эритроцитов 8. D) Все вышеперечисленное 9. A) Для обнаружения и определения антител к различным инфекциям, таким как вирусы и бактерии 10. C) Реагенты, способные образовывать видимые агрегаты 4. Кроссворд 9 1 5 6 4 8 12 2 3 7 11 10 13 По горизонтали: По вертикали: 1. обнаружение 5. реагент 2. гемагглютинация 7. инкубация 3. взаимодействие 8. агрегаты 4. антигены 9. непрямая 6. реакция 11. сыворотка 10. разведение 12. антитела 13. эритроциты По горизонтали вопросы: 1. Что является основной целью тестов на определение титра антител в сыворотке крови? 2. Какой процесс обуславливает образование агрегатов эритроцитов в гемагглютинационных реакциях? 3. Какой тип взаимодействия происходит между антителами и антигенами в иммунологических реакциях? 4. Какие молекулы вызывают иммунный ответ в организме, стимулируя образование антител? 5. Как называется химическая реакция, происходящая между антителами и антигенами в иммунологических тестах? 6. Какой процесс предполагает последовательное уменьшение концентрации раствора или образца? 7. Какие клетки крови играют важную роль в гемагглютинационных реакциях, связанных с образованием агрегатов? По вертикали вопросы 1.Что представляет собой химическое вещество или соединение, используемое для проведения реакций или определения химических свойств других веществ? 2.Как называется процесс поддержания определенной температуры и времени в химической или биологической реакции для стимуляции определенных процессов? 3.Как называются образовавшиеся группы частиц, объединенных в единое целое, например, в контексте гемагглютинационных реакций? 4.Как называется реакция, в которой обнаруживаются антитела, связанные с антигенами через их взаимодействие с некоторыми частицами, например, с вирусами или бактериями? 5.Какая биологическая жидкость используется для определения наличия антител или антигенов в организме? 6.Какие белковые структуры организма играют ключевую роль в иммунной системе и образуются в ответ на воздействие антигенов? 10.2Таблица Использова ние в Наименование Аббревиат Учет вирусологи реакции ура Достоинства Недостатки Компоненты реакции и Реакция Высокая Требует Флуоресцент Визуализация Обнаружени иммунофлуоресце чувствительно флуоресцентны но-меченые под е нции РИФ сть и й микроскоп и антитела микроскопом специфичес Наименование реакции Аббревиат ура Достоинства Недостатки Компоненты Учет реакции специфичност специализирова ь, нные красители визуализация на клеточном уровне Использова ние в вирусологи и ких антигенов вирусов в клетках и тканях Иммуноферментн ый анализ ИФА Высокая чувствительно сть и специфичност ь, подходит для массовых исследований Требуется специальное оборудование и реагенты Реакция диффузионной преципитации Простота и низкая стоимость Низкая чувствительнос Антигены, ть и антитела в специфичность геле Возможность количественн ой оценки, не требует специфическо го оборудования Определени е титров Ограничена Оценка по антител вирусами, наличию или против способными к Вирусы, отсутствию вирусов, гемагглютинаци эритроциты, гемагглютина включая и сыворотка ции грипп Высокая специфичност ь, позволяет оценить функциональн ую активность антител Определени е защитного иммунитета против вирусных инфекций, включая Отсутствие оценку цитопатическ эффективно ого эффекта сти вакцин РДП Реакция торможения гемагглютинации РТГА Реакция нейтрализации Полимеразная цепная реакция РН ПЦР Реакция непрямой гемагглютинации РНГ Высокая чувствительно сть и специфичност ь, быстрое получение результатов Чувствительн ость: РНГА является чувствительн ым методом обнаружения антител, что позволяет раннюю диагностику инфекционны Требует культуру клеток и длительное время для анализа Возможность контаминации, требует точного соблюдения протоколов Времязатратнос ть: РНГА может потребовать длительного времени для проведения, особенно при наличии необходимости в инкубации. Антигены, антитела, ферменты, субстраты Вирус, клеточные культуры, сыворотка Термоустойч ивая ДНКполимераза, праймеры, dNTPs, матричная ДНК Сыворотка крови: Содержит антитела, которые будут реагировать с антигенами. Антигены: Специфическ ие частицы, Диагностика вирусных Количествен инфекций, ная оценка по определение оптической титров плотности антител Визуальная оценка преципитаци и Амплификац ия специфическ их участков ДНК Визуальная оценка: Оценка результатов РНГА может осуществлять ся визуально, путем наблюдения наличия Идентифика ция и типировани е вирусов Обнаружени еи идентифика ция вирусной ДНК, мониторинг вирусных нагрузок Диагностика вирусных инфекций: РНГА широко применяется для диагностики различных вирусных инфекций, Наименование реакции Аббревиат ура Достоинства х заболеваний. Относительна я простота: Процедура РНГА не требует сложных оборудования и может быть выполнена в лабораторных условиях. Высокая специфичност ь: Метод обладает высокой специфичност ью, что означает меньшую вероятность ложноположительны х результатов. Недостатки Компоненты Возможность ошибок: Неопытность или ошибки в технике могут привести к неверным результатам. Требование к специалисту: Для правильной интерпретации результатов требуется опытный специалист. которые связываются с антителами в сыворотке. Эритроциты: Клетки крови, которые используютс я для образования агрегатов в результате взаимодейств ия антител и антигенов. Учет реакции агрегатов эритроцитов. Использован ие стандартов: Для определения титра антител можно использовать стандартные образцы с известной концентрацие й. Использова ние в вирусологи и таких как вирус гриппа, вирус ВИЧ, вирус гепатита и другие. Исследован ие иммунного ответа: РНГА также используетс я для изучения иммунного ответа организма на вирусные инфекции и оценки эффективно сти вакцинации.