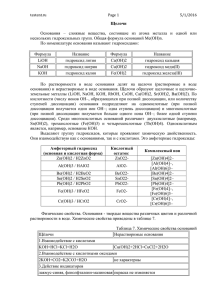
ЛАБОРАТОРНАЯ РАБОТА №2. «ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ГИДРОКСИДЫ (ОСНОВНЫЕ, АМФОТЕРНЫЕ, КИСЛОТНЫЕ)» Опыт. Получение гидроксидов никеля (II), цинка и кремния. Исследование их кислотно основных свойств. Ход работы: • В двух пробирках получить гидроксид никеля (ΙΙ). Для этого налить в каждую из них 1 мл раствора соли никеля (NiSO4) и добавить по каплям раствор щелочи (NaOH) до образования осадка. • В одну из пробирок с осадком гидроксида никеля (ΙΙ) добавить избыток раствора серной кислоты (H2SO4), в другую – избыток 10–40%-го раствора гидроксида натрия (NaOH). • В двух других пробирках аналогичным способом получить гидроксид цинка. • В одну из пробирок с осадком гидроксида цинка добавить избыток раствора серной кислоты (H2SO4), в другую – избыток 10– 40%-го раствора гидроксида натрия (NaOH). Вещество Гидроксид никеля (II) Гидроксид цинка Гидроксид кремния Результаты и наблюдения Отношение к Кислотноосновные реагентам (растворяется, свойства Формула не растворяется) Кислота Щелочь Обработка результатов и выводы: • Уравнения реакций получения гидроксидов в молекулярном и ионном виде. Нерастворимые вещества отметить (↓). Указать цвет осадка. NiSO4 + NaOH = ZnSO4 + NaOH= • Уравнения наблюдаемых реакций взаимодействия полученных гидроксидов с растворами кислот и щелочи (в молекулярном и ионном виде): Ni(OH)2 + H2SO4 = Ni(OH)2 + NaOH = Zn(OH)2 + H2SO4 = Zn(OH)2 + NaOH = Выводы • Нерастворимые гидроксиды получают охарактеризовать способ получения _______________________________ __________________________________________________________________ _______________________________________________________________ • Гидроксид никеля (II) проявляет _______________________ свойства; гидроксид цинка – __________________________ свойства; гидроксид кремния – ________________________ свойства. • Написать уравнения диссоциации Ni(OH)2, H2SiO3 и Zn(OH)2 и математические выражения для констант диссоциации указанных соединений: Ni(OH)2 K1 = K2 = Диссоциация Zn(OH)2 по основному типу: K1 = K2 = по кислотному типу: K1 = K2 =