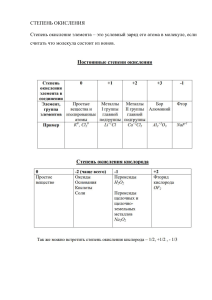
УРОК 6. СТЕПЕНЬ ОКИСЛЕНИЯ Тема, которую надо обязательно понять и научиться определять степени окисления. На уроке рассказываю - что такое степень окисления, - чем она отличается от валентности - откуда берётся - как образуется + и - - о постоянной и переменной степени окисления - как определять Степень окисление элемента – это условный заряд его атома в молекуле, если считать что молекула состоит из ионов. Ваша задача: - запомнить постоянные степени окисления (смотри файл) - многое совпадает с валентностью. - научиться определять степень окисления - отработать этот навык ДЗ Определить степень окисления всех атомов в веществах Р2О3, K2SiO3, CuS, N2O5, Na2SO4, K2FeO4, Ba(NO3)2, FeBr2, Са(ОН)2 (в гидроксидах нет исключения по степени окисления) Небольшое дополнение. Принято , что атом с отрицательной степенью окисления стоит справа, с положительной – слева. Но есть ИСКЛЮЧЕНИЯ эти вещества исторически принято записывать наоборот: NH3 - аммиак, здесь нет никаких исключений и водород +1, а азот -3. просто запись условно "неправильная" Точно так же СН4 - метан РН3 - фосфан (фисфин) ОН - гидроксильная группа , у кислорода -2, у водорода +1, но пишут сначала кислород, потом водород определите степени окисления в этих веществах тоже. Обратите внимание на азот - в степени окисления у него нет никаких исключений (у него только валентность!). В файлах вы найдёте удобные таблицы по степени окисления. Постоянная, которые надо запомнить (но они совпадают с валентностью величиной и понятны из строения атома) И обратите внимание на степень окисления кислорода и водорода.