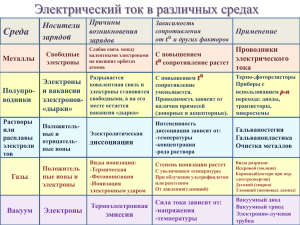
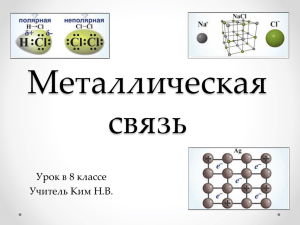
Взаимодействие атомов элементов-металлов между собой Мы уже знаем, как взаимодействуют между собой атомы элементов-металлов и элементов-неметаллов, а также атомы элементов-неметаллов между собой. Теперь познакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в форме слитка, куска или металлического изделия. Что же удерживает атомы металла в этом едином объёме? Давайте вспомним особенности строения атомов металлов: атомы большинства металлов на внешнем уровне содержат 1, 2, 3 электрона, которые они легко отдают при образовании связи. Но возникает вопрос, кому атомы металлов отдают электроны, если рядом нет атомов неметаллов, которые могли бы их принять? В слитке металлического изделия атомы металлов отдают свои внешние электроны в этот слиток, в общее пространство, превращаясь при этом в положительные ионы. Отданные электроны перемещаются от одного иона к другому, связывая их в единое целое. Ионы, принимая электроны, вновь превращаются в атомы, затем электроны вновь отрываются от атомов и так до бесконечности, этот процесс протекает непрерывно. В куске металла постоянно существуют атомы, ионы (положительно заряженные) и свободные электроны. Где какие электроны, разобрать невозможно, они все общие, поэтому их называют обобществлённые. Рис. 1. Образование металлической связи Таким образом, получается, что в атомах металлов возникает металлическая химическая связь. Металлическая связь, механизм её образования Металлическая связь — связь в металлах между атомами и ионами, образованная за счёт обобществления электронов. Схему образования металлической связи можно записать следующим образом: Me0 - ne- ⇆ Me�+. Металлическая связь имеет некоторое сходство с ковалентной связью, так как основана на обобществлении внешних электронов. Однако при образовании ковалентной связи обобществляются внешние неспаренные электроны только двух соседних атомов, а при образовании металлической связи в обобществлении этих электронов участвуют все атомы. Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твёрдом и жидком состоянии. Рис. 2. Сплавы металлов: а — сталь (на основе Fe и C); б — бронза (Cu, Pb, Sn); в — латунь (Cu, Zn) Пары металлов состоят из отдельных молекул (одноатомных и двухатомных). Атомы металлов связаны между собой ковалентной связью. Например, парами натрия заполнены лампы жёлтого цвета для уличных фонарей. Натрий в газообразном состоянии образует двухатомные молекулы. Свойства веществ, образованных металлической связью Металлическая связь обуславливает основные свойства металлов: 1. Металлический блеск — свет поглощается металлом, электроны начинают испускать свои волны излучения (лучше других отражают свет Ag, Cu, Al, Pd, Hg). 2. Ковкость и пластичность — свойство металлов, характеризующее их способность к обработке деформированием: ковкой, вальцеванием, штамповкой без разрушения, электроны смягчают перемещение ионов под внешним воздействием (самыми пластичными являются Au, Ag, Cu). 3. Тепло- и электропроводность — электроны движутся в объёме металла беспорядочно. Но даже небольшой разности потенциалов достаточно, чтобы электроны начали двигаться упорядоченно (лучшими проводниками тока являются Ag, Cu, Au, Al). Контрольные вопросы 1. 2. 3. 4. Что такое металлическая связь? Какие частицы участвуют в её образовании? Для каких веществ характерна металлическая связь? Как образуется металлическая связь? Какими свойствами обладают вещества с металлической химической связью?