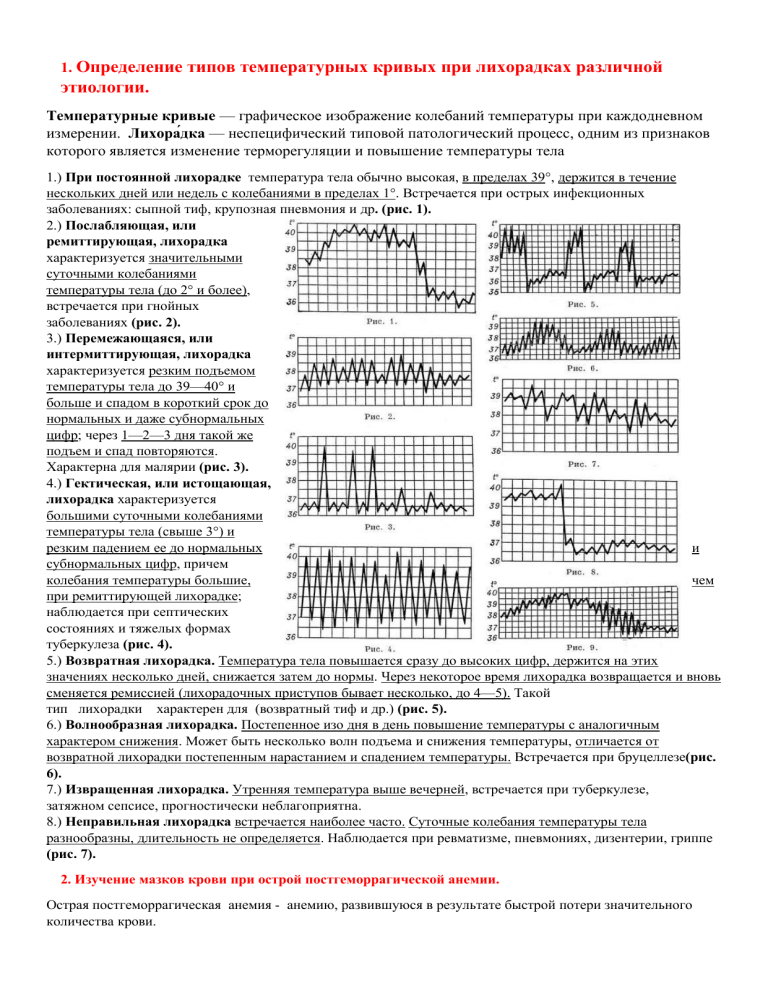
1. Определение типов температурных кривых при лихорадках различной этиологии. Температурные кривые — графическое изображение колебаний температуры при каждодневном измерении. Лихора́дка — неспецифический типовой патологический процесс, одним из признаков которого является изменение терморегуляции и повышение температуры тела 1.) При постоянной лихорадке температура тела обычно высокая, в пределах 39°, держится в течение нескольких дней или недель с колебаниями в пределах 1°. Встречается при острых инфекционных заболеваниях: сыпной тиф, крупозная пневмония и др. (рис. 1). 2.) Послабляющая, или ремиттирующая, лихорадка характеризуется значительными суточными колебаниями температуры тела (до 2° и более), встречается при гнойных заболеваниях (рис. 2). 3.) Перемежающаяся, или интермиттирующая, лихорадка характеризуется резким подъемом температуры тела до 39—40° и больше и спадом в короткий срок до нормальных и даже субнормальных цифр; через 1—2—3 дня такой же подъем и спад повторяются. Характерна для малярии (рис. 3). 4.) Гектическая, или истощающая, лихорадка характеризуется большими суточными колебаниями температуры тела (свыше 3°) и резким падением ее до нормальных и субнормальных цифр, причем колебания температуры большие, чем при ремиттирующей лихорадке; наблюдается при септических состояниях и тяжелых формах туберкулеза (рис. 4). 5.) Возвратная лихорадка. Температура тела повышается сразу до высоких цифр, держится на этих значениях несколько дней, снижается затем до нормы. Через некоторое время лихорадка возвращается и вновь сменяется ремиссией (лихорадочных приступов бывает несколько, до 4—5). Такой тип лихорадки характерен для (возвратный тиф и др.) (рис. 5). 6.) Волнообразная лихорадка. Постепенное изо дня в день повышение температуры с аналогичным характером снижения. Может быть несколько волн подъема и снижения температуры, отличается от возвратной лихорадки постепенным нарастанием и спадением температуры. Встречается при бруцеллезе(рис. 6). 7.) Извращенная лихорадка. Утренняя температура выше вечерней, встречается при туберкулезе, затяжном сепсисе, прогностически неблагоприятна. 8.) Неправильная лихорадка встречается наиболее часто. Суточные колебания температуры тела разнообразны, длительность не определяется. Наблюдается при ревматизме, пневмониях, дизентерии, гриппе (рис. 7). 2. Изучение мазков крови при острой постгеморрагической анемии. Острая постгеморрагическая анемия - анемию, развившуюся в результате быстрой потери значительного количества крови. Для острых постгеморрагических анемий выделяют следующие стадии: В первые часы и сутки в организме отмечается равномерное снижение ФЭК и плазмы. Развивается простая гиповолемия, поэтому лабораторные тесты периферической в пределах нормы. Рефлекторная стадия сопровождается спазмом периферических сосудов за счет активации симпатического отдела ВНС и активации гормонов гипоталамогипофизарно-надпочечниковой системы. Происходит перераспределение крови по органам и системам. Гидремическая стадия. защитных реакций начинает развиваться через 2-3 ч. Объем крови восстанавливается за счет тканевой жидкости, регистрируется олигоцитемическая гипо- или нормоволемия, отмечается снижение осмотической резистентности эритроцитов. Возможен гемолиз эритроцитов. Регенераторная стадия защиты на кровопотерю развивается на 4-5 день после остановки кровотечения. Усиление эритропоэза обусловлено увеличением выработки эритропоэтинов, гипоксией и стимуляцией продуктами распада эритроцитов. На 5-8 день умеренный лейкоцитоз (до 12,0-20,0х109 /л) С кровью теряются незаменимые компоненты эритроцитов и, прежде всего — железо. Поэтому с течением времени формируется отрицательный баланс железа, его дефицит, а за тем — и особая разновидность железодефицитной анемии — хроническая постгеморрагическая. Для мазка крови больного острой постгеморрагической анемией характерен нормобластический тип кроветворения, регенеративный сдвиг с появлением полихрмотофильных эритроцитов, ретикулоцитов и нормоцитов Мазок крови больного с хронической постгеморрагической анемией характеризуется нормобластическим типом кроветворения, гипохромией, признаками дегенеративного сдвига: анизоцитозом и пойкилоцитозом. 3. Мазок крови при B12-фолиеводифецитной анемии. B12-фолиеводифецитная анемия – это анемия, возникшая вследствие дефицита витамина В12 и фолиевой кислоты, также она может быть обусловлена дефицитом С, наследственным дефицитом некоторых ферментов, гельминтозом и др. Снижается число ретикулоцитов. Цветовой показатель повышается, резко выраженная гиперхромная анемия. Так же картина крови характеризуется нейтропенией, относительным лимфоцитозом, тромбоцитопенией. Классическая разновидность такой анемии – анемия при болезни Аддисона-Бирмена. Здесь происходит нарушение процесса кроветворения, атрофические изменения слизистой ЖКТ, нарушения со стороны нервной системы-неврологический синдром. Для B12 и фолиеводефицитных анемий характерны следующие гематологические проявления: 1) 2) 3) 4) (гиперхромная анемия); количество ретикулоцитов может быть снижено, но может быть и в норме; наличие в крови мегалобластов; эритроциты увеличены, в мазках крови обнаруживается макроциты, мегалоциты, пойкилоциты, анизоцитоз; 4. Мазок крови при гемолитической анемии. Гемолитическая анемия- анемия развившаяся вследствие ускоренной гибели эритроцитов в результате нарушения их целостности. Приобретенная гемолитическая анемия по типу кроветворения – эритробластическая, по степени регенерации костного мозга – регенераторная, по цветовому показателю – гипо или нормохромная. Мазок крови больного гемолитической анемией характеризуется нормобластичким типом кроветворения: гипо-, изо- или гиперхромией. Признаки дегенеративного сдвига: анизоцитоз, пойкилоцитоз. Признаки регенеративного сдвига: нормоциты оксифильные, полихроматофильные, базофильные и ретикулоциты. Так же может быть повышено содержание билирубина.заправить сетку камеры Горяева. Подсчет эритроцитов произвести в 5 расчерченных больших квадратах по диагонали с использованием формулы: Э=а*4000* 200 /80 где а — количество эритроцитов в пяти больших квадратах; 4000 — количество малых квадратов, объем которых составляет 1 мм3 200 — степень разведения крови; 80 — количество сосчитанных малых Картина крови Содержание гемоглобина 90-100 г/л, в период криза снижается до 40-50 г/л, особенно у маленьких детей. Количество микросфероцитов при наследственном микросфероцитозе бывает различным. У некоторых больных большинство эритроцитов - микросфероциты; у них обычно есть выраженные признаки повышенного гемолиза. Количество лейкоцитов при микросфероцитозе чаще нормальное, в период кризов наблюдается лейкоцитоз, иногда с выраженным нейтрофильным сдвигом. Как правило, наблюдается раздражение красного ростка костного мозга. По этиологии ГА: острые и хронические. При острой гемолитической анемии происходит массированная убыль эритрона. Особенностью острой гемолитической анемии служит комбинация симптомов ускоренного гемолиза (внутриклеточного, внутрисосудистого, либо смешанного); гиперкалиемия, системное действие медиаторов воспаления. Хронические гемолитические анемии не сопровождаются подобными симптомами острого гемолиза, но проявления ускорения гемолиза и стимуляции эритропоэза присутствуют. Главным в патогенезе гемолитических анемий является внутрисосудистый или внутриклеточный гемолиз эритроцитов. 5. Подсчет количества ретикулоцитов крови при анемиях. Ретикулоциты – это молодые эритроциты, в цитоплазме которых еще содержатся остатки митохондрий, рибосомы; и выявляется при суправитальном окрашивании (бриллиантовым кризиловым голубым и т.д). Выйдя из костного мозга в периферическую кровь, ретикулоциты в течение 24 часов теряют указанные компоненты и становятся зрелыми эритроцитами. Содержание гемоглобина в ретикулоцитах, продолжающих его синтез, в среднем, меньше на 17 %, чем в зрелых. При усилении эритропоэза содержание ретикулоцитов в периферической крови увеличивается. Отсутствие увеличения ретикулоцитов или полное отсутствие их в крови при анемии свидетельствуют об угнетении или прекращении эритропоэза. Количество 0,2-1,2% Существует несколько способов подсчета ретикулоцитов: 1. Подсчет количества ретикулоцитов в мазке после окраски их специальными красителями. Принцип метода основан на выявлении субстанции ретикулоцитов при суправитальной окраске щелочными красками (насыщенный раствор бриллиантового крезилового синего в абсолютном спирте) с дальнейшим подсчетом их в мазке крови. Окраску ретикулоцитов проводят либо на стекле, либо в пробирке. Подсчет осуществляют с помощью микроскопа: приготовленные мазки микроскопируют с иммерсионным объективом; в мазке ретикулоциты и эритроциты окрашены в желтовато-зеленоватый цвет, зернисто-нитчатая субстанция в ретикулоцитах – в синий (при окраске бриллиантовым крезиловым синим. 2.Подсчет количества ретикулоцитов при помощи люминесцентной микроскопии. Принцип подсчета количества ретикулоцитов при помощи люминесцентной микроскопии основан на использовании способности субстанции ретикулоцитов флюоресцировать после обработки крови акридиновым оранжевым. Кровь смешивают с акридиновым оранжевым в пробирке в соотношении 1 часть крови и 10 частей краски (смесь можно хранить не более 5 часов). Смесь перемешивают в течение 2 минут, каплю смеси наносят на предметное стекло и накрывают покровным стеклом. При этом жидкость не должна выходить за пределы покровного стекла. Микроскопируют с помощью светофильтра. В препарате эритроциты имеют темно-зеленые очертания и не флюоресцируют, а в ретикулоцитах зернисто-сетчатая субстанция светится ярко-красным цветом. 6. Определение количества гемоглобина при анемиях. Гемоглобин (Hb) – является основным компонентом эритроцитов и составляет 35 % от их общей массы. Это сложный белок, состоящий из гема (небелковая часть, комплекс железа с протопорфирином) и глобина, белкового компонента. Основные функции гемоглобина: 1. 2. 3. переносить кислород от легких к тканям; выводить углекислый газ из организма; регулировать кислотно-основное состояние В литре крови взрослого мужчины содержится от 4 до 5,1*1012 эритроцитов и 132-164 г/л гемоглобина; у женщин - 3,7-4,7*1012 /л и 115-145 г/л гемоглобина, у детей 4,0-5,5*1012 /л, новорожденные 4.5-7.0*1012 /л и гемоглобина 180- 240г/л. Определение уровня гемоглобина крови по методу Сали основан на превращении гемоглобина при прибавлении к крови хлористоводородной кислоты в хлоргемин коричневого цвета. Раствор хлорида гематита разводят водой до цвета стандарта, соответствующего известной концентрации гемоглобина. Определение уровня гемоглобина проводят в упрощенном колориметре —гемометре Сали. Этот прибор состоит из пластмассового штатива с 3 вертикальными гнездами. В боковых гнездах находятся 2 пробирки со стандартной жидкостью. В среднее гнездо гемометра вставляют открытую сверху стеклянную пробирку. Градуированная пробирка имеет шкалу с делениями, показывающую количество грамм-процентах (г%). При геометре имеются специальная пипетка для воды и стеклянная палочка для перемешивания. В градуированную пробирку наливают до нижней круговой метки 0,1 грамм-процента раствора хлористоводородной кислоты. Затем набирают кровь в капиллярную пипетку до метки «0,02 миллилитра». Обтерев кончик пипетки снаружи ватой, опускают ее в пробирку с 0,1 грамм-процента раствором хлористоводородной кислоты и осторожно выдувают кровь. Пробирку несколько раз встряхивают, ставят в штатив. Для полного превращения гемоглобина в хлорид гематита требуется не менее 5 минут. Через 5 минут геометр поднимают до уровня глаз и сравнивают цвет испытуемой жидкости с цветом стандартов. Обычно, за исключением случаев крайне тяжелой анемии, он темнее, чем в стандартных пробирках. С помощью неградуированной пипетки к испытуемому раствору добавляют по каплям дистиллированную воду и сравнивают со стандартами. Как только цвет исследуемой жидкости станет одинаков с цветом стандартов, отмечают, какому делению шкалы соответствует уровень жидкости (по нижнему мениску) в пробирке. 7. Определение цветового показателя при анемиях. Цветовой показатель – это соотношение между количеством гемоглобина крови и числом эритроцитов. Цветовой показатель позволяет определить степень насыщения эритроцитов гемоглобином. Содержание гемоглобина в 1 эритроците в норме равно 33 · 10 -12 пиктограмм ЦП = (гемоглобин (г/л) * 3) / первые 3 цифры количества эритроцитов в крови Например, гемоглобин 134 г/л, эритроциты 4,26 млн/мкл, тогда цветовой показатель равен (134 * 3) / 426 = 0,94. Цветовой показатель в норме 0,85-1,05. При повышении цветового показателя говорят о гиперхромии эритроцитов, и при снижении — о гипохромии. В12-дефицитная анемия, фолиеводефицитная анемия принадлежит к гиперхромным, а железодефицитная и хроническая постгеморрагическая к гипохромным. Величину 33 пиктограмм (пиктограмм — 1х10—12), составляющую норму содержания гемоглобина в одном эритроците, условно принимают за 1 и обозначают как цветовой показатель. 8. Изучение мазков крови при остром лейкозе. При выходе бластных клеток в кровь в лейкограмме определяется характерная для острого лейкоза картина: наличие молодых — бластных — клеток и зрелых гранулоцитов, моноцитов, лимфоцитов. В мазке крови отсутствуют промежуточные формы клеток-промиелоциты и миелоциты- что носит название - «Лейкемический провал». Так же в крови отмечаются лейкопения, анемия, тромбоцитопения. Во всех случаях повторно обнаруживаемой непонятной цитопении следует считать обязательным исследование пунктата костного мозга. Все подобные клетки при подсчете миелограммы или гемограммы могут быть отнесены к категории бластов лишь тогда, когда настоящие бласты составляют десятки процентов. Очень важно ориентироваться на содержание в мазке миелокариоцитов: например, при агранулоцитозе, могут преобладать молодые лимфоидные клетки с узкой цитоплазмой, иногда с нуклеолой (особенно — у детей), но с гомогенной структурой хроматина. Это — клетки-предшественники. Их следует причислять к категории лимфоидных клеток. Все лейкозы, как острые, так и хронические, происходят из одной клетки, подвергшейся мутации. Мутации подвергаются: протоонкогены; гены-супрессоры клеточного деления; гены, кодирующие клеточные эндонуклеазы; гены, кодирующие апоптоз клетки. Патогенез лейкоза этот процесс представляет серию мутационных событий. Первичный лейкозный клон обладает генетической нестабильностью. Поэтому подвержен опухолевой прогрессии. Таким образом, возникают дополнительные опухолевые субклоны. Первичный лейкозный клон какое-то время сосуществует с нормальным клоном, однако, обладая преимуществом в росте, опухолевый клон приводит к сокращению объема нормального кроветворения, что проявляется анемией, тромбоцитопенией. Накопление лейкозной массы сопровождается развитием недостаточности костномозгового кроветворения. Клиника Картина острого лейкоза складывается из четырех основных синдромов: анемии, тромбоцитопении; расселения лейкозных клеток по костному мозгу и селезенке, печени, лимфоузлам и паренхиматозным органам; геморрагического синдрома; интоксикационного синдрома. Причины смерти при остром лейкозе: Прогрессирование лейкоза. Инфекционные осложнения (пневмонии, сепсис, грамотрицательная флора) Геморрагические осложнения (кровоизлияния в мозг). Печеночная недостаточность. 9. Изучение мазка крови при хроническом миелолейкозе. Хронический миелолейкоз – форма лейкоза, которая характеризуется ускоренной и нерегулируемой пролиферацией преимущественно миелоидных клеток в костном мозге с их накоплением в крови. Картина крови в момент исследования: умеренная анемия нормо- или слегка гиперхромного типа; лейкоцитоз с бластами в крови; Для хронического миелолейкоза характерно стадийное течение. 1. При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния. 2. Во второй фазе – фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения. 3. Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток. 10. Изучение мазка крови при хроническом лимфолейкозе. В крови при лейкемической форме заболевания количество лейкоцитов доходит до 300-10 в 9 степени/л крови и более; 80 95% клеток белой крови составляют лимфоциты, преимущественно зрелые. Можно отметить некоторые особенности в строении их ядра и цитоплазмы: клетки нежные, при изготовлении мазка легко распадаются, образуя характерные «тени Боткина - Гумпрехта». В небольшом количестве встречаются молодые клетки - пролимфоциты и лимфобласты. Нормохромная анемия наблюдается у половины больных, часто отмечается тромбоцитопения. Больные страдают от аутоиммунной гемолитической анемии, которая является основной причиной смерти. Методика подсчета в камере Принцип метода подсчета лейкоцитов аналогичен принципу подсчета эритроцитов. Оборудование и реактивы: 1. Пробирки для подсчета лейкоцитов. 2. 3 %-ный раствор уксусной кислоты, к которому прибавлено несколько капель метилвиолета 3. Счетная камера. 4. Микроскоп. Смеситель для лейкоцитов отличается от смесителя для эритроцитов тем, что имеет более широкий просвет капилляра и меньший по величине резервуар. На смесителе нанесены 3 метки: 0,5, 1,0 и 11. Это позволяет развести кровь в 10 либо в 20 раз (чаще разводят в 20 раз). Ход исследования. При работе со смесителями кровь набирают до метки 0,5, затем разводят 3 %-ным раствором уксусной кислоты до метки 11. Встряхивают в течение 3 мин, после чего сливают 1-2 капли и заполняют счетную камеру. При работе с пробирками для подсчета лейкоцитов наливают 0,4 мл 3 %ного раствора уксусной кислоты и в нее выпускают 0,02 мл крови, отмеренной пипеткой от гемометра Сали. Затем в жидкость опускают пипетку и, набрав содержимое, заполняют счетную камеру. Так как лейкоцитов гораздо меньше, чем эритроцитов, то для большей точности подсчет производят в 100 больших квадратах. Обычно в одном большом квадрате находится 1-2 лейкоцита. Число лейкоцитов в 1 мкл крови рассчитывается по формуле: X = (А х 4000 х В)/Б, где X — количество лейкоцитов в 1 мкл крови; А — количество лейкоцитов, сосчитанных в 1600 малых квадратах; Б — количество сосчитанных малых квадратов (1600); 4000 — величина, умножая на которую мы получаем количество клеток в 1 мкл. 11. Подсчет количества лейкоцитов и лейкоцитарной формулы при воспалении. Лейкоциты в зависимости по плотности распределяются в мазках неравномерно: нейтрофилы, базофилы, эозинофилы – по перефирии, моноциты и лимфоциты – ближе к середине. При подсчете лейкоцитов используют Методы Шиллинга или Филиппченко. По Шиллингу определяют количество лейкоцитов в четырех участках мазка(четырехпольный метод). Всего в мазке подсчитывают 100-200 клеток. Метод Филиппченко состоит в том, что мазок мысленно делят на 3 части: начальную, среднюю и конечную(трехпольный метод). Подсчеты ведут по прямой линии поперек мазка от одного его края к другому. В каждой части подсчитывают одинаковое число клеток. Всего учитывают 100-200 лейкоцитов. ПОДСЧЕТ КОЛИЧЕСТВА ЛЕЙКОЦИТОВ Методика подсчета в камере Принцип метода подсчета лейкоцитов аналогичен принципу подсчета эритроцитов, суть его состоит в точном отмеривании крови и разведении ее в определенном объеме жидкости с последующим подсчетом клеточных элементов в счетной камере и пересчете полученного результата на 1 мл крови. Оборудование и реактивы: 1. Смесители или пробирки для подсчета лейкоцитов. 2. 3 %-ный раствор уксусной кислоты, к которому прибавлено несколько капель метилвиолета или метиленовой синьки. 3. Счетная камера. 4. Микроскоп. Смеситель для лейкоцитов отличается от смесителя для эритроцитов тем, что имеет более широкий просвет капилляра и меньший по величине резервуар. На смесителе нанесены 3 метки: 0,5, 1,0 и 11. Это позволяет развести кровь в 10 либо в 20 раз (чаще разводят в 20 раз). Ход исследования. Техника взятия венозной крови у крысы. Под нембуталовым наркозом (30 мг/кг) у крысы вызвать острую кровопотерю (15% от объема циркулирующей крови). Затем для подсчета количества лейкоцитов взять 0,1 мл венозной крови и поместить на часовое стекло, предварительно обработанное раствором гепарина (250 Ед. на 1 мл физиологического раствора). Для подсчета количества лейкоцитов из капли крови, помещенной на часовое стекло, ровным столбиком набрать 20 мкл крови и поместить в пробирку с 0,4 мл 3% раствора уксусной кислоты. Кровь осторожно выдуть в раствор кислоты и, не смешивая содержимое пробирки, в верхнем слое раствора уксусной кислоты аккуратно промыть пипетку. После этой манипуляции содержимое пробирки перемешать между руками. Через 10-15 мин содержимое пробирки вновь тщательно перемешать, на стеклянной палочке каплю раствора лейкоцитов поместить под притертое стекло камеры Горяева. Через 3 минуты приступить к подсчету клеток. Л = а*4000*20/1600 в 1 мкл а – количество лейкоцитов, 1/4000 – объем одного малого квадрата 1600 – количество малых квадратов в 100 больших, 1/20 – степень разведения крови Полученную при подсчете цифру лейкоцитов перевести из внесистемной в системную величину, учитывя, что системной единицей объема является 1 литр. X = (А х 4000 х В)/Б, где X — количество лейкоцитов в 1 мкл крови; А — количество лейкоцитов, сосчитанных в 1600 малых квадратах; Б — количество сосчитанных малых квадратов (1600); В – степень разведения крови 4000 — величина, умножая на которую мы получаем количество клеток в 1 мкл. все лейкоциты - 100%, из них: базофилы 0-0.5% эозинофилы 1-5% нейтрофилы: - юные 0-1% - палочкоядерные 16% - сегментоядерные 60-65% лимфоциты 20-35% моноциты 2-8% 12. Определение ядерного сдвига нейтрофилов при различных заболеваниях. По этому признаку различают шесть видов нейтрофильного лейкоцитоза: 1) без ядерного сдвига - увеличение количества зрелых сегментоядерных нейтрофилов на фоне общего лейкоцитоза 2) с гипорегенеративным ядерным сдвигом влево - увеличение содержания палочкоядерных форм нейтрофилов (свыше 5%) на фоне нейтрофилии; характерен для легкого течения ряда инфекций и воспалений; 3) с регенеративным ядерным сдвигом влево - на фоне нейтрофилии и увеличенного содержания палочкоядерных форм обнаруживаются метамиелоциты; общее количество лейкоцитов, как правило, увеличено; характерен для гнойно-септических процессов; 4) с гиперрегенеративным ядерным сдвигом влево - характеризуется появлением в гемограмме еще более молодых форм лейкоцитов, при этом эозинофилы часто вообще отсутствуют ; 5) с дегенеративным ядерным сдвигом влево – повышение содержания палочкоядерных нейтрофилов сопровождается появлением значительного числа деструктивно измененных сегментоядерных форм 6) с дегенеративным ядерным сдвигом вправо - характеризуется появлением в гемограмме гиперсегментированных нейтрофилов; отмечается при лучевой болезни 13. Определение СОЭ при различных заболеваниях. По методу Панченкова В градуированный на 100 делений капилляр Панченкова набирают до метки «Р» 5%-ый раствор цитрата натрия (антикоагулянт) и переносят его на часовое стекло. Затем в тот же капилляр набирают дважды кровь до метки «К» и оба раза выдувают её на часовое стекло (достигается соотношение крови 4:1). Кровь, тщательно перемешанную с цитратом натрия, вновь набирают в капилляр до метки «К». Капилляр ставят в специальный штатив строго вертикально. СОЭ учитывают через 1 час, при необходимости через 24 часа и выражают в миллиметрах. По методу Вестергрена (в пробирке) Метод Вестергрена — это международный метод определения СОЭ. Он отличается от метода Панченкова характеристиками используемых пробирок и калибровкой шкалы результатов. Результаты, получаемые этим методом, в области нормальных значений совпадают с результатами, получаемыми методом Панченкова. Но метод Вестергрена более чувствителен к повышению СОЭ, и результаты в зоне повышенных значений СОЭ будут точнее результатов, получаемых методом Панченкова. Для выполнения определения СОЭ по методу Вестергрена необходима венозная кровь, взятая с цитратом натрия 3,8 % в соотношении 4:1. Также используется венозная кровь, взятая с ЭДТА (1,5 мг/мл) и затем разведённая цитратом натрия или физиологическим раствором в соотношении 4:1. Метод выполняется в специальных пробирках Вестергрена с просветом 2,4—2,5 мм и шкалой, градуированной в 200 мм. СОЭ считывают в мм за 1 час. 14. Определение гематокритной величины Гематокрит — это соотношение между объемом форменных элементов крови, в основном эритроцитов, и объемом плазмы. Метод определения гематокрита основан на разделении плазмы и эритроцитов с помощью центрифугирования. Определение производят в гематокритной трубке, представляющей собой стеклянную пипетку, разделенную на 100 равных частей. Перед взятием крови гематокритную трубку промывают раствором гепарина или щавелевокислых солей. Затем набирают в трубку капиллярную кровь до отметки «100», закрывают резиновым колпачком и центрифугируют в течение 1—1,5 часа при 1,5 тысячи оборотов в минуту. После этого отмечают, какую часть в градуированной трубке составляют эритроциты, это и есть гематокрит. Гематокритную величину определяют с помощью отсчетной шкалы, прилагаемой к центрифуге. В норме объем массы эритроцитов меньше объема плазмы. Увеличение гематокрита наблюдается при эритремии, повышении количества эритроцитов, и обезвоживании организма, уменьшение гематокрита наблюдают при анемиях. Методика: 1. Промыть гематокритный капилляр раствором гепарина. 2. Надеть мундштук на капилляр гематокрита. 3. Закрыть капилляр при помощи резинового уплотнителя с обеих сторон. 4. Поставить два капилляра в центрифугу. Центрифугировать при 3000 об/мин течение 10 мин. Запротоколировать результаты. На основании полученных данных сформулировать вывод. 15. Определение белка в лимфе и крови рефрактометрическим методом. Простым способом для определения белков сыворотки является рефрактометрический (преломляющий), основанный на свойстве сред различно преломлять проходящие через них лучи света. Для определения показателя (коэффициента) преломления имеются приборы-рефрактометры. Погружной рефрактометр Пульфриха состоит из зрительной трубы с окуляром и объективом и двумя призмами в конце. Имеется шкала с делениями для определения границы между освещенной и темной частью поля зрения и компенсатор, при вращении которого устанавливают резкую границу между освещенной и темной частью поля зрения. Для определения рефракции применяется баня со стеклом в стенке. В баню наливают воду, разбавляя по мере надобности теплой или холодной водой до требуемой температуры. Прибор снабжен точным термометром для поддержания постоянной определенной температуры (17,5°) воды в бане. Для направления луча света в приборе имеется специальное зеркало. Оборудование и исследуемый материал: 1. Рефрактометр 2. Фильтровальная бумага 3. Сыворотка и вода Расчёт. Определив показатель преломления по таблице, вычисляют процент содержания белка в испытуемой пробе (г/100 мл). Коэффициент пересчета в единицы СИ (г/л) равен 10. Примечания. Чувствительность метода невелика (0,5-1%). Клинико-диагностическое значение: повышение содержания белка в крови (гиперпротеинемия) наблюдается при венозном стазе, гипогидратации, гипериммуноглобулинемии; снижение уровня белка в крови (гипопротеинемия) ниже 60 г/л может быть связано с потерей белка (при гастроэнтеропатиях, ожогах, нефротическом синдроме) и снижением синтеза белка (при тяжелой белковой недостаточности, хронических заболеваниях печени). Норма (сыворотка) - 65-85 г/л. 16. Определение времени рекальцификации. Принцип. Цитратную плазму рекальцифицируют и измеряют время до наступления свертывания. Методика: В пробирку, находящуюся в водяной бане при температуре 37˚С, ввести 0,2 мл 0,227% раствора хлорида кальция и 0,1 мл 0,85 % раствора хлорида натрия. Через 1 мин добавить 0,1 мл испытываемой плазмы, немедленно включить секундомер и заметить время образования сгустка фибрина. Исследование повторяют 2-3 раза и вычисляют средний результат. Нормальные величины: 60-120 с. Оценка. В норме время рекальцификации колеблется в довольно значительных пределах — между 60 и 120 секундами. Только при однозначном удлинении времени кровотечения можно говорить о замедлении свертывания. Удлинение наблюдается при гемофилии, резких нарушениях функции печени, анафилактическом шоке. Укорочение имеет место после сильных кровопотерь. 17. Определение протромбинового времени. Протромбиновое время- это время образования сгустка после добавления в плазму тканевого фактора. Методика. В пробирку налить 0,1 мл испытуемой плазмы, 0,1 мл суспензии тромбопластина и погрузить в водяную баню при 37—38ºС. Через 1 мин туда же добавить 0,1 мл 0,277% раствора хлористого кальция, включить секундомер и отметить время образования сгустка. Исследование повторяют и вычисляют средний результат. Определение протромбинового времени — это определение времени от момента внесения плазмы крови до появления хлопьев фибрина. Протромбиновое время здорового кролика, определенное этим методом при разведении крови 1:4 (1 мл оксалата натрия — 4 мл крови), равно 12-20 с (в зависимости от активности тромбина) Референсные значения: 78 - 142%. 18. Определение осмотической резистентности эритроцитов. Осмотическая резистентность эритроцитов – это устойчивость эритроцитов гемолизу в гипотонических растворах NaCL. Осмотическая резистентность зависит от зрелости эритроцитов и объема плазмы крови. Min ОРЭ – соответствует такой концентрации NaCl (в %), при которой наблюдаются первые признаки гемолиза. Норма: 0,48-0,44% Max ОРЭ – соответствует такой концентрации эритроцитов (в %), при которой гемолизируются все эритроциты. Норма: 0,32-0,28% Методика: Схема постановки реакции и получения гипотонического раствора хлорида натрия. В каждую пробирку добавить по 2-3 капли крови. Определить через 1 час начало гемолиза. Объяснить механизм нарушения осмотической резистентности. Результаты: В пробирке №4 наблюдается наименьшая осмотическая резистентность (помутнение и начало гемолиза). В пробирке №5 наблюдается максимальная осмотическая резистентность (мутность отсутствует, гемолиз полный). Обсуждение результатов: Минимальная осмотическая резистентность определяется по гипотоническому раствору NaCl такой концентрации, при которой гибнут только наименее устойчивые эритроциты (в норме 0,44-0,46%) р-ра NaCl, а в 4 пробирке полученная концентрация =0,5. Максимальная осмотическая резистентность соответсвует р-ру NaCl, в котром полностью гемолизируются все эритроциты (в норме 0,32-0,28 р-ра NaCl). А в 5 пробирке полученная концентрация 0,4. Все значения превышают норму, это можно объяснить гидремической стадией ОПГА, когда в эритроциты поникает вода, снижается их осмотическая резистентность, что приводит к гемолизу. 19. Определение типов желудочной секреции. Одним из проявлений нарушения функции ЖКТ является изменение секреции. В зависимости от особенностей изменения секреторной функции желудка выделяют несколько ее типов: тормозной, возбудимый, инертный, астенический. Тормозной тип. Увеличенный латентный период секреции (между пищевой стимуляцией желудка и началом секреции), сниженная интенсивность нарастании и активности секреции, укороченная длительность секреции, уменьшенный объем секрета. При крайней степени торможения секреции развивается ахилия — практическое отсутствие желудочного сока. Возбудимый тип. Укороченный латентный период начала секреции, интенсивное нарастание секреции, увеличенная длительность процесса секреции, повышеный объём желудочного сока. Инертный тип. Увеличенный латентный период, замедленное нарастание секреции, увеличеный объём желудочного сока. Астенический тип. Укороченный латентный период начала сокоотделения, интенсивное начало и быстрое снижение секреции, малый объём желудочного сока. Хаотический тип. Характерно отсутствие каких-либо закономерностей динамики и объёмов секреции, периодов её активации и торможения в течение продолжительного времени (нескольких месяцев и лет). Общее количество сока, как правило, увеличено. 20. Определение патологических компонентов мочи. Методика: В каждой из четырех порций мочи последовательно определить содержание глюкозы, белка, кровяных и желчных пигментов. Определение глюкозы в моче. В пробирку налить 6-8 мл мочи, добавить 20 капель реактива Гайнеса, и содержимое поместить в водяную баню с кипящей водой. При наличии глюкозы в моче содержимое окрасится в желтый цвет. Определение белка в моче. В 2 пробирки налить по 3 мл мочи. В опытную пробирку добавить 6-8 капель 20% раствора сульфасалициловой кислоты. На темном фоне сравни-вают контрольную пробирку с опытной. При наличии белка в опытной пробирке появится помутнение. Определение крови и кровяных пигментов в моче. В пробирку налить 5 мл мочи и добавить несколько капель щелочи. Содержимое пробирки подвергнуть кипячению. При наличии крови и кровяных пигментов появится осадок грязно-белого цвета, постепенно приобретающий коричневую окраску. Полученные результаты внести в таблицу, объяснить общие возможные механизмы появления патологических примесей в моче. Составить план проведения дополнительных количественных лабораторных и клинических обследований для уточнения конкретных механизмов протеинурии, глю-козурии, гематурии.









