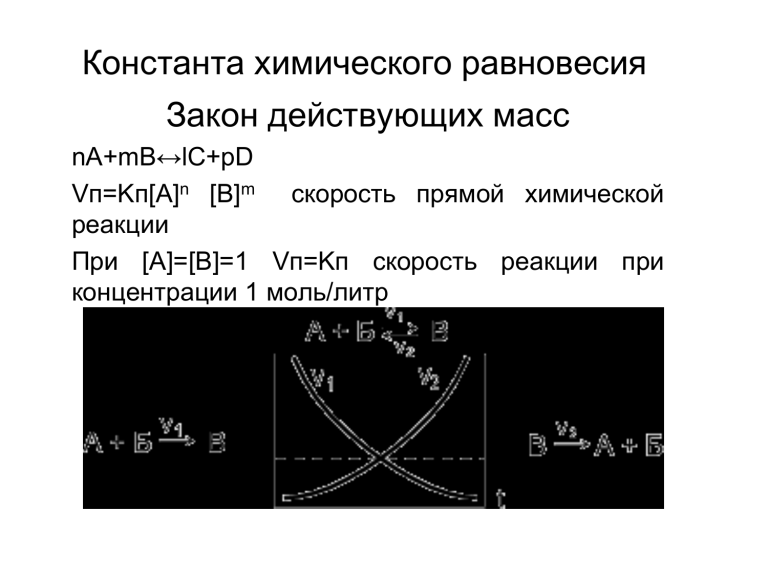
Константа химического равновесия Закон действующих масс nA+mB↔lC+pD Vп=Kп[A]n [B]m скорость прямой химической реакции При [A]=[B]=1 Vп=Kп скорость реакции при концентрации 1 моль/литр До установления равновесия Кп/Ко или Vп=Vо Kп[A]n [B]m = Kо[С]l [D]p Кп/Ко= [С]l [D]p / [A]n [B]m = Kc концентрационная константа равновесия При К>1 прямая реакция, при К<1 – обратная. pK=-lgKc Кт(термодинамич. конст. равн.)=aCaD/aAaB= =[C] [D]fcfd/[A] [B]fafb=Кс (fcfd / fafb) , где а=fCактивность ионов Типы констант равновесия Устойчивость комплексных соединений Mn+ + nL ↔ [MLn] Kуст= [MLn]/ [Mn+ ] [L-]n Kуст= [Cd(NH3)4]2+ =1,2 × 105 Kуст= [Cu(NH3)4]2+ =1,1 × 1012 на 7 порядков устойчивость аммиаката меди больше чем аммиаката кадмия. Кислотность HA↔ [H+] [A-] Kкисл= [H+] [A-] / [HA] Ионизация осадков MAт↔ [M+] [A-] Kст= [M+] [A-]/[MA] ПР=Kст[MA]=[M+] [A-] Общая константа A+B ↔AB 1-я ступень AB+B ↔AB2 2-я ступень AB2+B ↔AB3 3-я ступень A+3B=AB3 K1=[AB] /[A] [B] K2=[AB2] /[AB] [B] K3=[AB3] /[AB2] [B] Kp=K1K2K3= [AB3] /[A] [B]3 Определение направления химической реакции [Cd(NH3)4]2+ + Сu2+↔ [Cu(NH3)4]2+ + Сd2+ Kравн=Kобр [Cd(NH3)4]2+/Kобр [Cu(NH3)4]2+ = = Kуст [Cu(NH3)4]2+/ Kуст[Cd(NH3)4]2+ Kравн=1.1 × 1012/1.2× 105=0.9×107. Критерии применимости реакций для количественного анализа A+B ↔AB, если вещества соединились на 99.99%, то Kравн.= [AB]/[A][B]= 99.99/0.01 × 0.01=1 / 1×10-4× 1×10-4= 1×108. т.е. реакция проходит практически до конца, если Kpавн. ≥ 1×108