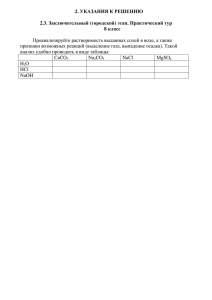
Задание № 1. «Закончи предложение одним словом» 1. Положительно заряженный электрод - … 2. Отрицательно заряженный электрод - … 3. Направленное движение заряженных частиц - …. 4. Положительно заряженные частицы - … 5. Отрицательно заряженные частицы -…. 6. Вещества, водные растворы или расплавы которых проводят электрический ток -…. 7. Вещества, водные растворы или расплавы которых не проводят электрический ток -…. 8. Процесс распада электролита на ионы при растворении или расплавлении вещества -…. Задание № 3 «Та- инственная коробка» Задание № 2 «Куча мала» На доске беспорядочно записаны формулы ионов. 2+ + 2+ Ca ; K ; CI ; Mg ; SO42-; CO32-; Fe3+; OH- Разложите их по двум папкам с названием «КАТИОНЫ» и «АНИОНЫ». Дайте названия всем ионам. Задание №4 «Разгадай тайну пирамиды» 1.Я вещество белого цвета, принадлежу к Ребята, на экране представлена пятиклассу соли. Я сильный электролит с ионной связью. Вы видите меня постоянно на этажная пирамида, «строительными камнями» своем столе. У меня соленый вкус. Меня зо- которой являются химические соединения. Найдите такой путь с вершины пирамиды к ее вут … основанию, чтобы в-ва «камней» были растворимы в воде. При определении каждого 2.Я слабый электролит, принадлежу к мало- следующего шага следует иметь в виду, что растворимым в воде солям. Меня использу- можно выбирать лишь один из двух «камней», ют как строительный материал. И в школе я непосредственно прилегающих к предыдущевам пригодился. Я белого цвета и у меня му. кислотный остаток карбонатной кислоты. Меня зовут … 3.Я прозрачная жидкость без цвета и запаха. Сама по себе я не провожу электрический ток, но это делают другие вещества, растворенные во мне. Меня вы можете встретить повсеместно. Я - … Задание № 5. «Найди меня» Укажите сильные электролиты (написать на доске) HCI; BaSO4; KOH; Ba(OH)2; Fe(OH)3; Na2CO3; Ca3(PO4)2 Задание № 6. Напишите уравнение диссоциации предложенных веществ (в задании 5). Прочитать уравнение диссоциации. Одновременно у доски работают два человека. Анализируем выполнение задания. Используйте шестерку слуг, Зовут их: КАК и ПОЧЕМУ, КТО, ЧТО, «Ионы, объединяйтесь!» Составить молекулярные формулы ве- КОГДА и ГДЕ! ществ, состоящих из предложенных ионов. На предыдущих уроках мы выяснили, что свойства растворов электролитов зависят от Назвать вещества. свойств ионов. Но химия изучает отношение 2+ + 2+ веществ друг к другу. Что будем наблюдать, если смешать растворы электролитов? 223+ 4 3 Демонстрация опытов: (написать на доске) Опыт 1. Смешивание растворов CuSO4 и NaOH. Задание № 7. Ca ; K ; CI ; Mg ; SO CO ; Fe ; OH Опыт 2. Смешивание растворов Na2CO3 и HCl. Опыт 3. К раствору NaOH добавляют фенолфталеин и приливают раствор HCl. Опыт 4. Смешивание растворов KCl и Na2SO4. Группа №1 Инструкция по проведению работы в группах. 1. Проведите реакции между веществами согласно вашего варианта. 2. Опишите, что наблюдаете. Какой признак указывает на то, что реакция произошла? 3. Пользуясь таблицей растворимости, запишите уравнения реакции в молекулярной, полной и сокращенной ионных формах. Группа №1 Na2SO4, BaCl2 Na2CO3, CH3COOH NaOH, HCl Группа №2 Инструкция по проведению работы в группах. 1. Проведите реакции между веществами согласно вашего варианта. 2. Опишите, что наблюдаете. Какой признак указывает на то, что реакция произошла? 3. Пользуясь таблицей растворимости, запишите уравнения реакции в молекулярной, полной и сокращенной ионных формах. Группа №2 AgNO3, HCl Na2CO3, CH3COOH KOH, HCl Группа №3 \Инструкция по проведению работы в группах. 1. Проведите реакции между веществами согласно вашего варианта. 2. Опишите, что наблюдаете. Какой признак указывает на то, что реакция произошла? 3. Пользуясь таблицей растворимости, запишите уравнения реакции в молекулярной, полной и сокращенной ионных формах. Группа №3 CuSO4, NaOH Na2CO3, CH3COOH NaOH, HCl Закрепление Среди предложенных реакций выбрать реакции обмена и определить какие из них будут протекать до конца. Запишите уравнения реакций в полном ионном виде (ПИУ)и сокращенном виде (СИУ): 1. CuO+H2= Cu+H2O 2. 3K2CO3+2H3PO4=2K3PO4+3H2O+3CO2 3. 2H2O=2H2+O2 4. CaO+2HCl=CaCl2+H2O 5. MgCl2+K2SO4=MgSO4+2KCl 6. NaCl+AgNO3=NaNO3+AgCl 7. 3Ca(OH)2+2H3PO4=Ca3PO4+6H2O 8. Cu(NO3)2+2NaCl=CuCl2+2NaNO3 9. FeCl3+3NaOH=Fe(OH)3+3NaCl