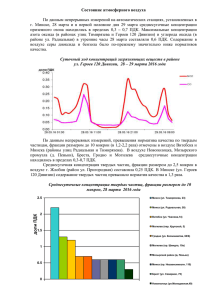
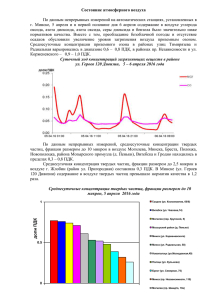
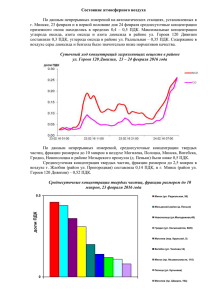
Контроль состояния ОС (мониторинг ОС) Термин мониторинг (от английского monitoring– контроль) появился в 1972 г. (Стокгольмская конференция ООН по окружающей среде). Важным решением Стокгольмской конференции была рекомендация по созданию глобальной системы мониторинга окружающей среды (Global Environmental Monitoring Systems – GEMS). Мониторинг окружающей среды это комплексная система наблюдений, оценки и прогноза изменений состояния окружающей среды. Этим термином называют регулярные, выполняемые по заданной программе наблюдения природных сред, растительного и животного мира, позволяющие зафиксировать изменения их состояния под влиянием антропогенной деятельности. Основная цель мониторинга состоит в обеспечении структур, отвечающих за управление природоохранной деятельностью, своевременной и достоверной информацией, позволяющей: – оценить состояние экосистем и среды обитания человека; – выявить причины при изменении этого состояния; – оценить последствия такого изменения; – определить корректирующие меры в случае нарушения состояния экосистем; – определить превентивные меры для исправления негативных изменений до того, как будет нанесен ущерб. Наиболее универсальным подходом к определению структуры системы мониторинга окружающей среды является его разделение на блоки: – наблюдение; – оценка фактического состояния; – прогноз состояния; – оценка прогнозируемого состояния. Блок-схема мониторинга ОС Мониторинг ОС является составной частью системы управления, поскольку информация о фактическом состоянии природной среды и тенденциях ее изменении должна быть положена в основу разработки мер по охране природы. Результаты оценки фактического и прогнозируемого состояния биосферы, в свою очередь, дают возможность уточнить требования к системе наблюдений. Общая характеристика состояния окружающей среды и экологических систем Человечество вступило в новую эру своего существования, когда потенциальная мощь создаваемых им химических, биологических и физических средств воздействия на окружающую среду обитания становится соизмеримой с силами природы. За ХХ век масштабы экономики выросли в 20 раз, использование природного топлива увеличилось в 30 раз. Произошло расширение промышленности примерно в 50 раз. Любые процессы, связанные с производством, характеризуются не только преобразованием ресурсов и получением нужных веществ, но и образованием побочных продуктов. В большинстве случаев, эти продукты чужды среде, попадая в организм они вызывают негативные изменения, как на соматическом (злокачественные образования), так и генно-хромосомном (мутации) уровнях. Кроме того, нарушен круговорот веществ, в результате чего большинство отходов не минерализуются. Деятельность микробов в воде и почве затормаживаются различными токсическими веществами. К тому же в процессе производства образуется большое количество веществ, которые невозможно разложить биологическим путем (полимерные материалы), и они накапливаются в атмосфере, гидросфере и почве, нарушая деятельность большинства экосистем. К настоящему времени синтезировало свыше 7 млн. новых химических веществ, при этом в повседневной жизни используются не более 100 тыс. видов химической продукции, причем этот ассортимент расширяется ~1000 единиц в год. (химическая агрессия, организм человека не обладает механизмами противодействия по отношению к этим веществам). Актуальность задач по защите от загрязнений в будущем будет только возрастать, поскольку, общий мировой объем произведенной продукции в последние десятилетия удваивается через каждые 15 лет, а количество вырабатываемой энергии возрастают вдвое еще быстрее – каждые 12 лет. КОНТРОЛЬ ЗАГРЯЗНЕНИЯ АТМОСФЕРНОГО ВОЗДУХА Воздух в основном состоит из азота (78,08 %), кислорода (20,95 %), значительно меньшего количества инертного газа аргона (0,93 %) и еще меньшего – углекислого газа (0,03 %). Помимо этих постоянных компонентов воздуха, важным компонентом является также водяной пар, содержание которого во влажном воздухе дотигает 4 %. Основная масса водяных паров содержится в нижних слоях (до 6 км) атмосферы, в стратосфере они практически отсутствуют. Все остальные имеющиеся в атмосфере газы (водород, озон, неон, гелий, криптон, ксенон) содержатся в следовых количествах, составляющих в сумме 0,02 %. Существенным компонентом воздуха часто оказывается пыль. Природные источники пыли – действующие вулканы, ветровая эрозия почв и биологические процессы (пыльца растений). В воздухе содержатся также микроорганизмы (бактерии, вирусы, плесневые грибки). Все другие компоненты, изменяющие естественный состав атмосферы, попадающие в воздух из различных источников, классифицируются как загрязнители. Основные источники загрязнения атмосферного воздуха: • промышленность (производство энергии, чёрная и цветная металлургия, химическая и нефтехимическая промышленность, предприятия по производству строительных материалов, горнодобывающая промышленность); • транспорт. Различают первичные и вторичные загрязнители воздуха. Первичные представляют собой химические вещества, попадающие непосредственно в воздух из разных источников. Вторичные образуются в результате взаимодействия в атмосфере первичных загрязнителей между собой или другими компонентами (кислород, озон, вода) под действием УФ-излучения. Стандарты качества атмосферного воздуха Степень загрязнения атмосферного воздуха сильно колеблется во времени и пространстве и определяется следующими факторами: – особенностями источника и загрязнителей (тип источника, природа и свойства загрязняющих веществ, объём выброса); – метеорологическими и топографическими факторами (направление и скорость ветра, температура, атмосферное давление, влажность, рельеф местности и расстояние до источника загрязнения). Для борьбы с загрязнением атмосферного воздуха необходимы стандарты качества воздуха (в России – предельно допустимые концентрации ПДК), на базе которых осуществляются все мероприятия по сохранению чистоты окружающей среды. Наличие стандартов качества воздуха позволяет направлять усилия по оздоровлению атмосферного воздуха более рационально, т.е. на мероприятия в тех регионах, где уровень загрязнений воздуха превышает ПДК. Для санитарной оценки воздушной среды используют следующие виды предельно допустимых концентраций: • ПДКрз – предельно допустимая концентрация вредного вещества в воздухе рабочей зоны, выражаемая в мг/м3 • ПДКпп – предельно допустимая концентрация вредного вещества на территории промышленного предприятия (обычно принимается ПДКпп = 0,3 ПДКрз); • ПДКнп – предельно допустимая концентрация вредного вещества в атмосферном воздухе населённого пункта (в воздухе населённых мест определяют ПДКмр и ПДКсс); • ПДКмр – максимальная разовая концентрация вредного вещества в воздухе населённых мест 3 (мг/м ); • ПДКсс – среднесуточная предельно допустимая концентрация вредного вещества в воздухе населённых мест (мг/м3). При установлении ПДКрз и ПДКнп учитывается различный характер воздействия вещества на человека в условиях производства и в населённом месте. При определении воздействия вещества в рабочей зоне находятся практически здоровые, взрослые люди, и время воздействия ограничено протяжённостью рабочего дня и рабочим стажем. При определении же ПДК нп учёту подлежат иные факторы; принимается во внимание, что вещество воздействует круглосуточно и в течение всей жизни на всех людей (взрослых и детей, здоровых и больных). Поэтому для одного и того же загрязнителя ПДКрз в десятки и даже сотни раз выше, чем ПДКнп. Атмосферные загрязнители по классификации вредных веществ по степени токсичности и опасности относятся к четырём классам опасности: 1-й класс – чрезвычайно опасные (свинец и его соединения); 2-й класс – высокоопасные (NO2, H2S); 3-й класс – умеренно опасные (сажа, SO2); 4-й класс – малоопасные (бензин, CO). Оценка качества атмосферного воздуха основана на сравнении фактически измеренной концентрации с ПДК. При одновременном присутствии нескольких загрязняющих веществ, их безразмерная концентрация Х не должна превышать единицу: Для оценки качества воздуха применяется и другой комплексный показатель I – индекс загрязнения атмосферы: где c – средняя за год концентрация, мг/м3; ПДКсс – среднесуточная ПДК, мг/м3, в случае отсутствия вместо неё принимается ПДКмр; k = 1,7 (класс опасности 1); k = 1,3 (класс опасности 2); k = 1,0 (класс опасности 3); k = 0,9 (класс опасности 4) Индекс загрязнения атмосферы применяют при ранжировании экологического состояния атмосферы по классам: В России осуществляется постоянный санитарный контроль за соблюдением ПДК токсичных веществ в воздухе рабочей зоны промышленных предприятий и атмосфере, проводимые санитарноэпидемиологическими станциями (СЭС) и сетевыми лабораториями Федеральной службы по гидрометеорологии и мониторингу окружающей среды. Основные контролируемые компоненты Оксид углерода Газ без цвета и запаха; образуется при сгорании органических видов топлива в условиях недостатка О2 (горит синим пламенем); 2C + O2 = 2CO – мольное соотношение 2:1, а для полного сгорания надо 2:2 2C + 2O2 = 2CO2 при взаимодействии CO2 с раскаленным углем, CO2 + С = 2CO Естественный уровень CO в атмосфере 0,01-1 мг/м 3 ; 90% атмосферного CO образуется в результате естественных процессов (вулканическая деятельность, лесные и степные пожары, жизнедеятельность флоры и фауны). Сотни миллионов тонн CO поступают в атмосферу ежегодно и в результате деятельности человека: – транспорт; – химическая промышленность: синтез-газ – смесь СО и водорода, из которой потом получают метиловый спирт, муравьиную и щавелевую кислоты; – угледобывающая промышленность (поверхностное окисление угля в шахтах и его тление); – сжигание топлива в быту. В основе биологического действия CO лежит образование карбоксигемоглобина HbCO вместо оксигемоглобина HbO2, т.е. CO занимает место O2. Сродство гемоглобина (Hb) человека к CO приблизительно в 240 раз выше, чем к О2. HbCO затрудняет подачу кислорода к тканям и существенно влияет на обмен веществ в мышцах (особенно сердечной мышцы). В обычных условиях в организме человека уровень HbCO составляет до 3% у детей, до – 5 % у взрослых, до – 7-8% у курящих (1 пачка в день). Тяжесть отравления зависит от концентрации и длительности воздействия CO, наличия хронических заболеваний, общего состояния здоровья человека и интенсивности дыхания. Мужчины более чувствительны к отравлению CO, чем женщины. CO не накапливается в организме. Существует определенная адаптация к хроническому воздействию CO (увеличение концентрации гемоглобина). Относиться к основным загрязнителям воздуха жилых помещений, образуется при пожаре. Особенно высокая концентрация CO наблюдается в жилых помещениях с печным отоплением с использованием твердого топлива, а также с газовыми плитами. ПДК в воздухе рабочей зоны — 20 мг/м3, 4 класс опасности. Диоксид углерода Углекислый газ (оксид углерода (IV), CO2). Диоксид углерода получается в результате множества окислительных реакций у живых организмов, и выделяется в атмосферу с дыханием. Образуется в результате активной реакции с атмосферным угарным газом (оксид углерода, CO). CH4 + 2O2 = CO2+ 2H2O C + O2 = CO2 2CO + O2 = 2CO2 Концентрация углекислого газа в атмосфере Земли составляет 0,038 %. Постоянный рост уровня углекислого газа в атмосфере наблюдается с начала индустриальной эпохи и в некоторых индустриальных странах к настоящему времени его концентрация атмосфере достигает 0,06 %. Используется в качестве инертной среды. Сжатый CO2 (баллоны) применяется в огнетушителях, для производства газированной воды. Твёрдая углекислота используется как хладагент в морозильных установках. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, изучения парникового эффекта. Промышленный способ получения CO2 – разложением природных карбонатов (известняк, доломит). CaCO3 = CO2 + CaO В Чехии, Иране и США есть доломитовые пещеры, в которых происходит естественное разрушение карбонатов и содержание CO2 в приземном слое может достигать 40 %. Долго не могли понять почему только собаки погибали в этих пещерах… Наиболее крупные источники загрязнения CO2: – комбинаты черной металлургии, нефтеперерабатывающей и нефтехимической промышленности; – ТЭЦ: сжигание ископаемого топлива (угля, нефти, газа) для производства тепла и электроэнергии; – транспорт: один из основных компонентов выхлопных газов двигателей внутреннего сгорания. Влияние на здоровье. Большая концентрация в воздухе вызывает удушье, длительный контакт приводит к заболеваниям дыхательных путей и нарушениям в сердечно-сосудистой системе. В качестве консерванта (Е290) входит в список пищевых добавок. Добавки с индексом (E-200– E-299) отвечают за сохранность продуктов, предотвращая размножение бактерий или грибков. В некоторых странах запрещен к применению в пищевой промышленности, в РФ допустим. Воздействие на окружающую среду. Усиленное поступление CO2 главным образом в результате растущей потребности в энергии приводит к нарушению кругооборота углерода, поглощает испускаемые Землей инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Приводит к снижению урожайности, деградации почв, общему загрязнению окружающей среды. ПДК CO2 в воздухе рабочей зоны – 9000 мг/м3 Озон Озон (аллотропная модификация кислорода, О3) образуется из кислорода в верхних слоях атмосферы под действием ультрафиолетового излучения: 3O2 = 2O3 В результате чего наиболее высокочастотное ЭМИ значительно ослабляется. Защитная функция. Толщина озонового слоя может значительно сокращаться в присутствии примесей, таких как, например, оксид азота NO, катализирующих реакцию его разложения: 2O3 = 3O2 Озон, как и любое химически активное вещество, токсичен. В воздухе содержится до 0,01 мг/м3, в городах до 2 мг/м3 озона (фотохимический смог). Фотохимический смог. Под действием яркого солнечного света NO2 реагирует с кислородом воздуха с образованием озона и оксида азота(II): NO2 + O2 = O3 + NO Основным источником NO2 в воздухе являются выхлопы автомобилей. N2 + 2O2 = 2NO2 Кроме того, при взаимодействии озона (сильный окислитель) с продуктами неполного сгорания бензина образуются органические перекиси. Фотооксиданты (озон и органические перекиси) вызывают старение и разрушение клеток, раздражают слизистые оболочки органов зрения и дыхания, могут быть причиной ряда онкологических заболеваний. Сам озон нарушает окислительные процессы в организме, оказывает резкое раздражающе действие на слизистые оболочки дыхательных путей. Используют озон для очистки воды и воздуха от микроорганизмов (озонирование) для дезинфекции помещений, для отбеливания бумаги, очистки масел. ПДК О3 в атмосферном воздухе населённых мест – 0.1 мг/м³, ПДК О3 в воздухе рабочей зоны – 0.16 мг/м³, 1 класс опасности. Двуокись серы Двуокись серы (оксид серы (IV), SO2) – один из основных компонентов вулканических газов, встречается и в природном газе. В нормальных условиях представляет собой газ с характерным резким запахом (запах загорающейся спички). Диоксид серы токсичен (т.к. химически активен). В производстве выделяется в процессе сгорания серосодержащего топлива или переработки сернистых руд (общемировое поступление около 200 млн. т. в год): S + O2 = SO2 В промышленных районах концентрация SO2 обычно достигает 0,05–0,1 мг/м3, в фоновых районах и над океаном она ниже в 10-100 раз. Из-за химической активности время жизни диоксида серы в атмосфере невелико (порядка нескольких часов). В связи с этим возможность загрязнения и опасность воздействия непосредственно диоксида серы носят, как правило, локальный характер. Большую опасность представляет окисление сернистого ангидрида в серный ангидрид: 2SO2+ O2 = 2SO3 Конечным продуктом реакции является аэрозоль или раствор серной кислоты в дождевой воде. SO3+ Н2O = Н2SO4 Источники загрязнения: Основной – сжигание органического серосодержащего топлива: ТЭЦ, комбинаты черной металлургии, двигатели внутреннего сгорания. Много SO2 образуется при производстве серной кислоты и минеральных удобрений, т.к. первая стадия технологического цикла – обжиг персульфидов (пирита): 4FeS2 + 11O2 = 8SO2 + 2Fe2O3 Влияние на здоровье – связано с острым раздражающим действием дыхательных путей человека. Вызывает общее отравление организма, изменение состава крови, нарушение обмена веществ и повреждение слизистых оболочек. В пищевой промышленности применяют как консервант (Е220). Влияние на окружающую среду. Высокие концентрации диоксида серы вызывают серьезное повреждение растительности и закисление почвы. Независимо от формы проявления, результатом является снижение продуктивности и замедление роста. Особенно чувствительны к SO 2 лишайники, которые используют в роли биоиндикаторов на это вещество. ПДК SO2 (максимальная разовая концентрация в воздухе населённых мест) составляет 0.5 мг/м3, 3 класс опасности. Окислы азота Окислы азота (NOх). Важнейшими являются оксид азота (II) NO и оксид азота (IV) NO 2. Остальные (оксид азота (I) N2O, оксид азота(III) N2O3, оксид азота (V) или азотный ангидрид N2O5), также могут присутствовать в воздухе, но содержатся на порядок в меньших количествахрядок и более). Естественные источники окислов азота – бактериальная активность в почве, грозы, извержения вулканов. Основной антропогенный источник – процессы горения при температуре выше 1000°С: двигатели внутреннего сгорания, ТЭЦ, комбинаты черной металлургии. В зависимости от конкретных услой реакции может быть образован весь спектр оксидов: N2 + O2 = N2O … N2O5 (max NO и NO2) Различные оксиды азота образуются в технологическом цикле производства азотных удобрений, азотной кислоты и красителей. Общемировое поступление оксидов азота в атмосферусосавляет около 20 млн. т. в год. Фоновые концентрации окислов азота изменяются в пределах 0,5-10 мкг/м 3. Типичное содержание диоксида азота в воздухе городов составляет 20-100 мкг/м 3; пиковые концентрации могут достигать 1000 мкг/м3. Влияние на здоровье. Окислы азота могут отрицательно влиять на здоровье сами по себе и в комбинации с другими загрязняющими веществами. При попадании в легкие человека и животных образуют азотную кислоту: Вызывают сложные рефлекторные расстройства, возможен летальный исход от отека легких. Способны повреждать эритроциты, и как следствие, порождать кислородную недостаточность. При высоких концентрациях N2O (веселящий газ) возбуждает нервную систему, оказывая наркотическое действие. Оксиды азота зарегистрированы в качестве пищевой добавки (E918). Влияние на окружающую среду. Окислы азота занимают второе место после диоксида серы по вкладу в увеличение кислотности осадков. NO2 играет важную роль в образовании фотохимического смога. Все окиды азота физиологически активны и относятся к веществам третьего класса опасности. ПДКмр (суммарное содержание оксидов азота) составляет 5,0 мг/м3. Контроль состояния ОС (темы для рефератов) 1. Стандарты качества водных сред (система ПДК, нормативы для загрязнителей) 2. Стандарты качества почвы (система ПДК, нормативы для загрязнителей) 3. Хлор и его соединения (характеристика, свойства, токсичность, ПДК для разных сред) 4. Фтор и его соединения (характеристика, свойства, токсичность, ПДК для разных сред) 5. Тяжелые металлы (характеристика, свойства, токсичность, ПДК для разных сред) 6. Пестициды (характеристика, свойства, токсичность, ПДК для разных сред) 7. Полиароматические соединения (характеристика, свойства, токсичность, ПДК) 8. Диоксины (характеристика, свойства, токсичность, ПДК для разных сред) 9. Бис-фенол и алкилфенолы (характеристика, свойства, токсичность, ПДК для разных сред) 10. Нефтепродукты (характеристика, свойства, токсичность, ПДК для разных сред) 11. Поверхностно-активные вещества (характеристика, свойства, токсичность, ПДК) 12. Нитрозамины (характеристика, свойства, токсичность, ПДК для разных сред) 13. Полихлорированные бифенилы (характеристика, свойства, токсичность, ПДК) 14. Парабены (характеристика, свойства, токсичность, ПДК для разных сред)