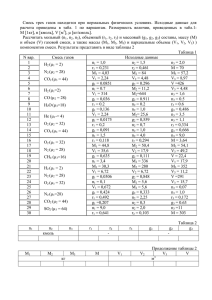
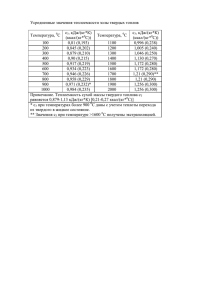
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФГБОУ ВПО «Воронежский государственный технический университет» Кафедра «Ракетные двигатели» МЕТОДИЧЕСКИЕ УКАЗАНИЯ для выполнения курсовой работы по дисциплине «Методы математического моделирования» для студентов специальности 160700.65, 24.05.02 «Проектирование авиационных и ракетных двигателей» очной формы обучения Воронеж 2015 Составители: д-р техн. наук Ю.В. Демьяненко канд. техн. наук А.А. Гуртовой д-р техн. наук А.В. Кретинин канд.физ.-мат. наук А.М. Сушков УДК 629.13 Методические указания для выполнения курсовой работы по дисциплине «Методы математического моделирования» для студентов специальности 160700.65, 24.05.02 «Проектирование авиационных и ракетных двигателей» очной формы обучения / ФГБОУ ВПО "Воронежский технический университет"; Сост.: государственный Ю.В. Демьяненко, А.А. Гуртовой, А.В. Кретинин, А.М. Сушков. Воронеж, 2015. 44 c. В методических указаниях для выполнения курсовой работы содержатся теоретические сведения для создания компьютерной программы, реализующей одномерную математическую модель горения в камере ЖРД. Издание соответствует требованиям Федерального государственного образовательного стандарта высшего профессионального образования по направлению 160700.65, 24.05.02 «Проектирование авиационных и ракетных двигателей», дисциплине «Методы математического моделирования». Рецензент д-р техн. наук, проф. Г.И. Скоморохов Ответственный за выпуск зав. кафедрой д-р техн. наук, проф. В.С. Рачук. Издается по решению редакционно-издательского совета Воронежского государственного технического университета. © ФГБОУ ВПО государственный университет», 2015 «Воронежский технический ВВЕДЕНИЕ В представленных методических указаниях теоретические основы для моделирования одномерного процесса горения в камере сгорания, базирующиеся на проведении термодинамического расчета процесса горения и истечения в камере сгорания ЖРД. Для определения удельных параметров и геометрических размеров ракетного двигателя необходимо знать температуру, давление, состав и скорости продуктов сгорания в камере сгорания в различных сечениях сопла. Эти данные необходимы также и для расчета охлаждения стенок камеры. Высокие температуры горения в камере ЖРД вызывают сильную диссоциацию продуктов сгорания, которая, в свою очередь, влияет на их температуру и состав. Поэтому при определении температуры и состава продуктов сгорания в ЖРД учет диссоциации является обязательным. Кроме того, следует принимать во внимание и зависимость теплоемкости продуктов сгорания от температуры. Исходными данными для термодинамического расчета горения и истечения продуктов сгорания являются: • химический состав горючего и окислителя; •соотношение между количеством горючего и окислителя в камере сгорания; •давление в камере сгорания; •давление на срезе сопла. Расчет температуры и состава продуктов сгорания на выходе из камеры сгорания (перед реактивным соплом) производится при следующих допущениях: • смешение компонентов топлива является полным; • физическая неполнота сгорания отсутствует; • отдачи тепла в стенки камеры нет; • процесс сгорания протекает при постоянном давлении; 3 •состояние продуктов сгорания на выходе из камеры сгорания является полностью химически и энергетически равновесным. При расчете процесса расширения в реактивном сопле ЖРД принимаются следующие допущения; • процесс расширения предельно химически и энергетически равновесен; •догорание топлива в сопле отсутствует; • отдачи тепла в стенки сопла нет; • трения и газодинамических потерь в сопле нет. В качестве иллюстрации излагаемого материала приводится пример проведения термодинамического расчета для кислородно-водородного жидкостного ракетного двигателя. Подробно изложенные этапы расчета имеют цель создания алгоритма программы численного решения. 4 1. Термодинамический расчет процессов горения и истечения. Теоретические основы Задача термодинамического расчета – определение температуры и состава продуктов сгорания в различных сечениях (в частности, входном, выходном и критическом). Особенностью процессов в тепловых двигателях при высоких температурах (более 2000 К) является значительное усиление термической диссоциации рабочего тела. Время пребывания продуктов сгорания (ПС) в таких двигателях очень мало: газообразные продукты в камерах сгорания находятся тысячные доли, а при течении по соплу – десятитысячные доли секунды. Наличие в камерах обратимых процессов диссоциации означает, что ПС представляет собой химически реагирующую многокомпонентную смесь газов. Эти процессы приводят к уменьшению преобразования химической энергии в тепловую, что должно учитываться при расчете двигателей. При течении по соплу температура и давление газа уменьшаются. Установлено, что в диапазоне изменения этих параметров в соплах влияние температуры на диссоциацию сказывается сильнее, поэтому по мере движения газа по соплу диссоциация ослабевает. Состав ПС по длине сопла меняется: на выходе имеется больше продуктов полного окисления. Для химически активного газа, в котором протекают химические реакции рекомбинации с выделением тепла, кроме необходимо внутренней энергии U и энергии давления P также учитывать химическую энергию U хим . При температурах газа менее 2000 К степень диссоциации невелика, поэтому при рассмотрении процесса расширения в соплах изменение химического состава и U хим можно не учитывать. При больших температурах в соплах происходит значительное изменение состава, а следовательно, и запаса 3 U хим . В этом случае уравнение энергии для движущегося газа записывают в виде: U P U хим w2 w2 I const , 2 2 (1) где I – энтальпия ПС. Нередко I называют полной энтальпией: P I U U хим . (2) Уравнение (1) обычно используют для определения скорости истечения из сопла диссоциированных ПС: wa 2 I к I а . Если не учитывать изменения химической энергии рабочего тела вследствие реакций рекомбинации, то при расчете скорости истечения ошибка может достигать нескольких процентов. Поскольку по соплу состав ПС меняется, то и отношение теплоемкостей c p c v для каждого сечения сопла будет иметь разное значение. Процесс расширения в соплах с подводом тепла вследствие реакций рекомбинации можно рассчитывать, используя уравнение адиабаты с некоторым средним значением показателя n: Pк n к Pa n a n lg Pк Pa lg к a С учетом уравнения состояния lg P к P a n Pк R a T a lg Pa R к T к где R R0P , i Pi 4 , (3) Ra , Ta , Pa – соответственно газовая постоянная, температура и давление ПС в выходном сечении сопла; Rк , Tк , Pк – то же на входе в сопло. Для нахождения этих параметров необходимо выполнять термодинамический расчет в указанных сечениях сопла. 2. Равновесность процесса Равновесным называется такой процесс расширения газовой смеси, при котором энергия колебательного движения частиц в каждом сечении сопла соответствует температуре (энергетическое равновесие), а состав ПС успевает отслеживать изменение определяющих параметров – температуры и давления (химическое равновесие). Обычно термодинамические расчеты двигателей выполняются в предположении полностью равновесного расширения. Такие процессы являются термодинамически обратимыми и идут при постоянной энтропии: S i S к S a const . Изоэнтропные процессы, по сравнению с адиабатными, являются более идеализированными. При их протекании не должно быть трения и теплообмена газа со стенкой, а также должно выдерживаться энергетическое и химическое равновесие. Для изоэнтропных процессов средний показатель процесса расширения называют показателем изоэнтропы. 3. Задачи термодинамического расчета Как уже отмечалось, в задачу термодинамического расчета входит определение температуры и состава газа в различных сечениях сопла. На основании этих расчетов в дальнейшем вычисляют расходный комплекс , скорость истечения wa , показатель изоэнтропы n, удельный импульс I у и некоторые другие параметры. 5 Состав ПС можно характеризовать парциальными давления газов Pi , числом молей , мольными (объемными) долями ri . Индекс «i» означает некоторое произвольно выбираемое вещество, содержащееся в ПС. Все эти величины взаимосвязаны, например: P n ri i i , (4) P n где P – общее давление смеси; n – общее число молей всех газов, образующихся при сгорании одного моля топлива. Для выполнения термодинамических расчетов обычно задают состав и энтальпию топлива, давление торможения на входе в сопло P0к и давление на выходе из сопла Pa . Продукты сгорания считаются идеальными газами, поэтому к ним можно применить уравнение состояния идеальных газов. Внутренняя энергия, энтальпия, константы равновесия, теплоемкость от давления не зависят. В состав ПС входит большое количество индивидуальных веществ. Так, даже для топлива, состоящего из четырех элементов (C, H, O, N), в составе ПС приходится при расчетах учитывать содержание одиннадцати газов: H 2 O , CO2 , CO , O2 , N 2 , H 2 , NO , OH , H , O , N . Помимо 11 парциальных давлений Pi (или числа молей ni ) неизвестной величиной является температура смеси T0к . Для отыскания 12 неизвестных составляют систему из 12 уравнений. Одним из них является уравнение Дальтона: Pк Pi . (5) Для составления других уравнений предварительно необходимо провести термохимические расчеты. n i 4. Основы расчета термохимических свойств топлива Задачи расчета – составление условных (эквивалентных) формул топлива, расчет стехиометрического соотношения 6 компонентов k m0 и коэффициента избытка окислителя , а также энтальпии топлива I, его компонентов и ПС. Пример. Составить условную формулу окислителя. Состоящего из четырехокиси азота N 2 O4 (массовая доля g N 2O4 0,96 ) и воды H 2O (массовая доля g H 2O 0,04 . Условную формулу запишем в виде: N 2 O4 x H 2 O , т.е. на один моль N 2O4 приходится x молей H 2O . Зная массовые доли и молекулярные массы веществ ( N 2O4 92 ; H 2O 18 ), можно составить пропорцию для определения x: на N 2O4 граммов N 2 O4 приходится x H 2O граммов воды H 2 O , с другой стороны, соотношение между массами этих веществ определяется их массовыми долями. Следовательно, из пропорции получим: N 2O4 x H 2O N O g H 2O x 2 4 0,211 g N 2O4 g H 2O H O g N O 2 2 4 Таким образом условную формулу можно записать в виде N 2 O4 +0,211 H 2 O или в виде одночлена, суммируя количество грамм-атомов одинаковых элементов: количество грамматомов азота в условной формуле bN 2 , кислорода bO 4 0,211 1 4,211 , водорода b H 2 0,211 0,422 . В итоге условная формула N bN ObO H bH имеет вид N 2 O4, 211 H 0, 422 . Иногда удобнее рассматривать сгорание не одного условного моля вещества, а одного килограмма. Тогда составляют, так называемую удельную формулу. Для перехода к такой формуле надо число грамм-атомов в условной формуле умножить на 1000 / ок , где ок – условная молекулярная масса окислителя. Для рассмотренного примера ок 2 14 4,211 16 1 0,422 95,8 . 7 В итоге удельная формула окислителя N 20,9 O44 H . В данном случае условная молекулярная масса равна 1000 г/моль. 5. Теоретическое (стехиометрическое) соотношение компонентов Под теоретическим соотношением компонентов k m0 (стехиометрическим коэффициентом) понимают минимальное количество килограммов окислителя, которое приходится на один килограмм горючего при полном окислении горючих элементов топлива. При этом считают, что азот в реакциях окисления не участвует. Полным является такое окисление, когда углерод C окисляется до CO2 , водород H – до H 2 O и т.д., т.е. в реакциях окисления проявляются высшие валентности элементов. Поскольку в действительности наряду с продуктами полного окисления имеются продукты неполного окисления (например, CO , OH и др.), а также NO (т.е. азот частично k m0 характер. окисляется), то носит условный Стехиометрический коэффициент k m 0 служит ориентиром для того, чтобы назначить действительное соотношение m компонентов k m ок . Значение k m 0 может быть mг определено по формуле замещения валентности элементов: ок biг i i 1 , k m0 (6) г biоо i i 1 8 где i – валентность (с учетом знака); biоо , biг – число грамм-атомов i-го элемента в условных формулах окислителя и горючего. Напомним, что наивысшие валентности равны: у водорода H 1 , у углерода C 4 , у кислорода O 2 . В ряде случаев вводится мольное соотношение компонентов k m 0 k m 0 г ок , т.е. количество молей окислителя, потребное для полного окисления одного моля горючего. При расчете k m 0 молекулярные массы горючего г и окислителя ок могут быть найдены из химической или условной формул компонентов. Действительное соотношение между компонентами топлива можно характеризовать коэффициентом избытка окислителя: km k km k . (7) m0 m0 При 1 топливо содержит избыток окислителя, а при 1 – избыток горючего. Подставляя в (7) выражение для k m , можно определить секундный расход каждого из компонентов: m m г m ок m г 1 k m , откуда k m 0 m m m г ; m ок . 1 k m0 1 k m0 На основании (8) можно записать условную формулу двухкомпонентного топлива в следующем виде: (8) CbCТ HbHТ ObOТ Nb NТ , где число грамм-атомов элементов в условном моле топлива определяется соотношениями: bCТ bC Г k m 0 bCO ; bH Т bH Г k m 0 bH O ; 9 biТ biГ k m 0 biO . Здесь biГ и biO – соответственно число грамм-атомов i-го элемента в молях горючего и окислителя. Заметим, что в общем случае в этих расчетах могут использоваться условные формулы компонентов. Пример: Для топлива, в котором в качестве горючего использован диметилгидразин CH 3 2 N 2 H 2 ( г 60,1 ), а в качестве окислителя – четырехокись азота N 2 O4 , имеющая влажность 4%, определить значение k m 0 и записать условную формулу при 0,8 . Как было показано ранее, условная формула данного окислителя имеет вид ( ок 95,8 ). N 2 O4, 211 H 0, 422 Стехиометрическое соотношение: кг ок. 95,8 4 2 (1) 8 95,8 16 k m0 3,2 кг гор. 60,1 4,211 2 0,422 1 60,1 8 Мольное стехиометрическое соотношение моль ок. k m 0 k m 0 г 2 ок моль гор. Действительное мольное соотношение: моль ок. k m 0 k m 0 1,6 моль гор. Следовательно, условную формулу данного топлива на основании (8) можно записать в виде: CbCТ HbHТ ObOТ NbNТ , где bCТ bC Г k m 0 bCO 2 0 2 ; bHТ 8 1,6 0,422 8,78 ; bOТ 0 1,6 4,211 6,74 ; b NТ 2 1,6 2 5,2 . 10 6. Энтальпия Уравнением (2) для ПС была введена полная энтальпия, которая учитывает химическую энергию веществ. Она характеризует все запасы энергии вещества, кроме кинетической: T I i Q хим c p dT Q хим , T0 где T0 – начальная температура отсчета. Поскольку в термодинамических расчетах постоянно имеют дело с разностями или суммами полных энтальпий, то значение T0 можно выбирать произвольно. При расчете понятие полной энтальпии вводится также для топлива и его компонентов. Это позволяет записать баланс энергии в двигателе через полную энтальпию. В существующих системах отсчета в качестве T0 выбирают температуры 298,15 К; 293,15 К; и 0 К. Под химической энергией понимают то количество тепла, которое выделяется или поглощается при образовании данного вещества из некоторых исходных веществ, так называемых стандартных элементов, химическая энергия которых берется за нуль отсчета. В качестве нулей отсчета химической энергии обычно берут газообразные O2 , H 2 , N 2 , C (графит βмодификации, электронный газ и т.д. Указанные состояния исходных веществ (они называются стандартными состояниями) являются наиболее устойчивыми и распространенными в природных условиях. Для всех веществ при температуре T T0 : T i c p dT 0 и I Q хим . T0 Химическая энергия Q хим равна разности энергетических уровней исходных и конечных продуктов реакции и 11 определяется строением молекул и атомов исходных и конечных веществ и не зависит ни от давления, ни от температуры. Для определения Q хим экспериментальным путем находят теплоту образования вещества H T00 , т.е. количество тепла, которое выделяется ( H T00 <0) или поглощается ( H T00 >0) при образовании данного вещества из указанных состоянии: исходных веществ, взятых в стандартном H T00 Q хим QT0 , где QT0 обусловлена отличием теплоемкости исходных и конечных веществ, участвующих в реакции. При определении H T00 для стандартных T0 20 C (температура или 25 C и условий давление 5 P 1,01325 10 Па ( 1 физ. атм.) QT0 0 и Q хим H T00 . Для индивидуальных веществ при температуре Т T I H T00 c p dT H (i ) , T0 (i ) где H – сумма теплот фазовых и полиморфных превращений при изменении температуры от T0 до Т. Полная энтальпия 1 кг двухкомпонентного топлива: I k m0 I ок . IT г 1 k m0 Значения энтальпии горючего I г и окислителя I ок берут из таблиц при температуре подачи компонентов в камеру двигателя (20 или 25 C ) для высококипящих компонентов, или температуре кипения при давлении P 1,01325 10 5 Па для криогенных компонентов. 12 Энтальпию одного условного моля двухкомпонентного топлива находят из соотношения I T I Г k m 0 I ОК , где I Г , I ОК – энтальпия горючего и окислителя, отнесенные к одному молю. Энтальпия продуктов сгорания I ПС ni I i , где ni – число молей i-го вещества в ПС, образующееся из одного условного моля топлива. С учетом (4) N I ПС Pi I i . P Общее число молей в 1 кг ПС N 1 , где условная Pi i . i P На основании последнего соотношения молекулярная масса ПС NP ri Pi i и энтальпия 1 кг ПС Pi I i . (9) Pi i Здесь суммирование проводится с учетом всех веществ, содержащихся в ПС. 7. Система уравнений для выполнения термодинамического расчета I ПС Термодинамический расчета горения выполняется в предположении отсутствия ионизации ПС. Система для расчета включает следующие уравнения: диссоциации; сохранения вещества; закона Дальтона; 13 сохранения полной энтальпии. Уравнения диссоциации описывают обратимые реакции диссоциации. Из химической термодинамики известно, что если в газовой смеси протекает обратимая реакция типа aA bB cC dD , то для условий химического равновесия константа равновесия этой реакции запишется следующим образом: Pc Pd K Ca Db f (T ) , PA PB где A, B, C, D – вещества, участвующие в данной реакции; a, b, c, d – число молей этих веществ; PA , PB , PC , PD – парциальные давления. Для идеальных газов константа К от давления не зависит, а определяется только типом реакции и температурой газа. Известно, что число независимых уравнений констант равновесия равно числу учитываемых веществ в ПС за вычетом числа элементов в топливе. Уравнения сохранения вещества выражают равенство числа грамм-атомов каждого химического элемента в топливе и продуктах сгорания. Эти уравнения можно записать, рассмотрев условную реакцию сгорания топлива. Запишем, например, такое уравнение для четырехэлементного топлива: CbCТ HbHТ ObOТ NbNТ nCO2 CO2 nCO CO nH 2O H 2 O n N N , где nCO2 , nCO , n H 2O , , n N – числа молей CO2 , CO, H 2 O, , N , которые образуются при сгорании одного условного моля топлива. Очевидно, что число атомов произвольно выбранного элемента в левой и правой частях этого уравнения должно быть одинаково. Так, например, баланс элементов водорода bHТ 2n H 2O nOH 2n H 2 n H . Количество уравнений сохранения вещества равно числу элементов в топливе. Уравнение закона Дальтона записывается в виде: 14 P Pi . i Вместо него можно записать уравнение для общего числа молей N ni , i если в качестве неизвестных выбраны не парциальные давления, а числа молей ni . При выполнении термодинамического расчета часто рассматривают сгорание такого количества молей топлива которое обеспечивает равенство а MТ , P N , следовательно, и равенство Pi ni . Если ввести M Т , то, например, уравнение сохранения для водорода будет иметь вид: M Т bHТ 2 PH 2O POH 2 PH 2 PH . Аналогично записывают балансовые уравнения и для других элементов. В них правая часть представляет количество грамм-атомов элемента в продуктах сгорания M Т молей топлива, а левая часть – количество грамм-атомов элемента в M Т молях топлива. Уравнение сохранения полной энтальпии для 1 кг топлива записывается на основании закона сохранения энергии TК TК I Т I ПС , где I ПС – полная энтальпия ПС при температуре сгорания TК . Если рассматривается сгорание M T молей топлива, то уравнение сохранения полной энтальпии имеет вид M T I T Pi I i , i где I T – полная энтальпия одного моля топлива при температуре подачи; I i – полная энтальпия i-го вещества в ПС при температуре сгорания TК (справочное данное). 15 В рассмотренной системе уравнений количество неизвестных (парциальные давления или числа молей веществ в ПС, температура TК , число молей топлива M T ) и количество уравнений одинаково. Эта система нелинейных алгебраических уравнений является замкнутой. В прикладной математики разработан ряд способов приближенного решения подобных систем, позволяющих получить ответы с заданной точностью. Наибольшее распространение получил метод Ньютона. На его основе созданы компьютерные программы и выполнены термодинамические расчеты на ЭВМ для самых разнообразных топлив. Первой частью термодинамического расчета является определение состава и температуры продуктов сгорания TК в конце камеры сгорания. Обычно заданными считаются состав топлива, его энтальпия и давление в камере сгорания P0 K . При расчете процесса течения его считают идеальным, т.е. происходящим при постоянном значении энтропии S. В качестве граничного условия для расчета задается давление в рассматриваемом сечении сопла (обычно это давление в выходном сечении сопла, так как по результатам таких расчетов непосредственно определяется теоретическая скорость истечения и другие параметры). Для вычисления неизвестных, характеризующих состав ПС в сопле, используют ту же систему уравнений, что и при расчете процесса горения, а для расчета температуры вместо уравнения сохранения энтальпии применяют уравнение, выражающее постоянство по энтропии. В интегральной форме это равенство записывается следующим образом: Sк Sа , где S к – энтропия ПС перед входом в сопло, определяемое по результатам расчета состава ПС в камере; S а – энтропия ПС в рассматриваемом сечении сопла, в котором при расчете обычно давление считается заданным. Энтропию ПС 16 определяют из табличных значений стандартной энтропии S i0 веществ. Под стандартным значением энтропии условно принимают энтропию для заданной температуры при давлении P 1,01325 10 5 Па (1 физ. атм.). Для пересчета значения энтропии веществ при других давлениях, но при той же температуре, используется известное в термодинамике соотношение S i S i0 R0 ln Pi , где R0 – универсальная газовая постоянная; Pi – физ. атм. Энтропия ПС определяется суммированием энтропий всех составляющих веществ: S S i ni . i wа2 используется в этих 2 расчетах для определения скорости газового потока. В частности, скорость истечения из сопла Tа TК I ПС Уравнение энергии I ПС Tа Tа ТК wа 2 I Т I ПС или wа 2 I ПС I ПС . Как уже было сказано ранее, показатель изоэнтропы находят по зависимости (3). 8. Модель расчета равновесного состава и температуры рабочего тела в камере сгорания и в выходном сечении сопла Как уже отмечалось, при сгорании четырехэлементного топлива, содержащего C, H, N и O (условная формула имеет вид C NC H N H N N N ONO ) образуется 11 газов, составляющих в сумме более 99% массы продуктов сгорания: H 2 O , CO2 , CO , O2 , N 2 , H 2 , NO , OH , H , O , N . Роль других возможных 17 соединений, например, N x H y , ионов, электронов и др., пренебрежимо мала в диапазоне температур и давлений, свойственных жидкостным ракетным двигателям. Поскольку эти одиннадцать соединений образованы из четырех простых веществ, можно записать семь независимых реакций диссоциации и рекомбинации в форме семи констант равновесия, например, в следующем виде: PH 2O PCO2 PH 2O ; K2 ; K3 ; K1 1/ 2 1/ 2 POH PH1 /22 PCO PO2 PH 2 PO2 K4 PNO 1/ 2 1/ 2 PN 2 PO2 ; K5 PH 2 PH2 ; K6 PO2 PO2 ; K7 PN 2 PN2 . Каждая из констант равновесия зависит только от температуры. С целью упрощения расчета считают, что мольная концентрация i-го компонента N i связана с его N парциальным давлением соотношением i 1 . Pi К вышеуказанным уравнениям необходимо добавить уравнения баланса элементов (с учетом N i Pi ): для углерода N C N X PCO2 PCO ; для водорода N H N X 2 PH 2O 2 PH 2 POH PH ; для азота N N N X 2 PN 2 PN PNO ; для кислорода N O N X 2 PO2 PH 2O POH PO PNO PCO 2 PCO2 , где N X – количество молей исходного топлива, являющееся наряду с парциальными давлениями неизвестной величиной. Замыкающим является уравнение суммарного числа молей для смеси компонентов 18 N Ni , i или уравнение закона Дальтона P Pi . i Полученная система из двенадцати уравнений, содержащая двенадцать неизвестных, может быть решена различными способами, например, методом, описанным ниже и заключающимся в последовательном логарифмировании, линеаризации и решении системы уравнений. Сущность указанного метода состоит в следующим. Рассмотрим, например, уравнение диссоциации углекислого газа PCO2 . K1 PCO PO12/ 2 В логарифмической форме оно имеет вид 1 ln PCO2 ln PCO ln PO2 ln K 1 0 . 2 Линеаризуя это уравнение в окрестности какого-либо начального приближения парциальных давлений 0 0 0 PCO2 , PCO , PO2 , можно в итоге записать: ln PCO2 ln PCO 1 ln PO2 CO2 , 2 где ln Pi ln Pi ln Pi0 ; 1 2 Уравнение баланса углерода после логарифмирования имеет вид ln( PCO2 PCO ) ln( N C N X ) 0 . 0 0 CO2 ln PCO ln PCO ln PO02 ln K 1 . 2 После линеаризации в окрестностях начального приближения получим 0 0 0 0 0 0 PCO ln PCO2 PCO ln PCO (PCO PCO ) ln N X (PCO PCO ) C , 2 2 2 19 где ln N X ln N X ln N X0 ; 0 0 C lg( PCO PCO ) ln( N C N X0 ) . 2 Аналогичные преобразования уравнения закона Дальтона (линеаризация в окрестностях парциальных давлений Pi 0 ) приводят к уравнению 0 0 ( Pi ln Pi ) P Pi , i где P ln Pi ln Pк . 0 i Здесь Pк – давление в камере сгорания. Таким образом, проводя линеаризацию всех исходных уравнений, получим линейную систему алгебраических уравнений, в которой в качестве неизвестных фигурируют параметры ln V (V – парциальные давления и число молей исходного топлива). Расчет проводят при заданных температуре и давлении методом последовательных приближений. В качестве начальных значений искомых неизвестных можно принять одинаковые значения парциальных давлений, а начальное значение N X0 выбрать из условия равенства масс продуктов сгорания и исходного топлива, т.е. P N X0 i i , T где i , Т – молекулярные массы соответственно i-го компонента и исходного топлива. Затем, решая систему линейных уравнений, находят поправки к неизвестным и далее уточненные значения искомых неизвестных (их логарифмов): ln Pi1 ln Pi 0 ln Pi ; ln N 1X ln N X0 ln N X , 20 которые являются начальными значениями для следующего приближения. Указанная процедура повторяется до достижения заданной точности определения неизвестных. Расчеты по описанному алгоритму проводятся для трехчетырех ориентировочных значений температур в камере сгорания (например, 3200, 3400, 3600, 3800 К). Для каждой температуры определяют молекулярную массу , полную энтальпию I ПС и энтропию продуктов сгорания по следующим формулам: 0 ( S i Pi 8314 Pi ln Pi ) I i Pi i Pi ; I ПС ; S , Pк i Pi i Pi где I i , S i0 – справочные значения соответственно полной энтальпии и стандартной энтропии i-го компонента смеси, причем в формуле для энтропии значения давлений Pi надо подставлять в физических атмосферах, а размерность Дж . [ S i0 ] моль С Искомую температуру Tк определяют по формуле линейной интерполяции на основании уравнения сохранения энергии в форме баланса энтальпий: TК I TT0 I ПС . Так же по формуле линейной интерполяции находят молекулярную массу К и энтропию S К при полученной температуре. Для расчета состава и температуры продуктов сгорания в выходном сечении сопла может быть применен упрощенный метод расчета, основанный на допущении пренебрежимо малого содержания в продуктах сгорания атомарных газов и окиси азота ( при 1 ). В этом случае нужно учитывать содержание только H 2 O , CO2 , CO , N 2 , H 2 . Исходные уравнения для расчета состава продуктов сгорания: 21 констант равновесия K PCO PH 2O PCO2 PH 2 ; баланса элементов в относительной форме N C PCO2 PCO N O 2 PCO2 PCO PH 2 0 ; ; NN 2 PN 2 NN 2 PN 2 N H PH 2O PH 2 ; NN PN 2 закона Дальтона Pа Pi . Данная система решается аналитически при трех-четырех значениях температур, лежащих в зависимости от топлива в пределах от 1200 до 2200 К. Температуру продуктов сгорания Tа определяют по формуле линейной интерполяции из уравнения сохранения энтропии S к S а в предположении об изоэнтропном расширении газа в сопле. Также находится а и молекулярная полная энтальпия ПС на срезе сопла I ПС масса а . 9. Расчет критического сечения При расчете критического сечения сопла давление заранее неизвестно, в отличие от КС и среза сопла. Поэтому здесь расчет необходимо вести для трех-четырех предполагаемых давлений в критическом сечении, которые лежат в окрестностях ориентировочного значения: n n 1 n 1 Pкр Pк 1 . n 1 22 Для каждого пробного Pкр находятся последовательно Tкрi , I крi , крi , Rкрi R0 крi Fкр. уд.i 1 wкрi 2 I к I крi , крi , Pкрi крi wкрi . Rкрi Tкрi , Истинное критическое сечение, соответствующее ему давление Pкр и другие параметры будут те, при которых удельная площадь получится минимальной. 10. Теоретические параметры истечения После нахождения термодинамических параметров в характерных сечениях вычисляют важнейшие теоретические параметры истечения ПС: – удельный импульс на расчетном режиме I р wа 2I к I а ; – удельный импульс в пустоте I П wа Fа. уд Pа ; – характеристическая скорость c Fкр. уд. PС 0 Fкр. уд. Pк ; – коэффициент тяги в пустоте K П I П – относительная площадь среза Fа – n средний P lg к Pа показатель а . lg к 11. Пример расчета 23 c Fа. уд. ; Fкр. уд. изоэнтропы расширения Исходные данные: жO2 жH 2 , давление в КС Pк 210 Атм , коэффициент избытка окислителя 0,8 , давление на срезе сопла Pа 0,2 Атм , энтальпии компонентов топлива iO2 398,3 Кдж / кг и i H 2 4353,9 Кдж / кг . Выполнить термодинамический расчет в камере сгорания, на срезе сопла, определить параметры критического сечения, вычислить удельный импульс, характеристическую скорость, коэффициент тяги в пустоте и другие параметры истечения. Методика расчета. Определяем массовое стехиометрическое 1. соотношение компонентов 2. bi г i 32 2 ( 1) кг .ок k m 0 ок 8 , г bi ок i 222 кг .гор мольное стехиометрическое соотношение 1 моль.ок k m 0 k m 0 г 8 0.5 , oк 16 моль.г. действительное мольное соотношение моль.ок k m k m0 0.8 0.5 0.4 . моль.г. Условная формула топлива H bH ObO , где bH bHг km 0 bHo 2 0 2 ; bO k m 0 bOo 0,4 2 0,8 , т. е условная формула H 2 O0.8 . Энтальпия топлива Kдд 4353,9 6,4 398,3 iТ 932,72 7,4 кг 2. Составим систему уравнений для КС: состав ПС – Н20, OH, H2, O2, H, O. 24 Система уравнений будет включать в себя 4 уравнения диссоциации, 2 уравнения сохранения вещества и уравнение Дальтона: PH 2O K1 , PH 2 PO12/ 2 K2 K3 K4 PH 2O POH PH1 /22 PH 2 PH 2 PO2 PO 2 , , , 2 M Т 2 PH 2O POH 2 PH 2 PH , 0.8 M T PH 2O POH 2 PO2 PO , 210 PH 2O POH PH 2 PO2 PH PO . Расчёт ведём для 4 температур– 3200, 3400, 3600, 3800 К. При 3200 К справочные значения констант равновесия определяются из таблиц: К1 = 11,4025, К2 = 9,9108, К3 = 12,7616, К4 = 19,3274. Алгоритм метода Ньютона, как было показано в § 2.8, состоит в последовательном логарифмировании и линеаризации всех уравнений системы. Логарифмирование и линеаризация 1-го уравнения. 1 ln PH 2O ln PH 2 ln PO2 ln K 1 0 ; 2 1 ln PH 2O ln PH 2 ln PO2 H 2O , 2 где на i-ом итерационном шаге 1 H 2 0 ln PHi 2O ln PHi 2 ln POi 2 ln K 1 ; 2 25 ln PH 2 0 ln PHi 21O ln PHi 2O ; ln PH 2 ln PHi 21 ln PHi 2 ; ln PO2 ln POi 2 1 ln POi 2 . Второе уравнение: 1 ln PH 2 ln K 2 0 ; 2 1 ln PH 2O ln POH ln PH 2 H 2O , 2 1 i где H 2 0 ln PHi 2O ln POH ln PHi 2 ln K 2 ; 2 i 1 i ln POH ln POH ln POH . Третье уравнение: ln PH 2 2 ln PH ln K 3 0 ; ln PH 2O ln POH ln PH 2 2 ln PH H 2 , где H 2 ln PHi 2 2 ln PHi ln K 3 . Четвёртое уравнение: ln PO2 2 ln PO ln K 4 0 ; ln PO2 2 ln PO O2 , где O2 ln POi 2 2 ln POi ln K 4 . Пятое уравнение: логарифмирование – ln(2 PH 2O POH 2 PH 2 PH ) ln(2 M T ) 0 . Выражения для частных производных от левой части этого уравнения по логарифмам всех независимых переменных: ln(2 PH 2O POH 2 PH 2 PH ) 2 PH 2O ; ln PH 2O 2 PH 2O POH 2 PH 2 PH 26 ln(2 PH 2O POH 2 PH 2 PH ) ln POH ; ln(2 PH 2O POH 2 PH 2 PH ) ln PH 2 ln(2 PH 2O POH 2 PH 2 ; PH ) ln PH 2 PH 2O POH POH 2 PH 2 PH 2 PH 2 2 PH 2O POH 2 PH 2 PH 2 PH 2O PH POH 2 PH 2 PH ; ln(2 M T ) 2 M T 1. ln M T 2 MT После линеаризации пятое уравнение: i i 2 PH 2O ln PH 2O POH ln POH 2 PHi 2 ln PH 2 PHi ln PH (2 PHi 2O i i POH 2 PHi 2 PHi ) ln M T (2 PHi 2O POH 2 PHi 2 PHi ) H , где i H ln(2 PHi 2O POH 2 PHi 2 PHi ) ln(2 M Ti ) . Шестое уравнение: ln( PH 2O POH 2 PO2 PO ) ln(0,8 M T ) 0 . Линеаризация проводится аналогично пятому уравнению: i POH ln POH 2 POi 2 ln PO2 POi ln PO ( PHi 2O PHi 2O ln PH 2O i i POH 2 POi 2 POi ) ln M T ( PHi 2O POH 2 POi 2 POi ) O , где i O ln( PHi 2O POH 2 POi 2 POi ) ln(0,8 M Ti ) . Седьмое уравнение (Дальтона): ln PH 2O POH PH 2 PO2 PH PO ln(210) 0 . линеаризация: 27 i PHi 2O ln PH 2O POH ln POH PHi 2 ln PH 2 POi 2 ln PO2 i PHi ln PH POi ln PO ( PHi 2O POH PHi 2 POi 2 PHi POi ) P , где i P ln( PHi 2O POH PHi 2 POi 2 PHi POi ) ln(210) . Таким образом, на i-ом итерационном шаге для определения поправок надо решить систему линейных алгебраических уравнений (СЛАУ) AV B , где матрица коэффициентов СЛАУ A(7,7) имеет вид: 1 0 1 0 1 2 1 1 1 0 0 2 0 0 1 0 2 0 0 1 0 0 i 2P i 2PHi 2 0 POH PHi H 2O i i 0 2POi 2 0 PH 2O POH i PHi O POH PHi 2 POi 2 PHi 2 . Вектор неизвестных V (7) : 0 0 0 0 0 2 i i i i 0 (2PH 2O POH 2PH 2 PH ) i i i i i PO ( PH 2O POH 2PO2 PO ) 0 POi 28 0 0 ln PH O v(1) 2 ln POH v(2) ln P v(3) H2 ln PO v(4) . 2 ln PH v(5) ln PO v(6) ln M T v(7) Вектор правых частей B(7) : 1 (ln PHi 2O ln PHi 2 ln POi 2 ln K1 ) 2 1 i (ln PHi 2O ln POH ln PHi 2 ln K2 ) 2 (ln PHi 2 2 ln PHi ln K3 ) i i (ln PO2 2 ln PO ln K4 ) i i i i i i i i (2PHi O POH 2 ) (ln( 2 2 P M ) ln( 2 )) P P P P P H2 H H2O OH H2 H Т 2 i i i i i i i i i (PH2O POH 2PO2 PO ) (ln(PH2O POH 2PO2 PO ) ln(0,8 MТ )) i i (PHi 2O POH PHi 2 POi 2 PHi POi ) (ln(PHi 2O POH PHi 2 POi 2 PHi POi ) ln(210) Для использования метода Ньютона нужно задать начальные приближения Pi 0 и M T0 . Начальные приближения парциальных давлений выберем из условия их равенства, т. е: 210 0 PH0 2O POH PH0 2 PO02 PH0 PO0 35 Атм. 6 Начальное приближение количества молей топлива M T0 находим по формуле: M T0 0 Pi i T , где молекулярная масса топлива Н2О0,8 T 2 0,8 16 14,8 : 29 35(18 17 2 36 1 16) 212,8378 14,8 Для начального приближения найдём коэффициенты матрицы А и вектор правых частей В: A(7,5) 210, A(7,6) 175, B (1) 4,2115, B (2) 4,0713, B (3) 6,1018, B (4) 6,5169, B (5) 148,3797, B (6) 4,7948, B (7) 0 . Т.о., при начальном приближении на первом итерационном шаге требуется решить СЛАУ: M T0 v(1) 0 v(3) 12 v(4) 0 0 4,2115; 1 v(1) v(2) 2 v(3) 0 0 0 0 4,0713; 0 0 v(3) 0 2 v(5) 0 0 6,1018; 0 0 0 v(4) 0 2 v(6) 0 6,5169; 70 v(1) 35 v(2) 70 v(3) 0 35 v(5) 0 210 v(7) 148,3797; 35 v(1) 35 v(2) 0 70 v(4) 0 35 v(6) 175 v(7) 4,7948; 35 v(1) 35 v(2) 35 v(3) 35 v(4) 35 v(5) 35 v(6) 0 0. Итерационный процесс продолжается до достижения заданной точности решения. В результате для четырех значений температур находим состав ПС, который задается парциальными давлениями: 3200 К: PH 2O 163,261 Атм, POH 2,536 Атм, PH 2 42,19359 Атм, PO2 0,1151521 Атм, Атм, PO 0,0771879 Атм. 3400 К: 30 PH 1,188321 PH 2O 158,8805 POH 4,692934 Атм, Атм, PH 2 42,82694 Атм, PO2 0,328097 Атм, PH 3,048517 Атм, PO 0,229119 Атм. 3600 К: PH 2O 151,8135 POH 7,874271 Атм, Атм, PH 2 44,08862 Атм, PO2 0,7746226 Атм, PH 4,86757 Атм, PO 0,5814166 Атм. 3800 К: PH 2O 141,5756 Атм, POH 12,05246 Атм, PH 2 46,0981 Атм, PO2 1,521998 Атм, PH 7,474695 Атм, PO 1,27793 Атм. По рассчитанному составу ПС для четырех температур находим энтальпии ПС по формуле: I ПС I i Pi i Pi , где значения энтальпий i-го газа в составе ПС берем из таблиц при соответствующих значениях температур. 3200 К. I H 2O 25324,1 ккал , кмоль , I OH 33321,1 ккал кмоль , I H 2 23024,4 ккал кмоль , I O2 25399,1 ккал кмоль , I H 66522,8 ккал кмоль . I O 73696 ,8 ккал кмоль Энтальпия продуктов сгорания: ккал . I ПС 959,62977 кг Для того, чтобы перевести ккал в Кдж, надо полученное значение умножить на коэффициент 4,187. Тогда 31 I ПС 4,187 (959,62977) 4017,97 Кдж 3400 К. . I H 2O 22711,4 ккал кг . , I 35110,7 ккал , кмоль OH кмоль , I 27355,5 ккал , I H 2 24827,2 ккал кмоль O2 кмоль , I 74701,8 ккал . I H 67516,4 ккал кмоль O кмоль Вычисления по формуле (9) приводят к результату: I ПС 668,819 ккал 2800,3467 Кдж . кг кг ,I 36913,7 ккал , 3600К. I H 2O 20082,2 ккал кмоль OH кмоль , I 29287,8 ккал , I H 2 26649,6 ккал кмоль O2 кмоль , I 75710 ккал , I H 68510 ккал кмоль O кмоль I ПС 395,155 ккал 1654,515 Кдж . кг кг , I 38729,1 ккал , 3800 К. . I H 2O 17438,7 ккал кмоль OH кмоль , I 31254,7 ккал , I H 2 28491 ккал кмоль O2 кмоль , I 76722 ккал . I H 69503,6 ккал кмоль O кмоль I ПС 8,076 ккал 33,8152 Кдж . кг кг Как отмечалось выше, энтальпия ПС должна равняться 932,72 Кдж . Поэтому энтальпии топлива, т.е. кг температура в камере сгорания лежит в интервале от 3600 К ( I ПС 1654,515 Кдж ) до 3800 К ( I ПС 33,815 Кдж ). кг кг Действительное значение температуры можно определить графически или, используя формулу линейной интерполяции. 32 (3800 3600) (1654,515 932,72) (1654,515 33,815) 3689,072 К 3690 К Зная температуру в камере сгорания, можно посчитать действительный состав продуктов сгорания, также используя линейную интерполяцию: P Pi 3600 Pi Pi 3600 i 3800 (3690 3600) ; 3800 3600 151,5756 151,8135 PH 2O 151,8135 90 147,2064 Атм ; 200 12,05246 7,874271 POH 7,874271 90 9,7545 Атм ; 200 46,0981 44,08862 PH 2 44,08862 90 44,9929 Атм ; 200 1,521999 0,7746226 PO2 0,7746226 90 1,11094 Атм ; 200 7,474695 4,86757 PH 4,86757 90 6,04078 Атм ; 200 1,27793 0,5814166 PO 0,5814166 90 0,89485 Атм . 200 Определим суммарное значение давления в камере сгорания, т.к. использование линейной интерполяции при определении состава ПС Pi могло привести к погрешностям, связанным с нелинейными функциональными связями Pi f (T ) : P Pi 210,00037 Атм , т.е. расчет состава ПС можно считать удовлетворительным. Для термодинамического расчета в выходном и критическом сечениях сопла необходимо вычислить значение энтропии на входе в сопло: T 3600 33 0 ( S i Pi 8,314 Pi ln Pi ) . S i Pi Кдж , [ Pi ] ф.атм. Здесь размерности [ S i0 ] кмоль, С Значения стандартных энтропий являются S i0 табличными значениями. Используя формулу линейной интерполяции, определим значения стандартных энтропий продуктов сгорания для температуры 3690 К: S i03700 S i03600 0 0 S iТ S i 3600 (3690 3600) . 3700 3600 SH0 2O 70,6463 , 0 SOH 63,0059 , SH0 2 50,1119 , SO02 69,7439 , SH0 39,7681 , SO0 51,0111 71,008 70,6463 ккал Кдж 90 70,9718 297,159 100 кмоль К кмоль К 63,2542 63,0059 ккал Кдж 90 63,2294 264,741 100 кмоль К кмоль К 50,3635 50,1119 ккал Кдж 90 50,3383 210,766 100 кмоль К кмоль К 70,0128 69,7439 ккал Кдж 90 69,5859 293,031 100 кмоль К кмоль К 39,9043 39,7681 ккал Кдж 90 39,8907 167,022 100 кмоль К кмоль К 51,1496 51,0111 ккал Кдж 90 51,1357 214,105 100 кмоль К кмоль К . Используя эти значения, находим суммарное значение энтропии ПС: 34 S ПС 16,72388 Кдж . кг К Срез сопла. Составим систему уравнений для среза сопла. Считаем, что на срезе сопла в смеси ПС присутствуют только H2O и H2, т.е. система будет состоять только из уравнения сохранения вещества и закона Дальтона. M T 2 2 PH 2O 2 PH 2 PH 2O 4 PH 2 M T 0,8 PH 2O PH 2 0,04 Атм. PH 2O 0,16 Атм. . Т.е. состав на срезе от Та не меняется. Найдём значение энтропии ПС на срезе в зависимости от Та. PH 2O ( S H0 2O 8,314 ln 0,16) PH 2 ( S H0 2 8,314 ln 0,04) S PH 2O H 2O PH 2 H 2 0,16 S H0 2O 2,43777 0,04 S H0 2 1,07047 0,16 18 0,04 2 0,16 S H0 2O 0,04 S H0 2 3,508 2,96 0,054054 S H0 2O 0,0135135 S H0 2 1,185135 Начнём с Т=1200 К: ккал Кдж S H0 2O 57,4654 4,187 57,4654 240,60763 кмоль К кмоль К ; ккал Кдж , S H0 2 41,0365 171,81983 кмоль К кмоль К Кдж S ПС 16,51283 . кг К 35 Т=1300 К ккал Кдж ; 4,187 58,309 244,13978 кмоль К кмоль К ккал Кдж S H0 2 41,6334 174,31905 , кмоль К кмоль К Кдж S ПС 16,73753 . кг К Т.к. значение энтропии ПС на срезе сопла должно равняться энтропии на входе в сопло, то истинное значение Кдж температуры Та ( S ПС 16,72388 ) лежит между 1200 К кг К Кдж Кдж ( S ПС 16,51283 ) и 1300 К ( S ПС 16,73753 ). кг К кг К Используя формулу линейной интерполяции, найдем температуру на срезе Та: 1300 1200 Tа 1200 (16,72388 16,51283) Найде (16,73753 16,51283) 1293,925 1294 К . м энтальпию ПС на срезе сопла: 48423,2 49477,2 94 I H 2O (1294) 49477,2 100 ккал Кдж 48486,44 203012,72 ; кмоль кмоль Кдж 7184,3 6438,5 ; I H 2 (1294) 6438,5 94 7139,55 кмоль 100 Кдж 203012,72 0,16 7139,55 0,04 10877,16 I ПС . 18 0,16 2 0,04 кг Удельный импульс на расчетном режиме: S H0 2O 58,309 I P wa 2(i k i a ) 2(932,72 10877,16) 1000 4460 м . с Плотность ПС в КС и на срезе: 36 18 147,2064 17 9,7545 2 44,9929 32 1,11094 210 кг 6,04078 16 0,89485 14,1028 ; кмоль 18 0,16 2 0,04 кг 14,8 а ; 0,2 кмоль Кдж 8,314 R КС 0,5895 ; кг К 14,1028 PКС кг Кдж 8,314 Rа 0,5612 9,7795 3 ; КС кг К 14,8 R КС TКС м P кг а а 0,0279 3 . Rа Tа м Средний показатель изоэнтропы расширения. P lg к Pa n 1,187 . к lg КС a Удельная площадь среза сопла. F 1 1 0,0080364 . Fа. уд. а m wа а 4460 0,0279 Удельный импульс в пустоте. I П wа Fа. уд. Pа 4622,8 4623 м . с Расчет критического сечения сопла. Проведем термодинамический расчет состава и температуры ПС для четырех предполагаемых значений давления в критическом сечении: 110 Атм, 115 Атм, 120 Атм, 125 Атм. Расчет проводится по системе уравнений для КС, но температура и действительный состав ПС определяется из условия S S к . Запишем результаты проведенных расчетов. P 110 Атм : 37 T 3447 K ; PH 2O 80,1687 Атм ; POH 3,7523 Атм ; PH 2 22,9091Атм ; PO2 0,3807 Атм ; PH 2,5061Атм ; PO 0,2832 Атм кг ; 14,29 ; кг ПС кмоль 8,314 Кдж R 0,582 ; 14,29 кг К I ПС 2284,93 Кдж 110 101300 кг 5,5544 3 ; (582 3447) м W КР 2(932,72 2284,93) 1000 1644,512 м Fкр уд. с 2 м с 1 1,095 10 4 . кг 5,5544 1644,512 P 115 Атм : T 3464 K ; PH 2O 83,6045 Атм ; POH 4,018 Атм ; PH 2 23,993 Атм ; PO2 0,4112 Атм ; PH 2,6664 Атм ; PO 0,3069 Атм кг ; кг кмоль 8,314 Кдж R 0,58232 ; 14,27747 кг К 101300 кг 115 5,77525 3 ; (582,32 3464) м W 2(932,72 2193,366) 1000 1587,859 м I ПС 2193,366 Кдж ; ПС 14,27747 КР 2 м с 1 1,0905 10 4 . кг 5,77525 1587,859 P 120 Атм : Fкр уд. 38 с T 3480 K ; PH 2O 87,05113 Атм ; POH 4,2807 Атм ; PH 2 25,07477 Атм ; PO2 0,44053 Атм ; PH 2,82343 Атм ; PO 0,32944 Атм кг ; 14,267 ; кг ПС кмоль 8,314 Кдж R 0,582746 14,267 кг К 101300 кг 120 5,9942 3 ; (582,746 3480) м I ПС 2109,62 Кдж W КР 2(932,72 2109,62) 1000 1534,211 м Fкр уд. с 2 м с 1 1,0874 10 4 . кг 5,9942 1534,211 P 125 Атм : T 3496 K ; PH 2O 90,4858 Атм ; POH 4,5502 Атм ; PH 2 26,1584 Атм ; PO2 0,47028 Атм ; PH 2,98321Атм ; PO 0,35215 Атм I ПС 2026,364 Кдж кг ; ПС 14,25665 кг ; кмоль 8,314 Кдж 0,583165 ; 14,25665 кг К 101300 кг 125 6,2109 3 ; (583,165 3496) м R W КР 2(932,72 2026,364) 1000 1534,211 м , с 2 м с 1 1,0886 10 4 Fкр уд. . кг 6,2109 1534,211 39 Таким образом, в результате расчета при четырех предполагаемых давлениях в критическом сечении получена дискретная, состоящая из четырех значений функция Fкр. уд. f ( P ) . Как отмечалось выше, истинное критическое сечение будет, если Fкр. уд. min . То есть необходимо найти давление, при котором выполняется это условие. Эта задача может быть решена следующим образом. Полученная дискретная функция Fкр. уд. f ( P ) заменяется непрерывным аналогом путем интерполяции кубическими сплайнами. Непрерывная интерполяционная функция исследуется на экстремум, и найденная точка экстремума и будет искомой, в которой определяется истинное давление в критическом сечении. Итак, существует дискретная функция: P Fкр. уд. 10 3 110 115 120 125 0,1095 0,10905 0,10874 0,10886 Проведем сплайн-интерполяцию этой функции, т.е. найдем коэффициенты трех кубических многочленов на соответствующих интервалах определения функции: [110;115] 1 ( x) a1 b1 ( x 110) c1 ( x 110) 2 d1 ( x 110) 3 ; [115;120] 2 ( x) a 2 b2 ( x 115) c 2 ( x 115) 2 d 2 ( x 115) 3 ; [120;125] 3 ( x) a3 b3 ( x 120) c3 ( x 120) 2 d 3 ( x 120) 3 . Здесь ( x) – это непрерывный аналог дискретной функции Fкр. уд. f ( P ) . После решения задачи интерполяции на участке [120,125] кубический сплайн выглядит: 40 3 ( x) 0,10874 1,8046 10 5 ( x 120) 1,3 10 5 ( x 120) 2 . 8,6687 10 7 ( x 120) 3 Экстремум этой функции ищется обычным способом: d 3 ( x ) находится производная и решается уравнение 0. В dx результате получается экстремальное значение x (т.е. P ), причем в данном случае это будет точка минимума функции Fкр. уд. f ( P ) . В нашем случае минимум удельной площади критического сечения обеспечивается при P 120,64 Атм . Таким образом, давление в критическом сечении найдено. Далее необходимо провести термодинамический расчет для этого давления, в результате которого находим: 120,64 Атм. T 3482 K ; PH 2O 87,49 Атм ; POH 4,3163 Атм ; PH 2 25,214 Атм ; PO2 0,4442 Атм ; PH 2,8434 Атм ; PO 0,3323 Атм кг ; кг кмоль 8,314 Кдж 101300 кг R 0,5828 ; 125 6,0222 3 ; 14,2656 кг К (582,8 3482) м W КР 2(932,72 2098,94) 1000 1527,23 м с 2 м с 1 1,0873 10 4 Fкр уд. . кг 6,0222 1527,23 После нахождения параметров критического сечения находятся остальные теоретические параметры истечения. Характеристическая скорость: C* Fкруд PK 1,0873 10 4 210 101300 2312,965 м . с Коэффициент тяги в пустоте: I ПС 2098,94 Кдж ; ПС 14,2656 41 IП 4623 1,999 . C* 2312,965 Относительная площадь среза Fа. уд. . 73,91 . Fа Fкр. уд. КП Найдём средние показатели изоэнтропы течения n до критики и после: P lg K P КС – критика: n 1,143 K lg lg Критика - срез: n P Pa lg a 1,191 Общий: n = 1,187. 42 Библиографический список 1. Алемасов В.Е., Древалин А.Ф., Тишин А.П. Теория ракетных двигателей / Под ред. В.П.Глушко. – М.: Машиностроение, 1989, 464 с. 2. Основы теории и расчета ракетных двигателей. В 2 кн. Кн. 1. Учеб. для авиац. спец. вузов / А.П. Васильев, В.М. Кудрявцев, В.А. Кудрявцев и др.; под ред. В.М. Кудрявцева. М.: Высшая школа, 1993, 383 с. 3. Шевелюк М.И. Теоретические основы проектирования жидкостных ракетных двигателей. – М.: Оборонгиз, 1960, 684 с. 4. Териодинамические и теплофизические свойства продуктов сгорания. Справочник в 10 т. / Под ред. В.П.Глушко. – М.: ВИНИТИ АН ССР, 1971-1979. 5. Мелькумов Т.М., Мелик-Пашаев Н.И., Чистяков П.Г. и др. Ракетные двигатели. – М.: Машиностроение, 1968, 511 с. 43 Содержание Введение Термодинамический расчет процессов горения и истечения. Теоретические основы 2. Равновесность процесса 3. Задачи термодинамического расчета 4. Основы расчета термохимических свойств топлива 5. Теоретическое (стехиометрическое) соотношение компонентов 6. Энтальпия 7. Система уравнений для выполнения термодинамического расчета 8. Модель расчета равновесного состава и температуры рабочего тела в камере сгорания и в выходном сечении сопла 9. Расчет критического сечения 10. Теоретические параметры истечения 11. Пример расчета Библиографический список 1. 44 3 4 6 7 8 9 12 15 19 24 24 25 44 МЕТОДИЧЕСКИЕ УКАЗАНИЯ для выполнения курсовой работы по дисциплине «Методы математического моделирования» для студентов специальности 160700.65, 24.05.02 «Проектирование авиационных и ракетных двигателей» очной формы обучения Составители: Гуртовой Андрей Александрович Демьяненко Юрий Васильевич Кретинин Александр Валентинович Сушков Алексей Михайлович В авторской редакции ФГБОУ ВПО «Воронежский государственный технический университет» 394026 Воронеж, Московский пр., 14