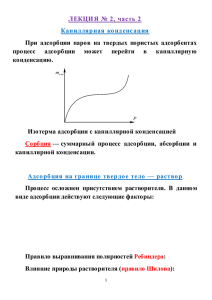
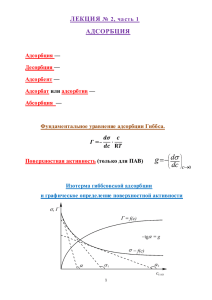
1. Особенность поведения веществ на границе раздела фаз. На границе раздела фаз, например на поверхности жидкости, молекула испытывает неодинаковое притяжение со стороны каждой из фаз. На границе «жидкость — воздух» притяжение будет сильнее со стороны жидкости, и молекула будет «втягиваться» внутрь жидкости (рис. 1.3, б). В любом случае силы, действующие на молекулу, находящуюся на границе раздела фаз, не уравновешены. Молекулы на границе раздела фаз взаимодействуют сильнее с одноимёнными молекулами со стороны жидкой фазы, нежели газообразной, поскольку их плотность в жидкости многократно превышает плотность в газовой фазе. Все жидкости и твердые тела ограничены внешней поверхностью, на которой они соприкасаются с фазами другого состава и структуры, например, С паром, другой жидкостью или твердым телом. Свойства вещества в этой межфазиой поверхности, толщиной в несколько поперечников атомов или молекул, отличаются от свойств внутри объема фазы. Внутри объема чистого вещества в твердом, жидком или Газообразном состоянии любая молекула окружена себе подобными молекулами. В пограничном слое молекулы находятся во взаимодействии или с разным числом молекул (например, на границе жидкости или твердого тела с их паром), или с молекулами различной химической природы (например, границе двух взаимно малорастворимых жидкостей). Чем больше различие в напряженности межмолекулярных сил, действующих в каждой из фаз, тем больше потенциальная энергия межфазовой поверхности, кратко называемая поверхностной энергией. 2. Что такое адсорбция? Дайте понятие физической адсорбции и хемосорбции. Адсорбция - это процесс, происходящий на границе раздела фаз. Он затрагивает только поверхностные слои, взаимодействующих фаз, и не распространяется на глубинные слои этих фаз. Адсорбцией называют явление накопления одного вещества на поверхности другого. В общем случае, адсорбцией называют изменение концентрации вещества на границе раздела фаз. Хемосорбцией называется поглощение одного вещества другим, сопровождающееся их химическим взаимодействием. Физическая адсорбция имеет место в том случае, когда частицы адсорбата и адсорбента связываются только относительно слабыми силами межмолекулярного взаимодействия (Ван-дер-Ваальсовыми силами). Процесс физической адсорбции сопровождается выделением сравнительно небольшого количества теплоты – в пределах 8…20 кДж/моль. 3. Факторы, влияющие на процессы адсорбции. 1. Природа фаз (предельная адсорбция, константа α). Кристаллические вещества адсорбируют хуже, чем аморфные. Лучше адсорбируются газы, которые легче конденсируются. Например, активированный уголь хорошо адсорбирует хлор (Ткип = 239,7 К), аммиак (Ткип = = 240 К), но не адсорбирует оксид углерода (II) (Ткип = 83 К), азот (Ткип = 77,0 К), водород (Ткип = = 20,0 К). 2. Давление (концентрация в случае адсорбции из раствора). 3. Температура. Повышение температуры способствует понижению адсорбции и усилению десорбции. 4. Какие уравнения описывают адсорбцию на твердой поверхности? Изотерма адсорбции по Ленгмюру является уравнением гиперболы и представлена в виде: Г = Г¥ × где Г – величина адсорбции на единицу поверхности; Г¥ - предельное количество вещества, адсорбированного единицей поверхности при полном насыщении поверхности; С – равновесная концентрация. В уравнении Ленгмюра также имеются две константы - Г¥ и К. Уравнение Лэнгмюра справедливо для мономолекулярной адсорбции на адсорбенте с энергетически эквивалентными адсорбционными центрами. Однако реальные поверхности твердых тел, как правило, не обладают таким свойством, особенно в случае пористых тел. В этом случае адсорбция на поверхности твердого тела описывается эмпирическим уравнением Г. Фрейндлиха Адсорбция растворенного вещества на твердой поверхности подчиняется определенной закономерности, согласно которой концентрация адсорбированного вещества возрастает не пропорционально его концентрации в растворе, а значительно медленнее, и пропорциональна корню n-ой степени из концентрации раствора. Эта зависимость при постоянной температуре может быть представлена следующем уравнением: Х/m = К С1/n где Х – количество (моль) вещества, адсорбированного m г адсорбента: Сравновесная концентрация; К и 1/n – эмпирические константы, характерные для данных адсорбента и адсорбата, значение 1/n колеблется между 0,1 – 0,7. Данное уравнение известно под названием изотермы адсорбции и имеет вид параболы. 5. Почему уравнение адсорбции Гиббса не применяют для описания поверхностных явлений на границе раздела твердой адсорбент-адсорбат? Непосредственное применение фундаментального уравнения изотермы адсорбци и Гиббса к адсорбции на твердой поверхности невозможно из-за отсутствия сведений о поверхностном натяжении компонентов раствора на границе с твердой фазой, однако это уравнение используется при выводе соотношений, которые содержат только измеряемые величины и являются уравнениями 6. Почему уравнение изотермы Ленгмюра неверно описывает большинство процессов, имеющих место на поверхности твердых тел? Представления, развитые Лэнгмюром, в значительной степени идеализируют и упрощают действительную картину адсорбции. На самом деле поверхность большинства адсорбентов неоднородна, молекулы адсорбата взаимодействуют друг с другом на поверхности адсорбента, и адсорбция часто не заканчивается образованием мономолекулярного слоя. В этом случае уравнение изотермы адсорбции усложняется. 7. Что такое изотерма адсорбции? Изотерма адсорбции — зависимость величины адсорбции от концентрации адсорбтива при постоянной температуре. 8. Что означают постоянные величины в уравнениях изотермы адсорбции? Х/m = К С1/n, где Х – количество (моль) вещества, адсорбированного m г адсорбента: С- равновесная концентрация; К и 1/n – эмпирические константы, характерные для данных адсорбента и адсорбата, значение 1/n колеблется между 0,1 – 0,7. Данное уравнение известно под названием изотермы адсорбции и имеет вид параболы. Константа k представляет величину адсорбции при равновесной концентрации адсорбтива, равной 1 моль/л. Показатель 1/n – правильная дробь, характеризует степень приближения изотермы к прямой. 9. Изотерма адсорбции Фрейндлиха в логарифмических координатах. Какой смысл имеют коэффициенты k и 1/n в уравнении Фрейндлиха-Бедекера? Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы. Другими словами, чем выше давление или чем больше концентрация растворенного вещества, тем больше вещества будет адсорбироваться на поверхности, однако пропорциональность должна носить не прямой, а степенной характер. где р – равновесное давление; или , где с – равновесная концентрация; вместо β – k!!! Константа k представляет величину адсорбции при равновесной концентрации адсорбтива, равной 1 моль/л. Показатель 1/n – правильная дробь, характеризует степень приближения изотермы к прямой. Константы уравнения Фрейндлиха легко находятся графическим способом после его логарифмирования: На графике, построенном в координатах lgГ =f(lgC), отрезок, отсекаемый прямой на оси ординат, равен lgk, а тангенс угла наклона α прямой к оси абсцисс равен 1/n. Уравнение Фрейндлиха является эмпирическим уравнением. Кроме того, это уравнение, представляющее собой уравнение параболы, не может дать прямолинейного нарастания адсорбции от равновесной концентрации, а также предельного значения адсорбции, не зависящего от концентрации. 10. Понятие об ионообменной адсорбции. Ионообменная адсорбция – это процесс обмена эквивалентным количеством одноименно заряженных ионов из раствора и ионами на поверхности адсорбента. Адсорбенты, способные к обмену катионов, называют катиониты, а способные к обмену анионов – аниониты. это обратимый процесс стехиометрического обмена ионами между раствором электролитов и твердым телом. Твердый адсорбент, практически нерастворимый в воде, поглощает из раствора ионы одного заряда (катионы или анионы) и вместо них отдает в раствор эквивалентное число других ионов того же заряда. Такой обменный ионный процесс аналогичен обменным химическим реакциям, но только протекает на поверхности твердой фазы. Ионообменная адсорбция имеет следующие особенности: 1) 2) 3) специфична, т. е. к обмену способны только определенные ионы; протекает более медленно, чем молекулярная адсорбция; может приводить к изменению рН среды. 11. Значение сорбционных процессов в биологических системах. Сорбция (от лат. sorbeo — поглощаю), поглощение твёрдым телом или жидкостью вещества из окружающей среды. Поглощающее тело называется сорбентом, поглощаемое им вещество — сорбатом (или сорбтивом). В биологических системах большую роль играет сорбция (адсорбция) определённых веществ на поверхности клеток и мембранах внутриклеточных структур, а также сорбция (абсорбция) органоидами клетки и молекулами биополимеров. Для биологических систем характерна высокая специфичность (избирательность) сорбции, что определяется особенностями пространственной конфигурации молекул сорбента. Эти макромолекулы играют роль рецепторов для соответствующего сорбата. Примерами сорбции может служить связывание молекул CO2 хлоропластами при фотосинтезе у растений, аминокислот — эритроцитами, переносящими их к тканевым клеткам, прикрепление фага к поверхности чувствительных к нему бактериальных клеток и др. 12. Поверхностно-активные вещества, особенности строения молекул. Примеры применения ПАВ. Поверхностно-активные вещества (ПАВ) — вещества, снижающие при растворении поверхностное натяжение растворителя. Дифильность молекул ПАВ — наличие полярной (гидрофильной) и неполярной (гидрофобной) частей — характерная особенность их строения, придающая этим молекулам особые свойства. Дифильностыо молекул ПАВ обусловлена их тенденция собираться на границе раздела фаз, погружая гидрофильную часть в воду и изолируя от воды гидрофобную. Эта тенденция определяет их поверхностную активность — способность адсорбироваться на границе раздела вода — воздух или вода — масло, смачивать поверхность гидрофобных тел, образовывать структуры типа мыльных пленок или липидных мембран. Органические ПАВ с дифильным строением молекул классифицируются на анионогенные (анионные), катионогенные (катионные), амфо- литные и неионогенные. К природным ПАВ относятся разнообразные биологически активные вещества — липиды, белки, холевые кислоты, входящие в состав желчи. Все они имеют важное значение для жизнедеятельности организмов. ПАВ находят широкое применение в различных отраслях промышленности и в быту. Одно из основных применений ПАВ — использование их в качестве моющих средств — детергентов. Анионные ПАВ используют как смачиватели, основные компоненты моющих средств, пенообразователи; они являются главными мицеллообразующими ПАВ с наибольшим объемом производства и ассортиментом. Катионные ПАВ используют в качестве ингибиторов коррозии, фло- тореагентов, бактерицидных, дезинфицирующих и фунгицидных средств; в текстильной промышленности как закрепители при окрашивании и при отделке готовых тканей. 1. Дайте понятие истинной, средней скорости реакции. 2. Дайте понятие кинетического уравнения, порядка реакции. Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим уравнением реакции в дифференциальной форме. Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. 3. Для каких реакций частные порядки по реагентам в кинетическом уравнении совпадают со стихиометрическими коэффициентами уравнения реакции? Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода: гидролиза этилового эфира 4. Какой физический смысл константы скорости химической реакции? от чего она зависит? Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. 5. Дайте понятие "молекулярность" реакции. Для каких реакций порядок и молекулярность совпадают? Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия. Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. 6. В чём сущность интегрального и дифференциального метода определения порядка реакции? Интегральные методы определения порядков реакций. Эти методы основаны на применении интегрального кинетического уравнения. Их преимущество в том, что они используют первичные данные (концентрация — время), полученные непосредственно из опыта. При этом достигается усреднение константы скорости. Различают несколько интегральных методов. Способ подстановки. Позволяет установить соответствие опытных данных одному из интегральных кинетических уравнений для целочисленных порядков (от 0 до 2). Можно этот способ осуществлять алгебраически, а можно графически. 7. В чём физико-химический смысл энергии активации? Какие существуют методы определения энергии активации?