1. Характеристи¬ка химического эле¬мента на основании его положения в Пе¬риодической системе Д. И. Менделеева
advertisement

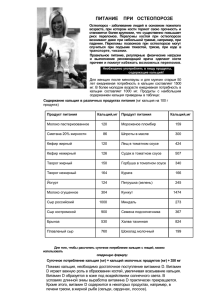
1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Чтобы узнать значение слова мы обращаемся к словарю. Чтобы узнать какое растение мы нашли, мы смотрим в каталог. Что же мы будем использовать, если необходимо дать характеристику химическому элементу? Основной источник познаний о химических элементах – Периодическая система химических элементов Дмитрия Ивановича Менделеева. Навыки описывать химический элемент, имея перед собой только эту таблицу, крайне необходимы любому ученику и являются основой познаний о химии. Составим план описания химического элемента с помощью Периодической системы Дмитрия Ивановича Менделеева. 1. Находим химический элемент в таблице и по его положению описываем строение его атомов. 2. Все химические элементы в таблице делятся на металлы и неметаллы. Отмечаем металл или неметалл, описываемый нами элемент. 3. Сравнение свойств нашего простого вещества металла или неметалла с соседними по подгруппе элементами. 4. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами. 5. Состав и характеристика высшего оксида описываемого элемента (то есть относится к основным, кислотным или амфотерным). 6. Состав и характеристика высшего гидроксида (то есть он является основанием, амфотерным гидроксидом, кислородосодержащей кислотой). 7. Если элемент неметалл, то состав летучего водородного соединения. При описании химического элемента металла и неметалла следует руководствоваться знаниями о строении химических элементов, а также основными закономерностями изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп и периодов Периодической системы Дмитрия Ивановича Менделеева, которые были рассмотрены ранее. Дадим описание одного химического элемента металла и одного неметалла в соответствии с составленным планом. Характеристика металла на примере кальция (Са). 1. Первый пункт - находим химический элемент в таблице и по его положению описываем строение его атомов. РИСУНОК – Таблица Менделеева, выделяем Кальций. Кальций в Периодической системе находится под номером 20 и имеет относительную атомную массу 40. Значит, порядковый номер кальция равен 20 и заряд его ядра +20 (Z (зэт) - число протонов, имеющих положительный заряд). Массовое число равно 40 (А=40 (а равно 40)). Отсюда находим N (эн) – число нейтронов, не имеющих заряда. N = А – Z (эн равно а минус зэт) равно 20. Так как атом в целом электронейтрален (число протонов равно числу электронов), то число электронов равно 20. Химический элемент кальций находится в четвертом периоде Периодической системы, значит, электроны расположены на четырех энергетических уровнях. Записываем на основании этого электронную формулу кальция: 20Ca 2e 8e 8e 2e (черточки над е) Это значит, что на первом энергетическом уровне вокруг ядра атома кальция находится два электрона, на втором – восемь, на третьем – тоже восемь, на четвертом – два электрона. Из электронной формулы видно, что кальций имеет на внешнем (четвертом) энергетическом уровне два электрона, то есть, отдавая внешние, наименее устойчивые электроны, он будет проявлять восстановительные свойства и иметь степень окисления +2. Восстановительные свойства кальция будут выражены сильнее, чем у магния и бериллия, но слабее, чем у стронция. Это обусловлено тем, что чем больше радиус атома (он возрастает с увеличением количества энергетических уровней), тем легче внешние электроны покидают атом, так как связь с ядром уменьшается. РИСУНОК 1. Когда электроны покидают внешнюю оболочку атома, он превращается в ион. В частности, кальций превращается в ион Са2+ (кальций-два-плюс). 2. Второй пункт плана описания. Отмечаем металл или неметалл, описываемый нами элемент. Атомы кальция образуют простое вещество, соединяясь металлической связью в металлическую кристаллическую решетку. Значит, кальций металл, обладающий такими металлическими свойствами как металлический блеск, хорошая теплопроводность и электропроводность, пластичность, высокая плотность и высокая температура плавления. 3. Третий пункт плана. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами. Металлические свойства кальция сильнее, чем у бериллия и магния, но слабее, чем у стронция. Металлические свойства веществ обусловлены способностью атомов, входящих в эти вещества отдавать внешние электроны. Из предыдущего пункта известно, что атом кальция гораздо быстрее отдает свои внешние электроны, чем бериллий и магний. 4. Четвертый пункт плана. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами. Металлические свойства кальция выражены слабее, чем у калия. Калий на внешнем энергетическом уровне содержит только один электрон, а кальций два. Так как металлические свойства обусловлены устойчивостью электронов на внешнем энергетическом уровне атома (чем менее устойчивы электроны, тем выше металлические свойства), то один электрон у калия будет менее устойчив, а значит, его металлические свойства будут выше. 5. Пятый пункт плана. Состав и характеристика высшего оксида описываемого элемента. Оксид кальция СаО (кальций-о) является основным оксидом и проявляет такие свойства основного оксида как взаимодействие с водой с образованием щелочи, взаимодействие с кислотным оксидом с образованием соли, взаимодействие с кислотой с образованием соли и воды. 6. Шестой пункт плана. Состав и характеристика высшего гидроксида. В качестве гидроксида кальцию соответствует основание Са(ОН)2 (кальций-о-аш-два). Он проявляет типичные свойства оснований: мылкость на ощупь, изменение окраски индикаторов, взаимодействие с кислотами с образованием соли и воды, взаимодействие с оксидом неметалла с образованием соли и воды, взаимодействие с солью с образованием новой соли и нового основания. 7. Последний, седьмой пункт - состав летучего водородного соединения. Металл кальций летучего водородного соединения не образует. Характеристика неметалла фосфора Р (пэ) в соответствии с планом. 1. Фосфор – элемент VA-группы Периодической системы, 3-го периода. Порядковый номер фосфора равен 15 и заряд его ядра +15 (число протонов Z (зэт)). Так как атом в целом электронейтрален (число протонов равно числу электронов), то число электронов равно 15. Массовое число 30 (А=30 (а равно 30)). Отсюда находим N (эн) – число нейтронов. N = А – Z (эн равно а минус зэт) равно 15. Записываем строение электронной оболочки фосфора. - - (черточки над е). Это значит, что на первом 15Р 2е 8е 5е энергетическом уровне вокруг ядра атома кальция находится два электрона, на втором – восемь, на третьем – пять электронов. Атомы фосфора проявляют как окислительные (степень окисления при этом -3), так и восстановительные свойства (степени окисления +3 и +5). Фосфор – менее сильный окислитель, чем азот, но более сильный, чем мышьяк. Это связано с тем, что радиус атомов от азота к мышьяку увеличивается. По этой же причине восстановительные свойства пятой группы, главной подгруппы при переходе от азота к мышьяку усиливаются. 2. Фосфор относится к типичным неметаллам. Строение кристаллической решетки фосфора зависит от его аллотропной модификации. Есть белый, красный и черный фосфор. У наиболее распространенного белого фосфора молекулы имеют вид тэтраэдра. Красный и черный фосфор имеют иное строение кристаллической решетки. 3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка. 4. Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее, чем у серы. 5. Высший оксид фосфора имеет формулу Р2О5 (пэ-два-о-пять). Это кислотный оксид, который проявляет все типичные свойства кислотных оксидов. Например, такие как при взаимодействии со щелочью образовывать соль и воду, при взаимодействии с основным оксидом образовывать соль, при взаимодействии с водой образовывать кислоту. 6. Высший гидроксид фосфора – фосфорная кислота Н3РО4 (аш-три-пэ-очетыре), раствор которой проявляет все типичные свойства кислот. Например, такие как кислый вкус, изменение окраски индикаторов, взаимодействие с основаниями и оксидами металлов с образованием соли и воды. 7. С водородом фосфор образует летучее соединение фосфин РН3 (пэ-аштри). При помощи Периодической системы Дмитрия Ивановича Менделеева можно дать характеристику большинству элементов-металлов и элементовнеметаллов главных подгрупп.