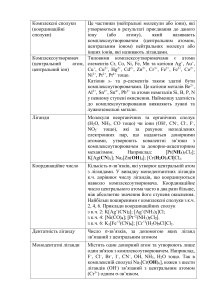
Хімічні властивості основних оксидів 1. Основні оксиди, утворені лужними і лужноземельними металами, взаємодіють з водою, утворюючи розчинні у воді основи — луги. Оксиди інших металів у воді не розчиняються. Основний оксид + вода основа CaO+H2O=Ca(OH)2 → 2. Основні оксиди взаємодіють з кислотами, утворюючи сіль і воду. Основний оксид + кислота сіль + вода CuO+H2SO4=CuSO4+H2O → 3. Основні оксиди можуть взаємодіяти з оксидами, що належать до інших класів, утворюючи солі. Основний оксид + кислотний оксид сіль MgO+CO2=MgCO3 → Хімічні властивості кислотних оксидів 1. Кислотні оксиди можуть взаємодіяти з водою, утворюючи кислоти. Кислотний оксид + вода кислота SO3+H2O=H2SO4 → Зверни увагу! Силіцій оксид SiO2 з водою не реагує. 2. Кислотні оксиди взаємодіють з лугами, утворюючи сіль і воду. Кислотний оксид + основа сіль + вода SO2+2NaOH=Na2SO3+H2O → 3. Кислотні оксиди можуть реагувати з основними (та амфотерними) оксидами, утворюючи солі. Кислотний оксид + основний оксид сіль CO2+CaO=CaCO3 → Хімічні властивості амфотерних оксидів 1. Амфотерні оксиди при взаємодії з кислотою або кислотним оксидом, виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами, утворюючи сіль і воду. ZnO+2HCl=ZnCl2+H2O 2. Амфотерні оксиди при взаємодії з лугом або з оксидом лужного або лужноземельного металу, проявляють кислотні властивості. При сплаві їх з лугами протікає хімічна реакція, в результаті якої утворюється сіль і вода. Якщо ж з калій гідроксидом ZnO+2KOH=K2ZnO2+H2O сплавити алюміній оксид, крім води, утворюється калій алюмінат: Al2O3+2KOH=2KAlO2+H2O Хімічні властивості кислот 1. Дія кислот на індикатори 2. Взаємодія кислот з металами Кислоти взаємодіють з металами, що стоять в ряду активності металів лівіше водню. В результаті реакції утворюється сіль і виділяється водень. Зверни увагу! Нітратна кислота і концентрована сульфатна кислота з металами Mg+2HCl=MgCl2+H2 ↑ взаємодіє інакше (сіль утворюється, але водень при цьому не виділяється). 3. Взаємодія кислот з основними і амфотерними оксидами Кислоти реагують з основними і амфотерними оксидами. У результаті реакції утворюється сіль і вода. K2O+2HNO3=2KNO3+H2O Al2O3+6HCl=2AlCl3+3H2O 4. Взаємодія кислот з основами і з амфотерними гідроксидами Кислоти реагують з основами і з амфотерними гідроксидами, утворюючи сіль і воду. KOH+HNO3 KNO3+H2O Al(OH)3+3HCl AlCl3+3H2O. → → Реакції між кислотами і основами називають реакціями нейтралізації 5. Взаємодія кислот з солями Кислоти реагують з розчинами солей, якщо в результаті реакції один з продуктів випадає в осад. H2SO4+BaCl2=BaSO4 +2HCl Na2SiO3+2HNO3=H2SiO3 +2NaNO3 ↓ ↓ Продукт реакції при звичайних умовах, або при нагріванні випаровується. NaCl(т.р.)+H2SO4(конц.)=Na2SO4+2HCl FeS+2HCl=FeCl2+H2S ↑ ↑ Якщо кислота, яка вступає в реакцію, є сильнішою, за ту кислоту, що утворюється. 2HCl+CaCO3 CaCl2+H2O+CO2 (H2CO3) Для того, щоб винести судження про можливість протікання реакції, можна скористатися витискувальним рядом кислот: HNO3 H2SO4 HCl H2SO3 H2CO3 H2S H2SiO3 H3PO4 У цьому ряду кислота, що знаходиться лівіше, може витіснити з солі кислоту, що знаходиться правіше. → ↑ → 6. Розклад оксигеновмісних кислот При розкладанні кислот утворюється кислотний оксид і вода. H2CO3 H2O+CO2 H2SO3 H2O+SO2 ⇄ ⇌ ↑ ↑ Хімічні властивості нерозчинних основ 1. Нерозчинні основи взаємодіють з кислотами, утворюючи сіль і воду. Cu(OH)2+H2SO4=CuSO4+2H2O Fe(OH)3+3HCl=FeCl3+3H2O 2. Деякі нерозчинні основи можуть взаємодіяти з деякими кислотними оксидами, утворюючи сіль і воду. Cu(OH)2+SO3=t°CuSO4+H2O 3. Нерозчинні основи при нагріванні розкладаються на оксид металу і воду. Cu(OH)2=t°CuO+H2O 2Fe(OH)3=t°Fe2O3+3H2O 1. Хімічні властивості лугів Зміна забарвлення індикаторів у розчинах лугів 2. Луги взаємодіють з кислотами, утворюючи сіль і воду. Реакції обміну між лугами і кислотами називають реакціями нейтралізації. NaOH+HCl=NaCl+H2O Ca(OH)2+2HNO3=Ca(NO3)2+2H2O 3. Луги взаємодіють з кислотними оксидами, утворюючи сіль і воду. Ca(OH)2+CO2=CaCO3 +H2O 6NaOH+P2O5=2Na3PO4+3H2O ↓ Зверни увагу! За допомогою цієї хімічної реакції можна довести наявність карбон(IV) оксиду: при пропусканні вуглекислого газу через вапняну воду (насичений розчин кальцій гідроксиду), розчин мутніє, оскільки випадає осад білого кольору — утворюється нерозчинний кальцій карбонат. 4. Луги можуть взаємодіяти з розчинними у воді солями. Реакція обміну між основою і сіллю можлива лише у тому випадку, якщо обидві вихідні речовини є розчинними у воді, а в результаті реакції утворюється хоча б одна нерозчинна речовина (випадає осад). 2NaOH+CuSO4=Na2SO4+Cu(OH)2 Ca(OH)2+Na2CO3=CaCO3 +2NaOH ↓ ↓ 5. Малорозчинні луги при нагріванні розкладаються на оксид металу і воду. Ca(OH)2=t°CaO+H2O ↑ Хімічні властивості солей 1. Солі можуть взаємодіяти з металами. У ході реакції заміщення, що протікає у водному розчині, хімічно більш активний метал витісняє менш активний. Fe+CuSO4 FeSO4+Cu 2Al+3CuCl2 2AlCl3+3Cu → → 2. Солі можуть взаємодіяти з кислотами. Протікає реакція обміну, у ході якої хімічно більш активна кислота витісняє менш активну. BaCl2+H2SO4 BaSO4 +2HCl CaCO3+2HCl CaCl2+H2O+CO2 (H2CO3) → → ↓ ↑ 3. Розчинні у воді солі можуть взаємодіяти з лугами. Реакція обміну можлива у тому випадку, якщо в результаті хоча б один з продуктів є практично нерозчинним у воді (випадає в осад). Ni(NO3)2+2NaOH Ni(OH)2 +2NaNO3 Na2CO3+Ca(OH)2 2NaOH+CaCO3 → → ↓ ↓ 4. Розчинні у воді солі можуть вступати в реакцію обміну з іншими розчинними у воді солями, якщо в результаті утворюється хоча б одна практично нерозчинна у воді речовина. Na2S+2AgNO3 2NaNO3+Ag2S Ba(NO3)2+K2SO4 2KNO3+BaSO4 → → ↓ ↓ 5. Деякі солі при нагріванні розкладаються. Як приклади таких хімічних реакцій розглянемо, як протікає розклад карбонатів. При сильному нагріванні кальцій карбонат (крейда, вапняк, мармур) розкладається, утворюючи кальцій оксид (палене вапно) і вуглекислий газ: CaCO3 t°CaO+CO2 ⇄ ↑