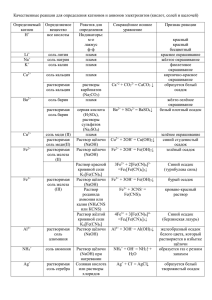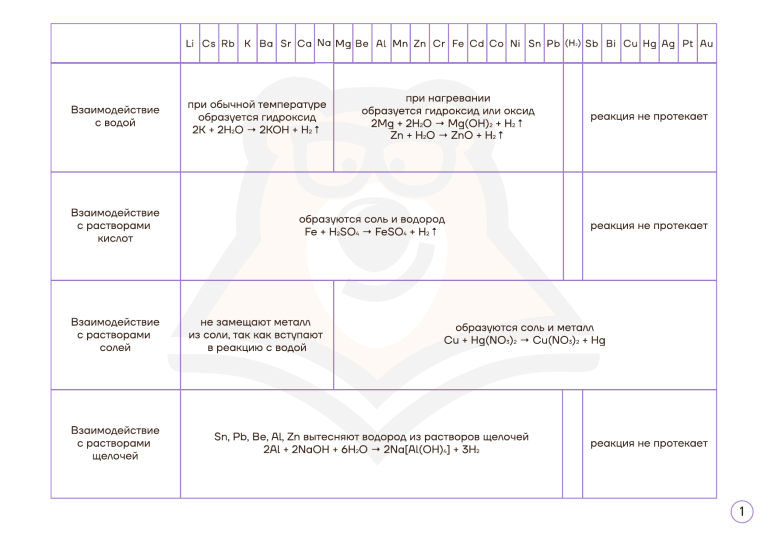
Li Взаимодействие с водой Взаимодействие с растворами кислот Cs Rb K Ba Sr Ca Na Mg be при обычной температуре образуется гидроксид 2K + 2H2O → 2KOH + H2↑ не замещают металл из соли, так как вступают солей в реакцию с водой щелочей Fe Cd Co Ni Sn Pb (h ) sb 2 bi Cu Hg Ag Pt Au при нагревании образуется гидроксид или оксид 2Mg + 2H2O → Mg(OH)2 + H2↑ реакция не протекает Zn + H2O → ZnO + H2↑ реакция не протекает Fe + H2SO4 → FeSO4 + H2↑ с растворами с растворами Cr образуются соль и водород Взаимодействие Взаимодействие Al mn Zn образуются соль и металл Cu + Hg(NO3)2 → Cu(NO3)2 + Hg Sn, Pb, Be, Al, Zn вытесняют водород из растворов щелочей 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 реакция не протекает 1 концентрированная H2SO4 концентрированная HNO3 разбавленная HNO3 Сера S + 2H2SO4 → 3SO2 + 2H2O S + 6HNO3 → H2SO4 + 6NO2 + 2H2O S + 2HNO3 → H2SO4 + 2NO Фосфор P 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O P + 5HNO3 → H3PO4 + 5NO2 + H2O 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO Углерод C C + 2H2SO4 → CO2 + 2SO2 + 2H2O C + 4HNO3 → CO2 + 4NO2 + 2H2O 3C + 4HNO3 → 3CO2 + 4NO + 2H2O S Взаимодействие металлов с кислотами-окислителями Li -- Zn (кроме Al) + HI, KI H2SO4 (конц.) редко о нем подсказывают в условии задания правее Cr и Al H 2S бесцветный газ с неприятным запахом S желтый осадок SO2 бесцветный газ с резким запахом HNO3 NO2 конц Al, Fe, Cr при tº бурый газ с неприятным запахом разб. NO * оч. разб. Mg, Ca бесцветный газ без запаха NH4NO3 нет видимых изменений 2 Необратимый гидролиз бинарных соединений в воде в растворе HCl в растворе KOH нитрид калия K3N образуется гидроксид и аммиак K3N + 3H2O → 3KOH + NH3 образуется cоль металла и соль аммония K3N + 4HCl → 3KCl + NH4Cl реакция не протекает фосфид бария Ba3P2 образуется гидроксид и фосфин Ba3P2 + 6H2O → 3Ba(OH)2 + 2PH3 образуется соль металла и фосфин Ba3P2 + 6HCl → 3BaCl2 + 2PH3 реакция не протекает хлорид фосфора(III) PCl3 образуется смесь кислот PCl3 + 3H2O → H3PO3 + 3HCl реакция не протекает образуется смесь солей PCl3 + 5KOH → K2HPO3 + 3KCl + 2H2O cульфид фосфора(V) P2S5 образуется смесь кислот P2S5 + 8H2O → 2H3PO4 + 5H2S реакция не протекает образуется смесь солей P2S5 + 10KOH → 2K3PO4 + 5K2S + 5H2O карбид кальция Na2C2 образуется гидроксид и ацетилен Na2C2 + 2H2O → 2NaOH + C2H2 образуется соль металла и ацетилен Na2C2 + 2HCl → 2NaCl + C2H2 реакция не протекает карбид алюминия Al4C3 образуется гидроксид и метан Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 образуется соль металла и метан Al4C3 + 12HCl → 4AlCl3 + 3CH4 реакция не протекает силицид магния Mg2Si образуется гидроксид и силан Mg2Si + 4H2O → 2Mg(OH)2 + SiH4 образуется соль металла и метан Mg2Si + 4HCl → 2MgCl2 + SiH4 реакция не протекает бромид кремния SiBr4 образуется смесь кислот SiBr4 + 3H2O → H2SiO3 + 4HBr реакция не протекает образуется смесь солей SiBr4 + 6KOH → K2SiO3 + 4KBr + 3H2O 3 Качественные реакции в неорганике Реагент Признак Ион F Ca2+ белый осадок CaF2 SiO3 Cl-- Ag+ белый осадок AgCl Mg Br-- Ag+ бледно-желтый осадок AgBr Ca I -- Ag+ желтый осадок AgI Sr H+ газ с запахом тухлых яиц H2S Ba Cu2+ черный осадок CuS Al Pb2+ черный осадок PbS Zn Ag+ черный осадок Ag2S Be H+ газ с запахом жженых спичек SO2 Cr Ca2+ белый осадок CaSO3 Cr Sr 2+ белый осадок SrSO3 Ba2+ белый осадок BaSO3 Sr 2+ белый осадок SrSO4 Ba2+ белый осадок BaSO4 OH-- газ с запахом нашатыря NH3 Mn 2+ OH-- бледно-розовый осадок Mn(OH)2 Li + белый осадок Li3PO4 Ag + OH-- коричневый осадок Ag2O Ag+ желтый осадок Ag3PO4 Cu 2+ OH-- голубой осадок Cu(OH)2 Ион -- S 2- 23 SO 24 SO NH4+ PO 24 CO32- + H Реагент Признак 2- H+ бесцветный осадок H2SiO3 2+ CO32- белый осадок MgCO3 2+ CO32- белый осадок CaCO3 2+ SO42- белый осадок SrSO4 2+ SO42- белый осадок BaSO4 3+ OH-- белый осадок Al(OH)3 2+ OH-- белый осадок Zn(OH)2 2+ OH-- белый осадок Be(OH)2 2+ OH-- желтый осадок Cr(OH)2 3+ OH-- серо-зеленый осадок Cr(OH)3 OH-- серо-зеленый осадок Fe(OH)2 2+ Fe K3[Fe(CN)6] окрашивание раствора в синий 3+ Fe OH-- бурый осадок Fe(OH)2 K4[Fe(CN)6] окрашивание раствора в синий газ без запаха СО2 4