Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
ГОУВПО «Ивановский государственный химико-технологический университет»
А.К. Кузнецов, И.М. Захарова
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
по курсу “Физико-химия полимеров”
Учебное пособие
для студентов специальности 240201 “Технология и оборудование
производства химических волокон и композиционных материалов
на их основе”
Иваново 2007
УДК: 541.6(7)
Кузнецов, А.К., Захарова, И.М. Лабораторный практикум по курсу «Физико-химия полимеров»: учеб. пособие для студентов специальности 240201
«Технология и оборудование производства химических волокон и композиционных материалов на их основе» / ГОУ ВПО «Иван. гос. хим.-технол.
ун-т. Иваново, 2007. 96 с. ISBN
Лабораторный практикум содержит 9 работ, касающихся фазовых и
физических состояний полимера, его деформационно-прочностных
свойств, взаимодействия полимеров и низкомолекулярных жидкостей, выполнение которых позволит студентам определить важные для полимера
физико-механические, молекулярно-массовые и некоторые термодинамические параметры. Предназначен для студентов специальности 240201,
изучающих курс “Физико-химия полимеров”.
Рецензенты:
доктор технических наук Л.В. Шарнина (Ивановский государственный химико-технологический университет); кандидат технических наук А.В. Баранов (Ивановская государственная текстильная академия)
2
ВВЕДЕНИЕ
В настоящее время нет ни одной отрасли народного хозяйства, где не
использовались бы полимеры. Широкое применение полимеров стало возможным вследствие их особых характеристик, эффективных способов переработки в изделия и наличия больших сырьевых запасов нефти и природного газа.
Полимеры обладают такими свойствами, благодаря которым их применение в народном хозяйстве способствует ускорению научнотехнического прогресса, снижению трудоемкости и себестоимости продукции, улучшению ее потребительского спроса. Различные способы переработки полимеров постоянно претерпевают качественные изменения в результате использования новейших технологий и оборудования. В связи с
этим, для успешного ведения процесса необходимы прочные знания теоретических основ физикохимии полимеров.
Рациональное использование полимерных материалов невозможно
без всесторонней оценки их свойств и структуры. Полимерные материалы
в изделиях очень часто подвергаются самым разнообразным нагрузкам и
деформациям, различные внешние факторы (климатические, излучения,
напряженно-деформированное состояние, температура) существенно
влияют на эксплуатационные свойства полимерных изделий.
Механические свойства полимеров – это комплекс свойств, определяющих механическое поведение материала под действием внешних сил,
механические свойства полимеров характеризуют реакцию материала на
внешнее воздействие. Основными понятиями, характеризующими механическое поведение полимерных материалов, являются напряжение и деформация. Под действием внешних сил и возникающих в теле напряжений
они деформируются. Внешне деформация выражается в изменении размера или формы тела.
Вязкотекучее состояние – одно из основных физических состояний
полимеров, при котором воздействие внешних механических сил приводит
к развитию в полимерном теле в основном необратимых деформаций, развивающихся за счет перемещения макромолекул как целого друг относительно друга. В вязкотекучем состоянии находятся расплавы кристаллизующихся полимеров, аморфные полимеры выше их температуры текучести, растворы и дисперсии полимеров.
Исследование взаимосвязи реологических свойств полимеров в вязкотекучем состоянии с химическим строением и структурой высокомолекулярных соединений являются одной из важнейших проблем современной химии и физики полимеров. Практическое значение такого рода исследований обусловлено тем, что подавляющее большинство процессов
3
формования (переработки) и многие процессы синтеза полимеров осуществляются через расплавы, растворы или дисперсии.
Процессы перевода полимеров в раствор лежат в основе производства многих полимерных изделий, в том числе нитей и волокон, и широко
используются при исследовании свойств самих полимеров. Поэтому изучение круга вопросов, связанных с закономерностями образования и поведения растворов макромолекул в различных условиях, является важной частью фундаментальной подготовки студентов в области физико-химии полимеров.
Учебное пособие к лабораторному практикуму по курсу “Физикохимия полимеров” содержит 9 работ, связанных с изучением фазовых и
физических состояний полимеров, его деформационно-прочностных
свойств, взаимодействия полимеров и низкомолекулярных жидкостей,
приводящего к образованию различных по фазовому состоянию систем
полимер-жидкость, а также с определением молекулярно-массовых и некоторых термодинамических характеристик полимеров.
К каждой работе имеется краткое теоретическое введение, необходимое для осмысленного выполнения эксперимента и правильной трактовки полученных результатов, а подробное описание установок и хода работы существенно облегчает ее практическое выполнение.
В приложении даны таблицы величин, используемых в расчетах, и
программа обработки результатов на ЭВМ.
Завершает пособие список литературы, знакомство с которой необходимо для глубокого освоения курса.
Данное учебное пособие может быть полезно студентам других специальностей, изучающих физико-химию полимеров.
4
ОСНОВНЫЕ ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
1. К выполнению лабораторной работы допускаются студенты, прошедшие инструктаж по технике безопасности и получившие допуск у преподавателя после предварительного собеседования.
2. При подготовке лабораторных установок следует соблюдать правила
безопасности, предусмотренные соответствующими инструкциями. По
завершению подготовительного этапа необходимо получить разрешение у преподавателя на проведение дальнейших работ.
3. Работы с легколетучими веществами проводят в вытяжном шкафу;
4. Работы с горючими и легковоспламеняющимися веществами проводят
вдали от источников огня и нагревательных приборов.
5. Работы, связанные с возможностью разбрызгивания и выброса веществ,
использованием вакуума, проводят в защитных очках, масках или в
специальных местах с защитным экраном.
6. При нагревании горючих, легковоспламеняющихся и взрывоопасных
смесей пользоваться водяными или масляными банями. Запрещается
нагревание таких веществ, даже в малом количестве, в сушильных
шкафах.
7. При работе с ядовитыми веществами необходимо пользоваться средствами индивидуальной защиты: перчатками и аспираторами. Запрещается проводить работы вне вытяжного шкафа.
8. В случае травмы (ожог, порез и др.) следует немедленно сообщить об
этом преподавателю и приступить к оказанию мер первой помощи,
воспользовавшись имеющейся в лаборатории медицинской аптечкой.
Обратиться к врачу.
9. ПОМНИТЕ: при химических ожогах пораженное место сначала промывается обильным количеством воды, а затем разбавленной уксусной
кислотой при ожогах щелочами или слабым раствором питьевой соды
при ожогах кислотами.
10. По окончании работы рабочее место приводится в порядок. Запрещается жидкие отходы сливать в раковины, а твердые выбрасывать в урну.
Необходимо пользоваться специальными склянками, имеющими соответствующие надписи и хранящимися в вытяжном шкафу.
11. Студент, допустивший нарушение правил техники безопасности, отстраняется от выполнения лабораторной работы до повторного инструктажа.
5
ПОРЯДОК ПРОХОЖДЕНИЯ СТУДЕНТАМИ ПРАКТИКУМА
ПО ДИСЦИПЛИНЕ “ФИЗИКО-ХИМИЯ ПОЛИМЕРОВ”
Получив задание по работе, студент должен предварительно ознакомиться с ее теоретическими основами, используя для этого рекомендуемую методическую литературу. Перед началом работы преподаватель проводит собеседование по плану и методике проведения работы, порядку
обработки экспериментальных данных.
После получения допуска к проведению лабораторной работы студент обеспечивается необходимыми реактивами, приборами и оборудованием, перечень которых имеется к каждой работе, и приступает к подготовке выполнения эксперимента. Окончательную готовность студента определяет преподаватель или дежурный лаборант проверкой соответствующих установок или приборов.
По окончании выполнения экспериментальной части студент согласует с преподавателем полученные результаты и приступает к оформлению
работы.
Отчет должен включать следующие разделы:
∗ название лабораторной работы;
∗ цель и задание;
∗ теоретическое введение;
∗ методика эксперимента и описание (схемы) установок и приборов;
∗ результаты работы в виде таблиц и графиков;
∗ выводы по работе.
Выполненная работа защищается студентом на следующем занятии
или на коллоквиуме. Общая оценка складывается из оценок за выполненную работу, сдачу коллоквиума и учитывается в текущем рейтинговом
балле. По решению преподавателя в оценке может быть учтена своевременность выполнения работы и сдача по ней отчета.
6
1. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
ПОЛИМЕРОВ В ПРИСУТСТВИИ ЖИДКОСТЕЙ
ТЕОРИЯ
Исследование процесса плавления полимера в присутствии жидкости
представляет интерес по ряду причин. Во-первых, в результате эксперимента получается зависимость температуры плавления Тпл полимера от состава бинарной системы полимер-жидкость, имеющая чисто практическое
значение. Во-вторых, анализ зависимости Тпл как функции состава системы позволяет рассчитать такую важнейшую характеристику полимерного
кристалла как энтальпия его плавления. В-третьих, по характеру зависимости Тпл от состава можно судить о границе совместимости расплава полимера и жидкости.
Концентрированные полимерные системы характеризуются статистическим распределением сегментов цепей по объему раствора или гетерогенной смеси. Поэтому к ним применима классическая теория растворов
полимеров Флори-Хаггинса, описывающая взаимодействие в системах
аморфный полимер-жидкость. Согласно этой теории, изменение химического потенциала растворителя Δμ1 при образовании раствора, содержащего ϕ2 объемных долей полимера, описывается уравнением:
Δμ1
[
(
)
= RT ln (1 − ϕ 2 ) + 1 − 1/ x ϕ 2 + χ 1ϕ 22
]
Дж/моль,
(1.1)
в котором x – отношение мольного объема полимера к мольному объему
жидкости, а χ1 – параметр Флори-Хаггинса, характеризующий энергетику
взаимодействия полимера и жидкости.
Изменение же химического потенциала макромолекул при переходе
из высокоэластического состояния в раствор, содержащий ϕ2 объемных
долей полимера , – Δμ2 выражается соотношением:
Δμ 2
[
(
)
]
= RT ln (ϕ 2 ) − x − 1 ϕ1 − χ 1 xϕ12 .
(1.2)
При этом Δμ2 имеет размерность Дж/моль полимера. Однако в силу
того, что полимеры полидисперсны, т.е. содержат макромолекулы разных
размеров, величину Δμ2 удобнее относить не к молю полимера, а к молю
мономерного звена или сегмента.
Чтобы осуществить такой пересчет, необходимо разделить обе части
уравнения на V2, т.е. мольный объем полимера, и умножить на Vm – мольный объем мономерного звена:
7
Δμ 2
= RT
[
(
)
Vm
ln(ϕ2 ) − x − 1 ϕ1 + χ 1 xϕ12
V2
].
(1.3)
С другой стороны, V2 = x V1. Поэтому окончательно будем иметь
Δμ 2
= RT
[( )
Vm
x
V1
−1
(
)
ln(ϕ 2 ) − 1 − 1 / x ϕ1 + χ 1ϕ12
]
.
(1.4)
Для полимеров с высокой молекулярной массой ( x → ∞ ) уравнение
(1.4) упрощается
Δμ 2
= −RT
(
)
Vm
ϕ1 − χ1ϕ12 .
V1
(1.5)
Для большинства полимерных растворов или набухших систем реализуется ситуация, когда растворитель не способен проникать в кристаллическую решетку полимера из-за стерических ограничений. Это соответствует бинарной жидкой смеси, в которой лишь один компонент кристаллизуется во всей области составов. Согласно условиям фазового равновесия, кроме равенства температур и давлений, требуется также и равенство
химических потенциалов кристаллизующегося компонента в обеих фазах.
Поэтому при температуре плавления набухшего полимера (в равновесных
условиях) требуется, чтобы
0
μ кm − μ 0m = μ ж
m − μm ,
(1.6)
где верхние индексы «к» и «ж» относятся к кристаллической и жидкой фазам, а за стандартное состояние принят чистый расплав полимера.
Изменение химического потенциала мономерного звена в результате плавления полимера может быть записано следующим образом
μ кm − μ 0m = −ΔFпл. = −(ΔН пл. − Т пл.ΔSпл. ).
(1.7)
Поскольку температура плавления чистого полимера Т пл. = ΔН пл. / ΔSпл. ,
уравнение (1.7) можно записать в виде
0
⎛ Т .⎞
⎟.
μ кm − μ 0m = − ΔН пл. ⎜⎜1 − пл
0 ⎟
⎝ Т пл. ⎠
(1.8)
При этом неявно принимается, что ΔНпл. и ΔSпл. сами по себе от температуры не зависят. Приравнивая уравнения (1.5) и (1.8) друг к другу, получаем
8
− RTпл.
(
)
⎛ Т .⎞
Vm
⎟
ϕ1 − χ1ϕ12 = − ΔH пл. ⎜⎜1 − пл
0
⎟
V1
⎝ Т пл. ⎠
или
(
⎛ 1
1 ⎞⎟
R Vm
2
⎜
−
=
ϕ
−
χ
ϕ
1
1
1
0 ⎟
⎜Т
⎝ пл. Т пл. ⎠ ΔH пл. V1
)
(1.9)
в качестве основного соотношения для определения понижения температуры плавления в присутствии растворителя.
Из этого уравнения следует, что понижение температуры плавления
полимера в присутствии жидкости будет тем больше, чем выше термодинамическое качество растворителя (меньше χ1), меньше мольный объем
жидкости и меньше энтальпия плавления чистого кристалла полимера.
Следует иметь в виду, что ΔНпл. имеет размерность джоуль на моль закристаллизованных мономерных звеньев, и по этому она всегда больше, чем
экспериментально определяемая теплота плавления полимера, т. к. степень
кристалличности последнего практически никогда не достигает 100 %.
Для обработки экспериментальных данных уравнение (1.9) целесообразно представить в несколько ином виде
1
1
− 0
Tпл. Tпл.
RVm
RVm
=
−
χ1ϕ1,
ΔH пл.V1 ΔH пл.V1
ϕ1
(1.10)
в соответствии с которым следует ожидать прямолинейной зависимости
Δ(1/Тпл.)/ϕ1 от ϕ1. Отрезок β, отсекаемый этой прямой на оси ординат, позволяет рассчитать величину ΔНпл./Vm:
ΔH пл.
Vm
= ΔH 'пл. =
R
Дж/см3,
βV1
(1.11)
а тангенс угла наклона – параметр χ1:
χ1 = tgα
'
ΔH пл.V1
R
.
(1.12)
Параметр Флори-Хаггинса χ1 можно представить в виде трехчлена
9
⎛1
⎞ V
χ1 = ⎜ − Ψ ⎟ + 1 (δ1 − δ 2 )2 ,
⎝2
⎠ RT
(1.13)
в котором Ψ – его энтропийная характеристика, а δ1 и δ2 – параметры растворимости жидкости и полимера соответственно.
Очевидно, что, если
Ψ=
1 V1
+
(δ1 − δ 2 )2 ,
2 RT
то χ1 = 0 и уравнение (1.9) упростится до линейной зависимости обратной
температуры плавления от объемной доли растворителя в системе
1
1
RVm
= 0 −
ϕ1.
Tпл. Tпл. ΔH пл.V1
(1.14)
Необходимо обратить внимание на то, что в уравнениях (1.10) и (1.14) ϕ1,
V1 и Vm относятся к температуре плавления, тогда как исходные смеси полимера и жидкости готовятся при комнатной температуре. Чтобы устранить необходимость постоянно учитывать различие в плотности жидкости
при температурах эксперимента и приготовлении системы, а также исключить из рассмотрения не совсем определенную величину ρ2 – плотность
полимера (полимер всегда содержит аморфную фазу, и поэтому его плотность зависит от соотношения количеств аморфной и кристаллической
фаз), перейдем от объемной к массовой доле растворителя.
По определению
G1
1
G ρ
ρ1
=
≅ 1 2.
ϕ1 =
G1 G 2
G ρ
+
1 + 2 1 G 2 ρ1
ρ1 ρ 2
G1 ρ 2
(1.15)
Подстановка ϕ1 из этого уравнения в уравнение (14) приводит к соотношению
1
1
RVm ρ 2
= 0 +
w1 ,
Т пл. Т пл. ΔH пл.V1 ρ1
(1.16)
где W1 – массовая доля растворителя в исходной смеси. Поскольку вне зависимости от температуры произведение мольного объема жидкости на ее
10
плотность равно молекулярной массе жидкости, а произведение мольного
объема мономерного звена на его плотность – молекулярной массе этого
звена, можно записать
1
1
RM m
= 0 +
w 1.
Т пл. Т пл. ΔH пл.M1
(1.17)
В этом случае 1/Тпл. есть линейная функция W1 и из угла ее наклона рассчитывается величина ΔНпл./Mm, выраженная в джоулях на грамм закристаллизованных мономерных звеньев.
При таком подходе уравнение (1.10) приобретает вид
1
1
− 0
Tпл. Tпл.
RM m
RM m
ρ
=
−
χ1 w 1 2 .
ΔH пл. M 1
ΔH пл. M 1
w1
ρ1
(1.18)
В заключение следует сделать два замечания.
1. Уравнение (1.9) и все вытекающие из него соотношения справедливы только в области полной совместимости расплава полимера и жидкости. При достижении предела растворимости жидкости в расплаве полимера состав кристаллизуется, фазы становятся неизменными и Тпл оказывается независимой от ϕ1 или w1.
2. В указанные уравнения входит равновесная температура плавления, достигаемая при бесконечно медленном нагревании системы. В любом же реальном эксперименте скорость нагрева конечна. Поэтому для получения истинного значения Тпл необходимо провести эксперименты при
нескольких скоростях нагрева и полученную зависимость Тпл = f(ΔТ/Δt)
экстраполировать на (ΔТ/Δt) → 0.
АППАРАТУРА
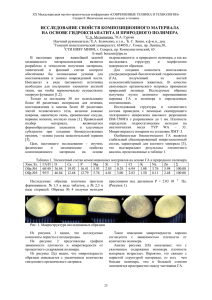
Для определения температуры плавления чистого полимера и его
смесей с различными количествами жидкости в данной лабораторной работе используется прибор, показанный на рис. 1.1.
Прибор состоит из двух пробирок 1 и 2, термометра 3, нагревательной спирали 4, навитой на внутреннюю пробирку 1, и латера 5, позволяющего менять напряжение, подаваемое на спираль, а, следовательно, и скорость нагрева воздуха внутри пробирки 1 при вставленном в нее термометре.
Исследуемый образец, запаянный в стеклянную ампулу 6, прикрепляется резинкой к ртутному резервуару термометра.
11
Рис. 1.1. Схема прибора для
определения температуры
плавления полимеров
3
4
1
6
2
5
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ПОСТРОЕНИЕ ГРАДУИРОВОЧНЫХ ГРАФИКОВ ЗАВИСИМОСТИ
СКОРОСТИ ПОДЪЕМА ТЕМПЕРАТУРЫ ОТ НАПРЯЖЕНИЯ НА
НАГРЕВАТЕЛЕ
Цель этой части эксперимента в том, чтобы установить зависимость
между величиной напряжения, подаваемого на спираль, и скоростью нагрева (ΔТ/Δτ) воздуха во внутренней пробирке при помещенном в нее термометре без образца.
Прибор включается в сеть и с помощью регулятора на выходной
обмотке автотрансформатора устанавливается напряжение в 15 В. В течение 20 – 30 мин через каждые 2 мин производятся замеры температуры во
внутренней пробирке и рассчитывается средняя скорость нагрева. После
этого нагрев отключается, термометр вынимается из внутренней пробирки
и прибор охлаждается до температуры, близкой к комнатной. На выходной
обмотке задается меньшее напряжение и операция определения скорости
нагрева повторяется. В ходе эксперимента необходимо найти значение напряжения, позволяющее иметь скорость нагрева 1; 5 и 10 К/мин.
12
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ ПОЛИМЕРА ИЛИ ЕГО
СМЕСИ С ЖИДКОСТЬЮ
ОБЪЕКТЫ ИССЛЕДОВАНИЯ
Объектами исследования могут быть полиэтилен низкой (ПЭНП) и
высокой (ПЭВП) плотности, полипропилен, полиэтилентерефталат, поликапроамид и их смеси различного состава с жидкостями, имеющими к этим
полимерам различное термодинамическое сродство. Каждый образец запаян в отдельную ампулу, имеющую шифр, по которому можно установить
состав и массовое соотношение компонентов в системе.
ХОД ЭКСПЕРИМЕНТА
С помощью регулятора устанавливается напряжение, обеспечивающее скорость нагрева 10 К/мин. К термометру с помощью резиновой
петли прикрепляется ампула с чистым полимером, указанным преподавателем, и он помещается в прибор. Включается система обогрева и с интервалом 0,5 мин записываются показания термометра (табл. 1.1). При приближении к температуре плавления внимательно следят за поведением образца и фиксируют температуру, при которой он становится совершенно
прозрачным.
По полученной зависимости температуры от времени эксперимента
уточняют фактическую скорость нагрева и фиксируют ее в рабочем журнале вместе с найденной температурой плавления. Сразу после достижения
температуры плавления образца нагрев прибора отключается, и, не вынимая образца, охлаждают его до температуры на 15 – 20 К ниже найденной
температуры плавления, фиксируя время, потребовавшееся для этой операции.
Устанавливают напряжение, обеспечивающее скорость нагрева 5
К/мин и проводят наблюдения, как указано выше. Рассчитывают фактическую скорость нагрева и фиксируют ее в журнале вместе с соответствующей ей температурой плавления образца. Вновь охлаждают образец до
температуры на 15 – 20 К ниже найденной и повторяют операцию плавления при скорости нагрева 1 К/мин.
По полученным результатам строится график Тпл. = f(ΔТ/Δτ) и путем
экстраполяции на (ΔТ/Δτ) = 0 находится истинная температура плавления
0
полимера Т пл. .
Совершенно аналогичным образом поступают с образцами, содержащими различные количества заданной жидкости.
При этом следует иметь в виду, что постоянство скорости охлаждения системы при подготовке ее к операции плавления с новой скоростью
13
нагрева еще более важна, чем при опытах с чистым полимером, т. к. присутствие жидкости может существенно затруднять кристаллизацию полимера, и на получаемую экспериментально зависимость Тпл. = f(ΔТ/Δτ) может накладываться зависимость Тпл. от достигнутой при охлаждении
средней степени кристалличности полимера размеров образовавшихся
кристаллов.
Таблица 1.1
Первичные результаты эксперимента
Время, мин
Образец Образец Образец Образец
1
2
3
4
Заданная скорость нагрева, К/мин
10 5 1 10 5 1 10 5 1 10 5 1
0
0,5
1
2
…
Температура плавления, К
Фактическая скорость нагрева
вблизи температуры плавления,
К/мин
ОБРАБОТКА РЕЗУЛЬТАТОВ
МАТЕМАТИЧЕСКАЯ ОБРАБОТКА ЗАВИСИМОСТЕЙ Тпл. = f(ΔT/Δτ)
Экспериментальные данные обрабатываются методом наименьших
квадратов на ПЭВМ с целью определения доверительного интервала значения Тпл., получаемого экспериментально на (ΔТ/Δτ) → 0.
ОБРАБОТКА ЗАВИСИМОСТИ Тпл. = f(W1)
Результаты эксперимента суммируются в таблице, включающей
следующие графы:
Таблица 1.2
№
п/п
W1 Т пл.
1
Т пл.
1
1
− 0
Т пл. Т пл.
14
1
1
− 0
Т пл. Т пл.
W1
Затем они наносятся на графики в координатах
1
= f ( W1 ),
Т пл.
(1.19)
1
1
− 0
Т пл. Т пл.
= f ( W1 ).
W1
(1.20)
Если система подчиняется уравнению (1.17), то первая функция будет выражаться прямой с тангенсом угла наклона, равным
RM m ΔH пл.M1 , пересекающей ось ординат в точке, соответствующей
0
1 Т пл
. , а вторая функция будет прямой, параллельной оси абсцисс, с ординатой равной RM m ΔH пл.M1.
Если же система подчиняется уравнению (1.18), то первая функция
будет выражаться кривой, а вторая прямой, отсекающей на оси ординат
отрезок, равный RM m ΔH пл.M1 , и имеющей угол наклона, тангенс которого равен
RM m ρ2
χ1.
ΔH пл.M1 ρ1
Обработав прямые методом наименьших квадратов, можно рассчи-
ρ
тать затем либо только ΔH пл. , либо ΔH пл. и произведение χ1 2 .
ρ1
В случае, когда при W1, большей некоторого значения, Тпл. не зависит от W1, обработка экспериментальных данных по уравнениям (1.17) и
(1.18) проводится только применительно к области значений W1, меньших
критического.
15
2. КРИВЫЕ ТЕЧЕНИЯ КОНЦЕНТРИРОВАННЫХ
РАСТВОРОВ ПОЛИМЕРОВ
ТЕОРИЯ
Кривая течения или реограмма – графическое изображение взаимосвязи между напряжением τ и скоростью γ сдвига при течении жидкости в
капилляре или зазоре между двумя поверхностями, одна из которых вращается.
В общем виде эта зависимость может быть представлена уравнением:
τ = ηэф.γ1/n,
(2.1)
где ηэф. – коэффициент пропорциональности, называемый эффективной
вязкостью, а n - индекс течения характеризующий степень отклонения
жидкости от ньютоновской, подчиняющейся уравнению
τ = η.γ,
(2.2)
в котором η – ньютоновская вязкость.
Если n < 1 то жидкость называется псевдопластической, если же n >
1, то дилатантной * .
В первом случае эффективная вязкость с ростом скорости сдвига, по
сравнению с ньютоновской, уменьшается, а во втором наоборот возрастает:
(2.3)
ηэф. = η.γ (n-1)/n.
Жидкости, закон течения которых подчиняется уравнению
τ = τо + ηэф.γ,
(2.4)
называются бингамовскими или высокопластичными, а величина τо – напряжением предела текучести или просто пределом текучести.
Необходимо обратить внимание на то, что при течении жидкостей
реализуется именно деформация сдвига, т. к. слои жидкости скользят
(сдвигаются) друг относительно друга. Поэтому сопротивление жидкости
течению, именуемое напряжением сдвига, направлено в сторону, противоположную по касательной к поверхности перемещающихся слоев, а не по
нормали (т.е. перпендикулярно), как это имеет место при деформации растяжения или сжатия.
*
Дилатансия – явление загущения системы при течении с ростом скорости сдвига
16
Представим себе, что твердое тело длиной L и радиусом R равномерно движется в трубе под действием перепада давления ΔР, приложенного перпендикулярно поперечному сечению этого тела.
Внешняя сила, действующая на тело, может быть, очевидно, найдена
из соотношения:
сила = перепад давления х площадь = ΔPπR2.
Сопротивление движению тела, равное этой силе, создается напряжением сдвига, действующим по боковой поверхности тела. Поэтому напряжение зависит от площади поверхности, по которой тело касается стенок трубы:
сила = напряжение сдвига х поверхность сдвига = τ2πRL
Приравняем правые части обеих формул и получим:
ΔPπR
= τ2πRL.
Если тело вращается в трубе, то поверхность сдвига останется той
же, как и при движении тела вдоль трубы, но направление действия напряжений, возникающих на этой поверхности, изменится: они будут препятствовать вращению. Крутящий момент М, вызывающий вращение,
можно записать следующим образом:
Мкр. = сила х R,
поэтому
сила = Мкр.х R.
Эта сила действует на поверхности 2πRL, так что напряжение сдвига будет
равно
(2.6)
τ = Mкр./(2πR2L) Па.
В рассмотренном случае тело движется относительно стенок как единое
целое, т. к. прочность межмолекулярных связей в объеме его много больше
прочности сил взаимодействия (адгезии) на поверхности раздела твердое
тело – труба.
При течении же жидкости обычно реализуется противоположный
вариант: адгезия жидкости к поверхности трубы выше ее когезионной
прочности, и поэтому жидкость перемещается в трубе как совокупность
17
множества концентрических молекулярных слоев, движущихся и относительно стенки, и относительно друг друга. Более того, именно в силу того,
что слой жидкости, непосредственно примыкающий к стенке трубы, оказывается практически неподвижным вследствие адгезионного взаимодействия с ее поверхностью, напряжения сдвига, определяемые уравнениями
(2.5) и (2.6) характеризуют сопротивление течению, развивающееся в объеме жидкости, и, таким образом, отражают особенности ее молекулярного
и надмолекулярного строения. Если же жидкость скользит относительно
стенок трубы как твердое тело, то никакой информации об особенностях ее
молекулярной организации получить из такого эксперимента невозможно.
Правомерным в этом случае оказывается лишь утверждение, что когезионная прочность деформируемого материала выше сил трения, возникающих
на соприкасающихся поверхностях твердого тела и трубы.
Таким образом, от того, течет ли “нормальная” жидкость по капилляру (трубе) длиной L или движется в зазоре между коаксиальными цилиндрами такой же высоты, напряжение сдвига, возникающее между слоями жидкости, обратно пропорционально L. Однако в первом случае напряжение прямо пропорционально расстоянию слоя от центра капилляра (трубы) и достигает наибольшего значения при движении пристенного слоя,
возрастая с увеличением диаметра капилляра, тогда как во втором случае
оно обратно пропорционально квадрату расстояния от оси коаксиальных
цилиндров и, следовательно, тем больше чем меньше диаметры. Другими
словами, если при изучении реологических свойств жидкости методом капиллярной вискозиметрии увеличения τ при постоянной внешней силе
можно добиться, взяв капилляр большего диаметра, то при использовании
ротационной вискозиметрии – взяв наоборот цилиндры меньшего диаметра. Скорость сдвига γ, входящая в уравнение (2.1 – 2.3), зависит как от относительной скорости перемещения соседних слоев жидкости, так и от
расстояния между ними.
Поскольку вискозиметрические измерения проводятся в очень широком диапазоне τ и γ, получаемые значения η или ηэф. изменятся в сотни и
тысячи раз. В этой связи кривые течения строятся обычно в двойных логарифмических координатах ln(η) = f(ln(τ)) или ln(η) = f(ln(γ)). В случае ньютоновских жидкостей, для которых ηэф = η = const, эти функции выражаются прямыми, параллельными оси абсцисс, а в случае неньютоновских –
кривой, показанной на рис. 2.1. Верхний горизонтальный участок этой
кривой соответствует области значений τ и γ, которая характеризуется наибольшей ньютоновской вязкостью ηо. Нижний участок соответствует области значений τ и γ, характеризующийся наименьшей ньютоновской вязкостью η∞. В переходной области проявляется так называемая аномалия
вязкости или структурная вязкость, отражающая изменение структурной
18
организации концентрированного раствора полимера под действием напряжения сдвига.
lgη(η, Па.с)
lgη
0
lgη
m
lgτ(τ, Па)
Рис. 2.1. Зависимость вязкости от напряжения сдвига в двойных
логарифмических координатах
Следует, однако, заметить, что получение полной реологической
кривой, типа показанной на рис. 2.1, во многих случаях оказывается невозможным как по техническим причинам, так и в силу того, что эффект
аномалии вязкости может пропадать при повышении температуры и при
изменении термодинамического качества растворителя.
Помимо величин τ и γ, вязкость концентрированного раствора полимера зависит от его концентрации, температуры, молекулярной массы полимера и степени его полидисперсности.
В данной лабораторной работе имеется в виду использование ротационной вискозиметрии для получения одной из следующих зависимостей:
(2.7)
ηэф. = f (τ, γ)C,T, M = const,
ηэф. = f (С)τ, γ, T, M = const,
(2.8)
ηэф. = f (T)τ, γ, C, M = const.
(2.9)
Вид зависимости (2.7) уже обсуждался выше. Концентрационная зависимость ηэф. обычно представляется в виде степенного ряда
(2.10)
ηэф.= a + bC2 + dC3 + …,
а ее температурная зависимость, как правило, хорошо описывается уравнением Френкеля-Эйринга-Аррениуса
19
ηэф.= AeU/RT,
(2.11)
где U – энергия активации вязкого течения.
АППАРАТУРА
В качестве рабочего инструмента в работе используется ротационный вискозиметр «Реотест RV2» – (рис. 2.2) с цилиндрическими измерительными приборами.
Этот прибор служит для измерения динамической вязкости ньютоновских и проведения точных реологических измерений неньютоновских
жидкостей. При помощи вискозиметра «Реотест» можно изучать следующие аномалии текучести: структурную вязкость, дилатансию, пластичность (предел текучести), тиксотропию, реопексию (антитиксотропию) –
возрастание вязкости во времени при γ = const.
Характеристики измерительных устройств и области определяемых с
их использованием значений τ и γ приведены в табл. 2.1 и 2.2, а величины
возможных скоростей вращения внутреннего цилиндра – в табл. 2.3.
Таблица 2.1
Отношение между радиусами, необходимое количество измеряемого
вещества, напряжение и скорость сдвига, вязкость
Измерительное
устройство
r/R
Количество
вещества,
мл (± 5%)
Диапазон
S1
0,98
25
S2
0,94
30
S3
0,81
50
H
0,81
17
I
II
I
II
I
II
I
II
τ
Напряжение
сдвига,
τ, Па
Скорость
сдвига
γ , с-1
Вязкость
η, мПа.с
11-110
55-550
12-120
60-600
16-160
80-800
60-600
300-3000
1,5-1310
2-3,8.105
20-3,8.106
7-1,2.105
70-1,2.107
30-5.106
300-5.107
100-1,8.107
1000-1,8.108
20
0,5-437
1,6-146
1,6-146
Таблица 2.2
Значения постоянных Z измерительных устройств
Измерительное устройство
Z
I
5,75
56,0
8,10
29,3
S1
S2
S3
H
II
6,17
59,1
78,6
293,2
Таблица 2.3
Зависимость скорости вращения от ступени передачи
Номер
ступени
W, об/мин, при типе ступени
1
2
3
4
5
6
7
8
9
10
11
12
a
5/9
1
5/3
3
5
9
15
27
45
81
135
243
b
5/18
0,5
5/6
1,5
2,5
4,5
7,5
13,5
22,5
40,5
67,5
121,5
ПРИНЦИП ИЗМЕРЕНИЙ
В цилиндрическом измерительном устройстве исследуемый материал помещается в кольцевой зазор, образующийся между двумя коаксиальными цилиндрами (рис.2.2).
Наружный неподвижный цилиндр радиусом R выполнен в качестве
измерительной емкости. В него помещается исследуемый материал, а сам
цилиндр помещается с целью поддержания постоянства температуры в
термостатирующую баню, подключаемую к жидкостному циркуляционному термостату. Внутренний цилиндр радиусом r и длиной l, вращающийся
с постоянной скоростью W, соединен через измерительный вал с цилиндрической винтовой пружиной, отклонение которой является мерой крутящего момента Мкр., действующего на внутренний цилиндр. Отклонение
пружинного элемента воспроизводится потенциометром, включенным в
21
мостовую схему, причем изменение тока, протекающего по диагонали
мостовой схемы, пропорционально крутящему моменту пружины.
ОПИСАНИЕ ПРИБОРА
Ротационный вискозиметр состоит из двух основных узлов: вискозиметра и блока измерений. Вискозиметр состоит из привода, измерительного механизма и цилиндрического измерительного устройства. К приводу
относится синхронный двигатель с переключаемыми полюсами, находящийся в стойке, 12-ступенчатая коробка передач и мост передачи. Установка требуемой ступени числа оборотов производится поворотом рычага.
Ступень числа оборотов, соответствующая данному положению рычага,
указывается на шкале. Для переключения со ступени I до ступени 12 требуется примерно 2,5 оборота рычага. Между этими ступенями находятся
все остальные.
Рис. 2.2. Схема ротационного вискозиметра типа RV: 1 – основание;
2 – привод; 3 и 4 – измерительный механизм; 5 – измерительный
цилиндр; 6 – термостатированный сосуд; 7 – распределительный
рычаг; 8 – шкала; 9 – частотный измеритель; 10 – измерительный вал; 11- двухступенчатый динамометр; 12 – оптический
датчик; 13 – показывающий прибор; 14 – переключатель диапазона; 15 – муфта; 16 – зажимной рычаг; 17 – запорная крышка;
18 – запорная гайка; 19 – термометр; 20 – зажимной рычаг.
22
В стойке расположен переключатель числа оборотов, при помощи
которого производится переключение скорости вращения двигателя с 1500
(положение а) до 750 (положение в) оборотов в минуту. Выбор скорости
вращения может производиться при любых условиях работы. Это касается
как переключения двигателя, так и переключения передачи.
Измерительный механизм представляет собой механо-электрический
преобразователь крутящего момента. Для измерения Мкр., действующего на
вращающемся измерительном цилиндре, используется вращение измерительного вала относительно приводного вала в направлении, обратном
действию двухступенчатого динамометра. Потенциометр, связанный с динамометром и включенный в мостовую схему, воспроизводит величину
относительного вращения. При этом первоначальный сигнал «крутящий
момент» преобразуется в пропорциональный ему аналогичный сигнал тока. Переключатель диапазона динамометра позволяет по выбору устанавливать диапазоны напряжения сдвига I и II с отношением между ними,
равным ~10. Переключение диапазона можно производить в любых условиях работы, в том числе и при вращающемся измерительном вале. Для
этого нужно установить до упора переключатель диапазона в случае диапазона 1 у левого конечного положения, а в случае диапазона II – у правого.
Цилиндрическое измерительное устройство состоит из измерительного цилиндра, измерительной емкости и термостатирующей бани.
Для присоединения измерительного цилиндра необходимо ухватить
его за рифленую часть и зафиксировать на измерительном валу. Затем ввести втулку муфты вверх в положение освобождения, а измерительный цилиндр вставить до упора на измерительный вал. При этом маркировочный
штрих муфты должен указывать на обозначение цилиндра S1, S2 и т.д. После освобождения втулки она перескакивает в положение натяжения. Измерительная емкость, расположенная под цилиндрической направляющей
измерительного механизма коаксиально к измерительному цилиндру, фиксируется при помощи натяжного кольца. С целью обеспечения простоты
очистки измерительных емкостей они выполнены из нескольких частей –
измерительной трубки, крышки и запорной гайки. Подтягивание или освобождение запорной гайки производится при помощи ключа, поставляемого
вместе с прибором.
Двустенную термостатирующую баню, в которую вставляется термометр, соединить через штыковой затвор с измерительной емкостью, и
зафиксировать при помощи натяжного кольца. В отверстии термостатирующей бани предусмотрено уплотнение (пербутан или ПТФЭ) против
вытекания термостатирующей жидкости через соединение между измерительной емкостью и термостатирующей баней. Подключение термостати23
рующей бани к циркуляционному термостату производится через шланговые наконечники, направленные в рабочем положении термостатирующей
бани на заднюю стенку. Учитывать показание стрелок – впуск-выпуск!
При установке термостатирующей бани нужно закрыть или отключить насос циркуляционного термостата.
ВНИМАНИЕ! Термостат разрешается включать только тогда, когда
термостатирующая баня установлена и зафиксирована у измерительной
емкости.
Механическая настройка нуля производится при отключенном механизме. Электрическая настройка нуля производится при свободно вращающемся измерительном цилиндре. Проверка скорости вращения синхронного двигателя на соблюдение номинального значения w может производиться при помощи измерителя частоты, который используется в данном случае вместо измерителя скорости вращения. Отклонение от 50 Гц
требует при проведении точных измерений корректировки скорости сдвига, т.к. ее значение изменяется пропорционально частоте.
ПРОВЕДЕНИЕ ИЗМЕРЕНИЙ
ПРИГОТОВЛЕНИЕ РАСТВОРА ПОЛИМЕРА
В соответствии с заданием преподавателя готовится один или несколько растворов полимера в указанном растворителе. Объем каждого
раствора 100 мл. Для этого расчетная навеска полимера g2, взвешенная с
точностью ±2.10-4 г, помещается в предварительно взвешенную с такой же
точностью коническую колбу на 200-250 мл и заливается расчетным количеством растворителя из мерного цилиндра. После этого производится повторное взвешивание колбы и находится точная масса добавленного растворителя g1. Концентрация полимера в растворе (граммы полимера на 100
мл растворителя) рассчитывается по формуле:
Ci = 100g2ρ1/g1 ,
где ρ1 – плотность растворителя при температуре измерения вязкости.
Колба закрывается притертой пробкой и помещается на магнитную
мешалку с нагревательным стеклом или в водяной термостат для ускорения процесса растворения.
ВЫБОР ИЗМЕРИТЕЛЬНОГО УСТРОЙСТВА
При выборе измерительного устройства необходимо учитывать реологические характеристики исследуемого раствора. Измерительные уст24
ройства S1, S2 и S3 используются для средних, а измерительное устройство
Н – для высоких значений вязкости. Для растворов полимеров, используемых в данной лабораторной работе, имеет смысл начинать эксперимент на
измерительном устройстве S1.
ПРОВЕРКА УСТАНОВКИ НУЛЯ (производится учебным мастером)
До начала измерений нужно произвести проверку установки нуля.
Для этого необходимо выполнить следующие операции:
1. Установить «Реотест» и подключить его к сети.
2. Соединить выбранный измерительный цилиндр с прибором.
3. Проверить при отключенном устройстве нуль индикаторного прибора.
Если необходимо, произвести механическую корректировку нуля.
4. Включить измерительный механизм и двигатель. Проверить нуль индикаторного прибора. Если необходимо, произвести электрическую корректировку нуля.
ЗАПОЛНЕНИЕ ИЗМЕРИТЕЛЬНЫХ ЕМКОСТЕЙ
Перед началом заполнения измерительной емкости она разбирается и
тщательно очищается соответствующим растворителем при использовании
щеток, прилагаемых к прибору. После очистки и сушки всех деталей,
включая прокладку, измерительная емкость вновь собирается.
Исследуемый раствор в количестве, указанном в табл. 2.1, вносится в
емкость сверху. При этом предпочтительным является взвешивание раствора вместо определения его количества по объему.
Соединение цилиндрического измерительного устройства с измерительным механизмом производится, как описано выше.
ТЕРМОСТАТИРОВАНИЕ
Вязкость текущего материала очень сильно зависит от температуры.
Поэтому при измерениях необходимо тщательное термостатирование измерительного устройства. Для этого измерительная емкость с исследуемым
материалом погружается в термостатирующую баню. Подключение бани к
циркуляционному термостату обеспечивает безупречное термостатирование измерительного зазора.
В данной лабораторной работе предполагается исследование реологических свойств растворов полимеров в области температур 20 - 70 0С.
Поэтому в качестве термостатирующей жидкости используется дистиллированная вода.
25
После того как показания контрольного термометра достигли требуемого значения температуры, термостатирование продолжается в течение ~30 мин.
ИЗМЕРЕНИЕ
После достаточно длительного термостатирования можно начинать
измерения. Для проведения измерений следует исходить из того, что с точки зрения функционирования прибора нет жестких требований к последовательности проведения работ. Так, например, для ньютоновских жидкостей достаточно проводить измерения в одной точке для того, чтобы получить величину динамической вязкости. Реализуемые при этом скорость и
напряжение сдвига являются произвольными.
У материалов со структурной вязкостью или у материалов с дилатансией необходимо снять зависимость между напряжением и скоростью
сдвига, чтобы построить кривую течения. Для этого нужно начать с измерений при малых значениях скорости сдвига и отсчитывать показания на
индикаторном приборе. Увеличение скорости сдвига производится путем
увеличения скорости вращения измерительного цилиндра путем переключения редуктора.
Часто требуется снятие кривой гистерезиса исследуемого материала. Это имеет место у тиксотропных и реопексических жидкостей. В данном случае измеряется напряжение сдвига при возрастающей и при
уменьшающейся скорости сдвига. При этом нужно следить за тем, чтобы
необходимые переключения производились таким образом, чтобы у ряда
измерений с возрастающей скоростью сдвига требуемая скорость вращения устанавливалась со стороны нижних значений, а у ряда измерений с
уменьшающейся скоростью сдвига, наоборот, с верхних.
Определение предела текучести может производиться при малых
скоростях вращения измерительного цилиндра, например, путем определения того значения напряжения сдвига, при котором измерительный вал
начнет вращаться после включения двигателя. Начало вращения можно
наблюдать по накатанной части муфты.
Другие нюансы эксперимента обсуждаются с преподавателем в
процессе подготовки и выполнения работы.
Для проведения работ, следующих после измерений, таких как снятие термостатирующей бани, измерительной емкости и измерительного
цилиндра, не требуется определенной технологии. Эти элементы лучше
всего снимать в вышеописанной последовательности.
ОБРАБОТКА РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
26
Между отсчитываемыми измерительными значениями и реологическими параметрами имеет место следующая взаимосвязь. Для напряжения
сдвига, действующего в исследуемом материале, получается:
τ = zα дцПа,
где z – постоянная цилиндра, указанная в табл. 2.2; α – отсчитываемое
значение шкалы на индикаторном приборе. Скорость сдвига γ (с-1) пропорциональна скорости вращения внутреннего цилиндра
γ = 2W’/{[1-(r/R)2]60} с-1.
При этом
W’ = Wν/50,
где W – значение скорости вращения по табл. 2.3, ν – фактическая частота
переменного тока, зафиксированная при выполнении эксперимента по измерителю частоты.
По рассчитанным значениям τ и γ находят значение динамической
вязкости
η = 100τ/γ, мПа.с.
Для неньютоновских жидкостей путем данного расчета получается
значение «эффективной вязкости».
Суждение о том, является ли жидкость ньютоновской или неньютоновской, можно сделать из сопоставления результатов эксперимента, записанных в виде нижеследующей таблицы.
Таблица 2.4
Дата….., концентрация раствора….г/100мл, тип измерительного
устройства…, константа цилиндра…, температура…0С, частота тока …Гц
Область измерений
1
.
W,
об/мин
α
τ,
10 , Па
-1
γ,
с-1
η,
мПа.с
Если рассчитанные значения η, оказываются закономерно изменяющимися (уменьшающимися или возрастающими) с ростом τ и γ, то жидкость является неньютоновской, и, следовательно, необходимо внести
уточнения в расчет γ и η.
В этом случае
γ = W’/{[(r/R)-1]60}, с-1.
На основе уточненных значений γ, рассчитывают новые значения η.
27
3. ДЕФОРМАЦИОННО-ПРОЧНОСТНЫЕ СВОЙСТВА
ПОЛИМЕРОВ
ТЕОРИЯ
Способность к большим обратимым деформациям является характерным свойством полимерных материалов. Это свойство характеризует внутреннюю реакцию полимера на внешнее воздействие, выражающуюся в деформации — изменении формы полимерного образца. В зависимости от видов воздействия на полимерный образец различают деформации растяжения, сжатия, изгиба, сдвига, кручения, всестороннего сжатия и др. Наиболее важным деформационным свойством полимеров является зависимость деформации ε от величины прилагаемого напряжения σ –
так называемая диаграмма напряжение - деформация. Такие диаграммы
снимают на разрывных машинах и динамометрах.
Вид диаграмм ε = f(σ) определяется главным образом фазовым и физическим состояниями полимера. Рассмотрим деформационные свойства
аморфных и кристаллических полимеров.
ДЕФОРМАЦИОННЫЕ СВОЙСТВА АМОРФНЫХ ПОЛИМЕРОВ
Линейные аморфные полимеры в зависимости от температуры могут
находиться в трех физических состояниях: стеклообразном, высокоэластическом и вязкотекучем. Типичные диаграммы ε = f(σ) для аморфных
полимеров приведены на рис. 3.1.
В стеклообразном состоянии полимеры способны развивать незначительные деформации под действием небольших напряжений (рис. 3.1,
кривые 1 и 2).
Начальный участок зависимости ε = f(σ) для любого полимера, являющийся прямой линией, соответствует упругой деформации, которая
невелика по величине и формально подчиняется закону Гука:
σ = Eε,
(3.1)
где σ – удельная нагрузка на образец; ε – относительная деформация; Е –
модуль упругости.
Модуль упругости характеризует устойчивость материала к деформации под действием внешних нагрузок. Упругая деформация невелика и
полностью обратима. Она обусловлена изменением расстояний между
атомами вещества. При этом работа внешних деформирующих сил расходуется на преодоление внутренних сил взаимодействия, т. е. упругая деформация полимеров носит энергетический характер.
28
σ
1
a
b
c
d
e 2
3
Рис. 3.1. Кривые растяжения аморфных
полимеров: 1 – жесткие хрупкие полимеры при температуре ниже температуры
хрупкости; 2 – жесткие пластичные
аморфные полимеры в интервале от температуры хрупкости до температуры стеклования; 3 – эластичные аморфные полимеры в высокоэластическом состоянии
ε
Ниже температуры хрупкости Тхр стеклообразного полимера, когда
гибкость цепи очень низка, полимер способен развивать только упругую
деформацию, как и низкомолекулярные твердые тела (рис. 3.1, кривая 1).
Дальнейшее деформирование образца полимера, находящегося в таком состоянии, приводит к его разрушению. Таким образом, ниже Тхр полимер не
обладает преимуществами по сравнению с низкомолекулярными твердыми
веществами. Нагрузка на единицу поперечного сечения образца, при которой наступает его разрушение в процессе деформирования, называется
разрушающим напряжением σр. В зависимости от вида деформации различают разрушающее напряжение при растяжении, сжатии, изгибе и др.
В стеклообразном состоянии для полимеров характерны лишь малые
деформации при небольших напряжениях. Однако в отличие от низкомолекулярных веществ полимеры, находящиеся в стеклообразном состоянии,
под действием больших усилий способны развивать при определенных условиях значительные деформации (до нескольких сотен процентов). Способность стеклообразных полимеров развивать большие деформации называют вынужденной эластичностью, а деформацию — вынужденноэластической. Вынужденно-эластическая деформация развивается в температурном интервале между Тхр и температурой стеклования полимера Тс.
Типичная зависимость ε = f(σ) для стеклообразного полимера при
температуре выше Тхр приведена на рис. 3.1 (кривая 2). В начальный момент развития вынужденно-эластической деформации в образце образуется участок со значительно уменьшенным поперечным сечением (шейка),
который по мере развития деформации увеличивается в размерах. Образованию «шейки» на кривой ε=f(σ) соответствует скачок а–b–с. Напряжение,
отнесенное к единице поперечного сечения образца, при котором начинает
развиваться вынужденно-эластическая деформация называют пределом
текучести σт. Вынужденная эластичность обусловлена изменением конформации макромолекул. Под действием внешних нагрузок макромолекулы разворачиваются и величина деформации возрастает. В данном случае
проявляется кинетическая гибкость цепи. Следовательно, вынужденно-эла29
стическая деформация носит кинетический характер. Для того чтобы заставить цепи выпрямиться, необходимы значительные напряжения. После
прекращения действия нагрузки при температуре ниже Тс вынужденноэластическая деформация не снимается, а при температурах выше Тс, когда
полимер переходит в высокоэластическое состояние, образец полностью
восстанавливает свои размеры и поэтому такая деформация носит обратимый характер. Вынужденно-эластической деформации на кривой ε = f(σ)
соответствует горизонтальный участок с–d, характеризующийся большими
деформациями при постоянном приложенном напряжении.
В высокоэластическом состоянии полимер развивает очень большие
обратимые деформации под действием небольших приложенных напряжений. Полимеры, находящиеся в высокоэластическом состоянии, называются каучуками, или эластомерами. Сущность высокоэластичности состоит в распрямлении свернутых гибких цепей под влиянием приложенных нагрузок и возвращении цепей к первоначальной форме после снятия
нагрузок. Высокоэластичность, как и вынужденная эластичность, имеет
кинетический характер и обусловлена подвижностью макромолекул, которая в высокоэластическом состоянии несравненно выше, чем в стеклообразном. В результате в высокоэластическом состоянии большие деформации развиваются при малых напряжениях, а в стеклообразном – при более
значительных напряжениях. После снятия нагрузки усилие, возникающее
из-за стремления макромолекул принять равновесное свернутое состояние,
возвращает эластомер в исходное состояние, а застеклованный полимер
остается в деформированном состоянии. Типичная кривая ε = f(σ) для эластомеров приведена на рис. 3.1 (кривая 3).
Общая деформация полимера складывается из упругой деформации
εупр , высокоэластической деформации εвэл и деформации течения εтеч.:
ε = εупр+εвэл+ εтеч
(3.2)
Течение – это необратимое перемещение макромолекул относительно друг друга под действием внешнего приложенного усилия.
Оно определяется межмолекулярным трением и поэтому в низкомолекулярных жидкостях и газах течение осуществляется легко, а в полимерах
оно существенно затруднено из-за большой длины макромолекул и
вследствие этого больших межмолекулярных взаимодействий. Вследствие
наличия течения при деформировании полимеров полного восстановления размеров образца после снятия нагрузки не происходит. Разность
между размерами образца до и после нагрузки называется остаточной
деформацией.
Течение является нежелательным процессом для полимеров, эксплуатирующихся в высокоэластическом или стеклообразном состоянии.
Поскольку течение происходит в результате движения макромолекул от30
носительно друг друга, то связывание макромолекул эластомеров между
собой редкими поперечными химическими связями (сшивка, вулканизация) приводит к значительному снижению остаточного удлинения (резины). Однако при большой густоте сетки макромолекулы теряют подвижность и полимер утрачивает эластичность и становится твердым (эбонит).
С повышением температуры энергия взаимодействия между макромолекулами уменьшается и возрастает εтеч, поэтому εтеч довольно велика при
температурах, соответствующих вязкотекучему состоянию полимеров. В
вязкотекучем состоянии для полимеров наибольший вклад в общую деформацию вносит деформация течения, но при этом проявляется также
способность полимеров к высокоэластическим деформациям. Высокоэластичностью расплавов полимеров объясняется эффект разбухания струи,
выдавливаемой из отверстия. Долей упругой составляющей в общей деформации полимера в текучем состоянии практически можно пренебречь.
ДЕФОРМАЦИОННЫЕ СВОЙСТВА КРИСТАЛЛИЧЕСКИХ ПОЛИМЕРОВ
Кристаллические полимеры под действием приложенных напряжений способны развивать значительные деформации (до нескольких сотен процентов). Характерные кривые ε = f(σ) для кристаллических полимеров приведены на рис. 3.2. Помимо упругой деформации кристаллические полимеры при больших нагрузках проявляют вынужденноэластическую деформацию.
Деформация кристаллических полимеров сопровождается не только
выпрямлением свернутых цепей макромолекул в аморфных областях, но и
ориентацией кристаллитов и частичной их рекристаллизацией. В зависимости от природы кристаллического полимера процессы ориентации кристаллитов и рекристаллизации могут протекать различно. Часто наблюдается преобразование кристаллитов в фибриллярные надмолекулярные
структуры.
Вследствие ориентации макромолекул их свойства в различных направлениях относительно направления ориентации существенно различаются, т. е. наблюдается анизотропия свойств. Анизотропия свойств также
проявляется и в деформированных стеклообразных полимерах.
ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА ДЕФОРМАЦИОННЫЕ
СВОЙСТВА ПОЛИМЕРОВ
Значительное влияние на деформационные свойства полимеров оказывают химическое строение и характеристики макромолекул (молекулярная масса и молекулярно-массовое распределение, гибкость цепей, наличие разветвлений и сшивок, регулярность строения и др.), а также надмолекулярная структура полимеров. Молекулярная масса полимеров существенно влияет на Тхр, Тс и Тт полимеров и поэтому варьированием мо31
лекулярной массы можно изменять температурные интервалы реализации
полимерами различных физических состояний, т. е. изменять температурные области эксплуатации и переработки полимеров.
σ
T
1
T
2
T
3
T
4
T
Рис. 3.2. Кривые растяжения кристаллического полимера при различных температурах (Т1<Т2<Т^<Т4<Т5)
5
ε
Повышение молекулярной массы полимеров расширяет температурную
область высокоэластического и вынужденно-эластического состояний
вследствие снижения их Тхр и повышения Тпл. Высокоэластическая и вынужденно-эластическая деформация наступают лишь по достижении определенной критической молекулярной массы, при которой цепи способны
проявлять достаточно высокую кинетическую гибкость и макромолекулы
вследствие их большой длины сильно взаимодействуют друг с другом.
При увеличении молекулярной массы до некоторого предела относительная деформация сначала возрастает, а затем практически не изменяется.
Деформационные свойства полимеров зависят также от кинетической гибкости макромолекул. Гибкость макромолекул определяется
не только их химическим строением, но и существенно зависит от температуры. С повышением температуры понижается модуль упругости, разрушающее напряжение и предел текучести, а относительное удлинение
возрастает (за исключением области температур, близких к температуре
текучести или плавления полимеров) (см. рис. 3.2).
Гибкость макромолекул зависит также и от плотности упаковки макромолекул. Рыхлая упаковка облегчает изменение конформации макромолекул и способствует проявлению вынужденной эластичности у стеклообразных аморфных полимеров. Плотность упаковки макромолекул в значительной степени зависит от степени разветвленности макромолекул. Увеличение степени разветвленности до некоторого предела облегчает протекание процесса вынужденной эластичности, но, как правило, отрицательно сказывается на величине полного относительного удлинения. Плотность упаковки кристаллических полимеров в основном определяется степенью кристалличности. Уменьшение степени кристалличности способствует проявлению вынужденной эластичности. Деформационные свойства
кристаллических полимеров зависят также от влияния структуры кристал32
лических образований. Уменьшение размеров надмолекулярных кристаллических образований в полимере облегчает процесс вынужденной эластичности. Однако следует отметить, что ни степень кристалличности, ни
размер кристаллических образований практически не влияют на максимально достижимое относительное удлинение, они лишь упрощают или
ужесточают требования к условиям ее достижения.
Деформационные свойства полимеров зависят от их структуры, которая в свою очередь определяется методом переработки (из раствора, расплава) и условиями изготовления изделий из полимеров (температурновременной режим, давление и др.). Поэтому к условиям формования образцов предъявляются вполне определенные требования.
Все полимерные материалы при длительном воздействии внешних
сил разрушаются при напряжениях, которые значительно меньше напряжений, возникающих при быстром воздействии силы. Это означает, что
сопротивление разрыву зависит от времени действия силы. Время от момента приложения силы до момента разрыва образца называется долговечностью материала. Зависимость логарифма долговечности от приложенного напряжения для различных материалов выражается прямой линией.
Увеличение нагрузки приводит к уменьшению долговечности. Таким образом, σр – это удельная нагрузка на материал, при которой его долговечность близка к нулю.
Одной из особенностей поведения полимеров при деформировании
является релаксационный характер реакции полимера на механическое
воздействие, выражающийся в зависимости деформаций и напряжений от
скорости (частоты) воздействия. Если скорость деформации очень высока
(удар), то развития вынужденно-эластической деформации не происходит,
сравнительно невелика и деформация эластомера. При очень малых скоростях деформирования вынужденно-эластическая деформация проявляется
даже у жесткоцепных полимеров. Это обусловлено неравновесным характером процесса деформации. Выведенные действием нагрузки из равновесного состояния макромолекулы стремятся вернуться в это состояние,
для чего необходимо время, которое определяется подвижностью макромолекул. С возрастанием скорости деформации увеличивается удаленность
макромолекул от равновесного состояния. При этом затрудняются их
дальнейшие конформационные превращения под действием внешних сил,
а следовательно, осложняется процесс деформации.
Таким образом, деформационные свойства одного и того же полимера зависят от целого ряда факторов: предыстории, температуры испытаний, скорости приложения деформации, продолжительности воздействия
нагрузки и др. Следовательно, деформационная характеристика полимера
– величина весьма относительная, зависящая от многих факторов. Условия
33
изготовления образцов, их кондиционирования и проведения эксперимента
оговариваются в стандартах на данный полимер или на данное испытание.
Большое число факторов, влияющих на деформационные свойства
полимеров, а также несовершенство измерительной техники вызывает естественный разброс результатов измерений. Поэтому на практике испытания проводят несколько раз и за окончательный результат принимают
среднее арифметическое значение определяемого показателя.
РЕЛАКСАЦИОННЫЕ ПРОЦЕССЫ
Установление равновесного состояния в системе происходит во времени. Это время называется временем релаксации. Релаксация—это процесс установления статистического равновесного состояния в системе. На
практике о времени релаксации судят по тому, с какой скоростью макроскопические величины, характеризующие состояние системы (σ, ε, Е и
др.), приближаются к своим равновесным значениям. Например, время релаксации можно оценивать по времени достижения максимальной деформации образцом под действием постоянной нагрузки или по времени снятия напряженности в образце, подвергнутому деформации — релаксации
напряжения.
Характерной особенностью полимеров является наличие двух типов
структурных элементов — звеньев и цепей. Эти структурные элементы
существенно различаются своими размерами и подвижностью, а следовательно, и временем достижения равновесного состояния. Поэтому полимеры обладают целым набором или спектром времен релаксации, соответствующих временам перегруппировки звеньев цепи, участков цепи, а также
надмолекулярных структур. Полимерные цепи вследствие их больших
размеров имеют малую подвижность и очень большие времена релаксации
(иногда годы), тогда как звенья цепи характеризуются большей подвижностью и малыми временами релаксации (10-4 – 10-6 с), что на четыре –
шесть порядков больше времен релаксации низкомолекулярных жидкостей.
Время релаксации τ для любых систем можно выразить через энергию активации релаксационного процесса ΔU:
τ = τ0eΔU/RT,
(3.3)
где τ0 - период колебания (1-10-13 с); R — газовая постоянная; Т — температура.
34
ПРИНЦИП ТЕМПЕРАТУРНО-ВРЕМЕННОЙ СУПЕРПОЗИЦИИ
При повышении температуры увеличивается подвижность макромолекул и уменьшается время их релаксации. Поэтому очень длительный релаксационный процесс можно провести за сравнительно короткое
время, если повысить температуру. Из этого следует, что влияние временного фактора и температуры на свойства вязкоупругих материалов, находящихся под действием напряжений, эквивалентно. Эта закономерность
получила название принципа температурно-временной суперпозиции. Используя этот принцип можно осуществлять экстраполяцию от малых к
большим временам релаксации, что сокращает время эксперимента. Экстраполяция сводится к тому, что экспериментальные кривые релаксации,
полученные при различных температурах, сдвигают горизонтально переносом их вдоль оси логарифма времени на некоторую величину lg ат, до
получения единой обобщенной кривой.
Температурные зависимости всех механических и электрических
свойств аморфных полимеров выше Тс могут быть описаны одной функцией ат, которая представляет собой отношение значения времени релаксации при температуре Т к значению времени релаксации при температуре
Т0, принятой за стандартную. Для каждого полимера можно выбрать свою
Т0 и выразить ат как функцию разности Т — Т0, причем для многих аморфных полимеров эта зависимость подобна и может быть выражена уравнением
lgат = -C1(T – T0)/[C2+(T – T0)],
(3.5)
где C1 и C2 – эмпирические константы.
Уравнение (3.5) получило название уравнения ВЛФ (Вильямса –
Лэндела – Ферри). На основании уравнения ВЛФ можно определить время
релаксации практически любой механической и электрической величины
данного полимера при любой температуре выше его Тс.. Использование
принципа температурно-временной суперпозиции позволяет прогнозировать изменение деформационных свойств полимеров на длительные сроки
(годы) по данным непродолжительного эксперимента.
35
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПРЕДЕЛЕНИЕ ДЕФОРМАЦИОННЫХ СВОЙСТВ ПОЛИМЕРОВ
ПРИ РАСТЯЖЕНИИ
Цель работы: получить кривые деформация-напряжение и определить деформационно-прочностные характеристики аморфных и кристаллических полимеров.
Образцы: поливинилхлорид, пластифицированный поливинилхлорид, полиэтилен, полистирол, полиэтилентерефталат, полиизобутилен (в
виде пленки, листа или пластины).
Приборы: машины для испытания резин типа ПМР-1, разрывная машина типа 2099-Р-5, штанцевый вырубной нож, толщиномер, штангенциркуль.
Методика работы: штанцевым вырубным ножом вырубают из полимеров, отобранных по указанию преподавателя, пять образцов в виде
лопаток (допускается использовать образцы в виде полосок с размерами
40х3 мм). Образцы нумеруют и измеряют толщину и ширину рабочей части образцов при помощи толщиномера и штангенциркуля с точностью 0,01
и 0,1 мм соответственно. Затем рассчитывают площадь поперечного сечения.
Зажимную длину принимают равной (20 ± 1) мм.
Скорость движения зажима разрывной машины устанавливают равной 15 мм/мин (или иной по заданию преподавателя).
Проведение испытаний на машине для испытания резин ПМР-1.
Включают машину в сеть, повернув пакетный переключатель на правой
стороне машины. Включают потенциометр, после его прогрева в течение
10 мин устанавливают «нуль» силоизмерителя потенциометра. Устанавливают необходимый предел нагрузки и требуемую скорость движения захватов. Приводят машину в исходное состояние (при необходимости).
Закрепляют образец полимера в зажимах и устанавливают их в захват машины. Нажатием кнопок «МЕШАЛКА-ПУСК» и «РАБОЧИЙ ХОД» на
управляющем блоке машины и кнопки «ПУСК» на силовом блоке приводят
машину в движение. Одновременно включают тумблер «ДИАГРАММА» потенциометра. По окончании испытания нажать кнопки «СТОП» на силовом
и управляющем блоках машины и отключить тумблер «ДИАГРАММА» на
потенциометре. Приводят машину в исходное состояние нажатием кнопок
«МЕШАЛКА-ПУСК» и «ВОЗВРАТ» на управляющем блоке и кнопки «ПУСК»
на силовом блоке. Вынимают зажимы из захватов машины.
Результаты испытаний, зафиксированных на диаграммной ленте потенциометра, вносят в таблицу «Форма записи результатов».
36
Таблица 3.1
Форма записи результатов
Образец:
Характеристика образца: длина, ширина и толщина рабочего участка, мм
(L0, h, d); площадь поперечного сечения, м2 (S = 10-6hd)
Условия испытания: температура; скорость деформации, мм/мин (Vз); скорость движения диаграммной ленты, мм/мин (Vd)
1
2
3
4
5
6
Фиксируемая
Расстояние
Деформация
Относительное
Усилие
Напряточка, № п/п
на диаграм(L-L0), мм
(Р), кгс
жениие
удлинение (ε), %
мной ленте
(σ), МПа
(Ld), мм
Обработка результатов. На основании записанных на диаграммной
ленте данных рассчитывают текущие значения:
деформации при растяжении
L − L0 = Ld
Vз
;
Vd
относительного удлинения при растяжении
ε=
L − L0
100;
L0
напряжения при растяжении
σ = 9.81 ⋅ 10−6 P S
и строят график зависимости напряжения от удлинения при растяжении.
Проведение испытаний на разрывной машине 2099-Р-5. Включают
машину в сеть, повернув тумблеры «ВКЛЮЧИТЬ» на измерительном и
управляющем блоках машины. Устанавливают плоские зажимы на заданное расстояние. Перед каждым испытанием нажатием кнопки «ПУСК» необходимо обнулить показания на пульте измерения. Затем устанавливают
в зажимы образец полимера. Нажатием кнопки «ВВЕРХ» приводят в движение верхний зажим с необходимой скоростью, устанавливаемой задатчиком скорости на управляющем блоке машины. С интервалом 5 с на
пульте измерения снимают показания усилия (Н). В момент разрыва происходит автоматический останов машины. На пульте измерения снимают
показания разрывного усилия (Н) и удлинения (мм). Далее нажатием кнопки «ВНИЗ» приводят машину в исходное положение.
Результаты испытаний вносят в таблицу, приведенную ниже.
37
Таблица 3.2
Форма записи результатов
Образец:
Характеристика образца: длина, ширина и толщина рабочего
участка, мм (L0, h, d); площадь поперечного сечения, м2 (S = 10-6hd)
Условия испытания: температура; скорость деформации, мм/мин (Vз)
1
2
3
4
5
Деформация
Относительное
Усилие
Напряжение
Время (τ), с
(L-L0), мм
(Р), Н
удлинение (ε), %
(σ), МПа
Обработка результатов. На основании полученных данных рассчитывают текущие значения:
деформации при растяжении
L − L0 =
Vз τ
;
60
относительного удлинения при растяжении
ε=
L − L0
100;
L0
напряжения при растяжении
σ = 10−6 P S
и строят график зависимости напряжения от удлинения при растяжении.
Задание. Объяснить найденный характер зависимостей напряжения
от удлинения при растяжении для аморфных и кристаллических полимеров и произвести их количественную оценку.
ОЦЕНКА ВЛИЯНИЯ СКОРОСТИ ДЕФОРМАЦИИ ХИМИЧЕСКИХ
НИТЕЙ НА ИХ ДЕФОРМАЦИОННО-ПРОЧНОСТНЫЕ СВОЙСТВА ПРИ
РАСТЯЖЕНИИ
Цель работы: получить зависимости разрывного усилия и удлинения при разрыве для химической нити от скорости ее деформации.
Образцы: технические полиамидные нити линейной плотностью 93,5
текс и структуры 93,5х1х2; текстильные полиэфирные, полиамидные и
вискозные нити различной линейной плотности.
Приборы: разрывная машина маятниковая типа РМ-30-1; разрывная
машина с тензодатчиком регистрации нагрузки марки 2099-Р-5.
Сущность метода заключается в растяжении нити до разрыва и определении величины разрывной нагрузки и удлинения при разрыве.
38
Разрывная нагрузка (Р) – максимальное усилие, выдерживаемое нитью при растяжении до разрыва.
Удельная разрывная нагрузка (Руд.) – отношение разрывной нагрузки нити к линейной плотности нити (Т).
Удлинение при разрыве (ε) – отношение приращения длины нити в
момент разрыва (Lp - L0) к зажимной длине.
Зажимная длина (L0) – расстояние между краями зажимных губок
разрывной машины в исходном положении.
Методика работы. Разрывную нагрузку нитей определяют методом
разрыва одной нити. Удлинение при разрыве нити определяют одновременно с определением разрывной нагрузки.
Зажимную длину принимают равной (100 ± 1) мм.
Скорости движения зажима разрывной машины устанавливают равными 100; 450 и 800 мм/мин (или иными по заданию преподавателя). При
каждой скорости испытывают не менее 25 одинаковых образцов.
Проведение испытаний на разрывной машине маятникового типа.
Включают машину в сеть с помощью тумблера. Устанавливают (если это
необходимо) подвижный нижний зажим в исходное положение, проверяют
нулевое положение указательной стрелки маятника и запирают при помощи рычага планку верхнего зажима. Затем устанавливают в верхний зажим
отрезок нити длиной 200 мм таким образом, чтобы петля нити охватывала
шпильку. Запирают верхний зажим. Конец нити пропускают через шпильку нижнего зажима, слегка натягивают нить, чтобы отсутствовало ее провисание, и запирают нижний зажим. Нажатием кнопки «ВНИЗ» приводят в
движение нижний зажим с необходимой скоростью, устанавливаемой регулятором скорости. В момент разрыва происходит автоматический останов нижнего зажима. Снимают показания усилия (кгс) по шкале маятника,
учитывая массу груза маятника, и деформации (мм) по шкале диска, кинематически связанного с перемещением нижнего зажима. Нажатием кнопки
«ВВЕРХ» возвращают машину в исходное состояние. Назначение «красной
кнопки» - аварийный останов машины.
Проведение испытаний на разрывной машине 2099-Р-5. Включают
машину в сеть, повернув тумблеры «ВКЛЮЧИТЬ» на измерительном и
управляющем блоках машины. Устанавливают ниточные зажимы на заданное расстояние. Перед каждым испытанием нажатием кнопки «ПУСК»
необходимо обнулить показания на пульте измерения. Затем устанавливают в зажимы отрезок нити длиной 200 мм таким образом, чтобы начальное
натяжение нити, фиксируемое на пульте измерения, составляло 1 – 3 Н.
Нажатием кнопки «ВВЕРХ» приводят в движение верхний зажим с необхо39
димой скоростью, устанавливаемой задатчиком скорости на управляющем
блоке машины. В момент разрыва происходит автоматический останов
машины. На пульте измерения снимают показания разрывного усилия (Н)
и удлинения (мм). Далее нажатием кнопки «ВНИЗ» приводят машину в исходное положение.
Результаты испытаний вносят в следующую таблицу.
Таблица 3.3
Форма записи результатов
№ п/п
Образец 1, скорость деформации 100 мм/мин
Разрывное Деформация Удельная разУдлинение
усилие (Р), (Lp-L0), мм
рывная нагруз- при разрыве
Н/кгс
ка (Руд.), Н/текс
(ε), %
1
2
...
25
Среднее значение
Среднее квадратичное отклонение
Обработка результатов. На основании полученных данных рассчитывают:
P уд . = P T
ε =
Lp − L0
L0
Н / текс ;
100
%;
затем строят графики зависимостей Руд. и ε от скорости деформации.
Задание. Объяснить найденный характер зависимостей разрывной
нагрузки и удлинения при разрыве от скорости деформации растяжения.
40
4. ОПРЕДЕЛЕНИЕ МОДУЛЯ СДВИГА ХИМИЧЕСКОЙ НИТИ
ТЕОРИЯ
Жесткость комплексной нити любой химической природы определяется жесткостью материала, из которого нить получена, ее структурой и
свойствами элементарной нити.
Модуль сдвига является величиной, характеризующей жесткость материалов при кручении. Пользуясь этой величиной, можно сравнить между
собой жесткость нитей различных видов.
Модуль сдвига комплексной нити рассчитывается по формуле:
G = 10-1K(1/T)2γ2nфWD2lτ-2 МПа,
(4.1)
где Т – линейная плотность комплексной нити, текс;
γ – плотность нити, кг/м3;
nф – количество элементарных нитей в комплексной нити;
τ2 – полупериод первого колебания диска после закручивания нити, с;
W – масса диска маятника, г ( 2,3-2,4 г);
D – диаметр диска, см (6,1 см);
l – длина подвеса нити, см (15 см);
K – константа, равная (10π2)/(8.981).
Таким образом, при определении модуля сдвига испытание сводится
к определению полупериода колебания диска маятника и линейной плотности нити, так как все остальные параметры испытания, а именно W, D и
l, должны быть приняты постоянными (W в пределах, указанных выше).
АППАРАТУРА
Для определения модуля сдвига пользуются крутильным маятником
КМ-20 с модифицированным диском.
Принцип действия прибора заключается в том, что свободно подвешенная нить закручивается на заданное число оборотов с помощью диска,
прикрепленного к концу нити. В процессе испытания определяется полупериод раскручивания нити.
Прибор, показанный на рис. 4.1, состоит из чугунной коробки 1, к
задней стенке которой прикреплен стержень 2. По стержню может перемещаться кронштейн 3 с верхним зажимом 4 и рычажком 5 для предварительного натяжения нити. Внутри коробки имеется механизм, несущий
подвижную опорную площадку 6 со шпильками 7, которые фиксируют положение диска маятника 8. На верхней крышке коробки 1 помещен уро41
вень 9. Сбоку прибора имеется рукоятка 10, фиксирующая кнопка 11 и
пусковая кнопка 12.
5
3
2
4
9
7
6
11
12
10
8
1
Рис.4.1. Крутильный маятник КМ-20
МЕТОДИКА ИСПЫТАНИЯ
Установка прибора. Прибор КМ-20 устанавливают на устойчивом
столе с помощью установочных винтов по уровню 9. Опорная площадка 6
поднимается и на нее укладывают диск маятника 8. Расстояние l между
верхним зажимом 4 и крючком маятника 8 должно быть равно 15 см. Для
предупреждения перекоса нити при заправке верхний зажим укрепляют
строго над крючком диска. Затем в верхнем зажиме закрепляют нить с отвесом. Конец отвеса должен находиться на одной вертикали с крючком
42
диска. Если конец отвеса отходит в сторону, то, поворачивая верхний зажим, добиваются правильной его установки относительно крючка диска.
Подготовка прибора к испытанию. Рукоятку прибора 10 приводят в
соприкосновение с фиксирующей кнопкой 11 до упора. При этом риска,
нанесенная на опорной площадке прибора, должна находиться против метки, расположенной на крышке коробки. В противном случае площадку повертывают вручную по часовой стрелке до тех пор, пока риска не расположится против метки. После этого на опорную площадку надевается диск
так, чтобы риска на диске совпадала с риской на опорной площадке.
Заправка нити. Чтобы диск при заправке нити не смещался, на него
ставят два грузика, масса которых в два раза превышает массу грузика
предварительного натяжения. С паковки сматывают нить и конец ее спускают, чтобы снять неуравновешенность крутки; после этого нить складывают в виде петли; среднюю часть петли надевают на крючок, а оба конца
нити заправляют в зажим 4 и перекидывают через шпильку, расположенную на рычажке 5. При этом ветви петли должны быть параллельны. На
правое плечо рычажка 5, на расстоянии, равном расстоянию от центра
вращения до шпильки, подвешивают грузик предварительного натяжения,
масса которого определяется линейной плотностью нити (табл. 4.1).
Перекинутые через шпильку концы нити натягивают и завертывают
зажим 4; выходящие из зажима концы нити срезают.
Таблица 4.1
Величина предварительного натяжения
Линейная плотность
нити, текс
Масса
грузика, г
Линейная плотность
нити, текс
Масса
грузика, г
< 10
2
34 – 50
5
10 – 25
5
51 – 100
5
26 – 33
5
101 – 200
10
201 и выше
20
Проведение испытания. После заправки нити нажимом на фиксирующую кнопку 11 вдавливают ее внутрь коробки прибора, затем поворачивают рукоятку 10 по часовой стрелке до упора в фиксирующую кнопку,
которая за это время под действием пружины снова возвратилась в исходное положение. Поворачивать рукоятку следует плавно с небольшой скоростью. Если при этом риски на площадке и на маятнике не станут против
стрелки, диск вместе с опорной площадкой вручную проворачивают (по
43
часовой стрелке) до совпадения рисок со стрелкой. Нажимают на пусковую кнопку 12, при этом опорная площадка опускается, и диск начинает
вращаться.
Одновременно с началом вращения диска включают секундомер и с
точностью до 0,1 с отмечают время от начала вращения диска до его останова перед изменением направления вращения, т.е. половину периода колебания диска. Число оборотов за один оборот рукоятки равно 20. Это
число оборотов принято для всех химических нитей (кроме нитей высоких
«тексов» – 93 и выше, у которых при таком числе оборотов очень велика
укрутка, вследствие чего диск соскакивает со шпилек опорной площадки).
Поэтому при испытании таких нитей рукоятку поворачивают только на
пол-оборота, т.е. диску сообщают десять оборотов.
После каждого испытания нить срезают у верхнего зажима.
Линейная плотность нити. Линейная плотность нити (единица измерения – текс) – это масса 1000 м нити, выраженная в граммах. Для этого
на мотовиле отмеряют 10 м исследуемого образца нити (соответствуют 10
виткам) и взвешивают его на аналитических весах с точностью до 0,001 г.
Затем составляют пропорцию и находят массу 1000 м нити. Это и будет
линейная плотность нити, выраженная в тексах.
44
5. РАСТВОРИМОСТЬ ПОЛИМЕРОВ
ТЕОРИЯ
Системы полимер-растворитель по основным закономерностям поведения подобны низкомолекулярным. Однако вследствие больших размеров макромолекул полимера имеют некоторые особенности:
• малую скорость установления равновесия;
• низкую концентрацию полимерного компонента в жидкой фазе в случае
неполного совмещения системы и, как правило, большую концентрацию
растворителя в полимерной фазе в этом же случае;
• зависимость фазового равновесия от молекулярной массы и молекулярно-массового распределения;
• способность образовывать студни.
Полимер, как и низкомолекулярное соединение, не может быть растворен в любой жидкости, а самопроизвольное растворение полимера происходит только тогда, когда полимер и жидкость имеют высокое сродство.
В общем виде процесс растворения полимера можно представить последовательным протеканием следующих стадий:
1. Фаза чистого растворителя и фаза чистого полимера. Система гетерогенная.
2. Растворитель, проникая в аморфную область полимера, образует раствор
в полимере - одна фаза, а другая фаза - чистый растворитель. Система
гетерогенная.
3. Фаза чистого растворителя и фаза насыщенного раствора растворителя в
полимере. Система гетерогенная.
4. Образуется фаза раствора полимера в жидкости и фаза раствора жидкости в полимере. Система гетерогенная.
5. Раствор полимера в растворителе. Система гомогенная.
Вторая стадия имеет место только при растворении полимера в низкомолекулярной жидкости (НМЖ) и ее называют набуханием.
Для растворов полимеров характерны высокая вязкость, медленная
диффузия и неспособность проникать через полупроницаемую перегородку.
Растворимость полимеров зависит от следующих факторов:
• природы полимера и растворителя;
• гибкости цепи полимера;
• молекулярной массы полимера;
• химического состава полимера;
• кристаллической структуры полимера;
• наличия поперечных химических связей;
• температуры растворения.
45
Растворение полимеров определяется строением полимера и низкомолекулярной жидкости, прежде всего полярностью. При близких значениях полярности полимера и растворителя может происходить набухание
и растворение. Если полярность полимера и низкомолекулярной жидкости
существенно различны, то растворения не происходит. Однако не всегда
процессы растворения можно объяснить с позиций полярный - неполярный
полимер и растворитель. Имеются случаи, когда сильно полярный полимер
не растворяется в очень полярной НМЖ, а способен растворяться в менее
полярных.
Протекание процесса растворения зависит от гибкости цепи, определяемой структурой полимера. Упрощая несколько механизм растворения,
можно предположить, что для жесткоцепных полимеров требуется одновременный отрыв большого числа звеньев, чтобы переместить макромолекулу в растворитель. Поэтому их растворение возможно в сильно взаимодействующих с ними растворителях или при повышенной температуре.
Гибкоцепная макромолекула легко диффундирует в растворитель, т.к.
диффузия будет заключаться в перемещении кинетически независимых
сегментов и непрерывном изменении конформации макромолекул.
У всех полимеров растворимость падает с увеличением молекулярной массы. Разветвленность полимерных молекул неодинаково сказывается на их растворимости. Небольшие количества коротких разветвлений,
как правило, улучшают растворимость, тогда как длинные разветвления снижают.
Значительное влияние на растворимость оказывает надмолекулярная
структура полимеров. Аморфные полимеры быстрее и лучше растворяются, чем аморфно-кристаллические, т.к. кристаллические участки полимеров
характеризуются плотной упаковкой макромолекул за счет большего числа
межмолекулярных связей, разрушить которые при комнатной температуре
затруднительно. Растворяются такие полимеры при повышенных температурах в жидкостях, энергия взаимодействия которых с полимером достаточно высока.
Растворение полимеров определяется их химическим составом, наличием функциональных групп, частичное замещение которых приводит к
изменению межмолекулярного взаимодействия как в полимере, так и в
системе полимер - растворитель, изменяя, таким образом, способность полимера растворяться. На растворимость полимера влияет не только количество функциональных групп, но и равномерность их распределения: чем
она выше, тем лучше растворяется полимер.
Наличие в полимере даже небольшого количества поперечных связей
(1-2 связи на полимерную цепь) всегда приводит к снижению растворимости, а при их достаточном числе - и к полной ее потере.
46
Относительно влияния температуры на процессы растворения следует отметить, что для большинства полимеров повышение температуры
способствует растворению. Однако есть случаи, когда наблюдается обратный эффект. Это имеет место тогда, когда растворение осуществляется за
счет сольватации активных групп полимера молекулами растворителя.
В силу многообразия типов межмолекулярного взаимодействия в
конденсированных системах влияние перечисленных факторов на процесс
растворения является достаточно сложным, что затрудняет прогнозирование растворения полимеров. Для качественных оценок известны методы,
основанные на учете энергетических факторов при растворении полимеров, например, величин поверхностного натяжения жидкости или величин
дипольных моментов. Джи для этих целей предложил использовать величину плотности мольной энергии когезии (ПЭК), равную
Δ
− RT
ПЭК = H исп.
Дж/м3,
V
(5.1)
где ΔHисп - мольная теплота испарения жидкости;
R - универсальная газовая постоянная;
T - абсолютная температура;
V - мольный объем жидкости.
На практике используют не саму ПЭК, а квадратный корень из нее
δ=
Δ
Hисп. − RT
V
(Дж/м3)1/2,
(5.2)
где δ - параметр растворимости Гильдебранта.
Если δ жидкости равна или мало отличается от δ полимера, то такой
полимер будет растворяться в ней. Правда, в таком подходе тоже есть исключения, т.к. энергия взаимодействия складывается из суммы различных
по своему происхождению взаимодействий (ориентационное и деформационное взаимодействие диполей, дисперсионное, водородные связи). В
этой связи правильнее представлять параметр растворимости через три составляющие: дисперсионную - δd, полярную - δp и обусловленную водородными связями - δh
δ = δd + δ p + δ h .
(5.3)
С этой точки зрения способными к взаимодействию следует считать компоненты, имеющие δ равными примерно величинам δd.
Для многих полимеров и НМЖ параметры растворимости известны
и приведены в приложении табл. 1 и 2.
47
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Качественное определение растворимости полимеров
РЕАКТИВЫ:
Растворители, относящиеся к различным классам органических соединений (спирты, кетоны и т.д.)
ПРИБОРЫ:
Пробирки, микробюретка или градуированная пипетка емкостью 2 - 5 мл,
термостат.
Ход определения: в чистые высушенные пробирки помещают по 10
мг сухого измельченного полимера и из микробюретки или градуированной пипетки наливают по 2 мл растворителя. Пробирки закрывают пробками и выдерживают 1-2 ч при комнатной температуре, периодически
встряхивая их содержимое. Полимер считают растворимым в данном растворителе, если образуется однородный раствор.
Отмечают также состояние полимера, не растворяющегося в данном
растворителе (происходит набухание или нет). Если полимер не растворяется при комнатной температуре, смесь осторожно нагревают до температуры кипения растворителя. В случае растворения полимера при нагревании раствор охлаждают, чтобы выяснить, остается полимер в растворе или
осаждается. Если полимер набухает, но не растворяется, необходимо испытать родственные растворители и их смеси.
Набухание без растворения даже в растворителях, наиболее сильно
действующих на данный тип полимера, обычно свидетельствует о наличии
трехмерной структуры. Полимеры трехмерного строения могут содержать
экстрагируемые фракции с относительно небольшой молекулярной массой.
СРАВНЕНИЕ РАСТВОРЯЮЩЕЙ СПОСОБНОСТИ
РАСТВОРИТЕЛЕЙ
Иногда необходимо не только знать, в каких жидкостях растворяется данный полимер, но и оценить их растворяющую способность, которую
по отношению к данному полимеру можно измерить величиной разбавления, т.е. количеством осадителя (нерастворителя), добавленного к раствору
до появления неисчезающей мутности раствора. Величина разбавления
может быть выражена либо объемом осадителя (в мл), либо отношением
числа молей осадителя к числу молей растворителя.
48
Для определения можно использовать растворы, приготовленные для
качественного определения растворимости, или специально приготовить
аналогичные растворы, как описано выше.
Ход определения: в пробирку с раствором из микробюретки медленно по каплям при перемешивании добавляют осадитель. Добавление осадителя (титрование) прекращают при появлении в растворе неисчезающей
мути. Количество осадителя (в мл или моль/моль растворителя), израсходованное на титрование, служит мерой растворимости полимера. По ее
значениям сравнивают растворители. Большее количество осадителя требуется добавить в тот раствор полимера, который содержит лучший растворитель.
Описанный метод отличается простотой, доступностью и расходом
малых количеств вещества и растворителей. Точность определения вполне
достаточна для лабораторного контроля растворимости полимеров и сополимеров и характеристики растворителей по их растворяющей способности.
Наиболее часто применяемые растворители и осадители приведены в
приложении табл. 3.
6. НАБУХАНИЕ ПОЛИМЕРОВ
ТЕОРИЯ
Прежде чем раствориться в низкомолекулярной жидкости, полимер
набухает. Набухать полимер может и в результате поглощения паров жидкости, увеличиваясь в объеме.
Различают ограниченное и неограниченное набухание. Неограниченное набухание - это процесс, самопроизвольно переходящий в растворение. В этом случае правильнее применять термин “набухание” только к
стадии, предшествующей растворению, где еще сохраняется общая форма
образца. Неограниченное набухание характерно для линейных аморфных
полимеров, сольватированные молекулы которых легко переходят в раствор и равномерно распределяются по всему объему растворителя, образуя
гомогенную систему.
Ограниченное набухание может быть у линейных и сшитых трехмерных полимеров. В первом случае ограниченное набухание связано с
тем, что энергия взаимодействия макромолекул друг с другом превышает
энергию взаимодействия макромолекул с низкомолекулярной жидкостью,
в результате чего макромолекулы не могут оторваться от фазы полимера и
перейти в фазу растворителя. Для трехмерных полимеров неограниченное
набухание в принципе невозможно, т.к. макромолекулы связаны друг с
другом химическими связями, устойчивыми в любых растворителях. Сши49
тые полимеры набухают только ограниченно, причем величина набухания
зависит от частоты сетки: чем чаще межмолекулярные связи, тем меньше
величина набухания.
Количественными характеристиками набухания являются: степень
набухания (α), которая определяется отношением массы или объема поглощенной полимером жидкости к массе или объему исходного полимера,
и скорость набухания.
Расчет степени набухания ведут по формулам:
αm =
m − mo
mo
100 % ,
(6.1)
где m - масса набухшего образца; mo - масса исходного образца. Или
αv =
V − Vo
Vo
100 % ,
(6.2)
где V - объем набухшего образца; Vo - объем исходного образца.
Скорость набухания (dα/dτ) обычно максимальна в начале процесса.
При ограниченном набухании по мере приближения системы к состоянию
равновесия dα/dτ → 0, α → αmax (αmax - равновесная степень набухания).
Скорость набухания зависит от скорости диффузии растворителя в полимер. В парах она значительно меньше, чем в жидкости.
Кинетика набухания может быть описана простым дифференциальным уравнением:
dα
= k (α max − α τ),
dτ
(6.3)
где k - константа набухания, ατ - текущее значение степени набухания.
Степень набухания зависит от строения полимера и низкомолекулярной
жидкости, времени набухания и выражается кривой с насыщением, пример
которой приведен на рис. 6.1. Из рисунка следует, что по истечению некоторого времени достигается определенная степень набухания, характерная
для данного полимера в данных условиях. Отсюда следует, что сравнение
набухания у различных полимеров можно проводить только по равновесным величинам.
При набухании полярных полимеров в полярных растворителях наблюдается уменьшение объема всей системы при увеличении объема полимера. Такое явление называется контракцией и вызвано повышением
плотности упаковки молекул растворителя, взаимодействующих с полярными группами полимера, по сравнению с чистой жидкостью. Обозначим
объем набухшего тела через Vн.т., а объемы полимера и жидкости Vс.т. и Vж.
50
α
τ
Рис. 6.1. Зависимость степени набухания от времени
Соответственно величину контракции ΔV можно представить соотношением:
ΔV = (V с.т. + V ж.) − Vн.т. .
(6.4)
Контракция прямо пропорциональна интегральной теплоте набухания.
При набухании полимера в условиях, ограничивающих увеличение
его объема, внутри образца развивается высокое давление, которое называется давлением набухания. Оно зависит от энергии взаимодействия полимера с растворителем, концентрации полимера в набухшей системе и условий проведения набухания. Давление набухания может быть определено
по уравнению:
k
(6.5)
Pp = Po c ,
где Pp - давление, развиваемое растворителем внутри полимера; Po - константа, определяемая химическим строением полимера, растворителя и
температурой процесса; C - содержание сухого полимера в набухшем образце; k - константа.
Набухание полимера приводит не только к увеличению объема и
размеров, искажению формы образца, но и к резкому снижению его прочности, причем в первый момент набухания, задолго до достижения максимальной степени поглощения низкомолекулярной жидкости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы: определить степень набухания полимера в раствори-
теле.
Порядок работы:
1. Изучение кинетики набухания образцов.
51
2. Построение кинетических кривых набухания и расчет константы скорости набухания.
Приборы и материалы: бюкс - 3 шт. (50 мл); аналитические весы;
секундомер; пипетка - 10 мл; резиновая груша; фильтровальная бумага.
Ход работы: образец резины (∼ 1 г) взвесить в бюксе известной массы с точностью до 0,0002 г и поместить в другой сухой бюкс. Проба заливается растворителем (по заданию преподавателя) в количестве 10 мл, одновременно включается секундомер. По истечении 5 мин образец вынимают из растворителя, снимают излишки последнего фильтровальной бумагой и взвешивают в бюксе известной массы.
Масса образца рассчитывается по выражению:
m(τ) = mi - mb ,
где mi - масса бюкса с образцом, mb - масса свободного бюкса.
После взвешивания образец вновь помещают в бюкс с растворителем, выдерживают следующие 5 мин. Повторяют операцию определения
массы набухшего образца как и в первом случае.
В дальнейшем время набухания устанавливают равным 10, 10, 10, 10,
15, 15, 20, 20 мин и далее до момента, когда различия в массах набухшего
образца в трех последних измерениях не превышает 0,003 г.
Аналогичные измерения проводят со вторым образцом в другом растворителе. Результаты измерения вносят в таблицу.
Таблица 5.1
Форма записи результатов
Время набу- Масса набухα(τ)
αmax - α(τ)
lg[αmax - α(τ)]
шего
образца
хания τ, мин
m(τ), г
Обработка результатов: для количественной характеристики набухания рассчитывают степень набухания для каждого фиксированного значения времени:
m(τ) - m0
α(τ) = ⎯⎯⎯⎯,
(6.6)
m0
где m0 - масса исходного образца, г.
Затем рассчитывают αmax - α(τ) и lg[αmax - α(τ)]. Полученные данные
вносят в таблицу. Константа скорости набухания k связана с текущими
значениями соотношением
lg[αmax - α(τ)] = lgαmax - 0,434kτ,
(6.7)
52
где αmax - максимальная степень набухания образца, которую находят по
зависимости
α(τ) = f (τ).
Строят на одном графике зависимости lg[αmax - α(τ)] от времени τ (в
с) для двух растворителей. По тангенсу угла наклона полученной прямой
определяют константу скорости набухания в исследованном растворителе.
Задание: сопоставить кинетические кривые набухания образцов резины в двух растворителях и объяснить наблюдаемые различия.
7. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ
ПОЛИМЕРОВ ВИСКОЗИМЕТРИЧЕСКИМ МЕТОДОМ
ТЕОРИЯ
В основе определения молекулярной массы полимеров методом
вискозиметрии лежит уравнение Эйнштейна-Симха
η=ηo (1+ υϕ) ,
(7 .1)
связывающее вязкость суспензии η с вязкостью чистой жидкости ηо и
объемной долей суспензированного вещества ϕ. При этом коэффициент
пропорциональности υ зависит от формы твердой частицы, возрастая от
2.5 для сферы до 25 для вытянутых элипсоидов. Кроме того, при использовании уравнения (7.1) следует иметь в виду, что оно выведено для суспензий, содержащих столь мало твердых частиц в единице объема, что наличие соседних частиц практически не сказывается на характере нарушения потока жидкости, вызванном рассматриваемой частицей. Именно
искажение потока жидкости в результате обтекания ею твердой частицы
приводит к росту макроскопической вязкости суспензии в сравнении с вязкостью чистой жидкости.
Поскольку размер макромолекул многократно превышает размер
молекул обычных жидкостей, поведение раствора полимера при его течении, например, через капилляр можно представить как течение своеобразной суспензии и использовать уравнение (7.1) для установления корреляции между вязкостями раствора и чистого растворителя.
Из уравнения (7.1) следует соотношение
⎛η
⎞
⎜ −1 ⎟ = η = υϕ ,
уд.
⎜η
⎟
⎝ 0
⎠
53
(7.2)
в соответствии с которым удельная вязкость ηуд пропорциональна объемной доле макромолекул в растворе, при условии, разумеется, что, как было отмечено выше, их количество в единице объема исчезающе мало.
Если макромолекулу в растворе представить в виде сферы с гидродинамическим объемом Vh, то при концентрации раствора по полимеру
C (г/см3), молекулярной массе полимера М и числе Авогадро N А объемная
доля полимера в растворе ϕ будет равна отношению
NA C
Vh ,
M
ϕ=
(7.3)
а удельная вязкость - отношению
NA C
Vh .
M
ηуд. = υ
(7.4)
Величина, равная ηуд/C и называемая приведенной вязкостью, в
идеале не должна зависеть от концентрации полимера в растворе. Причем
это положение тем более справедливо, чем меньше C. Поэтому практически следует пользоваться не величиной ηуд/C, определенной при некоторой конечной концентрации полимера в растворе, а величиной, получаемой путем экстраполяции зависимости ηуд/C = f(С) на С → 0. Эта величина, называемая характеристической вязкостью - [η], представляется, следовательно, выражением
[η]=lim
ηуд.
C
=υ N A V h .
M
Для макромолекулы, аппроксимируемой
сферой с радиусом Re, можно записать
Vh =
(7.5)
гидродинамической
4
3
π Re .
3
В соответствии с современными представлениями
между Re и радиусом инерции макромолекулы Rg имеет вид
R e = ζR g ,
(7.6)
взаимосвязь
(7.7)
а сам радиус инерции равен
R g =αβ M 6M o .
54
(7.8)
Здесь β - эффективная длина сегмента макромолекулы, не зависящая от ее размера и природы растворителя, α - коэффициент набухания
клубка, наоборот, сильно зависящий от природы растворителя, а Mo - молекулярная масса единичного фрагмента цепи (чаще всего мономерного звена).
Объединяя уравнения (4.5-4.8) и полагая, что υ = 2.5, будем иметь
3
[η] = 2.5 4 π N A ξ3 a 3 β3 M 2 3 2 =
3
M (6M o)
3 3
3
1
1
N
Aξ β a
= 0.227
2 = K M 2.
M
M 3o 2
(7.9)
Из этого уравнения следует, что характеристическая вязкость раствора полимера зависит как от его молекулярной массы, так и от размера клубка
макромолекулы, характеризуемого произведением параметров α и β, т.е.
от природы растворителя.
Опыт работы с растворами полимеров показал, что уравнение (7.9)
является частным случаем более общего уравнения
[η]= K M α
,
( 7.10)
называемого уравнением Марка-Куна-Хаувинка.
Так как параметры K и α не поддаются расчету, их находят экспериментально, определяя характеристическую вязкость в данном растворителе нескольких фракций полимера с различной молекулярной массой
Mi и выражая полученные результаты в виде функции
lg[η]=lg K +α lg Mi
,
(7.11)
угол наклона которой даст значение α, а отрезок, отсекаемый на оси ординат, lgK.
Значения констант K и α для ряда полимеров приведены в табл. 4
приложения.
Вязкость раствора пропорциональна полной концентрации всех молекул. Поэтому применительно к полидисперсному полимеру можно записать
55
α
lim ηуд. = lim ∑ ηуд. = K ∑ Ci M i ,
c→0
(7.12)
c→0
имея в виду, что Ci и Mi - концентрация и молекулярная масса i-фракции.
Разделив и умножив правую часть уравнения (4.12) на общую концентрацию полимера в растворе C, получим
lim ηуд. = KC ∑
c→0
Ci α
α
α
M i = KC ∑ f i M i ≡ KC M η .
C
(7.13)
где fi - весовая доля фракции с молекулярной массой Mi, а Mη - средняя
вязкостная молекулярная масса. Из этого уравнения следует, что
M η = [∑ f i Miα ]
1
α
,
(7.14)
т.е. только в случае α=1 Mη = Mw (Mw - среднемасссовая молекулярная масса). При α≠1 Mn < Mη < Mw (Mn - среднечисленная молекулярная масса).
Поскольку определение молекулярной массы полимера методом
вискозиметрии всегда предполагает проведение калибровочных опытов с
использованием образцов, молекулярная масса которых известна, при построении корреляции между M и η можно воспользоваться не только величиной [η], но и значением удельной вязкости, измеренным при некоторой стандартной концентрации. Например, для растворов поликапроамида
в концентрированной серной кислоте при 25 оС справедливо соотношение
M = 11300 ηуд. ,
(7.15)
если концентрация полимера в растворе равна 1 г полимера в 100 мл кислоты.
АППАРАТУРА
При вискозиметрическом определении молекулярной массы полимера используются капиллярные вискозиметры Оствальда (рис. 4.1,а) и
Убеллоде (4.1,б), принципиальное различие между которыми заключается
в том, что в вискозиметре Убеллоде уровень жидкости в левом колене не
влияет на время ее истечения из капилляра, позволяя тем самым переходить от более концентрированного к менее концентрированному раствору
путем разбавления первого расчетным количеством растворителя непосредственно в вискозиметре.
При работе же с вискозиметром Оствальда растворы требуемой
концентрации готовятся в отдельных колбочках.
Вне зависимости от типа используемого вискозиметра суть эксперимента сводится к определению времени истечения через капилляр объема жидкости, заключенной между метками 5 и 6.
56
Взаимосвязь вязкости с временем ее истечения, длиной капилляра l,
его радиусом R, расстоянием между метками 5 и 6 h, объемом жидкости в
шарике V и ее плотностью ρ дается уравнением
πhg R 4 ρt
ρV
η=
−m
,
8lV
8πlt
(7.16)
где g - ускорение силы тяжести, а m - константа вискозиметра, близкая к
единице.
Второй член в правой части этого уравнения отражает так называемую кинетическую поправку, учитывающую тот факт, что при истечении
жидкости в капилляре часть приложенной силы тратится не на преодоление сил трения между молекулами жидкости, а на придание ей некоторой
кинетической энергии.
Для того чтобы оценить, как параметры вискозиметра влияют на соотношение первого и второго членов в правой части уравнения (7.16),
найдем отношение z второго к первому, принимая во внимание, что в идеальном случае
t=η
z=
8lV
;
πρhg R 4
mg
⎛ η⎞
64 ⎜ ⎟
⎝ρ⎠
2
57
h R4
l
2
(7.17)
.
(7.18)
а
б
2
3
2
8
1
1
8
5
7
6
7
10
5
6
9
4
10
4
Рис. 7.1. Капиллярные вискозиметры: а - Оствальда; б - Убеллоде;
1, 2 и 3 - трубки; 4- резервуар; 5 и 6 - метки; 7 - измерительный шарик; 8 и 9 - шарики; 10 - капилляр
Из полученного уравнения видно, что кинетическая поправка будет оказывать тем меньшее влияние на результат расчета, чем тоньше и длиннее
капилляр и чем более сплюснутым является шарик вискозиметра (меньше
h). Например, при R=0,1 см, l=10 см, h=1 см и V=1 см3 кинетическая поправка (в % от величины) первого члена в уравнении (7.16) при различных
временах истечения раствора
t, c 20 40 60 80 100 200
z
26 6,5 2,9 1,6 1,0 0,26
Таким образом, с достаточным основанием можно считать, что при t >
80÷100 с кинетическая поправка мала и ей можно пренебречь. В этом случае уравнение (7.16) упрощается
πhg R 4 ρ
η=
t = Kρt ,
8lV
(7.19)
устанавливая простую связь между постоянной вискозиметра К, плотностью жидкости, ее вязкостью и временем истечения.
Как следует из уравнений (7.1-7.2), при определении молекулярной
массы полимеров методом вискозиметрии важно знать не абсолютное
значение вязкостей раствора и растворителя, а их отношения. Поэтому
58
η
ηотн. =
=
ρt
ηo ρo t o
,
(7.20)
где величины с индексом "о" относятся к растворителю, а без индекса - к
раствору. В случае разбавленных растворов ρ = ρo и, следовательно,
ηотн. =
t
to
ηуд. =
,
t
to
(7.21)
− 1.
(7.22)
Таким образом, эксперимент по определению молекулярной массы
полимера методом вискозиметрии сводится к измерению времени истечения в капиллярном вискозиметре чистого растворителя и нескольких растворов полимера, различающихся концентрацией последнего.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление растворов полимера
При вискозиметрических измерениях используются растворы полимеров с концентрацией 2.10-3 ÷ 1.10-2 г на 1 мл растворителя (0,2 ÷ 1 г на
100 мл).
Работа с вискозиметром Оствальда
В пять предварительно взвешенных конических колбочек или
бюксов берутся на аналитических весах с точностью ±2.10-4 г навески полимера порядка 0,1; 0,2; 0,3; 0,4; 0,5 г, и в каждую колбочку (бюкс) добавляется из мензурки 50 мл растворителя. После этого сосуд закрывается пробкой и вновь взвешивается. По разности весов сосуда до и после
приливания растворителя определяется точное количество последнего и
рассчитывается истинная концентрация раствора по формуле
Ci =
g i ρo
100,
−
m 2 m1
(7.23)
где gi - навеска полимера, г; m1 - масса бюкса с навеской полимера, г; m2 масса бюкса с навеской полимера и растворителя, г; ρо - плотность растворителя при температуре измерения вязкости, г/см3.
Закрытый пробкой сосуд оставляется на несколько часов для достижения полного растворения полимера в жидкости. Для ускорения процесса можно использовать перемешивание раствора магнитной мешалкой
и нагревание.
Перед использованием раствора в вискозиметрическом эксперименте делается контрольное взвешивание сосуда, чтобы учесть изменение
концентрации раствора за счет испарения растворителя.
59
Работа с вискозиметром Убеллоде
В этом случае готовится один раствор, содержащий примерно 5.10-3
г полимера в 1 мл растворителя. Методика подготовки такого раствора совершенно аналогична описанной выше.
Подготовка вискозиметра (см. рис. 4.1)
Тщательно вымытый и высушенный вискозиметр закрепляется строго вертикально в водяном термостате, обеспечивающем поддержание
температуры с точностью не более 0,05 оС. При этом важно, чтобы под
водой был не только весь капилляр и шарики над ним, но и часть отводов 2
над шариками. На отвод 2 в вискозиметре Оствальда и на отводы 2 и 3 в
вискозиметре Убеллоде надеваются резиновые трубочки.
Через отвод 1 в шарик 4 заливается 15 мл растворителя и производится его термостатирование в течение 15-20 мин. После этого с помощью водоструйного насоса растворитель засасывают в отвод 2 вискозиметра Оствальда до уровня, превышающего метку 5, и дают ему свободно истекать через капилляр, замечая секундомером время прохождения
его между метками 5 и 6. Операцию проводят 3-5 раз и рассчитывают
среднее время истечения растворителя - tср. Если найденная величина tср с
точностью до 0,2 с соответствует паспортному значению, вискозиметр
пригоден к работе.
При использовании вискозиметра Убеллоде поступают следующим
образом. После заполнения шарика 4 растворителем и термостатирования
пережимают резиновую трубку на отводе 3 и с помощью водоструйного
насоса поднимают растворитель до половины шарика 8. Одновременным
прекращением всасывания жидкости в отвод 2 и открытием зажима на резиновой трубке, надетой на отвод 3, дают возможность жидкости свободно истекать из капилляра. При этом необходимо добиться того, чтобы к
моменту подхода мениска жидкости к метке 5 шарик 9 был заполнен воздухом. В этом случае в отводе 2 образуется так называемый "висячий уровень", и сопротивление истечению жидкости через капилляр в принципе
не зависит от уровня жидкости в шарике 4.
Проведя 3-5 замеров, определяют среднее время истечения растворителя и сопоставляют его с паспортным значением, как и в случае
вискозиметра Оствальда.
Измерение времени истечения растворов
Вискозиметр Оствальда
После определения времени истечения растворителя вискозиметр
вынимают из термостата и осторожно выливают из него растворитель через отвод 1 в банку для сливов. С помощью резиновой груши выдавливают остатки растворителя из капилляра в отвод 1 и выливают его в банку.
60
Очищенный таким образом вискозиметр помещают в термостат и заливают
в шарик 4 через фильтр Шотта № 2 15 мл раствора с наименьшей концентрацией по полимеру. Делают 4-5 подъемов раствора в отвод 2 до уровня,
на который поднимали растворитель, и дают ему свободно истекать, не
фиксируя время истечения.
После этого вынимают вискозиметр из термостата и выливают раствор через отвод 1 в банку для сливов точно так, как это делалось с растворителем.
Вискозиметр вновь помещают в термостат, контролируя вертикальность его установки, и заливают в него через фильтр Шотта 15 мл того же
раствора. После термостатирования в течение 15-20 мин проводят 4-5 замеров времени истечения раствора, добиваясь того, чтобы расхождение
между параллельными измерениями не превышало 0,2-0,5 с.
Вискозиметр вынимают из термостата, тщательно освобождают его
от раствора, помещают в термостат и заливают через фильтр Шотта 15
мл раствора более высокой, чем предыдущий, концентрации. Как и ранее
выполняют холостые прогоны через капилляр, чтобы полностью смыть
остатки предыдущего раствора и выливают раствор из вискозиметра. Освобожденный от раствора вискозиметр устанавливается строго вертикально в термостат и вновь заполняется 15 мл исследуемого раствора.
После термостатирования в течение 15-20 мин проводят рабочие замеры
его времени истечения.
Аналогичным образом поступают с остальными приготовленными
растворами полимера.
Вискозиметр Убеллоде
После измерения времени истечения растворителя вискозиметр вынимают из термостата, выливают растворитель, ополаскивают вискозиметр легколетучей и смешиваемой с растворителем жидкостью и сушат
его, просасывая воздух с помощью водоструйного насоса. После того как
вискозиметр высохнет, его помещают в термостат, контролируя вертикальность положения, и заполняют шарик 4 15 мл предварительно профильтрованного через фильтр Шотта раствора полимера, используя калибровочную пипетку. Раствор в вискозиметре термостатируют 15-20 мин
и определяют время его истечения как указано выше.
Осторожно вводят в шарик 4 из калиброванной пипетки 5 мл растворителя и при зажатой резиновой трубке на отводе 3 продувают с помощью резиновой груши воздух через отвод 2, чтобы перемешать раствор
в шарике 4. Проводят два холостых прогона раствора через капилляр
для его полной гомогенизации, а затем выполняют 3-5 рабочих замеров
времени истечения раствора. Описанную операцию разбавления проводят
61
еще три раза, вводя по 10 мл растворителя и получают значения времени
истечения пяти растворов, концентрации которых равны:
Ci = C o
Vo ,
Vo − ∑ Vi
(7.24)
где Co - концентрация исходного раствора, г/мл, Vo - объем этого раствора, а ∑Vi - общий объем дополнительно введенного растворителя.
Подготовка вискозиметра к новым измерениям
После завершения опытов вискозиметр следует тщательно очистить
от раствора полимера, промыть легко летучей жидкостью и высушить.
Очистка вискозиметра от раствора полимера заключается в 5-6-кратной
промывке его 20 мл растворителя путем проведения операций, аналогичных описанным в разделе при замене в вискозиметре Оствальда одного
раствора другим.
ОБРАБОТКА РЕЗУЛЬТАТОВ
Результаты замеров времени истечения растворителя и растворов
различных концентраций записываются в виде таблицы
Концентрация раствора, Сi,
г/100мл
Время
истечения
t i, с
Среднее
значение ti,
ηотн. = tсредн.i/t0
с
ηуд.= ηотн.-1
ηпр.=
ηуд./Сi,
100мл/г
По результатам расчетов строится зависимость ηпр от Ci и обсчитывается методом наименьших квадратов с целью получения значения
характеристической вязкости [η] и его доверительных интервалов. По
таблице 4 приложения выбирают значения постоянных K и α и, решая
уравнение
[
η] ⎞ α
⎛
M=⎜
⎟ ,
⎝K⎠
1
(7.25)
находят значение M.
Программа обработки экспериментальных данных на ЭВМ приведена в приложении.
62
8. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ
ПОЛИМЕРОВ ХИМИЧЕСКИМИ МЕТОДАМИ
ТЕОРИЯ
Химические методы оценки молекулярной массы полимеров
основаны на определении в нем концентрации концевых звеньев
макромолекул и предполагают выполнение двух условий:
концевые звенья должны иметь специфические группы, отсутствующие во внутренних звеньях макромолекул и поддающиеся точному определению каким-либо химическим или физико-химическим методом анализа;
между концентрацией специфических концевых звеньев макромолекул и среднечисленной массой полимера должна быть
очевидная и однозначная взаимосвязь.
Поясним эти положения некоторыми примерами. В результате исследований, выполненных учеными разных стран, установлено, что макромолекула природного полимера - целлюлозы
имеет линейное строение и в основной своей массе удовлетворяет
идеализированной структуре
H
HO
OH
OH H
H
H
O
CH 2O H
H
H
O
O
H
OH H
H
O
H
CH 2O H
H
OH
OH
OH H
H
H
O
H
CH 2O H
H
O
CH 2O H
O OH
H
OH H
H
H
OH
n
В соответствии с этой структурой одно (левое) концевое звено имеет
четыре группы -OH вместо трех, характерных для внутренних
звеньев, а другое содержит альдегидную группу в скрытой (полуацетальной) форме. Очевидно, что в данном случае между среднечисленной молекулярной массой
полимера M n и концентрацией
концевых звеньев любого вида C, выраженной в молях на 1 г полимера, выполняется простое соотношение
Mn
= 1/C,
(8.1)
и, следовательно, для вычисления M n достаточно точно определить
концентрацию звеньев хотя бы одного вида. Экспериментально
63
проще определить количество звеньев, содержащих скрытую альдегидную группу. Один из вариантов такого анализа будет описан
ниже.
При синтезе поликапроамида (ПКА) гидролитической полимеризацией капролактама имеют место реакции
NH−CO + H2O
H2N(CH2)5COOH
(CH2)5
2H2N(CH2)5COOH
H2N(CH2)5CONH(CH2)5COOH
H2N(CH2)5COOH + NH−CO
H2N(CH2)5CONH(CH2)5COOH
(CH2)5
и т.д., приводящие в конечном итоге к образованию полимера, макромолекулы которого отвечают структуре
H2N(CH2)5CO[NH(CH2)5CO]n-2NH(CH2)5COOH
I
Последняя структура предполагает наличие в макромолекуле одной основной (−NH2) и одной кислой (−COOH) групп, поддающихся
определению методом кислотно-основного титрования. Очевидно,
что в этом случае, как и в случае с целлюлозой, справедливо соотношение (4.1), т.е.
Mn
= 1/[−NH2] = 1/[ −COOH]
(8.2)
Введение при синтезе ПКА регуляторов молекулярной массы
(для этой цели используются, как правило, моно- и дикарбоновые
кислоты) сопровождается протеканием дополнительных реакций
RCONH(CH2)5CO∼ + H2O (а)
RCOOH + H2N(CH2)5CO∼
HOOCR’COOH + H2N(CH2)5CO∼
+ H2O
HOOCR’CONH(CH2)5CO∼ +
∼NHCOR’COOH + H2N(CH2)5CO∼
+ H2O
∼NHCOR’CONH(CH2)5CO∼ +
и образованием не одного, а двух
64
H2N(CH2)5CO[NH(CH2)5CO]n-2NH(CH2)5COOH
11
RCONH(CH2)5CO[NH(CH2)5CO]n-2NH(CH2)5COOH
111
в случае монокарбоновой и трех
V
H2N(CH2)5CO[NH(CH2)5CO]n-2NH(CH2)5COOH
V
HOOCR’CONH(CH2)5CO[NH(CH2)5CO]n-2NH(CH2)5COOH
HOOC(CH2)5NHCOR’CONH(CH2)5[NH(CH2)5CO]n-2NH(CH2)5COOH
V1
в случае дикарбоновой кислоты типов макромолекул.
Поскольку в присутствии монокарбоновой кислоты каждая
макромолекула ПКА заведомо имеет карбоксильную группу, соотношение M n=1/[−COOH] остается справедливым. Соотношение
же M n= 1/[−NH2] в данном случае не выполняется, и знания концентрации аминогрупп для расчета M n оказывается недостаточно.
Однако, если можно независимым методом определить концентрацию групп RCO− или, предполагая реакцию (а) практически
необратимой,
принять
ее
равной
начальной
концентрации регулятора [RCOOH]o, величину M n правомерно будет
рассчитать по уравнению
Mn =
1/{[−NH2]+[RCOOH]o}.
(8.3)
Макромолекулы ПКА, полученного в присутствии дикарбоновой кислоты, содержат различные количества амино- и
карбоксильных групп, поэтому к такому полимеру неприменимо
уравнение (4.1) в любой форме. Вместе с тем макромолекулы остаются линейными, то есть содержат только две концевые группы,
что позволяет применить для расчета M n соотношение вида
M n = 2/{[−NH2] + [−COOH]}
(8.4)
Более того, если допустить, что дикарбоновая кислота реагирует всегда обеими группами, будут справедливы соотношения
Mn =
2/{[−COOH] − [HOOCR’COOH]o},
65
(8.5)
Mn =
2/{[−NH2] + [HOOCR’COOH]o}.
(8.6)
Таким образом, определение концентрации в полимере концевых звеньев разного типа позволяет не только рассчитать величину его среднечисленной молекулярной массы, но в ряде случаев
сделать заключение и относительно особенностей протекания реакции синтеза полимера.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Определение в целлюлозе концевых альдегидных групп
Концевое звено целлюлозы, содержащее альдегидную группу
в скрытой форме, в щелочной среде трансформируется из циклической в линейную молекулу. При этом освобождается альдегидная
группа, которая может быть окислена до карбоксильной группы по
реакции
−CHO + J2 + 3NaOH → −COOH + 2NaJ + 2H2O
Избыток же йода оттитровывается далее тиосульфатом в кислой
среде согласно реакции
J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
Поскольку на окисление одного моля альдегидных групп расходуется моль J2, а на восстановление последнего два моля тиосульфата, концентрацию альдегидных групп в навеске целлюлозы
(моль/г) следует вычислять из соотношения
[ −CHO] =
( a − b) N
2g(1 − w )1000
,
(8.7)
где a, b - объемы раствора тиосульфата с нормальностью N, пошедшие на титрование раствора J2 в "холостом" и "рабочем" опытах, мл; g - навеска целлюлозы, г; w - доля влаги в целлюлозе, взятой
на анализ.
Следовательно, среднечисленная молекулярная масса целлюлозы в исследуемом образце будет равна
Mn=
2 g (1 − w)1000
.
( a − b) N
66
(8.8)
Приборы: две конические колбы с притертой пробкой емк. 100 - 150
мл; термостат.
Реактивы: бура, ч., 0,05 н. раствор с pH = 9,2; йод, ч.д.а., 0,03 н.
раствор; тиосульфат натрия, ч.д.а., 0,013 н. раствор.
ХОД ОПРЕДЕЛЕНИЯ
В коническую колбу емк. 100 - 150 мл с притертой пробкой
помещают 10 мл 0,05 н. раствора буры. Колбу выдерживают 15 мин
в термостате при 25 ± 0,2 оC и добавляют в нее 20 мл 0,03 н. раствора йода, предварительно выдержанного в том же термостате. Содержимое колбы перемешивают, затем быстро вносят в нее 0,1 г исследуемой целлюлозы (точность взвешивания ± 0,0002 г), после
чего колбу закрывают притертой пробкой и помещают в термостат
при 25 ± 0,2 оC, время от времени перемешивая содержимое. Через 6
ч в колбу добавляют 15 мл 0,1 н. раствора HCl и избыток йода оттитровывают 0,013 н. раствором тиосульфата натрия, приливая в
конце титрования 2-3 мл 0,5 % раствора крахмала. Параллельно в
тех же условиях проводят "холостой" опыт с теми же количествами растворов йода и буры.
В практике технического анализа целлюлозы результаты описанного выше эксперимента принято выражать не в молях альдегидных групп в 1 г полимера, а так называемым йодным числом
(И.Ч.), т.е. количеством мл 0,1 н. раствора йода, израсходованного
на окисление альдегидных групп в 1 г целлюлозы. Поскольку в одном литре такого раствора содержится 0,05 молей J2, концентрация
альдегидных групп целлюлозы будет равна
И.Ч. 0,05
[−CHO] = ⎯⎯⎯⎯⎯,
1000
а
M n = 20000/И.Ч.
(8.9)
(8.10)
Из сопоставления выражений (8.9) и (8.7) следует, что
И.Ч. =
( a − b) N 10
g (1 − w) .
(8.11)
Долю влаги в целлюлозе определяют сушкой ее до постоянной массы в сушильном шкафу при 100-105 оС:
67
w=
g1 − g2
,
g1 − g
(8.12)
где g1 - масса бюкса с целлюлозой до высушивания, г; g2 - масса
бюкса с целлюлозой после высушивания, г; g - масса высушенного
бюкса г.
Определение в поликапроамиде концевых аминогрупп
Определение основано на прямом титровании этих групп
раствором кислоты, например хлорной:
−NH2 + HClO4 → −NH3+ClO4−
Точка эквивалентности устанавливается потенциометрически, кондуктометрически либо визуально по переходу окраски
индикатора.
Расчет концентрации аминогрупп в полимере проводится
по уравнению
[ − NH 2] =
( a − b) N k
g(1− w )1000
,
(8.13)
в котором а, b - объемы раствора кислоты нормальности Nk, пошедшие на титрование раствора полимера и аналогичного количества
растворителя соответственно, мл; g - навеска полимера, г; w - доля
влаги в полимере.
Потенциометрическое определение аминогрупп в ПКА
Приборы: рН-метр или иономер в комплекте со стеклянным и
хлорсеребряным электродами; бюретка на 10 или 20 мл с
ценой деления 0,1 мл; бюксы на 50 мл (количество
должно соответствовать числу рабочих и холостых опытов).
Реактивы: 85 % раствор фенола в этаноле или 15 % раствор
LiCl в циклогексаноле; HClO4 (или HCl), ч.д.а., 0,02 н.
раствор в этаноле.
ХОД ОПРЕДЕЛЕНИЯ
68
В предварительно взвешенный бюкс помещается ∼0,5 г (точность взвешивания ±0,0002 г) ПКА в виде стружки или гранул и
наливается из мензурки 20 мл растворителя. Точное количество добавленного растворителя устанавливается взвешиванием бюкса,
содержащего полимер и растворитель. Бюкс закрывается притертой
крышкой и помещается на магнитную мешалку с нагревательным
столиком, отрегулированным на температуру 60-70 оС. После полного растворения навески полимера, на что требуется 1-2 ч, бюкс охлаждается до комнатной температуры и помещается на магнитную
мешалку установки потенциометрического титрования. Электроды
помещаются в раствор и производится первый замер потенциала.
После этого из бюретки в раствор дозируются порции титранта по
0,2 мл и фиксируется величина потенциала. Добавление каждой
последующей порции производится после достижения стабильного
показания прибора от добавления предыдущей. Титрование прекращают, когда после более или менее выраженного скачка потенциала вновь наступает состояние очень медленного его изменения
при добавлении каждой новой порции титранта.
ОБРАБОТКА РЕЗУЛЬТАТОВ
В процессе эксперимента запись результатов ведется в виде
таблицы:
Объем добавленного титранта, мл
Показания прибора, mV (pH)
По этим данным строится график зависимости показаний прибора
от объема добавленного титранта, на котором находится точка перегиба, соответствующая моменту нейтрализации всех основных
групп, находившихся в растворе. Объем титранта, добавленного к
этому моменту, равен величине "а" в формуле (5.13). Чтобы найти
объем "b", входящий в эту формулу, в отдельный бюкс помещается
точно такое же количество растворителя, как и при получении раствора полимера, и проводится осторожное (по каплям) титрование
его до значения показания прибора, соответствующего точке перегиба кривой титрования раствора.
Доля влаги в полимере находится путем сушки его на воздухе при 100-105 оС.
ВНИМАНИЕ! Для точного определения концентрации аминогрупп проводится титрование не менее трех навесок полимера. Прежде чем
приступить к титрованию второй навески, следует провести обработку результатов первого титрования и скорректировать, если это необходимо,
69
объем порций титранта, добавляемых на разных участках кривой титрования.
Определение аминогрупп в ПКА с индикатором
Приборы: конические колбы на 100 мл (количество должно соответствовать числу рабочих и холостых опытов); мензурка на
50 мл; бюретка на 10 или 20 мл с ценой деления 0,1 мл;
водяной термостат.
Реактивы: 85 % раствор фенола в этаноле; бензиловый спирт свежеперегнанный; HClO4, ч.д.а. (или HCl): 0,02 н. раствор в
этаноле; крезоловый красный, 0,1 % раствор в этаноле.
ХОД ОПРЕДЕЛЕНИЯ
В коническую колбу на 100 мл с пришлифованной пробкой
помещается ∼1,0 г (точность взвешивания ±0,0002 г) ПКА в виде
стружки или гранул и наливается из мензурки 50 мл растворителя.
Точное количество добавленного растворителя устанавливается
взвешиванием колбы, содержащей полимер и растворитель. Закрытая пробкой колба помещается в водяной термостат, отрегулированный на температуру ∼80 оC. После полного растворения навески
полимера, на что требуется около 1 ч, образовавшийся раствор
титруется 0,02 н. спиртовым раствором HClO4 в присутствии двух
капель крезолового красного до перехода окраски из красной в желтую. При этом следует иметь в виду, что если раствор ПКА в феноле
перед титрованием лучше охладить до комнатной температуры, то
раствор в бензиловом спирте следует титровать только горячим.
В холостом опыте проводится титрование аналогичных количеств холодного спиртового раствора фенола и горячего бензилового спирта.
Расчеты ведутся по уравнению (8.13).
Определение в ПКА концевых карбоксильных групп
Определение основано на прямом титровании этих групп раствором щелочи
−COOH + NaOH → −COONa + H2O
или на обратном титровании избытка щелочи кислотой.
Индикация точки эквивалентности, как и в случае определения аминогрупп, может быть любой: потенциометрия, кондуктометрия или визуальный контроль изменения окраски индикатора. Однако потому, что сила карбоновых кислот при переходе от водного к
70
неводным растворам существенно уменьшается, точность определения карбоксильных групп в ПКА заметно ниже точности определения аминогрупп.
При прямом титровании расчет ведется по формуле
[ −COOH ] =
( a − b) Nщ
g(1− w )1000
,
(8.14)
N
,
[ −COOH ] = g(1(c−−wd))1000
(8.15)
а при обратном по формуле
к
где a, b - объемы раствора NaOH нормальности Nщ, пошедшие на
титрование раствора и равного количества растворителя; c, d объемы раствора кислоты нормальности Nк, пошедшие на титрование одного и того же объема раствора NaOH, добавленного в растворитель и раствор полимера соответственно.
Определение карбоксильных групп в ПКА с индикатором
Приборы: конические колбы на 100 мл (количество должно соответствовать числу рабочих и холостых опытов); мензурка на
50 мл; бюретка на 10 или 20 мл с ценой деления 0,1 мл;
водяной термостат.
Реактивы: бензиловый спирт свежеперегнанный, NaOH, х.ч., 0,02
н. раствор в этаноле; HClO4, ч.д.а. (или HCl),
0,02 н.
раствор в этаноле; крезоловый красный, 0,1 % раствор в
этаноле.
ХОД ОПРЕДЕЛЕНИЯ
В предварительно взвешенную коническую колбу на 100
мл с пришлифованной пробкой помещается ∼1,0 г (точность взвешивания ±0,0002 г) ПКА в виде стружки или гранул и наливается из
мензурки 50 мл растворителя. Точное количество добавленного растворителя устанавливается взвешиванием колбы, содержащей полимер и растворитель. Закрытая пробкой колба помещается в водяной
термостат, отрегулированный на температуру ∼80 оC. Растворение
продолжается около 1 ч. Полученный раствор в горячем виде титруется спиртовым раствором щелочи в присутствии двух капель крезолового красного до перехода окраски из желтой в красную. Ана71
логичным образом титруется соответствующее количество горячего
растворителя.
Расчет производится по формуле (8.14).
Для проверки полученных результатов дополнительно проводится обратное титрование по следующей методике. В приготовленный описанным выше способом раствор полимера и соответствующее ему количество растворителя добавляется
0,02 н. раствор
NaOH в количестве на 1,5 - 2,0 мл превышающем объем, пошедший
на титрование раствора в предыдущем эксперименте. Полученные
растворы титруются 0,02 н. раствором кислоты в присутствии крезолового красного до перехода окраски из желтой в красную.
Расчет производится по формуле (8.15).
Расчет среднечисленной молекулярной массы M n поликапроамида по результатам определения в нем концентраций аминои карбоксильных групп ведется по формулам (8.2) или (8.4) в зависимости от способа получения полимера.
9. ФРАКЦИОНИРОВАНИЕ ПОЛИМЕРОВ
ТЕОРИЯ
Фракционирование - это процесс разделения полимера на
фракции, различающиеся по молекулярной массе и/или составу.
Рассмотрим процесс такого разделения, основанный на зависимости растворимости полимера в жидкости от его молекулярной
массы.
В рамках классической теории растворов полимеров ФлориХаггинса взаимосвязь между размером макромолекулы, выраженным через отношение мольного объема полимера к мольному объему растворителя, и условиями выделения данной фракции может
быть получена из анализа выражения
Δ
1
⎡
2⎤
μ1 = RT ⎢ln(1 − ϕ2 ) + (1 − ) ϕ2 + χ1 ϕ2 ⎥,
X
⎣
⎦
(9.1)
связывающего изменение химического потенциала растворителя
Δ μ1 при образовании раствора, содержащего ϕ 2 объемных долей
полимера, со средним размером макромолекул X и параметром
Флори-Хаггинса χ1 , характеризующим интенсивность взаимодействия полимера и жидкости.
72
Для того чтобы оценить условия расслоения, т.е. определить
положение экстремумов на зависимости Δ μ1 = f (ϕ2 ), необходимо
найти производную этой функции
δΔ μ1
δ ϕ2
и, приравняв ее нулю, решить соответствующее квадратное (относительно ϕ 2 ) уравнение:
⎤
⎡
δΔ μ1
1
1⎞
⎛
= RT ⎢−
+ ⎜ 1 − ⎟ + 2 χ1 ϕ2 ⎥,
X⎠
δ ϕ2
⎦
⎣ 1 − ϕ2 ⎝
−
1
1⎞
⎛
+ ⎜ 1 − ⎟ + 2 χ1 ϕ 2 = 0.
1 − ϕ2 ⎝ X ⎠
(9.2)
(9.3)
Решение последнего уравнения имеет вид
ϕ2 =
(2 χ1 X − X + 1) ±
(2χ1 X − X +1) − 8 χ1 X
2
4 χ1 X
, (9.4)
а его корни ϕ ′2 и ϕ ′′ 2 соответствуют объемным долям полимера
в двух сосуществующих фазах.
В критической точке, т.е. в момент начала расслоения, состав
обеих фаз одинаков ( ϕ ′2 = ϕ ′′ 2 ), что может быть только при условии равенства нулю подкоренного выражения
(2χ1 X − X +1) − 8 χ X = 0.
2
1
(9.5)
Решение этого уравнения, дающее величину критического значения χ1kp , выражается дробью
(1± X ) ,
2
χ
χ11kp
, kp . =
2X
(9.6)
подстановка которой в уравнение (9.4) позволяет получить выражение для ϕ 2kp :
73
ϕϕ2 ,kp. =
2 kp
Поскольку величина
1
.
1± X
= 1 1− X
ϕϕ
2 , kp
2 .kp
(
(9.7)
) смысла не имеет,
окончательно можно записать
1+ X )
(
=
,
2
χ1kp
ϕ
ϕ2 ,kp. =
2kp
2X
1
1+ X
.
(9.8)
(9.9)
Из последнего выражения видно, что растворимость полимера уменьшается пропорционально корню квадратному из его
молярной массы и, следовательно, эффективность фракционирования с ростом X должна снижаться. Это положение иллюстрирует рис. 6.1, из которого видно, что чем меньше X , тем больше отношение ϕ 2 kp Δ X , характеризующее "чувствительность"
ϕ 2 kp
к изменению X .
Из рисунка видно также, что, во-первых, по мере роста X расслоение становится возможным во все более лучшем по термодинамическому качеству растворителе, и, во-вторых, что, подобрав серию жидкостей с разным уровнем термодинамического сродства,
можно экстрагировать из полимера фракции с вполне определенной
величиной молекулярной массы.
Необходимо подчеркнуть, что фракционирование, основанное на расслоении раствора полимера на две фазы, - равновесный
процесс и, следовательно, в обеих фазах содержатся макромолекулы всех размеров, имевшихся в исходном растворе, хотя концентрации их, естественно, различны. Иными словами, получение при
фракционировании монодисперсной, т.е. содержащей макромолекулы только одного размера, фракции принципиально невозможно.
74
χ1kp
χ1,kp.
25
0,85
20
ϕ 2 kp ,
ϕ2,kp.
%
15
10
0.60
5
1
2
3
4
0
5
Lg X
Рис. 9.1. Зависимость
χ1kp и ϕ 2kp от
X
Установлено, что отношение объемной доли полимера с размером макромолекул X в осадке ϕ,2 X и растворе ϕ 2 X равно:
ϕ2 X
= eσ X ,
ϕ2 X
,
(9.10)
где σ - сложная функция от степени полидисперсности полимера,
температуры и величины χ1.
Воспользуемся этим соотношением для оценки доли f X молекул с размером X , остающихся в растворе, если объем осадка равен V’, а раствора V. Очевидно, что
fX =
V ϕ2X
=
'
V ϕ 2 X + V' ϕ 2 X
1
V ϕ2X
1+
V ϕ2X
'
,
=
1
1+
r eσ X
.
(9.11)
Из уравнения (9.11) следует, что чем меньше r, тем большая часть
молекул сорта X останется в растворе. При этом степень разделения
будет определяться параметром r (r = V’/V).
75
Рассмотрим в качестве примера, иллюстрирующего влияние
величины r на эффективность фракционирования, распределение
между раствором и осадком двух фракций макромолекул, величины
X которых различаются в 10 раз: X 2= 10 X 1. Допустим, что
,
ϕ ϕ = 2 , т.е. концентрация низкомолекулярной фракции в
X1
X1
осадке в 2 раза выше, чем в растворе. Тогда
ϕ2 X
= eσ10 X1 = 210 = 1024.
ϕ2 X
,
Таким образом, при выбранных условиях концентрация высокомолекулярной фракции в осадке в 1000 раз больше, чем в растворе.
и ϕ, ϕ
в
Подстановка полученных величин ϕ , ϕ
X1
X1
X2
X2
уравнение (9.11) при различных значениях r приводит к зависимостям f и f от r, показанным на рис. 9.2. Видно, что когда объем
X
X
раствора превышал объем осадка в 10 раз, в осадок ушло 99 %
высокомолекулярных и 16,5 % низкомолекулярных молекул; при
100-кратном превышении объема раствора над объемом осадка в
последний уходит лишь 91 % высокомолекулярной фракции, но зато 98 % более коротких молекул остается в растворе. При тысячекратном превышении объема раствора над объемом осадка в растворе остаются не только практически все короткие молекулы (99,8
%), но и половина длинных. Учитывая это обстоятельство, фракционирование обычно ведут из 1 - 2 % растворов полимера.
Кроме соотношения твердой и жидкой фаз, при фракционировании необходимо учитывать строение твердой и жидкой фазы.
Поскольку фракционирование основано на достижении
равновесного распределения молекул разного размера между двумя
фазами, очевидно, что процесс будет протекать быстро в том случае,
когда концентрированная по полимеру фаза является гелем, а не порошком.
Для получения возможно более узких фракций проводят повторное фракционирование. Однако более чем трехкратное фракционирование не эффективно.
В настоящее время известны следующие методы фракционирования:
дробное осаждение;
дробное растворение;
распределение между двумя несмешивающимися жидкостями;
термодиффузия;
1
2
76
осадительная хроматография.
Данная лабораторная работа рассчитана на использование
технически наиболее простого из них - метода дробного осаждения.
fx
i
1,0
fx
1
0,8
0,6
fx
0,4
2
0,2
0,0
-2,0
-1,0
Рис. 9.2. Зависимость
f
Xi
-3,0
Lg r
от r
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
АППАРАТУРА
Для осуществления фракционирования методом дробного
осаждения в простейшем варианте достаточно иметь коническую
колбу на 250 мл с пробкой, обратный холодильник, магнитную мешалку, водяную баню, колбу Бунзена с набором фильтров Шотта №
2 или № 3 и бюретку на 50 или 100 мл.
МЕТОДИКА ЭКСПЕРИМЕНТА
В коническую колбу на 250 мл помещается 1 г высушенного и очищенного от низкомолекулярных примесей полимера (точность взвешивания ±2.10-4 г) и заливается 50-100 мл (в зависимости
от задания преподавателя) растворителя. Для ускорения процесса
растворения полимера колба соединяется с обратным холодильником, помещается на водяную баню, в которой поддерживается тем77
пература ∼80 оС. После завершения процесса растворения содержимое колбы охлаждается до комнатной температуры, и она помещается на магнитную мешалку.
При непрерывном перемешивании раствора в него из бюретки медленно добавляется осадитель до появления слабой, но неисчезающей при перемешивании мути. Колба снимается с магнитной мешалки и помещается в водяную баню, где в результате нагревания начавший выделяться из раствора полимер вновь растворяется.
После этого колбу вынимают из бани и, закрыв пробкой, оставляют охлаждаться на воздухе. По мере охлаждения раствора из
него начинает выпадать первая наиболее высокомолекулярная фракция. Раствору дают отстояться (от нескольких часов до нескольких
суток) и отделяют выпавший полимер, пропуская раствор через
взвешенный фильтр Шотта в сухую и чистую колбу Бунзена, защищенную от случайного попадания воды из водоструйного насоса
промежуточной склянкой.
Собранную маточную жидкость переносят обратно в коническую колбу, а осадок промывают осадителем и сушат при возможно более низкой температуре до постоянной массы. Зная массу
бюкса и массу бюкса с осадком, находят массу выделившейся фракции - g1.
Колбу с маточным раствором помещают на магнитную мешалку и при перемешивании добавляют новую порцию осадителя
до появления устойчивой мути. Нагреванием колбы в водяной бане
осадок полимера растворяют, как при выделении первой фракции.
Повторяется описанная выше операция отделения осадка от
маточника, промывка и сушка его до постоянной массы. В результате находят массу второй фракции - g2.
Аналогичным способом получают последующие фракции полимера.
Если в ходе фракционирования будут высажены из раствора
все фракции полимера, то очевидно, что сумма масс фракций
должна быть равна массе исходного образца.
У полученных фракций полимера определяется удельная вязкость раствора при некоторой постоянной концентрации полимера
Ci, выбранной в качестве стандартной.
ОБРАБОТКА РЕЗУЛЬТАТОВ
Результаты фракционирования принято представлять в виде
интегральной и дифференциальной кривых молекулярно-массового
распределения (ММР).
78
Интегральной кривой ММР называется кривая, выражающая зависимость суммарной массовой доли фракции w от молекулярной массы или величины ей пропорциональной.
Дифференциальной кривой ММР называется кривая, выражающая зависимость массовой доли молекул данной молекулярной массы от величины молекулярной массы, т.е. dW/dM = f(M).
Для построения интегральной кривой ММР полученные
экспериментальные данные представляются в виде таблицы:
Таблица 9.1
Номер
Масса
Массовая Суммарная Приведенная
ηуд/C
фракции
фракции gi,
г
g
ωi = i ;
∑ gi
доля
фракции ωi
массовая
доля wi
i
wi = ∑ ωi;
1
массовая
доля Wi
n = i −1
1
W i = ωi + ∑ ωi
1
2
По этим данным интегральная кривая может быть получена
двумя способами:
1. Из точки на оси абсцисс, соответствующей данному значению ηуд, восстанавливается перпендикуляр длиной, соответствующей в масштабе оси ординат величине суммарной массовой доли, отвечающей указанному значению ηуд. Затем параллельно оси
абсцисс проводятся прямые через точки, отвечающие последовательно возрастающим значениям wi, и получается ступенчатая линия. Вертикальные ступени этой линии делятся пополам, и через
них проводится плавная кривая (рис.9.3).
2. Можно заметить, что значения ординат, соответствующих точкам пересечения интегральной кривой с вертикальными ступенями, подчиняются закону
n = i −1
1
W i = ωi + ∑ ωi .
1
2
Поэтому сразу рассчитываются и наносятся на график величины Wi.
Какую информацию можно получить из интегральной кривой?
Проверить правильность фракционирования.
Оценить значения Mw и Mη и по ним рассчитать степень
полидисперсности полимера, характеризуемого величиной
критерия Шульца
79
U=
Mw
− 1.
Mn
(9.12)
Для проверки правильности фракционирования необходимо
сделать следующее. Через значение удельной вязкости нефракционированного образца ηуд проводят прямую, параллельную
оси ординат, до пересечения с осью абсцисс и ординатой, соответствующей W=1 (рис. 9.4). Если площади S1 и S2 равны, то фракционирование и построение интегральной кривой проведены правильно.
Кроме того, при правильном фракционировании должно соблюдаться равенство
(9.13)
ηуд = ∑ ω i ηуд .
i
Если допустить, что в пределах одной фракции распределение по молекулярным массам достаточно узкое, то величины Mw и
Mn нефракционированного образца могут быть рассчитаны из экспериментальных данных по уравнениям
M w = ∑ ωi M i ,
Mn =
1
.
ωi
∑
Mi
(9.14)
(9.15)
Для этого поступают следующим образом. На ординате откладывают 10 равных отрезков, например, через 0,1, т.е. получают 10
"теоретических" фракций. Затем находят значения молекулярных
масс, отвечающих координатам, равным половине каждой "теоретической" фракции. Таким образом получают значение молекулярной
массы десяти фракций. Поскольку ωi = 0,1, уравнения для расчета
M w и M n принимают вид
M w = 0,1∑ M i ,
(9.16)
M n = 10 ( ∑ 1 M i ) .
(9.17)
При малом количестве всех или отдельных фракций определение Mi через характеристическую вязкость традиционным способом
затруднительно. В
данном случае целесообразно воспользоваться приемом, позволяющим рассчитать [η] по одному значению ηотн, полученному для раствора полимера с концентрацией
80
С ≤ 0,5 г/100 мл. Дело в том, что между величиной произведения
[η]С и относительной вязкостью ηотн при этой же С существует
взаимосвязь, определяемая цифрами, приведенными в табл. 9.1.
Например, экспериментально установлено, что при С =
0,500 г/100 мл
ηотн = 2,013.
Согласно таблице, ηотн = 2,010
соответствует величина произведения [η]С = 0,7779, а ηотн = 2,015 величина 0,7910. Используя линейную интерполяцию, находим, что
ηотн = 2,013 соответствует значению [η]С, равному
0,7779 −
0,7779 − 0,7310
3 = 0,7498.
5
Таким образом, получается, что
[ η] =
W
0,7498
= 1,45.
0,500
1,0
0,8
0,6
0,4
0,2
0,0
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
ηу д
Рис. 9.3. Интегральная кривая ММР
Дифференциальная кривая ММР строится путем графического дифференцирования интегральной. Для этого ось абсцисс под
интегральной кривой следует разбить на возможно большее число
равных отрезков и восстановить из них перпендикуляры до пересечения с интегральной кривой. Если теперь через каждую точку пересечения провести прямые, параллельные оси абсцисс, то интегральная кривая окажется разбитой на столько прямоугольных
81
треугольников, на сколько частей была поделена ось абсцисс. Причем чем меньше треугольник, тем ближе его гипотенуза к прямой и
тем точнее отношение катетов отражает величину производной в
точке, соответствующей половине гипотенузы, т.е.
dW
ΔW
=
.
d ηуд Δ ηуд
(9.18)
По полученным значениям dW/dηуд строится зависимость dW/dηуд
=f(ηуд)1/2, где (ηуд)1/2 - значение ηуд, соответствующее точке на половине гипотенузы каждого треугольника,
являющаяся дифференциальной кривой ММР.
1
W
S2
S1
ηуд
Рис. 9.4. Проверка правильности фракционирования
Чем больше полимер полидисперсен, тем шире дифференциальная кривая ММР и тем больше величина критерия Шульца. Для
монодисперсного полимера критерий Шульца равен единице.
Таблица 9.1
Зависимость произведения [η]С от величины ηотн
ηотн
Величина произведения
[η]C при значении третьего знака ηотн
82
ηотн
Величина произведения
[η]C при значении третьего знака ηотн
1
0
5
2
3
0
5
4
5
6
1.05
0.0491
0.0539
1.11
0.1058
0.1104
1.06
0.0587
0.065
1.12
0.1151
0.1197
1.07
0.0688
0.0730
1.13
1.1242
0.1283
1.08
0.0777
0.0825
1.14
0.1334
0.1379
1.09
0.0872
0.0818
1.15
0.1424
0.1469
1.10
0.0965
0.1012
1.16
0.1514
0.1559
1.17
0.1604
0.1648
1.52
0.4439
0.4476
1.18
0.1693
0.1737
1.58
0.4512
0.4549
1.19
0.1731
0.1825
1.54
0.4586
0.4623
1.20
0.1869
0.1913
1.53
0.4639
0.4696
1.21
0.1955
0.2000
1.56
0.4732
0.4768
1.22
0.2043
0.2086
1.57
0.4805
0.4841
1.23
0.2129
0.2172
1.58
0.4677
0.4913
1.24
0.2215
0.2258
1.59
0.4949
0.4984
1.25
0.2301
0.2343
1.60
0.5091
0.5056
1.26
0.2385
0.2428
1.61
0.6091
0.5127
1.27
0.2470
0.2511
1.62
0.5162
0.519
Продолжение табл. 9.1
1
2
3
4
83
5
6
1.28
1.29
1.30
1.31
1.32
1.33
1.34
1.35
1.36
1.37
1.38
1.39
1.40
1.41
1.42
1.43
1.44
1.45
1.46
1.47
1.48
1.49
1.50
1.51
1.87
1.88
1.89
1.90
1.91
1.92
1.93
1.94
1.95
0.2558
0.2636
0.2719
0.2802
0.2884
0.2965
0.3046
0.3127
0.320
0.3 87
0.3367
0.3446
0.3524
0.3603
0.3758
0.3758
0.3835
0.3912
0.3988
0.4064
0.4140
0.4215
0.4290
0.4364
0.6844
0.6908
0.6872
0.7085
0.7098
0.7161
0.7224
0.7287
0.7349
0.2595
0.2676
0.2760
0.2843
0.2925
0.3006
0.3087
0.3167
0.3247
0.3327
0.3406
0.3485
0.3564
0.3642
0.3797
0.3797
0.3874
0.3950
0.4026
0.4102
0.4178
0.4252
0.4327
0.4402
0.6876
0.6940
0.7003
0.7067
0.7130
0.7193
0.7255
0.7318
0.7380
1.63
1.64
1.65
1.66
1.67
1.68
1.69
1.70
1.71
1.72
1.73
1.74
1.75
1.76
1.77
1.78
1.79
1.80
1.81
1.82
1.83
1.84
1.85
1.86
2.21
2.22
2.23
2.24
2.25
2.26
2.27
2.28
2.29
0.5233
0.5303
0.5373
0.5443
0.5512
0.5582
0.5650
0.5719
0.5787
0.5855
0.5923
0.5990
0.6057
0.6125
0.6558
0.6558
0.6324
0.6390
0.6455
0.6521
0.6586
0.6651
0.6715
0.6780
0.8857
0.8954
0.9011
0.9068
0.9124
0.9181
0.9237
0.9293
0.9349
0.5268
0.5338
0.5408
0.5478
0.5547
0.5616
0.5685
0.5753
0.5821
0.5889
0.5957
0.6024
0.6091
0.6158
0.6291
0.6291
0.6357
0.6423
0.6486
0.6553
0.6618
0.6683
0.6748
0.6812
0.6926
0.8983
0.9040
0.9096
0.9153
0.9209
0.9265
0.9321
0.9376
Окончание табл. 9.1
1
2
3
4
84
5
6
1.96
1.97
1.98
1.99
2.00
2.01
2.02
2.03
2.04
2.05
2.06
2.07
2.08
2.09
2.10
2.11
2.12
2.13
2.14
2.15
2.16
2.17
2.18
2.19
2.20
0.7411
0.7473
0.7535
0.9596
0.7657
0.7779
0.7779
0.7840
0.7800
0.7960
0.8020
0.8080
0.8140
0.8199
0.8258
0.8376
0.8376
0.8435
0.8498
0.8552
0.8610
0.8668
0.8725
0.8783
0.8840
0.7442
0.7504
0.7565
0.7627
0.7638
0.7810
0.7810
0.7870
0.7930
0.7990
0.8050
0.8110
0.8170
0.8229
0.8288
0.8406
0.8406
0.8464
0.8522
0.8581
0.8639
0.8696
0.8754
0.8812
0.8869
2.30
2.31
2.32
2.38
2.34
2.30
2.36
2.37
2.38
2.39
2.40
2.41
2.42
2.43
2.44
2.45
2.46
2.47
2.48
2.49
2.50
85
0.9604
0.9460
0.9515
0.9570
0.9625
0.9735
0.9735
0.9789
0.9844
0.9398
0.9952
1.0009
1.0063
1.0116
1.0170
1.1276
1.0276
1.0329
1.0382
1.0435
1.0487
0.9432
0.9487
0.9543
0.9598
0.9653
0.9662
0.9762
0.9816
0.9871
0.9925
0.9979
1.0086
1.0089
1.0143
1.0196
1.0303
1.0303
1.0356
1.0408
1.0461
ПРИЛОЖЕНИЯ
Таблица 1
Параметры растворимости полимеров
σ,
ПОЛИМЕР
ПОЛИМЕР
3 1/2
Полиизобутилен
Полиэтилен
Полипропилен
Полистирол
Полиметилметакрилат
Поливинилацетат
Полиэтилентерефталат
Поливинилиденхлорид
7,85
7,7 - 7,9
8,2
8,56
9,08
9,4
10,7
12,2
σ,
(КАЛ/СМ3)1/2
(КАЛ/СМ )
Эпоксидная смола
Полиуретаны
Поливинилхлорид
Найлон 6,6
Полиакрилонитрил
Полихлоропрен
Диацетатцеллюлоза
Гидратцеллюлоза (целлофан)
10,9
11,9
9,50 - 9,58
13,6
15,4
8,6 - 9
10,9
15,65
Таблица 2
Параметры растворимости растворителей
РАСТВОРИТЕЛЬ
σ,
РАСТВОРИТЕЛЬ
(КАЛ/СМ3)1/2
н-Гексан
Гептан
н-Октан
Этиловый эфир
Циклогексан
Бутилацетат
Четыреххлористый углерод
н-Ксилол
Диэтилкетон
Толуол
Этилацетат
Бензол
Хлороформ
Тетрагидрофуран
Ацетон
7,3 - 7,4
7,5
7,55
7,6
8,2
8,5
8,5 - 8,6
8,8
8,8
8,9
9,04 - 9,1
9,15 - 9,18
9,3
9,32 - 9,55
9,71 - 10
Циклогексанон
Целлозольв
Диоксан
Уксусная кислота
Сероуглерод
Анилин
Циклогексанол
Бутиловый спирт
Ацетонитрил
Пропиловый спирт
Диметилформамид
Этиловый спирт
Метиловый спирт
Аммиак
Вода
86
σ,
(КАЛ/СМ3)1/2
9,9
9,9
9,95
10,1
10,05
10,3
11,4
11,4
11,7 -11,89
11,9
12,1
12,7
14,5
16,3
24,2
Таблица 3
Растворители и осадители различных полимеров
Полимер
1
Растворители
2
Полиэтилен
Тетралин, ксилол и толуол
при 80-135 оС
Полипропилен
Ксилол, о-дихлорбензол при
температуре выше 80 оС
Полистирол
Ароматические и хлорированные
углеводороды,
сложные эфиры, кетоны,
диоксан
Поливинилхлорид
Хлорированные углеводороды, циклогексанон, тетрагидрофуран
Полиакриловая
ки- Вода
слота
Полиметакриловая
“
“
кислота
Полимеры эфиров ак- Сложные эфиры, хлорирориловой и метак- ванные и ароматические угриловой кислот
леводороды, кетоны и диоксан
Полиакриламид
Вода
Полиметакриламид
Полиакрилонитрил
Поливинилацетат
Поливиниловый
спирт
Поливинилформаль
Осадители
3
Спирты, гликоли
“
“
Низшие спирты,
алифатические углеводороды
Спирты, этиленгликоль,
вода
Этиловый
спирт
Ацетон,
этиловый спирт
Алифатические
углеводороды,
низшие спирты, вода
Низшие спирты
“
“
Алифатические
углеводороды
Вода, алифатические углеводороды
“
“
Диметилформамид,
нитробензол, этиленкарбонат
Ацетон, метиловый и этиловый спирты, сложные
эфиры, ароматические и
хлорированные
углеводороды
Вода
Спирты, ацетон
Уксусная кислота, диоксан, Вода
60 % водный этиловый
спирт
Окончание табл. 3
87
1
2
3
Поливинилэтираль
Спирты, ацетон, спирто- Вода, алифаводные и спирто-бензоль- тические угленые смеси, диоксан, дихло- водороды
рэтан
Поливинилбутираль
Спирты, диоксан, дихлорэтан, спирто-водные и
спирто-бензольные смеси
“
“
Полиэфиры
Низшие спирты, кетоны,
ароматические
углеводороды, сложные эфиры
“
“
Полиэтилентерефталат
Фенолы, бензиловый спирт
и нитробензол (при нагревании), смесь фенола с тетрахлорэтаном (1:1), смесь
фенола с дихлорэтаном
(40:60), диметилформамид
Полиамиды
Фенолы, бензиловый спирт Вода, низшие
(при нагревании), смеси фе- спирты
нолов с водой, бензолом,
хлорированными
углеводородами,
диметилформамид
Феноло-формальдегидная смола
Ацетон, метиловый и эти- Петролейный
ловый спирты
эфир, вода
Ацетат целлюлозы
Сложные эфиры, кетоны
Этилцеллюлоза
Метилацетат,
зольная смесь
88
Лигроин, циклогексан, алифатические углеводороды
Спирты, вода
спирто-бен- Петролейный
эфир
Полимер
1
Полистирол
Таблица 4
Значение K и α для некоторых полимеров
Растворитель Темпе- К.104
М.10-3
α
ратуо
ра, С
2
3
20
25
4
1,23
2,7
5
0,72
0,66
Толуол
Метилэтилкетон
Циклогексанон
25
25
1,7
3,9
0,69
0,57
20
0,143
1,0
25
0,11
1,0
Ацетон
20
4,52
0,62
Бензол
30
25
14,7
0,468
0,52
0,77
Хлороформ
35
20
1,282
0,6
0,71
0,79
Полиакриламид
Вода
25
0,631
0,80
Полиакрилонитрил
Диметилформамид
20
3,07
0,76
25
3,92
0,75
20
3,21
0,75
25
3,0
0,5
25
5,95
0,63
20
0,99
0,75
25
1,90
0,66
25
1,02
0,75
Поливинилхлорид
Полиметилметакрилат
Бензол
Диметилсульфоксид
Поливиниловый Вода
спирт
Поливинилацетат
Ацетон
Диоксан
89
6
1,2-540
1,02000
3-1700
3-1700
30,0125
16,6138
706300
208000
105000
281000
8,51700
11,6195,0
45,0420,0
421390
-
Окончание табл. 4
1
Ацетат целлюлозы
2
Толуол
Хлороформ
Ацетон
3
25
20
25
4
1,08
1,58
0,19
5
0,53
0,74
1,03
6
68-680
11-130
25
1,49
0,82
-
Программа обработки на ЭВМ результатов определения
молекулярной массы полимеров вискозиметрическим
способом (Microsoft Excel, Visual Basic)
'Расчет молекулярной массы визкозиметрическим способом
'Программа для печати
'
Option Explicit
Dim MMSheet As Object
Dim OutputRange As Object
Dim N As Integer
Dim Y1(10) As Double
Dim Y2(10) As Double
Dim Kon As Double
Dim Alf As Double
Dim Iks(10) As Double
Dim Y(10) As Double
'
Sub MMKuzne()
Dim M As Integer
Dim Fam As String
Dim Kyrs As String
Dim Pol As String
Dim Ras As String
Dim Tem As String
Set MMSheet =
Application.Workbooks("MMass.xls").Worksheets("Молекулярная масса")
Set OutputRange = MMSheet.Range("ММНачало")
ClearRange OutputRange
Fam = InputBox("ФИО:", "Ввести данные")
90
Kyrs = InputBox("Курс/группа:", "Ввести данные")
Pol = InputBox("Полимер:", "Ввести данные")
Ras = InputBox("Растворитель:", "Ввести данные")
Tem = InputBox("Температура:", "Ввести данные")
Kon = Val(InputBox("K:", "Ввести данные"))
Alf = Val(InputBox("a:", "Ввести данные"))
OutputRange.Cells(1, 3).Formula = Fam
OutputRange.Cells(1, 9).Formula = Kyrs
OutputRange.Cells(4, 1).Formula = Pol
OutputRange.Cells(6, 1).Formula = Ras
OutputRange.Cells(8, 1).Formula = Tem
OutputRange.Cells(10, 1).Formula = Kon
OutputRange.Cells(12, 1).Formula = Alf
N = Val(InputBox("Число опытов:", "Ввести данные"))
OutputRange.Cells(4, 3).Value = 0
For M = 1 To N
Iks(M) = Val(InputBox("Концентрация, г/мл:", "Ввести данные"))
Y(M) = Val(InputBox("Относительная вязкость:", "Ввести данные"))
Next M
TotalitMM
MMSheet.OnEntry = "TotalitMM"
End Sub
'
'Расчет промежуточных и итоговых значений
'
Sub TotalitMM()
Dim Z As Double
Dim Z1 As Double
Dim X As Double
Dim SX As Double
Dim SY As Double
Dim SXY As Double
Dim SX2 As Double
Dim B1 As Double
Dim B0 As Double
Dim B2 As Double
Dim B3 As Double
Dim Yr As Double
Dim MM As Double
Dim MM1 As Double
91
Dim MM2 As Double
Dim DeltaW As Double
Dim DeltaT As Double
Dim DeltaD As Double
Dim theRow As Integer
SX = 0
SY = 0
SXY = 0
SX2 = 0
DeltaW = 0
For theRow = 1 To N
Z = Y(theRow)
Y1(theRow) = theFY1(Z)
Z1 = Y1(theRow)
X = Iks(theRow)
Y2(theRow) = theFY2(Z1, X)
OutputRange.Cells(theRow + 4, 3).Value = X
OutputRange.Cells(theRow + 4, 4).Value = Z
OutputRange.Cells(theRow + 4, 5).Value = Z1
OutputRange.Cells(theRow + 4, 6).Value = Y2(theRow)
SX = SX + X
SX2 = SX2 + X ^ 2
SY = SY + Y2(theRow)
SXY = SXY + X * Y2(theRow)
Next theRow
B2 = SX * SY - N * SXY
B3 = SX ^ 2 - N * SX2
B1 = B2 / B3
B0 = (SY - B1 * SX) / N
OutputRange.Cells(4, 7).Value = B0
For theRow = 1 To N
Yr = B0 + B1 * Iks(theRow)
DeltaW = DeltaW + (Yr - Y2(theRow)) ^ 2
With OutputRange
.Cells(theRow + 4, 2).Value = theRow
.Cells(theRow + 4, 7).Value = Yr
End With
Next theRow
MM = (B0 / Kon) ^ (1 / Alf)
DeltaT = N - SX * SX / SX2
DeltaD = (DeltaW / ((N - 2) * DeltaT)) ^ 0.5
MM1 = ((B0 + DeltaD) / Kon) ^ (1 / Alf) - MM
92
MM2 = MM - ((B0 - DeltaD) / Kon) ^ (1 / Alf)
With OutputRange
.Cells(3, 9).Value = B0
.Cells(6, 9).Value = MM
.Cells(4, 9).Value = DeltaD
.Cells(7, 9).Value = MM1
.Cells(8, 9).Value = MM2
End With
End Sub
'
'Очистка выходной таблицы
'
Sub ClearRange(theRange As Object)
Dim theRow As Integer
Dim St As Integer
For theRow = 4 To 12 Step 2
theRange.Cells(theRow, 1).ClearContents
Next theRow
theRange.Cells(3, 9).ClearContents
theRange.Cells(4, 9).ClearContents
theRange.Cells(6, 9).ClearContents
theRange.Cells(7, 9).ClearContents
For theRow = 4 To 13
For St = 2 To 7
theRange.Cells(theRow, St).ClearContents
Next St
Next theRow
End Sub
'
' Печать
'
Sub PrintReceipt()
MMSheet.OnEntry = " "
MMSheet.Range("ММоблпечати").PrintOut
End Sub
Function theFY1(Z)
theFY1 = Z - Z / Z
End Function
Function theFY2(Z1, X)
theFY2 = Z1 / X
End Function
93
Список использованных и рекомендуемых
к внимательному прочтению литературных
источников
1. Блиничева, И.Б., Мизеровский, Л.Н., Шарнина, Л.В. Физика и химия волокнообразующих полимеров: учеб. пособие / Под ред.
проф. Б.Н. Мельникова; Иван. гос. хим.-технол. ун-т. Иваново,
2005. С. 116-256, 292-315, 316-352
2. Тагер, А.А. Физикохимия полимеров. 3-е изд.- М.: Химия, 1978. 544 с.
3. Практикум по химии и физике полимеров: Учеб. Изд./ Аввакумова, Н.И., Бударина, Л.А., Дивгун, С.М. и др.; Под ред. Куренкова,В.Ф. – М.: Химия, 1990. – 304 с.
4. Тугов,, И.И., Костыркина, Г.И. Химия и физика полимеров.- М.:
Химия, 1989. - 430 с.
5. Зуев, Ю.С. Разрушение полимеров под действием агрессивных
сред. - М.: Химия, 1972. - 232 с.
6. Рафиков, С.Р., Павлова, С.А., Твердохлебова, И.И. Методы определения молекулярных весов и полидисперсности высокомолекулярных соединений. - М.: Изд-во АН СССР, 1963. - 335 с.
7. Цянь Жень - Юань Определение молекулярных весов полимеров /
Под ред. С.Р.Рафикова. - М.: Изд-во иностр. лит., 1962. - 234 с.
94
СОДЕРЖАНИЕ
Введение
3
Основные правила техники безопасности
5
Порядок прохождения студентами практикума
по дисциплине “Физико-химия полимеров”
6
1. Определение температуры плавления полимеров в
присутствии жидкостей
7
2. Кривые течения концентрированных растворов
полимеров
16
3. Деформационно-прочностные свойства полимеров
28
4. Определение модуля сдвига химической нити
41
5. Растворимость полимеров
45
6. Набухание полимеров
49
7. Определение молекулярной массы вискозиметрическим методом
53
8. Определение молекулярной массы химическими
методами
63
9. Фракционирование полимеров
72
Приложение
86
Список использованных и рекомендуемых к
внимательному прочтению литературных источников
94
95
Лабораторный практикум
по курсу “РАСТВОРЫ ПОЛИМЕРОВ”
Учебное пособие для студентов специальности 28.02.00 “Технология и оборудование производств химических волокон и
композиционных материалов на их основе”
Редактор О.А.Соловьева
Лицензия ЛР N 020459 от 10.04.97. Подписано в печать 15.05.98.
Формат 60х84 1/16. Бумага газетная. Печать плоская. Усл.печ.л. 3,72.
Уч.-изд. л. 4,13. Тираж 75 экз. Заказ
Ивановский государственный химико-технологический университетет. 153460, г. Иваново, пр. Ф.Энгельса, 7.
96
Кузнецов Александр Константинович
Захарова Ирина Михайловна
Лабораторный практикум
по курсу «Физико-химия полимеров»
Учебное пособие
для студентов специальности
240201 «Технология и оборудование производства
химических волокон и композиционных материалов на их основе»
Редактор В.Л. Родичева
Подписано в печать 3.04.2007. Формат 60 х 84 1/16. Бумага писчая.
Усл. печ. л. 5,58. Уч.- изд. л. 6,19. Тираж 75 экз. Заказ
ГОУВПО Ивановский государственный химико-технологический
университет
Отпечатано на полиграфическом оборудовании кафедры экономики
и финансов ГОУВПО «ИГХТУ»
153000, г. Иваново, пр. Ф. Энгельса, 7
96
Кузнецов, А.К., Захарова, И.М. Лабораторный практикум по курсу
«Физико-химия
полимеров»:
учебное
пособие
для
студентов
специальности 240201 «Технология и оборудование производства
химических волокон и композиционных материалов на их основе» / ГОУ
ВПО «Иван. гос. хим.-технол. ун-т. Иваново, 2007. 96 с. ISBN
Лабораторный практикум содержит 9 работ, касающихся фазовых и
физических состояний полимера, его деформационно-прочностных свойств,
взаимодействия полимеров и низкомолекулярных жидкостей, выполнение
которых позволит студентам определить важные для полимера физикомеханические, молекулярно-массовые и некоторые термодинамические
параметры.
Предназначен для студентов специальности 24.02.01, изучающих курс
«Физико-химия полимеров»
Рецензенты:
Доктор технических наук Л.В.Шарнина ( Ивановский государственный
химико-технологический университет);
Кандидат технических наук А.В.Баранов (Ивановская государственная
текстильная академия)
97