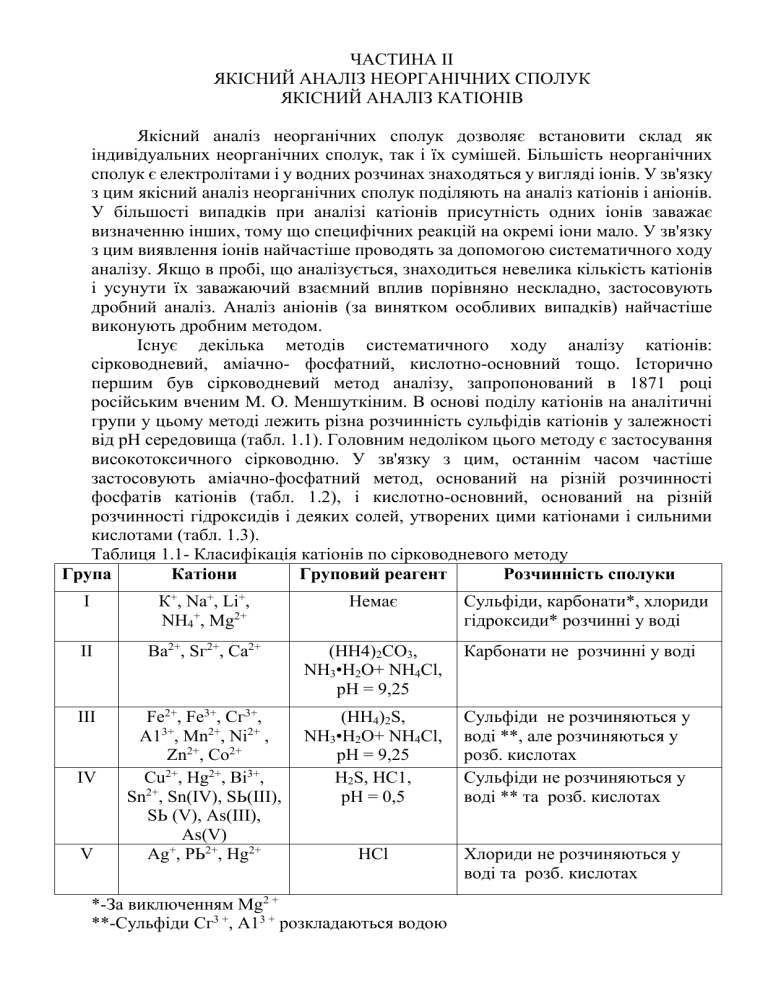
ЧАСТИНА ІІ ЯКІСНИЙ АНАЛІЗ НЕОРГАНІЧНИХ СПОЛУК ЯКІСНИЙ АНАЛІЗ КАТІОНІВ Якісний аналіз неорганічних сполук дозволяє встановити склад як індивідуальних неорганічних сполук, так і їх сумішей. Більшість неорганічних сполук є електролітами і у водних розчинах знаходяться у вигляді іонів. У зв'язку з цим якісний аналіз неорганічних сполук поділяють на аналіз катіонів і аніонів. У більшості випадків при аналізі катіонів присутність одних іонів заважає визначенню інших, тому що специфічних реакцій на окремі іони мало. У зв'язку з цим виявлення іонів найчастіше проводять за допомогою систематичного ходу аналізу. Якщо в пробі, що аналізується, знаходиться невелика кількість катіонів і усунути їх заважаючий взаємний вплив порівняно нескладно, застосовують дробний аналіз. Аналіз аніонів (за винятком особливих випадків) найчастіше виконують дробним методом. Існує декілька методів систематичного ходу аналізу катіонів: сірководневий, аміачно- фосфатний, кислотно-основний тощо. Історично першим був сірководневий метод аналізу, запропонований в 1871 році російським вченим М. О. Меншуткіним. В основі поділу катіонів на аналітичні групи у цьому методі лежить різна розчинність сульфідів катіонів у залежності від рН середовища (табл. 1.1). Головним недоліком цього методу є застосування високотоксичного сірководню. У зв'язку з цим, останнім часом частіше застосовують аміачно-фосфатний метод, оснований на різній розчинності фосфатів катіонів (табл. 1.2), і кислотно-основний, оснований на різній розчинності гідроксидів і деяких солей, утворених цими катіонами і сильними кислотами (табл. 1.3). Таблиця 1.1- Класифікація катіонів по сірководневого методу Група Катіони Груповий реагент Розчинність сполуки І К+, Na+, Lі+, NH4+, Мg2+ Немає II Ва2+, Sг2+, Са2+ (НН4)2СО3, NH3•Н2О+ NН4Cl, рН = 9,25 Карбонати не розчинні у воді III Fе2+, Fе3+, Сг3+, А13+, Мn2+, Ni2+ , Zn2+, Со2+ Сu2+, Нg2+, Ві3+, Sn2+, Sn(IV), SЬ(III), SЬ (V), Аs(III), Аs(V) + Аg , РЬ2+, Нg2+ (НН4)2S, NH3•Н2О+ NН4Cl, рН = 9,25 Н2S, НС1, рН = 0,5 Сульфіди не розчиняються у воді **, але розчиняються у розб. кислотах Сульфіди не розчиняються у воді ** та розб. кислотах HCl Хлориди не розчиняються у воді та розб. кислотах IV V *-За виключенням Mg2 + **-Сульфіди Сг3 +, А13 + розкладаються водою Сульфіди, карбонати*, хлориди гідроксиди* розчинні у воді Таблица 1.2 - Класификація катіонів по аміачно-фосфатному методу Група Катіони Груповий реагент Розчинність сполуки І Аg+, РЬ2+, Нg2+ ІІ Sn2+,Sn(IV), SЬ(III), SЬ (V) III Ва2+, Sг2+, Са2+, (NН4)2НРО4, конц. 2+ + 2+ 2+ Мg ,Li , Мn , Fе , NH3 • Н2О А13+, Сг3+, Fе3+ Фосфати не розчиняються у воді та у надлишку розчину аміаку IV Сu2+, Сd2+, Нg2+, Со2+, Nі2+, Zп2+ (NН4)2НРО4, конц. NH3 • Н2О V К+, Na+, NH+, немає Фосфаты не розчиняються у воді, але розчинні у надлишку розчину аміаку Хлориди, нітрати і фосфати розчиняються у воді HCl НNО3 Хлориди не розчиняються у воді Метастанатна та метастибатна кислоти не розчиняються у воді Таблица 1.3 - Класифікація катіонів по кислотно-основному методу Група Катіони Груповий реагент Розчинність сполуки І К+, Na+, Lі+,NH4+, Немає Хлориди, сульфати, гідроксиди розчиняються у воді Хлориди не розчиняються у воді Сульфати не розчиняються у воді Гідроксиди не розчиняються у воді, але розчинні у надлишку лугу II Аg+, РЬ2+, Нg2+2 HCl III Ва2+, Sг2+, Са2+ Н2SО4 + С2Н5ОН IV А13+, Zn2+, Сг3+, Sn(II), Sn(IV), Аs(III), Аs(V) Надлишок конц. NaОН + 3 %вий розчин Н2О2 V Fе2+, Fе3+, Мg2+, Мn2+, Ві3+, SЬ(III), SЬ(V) Надлишок конц.NН3*Н2О Гідроксиди не розчиняються у воді, надлишку лугу, розчині у аміаку. VI Cо2+, Ni2+, Cd2+, Сu2+, Нg2+ Надлишок конц.NН3*Н2О Гідроксиди не розчиняються у воді та надлишку лугу, але розчинні у надлишку р-ну NН3 КАТІОНИ І АНАЛИТИЧНОЇ ГРУПИ К+, Nа+, Li+, NН4+ В медичній практиці застосовують лікарські препарати, що містять катіони 1-ої аналітичної групи. Солі лужних металів у відношенні їх фармакологічної дії поділяються на лужно-діючі (карбонати) і нейтральні. Лужно-діючі солі дуже широко застосовуються в медицині. З усіх солей найбільше значення мають солі натрію, а особливо натрію гідрокарбонат. Ця сіль приймає велику участь в підтримці кислотно-лужної рівноваги в організмі і буферності крові і тканин. До нейтральних відносяться галогеніди і послаблюючі солі (натрію сульфат). Особливо, різноманітне застосування натрію і калію хлоридів, бромідів і йодидів. Натрію хлорид – основна складова частина сольових і колоїдносольових розчинів, які застосовуються як замінники плазми. Застосовують також гіпертонічні розчини натрію хлориду (3, 5, 10%-ові) та ізотонічний 0,9% розчин натрію хлориду. Калію хлорид є антиаритмічним засобом і джерелом йонів калію. Він також входить до складу замінників плазми. Натрію і калію броміди застосовують як седативні (заспокійливі) засоби. Йодиди застосовують при недоліку йоду в організмі і деяких запалювальних захворюваннях. Широко для медичних цілей використовується 9,5-10,5 % розчин аміаку - нашатирний спирт. Ознайомлення з якісними реакціями на катіони 1-ої аналітичної групи дозволить майбутнім спецілістам ідентифікувати лікарські препарати, що містять ці катіони, а також сприятиме подальшому вивченню профільних дисциплін: фармацевтичної хімії, фармакогнозії, технології ліків та ін. Реакції катіона калію 1. *Дія натрію гідротартрата NaНС4Н4О6 утворюється білий кристалычний осад калію гидротартрата К+ + NaНС4Н4О6→ КНС4Н4О6↓ + Na+ Аналогічно проводять реакцію з розчином тартратної кислоти К + + Н2С4Н4О6 → H + + КНС4Н4О6 ↓ 2. *Дія натрію гексанітрокобальтата (III) Na3[Со(NО2)6] утворюється жовтий кристал . осад дікалійнатрія гексанітрокобальтата (III): + 2К + Na+ + [Со(NO2)6 ] 3 - → К2Na[Со(NO2)6]↓ 3. Мікрокристалоскопічна реакція з дінатрійплюмбумом (II) гексанітрокупратом (II) Na2РЬ[Сu(NО2)6]утворюється чорний осад дікалійплюмбум (II) гексанітрокупрат (II): + 2К + РЬ2 + + [Сu(NО2)6] 4 - → К2РЬ[Сu(NO2)6]↓ 4. *Дія натрію тетрафенілбората Na[В(С6Н5) 4] утворюється білий кристалічний. осад калію тетрафенілборат: + К + [В(С6Н5)4] - → К[В(С6Н5)4]↓ 5. *Реакція фарбування полум'я Солі калію забарвлюють полум'я пальника у фіолетовий колір Реакції катіона натрію 1. * Дія калію гексагідроксостібата (V) К[SЬ(ОН)6 ]утворюється білий кристалічний осад : + Na + [SЬ(ОН)6] - = Na[S (ОН)6]↓ 2. Дія цинктріуранілуоктаацетата Zn(UO2)3( СН3СОО)8 утворюється жовтий кристал. осад натрійцінктріураніла нонаацетат - вода: Na++Zn2 ++ЗUO22 ++8СН3СОО9Н2О+СН3СООН=NаZn(UO2)3(СН3СОО)9•9Н2О↓+H+ Під мікроскопом кристали NаZn(UO2)3(СН3СОО)9•9Н2О мають вигляд правильних октаедрів або тетраедрів . 3. * Реакція фарбування полум'я Солі натрію забарвлюють полум'я пальника в жовтий колір Реакції катіона амонію 1. * Дія лугу на іони амонію реагують з NaОН і КОН при нагріванні з виділенням аміаку: NН4 + + OH - = NН4OH = H2O + NН3 ↑ Аміак визначають. по запаху або по фарбуванню вологою лакмусового паперу у синій колір. 2. * Дія магнію оксиду МgО.Магнію оксид реагує з водою: MgO + H2O = Мg(ОН)2 NН4 + + Мg(ОН)2 = NН4OH = H2O + NН3 ↑ МgO виділяє аміак з солей , як і луги , але не розкладає леткі основи. Потім додають розчин Na3[Со(NО2)6]. 2NН4 + + Na + + [Со(NO2)6]3 - = (NН4)2Na[Со(NO2)6]↓ утворюється жовтий осад. 3. * Дія реактиву Несслера К2[НgІ4] + КОН утворюється червоно -бурий або жовто -бурий осад йодиду основи Мілона : + NН4 + 2[НgІ4] 2 - + 4OH - = [Hg2NН2O]I↓ + 7I - + H2O 4. Реакція солей амонію при нагріванні. Солі летких кислот розкладаються повністю: NН4Cl = NН3↑ + НCl Солі нелетких кислот розкладаються частково: (NН4)2SO4 = NН3 ↑ + NН4НSO4 Реакції катіона літію 1. * Дія фториду амонію NH4F. Утворюється білий осад LiF : Li + + F- = LiF ↓ 2. Дія динатрію гідрофосфату Na2НРО4. Утворюється білий осад 3Li + + НРО42 - → H + + Li3РО4↓ 3. * Реакція фарбування полум'я Солі літію забарвлюють полум'я пальника в червоний колір Дія деяких реагентів на катіони І аналітичної групи Катіони Реагент К+ Na+ Lі+ КОН, NaOН К2СО3, Nа2СО3 білий кристал.осад Lі2СО3, розчиняється у кислотах NН4+ Виділяється NН3 (при нагріванні) Виділяється NН3 (при нагріванні) NaНС4Н4О6 Nа3[Со(NО2)6] Nа2РЬ[Сu(NО2 )6 ] білий кристал.осад КНС4Н4О6, розчиняється у кислотах і лугах Жовтий кристал.осад К2Nа[Со(NО 2)6], розчиняється у неорг.кислот ах Чорний кристал. осад К2РЬ[Сu(NО 2 )6 ] білий кристал.осад NН4НС4Н4О6, розчиняється у кислотах і лугах Жовтий кристал.осад Li3[Со(NО2)6], розчиняється неорг.кислотах Чорний кристал. осад (NН4)2РЬ[Сu(NО2 )6 ] К[SЬ(ОН)6] білий кристал.осад Na[SЬ(ОН)6] Zn(UO2)3(СН3 СОО)8 + СН3СООН Желтый кристалл. осадок NаZn(UO2)3( СН3СОО)9 9 Н2О К2[НgІ4] + КОН Жовтий кристал.осад (NН4)2Na[Со(NО 2)6], розчиняється неорг.кислотах білий Білий аморфний кристал.осад осад НSЬО3 (из конц растворов) Li[SЬ(ОН)6] Зелений кристал. осад LiZn(UO2)3(СН3 СОО)9 червонобурий або жовтобурий осад [Hg2NН2O]I Систематичний хід аналізу суміші катіонів 1-ої аналітичної групи При аналізі суміші катіонів 1-ої аналітичної групи іони амонію відкривають дробним методом в окремій пробі при нагріванні розчину з лугом, або дією реактиву Несслера. Якщо іони амонію знайдені, їх необхідно видалити з розчину, бо вони заважають виявленню іонів К + і Na+ . Для виявлення іонів Na+ до окремої порції розчину додають КОН або К2СО3 і нагрівають до повного видалення аміаку. Потім розчин нейтралізують оцтовою кислотою (при необхідності упарюють), охолоджують і виявляють іони натрію дією розчину K[Sb(OH)6] або Zn(UO2)3(CH3COO)8. Для виявлення іонів К + аміак видаляють з досліджуваного розчину дією NaOH або Na2СОз при нагріванні, розчин також нейтралізують СНзСООН (при необхідності упарюють), охолоджують і виявляють іони К + дією розчинів NaHC4H4O6, або Na3[Co(NO2)6]. Якщо іони амонію відсутні, іони К + і Na+ виявляють із окремої порції розчину, що аналізують, дією відповідних реагентів. Схема систематичного ходу аналізу катіонів I аналітичної групи К + , Nа + , NН4 + ( катіон Li + відсутній) 1. Визначення NН4 + в окремій порції розчину дією лугом при нагріванні NН4 + + OH - → H2O + NН3 ↑ 2. Видалення NН4 + в окремій порції розчину перед визначенням іонів К + дією NaOH або Na2CO3 NН4 + + OH - → H2O + NН3 ↑ 3. Нейтралізація розчину № 2 оцтовою кислотою 4. Визначення К + в розчині № 3 реагентами К+ + NaНС4Н4О6→ КНС4Н4О6↓ + Na+ 2К+ + Na+ + [Со(NO2)6 ] 3 - → К2Na[Со(NO2)6]↓ 2К + + РЬ2 + + [Сu(NО2)6] 4 - → К2РЬ[Сu(NO2)6]↓ 5. Видалення NН4 + в окремій порції розчину перед визначенням іонів Na + дією NaOH або K2CO3 NН4 + + OH - → H2O + NН3 ↑ 6. Нейтралізація розчину № 5 оцтовою кислотою 7. Визначення Na + в розчині № 6 реагентами Na++Zn2 ++ЗUO22 ++8СН3СОО-9Н2О+СН3СООН = NаZn(UO2)3(СН3СОО)9•9Н2О↓+H+






