_ 2ХИМИЯ
реклама

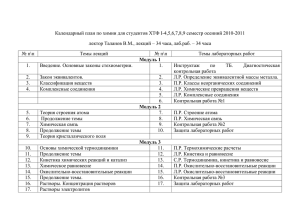
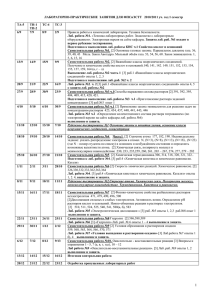
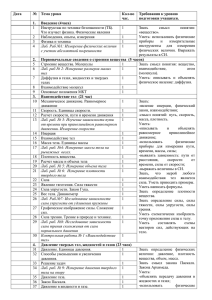
ЛАБОРАТОРНО-ПРАКТИЧЕСКИЕ ЗАНЯТИЯ ДЛЯ CТУДЕНТОВ РФ-13-9 В ОСЕННЕМ СЕМЕСТРЕ 2013/2014 уч. год № 1. 2. 3. 4. Мероприятия Защита лабораторных работ Выполнение и оформление лабораторных работ Рубежный контроль Экзамен Всего Количество Макс. балл за одно меропр 10 10 2 2 1 15 40 Итого Макс 20 10 30 40 100 РФ 4/09 11/09 18/09 25/09 2/10 9/10 16/10 23/10 30/10 6/11 13/11 20/11 27/11 4/12 11/12 18/12 Правила работы в химической лаборатории. Техника безопасности. Лаб. работа №1. «Техника лабораторных работ. Знакомство с лабораторным оборудованием». Электронная версия на сайте кафедры. Самостоятельная работа №1. [2] Основные газовые законы. Парциальное давление газа. 36, 39, 40, 43 Моль. Закон Авогадро. Мольный объём газа. 53, 54, 56, 60. Закон эквивалентов. 1, 5, 6, 15, 16 Самостоятельная работа №2. [2] Важнейшие классы неорганических соединений. Получение и химические свойства кислот и оснований.140, 141, 142. 149, 151, 152, 153. Лаб. работа №2 ч.1 [3]раб.1 «Важнейшие классы неорганических соединений» опыты 1, 2, 3. Защита лаб.раб.№1 Самостоятельная работа №3. [2] Важнейшие классы неорганических соединений. Получение и химические свойства оксидов и солей. 153, 154, 155, 157, 159(а), 162, 164(а,г-л). Лаб. работа №2. ч. 2 [3] раб.1 «Важнейшие классы неорганических соединений» опыты 4, 5 . Защита лаб.раб.№2 Самостоятельная работа №4. [2] Химический эквивалент 1, 3, 6, 11, 26. Лаб. работа №3. раб.2 «Химический эквивалент». Защита лаб.раб.№3 Самостоятельная работа №5 [2] Способы выражения состава растворов. 391 , 392, 395, 404, 409, 415, 420, 421. Лаб. работа №4 ч.1 раб.3 «Приготовление раствора заданной концентрации»оп.1. Самостоятельная работа №6 [2] Применение закона эквивалентов для решения задач по концентрации растворов. 423, 434, 437, 440, 441, 443, 446. Лаб. работа №4 ч.2 «Определение количественного состава раствора титрованием» (по электронной версии на сайте кафедры лаб.раб.№6). Защита лаб.раб.№4 Защита лабораторных работ. Промежуточная аттестация №1 ( по темамы- основные законы и понятия химии, основные классы неорганических соединений, концентрация Самостоятельная работа №7 [2]. Часть1 Строение атома 177, 182, 190. Индивидуальное задание: указать распределение электронов в атомах N, (N+3), (N+8), (N+13), (N+18) , (N+23) (где N – номер студента по списку) в основном и возбуждённом состоянии и определить возможные валентности атома. [2] Химическая связь, полярность молекул и межмолекулярное взаимодействие 230, 233, 235,259, 260, 261, 265 – 267, 274, 277, 279 – 282 Часть 2 [2] Химическая термодинамика 306, 314, 318, 320, 321, 322. Лаб. работа №5 [3] ч.1 .раб.4 «Скорость химических реакций. Скорость гетерогенной реакции» оп.1а, 1б. Самостоятельная работа №8 [2] Скорость химических реакций. Химическое равновесие. [2] 326,330,332,333,362,363,364 Лаб. работа №5. [3] ч.2, раб.4 «Химическая кинетика и химическое равновесие. Катализ» опыты 2, 4. Защита лаб.раб.№5 Самостоятельная работа №9 [2] Физико-химические свойства разбавленных растворов неэлектролитов 471, 479, 490, 496, 500 [2]Диссоциация сильных и слабых электролитов. Активность ионов. Определение рН растворов кислот и оснований. Ионно-обменные реакции в растворах электролитов. [2] 510, 511, 524, 525, 540, 541, 580(а, б), 583 Лаб. работа №6 [3] раб.5 «Электролитическая диссоциация » оп. 1(а,в,д), 2(г), 3 , раб.№8 оп. 1. Защита лаб.раб.№6 Самостоятельная работа №10 [2] Гидролиз 586,588,589. Условия образования и выпадения осадков 559, 560, 563, 564, 566, 570, 571. Лаб. работа №7 [3] раб.6 «Гидролиз» оп.1а, 2б, 4б. Лаб.работа №8 [3] раб.7 «Условия выпадения и растворения осадков» оп.4б. Защита лаб.раб.№7, 8. Самостоятельная работа №11. Окислительно - восстановительные реакции [3] Вопросы и упражнения 1 - 5, 7 (а, в, г, и,к), 10 – 12 Лаб работа №9 [3] раб.9 «Окислительно-восстановительные реакции» оп. 1, 2. Защита лаб.раб.№9 Самостоятельная работа №12 [2] Электрохимические процессы. Электродные потенциалы. Направление окислительновосстановительных процессов. 655, 657, 661, 665. Лаб.работа №10. [3] раб.12 «Электродные потенциалы» оп.1 Защита лаб.раб.№10. Защита лабораторных работ. Промежуточная аттестация №2 ( по темам - строение атома ,химическая связь. Полярность молекул, межмолекулярное взаимодействие. Термодинамика. Кинетика и равновесие.ОВР.ЭДС. Отработка пропущенных лабораторных работ Подведение итогов. 1. 2. Литература Н.Л.Глинка «Общая химия». М.Интеграл-пресс, 2006. Н.Л.Глинка. Задачи и упражнения по общей химии. М.Интеграл-пресс,2006. Лабораторный практикум по общей и неорганической химии, изд.РГУНиГ 3. им.Губкина, 2007. 4. Н.В.Коровин. Общая химия. М.Высшая школа, 2007. 1