д.д.Петров,Х. В. Бальян,д.Т.Трощенко
ОРГАНИЧЕСКАЯ
ХИМИЯ
Под редакцией
профессора М. д. Стадничука
Издание пятое,
переработанное и дополненное
Допущено Министерством образования рф
в качестве учебника для студентов
химико-технологических вузов
и факулыnетов
CaHIj:T- Петербург
«Иван Федоров»
2003
ББК
24.2
П 30
УДК
547
Книгу к изданию подготовил
доктор химических наук, профессор
Мирослав дмитриевич Стадничук
Петров А. А., Бальян Х. В., Трощенко А. Т.
П 30
Органическая химия: Учебник для вузов';/Под ред. СтадниМ. д.
ров», 2002.
'IYKa
-
5-е изд., перераб. и доп.
-
СПб .. «Иван Федо­
- 624 с., илл.
ISBN 5-81940-067-4
в учебнике систематически изложены основы современной органи­
ческой химии. В доступной форме даются сведевия о l<baHTOBO-ХИМИ'lе­
ской природе простых и кратных связей. Излагаются современные
взгляды на механизмы важнейших реакций. Большое внимание уделе­
но праКТИ'lескому использованию достижений органической химии.
Пятое издание существенно переработано и дополнено новыми дан­
ными, ПОЛУ'lенными в оргаНИ'lеской химии за последнее время.
Предназначается Д)lЯ студентов химико-технологических вузов и
факультетов.
УДК
ББК
ISBN 5-81940-067-4
©
©
Петров А. А. и др.
547
24.2
2002
Изд-во «Иван Федоров»,
2002
ПРЕДИСЛОВИЕ
Предлягяемое читателю учебное пособие предстявляет собой пятое (первое
посмертное) переряботанное издание У'lебникя А. А. Петровя, А. Т Трощенко и
Х. В. БЯJIЬЯНЯ по курсу «Оргяническяя химия».
В учебнике в доступной для студентов
2-3 курсов форме
изложены основы ор­
ганической химии на современном уровне развития теории, экспериментальной
техники и достижений промышленного производства органических веществ. Тео­
ретические вопросы излагаются на основе бутлеровских представлений о взаим­
ном вJlиянии ятомов В молекулях и современных квантово-химических воззрений.
В учебнике значительное место отведено описанию механизмов важнейших
реакций и П!JаКТИ'lескому использованию достижений оргянической химии. Отме­
'Iается ИСКЛЮ'lительная (юль в современной оргянической химии физических ме­
тодов исследовяния, однако излагается только сущность важнейших из них. Более
подробные сведения студент может найти в специальных монографиях, список
которых приведен в конце книги.
Объем и рясположение материала соответствуют действующей программе
110
ОРГЯНИ'lеской химии для химико-технологических специаЛl>ностей вузов. Основу
содержяния книги состявляет курс лекций по ОРГЯНИ'lеской химии, читяемый
в Санкт-Петербургском Технологическом институте.
При подготовке пятого издяния учебникя авторы стявили перед собой задачу
ЗН(lчительно обновить фаКТИ'lеский мятериал с учетом новых достижений в орга­
liИ'lеской химии и техtIOЛОГИИ.
Переработке подвергнуты все рязделы У'lебника. Знячительно рясширены све­
дения о современных методах лябораторного и промышленного О(Jгянического
синтезя, тяких, кяк твердофазный синтез, межфазный кятализ, синтез с примене­
ннем краун-эфиров, металлокомплексный кятализ. Значительно более глубоко
и полно освещяются экологические вопросы.
Особенностью книги является и большее приспособление ее к условиям и воз­
можностям самостоятельной (Jяботы студентов.
Кроме прогряммного мятерияля учебник содержит тякже материял для более
УГJlублеtlНОГО изучения (набран петитом), обычно включающий сямые последние
даНные в облясти рязвития теории и методов оргаНИ'lеского синтезя.
Проф. М. Д. Сmаднuчук
Пересчет некоторых используемых в книге
единиц физических величин в единцы СИ
lA=lO-IО м
ДЛИllа
Давление
lатм=I,ОllО5Па=О,lМПя
1 мм
рт. ст.=
Энергия, теплота
ЭлеКТРИ'lеский дипольный момент
. 1D
=
1,33 10~ Па
I ККЯЛ = 4,19 кДж
3,:34 . 10-:30 КЛ М
ВВЕДЕНИЕ
1. ПРЕдМЕТ И ПУТИ РАЗВИТИЯ ОРГАНИЧЕСКОЙ ХИМИИ
oРГilllf1"ескяя
11
химия
изучяет
соединения
углерод(!
-
углеводороды
их ПРОI1ЗIюдные, в состяв которых могут входить по"ти все '::Iлементы
периоди"еской системы.
Выде.тIение ОРI'яни"еСIЮЙ химии в сямостоятеJIЫ-IУЮ НilУЧНУЮ дисциплину
обус.тlОвле!lО болшlИМ 'IИCJIОМ и многообрязием соединений углероЩ!, IIЯЛИ­
"нем специфИ'Iеских свойств, отличяющих их от соединений других элемен­
тов, и, няконец, их исключительным зна'Iением в жизни человекя.
В нястuящее время известно более
4,5
МИ.ллионов ОРГЯ!lических соеди­
нений, в то время кяк соединений lIеоргянических всего около
700 тыс.
Преврящения оргинических соединений УПРilВЛЯЮТСЯ общими зяконя­
ми химии, n тnкже специфическими зякономерностями, хяряктерными толь­
ко /I,nfI оргmlИ'lескнх соединений. ОРГЯНН'Iеские соединения оБЫ'[f1O менее
стойки,
'leM неОРГ<ШИ'lеские, легче ОКИСJIЯЮТСЯ (горят), подавляющее
болыuинетво из них имеет ТОЛI,КО ковялеlпные связи между атомями.
Особое положение оргяни"еской химии в системе няук обусловлено
еще и тем, что оня изучяет более ВЫСОКООР'-ЯIНlЗОВilIIIIУIO мятерию, чем не­
ор,'nни"ес,<ая химия, и тесно связяня с биологией: OP'-,ШИ'IеСIше вещества
lIOЯПИ.IlИСЬ ни 3емле позже неОРГЯllи"еСIШХ, они являются носителями
ЖIl3JIедеятеЛЫJОСТИ.
Но не TOJII,KO этим определяется исключительное значение ОРI'аниче­
екой химии. ОРГИНИ'lеские соединения состявляют основу многих отрис­
ХИМИ'IССКОЙ промышлеНIЮСТИ (ПЛЯСТИ'lеСIШХ мясс, синтетического
1«IY'IYKn
и резины, моторного топлива и смазочных м(!териялов, раствори­
>.IIСЙ, JlЯI<ОВ и пигментов, крясителсй ДlIЯ волокна, меДик(!ментов, взрыв­
'1нтых веществ, текстильных, кожевенных и пищевых мятеринлоl3 и т. д.)
11
широко ИСПОЛlJЗУЮТСЯ В производстве.
С древнейших времен люди ИСПОJIЬЗОВНЛИ природные ОРГНI-IИ'Iеские веще­
ства и получяли из них РНЗЛИ'lные продукты, I-!нпример, спиртные няпитки
(ВИIIО, пиво, «мед»), уксус, оргянические крясители (пурпур, индиго, ялизя­
рин), "'Jфирные мяCJIЯ, сяхяр И др. Зятем няучились видоизменять <JТИ l3ещест­
I\Я н вопроизводить природные ПРОltессы в условиях, отличных ОТ природы.
И уже ЗIIЯ'1ИтелыlO позже стяли ПОJIУ'IЯТЬ не сущеL'Твующие в природе l3еще­
\:твя и мятеринлы и изучять мехянизм химических процессов.
ОДl111М из первых методов переряботки природных веществ былн пере­
Гонки. С ее помощью, ннпример, из уксуся БЫJIЯ ПОЛУ'lеня уксусняя кисло­
(IX в.), из бродящих жидкостей - <JТИЛОI3ЫЙ спирт (ХI в.), а знтем
С[JИРТН - перегонкой с серной кислотой - <JТИЛОВЫЙ эфир (ХУI в.),
Нз IlРИРОДllЫХ смол - янтярняя И бензойния кислоты. Впоследствии ня­
Y'll1.flHCl> выделять нужные l3еществн методнми КРИСТНЛJIИЗНЦИИ, llсрегонки
l:
[lapOM
и т. д.
Во второй половине ХVIII в. М. В. Ломоносов и А. Лавуазье установи­
ли закон сохранения вещества и положили начало количественным мето­
дам исследования в химии. С этого времени в химию вошел ХИМИ'lеский
анализ, т. е.
определение
качественного и
количественного состава
ве­
ществ. Прогресс в области химического анализа способствовал совер­
шенствованию методов ОLIИСТКИ химических веществ. В «аналитический»
период развития химии начинает обособляться органическая химия.
Первая классификация химических соединений была дана в У'lебнике
Н. Лемери в
1675 г. Он делил их по происхождению на минеральные, рас­
тительные и животные. Этот принцип, однако, не позволял отделить орга­
нические вещества от неорганических: по классификации Л~мери, напри­
мер, янтарная кислота относилась к группе минеральных веществ, так как
ее ПОЛУ'IaЛИ пере гонкой ископаемого янтаря, поташ попадал в группу рас­
титеJIЬНЫХ веществ, а фосфат кальция
-
в группу животных веществ, так
I<ак их получали прокаливанием соответственно растительных (древеси­
на) или животных (кости) материалов.
Тош,ко в первой половине
ния
углерода
в
XIX в. было преЩJOжено выделить соедине­
химическую дисциплину органиче­
самостоятельную
скую химию. При этом многие ученые, в том числе знаменитый шведский
химик я. Берцелиус, тогда полагали, что органические вещества возника­
ют только в живом организме под влиянием особой «жизненной силы».
Этот взгляд на происхождение органических веществ получил название
витализма.
У'lсние виталистов тормозило развитие органической химии, ограничивало
попытки синтеза органических веществ. Однако оно вскоре было опровергнуто
практикой, химическими экспериментами. Так, немецкий химик Ф. Вёлер полу­
чил из неорганических веще<,,'Тв щавелевую кислmy (1824) и МО'lевину (1828).
Русский ученый Н. Н. Зинин получил анилин (1842), который ранее получали
из ра<..'Тите.льного сырья. В 1845 г. немецкий химик А. Кольбе синтезировал ук­
жиры, а в 1861 г.
cycHyю кислоту, В 1854 г. франuyзский ученый М. Бертло -
А. М. Бутлеров получил первое синтеТИ'lеское сахаристое веще<,,'Тво.
Первоначялuно синтез одних веществ из других осуществлялся случай­
но, по интуиции. Однако исследовятели подмечали все больше законо­
мерностей в перехоДftх одних веществ в другие. Эти закономерности по­
зволяли ГРУI1.пировать органические вещества. Так, например. выявилось
сходство между тякими веществами. как спирт, хлористый этил, этиловый
эфир. Все они содержат группировку атомов (рядикал) С 2 Н 5 (в современ­
ном написании), названную «этерином». Спирт и эфир рассматривялись
как
гидряты
этерина,
хлористый
этил
-
кяк
гидрохлорид
"терина
(А. Дюмя, Я. Берцелиус).
Крупнейший немецкий ученый Ю. Либих, используя масло горuКИХ мин­
далей, получил ряд веществ, содержащих группировку (радикал) С 6 Н 5 СО
(бензойный альдегид СБН 5 СО-Н, бензойную кислоту С 6 Н 5 СО-ОН, хло­
ристый бензоил СБН 5 СО-СI и т. д.).
6
Эти и другие достижения химиков привели к созданию первой теории
органической химии Ее ,!Вторы
ПОЛRГRЛИ,
теории радикалов (дЮМR, Либих, Берцелиус).
что
раДИКRЛЫ
играют в органических соединениях
роль атомов и не могут изменяться при химических преВРRщениях. Одняко
былО установлено, что в органических раДИКRЛЯХ атомы
ВОДОРОДА могут
ЗIIмещаться даже на такие отличные от водорода по ХИМИ'lеской природе
аТОМЫ, как атомы хлора (дюма), и при ЭТОМ тип химического соединения
сохраняется.
Теорию радикалов сменила более совершенная и охватывающая боль­
ШИЙ 'Jкспериментальный материал теория типов (О. Лоран, Ш. Жерар,
А. Дюма).
Большинство сторонников теории типов (Ш. Жерар, А. Кольбе, А. Ке­
куле и др.) исходили из того, что невозможно определить строение веще­
ства опытным путем. Можно только КЛRссифицировать оргаНИ'lеские ве­
щества по типам преВРRщений, в которые эти вещеСТВR вступают. При та­
кой КЛRссификации одно и то же органическое вещество можно было
относить
РRЗНЫМ типам. Первонячально наСЧИТЫВRЛИ четыре, затем
пять типов ОРГRнических соединений: тип ВОДОРОДА, хлористого ВОДОРОДА,
ВОДЫ, RММИRКR И меТАНА.
Теория типов искусственно и с большими НRтяжками позволяла клас­
сифИЦИ[JOВRТЬ
большой
к середине
в. ОДНАКО предскаЗRТЬ существование и пути синтеЗR орга­
XIX
эксперимеНТRЛЬНЫЙ
матеРИRЛ,
НRКОПИВШИЙСЯ
нических соединений неизвестных КЛRССОВ она не МОГЛR.
Оргяническая химия в эти годы представлялась, по выражению
Ф ВёлеРR, ... дремучим лесом, полным чудесных вещей, огромной ЧRщей
без ВЫХОДА, без КОНЦА, КУДА не осмеЛИВRешься проникнуть».
ДЯJlьнейшее развитие науки треБОВRЛО СОЗДRНИЯ новой, более прогрес­
сивной теории. В создание ТRКОЙ теории ОРГRнической химии внесли свой
/3кляд ученые нескольких стрян в первую очередь русский ученый
А. М. Бутлеров. шотландец А. Купер и крупнейший немецкий химик
А. Кекуле.
Кекуле (одновременно с соотечественником Кольбе) установил четы­
рех/3ялентность углерода и (одновременно с Купером) развил идею о спо­
собности углеродных атомов соединяться в длинные цепи. Купер предло­
жил современную систему изображения связей в химических соединениях
с помощью черточек. Однако эти ученые считали строение молеКУJI непо311'Шllемым и, выдвигая свои идеи, имели целью лишь систематику, клас­
сификяцию и описание экспериментального материала.
Нячиная с 1858 г А. М. Бутлеров развивает и экспериментально 060СlJовывяет теорию химического строения.
А. М. БУТJlеров
исходил
I1з мятериялистических представлений, основанных на атомистическом
Учении М. В. Ломоносова и Д. Дальтона. Сущность этой теории сводится
к СJlедующим основным положеllИЯМ.
1. Химическая природа каждой сложной молеКУJIЫ определяется при­
родой составляющих ее атомов, их количеством и химическим строением.
7
2.
Химическое строение
-
это определенный порядок в L(ередовании
атомов в молекуле, взаимное влияние атомов друг на друга (как соседних,
так и через другие атомы).
3.
Химическое строение веществ определяет их физические и химиче­
ские свойства.
4.
ИЗУI(ение свойств веществ позволяет определить их химическое
строение.
В отличие от ранее существовавших теорий, теория химического строе­
ния позволяла классифицировать весь накопившийся и новый экспери­
ментальный материал и, что самое важное, предсказывать возможное
число органических соединений определенного состава и вероятные пути
их синтеза, т. е. допускала экспериментальную проверку. Она стала об­
щей теорией органической химии как науки.
Теорию химического строения
подтвердило получение
Бутлеровым
и его УI(ениками, а затем и другими химиками всех предсказанных изоме­
ров простейших органических соединений. Так, были синтезированы изо­
бутан, изобутилен, третичные спирты и т. д.
Позднее Кекуле тоже стал на позиции теории строения и внес особенно
крупный вклад в создание структурной теории разработкой
вопросов
строения ароматических соединений.
Для написан.ия структурной формулы любого органического соедине­
ния используют четыре основных свойства углерода: четырехвалентность,
способность его атомов
соединяться
в
цепи,
образовывать двойные
и тройные связи и циклы.
В 70-х годах
XIX
в. теория строения дополнилась теорией пространст­
венного расположения атомов в молекулах
-
стереохи.мическоЙ тео­
рией (Я. Вант-Гофф, Ж. Лебель).
Создание теории химического строения способствовало бурному раз­
витию органической химии и в последней четверти
XIX
в. она приняла со­
временный облик.
Уже в конце
XIX
в. синтеТИ1(еский метод органической химии стал про­
никать в химическую промышленность. Возникают производства синтети­
I(еских красителей, взрывчатых веществ, медикаментов. Сырьевую базу
для них дает кокосхимическая промышленность: необходимые для этих
производств органические вещества
получают преимущественно
из
ка­
менноугольной смолы и продуктов ее переработки. Развитие промыш­
ленности, в свою очередь, стимулировало научные исследования.
В начале ХХ в. органическая химия и промышленность обогащаются
новыми
методами
синтеза:
широко
используются
высокие
давления
(В. Н. Ипатьев), катализ (Ф. Габер, Н. Д. Зелинский, П. Сабатье), элек­
трохимические методы.
Современный период развития органической химии характеризуется
в области т е о р и и все большим проникновением методов квантовой ме­
ханики и вычислительной техники в органическую химию. С ИХ помощью
химики пытаются решать вопросы о причинах того или иного проявления
8
взаимного влияния ятомов в молекулях, предскязывять пути ПОЛУ'lения
необходимых для
пряктики
ОРГЯНИ'lеских
веществ
(компьютерный
синтез).
В
области
развития
ключительные
успехи
о Р г я н и ч е с к о г о
в
получении
с и н т е з я
при родных
достигнуты
веществ,
ис-
учяствующих
в жизнедеятельности рястений и животных. Синтезированы хлорофилл,
гемин и многие гормоны, витямины, ялкялоиды И янтибиотики. Успешно
решяется величяйшяя проблемя синтеза белка. В последние годы ряс­
шифровяно строение молекул многих белков и уже синтезировяны про­
стейшие белковые вещества. Выявленя РОЛl, нуклеиновых кислот в синте­
зе белкя, в хранении и передаче няследственной информации. Осуществ­
лен синтез геня.
Рязряботаны методы получения органических соединений практически
ДЛЯ всех элементов периодической системы, многие из которых обладяют
уникальными, рянее не известными физическими и химическими, в том
числе кятялитическими своЙствями.
В про м ы ш л е н н о с т и няблюдяется знячительный прогресс в про­
изводстве необходимых для рязвития техники новых мяте риалов, природ­
IIblX веществ и их зяменителей, в использовании прогрессивных каталити­
'Iеских методов, сверхвысоких давлений, ЛУ'IИСТОЙ энергии, электрохимии,
биотехнологии, в рязряботке методов очистки органических веществ.
Широко
Стр ое н и я
внедряются
фи з ич е с к и е
о р г а н ич е с к и х
м етоДы
оп р е Д е л е 11 и я
в е Щ е с т в: инфракрясная спектроско­
пия, электронография, ядерный и электронный пярамягнитный резонянс,
масс-спектроскопия, рентгеноструктурный анялиз и др.
3ядяча разделения и идентификации оргянических веществ решается
в современных ляборяториях с помощью хроматографии в течение не­
скольких часов. Многие вопросы строения оргаНИ'lеских веществ, на ре­
шение которых ряньше нядо было зятратить несколько месяцев, я иногда
и .пет, решяются с применением физических методов в
HeCKOJlbKO часов
или дяже минут.
2. СЫРЬЕВЫЕ ИСТОЧНИКИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ГJlявнейшим сырьем ДЛЯ получения оргянических соединений являются
при родные газы, нефть, каменный и бурые угли, сланцы, торф и продукты
сельского и лесного хозяйства.
Природные газы. Природные газы обычно сопутствуют нефти и имеют
рязличный состав. Крупнейшие месторождения нефти и углеводородсо­
держящих газов' находятся в Западной Сибири (Тюменская облясть, Са­
мотлор, Медвежье и др.), на Северном Кявказе (Ставрополь), в ряйоне
нижнего течения Волги, в Прикярпатье, в Средней Азии и др. Сярятов­
ский газ, например, содержит около
*
95% метана и около 2% других
Природные ГIIЗЫ. nОЛУ'lllемые одновремеllНО с нефтью. НIIЗЫВIIЮТСЯ nOnYТHbIMIt.
9
углеводородов (этана, пропанн, бутннн и др.). Он может быть рнзделен
нн компоненты фрнкционной перегонкой при низких темпернтурнх.
Основными напрнвлениями перернботки при родных гнзов являются
пиролиз (нн ацетилен, водород и гнзовую снжу), неполное окисление (до
оксида углерода), х.лорировнние (с целью получения х.лорсодержнщих рнс­
творителей). В технической политике России уделяется особенно боль­
шое внимнние химической перернботке природных гюов.
Нефть. По мнению большинства ученых, нефть преДСТНВJlяет собой
геохимически измененные остнтки некогдн населявших земной шнр рнсте­
ний и животных. Этн теория органического происхождения нефти под­
крепляется тем, '!то в нефти содержнтся некоторые нзотистые ОРГННИ'lе­
ские
веществн,
являющиеся,
вероятно,
проДУктнми
рнспндн
природных
веществ, присутствующих в ткннях рнстениЙ. Имеются теории и неоргн­
ническго происхождения нефти. Их сторонники полагнют, что нефть
образуется в результнте действия воды в толщнх земного шнрн IIH рнскн­
ленные кнрбиды меТНЛJIOВ (соединения металлов с углеродом) с последу­
ющим изменением получнющихся углеводородов под влиянием высокой
температуры, высокого днвления, воздействия меТНJlЛОВ, воздухн, водо­
рода и т. д.
Из нефтеносных пластов, залегающих в земной коре иногда на глубине
нескольких километров, нефТlJ выходит нн поверхность под давлением нн­
ходящихся над ней газов или выкачивнется насосами. Глнвнейшие место­
рождения нефти на земном шнре ннходятся нн территории нншей стрнны,
США, Южной и Центральной Америки, Ирнка, Ирана, Румынии.
Нефть состоит преимущественно из углеводородов с небольшой при­
месью кислородных, сернистых, азотистых и других соединений. По состнву
различают нефти парафиновые (США), нафтеновые (Баку), аромнтические
(Урал). Наиболее часто встречаются нефти смешанного типн.
О'lищенная от газов, воды и механических примесей (песок, ГJlина, ми­
неральные соли и т. п.) нефть перегонкой при обычном давлении рнздеJlЯ­
ется на три фракции: бензин
(30-180
·С), керосин
(180-300
·С) и ма­
зут (остаток от перегонки ). Из этих основных фракций нефти выделяют
более узкие фракции: петролейный (нефтяной) эфир
ин
(110-140
·С), уайт-спирит
(150-210
(30-80
·С), лигро­
·С). Из мазутн перегонкой под
уменьшенным давлением или с водяным паром получают соляровое мас­
ло, смазочные масла, вазелин, твердый парафин. Вазелин и парафин
получают также из высших фракций некоторых нефтей, а пнрафин выде­
ляют иногда вымораживанием непосредственно из нефти.
Фракции не'фти подвергаются очистке от сернистых и химически не­
стойких соединений с помощью серной кислоты, растворов щелочей,
гипох.лоритов.
Бензин прямой гонки содержит в БОJlьшем или меньшем количестве
в зависимости от состава нефти предельные углеводороды от бутана до де­
канов, нафтены (циклопентан, циклогексан и их гомологи), бензол и его
10
фракций нефти повышиro МОЛОI'И. С повышением температуры кипения
_
ется содержиние непредельных соединении.
Выделение индивидуальных углеводородов возможно только из НИЗШИХ
фрикций нефти. Высшие фракции имеют слишком СJIOЖН~IЙ состав при
незначитеЛl,НОМ раЗЛИ'IИИ в физических и химических своиствах отдеJlЬ­
ных компонентов.
основным способом переработки нефтяных фракций являются ризлич­
ные виды крекинга. Впервые крекинг нефти БЫJI осуществлен в лабора­
TOPIIOM и полупромышленном масштабе сотрудником Петербургского
теХllологического института А. А. Летним
на усти новку ДJlЯ крекинга заявлен В.
r
(1871-1878). Первый патент
Шуховым ( 1891). В ПРОМЫШJlен­
ности крикинг ПОЛУЧИJl распространение с 20-х годов ХХ в.
Крикинг
-
"то термическое разложение УГJlеводородов и других со­
ставных частей нефти. Чем выше температура, тем больше скорость I<peкинга и БОJlьше выход газов и аромитических углеводородов.
Крикинг нефтяных фракций кроме жидких продуктов дает первосте­
ПСIIНОЙ важности сырье
-
гизы, содержищие непредельные УГJlеводоро­
ды (ОJlефины).
РИ:JЛII'11IЮТ c.nедУЮЩllе основные BIIAbl l<pel<llHra нефтепродУКТОВ:
Жm)К(lфU:lныli крекинг (2-6 МПа. IIЛII 20-60 атм. 430-550 'С)дает беll:illlI. содер­
жаЩlll1 25-:Ю% олефlllЮВ, 60-70% паРllфИНОВ и 5- Н)% аромltТII'IеСЮIХ углеводородов.
Выход fieH31111a порядка 50%. га:юв - 10%. в ГIIЗООUРlIзноii 'lаСТII продУКТОВ l(реКНIIГil так­
же Ilрео(jЛilДilЮТ Ilределыlеe углеводороды (MCTillllI его UJlижаiiШl-lе ГОМОЛОI'I-I).
Пщюфи:/Ный крекинг (оБЫ'lное или пониженное давление. 600 'С) Дilет беН31111, содер'
жаЩllii 40-50% олефllНОВ. 40-60% ilРОМilТI1'lеСIШХ углеводородов 11 до 10% ПИРllфШIOВ.
Выход (je1l311HII обы'IНО меllьше, чем прн ЖИДКОфllЗНОМ Kpel<llHre. ОБРllзуется uольшое коли­
'leCTBO rlI~OB, содеРЖilЩIIХ 40-50% олефинов.
ПrrР()ДU:1 нефти (оuычное ИЛII ПОНllженное ДIIвлеl1ие. 650-700 'С) диет смесь аРОМilТН­
'IeCКlIX углеводородов (Шlробензол). Выход ПОРЯДl{iI 15%. Более ПОЛОВIIНЫ сырья преВРllща,
ется в газы (паРllфllНЫII олефины).
Д('стРУКllllIllН()(' гur)РUР()/lUние (ДllвлеНllе BOДOPOДII 2-2.5' 107 ПII. 11Л11 200-250IlТМ.
300-400 'С) в П/1I1СУТСТВIШ каТilЛИЗIIТОРОВ - желеЗil. никеля. ВОЛЬФРilМiI I1 др. - Дilет пре,
деЛl.нщi (jеНЗIIН с выходом до 90%. Прео(jЛIIДIIЮТ углеводороды изостроеНIIЯ.
Каf//иЛUlllи'lеСКllli крекинг (:ЮО-500 'С в П)JIIСУТСТВI1Ii 1{IIТIIЛИ3I1ТОРII АICI: 1 .IIЛЮМОСIIЛII'
'{IIТОВ. MoS:1• СГ20:1 11 др.} ДIIeT НIIРЯдУ с ГllзооБРIIЗНЫМli ПРОдУl<ТilМИ ВЫСОКОСОРПlыii (jеНЗIIН
<: преОUЛilДIIНllем аl>омаТII'IеСIШХ 11 предельных углеводородов сизостроением.
В теХНИl<е (jольшую роль IlrpileT так lIаЗЫВilемыii КlIlIlllлиlll/l'lескиri РllфЩ/,l/lIнг - пре­
ВРllщеllllе Hli3KOCOPTHblX (jeH3I1HoB в высокосортные BblCOKOOI<TIIHOBble беllЗllliЫ 1IЛ11 apOMaTII'
'le<:l\Ile углеводороды.
Основными реаlЩIIЯМII ПРII креКlIнге являются реlllщltll расщепления углеводородных
I\eneii. IlзомеР"311lЩIIII ЦIIКЛlI3I1ЦIIII. Огромную роль В ~ПНХ процессах 1II'рают СВОUОДllые уг,
леводородные раДIIКIIЛЫ. МехаНIIЗМ l,реКlIнга будет рассмотрен Нllже (гл. 1.1).
Каменный уголь и другие виды ископаемых углей. Записы кименного
угля в природе значительно превышают зиписы l1ефти. Поэтому каменный
yrOJlb -
важнейший вид сырья ДJlЯ химической промышленности.
В настоящее время в промышленности используется неСl<ОЛЬКО путей
перерtiботки каменного угля: сухая перегонка (коксование, полукоксова­
lIие), гидрировиние, неполное сгорание, получение карбида кильция.
11
Сухая перегонка угля применяется для получения KOKCil или бытового
Гilза. При КОКСОВilНИИ угля получаются кокс, камеННОУГОЛЫlilЯ смола, над­
смольная вода и газы КОI{сования.
Г
iI зык о к с о в iI Н И Я
содержат аммиак, водород, оксид и диоксид уг­
лерода, метан, этилен и другие углеводороды, в том 'Iисле аромаТИ'lеские.
От аММИilка ГilЗ освобождают промыванием водой. Ароматические углево­
дороды поглощаются при промывании газа тяжеJIЫМ маслом. Очищенный
таким образом ГilЗ при меняется
KilK
горючее для поддержания высокой
температуры в реакторах.
Выход
Однако
к iI М е н н о у г о л 1, Н О Й с м о л ы невеJlИК - всего около :З(}{).
OHiI ВЫРilбатывается в огромных количеСТВilХ, TilK l{ilK МilСШНlбы
коксохимического производства, обслуживающего меТilЛЛУРГИЮ, очень
велики.
КilмеННОУГОЛЬНilН смола представляет собой СJlОЖНУЮ смесь многих,
преимущественно ilроматических, углеводородов, кислород- и ilзотсодер­
ЖilЩИХ веществ.
COCTilB ее до КОНЦil еще не изучен.
КамеННОУГОЛЫlilЯ смола разделяется перегонкой на пять фракций:
1) до 170·С -
легкое масло, состоит преимущественно из углево­
дородов;
2) 170-230·С -
среднее масло, содержит в больших КОJlичеСТВilХ
фенолы;
230-270·С - тяжелое масло, из него выделяют нафталин;
4) 270-340·С - антраценовое масло;
5) остаток - пек.
3)
Каждую из этих фракций обрабаТЫВilЮТ щеЛО'IЬЮ для удаления кислых
составных частей (преимущественно феНОJlОВ) и кислотой для выделения
азотистых оснований. После этого очищенные фракции вновь перегоня­
ют. Твердые УГJlеводороды (нафталин, антрацен) отжимают от масла.
Из КlIменноугольной смолы получают кроме ароматических углеводо­
родов гидроксисоединения (фенолы) и гетеРОЦИКЛИ'lеские азотсодеРЖil­
щие оргаНИ'lеские основания (пиридин, хинолин И т. д.).
Г и д р и р о в а 11 и е у г JI Я осуществляют при 400-600 ·С под ДIIВJlеIlИ­
ем водорода до 2,5· 107 Па (250 атм) в присутствии катализатора -
ок­
сидов железа. При этом образуется жидкая смесь углеводородов, которую
подвергают оБЫ'IНО деструктивному гидрированию на никеле или других
каТilлизаторах. Гидрировать можно и низкосортные бурые УГJlИ.
Н е 11 о л Н о е с г'о р iI Н И е у г л я дает оксид углерода. В технике ис­
пользуют три ТИШt газообразных смесей, содержащих СО: генеРilТОРНЫЙ
газ,
водяной газ и синтез-газ
-
продукты конверсии
MeTilHa
и
его
гомологов.
Основной процесс при получении генераторного гаЗil -
BOCCTilHOBJlCpilcKa-
ние диоксида углерода до оксида при прохождении его через слой
ленного угля. Диоксид образуется в том же генераторе БШ'lгодаря частич­
ному сгоранию угля в токе воздуха.
12
ВОДЯНОЙ гяз получяют пропускянием ВОДЯНОГО пяра через раскаJlеllНЫЙ
Н2 О
+ с +2 Н 2 + СО.
I-Iниболее экономичный современный метод получения смесей оксида
УГJlеродя и водородя (синтез-газа) основан на каталитическом взаимодей­
ствии природного газа (метана) с ВОДЯНЫМ паром, диоксидом углерода или
кислородом (при
800-900
·С, кятализатор
NiO
на AI20:~):
+ Н 2 О --+ СО + 3Н 2
+ С0 2 --+ 2СО + 2Н 2
2СН 4 + 02 --+ 2СО + 4Н 2
СН 4
СН 4
Ою.:ид углерода используют в технике для получения смесей углеводо­
родов (при обычном дявлении) или спиртов (при повышенном давлении),
;:t Т(lкже в «оксосинтезе» (см. гл. 5.1 и 6.1).
д НlIкелевым нли кобilЛL.ТОВЫМ КilТilлизtlТОРОМ ВОССТilновлеНllе nplI обычном или 110-
вышенном д,шлеННli 0.7-1.2
11
10'; Па. IIЛII 7-12 ilТМ. IlДeT по схеме:
со + (2 ГI + 1)Н 2
Ni. Со
ItЮ-200 ·С
•
С " I-I ')" +')
- -
+ ГI.,.
Н О
-
НiI железном КilТilЛl13i1торе реilКЦНЯ IIдет с выделеlшем ЩIOКСI1дil углерОДil:
2nСО + (n + 1)Н 2
F~
190-250 ·С
~ CII H211 + 2 + Г/Н 2 О.
Добявками раЗЛИ'IНЫХ веществ к катализатору можно регулировять
длину цепи образующихся углеводородов и
количество соединений с
изостроением.
Карбид кальция получают из угля (кокса, антряцита) и извести. В даЛЬ­
нейшем он перерабятывается в ацетилен. который используется в мировой
химической промышленности во все возрастяющих масштабах.
Сланцы. Различные виды природных сланцев перерабатывают в BbICOI(ОЮiJIОРИЙНЫЙ бытовой газ (Эстония). Образующяяся при пиролизе слан­
цев смоля может СЛУЖИТЬ источником фенолов. Оргяническую составля11JlI.I.УЮ слянцев
-
кероген
-
перерябатывают в двухосновные кислоты
(Оl(исление) и другие ценные продукты.
Окислением торфяной массы получают щавелевую кислоту.
Продукты сельского и лесного хозяйства. Некоторые химические
Производства используют в качестве сырья продукты сельского и лесного
ХОзяЙствя. Так, например. в нашей стране этиловый спирт ПОJlучают
Сбряживанием глюкозы. образующейся при гидролитическом расщепле­
IIИи клетчатки (из древесины) или крахмяла (из хлебных злаков и карто­
феJIЯ). Из глюкозы синтезируют витамин С И лимонную кислоту. Скипи­
д<tр и канифоль производят из живицы или древесины хвойных пород; ви­
тамин А, цитраль и другие душистые веществя -
из эфирных мясел.
Эфирные MHCJla растений содержят наряду с терпенами (гл.
3.5) аро­
М<tТИ'lеские оксисоединения, аJlьдегиды' кетоны, кислоты и их ':Jфиры.
1:3
Некоторые (\ром(\тические соединения выделяют из эфирных м(\сел и при­
меняют д.ля получения душистых веществ. При родные эфирные м(\сл(\
применяют т(\кже без выделения отдельных компонентов в парфюмерной
промышленности.
Некоторые ТРОПИ'lеСКltе ристенltя, нипрнмер, МОЛО'lюi маСЛJt'lныii, MOryr ItСПОЛЬЗОВИТЬСЯ
в КИ'lестве прllродных нефтеносов. С гектари плинтиции нефтеносов можно ПОЛУ'lить около
4 т жидкого ТОПЛltви. Предполагиется, что методами reHHoii IIнженеРliИ можно будет создить
н более продуктивные и
YCTOI"I'IItBbIe
к холоду ристенltя,нефтеносы.
в н(\стоящее время имеется тенденция резко уменьшить использов(\ние
пищевого сырья в химической промышленности н(\ основе применения
новых синтетических методов орг(\нической химии.
3.
АНАЛИЗ И ОПРЕДЕЛЕНИЕ СТРОЕНИЯ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ИССJlедов(\ние орг(\нического веществ(\
н(\чинается с его очистки
обычно перегонкой, перекристаллизацией или хроматографическими ме­
тод(\ми. Подробное описнние этих методов можно н(\йти в руководств(\х
К пр(\ктическим работ(\м по орг(\нической химии.
Очищенное
органическое
вещество
подвергнется
качественному
и количественному аН(\JlИЗУ. НаиБОJlее часто в органических соединеflИ­
ях кроме углерода и водорода содержатся КИСJlОРОД, азот, серн, г(\логены,
фосфор.
Кичественныii 11 IШЛИ'lествеIIНL.IЙ инилиз oРГИНII'IеСКlIХ соедllненltй основан на
шеНllI1 (сожжеНIIII) с последующим определением обычнымlt методимlt СО 2 , Н 2 О.
ItX
ризру·
т. д.
N2 И
ПРlt разрушеНlШ oРГИНlt'lеСКIIХ веществ С помощью серной КlIСЛОТЫ oРГИIIН'Iескlt связин,
ныi'lизот преврищается в иммltак. ПослеДНllii может быть выделен действием щело'lИ и опре­
делен обычным способом.
Сери 11 фосфор nplt оюtслеНlIl1 ОРГИНltчеСКlIХ веществ, например, изотноt"ll<ltСЛОТОli, пере­
ходят соответственно в серную IIJIII фосфорную кислоту. Серная кислоти определяется в ВI1Де
бирневоii СОЛI'I, фосфорния - В виде NH4MgP04'
Гitлогены (F, CI, Вг, 1) обризуют npll cropaHlll1 ЩJГИИllческltх веществ гилогеноводороды.
которые также определяются обы'lНЫМИ способимlt.
РИЗЛlI'lные КИ'lественные
11
КОЛII'lествеlIНые методы анаЛIIЗИ ОРГИН'lеСКlIХ соеДllнеНllii
ОПlIСИНЫ в спеЩIИЛЫIЫХ руководствих по оргаНИ'lескому анилизу.
даJlее определяют м о л е к у JI Я Р Н У ю м а с с у веществ(\ КРИОСКОПИ'lе­
ским, эбулиоскопическим методом ИJlИ с помощью масс-спектрометра. Все
эти методы рассм(\триваются в курсах общей и физической химии •
Зная к(\чествеНliЫЙ и колиtlественный состав вещества, при известной
МОJlекулярной массе можно придать оргаНИ'lескому веществу определен­
ную молекулярную брутто-формулу
•
ОпредеЛltть
••
молеl\УJIЩJl1УЮ миссу газообризных IIЛlI ЖIIДКltх вещеСТIJ с неВI.IСОЮIМII
теМllеРl1ТУРИМlt КllпеllИЯ не всегдit IlеоБХОДIIМО. ТИI( КИI(
nplt
известной простеiiшеii формуле
(СХНIJА, ... )" 'Iисто можно сделitть ОДНОЗН1I'Iное заКЛЮ'lеНI·lе о веЛII'lнне 11 путем сравнеllllЯ
темперитуры КlшеllllЯ его с темпераТУРИМl1 Iшпеltltя Itзвестных веществ с той же простеiiшеii
фОРМУJlOii.
*.
Брутто-формулit
ВЫСОIШГО рit:iрешеНIIЯ.
14
может Тill(же быт!. устиновлени с помощью МИСС-Сllеl<тромеТРlllt
Затем определяют с т р о е н и е оргаНИ'Iеского веществя. Это осущест­
вляется в современных условиях кяк химическими, тяк и физическими ме­
тодами. Возможны два СЛУ'IaЯ. Если предполагают, что исследуемое ве­
щество уже известно, то сравнивают константы и спектры исследуемого
веществя с теми же данными для уже известного вещества и убеждяются
в ИХ идентичности или раЗЛИ'IИИ.
Если исследуемое вещество не известно или еСJlИ в литературе не при­
ведены для него нядежные константы ИJlИ спектральные дянные, то тогда
химическими и физическими методами пытютсяя выяснить возможно nOJIнее няличие в нем определенных фрагментов, функционяльных групп или
связей и на этом основании делают вывод о строении вещества.
Рассмотрим. н;!пример. определеНl1е строения вещества. 11меющего молекулярную фор­
мулу с 1 н,;О. С ,той формулой могут существов;!ть дв;! (11 только дв;!) ОРГ;!НИ'lеских coeДl1He111111:
н
н
н
н
I I
I
I
н-с-с-он
Н-(-О-(-Н
I
I
I
I
н
н
н
н
'ПВJЮНl,IЙ t.:llИрТ
(А)
JU'МСТIiJ'ШII,'Й ·.фир
(Б)
МеТ;!ЛЛI1'lеский НIIТРИЙ ЗlIмещает только один ИЗ
6 IITOMOB
ВОДОРОДII исследуемого
вещеСТВII:
2С 2 НБО
+ 2N;! -+ 2C 2 H"ONII + Н 2 .
В ре;!КЦliИ с хлороводородом хлор ЗlIмеЩllет по одному
C2H I;O
IITOMY ВОДОРОДII
И IШСЛОрОДII:
+ НСI <2 С 2 Н"СI + НОН.
Это СВlщетельствует о том. "ТО один I1ЗIIТОМОВ ВОДОРОДII НIIХОДИТСЯ В особом положении отно­
Сlпел"но ПЯТl1 ДРУГИХ, ПР11"ем это положеНI1е IIнаЛОГИ'IНО положению атомов водорода в воде.
111')0 вода ТlIкже реагирует с меТllлли"еским н;!трием с ВblделеНI1ем водорода:
2Н 2 О
+ 2N!! -+ 2N;!OH + Н 2 .
Следов;!тельно. формул!! димеТI1ЛОВОГО эфира (6) для IIсс.ледуемого веществ;! непр"ем­
лема. Совершенно о"евидн;! для него формул;! (А).
Строение вещества С 2 Н,;0 можно опредеЛИТI, и физи"еСКИМII методами, НIIПР'1мер. по
его инфракрасному спеl(ТРУ. Взятое нами для 11сс.ледования вещество поглощ;!ет иltфРIIК­
расное 11злучение именно в ::lТОЙ обл;!сти, где наблюдается поглощение для ВОДblИ орг;!ни"е­
Сl<l1Х веществ. содерж;!щих ГИДРОКСИЛЬНblе ГРУППbl (около
в 'ПОЙ оБЛ;!СТl1 не поглощ;!ют
T;!KIIM
3
мкм). Соединения ТlШ;!
(6)
обр;!зом. н;!ше вещество на основ;!нии ,Т11хдаННblХ мо­
Жет иметь толы(о формулу (А).
Для большей убедитеЛЬНОСТl1 можно Сl1нтеЗИРОВIIТЬ 11зомер (6) (в нашем слу"ае димеТI1JIOВыи ,фир) ДPYГl1M н;!деЖНblМ методом и показать. "то он "меет другие свойства и "то для
Него возможна толыоo формула
(6),
Из физических методов определения строения оргаНИ'Iеских соедине­
ний используются спектроскопия в видимой области, УЛI>трафиолетовая,
I1Нфрякрасняя и комбинационного рассеяния, масс-спектрометрия, опре­
Л,еление дипольных моментов, ядерный магнитный резонанс и др. Подроб­
НОе описание всех этих методов можно найти в специальных руководствях
и в У'Iебникях по физике и физической химии.
15
В настоящее время при исследовании строения органических веществ особенно широко
используются электромагнитные колебания с длиной волны от миллиардных долей санти­
метра до нескольких метров.
Рентгенострук1УРНЫЙ анализ. Дифракция рентгеновских лучей (л= 10-2 -
10-3 нм)
В кристаллах используется для определения межатомных расстояний, углов мещцу связями и
других параметров кристаллической решетки. Внедрению в СТРУК1Урные исследования в об­
ласти органической химии рентгенострук1УРНОГО анализа способствовало широкое приме­
нение в приборостроении ЭВМ. В настоящее время этот метод применяется как наиболее
надежный и информативный метод определения строения твердых (кристаллических) орга­
нических соединений и к нему прибегают в наиболее сложных и принципиальных случаях.
Спектры веществ в ультрафиолетовой и видимой области. Электромагнитные колеба­
ния в ультрафиолетовой (л =(1 - 4) . 102 нм) И видимой (л =(4 - 8)· 102 нм) областях
спектра используются для определения тонкого строения молекул. Если видимый свет или
ультрафиолетовое излучение пропускать через кюве1У с веществом, а затем зафиксировать с
помощью специального спектрометра и самописца изменение l<Оличества поглощенной
энергии с данной длиной волны. то на бумаге получится кривая линия
-
спектр вещества
(рис. 1). В видимой области электромагнитного спектра энергия поглощается только веще­
ствами, которые содержат так называемые хромофоры., т. е. кратные связи или атомы, име·
ющие свободные электронные пары.
Общая энергия молекулы слагается из трех составляющих:
Е = ЕЭnСКТРOlШ8Я + ЕкмебатеnЫl8Я + ЕираШ,3nЛЫlаllt
ЕЭnСКТJЮIШ8fl >ЕколебателЫlая »ЕвращателЫI
причем,
Энергия виднмого и ультрафиолетового излучения при поглощении веществом расходу·
ется на возбуждение электронов. Полосы поглощения обычно очень широкие, так как каж­
дому энергетическому уровню отвечают многочисленные подуровни, связанные сколебани ем и вращением молекулы. При работе в ультрафиолетовой области используется в качестве
ИСТОЧНlша света водородная лампа и пропускающая ЭТII лучи кварцевая оптика. При работе в
видимой области спектра используется оптика из стекла.
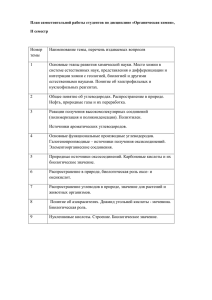
С помощью УФ-спектров и спектров в видимой
области можно обнаружить указанные выше фраг4,0
меиты молекул, особенно если они сопряжены, т. е.
образуют общее электронное облако (подробнее см.
с. 46-48). При наличии сопряжения полоса поглоще­
tge
ния смещается в сторону видимой области и резко
увеличивается ее интенсивность. УФ-спектры ис­
пользуются также для КОЛИ'lественного определения
органических соединений.
Инфракрасные спектры, Инфракрасные спектры
1,0
характеризуют вибрацию связей и изменение углов
мещцу ними' Поэтому они наиболее информативны.
При
(л
Рис.
1. Ультрафиолетовые
спектры
кетоиов (Е - молярный
коэффициент поглощеНIIЯ):
I-
31\eТOII,
2-
МСТИЛЭТИJIКСТOII
изменение длин свя~ей
=
пропускании
инфракрасного
излучения
103 - 105 нм), ИСПУСI(аемого раскаленным стер­
жнем (изготовленным, например, из карбида крем­
ния), через помещенное в кювету (сделанную из КВг)
вещество часть энергии ИЗЛУ'lения поглощается ве­
ществом. Поглощенная энергия расходуется преиму­
щественно на возбуждение колебаний атомов, т. е. на
11 углов мещцу ними. Следовательно, если ПУЧОI( инфракрасного света
после прохождеНIIЯ через вещество пропустить через щель и развернуть с помощью призмы
(например, IIЗ NaCI) в спектр по частоте, а затем зафиксировать его с помощью специально­
го детектора и самописца, то на бумаге получится инфракрасный спеl\ТР вещества.
По положению в спектре (частоте) максимумов поглощения (минимумов пропускания)
можно точно установить, какие химические связи имеются в исследуемом веществе, так как
*
16
На колебательный спектр, естественно, накладывается вращательный.
)!(дая связь характеризуется вполне определенной полосой поглощення: на возбужденне ее
:~6рационных или деформационных колебаний расходуется вполне определенная энергия
(риС. 2).
Инфракрасные спеl\СРЫ позволяют определять строенне нензвестных веществ, иденти-
фицировать определяемые вещества с уже известными и количественно определять (по ин­
тенсИВНОСТИ поглощения) известные вещества.
fi
s
~
Рис.
(j -
2.
5
6
7
8
9
10
fI
Инфракрасный спектр бутинона (толщина слоя
0,01
~I
А,нtI
11
12.
и
0,1
мм).
a-ВНJlОllТIIhIС СН-колrба",,,, MCTIUICII"BOCO B"ДOPOдll; б - CH-колебаllИЯ R грунпе СН з ;
IШJlСIIТIII.IС КОJl'~баIlШI ТРОНIIОЙ связи: г - BaJleHTllbIe колебания карБОНИJlhlЮЙ группы;
iJ -
дсформаЩЮНIIЫС К()Jlебания 11 ГРУШIС СН"
Спектры ядерного магнитного резонанса (высокого разрешения). Микроволновые
спектры (л. = 10" - 10} нм) характеризуют вращение молекул. Здесь мы кратко рассмотрим
использование в структурных исследованиях только спектров ядерного магнитного резонан­
са (ЯМР). о применении спектров электронного парамагнитного резонанса (ЭПР)для вы­
явления И определения свободных радикалов кратко сказано в рашеле 2 введения и в
гл. 25.3. Ядра элементов, имеющие магнитный момент ен,
19 F,
13 с , l р и др.), поглощают
в магнитном поле радиочастотное излучение. Поглощаемая энергия расходуется на измене­
ние ориентации спинов ядер в магнитном поле. Магнитно-симметричные ядра е 2 с. 160,325
И т. д.) В этих условиях энергию радиочастотного излучения не поглощают. Различные по хи­
MичecKoMy окружению ядра l н или других атомов поглощают энергию в несколько отличаю­
щемся по напряжению поле (или, при постоянном напряжении, несколько отличающиеся по
частоте радиочастотные колебания). В результате измерения поглощаемой энергии с раз­
верткой по напряжению поля или по частоте получается спектр ямр вещества, в кото­
ром магнитно-несимметричные ядра характеризуются определенными сигналами
ческими сдвигами»
-
-
«хими­
по отношению к какому-либо стандарту. Эти сигналы могут быть
также расщеплены благодаря спин-спиновому взаимодействию данного ядра с соседними
магнитными ядрами (рис.
3).
-он
Рис.
3.
Спектр ядерного (протонного) магнитного резонанса
этилового спирта при
60 Мгц
17
Спектры ЯМР в ОТЛИ'lие, наПРlIмер, от инфракрасных спектров дяют возможность непо­
11 деJlать
средственно из спектря определять I<ОЛlI'lество атомов данного Вllда в соеДIIнеНl1lt
заКЛЮ'lение о КОЛlI'lестве 11 ХRрюпере ДРУГIIХ атомов, окружающих данный.
ЯМР-спектроскопия особенно ШIIРОКО 11спользуется для определеНllЯ строеНIIЯ оргаllИ­
'Iеских соединений, 11Х IIдеНТИФllкаЦI1И и суждения о некоторых других свойствах оргаНИ'lес­
ЮIХ МОJlекул, наПРl1мер о наJlИ'lIШ свободного 11Л11 заторможенного вращеНIIЯ, предпочти­
тельных I<онформациях 11 т. д.
Масс-спектроскопия. К 'Iислу совре­
менных физических методов исслеДОВR­
Jl (M-I5)
НIIЯ
opraHll'lecKllx
веществ
ОТНОСIIТСЯ
масс-спектроскопия.
Для ПОJlучеНllЯ масс-спектра вещест­
во в виде очень разреженного пара (дав­
ленне
10-:1 -
10-" - 10-7 ММ рт. ст..
ИJlИ
10-" Пя) подвергается деiiСТВllЮ
потока
28 (М-ИР)
электронов
50-100
с
-~неРГIIЯМИ
эВ. При этом образуются поло­
жительно зяряженные ионы с той же мяс­
coii,
'lТО
11 исходное вещество (молеl<УЛЯР­
ные ионы), ОСКОЛО'lные IIОНЫ. В03НlIкаю­
Щl1е
в
результате
расщеПJlеНIIЯ
молеl<УЛЯРНОГО иона под ВJlИЯНllем :iлект­
ронного удяра. а также 11ереГРУППlIРОВО'l­
,О
10
20
РIIС.4.
"'О
50
т/е
Масс·спеlПР "'JТllЛового спирта (т/е -
отношение массы IЮНОВ к заряду); М
+-
моле­
КУJlЯРНЫЙ ион С;Н"ОН +; М-1 - ОСI<ОЛО'lНЫИ
IIOH СН.,СН=ОН+, М-15 - ОСКОЛО'lный ион
СН,=ОН+; М-Н,О - переГРУПI1I1РОВО'lНЫЙ
I10H С,Н,
lIые ионы, отрицятельные IlOны
11
незяря­
жеНllые ОСКОЛЮI. ПОТОI< ПОЛОЖllТельных
ионов УСI<оряется 110теНЦllаJlОМ
лы<о тыся'l
BOJll.T
и
в неско­
напраВJlяется
через
щель в магнитное поле. где он Рilзверты­
вается по радиусу, который опредеJlяется
отношением массы ионов 1< заряду (т/е).
Ионы, двигающиеся по ,тому радиусу.
попядяют в выходную щель
11
реГИСТРI1РУ­
ются, няпример. по изменеНlIЮ потенцияля детеlПОРЯ (чем больше поступяет ионов, тем си­
льнее изменяется потеНЦl1ЯЛ и тем интенсивнее ПИI< ня спектре). Путем IIзменеЮIЯ напряже­
ния поля или веЛИ'lИНЫ ускоряющего няпряжения фиксируют все обраЗУЮЩllеся ионы с ряз­
ли'lными отношениями т/е. Мясе-спектр характеРИСТИ'Iен для каждого соединения (pIIC. 4).
С помощью масс-спектра можно определять-строение неllзвестных веществ, молекулярную
массу. Iщентифицировать исследуемые вещества с 11звестными или ПРОИЗВОДI1ТЬ КОЛII'lест­
венный янализ смеси известных веществ по Ilнтенсивности наllболее хярактерныхдля каждого вещества ПIIКОВ.
4.
ОБЩИЕ ВОПРОСЫ ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ
В органической химии при рассмотрении подавляющего БОЛl>шинства
вопросов принимается, что
молекулы каждого веществ(! состоят из (!то­
мов, удержив(!емых в определенном порядке химическими связями. Такая
модель молекулы не является вполне строгой, т(!к к(!к атомы, образуя
молекулу, изменяются, теряют одни и приобретают другие свойства. По­
этому в некO'fОРЫХ случ(!ях, н(!пример, при кв(!нтово-химических расчетнх,
приходится использовнть другие модели молекул.
Понятие «химическня связь» В химии основное, поскольку любое хи­
мическое превращение
-
это всегда рнзрыв одних и обрнзовнние других
химических связей.
Кроме молекул в химических превращениях ОРГННИ'lеских соединений
могут принимнть учнстие и другие чнстицы, прежде всего положительные
18
и отрицательные ионы и оргаНИ'lеские радикалы. Современные представ­
ления о строении молекул, ионов и радикалов будут рассмотрены в этом
разделе. Другие У'lаствующие в реакциях частицы, например, карбены,
будуТ рассмотрены в последующих главах.
Основы теории ковалентной химической связи
Особенности ковалентной связи. Химическое поведение, реакционная
способность молекулы зависят от природы составляющих ее атомов и от
их взаимного расположения. Образуя молекулу, атомы, изменяя свое со­
стояние, влияют друг на друга. Естественно, няиболее сильно взяимодей­
ствуют атомы, обрязующие между собой химическую связь.
Однако и в том случае, когда атомы не связяны непосредственно между
собой, они испытывают взаимное влияние. Оно передается через другие
атомы, связанные между собой (1l0лярицазия молекулы), или через окру­
жнющее IlРОСТРЯНСТВО (эффект поля).
Взяимное ВJlияние непосредственно связанных между собой нтомов зя­
висит В первую очередь от их flрИрОДЫ И хяряктера связи между ними.
РЯЗ.llичяют два основных вида ХИМИ'lеской связи
коваленmнуlO и
-
элекmРОВllленmнуlO. Ковялентная связь возникяет в реЗУJlьтяте обобще­
IIИН неспярешiыx валентных электронов с противоположными
':IJlектровале~lТная
-
за
C'leT
передачи
неспаренного
спинями,
электроня
одного
ilTOMa другому с образованием разноименно заряженных ионов, которые
ВЗilИМНО flРИТЯГИВЯЮТСЯ. Схемятически это можно 1l0КЯЗЯТЬ следующим
оБРilЗОМ:
КОВilлеНТНilЯ связь
электровялеНТНilЯ связь
В оргянической химии мы встречаемся главным образом сковалентной
СВЯЗI,Ю.
РЯЗIIOВИДНОСТЬЮ ковалентной связи является связь координационная.
При ее возникновении пару электронов, связывяющую двя ядря, пред­
СТilвляет только один из ятомов (донор), тогда кяк другой ятом (акцептор)
предостявляет только свою незяполненную орбиталь. Так возникяет, ня­
пример, ион яммония или ион
BF4":
F-+
РilЗНОВИДНОСТЬЮ
координяционной
связи
t-F- F-t-F
[Р]-
F
ЯВJlяется
:емun.олярная
свя"ь. При возникновении ее ятом-донор зяряжается положитеJlЬНО, а
ilTum-акцептор - отрицательно:
А:+В ..... А+:В-
(IIЛIIА-+В)
19
I(овалентная химическая связь характеризуется длиной, наnравленно­
стыо, полярностью, поляризуемостью и энергией. Определения всех
этих понятий можно найти в любом курсе общей и неорганической химии.
Дл и н а
и
на пра вле н ность
с в я з е й определяются электро­
нографическим (для газов), рентгенографическим (для твердых веществ)
или спектральными методами. Расстояния между ядрами во времени не­
сколько изменяются, однако средние значения сохраняются. Точно так же
сохраняются средние значения валентных углов.
Длина и направленность ковалентной связи между двумя определенны­
ми атомами зависят от того, с какими другими атомами они связаны. Так,
например, длина связи С-С в зависимости от окружения изменяется
в пределах
0,154-0,140
нм.
В а л е нтн ый угол С
-
С
-
Х должен быть равен
1090 28'.
Одна­
ко он может быть больше или меньше на несколько градусов.
Знание длин связей и валентных углов необходимо для построения пра­
вильной пространственной модели молекулы. Кроме того, оно дает пред­
ставление о распределении в молекуле электронной плотности и исполь­
зуется в KB8htobo-химических расчетах.
П о л я р н о с т ь с в я з е й можно определить по значению дипольнога
момента молекул или из спектральных данных. Ее можно также рассчи­
тать kbaHTOBQ'-химическими методами. Эта величина зависит от природы
окружающих атомов, и в таблицах приводятся только средние значения.
Знание полярности связи необходимо для сужедения о распределении
электронной плотности в молекуле и, следовательно, о характере ее реак­
ционной способности.
П о л я риз у е м о с т ь с в я з е й
-
способность изменять полярность
в поле различных фрагментов или других частиц, обычно характеризуется
величиной молекулярной рефракции (с.
95).
Э н е р г и я с в я з и определяется, исходя из термохимических (по теп­
лотам образования, сгорания, гидрирования и т. д.) или из спектральных
данных.
Знание энергии связей необходимо для суждения об их прочности,
а следовательно, и о возможности той или иной реакции. Следует заме­
тить, что прочность связей (термодинамичес"ий фа"тор) определяет
направление реакций только в состоянии равновесия. При удалении от
состояния равновесия прочность связей уже не является решающим фак­
тором в определении направления реакции. Оно зависит от "инетиче­
с"ого фа"тора
-
энергии активации.
Энергетические уровни в атоме. Орбитали. В современной органической химии при
объяснении реакционной способности оргаиических соединений широко используются
кваllтово-механические представлеиия о строении атомов и молекул. Из квантовой механики
известно, что электроны в атоме располагаются преимущественно в пределах некоторых
стационаРflЫХ орбиталей, раЗЛII'lающихся запасом энергии. Положение электрона не мо­
жет быть точно определено. Квантовая механика позволяет находить только вероятность
пребывания электрона в том или 11НОМ положении относительно ядра (плотность «электрои­
ного облака»).
20
в основе KBaHT0801, механики лежит 1/0лно(юе уравнение Шредингера (см. курсы физи·
1\11 и
Ф /IЗИ'lескоЙ хим 1111 ). позволяющее определить волновую функцию электрона 'V, характе·
юшую его энергию.
РIIЗi<вадрату волновой ФУIIIЩIIII 'V 2 придается физический смысл в е р о я т ~ о с т и пр е 6 ы .
в а н /1 Я эл е к т р о н а в определенном месте пространства. Вычисляя 'V по трем коорди·
ным осям относительно ядра атома, находят форму орбllтали данного электрона.
нат
функция
Ijf для
•
каждого электрона по координатным осям может нметь положительныи
или отрицательный знак (что не имеет никакого отношения к знаку заряда). Квадрат этой
Ф нкции, естественио, всегда положителен.
у В органической химии рассматриваются преимущественно семь низших типов знергети·
ческихуровней (орбиталей ):
Is, 25, 2р, 35, 3р, 3d, 45. Для s-орбиталей вероятность нахожде­
ния электрона на определенном расстоянии от ядра во всех направлениях одинакова, т. е. эти
ор6итали имеют сферическую симметрию (рис.
5).
~
q05Z9~0
Рис.
5.
Схематиче­
ский вид электрон­
Рис.
6.
2,0
11М
Зависимость электронной
~
Рис.
7.
Схематиче­
ПJ\ОТНОСТИ от расстояния от ядра
ское изображение
в атоме водорода
лектронного облака
IЮГО оБJ\ака
2S·0рбитали
IS·YPoBHeii
Вероятность нахождения электрона на определенном расстоянии от ядра можно предста­
BlfТl, графически (p/IC. 6). Для уровня 1" эта вероятность имеет максимум на расстоянии от
ядра О/ЮJlO
0.053 нм. ВОJ\новая
= о (рис. 7).
lIоверкност[, с Ijf
фУНlЩия
Ijf,.
ПОJ\ожительна. Орб"таль
2" содержит узловую
В атомах имеются три одинаковых по энергии р-орбитали, оси которых (рх, р,ц'
pz) взаим­
но перепендикулярны (рис. 8). Протяженность р-орбиталей, имеющих форму гантелей, от­
носится к протяженности s-орбитали, как 3 : 1. Орбитали d-электронов имеют еще более
сложную форму. Вероятность нахождения электронов вблизи ядрад.nя всех типов орбиталей
равна нулю.
х
Рис.
8.
Схематическое изображение электронного облака трех р-орбнталей
На каждой орбитаnн может находиться не более мух электронов, причем обязательно
- nринциn Паули. Такие электроны рассмат­
РIJваются как спаренные.
1.
с Противоположно направленными спинами
2. КаЖдаЯ новая орбlпаль заполняется только после того, как будут заполнены все пре­
ДЫдущие, БОJ\ее YCToii':IIBble орбflтали.
21
,3.
ЗiщолнеНllе орбllталей равноН
согласно которому
':IHeprlIII происходит в соотвеТСТВИII с праВllЛОМ Гунда,
':IJ1eKTpOHbI заполняЮТ ·~ти optil!TaJ1lI возможно более равномерно. CHa'la-
ли каждУЮ орбиталь заtшмает ОДI!Н элеl(ТРОН, и только тогда, когда на всех орбllталях уже бу­
дет по одному :~леКТРОIlУ, на ннх может размеСТI1ТЬСЯ ВТОРОI1 электрон с противоположным
СПIIНОМ.
Tal(,
если имеется несколько р·орбllталеЙ равной
':IHeprllll 11 два
::Iлеl<трона, то они заiiмут
две ор6итали (по одному Э.llектрону), ПРИ'lем будут IIметь одинаково направленные спины.
Электроны отталкtlВ1IIOТСЯ друг от друга (заряжены одноименно ) и, следовательно, рас­
полагаются по возможности
(ec.ll1I орбитаЛII
не ОТЛИ'lаются по энергии) на раЗНl.lХ орБИТIIJ1ЯХ.
Дпя атомов первых деСЯТl1 элементов ТАМИЦЫ Д. И. МенделееВА размещеНllе :~el(TpO­
нов 1111 атомных орбlПМЯХ представлено в таБJI. 1.
т А б.ll Н Ц 11
1.
Электронные оболочки первых десяти элементов
таБЛИllЫ Д. И. Менделеева
ЭлемеllТ
и его
Энергетические УРОВIIИ и ЧИСJlО
порядковый
ЭJIектронов
"омер
22
IН
n=1
2Не
11=\
3Li
n=2
n=1
4 Ве
n=2
11=1
5В
n=2
n=1
6С
n=2
17=1
7N
11=2
n=1
80
n=2
11=1
9F
11=2
n=1
\ONe
11=2
11=1
+
Обозначеllие
ЭJIектронного
СО(.'ТОЯIIИЯ
Is
* +---
* -**-- -**+
**++ -**+++
***++
****+
*****
Is2
\s22.\·
--
Is 22.';
Is22.';2p
1.';2s22p2
Is22?2p:1
/s22.-.:J2pl
/.~22.~22pr.
\s22s22pl;
теория молеКУЛЯРНblХ орбиталей. Теория резонанса. Для того 'IT06bl
вознИКЛil химическая связь между атомами, они должны при6лизиться друг
к другу. При таком сближении на определенном расстоянии между ядрами
происходит «перекрывание» электронных оболочек: ЭJlектроны попадают
междУ ядрами, теряют энергию, атомы притягиваются, образуется хими'/е­
~J{ая связь. При дальнейшем сближении ядер начиняет сказываться оттал­
кивание между ними и потенциальная энергия вновь возрастает. Минимум
потеНЦИiiЛЫЮЙ энергии системы на кривой энергия
ядрами oTBe'laeT длине ХИМИ'lеской связи " (рис.
расстояние между
-
9).
Квантово-мехянический анялиз явления
Е
образовяния химической связи требует ре­
шения уравнения Шредингера применитеЛl,­
но
к
молекуле,
т. е.
для
всех
электронов,
участвующих в образовании связи. Точное
решение возможно только для ионизировян­
ной молекулы водорода. Поэтому при
pac'lc-
те других молекул приходится прибегать к
приближенным решениям, точность которых
непрерывно
r
r,
PIII:. 9. ПотеlЩI1ИЛЫIЯЯ энергия
Е СlIстемы I\Ю( ФУНIЩНЯ
межъядерного РЯССТОЯНI1Я г
орбшnалеt1 (МО) и
возрастяет
по
мере
совершен­
ствования расчетных методов с применени­
ем ЭВМ.
В квантовой химии в настоящее время ис­
пользуется два таких приближенных метода.
Они носят назвяния .метода .моле"улярных
Memoda валентных пар. Первый из них удобнее для
КОЛИ'lественных рясчетов, особенно при ИСПОльзовании ЭВМ. Второй бо­
лее УДОбен для качественных рассуждений, тяк как использует 06ычную
символику органической химии. Оба эти метода
-
не более
'leM матема­
тические приемы приближенного решения уравнения Ll1редингера приме­
'"fТслыю к молекуле и сами по себе не являются доказательством верно­
сти I<яких-либо наглядных представлений. Последние в зна'lительной сте­
ПеНИ создаются химикями на основе
использования соответствующей
kbaflTOBO-ХИМИЧ~СКОЙ терминологии.
П оргянической химии мы встре'lаемся с тремя видами ковалентной
СВЯЗИ: простой (ординарной), двойной и тройной. Сначяла мы рассмотрим
IIРСН:ТУЮ а-связь.
Природа О'-свяэи. Применительно к методу МО образование ХИМИ'lе­
Щой ковалентной связи представляется как переход двух электронов с
iITOMHbtX орбиталей на связывающую молекулярную орбитаЛl> БОJlее низ­
I(oii 'Iнергии. При этом в обычных раС'lетях ПРИIНlМllется, 'по новая моле­
~(УJIЯРНЯЯ волновая функция
'l'MOJI
является Jlинейной комбинацией двух
<ITOMHbIX функций (приближение ЛКАО). СУММИРОВlIние двух атомных
ФУ/lКlЩЙ дает
\1,
Т'МОJl
связывающей молекулярной.
орбитали:
•
Энергия электронов на связывающей орбитали ниже, чем энергия тех'
:
же двух электронов на атомных орбиталях.
Разность атомных волновых функций дает волновую функцию разрых;~
ляющей (антисвязывающей) орбитали:
",'
мол =N2('I' , -
'1').
Здесь N 1 и N2 - так называемые константы нормализации. Энергия пары'
электронов, занимающих эту орбиталь, выше, чем энергия электронов на '
двух исходных атомных орбиталях (рис. 10).*
.
/
/
,
ф.
\
\
Ф~
1
\
МОJl
\
/
\
Н
\,
/
, t;~ол
J
I
,+ф
I
/
2
ф.-t-<.',
.
/
, "'101011
t
I
I
I
I
>-+-""
1"'101011
6
4J
Рис. 10. Волновые функции ~TOI\1HЫX И моле"улярных орБИТi!леii:
а -
RfJ:tМУJJ1f,.'JlИL' 1Jf.'''ВШ"О JlоrЩДКtf; (j -
Н":Jму.щmllt' IIТОIШ"О "OI))1дка
Таким образом, при образовании (J-связи две атомные орбитали (АО)
заменяются двумя молекулярными орбиталями (МО). Связывающая МО
(рис.
11
а) имеет между ядрами повышенную электронную плотность и
симметрична относительно оси между ядрами и зеркальной плоскости
между ними. Разрыхляющая МО (рис.
(",2
11
б) имеет между ядрами узел
= О) И не увеличивает, а уменьшает энергию связи между атомами: по­
падающие на нее электроны дальше от ядра, чем в случае свободных ато­
мов. Разрыхляющая МО симмеТРИ'lна относительно оси между ядрами.
и антисимметрична
относительно зеркальной
плоскости
между
ними ..
На эту орбиталь электроны попадают только в результате возбуждения
молекулы (увеЛИ'lения ее энергии по сравнению со стационарным состоя-,
нием), а также добавочные электроны (помимо тех, которые уже образу­
ют связь).
IТ\
LDG':L
ff'\
~
\J+\J~~~~tJ
Рис. 11. Cxel\1~ обр~зов~ния а-связи Прll переl\РЫВilНIIИ s-орбит~леit:
u· -
СIIЩI.II'ИIОЩИ,1 МО;
fi -
РЮlн.IXJI'IIОЩ311 МО
*
В последние годы в ОРГ~НИ'lес,(ой ХИМШI Прll l(ВilнтовомеХ~НИ'lеСI(IIХ p~c'leT~X успешно
IIспольэуется метод возмущения МО (Дж. Дью~р). Обр~зов~ние НОВЫХ молекулярныХ
ор6ит~телеii Р~ССМ~ТРИВilется K~K возмущение ~lмеЮЩIIХСЯ ~TOMHЫX или молекулярныХ
орбllТilтелеЙ. что позволяет оспольэов~ть П~Рilметры последних в Рilсчет~х 11 Зli~чительно иХ
упрощает. H~ рис. 10 изображены ДB~ возможных способа возмущеНl1Я. КОГДil '1" 11 '1'2 м~ло (а)
и СIIЛЬНО ОТЛli'I~ЮТСЯ по знеРГИ11
24
(6).
Взаимное перекрывание s- и р-орбиталей может быть осуществлено
мя способами (рис. 12), причем способ а не ведет к образованию свя-
дву
. связывающее
зи.
u
u
и разрыхляющее связь взаимодеиствия в верхнеи и ниж­
ней ветвяХ гантели взаимно компенсируются.
-~а
~~
~---~
б
Рис.
12. Схема перекрывания s- и p-орбllТалей:
u. -
Ilсt;НЩИ.IВИIOIЩШ МО;
(j -
СШI:·Н.Ш(tющсш МО
Перекрывание двух р-орбиталей возможно двумя способами, каждый
из которых при водит к образованию связывающей (а) и разрыхляющей
(б)
молекулярных
орбиталей.
В
одном
случае
образуется
а-связь
(рис. 13а и б), а в другом л-связь (рис. 14а и б).
а
Рис.
1З. Схема перекрываНI1Я р-орбиталей
с образованием а-связи
в теории валентных пар энергия молекулы вычисляется как энергия
JIИнейной комбинации энергии нескольких валентных структур, ОТЛИ'IaЮ­
ЩИхся друг от друга только положением электронов. Возможность рас­
Пределения электронов различными способами рассматривается как ста­
БИJIИЗИРУЮЩИЙ фактор: делокализация электронной плотности ведет
к выигрышу энергии. Особенно стабилизируется молекула, если для нее
ВОЗможно несколько способов распределения электронной плотности
Р<IВНой энергии.
Валентные структуры молекулы, ОТЛИ'lВющиеся только расположени­
ем электронов (но не ядер), называются граничными структурами.
25
-8-+ -ffi---ffi
~
- . . . -.... ----+--
V
а
--------1.- -- ..... ---.... --_
РIIС.
14.
Схема перекрывания р-орбиталей с образоваНliем л-связеii:
а
-
~,'>I:II"BНlOI'LНI, МО: (j -
I'И:Ч""ХJIIII"IILЮ' МО
Реально они не существуют. Реальное состояние описывнется кнк нало­
жение (суперпозиция, резонанс) гряничных структур. Так, например, са­
мую простую молекулу водорода можно описать как резонанс граничных
структур (~ знак резонанса):
н+н- н Н-Н+.
В теории ваJlентных пар (резонанса) отдельные атомы не утрачивают
свою индивидуальность, как не утра'lИвается и предстаВJlение о реальных
носителях связи
-
электронных парах между атомами. Поэтому резонан­
сные представления с успехом используются при качественной оценке ре­
акционной способности оргаНИ'lеских соединений.
а-Связи и геометрия молекул. Гибридизация. Атомы хлора, кислоро­
да и азота могут образовывать ковалентные связи с другими атомами,
например, с атомами водорода, путем перекрывяния их одноэлектронных
р-орбиталей с s-орбитаJlЯМИ атомов водорода, и этим опредеJlяется гео­
метрия образующихся молекул.
В СJlучае хлора его единственная одноэлектронная р-орбиталь будет
пере"рываться с 1S-0рбиталью водорода. Две другие заполненные (двух­
ЭJlектронные) орбитали хлора должны расположиться под прямыми угла­
ми к связи Н -CI и друг к другу. Молекула НСI имеет линейное строение.
При образовании а-связей между атомами кислорода и водорода пере­
крываются 1S-0рбитали атомов водорода с двумя находящимися под пря­
мым углом друг к другу одноэлектронными р-орбиталями атома кислорода.
Таким образом, угол между двумя НО-связями должен составлять
В действитеш,ности он несколько больше
-
около
90·.
105· (рис. 15).
И няконец, при образовянии молекулы аммияка из трех атомов водоро­
дя и одного ятома азота перекрываются три р-орбитали атома азота, рас­
положенные под прямыми углами. с 1S-0рбиталями водородя. Следовате­
льно. в молекуле аммияка углы между а-связями должны быть равны
26
90·.
в действительности они составляют около 1ОТ, однако молеКУJlа сохраня ет ожидаемую пирамидаЛЫIУЮ с:руктуру.
Итак, при образовании связеи элемент
водород, геометрия молеку­
-
лы в принципе отвечает расположению орбиталей, причем никакого пере­
распределения электронов между орбиталями не происходит.
Рнс.
15.
Схемltтическое 11зобрltжеНllе элеl\ТРОННЫХ состояний атомя углеродя:
II -
()СIЮШro~: (j -
s/i'.I'НUРI1./tIЮС
в случае атомов углерода а-связи образуются более сложным спосо­
бом. В изолированном атоме углерода в его основном состоянии L-обо­
ЛОЧЮl имеет строение
2s22Px2p!l. Поэтому углерод должен быть двухва­
лентным элементом, так как
011
имеет
TOJlbKO
два неспаренных электрона.
Если предположить, что один электрон сорбитали
2s поднят (с затратой
энергии) на свободную орбиталь
2Pz, углеродный атом должен приобрести
электронную структуру 1s22s2Px2p!l2Pz с одним неспаренным электроном
на каЖдОЙ орбитали L-оболочки (рис.
16). При этом он должен быть спо­
собен образовап. ковалентные связи с чеТЫРI,МЯ другими атомами, напри­
мер с атомами водорода. Но три 2р-орбитали могут перекрываться доста-
Рис.
*
16.
*++-
*++++
СхематичеСl<Ое 11зо6ражение
·:lJleKTpOHHbIX состояний ItTOMIt углерод;l:
Точно хорошо, например с 1S-0рбиталями трех атомов водорода. Пере­
крывание же 2S-0рбитали с 1S-0рбиталью четвертого атома водорода не
Может быть достаточно полным по пространственным условиям. В ре­
Зультате этого должны образовяться три прочные углерод-водородные
Связи и одна слабяя. Соглясно квянтово-химической теории тякяя молеку­
ла образоваться
не
может.
Все
\leTbIpe
связи
С-Н должны
быть
равноценными.
В валентных состояниях углеродных атомов (т. е. в тех состояниях, кото­
рые имеют место в молекулах) электроны оказываются ряспределенными
не на чистых s- и р-орбиталях, а на смешянных или тяк называемых гиб­
ридных орбиталях (Полинг). Гибридные орбитали имеют более высокую
Энергию, чем s-
и р-орбитали,
но они
выгоднее
геометрически д.nя
27
образования I:ВЯЗИ, так кяк эффективнее перекрыва.
ЮТI:Я 1: орбитаJIЯМИ других атомов и, следоватеJlЫIO, об­
разуют поле е прочные связи.
ПОСКОJlЬКУ ХИМИ'lеская I:ВЯЗЬ тем прочнее, чем бо­
льше
перекрывание
орбиталей,
ковалентння связь
Вl:егда имеет такое направление в ПРol:транстве,
РIIС.
17.
Моде.%
s/-гнбрндного t:ОСТОЯ­
лей при данном межъядерном раI:I:ТОЯНИИ.
у атомн углерода в MOJleKYJle метяня СН 4 четыре
2s2Px2py2pz заменяются че-
НIIЯ '~леlПронноii обо-
JIO'IЮI ~TOMiI углеРОДi1
ко­
торое нниБОJlее СПОl:обl:твует перекрыванию орбита­
чисто атомные орБИТНJlИ
тырьмя гибридными орбитаJlЯМИ одинякового вида и
рявной энергии (РИI:.
17). Эти орбитали имеют концентрацию электрон1101'0 оБJlака ВДОJlЬ некоторых осей, напраВJlенных к вершинам правильно­
го тетря':lДРН (под углом 109028'), и ЦИJlИНДРИ'lескую I:имметрию относите­
лыю ':Iтих осей.
Эllергия, lIеобходимая для перемещения ЭJlектронов Уl'леродного атома
1: ЧИI:ТО атомных орбиталей (основного состояния) ня гибридные орбита­
JlИ, 1: избытком компенсируются энергией образования более прочных
связей
( 427,1 х 4 ::: 1708,4 кДж).
Таким образом, четыре простые (ординарные) ковалентные связи в ме­
тане образованы перекрыванием четырех тетраЭДРИ'lеских (гибридных)
орбиталей нтомов углеродн с IS-0рбиталями атомов водородн. Атом угле­
рода в молекулах метана и других нясыщенных углеводородов находится
в состоянии sр:~-гибридизации·.
Принцип свободного вращения по а-связям. Конформационный
анализ. ПРОl:тая а-СВЯЗI, в принципе допускает свободное вращение
окружающих ее атомных группировок. МОJlекулы органических соедине­
ний БJlагодаря теПJlОВОМУ движению непрерывно меняют свою форму. От­
деJlbl-lые состояния, через которые проходят эти молекулы, получили на­
звнние конформаций. Изомеры, возникяющие при заторможенном вра­
щении нтомных группировок вокруг а-связи, называются ПО/JороmН/J/АШ
u:юмераМll И.IНI КОНфОРN,ерам/.l. Они представляют собой одно и то же
вещество и 11меют одну и ту же СТРУЮ'УрнуlO фОРМУJlУ. Выделить такие
конформационные изомеры в алифаТИЧСI:КОМ ряду в
cJlY'lae НИЗI<ОМОJlеку­
JlЯРНЫХ веществ невозможно.
Однако конформации, возникающие в процессе свободного вращения
вокруг простой связи как оси вращения, имеют неодинаковую устойчи­
вость. Некоторые из поворотных изомеров оказываЮТI:Я энсргетически
БОJlее выгоднын •. В таких состояниях
MOJleKYJlbI пребываlOТ БОJlЫlJее
*
ПОIISIТllе «ГllБРIIДН:i~ЦНIР) введено в i\Вi1НТОВУЮ ХIIМIIЮ ТОЛl.i\О i\Иi\ митеМНТllчеСlшi1 ПРllем.
Иt'IIOJIЬЗUВНlше его д.ля модельных IlредстнвлеНllii не являетс!! ПРОГlIМ. ВО:JМОЖНЫ
i\ВНIIТОlЮ-ХIIМII'lеСКllе расчеты 11 бе:J ввrдеlil1Я I1реДСТilВлеНllii о ГllБРllДlIЗНЦlIII орбllтзлеi'l.
Ili1I1Hule фОТО'>Лt'i\ТРОННОII Сllеi\ТРОСi\ОПIIII Уi\<!:iШ13ЮТ нн неРИВНОllенносТl, 'leTbIpex с-Н
СВЯЗl'ii в метине.
вР
еМЯ . Следовятельно, в действительности мы няблюдаем не вполне сво-
60дное врящение: оно окязывяется зяторможенным в преДПО'lтитеJII,НЫХ
состояниях.
Для гязообразного этана возможны, например, среди бесконечного количесТВЯ других следующие два крайних положения метильных групп
(ПР~lведены перспективные формулы и формулы Ныоменя -
вид молеку­
лы «с торна»):
'
НН
Н
Н
.;/н
1;1
н
I
Н
нХК
н
н
ндн
Н
н
88торможенная форма
1Н
Н
saслонениая форма
«3яторможенная» формя для этяна окязывается более выгодной, чем
«зяслоненняя», тяк кяк электронные оБОЛО'lКИ атомов водородя ВЗЯИМIЮ
ОТТi!ЛКИВЯЮТСЯ. Одняко переход зяторможенной формы в зяслоненную
требует в случае этаня около 12,6 I<ДЖ/МОЛI> энергии, '!то няходится на
уровне энергии теплового движения. Для бутана возможно два типа за­
торможенных кон формаций:
антн-конформер
C:KowellHble
конформер ..
Нз-за пространственного отталкивяния между метильными группами
анmu-конформер БОJlее УСТОЙ I IИВ (на
3,8 кДж).
Чем больше различия междУ атомными группами, связянными между со­
бой простой связью, тем больше разница в УСТОЙ I IИВОСТИ поворотных изоме­
РОВ. Тяк, например, в СЛУ'lяе дихлорэтана зяторможеюшя формя молекулы
ВЫГОДllее знслоненной ия 18,8 кДж/моль, в слу'raе гексаХJlОРЭТЯНН -
lIa
46,1 I<ДЖ/МОЛЬ:
н
CI~H
H~l
Н
88торможеНllая форма
(Cl)
Н
(H)~.(Н)
Н
Cl
заСЛОllеllllа я форма
2!)
Чем ниже температура, тем меньше энергия теплового движения и,!
следовательно, тем большее число молекул вещества находится в виде бо­
лее устойчивого поворотного изомера.
В соединениях с несколькими углеродными атомами благодаря враще­
нию вокруг простых связей форма углеродной цепи непрерывно изменяет­
ся. Зесь также существуют предпочтительные кон формации, и число мо­
лекул, находящихся в этих конформациях, возрастает с понижением
температуры.
Только в некоторых случаях поворотные изомеры низкомолекулярных
веществ не могут переходить друг в друга при обычных температурах
вследствие
ограничения свободного вращения объемными атомными
группировками. Тогда возникает стереоизомерия (гл. 25).
Изучение особенностей и условий существования поворотных изоме­
ров получило название конформационного анализа.
Природа двойной связи. 1t-связь. Помимо тетраэдрической sр3_ гибри­
дизации, характерной для углерода в насыщенных углеводородах, воз­
можны также гибридные орбитали и других типов. Так, при образовании
двойных связей в молекулах ненасыщенных соединений мы встречаемся с
гибридизацией одной s- и двух р-орбиталей углерода с образованием трех
эквивалентных
(рис.
18).
гибридных
орбиталей,
называемых
sр2- 0р биталями
КаЖдая из них имеет цилинидрическую симметрию относитель­
но одной из трех осей, расположенных в плоскости под углом
В реальной молекуле этилена угол Н-С-Н равен
Рис.
120°.
116,7°.
18. Схема образования sp' -гибридного состояния
Ось чертвертой атомной р-орбитали, не затронутой гибридизацией,
расположена под прямым углом к плоскости, в которой лежат три оси
sр2_ ги бридных орбиталей.
Перекрывание трех гибридизованных орбиталей с орбиталями других
атомов дает уже рассмотренные а-связи. Перекрывание двух негибриди­
зованных р-орбиталей между собой дает так называемую 1t-связь.
Связывающая МО в этом случае имеет две области высокой электрон­
ной плостности (по одной С каЖдОЙ стороны плоскости, образованнойдву-
30
я связями). Она антисимметрична относительно оси, соединяющей оба
м
ядра,
и
симметрична
(см. рис.
•
относительно зеркальнои
14).
плоскости
между ними
.
Разрыхляющая МО имеет две узловых плоскости. Она симметрична
относительно оси, соединяющей ядра, и антисимметрична относительно
зеркальной плоскости между ними.
тс-Связь менее прочна, чем О"-связь, так как р-электронные орбитали с
параллельными осями перекрываются значительно меньше, чем при об­
разовании теми же р-электронами или s-электронами О"-связи (перекры­
вание по оси орбиталей). Общая прочность (О"+тс)-связей в этилене со­
ставляет 607,1 кДж/моль, в то время как для О"-связи между двумя угле­
родными атомами в этане она составляет 350,0 кДж/моль. Разница
257,1 кДж/моль является приблизительной мерой прочности тс-связи.
Таким образом, двойная связь представляет собой сочетание 0"- и
те-связей. Последняя обладает максимальной прочностью, когда молекула
имеет пленарную (плоскостную) конфигурацию. Для поворота в молекуле
этилена (рис. 19) одной группы СН 2 относительно другой группы СН 2 во­
круг оси С - С необходимо приложить энергию, достаточную, чтобы ра­
зорвать тс-связь и вернуть два электрона на отдельные р-орбитали. Энер­
гия молекулярных столкновений при обычной температуре для этого не­
достаточна и потому вокруг двойной связи нет свободного вращения.
Рис.
19.
Схематическое изображение строения молекулы этилена
Длина олефиновой связи (О"
+ тс-связь)
между двумя ненасыщенными
углеродами в алкенах меньше, чем длина простой О"-связи в насыщенных
углеводородах
(0,154
нм), и составляет
0,134
нм. Это понятно: чем боль­
Ше концентрируется электронное облако между ядрами, тем более сильно
они стягиваются.
Природа тройной связи. Кроме рассмотренных sрЗ_, или тетраэдриче­
екай, гибридизации и
третий
sp2_,
вид гибридизации
или тригональной, гибридизации, имеется еще
-
комбинация
одной
2S-0рбитали
и
одной
2P-О Р битали. Образуются две эквивалентные гибридные sр-орбитали,
СИмметричные относительно оси р-орбитали, использованной для гиб­
РИдизации (р),
и
расположенные
в
противоположных направлениях
(РИС. 20).
Другие две р-орбитали (ру' и pz), расположенные под прямым углом друг
к другу, не участвуют в этой гибридизации. Если два углеродных атома,
Находящихся в таком состоянии, соединить вместе так, чтобы sр-орбиталь
31
одного
перекрывалась sр-орби­
талью
другого,
то
образуется.
прочная а-связь (рис. 21).
Одновременно две другие не­
гибридизоваанные р-орбитали у
каждого атома углерода образуют
Sft
~
.
Х
1,93
а -
двумя углеродными атомами опи­
сывается в рамках этой теории
как сочетание одной 0'-
п-связей (рис.
а
Рис.
меж,ду собой две п-связи. Таким
образом, тройная связь междУ
20.
и двух
21 ).
6
Если вторая sр-орбиталь каж-
Схема sр-гибридизации:
дого атома углерода использова-
«смешивание» (<<наложение») s- и р-электронных
орбиталей; б - sр-гибридизированные орбитали
на для образования а-связи с
атомом водорода, образуется мо-
лекула ацетилена. В каждой молекуле атомы углерода и водорода лежат
на одной прямой, молекула является линейной.
Тройная связь ацетилена менее прочна, чем можно было ожидать из суммы
а-связь
+ 2п-связь (этиленового типа).
Энергия углерод-углеродной связи
в этане 35'0,0 кДж/моль, в этилене 607,1 кДж/моль, а в ацетилене
822,7 кДж/моль. Разница энергий связи для ацетилена и этилена
215,6 кДж/моль, т. е. меньше, чем для этилена и этана
(257,1 кДж/моль). Длина тройной связи 0,120 нм, т. е. меньше, чем двой­
ной
(0,135
нм) и тем более простой
(0,154
нм).
Квантово-химические представления об образовании ординарных, двой­
ных и тройных связей хорошо объясняют появившиеся еще в прошлом сто­
летии стереохимические тетраэдрические модели этих видов связи, однако
в отличие от последних они позволяют понять различия в химическом пове­
дении каждого из видов связей, в частности склонность этиленов к реакци-
!
•
ям электрофильного, а ацетиле-
нов
-
нуклеофильного присое­
динения (см. ниже).
Строение ионов и радикалов
Большинство реакций органи­
ческих
I-Ч
ОДни
Рис. 21. Схематическое изображение строения
молекулы ацетилена (ядра атомов углерода и во­
дорода на одной прямой, две 7t-СВЯЗИ между ато­
мамиуглерода находятся в двух взаимно перпен-
дикулярных плоскостях)
32
соединений
проходит
меж,ду молекулами, меж,ду моле­
кулами и ионами или меж,ду мо­
лекулами и свободными радика­
лами. Поэтому наряду со знани­
ем современных представлений о
строении молекул необходимо и
знание
строения
ионов и радикалов.
органических
Какие же ионы могут дать важнейшие атомы, входящие в состав орга-
еСК ИХ соединений (С, Н, N, О, галогены)?
Ка р б е н и е в ы е и о н ы. Атом углерода в определенных условиях
может потерять один электрон с образованием положительно заряженноо карбкатиона - карбениевого иона. Образование карбениевого иона
нич
~озможнодвумя путями: при гетерополярном разрыве простой С-Х-свя­
зи И В результате присоединения какого-либо катиона по двойной связи.
С этими двумя процессами мы встретимся во многих разделах этой
книги.
В карбениевом ионе орбитали оставшихся трех электронов распо-
лагаютСЯ в одной плоскости под равными углами
(рис.
..
-ё-
I
*
- sр2_ ги бридизация
22).
-н-+++
,
Рис.
22.
+le-
*
I
I
-1
-с-
++++
а
е-
*
..
+
-с-
I
+++
6
Схемы электронных состояний углерода:
а - атома (тстраЭДРИ'lсская. sp'-гиБРИJ\ИзаЦИ>l); б - карБОllиевого ИОllа (ТРИГОllaJIЫШЯ, sр'-гибридиэация;
в - карGаllИOllа (тетрагоllаJlыlя,' sp'-гиGРИДllзация)
в растворах карбениевые ионы могут находиться в свободном состоя­
нии или в виде ионной пары. Простые алкильные карбениевые ионы весь­
ма
неустойчивы,
+
причем
устойчивость
их
уменьшается
в
ряду:
+
Нз C»R 2 CH >RCH;, однако они могут давать устойчивые соли с суперкислотами, например:
(СНз)зСН + SbF5 + FSОзН ~ (СНз)зС+ + SbF6S0~ +Н 2 .
Устойчивость карбениевых ионов определяется сверхсопряжением
(с. 47-48) и индукционным эффектом (эффектом поля). Стабильные кар­
бениевые ионы рассматриваются в гл. 15 и 27.
Карбениевые ианы вступают в следующие виды химических превраще­
IIИЙ: присоединение соединений и ионов со свободной электронной парой;
изомеризация (в сторону образования третичного карбкатиона); потеря
Протона от соседнего атома; присоединение по кратной связи.
Атом углерода может также присоединить один электрон и дать карб­
анион. В карбанионах центральный углеродный атом имеет свободную
пару электронов и, следовательно, несет отрицательный заряд. Указан­
ный атом находится в состоянии sр3_ ги бридизации. Неподеленная элект­
РОнная пара занимает одну из вершин тетраэдра: карбанионы имеют пи­
рамидальную структуру.
2 Зах. 181
33
Устойчивость карбанионов тем выше, чем сильнее сопряженная с HIf~
кислота, образующаяся в результате присоединения протона (о сопряжен;; l'
ных кислотах и основаниях см. гл. 1.4). Поэтому алкильные карбанионы, кal(
и карбокатионы, весьма неустойчивы и существуют в растворах в виде ион.,:
ных пар или сольватов. Сольваты характерны для полярных растворителей,::
ионные пары различной степени устойчивости (контактные или тесные, рык.';
лые или сольватно-разделенные) - для неполярных растворителей. В соль- I
ватах ка>IЩЫЙ ион полностью изолирован от противоиона молекулами рас.:
творителя. В ионных парах взаимодействие между противоположно заря.:
женными ионами в той или иной степени сохраняется. Этот вопрос подробно
рассматривается в курсах общей и физической химии.
Определенная косвенным путем устойчивость алкильных карбанионов
убывает в следующем ряду:
СН з - СН 2 >(CH~)2CH >(СНЗ)ЗС.
Она значительно возрастает при сопряжении электронной пары с крат­
ной связью, с ароматическим кольцом, при введении в молекулу электро­
ноакцепторных группировок и при возрастании s-характера карбанионно­
го углерода.
Образование карбанионов может происходить при гетеролитической
1.4) диссоциации ковалентной связи и в результате присоединения
(гл.
анионов по месту кратной связи.
Главнейшие реакции карбанионов
-
соединение с электронодефицит­
IIЫМИ частицами и присоеДИllение по кратным связям.
С образованием карбениевых ионов в этой книге мы встретимся во
многих разделах (ацетиленовые углеводороды, кетокислоты, ароматиче­
ские соединения, небензольные ароматические системы и др.).
и о н ы н е к о т о р ы х Д р у г и х э л е м е н т о в. Атом азота, потеряв
электрон, при обретает валентное состояние атома азота в аммонийном
ионе с тетраэдрической структурой (рис.
23).
Присоединение одного элек­
трона к атому азота дает отрицательный двухвалентный ион.
-N-
+lе-
•
I
*+++
**++
*
CI
Рис.
а
-
-1 е-
-N-
*
23.
6
iJ -
атома а:юта; в
1+
I
-N-
++++
Схема электронных состояний:
lUIyxnaJI~IITllOrO а:ют·аШlOна;
•
-
*
•
иона аммония
Атом кислорода может потерять один электрон и перейти в валентное
состояние кислорода в оксониевом ионе. При этом он напоминает по
строению атом азота. Оксониевые ионы легко образуются при действиИ
34
т на кислородсодержащие органические соединения. Присоединив
кИСЛ Орон атом кислорода образует одновалентный «гидроксильный» аниэлект
,
он (рис. 24).
+1 е-
0-
*
,
Рис.
а
-
атома
KIfCJIOPOJI/I; 6 -
*
24.
-lе-
-о-
*
•
,
Схема электронных состояний:
«оксиnыюго» (lIапример, гидроксиnыюго); в
-
ОКСОIIИС80ГО иоиа
и наконец, атом фтора, потеряв один электрон, превращается в двух­
валентный катион, а присоединив электрон, - в обычный анион фтора
(рис.
25).
Переход в двухвалентный катион более всего характерен д/lЯ
иода.
****
,
*
+
-1 е-
р-
-Е'-
а
Рис.
25.
а - атома фтора; 6 -
Схема электронных состояний:
двухвanеН11IОГО фторкаТИОllа; а
-
аниона фтора
Аналогично ионизируются и атомы других элементов. Для того чтобы
правильно понять механизм реакций тех или иных органических соедине­
Ний, необходимо знать возможный характер ионизации атомов в молеку­
лах этих соединений, так как смещение электронной плотности в молеку­
ле, приводящее к ее поляризации, может происходить только в направле­
Нии образования рассмотренных здесь ионов.
С в о б о д н ы е о р г а н и ч е с к и е р а Д и к а л ы. Частицы, имеющие
один или несколько неспаренных электронов, называют свободными ра­
ДИкалами. Наибольшее значение в органической химии имеют свободные
раДИкалы с неспаренным электроном на атоме углерода. Атом углерода,
несущий неспаренный электрон, находится в состоянии sр2_ ги бридизации
и, следоватеJlЬНО, имеет плоскую структуру.
В зависимости от строения свободные радикалы имеют различную
УСТойчивость. В большинстве случаев это крайне лабильные частицы.
Так, время полураспада радикала СН з в метанольной матрице при 77 К
равно 10-15 мин. Устойчивость свободных радикалов возрастает в ряду:
.
.
.
СН з -СН 2 «СНЗ)2СН«СНЗ)З С.
35
Сопряжение неспаренного электрона с кратными связями или бен-,
зольными кольцами увеличивает УСТОЙ'IИВОСТЬ р:щикалов. При налични.
у атома углерода с неспаренным электроном трех бензольных колец радИ •.
кал становится способным существовать в "астворах в равновесии с дн­
мером неопределенно долгое время (см. гл.
25.2).
Свободные радикалы могут быть идентифицированы химическими мето­
дами, но наиболее достоверный способ их идентификации
-
это наблюде­
ние сигнала неспаренного электрона в спектре электронного парамагннт­
ного резонанса (ЭПР). Радикалы благодаря наличию электрона с неском­
пенсированным спином проявляют парамагнитные свойства. В сильном
магнитном поле неспаренный электрон может находиться в одном из двух
спиновьiх состояний. При облучении системы радиоволнами определенной
длины волны происходит переход неспаренного электрона из одного спино­
вого состояния В другое, с более высокой энергией. Поскольку на такой пе­
реход затрачивается энергия, в спектре появится сигнал. Спектры ЭПР по
своему происхождению аналогичны спектрам ямр (см. выше), только
в
первых фик.сируется
а в спектрах ЯМР
-
изменение
в спиновом состоянии
электронов,
парамагнитных ядер.
Свободные радикалы являются обычными промежуточными продукта­
ми многих реакций органических соединений, особенно в газовой фазе.
Они образуются при термическом и фотохимическом разложении органи­
ческих веществ, при окислении и восстановлении и в других реакциях.
К важнейшим реакциям свободных радикалов относятся: отрыв от мо­
леКУJI преимущественно атома водорода, присоединение по кратным свя­
зям, разложение, перегруппировка, соединение двух радикалов.
При окислении радикалов образуются карбениевые ионы, при восста­
новлении
-
карбанионы.
Со свободными радикалами мы встретимся во многих разделах книги
(крекинг, реакции замещения и окисления алканов, присоединения и по­
лимеризации алкенов, восстановления карбонильных соединений и др.).
Стабильные свободные радикалы рассматриваются в гл. 25.2.
Формулы и модели молекул органических соединений
Структурные формулы. Все естественные науки, в том числе и органи­
ческая химия, для описания относящихся к ней явлений используют мо­
деЛЫlые представления.
Модели отражают какие-либо определенные
стороны реальной действительности, но не являются ее фотографиями.
Наиболее
'laCTO в
органической химии в качестве моделей используются
обычные структурные формулы. Они правильно отражают объективно
существующий порядок чередования ядер в молекуле, но ничего не говорят
о ее других свойствах. Согласно теории химического строения каждое
вещество имеет строго определенное химическое строение. В то же время
одной и той же брутто-формуле может соответствовать несколько ве­
ществ
36
-
столько, сколько можно построить молекул из данного количест-
атоМОВ' учитывая правила валентности. Все они будут имеТl> разное хи­
.кое строение и разные структурные формулы. j3ещества, тождествен-
Ba
мичес
по
H~
u
•
составу и молекулярнои массе, но отли"ающиеся по химическому
"
К
строению, называют изомерами. ак уже ОТМС"8ЛОСЬ (:м., с. 15), MOlyr, например, существовать два вещества с брутто-формулои С 2 Н 6 О:
Н
Н
Н
Н
I
I
I
I
н-с-с-он
I
I
н
н
и
н-с-о-с-н
I
I
н
н
д1tМСТИJIIIIII.lii "фир
":ПИJШIИJIJi CllltpT
(А)
OНlI
являются
(Б)
структурны­
МИ изомерами. Другие струк­
тypllbIe формулы из этих 9 ато­
мов без нарушения правил ва­
лентности
построить
нельзя.
Структурная теория позволяет
предусмотреть, сколько может
органических
существовать
веществ с данным составом
и
кзково их строение·.
Пространствеlшые (стерео­
химические ) формулы и мо­
дели. При решении вопросов,
связанных
с
пространствен­
строением
IIbIM
.,....--..,...,.8
(стереохи­
мией) органических соедине­
IIИЙ, используются различные
способы изображения их стро­
ения
113
плоскости
чертежа.
Наиболее часто используютсн
Проекционные
и
IП
ик-_-а
nерсnек.­
f1l118ные формулы с раЗJIИ'IНОЙ
Степенью приближенин к реа­
JILlIOMY расположению атомов
I! 11POCTp<1HCTBe. С этими спо­
СОбi'lМИ
изображенин
IV
про­
СТР<lIiственного строения мо­
леКУJI МЫ будем еще неодно-
Кратно
Рi'lЗJIИЧНЫХ
КУрса.
-------
встречаться
в
разделах
этого
•
6
Рllе.
26, РаЗЛII'lные мuдели молекул мстана (1). 'на·
Ila (11), 'iТllлсна (111) 11 ,ЩСТlIЛСllа (lV); тетра'ЩIJlt'lС­
ские (а). стеРЖlIсвые (б). Стюарта -
БРllглебil (11)
ОДllако не все :1ТI1 вещества MOryт 6bITL. получены в деЙСТВllтеЛL.НОСТlI,
37
Более наглядное и точное представление о стереохимии молекул opгa-~
нических соединений дают mеmраэдричес"ие модели. В настоящее вре-;
мя чаще всего применяlOТ два типа моделей: стержневые и заПОЛНЯЮщиеl
пространство.
В стержневых моделях атомы условно представлены шариками, а свя­
зи
-
соединяющими их стержнями. Иногда длина стержней делается
пропорциональной длине связей. Такие модели хорошо передают взаим­
ное расположение атомов в пространстве.
В начале 3О-х годов были предложены модели второго типа (модели
Стюарта
-
Бриглеба). Роль атомов в них играют шарики с радиусами,
пропорциональными ван-дер-ваальсовым радиусам атомов. В местах со­
единения эти шарики срезаны так, чтобы «межъядерное» расстояние
было пропорционально сумме ковалентных радиусов, образующих связь
«атомов». Эти модели кажутся более близкими к реальным молекулам,
однако они мало пригодны для анализа валентных углов и углов враще­
ния вокруг связей. Для этих целей обычно используются стержневые
модели. Модели различных типов изображены на рис. 26.
Стерические формулы (модели) молекул правильио отражают размещеиие ядер. составnяю­
щих моле ..'УЛУ атомов в простраистве. но ничего не говорят о природе связей и их реакционной
способности. МеЖllY тем плоскостные структурные формулы и простанственные модели МOJJе­
кул. абстракции. по современным представnениям весьмадапекие от описания реального состо­
яния МOJJекул, П03ВOJJИЛII nocтpOltTb все современное здание органической ХИМИII, синтезировать
cnожнеЙШllе при родные вещества и создать современную промышленность. Еcnи бы они не от­
ражали объективную реальность, все бы это было невозможным.
Долгое время химики при изображении химических реакций меЖllY органическими соеди­
нениями могли обходиться обычными структурными формулами, дополняя их раэnичными
правилами, ОПllсывающими реакuионную способность. С введением I! органическую химию
электронных представnений, с развитием общей теории реаКЦIIЙ органических соединений
появились неоБХОДIIМОСТЬ
11 возможность отображать в структурной формуле особенности
реакциоиной способности молекул.
Октетные формулы, Поскольку каждая ковалентная связь образова­
на парой валентных электронов, зная число электронов на внешней обо­
лочке атома, для любого органического соединения легко написать ок­
тетную формулу. В этих формулах учитываются только внешние ва­
лентные электроны атомов, как образующие, так и не образующие
химическую связь.
Соединения с ординарными связями:
н
H-t-H
н
или
-I
н
н:ё:н
А
н
н
H-t-LH
Й
h
I
Н-С-Сl
I
н
или
H:e:Cl:
А-
н
It.llОРИСТWЙ lleTII.II
38
н:ё:ё:н
АА
ltТa&
кетав
Н
нн
или
Н
I
Н
н-с-о-н или
н:ё:о:н
h
кети.llО.wI спирт
н-
Соединения с кратными связями (двойными и тройными):
Н
Н
Н
н)с=С<н H:~:~:H
н)с=о
этилен
Н-С-С-Н
H:~::~
иуравьииыll: альдегид
Н:СнС:Н
Н зС-С=N
HaC:Ci!N:
ацетОИИТРВII
ацетилен
Соединения с семиполярными связями
о
CH-N~
3
"'о
СН з :N::б:
СНз-N
:6:
=: С
CHa:N:iC:
lIетилвзоцианвд
иитрометан
Из приведенных формул видно, что каждый валентный штрих в струк­
турной формуле может быть заменен символом пары электронов. Октет­
ные формулы помогают понять строение и химизм реакций органических
соединений.
Мезомерные и резонансные формулы. Граничные структуры. Ок­
тетные формулы дополняют обычные структурные формулы представле­
ниями о природе химических связей и помогают решению вопросов, свя­
занных с реакционной способностью и механизмами реакций.
Для описания распределения электронной плотности в молекуле с по­
мощью структурных формул используют два приема: либо обычные струк­
турные формулы дополняют стрелками (прямыми и изогнутыми), отобра­
жающими направление и способ смещения электронной плотности (ме­
зо,мерные формулы), либо для одного и того же вещ€ства используют
несколько структурных формул, отображающих крайние (граничные)
смещения электронной плотности. Действительное распределение элект­
ронной плотности будет в этом случае промежуточным между граничными
структурами. Изображение одной молекулы несколькими формулами не
означает, что эта молекула существует в виде нескольких электронных
изомеров: все граничные структуры относятся к одной молекуле:
Граничные структуры
Мезомерные
811СТ8Т811ИОII
н
I
I
О
H-c-cf _
н
"О
н
I
I
~ н-с-с/
н
н
о
н """\1-'
i-c((~
~O
~O
н
хлористый ВИIIИЛ
39
Граничные структуры
Мезомерные
ДИВИНИJl
N I N 'ДНМСТНJl3МИlюаКРОJICIIII
в основе этих двух способов изображения органических молекул лежит
реальное явление: если электронная плотность в молекуле может быть
распределена несколькими способами, то все эти способы будут осущест­
вляться, так как перераспределение ведет к выигрышу энергии, к стаби­
лизации молекулы. В таком случае ни одно из возможных частных распре­
делений электронной плотности не может отвечать реальной молекуле.
Ей может соответствовать только некая гибридная формула, отражающая
все возможности с различными долями вероятности, или набор граничных
формул, отражающих все или по крайней мере главные из возможных
способов распределения электронной плотности. Использование неско­
льких граничных формул особенно необходимо, когда два или несколько
способов распределения электронной плотности не отличаются или мало
отличаются по энергии. С этим мы встретимся при рассмотрении химии
ароматических соединений.
Мезомерные и граничные формулы нередко позволяют качественно
описывать
реакционную
способность,
но
предсказательная
сила
их
невелика.
COBpeM~HHыe квантово-химические модели молекул дают возможность
во многих случаях не только описывать, но и предсказывать определенную
реакционную способность, однако и они не являются фотографиями объ­
ективной реальности (молекул).
Наиболее широко и успешно для расчета энергии молекул и переход­
ных состояний, а следовательно, для количественного определения реак­
ционной способности в настоящее время используется метод молекуляр­
ных орбиталей (МО). Однако модельные представления этой теории не
40
быть положены в основу изложения всей органической химии, ибо
М;faзначение - решение какой-либо математической задачи. Химики
:асто их преобразуют в соотв~тствии со своими конкретными представлени я
ми
, что
не является строгим подходом.
v
ТакИМ образом, в зависимости от решаемых задач в органическои хи-
м
ии используются различные модели молекул. Они все правильно отра-
жаю т те стороны о
б
v
ъективнои реальности, которые они призваны описы-
вать. Однако не следует рассматривать модели как реальные молекулы.
последние много сложнее своих моделей. Наши знания о них будут все
более и более уточняться. В этом коренная особенность познания объек­
тивной реальности, природы.
5.
Основы теории реакций
органических соединений
Химические превращения органических соединений характеризуются
Нilправлением, скоростыо и механизмом.
Реакции органических соединений, представляющих собой многоатом­
ные, часто очень сложные молекулы, в принципе всегда могут идти в не­
скольких (в частном случае в двух) возможных направлениях. Выражен­
ность какого-либо одного преобладающего направления характеризует
селективность реакции. Реакцию считают региоселективной, если об­
разуется преимущественно один из возможных продуктов реакции, и ре­
гuосnецифичной, если образуется исключительно один продукт. Направ­
ление реакции зависит от состава, строения, «реакционной организации»
вещества и от внешних условий. Решить вопрос о возможном направле­
нии реакции данного вещества в данных условиях помогают многочислен­
ные экспериментальные правила органической химии. Теоретически он
решается на основе общей теории химических реакций.
Некоторые вопросы общей теории химических реакций. Непремен­
ным УСJ!овием реакции между двумя частицами является их столкновение.
Однако не каждое столкновение приводит к химической реакции. Оно ре­
зультативно только в том случае, если сталкивающиеся частицы имеют
энергию, равную или большую, чем энергия, необходимая для осуществ­
ления реакции. Последняя называется энергией активации реакции.
ВеJlI\tlина энергии активации определяет возможность и скорость химиче­
ской реакции при данных условиях: чем ниже энергия активации, тем бо­
лее вероятна реакция. С константой скорости реакции энергия активации
Связана с известным из общего курса химии уравнением Аррениуса:
J:
k == Ае -RT.
ЭТИ элементарные представления приводят к важному следствию.
Между исходными соединениями и конечными продуктами реакции, ока­
Зывается, лежит резко отличное от них, так называемое переходное со­
стОяние (рис. 27). Главное отличие между молекулой и переходным со­
СТоянием в том, что последнему отвечает максимум энергии на потенциа­
льной кривой реакции, а молекулам исходного вещества и конечного
41
продукта
минимумы энергии. Молекулы находятся в стационарном со ...,
-
стоянии длительное время, переходное же состояние имеет время жизни
близкое к нулю, -
...
ЭТО В какой-то мере процесс.
с
1:
Хm) (КIJIJРI)иНillllа) реакции
Рис.
27,
КРIIВ~Я II:iменеНIIЯ потеНЦli~'
льноii энерпНl в ре~КЦfllt:
А
-
"t..~Щl·СТЩi;
IICXOJLIII,I.:
P~HKHII"';
С
'''Ш'рl'ЮI
". -
-
11Crl'XOjLllOt:
В
-
PIIC, 28.
ПотеНЦII~лuные
р~ктеризующие раннее
IIРОДУКТI.1
COliIНIIII1C;
It
I\pltBble, X~·
позднее пере·
ходные СОСТОЯНliЯ
ИКТliIIИl\lЩ l!.Il- ТСIIJЮIЮЙ
'''ффСКТ РСИКI\ШI
Внеравновесных процессах (далеко от состояния равновесия) направ­
Jlение и скорость реакции зависят только от значений энергии активации
альтернативных реакций (кинетический контрою.», Если в системе при
данной температуре нет необходимого количества молекул, обладающих
соотвествующей энергией, реакция не будет наблюдаться.
Энергия активации тем меньше, чем стабильнее переходное состояние.
Стабильность последнего,
ем
-
в свою очередь, определяется сопряжени­
возможностями перераспределениSl (делокаJlизации) электронной
плотности.
Итак, мы пришли к выводу, что для суждения о возможности того или
иного направления
реакции
необходимо знать структуру переходного
состояния.
Никакими физическими методами это сделать принципиально невоз­
можно. Параметры этого состояния могут быть рассчитаны лишь совре­
менными квантово-химическими методами с большей или меньшей степе­
нью приближения.
Суждения об особенностях переходного состояния могут быть сделаны
на основе nринцun.а ХЭ'м'монда, согласно которому оно должно быть по­
хожим по строению на исходные вещества (А) или на конечные продукты
(В). Если реакция экзотермична и переходное состояние (С 1) достигается
быстро, исходные вещества не успевают сильно измениться и переходное
состояние (С 2 ) достигается в самый последний момент акта химичеСl<ОЙ
реакции, то оно должно быть похоже на конечные продукты (рис.
28).
Характер переходного состояния определяет селективность (избирате­
льность) реакции. Обычно два или несколько реакционных центров в ис­
ходной молекуле мало отличаются по энергии. Альтернативные KOHe'IHbIe
42
кты ризличиются больше. Если это ТИК, то при р и н н е м переход·
ПРО~остоянии нельзя ожидать ЗНН'lительной избирнтелыlOСТИ. Нноборот,
НОМ С
при
поз д" е м
персходном
состоянии
из
б
ирательность
б
сМ .. нипример, хлорировнние и бромирование нлканов, гл.
(
удет
u
высокои
1.1).
ИтяК, глявным фяктором, определяющимннпрнвление нернвновесных
еИКЦИЙ оргиничсских соединений, является относительная устойчивость
~epeXOДHЫX сОСТОЯНИЙ (кинетичсский контроль). ПОСКОЛl,ку она зависит
не тОЛЬКО от составн и строения ренгирующих молекул, но и от природы
ристворителя, ННЛИ:IИЯ кнтализаторов или других добавок, напра"вление
химических реакции в первую очередь определяется реакцu.онноu. орга­
нu:uщuей вещества. Это понятие ВКЛЮ'lнет взнимное влияние нн струк·
туру переходного состояния всех компонентов ренкционной смеси, а тнк­
же внеЦIIIИХ факторов.
Строение всществн в той мере определяет его реакционную способность,
в КЯКОЙ оно окязывает влияние на ренкционную организнцию вещества.
В рявновесных процесснх энергии нктивнции реакций в обоих напрнв­
лениях мяло РИЗЛИ'lнются между собой и ннправление реакций опредеJIЯ­
ется относительной УСТОЙЧИВОСТЬЮ исходных веществ и продуктов ренк­
ции. Ренкция идет преимущественно в напрнвлении обрнзовнния более
УСТОЙЧИВЫХ продуктов. В этом случае в полной мере ответ на вопрос о нн­
flряв.nенин реакций днет СРНВllеllие знергий разРЫВНlOщихся и образуlO­
щихся связей (термодu.намuческu.Й контроль).
в l\Вянтовоii ХНМИlI ХНМllчеСКlJе реRКЦIШ траl\ТУЮТСЯ КАК нзмеllеНllе в РСi1Пlрующеii CIICTe·
ме СПОСО(\iI пеРI.'I(РЫВilНИЯ (смеШIIВ;III1iЯ) IIТОМНЫХ IIЛJI молекулярных ор6НТilлеi·l.
В TeupIIII молеl{УЛЯРНЫХ орбllТllлеii НII'IIIЛ!.НЫМ IIКТОМ кюкдоii ХIIМИ'lеСIЮН реаКЦНI1 (обыч·
но НiI СТilд1lJ1 переходного СОСТОЯllliЯ) С'IIПllется Лllбо
nepel{pbJBIIHlle
одноэлектронных
01'(\11'
T1Im~H (с пrЮТlIВОПОЛОЖНЫМII CnIIНIIMJI). лн60 перекрываНllе занятоii IIтомноi"l орбllТМllllЛJI
в ы с ш е ii :111 н Я т о ii молекулярноi'1 орбllТilЛII (а· IIЛI-I1t·тнпи) со свободноii атомнои ор6и·
TilJlblO IIЛII 1111 3 Ш е il в а к iI н Т Н О Й молекулярноii ор6J1Тilлью(а· IIЛJI1t·ТIlПil). nplI'leM пере·
J\РЫll1lЮЩllеся ор611ТilЛII не должны ОТЛIIЧilТЬСЯ по CIIMMeTpIIII 11 должны 6ыт!. 6ЛIIЗl\НМII по
УРОВJJЮ ·"неРПIII. По TeopllII К. ФУКУII В3<JlIмодеikтвуют толыю TilK HiI:lblBaeMbJe гfl{IНU'lНl~1!
IJр(i/IIIЩЛ/1 - НШI(iолее высокие по '"HeprlIIl 113 ЗilНЯТЫХ I1 111111 более НИ31ше по '"HeprllIi 113 BiI'
I,ннТlШХ. ПереI\РЫВilИII~ двух занятых ОР(\IПilлеii не ведет 1\ 06Р1l30ВilIII1Ю связи: ПРОIIСХОДIП
ОТТ ilJlJ\JJ Вillнt е .
Вопросы теории ХИМИ'lеских реакций подробно рнссматриваются в кур­
се физической химии.
Механизмы реакций органических соединений. ХИМИ'lеские реакции
мщу.. проходить кнк С обрнзовннием промеЖУТО'lIlЫХ продуктов, так и без
IJ~ГO. Путь, по которому осуществляется переход от исходных веществ
к КОllечным проДУктнм, называется механизмом реакции. Вопрос о мехн­
liНЗме ренкции решнется в настоящее время с применением ХИМИ'lеских
(преимущественно кинети"еских, стереОХИМИ'lеских и изотопных) и физи­
'Iеских методов. Нниболее нндежным доказнтельством мехннизма ренкции
ЯВЛнется обнаружение в системе промежуто'lНЫХ "нстиц в концентрации,
Обеспечивнющей наблюднемую скорость ренкции.
к.овнлентная связь между атомами А и В может быть разорвана, во-вер­
ilЫх, тяким образом. 'ПО электронная пнрн или делится между нтомами А и
4:~
В, или переД(lется одному из ятомов. В первом слу'ше Ч(lСТИЦЫ А и В полq
Ч(lЮТ ПО одному электрону и СТ(lIЮВЯТСЯ свободными Р(lДИК(lЛ(lМИ. ПРОИС~
ходит гомолumuческое расщепление свя:щ
д: 8-+д-
+
о,
-В.
'i
Во втором СЛУЧ(lе (lTOM А ЛИШ(lется элеКТРОН(I, который он преДОСТ(lВИЛ.
для оБР(lЗОВ(lНИЯ КОВ(lJlентной связи, и приобреТ(lет положитеJlЬНЫЙ за­
ряд,
(1
НТО М В З(lХВ(lтывнет об(l общих элеКТРОН(I (в том числе и «доб(lВОЧ­
ный» электрон) и приобреТ(lет ОТРИЦ(lтельный З(lРЯД. Поскольку дв(I об.
раЗОВ(lВШИХСЯ ИОН(I имеют Р(l3личные электронные структуры, этот тип рас­
щепления известен K(lK геmеролшnическое (ионное) расщепление связи:
А: 8 -+ (д)+
+ (:8)-.
При гетеРОJllпическом расщеплении оБР(lзовавшиеся чястицы облада­
ют ЭJlектрическими зщ)Ядами (ионы) и подчинены обычным заКОН(lМ элек­
ТРОСТ(lтического притяжения и оттаJlI<ИВ(lНИЯ.
В настоящее время раЗЛИЧ(lЮТ три тип(l ионного состояния частиц: тес­
ные ионные пары, рыхлые ионные П(lРI>I
t Р(lзделенные
'I(lСТИ1ЩМИ
P(lCTBO-
ритеJlЯ) и свободные ионы. Т(lКИМ обрнзом, оБР(lзующиеся ПРИ гетеролизе
КОВ(lленпlOЙ связи Ч(lСТИЦЫ могут быть в рюличной степени Р(lзобщены
между собой.
В отличие от ионов свободные Р(lДИК(lЛЫ не имеют электрических
зарядов.
K(lKOB меХЮIИЗМ реакции -
своБОДIIОР(lДИКЯЛЬНЫЙ ИЛИ ионный,
-
мож­
но установить, изучив условия, БЛ(lгоприятствующие течению ре(lКЦИИ.
Свобоонораоикальные реакции:
1)
инициируются
светом,
высокой
темпеР(lТУРОЙ
или
свободными
раДИК(lЛ(lМИ, обрюующимися при рnзложении других веществ;
2)
тормозятся вещеСТВ(lМИ, легко реагирующими со свободными ради­
К(lJIaМИ, например, Т(lКИМИ,
3)
4)
K(lK гидрохинон или дифениламин;
проходят в неполярных растворителях или паровой фазе;
Ч(lСТО имеют аВТОК(lТ(lЛИТИ'lеский
X(lp(lKTep
и индукционный период
перед ннчалом ре(lКЦИИ;
5)
в кинетическом отношении Ч(lСТО являются цепными.
Ионные реаКЦllи:
1)
К(lтализируются кислотами н основаниями и не подвержены вЛИЯ­
нию
CBCT(I ИЛИ свободных радикалов (в частности, ВОЗНИК(lЮЩИХ при раз­
ложении пероксидов );
2) не ПО}l.вержены влиянию акцепторов свободных Р(lДИК(lJlОВ;
:3) H(I ход ре(lКЦИИ ОК(lЗЫВ(lет влияние ПРИРОд(l Р(lстворителя;
4) редко ПРОИСХОДЯТ в П(lРОВОЙ ф(lзе;
5) кинетически являются большей ч(lстью ре(lКl~ИЯМИ первого
или вто­
рого ПОРЯДК(I.
Действие pe(lreHT(I ня молекулу ОРГ(lНИ'lеского соединения осуществля­
ется БJl(lГОД(lРЯ его способности ВЗ(lимодеЙСТВОВ(lТЬ с атомными ядрамИ
или с элеКТРОН(lМИ. Ре(lгеиты, которые ОТД(lЮТ свою электронную П(lРУ ДJlЯ
44
бразоВЯ!НiЯ связи с атомными ядрами других молекул, называютсн НУК­
~еофUЛЬNЫ.мu и~и элекmронодонорными.
Реагенты, деиствие которых связано с приобретением электронов (с
• ,тичным приобретением электронной пяры, которяя рянее принадлежя,ас
"
) нязывают электроФ ильными или
ла ПО'nНОСТЫО другои
молекуле,
элекmроноакцепторными.
ОчеНl, многие реякции происходят непосредственно между молекулями
органических с.оединениЙ. В тяких реакциях обрязование новых и разрыв
прежнИХ связеи в реягирующих молекулах происходят синхронно в цикли­
ческОМ переходном состоянии. Для реакций этого типа требуется значите­
JlЫЮ меНЫllая энергия, чем для реякций, включающих полную диссоция­
I(ИIO молекул, вступающих в реакцию, Такие реакции назывяются пери­
цtlКЛUfJескuми (см. гл. 1.3.).
Факторы, определяющие реакционную способность молекулы. Спо­
соБIlОСП, органических молекул к тем или иным типам превращений опре­
деляется прежде всего распределением и подвижносп,ю ЭJlектронов, т. е.
ЗЯВНСИТ:
зей;
1) ОТ постоянной поляризяции связей; 2) от поляризуемости свя­
:3) от сопряжеllИН; 4) от сверхсопряжения (гиперконъюгации)
*.
СОГШЮЮ современным представлениям теории электронных смеще­
нuй '7Iлектронная плотность в молекулах кяждого вещества распределена
в соответствии с химическим строением.
Ряспределеllие злектронной
плотности Q"-связи симметрично относительно оси, проходящей через
центры связянных атомов. В молекулах с рязными атомями электронная
ПJlОПIOСТ[, больше у атомов, облядяющих большим сродством к электрону.
Следствием этого является няличие у тякой связи частичного электриче­
ского момента диполя (дипольного момента) "".
В молекулях, подобных молекулям метяня, четыреххлористого углеро­
дя и др., все связи рявноценны и, следовательно, ряспределение злект­
РОНIIОЙ плотности симметрично. Такие молекулы не имеют диполыюго
моментя.
В молекуле хлористого метила CH~CI в ковялентной связи С-CI хлор
Имеет большее сродство к электрону, '/ем углерод. Следовятельно, поде­
JJeНIIЯЯ (обобЩСIIНЯЯ) пяра больше притягивается к хлору, чем к углероду, и
,.nеКТРИ'lеские центры валентных электронов и атомных ядер не совпадают.
(ОЗJt<lется электрический диполь с чястичным отрицательным ЗЩJЯдОМ lIа
пТОме хлора и чаСТИ'lНЫМ положительным зарядом на углеродном атоме:
&tН;,С
6-
_ _ CI.
IIоляризация одной кякой-либо связи в сложной молекуле оказывяет
В.:IIНlIIие 11Я состояние соседних связей, индуцирует ДИПОJlьные моменты,
. * З,щономеРliOСТlI в реillЩ11OННО11 спосоБНОСТlI ОрГilНll'lеСЮIХ coeAIIHeHllii, I\OTopble в "Toii
I\Hllrl' ТРЯI<ТУЮТСЯ КilК следствие сопряжения IIЛИ сверхсопряжения в СТilЦIIOI1i1РНОМ СОСТОЯНIIИ
MOMI\YJI. МОГУТ быть объяснены и ДРУГI1М путем - I1i1 основе преДСТilвлеНllii о гиБРIIДНЗilЦlIl1
ЯТОмов (Дж. ДL,ЮЯР. Б. М. Мllхяiiлов).
** ДIIПОЛL,НЫi'i момент оБУСЛОВЛllвяется ТЯI(же элеl<ТJJOННЫМII ПilрЯМII. не У'IЯСТВУЮЩIIМII в
ОБРЯ:JОВЯНIIII связеН.
45
однако значительно меньшие по величине. Такой эффект называется UН-l
дукционным эффектом и изображается прямой стрелкой по линии СВя-1
зи. Он оказывает существенное влияние на реакционную СПОСОБНОСТЬ'j
"
молекул.
Б молекулах симметрично построенных гомологов и производных эти­
лена электронное облако связи с=с имеет плоскость симметрии, распо-:
ложенную перпендикулярно к оси а-связи и проходящую через ее середи­
ну. Б молекулах несимметричных производных и гомологов этилена этот
вид симметрии отсутствует, электронное облако смещено в сторону более
электроотрицательной группы. Молекулы таких веществ имеют диполь­
ный момент. Это смещение электронной плотности может проявляться в
особенностях реакций присоединения (правило Марковникова).
Наряду с неодинаковым распределением электронной плотности весь­
ма важно, 'ITO связи отличаются друг от друга и по способности к перерас­
пределению электронной плотности в момент реакции под влиянием раз­
личных факторов,
т.
е.
поляризуемостью.
Существенным
свойством
7t-связи является ее высокая поляризуемость, значительно превышающая
поляризуемость простой а-связи.
Б молекулах с несколькими двойными связями строение и свойства
электронной оБОЛО'IКИ в значительной степени зависят от взаимного рас­
положения двойных связей. Молекулы с чере.дующимися простыми и
двойными связями обладают рядом специфических особенностей, резко
отличающих их от прочих молекул (см. гл.
1.3.). Такие
соединения приня­
то называть системами с сопряженными (конъюгированными) связя­
ми. Аналогичной особенностыо отличаются соединения, в которых ка­
кой-либо атом, имеющий неподеленную пару электронов, находится ря­
дом с углеродным атомом, образующим двойную связь.
Каждый из атомов сопряженной системы имеет р-электрон. Благодаря
взаимодействию всех р-электронов образуется единая сопряженная сис­
тема, которую нельзя рассматривать как состоящую из нескольких неза­
висимых двойных связей (рис.
а
29).
6
PIIC. 29. Схематическое lIэображенне строения молекул днвинила (а) и вид сверху (б).
I
2
3
4
2
3
ПереКРЫВ311ие электронных облаков ме>IЩY С-С и С-С больше, чем ме>IЩY С-С.
Явление сопряжения можно иллюстрировать на молекуле 1,3-бутади­
ена (см. гл. 1.3.). Если допустить, как в простейшем случае этилена, что
атомы углерода в молекуле бутадиена используют sр2_ ги бридные орби­
тяли д.nя образования а-связей, и если изобразить все атомы молекулы
46
зди ена лежащими в одной плоскости, то орбитали р-электронов вза­
БУТ nерекрываются, образуя описанную выше единую систему электроимно
•
нов. вследствиес пере распределения электроннои плотности д.лина пров молекулах с сопряженными связями меньше д.лины
И• связи С '.
б
nсТОOCTbIX С-С-связеи• в предельных углеводородах,
но
ольше д.лины
Ройной С-С-связи В этиленовых углеводородах.
дв Переход от молекул с изол~рованной системой связей к молекулам с
системой
сопряженных
связеи
сопровождается
уменьшением
энергии,
увеличением прочности молекулы.
Характерной особенностью молекул с сопряженными кратными связя­
ми является передача эффекта заместителей через цепь сопряжения на
значительные расстояния, качественно отличная по механизму от переда­
чи эффекта по цепи cr-связей (на небольшие расстояния).
В теории молекулярных орбиталей сопряжение связывается с весьма иизким уровием од­
ной из молекулярных n-орбиталей
'V., где все атомные орбитали перекрываются в той же
фазе (рис. ЗО).
Разрыхляющие
орбитали
'1':1---
СВЯЗblвающие
орбитали
Рис. зо. Схема молекулярных n-орбиталей l,З·бутадиена
Если непосредственно с ненасыщенной группой связана водородсодер­
Жащая группа, подобная метилу, то появляется особый вид сопряжения,
наЗываемый сверхсоnряженuем.:
Н-Ф-СН=СН2
Н
Сверхсопряжение (гиперконъюгация) проявляется в том, что атомы
ВОдорода радикала, связанного с ненасыщенной группой, являются БО./lее
аКтивированными (протонизированными): электронная плотность связей
С-Н метильной ;-руппы смещается в сторону двойной связи.
47
Взаимодействие электронов метильной группы сненасыщенной груп"
пой приводит к укорочению связи НзС-СН на
0,008
нм, к уменьшени.
"
теплоты гидрирования и к ряду других явлений.
В рамках квантово-химической модели сверхсопряжение описывается как боковое пере.!
крывание (частичное, слабое) орбиталей СН-связей с 7t-орбиталями кратной связи, как это
ПОl\азаllО на рис. 31 для одной из возможных конформаций.
Сверхсопряжение играет важную роль во многих
явлениях в органической химии.
Помимо электронных факторов на скорость и на­
правление реакций может сильно влиять и геомет­
рия молекул. Реакция с участием одних и тех же
центров могут протекать с различной скоростью в
зависимости от окружения центра. Неблагоприят­
Рис.
ные стерические эффекты называют nространст­
венными затруднениями.
Обсуждение
вопросов
реакционной способности
31.
Схема перекры­
вания орбиталей при
сверхсопряжении
органических
ве-
ществ только с учетом их строения не является строгим, так как на ско­
рость, направление и механизм реакций могут оказывать влияние и дру­
гие, 'шсто анализируемые факторы, в частности природа растворителя,
присутствие· катализаторов.
Классификация реакций органических соединений по характеру хи­
мических превращениЙ. Органические соединения способны к разнооб­
разным химическим превращениям. Направления превращения опреде­
ляются их строением и условиями реакций. Превращения органических
соединений могут проходить без изменения углеродного скелета или с его
изменением. Большинство реакций проходит без изменения углеродного
скелета. Это значительно упрощает изучение органической химии.
А. Р е а к ц и и б е з и з м е н е н и я у г л е р о Д н о г о с к е л е т а. К этому ТИПУ преВРRщений органических соединений относятся реакции:
1)
2)
3)
замещения,
4)
изомеризации.
присоединения,
элиминирования (отщепления),
РеRКЦИИ замещения характерны для всех классов и рядов органических
соединений. Замещаться могут атомы водорода или атомы любого другого
элемента (кроме углерода).
К реRКЦИЯМ присоединения способны только соединения, имеющие
крнтные связи между атомами углерода, углерода и кислорода, углерода и
азота, азота и азота и т. д., а также атомы со свободными электронными
парами или вакантными орбиталями.
Реакции элиминирования особенно характерны для соединений, содер­
жащих электроотрицательные группировки. Легко отщепляются (элими­
IIИРУЮТСЯ) такие вещества, как вода, ГRлогеноводороды, аммиак. В значи­
мере это СВЯЗRНО с большой энергией образования этих
тельной
соединений.
48
РеакЦИИ изомеризации без изменения углеродного скелета особенно
егКО идут тогда, когда в процессе какого-либо превращения возникают
л еакционноспособные промежуточные частицы, например, карбениевые
рно нь! . Весьма склонны к изомеризации непредельные соединения и их
производные.
Б. Р е а к Ц и я с и з м е н е н и е м у г л е р о Д н о г о с к е л е т а бывают
следующих типов:
1) удлинение цепи,
2) укорачивание цепи,
3) изомеризация цепи,
4) циклизация,
5) раскрытие цикла,
6) сжатие или расширение
цикла.
Существуют специальные приемы, позволяющие Уд,llинять или укора­
чивать углеродную цепь. Для Уд,llинения цепи используют реакции заме­
щения и присоединения с участием углеродсодержащих молекул. Обыч­
ными реагентами в этих реакциях являются синильная кислота и ее соли,
оксид этилена и его гомологи, оксид и диоксид углерода, галогеналкилы.
Методы укорачивания углеродной цепи это реакция крекинга или
реакции, включающие изомеризационные процессы. Известны реакции
УI<Ора'!ивания цепи с отщеплением NCN, СО 2 и других фрагментов.
Изомеризация углеродной цепи особенно часто наблюдается в реакциях,
сопровождающихся промежуточным образованием карбениевых ионов.
Замыкание открытой цепи в цикл возможно в процессах дегидрирова­
ют, элиминирования и особенно при электроциклических реакциях и
близких к ним процессах.
Возможность раскрытия цикла очень сильно зависит от числа углерод­
IIЫХ атомов в нем. Наиболее.часто оно достигается в реакциях гидрирова­
ния и окисления.
Сжатие и расширение цикла, как и реакции изомеризации, чаще всего
Происходит в случае промежуточного образования карбениевых ионов, а
также в результате внедрения в цикл карбенов.
Изучение условий и методов проведения и механизма всех эти типов
ХИМических превращений органических соединений составляет основное
содержание курса органической химии.
Номенк.лаryра реакций органических соединений. Дnя трех основных типов химических
~евращений органических соединений (замещение, присоединени~, элиминирование)
е>к.цународным союзом теоретической и прикладной химии (ИIОПАК) разработана систе­
маТическая номенклатура, причем в отличие от понятия реакция. включающего все реаген­
ты. Понятие nревращение включает только субстрат и продукт реакции. Приведенные при­
~epы позволяют назвать по этой номенклаryре любые из упомянутых в этой книге реакций
Указаl'НЫХ типов.
3 а м е щ е н и е. Название строится из названия входящей группы, префикса -де- и на­
ЗваИIIЯ уходящеii ГРУППЫ:
RHlg + H~~RH
+ HHlg Гllдро-де-галогенирование
-----• .Меж.цународнЫil союз теоретической и прикладной химии (lnternational Union of Puгe and
I
\
pplJed Chemistry - IUРАС).
49
RHlg +
H20~ROH
+ HHlg
гидрокси-де-галогеиирование
R-СНlg 2 -R " +H20~R-CO-R
R-СНlgз
+
2Н 2 О ~
R-COOH
I
+ 2HHlg оксо-де-днгалогено-дизамещение,~~
+ 3HHlg гиДРокси. оксо-де-тригалогено.,:
тризамещение
~
R-CO-OR' + H20~R-COOH + R'-OH гидрокси-де-алкоксилироваНие
R-NH 2 + HONO~N2 + R-OH гидрокси-де-диазотирование
R-Hlg + NНз~R-NН2 + HHlg амино-де-галогенирование
Аг-Н + Н2S04~Аг-SО20Н + Н 2 О
сульфо-де-гидрирование
Аг-Н + СН 2 О + HCl~ Аг-СН 2 Сl + Н 2 О
хлоралкил-де-ГИДРllрование
При с о е Д 11 Н е н и е. Название строится из иаименований обоих адцендов и СЛОВа
присоединение.
R-CH=CH 2 + Н 2 ~ R-СН 2 -СН З дигидро-присоедннение
R-CH=CH 2 + HIg2 ~ R-СННlg-СН 2 Нlg дигалогено-присоединение
R-CH=CH 2 + HHlg2 ~ R-СННlg-СН з гидрогалогено-присоединение
R-CH=CH 2 + НОН ~ R-СНОН-СН з гидро-гидрокси-присоедннение
R-C..CH + НОН~R-СО-СНЗ днгидро-оксо-диприсоеднненне
R-CH=CH 2 + СО + Н 2 О ~ R-CH 2-CH2-COH гИДро-формилприсоединение
R-CH=CH 2 + C1 2 +
Н 2 О ~ R-СНОН-СН 2 Сl
гидрокси-хлоро­
присоединение
R-CH=CH 2 +
R-SО2Сl~R-СНСl-СН2СО2R алкилсульфонил-хлоро­
присоединение
э л и м и н и р о в а н и е. Название строится из названия уходящей группы:
R-CH 2-OH ~ R-CHO + Н 2 С.О-дигидро-элиминирование
R-CH 2-CH 20H ~ R-CH=CH 2 + Н 2 О гидро-гидрокси-элиминирование
R-СН2-СН2Нlg~R-СН=СН2 + HHlg
гидро-галогено-элиминирование
R-СННlg-СН2Нlg~R-СН=СН2 + Hlg2 дигалогено-элиминирование
R-C-H~R-CN + Н 2 О
С-гидро-N-гидрокси-элиминирование
11
NOH
R-CO-NH 2---+ R-CN +
6.
Н2 О
N.N-дигидро-С-оксо-днэлиминирование
К.nассификация органических соединений
В зависимости от строения углеродной цепи оргаНИLlеские соединенИЯ
разделяют на соединения с открытой цепью (алифатический, или жир­
ный, ряд) и циклические. Последние делятся на две группы: карбоциклu­
ческие соединения (циклы состоят только из атомов углерода) и гетеро­
циклические (в цикл входят и другие атомы, кроме атомов углерода).
Карбоциклические соединения, в свою очередь, включают два ряда:
алициклический и ароматический. Ароматический ряд объединяет аро­
матические углеводороды - бензол, нафталин и т. д. И их производные.
В каждом ряду органические соединения делятся на классы в зависимО­
сти от состава и строения. Наиболее простыми представителями соедине­
ний алициклического и ароматического рядов являются углеводороды.
При замене атомов водорода в углеводородах на другие атомы или группы
50
ов (функциональные группы) образуются различные классы органи­
аТОМ х соединений данного ряда. Атомы-заместители и функциональные
~~
u
u
груППЫ определяют главнеишие напра~ления химических превращении
. анного
класса органических соединении.
Д углевоДОРОДЫ и их производные с одним и тем же атомом-заместите­
лем или с одной и той же функциональной группой образуют гомологические ряды.
гомологическим рядом называют бесконечный ряд веществ, отличаюш.иХСЯ друг от друга на любое число групп СН 2 (гомологическая разность),
имеюш. их сходное строение и, следовательно, сходные химические свойст­
ва. Суш.ествование гомологических рядов связано со способностью угле­
рОДНЫХ aTO~OB соединяться между собой в длинные цепи. Сходство хими­
ческих своиств гомологов значительно упрощает изучение органических
соединений.
Основные классы органических соединений.
1. Угеводороды (R-H).
11. Галогенопроизводные (R-Нlg).
ш.
Спирты (R-OH).
IV. Эфиры простые и сложные (R-O- R, R-CO-OR).
V. Карбонильные соединения - альдегиды и кетоны
VI.
VII.
VIII.
IX.
Х.
(R-CHO, R-CO-R).
Карбоновые кислоты (R-COOH).
Амины (R-NH 2 , R2NH, RзN).
Нитросоединения (R-N<?2).
Сульфокислоты (R-SОЗН).
Металлорганические соединения
(R-Me).
Число известных классов органических соединений велико нс развити­
ем науки оно все время увеличивается.
Во все эти классы входят как предельные вещества, так и вещества, со­
держащие кратные связи (непредельные или ненасыщенные). Наряду с
веществами, содержащими какую-либо одну функциональную группу, су­
ществуют соединения со смешанными функциями, т. е. содержащие в од­
ной молекуле различные функциональные группы.
Изучение органической химии начинают обычно с жирного ряда и с
наиБОJIее простого класса веществ
-
углеводородов.
Ч
А
С
Т
ПЕР
Ь
В
А
Я
Соединения
с открытой цепью
(алифатический,
жирный ряд)
1. УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ
С ОДНОЙ ИЛИ НЕСКОЛЬКИМИ ОДИНАКОВЫМИ
ФУНКЦИОНАЛЬНЫМИ ГРУППДМИ
ГЛАВА
1
УГЛЕВОДОРОДЫ
УглеводороЩ\ми называют самые простые органические соединения, со­
стоящие из углерода и водорощ\. В зависимости от характера углеродных
связей и соотношения между количествами углерощ\ и водорода они разделя­
ются на предельные и непредельные (этиленовые, ацетиленовые) и др.
1.
ПРЕДЕЛЬНЫЕ (МЕТАНОВЫЕ) УГЛЕВОДОРОДЫ
(АЛКАНЫ, ПАРАФИНЫ)
*
Предельными насыщенными углеводородами называют такие соедине­
IIИЯ углерода с водородом, в молекулах которых каждый атом углерода за­
трачивает на соединение с любым соседним углеродным атомом не более
одной валентности, причем все свободные (не затраченные на соединение
с углеродными атомами) его валентности насыщены водородом. Все ато­
мы углеродн находятся в sр:3_ ги бридном состоянии.
Предельные углеводороды образуют гомологический ряд с общей фор­
мулой С"Н 2 " + 2. Родоначальником этого ряда является метан.
* От
ЛiП. PUГllIll -
химическую инертность
52
мало. 1I uffinus IIмеЮЩllЙ сродство; наЗВlIние укаЗЫВllет HII
MeTIIHoBbIX углеводородов.
Изомерия. Номенклатура
предеЛl,ные углеводороды
с 11 =
1, 2
и
3
могут сущеСТВОВ<lТЬ ТОЛЬКО
в виде одного изомеР<I·
~
н-е-н
н
н
н
H-d-(~--H
н
н
МСI',Ш{II=I,
Н<lЧИН<lЯ
С четвертого
н
H-(~-(~-(~-+I
JI ~ JI
I I
JI
н
Illюшtll(II=:"
члеН<I
гомологического
РЯД<l,
с ЯВJlением структурной изомерии. Углеводород с 11 =
мы
встре"<lемся
4 (БУТ<lН) сущест­
вует в виде двух,
углеводород с 11 = 5 - в виде трех, углеводород
== б - в виде пяти структурных изомеров (см. ниже). Д<lлее число изо­
меров, K<lK это видно из Т<lбл. 2, быстро ВОЗР<lСТ<lет.
с 11
та
() ЛII
Ца
2.
Зависимость числа изомеров предельных уг.певодородов
от д.1IИliЫ l~еllИ
ЧИС,,10 атомов
•
цепи углерода
Число изомеров
1
2
3
8
9
10
15
20
25
30
2
4
5
Э
6
5
7
9
Число атомов
в цепи углерода
"исло изомеров
18
.15
75
4:347
3Э6 Эl9
36797588
4 111 846 76:~
ЧИСJlО изомеров ДJ1Я любого ГОМОЛОГ<l нельзя вblчислит') по К<lкоЙ-.пибо
формуле. ОДН<lКО существуют мятемятические приемы, которые позволя­
ют. Н<lпример, ВЫЧИСЛИТЬ число изомеров ДJ1Я гомологя с "ислом углерод­
ных <lТОМОВ, рявным
n + 1,
если известно число изомеров ДJ1Я углеводоро­
Д<I с числом углеродных атомов П.
И~омерня бутанов была IIсследовitнit А. М. Бутлеровым. Изомерные пентitны БЫЛII полу­
ЧеНЫ el'o учеНIII(ОМ М. д. Львовым: СI1Нтез всех 11зомерных renTaHoB был зitвершен к 1929 г.,
1I:IOMepIiLIX ОI<ТitIiОВ -- К 1946 г. Для ВЫСШIIХ гомологов получено в 'IIICTOM BllДe 110 lIескольку
IIЗомеров. И:iвестен, Hitnp"Mep, углеводород н-гектан CIIIIIH~II~ с т. пл. 115 'с.
Т<1кое большое число и многообразие структурных изомеров требует
'Iеткости в их няимеНОВ<lНИИ -
номенклатуре. В ОРГ<lнической химии
I1 С Г(ОJJ[,ЭУЮТСЯ эмпиричеСК<lЯ (тривияльная), Р<lЦИОНЯЛЬНЯЯ и систематиче­
СК<lЯ номенклатуры.
Тривиальная номенклатура -
ЭТО случайные названия органиче­
ских соединений, обычно укязывающие или ня их природиый источник,
I1JIИ на какое-либо их свойство, обратившее на себя в первую очередь вни­
М<1IIие химика, впервые полу',ившего это соединение. В настоящее -время
Тnк Н<lзывают ТОЛl,КО наиболее часто используемые соединения, l;Iапри­
Мер, ацетон, уксусная кислота и т. д.
Рациональная номенклатура учитывает строение называемого coe~
динения. Ее принципы менялись с течением времени. Так, в органическо
химии долгое время применялась номенклатура, основным принципом ко.
торой было обозначение всех изомеров и гомологов как производных
po't:
- метана. В на."1
стоящее время эта номенклатура под названием «рациональной» приме~~
доначальника ряда в случае предельных углеводородов
няется
только
в
тех
случаях,
когда
она дает
особенно
наГЛЯДНае;;
представление о соединеНИИ.J
Основные принципы систематической номенклатуры были приняТlil\
в 1892 г. на съезде химиков в Женеве. На последующих съездах в эту но.
менклатуру были внесены изменения и дополнения. Последние принципи,
альные изменения и дополнения были приняты на съездах химиков а
1957 г. и в 1965 г. и эта номенклатура получила название номенклатуры.
ИЮПАК. Она преимущественно и используется в этой книге.
Первые четыре предельных углеводорода с нормальной цепью (без раз·
ветвлений), когда каждый атом углерода связан непосредственно не более
чем с двумя другими атомами углерода, имеют эмпирические названия: метан
СН 4 , этан С 2 Н 6 , пропан СЗН S , бутан С 4 НIQ. Далее названия углеводородов
образуются из греческих и латинских числительных добавлений суффикса
-ан: пентан C5H12 , гексан C6H 14 , гептан C7H 16, октан
декан СIQН 22 , ундекан C11 H24 , додекан C I2 H26 и т. д.
C8H 1s,
CgH2Q,
нонан
Чтобы дать названия изомерам с разветвленной цепью, необходимо
знать наименования простейших одновалентных органических радикалов,
т. е. остатков, обращующихся в результате отрыва атомов водорода от
предельных углеводородов. Одновалентные радикалы называют, заменяя
суффикс -ан предельных углеводородов на -ил, например: алканы
лы, метан
-
метил СН з -, этан
СН з -СН 2 -СН 2 -,
таи
-
бутан
-
-
этил СН з -СН 2 -, пропан
бутил
-
-
алки·
пропил
СН з -СН 2 -СН 2 -СН 2 -,
пен·
пентил (амил) и т. д.
Если свободная валентность в радикале ПРИНaд,1Iежит атому углерода. не
имеющему или имеющему только одну непосредственную связь с углеродны·
ми атомами, то радикал называется nервичным. При наличии двух таких свя·
зей радикал называется вторичным, трех - третичным. Понятия пер·
вичный, вторичный, третичный и четвертичный часто в органической химиИ
относятся к углеродным атомам. Так, например, 2-метилпентан имеет три
первичных, два вторичным и один третичный углеродный атом.
От пропана может быть произведено два радикала (пропил и изопро·
пил), от бутанов - четыре радикала:
снз-tн-сн з изопропил снз-tн-сн 2-сн з вторичиый бутил
CH a- Н-СН 2-
т
СН з
54
изобутил
азвание изомеров с разветвленной цепью строятся следующим об-
Н
За основу принимается название углеводорода, которому соот­
pa~~;~yeT в рассматриваемом соединении самая длинная цепь. Эта цепь
ве ме уется, начиная с того конца, к которому ближе радикал-замести­
ну ь р В названии вещества цифрой показывают место радикала-заме­
тел .
стителЯ и называют заместитель, а затем называют углеводород, кото-
му отвечает главная цепь. Ниже приведены названия некоторых
~~леводородов по систематической, рациональной и эмпирической
номенклатурам.
Бутаны
*:
СН З
I
СНгСН-СНз
2-метилпропан,
н-бутан
триметилметан,
изобутан
Пентаны:
СН з
I
СН-С-СН
з I
з
2-Метилбутан.
н-пентан
СН з
диметилэтилбутан.
2,2-диметилпропан,
изопентан
тетраметилметан,
неопентан
Гексаны:
СН з
сн з - СН2-СНГСНГСНЗ -
I
СН з
СНг СН - СНг-СН2- СН з
2-метилпентан,
II-гексан
диметилпропилметан
СН з
СН з
I
СН:ГСНГСН-СН2-СНЗ
I
СН з
СН З
I
СНгСН- CH-СН з
3-метилпентан,
2,3-диметилбутан,
метилдиэтилметан
диметилиэопропилметан
I
СНГТ-СН2-СНЗ
СН з
2,2- диметилбутан,
триметилэтилметан,
неогексан
Радикалы с разветвленной структурой можно называть как замещен­
НЫе радикалы с нормальной структурой, например:
СН З
I
СН З
I
-СНГСН-СН-СН З
2,3-диметилбутил
---•
СН З
I
-СНГС-СНз
I
СН З
I
I
-СНГС-СН2-СНЗ
СН з
2,2-диметилпропил
СН з
2,2-диметилбутил
(неопентил)
РаДIIJ<алы переЧllСЛЯЮТ по алфавиту (метил, пропил, этил, и т. Д
).
55
Углеводород
СН:Г fH-СН2-ТН-СНГСН2-СНЗ
CH-СН з
СН з
I
СН з
...
\
~.
может быть назван' 2-метил-4-изопропилгептан или 2-метил-4-(
тилэтил)-гептан (систематическая номенклатура).
l-r.te.;
r.
Способы получения
Предельные углеводороды можно получить из соединений с тем же, Me~;
ньшим и большим числом углеродных атомов.
.
1. Предельные углеводороды с небольшим числом углеродных атомов
(до 11 ВКЛЮ'lИтельно) можно выделить фракционной перегонкой природ­
ного газа или бензиновой фракции нефти, или смесей углеводородов, по­
лучаемых гидрированием угля, а также гидрированием оксида идиоксида
углерода (см. Введение
2).
Предельные углеводороды, начиная с пентана, наиболее часто полу­
чают в лабораторных условиях каталитическим гидрированием этилено·
13ЫХ или более непредельных углеводородов с тем же числом углеродных
2.
атомов и таким же строением цепи:
RCH =
СН 2
Катализатор
+ Н 2 ---~ RСН 2СН з .
Непредельные углеводороды с заданным строением углеродной цепи
легче получать, чем предельные.
В качестве катализаторов применяют коллоидные или мелкодисперс'
ные металлы (Pd, Pt, Ni) при обычных давлении и температуре. В случае
никеля иногда приходится проводить гидрирование при повышенных тем·
пературе и давлении. В последнее' время очень часто используют как ката·
лизатор хромит меди Cu· ОСГ20з (под давлением), а также катализаторы
гомогенного гидрирования, прототипом которых является хлортрис(три'
фенилфосфин)родий [(С 6 Н s )Р]зRhСl. В присутствии растворимого ката·
лизатора присоеДИllение водорода к олефинам в различных растворителях
идет при комнатной температуре.
3. Предельные углеводороды получают восстановлением галогенопрО'
НЗ130ДНЫХ каталитически 130збужденным водородом, водородом в момент
выделения или с помощью восстаНОl3ителей, каким, например, является
иодистый 130ДОРОД
*:
С 2 Н 5СI + Н 2 -1~C2H6 + HCI;
ХЛОрlIСТЫЙ
этltл
+ 2Н ---+С 2 Н(; + HCI;
С 2 Н 5 1 + Н1---+С 2 Н(; + 12'
С 2 Н"СI
* ИОДI1СТЫЙ
ЭфllРЫ и др.).
56
водород восстанаВJшвает 11 КlIслородные соединения (кислоты. спиРТЫ'
м ЖНО также из галогенопроизводных получить магний органические
иОнения (см. гл. 9.2) и затем действовать на них водой или алкилгало­
соеД оМ (реакция Гриньяра):
ГеНИД
С 2 Н 5 1 + Mg---+С 2 Н 5 МgI
ИОДIIСТЫЙ
ЭТIIЛМ3П1иii
C2 H 5 MgI + H 2 0---+С 2 Нс,
C~H5MgI
4.
+R-
+ Mg(OH)1
Hlg ---+С 2 Н 5 - R + MgIНlg.
Синтез предельных углеводородов из соединений с меньшим чис­
ЛОМ углеродных атомов осуществляется действием натрия на галогено­
производные
-
реакция Вюрца:
2С 2 Н 5 1
+ 2Na ---+С 2 Н 5 -
С2 Н 5
+ 2Nal.
При действии на галогенопроизводные металлического натрия легко
образуются натрийалкилы, которые далее реагируют с галогеналкилами,
возможно, по механизму реакций нуклеофильного замещения второго по­
рядка (см. гл.
2.1):
R-CH 2-CI + 2Na ~ [R-CH2T Na+ + NaCI
R-CH; Na+ + R-CH 2 -Сl~R-СН2-СН2-R + Na+
Особенностью синтеза Вюрца является то, что в случае использования
в качес,ве исходных веществ различных галогеналкилов в результате ре­
акции получается смесь трех углеводородов:
~СНгСНз
СНаl + С2 Н 5 1 ~ С 2 Н 5-С 2 Н 5
СН:ГС2Н5
Эту смесь приходится разделять, что не всегда возможно. Поэтому сме­
си двух различных галогеналкилов вводятся в реакцию Вюрца редко.
При использовании реакции Вюрца как метода получения предельных
углеводородов необходимо иметь в виду, что с удовлетворительными вы­
ходами конечных предельных углеводородов реагируют только первичные
галогенопроизводные. В случае вторичных и третичных галогенопроиз­
ВОДных выход предельных углеводородов типа R-R' составляет всего не­
СКОЛЬКО процентов. Основной побочный процесс - отщепление галоге­
Новодородов от исходных галогенопроизводных под влиянием карбаниона
натрийорганического соединения с образованием олефинов (см. гл.
2.1).
Вместо натрия в этой реакции могут быть использованы и другие метал­
ЛЬ!, например литий, магний, цинк.
5. Лучшие результаты по сравнению с реакциями Вюрца и Гриньяра
дает недавно предложенный метод синтеза алканов с использованием
%IiТliйорганических соединений (гл. 9.1) и солей меди (реакция
ори
- Хауса).
При обработке раствора галогеналкила в эфире металлическим литием
ПОЛучают литийорганическое соединение, которое затем при действии
57
соли меди переводится в литиЙалкилкупрат. На последний вновь деЙСТ1
ют галогеналкилом:
R - Х + 2Li ---+ R - Li + LiX;
'. ,
2R - Li + Св! ---+ R 2Cu - Li + Li!;
R2CuLi + 2R' -1 ---+ 2R - R' +LiI + Cu!.
В случае первичных галогеналкилов выходы предельных уг леВОДОРОД()i
типа R-R' близки к 100%, в случае третичных -
30-50%.
~.'
К методам получения предельных углеводородов относится таюк.
электролиз солей карбоновых кислот: анионы кислот распадаются Q
аноде с образованием свободных радикалов, которые объеДИНяютсi
в молекулы более сложных предельных углеводородов - реа"цШi
Кольбе:
6.
R-СООNа?R-СОО-+ Na+
R-COO- ~ R-COO·
анион
радикал
кислоты
кислоты
R-CO-O·~R·+C02
:~
2R'~R-R
углеводо­
углеводород
родный
радикал
Физические свойства
Физические свойства предельных углеводородов, как и других органи­
ческих соединений, определяются их составом и строением.
В гомологическом ряду углеводородов с нормальной цепью четыре пер­
вых члена при обычной температуре
-
газы, далее следуют жидкости
и, начиная с С 16 Н з4 ,- твердые вещества (табл.
3).
Температуры кипения в гомологическом ряду возрастают, причем раз­
ность температур кипения ближайших гомологов все это время уменьша­
ется. Изомеры с нормальной цепью углеродных атомов кипят при более
высокой температуре, чем углеводороды с разветвленной цепью. Это объ­
ясняется меньшим взаимодействием между молекулами с разветвленной
цепью в жидком состоянии: ответвления от главной цепи создают про­
странственные препятствия для сближения молекул. Следует подчерк­
нуть, что углеводороды с разветвленной цепью имеют меньшую склон­
ность к комплексообразованию, например, с мочевиной. Поэтому нор­
мальные углеводороды можно отделять от изомеров с разветвленной
структурой й виде комплексов с мочевиной (промышленный метод).
В промышленности в последнее время все большее значеНllе приобретают методы разде­
ления смесей с помощью клаmраmов - соединений включения. Эти методы основаны на
различной способности молекул, отличающихся по форме и величине, размещаться меЖIIY
молекулами некоторых твердых веществ, имеющих слоистую или сетчатую кристаллическуЮ
структуру. Извлеченные в виде клатратов вещества достаточно легко освобоЖIIJIЮТСЯ
ОТ «хозяина». В нефтеперерабаТЫВllющей промышлеНlIОСТl1 наиболее широко используютСЯ
в Ka'lecTBe клатратообразователеli мочевина, тиомочевииа, некоторые комплексные соли
металлов, цеОЛIIТЫ 11 другие материалы.
58
Табл ица
3.
Физические свойства
IleKoтopblx предельных углеводородов
углеводород
Метан СН4
Этан C2 HI;
пропан СзНа
н-Бутан C4H 1O
Изобутан СНзСН(СНз)СН з
н-Пентан C5HI2
изопентан (СНЗ)2СНСН2СНЗ
Неопентан СНзС(СНз)з
н-Гексан Cr.H I4
Неогексан (СН З );jССН 2 СН з
н-Гептан
н-Октан
C7H 1G
C8H I8
Изооктан
.Пока,атмь
т. пл., ос
т. кип., ос
ПЛотность
182.5
-182.8
-187,6
-138,3
-159,4
-129,8
-159,9
-16,6
-95,3
-99,7
-90,6
-56,8
-107,4
161.6
-88,6
-42,1
-0,5
-11,7
36,07
27,9
9,5
68,7
49,7
98,5
125,7
99,2
0,4161
0.5461
0.5082
0,584'
0,563
0,626
0,613
0,660
0,649
0,684
0,703
0,692
1,3575
1,3537
1,3513
1,3749
1,3876
1,3838
1,3974
1,3915
-53,6
-29,7
10.0
36,4
150,8
174,0
270.5
205,0
(2 кПа)
0,718
0,730
0,765
0.777
1.4056
1,4120
1.4313
0,56з2
прe.nомлеИИR
1,3378'
1,3326
-
(СН з )ЗССН2СН( СН З )2
(2.2.4трнметилпентан)
н-Нонан С!lН 2 ()
н-Декан С)()Н 22
н-Пентадекан С I5 Н З2
н-Эйкозан С 20 Н 42
н-Гектан С)(ЮН2()2
115.2
-
(при т. пл.)
-
-
I
2 ПРII температуре кнпения.
В жид)(ом состоянни поддавлеНllем.
Температуры плавления в гомологическом ряду предельных углеводо­
родов медленно возрастают. При этом предельные углеводороды образу­
Ют два ряда: четных и нечетных гомологов. Температуры плавления чет­
ных гомологов обычно выше, чем унечетных (объяснение см. в гл.
6.1 ).
В ряде случаев изомеры с разветвленной структурой имеют более высо­
кие температуры плавления.
Первым твердым углеводородом (т. пn.
104 ОС) является один из изооктанов - гексаметилэтан (2,2,З,З-тетра­
метилбутан ).
Плотность предельных углеводородов вначале быстро, затем медленно
Возрастает до
0,78.
Предельные углеводороды -
вещества неполярные и трудно поляри­
Зуемые. Растворимость их в воде ничтожна.
Атомы в молекулах предельных углеводородов соединены только а-свя­
Зями. Расстояния между соседНИМИ углеродНЫМИ атомами 0,154 нм. В ко­
РОТких цепях по С-С-связям возможно свободное или почти своБОдНое
Вращение.
59
д.,IКЯНЫ ПОГJIOЩЯЮТ ультряфиолетовое излучение в облясти длин вол»
менее 200 нм (они бесцветные). В ИК-спеКJ"рях для них хяряктерны поло­
сы в обласJИ 2800-3000 ем- 1 (валентные колебяния евюи с-н)
1:380-1470 ем- 1 (деформационные колебания той же связи). Полосы
поглощения, отвечающие колебаниям СВЯЗи с-с, мяло интенсивны и
трудно идентифицируются.
ЯМР-Сllектры алканов трудно рясшифровываютея, тяк кяк химические
сдвиги различным образом расположенных протонов имеют близкие зна­
'Iения (около
0,5-2
м. д.).
Химические СВОЙства
Химические превращения предельных углеводородов могут происхо­
дить либо в результате ГОМОJlитического рязрывя цепи углеродных атомов,
Jlибо за счет отрывя ятомов водорода (тякже обычно гомолитического)
с последующим зямеLцением их другими аТОмами или группями. Поэтому
для
предельных углеводородов харяктерны
реЯlЩИИ
р а с щеп л е н и я
и
з я м е Щ е н и я.
Р,?СщеплеННR цепи по (j-СВЯЗИ С -с требует меньшей '1нергии, так
кяк эта связь менее
прочняя (350 кДж/моль), 'leM а-связь с-н
(420 кДж/моль) *, ОДlIЯКО химические реакции идут чаще с рясщеплением
связей С-Н, так Ю'IК с)ти связи доступнее действию реягентов.
ГIpoцeccы расщепления связей с-с или С-Н с обрязовянием сво­
бодных радикалов (см. ниже) требуют больulOЙ энергии яктивяции и пото­
му при обычной темперятуре идут только В присутствии кятялизаторов.
Предельные углеводороды при обычной температуре не реагируют с кон­
центрировянными кислотами, сильными ОК\iслителями.
Место вступления заместителя в молекулу предельного углеводорода
опредеJlяется в первую О'lередь вероятностыо образования и стябильно­
стыо возникающего рядикяля. Рядикялы со свободным электроном у тре­
тичного ятома углеродя более стабильны благодаря сверхсопряжению и
потому леГ'lе образуются (с.
35, 47).
В СООТветствии с этим реации заме­
щеllИЯ в большинстве случяев идут нзБИРЯl'елыlO, наиболее легко у тре­
тичного углеродного атома.
Ниже показяны рязличия в прочности СВязей С- Н первичного, вто­
ричного и третичного атомов углерода:
CoeДIIH~Hlle
Энергия СВЯЗII·ПрI1
()
К. l\дЖ/МОЛh
422.9
Э:39.8
401.9
Реакции зямещения могут протекап) по ионному или радикалыlOМУ ме­
хянизму.
Их
* ГIpllBcдef1Ы
60
условно
обознячают
буквой
S
(от
среДН11С :iI1Я'1еНI1Я '"неРГl1И евязеi\ с-с 11 с- Н.
лат.
Slll)stitlltio-
ение), нуклеофильное замещение -
замеШ ьное -
SN, электрофильное -
SE,
SR' Эти реакции схематически можно записать так:
радикал
+ С--;;.А:+ В:С (5 N )
+ С+-;;'А+ + В:С' (51)
А: В + с·-;;. А· + В:С (51~)
А: В
А: В
РеакцИИ предельных углеводородов обычно идут по меХ<lНИЗМУ SR'
Примеры таких ренций будут рассмотрены ниже.
1. Галогенировзние. 3нмещение водородных нтомов галогенн­
ми -
ОДН<I из нниболее харнктерных ренкций предельных углеводородов.
Предельные
углеводороды
вступнют
в
реакцию
со
всеми
галогенами.
Со свободным фтором ренкция идет со взрывом. Возможны взрывы И
В реакциях с хлором. Скорость галогенирования резко снижается в ряду:
F>
СI
> Вг > 1.
Ннибольшее практическое значение имеют фТОРИРОВЮiИе
и хлорирование.
Непосредственное взаимодействие углеводородов с фтором днет
yrJle-
еод и фтористый водород; свободный фтор вызывнет крекинг углеводо­
родной цепи, тнк как эта реакция силыlO экзотермична:
t:.H. IJlж/моль
158.8
Рнзрыв t:ВЯЗI1 С- Н трепует ЗIlТРЯТЫ ОIIOЛО . . . . . .
427.1
О(jРil30ВlIние СВЯЗИ С- F дяет ВЫllГрЫШ ',mерГlШ . . . . . . . . . . . -452.2
О(jРllзовяние молеl<УЛЫ H-F дает выигрыш энеРГIШ . . . . . . . . -569.4
Р~:ч)Ывы молеl\УЛЫ фТОРIl H~ IIТОМЫ требует заТРIlТЫ
Тнкнм обрнзом, ренкция идет с выделением теплоты 435,7 кДж/моль,
н дЛЯ РНЗРЫВН связи С-С требуется всего 350 кДж/моль.
Разбнвление фтора азотом или Ilрименение растворителей (полностью
фторированные углеводороды) позволяют осуществить реакцию неl10средетвенного фторирования с высокими выходами 1l0ЛИфТОРПРОИЗВОД­
ных -
ценных ХИМИ'Iески стойких веществ (см. гл.
2.2):
СН 4 + 4F~ ~CF4 + 4HF.
Фторировннные углеводороды можно получить тнкже с помощью неко­
ТОРЫХ неорганических фторидов, например трифторида кобальта.
Хлор реагирует с предельными углеводородам только под ВЛИЯНl1ем
Света, нагревнния (300 ·С) или в пристствии кнтализнторов, причем по­
СJJедовнтельно замещаются хлором все атомы водорода:
СН:!С1
+ CI~ ~
ХJЮРII~ТI.lii
MrTllJI
CH:tC1:t + CI 2 ~
снс):!
CH2C1~
+ неl
XJIOpliCTblii
Ml'THJll'll
+ нс)
ХJЮIЮф()РМ
СНС):!
+ Cl 2
~
CCI'I + неl
Т~Т!,ilХJl()!,IЩ
УI'Ж'!'()Дil
61
Реакция углеводородов с хлором зна'lительно менее экзотеРМИ'lНа, 'lе"
реакция с фтором. Это видно из следующих данных:
14
АН. кДж/мo.nь
Ризрыв молекулы хлори на атомы требует :iaTpaTbI.
HCI ..... .
242.8
427.1
-347.5
-4:31.2
ЭнергеТИ'lеский баланс реакции.
-108.8
Разрыв связи С- н требует затраты около.
Образование СВЯЗII С-CI
Образование связи
.,
При хлорировании наиболее легко замещается водороду наименее гид_
рогенизированного (третичного) атома углерода. Соотношение между
скоростями замещения (при 300 ·С) водородных атомов при первичном,
ВТОРИ'IНОМ и трети'IНОМ атомах углерода 1 : 3,25 : 4,3 *.
Поскольку nepBli'lHbIM актом радикального галогенщювания является отрыв атома водо­
рода от молекулы радикалом (или атомом) при радикальном галогеНliроваНliИ не галогенамн.
а другими галогеНltрующимI1
реагентами. последовательность отрыва может изменяться.
Так. npll фОТОХИМII'Iеском хлорировании изопентана N -хлор-ди-mреmбутиламином в H2SO.
атомы водорода у перви'lНОГО углерода замещаются в 1.7 разя быстрее. чем у третичного. а в
случае нормально построенных углеводородов преllмущественной атаке подвергается вто­
рой от края цепи атом.
При термическом хлорировании образуются все возможные изомеры
моно- и полигалогенопроизводных. Однако существует оптимальная тем­
пература, при которой моногалогенопроизводные получаются с наиболь­
шим выходом. Для получения монохлорпроизводных необходимо брать
большой избыток углеводородов.
Катализаторами реакции хлорирования являются многие вещества:
сера; иод; хлориды меди, сурьмы, олова, алюминия и других металлов. Эти
вещества не только ускоряют хлорирование, но и способствуют образова­
нию полигалогенопроизводных. ИСКЛЮ'lительное значение д.nя выяснения
механизма хлорирования имеет тот факт, что катаJlизаторами при хлори­
ровании являются вещества, образующие при температуре реакции сво­
бодные радикалы (например, тетраэтилсвинец).
В результате МНОГО'lисленных работ по фотохимическому хлорирова­
нию с несомненностью был установлен цепной радикальный механизм ре­
акции. Так, например, д.nя хлорирования метана Н. Н. Семеновым и дру­
гими пред.nожен следующий механизм (SR):
АН. кДж/моль
зарождение цепи
CH~-H+CI" --+CH~+HCI
CH~+CI2 --+ CH:P+CI"
CH~+CH~ --+ СН:!-СН:!
CH~+CI" --+ CH:.-CI
CI+CI--+ CI 2
* При
IlспольэоваНИl1
'~TIIX
}
242.8
4.2
рост цеПlI
-108.9
-370.5
)
даННЫХ
-368.4
обрыв цешt
для
-242.8
расчета
ОЖllДI!емого
состава
прОдУктов
хлорироваНllЯ необходимо У'IIIТЫВЯТЬ 'ШСЛО I<аждого вида атомов водорода в молеl<уле.
62
диссоциация. молекулы
хлора
на
атомы
требует
знтраты
около
, 2 8 КДЖ/МОЮ>, Такая диссоцинция может быть вызвана при Об~IЧНОЙ
атуре фиолетовым светом, поглощение которого молекулои при­
24,
TeMn:~ энергию порядка 29:3,0 кДж/моль. Для термической диссоциа­
дает молекулы хлоря на атомы необходима температура около зоо"с.
циИ
диссоцияция
молекулы
хлора
на
ионы
тре
б
ует
затраты
около
1130,2 кдж/моль.
РеЯКЦИЯ бромирования алканов значительно менее экзотеРМИ'II-lа, чем
хлорирование, что видно из приведенного ниже энергетического баланса:
!J.Н,I<дЖ/МОЛЬ
. . . . . . . . . . . 192,6
Рязрыв СВЯЗII С-Н требует заТрlПЫ ОI<ОЛО . . . . . . . . . . . . . . . . 427,1
Рязрыв молекулы бром1t на атомы требует затраты.
Об(J1tЗоваНllе СВЯЭИ С-Вг
ОБРЯЗОВЯНlfе СВЯЗИ Н -
Вг
. . . . . . . . . . . . . . . . . . . . . . . . . -293,1
. . . . . . . . . . . . . . . . . . . . . . . . . -:Ш6,4
ЭнергеТII'Iескиii баланс реаКЦИlI
. . . . . . . . . . . . . . . . . . . . . . -39,/1
Мехянизм бромирования при воздействии света или тепла, как и хло­
рирования, цепной, радикаЛl>НЫЙ:
tJ.Н, кДж/мош,
Hlg l ---+ 2Н Ig"
СН: 1 СН;
1-1 + I-Ilg" ---+СН;
+ Hl-Ilg
+ н Igl---+СН;Нlg + Hlg"
F
CI
В,"
158.8
242,8
192,6
150,7
-1:34,0
-4,2
67,0
138,2
-293,1
-108,9
-100.5
-83,7
Эндотсрмический характер первой стадии роста цепи является причи­
ной очень низкой по сравнению с хлорированием скорости бромирования
RJIKRHOB.
Фотохимическое бромирование обычно проходит значительно более
изБИР<IТСJlЬНО, чем хлорирование:
2(СI-I,,1,-СН + CI 2 ~
(CI-I"),,C-CI + (СН;)2СН-СНР
ПРИ'IИНН повышения избирательности в значительно более медленном
ТС'IСIIИИ реакции, благодаря чему переходное состояние больше похоже на
КОНсчные продукты (более сильно отличающиеся по энергии), 'leM на ис­
ХОДНЫе вещества (см. с. 42).
Точно так же со значительно большей избирательностью проходит
Вt:ТУП,lIение в молекулу второго атома брома: замещается водород преиму­
Щественно у соседнего атома углерода по отношению к бромсодержащей
ГРУi1пировке.
O'lCHb высокая эндотеРМИ'IНОСТl> первой стадии роста цспи реакции
i1 0Дирования алканов (138,2 кДж/моль) делает ее практически неосуще­
СТВИМой даже при температурах порядка :300 ·С.
Следует спеЦЮIЛЬНО подчеркнуть, что энергия разрыва связи в молеКJI
JIЯХ галогенов, снижяющаяся в ряду
F> СI > Вг > 1, не определяет c~
POcТl, галогенировяния ялканов.
Рястворители влияют ня скорость И селективность гялогеНирован,,­
неЗflЯ'lитеЛЬflО, за исключеflием случяев, когдя они образуют комплеКСblQ
галогенирующим агентом, что ведет к резкому увеличению селективносТ1t
из-зя снижения яктивности ятякующей частицы.
В преДСТllВлениях теОР11l1 МО реИКЦIIЯ ридикилыюго цепного ХЛОрllрОВIIНИЯ может быт..
описяня следующим оБРИЗ0М.
В молекуле ХЛОрll в результите получения 'iнеРП1fl (возбуждеНIIЯ) ПРОflСХОДI1Т переСТРОii.
I(Я cr· 11 cr*,молеI(УЛЯРfIЫХ
CI-CI ризрывяется.
орбlПllлеii в две одно,лектронные IIтомные орбlIТИЛИ. Связь
Молеl<улtt метана имеет четыре СН-СВЯЗII cr·Тllпа. т. е. восемь молекулярных орбl1ТалеА
(четыре связываЮЩI1Х н четыре разрыхляющнх):
При столкновеl1l1l1 IIтома ХЛОрll с молекулоii метана АО хлора переlч)ывается с одной II~
валеНТIIЫХ (РИЗРЫХЛЯЮЩI1Х) молекулярных орбllТалеli метяна. ПРII 'iTOM орбllТаЛII Ilерестра,
f1ВIIЮТСЯ, оGрttзуя молеl<улярные орбl1ТЯJllI молекулы HCIII одно,ле"тронную орбl1ТIIЛЬ Paдll­
ЮIЛИ. Зятем Прll встрече РIIДИКIIЛII с молеl(улоii XJIOРЯ одноэлектронняя uрбllТIIJIЬ РЯДllкаЛR
п('реl<j)ывяется с ВЯl(юпноii cr*-орбl1ТЯЛЫО молекулы хлоря 11 орGIIТЯЛl1 переСТРИI1ВЯЮТСЯ с
обрttЗОВ1IIIием МО связи С-CI 11 освобождеНllем IIТОМII хлоря с БОЛЬШflМ выделеНllем
·"нерП1l1.
Процесс хлор"ровяния в пр"сутствии КЯТЯЛI1ЗIIТОРОВ. НЯПРl1мер хлор"Дов некоторых
метяллов, может
I1MeTL.
цеПlюii IlOнныII меХЯНI1ЗМ:
CI : CI + AICI:! --+ AICI 4 + CI+
CI+ + Н :СН:! ~СНt + HCI
CH~ + CI : CI--+CI : СН:! + CI+ 11 т. д.
Применеflие продуктов фторирования и хлорировяния алкянов рас­
смятривяется в гл. 2
2. Сульфохлорирование и сульфоокисление. При обычной темпера­
туре серная КИСJJота I/Я алканы не действует. * При нягревании оня дейсТ­
вует кяк окислитель. ОДflЯКО дымящая серная кислота с высшими пара­
финями дает сульфокислоты:
R-H + H~SO.I ~ R-SO:,H + H~O.
Небольшое пряктическое значение приобрел другой способ превраще­
ния паряфинов в сульфокислоты и их производные -
реакции сульфО­
ХЛОРИРОВЯflИЯ и сульфоокислеflИЯ, протекающие по следующим общИМ
УРЯВflеIШЯМ:
R-H + S02 + CI 2 --+ R-S0 2-CI + HCI (сульфОХЛОРllровяние)
НJ\КНIIСУJ\ыIЮХJ!О)'1IJl
R-H + 2S0 2 + 02 + Н 2 О ~ R-S0 20H
+ H 2S0 4 (СУЛЬФООlшслеНI1е)
НJIКЮIСУJII.фоКНt:JЮТtt
*
АлКЮIЫ легко реЯГI1РУЮТ с «супер-кислuтями». няпример со смесью S!)Fo; 11 FSО,н.
с выделеНl1ем водорода
64
11
обрязоваНllем кярБОНl1евых
flOHOB
(Г. Ола).
РеакЦИИ ':IТИ идут на свету ИЛИ в присутствии катализаторов, образую­
х в условияХ опытя свободные Р::lДИК::IЛЫ.
LllиВ еаКlt иЮ фотохимического сульфОХЛОРИРОВ::IНИЯ ВСТУП::lЮТ все угле-
f~AbI нЯЧИН::IЯ с MeT::IH::I, при КОМН::IТНОЙ темпеР::lтуре. 3::1мещение
BOAOPOAH~IX ЯТОМОВ на сульфохлоридную группу проходит изБИР::lтельно:
водОР
аТОМЫ
BOAOPOA::l,
связанные с вторичными углеродными ::Iтомами, З::lмеЩ::l-
ются легче, чем СВЯЗ::lнные с пеРВИЧIIЫМИ. ПОЛУЧ::lТЬ ':IТИМ методом третич­
ные СУJlЬфОХЛОРИДЫ не УД::lется ИЗ-З::l обрыва ре::lКЦИОННЫХ цепей. Наблю­
дается и обраЗОВ::Iние ДИСУЛuфОХЛОРИДОВ с 1,3 положениями СУЛЬфОХJlО­
риднЫХ групп. Побочными ПРОДУКТ::IМИ при СУЛuФОХЛОРИРОВ::IНИИ являются
продукты ХJlОРИРОВ::IНИЯ соответствующего углеВОДОрОД::l. КаТ::IJIИЗ::lТО­
рами сульфОХЛОРИРОВ::IНИЯ (в отсутствиие CBeT::I) служат органические
пероксиды.
[JеякцИЯ сульфохлорирования имеет цепной раДИК::IЛЫIЫЙ механизм
SR'
НоситеJlЯМИ цепи, как и в других реакциях предельных углеводородов, яв­
Jlяются свободные углеводородные радикалы. Н::Iиболее веРОЯТН::I следую­
щая cxeMiI фотохимического сульфохлорирования:
CI1~2CI"
RH+CI"_ R"+HCI
R"+S01_ RSOi
RS0 1CI+CI" 11 т. д.
RSOi+CI 1-
СУJII.ФОХJlОf!IЩ
РеНКЦIiЯ СУЛl>фохлорироваНlIЯ алканов была IIСПОЛl>зована в ГермаНlIII в
1939- 1919
гг.
д.nя получеНIIЯ заменнтелеii мыла. Обрнзующиеся при СУЛI>ФОХЛОРИРОВННItII углеводородных
фРНlЩllii CMeCII хлорннпtДрltДОВ сульфокнслот (см. гл. 7) деiiСТВllем соды 11Лi'1 CIIJlIIKHTOB IlpeВI'~lIlаIOТt:я в соли сульфокислот. I<OTopble ПРllменяются как СТllраJlьные ПОРОШIШ:
R-S0 1-CI + 2NaOH ----+
R-S0 1 -ОNа
+ NaCI + H~O.
СУJlUФООЮiCлеНllе выгоднее. чем СУЛЬфОХJlOрltровннltе. Tal( I(Ю( не расходуется хлор. однн­
КО ~Ta ренющя еще недостаТО'lНО IIЗУ'lена.
Недавно Gыло показано. что 502 с парафllнами npll освещеНIНI уф 1·1 В OTCYTCTBIIII ЮIСЛО­
PO;tH PI:HrllPYCT С оGразоваНllем аЛЮIЛСУЛЬФННОВЫХ ЮIСЛОТ. Скорости замещеШIЯ nepBII'IHUIX.
ВТОРllЧflЫХ 1I ТiJеТИ'lНЫХ атомов водорода относятся Kal( 25 : 34 : 48. СУЛЬФllновые ЮIСЛОТЫ
доМе леп(о ОКlIСЛЯЮТСЯ в СУЛЬФОКlIСЛОТЫ.
3. Нитрование. Атомы водорода в углеводородах могут быть З::Iмеще­
IIЫ нитрогруппоЙ. ЭТ::I ре::lКЦИЯ, НОСЯЩ::lЯ Н::IЗВ::Iние реакции нитрования,
Идет по схеме
R-H + HO-N02 ----+ R-N0 2 +
Н 2 О.
ПilР::lфИНЫ окисляются концеНТРИРОВ::IННОЙ ::IЗОТНОЙ кислотой или сме­
C[,I~.) азотной и серной кислот. Нитруются они только Р::lзб::lвленной ::IЗОТ­
НОН Кислотой при Н::IгреВ::IНИИ (М. М. КОНОВ::IЛОВ, 1888).
В реilКЦИЮ жидкофазного нumрованuя вступюот все углеводороды,
ОДН<tКо скорость реакции невелика и выходы нитросоединений низкие.
3 3/11:. 181
65
Наилучшие результаты получаются с парафинами, содержащими TPeтtt~
ные углеродные атомы. Реакция сопровождается образованием полин~
росоединений и окислительными процессами.
.'
В промышленности получило применение нитрование парами азотнQЙ
кислоты при 250-500 ·С - nарофазное ниmрование. Выбор темпера.
туры процесса зависит от длины цепи и строения углеводорода: ИЗОБУТа.
реагирует уже при 150 ·С, тогда как метан 1·lачинает реагировать толы(е
при 370 ос. Реакция сопровождается крекингом углеводородов, в резуль.
тате чего получаются всевозможные мононитропроизводные, начиная
01'
нитропроизводных с тем же числом углеродных атомов, что исходный yr~
леводород, и кончая нитрометаном. Так, в случае нитрования пропана об.
разуется 34% l-нитропропана CH:~-CH2-CH2-N02' 32% 2-нитро.
пропаllа CI-I~-CI-IN02-CH~,
26% нитроО/тана CI-I a-CH 2-N0 2 и 8%
нитрометана CH~N02' Полинитросоединения при парофазном нитрова.
нии не образуются. Обычные правила замещения, рассмотренные выше,
действуют и здесь.
На реакцию нитрования расходуется около
40 % азотной кислоты.
Остальная кислота действует как окислитель. Поэтому наряду с нитросое­
динениями в этом процессе получаются и различные КИСJlородные со~ди­
нения - спирты, альдегиды, кетоны, кислоты. Кроме Toro, образуются и
непредеЛЫ-lые углеводороды. Азотная кислота как нитрующий areHT мо­
жет быть заменена окислами азота.
Рядом исследований было показано, что реакция нитрования парафи­
нов радикальный процесс. На'IRЛЬНОЙ стадией нитрования ЯВJlяется
взаимодействие диоксида азота * с углеводородом, приводящее к возник­
новению свободных радикалов. Последние с диоксидом азота дают нитро­
соединения или эфиры азотистой кислоты:
R-H+N0 2 -+
R·+HNO~
HN0 2 + HNO:1 -+ NP4 +
N~04
RO+ NO;
-с
Н 2О
+ HNO:1 ~ 2N0 2
R-NO~ (нитросоеДl1неНI1Я)
R-O-NO
(ЭфI1РЫ IIЗОТllстоil КI1СЛОТЫ)
Из эфиров азотистой кислоты далее получаются различные кислород­
содержащие соединения.
4. ОкисJlение. Кислород воздуха и обычные окислители (КМJl 0 4,
I(2СГО4,
1(2CI-207 И
др.) ОКИСJlЯЮТ парафины только при высоких темпера­
турах с рюрывом углеродной цепи и образованием преимущественно кис­
лот_ При О/том В значитеЛI>НЫХ количествах получается конечный продуКТ
окисления
* Дl1ОI\СНД
-
диоксид углерода С0 2 .
II:ЮТiI содеРЖI1ТСЯ в IIзотноii Кl1слоте 11 о(jРII:lуется в реЗУЛ\.>ТIIте ОКllслеНI1Я
углеводородов IIзотноii Кllслотоil. По строеНIIЮ он является своБОДlIЫМ РIIДIIЮIЛОМ.
66
актическая ценность кислородсодержащих соединений и доступ-
~~ парафинов побудила химиков тщатеJlЬНО исследовать процессы
НО~:ления парафинов кислородом воздуха. Установлено, что в случае низ-
ок
"оафИНОВ окисление протекает с большими затруднениями.
ших п",
последовите.%lюе ОЮlслеlJllе ПЯРЯфl1lJОВДО СПIJРТОВ. ЮlрБОIНlЛL>НЫХ coeAflHeHllii. ЮIСЛОТ 11
И угnероди npollCXOAllT с возрастаЮЩllМ тепловым эффектом. '1Отому OCTaHoRllТb ГlIJO'
AIIOKCIIA
•
сс ня flУЖfюii СТЯДIIII O'ICHI, трудно.
це ОЮIС.IIеНllе 11ЩJilфllНОВ требует ВЫСОIШХ темпеРilТУР. ПРИI\оТОРЫХ ПРОИСХОДIIТ l<реЮIНГ уг­
левоДОРОДОВ' ПО'Jтому БОЛL>ШЯЯ 'laCTL> ПрОДУI<ТОВ ОЮlслеflllЯ имеет меНf,шее 'IIIСЛО углеРОДfIЫХ
томов. чем НСХОДНl>lе углеводороды.
а Угле~оДОРОДЫ оБРilЗУIOТ С ЮIСJIOРОДОМ
воздухом) ВЗРЫВ'lIIтые
(11
CMeCl1 11
широком ДllilШI­
зоне KOH1!ellТpaUllii. 1l0'ПОМУ ПРIIХОДIПСЯ раБОТilТL> вне 'iTOrO Дllilпа:ЮНtI. т. е. с O'leHL> НIIЗКИМИ
t(ОНllентрЯЦIIЯМII ЮIСJIOРОДil.
.
ЭПI трУДflOСТlI ОГРillJllЧllВilЮТ ВОЗМОЖIJОСТIIIIСПОЛL>зоваIfИЯ процеССtI окисления в технике.
ОднаliO. НЮIРllмер. ОЮlслеНllем бутана в промышленных количествах получается УI<СУСНilЯ
t(lIC.IIОТИ (гл. б).
НаиБО.IIЫIJее применение имеет окисление высших парафинов нефти
с цеJlЬЮ получения синтетических высших жирных кислот преимущест­
венно ДЛЯ мыловаренной промышленности.
Окисление высших парафинов проводят при температуре порядка
150
ос в присутствии катализаторов, например соединений марганца. При
этом образуются смесь кислот с РЯЗЛИ'IНОЙ длиной цепи. гидроксикисло­
ТЫ. KeToКIH:JIOTbl, сложные ':Iфиры, спирты, кетоны и т. д.
В процессе окисления предельных углеводородов получаются в качест­
ве промежуточных
продуктов
органические
гидропероксиды (гл.
4.:3).
в результате действия на углеводороды высокой температуры образу­
ются свободные радикалы, которые присоединяют молекулярный кисло­
род; возникающий при ':Iтом пероксидный радикал отрывает водород от
другой
молекулы
углеводорода
и
дает
новый
радикал
и
МОJIекулу
гидропероксида:
RO+O::O~ROO°
+RH) ROOH+R
IIСllOКСllДllt.lИ
o
IIСIЮКСIЩ
l'ilJllIKHJI
ДаЛ()нейшая судьба гидропероксидов зависит от их строения.
11еРВ(tя стадия распадя любого пероксидя - ':11'0 диссоциация по связи
О-о. Возникающие свободные кислородные радикалы либо ОТр'ывюот
ВОДОродные атомы от присутствующих в системе водородсодержащих час­
Тиц и дают спирты, либо распадаются по ~-связи (по отношению к свобод­
Ной) и дают альдегиды или кетоны.
Третичные гидропероксиды благодаря высокой стойкости в определен­
ных условиях могут быть и коне'IНЫМИ продуктами окисления. Они распа­
д,illOТся с образованием спиртов или кетонов по схеме:
(Н.
1·1
СН.
r'
+I~-II
l
H:'(-<r- O- OH ~ CI-I:i·J!...(r~О°
СН: 1
С 1-1:1
«Н.) (-01-1
.1:1
+ R
O
- [
W
CH1-C-CH:1+CH;
67
aj
Няправление распяда гидропероксидов вторичных ялкилов зависи'Г
условий. При низких температурах они дают преимущественно KeTOIt,,'
и спирты по схеме:
1 Н\
1Н.\
н-с-о-он ~
1
-110·
сн:\
-[+11-11 (CH:\)~CHOH
+ R"
:~
О
H..LC...!!...O·
,I! ,
1
сн:\
CH:1-
с-сн:\ + Н
При высоких температурях образуются преимущественно альдегидbl
и спирты:
7
7
сн:\
сн:\
СН:Гt-О-ОН ~ CHf-t...!!...О·
+11-1.1
(CH:\)~CHOH + R'
-[ ,
i
СН.гС-Н + сн;\
Гидропероксиды первичных ялкилов в этих условиях разлягяются по­
добным же образом:
7
сн.\-с-о-он
.
1
н
Последующее окисление спиртов и альдегидов приводит к кислотам.
ПОМIIМО ОКllсления ПIlРllфllНОВ КИСJ10РОДОМ ВОЗДУХII существуют 11 ДРУГllе методы IIX окис­
J1еНltя. ПР"ВОДЯЩltе ИНОГДII к сеJ1еl<ТIIВНОМУ ПОJ1У'lеШIIO цеJ1еВL.IХ продуктов. Так. например.
ОI<ИСJ1ение озоном на СИJ1ItI<агеJ1е l!Дет по треПI'lНОМУ IIТОМУ УГJ1ерОДII:
R:\CH~ R:!COH
5. Крекинг углеводородов при высоких температурах. При темпера­
туре выше 1000·С все предельные угдеводороды РЯСПЯДЯlOтся ня угдерод
и водород. Этот процесс используется как дешевый метод получения вода­
родя и гязовой сяжи. В определенных условиях удяется изолировять про­
межуточные продукты расщепления. в чястности яцетилен. Пиролиз ме­
тяня с обрязовянием ацетилена является промышленным способом полу­
чения последнего (см. гл. 1.4).
Нячальняя температуря распядя предельных углеводородов зависит ОТ
их молекулярной массы и строения. Чем больше молекулярная масса, тем
легче рясщепляется углеводород при нягревании.
При 300-700·С предельные углеводороды образуют сложную смесь
предельнь)х, непредельных и яромаТИ'lеских УГJlеводородов. Чем выШ~
темперятуря и больше глубина превращения, тем меньше состав ,тои
смеси зявисит от природы исходного углеводорода.
OCHOBllbIe процессы при крекинге
и
разрыв углеродной цепи.
- дегидрогенизация угдеводороД8
Одновременно происходит изомеризяциЯ
и циклизяция. Промежуточными продуктами во всех этих процессах явля­
ются свободные ал/.l.фаmuчеСК/.I.е рядикалы. Поэтому, чтобы понять ме­
ханизм обрнзовяния главнейших продуктов при крекинге углеводородов.
68
имо зиять, кякие процессU! происходят со свободными рядикалами
нео БХОД
. е их
06разовtJНИЯ.
[JO~ бодные ароматические рядикалы известны с 1900 г. (см. гл. 25).
• БВОдные ялифатические рядикалы были обнаружены только 1929 г.
СВО ОП"
Ф ПанСТОМ. В опытах
анета инертныи газ с парями тетраметилсвинца
проходил через квярцевую трубку, которую нагревали в TO'IKe а (рис. 32).
к нисосу
РЬ
(j
PIIC.
I -
:~2.
Инертныii
PIJ
2
Схеми УСТИНОВЮ1. f1споnьзованноii в опытих Панета:
"l'оlillРКИ С Т~ТI"'М~ТIIJIСIIIIIЩ()М;
2-
КIIИlщrll8>1 труliки;
~ -
JllJIIУIIIКИ
При :;,том на стенке трубки осяждалось «свинцовое зеркало»:
(CH;I)4PIJ~4CH;
+ PIJ.
Зятем трубку lIагревяли в точке б и здесь появлялось свинцовое зеркя­
ло, я первое зсркяло исчеЗЯJlО, тяк кяк ряди кал реягирует со свинцом
4Сн;
+ PIJ~(CH:I)4 РЬ.
я теТРiiМСТИJlсвинец уносился инертным гязом. Тетряметилсвинец можно
сконденсировять в ловушке, охлаждяемой снаружи жидким воздухом.
По рясстояиию между точкями а и б, скорости пропускания инеРПlOI'О
гязя и некоторым другим дянныM была выисленяя продолжитеЛI>НОСТЬ
существовяния
радикала
метиля
(0,006
с),
я
позднее ::JТИЛЯ и других
ряди КЯ.11O в.
По способности снимя'Гl.> зеркала раз.личных :::Iлементов свободные ра­
дикяJlы ОТJIИЧЯЮТСЯ кяк друг от друга, так и от атомарного водорода, По­
следний, няпример, не снимяет свинцовое зеркало. В нястоящее время
рязряботяно много методов получения и определения природы алифати­
'Iеских рядикялов,
ПРОJLOлжитеJIЬНОСТЬ жизни свободных ялифятических радикялов изме­
ряется тыячньIмии долями секунды, т. е, она значитеЛI>НО меньше прОДОJI­
>кит.елыlстии жизни атомарного водорода (0,1 с),
СВОбодные рядикялы способны к следующим основным химическим
ПреВРящениям (кроме захвятя атома BOДOPOДii с превращснием в углево­
Дород, при котором происходит передача цепи и количество свободных ра­
дИКялов не изменяется):
1) РЯСIIЯД
R-i-J!.CH".J!...CH:,
.
-~ R + CH~-Cн.,;-
69
3)
соединение
Распад свободных радикалов всегда идет по /3-связи (по отношению
к атому со свободным электроном)
*.
Неразветвленные радикалы менее
склонны к реякциям диспропорционирования и более склонны 1< реакциям
соединения. Для рядикялов с рязветвленной цепью няблюдяется обрятная
картиня.
Метильные рядикалы образуют метан, этан, этилен и водород. Этил
дяет этилен, этян, бутан и водород.
Для радикаля бутила харяктерны следующи~ реакции:
СН:Г СН 2 ~ сн 2-сн;
-
CH:гCH~ + CH~=CH2
сн;\-сн 2-сн 2-сн; + CH;гCH~ -
2С I Н', -
C1;H",
СкН,к
Для больших рядикалов при ряспяде хярактерно образов(!ние непре­
дельных углеводородов из остаткя с большим числом углеродных ятомов.
У'IlIтывая соотношение в СJШРОСТЯХ отрыва атомов водорода от J1epBI1'JHOrO. BTOpJI'JHOrO и
трети'lНОГО углеродных атомов (1 : 2 : 10) и 'J'IСЛО '~TJIX атомов в молекуле парафина. МОЖIIO с
достаТО'lноii ТО'lНОСТЫО преДСКilзат(, состав продуктов KpeКlIHra простеЙШIIХ углеводородов
на нtI'iаш,ноii стаДИl1 (до
10-20% превращеlН1Я).
Введением в зону реакции катялизаторов можно сильно изменить на­
праВJlение крекинга. Так, например, на некоторых кятализаторах удается
с хорошими выходами ПОЛУ'lать из предельных углеводородов олефины
или диолефины, т. е. осуществлять процесс дегидрогенизации. В присут­
ствии хлорида алюминия усиленно идут процессы изомеризяl.l,ИИ. На пла­
тине и некоторых других кятализаторах успешно осуществляются процес­
сы ароматизации
-
образования аромаТИ'lеских углеводородов.
В технике исключительную роль играет креl<ИНГ нефтяного сырья для
получения из высших углеводородов более ценных низших предеJlЬНЫХ и
непредеЛЫIЫХ углеводородов.
Отдельные представители. Применение
Первый в ряду предельных углеводородов
-
.метан (табл.
:3) -
яв­
ляется основной составной 'шстыо природных и попутных Г<l3013 И широко
используется в кячестве промышленного и бытового газя. Химически пе­
рерабатывяется главным образом в ацетилен, Г<J30ВУЮ сяжу, фторо- И
хлороп роизводные (схемя
*
~,Связь
разрыхлена
вслеДСТllе
электроном (сверхсопряжение ).
70
1).
взаllмодеiiствия
ее
~~леJ(ТJJOНОВ
с
неспяренным
Схе м 11
1,
ПромышлеНllое иt'пользоваllие MeTalla
IIJIH~:TMH~~c.:I"
"УI'ИII'"II"t""'''''''Ш
<:11;:')11
t
IIC==<:II + II~
СО+ II~
HI1'-'·ГlI:ll'll
~IIIIТ~'.'·I·H.'. 1111;Шlюi·1 '·н;'
~'HiК}I (1)'-';tI'IЮlltl~1
1IIIС'МI"III.rt~'lllюс.:1"I.)
Il/flИJ.lJ'1:I
N()~(:ICI11(>II);:~CII;IN()~
IIII'M~' J 11)1111111"1 РIIМ~'ТiШ
f~:fr'f.IiI·IX
~
/"1,11.'
IIIIТ!ИII\НIIII,-'
II<:N 111::=':11. lIi:=<:II-СN
:\:11;,
11:-\0.1
,-'Ш11 IJII.mНl
""IIIIJ"'l'ПfIl'"
ЮI4.:JICI1"Н
(:t~
х.'LIIIШIЮlli'lllll~'
/I~·Щt·С·IIIН
CIIIIT<.'TII',,-'('КII,-'IIIIJIIIКIIII,
IIIПI)lIЛ. 1IIIТjIlULl.IIIJЙ КitY'IYK
CI12C1~
"""""'!:;,.
Х.'IIIIIItС"ГI,IЙ
M'-'TII.'I'-'II
СIЮ::
CCI 1
Х!IIII"lфl'РМ
'll'll,lp'-'хXJlCIl'щ··' .... Н
YI·Jll'I'HjL
!"I.'
(<:11:: I~SiCI~
:UIM'-'ТII.'I:UIXJIIЧIt'IIJIНII
(T~CI~
ФI''-'1I11·11
( XJI/ЩНI\'IП I
'·IIJJIIKOllld
(1·.11. Н ..о1)
Эll1ан, nропан, 6уm.ан и nенmаны испо.лЬЗУIOТбl в технике ДJЩ полу­
'1('111151
соответственно 'Jтилеш\, пропилеНR, ДИВИНИJIR и изопреНR (дегидри­
РОВi1f1ие, в последнем с.лУЧRе с изомеризацией), Смесь ПРОПRна и БУТЯНR
IIСПОJlЬЗУЮТ В
KR'lecTBe ТОПЛИВR (бытовой сжиженный гяз), в последнее
Время значитеЛЫlые КОJlичества БУТRНR используют в технике ДJlЯ ПОЛУ'lе-
111151 УI<СУСНОЙ кислоты (окисление) (см, гл, 6),
>Кидкие углеводороды ИСПОJlЬЗУЮТСЯ как моторное топливо, Д,flЯ ДI3ИГR­
T(',;leii
внутреllнего сгорнния требуется ТОПJlИВО с высоким «ОКТНIЮВЫМ
'1I1l'.!IOM»,
в 11роцессе XIIMII'IeCJ{oi'l ПОДГОТОВЮI ПИРОlIuздушнui'1 CMeCII (ТОflЛIIВИ 11 воздухи) ВДВIIГЮСЛС
ВIIУТРСlIнего СI'ОР1IIШЯ Н1I1\1Il1ЛНR1IIOТСЯ B:iPblB'I<!Tble перОJ\СI1ДЫ, I{оторые могут детонщювитu
Р,'IЩllе, чем Н<!СТУI111Т неоfiХОДIIМulii момент Д/IЯ ВОСПJlЯМСllеlНfЯ CMeClI, Т, е, pilllblur, '!ем 1101'IlIl'III';ШIIГilТСJ1Я доi'щет дО НУЖIIОГО lIоложеНllЯ, Это lIЫЗЫВllет пор'lУ мотор<! (ДВIIГilтелu "сту·
'IIIT>,), НеО()ХUДlIмое ДЛЯ повышеllНЯ МОЩНОСТII ДВllг,пеJIЯ Уl!еЛII'lСlше cтenellll СЖ1lТIIЯ l'IilРО­
В<>:Цушноi'll'МСCJI в Цllmlндре ДВIIП1ТСЛЯ УСIIЛlIВ1Iет деТОН<!IЩЮ, Поэтому от моторного ТОI1Л1\l111
'ГРС('Уl'ТСЯ, IITO()I,I ОНО fiыло МiН(СIIМ1IЛL,НО YCToii 1 l11BO I{ деТОН1IЦIНI,
71
Наиболее легко детоиируют углеводороды с нормальным строением. Дnя того чтобы
сравнить способность к детонации различных горючих материалов, построили специальную
шкалу. За нуль в этой шкале принят н-гептан, за
100 -
изооктан. Если исследуемое топли­
во детонирует так же, как смесь 76% изооктана и 24% н-гептана, то топливу присванвают
октановое число 76. В настоящее время в качестве топлива для легковых автомобилей испо­
льзуется бензин с октановыми числами 72, 76, 93, 95.
Дnя получения высокооктановых бензинов в технике про водят крекинг нефтяных фрак­
ций в присутствии катализаторов.
Изооктан может быть получен из изобутана.
Высшие жидкие и твердые парафины используются как топливо (ди­
зельное), смазочный материал, в виде твердого парафина, озокерита и т. д.
ЭТИЛЕНОВblЕ УГЛЕВОДОРОДbI (дЛКЕНЫ, ОЛЕФИНbI)
2.
Этиленовыми углеводородами (алкенами или олефинами) называют
такие углеводороды, в молекуле которых содержатся углеродные атомы,
затрачивающие на соединение с соседним углеродным атомом две валент­
ности, т. е. образующие двойную связь между соседними sр2_ ги бридизо­
ванными атомами углерода.
Этиленовые углеводороды образуют гомологический ряд с общей фор­
мулой СпН 2п , родоначальником которого является этилен СН 2 =СН 2 .
Строение молекулы этилена изображено на рис. 19.
Изомерия. Номенклатура
Структурная изомерия начинается в этом ряду, как и в ряду предельных
углеводородов, с члена ряда С 4 , однако число изомеров значительно
больше.
Данные о числе структурных изомеров ДlJЯ
Таблица
4.
Зависи­
мость числа
CTPYK1YpllbIX
изомеров олефИIIОВ от
числа углеродных атомов
ЧИСJ10
Число
УГJ1СРОДIIЫХ
изомсров
атомов
ОJ1ефИНОII
углеродной цепи, в ряду олефинов наблюдается
структурная изомерия, обусловленная положени­
ем двойной связи в цепи. Кроме того, в ряду оле­
финов имеет место пространственная (геометри­
ческая), так называемая цuс-транс-изомерия,
цuс-Изомеры содержат определенные (в частном
1
случае одинаковые) атомы или группы атомов
2
при углеродах с двойной связью по одну сторону
от плоскости этой связи, транс-изомеры
3
72
первых девяти членов ряда приведены в табл. 4.
Наряду с изомерией, связанной со строением
-
по
разные стороны:
4
3
5
5
6
13
7
27
8
66
9
154
нзс"с=~Н:!
Н/
"Н
цuс-2-бутен
H:1c"c=c(H
Н/
СНз
mранс-2-бутен
Существование геометрической цис-транс­
изомерии в ряду олефинов связано с тем, что
7t-СВЯЗЬ не допускает свободного вращения во­
круг оси О'-связи между двумя углеродными ато-
мами. Переход одного геометрического изомера в другой возможен лишь
при высоких температурах, когда энергия теплового движения достаточна
ДJlя разрыва 1t-связи, при освещении благодаря поглощению световой
энергии или при действии катализаторов, также ослабляющих 1t-СВЯЗЬ.
Обозначение геометрических изомеров как цис- и транс-форм в более сложных случаях
встречает затруднение. Примером может служить геометрическая изомерия I·бром,
l·хлор·2.фтор·2,иодэтена:
Br"c=c(F
CI/
I
Е-изомер
Z-изомер
Для таких случаев пред.nожена номенклатура, включающая понятие старшинства заме­
щающиХ групп. В зависимости от расположения старших групп один из изомеров обознача­
ется Kal< Е (от нем. Entgegen - напротив), а другой - Kal< Z (от нем, Zuzammen - вмес­
те). В Z,изомере старшие замесппели расположены по одну сторону от плоскости п-связи, В
Е·изомере
-
по разные.
СтаРШl1НСТВО групп определяется атомным номером элемента, атом которого связан с
атомом углерода ДВОiiНОl1 СВЯЗI1. а пр" одном 11 том же элементе атомными номерами следую·
щих элементов вдоль цеПl1 заместителя. Ниже приведен ряд заместителей в порядке возрас­
таШ1Я старшинства:
Н < СНа < СН 2 -сн з < СН=СН 2 < С$СН < СНН" <
< СНО < СО ОН <
NH 2 <
ОН
< ОСН З <
F<
СI
CsN <
1.
СН 2 ОН <
< Вг <
По этой номенклатуре Цllс·2-бутеlJ является Z,изомером, а транс-2-бутен
-
Е,изомером.
Названия олефинов по систематической номенклатуре образуют из на­
званий аналогично построенных парафинов, заменяя суффиксы -ан- на
ен.-, причем цифрой показывают положение двойной связи (после какого
атома идет двойная связь). За главную цепь принимают самую длинную
цепь с двойной связью. Нумерацию углеродных атомов начинают с того
конца цепи, к которому двойная связь ближе. Для первого члена ряда со­
храняется и тривиальное название
-
этилен. В разговорной речи иногда
употребляются тривиальные и старые рациональные названия олефинов,
Так, например, олефины часто называют как алкилзамещенные родонача­
льника ряда
-
этилена или по соответствующему парафину, меняя окон­
чание -ан на -uлен. Приведем названия нескольких углеводородов:
СН 2 =СН 2
этен, этилен
CH 2 =CH-СН з
пропен, метилэтилен, пропилен
СН 2 =СН-СН 2 -СН:1
l-бутен, этилэтилен, бутилен
CH:1-CH=CH-CH:1
2-бутен, CUAlAt-ДlIмеТИЛЭТlIлен,
CI·1 2 =C-CII.\
2,меТJlлпропен, heCU.llAt-ДI1меТlIлэтилен,
I
.
СН З
псевдобутилен
изобутилен
СН2=СН-СН2-СН2-СН:I
I·пентен, пропилэтилен, амилен
СНз-СН=СН-СН~-СНз
2· пентен, CIl.lI.4t - метилэтилэтилен
СНгСН -уН-П 1:\
З-метил·l-бутен,И30пропилэтилен
СН з
73
CH:1-СН=r- СНз
2-метил-2-бутен, триметилэтилен
СНз
СН З-СН 2-С=СН 2
2-метил-l-бутен,
heCU,lLlI-метилэтилэтилен
I
СН з
I
СН
~
LH
:1
~
i
'
= ё1-LH2 -СН2
Ji.
LH
7
2-1СН-
НзС-С-СН з
J!.
LH
з
3-mреm-бутил-7-метил-2-0ктен
СНЗ
tн з
Следует заметить, что в русской литературе до последнего времени
цифру, укззываюшую положение двойной связи, ставили после окончания
-ен, что создавало неудобства при склонении названий углеводородов.
Непредельные углеводородные радикалы называют, добавляя к корню
суффикс -енил: этенил СН 2 =СН-, 1-пропенил СНз-СН=СН-,
2-пропенил СН 2 =СН-СН 2 -. Укоренились некоторые эмпирические
названия: винил СН 2 =СН-, аллил СН 2 =СН-СН 2 -, изопропенил
CH 2 =C-СН з , кротил СН з -СН=СН-СН 2 -.
I
Способы получения
Олефины встречаются в некоторых нефтях. Особенно велико их содер­
жание в канадской нефти. В чистом виде из нефти вьщелены углеводороды
от C6 H I2 до С 1з Н 26 .
1. Первые четыре члена ряда олефинов получают в технике в чистом
состоянии разгонкой под давлением или при пониженной температуре га­
зообразной части продуктов крекинга нефтяных дистиллятов, а также из
газов коксования (этилен, пропилен ).
Некоторые олефины для технических целей нужны в больших количе­
ствах, чем их может быть выделено из газов крекинга и других промыш­
ленных источников. Поэтому в технике все шире применяется получение
их дегидрогенизацией предельных углеводородов. Катализатором этого
процесса обычно является специальным образом приготовленный оксид
хрома
(III):
СН,.....СН -СН -СН
.1
2
2
3
2.
~
cг 01
":1
CH 2 =CH-СН 2-СН з
+ Н2
СНз-СН=СН-СН з + Н 2
Наиболее распространенным способом получения олефинов в лабо­
раторных УСЛО'13иях является дегидратация (отщепление воды) спиртов:
СН
СН
1 Г 1 2
Квтanизаmр~
СН 2=СН 2
+ Н 2 О.
[f.C~J?Hj
в качестве катализаторов дегидратации используют различные кисло­
ты (серную, фосфорную), кислые соли (KHS0 4 ), оксид фосфора (У), ок­
сид алюминия, соли алюминия и др.
74
условия дегидратации зависят от природы спирта. Особенно легко де­
гидратирУЮТСЯ третичные спирты: часто
они отщепляют воду уже при
перегонке.
Порядок отщепления воды в большинстве случаев определяется nра-
ВUЛО.Аt Зайцева: при образовании воды наиболее легко отщепляется во­
дород от наименее гидрогенизированного атома углерода:
СН -снон-сн-сн.
3
э
I
~
4
э
2
I
СНэ-СН=С-СН з
tн з
СНэ
+
Н 2 О.
2-метил-2-бутен
в процессе дегидратации двойная связь часто перемещается и строение
полученного углеводорода не соответствует строению исходного спирта.
Так, например, при дегидратации изоамилового спирта обычно получает­
ся смесь трех углеводородов:
снэ-rн-сн
СН 2
СНз
СН э1 Н-СН 2-СНРН
СН-С=СН-СН
З
СНз
I
з
СН;I
СН:Г-Т-СН2-СНЭ
СНз
Об изомеризации углеродного скелета при дегидратации см. гл.
3. Ме­
ханизм дегидратации спиртов приведен там же.
3. Удобным методом получения алкенов является пиролиз эфиров
(ацетатов) карбоновых кислот:
Н
OCOR
-~-~- 300-550·C~ "С=С/
I I
/"
+ R-COOH
.
Естественно, могут быть использованы только эфиры, имеющие в
Р-положении водородные атомы. Для получения высших олефинов испо­
Льзуется пиролиз спиртов в присутствии уксусного ангидрида.
4.
Олефины часто получают отщеплением галогеноводородов от гало­
генопроизводных. Моногалогенопроизводные дают олефины при дейст­
вии щелочей (дегидрогалогенирование):
СН 2-СН 2 + КОН ~CH2-CH2 + КСI + Н 2 О.
I
н
I
СI
Обычно для этих целей применяется спиртовой раствор КОН или
NaOH. Однако в этом случае может пойти побочная реакция - образо­
ваНие простого эфира:
С 2 Н 5 ОН
С 2 Н 5 С1
+ КОН ;::t С 2 Н 5 ОК + Н 2 О;
+ КОС 2 Н 5 ---+ С 2 Н 5 ОС2 Н 5 + KCI.
75
Поэтому иногда отщепляют гялогеноводород с помощью твердой из.!
- диметилянилиня иJl":
мель',енной щелочи или органических основяний
хинолина.
Напрявление дегидрогалогенировяния
при этом соответствует УЖе
рассмотренному правилу Зайцева:
:,.
CH:1CHBrCH 2CH:1 -НВг) CH:1CH = CHCH:1.
Механизм дегидрогалогенирования приведен на с.
5.
118, 119.
Для полу',ения олефинов иногдя используют метод отщепления га.
логенов от дигалогенопроизводных с ятомами галогена у
с о с ед н и х
уг­
леродных атомов. Ранее для этих цеJlей ИСПО.llьзовяш\сь цинковая пыль
(или стружки) в водно-спиртовой среде:
CH~--Bг
I
CH~--Bг
+ ZIl ~
CH~
I
+ ZIlBr2
СН 2
Однако вероятность изомеризяции обрязующегося алкеня под влияни­
ем галоген ида цинка застави.llЯ искать другие реагенты. Среди них приме­
няются иодид натрия в метаноле ИJJИ ацетоне, соли хрома
(II),
тиосульфат
натрия в диметилсульфоксиде, алюмогидрид лития.
Реакция зтя важна как метод, позволяющий временно «защищать»
двойную
связь:
алкен
может
быть
переведен
в дибромид,
а
затем
регенерирован.
6.
В некоторых слу',аях ацетиленовые углеводороды с определенным
строением получаются легче, чем отвечающие им по строению олефины.
В таких случаях последние получают частичным «.селективным» гидриро­
ванием
ацетиленовых
углеводородов,
например
над
паллядиевым
катализатором:
7.
В последнее время ДЛЯ синтеза олефинов с концевой двойной свя­
зью очень ',асто используется реакция Виттига:
+6
-6
(C1jH:i):ICH:1]Br + C.,H!)Li ~(CljH:i):1 р = СН2+ С 4 Н'II + Li8r
МСТIIJll'IIТРIIФСIIIIJI­
liP"MI1CTIoIH MCTIiJITpll-
фllСфllРИl1
фС11 ИJl(IЮСфOlll1 ii
+11 -11
-8
+8
(CJjH;i):\ Р = С Н 2 + О =CHC4H!)~(CljH:i):\P =О+СН 2 =СНС 4 Н!)
IIKCII}! ТРllфСIIIiJIфllСфШIИ
Физические свойства
Первые ',етыре ',лена гомологического ряда этиленовых углеводорО­
дов
-
газы. Олефины с числом углеродных атомов от
сти. Далее идут твердые тела.
76
5 до 17 -
жидкО­
олефИНbI с нормялыюй цепью углеродных ятомов.кипят при более вы­
. кой темперятуре, "ем их изомеры с рязветвленнои цепью. Перемеще­
со двойной связи в центр молекулы вызывяет повышение темперятуры
ние еНИЯ олефиня. цuс-Изомеры обычно кипят при более высокой темпекип
IIтуре. "ем транс-изомеры.
•
П.
еремещение двоинои связи в центр моле-
р лы ПОВblшяет темперятуру плавления. транс-Изомеры плявятся при
ку.
.
более высокои темперятуре. чем цuс-изомеры.
плотность олефинов меньше единицы. но больше, чем плотность соот­
ветствУЮЩИХ пяряфинов. В гомологическом ряду оня увеличивается. Для
олефинов Хllряктерны более высокие покязатели преломления света. чем
для ПIlРЯфИНОВ.
РIIСТВОРИМОСТЬ олефинов в воде весьмя маля. но выше. чем Ilарафинов.
Следует знметить. что олефины растворяются в рястворях некоторых со­
лей тяжелых металлов, обрязуя с ними комплексные соединения (няпри­
мер. в растворях ClI 2C1 2)·
Для олефинов хяряктерно избирательное поглощение инфрякрасных
лучей. поэтому инфрякрясные спектры с успехом используются для устя­
новления их строения. Тяк, няпример, для винильной группы вялентным
колебяниям двойной связи отве'lt'Iет полося около
ционным
колебяниям
связей
С-Н
-
1650 CM- 1• я деформа­
полосы 920 и
интенсивные
980 CM- 1. АНЯ.1l0ГИЧНЫМ колебяниям в группировке СН=СН соответству­
ют полосы 1660 и 965 см- 1 (транс) или 670 см- 1 (цис) , а в группировке
СI-I 2 =С - полосы 1660 и 890 CM- 1.
Вялентным и деформяционным колебяниям связи с- н у двойной свя­
зи также отвечают иные колебяния, чем в случае ялкянов, я именно
и около 1420 см- 1 соответственно.
ультряфиолетовой облясти спектра олефины
180-200 нм.
3100-3000
В
поглощяют
при
Спектры ядерного магнитного резонанся также весьмя хяряктерны для
олефиновых протонов.
Эти
протоны щ\ют химические сдвиги около
4,5-6 м. д., т. е. в более слябом поле, чем протоны у НЯСl;>lщенных атомов
углеродя.
В тябл. 5 приводятся важнейшие константы первых представителей
рвдя О.1lефинов.
т я (j л
1I
Ц <1
г
I
5. Физические свойства IleKoTopbfX этилеlЮВЫХ углеводородов
ПлотУглеводород
т. пл., ос
т. кип .• ·С
ность
d!O
I
Покаэа·
тель пре·
ломлеllИА
20
ПО
ЭТllлен
СН 2 =СН 2
-169.2
-10:3.8
0.5701
1.36:з2
ПРОГlllлен
СН 2 =СН-СН:\
-185.2
-47,7
0,6701
Ц62:з l
I·БУТ~II
СН 2 =СН-С 2 Н"
-185.3
-6.3 . 0.6:301
1.377il
0.6442
1.39924
ЦЩ··2·Бутен
CH1\
/СН 1
~/:=C"H .
-138.9
3.5
77
Ок.ончанuе mабл.s
Плот-
Углеводород
mранс-2-Бутен
Изо бутилен
т. пл.,·С
СНз':с
/Н
-с
н/ "СН з
СН 2
T-CH~
т. КИП.,·С
НОСТЬ
dl°
Покаэатель пре.
ЛОМJlеННII
,
nl/
1
105,9
0,9
О,660 З
1,38424
-140,8
-6,9
0,6313
1,3796
-165,2
30,1
0,641
1,3715
-151,4
37,0
0,656
1,3822
-140,2
36,4
0,649
1,3793
-137,6
231,2
0,650
1,3777
-168,5
20,1
0,633
1,3630
-133,6
38,6
0,662
1,3869
1,3877
;
~
11
СН з
I-Пентен
цuс-2-Пентен
mранс-2-Пентен
2-МеТlfл-l-бутен
сн 2 =снсн 2 -сн 2 сн з
CH;~c/C2H5
Н/
"н
С Н;\':с:= С/Н
Н/
"с 2Н 5
СН2=Т-СН2СНЗ
СН;!
:
3-МеТlfл-1-бутен
СН 2
ch-тн-сн з
СН!
2-МеТllл-2-бутен
сн!-т=сн-сн з
СН з
I-Гексен
СН 2 =СН( сн 2 )з сн з
-139,8
63,Б
0,673
I-Гептен
СН 2 =СН(СН 2 )4 СН З
-119
93,6
0,697
1,3998
I-Октен
сн 2 =сн(сн 2 )"СН з
-101,7
121,3
0,716
1,4090
2,4,4- Трнметил-
СН 2=т- СН 2 С(СН з ):\
93,5
101,4
0,715
1,4096
170,6
0,740
1,4215
I 0,791
1,4443
I-пентен
СН З
1-Децен
СН 2 =СН(СН 2 )7 СН З
-66,3
1-Октадецен
СН 2 =СН(СН 2 )15 СН З
18
I
При температуре кипения.
2
179
(2.lifПа)
При -100 ос з ПРII -1 О ос
4
При -25 ос
Химические свойства
Главным структурным элементом, определяющим реакционную спо­
собность олефинов, является двойная связь, представляющая собой соче­
тание 0'- и 7t-связей (sр2_ ги бридизация)_ При сравнении структурных и
78
3Н
ер гетических
параметров молекул алканов и алкенов видно, что двойu
ная связь значительно короче и прочнее ординарнои связи.
ия
двойной
связи
меньше,
чем
энергия
двух
.
О
днако энер-
ординарных,
на
~2 1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные
G-~вязи путем присоединения по месту двойной связи двух атомов или
атомных групп. Скорость такого присоединения определяется характером
присоединения молекулы и характером заместителей у двойной связи.
H-CH 2-CH2R
Длинасвязи,нм
Энергия
H-CH2-CH~CH-H
0,110
0,1535
0,100
0,150
0,134
0,108
427,1
349,6
322,4
360
607,1
435,5
связи,
кДЖ/моль
Таким образом, для олефинов наиболее типичны реакции nрисоеди­
ненuя. Однако следует иметь в виду, что олефины способны и к реакциям
замещения, причем некоторые из них идут значительно легче, чем у пара­
фи нов. Наиболее легко замещается водород у а.-углеродного атома по от­
ношению к двойной связи благодаря
n-сопряжению (сверхсопряже­
(1,
нию ): орбитали СВ -связей в а.-положении к двойной в не которой степени
перекрываются с негибридизованными орбиталями n-связеЙ. При разры­
ве таких СН-связей образуется радикал, стабилизированный сопряжени­
ем (ср. с. 47).
В реакциях при соединения двойная связь обычно выступает как донор
электронов. Поэтому для олефинов характерна реакция электрофильного
присоединения (АЕ)'
1. Гидрирован.не. Алкены непосредственно молекулярный водород не
присоединяют. Эту реакцию можно осуществить только в присутствии ге­
терогенных
(Pd, Pt, Ni)
или гомогенных (например, хлортрис-трифенил­
фосфин-родия RhСl(РhзРЫ катализаторов. Наиболее часто проводят ка­
талитическое гидрирование на гетерогенных катализаторах:
СН 2 =СН 2
+ Н 2 ---+ СН з -СН з : ыi =-137,3 кДж/моль.
Поскольку для гидрирования необходима адсорбция молекулы олефина
на катализаторе по двойной связи, олефины гидрируются тем легче,
чем
меньше
С. В. Лебедева.
заместителей
имеется
у
двойной
связи, -
правило
Известен также метод химического гидрирования с помощью сильных восстановителей,
например ДIfИМИда
NH = NH, образующегося при действии на гидразин окислителей:
R-CH=CH 2 + N2H2 ---+ R-СI-I2 -СН з + N2·
2. ГалогенирО!sанне. ОлефИНbl легко присоединяют галогены:
СН 2 =СI-l 2
+ ВГ2 ---+ сн 2 вг-сн2 вг.
Скорость реакции зависит от природы галогена и строения олефина.
Фтор реагирует с воспламенением ., иод -
------•
медленно на солнечном свету.
Присоединение двух атомов фтора сопрово
ется выделеиием 452,2 кДж/моль, тогда
КаК дпЯ разрыва С-С-связи требуется 350
моль. При соединение двух атомов хлора
СОпровождается выделением всего 138,2
моль.
79
Реакция присоединения облегчается при увеличении числа заместителей,
у двойной связи. Это объясняют большей поляризацией этиленовой связи:
под влиянием замещающих радикалов и увеличением устойчивости про-·
межуточных радикалов или ионов благодаря сверхсопряжению.
.1
Галогены могут присоединяться к олефинам по радикальному или ион.
ному механизму.
При р а Д и к а л ь н о м присоединении атомы галогена (обычно получа ...
ются по схеме ВГ2 ~2Bг) присоединяются к наиболее доступному иэ
атомов углерода с образованием наиболее стабильного из возможных ра­
дикалов, в случае, например, пропилена возможно образование двух ра­
дикалов:
СН 2-СН-СН 2
'
КС
снз-ёН-СН2ВГ (1)
•
СН З-СНВГ-СН 2
Легче образуется и более стабилен радикал
(1).
(Ш
В этой радикале сво­
бодный электрон сопряжен с электронами пяти СН-связей, тогда как в
радикале (11) он сопряжен только с электронами СН-связи. К тому же
крайний углеродный атом более доступен для атаки. Радикал (1) далее ре­
агирует с молекулой галогена с генерацией нового атома галогена:
.
СН з СНСН 2 Вг
+ ВГ2
_
СН з СНВгСН 2 Вг
.
+ Вг.
1.2·диБРОМlI(юпаll
Чаще происходит при соединение по ионному электрофильному механиз­
му. Молекула галогена атакует двойную связь, захватывая электроны и об­
разуя так называемый 1t-комnлекс. Затем отделяется отрицательный ион
галогена. К возникающему карбениевому или бромониевому катиону
(ср. а-комплекс, гл.
+I1r-Dr
15) присоединяется
Н2 С=СН2 -Н2 С
отрицательный ион галогена:
+
-
~ СН2 - СТ2- СН 2 + Вг -iН2--iН2
Вг- Вг
Jt·комплекс
Вг
Вг
или
Вг
1,2 -дибромзтан
Относительно природы промежуточного катиона можно сделать за­
ключение по стереохимическим результатам реакции. Свободный карбе­
lIиевый катион - плоский и, следовательно, присоединение к нему не бу­
дет стереоспецифическим. Бромониевый катион, наоборот, должен при­
водить
к
образованию
толы<О
mpaHC-aдJJYKTa
(аддукт
-
продукт
присоединеIlИЯ). По-видимому, рассматриваемые реакции могут идти с
образованием обоих типов катионов, так как известны случаи как стерео­
специфического, так и нестереоспецифического галогенирования.
Присоединение, по-видимому, идет через бромониевый катион, так как
в тех случаях, где может быть доказана конфигурация, были получены
продукты присоединения транс-конфигурации.
80
возможность существования бромониевых ионов доказана получением
стойких солей, например \~(SbF6
в рамках теории МО реакция электрофильного присоедннения брома к этилену может
бытЬ описана следующим образом. При активированном столкновении молекул этнлена и
брома происходит обратltмое образование 7t-комплекса путем перекрывания высшей заня­
той орбитали этилена 7t-типа со свободиой молекулярной орбиталью брома (а*-типа)
(рис.
33). Далее с выделением иона происходит образование либо бромониевого 7t-комплек­
са путем перекрывания свободной до катиона брома с высшей занятой 7t-орбиталью этиле­
на, либо карбениевого иона (а- комплекса) путем перекрывания низшей вакантной орбитали
бром-катиона с высшей занятой а-орбиталью одного из атомов углерода с появлением ва­
кантНОЙ орбитали (одноэлектронной) у соседнего атома углерода.
а*СН
- (J*CC
n*С=С
*-tt****
Рис.
33.
nС=С
(JCC
аСН
}
орбитали
)
орбитали
Разрыхляющие
Связывающие
Схема молекулярных орбиталей этилена
Реакция олефинов с галогенами служит для качественного и количест­
венного определения их в смесях. По количеству поглощенного брома
можно установить содержание олефина.
3.
Гидрогалогенирование.
Олефины
присоединяют
также
все
галогеноводороды:
СН 2 =СН 2
+ НСI --+ СН з -СН 2 СI.
XJюристый
этил
Наиболее легко реагирует иодистый водород. Фтористый водород часто
(ОСОбенно в присутствии влаги) присоединяется с одновременной полиме­
РИзацией олефина. С хорошими выходами алкилфториды получаются при
действии на алкены растворов
HP в третичных аминах (триэтиламин,
пи­
РНДИН) и тетрагидрофуране при О ос. Присоединение хлористого водорода
Требует обычно нагревания или присутствия катализаторов.
Л1еханизм электрофильного присоединения галогеноводородов двух­
СТупенчатый, как и механизм присоединения галогенов, однако n-комп­
лексы в этом случае, вероятно, не образуются: реакции идут через карбе­
IIНевые ионы и, следовательно, должны быть нестереоспецифичными.
Наблюдаемая в ряде случаев стереоспецифичность объясняется тем, что
в реакции участвуют не свободные карбениевые ионы, а ионные пары
Карбениевый ион - анион.
81
Присоединение галогеноводородов к несимметричным олефинам про­
исходит в соответствии с nравuлоJt Марковн.икова: водород направля­
ется преимущественно к наиболее гидрогенизированному углеродному
атому. Такое направление преимущественного присоединения галогена­
водорода определяется относительной стабильностью образующихся на'
первой стадии реакции катионов: катион (1) более стабилен, чем ка
тион (11), так как в нем более выражено сверхсопряжение (свободная ар
биталь катиона (1) может взаимодействовать с электронами шест
СН-связей, в то время как в катионе (П) только двух CH-связеЙ). На вто
рой стадии реакции оба катиона присоединяют анион галогена:
снз-сн-сн з + сг --+- СНз-СНCI-СН з
СН З-СН=СН 2
+
НСI
1
-(
_
СН з-СН 2-СН 2 + CI --+- сн з-сн 2-снр
11
Относительные возможности двух направлений реакции гидрогалоге-,
нирования хорошо иллюстрирует приведенный на рис. 34 график. Более,
устойчивому карбениевому иону отвечает более устойчивое переходное
состояние с меньшей энергией активации (E~), обеспечивающее боль­
шую скорость реакции.
Правило Марковникова соблюда­
ется только при ионном (гетеролити­
Е
ческом) механизме присоединения га-'
логеноводородов. При радикальном:
(гомолитическом) механизме при­
соединения галогеноводорода проис­
Рис,
-
XoiJ (коорiJuнаmоJреахцШ1 -
34,
Схема потенциальных кривых
гидрогалогенирования
ходит в обратном порядке
сидн.ыЙ эффект Караша.
-
nepOK~
. .
Радикальное присоединение на­
блюдается, например, при действИИ
на олефины бромистого водорода в присутствии пероксидов (или кислоро­
да). Последние взаимодействуют с бромистым водородом и освобождают
атомы брома, которые и присоединяются по месту двойной связи к край­
нему углеродному атому, так как при этом образуется более стабильныЙ
радикал. Возникающий радикал продолжает реакционную цепь:
,
Н 2О 2
+
2НВг---+2Вг+ 2Н 2 О;
СНЗСН:= СН 2 ~ СН зСН'СН 2 Вг
Радикальное присоединение
4.
HF и HI
+НВг) СН зСН 2СН 2 Вг + Вг',
никогда не наблюдалось.
Гипогалогенирование. Присоединение колефинам гипога.rюгениТ­
ных кислот и их эфиров также происходит по правилу Марковникова:
более электроотрицательный в гипогалоидных кислотах хлор направляет­
ся преимущественно к наиболее гидрогенизированному атому углерода:
сн з -СН =
82
-+
CH 2 +HOCI---+ СН з -СНОН-СН 2 С1,
Чтобы получить продукт присоединения к олефину, например хлорно­
ватистой кислоты, не обязательно использовать для реакции готовый рас­
твор этой кислоты. Можно взять хлор и воду. Тогда реакция идет по схеме:
СН 2 =
CH 2 +CI 2 +H 2 0 __ CH 2 C!-CH 2 0H+HCI.
Механизм реакции в этом случае можно представить следующим обра-
5. Гидратация. В присутствии катализаторов олефины присоединяют во­
ДУ, образуя спирты. Реакция, очевидио, идет по карбкатионному механизму,
так как в исследованных случаях она оказалась нестериоспецифичной:
I+~I-
СН З - =СН 2
Т
+
+Н
СНЗ
+
СНз-т-СН а
-
v
СН.-С-СН
.1
I
СН з
СНЗ
ОН
з
<:-
I
СН-С-СН
з
I
з
+
Н
сн з
Для получения спиртов часто используется поглощение олефинов кон­
центрированной серной кислотой. При этом промежуточный карбкатион
может реагировать как с содержащейся в кислоте водой с образованием
Спирта, так и с анионом серной кислоты с образованием этилсерной кис­
лоты. Последняя может получаться и при взаимодействии спирта с серной
кислотой:
Олефины поглощаются серной кислотой тем легче, чем больше ал­
КИЛьных радикалов имеется у двойной связи. Этилен поглощается только
96-98%-ной кислотой, пропилен -75-80%-ной, изобутилен 34-50%-ноЙ. Этой закономерностью можно воспользоваться для разде­
JJения олефинов различного' строения.
Сернокислотный метод гидратации олефинов имеет ряд существен­
HblX недостатков: большой расход серной КИСОТbI, трудность ее регенера­
ЧНIJ, коррозия аппаратуры и др. В настоящее время разработано и освое­
но промышленностью несколько новых методов. Например, гидратацию
83
':Iтилена производят при давлении не ниже 9,9 МПа (100 атм) и темпера~~
300-350 ос на силикагеле, пропитанном смесью фосфорной и воль
туре
фравомой кислот.
6.
Гидроборирование. Олефины присоединяют по двойноii связи бороводороды. Моно.
мерный бороводород ПРlfменяется в виде комплекся с теТРЯГI1ДРОфУРЯНОМ ИЛIf ЯМIIНЯМИ. В за
ВИСИМОСТlI от реягентов реякция проводится при температурях 0-100 ·С. Процесс обычк
не остаНЯВЛllвается ня еТIIДИИ образования МОНОlIлкилБОРIIНII. KOHe'IHbIMI1 ПРОДУКТIIМИ ЯМ
ютея ТРИRЛКllлБОРRНЫ. НRправление присоеДlIнения соотвествует правилу МllРllOВНИК08
(бор НRправляется
1<
более гидрогеНIIЗИI.JOВIIННОМУ атому углеРОДII). хотя определяющим'
здеСI> являются пространетвенные. а не '~лектронные фаIПОРЫ:
РеllКЦИЯ гидроборироваНIIЯ IIСПОЛl>зуетея дЛя превращеНIIЯ аЛI<енов в спирты е ориента··
циеii гидрокеl1ЛЯ ПРОТIIВ правила Марковникова (гл. 3.1 ).
Окисление. Олефины окисляются кислородом воздуха или другим ..
окислителями. Направление окисления зависит от условий реакции и вы·
бора окислителя.
а) Олефины с кислородом воздуха без катализатора образуют гидропе·
роксиды, распадающиеся с образованием спиртов и карбонильных соеди·
нениЙ. Воздействию кислорода с разрывом связи подвергается обычно
наиболее подвижный водородный атом, находящийся в ~-положении по
отношению к двойной:
СН:г-СН~Н2J!...н ~
~ CH2=CH-CH~-a
СНгСН-СНгО-О-Н _~
ml
{
CH~=CH-CHPH + R'
О
CH~=CH-J!H + Н
б) Кислородом воздуха в присутствии серебряного катализатора оле­
фины окисляются до органических оксидов (эпоксидов, см. гл. 4.2):
2C~~/H2
Аналогично
действуют
гидропероксиды
ацилов
(реакция
Прuле­
жаева):
CH~=CH2
~
+ C1;H,,-C-Q-OH
("и'ЩЮI1щюкс.:Ид(iСII:«.ltt J IХ
~
H2(~7H2
О
+ С,;Н"СООН
(1еII:~\lйllt'" КИС.IIота
Олефины можно также окислять в эпоксды С помощью полимерного
реагента
-
смолы, содержащей связанные с ароматическим ядром кар­
боксильные группы и обработанной Н 2 О 2 в кислой среде. Прореагиро'
вавшая смола вновь переводится в активное состояние обработкой Н2О2'
84
в современной Jlа(jораторной и ПРОМЫШJlенноВ
npaKTIII<e в 1<3'leCTBe матриц. на I<OTOPbIX
il'СИ JУЮТСЯ реагенты liЛИ китаJlflзаторы. широко ИСПОJlЬЗУЮТСЯ твердые CHHTeTII'!eCКlle вы­
~~I<~м~леl<улярные материаЛ1>l (1IIt1l!fI()офааны/i CLlHlI1e:I). Это могут БЫТL> СШIIтые нераство­
( 'Ie IIJIII ЛIlнеi"lные растворимые ВЫСОI\Омолеl<УJlярные соедииения. НаliБОJlее '!асто 11СПО­
I'IIM"
ЛL>ЗУЮТСЯ МОДИфlщироваННl>lе IIJlИ COnOJlliMepHbIe материаJlЫ на основе ПОJlllСТIllJOла (гл. 15).
пuлщн<РIIЛОВ. пuЛIIмеТllлаl<!JIIЛIIТОВ (гл. 6.3). nOJllllIMIIAOB н т. п. ИСПОЛЬЗУЮТТIIJ<же ПОЛИСIIХII­
)llДbl (гл. :~3.:~) н npOДYI<Tbl liX МОДIIФliКIIЦI1l1. ОсобеННОСТЯМII реакций НII ПОЛllмерных HOCIITe-
~ях ЯВJlяется леП,ОСТI, регенеРIIЦИII НОСlпеля и леп\Ость выделения ПРОДУКТОВ реIlКЦIIII. По­
слеДliее часто ДОСТllгается простым фНЛl>ТРОВIIНllем. цеНТРIlФУГIlРОВlIнием ИЛII ОСЮl<ДеНllем
ПОЛIlмери ПОДХОДЯЩliМ раСТВОРIIтелем. ЭПI особенности дают ВОЗМОЖIЮСТЬ в промышленно­
СТ11 леп(О автомаТ1IЗИРОВIIТЬ процессы.
В "ячестве ПОЛIIмерных реllгентов могут быть IIСПОЛЬЗОВIIНЫ 11 IlOнообменные смолы.
Ионоо(jменные смолы в ХЛОРlIдноi\. бромидноi1 ИЛII иоДнДной фОРМi\Х, оБРllБОТЮlНые. напри­
мер. бромом. могут быть НСl10Лl>зованы Д1IЯ бромироваНllЯ олефннов 11 ДРУГIIХ 0prIIHII'leCКlIX
соеДJlнеНllii. Смолы в ГllдlJИдноii форме могут превраЩIIТL> ВIЩllНlIльные Дllбромиды в
олефнны.
В) Рюбавленный раствор перманганата каJJИЯ (реакция Вагнера) ИJIИ
пероксид водорода в присутствии катализаторов (CгO:~, OS04 и др.) с оле­
финами образуют ГЛИКОJJИ. ПО месту двойной связи присоединяюп:я два
гидроксила:
:~СН~=СН~+2КМI104+4Н~О ~ :3СН20Н-СН~ОН+2МI1()~+2КОН
CH2=CH~+H202
O~OI » СН 2 ОН-СН 2 О1-1
·.. Tlblll'III"JIIIKf)JII,
Вероятные механизмы этих реакций:
СН,
11 - + МпО~
СН 2
~
ЗМпО~
СН,,-О,,_
снрн
l
;МI10 2
СН -О
1
<
CHpl-l
2
+ HP~ 2МI10 2 + MIlO;j +
+МI10:;
.
2НО-
СН,
СН 2-О"
11.0.
СНрН
IJ - + 0501 ~
/0502 ~ 1
+ 050
CH~
СН 2-О
снрн
'1
l
г) При действии концентрированных растворов окислитеJlей (перман­
ГnlIЯТ каJJИЯ, хромовая КИСJJота, азотная кислота) МОJlекула олефина раз­
РЫвnется по месту двойной связи, образуя кетоны или кислоты:
СН'-С=СН-СН
~
.,
1
.I
СН;\
СI-I;\-СО + СН;\СООI-I
I
СН:\
укс.:yt'ШISI
КIIL'ЛЩ';t
И'\~'''11I
1IIIIJIIIIIJJllш;ttl
КЩ,'JItI1''''
Эта реакция широко ИСПОJlьзовалась ДJlЯ опредеJJения строен ин олефи­
I10в, так как по образовавшимся кислотам и кетонам можно сделать ЗI'I­
КJIIО!lение о строении и составе радикалов, связанных с ЭТИJlеновой груп­
ПИРовкой в исходном соединении.
85
Для синтетических целей реакция окисления водным раствором перманганата использу. I
ется редко из·за низкого выхода целевых продуктов. Однако продукты окисления могут быть I
ПОЛУ'lены с высоким выходом при использовании перманганата калня, растворенного в беН-i
золе в прнсутствии краун-эфира (гл. 4.20, или водного раствора перманганата If периодат,
(реагент Лемае-Рудлеффа) или перманганата калия с примесью тетраоксида рутеНИII.
Существуют и реагенты, позволяющие остановить окисление на стадии образования альде_
гидов, например СГО2С12 и хромилтрихлорацетат.
.:
д) При определении строения олефинов в качестве спецИфическог~
окислителя используется озон реакция озонирования Гappuec~
(озонолиз). Озон присоединяется по месту двойной связи, образуя не-';
стойкие, взрывчатые озониды. При обработке водой они образуют перокт~
,.'
сид водорода и карбонильные соединения*:
СН З-СН=СН 2 + Оз ~
[СНз-СН-СНзl
L ' "о; J
~ СН:гСН-О-СН2
6-6
ИJ(Ю301IИЛ.
Альдегиды при этом могут окисляться пероксидом водорода до кислот,
С целью сохранения альдегидов среди продуктов реакции расщепление
озонидов проводят путем восстановления [с помощью Zп +СНзСООН,
(СНзО)з Р или LiAIH 4 и др.]. Полученные таким путем альдегиды исполь­
зованы в синтезе феромонов (Г. А. Толстиков).
7.
Алкилирование. Особое место среди реакций присоединения оле·
финов занимают процессы, идущие с удлинением углеродной цепи. К та­
ким процессам относится, например, аJlкилирование парафинов ОJlефина­
ми в присутствии фосфорной или серной кислот
(СН З )2 С =СН 2 + (СНЗ}JСН
I1,РО.;.
(СН з ):f=Н-СН 2-С(СН З }J
И~'юктаl(
или термическое (при
500
ос и
10-30
МПа, или
100-300 атм):
СН з
СН з
сн з-6::сН 2 + Н+ ~ снз-Lн з
(СНз~С+ + СН2=С(СНЗ~ ~ (СНЗ~С-СН2-qснз~
(СНзJзс-сндСНзJ..z + НС(СНЗ}J ~ (СНз)зССНfН(СНЗ)2 + (СНз~i: и т. д.
Этим путем можно получать парафины с изостроением, например изо­
октан, представляющие большой интерес как высокооктановое моторное
топливо.
* Превращение первичного озонида в изоозонидлротекает в две стадии: распадпервичногО
озонида на карбонильное соединение 1 и карбоНl1ЛОКСИД 11 и присоедннение карбонилоксИд8 к
.
карБОНlIЛЬНОМУ соединению
СНз-СН-СНз ~ СНз-СН=О + снр6-б ~ СН:гСН-О-СН2
"о;
86
1
11
6
6
8.
Диспропорционирование. Реакции диспропорционирования (ме­
аmезас) олефинов протекают в присутствии катализаторов Циглера
rпоследние получают взаимодействиемWСI 6 и MoCl s с этилалюминий­
дихлоридом):
2R-CH = CH-R' <=t R-CH=CH-R+R'-CH-CH-R'.
На основании экспериментальных данных, полученных с помощью дей­
терированных олефинов, предполагают, что диспропорционирование осу­
ществляется 'lерез промежуточное образование четырехчленного цикла.
Эта реакция имеет промышленное значение; так, например, из этилена и
2-бутена можно получать пропилен.
9. Теломеризация. Теломеризацией называют особый вид оборван­
ной на ранних стадиях цепной полимеризации непредельных соединений
с участием других непредельных или предельных соединений, поставляю­
щих концевые группы. Последние являются также передатчиками цепи.
В результате теломеризации образуется смесь продуктов различной, но
lIеБОJll,ШОЙ молекулярной массы (теломеРbl):
R-Х+nСН 2 =СН 2 --1ИII~ R-(СН 2 _СН 2 )n- Х ,
где
n= 1, 2, 3
и т. д.
Теломеризация может проходить по радикальному или ионному меха­
низмам. В первом случае реакции инициируют УФ-излучением или в ка­
честве инициаторов применяют пероксиды, во втором случае в качестве
катализаторов используют ионные соединения, например кислоты Льюи­
са (ер. гл. 1.4).
Продукты теломеризации используются в различных направлениях, на­
пример в синтезе галогензамещенных кислот (гл.
10.
6.2).
Полимеризация. Одним из наиболее важных для современной
техники превращений олефинов является реакция полимеризации. По­
лимеразацией называют процесс образования высокомолекулярного ве­
Щества (полимера) путем соединения с помощью главных валентностей
молекул исходного низкомолекулярного вещества (мономера).
Полимеризация олефинов может быть вызвана нагреванием, сверхвы­
СОКИМ давлением,
J<атализаторов.
облучением, действием
свободных
радикалов
или
В реакцию полимеризации могут вступать как индивидуальные вещест­
так и смеси мономеров. В последнем случае говорят о смешанной по­
JIНмернзации - соnолuмерuзаlluи.
I\(i,
Склонность к полимеризации зависит от строения олефинов: обычно
З(iмещение водорода радикалами по обоим концам двойной связи мешает
ПОЛимеризации (пространствеНlIые трудности).
Полимеризация олефинов в зависимости от механизма может быть
ДВух видов: радикальная или ионная.
Радикальная полимеризация вызывается (инициируется) ве­
lЦествами, способными в условиях реакции распадаться на свободные
87
радикалы (пероксиды, диазоаминосоединения и другие вещества), а TalOК
действием теплоты, света. Растущая частица полимера вплоть до момент'
стабилизации представляет собой свободный радикал. РадикаЛЫ-ИНИциа'
торы входят в состав молекул полимера, образуя его концевую группу:
Обрыв цепи происходит при столкновении с молекулой регулятора рос.
цепи, которым может быть специально добавленное вещество, легко отм-;.
ющее атом водорода или галогена.i
Каталитическая, ионная (катионная и анионная) полимери~~
за Ц и я происходит благодаря образованию из молекул мономера реакцк- ;
онноспособных ионов.
Катализаторами катионной полимеризации являются кислоты, хлори.
ды алюминия, бора и т. д. При каталитической полимеризации катализа­
тор обычно регенерируется и не входит в состав полимера. Процесс MO~
жет иметь цепной характер и протекать с очень большой скоростью. Поз;
тому ионную полимеризацию проводят при очень низких температурах.
Механизм катионной полимеризации этилена в присутствии АIСl з и
следов НСI можно представить следующим образом:
СН 2 =СН 2
+ HAIC1 4
~
CH:гCH~ + ПСН 2 =СН 2 ~
СНз-СН~
+
АЮ;;
СНз-СН2-(-СН2-СНг):·
Обрыв цепи может произойти вследствие захвата растущим катионом
аниона или с потерей протона и образованием концевой двойной связи.
Интерес к этому виду полимеризации обусловлен успешным его приме"
нением для получения полиэтилена низкого давления (в присутствии
R
2AICI
и ТiСl з катализаторов Циглера-Натта), а также стереорегуляр'
ных полимеров (см. ниже). Катализаторами анионной полимеризации слу­
жат щелочные металлы, их амиды, металлорганиtlеские соединения и т. Д.
Механизм
анионной
полимеризации
под
влиянием
металлалкилоВ
можно представить следующим образом:
СН 2
=
СН 2
+ R-M ~[R-СН2-СН2ГМ+;
[R-СН 2 -СН 2 ГМ+ + ПСН 2 = СН 2 ~[R-СН2-СН2-(СН2-СН2)t/ГМ+'
На реакцию полимеризации сильное влияние оказывает присутствие в
мономере нuчтожных примесеЙ. Некоторые примеси, например мноГО­
атомные фенолы, ароматические амины, хиноны, способны задерживатЬ
полимеризацию. Такие вещества называются ингибиторами (заме)J/lИ­
телями). Ингибиторами пользуются при хранении мономеров.
В результате полимеризации могут получаться жидкие вещества раз'
личной консистенции или твердые вещества. Многие из них широко при'
меняются в технике. Изменяя условия полимеризации, а также применЯ1l
полимеризацию смеси различных веществ, можно получать продукт Ь1
с З<lданными свойствами. В определенных условиях полимеризация можеТ
88
быть прекращена на ранних стадиях процесса в результате обрыва реакионной цепи.
Ц Различают три типа твердых полимеров: эластомеры (каучуки), термопластЫ и термореактивные полимеры. Последние при нагревании теряют
пластичность и растворимость.
Полимеры,
содержащие
асимметрические
атомы
углерода
(см.
гл. 11.1), могут быть пространственно упорядоченными (стереорегуляр­
ными) - синдиотактическиАШ (1) и изотактическими (11) - или не­
упорядоченными
-
атактическими:
\;!} \/ \,!} \!1 y~
,,/ " / "
СН2
СН2
/С,СН2
/ " / ,,/
СН2 СН2
СН2
11
Как видно из формул, различия меж,ду этими полимерами связаны
с расположением заместителей в пространстве по отношению к главной
цепи. Конфигурация полимеров в значительной степени определяет их
свойства.
Широкое использование полимеров в быту и технике в значительной степени определило
современную научно-техническую революцию, но в то же время породило серьезную эколо­
гическую проблему. Биосфера Земли непрерывно загрязняется полимерами и продуктами ЮС
переработки ИЛlI разложения, некоторые из которых обладают большой токсичностью. Поэ­
тому в последнее время много внимания уделяется получению «биодеградирующих» полиме­
ров. которые могли бы по истечении определенного времени перерабатываться микроорга­
низмами с образованием безвредных веществ.
11.
Изомеризация. При высоких температурах или в присутствии ка­
тализаторов олефины способны изомеризоваться. При этом происходит
или перемещение двойной связи (обычно в центр молекулы), или измене­
ние строения углеродного скелета, или то и другое одновременно:
СН:Г-СН-СН2-СНЗ -с: снз-сн
CH:I-
1
СН-СН:1
-CH 2
СН: 1
ОтделЬНblе представители. Применение
ЭТилен в больших количествах выделяют из газов крекинга и коксова­
НИЯ и используют ДJJя получения полимеров (полиэтилен, ПОЛИВИНИЛXJ10рид), растворителей (спирт, ДИXJ10рэтан, эфиры гликолей), антифризов
(Жидкостей, понижающих температуру замерзания воды), уксусного аль­
дегида и уксусной кислоты.
В последнее время этилен стал применяться в качестве регулятора ро­
ста растений: используются вещества, разлагающиеся в растениях с об­
Разованием этилена.
Пропилен также выделяют из промышленных газов и применяют, глав­
образом, ДJJя получения полипропилена и изопропилового спирта. ИЗ
HblM
89
последнего получают ацетон. Исходя из пропилена можно также получи~
акрилонитрил (гл. 6.3), глицерин (гл. 3.4) и фенол (гл. 20, А). Ниже пр..
ведены схемы промышленного использования этилена и пропилена.
'
Бутилены с нормальным ~троением перерабатываются на дивин~
(важнейший мономер в производстве синтетического каучука). ИзоБУТIi
лен используют для синтеза изопрена (мономер, используемый в ПРона
водстве изопренового каучука), высокооктанового топлива (изооктана~
полиизобутилена.
"
Пентены (амилены) с нормальным строением изометризуются в изоа
милены, и последние дегидрируются в изопрен (гл. 1.3).
Один из высших гомологов этилена цuс-9-трикозен СН З -(СН 2 )l2-СН=СН-(СН2)7-СНЗ вещество, привлекающее самцов до
машней мухи. Он используется для прекращения ее размножения. Таки,
вещества называются феро.м.онаJtlJ..
схема
2.
Промышлеllllое ИСПОЛЬЗ0ваllие этилеllа
Синтетичесхие каучуки
t
CHz=CH-СН=СНz
ДИВИИИJI
t
дсrидpирование
СНэ-СНzОН
окисление
СНэ-СНО
- - - - -......
-
:muю8ыil спиpr
ухсуcиыil am.цеnщ
t
СНэСООН
..
уксусн•• КИCllorа
t
пcwurеризаци.
СНэ-СНО
It
Н2О
пев
CCl.
CHzC\ -(снz)п-ссlэ
~
ICHz
Синтетн чес:кое
CHz
02
(CUCl21. (Pd Cl 21
волокно
и ар yrие м.териanы
CHzOH-СНzС\
C 6 H s -С z Н s
i
СН2 -СНz
........ 0 /
окис.
Clz
ОJ<ИCllСИИС (кат.ди,атор
Ag)
t
этилена
C 6 H s-СН=С Н z
CТНJЮII
1--1
Синтетические
каучуки
[
H - CHZ -]
C6H S
n
полистирол
90
..
С6Н 6
этидбеи30Jl
г
-НС'
днхлорэтаи
хлористый
_ННИJI
1-
[-снz -СНС!
1,.
палИВИНИЛXJIОРИД
Сн,сосн,
ацетон
l
tокисление
д,еrидpирование
HjOZ
CHz=сн -снzон
СН,-снон-сн,
алЛИЛО8WЙ спирт
И30ПРОПИЛО8ЫЙ спирт
Полимеры
t
NH,;Oz
HzO
(Кат.]
1"
CHzCI-СНОН-СНzСl _..__H_O_C_I_ CHz=CH- CHzCl
XIIориcтwА
.лил
450"С
1 CH z =CH-Сн,1.
ПOJlимеризаци_
~
сн,
I
(-сн! -CH-I n
полипропилен
:::1
-g
~
§
~
to
:r:
:r:
CHz-СН-СНzСl
:сн-сно
сн!
Н,С
окисление
алкнлирование
C6~
ICролсив
'0/
~
ЭРИXIIГ ПlAPИВ
шимеры
Эпоксиднwс
s:
"c.v
аКРИJIОI итрил
глицерив
~
х
11>
CHz=C H-CN
снzон-сн(оюснzон
!2НОН
n
I
сн,
I
СИ ,-с-сн-сн,
I
СО+Н !
сн,
смол ..
о
to
,.,
::
:::>
~
q"
снз
'"
"триптан"
1»
о
'"
:r:
::
to
:::>
",
о
СНз-СНz-СНz -сно
изопропиnбензDЛ
СН,-сн-сно
п
I
сн,
~
Спирты
со
C 6 H sOH
СН,сосн,
фенол
ацетон
:::>
1;
!Е
о;
3.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ
(дЛКддИЕНЫ)
Диеновые углеводороды имеют две двойные связи в молекуле, т. е. на
четыре атома водорода меньше, чем соответствующие им предельные уг­
леводороды. Общая формула алкадиенов
CnH 2n - 2'
Поскольку для образо­
вания двух двойных связей необходимо по крайней мере три атома углеро­
да,
в
этом
ряду
гомологи
с
одним
и
двумя
атомами
углерода
не
существуют.
В зависимости от взаимного расположения двойных связей диеновые
углеводороды можно разделить на три основных типа:
1) углеводороды с кумулированными (примыкающими к одному ато­
му углерода) двойными связями - аллен и его гомологи;
2)
углеводороды с сопряженными (конъюгированными) двойными
связями
3)
-
дивинил и его гомологи;
углеводороды с изолированными двойными связями.
Диеновые углеводороды по систематической номенклатуре называются
так же, как и этиленовые углеводороды, только вместо суффикса -ен ста­
вится суффикс -адиен (так как двойных связей две). Положение двойных
связей, как обычно, показывают цифрами. Для некоторых диенов сохра­
нились тривиальные или старые рациональные названия:
СН 2 =С=СН 2
пропадиен. аллен
СН З -СН=С=СН 2
1.2-бутаДllен, метилаллен
СН 2 =СН-СН=СН 2
I ,3-бутадиен. ДIIВИНИЛ
СН 2 -С-СН=СН 2
2-метнл-I,3-бутадиен.
I
СН
изопрен
з
СН З -СН=СН-СН=СН 2
1.3-пентаднен. Пllперltлен
СН 2 =С-С=СН 2
2.3-днметltл-I,3-бутаДltен
I I
СНЗСН:1
Диеновые уrлеводороды первых двух типов проявляют своеобразные
свойства_ Для углеводородов третьего типа характерны обычные реакции
этиленовых углеводородов, только в них принимают участие не одна, а обе
связи с большей или меньшей селективностью_
дллены. В молекуле аллена и ДРУГIIХ соеДиненltй с кумулироваННЫМII связями 'It-связи
располагаются в двух взаимно перпендикулярных плоскостях. Плоскости, в которых распо'
лагаются две пары водородных атомов, также взаимно перпендикулярны. Два крайних угле­
родиых атома алленовой системы находятся в состоянии sр2_ ги брндизации, средний sp-гнбридизаЦИlI (рнс. 35).
92
Эти
особенности
О ения проявляются
стр.
-
квантов о механического
в физических и химиче-
ских СВОl1ствах алленов.
В
частности, в рядУ ал-
ленОВ при двух различных заместителях у конеч­
ных углеродных атомов возможна ?птическая
активность благодаря молекулярнои асимметИИ. Два пространственных изомера, относящи­
~СЯ друг к другу как предмет к своему зеркально­
му изображению, при наложении не совпадают
11 следовательно, представляют собой две раз­
Л;iчные изомерные молекулы. Подробнее об оп­
тическоl"IllзомеРIШ см. гл. 10.
Для алленов характерны легкость гидрата­
ции разбавленной серной кислотой с образова­
нием кетонов, способность полимеризоваться
или конденсироваться с другими непредельны­
МИ соединениями с образованием четырехчлен­
ных циклов (С. В. Лебедев):
Рис.
35.
Схематическое
изображение
строения молекулы аллеиа
и
СН 2 =С-СН 2
I I
Н 2 С-С=СН 2
1,3-ДЛкадиены. Наибольшего внимания заслуживают углеводороды с
СОllряженными двойными связями. Родоначальником этого ряда является
дивинил (1 ,3-бутадиен).
Способы получения 1,3-алкадиенов
Способы получения углеводородов ряда дивинила в большинстве слу­
чаев не отличаются от способов получения олефинов, только соответству­
ющие реакции необходимо про водить дважды или в качестве исходного
вещества применять соединения, уже содержащие двойную связь.
1.
Дивинил и изопрен получают в промышленности дегидрогенизацией
СОответственно бутано-бутиленовых или изопентан-амиленовых смесей
обычно над катализаторами, содержащими СГ20з:
-Н
-Н
C4H 10 -~C4H8 -~С4НIi:
ДИВИИИJI
C5H I2 --=-~С5НIO --=-~C5H8.
изопрен
2. Дивинил, изопрен, диизопропенил (в промышленных масштабах)
3.3):
ПОЛучают дегидратацией гликолей (гл.
СН з -СНОН-СН 2 -СН 2 ОН _-Н 2 О ~CH2=CH-CH=CH2:
l,З-бут3l1ДllОЛ
С Н 2-СН Р Ч
1
дивинил
l,З-6утадиеll
~
СНгСНрН
6утюUlИOJI
93
CH:'-(r(ОН)--СН~-СНРН
-211,0
~ CH 1 =(f- СН=СН 1
СН: 1
СВ: 1
2-МСТIIJI-2,4-CiУТНIIJUЮJI
.11:ЮIlРСII
?H~)н
СН.,-С-С-СН"
. I I
.
СН:\СН: 1
:/,:!-1l11МСПIJI-2.:I-CiУТНIIJtfЮJI
Illlfl:lOlllЮllСIШJI
2-:!-JU1МСПIJl-I,:!-С>УТНдIIСII
:3.
Алкядиены получяют тякже дегидрятацией непредельных спиртов~:
Тяк, например, дивинил
-
дегидрятацией кротилового спирта:
СН з -СН=СН-СН 2 ОН
+н+
+
СНг-СН=СН-СН2-ОН
-
J
\
----
Не обязятельно применяТl> готовый кротиловый спирт. Очень большую
!ЮJJЬ в промышленном производстве дивиниля сыгрял метод С. В. Лебе­
девя,
в
котором
кротиловый
спирт
является
только
промежуточным
продуктом.
Пяры этилового спиртя пропускают наддегидратирующим и де гидри ру­
ющим кятализяторами, в результяте чего получяется дивинил с выходом'
более
70 % (от теоретического):
2C~HiiOH
При
этом
на
---+ CH2=CH-CH=CH2+2H~O+H~.
катализаторе
протекают
следующие
реякции
(Ю. А. Горин):
CH;I-CH~OH
---+
H~+CH;I-CHO
YKCYClIl,lii
HJII,JtC'"'"1J1
2СН;\-СНО ---+ CH;I-CHOH-CH~-CHO
-Н 2 О) CHa-СН=СН-СНО
P-ОКСIIМНСJI>IIII,I,i НJII~IСПIJI
КРОТOIЮIII,lii HJIW\CI'Hj!
КIЮТI-IJlOl\ыit СIIИРТ
IlllllHII11JI
Физические свойства I,З-алкадиенов
Дивинил при обычных условиях
алкядиены
-
-
гяз. Изопрен и другие простейши е
жидкости. Обычные закономерности, свойственные гомо­
логическим рядям углеводородов, действуют и в этом ряду.
94
Для алкадиенов с сопряженными двойными связями характерны ано­
мально высокие показатели преломления света. Благодаря этой особенасти найденные молекулярные рефракции алкадиенов значительно боль­
Н,е вычисленных. Разница между найденной и вычисленной величинами
~оставлнет обычно
1-1,5
единиц. Она называется молекулярной
экзальтацией.
Показателu преломлеНlIЯ ЖltдКИХ веществ может быть Ilсполu:юван для определения
строення 1I 'lltстоты. Его функциеii является молекулярння рефрющия
'1(1
1
М (11;)
-)
MR
1)
IIX
MR:
471 N 3 1. а.
(I(fl~" + 2)
В 'jTOM урявнеНШI, нязывнемом формулой Лорентцн-Лоренцн, веЛI!'IIIНН
MR 1),
в CM:1, хаРЯl\теРIt:iует поляриэуемость веществ и ЗНВИСIIТ от IIX строения; а
полярltзуемостu; N 1. - ЧIIСЛIJ ЛmUАlllr)mа.
-
измеряемяя
'jлектронняя
Для ,1(спеР'Iментяльного определения молекулярной рефрющии I!еобходимо Ilзмер"ть
рефР~lпометром покнзнтель IlреломлеНlIЯ (ГlI) It определить плотность вещества (d), а тю(­
же знат[, его молеl(УЛЯРНУЮ массу (М).
Молекулярная рефраКЦltя может бытu также paCC'lItTaHa ПО нтомным IIлlt СВЯ:iевым реф­
РИIЩIIЯМ по НJЩIIТl!ВНОi\ схеме. Атомные Itли связевые рефРНIЩIШ прнводятся в uбычных
СПР~ВО'lНIIКЯХ. OHI! рассчитаны на основе сопостаВJIения данныхдля болuшего 'I1!сла opraHIIчеСI\IlХ СОСДlIнеНllii.
Для 1,:~-бутаДllена найдена молекулярная рефраlЩIIЯ 21,1 О. Атомная рефРНКЦIIЯ углеро­
:\~ :г:ll~. водород;! 1,100. ИНl\ремент двоiiноii СВЯЗli 1,7:3:3, oТl(YДH молеl(улярная рефраlщltя
P~~IIH ,1 Х :г.418
IВ.?·1 = 1.:\6.
+ 6 х 1.10 + 2 х 1,7:3,3
=
а МОJICI(УJlярная :jкзаJН,таЦI!Я
19,74,
21,10-
Ллкадиены поглощают ультрафиолетовое излучение в значительно 'бо­
лее J.,IIИНIЮВОЛНОВОЙ области, чем алкены. Например, 1 ,З-бутадиен погло­
щает IIрИ
217
нм. Накопление в молекуле сопряжеllНЫХ двойных связей
ведет к дальнейшему смещению максимума поглощения из ультрафиоле­
TOBOi', области в видимую область: при
'IeTbIpex сопряженных двойных
связях ПОЯВJlяется желтая окраска.
В ИК-спектрах для 1,3-алкадиенов хярактерно снижение чястоты и
Уве.nи',ение интенсивности поло<;ы валентных колебаний двойных связей
(примерно ДО 1600 CM- 1).
Химические свойства
\ ,3-аJlкадиенов
две сопряженные 1t-СВЯЗИ обрязуют общее электронное облако - все
'leTblpe углеродных атомя няходятся в состоянии sр2_ ги бридизации (см.
Введеllие, 4.4, а также рис. 29). Это приводит к УКОРО'Iению простой связи
(до 0,146 нм) И К стаБИJlизации молекулы. Так, например, :lнергия образо-
1J","ня МОJlекулы дивинила на 14,6 кДж/моль больше по сравнению с ВЫ­
'IНС,lIеНIIОЙ энеРI'ией образовяния углеводорода того же состава, 110 без
Y'IeTa СОlIрнжения двойных связей. Эту разность называют энергией резо­
H"'"CiJ. Эта особенность в строении диеновых углеводородов делает их
~11()~ОБIlЫМИ присоединять раЗЛИ'lные вещества не только по одной из
'(ВОИIiI,IХ связей, но и к крайним атомам сопряженной системы I! 1 4 1
, - IOJlожение с перемещением двоинои связи.
u
u
95
1.
ется в
Гидрирование. Каталитически возбужденный водород присоединя.
1,2· и 1,4·положения:
~
I
3
4
СН 2=СН-СН=СН 2
+~-12
1 2
СН З-СН 2-СН=СН 2
1 4
СНГСН=СН-СНз
2. Присоединение галогенов. Галогены также способны присо.
единяться к сопряженным системам в 1,2- и 1,4-положения, причем ко.'
личество 1,4-продукта зависит от строения диенового углеводорода, при.
роды галогена и условий реакции. Выход продукта 1,4-присоединения
возрастает при повышении температуры (до известного предела) и при
переходе от хлора к иоду:
I
2
С С
1,2
3
4
СНг=СН-СН=СН2
~1 снр- Н '-СН=СН 2
3,4-ДИXJJор-1-бутеll
2
СНР-СН=СН-СНР
1,4
,
1.4-ДИXJJор-2-бутен
Как и в случае этиленовых соединений, присоединение может происхо­
дить как по ионному, так и по радикальному механизму.
При ионном механизме присоединения, например хлора, первоначаль'
(1) быстро превращается в сопряженный
карбений-хлорониевый ион с положительным зарядом на С 2 и С 4 , кото­
рый можно изобразить двумя граничными формулами (П) или одной
мезомерной формулой (Ш)_ Этот ион присоединяет далее анион хлора в
положения 2 и 4 с образованием продуктов 1,2- и 1,4-присоединения. По­
но возникающий 7t-комплекс
следние, в свою очередь, могут изомеризоваться в ПОДХОдЯщих условиях
один в другой до достижения состояния равновесия через тот же самый
промежуточный карбениевый ион:
CHZ=CH-СН=СН2
+C1 2
..
,
:
СН 2 =?СН-СН=СН 2 -
CI2
-
1
+
О
О+
[CH 2 CI-СН-СН=СН z - - - CH 2 CI-СН=СН-СН z ]
11
сН
сн
CHzCI-СН=СН=СН z
111
+
СГ
11
~
+сг
CH2CI-CHCI-CH=CH2
Э.4-дихлор-l-6утеи
(I,2-приtосдинсние)
___ CH 2 CI-CH=CH-CH 2CI
1,4-дихлор-2-бутеи
(I.4-приtocДинеИИе)
Если в условиях реакции присоединения система близка к СОСТОЯНИIlJ
равновесия, содержание каждого измера в продуктах реакции зависит ()'I
положения равновесия. Обычно 1,4-проДУкт энергетически более ВЫГО­
ден и потому преобладает.
!)6
Наоборот, когда система далека от состояния равновесия, может обра­
зоваться преимущественно 1,2-про.цукт, если энергия активации в реак­
циИ его образования ниже, чем в реакции образования 1,4-про.цукта. Так,
в случае присоединения хлора к дивинилу получается примерно равное
количество
1,2-
и l,4-дихлорбутенов, в случае же присоединения брома
получается около 66% 1,4-проДУкта, так как связь С-Вг менее прочна,
чем связь C-cl, и равновесие для бромида достигается легче. Повыше­
ние температуры приближает систему к равновесному состоянию.
При радикальном присоединении атома галогена образуется сопря­
женный радикал, который также обладает двойственной реакционной
способностью, однако образуется преимущественно 1,4-ад.цукт:
CH2=CH-CH=CH2~ [CH21-CH-CH=CH2~ СН 2 1-СН=СН-СН 2 );
СН 2 1-СН-=СН-=СН2 ~ СН 2 1-СН=СН-СН 2 1 + 1".
1.4·дииод·2·бутеll
Электрофильное прнсоединение хлора к бутадиену в рамках теорин молекулярных орби­
.алеЙ може. быть описано следующим об\lаЗ0М.
Молекула бутадиена имеет две 7t-связи, следовательно. четыре молекулярные 7t-орбита­
ли (две связывающие н две разрыхляющие).
НаЛII'lие очень'leTbIp('x
ннзкой7t-орбиталей
'1'1 орбитали с перев той же
KpbIBafllleM всех
фазе объясняет ее повышенную устоЙчнвость.
~_+
_
~+_
~_+
_
'1'3--- - - } l r - - r - - * -
ПРII аl\ТlIвированном СТОЛКlювеНIIИ молеку­
лы бутадllена с молекулой хлора высшая занят-
ная МО бутадиена '1'2 перекрывается со свободной АО С!+ С образованием молекулярных ор-
биталеll связи С-С! и освобождением CI-.
В результате возникает карбениевый ион алли-
~_+.
~+_
_
_
_
'1'2--- --il:-----1.---+-
льного типа с двумя электронами на трех п-ор-
биталях.
одна из которых ('1'2) имеет на втором
аТОме углерода узел (рис. 36).
Этот IIОН далее взаимодействует с ионом хло-
ра: ВЫСшая занятая орбнталь этого нона переКРывается с низшей вакантной орбнталью аллн­
льного иона. При этом новая связь С-CI может
~бразоваться лнбо с атомом C 1• лнбо с атомом
l
(на атоме С 2 узел).
'1'\
--tt- ~+_
_ ~+_
_ ~+_
_
---1jf---Jf---*-
Рис. 36. Схема молекулярных 7t-орби­
талей аллильного катиона (даны в стили­
зованной форме)
3. Гидрогалогенирование. В реакциях присоединения галогеноводо­
РОДОВ действуют те же закономерности:
CH~H-CH=CH2 ~
С
СНз-СНСI-СН=СН2
З·хлор·l-бyrcн
СНз-СН=СН-СНР
l·хлор·2·бyrell
4. Гипогалогенирование. Гипогалогенные кислоты и их эфиры присое­
~:1iЯЮТСЯ преимущественно в 1,2-положения. Здесь система в момент ре­
Чии особенно далека от состояния равновесия (связь с-о значительно
4 ЗЦ.181
97
прочнее связей C-Hlg), а энергия активации в реакции образоваН1
1,2-проДУкта ниже, чем в реакции образования l,4-продукта:
СН 2=СН-СН-СН 2 + HOBr
5.
ОН
Br
-+
~нгtН-СН=СН2
\-бром-З-буте,,-2-uл
Димеризация. При нагревании молекулы диеновых углеводород
способны присоединяться друг к другу таким образом, что одна из них ре
гирует в 1,2-, а другая в 1,4-положениях_ Одновременно в небольших К
личествах получается также продукт присоединения обеих молек;
в
1,4-положен~е:
СН2.
СН-СН=СН 2
+
1,2-1,4- ПРllCOe,ЦИиеиис
СН 2 =СН-СН=СН 2
1,4-1,4-прнс:оедииснис
в такую реакцию димеризации могут вступать и молекулы различн;
диенов:
СН2=СН-СН=СН2
4-винил-2-метнл-l-цнхлоrexсев
+
С Н 2=С-СН=СН 2
. I
СН з
4-ВИИИJI-I-метИJI-I-ЦИХЛОI'CJCсеи
6.
Диеновый синтез. Особенно легко такие реакции идут в том случ:
когда одна из реаr:ирующих молекул имеет активированную двойН:
связь,
98
электрофильность
которой
повышена
благодаря
сопряжеН!
с
электроотрицательными атомами. Подобные конденсации получили на­
u'!e
зва",
диеНО80го синтеза или реакции дильса-Альдера:
Н
Н
t=:\ I ~-c1
СН 2=СН-СН-СН 2 + СН2==<:Н-С=О днен
дllенофНJI
H~
11
/C~,~
,rcH2
: I
нс...... )<СН-СНО
СН 2 '
тетраnoдpa6eнэоАиwil
aпloAencд (3-ЦИIIJIG­
reксенupбu.дencдl
Эта реакция широко используется для качественного и количественно­
го определения диеновых углеводородов, а также для синтеза раЗЛИЧНblХ
соединений с шестичленными циклами
( гл. 14).
Реакции диенового синтеза и димеризации алкадиенов идут через цик­
лическое переходное состояние с одновременным или почти одновремен­
ным образованием обеих новых связей, т. е. как nерецU/слические про­
цессЬ! (с.
43).
Возможность и условия протекания подобного рода реакций циклизации, проходящих без
промежуточного образования радикалов или ионов, подчиняются закономерностям, нося­
ЩIIМ название правил Вудворmа-Гофлrана. Согласно этим правилам, д.nя того чтобы
замкнулся ЦIIКЛ. орбитали, образующие новые связи, должны иметь возможность перекры­
ТЬСЯ с образоваНllем связываЮЩllХ орбиталей, т. е. должны быть направлены друг к другу
cerMeHTaMII одинакового знака (СМ. Введение.
5).
ЕСЛII ДЛЯ этого не требуется возбуждение какоЙ·либо из реагирующих молекул (переход
электронов на более высокий уровень с изменением знака сегментов), то процесс разрешен
по симметр"и Kal{ термический, т. е. реакция будет идти И1ll1 ускоряться при нагревании. Если
мя указанной выше ориентации орбиталей необходимо перевести электроны одной из моле­
КУЛ на более высокий уровень (на разрыхляющую орбиталь ), реакция разрешена по симмет­
PIllI ТОЛЬКО как фотохимический процесс.
В реакЦl1И диенового синтеза при образовании шеСТИ'lленного цикла в обоих возможных
вариантах, а именно при перекрывании высшей занятой молекулярной орбитали (ВЗМО)
~
(lJlJ
I
,
1 -
г
Рис. 37. Схема диенового синтеза:
83/1'10 !lНСIIИ (СПЯ:lьшающз><) (СМ. pflC. 30, 2); 6 - немо ДИСllа (ра:IРЫXJIЯЮЩ3Я) (рис. 30, 3);
(J немо JU\l~IЮфIlЛЗ (ра:IРЫХШIIOЩ3111t); г - взмо ДИСIIОфИЛЗ (связывающая It)
99
алкадиеиа (см. рис.
30
и
33) с H~
шей свободной разрыxnяющей
08
биталью (НСМО) диенофила (PII~
37 а) или при перекрывании В31\\(
диенофила с НСМО (раЗРЫXnIJIQ
щей) anкадиена (рис. 37 б), пеJ)4lj
крывание орбиталей возможно бе!
перемещения
электронов
в
ка
кой-либо из реагирующих моле~
на более высокие уровни (с учаcni
ем атомов l,4-алкадиена и l,2-ДII~
нофила).
.
Таким образом, диеновый сюr
тез
разрешен
как
термическиi
процесс.
В противоположность диеноВQ
му синтезу замыкание двух молеку,
о
алкена в четырехчленный цикл Эi
г
прещено по симметрии как TepМII
Рнзрых.ляющсе взиимодеИL'Т8ИС Связывающее взаимодействие ческий процесс, так как В3МО QI
ной молекулы алкена и НСМО ~
Рис.
а
-
38.
Схема ЦИКЛИЗIIЦИИ двух молекул этилена:
ВЗМО (СВSI:lыпаЮЩ3Sln);
6-
ВЗМО (разрых.лшо­
гой будут направлены друг к дpyr
различными по знаку сегмеитам
(рис. 38 а). Дnя того чтобы реакцН
пошла, необходимо возбужден"
молекулы с помощью УФ-излучения, благодаря которому электроны в одной из молекул пе
щая
n); и и г -
НСМО (ра:IР~Iх.лЯlOщая
n)
рейдут сорбитали 7t на орбиталь п* (разрыxnяющую) и тогда орбитали обеих реагирующи
молекул станут обращены друг к другу сегментами одинакового знака и, следовательно, cтi
нет возможным связующее взаимодействие (рис. 38 б).
Разумеется, такие реакции могут идти и по радикальному или каталитн
ческому механизмам с образованием промежуточных частиц. К таКИI
процессам правила Вудворта- Гофмана отношения не имеют.
7.
Теломеризация. Описаны реакции теломеризации (с.
87) алкадие
нов с галогенопроизводными, водой, спиртами, кислотами, аминами и др:
например:
(СН
)
сеl
nСН 2 = СН-СН=СН 2 _ _ .L~ (СНз)зС-( -СН 2 -СН=СН-СН 2 - )n C1.
SnCl 4
Эти реакции используются, в частности, в многостадийном синтезе али
фаТИ'lеских и моноциклических терпенов (с.
8.
589).
Полимеризация, Важной особенностью диеновых углеводородо
с сопряженными связями является способность их полимеризоваться
каучукоподобные продукты.
Скорость полимеризации зависит от строения диенов и внешних усл~
виit. Замещение в середине молекулы облегчает, а на конце молекулы З~
трудняет полимеризацию: изопрен полимеризуется быстрее, пиперил~
Meд.neHHee, чем дивинил. При нагревании и под давление полимеризацd
ускоряется.
I
Промышленный интерес представляет цепная полимеризация диен~
вых углеводородов под влиянием катализаторов или инициаторов. В кач~
стве катализаторов используются щелочные металлы, металлорган_
100
ческие соединения, в качестве инициаторов- органические и неоргани­
ческие пероксиды.
При полимеризации отдельные молекулы мономеров MOryт соединять­
ся друг с другом в 1,2-, в 1,4-положении или одна молекула реагирует
в 1,2-, а другая - в 1,4-положении:
l.~ .,...СНг СН CH-СНгСНгСН=СН-СНгСНгСН=СН-СН2-···
{' Н IIOJ111МС· ~~ .:-СНГСН-СН2-СН-СН2-СН- ...
611И3iЩЮI
llv4
I
I
I
[Н
[Н
[Н
СН 2
СН 2
•
СН 2
1212
3
4
121234
.:-снгсн-,-еН2-СН=СН-СНГСНГСН-СН2-сн=сн-,-еН2-···
3
з1
1
[Н
НН
'СН 2
. Наиболее
'СН 2
ценные продукты получаются при стереорегулярной (про­
странственно упорядоченной) полимеризации в
1,4- положении с образо­
ванием цuс-конфигурации каждого остатка. Таким образом, реакция идет
на катализаторах, приготовленных на основе металлорганических соедине­
ний, например алюминий- или литийорганических (к. Циглер, Дж. Натта,
А. А. Коротков):
Н,
"",
/Н
Н,
/С=С,
СНl
/Н
/С=С,
CHl-СН2
Н,
/Н
/С=С,
СН2-СН2
Н,
/Н
/С=С, /""
CHl-СН2
СН2
цuс-полибутадиен
цuс-полиизопрен
Большое значение имеет сополимеризация диеновых углеводородов с
ДРУгими мономерами
-
стиролом, акрилонитрилом и др.
Натуральный и синтетический каучуки
Нюуральный кзу'/ук добывается из сока некоторых растений. К каучу­
ковым растениям относятся гевея, гваюлла, кок-сагыз, тау-сагыз, обык­
НОвенный одуванчик. При коагуляции млечного сока перечисленных рас­
"гений выделяется каучук. Промышленное значение имеет в настоящее
Время получение натурального каучука только на основе культивирован­
Плантаций тропического дерева гевеи.
110 химическому составу и строению натуральный каучук представляет
HblX
СОб
•
•
Он стереорегулярный цuс-полимер изопрена, транс-полимер изопре-
На встре'lается в природе в виде гуттаnерчu.
101
Строение KaY'lYKa было доказано м,етодом, озонирования (Гарриес
Получение при озонолизе левулинового альдегида подтверждает упоряда
'leHHoe 1,4-строение:
-cн.;-C~CH-CH ..-cн.)-~CH-CH.)-CH.C. .~-CH-Cн.;- ~
<
1:
<
...
СН:\
1:
сн.
-
- 1:
..
СН"
o=ch-снг-снг<f=о
JIСIIУJlНlllШt.lН ИJII.iIС'"НД
Натуральный каучук имеют только немногие страны.
сн.
••
OCTaJlbHbIe либа
покупают натуральный каучук, либо заменяют его синтетическим. Пионе~.
ром в организации крупного промышленного производства синтеТИ'lеско
го каучука был Советский Союз.
...
.
В настоящее время производят синтетические каучуки на основе сле~-.:
ющих мономеров: дивинила, изопрена, xnоропрена (с. 129), а также и'
олефинов, этилена (+пропилен) и изобутилена.:;
Шинный каучук получают сополимеризацией бутадиена со стиролом~
каучуки, устойчивые к действию бензина и масел, -сополимеризациеR
бутадиена с акрилонитрилом (с. 108); химически стойкий бутил каучук
_1
сополимеризацией изобутилена с дивинилом или изопреном.
KaY'lYK -
пластичный материал. ДJlЯ того чтобы придать ему проч­
ность, износоустойчивость, эластичность, стойкость к изменениям темпе:­
ратуры, к действию растворителей и химических реагентов, его подверга~
ют вулканизации нагреванием с серой или ее соединениям (вулканизатор)
в смеси с наполнителями (сnжn и др.). Имеются и другие ВУJlканизирую·
щие средства. В процессе вулканизации происходит «сшивnние» линей~
ных молекул каучука в еще более крупные сетчатые (трехмерные) молеку~
лы: ПОJlу'шется резина.
РаЗJlи'щые виды синтетического и натурального каучука
применяются в промышленности транспортных средств,
нии, электротехнике, обувной промышленности и т. д.
4.
o'leHb широка
машинострое·
~
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
(ДЛКИНЫ)
Ацетиленовыми УГJlеводородами называют такие соединения углероЮl С
водородом, в молекулах которых имеются атомы углерода, затра'lиваю·
щие на соединение с соседним атомом углерода три валентности, т. е. об­
разующие ТРОЙ.IУЮ связь (sр-гибридизация орбиталей атомов углеРОЮlt
см. рис.
21, 22).
Ацетиле.ювые УГJlеводороды образуют ГОМОJlОГИ'lеский ряд с общеА
формулой
НС=СН.
102
CII H 211 .
2.
Родона'lальником этого ряда является ацетиле­
~
Изомерия. Номенклатура
Структурная изомерия начинается в ряду ацеТИJlеновых углеводородов с
С •. однако изомеры С 4 Н б рюличаются только положением ТРОЙНОЙ СВЯЗИ,
НО не строением углеродного скелета. Структурная изомерия, обусловлен­
ная строением углеродного скелета, начинается с пятого 'Iлена ряда.
ЭТi1 особенность в строении, связанная с тем, что ацетиленовая груп­
пировкCI толы<о двухвалентна, обусловливает меньшее 'Jисо изомеров в
I'омологическом ряду ацетиленовых углеводородов по сравнению с этиле­
новыми. По числу изомеров ацетиленовые углеводороды занимают сред­
нее положение между предельными и олефинами (см. табл. б).
Ацетиленовые углеводороды по систематической номенклатуре назы­
вают, пользуясь теми же прявилями, что и В слу'/яе предельных углеводо­
родов, но суффикс -ан.- зяменяют суффиксом -ин.-. Главную цепь выбиря­
ют так, 'Iтобы в нее попяла тройняя связь, и нумеруют с того конця, К ко­
торому БJlиже тройняя связь. Простейшие ацетиленовые углеводороды
нюывают кяк ялкилзамещенные ацетилена, т. е. по ряционяльной
'lacTo
НОМСIII<.fIятуре:
IIC=CH
'HIIH,
II<:=<:-CI-I:\
ПIJOПIIII. М~Тl1ЛЯЦСТllлен
,щеТllлен
I-IС=С-СII 2 -СI-I:\
l-БУТIIН. ',ПIЛiщеТl1ЛСН
СI-I:\-С=С-СН\
2-{jУТlIН. ДlIмеТltляцеТI-IJIен
I-IС=С-СН 2 _СН 2 -СН:!
I-ПСНТIIН. ПРОПl-lляцеТltлен
СН:\-С=С-СН 2 -СН:!
2-пеНТIIН. метил',пtляцетнлен
СН=С-СI-I-СН.!
3-меТl1л-l-БУТI-IН. ItЗОПРОПllляцетнлен
I
.
СН:!
т я б л 11 Ц Я
6. 3ависимоt'ТЬ числа CTPYK"I)'pHbtX изомеров rtарафинов,
о.пефинов и аt(етилеltoв от числа атомов углерода в молекуле
Ч"Н'ТО атомов
YГ.~cpaдa в
М().;н~куле
-
Число СТРУКТУрlIЫХ изомеров
пара-
фины
алефин
ацети·
леtlЫ
Число атомов
углерода в
молекуле
Число <-труктурных изомеров
пара-
фИIIЫ
олефИII
ацети,
леllЫ
"--
1
1
-
-
5
:~
5
3
2
1
1
1
6
5
1:~
7
:~
1
1
1
7
9
27
14
4
2
3
2
8
18
66
32
Способы получения
J\llсти.леновые уг.леводороды получяют либо ЯJlкилировянием яцетиле­
IliI, Jlнбо отщеплением гялогеноводородов (или гялогенов) от полигя­
.I 1 ()("СIIОПРОИЗВОДНЫХ.
IШ
1. Алкилирование
ацетилена
осуществляют,
превращая
ацетиле.
в меТ<lЛЛОРГ<lнические соединения, чаще всего в натрий-ацетилен ИЛ
М<lГНИЙ-Г<lлогеН-<lцетилен (Ж. И. Иоцич). в первом СЛУЧ<lе реакцию Beдyr
в жидком <lММИ<lке и действуют <lМИДОМ Н<lТРИЯ *, во втором СЛУЧ<lе
-2
в эфире или теТР<lгидрофуране, причем образуются моно- и ДИ<lЛКИЛ<lце- :
ТИJlены:
НС=СН ~~7~:i'" HC=CNa 1~-lIг.. HC=C-R
НС=СН C~~::~I(I .. HC=CМgl ~ HC=C-R
CII,-MI(I,.
--;.. lMg-С=С-R ~
. ,
2. Ацетиленовые УГJlеводороды оБР<lЗУЮТСЯ при действии спиртовоВ'
H<I гемИ";·.~
щелочи, порошкообразного КОН, амида натрия или бутил-лития
Н<lльные и ВИЦИН<lльные ДИГ<lлогенопроизводные предельных углевоДоро-::
ДОВ или на галогенопроизводные олефинов, содержащие галоген у атома
углеРОд<l С двойной связью:
CH:!-CHCI~+2KOH
---+ HC.. CH+2KCI+2H~O
CH~CI-CH2C1 ~ HC~ = снеl ~ нс 2..сн
Р(С,;Н,.)"
RCHO+CHlg 4
I
RCH=CHlg2 ~ RC..CH
(Hlg=CI
ИЛl1 8г)
Физические свойства
Основные закономерности в изменении темпеР<lТУР кипения и плавле­
ния в гомологическом ряду <lцетиленовых углеводородов (Т<lбл.
7) сходны
с З<lкономерностями в ряду этиленовых углеводородов.
Положение тройной связи в цепи еще больше влияет
H<I температуру
при 27 ·с,
тогда как об<l бутаН<I и все бутилены при обычных условиях вещества
кипения. Так, Н<lпример, 1-бутин кипит при
8,5 ·С,
а 2-бутин -
I'азообрюные.
ПЛОТНОСТЬ и показатель преломления ацетиленов значительно выше,
чем олефинов и тем более парафинов.
Ацетиленовые углеводороды имеют в инфР<lкрасном спектре характер­
ные
ПОЛQСЫ
поглощения
валентных
колебаний
тройной
связи
при
4,75-4,2 мкм (2100-2300 CM- 1).
УФ-излучение <lЛКИНЫ, K<lK и <lлкены, поглощают в области ниже
200 нм. В спеКТР<lХ ямр протоны группировки С == с- н дают сигнал в
БОJlее сильном поле, чем протоны у двойной связи.
* Ре;НЩIIЮ с аМIIДОМ натрия можно прОВОДIIТЬ только с nepBII'lHDIMH галогенаЛКИЛII МИ '
BTopII'lHbIe и треТИ'lные гаЛОГСНIIЛКl1ЛЫ npll ~ПОМ отщепляют Гllлогеноводород.
104
---т
n (j л 11 Ц n 7.
Физические свойства некоторых ацетиленовых углеводородов
Показа-
Т. пл.,'С
Углеводород
Т.кип.,'С
ПЛОТ-
тель
IIOCTb
пролом-
(ЦО
леliИЯ
20
ПО
-
нс=сн
АLlеТllлен
МеТIIЛnLlеТllлен, nроnин
НС=С-СН: 1
1-БУТlIН
HC=C-C~H;-,
:2-БУПIН
СН:!-С=С-СН: 1
1-ПеНТIIН HC=C-CH~-CH~CH:!
2-ПеНТIIН
CH:I-C=C-CH~CH:!
,1_МеТllл-1-GуТl1Н
-
-81,8
-8:3,6
0,5651
-102,7
-23,:3
О,б70 1
1,:374i
-122,5
+8,5
0,671\2
1,:39622
-:32,:3
+27,0
О,6!)1
1,3921
-91\,0
+39,7
0,691
1)852
-101,0
нс=с-сн-сн:\
-
+56,1
0,710
1,40,19
+28,0
0,665
1,372:3
I
СН:!
1-Геl(сIIН
Н С=С - ( CH~ ):\ -
1-ГеnТlIН
HC=C-(CH~)~-CH:!
1·0ктnдеЩIII
сн:!
+71,4
0.716
J,:3984
-80,!)
+99,8
О,В:3
1,4084
+28,0
180,0
(2'10"Пn)
-
HC=C-(СН~)lii-СН:!
JЭ2,О
,---_
ПР!I
ПРII
~
J,4544
----
TeMnepfiType t<lшеНIIЯ.
() 'с.
Химические свойства
При р<!ссмотрении химических свойств ацетиленовых углеводородов
следует учитывать особенности тройной связи: по ср<!внению с <!лкен<!ми
алкнны несколько менее <!ктивны в ре<!кциях электрофильного присоедине­
нин н более <!ктивны в ре<!кциях с нуклеофилами (<!мнны, <!лкоголяты, мер­
каптиды)*. Эти особенности <!цетиленовой группировки объясняются ее
строением, Об<! углеродных <!том<! в <!цетилене н<!ходятся в sр-гибридном
СОСТОЯНИИ, Между тем чем больше доля s-орбит<!ли в гибридном состоянии,
Тем ближе электроны н<!ходятся к ЯДР;L(ВСПОМНИМ, что радиусы "- и р-орби­
Талей относятся друг к другу, к<!к 1: --J3 ) и, следов(!тельно, тем труднее эти
":iлектроны вовлек<!ются в химические преврюцения с У'1<!стием электрофи­
,пав, С другой стороны, ядр<! углерод<! в <!цетилене горюдо более доступны
для нуклеофильных ре<!гентов бл<!год<!ря его линейному строению:
Н
О, 10б 11М
С
=
О, l:го 11М
с--н.
Этими особенностями строения и объясняется то, '11'0 промеЖУТО'IНЫЙ
карбениевый ион, обрюующийся из этилен<!, примерно НiI 40 кДж/моль
СТilБИЛl.,нее К<!ТИОН<!, обр<!зующегося из ilцетилеНiI, Большое ВЛИЯНllе н(!
. * Следует, однако, IIметь в ВIIДУ,
'ITO ,щеТIIJlеIIЫ, I(Ю< 11 ЭТllлеНLI, леГ'lе реiiГИРУЮТ с
'J1tI\ТРОфIIЛbfIЫМII penreHTnMII, чем с нук.nеОФIIЛЬНЫМII.
IO,'j
t:оотношение скоростей реякций этиленов и Юl.етиленов окязывяет приро.,,~!
дя рястворителей.
..;
Этот же фактор обусловливает и значительную СН-кислотноt:ть кон.:!
цевой ацетиленовой группировки. Как t:ледует из !Jриведенных экспеРИ_i l
ментальных данных, ацетилен на
этилен, и только на
I(IIСJlОПI
1(,
6
18
порядков более сильная кислотя, чемj
порядков слабее, чем водя.
CH:1COOH
H~O
2·10-:;
10- lli
C~H:;OH
'1:
C~H~
C~H4
C~HIi
10-~~
((Г~II
I!г~1I
10- IX
Причиной кислотных свойств яцетиленя является t:ильняя поляризация'
связи С-Н блягодаря тому, что в sр-гибридной форме углеродный ятом
зна'lительно сильнее удерживает электроны,
'leM
в "р"2- и sра_гибридных:
формях. Следовательно, электронная пара С-Н-связи в молекуле аце-:'
тиленя ближе к ядру углерода, чем в случае этилена, и атом водорода бо-:
лее положительно поляризован*.
1. Гидрирование. Водород присоединяется по месту тройной связи,
в присутствии тех же катялизаторов, 'ПО и по месту двойной связи:
НС .. СН I~:I~ » CH~ = CH~ ':~
»CH:1-CH:\,
Реякция этя идет медленнее, 'leM у янялогично построенных олефинов.
Одняко в смеси олефина и яцетиленя в первую очередь гидрируется аце­
тилен, тяк кяк яцетилены легче ядсорбируются на поверхности кятялиза­
торя и не допускают на нее молекулы этилена. Это обстоятельt:ТВО позво­
ляет проводить селективное гидрирование IщеТИJlенов в олефины в при­
сутствии ПЯЛJlадия, а затем при необходимости ОJlефины гидрируются до
пярафюlOВ.
При гидрировании ацеТИJlенов в зависимости от условий проведения,
реакции могут быть получены цис- и mранс-алкены. Гидрировяние на
пялладии, слегкя отрявленном t:оединениями свинця или другими реяген?
тями, приводит к образовянию ЦUС-ЯJlкенов. Гидрировяние действием ме­
таллического лития в яммияке или яминях дает mранс-ялкены.
2. Галогенирование. Присоединение галогенов (XJюря, брома, иода)
к ацеТИJlеням по электрофилыlOМУ механизму тякже идет t: меньшей скоро·
стью, чем к олефиням. Образующиеся при этом mранс-дигялогенялкен'"
легко вьщеляются, тяк как дальнейшее приt:оединение гялогеня (кроме хло­
ря) идет с большим трудом. В случяе хлора реякцию ведут в растворителе··.
НС .. СН ~ СНВг = СНВг ~ CI-IBг~ - CHBг~,
TpHII~·1.2·JlII­
1.1."2.2-т~трil·
(iP"M,.T<·"
* ЭlJерпlЯ
ГОМОJIIIТliческого
(=46:i.51<дЖ/МОJIЬ)
(427.2I{ДЖ/МОJlЬ).
**
БОJluше.
расщеПJlеlНlЯ
..ем
в
(iP"M'1THII
СВЯЗI,I
МОJlеl<УЛЯХ
'~ТЯIJЯ
С-Н
в
МОJlекуле
(-101.9 I\дЖ/МОJlЬ)
,щеТIIJlеНII
11
ЭТIIJlена
Во Ilзбежаlше ВОЗМОЖltoго взрыва под воздеiicТВliем светя в реЗУJlьтате радикальноГО
ОЮlслеНIIЯ аL\еТllлена хлором. АцеТllJlен ropllT в атмосфере хлора,
106
причиной mранс-присоединения,
возможно, является бромониевая
структура промежуточного иона (см. с. 80).
3. Гидрогалогенирование. Галогеноводороды присоединяются к аце­
тиленам по электрофильному механизму непосредствешю или в присутст­
вии кятялизатора, например CI1 2C1 2 , HgCI 2 и др. При этом обычно получа­
ются смеси этиленовых моногалогенозамещенных и предельныхдигалоге­
ВОЗllмещевных производных углеводородов:
НС .. СН ~ Н 2 С = СНСI ~ СН:\ - CHCI 2 .
ХJIOI'ИСТI.lii
1.I·ДliXJIЩ)',ТЮI
НIIШIJI
Реякltии присоединения галогенов и галогеноводородов к ацетиленам
могут проходить по радикальному механизму. При электрофилыюм при­
соединевии соблюдается правило Марковникова, при радикальном меха­
низме наблюдается противоположное направление присоединения.
4.
Гидратация. Ацетилены очень легко присоединяют воду и кислоты.
Присоединение сильных кислот часто идет без катализаторов, присоеди­
нение воды ведут либо в присутствии сульфата ртути (реакц/.l.Я Кучеро­
ва), липо над гетерогенными катализаторами. При этом из ацетилена по­
JlУ'lllется уксусный альдегид, а из других ацеТИJlеновых углеводородов
-
кетоны:
СН:гС=СН
II}J
11 12SO, Iэ
СН:,-<:О-<:Н:,
Первая реакция используется в промышленном синтезе уксусного аль­
дегидя из ацетилена. Возможный механизм реакции Кучерова:
HC=CH+Hg2~HC
I
f
СН +H2~
-Н
Hg-CH=CH-OH
•
Hg2+
=t:
Hg!..-СНz-СНО ~СНs-СНО + Hg2+
5. Присоединение спиртов. Спирты присоединяются к ацетиленам
8 11РИсутствии алкоголятов:
[~-Oll
"
[~-O[['H'H OR
Н('-'Н
.=С
э> <'H 2=CH-OR.
.э С :1-<' (
)2
II~ - ОNиl
IШlllfJНIIII~i\ ~фиl'
И!lСТИJII.
[:1 2() • 111':1
Этим способом полу'.ают виниловые эфиры (гл. 4.1), применяемые как
МОномеры, а также ацетали (гл. 5.1).
Гlрисоединение спиртов в присутствии алкоголятов -
это типичная
реакция нуклеофилыюго присоединения. Ее механизм можно представить
eJl едующим образом:
НС ..СН + RO~HC = СН -
..
ROH
OR-":':""--+I Н 2 С
=
CHOR + RO-.
107
6.
Присоединение синильной кислоты. Ацетилен присоединяет СИНI{
льную кислоту в присутствии солей меди с образованием очень важно
мономера
акрилонитрила (гл. 6.З и 8.З):
-
НС.СН + HCN -1CU2(C~H2C = СН - CN.
7.
Присоединение бороводородов. Алкины присоединяют бораны с образованнем
насыщенных алкенборанов. которые могут быть переведены карбоновыми КИСЛОТа
в цuс-алкены ИЛИ окислены И гидролизованы в альдегиды или кетоны. Терминальные алКНН·
дают альдегиды. в то время как при их кислотной гидратации образуются кетоны:
~BH
Н+
• ~ R-CH=CH-H
R-C=CH ~ R-CH-CH-BR2 ~
."о
_
_
НО-
R-CH-C'H
8. Окисление. Алкины, подобно алкенам, могут подвергаться окисле~
нию по месту тройной связи. Продуктами окисления являются соответст.
вующие карбоновые кислоты.
Однако тройная связь более стойка к окислению, чем двойная. В каче·
стве окислителей применяются перманганат калия, озон и др. РеакЦИI
окисления алкинов используется
преимущественно для определения их
строения:
При окислении гомологов ацетилена кислородом воздуха реакция на­
правляется преимущественно на С-Н-связь в ~-положении к тройной
связи; образуется соответствующий гидропероксид (ср. с. 67).
9. Металлирование. Реакция Фаворского. Водородные атомы ацети­
лена способны замещаться металлами при действии сильных оснований
с образованием ацетиленидов. При этом ацетилен реагирует как более
сильная
кислота,
чем
кислота,
соответствующая
использованному
основанию:
HC..CH+NaNH 2 ---+ HC..C-Nа+NН з :
НС..СН+2[Аg(NН З )210Н
---+ Ag-С.С-Аg+2Н 2 О+4NН з ·
Ацетилениды тяжелых металлов (меди, серебра) обладают исключи­
тельной взрывчатостью.
Ацетилениды, подобно другим металлорганическим соединениям
(гл. 9), леГКО.вступают в реакции нуклеофильного замещения или присое­
динения с галогенопроизводными, альдегидами, кетонами, С0 2 , обраэYfl
важные кислородсодержащие соединения - спирты, кислоты. Чаще все­
го для этих реакций в лаборатории используется ацетилен ид натрия
в жидком аммиаке или смешанный ацетиленИД магния (комплекс ИоцU~
ча), образующийся при действии ацетилена на магнийорганические сое­
динения с предельными радикалами:
R-С.. С-Н+С 2 Н 5 МgI
108
---+ C 2 H 6 +R-С",С-МgI:
СНа
н 2о
I
R_C:ECMgI + СНз-СО-СН з ---,;.. R-С=С- 1 -ОМgI "':мтон'
СНа
---,;..
R-С=С-С(ОН)(СН а )2
+НСI
R-СеС-МgСI +C0 2 ---+R-С"'С-СООМgCl------+ R-C..C-COOH.
-МgC1 2
А. Е. Фаворский предложил проводить подобные синтезы в абсолют­
ном эфире в присутствии сухого порошкообразного КОН:
НС..СН+СНз-СО-СН з _кон
I
НС"С-С(ОНХСН З )2'
Предполагается, что в этой реакции обратимо возникает ацетиленид­
ный анион:
НС=СН + НО- ---,;.. НС=С + Н 2 О
CHa-СI rь НС=С CHa-~~=CH
I
+
---,;..
СНа
СНа
1
ОН
CH:Ii--С=СН + Н 2 О
---,;..
I
СНЗ-i-С=СН
+ НО-
СНз
СНа
в промышленности осуществляется конденсация ацетилена с муравьи­
ным альдегидом в присутствии ацетиленида меди, стабилизированного со­
единениями висмута. В результате получают пропаргиловый спирт и бу­
тиндиол (метод В. Реnnе):
НС",СН _СН 2 О
I
НС",С-СН 2 ОН _СН 2 О
СН 2 ОН-СЕС-СН 2 ОН.
I
10. Замещение водорода галогенами. Водородные атомы у ацетиле­
Новой связи замещаются также атомами галогенов (хлор, бром, иод) при
действии гипогалогенитов. В случае ацетилена при этом образуются са­
мовоспламеняющиеся на воздухе вещества:
нс..сн _ Na~ Hc..CCI_NaC~ CIC..CCI.
11. Полимеризация. Ацетиленовые углеводороды способны полиме­
ризоваться в нескольких направлениях:
с а) при нагревании в присутствии активированного угля (Н. Д. Зелин­
КБИИ) или лучше в присутствии Ni(СОМС6Н5)ЗР]2 (В. Реппе) ацетилен
о разует бензол:
си
ИС
111+
ИС
СИ
111
си
си
111
-
ИС~
1
.......СИ
11
ИС, ",СИ
СИ
си
109
б) под воздействием комплексных солей меди происходит линейна.
полимеризация ацетилена с образованием преимущественно винилацети;
лена идивинилацетилена:
нс.сн не .. ен ~HC..C-CH=CH2 не. сн ~H2C=CH-C..C-CH=CH2
C11 2C1 2
CII~CI2
IШIIIIJltlILеТЩН~11
ДIIIШllliJltlIL('ТI1JI('11
в) при действии на ацетилен комплеКСIIЫХ соединений никеля образу~'
ются ЦИКJlOоктатетраев и ДРУl'ие полимеры ацеТИJl(~на:
не=сн
не=ен
ен
111
ен
+
ен
111
ен
/
нс
"-
-11
не=ен
не
~=C{
ен
1
ен
Все эти процессы имеют практическое применение.
12.
Изомеризация. АцеТИJlеновые углеводороды способны к изомери­
зации с перемещеllием тройной связи или с превращением в диеновые
углеводороды.
При действии щелочных метаЛJlОВ или очень сильных оснований, таких,
как амид lIатрия, 3-аминопропиламид калия, тройная связь легко переме­
щается из внутреннего положения в терминальное: равновесие сдвигает­
ся в сторону ацетиленидного аниона. При действии спиртовых растворов
щеЛО'lей тройная связь переходит с конца молеКУJIЫ в центр с образовани­
ем более термодинамически стабильного алкина (стабилизация сверх­
сопряжением ).
ПромеЖУТО'lНЫМИ продуктами в этих превращениях явJlяются аллено­
вые УГJlеводороды (А. Е. Фаворский):
IPN~
сн:\сн=('-сн
~ сн ;\- С-('
ен ;\
сн;1 сн 2- С-('н
= - Ч
Е
Nи
,2 ~
= ,-,
В присутствии некоторых катализаторов ацетиленовые углеводороды
могут превращаться в сопряженные диеновые, опять-таки через стадИЮ
аJlJlеновых УГJlеводородов (Я. М. СJlободин):
CH;j-СН:l-С..сн ~ CH;\-СН=С=СН 2 --+ СН:l=СН-СН=СН 2 ·
Отдельные представители. Применение
Из ацетиленовых углеводородов наиболее важное промышленное знВ­
'Iение имеет ацетилен.
Ацетилен. Получается в технике действием воды на карбид кальцИЯ
или пиролизом природных газов (см. Введение).
Сжиженный ацетилен представляет большую опасность, так как 014
склонен к взрывному разложению. Теплота распада ацетилена на элемеJf'
110
ы составляет 226,9 кДж/моль, в то время как для этиленя оня рявия
;2.4 кдж/моль, я для этяня - 84,6 кДж/моль. Поэтому сжятый яцети­
лен хранят в баллонах, няполненных адсорбентом, пропитянным подходя­
lЦИМ
рястворителем
(обычно
ацетоном)
под давлением до
2,5
МПа
(25ЯТМ).
При горении ацетиленя в кислороде рязвивяется очень высокяя темпе­
ратура (до
3000
·С), поэтому он широко применяется для тяк нязываемой
ацетилеllОВОЙ свярки и резки метяллов. В последнее десятилетие яцети­
леll получил большое применение в химической промышленности, преи­
мущественно для получения плястмасс, каучука, рястворителей. Про­
мышленное использовяние яцетилена показано на схеме
4.
Вuнuлацеmuлен. Значительная часть яцетилена в промышленности
перерябатывяется на виниляцетилен. Кроме того, винилацетилен образу­
ется в I<ячестве побочного продуктя при получении ацетиленя электрокре­
кингом из метяня.
Виниляцетилен
-
при обычных условиях газ. Т. кип. +5·с. Подобно
дивинилу он присоединяет гялогены в
3,4-
(по яцетиленовой связи) и
в 1,4-положения. Аналогично присоединяются и гялогеноводороды:
{.i\ :\ ~]
HC=C.:LCH~CH~
.
1,4-IIРШ:ОС-
JtII\]~]II]~
СН~=С=СН-СН1:l
~CIIP~
11<.1
'-"'-==;':""';~ CH~=CCI-CH=CH~
)(JЮIЮ]]I'Ш
в присутствии кятялизяторов (Cll;!Cl 2 И др.) 1,4-яддукты легко изоме­
ризуются в Э,4-я,ддукты. Этя реакция используется в синтезе хлоропрено­
вага I<ЯУЧУКЯ из винилацетиленя (гл.
Дuацеmuлен. Диацетилен (т. кип.
2.3).
1О ·С,
взрывается выше
60
·С) полу­
чяется в технике в кячестве побочного продуктя в производстве яцетилена
ПИРОJlИЗОМ метаня. В ляборятории он может быть ПОЛУ'lен из бутиндиоля:
Появление в соединении двух тройных связей сильно увеличивяет
СКЛонность его к реякциям с нуклеофильными реягентями. Дияцетилен
.lIегко присоединяет спирты в IlрИСУТСТВИИ щелочей:
HC"'CC"'CH+ROH~HC"'CCH=CHOR.
ЛМИIIЫ присоединнются к нему на холоду с выделением тепла:
ди- и полиацетиленовые соединения встречяются в природе преиму­
ЩеСТвенно в высших растениях (Ф. Больман).
111
Схем а
t-.:.
(,:юrтспr'rсский KaY'rYK
J--
4.
Промышленное использоваиие ацетилеllа
(C,HoCI)"
rlOЛИХnОРОПРСН (СК)
CI-c
.....,
СНСlгСНCl2- CHCI=CHC
HOCH 2-СН з - СН 2 =СН 2
сн 2 он-снон-снрн
г!rrщсриrr
J--
CH~OH-C=C-CH20H
1,4 бут1иrr;uюn
I
CH 2 =CH-CN
СиrJТСТИ'rсскос BO.IIOKrro
=СН
rr
11"
нс=с-сн.,он
IlРOlIИРПIJIOIIЫЙ
с
=СН 2
CllltpT
"шЬ
-HCSCH
СНз-LН О
{
СН:Г СН 2 0Н
'jПIЛОИЫЙ СIIИI'Т
СНгСООН
уксусrrИR ~rrсnоти
СН з-СООС 2 Н 5
~ти.ааНСТttТ
СН:,СНОН-СН 2 -СНО
С,I-1"ОН
аЛI ..ДОЛI ..
I
CH~OH -CH~-CH2-CHPH
1,4 БУТИllдио..1
J
C,H G
I
CH:rCHOHCH 2CHPH
CH 2 =CH-ОС,Н r,
Rнrrиnаllстат
виrrИJlБУГИnОllыii ,фrrр
СН 2 =СНCI
МОР"ст ,"шм
:lИШlllн ..1
J
(С{;Н{2 0 )"
1,:j-6утаr~1ИОn
I
СН 2 =СН-СН= СН 2
дивиrrиn
СIIIПСТl1'IССКИЙ
rю,щмср ,фира
(C.rH60 2 )"
(C 2H:,CI)"
КИУ'Iук
(6вnr.13М Шостаковского)
по.nИUlllrllШЩСтат
ПМИXJIОРВIllIИJ'
СиrrТСШ'rескltii KBY'rYK
ГЛАВА
2
моно· и ПОЛИГАЛОГЕНОПРОИЗВОДНЫЕ
УГЛЕВОДОРОДОВ
Гялогенопроизводные можно раССМ~lТривать как продукты замещения
в углеводородах одного или нескольких атомов водорода атомами гялоге­
нов. В соответствии с этим могут существовать предельные и непредель­
ные моно- и полигалогенопроизводные.
'. МОНОГдЛОГЕНОПРОИ3ВОДНЫЕ ПРfДЕЛЬНЫХ УГЛЕВОДОРОДОВ
Моногалогенопроизовдные предельных углеводородов носят название
галогеналкuлов. Их общая формула
Cn H211 +,Hlg.
В зависимости от поло­
жения атома галогена, характера атома углерода, с которым атомы гало­
геня СВЯЗRНЫ, различают первичные, вторичные и третичные галогено­
производные:
RCH 2-C1, R2CH-CI
и RзС-СI.
Изомерия. Номенклатура
Изомерия галогенопроизводных зависит от строения углеводородного
скеJlетн и положения атома ГRлогена в цепи. Следовательно, ГRлогенопро­
изводные имеют большее число изомеров, чем предельные углеводороды.
Изомерия наЧИНRется с третьего члена ряда.
НRЗВRНИЯ
галогенопроизводных
по
систеМRтической
номенклатуре
обрязуют из нязваний соответствующих им предельных углеводородов,
добавляя НRзвание
галогена с цифрой, указывающей
его положение
в цепи. Простейшие галогенопроизводные называют по входящим в них
радикалам:
СН:\-CI
хлормеТ1IН. ХЛОРltСТЫI-t метил
СН:\-СН 2 С1
ХЛОР3Т1II1. ХЛОРIIСТЫЙ зтltл
(plic.39)
Cli:\-CH 2-CH 2C1
l-ХЛОРПРОП1lН. хлористый ПРОПltЛ
CH:j-СНCI-СН:!
2-ХЛОРПРОП1lН.
ХЛОРltСТЫЙ изопропил. IIЛИ ХЛОРIIСТ"lii
ВТОРИ'lныii пропил
СН:\-СН 2 -СН 2 -СН 2 -СI
l-хлорБУТIlН. ХЛОРИСТЫЙ БУТIIЛ
CH:\-CHCI-CH2-CH~
CH:!-СН(СН а )-СН 2 С1
2-хлорБУТ1IН. хлорltСТЫЙ ВТОРИ'lныii бутил
CH:\-CCI-CH:\
2-метил-2-ХЛОРПРОПIlН. хлорltСТЫЙ
2-меПlл-l-хлорпропан. ХЛОРllстыil изоБУТItЛ
TpeTII'IHbIii
бутltл
I
СН: !
Способы получения
Моногалогенопроизводные получают из предельных углеводородов ре­
<I!Щией ЗRмещения, из олефинов - присоединением галогеноводородов,
ИЗ спиртов - реакцией с галогеноводородами и галогенидами фосфора.
J I:i
1.
Получение моногалогенопроизводных из предель­
ных углеводородов реакцией замещения атомов водо­
рода галогенами - наиболее важный технический ме­
тод. Особенности реакции замещения водорода ато­
мами галогена были подробно рассмотрены выше·.
Рис. 39. Модель молекулы хлористого
метила
2.
Присоединение галогеноводородов колефинам
идет обычно на холоду (гл.
1.2).
Этот способ особенно
удобен для получения моногалогенопроизводных, так
как реакция не сопровождается образованием побочных продуктов
-
по~
лигалогенопроизводных, как это происходит при использовании первого
метода.
3.
Очень часто галогенопроизводные получают замещением гидрокси­
льной группы спиртов галогеном:
а) действием галогеноводородов
R-OH+HCI
~
R-CI+H 20
или
R-ОН+КВг+Н 2 SО 4
--+ R-Вг+КНSО 4 +Н 2 О;
б) галогенидов фосфора
R-OH+PCI 5 --+ R-СI+НСI+РОСl з ,
3R-ОН+РОСl з
--+ 3R-СI+РО(ОН)з:
в) хлористого тионила
R-OH+SOCI 2 --+ RO-SO-CI+HCI,
RO-SO-CI --+ R-CI+S0 2.
При работе с РСl з в качестве побочного продукта образуется сложный
эфир Р(ОR)з.
Галогениды фосфора иногда получают непосредственно в реакционной
системе взаимодействием красного фосфора с бромом или иодом.
Легче всего замещается галогеном гидроксил у третичного атома угле­
рода. В этом случае часто достаточно взболтать спирт с концентрирован­
ной галогеноводородной кислотой. В первичных спиртах гидроксил при
действии галогеноводородов замещается только в присутствии катализа­
торов: кислот, галогенидов цинка и т. д.
Применение хлористого тионила SOCl 2 для получения хлоралкилов
особенно удобно, так как все побочные продукты этой реакции - раство­
римые
в
воде
газы,
которые
легко
отделяются
от
полученного
гало­
геналкила.
4. МОНОГf\логенопроизводные получают действием галогенов на сухие
серебряные соли карбоновых кислот. При этом углеродная цепь укорачи­
вается на один углеродный атом:
HIg 2
R-СООАg -~ R-СООНlg -_~
•
R-Hlg.
Следует отметить, что в органической химии ярко выражена взаимосвязь и взаимная
обусловленность различных ее разделов. Одни и те же реакции на протяжении всего курса
приводятся в одних случаях как характеризуюuцие свойства данного класса' соединений,
а в других
114
-
как метод получения другого класса BeuцecTB.
5. Фтористые алкилы получают обменной реакцией из хлористых,
бромиСТЫХ или иодистых алкилов действием фторидов Hg, Ag, Со, Sb и
др. Например:
2С 2 Н 5 Вг+ HgF2
--+ 2C2HsF + HgBr2·
Реакции между хлористыми и бромистыми алкилами и KF в обычных
условиях не проходят. Однако их можно провести взаимодействием KF
с галогеналкилами в бензоле в присутствии краун-эфира 8-краун-6
4.2). С хорошим выходом и в мягких условиях обменные реакции
(гл.
можно проводить с помощью ионообменных смол (гл.
1.2).
Физические свойства
Физические свойства галогенопроизводных зависят от природы галоге­
на, состава и строения углеводородного радикала.
При обычных условиях фтористые метил, этил, пропил и бутил, хлори­
стые метил и этил, бромистый метил являются газами. Все остальные га­
логеналкилы
-
жидкости, высшие представители
-
твердые вещества.
Температура кипения галогеналкилов с одинаковым углеродным скеле­
том возрастает от фтористых к иодистым алкилам; при одном и том же
числе углеродных атомов температура кипения ниже всего у третичных
галогеналкилов.
Плотность галогеналкилов возрастает при переходе от фтористых
к иодистым.
Низшие галогеналкилы обладают сладковатым запахом. Они практи­
чески нерастворимы в воде, но хорошо растворяются в органических рас­
творителях и сами являются растворителями.
Галогеналкилы обладают значительной полярностью.
В ИК-спектрах полоса валентных колебаний связи C-F находнтся в об­
ласти длин волн
1000-1350 CM- 1,
связи С-С!
-
около
600-800 CM- 1.
Химические свойства
Галогеналкилы
-
один из наиболее реакционноспособных классов ор­
гаНических соединений. С их помощью вводят в различные органические
Соединения алкильные радикалы, т. е. они являются алкuлирующuми ре­
агентами. Наиболее характерны для них реакции нуклеофильного заме­
щения (SN), а также отщепления (Е).
При нуклеофильном замещении нуклеофил атакует молекулу, предо­
ставляя для образования новой связи свои электроны. Электроны разры­
ваЮщейся связи уходят вместе с освобождающимся ионом. Такие реакции
ИДУт только в жидкой фазе, обычно в растворах. В газовой фазе они идти
Не могут, так как диссоциация, например, связи С-С! требует затраты
более 921,1· кДж/моль. В жидкой фазе затрата энергии на диссоциацию
115
значительно ниже (около 251,2 кДж/моль) благодаря выделению тепло_
ты гидратации (сольватации) ионов.
Скорость замещения атомов галогенов в галогеналкилах весьма раз­
лична и в зна'lительной степени зависит от строения радикалов, с которы_
ми связан атом галогена, а также от при роды галогена, нуклеофила и рас­
творителя. Заключение о влиянии строения радикала на скорость нуклео_
фильного замещения можно сделать, сравнивая относительные скорости
гидролиза галогеналкилов в присутствии гидроксильных ионов (80%-ный
этанол при
55
ОС):
Бромистый аЛl<ltл
Относительная
гидролиза
........ .
скорость
................ .
СН,Вг
С,Н,Вг
(СН,),СНВг
(СН,),СВг
2140
171
5
1010
в случае бромистого метила и бромистого этила скорость гидролиза
пропорциональная концентрации как гидроксильных ионов, так и гало­
генаJlкила (реакция нуклеофильного замещения второго порядка
SN2).
ДЛЯ бромистого изопропила нельзя установить простого математичес­
кого соотношения между концентрацией реагентов и скоростью peaK~
ции. В случае третичного бромистого БУТИJlа скорость реакции зависит
только
от концентрации
галогеналкила
и
не
зависит
от
концентрации
гидроксильных ионов (реакция нуклеофильного замещения первого по­
рядка
SN {).
Это можно объяснить, допустив, что замещение при углеродном атоме
может
происходить двумя
раЗJlИЧНЫМИ
путями,
причем
в
определенных
условиях могут иметь место одновременно оба процесса.
Гидролиз третичного бромистого бутила проходит по механизму SN {.
- двухстадийный процесс. Первая стадия - обратимая диссоциация
Это
галогеналкила на ионы (мономолекулярная реакция):
(CH;j);jCBг
;::t
(CH;j);jC+ + Вг-.
Диссоциация идет MeДТIeHHo с образованием интермедиата
-
карбени­
евого катионн, который далее быстро реагирует с молекулами раствори­
теля или реагентн, способными давать пару электронов для знполнениЯ
внкантной орбитали углеродного атома:
(CH;j);jC+ +ОН- --+ (CH;j);tC-ОН (быстро)
Скорость реакции в целом определяется скоростью нниболее MeДТIeH­
ного процесса, т. е. скоростью диссоциации, и потому весь процесс заме­
щения проходит в соответствии с кинетическим уравнением ренкции пер­
вого порядка.
В случне бромистого метила реакция имеет совершенно другой одно­
стадийный механизм
116
- SN2.
Гидроксильный ион атакует молекулу бромистого метила, вытесняя
броМ в виде иона, причем разрыв связи углерод новой связи углерод
НО- +
-
H,,~+
Н
галоген и образование
кислород происходит одновременно:
iI-
/С-Вг ~
I
Н
[ .../"Нl6+ J
6-
но
Н
с.
6-
..Вг
/н
~ НО-С,Н
'н
Н
+
Вг-
РеакцИЯ идет через переходное состояние, в котором связь углерод
логен удлинена и ослаблена, в то время как связь углерод
-
-
га­
кислород об­
разовалась только частично.
В представлеНllЯХ теории МО переходное СОСТОЯНllе при бимолекулярном НУl\леОфIIЛЬ­
ном замещеНИl1 ВОЗНlIкает в результате перекрывания высшеl1 занятоli орбиталн нуклеофила
11 Нllзшеii BaKaHTHoii орбнтали реагирующей молекулы.
В переходном состоянии орБИТl!Л1I нуклеофила и уходящей группы перекрываются с про­
ТlIВОПОЛОЖНЫМII долями одно2й 1I той же p-орбllТаЛIl углеродного атома реаlЩИОННОГО центра,
находящегося в СОСТОЯНIНI sp ·гиБРI1дllзации. Такое состояние возможно только на ма"симу,
ме
I<pllBoii потенциальной энеРГl1l1 и ни в коем случае на может рассматриваться l<aK проме·
жуточное соединеНllе - IlНтермедиат. ПРfl переходе с потереl1 энеРГIШ "химичеСI<ОМУ соеди­
HeНlllO ОДllа 113 групп должна УЙПI, тю< как атом углерода не может 11ме'ГЬ более четырех
замеСТlпелеJI 11, следовательно, удерживать более 8 злеIПРОНОВ.
Атака в принципе может осуществляться тремя способами: с TblJla,
с фронта и латеральная (боковая). Вычисления, основанные на физиче­
ской теории, показывают, что энергия образования переходного состоя­
ния является наименьшей, когда нуклеофильный ион (или MOJ\eКYJ\a) ата­
кует реагирующую молекулу с противоположной стороны (с тыла) по от­
ношению к замещаемой группе (галогену).
В реакциях гидролиза, проходящих по этому механизму, скорость про­
ПОрциональна
концентрации
галогеналкила
и
реагента,
вызывающего
ГИдролиз. Весь процесс хорошо описывается уравнением второго порядка
и обозначается SN2 (замещение нуклеофильное, бимолекулярное).
По мономолекулярному механизму наиболее легко реагируют третич­
ные, по бимолекулярному
-
первичные галогенопроизводные.
По способности к замещению галогены рnсполагаются в ряд I>Bг>CI,
СОВГlnДnЮЩИЙ с рядом увеличения основности.
Нуклеофильная
nктивность
реагентов
увеличивается
в
ря.11У
Н20<CI-<Вг-<НО-. Этот ряд не совпадает с ростом основности соот­
ветствующих реагентов'_
По отношению к изменению природы растворителя особенно чувстви­
тельны реакции типа SN 1, так как сама возможность подобных реакций
ОПределяется ионизирующей способностыо растворителей.
В реакциях, протекающих по механизму SN 1, при нейтральном субстра­
Те Скорость возрастает с увеличением полярности растворителя. В про­
Тонных растворителях они и.11УТ быстрее, 'leM в аПРОТОIIНЫХ. В реакциях,
------• Основность определяется константой ЮIСЛОТНО-ОСНОВНОГО равновесия (см. гл. 1.4). Это
теРМОДllнаМflчеСКltii фактор. Нуклеофильность определяется I<OHcTaHToii CI<OPOCТlt соот8еТСТВУlOЩIIХ реаКЦIIЙ, следовате,nьно, это КlшетичеСЮIJt фактор.
117
протекающих по механизму SN2, увеличение полярности растворителей
ведет к уменьшению скорости реакции, за ИСКЛЮ'lением реакций нейтра.,
льных веществ с нейтральными нуклеофилами, когда скорость сильно
возрастает.
Механизмы замещения SN 1 и SN2 в жирном ряду преобладают, однако
известны и другие механизмы, например тетраэдрический, отщепления
-,
присоединения. Они рассмотрены в других разделах (с. 127).
В каждом отдельном случае в зависимости от природы субстрата, нук­
леофила, уходящей группы и условий реакции осуществляется тот меха.
низм, который требует меньшей энергии активации, т. е. обусловливает
большую скорость реакции.
Галогеllопроизводные способны также отщеплять галогеноводороды
с образованием олефинов, т. е. выступать в реакции P-элиминироваННR.
Наиболее часто элиминирование в растворах проходит по ионным Mexa~
низмам Еl и Е2.
Реакции, протекающие по ЕI-механизму, не требуют присутствия ка­
КИХ-Jlибо реагентов, но необходим ионизирующий растворитеJlЬ. Стадией,
определяющей скорость реакции, ЯВJlяется образование интермедиата
-
карбениевого иона, который переходит в стабильное соединение (оле­
фив), отщеПJlЯЯ протон:
СН 1
+11.,0 )
Er.tC:L1I~1111O
I .
CH1-C+ + сг
. l
СНа
С!уН
-{++ Н2О
CH a
СНа
Реакции отщепления типа Еl обычно сопровождаются реакциями за­
мещения SN 1. Разветвленность алкилыюй группы БJlагоприятствует уве­
личению выхода олефина.
Реакции отщепления, протекающие по бимолекулярному механизму
Е2, требуют присутствия основания. Отрыв протона и потеря галогена
происходят одновременно (без образования промеЖУТО'lНОГО соединения)
через переходное состояние, в котором нуклеофильный реагент образует
связь с протоном в той мере, в какой происходит отщепление галогена,
например:
С 2 НД- + Н-СН 2-СН-Вг
.,
I
СН:1
~
[C2Hr.O"'H"'CH2-1Н-ВГ]
~
СН:1
111..'PCXOДlIOC СОСТШIIIIiС
~ С 2 Н,-,ОН + СНР1Н +
СНа
118
Br
скорость такой реакции пропорционаю,на концентрации обоих реаген­
тов. ОбычНО одновременно с отщеплением происходит и нуклеофильное
замещение по механизму SN2.
Если имеется ВОЗМОЖНОСТЬ дЛя отщепления галогеноводорода в двух
направлениях, образуется преимущественно более разветвленный (энер­
геТllчески более выгодный) олефин -
правило Зайцева.
OAHal(O направление ЭЛИМliНllрования зависит от природы галогена. Так. пр" дегидрога­
логеНllроваНIIII
2-галогенпентанов
выход
l-пентена
IIзменяется
C~H"F 8:3%. C:jH1,CI 37%. с"н"Вг 25%. С"Н,,! 20% .
•1
сле.дуЮЩliМ
образом:
Пр" термическом ЭЛIIМllllllроваНIIИ ре3lЩIШ большей частью li.дyT через Цl1I(Лliческое
liX
переходное состояние с ГIРОТIIВОПОЛОЖНЫМ направлеНllем ЭЩiМliНllроваНIIЯ. посколы(у
CKOPOCТL,
заВИСIIТ
от
стаТИСТII'IеСI<ОГО
фактора
('Iliсла
атомов
вqдорода.
способных
к отщеплеНIIЮ).
Кроме указанных механизмов отщеплеНIIЯ галогеноводородов существует еще особыii
Elcl) мехаНIIЗМ
рыв
IlpOTOlla
(мономолеКУЛЯРllое отщеплеНllе сопряженным
oCHoBaHlleM). при котором от­
предшествует потере уходящеil группы:
Н
Х
Х
_~_~_ ~ "C:'-(~I I
в ·;ТОМ случае
CI(OPOCTb
(il.юро
I
+
Н:В
-х· эо "С-С/
~CJUIt·"I()
/
,-
"
реаlЩlI1I ограНИ'l'lвается наиболее MeДJIeHHOl1 BTOPOI~I cTaДlleil.
CKOPOCТU реаlЩИII "а этой стаДИII.
КОI1ltefПРЮ(IIII
/
I(al(
и в случае бllмолекулярного отщеплеНIIЯ. зависит от
aHllolla.
Активность оснований в реакциях, протекающих по механизму Е2, из­
меняется в том же направлении, '!ТО и их сила:
NH~
> ОС 2 Н;; > ОН- > CH:1COO-.
При обоих механизмах скорость отщепления гаJIогеноводородов убы­
вает в ряду: третичные> вторичные> первичные и I>Br>CI.
Р(lССМОТРИМ отдельные реакции галогенопроизводных.
1. При катаЛИТИ'lеском гидрировании галогеналкилов ИJIИ действии на
liИХ водорода в момент выделения, а также иодоводорода происходит за­
мещение атома галогена водородом:
R!
~R-H+НI
I Кат. I
С 2 Н г.!+Ю ~ C2 H1j +!2·
2. действуя раствором соли галогеноводородной кислоты в спирте или
~цeTOHe на галогенопроизводные, можно заменить один галоген другим.
ЕСЛIi заменяют хлор бромом ИJIИ иодом, то следует вести реакцию с соля­
Ми щелочных металлов, хлориды которых хуже растворимы, чем бромиды
11 11ОJtиды. При замещении галогена с БОJlЬШОЙ атомной массой raJIoreHOM
с МеНыuей атомной массой следует применять соли серебра, так как иодид
Се
Ре б)ра менее растворим, чем бромид и особенно хлорид:
R-СI+Nа!;::::t R-!+NаСI
R-I+АgСI;::::t R-CI+A~!.
119
3. Большое значение (для получения спиртов из углеводородов) имеет
реакция галогеналкилов с водой (гидролиз). Гидролиз ведут в ПРИСУТСТВИИ
едких щелочей или карбонатов щелочных металлов при нагревании, ино.
гда при температуре выше температуры кипения воды (в автоклаве):
R-CI+H~O +2
R-OH+HCI
R-CI+N~OH ~ R-ОН+NаСI.
BOJtIII,II:j
раСТIIОР
4.
При действии IНI галогеналкилы алкоголятов образуются ПРОСТые
эфиры:
C~H,jB'r+N~OC2H;; ~ С~Н,j-О-С~Нг.+NаВг.
1I11·.TIIJIOIII,lii :.фltр
Кроме того, в БОJIЬШИХ или меньших количествах образуются непреде­
льные углеводороды.
5.
При взаимодействии с аммиаком и аминами галогеналкилы алкили­
руют их с образованием соответствующих первичных, вторичных или тре­
тичных аминов, а также СОJ\ей аммониевых оснований (гл.
3.2).
Приведем
здесь только реакцию образования первичного амина:
CH:!I+NH:! ~
6.
[СНаNН:!)+Г ~ CH:!NH 2 +NH 4!.
Реакцией галогеналкилов с солями синильной кислоты получают
цианистые алкилы (нитрилы) и изонитрилы. ПОJ\ЬЗУЯСЬ этой реакцией,
можно перейти от предеJ\ЬНЫХ углеводородов к карбоновым кислотам
(гл.
6):
CH4+CI~ ~ СН:!CI ~ CH:!CN.
НI\СТОIIИТf1IIJI
7.
При нагревании с солями органических кислот галогеналкилы дают
сложные эфиры:
О
С 2 Н) + AgO-Со-СН;j ----+- CH;j-~-ОС2Нfi + Ag!
УКСУСlю·.ТIIJЮllыii ,фщ'
HI\CTHT серебрн
При нагревании с нитритом серебра они образуют нитросоединения
и эфиры азотистой кислоты:
8.
С 2 Н,-,I
+ AgN0 2
-с
C2H,jN02 + AgI
IIIПIЮ·..,НII
C2H"ONO + AgI
,.ТИJII IIITpllT
Атакующая в этой реакции нуклеофильная частица - ион N02"ПРОНВJ\яет двойственную реакционную способность (амбидентные свойСТ'
ва), т. е. может присоединять радикаJ\ по азоту (механизм
роду (механизм
120
SN 1):
SN2) или
КИСЛО'
. .
:O-N=o
RX +
~
_..
SN 2
R- Jj
S~I
-o-N=6
R..
..
-с:
.
Q-N-Q.
ко·...
МеханиЗМ реакции, а следовательно, и ее направление сильно зависят от
при роды растворителя. Сольватирующие растворители (вода, спирты)
способствуют образованию эфира.
9.
При действии на галогеналкилы многих металлов галоген замеща­
ется металлом. Это наиболее важный метод синтеза метаЛЛОРГННИ'lеских
соединений. Например:
·.фир С:l Н ;; L·+L·B
С2 Н ;; В Г +2L ·I --'-'---+
I
I г.
"1TliJIJII-IТltii
10.
При действии спиртового раствора едких щелочей или органиче­
ских соединений (хинолин, диметиланилин) галогеннлкилы отщепляют га­
логеноводород и дают олефины. Например:
CH:1CH 2 CH 2 Br +
КОН
---+ CH:1 -СН=СН 2 +КВг+Н 2 О.
crl~lpToBblii
рНсТПор
Механизм реакции рассмотрен в гл.
2.
Отдельные представители. Применение
В технике из галогеналкилов наибольшее применение имеют хлори­
стый метил и хлористый этил. Их получают хлорированием соответст­
вующих предельных углеводородов. Хлористый этил получают также при­
соединением сухого хлористого водорода к этилену в присутствии ХЛОРИД<l
железа FeCl:~.
В химической промышленности хлористый метил и хлористый этил
применяются как алкилирующие средства. Хлористый этил применяется
в больших количествах для получения антидетонатора тетраэтилсвинца
(ТЭС), а также в медицине для кратковременного наркоза и для местной
анестезии (обезболивания), в частности, в зубоврачебной практике.
2. ди- и ПОЛИГАЛОГЕНОПРОИ3ВОДНЫЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ
Ди- и полигалогенопроизводные могут иметь одинаковые или разные
атомы галогенов у одного и того же или у разных атомов углерода.
Изомерия. Номенклатура
Галогенопроизводные с атомами галогена у одного и того же атома уг­
.1!ерода называются геминаЛЬНbl.ми, у рядом стоящих атомов углерода 8UЦuнальнымu. Ниже приводятся примеры названий полигалогено­
ПРОизводных:
121
CH2CI 2
дихлорметаи, хлористый метилен
.!
СНСl з
трихлорметан,хлороформ
CCI~
тетрахлорметан, четыреххлористый углерод
СН з СНСI 2
1,1- днхлорэтан, хлористый этил иден •
CH 2CI-CH 2C1
CHCI 2 -CH 2CI
1,2-днхлорэтан, хлорнстый этнлен
ССlз-СН з
ССl з -СН 2 С1
1,I,l-трихлорэтан
CHCI 2 -CHCI 2
1,I,2,2-тетрахлорэтан
1,I,2-трихлорэтан
1,I,I,2-тетрахлорэтан
Способы получения
Полигалогенопроизводные обычно получают из углеводородов или из
кислородсодержащих· соединений.
1.
ди- и полихлориды могут быть выделены из продуктов хлорирова­
ния предельных углеводородов.
2.
Геминальные дигалогенопроизводные
образуются
пентагалогенидов фосфора на альдегиды и кетоны (гл.
1°
СНз-С"н + PCI 5 ~СНз-СНСI2
при действии
5.1).
Например:
+ РОСl з .
з. 8ицинальные дигалогенопроизводные можно получить присоедине­
нием галогенов к непредельным углеводородам:
СНЗ-СН=СН2+ВГ2
---+ СН з СНВгСН 2 Вг.
l,2-диБРОМПРОПВII
4.
ди- и полигалогенопроизводные с атомами галогенов у различнЬ\х
углеродных атомов образуются при действии галогеноводородов, галоге­
нидов фосфора, хлористого тионила на гликоли или другие многоатомные
спирты:
3СН 2 ОН -СН 2 -СН 2 -СН 2 ОН + 2РВг з
---+ 3СН 2 ВгСН 2 СН 2 СН 2 Вг+2Р( Он)з·
l,4-дибромбутан
Физические и химические свойства
ди- и полигалогенопроизводные
-
тяжелые жидкости или кристалли­
ческие вещества. Нерастворимы в воде.
ди- и полигалогенопроизводные, как и галогеналкилы, вступают в раз­
личные реакции нуклеофильного замещения (с водой, аммиаком и т. п.),
Если атомы галогена находятся при различных атомах углерода, то при
гидролизе образуются двухатомные спирты (гликоли). Например:
CH 2C1-CH 2CI+2HOH +:t CH 20H-CH 20H+2HCI.
* НазваНIIЯ двухвалентных радllкалов, IIмеЮЩlIхдве свободные валентности у одного 11 того
же углеродного атома, производятся заменоil ОКОН'lания -ан предельного углеводорода на
-илиден (кроме метилена).
(22
Если атомЫ галогена находятся при одном углеродном атоме (геми­
нальные соединения), то при гидролизе получаются альдегиды, кетоны
или кислоты. Например:
СН з СНСI 2 +Н 2 О
---+ СНз -СН-0+2НСI;
СН з -ССI 2 -СН з +Н 2 О
СН з -ССl з +2Н 2 0
--+ СН з -СО-СН з +2НСI;
--+ СНзСООН +ЗНСI.
РеакциИ во всех случаях идут через ряд стадий:
/ОН
СНзСНСI2+НОН~ снэ-сн,
,;0
HOH~ снэ-с,н+ НСI
СI
/ОН
,;0+
СНэССlэ+НОН ~снэ-сн, СI
~ снэ-с,
СI
НСI
CI
,;0
,;0
снз-с, + НОН ~снз-с,
+ НС!
ОН
CI
ОтделЬНblе представители. Применение
Наибольшее значение в технике имеют продукты хлорирования метана
и этана, а также фторхлориды.
Хлористый .метилен CH 2CI 2 -
жидкость С т. кип.
41
ОС, Применяет­
ся как негорючий и легко л~тучий растворитель.
ХЛОРОфОРАt. Кипит при
61
·С. Применяется как растворитель (ранее он
применялся главным образом в медицине мя общего наркоза). В про­
мышленности хлороформ получают действием хлора и щелочи или хлор­
ной (белильной) извести на спирт:
CI
+ЗСI
СЩ:Н 2 ОН -2t1ЕI''' СНэСН=О -энс'''' CClrCH=O
хлорал
..
,;0
2ССl э-СН=0 + Ca(OH)2-' 2СНСl з + Са(О-С, )2
хлорофор~
фnрми"т Н
IWIЬЦИА
При действии на хлороформ щелочей в качестве промежуточного про­
ДУкта образуется дихлоркарбен, используемый в современной органиче­
ской Химии Д/Jя введения метиленовой группы.
дихлоркаРбен может рассматриваться как галогенопроизводное про­
СтеЙшего двухвалентного радикала метилена (карбена). Двухвалентные ра­
Дикалы, как и одновалентные, часто являются промежуточными продукта­
МВ в реакциях органических соединений. Специальное название карбены
ОНИ Получили потому, что по свойствам они не являются полными анало­
ГаМИ одновалентных радикалов. Наличие двух несвязанных электронов у
123
одного и того же атома углерода придает карбенам специфические своЙст.
ва. Спины этих электронов (в зависимости от природы карбена и метода
его получения) могут быть параллельными (триплетное состояние) 11
антипараллельными (синглетное состояние).
в триплетном состоянии карбе.
ны проявляют некоторые свойства:
H~H
Q
Рис.
~:
6
Схема двух состояний карбена:
ТРllплентноro (а) н синглетноro
40.
бирадикалов. В синглетном состо.:
янии они, С одной стороны обл8Да_'
ют дефицитом электронов, ЧТО
роднит их с ионами карбеНИR
(с. 33), с другой стороны, имеют
свободную электронную пару, что
делает их аналогами карбанионов.
Поэтому карбены могут проявлять как электрофильные, так и нуклеофи­
льные свойства в зависимости от способности связанных с карбениевым
углеродом атомов или групп оттягивать или нагнетать электроны, а также
от характера реагента.
В триплетном метилене имеет место sр-гибридизация и два свободных
электрона расположены на двух негибридизованных р-орбиталях, в синг­
леТIIОМ - оба электрона находятся на гибридной орбитали, которая име­
ет больший s-характер и, следовательно, меньшую энергию (рис. 40). Та­
ким образом, следовало бы ожидать, что синглетное состояние будет бо­
лее устойчивым. Однако уменьшение взаимного отталкивания электронов
в триплетном состоянии (вследствие того, что электроны расположены на
р-орбиталях и спины их параллельны) компенсирует выигрыш энергии,
связанный с большим s-характером, и для незамещенного метилена в He~
возбущденном состоянии триплетное состояние более устойчиво. чем сии­
глетное. В то же время для дихлоркарбена более устойчиво синглетное
состояние.
Примерами реакций, идущих с участием дихлоркарбена, могут служить
реакции получения диазометана:
CHCI:1+KOH ---+ :CCI2 +KCI+H20;
Н
NH 2-NH 2 + :CCI2
--:.
Nh 2-fLССI; -2IЮ..
Н
124
CH 2N2
Другие прИМ~i?lс.rd. гл.
8.3, 15, 28
и др.
Чеmblреххлорuсmый углерод. Применяется как негорючий раствори­
тель, в частностИ, при тушении пожаров, если горят ЖИдкости с плотно­
стью ниже
1-
легче воды. Служит д.1Iя получения фреона-12.
при тушении пожаров с помощью
CCI 4
возможны отравления, так как при окислении
CCl 4 может образоваться фосген.
1,2-Дuxлорэmан. Т. кип.
84
ос. Дешевый, но ядовитый растворитель.
ИСХОДНЫЙ продукт д.1Iя синтеза хлористого винила, используемого в про­
мышленности пластмасс.
Гексахлорэmан. Кристаллическое вещество с т. пл.
187-188 ос (в за­
пaяHHoM капилляре). Применяется как инсектицИд (средство борьбы
с вредными насекомыми), в качестве глистогонного средства (в ветерина­
рии), а также для производства дымовых шашек.
Большое применение в технике охлаждения получили nолифmорхлор­
углеводороды (фреоны).
Производные метана обозначают двухзначными, а производные этана - трехзначны·
ми числами. Последняя цифра указывает число атомов фтора, предпоследняя - содержание
водорода: 1 - пергалогенированные соединения (нет атомов водорода), 2 - есть один атом
водорода, 3 - два атома водорода и т. д. Например, F-12 - дифтордихлорметан CF2CI 2;
F·22 - дифторхлорметан CHF2CI; F-114 - тетрафтордихлорэтан CCIF2-CF2CI и т. д.
Фреоны
-
очень устойчивые соединения, они не гидролизуются и поэ­
тому не корродируют металл; используются как хладоагенты, как раство­
рители !шсектофунгицидов для образования аэрозолей и как промежуточ­
ные продукты в синтезе фторпроизводных.
Наиболее распространенный фреон-12 получают из
сутствии
CCI4
и
HF
в при­
SbFs как катализатора:
CCI 4 + 2HF .JSbFs ]
~2HCI +CF2CI 2 .
Важное применение получил фmороmан СFз-СНСIВг
-
бесцветная
тяжелая жидкость с запахом, напоминающим хлороформ. Это одно из са­
мых эффективных средств для общего наркоза. Имеет ряд преимуществ
перед хлороформом: мало токсичен, почти не дает стадии возбуждения,
Нf1ркоз быстро проходит ".
Инертные перфторуглеродные жидкости предложено применять в ка­
чеСтве заменителей плазмы крови.
Широкое применение фреонов в технике и в быту создало угрозу д.1IЯ существования
в стратосфере ОЗОННОГJ слоя, защищающего Землю от жесткого ультрафиолетового излуче­
ННя. Пары галогенопрС>изводных фотохимически расщепляются в стратосфере с образовани­
ем атомов галогенов, У.оторые вызывают превращение озона в кислород.
----•
в науке о лекарственных веществах - фармакологни - все этн вещества
фассифицируются в зависимости от их основного влияння на различные биологические
а ун JЩИИ человеческого организма. Средства Д1\Я общего наркоза - фторотан, хлороформ,
На таКже прнведенные ниже этиловый эфир, циклопропан действуют преимущественно
цеliТРальную нервную систему.
125
3,
ГдЛОГЕНОПРОИ3ВОДНЫЕ НЕПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ
Номенклатура и изомерия галогенопроизводных непредельных УГле~
водородов в принципе не отличаются от номенклатуры и изомерии преде.'
льных галогенопроизводных. Приведем примеры:
CH1=CHCI
CH 2 =CCI 2
CHCI=CHCI
CH:1-CH=CHCI
хлорэтен. хлористый ВI1НIfЛ
СI-I 2 С1-СН=СН 2
3-хлор-l-пропен. ХЛОРl1стыii ЯЛJll1Л
I,I-днхлорэтен. ХЛОРIfСТЫЙ ВIIНI1Лl1ден
1,2-Дllхлорэтен
I-хлор-I-пропен
Способы получения, Для получения непредельных галогенопроизвод,
ных могут быть использованы следующие методы.
1.
Отщепление галогеноводородов от предельных ди- и полигалогеНQ.
производных:
-HHI~) RCHlg = CHR'
RCHHlgCHHlgR'
2. Прямое галогенирование алкенов обычно проводят при высоких
температурах. Для каждого алкена имеется критическая температура,
выше которой замещение является главной ре<JКlJ,ИеЙ. Рюветвленные ал·
кены уже при обычной температуре дают продукты замещения аллильно·
го типа:
"'ОО ос
СН;гСН=СН .. +CI .. ~ C1Н.СН.=СН.
<
<
СI
<
<
<
СН: 1" '
,
~"oc CICH 2,-, ,
/С=СН) +CI,) ---:;,..
/С=СН 2
СН
СН,
.1
,\
Физические свойства в гомологическом ряду непредельных галогено'
водородов подчиняются обычным закономерностям.
Химические свойства. БОJlЬШОЙ интерес представляют различия в хи­
мических свойствах непредельных галогенопроизводных в зависимости от
положения атома галогена и ДВОЙНОЙ связи. По этому признаку все непре­
дельные галогенопроизводные могут быть Р(lзделены на три группы: сато·
мами галогена при углероде с двойной связью
в a-ПОJlожении к двойной связи
(ll)
(1),
с атомами галогена
и остаЛЫiblе галогенопроизводные
с атомом Г<Jлогена, удаленным от двойной связи (Ш):
CH 2 =CCI-CH:1
СН 2 =СН-СН 2 С1
I
I!
CH 2=CH-CH 2 -CH 2CI.
111
Для галогенопроизводных первой группы характерна малая реакциоН'
(lTOMbI галогена
ная способность атома галогена и двойной связи. Здесь
далеко не всегда можно заместить на I<акие-либо другие атомы и группы.
Реакции присоединения по двойной связи идут очень медленно.
Взаимное влияние двойной связи и атома галогена объясняется сопря'
жением между свободными электронами атомов Г(lлогена и двойной свЯ'
зью. В результате этого сопряжения связь галогена с углеродом укорачи'
вается (см. Т<Jбл.
126
8). Дипольный
момент связи ПОНИЖ<Jется, TflK KflK индУ'"
ци
онная составляющая дипольного момента
u
момент, возникающии
б
и значительно меньший
лагодаря сопряжению, направлены в различные
стороны:
т а (j л 11 Ц а
8.
Дnина связей и дипольные моменты преДeJlЬНЫХ
и непределЫIЫХ хлорпроизводных
Двина связи, нм
Вещество
СН,-СН,-CI
СН,=СН,
СН,=СН-СI
Укорочение связи
C-CI
Дипольный момент
С-С
D
IVI' М' 10'"
0,154
2,05
6,85
-
О
О
1.44
2,95
С=С
-
0,176
-
0,135
0,169
C-Hlg
0,138
можно объяснить и большей электроотри­
цательностью sр2_ ги бридизированного атома углерода по сравнению
с sp:J-гибридизированным. Он сильнее притягивает элеКРОIIЫ связи. По­
следняя становится короче и, следовательно, прочнее. Малая вероятность
замещения галогена по механизму
SN 1 обусловлена
также тем, что моле­
кулы винильных галогенидов стабилизованы сопряжением, в то время как
в ионе )C=C~ такая стабилизация невозможна.
Атом фтора у двойной связи значительно более подвижен, чем атомы
других галогенов. Он легко замещается в реакциях с нуклеофилами.
РеЮЩl1ll замещеНIIЯ по меХ3НIIзмам
SNI
11
SN2
В ряду непредельных галогенопроll3ВОД­
НЫХ
- реДl(ое явлеНliе. Для Hel(OTOpbIX 11звестных реЮЩIIЙ замещеНIIЯ галогена установлен
Mexalll13M «присоеДlIнение - отщеплеlНlе» или «отщеплеНliе - пр"соеДliнение». HanplIмер:
Индукционный эффект aToMfI галогена сильно уменьшает электронную
ПJlOтность двойной связи, благодаря чему затрудняется электрофильное
Присоединение. Присоединение идет по правилу Марковникова:
СН 2 =СНХ + НХ--+СН: 1 -
СНХ 2 ·
Во-первых, при электрофильной атаке только в этом случае возможно
СОlIряженное переходное состояние:
п
. .
С'\,
n
х· н ·СН 2 =СН-Х:
127
Во-вторых, из двух возможных промежуточных катионов более ус
чив, а следовательно, более вероятен катион (1), так как его заряд ча
но компенсируется сопряжением с галогеном:
ri:
CH~-CHгX.
+
сн-сн-х:
.\
..
11
I
Этиленовые фторпроизводные очень часто в реакциях присоеДИне
не подчиняются обычным правилам, определяющим направление Присо
динения,
вследствие
сильной
электроотрицательности
атома
ФТо'
(И. л. Кнунянц, Г. Мак-Би).
.:
в случае галогенопроизводных второй группы атом галогена легко за
мещается. Это объясняется большой устойчивостью (благодаря сопря
'i!i
нию) карбениевого иона, возникающего при диссоциации галогеНОПРОИЭ_.i
водного типа:
..
cr":\
+
CH2=CH-CH~-<;;I: ~ СН 2 =СН-СН 2
.•~
+
.. :~I:
в аллильном карбениевом ионе обе возможные граничные структуры
равноценны,
что
указывает
на
высокую
делокализацию
электронной
плотности, а следовательно, на стабильность иона. Квантово-химическаи
модель этого иона представлена на рис. 41.
Несмотря на то, что в молекулах галогеналлилов
Ж
+
-
+
н
+
Ж
+
РI1С.
41.
атом галогена сильно оттягивает электроны, электро­
<1>:\
фильные реагенты присоединяются к ним в COOTBe'I"'·
ствии справилом Марковникова. Только при далЬ"
нейшем накоплении галогенов, например в случае
СFз -СН=СН 2 ,
трифторпропена
<1>2
присоединение
идет с нарушением правила Марковникова.
Галогенопроизводные третьей группы сущест­
венно не отличаются по свойствам от предельнbIX
-
галогенопроизводных, с одной стороны, и от оле­
<1>1
КваНТОВОХI1МИ-
ческая модель аЛЛ11ЛЬНОГО
l<арбениевого иона (одна
орБИТIIЛЬ свободна)
финов
-
с другой.
Orдельные представители. Наибольшее техниче­
ское значение из галогенопроизводных непредель­
ных углеводородов имеют хлористый винил, хлористый аллил, тетрафторэтилен, хлоропрен.
Хлористый винил при обычных условиях газ. Получают его либо присоединением хлорово­
дорода к ацеТИJlену, либо отщеплением хлороводорода от дихлорэтана:
NиОН
- CH 2CICH 2C 1 - - -.... СН 2
=
СНСI
+ NIICI + н 2 о.
CIIItJlT·I'·P
Хлористый винил способен к фотохимической, термической и каталИ­
тической полимеризации по схеме:
nСН 2 =СНСI
СI
-+ ...
[
CI]
IIOJIIШIIIIИJIXJIOI'IЩ
128
СI
-сн 2-tн- Ch 2-tн 11_2- СН 2-tн-...
1
П олимерь
ых
ХJЮРИСТОГО
винила
широко
применяются
..
в
производствс
U
материалов, грампластинок, плащеи и других изделии.
IiЗОЛЯЦИ~;~blЙ аллuЛ - бесцветная жидкость с т. кип. 45 ос. Получается
~лоtтемпературным хлорированием пропилена (с. 126). Применяется
высок
каК исхО
дное вещества для получения аЛЛИJЮВОI"О спиртя и глицериня
3.4)·
( гл.Хлоропрен
(т.
hg ОС)
КИП ..)
ВИllиляцетилену в
получают присоединением хлороводородя
присутствии
C11 2 C1 2
или дегидрохлорировянием
; 4_дихлор-2-бутеня (гл. 1.3). Применяется для получеl-IИЯ синтеТИ'lеско­
г~ каучука, устойчивого к истиранию, огню, плохо пропускяющего ГЯЗЫ.
полимеризация хлоропрена и вулканизация полученного кяучука проис-
ХОДЯТ самопроизвольно под влиянием к~слорода воздуха.
Теrnрафmорэmuлен
-142,5 ОС, плотность
,о ,
бесцветныи газ, т. кип. -76,3 С, т. IIЛ.
1,533 (-80 ОС). Получается при пиролизе
-
фреона-22:
2CHCIF~
700 0 С ~ CF~
=
CF~ + 2HCI_
В присутствии пероксидных катализяторов rюд давлением тетрафтор­
этилен I/олимеризуется с обрязовянием продукта с молскулярной массой
от
500000 до 2
ОСЮ
000,
известного под названием mефлон. ОТШI'lитель­
I/ое свойство этого полимера
-
чрезвычайная химическая инертность.
Он УСТОЙ'II1В ко всем реагентам, зя ИСl<Jlючением раСПЛЯВJlеНl-IЫХ щеЛО'I­
flbIX металлов. Водные щелочи, концентрированные кислоты (H 2S0 4,
НNО з ), пероксид водорода и другие окислители и органичеСI<ие ряствори­
тели lIа него не действуют. Он может быть использован в интерваJlе тем­
ператур от -70 до +250 ос. Из тефлона изготовляют стойкие к действию
агрессивных сред детали аппаратуры.
Необычайно высокая биологическая инертносТl) тефлона способство­
вала его ИСПОJlьзованию для изготовления искусственных кровеносных
сосудов, выпускаемых рядом фирм Европы и США.
ГЛАВА
3
ОдНО- И МНОГОАТОМНЫЕ СПИРТЫ
Спиртами, или алкоголями, называют гидроксильные производные уг­
Л1 еводородов. Спирты могут быть предельными и неп!)едеJlыrыми. Атом­
!ОСТ
1, спнртов определяется числом ГИДРОКСИЛЫ-IЫХ групп -он.
1.
ПРЕдЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ
гl
IIJIИ ~ell.eJlbIlbIC одноатомные спирты имеют общую формулу CflH 211 + 20
Ilе С"I-I 211 + 1ОН. В зависимости от
TOI"O,
при
Kal<OM
углеродном атоме,
РВИ'II!ОМ. вторичном или треТИ'I~IOМ, находится гидроксил, рязличяют
5 Заж_ 181
12й
спирты пеРВИ'lНые
R-CH 20H (1, IlI),
ВТОРИ'lные
R2CHOH (II)
и Трет" 1
ные RзС-ОН (IV).,~
Изомерия. Номенклатура
Изомерия спиртов зависит от строения углеродной цепи и ПОЛожен"
гидроксила в цепи. Так, например, спирты состава C 4 H gOH МОжно рас
сматривать как производные углеводородов С 4 Н!о, нормального БУТан
и изобутана, в которых один атом водорода замещен группой ОН. д,.
нормального бутана:
НО-СН 2-СН 2-СН 2-СН:.
СН:г- тН -СН 2-СН:.
ОН
11
для изобутана:
СН .•
I .
. I
HO-СН2-тН -СН:.
СН.-СН-СН.
СН:.
.
ОН
IV
111
ОБЫ'IНО спирты называют по радикалу, связанному с гидроксиnьно
группой. По систематической номенклатуре название спирта составnяе1
ся из названия соответствующего предельного углеводорода с добавnен~
ем к суффиксу -ан суффикса -ол и указанием номера углеродного аТОМI
при котором находится гидроксил (табл.
9).
Кроме того, спирты можно H~
зываТ!, как замещенные метилового спирта
т а б л 11 Ц а
9.
-
карбuнола.
Номеllклатура спиртов
НаЗRание
Формула
тривиалыlOС
Метиловый
(древесный)
ЭТllловыii
:\
~
2
Метанол
ЭТIIНОЛ
\
CH:\-CH~-CH20H
1
(BIIHHbIii)
ИЮПАК
ПРОПlIЛОВЬllj
I·Пропаноn
:\
CH:1-СНОН-СН а
ИЗОПРОПllЛовыil
2-Пропаноn
1
:\
2
1
. CH:\-CH~-CH2-CH20H
БУТlIловыii
I-БутIlНОЛ
1
~
:!
.\
CH:I-СНОН-СН2-СНа
ВТОРlIчныii БУТIIЛОВЫЙ
2-Бутаноn
130
ОК()НlЩНUI! lIIufiл.
СИ:I
С
ИзоБУТl1ЛОВЫЙ
2·МеТflл·!·пропанол
TpeТli'IHbIii БУТliЛОВЫЙ
2·МеТliл·2·пропанол
Амиловыii
j·Пентанол
И:1- Сlи-сн.,ои
-
r.
4
I
~
4
:1
~
:1
I
Сн:I_СИ~-СИ~-СН~-СН~ОН
:1
4
5
СН:гСИОН-СН~-СН~-СН:1
~
BTOPII'IHbIli
I
ОПТII'lеские
аКТИВНЫ!"1
СИ:гСИ~-тН -CH~OH
CH1-СН-Сн .• -СН.,oн
•
2·Пентанол
2·Метил·!·бутанол
амиловый
СНа
. I
амиловый
9
-
Изоамиловый
З·МеТllл·j·6утаfIOЛ
Неопентиловый
2,2'ДlIметил,
СН: 1
С 1-1:1
:1
)
I
СН'Г С-СН .• ОН
.
I
•
·!·пропанол
СН: 1
Способы получения
Существует много способов получеflИЯ спиртов. Здесь приводятся
лишь простейшие из них .
•1. Спирты получают гидролизом галогеналкилов при IJагревании с во·
ДОИ или водным раствором щелочей. В первом СЛУ'l2е реакция обратима:
I 101 1
С 2 Н,р
8
С•
.
С2Н',ОН +НСI
2Н!;ОН
•
+ NaCI
~. Синтез спиртов осуществляется действием металлорганических,
И I<1СТНОсти магнийорганических. соединений на альдегиды, кетоны
, СЛОЖНЫе эфиры. Впервые такой синтез с ПРИМСl1ением цинкорганиче­
~КI~ соединений был осуществлен А. М. Бутлеровым и его учениками
. С . З1\йцевым и Е. Е. Вагнером .
... ~ Иllтез спиртов с помощью маГlIИЙОРI'аНИLlеских соединений, разрабо­
'<.flflb "13 .
Iи . r риньяром, проходит по следующей общей схеме. В альдегидах.
131
кетонах и сложных эфирах имеется карБОНI1ЛЫ!аЯ группа, в которой элej
тронное облако смещено к атому кислорода, что условно изображают 'I'~
-с 'Ъ
I
.
Благодаря этому смещению у атома углерода возникает некО1'О.'
рый положительный знряд, а у атома кислорода - дробный O'l'p";
цателыlйй знряд. В мнгнийгнлогеННJlкиле R-МgВг остаток R ведет ce&i
как нуклеофильная частицн, легко присоеДI1НЯЮЩНЯСЯ к УГJlеродному a'l'~
му карбонильной группы. Реакция проходит по схеме
=
,
R
,
,R
,
1\,
'
1
СН:г~НгМgВг+
0v ~~ R~ ВгМg-О-С-С
2Н5
~ _______________ J R
~
'....
Полученное соединение (магнийбромнлкоголят) легко гидролизуе1'Cl
с образованием соответствующего спирта:
R'
R'
1
1
С 2 ! !,,-С-О-МgВг+ нон ~ Ч !,,-с-он +MgBгOH
I
I
R
1Jt:IICШШШt:ОJII.
R
"""111111
I.'IIIIIП
Синтезы по этой схеме с муравьиным альдегидом приводят к первич­
ным спиртам:
н,,Н
/С=О
МУj);ШI,IIIIIdIИ'
CP;MgBг ~ Ср~-СНРМgВг~
+
()рIIМИL:ТЫli
Мill'II.,ЙfiIЮМ'ШКt1Il)}Шl'
~ сн;\- сн 2 -::- снрн + MgBг( ОН)
м",",шii.""1JI
ilJJI.-IIСI'JI)I
IllюrlllJЮНIoIИ I.:ШIР"
Со всеми другими альдегидами образуются вторичные спирты:
СН\
сн:\
СН,
1
1\
·i'..c=o + C2H,MgBг~
С"Н,C-ОМgВг ~ С"Н,-с-он
+ MgBг(OНl
"
•. , 1
•. , 1
н/
yкcyclI ... il
Н
ilJIЫLСП!Д
Н
Iпtфll'llll,lii fiУТИJIIJlИ,lЙ CI1HpT
Мill1lнiiUJЮМ,tJlКСJI"С)JISI'l'
Взнимодействием мнгнийгалогеналкилов с кетонами получают третиЧ­
ные спирты:
СН ,
CB:1,,-
с=о + C.,H,MgBг~
СН /
- ,1"
.1
""t"1'"'
1 '
•
C.,H,MgBг ~С2Н,-С-ОМgВг---;;.
-
.)
.,
1
сн.
,\
СН,
1 .\
~ С 2 Н:;-т- ОН + МgВг(ОЮ
СНа
ЧIСТIIIIIII.IIИ'
ilМltmШl.lii CIIHI'T
132
ействие магнийгалогеналкилов со сложными эфирами (кроме
8заИМОдравьиной кислоты) также приводит к третичным спиртам, при-
мУ
С ложные э Ф иры
3фи ров
. ббльШИМ
выХОДОМ, чем из кетонов.
чем с
в этиХ условиях образуют вторичные спирты.
муравьинои
u
кислоты 'IЯ идет в две стадии: сна'iaла, как оБЫ'IНО, происходит присоеди­
реакЦ'
аГliийорганического соединения по группе >с=о, а затем в реак-
нени е ~тупает новая молекула магниЙгалогеналкила. При этом аЛКИJl по-
цИЮ ве
~~
_Ф ирнои
еГО становИТСЯ на место':)
п-!-с=о
-:1
(
CII.Mgllг
.,
OC~H"
УI<СУСIIО',ПIJIOВI,lii
u
группы
C~
- OR'.
+CII .. Ml.(lIг
~СН:\-С-ОМgВг.·'
I
I
-С~II,,()Мgllг
..
OC~H ..
"II)lIJ!
?Н:\
?Н:,
~ СН.1 -С-ОМgВг~
СН-С-ОН
I
.\ I
СВ:,
СН,
·'l>L'illlll'IIJj.i I3УПl.mmыii L'JJJJP'"
3. Спирты ПОJlучают тякже гидратацией (присоединение воды) этиле­
новых УГJlеводородов (см. гл. 1.2). Реакция проходит в строгом соответст­
вии справилом Марковникова.
4. Спирты С другой ориентацией ГИДРОКСИJlа получают из алкенов ре­
акцией гидроборирования диборанами с ПОСJlедующим окислением. Ди­
мерный гидрид бора лрисоединяется к алкенам с образованием боралки­
лов (по обычной схеме электрофилыюго присоединения):
6R-CB=CH2+(BH:I)2--+2(R-CH2-CH2):IB.
Последние окисляются пероксидом водорода с образованием спиртов
и борной КИС.поты:
(RCH 2CH 2):1 в +
ЗН 2 О 2 ~ ЗRСН 2 СН 2 ОН + H:1BO:1.
Реакцию проводят в тетрагидрофуране или другом подходящем раство­
РИтеле. Диборан ПОJlучают в том же растворителе по реакции
ЗNаВН 4 + BF:I--+2(ВНа)2+ЗNаF.
Ви \~~осстановление альдегидов, кетонов и сложных эфиров в присутст­
зо и 1, Со, CII, Pt, Pd и некоторых других катализаторов приводит к обра­
нь~а:иlO СПиртов: первичных - при восстановлении альдеl'ИДОВ и CJlOжФиров И вторичных - при восстановлении кетонов:
Н
I
CH:I-C=O+H2~ СН: I-СН 2 ОН.
УКСУСIIЫЙ aJII"'\CI'11.1
133
о
. R-
11
С-ОС 2 Н 5
+ 2Н 2 -.:;. R-
СНРН + С 2 НРН
'fПIJIОВI.Й эфир
карБOlIORОд КИСЛОТЫ
~
СН З- С- СН з
+ Н 2 -.:;.
СН з -СНОН
ацетон
-
J
СН з
ИЗОПРОПИnОRыА
спирт
Применяют и некаталитические методы восстановления.
Физические свойства
Спирты дО С 1О при обыкновенной температуре - жидкости; начинаа
с С 11 и выше - твердые тела. Спирты С 1 -С 2 смешиваются с водой во
всех соотношениях и имеют характерный запах. По мере увеличения мо­
лекулярной массы растворимость жидких спиртов в воде уменьшаетCR
и запах их становится неприятным. Твердые спирты лишены запаха и поч­
ти нерастворимы в воде. Жидкие спирты являются хорошими растворите­
лями многих органических веществ.
Температура кипения спиртов возрастает по мере увеличения их МOJIе­
кулярной массы, например:
Спирт .....
Т.КIIП., ос
.
СНРН
С.Н.ОН
н-С,Н.ОН
64,5
78,3
117,7
..
Спирты нормального строения кипят при более высокой температуре.
чем спирты с разветвленной цепью. При одинаковом числе углеродных
атомов первичные спирты кипят при более высокой температуре, чем вто­
ричные, а вторичные
-
при более высокой температуре, чем третичные.
Например, температура кипения бутиловых спиртов С 4 Н 9 ОН: нормаль·
ного
117,7 ОС, изобутилового 107,3 ОС, вторичного 99,5 ос и третичноro
82,8 0 с. Температура плавления, наоборот, выше у третичных спиртов.
Плотность спиртов меньше
1.
Температура кипения спиртов значительно выше температуры кипения
соответствующих углеводородов и даже галогенопроизводных. Например,
этан кипит при -88,3 ОС, бромистый этил С 2 Н 5 Вг - при +38,0 оС,
а этиловый спирт - при +78,3 Ос. ЭТО различие обусловлено тем, что
спирты, как и вода, хотя и в меньшей степени, являются ассоциирован нЫ •
ми ЖИДКdСТЯМи.
Отдельные молекулы спиртов соединяются между собой с помоlЦЬ~
так называемых водородных связей, возникающих между водородныМИ а
кислородными атомами гидроксильных групп различных молекуЛ спиРТ
(с участием неподеленных пар электронов кислорода):
~
R
f
:Q-H6.-HQ-H...
134
ция оказывает существенное влияние на физические свойства
Ассоци:ак как в жидкости присутствуют димерные, тримерные и поли­
спиртов.
е молекулы.
мерНЫ спиртов xaplIKTepHo поглощение в инфракрасной области около
Дл:м (3600 C~Г 1) - валентные колебания неассоциированного гидро2.8 м около 3 1 мкм (3200 CM- 1) - аналогичные колебания ассоцииро-
.
ксила и
НО ГА гидроксила.
ван
Химические свойства
химические свойства спиртов обусловлены присутствием реакцион­
носпособной гидроксильной группы -он. Реакции с участием этой груп­
пы проходят с разрывом связи 0 - Н или с-о.
1. КИСЛОТНО-ОСНОВНbIе свойства. Спирты - вещества нейтральные,
НО в незначнтельной степени они проявляют амфотерные свойства.
При взаимодействии спиртов со щелочными металлами водород гидро­
ксила замещается металлом с образованием алкоголятов:
2C 2H 5 0H+2Na --+ 2C2H 50Na+H 2 ·
алКОГОJIЯТ
(этилат
lIатрия)
Алкоголяты легко разлагаются водой:
C2H,jONa+HOH +::t C2H 50H+NaOH.
так как спирты более слабые кислоты, чем вода (с.
cTBa
>
106).
Кислотные свой­
спиртов убывают в следующем порядке: первичные
>
вторичные>
третичные.
Как и вода. спирты проявляют и основные свойства: они реагируют на
холоду с СИJIЫIЫМИ кислотами, образуя соли алкилоксон.ия·:
R-Q-H +НВг ~ R-O-H + Вг
I
Н
Основные свойства спиртов убывают в противоположном порядке по
сравнению с кислотными.
2. 3терификация. Спирты взаимодействуют с минераЛЬНblМИ и орга­
НИческими кислотами с образованием соответствующих сложных эфиров
И воды:
С 2 НрН
+ HOSO:fl
~ С 2 Н 5 ОSО зН
этилсулЬфат.
+ Н 2О
311fЛсеРllая кислота,
се""0'ТИЛ"ВЫЙ -фир
О
---
О
,
11
~
11
C/1 50H + HO-С-СНЗ~С2Н50-С-СНз+ Н 2О
УКСУСIIО.ТИЛОRЫЙ эфир.
этнлацt'Т3Т
'п
raJIore Plt нагреваНIIИ. а в случае третичных спиртов и на холодУ. оксониевые СОЛIf
НОВодородных КI;слот превращаются в галогенопроизводные.
135
Реакция образования сложных эфиров минеральных и органичес~
кислот обратима: на определенной стадии наступает равновесие.
Скоросп) о?разо~ания сложных эфиров, как показал Н. А. MeHIlJyy
кин, при однои И тои же кислоте для первичных спиртов примерно в
раза больше, чем для вторичных, и в
3.
раз больше, чем для третичныt''.,'
20
Дегидратация. При действии на спирты водоотнимающих вещеCiii
происходит межмолекулярное или внутримолекулярное отщепление воды.
Водоотнимающими веществами являются кислоты (H 2S0 4 , Н з РО 4 , щаве:.\
левая, бензолсульфокислота и др.), оксиды (алюминия, тория и др.), -н е ко.'
торые соли (гидросульфат калия, сульфат меди, хлорид цинка и др.).
При межмолекулярной дегидратации спиртов ПОЛУ'Iаются просты~
эфиры (R-O-R или R - O - R ' ) : '
I
R-OH+HO-R (IIЛИ I-IO-R') ----+ R-O-R (IIЛИ R-O-R')
. ',.
+Н 2 О.
В СЛУ'Iае внутримолекулярной дегидратации спиртов, проходящей
111
тех же катализаторах, но при более высокой температуре, образуюТCI
непредельные углеводороды, например:
II:ЮllРОllliJlОныii 1.:IIIIpT
11 POII IIШ 11
При ЭТОМ водород отщепляется от наименее гидрогенизированного атома
углерода, соседнего с углеродом, несущим гидроксильную группу (прави­
ло Зайцева):
CH: t-СН 2-ОI-С!--I:1 ~
CH:1-
I
СН =CH-CH:1+
HP
:2-()yrcll
ОН
CII,If.If-;"'''СТIIJl:'ТI'JIСIl
Эта закономерность в сочетании справилом Марковникова дает воз­
можность переходить от одних спиртов к другим. Например, от изобутило~
вого спирта к третичному бутиловому спирту:
СI-I.\
СН\
I .
СН\
I .
I .
сн.\- СН -СН,он ~ CI--I: г C=CH.,~ снг с- СН\
•
11:III()УI'IIJЮIII.Jii
-
.
1t:III('Y'rllJl~1I
-
•
I
.
ОН
CIIII,,'"
TIK'TII'IIIIJii
(IУЛIJIIIIII.I'-''':IШРГ
Реакции отщепления воды, как и реакции отщепления галогеноводорО­
дов, могут проходить по механизмам Е 1 ИJIИ Е2 в зависимости от строения
спирта и условий реакции. Ниже приведеllа схема отщепления воды ":
механизму Е 1 при каталитическом воздействии кислоты на третичнЬ!
спирт:
сн:!
сн:\
СН\
.
l
11+.
l [1 ~ •
l
<-н\-с-он ~CH.\-c-o ~ СН.\-С+
. I
. I i1
. I
СН\
136
СН:\
СН 2
.
11
~CH\-C
СН\
+
. I
СН:\
Н+
4.
Заме
группа спиртов
Щение гидроксильной группы. Гидроксильная
. )
замещатьсЯ галогеном при взаимодеиствии спиртов: а
с гало-
способна однымИ кислотами, б) с галогенидами фосфоря (например,
reHoBOpAOO~1 PCl s) или в) с тионилхлоридом (хлорангидридом сернистой
pCI.~,
3'
ис~оты SOCI 2)·
к а) РеяКЦИЯ спиртов с галогеноводородами обратима:
R-OH+HCI
+::!: R-Cl+Н~О.
т еТИ'lI!ые СПИрТЫ вступяют в эту реакцию значитеJlЫIO легче вторичных и
р вичныХ, вторичные -
пер
тталкивяющиМ
"
легче первичных. Это объясняется электроно-
деиствием алкильных групп
( что
о
б JlertlaeT
отщепление
Оидроксила) и большей устойчивостью образующегося катиона (благода­
~я сверхсопряжению ) при протекании реакций по механизму Е 1.
ГИДРОКСИJl -
трудноуходящая группа. Обычно его переводят действи­
ем кисоТ 13 оксониевую I'РУППИРОВКУ или действием ацилирующих реаген­
тов - в СJ\ОЖ~IЫЙ эфир (ацетат, тозилат). Например:
СН.\
С(Н\
1..
H"C-<f-
СН..
+
11'
-11.,0
I
"+11.-
СН
I "
Q - H Ее :> CI-I~f-r-H~CH.\-\+ ~CH'\-l-Bг
СН,
Н}:
Н
СН;\
СН.\
Реакцию галогеноводорода со спиртами чясто проводят так, что галоге­
новодород обрюуется непосредственно в реакционной среде, например
при НRгревании спирта с бромидом натрия и серной кислотой:
C~H;;OH+NaBг+H~SO.1 ~ C~H"Bг+NaHSO~+H20.
б) Ilри реакции спиртов с галогенидами фосфора могут получап,ся
в зависимости от условий, как галогенопроизводные, так и эфиры фосфо­
ристой кислоты:
Щ-ОН+РСI: 1 ~ ЗR-СI+Р(ОI--I):I
ЗR-ОН+РС1:I ~ Р(ОR):I+ЗНСI.
В СЛУ'lяе применения PCl s последний переходит в хлороксид фосфора,
например:
C~H;;OH+PCI;; ~ C~HiiCI+HCI+POCI:I'
в) Рсякция С тионилхлоридом идет с образованием алкилхлорида, хло­
РОВодородя и диоксидя серы:
C~H"OH
SOCI"
-НCI
~ C.,H.,OSOCl ~C2H2C1 + S02 + HCI.
--
ф Г) Спирты можно превращать в хлориды и реакцией с CCI 4 и три­
еНИJIфосфином:
R-OH+CCI 4 +P(C(;H"):1 ~ R-CI+CHCI:1+OP(C(;H,,):I'
lЗ7
5.
Окисление. Спирты окисляются кислородом воздуха в ПРИСУТСni
медных и других катализаторов при
300-500 ос такими окислителя ..
как хромовая смесь, хромовый ангидрид, твердый комплекс СгОз с пир
дином,
КМпО4,
специально
приготовленный
диоксид
марган
R0 4 +NaI0 4 , Аg2 СО з (осажденный на цеолите) и др.:
а также дегидрируются при 100-180·С над
Cu, Ag, Ni,
Со,
Pt
и
Pd ~
Во всех этих случаях первичные спирты дают альдегиды, вторичные ~1
,,;
кетоны.
Альдегиды при дальнейшем окислении дают кислоты с тем же число.
углеродны атомов. Кетоны MOryт быть окислены дальше до двух КИCJIof.
С разрывом углеродной цепи. Третичные спирты окисляются очень Tpyднoi'
с разрывом углеродной цепи и образованием смеси кислот и кетонов:
[Катl
R-CHPI-I
IIс".ИЧIIЫЙ
спнр-г
И.
С
+О.; [КаТ)
О
R-C#'
"н
a.nt./lСГ,Щ О
#'
R-C"
По скорости (легкости) окисления и
.#,О
+ [01
Н
~R-C"
ero
I\ИСJюта
ОН
продуктам можно судить
о строении спиртов.
6.
При взаимодействии спиртов с магнийгалогеналкилами водород
группы замещается на магнийгалоген и выделяется
гидроксильной
углеводород:
R-OI-I +Cl-lзМgI ----+ R-ОМgI +СI-I 4 •
ПО количеству выделившегося метана судят о процентном содержаниИ
спирта в смесях (метод Чугаева-Церевитинова-Терентьева).
ОтдеJJЫfые представители. Применение
Метиловый (древесный) спирт, метанол СНзОН, представляет со­
бой бесцветную жидкость со слабым спиртовым запахом. Т. 1{ИП. 64,7 ос.
В настоящее время основными способами получения метанола являют­
ся окисление метана на селективном медном катализаторе и синтез ИЗ оК­
сида углерода и водорода в присутствии, например, цинк-хромового ката­
лизатора (примерно 90% оксида цинка и около 10% оксида хрома) при
20-30 МПа (200-300 атм) и 400 ос или меДl10ГО катализатора npll
250 ос
138
и
7 МПа (70
атм).
еакЦИЯ представляет собой не простое восстановление оксида уг­
эта ~ в ней принимает участие вода:
лерода
--+ СО 2 +Н 2
--+ СН З ОН+Н 2 О
СО+Н 2 О
СО 2 +ЗН 2
СО+2Н 2
--+ СН з ОН-IIО.8 кДж/моль
МетаноЛ имеет широкое и разностороннее применение. Значительные
чества его потребляются в производстве формальдегида, он служит
•
коли
полупродуктом в производстве муравьинои кислоты, мет~лацетата, ме-
тил- и диметиланилина, метиламинов и многих красителеи, фарма~евти­
ческИХ !1репаратов, душистых веществ и т. д. Метанол - .хорошии рас­
творитель, поэтому он широко применяется в лакокрасочнои промышлен­
ности.
В
нефтеперерабатывающей
промышленности
его
применяют
в качестве растворителя щелочи при очистке бензинов от меркаптанов,
а также при выделении толуола путем азеотропной ректификации.
Метиловый спирт является сильным ядом: в пищеварительном тракте
он образует формальдегид и муравьиную кислоту.
Этиловый (винный) спирт I
этанол С 2 Н 5 ОН (рис.
42) -
бесцвет­
ная жидкость с характерным спиртовым запахом; т. кип. 78,3 ос. Смеши­
вается с водой в любых соотношениях и образует с ней азеотропную (не­
раздельно кипящую) смесь состава
лучения
совершенно
пользуются
чистого
95,57 %спирта и 4,43 %воды. Для по­
безводного,
преимущественно
двумя
или
абсолютного,
спирта
методами.
К водному спирту прибавляют немного бензола и
полученную смесь подвергают фракционирован­
ной разгонке. При этом сначала гонится смесь
воды, спирта и бензола, затем спирта с бензолом
н, наконец, чистый спирт. По другому методу на­
гревают 96%-ный спирт с оксидом кальция или
прокаленным сульфатом меди (II) или применяют
молекулярные сита. При этом основная масса
Воды удаляется, но
0,2-0,3%
Рис. 42. Модель молекуЛЫ этилового спирта
ее прочно удержи-
ваются в спирте и от них можно избавиться отгонкой спирта с добавлени­
ем металлического кальция или магния, связывающих воду в соответству­
ющие ГИдроксиды.
В теХнике этанол по объему производства занимает первое место среди
ДРУГИХ Органических продуктов.
r Этиловый спирт получают брожением сахаристых веществ, чаще всего
/ЮI<ОЗЫ (виноградного сахара), под влиянием энзимов (см. гл. 32.2)
ДРО>юкей по общей схеме:
r
ГJ\юкоза
В JIЮКОза или содержится в готовом виде в исходных продуктах, например
СОКе винограда, при брожении которого получается виноградное вино
139
с содержанием от 8 до 12% спирта, или ее получают из так называ~е"
полисахаридов полисахаридов
крахмала иЛи клетчатки (целлюлозы). Общая фор
.
(C 6H100S)II' При полном гидролизе они образуют ГJIЮк .
В качестве крахмалсодержащих веществ преимущественно ИСПОЛЬЗУlOт
хлебные злаки (пшеница, рожь, ячмень), рис, кукуруза, и особенно карто
фель, т. е. пищевые продукты.
j
~,:
Задача возможно более полной замены пищевых продуктов при ПРО\fЗ"
водстве веществ, используемых для технических цеJlеЙ. в частности cnl(p~:
та,
непищевым
сырьем
в
производстве
этанола
в двух направлениях. Первое направление -
успешно
разрешаетat
это замена крахмала клe1i
'laТКОЙ (целлюлозой), содержащейся в громадных количествах в ОТХО.;
лесной, цеJIЛЮЛОЗНОЙ и деревообрабатывающей промышленности (сучыt'
ветки, опилки, стружки, сульфитные щелоки и др.). Эта отрасль промы~
ленности под названием гидролизной ПОЛУЧИЛ<l в нашей стране широк~
развитие. Второе наПР<lвление циеЙ(см.гл.l.2).
синтез спирта из этилена его гидратat
r.
В некоторых странах этиловый спирт ПОЛУЧ<lЮТ из <lцетилена, KOTOPЫ~
реакцией Кучерова переводят в уксусный альдегид, <1 последний гидриру~
ют в присутствии
металлического каТ<lJlИзаТОР<l (меди или палладия)
в этиловый спирт:
С 2 Н 2 ---.!'H~?
~ сн,р-ю ~~ сн,\сн
2 он.
1111(- l '
,
YKcyc"",;i
ttJlj,)Lсп~Jt
Этиловый спирт в больших количествах потребляется в производств~
дивинила (перераб<lтывается в синтетические каучуки), этилового эфира,
хлороформа, XJюраля ССI;зСНО (используется для получения инсектици~
да .lЩТ, см. с. 441), этилена высокой чистоты, этил ацетата СНЗСООС21f~
и других сложных эфиров, употребляемых в Ka'lecTBe растворителей лакОВ
и душистых веществ (фруктовые эссенции). В
Ka'leCTBe растворителя ши­
роко при меняется и сам этиловый спирт, особенно в производстве фарма­
цеВТI1ческих, душистых, красящих и других веществ. ЭТИJlОВЫЙ спирт
-
хорошее антисептическое средство.
ПРОl/uловый сnирт СН:/-СН:/-СН 1 ОН получают оксосинтезоМ из
этилена, окислением пропана, а UЗОГlроnuЛоВЫЙ CH:J-CHOH -снз
-
гидратацией пропилена. Эти спирты, а также их сложные эфиры приме­
няютсн как растворитеJlИ. В ряде случаев они заменяют этиловый спирт.
Изопроr1иловый спирт окислением (над серебряным катализатоРОМ
при 450-500 ОС) или дегидрированием переводят в ацетон.
Бутuловый cnuprn СН;з-СН:/-СН 2 -СН 2 ОН в ПРОМЫШJlенноСТИ
получают гидрированием маслЯlЮГО альдегида (продукт оксосинтеэВ.
см. rJI. 5.1), Оl<сосинтезом из пропилена в присутствии пентакарбоНИJl8
жеJlеза и аминов:
140
брожением глюкозы под влиянием особых биктерий (Bacterium
TII~~~!ylicuт). При этом одновременно обризуется ицетон. Глюкозу по­
асе! т гиДРОJlИЗОМ крихмала и клетчатки ( см. гл. 33.1).
JlУЧБIlJO ловЫ Й СПИРТ и его сложные эфиры применяют в больших КОJlиче~И
•
11
Кllчестве РlIстворителеи лаков и смол.
СТВII~;бутuловый спирт (СН;З)2СНСН20Н
-
маслянистая жидкость,
е ~меШИВIIЮЩIIЯСЯ с водой. Побочный продукт в синтезе метинола из ок­
ИИ а УГJlеРОДII. Его прим.еняют для получения изобутилена, изомисляного
с JLдегида и ИЗОМRСЛЯIЮИ кислоты, а ТlIкже в качестве ристворителя.
IIЛЬrреm_Буmиловый спирт (СН;з):~СОН - легкоплавкое твердое веще-
тво (т. пл. 25,5 ОС) С запахом плесени. Впервые был синтеЗИРОВЮI
~ М. Бутлеровым при действии цинкдимеТИJlа ZI1( CH:~)2 на ХЛОРИСТЫЙ
а~еТИJl СНз-СОCl. В промышленности его ПОЛУ'IIIЮТ ГИДРlIтацией изо­
БУТИJlена
и
применяют
для
введения
в
оргинические
соединения
трет-БУТИJlЫЮЙ группы.
АJIlIЛ(}(/Ы(! CIIll[lll1bl CiiH 11 ОН. Известно восемь IIзомерных IIМI1ЛОВЫХ CnllpTOB. В про­
мышленных масштабах аМlIловые cnllpTbI получают 113 neHTaflOB НШI 113 ЯМllленов. В первом
случае пеlпан ХЛОIН1РУIOТ:
а образовавUlУЮСЯ CMec~ монохлорпентанов подвергают гидролнзу:
Для получеНllЯ аМllЛОВЫХ СПI1РТОВ из аМl1ленов послеДНllе подвергают сеРIЮЮIСЛОТllOii
ГlIдiJатаЦI1И. Пр" 7Том оБРIlЗУЮТСЯ ТОJl~КО вторичные и треТlIчные спирты.
ПервuчГ/Ь/е /.lэоамuловые спирты
(CH)~CH-CH2-CHPH
11
CH,,-СН2-<rН-СН20Н
СН.
СQСТRВЮ11ОТ ГJ1RВllУЮ чист!> сивушного масла',
откуди
их получюот
перегонкой.
АМИJlовые спирты и их эфиры - хорошие растворители. Изоамилаце­
тат UЗ()-С5НIIОСОСН:~ (грушевия эссенция) применяется при изготовле­
нии ГIРОХJlадитеЛЫIЫХ н·апитков и некоторых кондитерских изделий.
с ВЫсщuе спuрты встречаются в природе, но получюотся и синтетиче-
ким путем. Они в ПОСJlеднее время приобрели большое значение в I1рОИЗ­
B~ДCTBe МОющих средств (
алкилсульфатов, искусственного воска
JlОЖllые эфиры высших спиртов и высших жирных кислот) и других
ПРОДУКТОВ.
с. ,~_ П~lIроде встре'lаются. IIIIПРllмер. СПlIРТUI: l{(!mUЛIIIIЫЙ CI;;H:IICH~OH. Ц(![lUЛ(}/JIJ/Й
M~:;III;I,IC~lOH. ,'Il/f>lIЦ/IЛIIIIЫЙ С:ЮНliIСН~ОН. Первыii
1·13 fllfX
в BIIДt! сложного Эфl1ра пал~­
ДО(jыn~ВQII ЮIСЛОТЫ CliiH:IICH2-0СО-СliiН:1I составляет главную част~
YiКe
Cfll![I)/Ul(l!lIlll.
СМОго II:J черепных полостей ЮIТ<'I. ЦеРllловыii СПllрТ тоже в BltДe сложного Эфltра. flO
церОТlIlIовоii I<ИСЛОТЫ C2;;HiilCH2-0-СО-С2;;Нiil содеРЖI1ТСЯ в I\ltT<'IiicKOM воске
---
'с
СПIIРтаllВУШIIЫС масла образуются в I<a'leCTBe поБО'IНЫХ продуктов при получеНlI1I ·1ТltЛОВОГО
IIЗ I(lIртофеля IIЛИ ЗЛiIКОВ.
141
(выделеНltЯ насекомых). МИРIЩНЛОВЫl1 спнрт в виде эфира пяльмитиновой и церотнu- ~
кltСЛОТ входит В состяв пчелиного воска.
......
ВНЯЧ8ле высшие спирты ПОЛУ'18Лlt ВОССТ8новлением прltродных высших ЖllРНЫх kИ"'~
(в виде эфиров). Позднее эти КlIСЛОТЫ СТ8ЛИ ПРОIIЗВОДИТЬ синтетическим путем (см. гл. 6~
Другой способ получения высших спиртов
-
ГИДРl1РОВ8Нllе высшltх яльдеГIIДОВ, ПОЛУЧае_
оксосltнтезом. Кроме того, в промышленностlt начинают при менять HOBbIii метод СИ
•
"
ВЫСШltхспнртов, оснооянный на l(ятаЛIIТllческом ОI(ИCJ1еНlIIt пяряфинов юtCJ10РОДОМ BO~
2.
.
НЕПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ
~.
Нснасыщенные (непредельные) спирты могут быть этиленового, аце.:
тиленового и других рядов. Простейшие ненасыщенные спирты с гид~
ксилом при атоме углерода с двойной связью
- очень нестойкие coeДHH~~
ния (nравuло Эльmекова); их период полураспада от нескольких минут
нескольких часов. При этом они постепенно изомеризуются в альдегид18
.r$
или кетоны:
l ~
"c-c
~
/-
6н
dh-С-
6
1
Однако известны и стабильные енолы (см. гл. 5.4).
От ПРОПИJlена, например, можно было бы произвести спирты
СН;\-СН=СН 2
'
НОСН2-СН=СН'
2
СН-С "СН ~ сн-с-сн.
Т
:1
I
"d
Н
1, II и III:
-
2
11
.1
.1
11
юtg(1II
СН.-СН 'СН ~ СН-Сн'-СН
с1>Н
,1
111
.1
2
IllЮllНОIЮIIIАli
11
О
ИJIt.lIСI·IUI
Однако спирты
II
и
III -
стен только первый спирт -
нестойкие вещества. В свободном виде изве­
аллиловый, или 2-пропен-l-ол.
По системаТИ'IССКОЙ номенклатуре ненасыщенные спирты называЮТ
как производные соответствующего непредельного углеводорода с добав­
кой суффикса -ол, причем место присоединения гидроксила показываете"
цифрой.
.
Ниже приведены названия важнейших непредельных спиртов (тривиа­
льные, рациональные и по систематической номенклатуре):
.
J-IOСН:z-СН=СН:z
ялJ1ttловыil спирт, ВИНltлкарбинOJ1, пропенOJ1
CH:1-СНОН-СН=СН:z
ВIIIНIлмеТI1ЛкярБИНОЛ,3-Бутен-2-0Л
HOCH:z-С-СН
пропаРГltловый спирт, ацеТI·lленилкарбинOJ1,
2-ПРОПltн-I-ол ПрОПltнол
(СН:1 )2СОН - С..СН
дltмеТИЛlll1етилеНI1Лкярбинол, 2- метил-3-БУТltн-2- ОЛ
(CH: 1 ):zCOH-СesС-СН=СН 2 дltмеТI'IЛВИНИЛllцетилеНl1Лкар6ItнOJ1,
2-меТltл-5-гексен-3-ин-2-0Л
* в данном случае можно не ставить цифры, так кяк другого изомеря пропенола неТ.
142
ельные представители. Рассмотрим технические методы получе­
ОТД ажнейше е применение некоторых ненасыщенных спиртов.
НИЯ И Вuловый спирт - это енольная форма уксусного альдегида (см.
Bи~). В момент образования он в обыч~ых условиях быстро превраща­
гЛ. 5. ,тойчивый тауmомер - уксусныи альдегид. Однако в определен­
етсЯ Вс~~виях (Н<lПримср, пиролизом гликоля) el'o все же можно получить
ных У ить В течение нескольких минут или часов (в растворах).
их~н
n
вые
остые и сложные э
Ф
иры винилового спирта
-
•
достаточно устоичи-
~оединения. Применяются в ПРОМЫШJlенности (см. гл. 4.1 ). Полимер
б
•
винилового спирта, получаемыи гидролизом винилацетата, -
u
елыи рас-
оримый в воде 110рОШОК. На его основе получают синтетическое волок­
:~ вuнОЛ и лекарственные препараты (с. Н. Ушаков).
АллаЛО6ЫЙ спuрт -
бесцветная жидкость, т. кип. 97,5 ·С, с острым
неприятныМ заllахом; смешивается с водой в любых соотношениях; явля­
ется промежуточным продуктом при синтезе глицерина (гл.
:3.4).
Обладает свойствами как спиртов, так и непредельных углеводородов.
Получают аJlЛИЛОВЫЙ спирт гидролизом хлористого аллиля
- ПРОдуКТЯ
5%-ным ряствором
высокотемпературного хлорирования пропилена щелочи.
Пропарг/lловый спирт
НС
== С-СI-I 2 ОН
неприятного ЗЮlахя, кипящая при
114,7 ·С;
-
бесцветная жидкость
является промеЖУТО'IНЫМ
продуктом при получении аЛЛИJIOВОI'О спирта и глицерина, а также в про­
изводстве днвиниля. ПОЛУ'lают пропаргиловый спирт конденсацией аце­
тиленя с формаJllJдегидом (с.
109).
Пропаргиловый спирт проявляет химические свойства однозамещен­
ного яцеПfJIСНЯ и первичного спирта; при обработке его аммиачным рас­
твором оксида серебра или
CU2C12 образуются соответствующие серебря­
ные ИJIIf ме;щые ВЗРЫВ'lятые ацеТИJlеl·fИДЫ. При взаимодействии с гаJlоге­
НИДRМН фосфоря,
например с трехбромистым фосфором,
спиртовая
I'руппя зямеЩRСТСЯ ГRлогеном:
н<:=с-снрн
AgC=C-СНРН
+ HP
ClIC=C-СНРН
+ H~O
нс=с-сн 2 вг
+
Р(ОН):I
GpOMHCl'lolii ЩЮIIНРПIJI
Дlt"I{'1I111.'/(f/{{'lI/llлеНlIлкар6ltНОЛ IIЛИ 2,меТllл-З·БУТllн-2-0Л
нс=с-с(он )-СН\
IIДIIУГllе'
нов
I
.
СНа
•
ГР~ТlI'шые iщеТliлеliовые СПltрты ПОЛУ'lilЮТ 113 ilцеТllлеНiI 11 соответствующих кето·
TOHI<O IIзмеЛl>'lенного совершенно сухого кон в ИUСОJIIОТНОМ '~фllре
nПОРСЮtii) IIЛII Прll деЙСТВIIIII<ilРUОНIIЛl>lIl>IХ соеДILНеНlll1НiI ilцеТllлеlll1Д lIilТрllЯ в ЖIЩ-
(Л. ЕВ ~~)IICYTCTIIIIII
Ком -.
RMMII~Ke (Г. МеРЛI-IНГ).
ЭТuт·
~nllpT может служить "сходным веществом в СILНтезе ItзопреНiI.
143
АнаЛОГII'lНЫМ путем из ВllНllЛ1щеТllлена и "етонов И. Н. Назаров получил МИОГИе виj
ацеТllленовые СnllРТЫ. Hanpl'IMep cJll'\II!IIIL1ЛI1ltНllлацеmIIЛI!Н!tлкuрбuнол:
СН 1
.
I .
СН.,..:....СН-С=СН
<
+
.
СН.\'
I .
.,
O=C-CHI~ СН,=СН-С=С-С-СН
.
1 · 1 .•
-
ОН
'\
ПОЛllмеРllзаЦllей димеТИЛВИНllлацеТllлеНllлкарбllнола получают универсальный КII\IБIIL
НОЛЫlыii I<лей, весьма прочно СI<леивающий металл с металлом. деревом
11 стеКлом,дереВОео
1·1 np0'/IIMII материалами.
MHorlle ВЫСШllе непредельные cnllpTbI с одной 11 двумя ДВОI'НЫМИ СВЯЗЯМII являютея фе,~'
ршюна,\1II насекомых.
"',
стеl<ЛОМ
ФеромонаМII называют вещества, вырабатываемые 11 выделяемые ЖIIВЫМИ организмаr.iJj
в Оl\ружающую среду и вызывающие ответную ре3lЩИЮ у воспринимаЮЩllХ их особей ТО",
же Вlща. Наllболее IIЗУ'lены феромоны насекомых.
Феромоны могут быть половыми (привлекающими партнеров). следовыми. тревог\
11 т. п. Для НIIХ характерны эффеКТlIвностьдеiicтвия при очень большом разбавлении и высо;
кая спеЦllфll'IНОСТЬ. МIIНllмальные воспринимаемые концентраЦlШ порядка lo-12~
1O-I~ мкг/мл. Для ответной реalЩlIl1 достато'/но попадания в рецептор одной или несколь.
KIIX молекул феромона.
ФеРОМОllЫ вырабатываются раЗЛII'/НЫМII клеткаМII ИЛII спеЦllальными железами. Вое.
ПРllЯТllе IIХ другоii особью осуществляется с помощью весьма '1УВСТВIПСЛЬНЫХ рецепторов 7'
«антенн».
Феромоны HaCel\OMbIX O'ICHb СIIЛЬНО ОТЛllчаются друг от друга по CBoeii ХIIМII'/еской приро·
де. Это могут быть углеводороды, спирты, 3фl·IРЫ. l\арБОНllльные 11 гетероцикличеСI<ие соеди'
IlеНlIЯ. Ниже для пр"мера приведены формулы аТТРlllпанта бабО'lКlI COBКlI CH:1(CH 2 ):\CH -.
/0,
= CH(CH2)XOCOCH:I' непарного шеЛIШПРЯда (CH")2Cl-l(СН2)"СН-СН(СН2)!lСН:1, хлоп·
6
що-"
СН
. :::
КОВОГОДОЛГОflOСlIка
СН:\ . техасского муравьеда
СН:Р2 с'\..#.1,,/'\..#)'\../'\...
I
\
ОСОСН:\
. ба60'IКII
.
«Mollapx»
<:02СН:\ .
ДеЙСТВllе феромонов может быть зна'IIIТельно УСllлено IIHepTHblMl1 ПРllмеСЯМl1 самой раз'
Лllчноii прl1роды (наблюдается СlIнергизм).
3.
ДВУХАТОМНЫЕ СПИРТЫ (ГЛИКОЛИ)
Спирты, содержащие несколько гидроксильных групп, называют МНО'
гоатомнымИо (двухатомными, трехатомными, четырехатомными и т. д.).
Двухатомные спирты называют гликолями.
Общая формула предельных гликолей С"Н 2 ,,(ОН)2. Два гидроксИJ\8
у одного атома УГJIерода обычно не удерживаются. Вещества с такиМ сТРО'
ением в момент образования теряют воду и образуют альдегид ИJ\И кетОН
(правило ЭрленмеЙера). Однако эфиры подобных гликолей - ВПОJ\не
устойчивые соединения (ацетали, см. гл. 5.1). Обычные гликоли содер)l(llТ
ГИДРОКСИJlьные группы у различных атомов углерода.
144
Изомерия. Номенклатура
тве примеря изомерии двухатомных спиртов приведем изомер-
В качес
, Н (OI J )
икоЛ И состаВ(1 С 4 8
1 ;2:
гЛ !-I_C!-IOII-CH~-CH;I
~~~g!-l_СН2-СНОН-СН;1
(11)
CH~OH-TOH-CH;I
C!-lp!-l_CI-I~-CH~-CH~OH
(1Il)
CH 2 0H-СН(СНа)-СН 2 ОН
Hbl:
CH;I-CHOH-CHOH-CH;I
(1)
(lV)
(V)
СН;I
(VI)
В зависимости от положения гидроксильных групп раЗJ\ичают а-глико­
ли (группы ОН у рядом стоящих углеродных атомов ЛИ (группы ОН в 1,3-положении -
1,4-положении -
Н,
VI),
1, IV,
У), ~-глико­
у-гликоли (группы ОН в
III), б-ГJ\ИКОЛИ и Т. д.
По характеру углеродных атомов, несущих гидроксильные группы, ряз­
личают гликоли первично-вторичные (1, Щ, двуперви'шые
вторичные ОУ), первично-третичные (У) и т. д.
(III, VI), дву­
Названия гликолей производят от названия этиленовых углеводородов
(а-гликоли) или от НilЗвяния предельных Уl-леводородов (систематическая
номенклятуря ). В первом случае название этиленового углеВОДОРОД<l сопро­
ВОЖД<lется словом гликоль; например, этилеНГЛИКОJlЬ сн 2 - СН 2 ' пропилен-
I
он
I
он
гликоль СI-I.,- СI-I.,-СН,\ . По систеМ<lтической номенклатуре к наЗВ<lНИЮ
I -
I -
ОН
01-1
,
предельного углеводорода добавляют суффикс -диол и укаЗЫВ<lЮТ положе­
ние ГИДРОКСИЛЫIЫХ групп. Например, этандиол СН 2 ОН-СН 2 ОН, 1,2-IlРОllан­
СI-I 2 ОН-СНОН-СН;(,
1,3-бутандиол
CH20H-CH 2 -CHOJ-[-CI-I;I,
диол
2-метил-l,2-ПРОllаНДИОJl CH 20H-COH-CH;I' 2,3-диметил-2,3-бутандиол
СН,гСОН-СОН-СН
'1
СН;\
r
I
а'
СН;I
СI-I;\
Способы получения
Гликоли Можно 1l0ЛУLIИТЬ теми же способами, что и одноатомные спир­
ты, или Другими. Здесь приведены В<lжнейшие способы.
1. Гидролиз дигалогенопроизводных предельных углеводородов или
ХЛОргидринов:
CI-I;I-CI-I 2 -Cl-ICI-CH 2 CI+2H 20 ~ CH;I-CH 2 -CHOH-CH 20H+2HCI
ClI;I-СН 2 -СНОН-СН 2 СI+2Н 2 О ~ CH:1-CH 2 -CHOH-CH 2 0I--I+HCI
2. ГИДР<lтация а-оксидов:
JlI+1
'
О
C~2/CH2+HOH~ СН 2 н-снрн
3
О
ЛI1 (. Окисление олефинов пероксидом водорода или пермаНГЮlатом кая СМ. fJI. 1.2)_
145
4. Полиметиленгликоли общей формулы НОСН2(СН2)ХСН20Н"
но получать каталитическим (или с помощью LiAIН 4 ) восстаНОВлен
эфиров дикарбоновых кислот. Например, диэтиловый эфир адиnиНов
кислоты при восстановлении переходит в 1,6-гександиол:
.'.
•
О
11
CН 2 - СН 2-С-ОС2 Н 5 __+_41-<1,~CH2- СН 2- СН 2ОН
1
)о 1
+ 2C2HsOH
СН 2 - СН 2-С-ОС 2 Н..
СН 2 - СН 2- СН 2 ОН
11
~
О
диэ11tЛовыА эфир адиПНIЮВОЙ КИCJIOТl.l
·с,
tA
Физические и химические свойства
Низшие члены ряда гликолей
-
густые жидкости, высшие
-
••
крие.
таллические вещества. Температура кипения гликолей значительно вы.
температуры кипения спиртов, что является следствием усиления ассоЦ1Р­
ации молекул (образование водородных связей) из-за наличия в ГЛИКОJlIII
двух гидроксильных групп. Гликоли хорошо растворимы в воде (nyчще.,\
чем одноатомные спирты), имеют сладкий вкус; плотность простейUIIII
гликолей больше единицы.
j
Химические свойства гликолей аналогичны свойствам одноаТОМНbII
спиртов. Однако у гликолей могут вступать в реакции как одна, так и обе
гидроксильные группы.
1. С щелочными металлами гликоли образуют полный и неполныА
глtlколяты: CH 2 0Na-СН 2 ОNа, CH 2 0H-СН 2 ОNа.
Гликоляты образутся не только со щелочными металлами, но и с оксидами.
некоторых других металлов, например с гидроксидом меди. При дейстВИR
щелочи на сульфат меди
(1I) образуется голубой
осадок гидроксида меди (11).
Этот осадок не растворяется в спирте, но очень легко на холоде растворяется
в гликоле вследствие образования комплексного гликолята меди:
Н
1
...··О-СН 2
2 1
+ Cu(OH)2 ~ 1
,.. Cu
1 + 2Н 2О
снрн
СН 2-О"
"О-СН 2
1
снрн
СН 2-О"
Н
2. С минеральными и органическими кислотами получаются полные 11
неполные эфиры. Например, в приведенной реакции образуются непол­
ный и полный эфиры этиленгликоля и азотной кислоты
•
C~ON~
ЮNО
2
СН
1 ОН С+l Н О +
2
снрн
+2IЮNО
-
нитраты:
1
снрн
2Н 2 О + yHPN0 2
CHPN0 2
Соответственно можно получить полные и неполные простые эФсИР~'
например диэтиловый эфир этиленгликоля С2Н50СН2-СН20 2 S
146
ИЛОВЫЙ эфир CH 2 0H-СН 2 ОС 2 Н s · Последний под названием
и МОНОЭТДОЗ0дьв применяется как растворитель в производстве нитрола­
эtntLllцед много пороха (пироксилина), ацетатного шелка и других произ­
кОВ,
безДЫ
еллЮЛОЗЫ (гл. 33.3).
ВОДНЫоХ Цисление гликолей проходит сложно, ступенчато:
К
3.
снрн
I
снрн
~О
~ С"
I
Н
{
снрн
ГJlикме.",Й
О
CHPH-COOH~HOOC- С(
Н
КИСЛОТ. ~ глиоксило
•••
кислота
гликолева.
~
Н
аЛbl\СГI\II
~O
/С-С"
Н
ГЛИОКС8ЛЬ
t
СООН
I
СООН
waвелеВ8Н
кислота
При этом, как и в случае одноатомных спиртов, по продуктам окисле­
ния можно судить о строении гликоля.
Если при окислении гликоля состава С 4 Н в (ОН)2 (возможно 6 изоме­
ров) в продуктах окисления обнаруживают только уксусную кислоту, то
гликоль мог иметь только формулу 2,3-бутандиола:
СНзСНОНСНОНСН з ~ 2СН зСООН.
Специфическим методом окисления а·гликолеЙ до карбонильных соединений является
Окисление с помощью иодной кислоты. Промежуточным продуктом в этой реакции являются
ЦIIКJI\lческие кислые эфиры ортоuодной кuслоты, распадающиеся с разрывом углерод·уг·
леродной связи:
СН 2ОН
~HOH + НI0 4
tн з
С!.У O~1/0H
....,.
tH1Q/g'o ....,.
tн з
эфИР ортоиодноА КИСЛОТЫ
Реакция идет с почти количественным выходом. Гликоли другого строения и спирты в эту
реаКЦltю не вступают.
4. Отщепление воды от гликолей может иметь внутримолекулярный
~ межмолекулярный характер. Направление отщепления воды зависит
(Т УСЛОвий реакции. Примеры внутримолекулярного выделения воды
МЯ
<1-,
~. И у-гликолей):
СНРН-СН 2ОН.:!:!4 [снгснон] ~ СН З- СНО
147
Своеобразную изомеризацию претерпевают a-двутреТичные глик
называемые nинаконами, в присутствии серной кислоты. Де гидрат
их приводит к кетонам:
Нз~/С~~..
' ...... с-юН
.'1
-1-10
i l i.... ~
i /~OH:!.
,·J.... 1
l~~~j
сн
з
meTIU1-трет­
тетрамстил­
этилеlll"JIИКОЛЬ
бутилкеТОII
(ПИllаКОII)
(IIИIl3КОЛИII )
Подобные кетоны имеют общее название nuнаколuны и поэтому перJ
группировка называется nuнаколuновоЙ. Механизм ее можно предста;
вить следующим образом:
СН З СlН з
I
I
СН-С-С-СН
з
I
1-1+.
з
~
-Н+
ОН ОН
сн.1
CH-~-'
С-СН з + Н+
3
L 11
СН: 1 б
При дегидратации пинаконов в присутствии оксида алюминия образу­
ются преимущественно непредельные алкадиеновые углеводороды, на­
пример:
СНзСН з
СНзСН з
I I
сн-с-с-сн
3
I I
з
ОН ОН
,
-11.0 ...
I
СН 2=С-С=СН 2
2.3-ДИМL'Тил-I.3-lIyтaдиен
Межмолекулярное выделение воды приводит к образованию оксиэфИ­
ров (спиртоэфиров ) или циклических простых эфиров (см_ гл.
4_2):
С,н.Йtс_-qg-С,Н 2
СНрН
---+ НР+ lH2-О-С,Н 2
---+ o/CH 2-СН2)о
снрн
снрн
снрн
'-СН2-СН2
дизтилеllГnИК()ЛЬ
дноксии
(~. Р'-диокси:,тиn"в",й .фир)
Отдельные представители. Применение
Из представителей гликолей заслуживают внимания этиленглика:::
диэтиленгликоль, полиэтиленгликоли (полиметиленгликоли ), 1,4-61"
~M.
Эmuленглuколь -
т. кип. 198 ос. Сильно понижает температуру замерзания воды. так,
148
~
вязкая бесцветная жидкость, сладкая на s lIа:
прtlмер,
600/0- ный ВОДНЫЙ раствор гликоля замерзает при
-49
Ос. Его
применяют для приготовления антифриза. Этиленгликоль весь­
с успеХО:СКОПИllен, поэтому его применяют при изготовлении печатных
ма ГИГ~текстильных, типографских и штемпельных) и т. д. Азотнокислый
красоК ленглИКОЛЯ - динитроэтиленгликоль - сильное взрывчатое ве­
эфир 3ТИзаменяющее нитроглицерин.
Ul.е~ТВ~Ромышленном масштабе этиленгликоль получают из этилена
по ел
еДУЮЩИМ
трем схемам:
,--О..:.,-,-<В_()3J\_",-,;!_Ка_т"_'-:'-Сн -сн ~CH.pH-CH он
....: ......
О
2
2
окись этилена
I--_ _C-=..I,-~CHP-CHP 2НОН эо сн.рн-сн.рн
но CI(CI,+II,O) HOCH 2 -Снр-1.!Q.!l;..Сн.рн-сн.рн
ГИIЮXJюрирооанне
ЗТИЛСJlХЛОРГJoU1РИJI
с двухосновными кислотами этиленгликоль вступает в реакцию поли­
t
конденсации, образуя высокомолекулярные полиэфиры:
fl
,
н 2 с-он
I
нос-он
-
+ 1:
J-Ю-<,:=О
I
R
I
j
о1
оI
~ -OCH2-CH2-0-~-R~+2nН 2О
НО-С=О
n
Полиэфиры эп;ленгликоля широко применяются в различных отраслях
промышленности: как пленкообразующие вещества для лаков и красок,
в производстве пластмасс и особенно синтетических волокон (напри­
мер, лавсана) (см. гл.
24.8).
Этиленгликоль используется также в произ­
Водстве полиуретановых смол, применяемых д.ля изготовления клеев, ла­
ков, синтетического волокна, синтетического каучука и т. д.
При межмолекулярной дегидратации этиленгликоля могут быть полу­
чены в зависимости от условий диэтиленгликоль или диоксан:
/сн 2-сн 2,-
2I-IQCH2- снрн -11",0>- НОСН2-СН2-О-СН2- CHPH:!!E.~o,-
/0
СН 2-СН 2
Дuэmuленгликоль - жидкость, т. кип. 245,5 ОС; применяется как
~:~:воритель и для заполнения тормозных гидраВЛИ'lеских приспособле­
llJ и, в текстильной промышленности его используют при отделке и краении тканей.
с диоксан - жидкость, кипящая при 1О 1 ОС, растворим в воде в любых
IQООТlJошениях. Образует азеотропную смесь с водой. Обычно его получаР "Г ВЗ<lНМодействием гликоля с дихлорэтаном. Применяется в качестве
J\yаство рителя для эфиров целлюлозы, масел, жиров. Может служить позу ПРОДУктом в некоторых синтезах. Диоксан ядовит. При хранении обра­
"Г,,~"Г ВЗРЫВООП<lсные пероксиды. Эти два обстоятельства необходимо учи8а"Гь при Р<lбот(' с диоксаном.
149
1,4-Буmандuол
жидкость с т. пл.
-
19
ОС, т. кип.
229
ОС, Его
n
,1
мышленное получение основано на конденсации ацетилена с Формал~
гидом в присутствии медного катаJlизатора (В. Реппе):
,
С:!Н:!
и
[CllC~],
-~
1
+2Н;! (Pel)
о{
'"
+ 2СН:!0 --~HOCH:!C .. ССН:!ОН ---~
Бутандиол при перегонке над фосфорной кислотой (в смеси с
образует тетрагидрофуран:
C4H9 NH 2 )
CH~-CHp:H: ПII'O
CH~-CH2"
сн 2-снрн
СН 2-СН 2
l
" ' : ~7(1'~:!~(1c --1
Теmрагuдрофуран
-
жидкость с т. кип.
NaH 2POl
/о+нр
65 ОС,
Применяется в качест­
ве растворителя природных и синтетических смол, эфиров целлюлозы И
ацетилена, для получения l,3-бутадиена:
,>0
сн 2-сн,1'-.
1,
CH~-CH~
~ СН,-сн-сн=сн 2 +нр
Катализатором дегидратации служит тот же смешанный катализатор
Н з РО 4 , NaH 2P0 4 и C4 H 9NH 2 .
4.
ТРЕХАТОМНЫЕ СПИРТЫ. ГЛИЦЕРИН
Первым представителем трехатомных спиртов
(1,2,3-пропантриол) СН 2 ОН -СНОН -СН 2 ОН.
является
глицерин
Способы получения. Глицерин ПОЛУ'lают из жиров или синтезоМ
из пропилена или ацетилена.
1. Гидролиз жиров на примере трипальмитата глицерина можно изоб­
разить схемой:
О
11
C1'HP-?С1'-СIг.Н:11
I .
+311011
I Кат. I
,',
СНО-С-С I 'Н' 11
~
СНР-С-С I :;Н:11
+:IN.OII
При щелочном гидролизе получают натриевые соли высших жИРfI:
кислот (в данном случае пальмитиновой кислоты) - мыла; отсю~ 31'ь/_
процесс и вообще гидролиз СЛОЖIIЫХ эфиров при действии щелочек
вается омылением.
150
",33
-
синтез
2.
ГJНщерина из ПРОПИJlена осущеСТВJlяется по схеме
СН c:,:j:,II<,IIII<:>CH)=CH-СН~(] I;'I'I""'":I~ СН.)
CH~:::::CH- -' ';
.,z'IЩIIКI'I,lit i1Л':НIJI
-11\.,
ch-сн.,ОН ~
- tt;r,;tIIJIOIII.li'l
\.:ннрг
СН.,ОН -CHCI-CHPH
Г '~":">JIOIII~I;'1""II" "JI""~III'""
~СНiJ-СНОН- снрн
Iir;tIOJIШ
.lll ,<:1
ПО другому
методу
аJlJlИJlОВЫЙ
спирт
СНрН -СНОН-СНРН
обрабiпывают
пероксидом
водорода:
СН.}
-
,
_
70
"С
"
= CHCH~OH + HOOf-I-~СНРНСНОНСНрн.
I Кит. I
Перокснд водорода присоединяется сравнитеJlЬНО
JlerKO
в присутствии
Кi!таJlизаторогз, например ВОJlьфрамовой кислоты.
д.1Я CIIHTC]~ ГЛlIU~РliI1~ IIСПОЛ(,3УЮТ Т~I(же l(ондеНС~L1ИЮ ~LIeTIIJleH~ с форм~m,депIДОМ
3.
в пропаРПlловыii СI1I1РТ: 11OCJ1C,'JJllli\ ГIIДРllрОВ~Нl1ем H~Д паЛJ1адием переВОД51i в aJ1J\IIJ1oilbIi'l
СПlIРТ.
I\OTopbJii
ОДНI1М 113 ОПllСiJНIIЫХ методов ГlреврiНЦ~ЮТ в ГJllщернн:
С 2 !1 2 + с 1-1 2 =O~HC",CCH~OH-+~CH2 =CHCH 20I'I_H10 "
111101 Inрt·II.IIOIн.IЙ
)
t1ЛJIIIJ10ВI,lli l'IIII[lT
L:llltpT
РЮ[JаботаНl!ые 11 внедренные в производство синтетические методы
ПОJIУ'IСННЯ гmщсрина успешно разреШИJlИ важную народо-хозяйствеllНУЮ
задачу
СUI<раТНJIСЯ расход пищевых жиров на технические цеJlИ.
-
Физи"еские свойства. ГJlицерин -
нейтральная, вязкая, бесцветная
ЖИДКОСТЬ. сладкая на вкус. Трудно кристаллизуется. Т. ПJl. 17 'С, ПЛОТ­
ность 1,26. O'l~HI, Гllгроскопичен. Смешивается с водой в любых соотно­
шениях. ПРII атмосфсрном давлении кипит при 290 ос с 'I<IСТИ'lНЫМ рюло­
жеIlНСМ, ПО'7тому для его очистки перегонку производят под 13<1КУУМОМ .
. Химические свойства глицерина обусловлены в первую очерещ> при­
СУТ~ТВflем трех гидроксильных групп.
1
. IЗOf(ОРОДIIЫ~ атомы ГИДРОКСШIЫIЫХ групп в глицерине ЗRмеШ,аются
~; М,ета.n.п при действии не только щелочных металлов, но и гидроксидов
"'~Л('
ЗЬ
За, меЩI, каJll,ЦИЯ, БRРИЯ и др. Полученные при ЭТОМ соединения на,
IВ~IOТся гл uцераmамu.
);, 1Л~щсратЬ! тяжслых MeTRJlJlOB, в том
"pal<'Гl'p
2
' Подобно гликоляту меди.
числе и меди, имеют КОМIIлексный
Г1рн взаимодействии с галогеноводородами (НО и Hl3г) ПОJIУЧiiЮТСЯ
MOI'
10, fI "
"I!ХJЮр- IIЛИ БРОМГИДРИIlЫ глицеРИНR, НRпример:
С"~ШКIi( )НСН 2 ОН ~~CH2CICHOHCI-I20H ~~
~CICI-I~CHOHCH~C1
151
В реакции с иодистым водородом могут быть зямещены все гидрокси­
ЛI,ные группы глицериня, но образующийся при этом трииодпропан вос­
станавливяется иодистым водородом в иодистый изопропил:
снрн-снон-снрн:mъ", CI-Ч-С!-II-СН) +_~J.l1 )о СНгСНI-СН:\
ТI)lШllitЩЮI1ИII
:!
- :.!
З. При действии гаJ\огенидов фосфора замещаются raJ\oreHOM все три
гидроксиля:
CH20I-I-СНОН-ClI~ОН+РВГ:1 ~ СН2Вг-СI-IВг-СН~Вг+Р(Ш-l):1
1,2,:J-ТР"UРОМIII'0IIИII
При взяимодействии с иодом и фосфором образующийся 1,2,З-трииод­
пропан ряспадается ня иод и иодистый яллил:
снрн-снон-снрн ~I~;I)'" CH)-СНI-СI-Ч~СН:r-СН~СН2I
IШ)LIIС"ГloIltilJIJllfJl
.\
4. При взаимодействии глицеРИflЯ с неоргаНИ'lескими и органическими
КИСJIOТЯМИ Г10ЛУ'lЯЮТСЯ полные инеполные СJ\ожные эфиры. Приводим ре­
якцию образовяния полного эфира RЗОТНОЙ кислоты:
снрн
C1'LJOH
1п
CHPNO~
+.IIINO,:III,S(),I
-:111,0
)о
снрн
cl HONO
(
~
CHPN0 2
Полный азотнокислый эфир глицерина
-
глицеринтринитрат
ТРОГJlицерин (обычное, но химически неправильное нязвание)
-
-
ни­
взрыв­
'laтое вещество, применяемое д.ля изготовления динамитя.
Аналогично получается и полный уксуснокислый эфир глицерина:
О
сн.,он
1 -
/0
~:HOH +зсн:\-с"
снрн
11
СНР-С-СН!
11+
I
О'
11
;jёЕ~:=;:Э~СН-О-С-СН:1
OHI
W
снр-с-сн:\
Примеры неполных эфиров -
моноацетат и диацетят глицерина:
CH:г«()COCA~)CHOHCH2()H и СН:iОСОСН)ЗСНОНСН20СОСНз.
Особенно БОЛl,шое ПРЯКТИ'lеское знячение имеют полиэфиры глицери­
на и яромаТИ'lеской двухосновной кислоты (фталевой кислоты, см. гл.
25.3). Эти полиэфиры -
глицеринофталевые смолы, которые называюТ
тякже ГЛИфПlЛями, широко применяются д.ля изготовления ляков.
5. При дегидрятации глицериня (нагреванием с гидросульфатом калИЯ
и с некоторыми другими водоотнимающими веществами) образуется про­
стейший непределыlйй альдегид акролеин с острым неприятным запахоМ
152
и раздражающим действием на слизистые оБОJlОЧКИ глаз, носа и дыхатеJlЬ-
ных пугей:
ch.,oH-СНОН-СНРН
-Н. О
'~ СНРН-СН=СН-ОН Е
~
-
~ С'1-1 l
>
ОН- С'1-I~- С'Н-О
-НР ~ ('Н
-CH-CI-I-O
- 2
itKIICIJlC.111
Акролеин
образуется
при
пригорании
жиров
и
жиросодержащих
веществ.
6.
Глицерин подвергается окислению, как и все первичные и вторич­
ные спирты. Состав продуктов окисления зависит от природы окислителн.
Н~1'lаJIЬНЫМИ продуктами окисления являются глицериновый альдегид и
диоксиацетон, конечным продуктом (без разрыва углеродной цепи) -
Аtезоксалевая кислота НОСО-СО-СООН:
СН=О
сн.,он
СООН
снон
С=О
с=о
I
I
I -
I
I
снрн
I
СНрН
J'JIIIIL~I)11lf1)lll.lit
СООН
lLИ11Кl.:иitlLСТt111
мс·юк...:itJIС""'JI
;tJll';lС,",IД
КlICJlllTto\
Применение. Глицерин в больших КОJlичествах потребляется в хими­
'lеСl<ОЙ, пищевой (для изготовления кондитерских изделий, ликеров, про­
хладительных напитков и др.), текстилыlOЙ и ПОJlиграфИ'lеской промыш­
ленностях (добавляется в пе'IaТНУЮ краску для предохранения от высыха­
ния), а также в других отраслях производства.
Его применяют в производстве пластических масс и лаков (глифтале­
вые смолы), ВЗРЬ!В'IaТЫХ веществ и порохов, космеТИ'lеских и лекарствен­
ных препаратов, а также в качестве антифриза.
ГЛАВА
.4
ПРОСТЫЕ ЭФИРЫ
1.
ПРОСТЫЕ ЭФИРЫ (ОКИСИ дЛКИЛОВ)
Простые эфиры можно представить как соединения, образованные за­
мещением обоих атомов водорода MOJleKYJlbI воды двумя алкильными ра­
дикалами или замещением гидроксильного водорода спиртов одним aJIКИ.IIЬНЫм радикалом.
Изомерия. Номенклатура
ОБШ,ая формула простых эфиров I~-O-R или R-O-R'. В первом
CJIY'lae оба радикала одинаковые, а во втором - разные. Простые :iфИРЫ
с раЗЛИ'lНЫМИ радикалами называются смешанными эфирами. По общей
формуле С"Н:.гff+20 эфиры изомерны спиртам.
153
Как ВИДНО из общей формулы простых эфиров, их изомерия и но­
менклатура обусловлены характером радикалов:
СНз-О-СН з
диметиловый эфир, метиловый ЭфИр·, метОксиме­
тан (систематичеСl{ая номенклатура)
метилэтиловый эфир, метоксиэтан
диэтиловый ИЛИ ЭПIЛОВЫЙ эфир, этоксиэтан
С2Н5-0-СН2-СН2-СНЗ
ЭТИЛПРОПИЛОВЫЙ эфир, l-этоксипропан
с 2 н 5 -о-сн-сн з
этилиэопропиловый эфир, 2-этокснпропан
I
СНз
СН з -О-
т Н-СН 2 -СН з
метил-втор-бутиловый эфир, 2-метоксиБУТЗIl
и Т.д.
СНа
Способы получения
Простые
эфиры
обычно
получают
одним
из
следУЮЩИХ
способов.
1, Реакцией галогеНОПРОИЗВОДIIЫХ с алкоголятами
общих
реакция Виль­
-
ямсона:
C2H50Na+I -С 2 Н 5 ---+ Cz H 5 -О-С2 Н 5 +NаI.
2.
Дегидратацией спиртов под влиянием кислот,
особенно серной
кислоты:
Физические свойства
Два первых представителя эфиров, метиловый и метилэтиловый, при
обычных условиях
-
газы, Все остальные простые эфиры
-
жидкости,
которые кипят при температурах, значительно более низких, чем соответ­
ствующие спирты. Например: этиловый спирт кипит при 78,3 ос, а мети­
ловый эфир (СНЗ)20 (с тем же эелементным составом)
-
при
-24
ос,
этиловый эфир (С2НБ)20 - при 35,6 ос. Это связано с отсутствием водо­
родной связи меЖдУ молекулами эфиров.
Эфиры плохо растворимы в воде, их плотность ниже единицы, они об­
ладают характерным приятным запахом.
* в случае одинаковых радикалов приставка дu- часто опускается.
154
Химические свойства
Простые эфиры - нейтральные и малоактивные соединения. Разбав­
ленные минеральные кислоты, щелочи, металлический натрий и PCl 5 на
хоЛОДУ на Hi1X не действуют.
1.
О б раз о в а н и е о к с о н и е в ы х с о е Д и н е н и й. Простые эфи­
ры присоединяют кислоты; протон кислоты присоединяется к кислороду
эфира за счет
ero
неподеленных электронов:
С2 Н 5\/O+H+CI-~[С 2 Н 5\+}
/О-Н 1С2 Н5
±
или [(C2H5)2UH]CI-
С2Н5
Образующиеся комплексные соли напоминают соли аммония:
NН з
+ н+сг = [NН 4 J+СГ.
По аналогии с солями аммония эти кислородсодержащие соединения
называются оксониевыми (соли оксания).
2. А ц и д о л и з. Концентрированные кислоты (серная, ИОДИСТО80ДО­
родная), а также некоторые другие реагенты (хлорное железо в уксусном
ангидриде, ацетилтозилаты) расщепляют простые эфиры по механизму
SNl (эфиры третичных спиртов) или SN2 (эфиры первичных спиртов):
+
(СНзJзС-О-R+Н+ ~ (снз)зс-о-н
MeдI1.
?
(СНз)зС++RОН
k
(снз)з с + + х- быстро ~ (снз)з с - х ;
+Х-
11+ (с 2 н 5 )рн
+
(C2Hr.)P~
Е
0)0
t
~+
J
Х··· Н 2 "·О-С 2 Н 5 ~ с 2 н 5х+ С2 Н 5ОН
Т
сн з
3.
Р а с щеп л е н и е. Металлический натрий при нагревании также
расщепляет простые эфиры (п. п. Шорыгин):
Отдельные представители. Применение
ИЗ простых эфиров наибольшего внимания заслуживает этиловый
Эфир, часто называемый просто эфиром. Он получается дегидратацией
ЭТилового спирта.
Этиловый эфир
пахом, т. кип.
35,6 ос,
бесцветная прозрачная жидкость с приятным за­
плотность
0,7135.
Он мало растворим в воде: в
100
155
частях воды при 20 ос растворяется 6,5 частей эфира; вода также частич­
но растворяется в эфире; в 100 частях эфира около 1,25 частей воды.
Эфир смешивается со спиртом в любых соотношениях, легко испаряется
и воспламеняется. При обращении с эфиром следует всегда учитывать,
что, во-первых, пары его примерно в 2,5 раза тяжелее воздуха и потому не
сразу с ним смешиваются, что увеличивает опасность взрыва и пожара, и,
во-вторых, при хранении эфир окисляется с образованием взрывчатых
перекисных соединений. Поэтому перед работой необходимо проверить,
не содержит ли эфир перекиси. Для этого пробу эфира встряхивают с под­
кисленным раствором иодида калия. Побурение раствора свидетельствует
о наличии перекисей, которые окисляют иодистый водород до иода.
Чтобы очистить эфир от перекисей, его встряхивают с водным раство­
ром сульфата железа (11) или с СаН 2 .
Этиловый эфир находит разностороннее применение, особенно в каче­
стве хорошего растворителя. В медицине его употребляют Д1lя наркоза и
усиления сердечной деятельности.
Эфиры неnредельных спиртов. Известны эфиры и с непредельными этиленовыми и
ацетиленовыми раднкалами. Наибольшее значение имеют виниловые эфнры, образующиеся
при взаимодействии ацетилена со спиртом (с. 107). В отличие от предельиых эфиров винило·
вые эфиры подвергаются Гltдролнзу при действии даже разбавленных растворов кислот уже
на холору с образован"ем уксусного альдегида и спирта:
СJ-I 2=СН-ОС 2 Н 5 НП1' ~ CH2=t~OH + СН 2 J-1 5ОJ-l
СНГС'Н
В практике используется способность виниловых ЭфltрОВ полимеризоваться; ПОЛltмер
винилбутltлового эфира ускоряет заживление ран (бальзам М. Ф. Шостаковского).
Дивиниловый эфир Itспользуется как анестетик.
2.
а.·ОКИСII:
(оксираIIЫ)
ЦИКЛИЧЕСКИЕ ПРОСТblЕ ЭФИРbI (ЭПОКСИСОЕДИНЕНИЯ)
снзс~/сн-снз
О
ОКИСI» ЭТМСllа,
OKIIC~ ПРОllилеl18,
ОКИСЬ CHMM-ДIIмеТliЛЭТlfJlеIlЗ,
эrlOКСИЭТ811,
l,2'ЭПОКСllпропаll,
ОКСНрЗl1
меТИЛОКСНр811
2,3-ЭllOксибутаll,
2,3-ДlIмеТИЛОКСIlРЗIl
сн -сн -СJ-I-СН
LO~
Р-ОКIIСИ:
(OKCCTallbI)
OKIIC~ тримеТIUlеllа,
l,3-Э/IOКСllI1ропаll, OKCCТOdll
у-ОКИСI/:
( оксолаllЫ)
l,3-ЭlIоксиБУТЗIl,
2 - MCTIUIOKCLOТ811
CHГ~2
CHГ~2
CJ-Irck 2
СН;гСН-ck 2
I
о
тетраГllдрофураll,
l,4-эпокснбутаll,оксолаll
156
3
I
о
jJ-МСТllJlтетрагндрофураll,
2-меТИДОКСОnЗII
Оксид этилена
жидкость (т. кип.
-
10,7 ос,
плотность
0,897 при
О ОС),
С водоЙ смешивается в любых соотношениях. Имеет важное техническое
значение (см. схему 5). В промышленности его получают главным образом
из этилена двумя способами: через этиленхлоргидрин путем его дегидро­
хлорирования или прямым каталитическим окислением этилена (гл. 1.2):
1HOC:~:): сн
- сн 2 + N,CI + Н 2О •
I 2-сн
I 2 ~CH
........0/
СН 2 =СН 2
он
о
в
СI
СН 2 -СН 2
.
........ 0 /
'Ag]
Окис.Ь этилена относится к весьма реакционноспособным соединени­
ям, поэтому она широко применяется при различных синтезах в больших
промышленных масштабах. Реакции присоединения к оксиду этилена лег­
ко проходят с разрывом связи С-О. При этом активный атом водорода
присоединяющейся
молекулы
а остальная частье ее
-
неизменно
направляется
к
кислороду,
к углероду окисного кольца по общей схеме:
(-------1
СН 2'7"-СН2
.......
У.
Т
н-х
I
-
носн2-сн 2-х
O-*----....J
Все эти реакции в кислой среде могут проходить по механизму
SN 1 или
в щелочной среде - по механизму SN2. Определить механизм реак­
ции в первом случае помогает ее стереохимическая направленность. От­
SN2,
сутствие стереоспецифичности указывает на промежуточное образование
карбевиевого иона (механизм
SN1),
обращение конфигурации
стке в реакции циклического оксониевого иона (механизм
SN2):
на уча­
1. Как уже было показано ранее, присоединение воды к оксиду этиле­
на приводит к образованию этиленгликоля, ди- и триэтиленгликоля:
157
с хе м а
5.
Некоторые примеры промышленного органического синтеза
на основе окиси этилена
ИзомсриэаЦll11
~==;';"';'----.1~ СНэСНО
{
СНЗ-СООН
укс)'снаи КШ:..1с"lТi1
УICС)'СН.oIЙ
MhДCгltjI
СНз-СНzОН
:rrИЛО8ЫЙ спирт
Димсриэации
+ HzO
CHzOH-СНzОН
зт •• леIIГ..,IIКОЛЬ (ди- и пмнэтиленглиJC.ОЛИ)
+HOR
НОСН) -
CHzOR
моноэфирw ЭТИЛСНГЛИКОЛJl
HOCHz-СНz-О-СНz-СНz-ОR
МОНО:JфIlРЫ ди- И поnиэтиnекrnИlConей
HOCHz-СНz-О-С-R
11
+HOOC-R
О
cnожныс МОJlо:нIШРIII :rfltлеНГnИХОЛI
HOCHz-СНz-О-СНz-СНz-О-С-R
11
О
сложные аtоиозфиры ди- и ПОЛИЭТИЛСНГЛIII(ОЛСЙ
HOCHz-СНz-NНz
зтанолам:ии, аминоэтанOJI
+ NH]
t-....;...;.;.!...--+--ШОСНz -СНz)zNН
окиСЬ ЭТlUlенз
ДJfэтпкол:tмии
(HOCHz -снz)з N
триэтаноламиtl
HOCHz-СНz-SН
ТИQГnИКOnЬ
HOCHz-СНz -S-СНz-СНz-ОН
тиодигnиltOllЬ
j-:+~Н:.::S:..--=.:R~_ _--I~НОСН2-СНz -S-R
~ - rипрокситиroфиры
1-+..;.Н;,;С;,;N----_~НОСНz-СНz-СN
f
CHZ=CH-СN
акрилонитpиn
CHz=CH-СООН
ЭТlfлеКЦllанmдрин
aKpКnOla. kИСЛОТ~
(иитрил-ll-rиnрокси-
СН
кислоты)
aJlUJl81СрКJIаты
ПРОПИОН080Й
-"H-COOR
. 2-"'"
+НОС I8 Н З7
1--.-;:.::......::.:...---НО-СНz-СНz-ОСI8Н37 и другие моющие
средСТ8а
Пo.nИМ:СРИЗ3Ц}IR
~;.;;.;....==~--;- (-СНZ-СНZ-D-)n
синтетические волокна и
158
мастмассы
2.
оксид этилен(!
JlerKO присоединяет галогеноводороды с образоваllИ­
еМ гаJlогенозамещенных спиртов:
C~~/CJ-I2+ НСI ~CHP -снрн
О
Il-XJЮР""'ПIJIllItI,lii Cllllp"f.
~-Х,JI(IIJ'iПIIЮJr.
·.. ТltJIСIIXJIIJ!'."IIДI'ИII
З.
Присоединение спирта к оксиду этилена в присутствии кислот или
щеЛО'Iей приводит к образованию очень ценного растворителя -
этил­
целлозольва (неполного эфира этилеНГЛИКОJlЯ):
СН.,- СН 2 + Hoc.,H~CHPH- СН 2 -
00':0""""
- .•
Нешмметри'!ные ОКСIIДЫ присоединяют
cnlipTbI
О -с.,Н<;
- .
в присутстВlШ КlIСЛЫХ ИЮI щело'!ных ЮI­
TMIII~aTopoB по· разному. Например. в СЛУ'lае ОКСИда liзоБУТllлена ПОЛУ'lаются неполные тре­
ТlI'!HbIe IIЛИ nepBII'!HbIe ЭфllРЫ ГЛИI\ОЛЯ (А. А. Петров):
0
_
00
RO
(CH;t)2C - )=Н 2 +
Н
-С"> (CH;j)2COR-СН20Н
........ 0
-
(CH;t)2COH-СНРR
Это праВIIЛО связано С раЗЛll'lНЫМ механизмом деilСТВIIЯ указаНlIЫХ катаЛliзаторов. Ще·
ЛО'!II увеЛИ'!lIвают НУI(леОфИЛl>НУЮ аКТИВНОСТI> реагента. превращая CnllpT в аЛIШГОЛЯТ. аНIЮН
которого 1I ilTilKyeT KpailHllil углеродныil атом оксида (мехаНIIЗМ
SN2).
КIIслотыдают С OKCltДa·
МII OKCOHlleBbIe соеДllнения. способные непосредственно пр"соединять спирт С раЗРl>IВОМ бо·
лее 110ЛЯРIIЗованной СВЯЗII оксидного кольца (механизм SN 1):
RO-СНz
-+
ROfHz
+КОН
(СН з )zС-ОН
I
+
RO-
(С Н з)zС-О-
кон
н+
CHzOH
--- ( СНз)zС-О-R
1+
I
н
---
+
н+
4. Оксид этилена присоединяет (!ммиак и амины с обр(!зованисм ами­
"ОСI1ИРТОВ:
JШ"iТitIЮJfitМIIII
Тfll''''П:4IIIUI:4МIIII
159
Этаноламины применяют ДIIЯ очистки газов от СО 2 и H2S, С которыми
этаноламины образуют легко разлагающиеся при нагревании соли.
Несимметричные оксиды при соединяют аммиак и амины по правиny
К. А. Красуского: аминогруппа направляется преимущественно к более
гидрогенизированному углеродному атому кольца:
(CH3)2~-7H2 + NН з -(СН)СОН-СН 2 NН 2 •
О
5.
При нагревании до
300-400 или до 150-300 ос в присутствии не­
которых катализаторов (АI 2 О з , Н З РО 4 и др.) оксид этилена изомеризуется
в уксусный альдегид:
CHICH2~[CH2=CHOH]~ снз-сн=о.
"
О
ПJюмежyroЧllыА
/
УКСУСШJlА
IIеуt.,.оАIIИВhlА
anWJ,сгид.
RltIlИnОВЫЙ СПИРТ
IЗ схеме
5 приведены
основные превращения оксида этилена.
Краун-эфиры. В последнее время в лабораторной практике и технике
получили широкое применение так называемые краун-эфuры (от англ.
сгошn
-
корона). Они представляют собой поли эфиры с большими цик­
лами, включающими несколько атомов кислорода. Краун-эфиры могут
образовывать с солями металлов комплексы, способные растворяться в
неполярных растворителях. Обычно это кристаллические вещества, кото­
рые очищают хроматографически. Токсичны.
Названия краун-эфиров образуют с учетом числа и природы заместите­
лей, общего числа атомов углерода и кислорода в полиэфирном цикле
и числа атомов КИСJlорода в цикле.
Получают краун-эфиры чаще всего действием на гликоли бис-~-хлор­
эфиров в присутствии щелочей.
Различные краун-эфиры связывают различные катионы. Например,
[12]-краун-4 связывает ионы лития, но не калия, в то время какдициклО­
гексил-[ 18]-краун-6 связывает ионы калия, но не лития.
г\
~)
(12)
160
крауи-4
(15)
краун
-5
[181
ДИЦИlUlоrcхсил-1181 храуи-6
храуи-6
Краун-эфиры широко используют для разделения катионов, а в органи­
ческоМ синтезе для переведения неорганических соединений в раствори­
мое в органических растворителях состояние. Так, например, краун-эфи­
ры ускоряют омыление сложных эфиров с помощью водных растворов
КОН (гл.
6.1),
делают возможным окисление органических соединений
КМ ПО 4 в бензоле (гл.
1.2 и др.).
С помощью оптически активных краун-эфиров можно разделять раце­
Аtические смеси на антиподы (гл.
1О).
В органическом синтезе нашли также применение и макроциклические
полиаминоэфиры
криnmан.ды, образующие с катионами металлов со­
-
единения включения
3.
-
криптаты.
ПОНЯТИЕ ОБ ОРГАНИЧЕСКИХ ПЕРОКСИДНЫХ СОFДИНЕНИЯХ
Подобно тому как спирты и простые эфиры можно рассматривать как
продукты замещения одного или обоих атомов водорода в молекуле воды
алкилами, так и органические гидропероксиды и пероксиды можно рас­
сматривать как алкильные или ацильные производные пероксида водоро­
да Н-О-О-Н. Соединения типа R-O-O-H и R-CO-OOH со­
ответственно называются гидропероксидами алкилов или ацилов, а типа
R-O-O-R и R-CO-O-O-CO-R -
пероксидами алкилов или
ацилов. Например:
CH;j-О-О-Н
С 2 Н,,-0-0-н.
CIf;j-С-О-О-Н
11
гидропероксид метила
гидропероксидэтила
гидропероксид ацетила (надуксусиая Кllслота)
О
~Н;j-О-О-СН:j
С 2 Н 5 - О - 0 - СН з
C2H5-0-0-C~H5
CH;j-С-О-О-С-СН з
11
О
пероксид метила
пеРОI(СИД меТИЛЭТllла
пер оксид этила
пероксид ацетила
11
о
Гидропероксиды и nероксиды алкuлов обычно получают действием
СПиртов на конце:прированную Н 2 О 2 . Это маслянистые жидкости с не­
ПРиятным запахом, обжигающие кожу. Гидропероксиды и пероксиды
первичных алкилов малоустойчивы и при перегреве легко взрываются.
6 Зах. 181
161
Гидропероксиды и пероксиды вторичных алкилов более УСТОЙЧИВbI
а третичных еще прочнее. Гидропероксид третичного БУТИJl~
(СНз)зС-О-О-Н представляет собой жидкость, растворы которой
(например, 6-%-ный раствор в триметилкарбиноле) безопасны в Обра_
щении.
Гидропероксиды и пероксиды алкилов и ацилов - хорошие окислите_
ли. Они выделяют иод из НI (подкисленных растворов КI):
При нагревании гидропероксиды и пероксиды алкидов и ацилов раЗJlа­
гаются с образованием свободных радикалов, например:
(CHJ.C-O-O-H~(CH.}C-O·+ н-о·
.1.1
.1.11
L;..(CH)2C=O +СН:1
или
СН\-С-О-О-С-СН 1 ~2CH\-C-O ~2CO,,+ 2СН:\
.
11
.0
Ilt'I)tЖСНJl
11·
.
О
11
,
.
О
;lllCTllml
Поэтому они являются инициаторами различных цепных реакций в рас­
творах. В промышленности они используются как инициаторы реакции
полимеризации.
ГЛАВА
5
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегидами и кетонами называют производные углеводородов, содер­
жащие карбонильную группу с=о. в молекуле альдегидов по крайней
мере одна валентность карбонильной группы затрачивается на соедине­
ние С атомом водорода, а другая с радикалом (предельного ряда в пре­
дельных аЛlщегидах и непредельного - в непредеЛЫIЫХ альдегидах). Об­
щая формула альдегидов R-C-H, причем R может быть равно Н.
11
О
в СЛУ'lае кетонов обе валентности карбонильной группы затрачиваютСЯ
на соединение с радикалами. Общая формула кетонов
R-C-R'.
11
О
162
1.
ПРЕдЕЛЬНЫЕ АЛЬДЕГИДЫ И КЕТОНЫ
Изомерия. Номенклатура
Общая формула предельных альдегидов и кетонов С"Н 2 "О.
изомерия альдегидов связана со строением радикалов. Так. например.
_
извеСТIIО 'ICTbIpe аJlьдегида с формулой
/0
С"н!)-с"
(см. ниже).
Н
Альдегиды наЗI>шают или по кислотам, в которые они переходят при
окислении (с ТСМ же числом углеродных атомов), или по предельным угле­
водородам с добавлением суффикса -аль (систематическая номенклатура).
Пр
11 М еры:
~Л
н-с"
муравьиный альдегид (формальдеГlЩ). метаналь
(РИС,
н
~Л
а)
УI<СУСНЫЙ альдегид. ,таналь
CII,,(,
,
43
(P1lC, 43 (j)
'1-1
О
Сн,сн;-с-I'
, -
"н
Cl-lгСН-СНО
, I
ПРОПl10flOВЫЙ альдеГI1Д. пропаналь
l1Зомасляныii альдегид. 2-метилпропанtlЛI,
СН\
CH:I-CH~-CH2-CH2-CHO
валеРllановыii альдегид. пентаналь
CI1\-lrН-СI-!~-СНО
IIзовалеРl1ановый альдегl1Д. 3-метнлбутаналь
СН\
C!-I:\-СНг-?Н-СНО
СН,\
мепm,ТНЛУf{СУСНЫЙ аЛL,дегид. 2-меТl1лбутаналь
са
I '
(1 j,\- с-сна
, I
,\
ТРl1метилуксусный ал ьдеГl1д. 2.2-димепtлпропанмь
СНа
а
tJ
Р llс , '1,",
) М одель молекулы мураВЫIНОГО
11 уксусного (б) альдегидов
(а)
Рис,
44,
Модель молекулы
ацетона
lб3
Изомерия кетонов связана со строением радикалов и с положеНие~
карбонильной группы в углеродной цепи. Кетоны называют по наимено.
ванию радикалов, связанных с карбонильной группой. По системаТИчес_
кой HOMeHКJlaтype к названию предельного углеводорода добавляется СУф.
фикс -он и указывается номер атома углерода, связанного скарбониль.
ным кислородом:
."
I!цетон (ТРИВИl!льное Нl!зваНllе).
СН,-С-СН.,
димеТlfлкетон, пропанон (рис.
.
О
СН,- С-СН 2- СН' I
.
11
44)
метtlлэтttлкетон,
.
бутанон
О
I
1:'
СН:,- п- СН 2 -
4
СН 2 -
метилпропилкетон,
5
СН: 1
2-пеНТI!НОН
О
метилизопропилкетон,
сн,-С-СН-СН,
.
I
11
1
О
СН:,
"
СН.,- СН"
.
-
3-меТllл-2-бутанон
.
:~
1
ДIIэтилкеТОII,3-пентанон
:,
С-СН,- СН.,
-
11
<
•
О
метItЛ-IJI/юр-бутилкетон,
СН,- С-СН-СН,,-СН,
,
"1
О
<
3-меПIЛ -2 - пентанон
,
СНа
Способblполучения
Альдегиды и кетоны получают рядом общих методов,
1_
Окислением или каталитическим дегидрированием первичных спир'
тов ПОЛУ'lают альдегиды, вторичных
-
кетоны. Эти реакции уже приво­
дились при рассмотрении химических свойств спиртов.
2.
Альдегиды и кетоны удобно также получать пиролизом кислот и их
смесей в' виде паров над оксидами некоторых металлов (Th0 2, М ПО 2'
СаО, ZпО) при
400-450
ас:
R-COOH + Н-СООН -----+ R-CHO + СО 2 + Н 2 О
2R-COOH -----+ R-CO-R + СО 2 + Н 2 О
R-COOH + R'-COOH -----+ R-CO-R'+
Во
MltOrllX учебниках указывается, .. то альдегиды
СО 2
+ Н2 О
и кетоны могут быть ПОЛУ'lены пирол и -
зом Са- 11 Ва-солей карбоновых кислот. В действительности эта реакция дает очень низкие
выходы. Однако некоторые метилкетоны все же могут быть полу~ены пиролизом смесей ба­
pllel3bIX ИЛII железных солеii уксусной
и какой-либо другой КИСЛОТbI. Все эти реакции имеЮТ
радикальныii механнзм.
3_
Гидролиз геминальных дигалогенопроизводных при водит к альдегИ­
дам, если оба галогена находятся у одного из крайних атомов углерода, И
кетонам, если атомы галогена находятся у одного из средних атомов угле-
164
ЭТИ реакциИ уже упоминались при изучении химических свойств ди­
РОД~~енопроизводных углеводородов (гл. 2.2).
гал4 . Гидратация ацетилена и его гомологов в условиях реакции Кучерова
(с.
107) при водит
соответственно к уксусному альдегиду или кетонам:
НС.... СН
+
Н2 О
---.
CHa-СНО
R-C-=CH + Н 2 О ---. R-C-CH:1
11
О
5. Карбонильные соеДllнения с высокими выходами (порядка 80%) образуются при
окислении соотвеТСТВУЮ~ltх спирт?в смесями диметилсульфоксида с уксусным ангидридом
или безводНОЙ фосфорнои кислотои.
RCH 2 0H + (CH:1)2S0 ---. RCH=O
6.
+ (CH;j)2S
ПревращеНl1е галогеналкилов в альдегиды с удnннением цепн на однн атом углерода
достигается обработкой 11Х натршiтетракарбонилферратом в присутствии трифеНИЛфОСфlt­
на. а затем уксусной ЮIСЛОТОЙ:
R - Hlg + Na2Fe(CO)4
(С/;Н:;).I
Р
l ) 1.
)
' . I RCOFe\CO:1 p\C\jHr. :1
СН·\СООН
.
I
R - СН = О
Имеется lIеСl<ОЛЫ<О модификации этого метода.
Кетоны с ХОРОШИМI·I выходам" получаются пр" взаимодействии хлораНГllДРllДОВ кис­
лот с ЛИТlliiднаЛl\илкупратаМI1 11 кадмийалкилами:
7.
R2CLILi + R'COCI---.
2R- C~
О
"СI
R-СО-R'+LiСI
+ Cd (С,Н)., -+ 2R - ., -
+ R-Cu
С-С"Н"
+ CdCl.)
11
<..
О
8.
В технике альдегиды получают прямым присоединением СО и Н 2
100-200 ос поддявлением 10-20 МПа
колефинам (оксосuнmез) при
(100-200 атм) в присутствии кобальтового или никелевого катализато­
ров (например, Со + Th0 2 + MgO, нанесенные на кuзельгур):
,
-
О
~
R- CH~- CH~- С,
О
Н
R-CH=CH~+ СО + H~ {
R-CH-C~
1
"Н
СН:\
Реакцию с 3Т1tленом 11 пропиленом проводят в газовой фазе, а с более СЛОЖНЫМII олефlt­
нами (С 4 -С 2о ) - в жидкоii фазе. Как видно из ПРlшеденной схемы, при ОКСОСltнтезе полу­
чаются аЛl.деГllДЫ, содержащие на один атом углерода больше. чем исходные олефllНЫ. Этот
СIIНтез IIMeeT важное значеНllе дnя получения высших первичных спиртов (катаЛ\lТllllеСIШМ
80сста
новлением альдегидов). МехаНI1ЗМ ОКСОСl1нтеза можно представить следУЮЩllМ
б
о разом:
2Со
+ 8СО ---. Со 2( СО )11
С0 2 (СО)х
+ Н 2 ---+
R-CH=CH 2 + НСО(СО)4 ---.
2НСО(СО)4
R-СН 2 -СН 2 -Со(СО)4
R-СН 2 -СН 2 -Со(СО)4 +СО ---. R-CH 2-CH 2-CO-CO(CO)4
H-O-l2-CH2-CO-CO(CO)4 +
НСО(СО)4 ---. R-CH 2-CH2-CHO + СО(СО)II
165
Физические свойства
Муравьиный альдегид
ttльдегиды и кетоны
-
-
газ с весьма резким запахом. Другие НИЗIUИе
жидкости, легко растворимые в воде; НИЗlUие аль·.
де гиды обладают удушливым запахом, который при сильном рttзведении
стttlЮВИТСЯ приятным (нttпоминает зttпах плодов). Кетоны nttXHYT ДОВОль.
110 приятно.
При одном и том же составе и строении углеродной цепи кетоны кипят
при несколько более высоких
TeMnepttTypax,
чем альдегиды. ТемпературЬ!
кипения альдегидов и кетонов с нормальным строением цепи выше, чем
у соединений изостроения. Например, валериановый альдегид кипит при
103,4
ОС, а изовалериановый
-
при
92,5
ос. Альдегиды и кетоны кипят
при температуре, значительно более низкой, чем спирты с тем же числом
углеродных атомов, например у пропионового альдегида т. кип.
У ацетона
65,1
ОС, У н-пропилового спирта
97,8
48,8
ОС,
ос. Это показывает, что
ttльдегиды и кетоны в отличие от спиртов не являются сильно аесоцииро·
ванными жидкостями. В то же время температуры кипения карбонильных
соединений значительно выше температур кипения углеводородов с той
же молекулярной массой, что связано с их высокой полярностью. Плот­
ность альдегидов и кетонов ниже единицы.
В ИК-спектрах для СО-группы характерно интенсивное поглощение
при
1720
CM- 1. В спектре ямр сигнал водорода альдегидной группы на·
ходится в очень слабом поле.
Химические свойства
Альдегиды и кетоны отличаются большой реакционной способностью.
Большинство их реакций обусловлено присутствием активной карбониль­
ной группы. Двойная связь карбонильной группы сходна по физической
природе с двойной связью между двумя углеродными атомами (а-связь
7t-связь) (рис.
45).
Однако в то время как Ес=с
<
+
2Е с - с , энергия связи
С=О (749,4 кДж/моль) больше, чем энергия двух простых С-а-связей
(2 х 358 кДж/моль). С другой стороны, кислород является более электро­
отрицательным элементом, 'leM углерод, и потому электроннttя плотность
вблизи атома кислорода больше, чем вблизи атома уг­
R r (.... I<.Oo
~
леродtt.
Дипольный
момент
карбонильной
груп-
пы - около 9 • 10-:30 Кл/м (2,7 D). Благодаря такОЙ
~
C~O: поляризации углеродный атом карбонильной группы
~~P2.
обладает электрофильными свойствами и спосо б ен
R'
,...\');~
реагировать с нуклеофильными реагентами. С оответPltc. 45. CxeM3TII'1e. ственно атом кислорода является нуклеофильнЫМ.
ское
I1зображеНllе
В реакциях присоединения отрицательно поляризо­
молекулы
ванная часть присоединяющейся молекулы всегда на­
альдегидов 11 кетонов:
правляется к углеродному атому карбонильной груП­
строения
R - 3ЛI<lIЛ. R' - Н в
мьдеГI1ДЯХ 11 3ЛКl1Л в пы, в то время как ее. положительно поляризованная
кетонах
166
часть направляется к кислородному атому.
РеакцИЯ присоединения н~клеофИЛЬНЫХ реагентов по месту карбоильной связи - ступенчатыи процесс. Схематически реакцию присо-
недин ения , например гидросульфита натрия к уксусному альдегиду, можно
изобразить следующим образом:
0-
oS+DoS-
I
н
о
0-
I
ОН
I
СНЗ-i- О +:~-OH .. • снэ-,-t- о
н
.
НО
I
0-
I
~ СНэ1-t-0
О
н
о
Радикалы, способные увеличивать положительный заряд на атоме уг­
лерода карбонильной группы, сильно повышают реакционную способ­
ность альдегидов и кетонов; радикалы или атомы, уменьшающие положи­
тельный заряд на этом углеродном атоме, оказывают противоположное
действие.
Помимо реакций присоединения по карбонильной группе для альдеги­
дов и кетонов характерны также реакции с У'lастием соседних с карбо­
нильной группой углеродных радикалов, обусловленные электроноакцеп­
торным влиянием на них карбонильной группы. К ним относятся реакции
окисления, галогенирования, конденсации.
А. Гидрирование. Присоединение водорода к альдегидам и кетонам
происходит в присутствии катализаторов гидрирования (Ni, Со, Сн, Pt, Pd
и др.). При этом альдегиды переходят в первичные, а кетоны во вто­
ричные спирты. На этом основан 9ДИН из методов получения спиртов.
В последнее время в качестве восстанавливающего агента часто применяют Лlfтийалю­
минийгидрид LiAIH 4. Реакция идет с переносом гидридного иона;
Преltмуществом восстаиовления с помощью LiAIH 4 является то, что этот реагеит не вос­
станаВЛltвает двойные углерод-углеРОДНblе связи.
При восстановлении альдегидов или кетонов водородом в момент выде­
ления (с помощью щелочных металлов или амальгамированного магния)
Образуются наряду с соответствующими спиртами также гликоли:
пинакои
Соотношение между образующимися спиртом и гликолем зависит от
при роды карбонильного соединения и условий восстановления. При вос­
С:Т<lНОвлении кетонов в продуктах реакции в апротонных растворителях
ПреоБЛ<lдают пинаконы; в случае алифатических насыщенных альдегидов
167
гликоли образуются в малых количествах. Реакция протекает с проме>Ку_
точным образованием свободных радикалов:
_+_e_-....:('-и3_М_ет_алл_а-')_
. .~
R-C-O:
R-C-OH
I ..
I ..
R
R
i
!
R-C-OH
Б. Реакции нуклеофильного присоединения.
Присоединение маг­
1.
нийгалогеналкилов подробно разобрано при описании методов получения
спиртов (гл.
2.
3.1 ).
Присоединение СИНИJ\ЬНОЙ кислоты приводит К образованию а-ок­
СИНИТРИJ\ОВ, омылением которых получают а-гидроксикислоты (гл.
8+~&СНз-С=О
I
+
а+
6-
10):
он
I
I
HCN - - - СНз-С-СN
н
н
нитрил
о. ·ГИДРОКСИПpdпионовоИ
кислоты
Эта реаlЩllЯ наЧlIниется НУl\леОФllльноii аТИIЮII углеродного итоми "оном CN-. Ц"ИН"о
CTblii водород пр"соеДllняется очень медленно. ДобивлеНllе каПЛlI риствора ЦIIИНlIСТОГО калия
ЗНЯЧlfтt~льно УСlюряет реакцию. в то время КИI< добавлеtllfе м"нералыюii КIfСЛОТЫ уменьшает
скорость реiНЩИlI ПРЮПlfчеСКlI до нуля. Это показывает. что aKТlfВHЫM реагентом при обра­
З0ваНlfИ ЦllаНГlIдрина является ион CN-:
:N=ё:+R2С=О~:N=С-СR2-0 Е 11+ Э :N=C-CR2-OH
3.
Присоединение гидросульфита натрия дает кристаллические веще~
ствн, обычно называемые гидросульфитными производными альдегидо~
или кетонов:
9'0_----.. . .
R-C~
+
НSОзNа
/
'н
Н
R-C=O
+
/он
НSОзNа
' ....--_--~
сн з
'б8
он
-R-С-SОзNа
-R-C-SO Na
I
сн з
з
n
и нагреваllИ И с раствором соды или минеральных кислот гидросуль­
Ple производные разлагаются с выделением свободного альдегида
фитнь
или кетона, например:
он
I
I
2R-C-SO'IN~ +Nа.,СО·I~2R-СНО+2N~"SО·I+ СО., + Н,О
.
~.
-
~.
-
н
РеакцИЯ с гидросульфитом натрия используется ДЛЯ качественного
определения ilльдегидов и кетонов, а также для их выделения и очистки.
Следует, однако, Зilметить, что в реакцию с гидросульфитом натрия в жир­
ном
ряду
вступают
только
метилкетоны,
имеющие
группировку
CH;j-СО-.
4.
Взаимодействие с аммиаком позволяет различать альдегиды и кето­
ны. Атll,дегиды выделяют воду, образуя альдu.м.uн.ы:
НI!~пtJII';lIIМIIII.
'"THIIHMIII'
которые легко ПО.ТIимеризуются (ЦИК.ТIизуются в кристаллические триме­
ры
альдегudа.м.мuакu
-
*:
СНЗ
JH
HN/ 'NH
I
3СНз-С=NН -
~
I
СН з -НС, /СН- СН З
NH
anьдеrидaммиак
При циклизации разрывается двойная связь C=N и три молекулы ими­
на соединяются в шестичленный цикл с чередующимися атомами углерода
и аЗота.
Кетоны с аммиаком подобных соединений не образуют. Они реагируют
O'ICllb медленно и более сложно, например так:
( СН
.
-
\110-\
_
_
_
_
_
+NII"
,,).,с=о ~(CH\).,C=CH-CO-CHI ~
-
-11.,0
-
.
~
.
~ (СН\).,С-СН.,-СО-СН\
. -1
-
.
NH~
-----
ву ~. АцетмьдеГltд~ММI1~К под назВ~Нl1ем ЩjлкаЦШ71 ПРl1меняется в 1<~lJeCTBe УСКОРlпеля пр"
JII\~НlfзаЦltl1 I<~YIJYI\OB.
169
5.
С гидроксиламином альдегиды и кетоны, выделяя воду, образYlOl'
оксимы (альдоксимы и кетоксимы):
СН з- CH=[~~~;JNOH~ Н 2О + СНз-СН=NОН
ацетanwщхсим
ацетоноксим
Эти реакции применяют для количественного определения карбониль_
ных соединений
•.
Механизм реакции
(R=H
или
Alk):
0-
..
СН з - Т = 0+ H2NOH
?
I
СН з - Т
R
-
+
NHpH
?
R
:ОН···Н:
Т
Т'
....
~ СН
з
-
С
I
-
ОН
N-
?
СН
з
-
R
С
I=
N-
ОН
+
Н О
2
R
6. Особый интерес представляют реакции карбонильных соединений
с гидразином и его замещенными. В зависимости от условий гидразин
вступает в реакцию с альдегидами и кетонами в соотношении 1 : 1 или
1 : 2. В первом случае образуются гuдраЗОНbl, а во втором - аЗUНbl
(альдазины и кетазины ):
СН з - c=!o+h:1N-NН2~СНз-С=N-NН2
I .......>.
2
I
СНз
СНз
I1IдjIIIЗOн
~ СН з - CH=N -
N= СН -
СНз
альдазин
СНг С= N - N !H::j'-ol = С - СНз -:n::o+" СНз - С = N - N= С - СНз
I -
СНз
•
...........
I
СНз
2
I
СНз
I
кетазин
СНз
При взаимодействии альдегидов с солянокислым гидрокснnамниом освобоЖlVlетСЯ
соляная кислота. которую можно оттитровать и ПРОIlЗвестн соответствующий расчет.
170
гидразоНЫ кетонов и альдегидов при нагревании с твердым КОН выделяю т
аз от
и дают ;lредельные углеводороды (реакция Кижнера):
СН:1 -
?=t=
СН:!
сн.
.1
N - NIH2
tt
~
N2 +
СН з - СН 2 - СН з .
- CH-N=NH
I
СН з
в настоящее время эту реакцию проводят нагреванием карбонильного соединения с гид­
разином в высококипящнх полярных растворителях (ди- и триэтиленгликоли) в присутствии
щелочи. Реакция может быть проведена и при комнатной температуре при действии
mреm-бутнлкалия в диметлисульфоксиде (гл. 7.1).
Альдегиды и кетоны с замещенными гидразинами
ном' C6H5 -NH-NH 2 И семикарбазидом
с фенилгидрази­
-
О
H2N-HN-C(
NH2
образуют
соответственно фенилгидразоны и семикарбазоны. Это кристаллические
вещества. Они служат для качественного и количественного определения
карбонильных соединений, а также для их выделения и очистки.
Образование фенилгидразонов:
R-СН=L(Т~~~;jN-NН-СБН5~Н20 +R-CH=N-NH-C6H5
Семикарбазоны образуются по схеме:
"с
'Х---Н/ -=L'!.~
__ 2jN-NН-СО-NН2~НР + "/C=N-NH-CO-NH 2
Реакции альдегидов и кетонов с производными гидразина по механизму
аналогичны их реакциям с аммиаком и гидроксиламином. Например, для
ацетальдегида и фенилгидразина:
0"
I + -NH-CII. ~
СН з- СI= 0+
NH2 -NH-C6Н..• .....---~ СН 3- C-NH
(2
1•.• ........Н
Н
он
н
I
I
~СНз- r-N-NН-С6НS?СНЗ- т= N-NН-С 6 Нs
Н
Н
для этих реакций характерен кислотный катализ **.
~-----
.: Еще ЛУ'lше с 2,4-динитрофенилгидразином.
1<11
Реюпщю часто ['роводят в буферных растворах,
Tal(
как при высокой концентрации
CJJOTbI уменьшается реакционная способность азотистого основания (образование соли).
171
7. Альдегиды и кетоны способны присоединять по карбонильной rpyn.
пе воду с образованием гидратов - геминальных гликолей. Эти соеДИНе.
ния во многих случаях существуют только в растворах. Положение paBHO~
весия зависит от строения карбонилсодержащего соединения:
-С-
+
нон
#
I
но-с-он
11
I
О
Так, формальдегид при
20
ос существует в водном растворе на
форме гидрата, ацетальдегид
на
-
58%;
99,99% в
в случае ацетона содержаНие
гидрата незначительно, а хлораль и трихлорацетон образуют стойкие кри,
сталлические гидраты.
Альдегиды с более высокой молекулярной массой (С 7 И выше) образуют с водой устойчи­
вые при низких температурах твердые полугидраты:
~
~
6н
6н
R-C-O-C-R
8.
При действии на альдегиды спиртов образуются полуацетали:
А
;ОН
B-CH=O+HOB~ В-С\
OR
в присугствии следов минеральной кислоты образуются ацетали:
/
+
он
нон
+ н+ #
R-CH"
I
R-CH-OR #
OR
+
R-CH-OR + Н 2О;
+
R-CH-OR +ROH #R-CH(OR>2 + н+
ацеталь
Ацеmалu
-
жидкости с приятным эфирным запахом. При нагревании
с разбавленными минеральными кислотами (но не щелочами) они подвер'
гаются гидролизу с образованием спиртов и выделением альдегидов:
CHj:hkoc;h;'i2-~н;iо#снзСН =0 + 2C2HsOH.
L _______________ •
Ацеталь, полученный из масляного альдегида и поливинилового спир'
та, используется в качестве клея при изготовлении безосколочных стекоЛ.
Ацетали кетонов получаются более сложно - действием на кетоны
этиловых эфиров ортомуравьиной НС(ОС 2 Н s )з или ортокремниевой кис·
лоты:
СН з - У = О + С 2 Н 5 О -СН (ОС2НS)2---+СНЗ-У(ОС2НS)2 + С 2 Н БО-СНО
C~
172
C~
9.
A.nьдегиды и кетоны при взаимодействии с
nа
рор.
кисло
PCls
обменивают атом
на два атома хлора, что используется д.ля получения геминаль­
ныХ дихлоралканов:
"
"
/C=0+PCI 5 .....".. /CCI 2+ РОСl з
Эта реакция в стадии, определяющей характер конечного продукта,
также является реакцией нуклеофильного присоединения:
R-T=O+PC~. PC~(2PCI5)
--
[R-r"t.....ОРСI4J PCI;
н
-
-PCI,
..
н
+
R-CHCI-OPCI4 -POCI~ R-CHCI + СГ - - R-СНCl 2
В. Реакции окисления. Окисление альдегидов идет значительно лег­
че, чем кетонов. Кроме того, окисление альдегидов приводит к образова­
нию кислот без изменения углеродного скелета, в то время как кетоны
окисляются с образованием двух более простых кислот или кислоты и
кетона.
Альдегиды окисляются кислородом воздуха до карбоновых кислот.
Промежуточными продуктами являются гидропероксиды:
R-CHO + 02 ~ R-CO-OOH
R-CO-OOH + R-CHO"""'" R-~-0-0-TH-R....."..2R-COOH
О
ОН
Аммиачный раствор гидроксида серебра [Аg(NНзЫОН при легком на­
гревании с альдегидами (но не с кетонами) окисляет их в кислоты с обра­
Зованием свободного металлического серебра. Если пробирка, в которой
идет реакция, была предварительно обезжирена изнутри, то серебро ло­
ЖИТСЯ тонким слоем на ее внутренней поверхности - образуется сереб­
РЯное зеркало:
~O
СНз-СНО + 2[Аg(NН З )2]ОН""""'СН З-С(
+
ONH 4
3NН з + HP
+ 2Ag
Эта реакция, известная под названием реакции серебряного зеркала,
СЛУЖИТ дЛЯ качественного определения альдегидов.
~ля альдегидов характерна также реакция с так называемой фелинго­
дОи жидкостью. Последняя представляет собой водно-щелочной рас­
Твор КОмплексной соли, образовавшейся из гидроксида меди и натрийка­
лиевой соли винной кислоты. При нагревании альдегидов с фелинговой
173
жидкостью медь
(II) восстанавливается до меди (1), а альдегид окисляется
до кислоты:
COONiI
COONiI
I
СНОН
I
+ 2ClI(OH)~
I
I
СНОН
+ R-CHO --;;. R-COOH + CllP +
СНОН
+ 2НР
СНОН
I
I
СООК
СООК
Красная окись меди CLI20 почти количественно выпадает в осадок. Ре­
акция эта с кетонами не идет.
Альдегиды могут быть окислены в карбоновые кислоты с помощью
многих обычных окислителей, таких, какдихромат калия, перманганат ка­
ЛI1Я, по ионному мех<'lНИЗМУ, причем первой СТ<'Iдией процесс<'l обычно яв­
ляется присоединение окислителя по СО-группе.
Окисление кетонов протеК<'Iет с р<'lзрывом углеродной цепочки в Р<'lЗНЫХ
Н<'IПР<'lВJlениях в З<'Iвисимости от строения кетонов.
По проДУкт<'IМ окисления можно судить о строении кетонов, а так как
кетоны образуются при окислении вторичных спиртов, то, слеДОВ<'Iтельно,
11
о строении этих спиртов.
Г. Реакции полимеризации. Эти реакции хаР<'lктерны только для аль­
дегидов. При действии на альдегиды кислот происходит их тримеризация
(чаСТИ'lНО и тетрамеризация):
3R-CH=0
Мех<'IНИЗМ полимеризации может быть представлен в следующем виде:
R-CH=O
+
R
н+ _
R-CH-OH +R-CH=O..
R-CH-O-!H-OH-
R
+R-CH=P ..
I
R-CH-O-CH-O-CH-OH - I
R
+
CHR
о...... .......0
I
I
+ н+
RHC .............CHR
О
Д. Галогенирование. Апьдегиды и кстоны реагируют с бромом и
ИОДОМ С один<'IКОВОЙ скоростью независимо от концентрации галогена. Ре­
<'IКЦИI1 ускоряются К<'IК кислотами, Т<'IК и ОСНОВ<'IНИЯМИ.
174
подробное изучение этих реакций привело к выводу, что они идут
с пред
В <'~рительным
(С Н )2
превращением карбонильного соединения в енол:
С =<> IH+I или IHcJ)..
-
СН)-С=СН 2 +BBr~.. Ch)--t--СН2Вr~ CH)-С-СН 2 Вr
I
-
ОН
-
I~
О-Н
r
-Н
11
б
LUело ЧИ и КИСЛОТЫ способствуют образованию енольных форм:
снз-сQ-н+но- •• СН з-С=СН z +Н z О
~)
Ь-
о
сн з-с-сн z -н+
11)
о
н+ •
I
Q
СНЗ-С-СН2-Н~ CH,-C=CНz+H
11+
но
+
1
он
Е. Реакции конденсации. 1. Альдегиды в слабоосновной среде (в при­
сутствии ацетата, карбоната или сульфита калия) подвергаются альдоль­
ной конденсации (А. п. Бородин) с образованием альдегидоспиртов
(гидроксиальдегидов), сокращенно называемых альдолями. Альдолu об­
разуются в результате присоединения альдегида к карбонильной группе
другой молекулы альдегида с разрывом связи с-н в а-положении к кар­
бон илу, как это покязано на примере уксусного альдегида:
..........
он
CH,-~H=b + ~~H~-CH=O ~ CH:Ith-СН~-СН=О
~ .... ___ ..... _...... ___ j
ilJII..тL()JII.{~-l"iшроtu:IIМiIt:JIШII.Ii}
itJl1.J\C'-И)\. :\-,"ИJ\l)()КСI\())"гftllitJlI.}
в случае альдолизации других альдегидов, например пропионового,
в реаlЩИIO вступает только группа, няходящаяся в а-положении к карбо­
нилу, тяк как только водородные атомы этой группы в достаточной степе­
ни активируются карбонильной группой:
..
CH:гCH~-CI-IO
!'i
~a
~
I
+ 1-1- Н-СНО ~ CI-I:1-СН 2-СНОН- Н-СНО
1
r
СН:1
СН: 1
:i-r-ИJЦКlкси-:l-МСТНJIIIСIIТИIIЮII.
ЕСJIИ рядом С карбонилом находится четвертичный атом углерода,
<lJlЬДОJJизация
невозможна.
Например,
триметилуксусный
аJJьдегид
(СНз)зс-сно не дает альдоля.
МеХЯIIИЗМ реакции альдольной конденсации, катализируемой основя­
IiИями, следующий. Альдегид проявляет свойства СН-кислоты (см. гл.
1.4). Гидроксильный ион (катализатор) обратимо отрывает протон от
~-углеродного атома:
Н-9: + н-снгсно ?
н-о-н + ён 2-сно
17!i
Образовавшийся еноляm-анион* -
сильный нуклеофил. Он ПРИСое.
диняется к электрофильному атому углерода второй молекулы альдегИДа:
d-
cН~
СНз-С
'Н
_
+ :СН 2-СНО -
н
н
1 . & 0 +НОН
I
.&0
сн э -с-сн 2 -с:? ~СНз-С-СН2-С~
I
'н -НО
I
"
~-H
w
Н
апьдonь
Альдоль при нагревании (без водоотнимающих веществ) отщепляет
воду с образованием непредельного кротонового альдегида:
снз-сн-сн-сно -II.o~ снз-сн=сн-сно
кротоновый 3Jlцn,егид,
_J ______ l_
LQt!. ___J:lJ
2·бyrellаnь
аЛЬДОJl(.,3-ги.щюКсибутilIIМ ....
Поэтому переход от предельного альдегида к непредельному через аль­
доль называется кротоновой конденсацией. Дегидратация происходит
благодаря o'leHb большой подвижности водородных атомов в а-положе­
нии по отношению к карбонильной группе (сверхсопряжение ), причем
разрывается, как и во многих других случаях, ~-связь по отношению
к карбонильной группе.
При действии на альдегиды, способные к альдольной конденсации,
сильных оснований (щелочей) в результате глубокой альдольной (или
кротоновой) поликонденсации происходит осмоление. Альдегиды, не спо­
собные к альдольной конденсации, в этих условиях вступают в реакцию
КаННlщцаро **:
Альдольная конденсация кетонов происходит в более жестких услови­
ях
-
в присутствии оснований, например Ва(ОН)2' При этом образуются
~-кетоноспирты, легко теряющие молекулу воды:
* Енолят-анион
-
сопряженный ион. Для него можно использовать одну из приведенных
Нlfже формул:
_;0
~H2-C'H -
/0CH~C'\.H
или
rL
,./l-
CH2=C'HJ
То, что [JеаiЩIIЯ далее Iщет по углеродному реакционному центру, а не по кислородноМУ,
оБЪЯСllяется деЙСТВI1ем теРМОДИllамического фактора: реакция по углеродному центрУ
экзотеРМllчеCl\ая (-16,7 кДЖ/моль), а по кислород/юму - эндотермическая (83,7 к.l1.Ж/моль~
** В определеНllblХ условиях в реакцию КаННlщцаро вступают и альдегиды, имеющие
в a-положеНIIИ к ка[JБОIlИЛУ водородные атомы. так, например, изо масляный альдегид при
нагревании до 150 ·С с ГИДрОI<CI1ДОМ баРl1Я дает изобутиловый спирт 11 изобутират бариЯ:
4(СНЗ)2СНСНО-+ВИ( ОН)2 {(СНЗ)2СНСОО]2 Ва + 2(CH;I)2CHCH20H.
176
ОН
сНз-9=О + СН;J-n-СНЗ ~ СНз-{-СН2- n-СН з -н,о"
СН З
О
СН З
О
диаЦСТОIiО8Ый. спирт,
4 -rИДРокси -4 -меrnл - 2 - щ~нтаfЮН
окись мсзитила.
4- метиn-3-пентен-2-0Н
В еще более жестких условиях, например при нагревании с концентри­
рованной серной кислотой, кетоны подвергаются межмолекулярной де­
гидратации с образованием непредельных кетонов:
Возможна и конденсация между альдегидами и кетонами, например:
О
О
CHa-СНО + Н2СН-~-СНЗ ~ СНз-СН=СН-~-СНз
3-ПСl1теli-2-оl1
2
ВО Всех этих реакциях вначале идет альдольная конденсация, а затем де­
гидратация образовавшегося гидроксикетона.
2. СЛОЖНОЭфирная конденсация альдегидов проходит при действии
на них алкгоголятов алюминия в неводной среде (В. Е. Тищенко).
~
Н
/C-СН з ~
О
11
СН з-СН 2-О-С-СН з
УКСУСНО3ТНЛОВЫЙ
.фир
Механизм этой реакции в случае применения этилата алюминия можно представить сле­
ДУЮЩИМ образом:
177
н
I
R-C=O
н
+
н
1 •. _
R-С-О-АJ(ОС 2 Н s )з
+ -
R
11...-.-
R-с-о-сLО..l..АJ(оr-н.)з
-
+
1
t
-
_
•
ljI
L ___ .J
R
1
R-СНгО-С=О
-
+
АJ(ОС 2 Н ъ )э
Взаимодействие алюмииия с киcnородиым~атомом альдегида значнтельно увеЛИчивает
электрофильность карбонильного углеродного атома, что облегчает конденсацию, перенос
гндридного иона (указан стрелкой).
Недавио было показано, что НзВО з является эффективным катализатором cnожноэфнр_
ной конденсации. Так, параформальдегнд при нагревании с НаВОз в автоклаве образует ме.
тилформиат:
2СН О
2
НзВО з
с 6Н 12' 250"<:
.. НСООСН з
Ж. ДекарБОllилирование. Альдегиды при нагревании с трис(трифенилфосфин)роднЙ.
хлоридом претерпевают декарбонилирование с образованием углеводородов:
При изучении химических превращений альдегидов и кетонов необхо­
димо обратить внимание на существенные различия между ними. Альде­
гиды легко окисляются без изменения углеродной цепи (реакция серебря­
ного зеркала), кетоны окисляются трудно с разрывом цепи. Альдегиды
полимеризуются под влиянием кислот, образуют альдегидоаммиаки, со
спиртами в присутствии кислот дают ацетали, вступают в сложноэфирную
конденсацию, дают окрашивание с фуксинсернистой кислотой. Кетоны не
способны к подобным превращениям.
Отдельные представители. Применение
Муравьиный альдегид (формальдегид)
специфическим запахом, т. кип.
-21
-
бесцветный газ с резк~м
ос. Он ядовит, действует раздражаю­
ще на слизистые оболочки глаз и дыхательных путей. Хорошо растворим в
воде, 40%-ный водный раствор формальдегида называется формалином.
В промышленности формальдегид получают двумя методами
-
непоЛ­
ным окислением метана и его некоторых гомологов и каталитическИМ
окислением или дегидрированием метанола (при
650-700 ос над сереб­
ряным катализатором):
СНзОН ~ Н 2 +Н 2 СО.
Благодаря отсутствию алкильного радикала формальдегиду присущи
некоторые особые свойства.
1.
В щелочной среде он претерпевает реакцию окисления
новления (реакция Канниццаро):
178
-
восста­
ОДНИ молекулЫ формальдегиuда восстанавливаются другими, окисляю­
~ими
сЯ при этом до муравьинои кислоты:
Н-С=О
-
+ НО
Е
...
6
I
Н-С-ОН
А
h
г'\ г-,
о)
I
СИ =O+IН:IC-OH-CH,O-+HCOOH
• 2
L..T.J
L.. ______ .J
I
• СН,ОН+НСОО-
Н
перенос гидридноro иона
2. При легком нагревании формальдегида (формалина) с аммиаком
получается гексаметилентетрамин (уроmроnин.), синтезированный впер­
вые А. М. Бутлеровым:
уротропии
Уротропин в больших количествах применяют в производстве фенол­
формальдегидных смол, взрывчатых веществ (гексогена, получаемого ни­
трованием уротропина)
+
(3CH zO
+
NНэ)
гсксаген
в медицине (в качестве мочегонного средства, как составная часть антигрип­
ПОЗНого препарата кальцекса, при лечении почечных заболеваний и др.).
3. В щелочной среде, например в присутствии известкового молока,
"ак это впервые было показано А. М. Бутлеровым, формальдегид подвер­
гается альдолизации с образованием оксиальдегидов вплоть до гексоз
и еще более сложных сахаров, например:
С 'I О +СIlР
г
i
-........,.
СН ОН-С
~
,0 +СН.D
Л СН.=О
~ СН ОН-СНОН-С"'" ~
'Н
2
'Н
,о
... --;;.. СН 2 ОН- (СНОН)з-С,н
геКСО:lИ
179
В присутствии щелочей формальдегид может конденсироваться и сдру_
гими альдегидами, образуя многоатомные спирты. Так, конденсацие!\
формальдегида с уксусным альдегидом получают четырехаТОМНbJli
спирт - nенmаэрumрum C(CH 2 0Hk
СН:\СНО + ЗН 2 СО
ИJII,J\ОJIЮНI\ШI
~ (НОСН 2 ).\ССНО
•
(НОСН 2 ).\ССНО + Н 2 СО;\ +НО- ~ (НОСН 2 )4 С + НСООрС8КI\И>l
•
КИIIIIИI\ЩIРО
Пентаэритрит используется для получения смол и весьма сильного
взрывчатого вещества - тетранитропентаэритрита (ТЭН) C(CH 20N0 2
4. Формальдегид способен к полимеризации с образованием цикличе­
ских и линейных полимеров. Под влиянием разбавленных кислот он обра­
k
зует циклический кристаллический (т. пл.
63
ОС) тример, называемый
mрuоксuм.еmuленом.:
Н 2 СО ~ снрн ~ снго-снрн щ:о>
СН 2
~ сн 2-о-сн 2-о-снрн ~
0/"0
I
I
+ н+
Н 2 С,,/СН 2
О
Тример не проявляет химических свойств альдегида, однако способен
к деполимеризации с регенерацией формальдегида.
Совершенно сухой газообразный формальдегид в присутствии специ­
фических катализаторов (например, карбонила железа) образует высоко­
молекулярный полиформальдегид с т. пл.
н 2 со ~
Hi-6
185 ОС:
,,{=о> -н 2 с-0-сн 2-о- ~
II,C=O> ...-Н 2 С-0-СН 2-О-(-Н 2 С-0-)"",
Он не растворим при обычных температурах ни в одном растворителе,
обладает высокой прочностью и применяется для изготовления синтети­
ческого волокна и разнообразных изделий (труб, листов и т. д.).
Полимеры формальдегида, образующиеся в водных растворах, имеюТ
обшую формулу НО(СН 2 -О-СН 2 -О- )nН, где
ких пределах. При
n
колеблется в широ­
n от 8 до 100 этот полимер называется
параформальде­
гидом (парафt>рмом). Он выпадает в виде белого осадка при стоянии коН­
центрированных растворов формалина и имеет т. пл.
121
ос.
При нагревании с разбавленной серной кислотой парформ и триокси­
метилен нацело превращаются в газообразный формальдегид, на чем и
основано их применение в качестве транспортабельного сырья для поЛУ­
чения формальдегида.
Спрессованные таблетки и палочки уротропина, а также параформа
или триоксиметилена применяются в качестве горючего (сухой спирт).
180
5 формальдегид способен вступать в раЗЛИЧНblе реакции конденсации с
.
образО
ванием синтетических смол, широко применяеМblХ в ПРОМblшленно-
Та К
поликонденсациеи
u
ф.
ф
ф
ормальдегида с енолом получают фенол ор-
'
альдегидные СМОЛbl, с мочевинои или меламином -
ети.
u
кар
6aAtu дН,ые см,олы.
м б Продуктом конденсации формальдегида с изобутиленом (в присут­
~и H2S04) является 4,4-диметил-l,3-диоксан, КОТОРblЙ при нагрева­
~:: до 200-240 ОС в присутствии катализаторов (Si0 2 +Н4Р207) разла­
гаетсЯ с образованием изопрена (гл. 1.3).
7.
О раЗЛИЧНblХ синтезах на основе формальдегида сказано Вblше, на­
пример о производстве глицерина и его промеЖУТОЧНblХ продуктах. О не­
которых других синтезах, например нитро- и аминоспиртов, см. гл. 12.
Формалин широко применяется в качестве дезинфицирующего веще­
-ства ДЛЯ дезинфекции зерно- и овощехранилищ, парников, теплиц, ДIIЯ
протравливания семян и т. д.
Уксусный альдегид, ацетальдегид СНзСНО,
-
жидкость с резким не­
прятным запахом. Т. кип. 21 Ос. ПаРbl ацетальдегида ВblЗblвают раздра­
жение СЛИЗИСТblХ оболочек, удушье, головную боль. Ацетальдегид хорошо
растворим в воде и во многих органических растворителях.
ПРОМblшленные методЬ! ПОЛУ'lения ацетальдегида уже бblЛИ рассмот­
рены: гидратация ацетилена, дегидрирование этилового спирта, изомери­
зация окиси этилена (см. схему
5),
каталитическое окисление воздухом
предельных углеводородов.
В последнее время ацетальдегид получают окислением этилена кисло­
родом воздуха в присутствии катализатора по схеме:
СН 2 =СН 2 +Н 2 О
+ PdCI 2 - - - . CH:1-CHO +
Pd + 2CLICl 2
---.
2НСI
+ Р{I
2CuCI + PdCI 2
2CLICI + 2НСI + 1/202 ---. 2CuCI 2 + H:tO
2СН 2 =СН 2
+02
PdCI 2
CIICI 2
12СНаСНО
другие 1-алкеНbI образуют в этой реакции метилкеТОНbI.
Из ацетальдегида в ПРОМblшлеННblХ масштабах получают уксусную кис­
лоту, УКСУСНblЙ ангидрид, ЭТИЛОВblЙ спирт, альдоль, бутиловый спирт, аце­
тали, этилацетат , пентаэритрит и ряд других веществ.
Подобно формальдегиду, он конденсируется с фенолом, аминами и дру­
ГИми веществами, образуя синтетические смолы, которые используются
в Производстве раЗЛИ'lНblХ полимеРНblХ материалов.
I10ддействием небольшого количества серной КИСЛОТbI ацетальдегид по­
Лимеризуется в nаральдегuд (С 2 Н 4 ОЗ)3 И м,етальдегид (С 2 Н 4 0)4; количе­
CTB<t последнего возрастают с понижением температуры (до -10 ОС):
Г
I
J
ЗСН:гСН=О ~ З~НгСН-О-
l~-CH:I
~
t _
I
CH:гC~/ Н-СН:\
О
IIIII»LIII.JIСГJЩ
181
Паральдегид - жидкость с т. кип. 124,5 ОС, метальдегид - КРИстал_
лическое вещество. При нагревании со следами кислоты оба эти вещестВа
деполимеризуются, образуя ацетальдегид. Из паральдегида и аммиака по­
лучают 2-метил-5-винилпиридин (гл. 30.1), используемый при СИНтезе
сополимеров
-
синтетических каучуков.
Трихлоруксусный альдегид, хлораль ССlзСНО, получается ХЛОРИро_
ванием этилового спирта (гл. 3.1).
Хлораль бесцветная жидкость с резким запахом; с водой образует
кристаллический гидрат - хлоральгидрат. Устойчивость хлораЛЬГидра_
та объясняется усилением ЭJ\ектроноакцепторных свойств карбонильного
углерода под влиянием сильного индукционного эффекта хлора:
Cl,
а.
нон
CI-C-CH - - ССl э -СН(ОН)2
Cl'
ga-
Обладает снотворным действием. Конденсацией хлораля с хлорбензо­
лом получают в промышленных масштабах инсектициды (с.
441).
При действии на хлораль щелочей образуется хлороформ:
(J
СCI,\СНО+ОН- Е
•
,.
CCI,\t-н МС;VIСIIIЮ" CCI~+HCOOH?CHCI'I+HCOO-
filACТlIll'
•
•
Ацетон СНзСОСН з - бесцветная жидкость с характерным запахом;
56,1 ОС, пл. 0,798. Хорошо растворим в воде и во многих органиче­
т. кип.
ских растворителях.
Ацетон получают:
1) из ИЗОПРОПИJIОВОГО спирта - ОКИСJIением или дегидрированием;
2) ОКИСJlением изопропилбензола, получаемого алкилировянием бен­
зола, наряду с фенолом (гл. 20.1);
3) ацетон-бутянольным брожением углеводов (гл. 33.1).
Ацетон в кячестве растворителя применяется в очень больших количе­
ствах в лакокрясочной
промышленности,
в производствах ацетятного
шелка, кинопленки, бездымного пороха (пироксилина), для растворения
ацетилена (в баллонах) и т. д. Он служит исходным продуктом при произ­
водстве небьющегося оргаНИ'lеского стекла, кетеня и т. д.
2.
Н ЕПРfДEJ1ЬНЫЕ АЛЬДЕГИДЫ И КЕТОНЫ
Важнейшие свойства непредельных альдегидов рассмотрим на примере
только акролеиня и кротонового альдегида.
Акролеин. Существует несколько методов ПОЛУ'lения якролеина.
1. Альдольная конденсация формальдегида с уксусным альдегидом
приводит к гидроксипропионовому альдегиду, который далее подвергается
дегидратации:
CH~=O + HCH~CHO ~ CH~OH-CH~-CHO ~ H~O +CH~=CH-CHO.
182
2.
Прямое каталитическое окисление пропилена
СН 1 = СНСН:!
~CH1 = СНСНО + Н 1 О.
+ 02
260-270·С
3 Дегидратация глицерина (гл. 3.4).
д'кролеин - бесцветная жидкость с т. кип. 52,5 ос, пл. 0,841, очень
Ры м
запахом, раздражающим слизистые оболочки.
ост
Акролеину присущи
реакции,
u
своиственные этиленовым углеводоро-
дам и альдегидам. Взаимное влияние двойной этиленовой связи и карбо­
нильной группы находит отражение в некоторых особенностях акролеина.
1. Порядок присоединения НВг не соответствует правилу МаРКОВIIИкова:
r---~--i,
CHz=CH-С=О
~L
I
н'
+ HBr
.I
I
_ _ _ _ _ _ _ _ _ J,
~-бромпроПиОН08.. iI
uьдеl'ИД,
Э-6ромпропаналь
в случае акролеина, кротонового альдегида и других непредельных сое­
динений с сопряженными двойной и карбонильной связями присоединение
галогеноводородов происходит по концам сопряженной системы, ПРИ'lем
ПОJlожительно поляризованный водород направляется к отрицатеJlЬНО по­
ляризованному кислороду, а отрицательно поляризованный галоген
-
к
положительно поляризованному углероду карбонильного соединения:
3+
а
",,4-
CH 2 =CH-СН=о
+
1+1-
HBr---+- CH 2 Br-СН=GН-ОН ~СН 2 Вr-СН 2-СНО
Образующаяся енольная форма альдегида немедленно превращается в
более устойчивую карбонильную форму.
Таким образом, хотя водород и не направляется к наиболее гидрогени­
зированному атому углерода, как этого требует правило Марковникова,
тем не менее присоединение происходит в соответствии с электронной по­
ляризацией реагирующих частиц, т. е. по существу в соответствии с той
БОJlее общей закономерностью, которая проявляется и в реакциях присо­
еДинения по правилу Марковникова галогеноводородов к несимметрич­
ным олефинам.
2. СИНИJlьная кислота присоединяется к акролеину по карбонильной
.
ГРУПпе:
СН 2 =СН-СНО
+HCN --+ CH 2 =CH-CHOH-CN.
3. ГИДРОСУЛЬфит натрия присоединяется не только по карбонильной
ГРУПпе, но и по этиленовой связи:
,
он
I
СНг=сн-сн=о + 2NaHSO;j ~ NaO:IS-СНгСНгСН-SО:INIt
183
4.
При хранении акролеин очень легко полимеризуется. В ПРИСУТСТВIfЦ
.
незначительных количеств гидрохинона он более стоек.
Акролеин используется для получения пластмасс, отличающихся боль_
шой твердостью. При конденсации акролеина с пентаэритритом получают
полимеры, по внешнему виду похожие на обычное стекло.
Предложено использовать акролеин. в качестве исходного вещеСТва
в синтезе глицерина, а также меmион.ин.а (с.
219).
Кроmон.О8ЫЙ альдегид снз-сн=сн-сно (2-бутеналь) - жид­
кость с резким запахом; т. кип. 105 ос. Получается кротоновой конденса_
lщей ацетальдегида. Применяется дlIя получения масляного альдегида
бутанола, масляной кислоты, а также малеинового ангидрида (гл. 6.5). '
МеmUЛ8ин.uлкеmон.,
3-бутен-2-0Н
СН з -СО-Cl-I=СН 2 , -
про­
стейший представитель не насыщенных кетонов. Получается преимущест­
венно двумя способами:
1)
гидратацией винилацетилена:
,
не == с - сн
2)
Н 2О
= СН 2 ---тн;;~снз -
СО
-
сн
= сн 2 :
конденсацией формальдегида с ацетоном и последующей дегидрата­
цией (при нагревании) образовавшегося кетоспирта:
---) сн 2 =сн-со-сн з + н 2 о.
Метилвинилкетон
-
жидкость с т. Кип.
81
ос. Проявляет свойства
как кетона, так и этиленовых соединений. В отличие от акролеина метил­
ВlIнилкетон присоединяет
HCN
не по карбонильной группе, а по двойной
связи:
Метилвинилкетон легко полимеризуется в бесцветную стекловидНУЮ
массу, применяемую в производстве изделий из полимерных материалов.
3.
Кетены
-
КЕТЕНЫ
своеобразные соединения, напоминающие по строению не­
предеЛЫ1Ь1е кетоны и аллены.
Кеmен. -
первый представитель ряда кетенов. Это газ с резким запа­
хом. Его в больших количествах получают пиролизом ацетона:
снз-со-сн з
600-700 ос
- - -_ _ СН 4 +СН 2 =С=О.
Кетен не проявляет обычных свойств кетонов -
не дает оксима, фе­
нилгидразона, отличается большой СКЛОНностью к реакциям присоедии е -
ния (обычно по связи с=о). При хранении образует димер 184
диKeгneH .
В
хи
.. иуескоЙ
..·
промышленности из кете на в крупных масштабах полуu
ксусную кислоту, уксусныи ангидрид, этилацетат, дикетен, ацетоук-
уа~нть;й эфир (см. гл. 12) и ~ругие вещества, являющиеся полупродуктами
су
в про
изводстве красителеи, лекарственных веществ (например, СИlпез
5 3)
черездикетен, см. гл . .
:
сн 2=с=о
1
Jно-со-сн з
сн:гсо-о-со-снз
УКСУСlJая
уксусный аНГНЩJIIД
зтилацетат
кислота
днкетен
4.
ДИAJ1ЬДЕГИДЫ И ДИКЕТОНЫ
Диальдегиды и дикетоны - соединения, содержащие две карбоюlЛЬ­
ные группы в молекуле. ПО взаимному положению этих групп различают
а-, Р-, у- и т. д. диальдегиды и дикетоны. Приведем несколько примеров
диальдегидов и дикетонов:
О
О
11
11
ГЛИОl\саль, или этандиаль (ct-диальдегид)
Н-С-С-+!
о
о
11
11
малоновый альдеГlЩ (!3-диальдегид)
H-С-Cl-lгС-+!
о
о
11
11
н-с-снгснгс-+!
о
янтарный альдегид, 1,4-6утандиаль (у-диальдегид)
о
диацетил
11 11
Снз-с-с-сн:!
*,
6угандион (ct-дикетон)
ацетилацетон , 2,4 - пентандион (!3-Дlfкетон)
с
о
о
11
ацеТОНlfлацетон, 2,5-гександион (у-дикетон)
Н з-ё-сн 2-сн 2-с-сн з
11
Глuоксаль получают осторожным окислением таких органических сое­
Динений, как спирт, уксусный альдегид, этиленгликоль и др., ДИОКСI1ДОМ
селена или кислородом воздуха в присутствии катализатора:
МеДIJЫЙ
____
•
носн 2 -сн,он
-
_
катаJlиза~ НСО-СНО+2Н 2 О.
250-300 ОС
СН,-с=о- остаток УКСУСНОЙ кислоты, называется ацетилом.
185
Это твердое вещество желтого цвета с т. пл.
15 ос
и т. кип.
50,4 OC~
в расплавленном состоянии очень бblСТРО полимеризуется в твердый бet­
цвеТНblЙ полимер (тример ).
Глиоксаль обладает всеми свойствами альдегидов. В реакции МОЖет
участвовать как одна, так и две карБОНИЛЬНblе ГРУППbl, например:
NOH NOH
11
11
NOH
11
NII.oII
сн-сно
11
нс-сн
l".ПIЮКI.:IiМ,
МШltЮКl,;llМ
J\ИОКСИМ
"JlИОК!.:iШSl
сно-сно
I"JIИIIКСНJISI
CH-CH=N-NH-C Н
11
6 5
N-NH-C!;H"
сн-сно
11. N-NII-C .11,
11
N-NH-C(;H"
фСllНJll'Нltl1itЖНI
При воздействии концентрированного раствора гидроксида калия гли­
оксаль превращается в оксиуксусную (г ликолевую) кислоту (внутримоле­
кулярное окисление -
восстановление, реакция Канниццаро):
сно - CHO~ HOCH~ - соон.
(КОН)
Дuацеmuл получают из метилэтилкетона обработкой азотистой кисло­
той или ее аМИЛОВblМ эфиром:
IIONO
cн.-~-CH-CH .
.\
CH:I-~-CH2-CH:\
<:,,11 ONO
О
11
О
1
.1
NO
СН:ГП-ТН-СН:I
-С) 11101 1
О
NO
Образующийся нumрозокеmон изомеризуется в монооксим дикетона:
CH.\-~-CH-Cн.\ ~ Cн.\-~-(."'-CH.\
.
11
О
1
NO
.
.
11
О
11
.
NOH
При кипячении последнего с разбавленной серной кислотой получают­
ся диацетил и гидроксиламин:
cн.-~-~"'-cн.
.\
11
О
Диацетил -
11
.\
NOH
(II,SO,)
11,0
~ сн.-с-(."'-сн + NH он
.\
11 11
з
2
О
О
желтая жидкость с острым запахом, т. кип. 88 0 с. ПарЫ
диацетила имеют жеЛТblЙ цвет.
Диацетил обладает свойствами кетонов, причем в реакцию может ВСТУ­
пать или одна, или обе карБОНИЛЬНblе ГРУППbl. Например, диацетил с гид-
186
М ином может образовать моно- или диоксим, последний наЗblваР оксила.меmuлглuоксu.мом:
ется
дu
Nllpll
сн·гс-с-сн!
"" -с
.
о
.
о
2Nllpll
CH-~-~-CH
11
.1
N-OH
11
.1
О
С Н:I-п--п-СН:1
NOH
NOH
illiМСТIIJII"JIШ,КСНМ
Диметилглиоксим с солями никеля дает яркий kpacho-фиолеТОВblЙ
кристаллический осадок. Эта реакция, ОТКРblтая Л. А. ЧугаеВblМ, служит
ДЛЯ качественного и количественного определения никеля. Оса­
ДОК - внутрикомлексная COJlb (клешневидное, хелаmн.ое соединение):
/СН:!
H:1C\
С=О
О-С
Н< \N/ \Н
'с-с! '0=/
НаС/
\СН:!
ДиацеТИJJ применяют д.ля придания соответствующего запаха маргари­
ну и сырам.
АцеmТlЛацеmон. - жидкость, обладающая ПРИЯТНblМ запахом, т. кип.
137 0 с. Получается конденсацией этилацетата с ацетоном в присутствии
аЛКОголята натрия:
сн-с-ос. Н" + нсн.-с-ен N~.,OC211r, ~ СН-С-СН-С-СН
.!
~
l.,
2
~
.1 -С,IIr,ОIl
.1
~
2
~
.1
Механизм этоl1 реаКЦliИ представляется в следУющем виде. Анион 'пилата отщепляет
протон от молекулы кетона (кетон является более кислым соединением. 'leM сложный эфир)
с ОбразоваНllем реакционноспособного аниона, которыl1. будучи нуклеофильным реагентом.
ПрнсоеДlIняется
1(
электрофильному углеродУ ~1фира:
СНгСО-СНа
+ с 2 н,р- ~ :ёН 2-СО-СНа + C2Hr,OH
О
~ CH:I-~-CH2-CO-CH:1 + с2 н,р-
IIТ.Д.
АЦСТИJlацетон, как и другие анаЛОГИЧНblе Р-дикетоны, реагирует с учас­
TlieM одной или двух карбонильных групп. Но д.ля него характернЬ! и свойст­
Ва liепредельного кетоспирта, что оБУCJIовлено способностью Р-дикетонов
187
к таутомерному превращению -
самопроизвольной обратимой paBHQ.1
кето-енольноu таутО'м'ерuu:
':
весной изомеризации -
.,
Н з С,
С=СН
11
\ .../
11
о
о
диксmlll1311 форма (15')(,)
'C-СНз
if
СНЗ-С- СНZ-С- СН З
kcto-еlЮJll>llаll форма (85')(,)*
в свободном виде ацетил ацетон представляет собой
равновесную
смесь дикетона инепредельного кетоспирта с сильным преобладанием по­
следнего. Большая устойчивость енольной формы (в отличие от монокето.
нов, гл.
5.1)
обусловлена возможностью образования внутримолекуляр­
ной водородной связи.
В химические превращения ацетилацетон вступает и как дикетон и как
непредельный кетоспирт.
ТIIК. наПРllмер. при взаllмодействии с избытком анилина ацетилацетон реагирует какди·
кетон: в реакцию ВСТУПIIЮТ обе карбонильные группы:
21·I,NCI;II,. ЭI С"Н
С ("Н
С СН .\
СН.\-С-СН.-С-СН.
,
I
I()
'\- - 2- 'о"
11
'-1,
'11
11
'
б
N-C,;H" N-С';Нfi
-
J1И~ШIUI
fII~СПlJlаЦСnJIIi1
Сдругоil стороны. при взаимодействии с металлическим натрием ацетилацетон реагирует
как непредельный спирт. образуя енолят. С раствором хлорида железа FeCl a он дает интен­
сивную окраску. специфическуюД/lЯ соединений. содержащих ГИЩJOКСIIЛЬНУЮ группуу атома
углерода СДВОЙНОII связью
11 т.
п.
НаТРl1ltенолят aцeТl1JlaцeTOHa
npll ВЗlIlIмодеЙСТВIIИ с галогеналкилами превращается
валкилзамещенный ацетилацетон. т. е. наблюдается замещение не у атома KIICJlOpOдa.
11 у атома углерода:
·СН-С-СН=С-СН
.\
"
1
ONa
О
,\
+
С 2 Н.<,Вг ~
I
2:\
-1
5
СН-С-СН-С-СН
,\ "1
О
"
С 2 Н" О
.\
+ NaBr
~11tJlаltСТИJlаII.tVn)II.
:4·'iTIIJI-2,4-IIСllТаIIЛIЮII
Это ПРОЯВJIеНllе двойственной реакционной способlЮСТlI
-
ШlбlliJенmносmu
-
аниО·
на аЛКОГOJlЯТII aцeТl1JlaцeToHa:
СН\-С-СН=С-СН\ ~CH\-C-CH-C-CH\
•
'"
о
ДрУГllе меТIIЛЛЫ -
61_'
'"
о
железо. медь. IIЛЮМИНl1It. хром и т. Д. -
".
о
ТlIкже образуют енолятbI.
Эти еноляты 11меют строеиие вунтрикомплеl<СНЫХ хелаmНI>lХ солей ТI1Па:
.. Непредельные CnltpTbI этиленового ряда по системаТИ'lеской номенклатуре имеJ01
окончание -ен(}л.
188
MHOrl 1e из них перегоняются или возгоняются без разложения, 'по было I1спользовано Д/IЯ
• ого определения валентности некоторых металлов (HanpllMep, аЛЮМllНI1Я 11 беРIIЛЛI1Я).
то 'н
Подробнее
о
•
I(ето-енольнои
таутомерии
• •
•
реаКЦIЮННОII
J.J двоиствеННОl1
спосо
б
НОСТI1
см. гл. 11.
АцетиЛ ацетон быстро ГI1ДРОЛllзуется теплыми едкими щелочами с образованием СОЛI1 УК-
сусной кислоты и ацетона:
CH:I-CO-CH~-CO-CH:I
+NaOH_CH:1COONa
+ CH:1-CO-CH:1·
Процесс IIдет по следующей схеме:
СН,
н-о.. :
1 .
+
..
СН,
1 .
С-СН.-С-СН
\\
2
11" - - H~O-CQH-C-CH
.. 1
2
11
.,
Со
О
<";Q:
О
--
СН:,
..
1
..
11
-Н-О-С
+ :Сн . -С-СН,
•
11
.
О
О
-,..~
~y.Oy.
NaO-С-СН
11
СН,-С-СН,
.
3
11
.
О
О
ГЛАВА
6
одно. И МНОГООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
И ИХ ПРОИЗВОДНЫЕ
Органические карбоновые кислоты характеризуются наЛИ'lием кар-
~O
ОО/(СUЛЬ/iОЙ группы -с"
дв
ОН
. По
числу этих групп различают ОДНО-,
М УХ-. Трех- и вообще многоосновные кислоты. Органические кислоты
быть предельными (насыщенными) - карбоксил связан с алки­
r ОМ - и непредельными (ненасыщенными) - карбоксил связан с не­
JI oryт
'рел.еm,ным радикалом.
189
ОДНООСНО8НЫЕ ПРЕдЕЛЬНЫЕ КДРБОНО8ЫЕ КИСЛОТЫ
1.
С?дноосновные предель~ые карбоновые кислоты имеют общую ФОРМУ.I
лу С//Н 2 //О 2 ИЛИ С//Н 2 // + 1СООН.
'
Изомерия. Номенклатура
Кислоты с числом углеродных атомов меньше 'lетырех не имеют ИЗОМе.
ров, кислота с четырьмя aтOMaMII углерода имеет два изомера, для кислот
общей формулы С 5 Н I()O:Z известно четыре изомера. Число изомеров, как
и следовало ожидать, увеличивается
110
мере возрастания длины углерод.
ной цепи.
Кислоты от С 1дО С 3 имеют следующие формулы и названия (тривиаль,
ная и систематическая номенклатура):
н-соон
мураВЫIная, метановая кислота
СН:!-СООН
УI{сусная. ,тановая ЮIслота
CH:!-ClI~-СООIl
ПРОПl10новая. пропановая Кllслота
CI-I:!-CI-I~-CH~-COOH
масляная. бутаНОВilЯ l<ltслота
:,
:.!
I
СI-I.\-СН-(ООН
,
1
\\З0масляная. ДllмеТI\ЛУI{сусная. 2-меПlлпропановая кислота
СН,
CH:!-CH~-CB~-CH~-COOH
1
:,
I
~
CB:г~B-CНrCOOH
валериановая. l1ентановая ЮIслота
IIЗОПРОПIIлуксусная, З,меТl\лбутановая Юlслота
СН:,
:,
'\
~
\
СI-I.,-СН:,СВ-СООН
,
-
меПIЛ'НItЛУI{сусная. 2,меТI\лбутановая ЮICJ\ота
1
св:,
св"
:,
21' \
СI-I.,-С-СООI-I
,
1
тримеТИЛУКСУСI1ая. 2,2-диметltлпропановая
ЮIслота
СН:,
По систематической номенклатуре кислоты ннзывают по соответстВУ­
ющим предельным углеводородам с добавлением окончания -овая и слова
кислота, г.ричем счет цепи начинается от карбоксильной гру"пы.
Тривиальные название некоторых других кислот:
CI-I:!-(CI-I~)4-COOI-I
I{апроновая кислота
CI-I:1-(CI-I 2);;-COOI-I
энантовая кислота
CHa-{ СН2)\lГСООН
лаурииовая кислота
CH:I-(CH2)14-COOH
паЛЬМIПllновая Юlслота
CI-I:I-(СН2)lli-СООI-I
стеариновая Кllслота
190
Радикалы кислот
-
ацuлы
О
н-с(
-
имеют следующие названия:
форм ил, метаноил (радикал муравьиной кислоты)
ацетил, этаноил (радикал уксусной кислоты)
,/,0
снг-с,,"
'н
О
С#'
пропионил, пропанонл (раДl1кал пропионовоil кнслоты)
сн:,- С ~--,,"
О
СН:,-сн 2-
#'
сн 2 -С"
бутирил, бутаноил (радикал масляной КIIСЛОТЫ)
СпосоБЫПОJlучения
Известен ряд общих способов получения кислот. Многие из них уже
были рассмотрены ранее:
1.
2.
Окисление первичных спиртов (гл.
Окисление альдегидов ( гл. 5.1).
3.
Синтез через металлоргянические соединения, например:
3.1).
О
CH,Li +
4.
О
С0 2 ~ CH:I-~-ОLi ~ CH:I~-OH +
Гидролиз (омыление) нитрилов
(R-CN),
LiCI
в свою очередь получае·
мых взяимодействием галогеналкилов с цианидом калия:
R-CI + KCN __ R-C.... N +
R-С=аN
КСI
+ 2Н 2 О __ R-COOH + NH:\ (или R-COONH 4 )
Реакцию проводят, нагревая нитрилы с водными растворами мине·
paJII>HbIX кислот или щелочей. При этом в кислой среде азот выделяется
в виде аммонийной соли, а в щелочной
Кислота же получается в виде соли:
~
КОII
IIХ
R-C=N +
2Нр
-
в виде аммонийного основания,
R-COOH
R-COOK + NHpH
В Промышленности КИСJlОТЫ получают следующими способами:
1. Окисление парафиновых углеводородов воздухом или техническим
КИСлородом при высокой температуре в присутствии или в отсутствие ка·
тализяторов. Низшие углеводороды (с числом атомов углерода до 8) окис·
J1ЯЮТСЯ главным образом в паровой фазе, при повышенном давлении, я
~ыulиеe углеводороды (парафины СI6Н34-СЗОН62' ДЛЯ ПОЛУ'lения кислот
loH2U02-С20Н4002) - преимущественно в жидкой фазе. Окисление
~РОВОДЯТ при температуре около 500 ос и ятмосферном давлении или при
00 ОС под давлением 12-20 МПа (130-200 ятм). Катализаторами
191
служат металлы, их соли и оксиды. При получении высших жирных КИСЛor';
130-150 ос. n
в присутствии катализаторов температуру снижают до
окислении угле~одородов обычно образуется смесь кислот с различн:
количеством углеродных атомов.
2.
ОКСОСЩlТез применяют в двух вариантах:
а) с его помощью получают альдегиды и окисляют их в соотвеТСТ8У1О_
щие кислоты;
б) взаимодействием олефинов с оксидом углерода (11) и ВОдЯным Па­
ром в присутствии катализаторов (тетракарбонил никеля, Н з РО 4 и др.)
при температуре
300-400 ос
и давлении
2-5·107
Па
(200-500 ат_)
получают смесь кислот нормального и изостроения, например:
Физические свойства
Низшие кислоты с числом атомов углерода до
3-
легкоподвижные
бесцветные жидкости с характерным острым запахом; они смешиваются
с водой в любых соотношениях. Большинс,во кислот С 4 -C g масляни­
стые жидкости с неприятным запахом. Растворимость их в воде сильно
уменьшается по мере возрастания молекулярных масс. Кислоты от СlO
и выше - твердые вещества, нерастворимые в воде. Плотности муравьи­
ной и уксусной кислот больше единицы, остальных меньше единицы.
Температура кипения кислот возрастает По мере увеличения молекуляр­
ной массы, при одном и том же числе углеродных атомов кислоты норма­
льного строения кипят при более высокой температуре, чем кислоты изо­
строения. Например, валериановая кислота СНЗ-(СН2)З-СООН ки­
пит при 186,0 ос, а изомерная ей триметилуксусная (СНз)зС-СООН
при 163,7°С.
Тnn.
У КИслот нормального строения на­
·С
блюдае,ся
20
О f--,!-L\-.~.L....:i:-~'rI-~~~;11 n
-20
выше, чем температура плавлениЯ
соседних кислот с нечетным числоМ
углеродных атомов. КаПРИЛОi'Jая кисло­
та
-60
товая
C7H l5 COOH плавится, например.
16,2 ос, а рядом стоящие энан­
при
46.
Зависимость
темпераТУрbl
плавления ОДИООСИОВИblХ кислот от числа
атомов углерода в молекуле КИСЛОТbl
192
закономер­
С четныlM числом углеродных атомов
-40
PIfC.
интересная
ность: температура плавления кислот
СБН1зСООН
и
пеларгоновая
CSH l7 COOH имеют соответственНО
Э
т. пл. -10,5 и 12,5°С (рис. 46). та
явление объясняют различным ПРО'
еННЫМ расположением метильной и карбоксильной групп отно­
CTpaHC~~ друг друга. В кислотах четного ряда они расположены по разные
Сf!тел: ы оТ оси молекулЫ, анечетного - по одну сторону, что схематиче­
старо
сКН дЛЯ
приведенных примеров можно изобразить так:
СН СН 2
СН
,2/,2/,
/Н СН
С 3
СН
2
2
энанrо вая
СООН
кислота
СН 2 СН 2 СН 2 СООН
/,/,/,/
СН з СН 2 СН 2 СН 2
СН 2 СН 2 СН 2 СН 2
/'-/'-/'-/'-
СН з СН 2 СН 2 СН 2 СООН
каПРИIIовая
neлaргоновая
КIIСЛ0f8
КIIСЛ0f8
Благодаря более симметричному строению молекулы кислоты с четным
числом углеродных атомов сильнее взаимодействуют между собой в крис­
таллическоИ решетке и ее труднее разрушить при нагревании.
Сравнение температур кипения кислот и спиртов с одинаковым числом
углеродных атомов показывает, что кислоты кипят при значительно более
высоких температурах, чем спирты. Например, температура кипения ук­
сусной кислоты 118,5 ОС, а этилового спирта 78,3 ОС. Это можно объяс­
нить тем, что молекулы кислот более ассоциированы. Об этом свидетель­
ствуют также молекулярная масса и плотность паров некоторых кислот.
Экспериментальное определение этих констант приводит к удвоенны1M
величинам.
Химические свойства
Кислотный характер карбоновых кислот ярко выражен. Это объясня­
ется взаимным влиянием атомов в карбоксильной группе: в ней электрон­
ная плотность смещена в сторону наиболее электроноакцепторного ато­
ма
-
кислорода:
~B­
~O
-c~
'-..n В +
О-Н
ЭТО ослабляет связь между кислородом и водородом и облегчает отде­
ление иона водорода, т. е. диссоциацию кислоты:
R-COOH +:t R-COO- + Н+.
Связи между атомами углерода и кислорода в карбоксильной группе
в СООтветствии с обычной формулой не равноценны, тогда как в карбокси­
латном ионе оба атома кислорода равноценны: три р-электрона делокали30ваны между тремя ядрами (рис. 47):
Ве Степень диссоциации, а следовательно, и сила кислот зависят также от
личины и характера радикала, связанного с карбоксильной группой:
7 Зlllr. !8!
J93
~-g,:---
константа диссоциации кислот немного YMeIfЬ~
ется с увеличением радикала. Например, Д/)Я
-c~~(\
\)
,\
'\
.
лее
сильной
(К=
PIIC.
yii
сусной кислоты К = 1,76' 10-5, а ДЛЯ валеРиаИ$
вой - К = 1,50' 10-5. Из жирных кислот наи6&!
47. СхеМII строения
является
муравьиная
КИСЛОТа
2,14 • 10-4). В общем органические кар"боol
новые кислоты являются слабыми кислотами.
КllрБОКСИЛIIТНОГО Iюна
С
ила кар
б
оновых кислот увеличивается, еСЛIt
водородные атомы радикала, особенно у CoceДНe~
го с карбоксильной группой углерода, замещаются электроноакцепторны.
.'
ми (электроноотягивающими) атомами или группами.
С участием карбоксильной группы кислоты образуют ряд nроизводнщ
кислот: соли, галогенангидриды, ангидриды, сложные эфиры, амиды, ни~
трилы и др.
1.
Карбоновые кислоты способны образовывать соли с металлами;
с их оксидами и гидроксидами:
CH:1-COOH +NaOH - . CH:1-COONII +
Н 2 О.
инстит IШТI'ИII
Свойства солей карбоновых кислот уже рассматривались ранее. Пиро·
лизом натриевых солей в присутствии твердой щелочи, а также электро­
лизом получают углеводороды.
2.
При действии галогенидов фосфора на карбоновые кислоты образу·
ются галогенангидриды кислот. При этом, как и в случае спиртов, гид.
роксил замещается галогеном, например:
R_C;"O
'ОН
~
R-
с,О
+
ЮСI.
+ HCI
'<:1'\
Хлорангидриды кислот могут быть получены также действием на орга·
нические кислоты хлористого тионила:
;"0
R-C-..
+ SOCI 2
"ОН
----;.
Галогенангидриды кислот можно называть по кислоте и галогену, на·
пример хлорангидрид уксусной кислоты. Но чаще их называют по кислот·
а
ному радикалу R-C" - ацилу. Перед названием ацила указываюТ
галоген. Например:
"
Cн.-c~
.\
О
"СI
XJЮIJllСl'lАЙ itl(СТИJI.
fip()M.'CTloIii
XJЮIIНС·П.аЙ 'iT~II'IItJl.
()Рllмис'r'oIit ())''I'itIЮИJI.
XJII)I»1III'НД,,'Щ УКСУСIIШI КlICJЮТI.'
Низшие галогенангидриды -
(1IЮМitlll'll;tl'ltД МИI.:JI)llюii КШ:JIIIТI.I
жидкости с весьма резким запахом, раз'
дражающим слизистые оболочки.
194
6УТИIЩJ1.
Н
В галогенангидридах обладает большой реакционной способ-
ГаЛО ге
"
.
Ю У бывающеи в ряду.
ность
RCO-I > RCO-Br > RCO-CI > RCO-F.
n
и взаимодействии га~огенангидридов с соединениями, содержащими
мРметал ла или активныи атом водорода, происходит замена его кислот­
a:~M остатком. Подобные реакции называются ацuлuрованuем., в частно­
н
сти
ацетилированием (если в новую молекулу входит ацетил). Рассмотрим
"
некоторые из таких реакции на примере хлористого ацетила:
~O
СН:ГС"с1 + НОН ГНJЦ'IJI''''~ СН:\-СООН + НСI
СН,-\
. C~\.
О
СI
~
+ HOC.1.. H 11
CH\-C-OC
.. H 11 +
•
11
.1
НСI
О
ilМНJliЩL.,"i4Т. IIСIIТНJI1.jrrlIIШIТ
СН-С-CI
.\ 11
+ NaOC.. H..
~ СН\-С-ОС .. Н ..
.1
.1
•
'11'
О
+ NaCI
О
·........,.аl1L'Та1·. 'iТИJI"iТilll(Ja"Г
СН\-С-СI
, 11
+
AgO-С-СН\ ~ СН,-С-О-С-СН\
11'
О
о
О
11
11
О
О
'
+ AgCl
YКCYCII'''" ИIIГНдIJНJL
СН,\-С-СI
, 11
+ 2HNH ..
~
CH\-C-NH .. + NH.cI
. ' 11
О
•
"
О
амид УКСУСIЮН КИСJIIП"!.'
(.'I<.""M'III)
11СI)fIКСИД аltL'Тиnа
Таким образом, исходя из галогенангидридов кислот можно получить
Все производные кислот: ангидриды, галогенангидриды, сложные эфиры,
амиды, пероксиды и др. Все эти реакции являются реакциями нуклеофи­
~bHOГO замещения и идут в большинстве случаев по тетраэдрuческом.у
еханизму (в случае слабых электрофилов по механизму SN 1). Например:
R-t С1
OR
+
RO-
---+
R-i~1 - +
OR
R-n CI+
195
Галогенангидриды кислот, имеющие в f3-положении атомы водоро-:
при нагревании в присутствии каталитических количеств палладия гл.
декарбонилируются с образованием олефинов:
.
"
Ацилгалогениды, не имеющие в f3-положении атомов водорода, дают пра
этом алкилгалогениды с меньшим числом углеродных атомов, чем в исхо..,
ном ацилгалогениде.
3. При дегидратации кислот или при взаимодействии солей кислот с их
галогенангидридами образуется ангидриды кислот:
а)
U
R-CO"
2R-C-OH ~
О
+
Н 2О
R-CO/
О
О
О
О
б) R-~-ОNа + CI-~-R + R-~-O-~-R + NaCI
Первый способ применим не для всех кислот. Так получают, например,
ангидрид уксусной кислоты. Пары кислоты пропускают при высокой тем­
пературе над А1 2 О з , продукты реакции быстро охлаждают и отделяют
воду. Ангидрид трифторуксусной кислоты получают действием на кислоту
сильного водоотнимающего средства Р205. Второй способ более
универсален.
Чтобы ПОJlУЧИТЬ смешаииый ангидрид. берут соответствующие проltзводные разных кис­
JlОТ. Например. натриевая СОJlЬ маСJlЯНОЙ КИCJIоты с хлористым ацеТИJlОМ образует уксуСНО­
маCJIЯНЫЙ аНГlIдрllД.
Для ПОJlучеиия ангидридов Кl1CJ10T удобным реагентом ЯВJlяется метоксющеТИJlен:
2R-COOH +
СНР-С=СН ~
Ангидриды низших кислот
-
легкоподвижные жидкости с острым за­
пахом; в воде плохо растворимы или вовсе нерастворимы. Кипят при 60лее высокой температуре, чем соответствующие кислоты.
Ангидриды кислот обладают большой химической активностью и явля­
ются, как ~ галогенангидриды, хорошими ацилирующими агентами:
а) при легком нагревании с водой они образуют соответствующие КИС­
лоты:
о
CH-r!'
.\
,
-"О
сн.-с/
.\
О
196
6)
са спиртами образуют смесь кислоты и сложного эфира:
~
:H:1-:)0 +
CH:гC~
НОС 2 Н"
СНаСООН
_
~
CHa-С-0-С 2 Н"
+
О
В) С аммиаком дают смесь соли кислоты и ее амида:
_
#,0
ен:гс"о
+ 2HNH 2
сн.-с/
.1
~
_
#,0
CH:1-COONH1 + СНг-С"NН2
-
;l1~сТitМJЩ
О
г) ангидрИДЫ кислот реагируют с галогеноводородами с образованием
галогенангидридОВ кислот. Эта реакция особенно важна ДIIЯ получения
фторангидридов:
-IOT
(R-CO)20 + НF(ж\ Е
')0
R-CD-F + R-COOH
Все эти реакции идут подобно реакциям хлорангидридов кислот в боль­
шинстве случаев по тетраэдрическому механизму.
Уксусный ангидрид широко применяется при ацетилировании органи­
ческих гидроксилсодержащих соединений (например, в производстве аце­
татного шелка). В промышленности его ПОЛУ'lают окислением уксусного
альдегида кислородом воздуха на медно-кобальтовом катализаторе. При
этом вначале образуется гидропероксид ацетила, реагирующий с уксус­
ным альдегидом с образованием уксусного ангидрида:
_
о,
CH:\C~-H ~ СН.-С-О-ОН
.1
11
CII..-CIIO
.
-11,0
)о (CH.j-СО) О
.
2
О
в небольших количествах уксусный ангидрид получают также из ацетона
5.3).
через кете н (см. гл.
4. При пропусканrtи паров кислот вместе с аммиаком наддегидратиру­
IOЩИми катализаторами получаются амиды кислот:
R-COOH + NH:1----+R-CO-NH 2 + Н 2 О.
Амиды кислот получают также действием NН з на галогенангидриды
~Л: ~нгидриды кислот (см. выше) или из аммонийных солей кислот. При
КУ ои перегонке этих солей отщепляется вода с образованием амидов
ИСJJОТ:
itММОШIЙШШ !.:(JJII.
КШ.:.IIIIТloI
197
ОДНlIМ из наиболее важных совремеtЩI.IХ реагентов, используемым Д/IЯ ПОлучеННI\
дов кислот, является дНциклогексилкарбодимид:
~C6HI:I
~O
R-C,
+С
.... ОН
11
•
н
N-C,;
N-C,.H 1·\
11
~
•.
I!'-NII,Э>
R-CO-O-C
1
NH----C,;H1:I
13
ДНI~НКJI()гскснnКitI)(И)дНМИД
R-CO-NHR' + (C,;H 1:\NH2)2
..
Амиды кислот - кристаллические вещества (кроме жидкого ам
муравьиной кислоты - формамида). Они подвержены различным n
вращениям:
а)
при нагревании с
P20 s отщепляется
вода с образованием НИТРИJl
кислот:
О
2CH:jC(
-+
NH2
R-C==N +
Н2О
Ib
б) водород аминогруппы NH 2 сравнительно легко замещается метал~
лами. Ацетамид. например, реагирует с оксидом ртути:
в) амиды при кипячении с водными растворами минеральных кислот И
щелочей гидролизуются с образованием карбоновой кислоты или ее соли:
~O
2СНгС,
+ НОН
-с R-COOK + NH\
.
R-COOH + NHp
NH2
Амиды кислот образуются как промежуточный продукт при омыленИИ
нитрилов.
5. Характерной особенностью карбоновых кислот является их способ­
ность образовывать со спиртами в присутствии минеральных кислот
сложные эфиры
-
реакция эmерификации
R-COOH + HO-R'
=
*:
R-COOR'+H 20.
Как указывалось ранее, эта реакция обратима. Равновесие (в случае
простейших спиртов и кислот) наступает тогда, когда в реакцию вступает
по 2/3 моль исходных веществ (Бертло, 1862). По исследованиЯ"
•
Названия сложных эфиров образуют из названия СПlIРТОВОГО радИкала в каче~
ПРIIСТI!ВКИ и Нl!зваНlIЯ кислоты, в котором ОКОН'Iание -OI/ЦЯ заменяется на -оаm. например,
СН _C~O
.\
'ОСН:\
МСТИJI'i1аIЮНТ
CH:-C~O
,\
'OC2Hr.
'iТНJI"iТilIШАТ
Их также называют по спиртовому радикалу н кнслоте. добавляя слово .W/JUP: метилов~:
или соответственно этиловый эфир уксусной КlIСЛОТЫ. Общеприняты и такие назван
аЛКlIЛфОРМIIIIТ. МКllлацеТIIТ и др., соответственно метил- или этилацетат.
198
Б Н. МенШУТКИНЫХ, скорость реакции этерификации зависит от
Н. А. Иия 'спиртов и кислот. Кислоты строения R-CH 2-COOH скорее
строен т в реакцию, чем кислоты строения R2CH -соон и
ту п аю
ВС -СООН.
Rз С оль катализаторов
в реакции этерификации играют ионы водорода.
р
род
карбонильной
группы кислоты, захватывая протон, образует
КИСЛО
карбкатиО Н 1:
8-
8+~O +н+
R-C~
'ОН
1
Карбкатион
01"
+ ОН
R-C .......
'ОН
1
присоединяет молекулу спирта за счет неподеленных
электронОВ атома кислорода с образованием промежуточного тетраэдри­
'lескОГО KOMnJJeKca 11, который способен обратимо распадаться с отщепле­
нием воды и образованием нового карбкатиона сложного эфира Ш. При
диссоциации последнего образуется сложный эфир, причем освобождает­
ся катализатор
-
протон:
ОН
он
R_C/OH+H-ЬR'?R~6-t-R? R'o-t-R ?R~O-C-R+H+
'ОН"
I
н
I
ОН
11
-Itto
11
О
111
БОJJЬШОЙ интерес представлял вопрос: КИСJlота или спирт отщепляют
гидроксил при реакциях эфирообразования.
С помощью «меченых атомов» (тяжелого изотопа кислорода 180) было
c'leT водорода спирта
показано, что вода при этерификации образуется за
и гидроксила кислоты:
R-С(~н:::::~ГО-R'
-
R-C<~_R' + HP
СЛожные эфиры ПОЛУ'lают также взаимодействием галогенацилов со
спиртами и алкоголятами и нагреванием СОJlей карбоновых кислот с гало­
геналкилами и действием спиртов на ангидриды кислот.
КiI~ОЗМОЖДНО получение сложных ЭфliРОВ и С помощью иоиообменных смол из карбоновых
от 11 галогеНОnРОIIЗВОДНЫХ.
Кат ОНII могут быть также получены из галогеноnроизводных карБОНliЛllроваНllем на
аЛllзаторах:
R-Нlg+СО+R'-ОН
511;;,5°2 I
R-СООR'+ННlg.
п СЛожные эфиры низших кислот и спиртов
-
жидкости с приятным за­
в ахом, I!МИТИРУЮЩИМ в некоторых случаях запах ПJlОДОВ. Их Ilрименяют
ацПище130Й промышленности в Ka'lecTBe фруктовых эссенций (изоамил­
РИ е"Гат - грушевая эссенция). Кроме того, они применяются как раство"гели (бутилацетат).
199
Превращения сложных эфиров сходны с превращениями других произ.
водных кислот. Обычно они проходят по тетраэдрическому механизму.
Сложные эфиры
1.
-
мягкие алкилирующие средства.
При нагревании с водой в присутствии кислот и щелочей, особенно
в присутствии краун-эфиров (гл.
4.2),
сложные эфиры подвергаются гид.
ролизу с образованием соответственно кислот или их солей:
I
н+
R-CO-OR'+ H 20;::::=:Z R-COOH+ R'-OH
НО- ---+
R-CO-OR'+
R-COO- + R'-OH.
ДЛЯ расщепления сложных эфиров используется также специфический
реагент (СНз)зSiI:
R-CO-OR'+ (CH:1):ISiI---+ R-СО-ОSi(СН:1 );\+ R'-I
2R-СО-ОSi(СН:1 ):I+ Н 2 О
---+ 2R-COOH + (CH3):ISi-О-Si(СН:1 ):I'
2. При нагревании со спиртами в присутствии кислот сложные эфиры
вступают в реакцию переэтерификации. Таким путем получают некото­
рые менее доступные сложные эфиры:
н+
R-COOR'+ R"OH
3.
(изБЫТОI<)
+===Z R-COOR"+ R'OH.
При обработке жидким аммиаком эфиры образуют амиды кислот:
R-COOR'+ NH:1 +2 R-CONH 2 + R'OH.
ОтдеЛЬНblе представители. Применение
Муравьиная кислота НСООН
-
жидкость с резким запахом, т. кип.
100,8 0 с. Образует с водой азеотропную смесь, содержащую 77,5%
кислоты и кипящую при
107
0 с.
При попадании на кожу вызывает
ожоги. Вдыхание ее паров вызывает сильное раздражение дыхательныХ
путей.
В промышленности муравьиную кислоту получают из ее натриевоii
соли (формиата натрия), которая образуется при пропускании оксида
углерода через раствор гидр оксида натрия:
СО+
NaOH
I "о'·с
1')"
_D- D,
)
HCOONa.
O.5-I,ОМПа
Полученную соль действием серной кислоты переводят в свободную
кислоту:
2HCOONa + H2S0~ - - . Na2S04 + 2НСООН.
Муравьиная кислота обладает многими химическими свойствами оБы''·
ных кислот. Но ей присущи и некоторые специфические свойства:
200
1.
она легко окисляется и служит поэтому хорошим восстановителем:
нсоон
2.
+ HgCI 2
__
Hg
+ С0 2 + 2HCI;
При нагревании с концентрированной
H 2S0 4
распадается с образо­
ванием воды и СО:
нсоон ~ Н 2 О +СО;
З. Формиаты щелочных металлов при сплавлении Р<lспдаются с обра­
зованием солей щавелевой кислоты:
2H-СООNа ~ Н 2
+ NaOOC-СООNа.
Муравьиная кислота применяется (вместо уксусной кислоты) при кра­
шении тканей, в кожевенном производстве, в консервном, спиртовом
и пивоваренном производствах. Она применяется также в медицине, для
приготовления катализаторов и в ряде синтезов.
Из производных муравьиной кислоты в последнее время приобрел
большое значение дuметuлформамuд:
н-с(
О
N(CH:\)~
ЭТ<I жидкость С т. кип. 153 ·С является селективным растворителем при
выделении ацетилена из Г<lЗОВЫХ смесей (один объем димеТИЛфОРМ<lмида
растворяет при
25
·С и обычном Д<lвлении
31,4
объема ацетилена) и при
абсорбции хлороводорода, S02' С0 2 и некоторых других газов. В качестве
растворителя диметилформамид применяют при производстве волокна
нитрон.
Известны также сложные эфиры муравьиной кислоты, отвечающие ее
ортоформе н-с(онн (в свободном состоянии не существует), mlПример
НС( ОС 2 Н 5 )з -
ОН
ортомуравьиный эфир.
Его получают действием Н<I хлороформ <lЛКОГОЛЯТОВ. Реакция идет
с промежуточным оБР<lзованием ДИХЛОРК<lрбена (гл.
СНСI З
+ с 2 н"О-
~:CI. + С) 1.;011 -
?
:СcI;
2.2):
+ C~Hr,OH
С) 1,~(t-l:(:I, -
C.ll"OCIICl,
11
в Уксусная кислота СНзСООН (беЗВОДН<lЯ) при + 16,6·С застывает
Кристаллическую массу, напоминающую кристаллы льда, поэтому такую
201
кислоту называют ледяной.
Она обладает характерным острым (уксус­
ным) запахом, смешивается с водой в любом соотношении и кипит при
нормальном давлении без разложения при
118,5 ос.
В промышленных
1)
масштабах ее получают рядом способов, рассмотренных ранее:
тилена через уксусный альдегид;
2)
из аце­
при окислении предельных углеводо­
3) при окислении спирта.
В США уксусную кислоту получают главным образом окислением
родов;
бутана.
Разработан способ получения уксусной кислоты оксосинтезом по схеме:
l~hCI·I(CII·II)
СН аОН + СО 18()"(::
;j--l;'III"~
СН -"ООН
:1"'-'
Ледяная уксусная кислота является прекрасным растворителем ДIIЯ
многих органических веществ.
Водные
растворы
кислоты
поступают
в продажу под названием столового уксуса (3-5%-ный раствор) и уксус­
ной эссенции (70-80%-ный раствор). Ледяная и концентрированная ук­
сусная кислота вызывают ожоги на коже.
В ХИМИ'lеском отношении ДIIЯ уксусной кислоты характерны все свой­
ства карбоновых кислот.
Уксусная кислота широко применяется при крашении и ситцепечата­
нии, в кожевенном производстве, ДIIЯ получения сложных эфиров. ис­
пользуемых в лакокрасочной (растворители), пищевой (эссенции) и дру­
гих отра.слях промышленности. Уксусная кислота в БОЛЫllИХ количествах
расходуется
ДIIЯ
производства
уксусного
ангидрида,
винилацетата,
как
консервирующее и вкусовое вещество, а также в производстве красите­
лей, лекарственных и душистых веществ.
Большое практическое значение имеют соли уксусной кислоты
-
нат­
рия, алюминия, хрома, железа, меди, свинца и др. Большинство этих солей
растворимо в воде; при нагревании их водных растворов происходит сту­
пенчатый гидролиз. Например, соли трехвалентных металлов
(AI, Fe,
Сг)
гидролизуются по схеме
(СНаСОО):! Ме
НОН
t СНаСООН
НОН
СНаСООН + (CHaCOO)Me(OH)~
Этим
пользуются
в
красильной
НОН
+ (CH:!COO)~Me(OH)
t СН:!СООН
t
+ Ме(ОН):!
промышленности
ДIIЯ
нанесения
на ткань или пряжу гидроксидов алюминия, хрома и др.
Проnионовizя кислота С 2 Н 5 СООН плавится при
141
-22
·С и кипит при
·С. Ее получают преимущественно окислением пентана. Она может
быть получена также «оксосинтезом»:
CH:!CH~OH + СО
Rh /
СНа' ~ CH:jCH~COOH.
Пропионовая кислота находит все большее применение в синтезе гер­
бицидов, консервантов, полимерных материалов.
202
высшие жирные кислоты. В природе в свободном состоянии и в соста·
ве жиров обнаружено несколько десятков предельных жирных кислот.
низшие члены ряда (С 4 -С\0) входят в состав липидов молока. Кислоты
с промежутОЧНОЙ длиной цепи (С В -Н\4) содержатся в маслах некоторых
семян.
Наиболее
распространены
в
природе
nальм-итиновая
С\SНЗ\СООН и стеариновая С 17 Н зs СООН кислоты.. В промышленно­
сти их получают гидролизом (омылением) жиров, а также каталитическим
окислением парафинов. Соли этих кислот называют м-ы.лам-и.
МылаМIJ называют СОЛIJ щелочных металлов жирных кислот, содержащих
10-18 угле·
родных атомов. Они имеют Д/lI1ННУЮ, препятствующую растворению в воде углеродную цепь,
связанную со способствующим растворению карбоксилатным ноном, н поэтому действуют
как смачивающие, эмульгирующие агенты и ()еmергеНI1IЫ (моющие средства). Если угле·
родная цепь СОЛli щелочного металла liMeeT менее 1О углеродных атомов, то мыло не вызыва·
ет змульгнрования масла. При содержании более
'leM 18 углеродных атомов в цепи соль не
образует в воде коллоидного раствора.
В последние десятилетия стали производить синтетические продукты, обладающие свой·
ствами мыл или 3МУЛЬГИРУЮЩliХ агентов. Таковы, например, натриевые соли вторичных ал·
килсульфiiТОВ, имеющих от 8 до 18 углеродных атомов. Их пОЛУ'lают сульфированием олефи·
новых фракций продуктов крекинга нефТII.
При каталитическом восстановлеНlili жирных кислот, особенно из кокосового масла, об­
разуется смесь ЖllРНЫХ спиртов, которая превращается в моющие средства сульфliровани­
ем. В настоящее время ПРОliЗВОДИТСЯ значительно больше СliнтеТliчеСКllХ моющих средств,
'leM
мыла (свыше шестисот названий). Синтетические моющие средства в ОТЛli'ше от мыла
неЧУВСТВIIтельны к жесткой воде. Замена мыла синтеТИ'lеСКliМII средствами уменьшает рас­
ход пищевых ЖliРОВ на теХНИ'lеские нужды: 1 т сульфонатов дает ЭI<ОНОМИЮ 0,7 т жира.
Однако наряду с множеством достоннств синтетические моющие средL'Тва имеют li суще­
ственные недостатки. Главным из них является то, что некоторыве из IIИХ плохо удаляются
бltOЛОГИ'lеским путем из сточных вод и токсичны для бактерий активного ила, вследствие чего
нарушается биологическая очистка рек от загрязненнЙ. Это делает воду неПРliгодноit для
приготовления пищи и разведения рыбы.
Натриевые и калиевые мыла растворимы в воде и хорошо «мылятся».
Соли магния, кальция, бария и некоторых других металлов очень плохо
растворяются в воде; поэтому обычные мыла в жесткой воде, переходя
в
нерастворимое
состояние,
не
«мылятся»,
не
пенятся,
становятся
липкими.
Эфиры пальмитиновой кислоты составляют главную 'lacTb спермацета
и пчелиного воска.
Получаемая при омылении жиров смесь твердых жирных кислот, глав­
ным образом С\5НЗ\СООН и С\7НЗ5СООН' называется стеарином-. Из
стеарина с небольшой добавкой
парафина
изготовляют стеариновые
свечи.
2.
ГдJlОГЕНОЗДМЕЩЕННЫЕ ОДНООСНОВНЫЕ КИСЛОТЫ
Галогенозамещенные карбоновые кислоты можно рассматривать как
пр?ду кт замещения атомов водорода углеводородного радикала карбоно­
вои КИслоты атомами галогенов. Существуют моно- и полигалогенозаме­
ЩеННые кислоты.
203
Изомерия. Номенклатура
Изомерия галогенозамещенных кислот зависит от строения углеводо­
родного радикала и положения атомов галогена в цепи.
Взаимное положение галогена и карбоксильной группы показывают
буквами
греческого
СНз-СНСI-СООН,
алфавита,
например
/3-хлорпропионовая
а-хлорпропионовая,
CH 2 CI-CH 2 -COOH;
кислоты.
.
у-броммасляная СН 2 Вг-СН 2 -СН 2 -СООН
По систематической номенклатуре названия галогенокислот произво­
дят от названия соответствующей карбоновой кислоты, указывая цифрой
положение атома
галогена,
например 2-бромпропановая
кислота
СНз-СНВг-СООН.
Способы получения
Галогенозамещенные кислоты могут быть получены рядом способов.
1. Непосредственное галогенирование кислот происходит с трудом и
неселективно. Это обусловлено тем, что электронная ненасыщенность
карбонильного углерода в значительной степени нейтрализована смеще­
нием электронов от гидроксильной группы:
П
"",О
R -с Н 2-C~
..
а:н
Хлорангидриды и ангидриды карбоновых кислот галогенируются срав­
нительно легко.
Поэтому обычно при получении а-галогензамещенных кислот исполь­
зуют метод Гелль
-
Форльгард
-
Зелинского, заключающийся в дей­
ствии хлора или брома в присутствии фосфора:
3RCH:/-COOH + Р + 5,5ВГ2 --+ 3RCHBrCOBr + НРО:1 + 5НВг
RCHBrCOBr + Н 2 О --+ RCHBгCOOH + НВг
ХлОРllрование х.лорангидридов алифатнческих кислот хлористым сульфурилом, катали­
13- и у-замещение. Например, х.ло­
13- и 45% у-х.лорбутирилх.лорида. Анало­
зированное пероксидом водорода, дает преимущественно
рирование х.лористого бутирила дает 10% а-, 45%
ГИ'lная ориентация замещения
наблюдается
и при
высокотемпературиом парофазном
галогенироваиии.
Иодзамещенные кислоты получают действием иода на кислоты в при­
сутствии иодной кислоты или обменом галогена бромзамещенных кислот
с иодидом калия.
Действие фтора на органические кислоты вызывает взрыв, поэтому
фторзамещенные кислоты обычно получают обменом галогенов.
2. Присоединение галогеноводородов к ненасыщенным монокарбоно­
вым кислотам. При этом атом галогена становится в положение, наиболее
удаленное от карбоксильной группы, в соответствии с поляризацией крат­
ной связи (см. раздел 3 - непредельные кислоты):
СН 2 = CHCOOH~CHPCH2COOH
/tКРНJЮllа" КИCJЮТ/t
204
j)-XJЮРIlРOlIНOIюuа" К"CJЮТ/t
3.
Действие галогеноводородных кислот на гидроксикислоты или лак­
ТОНЬ! (гл.
11):
HO-CH~-CH2-COOH ~ CICH 2-CH 2-COOH + HP
P-XJЮ()IIРШIИОIIOItilП кис..:JЮТiI
гидраКIIИJI(III;ОI КИt;lота
СН 2-С, О
I
/0
~ ВГСН2-СНГСН2-СООН
СН 2 -СН 2
y·(iIКlMM.CJIIIII." КИ"""r.
riynt'КJJ1i1KTOII
4.
Теломеризация олефинов с полигалогенопроизводными, например
этилена
с
четыреххлористым
углеродом
в
присутствии
пероксидных
инициаторов:
[иниц.] ~ CI(CH~CH2)
+ЗН~О ~
CCI:1
-3HCI
n
__ CI(CH 2CH 2)"COOH
Выход продуктов с возрастанием
n
быстро падает: реакционная смесь
содержит преимущественно вещества с
5.
n = 1, 2
и
3.
Фторзамещенные кислоты могут быть получены из соответствую­
щих фторолефинов, а также диазотированием аминокислот в присутствии
HF и
пиридина.
Физические и химические свойства
Галогенозамещенные карбоновые кислоты могут быть либо жидкими,
либо твердыми кристаллическими веществами.
С одной стороны, ДJIя них характерны обычные реакции карбоновых
кислот с образованием солей, эфиров, хлорангидридов и ангидридов,
с другой стороны
-
сходство с галогеналкилами, обусловленное нали­
чием в радикале галогена, который легко замещается окси-, амино- и дру­
гими группами.
Галогенозамещенные кислоты сильнее соответствующих незамещен­
ных кислот. Влияние различных галогенов на их силу падает в ряду:
F> CI > Вг > 1. Кроме того, оно зависит от числа и положения атомов
галогенов.
КНCJЮТ3
............
~онофторуксусная ....
~онохлоруксусная ....
~онобромуксусная ....
~оноиодуксусная .....
Дифторуксусная .......
Уксусная
К
'10-1.
1.75
200
150
150
75
5700
КliCJЮТ3
К '10-"
......
3320
Трифторуксусная ..... 50000
Трихлоруксусная ..... 20000
140
а-Хлормасляная ......
9
~-Хлормасляная .......
3
у-Хлормасляная .......
Дихлоруксусная
Химические свойства галогенозамещенных кислот также зависят от
ПОложения галогена в молекуле.
205
а-Галогенокислоты при нагревании с водой легко обменивают атомы
галогена на гидроксильную группу с образованием а-гидроксикислоты:
CI-CH 2COOH + Н./О --+ НО-СН2 -СООН + HCI.
l'nИКОJIСR8Я кислота
~- Галогенокислоты при нагревании с водой теряют галогеноводород и
дают ненасыщенные кислоты:
Р'XJюrllrIOIIИOlЮll811 КИCJIOТ8
8КРИJЮll811 КИCJIOТ8
у-Галогенокислоты в этих условиях сначала образуют соответствую­
щие у-гидроксикислоты, которые затем, теряя воду, сразу же переходят
в лактоны (циклические внутренние эфиры):
CH1-CH-<:H 2-CH 2-COOH
. I
~
CH·1-CH-CH 2-CH 2-CO
Вг
.
I
I
0---1
Благодаря своей активности галогенокислоты играют важную роль
в ОРГRНИ'lеском синтезе.
ОтделЬНblе представители. Применение
Хлоруксусная кислота
СН 2 С1-СООН (т. пл.
в трех твердых модификациях:
а-т. пл.
61,3 ;
У (образуется при затвердевании после плавления)
189 ОС) существует
~ - т. пл. 56,2 ОС;
- т. пл. 52.5 0 с. Ее
получают хлорированием уксусной кислоты в присутствии иода и красного
фосфора или
кислотой при
PCI 5 или нагреванием трихлорэтилена с 96%-ной серной
185-200 ОС:
CHCI = CCI 2 + 2Н 2О
H:zSO ~ • CICH 2COOH + 2HCI.
ИЗ галогенозамещенных кислот наиболее широко применяется в про­
мышленности хлоруксусная кислота. Большие количества ее используют­
ся в производстве гербицидов, карбоксиметилцеллюлозы, индиго и мно­
гих других важных оргаНИ'lеских соединений.
Дихлоруксусная кислота CHCI 2 -COOH, т. кип. 194 ОС, т. пл.
Ее получают из хлоральгидрата обработкой карбонатом кальция
в присутствии катализатора (цианида натрия) с последующим действием
5-6 ОС.
концентриров"нной соляной кислотой:
.. I~•.CN.I.
~
-Col.l,. -21.0,. -211,0
~ (CI 2CH-СОо>'.Са
~
11.18
~
~fI ... 2
2CI 2СН-СООН
Дихлоруксусная кислота в виде дихлорацетильного остатка встречается в
природе в антибиотике хлоромицетине. Она используется в промышлен­
ном синтезе этого антибиотика.
206
Трихлоруксусная
58 ос
кислота
ССlз-СООН,
т. кип.
196,5 ОС,
т. пл.
Ее получают из хлораля окислением азотной кислотой, а также дей­
ствием на тетрахлорэтилен хлора и воды на солнечном свету:
CCI 2=CCI 2
Cl 2 , Н 2 О ~ CCI:1-COOH.
Трихлоруксусная кислота используется в медицине для прижиганий,
а в виде натриевой соли
-
в качестве гербицида для уничтожения злако­
вых сорняков (пырей, куриное просо, овсюг и др.) в посевах хлопчатника,
сахярной свеклы, лука, люцерны.
Монофторуксусная кислота FCH 2COOH, т. кип. 167-168,5 ОС,
т. пл. 31-32 ос Ее получают нагреванием метилового эфира хлоруксус­
ной кислоты С фторидом калия в автоклаве при 220 ос Полученный мети­
ловый эфир при омылении может быть превращен либо в соль, либо
в свободную фторуксусную кислоту. Кислота и ее производные чрезвы­
чайно токсичны. Натриевая соль фторуксусной кислоты используется для
истребления крыс.
в Южной Африке растет чрезвычайно ядовитое растение «Гllфблар» (DiсhареtаlllП1
действующим началом которого является фторацетат калия. Растение ПРОl1зра­
стает на почвах. богатых неоргани"еСI<ИМИ фторидами.
cYll1osllln).
Трифторуксусная кислота СFз-СООН, т. кип.
72-72,5 ОС,
явля­
ется очень сильной кислотой. Получают ее окислением таких соединений,
как
СF з -ССI=ССI 2 ,
СFз-ССI=ССI-СF з ,
или
электрохимическим
фторированием уксусного ангидрида_
Трифторуксусная кислота
-
важный катализатор для ацилирования
спиртов, гликолей, целлюлозы. Применяется для производства трифто­
руксусного
39,5 ОС,
ангидрида
т. пл.
-56 Ос.
-
бесцветной,
очень едкой
жидкости
с т. кип.
ОН широко используется в промышленности в ка­
честве промотора реакции ацилирования, например в производстве аце­
татного шелка.
ТрuФторнадуксусная кислота СFз-СОООН окисляет ·олефины
в а-эпоксиды или гликоли; первичные амины, нитрозосоединения и окси­
МЫ -
В нитросоединения; кетоны
-
в эфиры кислот.
ТетрафТОРПРОПl10новая кислота. получаемая присоединеНliем
с последУЮЩИМ ГI1дРОЛИЗОМ нитрила. применяется в
HCN к тетрафторэтилену
K3'IecTBe гербlЩI1да (гл. 20.6)д.nя борь-
61>1 С однолетними однодольными сорняками.
3_
НЕПРEДEJIЬНЫЕ ОДНООСНОВНЫЕ КИСЛОТЫ
Непредельные одноосновные кислоты этиленового ряда имеют общую
формулу С n Н 2n
_I-COOH, ацетиленового и диэтиленового рядов
С II Н 2n -з-СООН. При меры непредельных одноосновных кислот:
СН 2 =СН-СООН
аКРИЛОВ3Я,пропеновая
СН 2 =СН-СН 2 -СООН
винилуксусная.3-бутеновая
CH:1-CH=CH-COOH
кротоновая,2-бутеновая
207
СН 2 =С-СООН
(1- меТllлаl'риловая.
CHa-(СН2)7-СН=СН-(СН2)7-СООН
олеиновая
CHe=C-СООН
пропиоловая. ИЛII пропиновая
CH:i -С$5!С-СООН
тетроловая.2-бугиновая
CH:i-(СН2)7-Сs.. С-(СН2)7-СООН
стеароловая
l
СН: 1
CH:1-
метакриловая
.
меТllлпропеновая
(СН2),,-СН=СН-СН2-ПН
ЛliНОJ1евая
НООС-(СН 2 )7 -СН
CHa-СН2-СН=СН-СН:ГПН
ЛИНОJ1еновая
СООН-(СН2)7-СН=СН-СН:ГСН
Способы получения. Существуют два общих метода получения непре­
дельных кислот.
1. В исходном веществе имеется краткая связь, и задача сводится к
введению карбоксильной группы. Примером может служить получение
винилуксусной кислоты по схеме:
С Н.,• =СНСН . !
+CI 2 : 450·С ~CH. "СНСН СI
-НCI
2
2
+KCN
-KCI
~
---'СН 2 = СНСН 2 - CN +2Н 2 О ~ СН 2 "" СНСН 2СООН + NH a
rl\J\J1OJIII:<
2.
Исходят из предельной кислоты и переводят ее вненасыщенную
кислоту. Так, например, из (3-бромпропионовой кислоты можно получить
акриловую кислоту:
ВгСН 2 -СН 2 -СООН + 2KOH---.КВг + Н 2 0 + CH 2 =CH-СООк.
а из 2-гидрокси-2-метилпропановой кислоты
ТН:I
О
CH:1C-C<
I
СН:1
ОН
-
метакриловую кислоту:
_~O
_
1'12S01~ CH2=t-С"С + HP
СН:!
Физически.,е и химические свойства. Непредельные одноосновные
кислоты ОТЛИ'JaЮТСЯ от предельных более высокой плотностью и больши­
ми КОНСПIНПIМИ диссоциации.
Ненасыщенные кислоты образуют все обычные производные кис­
лот
-
соли, ангидриды, галогенангидриды, амиды, сложные эфиры и др.
С другой стороны, за счет кратной связи они вступают в реакции присое­
динения, окисления, полимеризации. Вследствие взаимного влияния кар­
боксила и кратной связи присоединение галогеноводородов к а-, (3-непре-
208
дельНЫМ кислотам происходит не по правилу Марковникова, т. е. водород
направляется к наименее гидрогенизированному углероду:
В+
t:::").
("'\&-
ch 2='=CH-С=0
I
+
В+
[,r
4-
г'. Р H
СН2 -СН=С
H-Br -
ОН
,
J
.-.:;0
BrCH2-СНгС7
-
,
О-Н
ОН
Ненасыщенные КИСЛОТЫ типа акриловой кислоты и их эфиры значи­
тельно
легче
подвергаются
полимеризации,
чем
соответствующие
им
углеводороды.
Отдельные представители. Применение. Рассмотрим наиболее важ­
ные одноосновные ненасыщенные кислоты и их эфиры.
-
Акриловая кислота сн 2 =сн -соон
жидкость с резким раз­
дражающим кислым запахом, кипит при 140 ·С, плотность 1,0621. В про­
мышленности ее получают по следующим схемам:
1)
окислением акролеина кислородом воздуха:
СНаСН = СН 2
2)
+ Х О" I СН
+ Х 01 I СН
2 = СНСООН:
из акрилонитрила гидролизом:
НС Е$ СН +HCN) СН 2
CLI,( CN),
3)
2 = СНСНО
=
+Н"О I СН 2
CHCN
=
СНСООН + NH:j :
ГИДРОJlШ
8КРИJЮlll1ТРИJI
из ацетилена, со и снзон в присутствии концентрированной
соляной кислоты. Источником оксида углерода является тетракарбонил
никеля (В. Реппе, 1944):
4НС=СН
+
4СНрН
+ Ni(CO)1 +
2НСI
_
в технике используют производные акриловой кислоты
-
ее эфиры,
особенно метиловый, называемый метилакрилатом. Его получают либо
описанным выше способом, либо алкоголизом акрилонитрила:
О
CH 2=CH-CN + HP +
СНрН ~ СН 2 =СН-С(ОСН;\ + (NH}2S01
Метилакрилат легко полимеризуется с образованием прозрачных Стек­
ловидных веществ. Поэтому его применяют в производстве органического
Стекла и других ценных полимеров и сополимеров.
Метакриловая кислота сн 2 =с(сн з )-сооГl и ее эфиры получа­
Ются в больших количествах методами, сходными с методами получения
rtкриловой кислоты и ее эфиров, в частности окислением изобутилена:
СН 2 =С(СН;\)2 ~ CH 2 =t- СНО ~ СН 2 . т- СООН
СН;\
СН;\
209
По другому способу исходным продуктом является ацетон. который
с
HCN дает
нитрил а-гидроксиизомасляной кислоты:
ОН
+ HCN
СН,-С=О
. I
~
I
I
CH-C-CN
.1
СН:,
СНа
31\СТОШ\И3Ш·И)!рИlI.
2·ГllДрокси·2,метил,
ПР(Ш31IIIИТРИJI
Ацетонциангидрин при нагревании с серной кислотой подвергается де­
гидратации и омылению с образованием метакриловой кислоты. Эта реак­
ция
в
присутствии
приводит
здесь
-
к
одноатомного
спирта,
соответствующему
в данном
эфиру
случае
метилового,
метакриловой
кислоты,
к метилметакрилату:
11.0
ОН
I
.\ I
CH-C-CN
IЮСII.
СН:\
сн,-?-СООСН: , + (NH 4 )2S 0 .1
СН:,
МL'ТИnМСТНКIJНJIНТ
Метuлметакрuлат, как и другие акрилаты, при полимеризации или
сополимеризации образует стекловидные полимеры (органические стек­
ла) с весьма ценными техническими свойствами. Эти полимеры имеют
цепную структуру:
СООСН,
СООСН
СООСН ,
СНа
СН:,
СН:,
I
. I
., I
.
-Сн'-С-СН -С-СН -С•••
2
I
2
I
2
I ...
Кротоновая кислота СН 2 -СН=СН-СООН известна в двух моди­
фикациях. Одна (устойчивая, стабильная) твердая, т. пл.
189 'с.
72
'С, т. кип.
Вторая (неустойчивая, лабильная) при обыкновенных условиях
жидкая, т. пл.
15,5 'С,
т. кип.
172 'с.
В присутствии следов иода или бро­
ма под действием прямого солнечного света лабильная форма быстро и
количествеНН(i превращается в стабильную форму. В остальном обе моди­
фикации кислоты имеют сходные свойства. Указанные различия меЖJIY
этими модификациями кислот являются следствием разного пространст­
венного расположения атомов и групп атомов у двойной связи, т. е. гео­
метрической или цис-транс-изомерии.
Стабильная форма представляет собой транс-изомер
(1) (атомы
водо­
рода расположены по разные стороны относительно плоскости двойной
связи). Лабильная форма - изокротоновая кислота - цис-изомер (11)
210
(атомы
водорода
связи):
расположены
по
одну
сн-с-н
~
сторону
плоскости двойной
Н-С-СН,
11
11
н-с-соон
.
н---с-соон
(I)K-:l'IO-"
(l1)K-:l.(;·III-"
теllJюта СnJI»IIIИiI
ТС'UЮТiI СI"ОРИIIНJI
2(Ю 1,:IIII(ж/м<,""
:lO:I4.H IIIIЖ/М<УII,
Природные высшие непредельные жирные кислоты. Известно более
100
ненасыщенных природных жирных кислот.
ИЗ высших ненасыщенных кислот большое значение имеет олеиновая
кислота С I7 Н ЗЗ СООН, остаток которой наряду с остатками пальмитино­
вой и стеариновой кислот входит в состав жиров. Олеиновую кислоту по­
ЛУ'lают омылением некоторых растительных масел. Это маслообразная
жидкость без запаха и вкуса.
Олеиновой кислоте присущи свойства ненасыщенных кислот. Она
обесцвечивает бромную воду (присоединение брома по двойной связи).
Разбавленный
раствор
марганцевокалиевой
соли
при
взбалтывании
с олеиновой кислотой обесцве'lивается, а олеиновая кислота переходит
в дигидроксистеариновую кислоту (по месту двойной связи присоединяют­
ся две гидроксигруппы). При долгом стоянии или при взаимодействии
с
некоторыми
химическими
реагентами,
например
при
встряхивании
с азотистой кислотой (водным подкисленным раствором нитрита калия
или натрия), жидкая олеиновая кислота (цис- изомер) переходит в твердую
элаидиновую кислоту (транс-изомер). Теплота сгорания олеиновой
кислоты 11 229 кДж/моль, элаидиновой кислоты 11 154 кДж/моль. Обе
кислоты имеют прямую углеродную цепочку с двойной связью между де­
вятым и десятым атомами углерода:
CH:\-(CH2~-~-H
CH.\-(CH"J-C-H
.
•
ОJ\СН\ЮIIИI\ КИCJЮТ3
11
H-C-(CH2~-COOH
НООС-(СН 2 )7- С- Н
3./IИИJ1ИIЮIIИII КИСJЮТИ
(цuс-и:шмср)
(mPUHC-II:\ОМСР)
Гидрирование (присоединение водорода по двойной связи) лревращает
олеиновую кислоту в твердую стеариновую кислоту. Щелочные соли оле­
Иновой кислоты олеиновые мыла применяеются в технике, напри­
мер для промывания шерсти и для других целей.
Высшие жирные полиеновые кислоты имеют большое биологическое значение. ОНИ'вхо­
ДЯТ в состав многих жнров (гл. 35.2). Почти все природные полиеновые кислоты являются
неразветвленными соединеНllЯМИ с четным числом углеродных атомов с метиленразделен­
ными двойными связями (от двух до шести, в цuс-форме). Наl(более pacnpocTpaHeflbI кисло­
ты состава С";. C 1M . C:l1I и С 22 . Линолевая и линоленовая кислоты содержатся только в рас­
Т1пельных маслах и не образуются в oРГ3Нflзмах ЖIIВОТНЫХ. Последние должны обязательно
ПОлучать 11Х с Пl1щеЙ. так как эти кислоты У'lаствуют в построении биологичеСl<l1Х мембран \1
СJ!Yжат исходным материалом Д/lЯ построения молекул простаглаНДllНОВ (гл. 14):
СН:Г(СН:l)4-СН=СН-СН2-СН=СН-(СН2)7-СООН
nИIЮJIСIIИII КИСJЮТИ
CH:I-СН2-СН=СН-СН:z-СН=СН-СН:z-СН2-СН=СН-(СН2)7-СООН
JIИllОJIСllOllёШ КИI.:JI()ТtI
211
В организмах животных найдены полиеновые метиленразделенные кислоты С 211 и С 22 .
В некоторых растениях обнаружены также кислоты C 1X с двумя И с четырьмя сопряжен­
ными ДВОЙНЫМli связями. Из них наиболее известна элеостеuрин(шuя кислотu - основ­
ной компонент тунгового масла.
В природных маслах представлены в виде сложных эфиров и некоторые высшие ацетиле­
новые кислоты (преимущественно метиленразделенные полиацетиленовые).
4.
ДВУХОСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫ
Двухосновные предельные (насыщенные) кислоты имеют общую фор­
мулу Cn H2n (COOHk Ниже приведены их важнейшие представители:
НООС-СООН
щавелевая, этандиовая
НООС-СН 2 -СООН
малоноваЯ,пропандиовая
НООС-СН 2 -СН 2 -СООН
янтарная,бутандиовая
НООС-СН-СООН
~Ha
метилмалоноваЯ,метилпропандиовая
HOOC-СН 2 -СН 2 - СН:l-СООН
глутароваЯ,пентандиовая
НООС-СН 2 -СН 2 -СН 2 -СН 2 -СООН
аroiпиноваЯ,гександиовая
HOOC-(СН2)г.-СООН
пимелиноваЯ,гептандиовая
ноос-(сн 2 ),,-СООН
пробковаЯ,октандиовая
НООС-(СН 2 )7--'-СООН
азелаиноваЯ,нонандиовая
НООС-(СН2)Х-СООН
себациновая,декандиовая
Способы получения
Общие методы получения двухосновных кислот аналогичны способам
получения одноосновных, например:
1.
Окисление двупервичных гликолей:
CH20HCH2CH2CH20H~ НООССН 2 СН 2СООН
2.
J
Гидролиз омыление) динитрилов:
СН 2
=
СН 2 ~CH2CICH2C1
2KCN
~ NCCH 2CH 2CN 4Н 2 О ~
---+ НООССН 2СН 2СООН
3.
Окисление гидроксикислот:
CH20HCH2COOH~CHOCH2COOH~
---+ НООССН 2СООН
Физические и химические свойства
Двухосновные кислоты
-
бесцветные кристаллические вещества, рас­
творимые в воде. Как и у одноосновных кислот, температура плавления кис­
лот с четным числом углеродных атомов выше температуры плавления со­
седних кислот с нечетным числом атомов углерода. Например, адипиновая
212
кислота (СН 2 МСООН)2 имеетт. пл. 153 ос, а глутаровая (СН 2 )з(СООН)2 и
пимелиновая (СН 2 МСООН) - соответственно 97,5 и 105,5 ос.
Двухосновные кислоты более сильные, чем одноосновныс. Это объяс­
няетсЯ взаимным влиянием карбоксильных групп, облегчающим диссоциациЮ:
{) С;о
~ --!.
Н Гril
'О-Н
о
во
'с-с' + н+
....
'он
-0/
Они способны давать в тех же условиях, что и одноосновные кислоты,
полные инеполные производные кислот: соли нейтральные и кислые (на­
пример,
оксалат
калия
коос-соок,
кислый
оксаЛliТ
калия
КООС-СООН), сложные эфиры - полные инеполные (нащ.Нiмер, ди­
этиловый эфир малоновой кислоты С2Н500С-СН2-СООС2Н5' моно­
этиловый эфир малоновой кислоты НООС-СН 2 -СООС 2 Н 5 ), ами­
ды - полные и неполные, например, диамид янтарной кислоты (сукцин­
амид) H2N-со-сн 2 -сн 2 -со- NH 2, моноамид янтарной кислоты
H2N-СО-СН 2 -СН 2 -СООН.
Вместе с тем наличие двух карбоксилов в одной молекуле обусловлива­
ет некоторые особенности химических свойств двухосновных кислот.
1.
Щавелевая, малоновая кислоты и одно- и двухзамещенные гомо­
логи последней при нагревании несколько выше их температур плавления
разлагаются (декарбоксилируются) с отщеплением одной карбоксильной
группы в виде СО 2 :
ноос-соон
---+ нсоон + CO~
HOOC-CH~-COOH
---+
HOOC-CHR-COOH ---+
HOOC-CRR'-COOH
~
сн:!-соон
+ СО 2
R-CH~-COOH
+ CO~
R-CH-COOH + со.}
I
-
R'
КИCJЮТИ
с другой стороны, в малоновой кислоте водородные атомы метилено­
вой группы -СН 2 - очень подвижны. С участием этих атомов малоновая
Кислота вступает в различные реакции замещения.
В эфирах малоновой кислоты они легко замещаются атомами щелоч­
Ных металлов. Так, например, из диэтилового эфира малоновой кислоты
при действии натрия или алкоголята натрия легко получается и натрий­
маЛОНО8ЫЙ эфир:
213
в анионе натриймалонового эфира отрицательный заряд рассредото­
чен между атомом углерода и двумя атомами кислорода, благодаря чему он
весьма устойчив и легко образуется из малонового эфира. Эта особен­
ность малонового эфира широко используется в лабораторной практике
для ПОЛУ'lения одно- и двухосновных кислот. Приведем два примера:
а) Получение одноосновной кислоты:
Н 2С/СООС2Нг.
'СООС 2 Нг.
NИ(RеIllII'ТС);.
ММJIШЮКI.rЙ 'iфНI)
[(
1~-lIr
]-
СН COOC2Hfi~ Na+
-N_lIr:-
IIНТlшАМИJЮIЮltl.rЙ 'iфНI)
I"нJlI"IJIИ~j
;э..
• /СООН
+ R-CH,
-+
2С 2 Н 5ОН
[~QQiH
iUIКНJIМflJI(JlIСШflН
KHCJICJ1iI
-+
С0 2 +
R- сн 2-соон
ilЛКИJIУКL')'\:IIНII КИ~JlflТИ
Для получения диалкилуксусной кислоты R2CHCOOH по приведенной
схеме последовательно замещают алкилами в группе -СН 2 - малоново­
го эфира два атома водорода.
б) Получение двухосновной кислоты. Если на натриймалоно­
вый эфир вместо RBr действовать эфирами а-бромзамещенных кислот
ВгСR 2 -СООС 2 Н s • то в конечном резу.пьтате получают двухосновную кис­
лоту:
Nа+[СН(СООС2Нr.~Г + CH;\-СНВг-СООс2 н r.
-N"llr...
HiOH
1°d,C2H"
Н\ОН
-+ сн-сн(сн з )-с0d,с2 н. liull 1l11lИЭ:t
.
..
~ш)}н
зс 2 ндн
..
+
сн-сн-соон
I
I
-+
соон СН;\
СОО:С2Н5
н;он
-+ С02 + yH2-~Н-COOH
соон
сн;\
МСТИJlSIllТНРllill1 КИI.:JIOТИ
с помощью малонового эфира можно синтезировать и полиосновные
кислоты.
2. Особенностью глутаровой и янтарной кислот является способ­
ность к образованию циклических ангидридов. Эта реакция легко идет при
нагреваНИI:I, например, янтарной кислоты и ее гомологов:
.,0
н 2о +
сн 2-с,
I
/0
СНГ С ,<>
ЯI111l1'lt,.1i
31IГНJq'JЩ
214
Подобные циклические соединения получают и из амидов янтарной
кислоты и ее гомологов:
СН-С4'"
I
2
сн-с
2
О
"NH 2
/ NH 2
"О,·,''',,.,,"" ;э.
'-о
НМIЩ ЯlIТitJ1IЮЙ
КИCJIOТI,I
(СУКIIИIIIIМИД)
При пиролизе кальциевых или бариевых солей адипиновой, пимели­
новой, проБКОВОЙ кислот отщепляется С0 2 и образуются циклические кетоны:
_4"'0
н 2 с-сн 2-с,
I
~ca :ЮО·С;э.
н 2 с-сн 2- С,
I
О
1\lfI(JЮIIСII'гаllflll
ОтделЬНblе представители. Применение
Щавелевая
кислота
НООС-СООН
содержится
в
виде
солей
во мног.их растениях, например в щавеле и кислице. Она кристаллизуется
из водных растворов в виде дигидрата (СОО Н)2 • 2Н 2 О С т. пл. 1О 1.5 ос.
Кристаллизационная вода удаляется медленной сушкой при 110-120 ос.
Безводная кислота плавится при 189 ·С.
lДавелевая кислота способна окисляться до С0 2 И воды:
(СООН)2 ~ 2С0 2 + н 2 о.
H<i
этом основано ее применение в качестве восстановителя и для уста­
новления титра перманганата калия.
При нагревании выше температуры плавления, особенно легко в при­
сутствии
концентрированной
серной
кислоты,
щавелевая
кислота
раЗЛ<iгается:
(СООН)2
---.
со
+ С0 2 + н 2 о.
Соли щавеJlевой КИСJlОТЫ (оксалаты) бывают средние и кислые. Изве­
СТны Т<iкже и молекулярные соединения кислых оксалатов с щавелевой
КИслотой, например КНС 2 О 4 • (СООН)2' 2Н 2 О - кисличная соль. На
liерастворимости оксалата кальция даже в уксусной кислоте основано
ПРИменение его в аналитической химии.
В Промышленности щавелевую кислоту получают окислением древес­
ных опилок кислородом воздуха при нагревании их с раСПJJавленным КОН
ИЛИ смесью КОН + NaOH, а также при быстром нагревании до
J1иевой или натриевой соли муравьиной кислоты.
400 'С
ка­
Щ<iвелевая кислота применяется при ПОJlировке металлов, в деревооб­
Раб<iтывающей промышленности (отбеJlка орехового и красного дерева),
ПРИ очистке урана, в качестве катализатора в процессах дегидратации,
215
в реакциях поликонденсации (например, при полу'/ении фенолформальде­
гидных смол), в красильной и кожевенной ПРО\\1ышленности и т. п.
Малоновая кислота НООС-СН 2 -СООН щество с т. пл.
130,3
кристаллическое ве­
.с. О синтезах с помощью ее диэтилового эфира уже
было СКRЗRНО.
Янтарная кислота НООС-СН 2 -СН 2 -СООН - кристалличес­
кое вещество с т. пл. 182,8 .с. В промышленности ее получают гидриро­
ванием МRлеиновой кислоты и ИЗ природной смолы
-
янтаря
-
путем
сухой перегонки.
Янтарную кислоту можно применять в реакциях поликонденсации
с гликолями; некоторые эфиры ЯНТRРНОЙ кислоты служат ПJlасти­
фикаторами.
Адиnиновая кислота НООС-(СН2)4-СООН - белое кристалли­
ческое вещество с т. пл. 153 ·С. Ее в больших количества получают окис­
лением азотной кислотой циклогексана, циклогексанола или циклогекса­
нона (см. гл.
14).
мышленности
используют
(с.
Адипиновую кислоту применяют иногда в пищевой про­
взамен
для
винной
производства
и
лимонной
ПОЛИRМИДНЫХ
кислот,
в
смол
волокна
и
основном
же
НRЙЛОН
233).
5.
ДВУХОСНОВНЫЕ НЕПРEДEJIЬНЫЕ КИСЛОТЫ
НRиболее простые неНRсыщенные двухосновные кислоты
- фумаро­
вая и малеиновая - имеют одну и ту же структурную формулу
НООС-СН=СН-СООН, но РRзные пространственные конфигурации.
ФумаРОВRЯ - транс-, а МRлеиновая - цис-изомер:
ноос-с-н
11
I+-C-COOH
ФУМtlРШltlJI КИСJIIIТtI
I+-C-COOH
11
I+-C-COOH
МftJIСИIЮI\Иtl КИ!.:JЮТiI
Обе кислотьi получаются при нагревании яблочной кислоты:
ноос-сн 2 -снон-соон
---+ н 2 о + ноос-сн=сн-соон
В зависимости от режима нагревания получается тот или другой изомер.
Малеиновую кислоту в промышленных МRсштабах получают каталити­
ческим окислением бензола или
гл.
нафтаЛИНR кислородом воздуха
.( см.
15).
Эти кислоты резко отличаются по физическим и некоторым химиче­
ским своЙст~ам. Фумаровая кислота имеет т. пл.
287-288
·С (в запаяН­
ном капилляре), а малеиновая плавится при 130·с. Фумаровая плохо
раствори·ма в воде (0,7 г кислоты в 100 мл Н 2 О при 25 ·С), малеино­
вая - очень хорошо (78,8 г в 100 мл Н 2 О при 25 ·С). Теплоты сгорания
этих
кислот неодинаковы: 1369,1 кДж/моль
1339,8 кДж/маш) для фумаровоЙ.
для
малеиновой
и
Эти кислоты сходны междУ собой по реакциям присоединения по месТУ
двойной связи водорода (в обоих случаях образуется янтарная кислота).
галогенов, например брома (образуется дибромянтарная кислота), га-
216
логеновОДОРОДОВ, например бромоводорода (получается бромянтарная
кислота), воды (образуется яблочная кислота НООС-СН 2 -СНОН­
-СООН) и др. Окисление фумаровой и малеиновой кислот разбавлен­
ным раствором КМПО4 приводит к винным кислотам: виноградной или
мезОВИННОЙ НООС-СНОН-СНОН-СООН (см. гл. 10.2).
При некоторых реакциях присоединения происходит предварительный
переход малеиновой кислоты в фумаровую.
Малеиновая кислота значительно сильнее фумаровой: их константы
диссоциации соответственно
117· 10-2
И
9,3' 10-2.
Обе КИСJlОТЫ способны за счет карбоксильных групп образовывать
соли, сложные эфиры, амиды и некоторые другие производные кислот.
Однако фумаровая кислота не дает циклического ангидрида, а малеИНОl3ая
легко его образует, так как оба ее карбоксила расположены по одну сто­
рону от плоскости двойной связи:
о
H-C-C~
'он
_
11
/он
H-C-C~
О
МIIJIС,.'IIIIIШI.lii
IIIIП1illШЛ
Малеиновая кислота под действием брома, иода, азотистой кислоты
легко переходит в устойчивую. стабильную форму
Обратный
переход осуществляется
- фумаровую кислоту.
под действием ультрафиолетовых
лучей.
Малеиновый ангидрид
нс-СО
11
)0,
как уже говорилось, легко образу-
нс-со
ется при нагревании малеиновой кислоты. Поэтому при каталитическом
окислении бензола и нафталина получается не сама малеиновая кислота,
R ее
RНГИДРИД.
Малеиновый
с Т. пл.
52,6 ·С;
ангидрид
-
бесцветное
кристаллическое
вещество
растворяясь в воде, он переходит в малеиновую кислоту.
Малеиновый ангидрид служит характерным реактивом для обнаруж~­
ния 1,2-диеновых соединений: он легко вступает в реакцию диенового
СИl1Тезэ (см. гл.
1.3) и
во многих случаях дает ценные продукты.
В последние годы он приобрел широкое применение в производстве
ПОJlИЭфИРНЫХ смол, а также ДJlЯ получения сополимеров (со стиролом, ак­
РИJlОВЫМИ и метакриловыми эфирами).
Мэлеиновый ангидрид гидратацией пере130ДИТСЯ в яблочную кислоту,
ПРИ меняемую в пищевой промышленности:
HC-~
1
/0 +
НС-СО
HP ~
НС(ОН)-СООН
H~H-COOH
217
ГЛАВА
7
СЕРОСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Сера является аналогом кислорода и потому может образовывать орга­
нические
соединения,
построенные
аналогично соединениям
кислорода.
Хорошо изучены такие соединения серы, как тиоспирты, тиоэфиры, тио­
альдегиды и тиокетоны, тиокислоты, а также сульфокислоты. В этом раз­
деле будут рассмотрены тиоспирты, тиоэфиры и сульфокислоты. Некото­
рые данные о тиокислотах сообщаются в гл. 10.5.
1.
ТИОСПИРТЫ (ТИМЫ) И ТИОЭФИРЫ (СУЛЬФИДЫ)
Подобно тому как спирты и простые эфиры можно рассматривать как
алкильные производные воды, так и тиоспирты и тиоэфиры можно рас­
сматривать как производные аналога воды
-
сероводорода, образован­
ные замещением алкилами одного или обоих атомов водорода в его моле­
куле. Общая формула тиоспиртов, инаLlе называемых muоламu или мер­
каnmанами, R-SH, а тиоэфиров (сульфидов) R-S-R':
CH:!SH
метилмеркаптан. метантиол (системаТИ'lеская номенклатура)
C:!H 5SH
ЭТl1лмерю!Птан. этантиол
C:!H 5 -S-С:!Нr.
ДIIэтItЛСУЛЬФI\Д. ЭТИЛТliOэтан
C:1H7 -S-C:!H 5
этилпропилсульФид.l-этилтиопропан
Тиоспирты И тиоэфиры получают из галогенопроизводных или спиртов
следующими общими методами:
С:!Н 5 !
+ KSH --+ C:!H'i-SН + Ю
С:!Н 5 ОН + H:!S :~~?~. C:!H 5 SH + Н:!О
С 2 Н 5 Вг + (NH:!)2C = S -+ [(NH2)2C = S+ - С 2 Н 5 ]Вг
2С:!Н 5 !
-110-. C2H 5SH + (NH 2):!CO
+ K2S --+ (C:!H5)2S + 2Ю
Меркаптаны кипят при значительно более низких температурах, чеМ
соответствующие спирты, очевидно, из-за меньшей ассоциации их моле­
кул. Для этилмеркаптана т. кип 37 ОС, а для этилового спирта 78,3 Ос.
Меркаптаны I1ЛОХО растворимы в воде. Низшие меркаптаны имеют отвра­
тительный запах. Меркаптаны в отличие от спиртов - слабые кислоты
(H 2S .:...- двухосновная слабая кислота, Ка = 6· 10-8); для этянтиола
КН -10-11. Поэтому тиолы, растворяясь в щелочах, образуют солеобраз­
ные соединения - тиоляты, или меркаnmиды, RSNa:
C:!H 5SH + NaOH --+ Н 2 О + C:!H 5SNa
218
Действие слабых окислителей на меркаптаны при водит к образованию
дuсульфuдов. Сильные окислители дают СУЛЬФОICuслоты:
101
C 2 H 5-S-S-С 2 Н r.
слабlolС ОКИCJIИТCJIИ
Jl.И~11fJIJUtСУЛl.фНJt
101
CHJII>II'oIC
C2Hr.-SО:IН
ОКНСЛИТCJ]
'iТill'СУJII.Ф()КИ..:JIIJТa
Таким образом, в отличие от спиртов при окислении тиолов окисляется
не углерод, а сера. Реакция идет, вероятно, по одному из следующих
путей:
R-SH{
R-S-S-R -+
J\НСУJII.фил
R-S-OH
СУJlI*IЮЫШ
-
КИСJЮТit
СУJII.фИ1iOНilll
КИCJШТ;t
Меркаптаны легко присоединяются к непредельным соединениям по
радикальному или нуклеофильному механизму. Радикальное присоеди­
нение:
RSH +R'--+RS' +RH
'+RSH
CH:1CH==CH 2 + RS'--+CH:1 CHCH 2 SR
tCH:\CH 2CH 2 SR
+ RS,
Нуклеофильное присоединение:
f'
_
-
+RSH
СИ,-СИ=СИ 2 +RS -си,-СИSR-СИ 2 -RS-" си,-СИSR-СИ,
Некоторые меркаптаны
имеют практическое
применение. Метил­
меркаптан, производимый в промышленности пропусканием смеси мети­
лового спирта и сероводорода над глиноземом
зуется
д.1Iя
синтеза
применяемого
в
при
400
медицине
'С, исполь­
.меmион.uн.а
СН:з -S-СН 2 -СН 2 -СНNН 2 -СООН.
Этил- и изоамилмеркаптаны используются д.1Iя одорации бытового
газа. Поскольку по запаху их можно обнаружить даже в самых ничтожных
Количествах, а природный газ практически не имеет запаха, добавление
незначительного количества изоамилмеркаптана дает возможность легко
заметить утечку в газопроводах. Додецилмеркаптан
C 12 H2S SH применяет­
ся как регулятор эмульсионной полимеризации в производстве синтетиче­
ского каучука.
Сульфиды
-
жидкости, кипящие при температуре, близкой к темпе­
ратуре кипения меркаптанов с той же молекулярной массой. Этилмеркап­
тан, например, имеет т. кип 37 'С, а диметилсульфид 38 ос. Они нераство-
219
римы В воде и имеют эфирный запах. По ХИМическим свойствам тиоэфи­
ры - вещества нейтральные. Действие на них окислителей, как показали
работы А. М. Зайцева, приводит к образованию сульфоксидов
или сульфонов
~
R-S-R
t
R-S-R
~
в зависимости от силы и количества окислителя:
[о]
С.IIабые
ОКИС.IIИТe.nн
[О]
",,0
....с-и.ll-.-.-ы-е"'-О';'КИ-С-.II-ит-е.ll-И---(С2НS )'S"
О
ИJlИ
с алкиnгалогенидами они образуют ТИОНИевые (сульфониевые) соли:
~
[
-S-CH]
I
. Г
CH....
СН: 1
И(JJt~С'·I.IЙ
ТрНМСТ~JIТIЮIIИА
к классу сульфидов относится боевое отравляющее вещество кож­
но-нарывного действия - иприт (J3,J3'-ДИХJIOРДИЭТИЛСУЛЬфИД). Это бес­
цветная жидкость (т. кип. 217 ·С) с чесночныM запахом.
Иприт можно получить по схеме:
Для дегазации иприта используется хлорная известь или хлорамины Б
и Т (см. гл.
18). Дегазаторы превращают иприт в сульфоксИД И другие
вещества.
Диметuлсульфоксид (СНЗ)2S
-+ О
шиРОко применяется как высоко­
полярный растворитель (дипольный момент 4,0 D, или 1,34· 10-29 Кn/M).
2.
ОРГАНИЧЕСКИЕ СУЛЬФОКИСЛОТЫ
Сульфокислотами называют производные углеводородов, содержащие
в Ka'lecTBe зяместителя сульфогруппу SОзН.
В соответствии с октетной формулой сульфогруппа имеет две ковалент­
ные и две семиполярные связи. Последние образованы с участием только
электронов атома серы. Однако д.1Iя сульфокислот может использоваться и
формула с шестью ковалентными связями (двумя ординарными и двумя
220
двойными), так как атомы серы имеют свободные d-орбитали, на которых
могут быть также размещены электроны (с расширением октета):
..
О
:0:
R~
О
t
R-S-OH
S~ ОН
"
R-S-OH
11
~
.к
:0:
О
О
Действительное состояние атома серы
-
промежуточное между со­
стояниями, отвечающими этим двум формулам.
Изомерия сульфокислот аналогична изомерии других замещенных уг­
леводОРОДОВ. Называют сульфокислоты по названиям соответствующих
им углеводородов с добавлением слова сульфокuслоmа. Например,
СН з 50 з Н метансульфокислота, СН 2 =СН -50 з Н этенсульфо­
кислота.
Способы получения. В лабораторной практике и в промышленности
применяется несколько способов получения сульфокислот исходя из
Ilpe-
дельных
.ио­
или
непредельных
углеводородов,
галогенопроизводных,
спиртов, РОД8ffffДОВ.
1.
Сульфокислоты С третичным углеродным атомом могут быть полу­
чены прямым сульфированием соответствующих алканов серной кИсло­
той. В промышленности смеси высших этиленовых углеводородов суль­
фируются триоксидом серы 50з. При этом получаются сложные СМеси
сульфокислот и эфиров серной кислоты.
2. Наиболее распространенным промышленным методом получения
сульфокислот и их производных является реакция сульфохлорирования
алканов. Используется также сульфоокисление алканов (см. гл. 1.1).
3.
В лабораторной практике сульфокислоты часто получают окислени­
ем тиоспиртов или роданидов (см. гл.
7.1).
Сульфокислоты наряду с эфирами серной кислоты получают аJJКИ­
лированием сульфита натрия галогенопроизводными:
4.
{
RO"
s---o
(ilJlКИJIИJЮlliillliС 1111 КИClIIIIЮJ1У)
RO/
1'0
R-S'..
6N~
(itJIКНJIИJКJltitlIIIС
1111
сере)
5. Олефины в присутствии пероксидов присоединяют гидросульфиты
с образованием солей сульфокислот:
Физические
и
химические
свойства.
Сульфокислоты
ЖИРIЮГО
РЯда - бесцветные кристаЛЛИ'lеские вещества. Гигроскопичны. Низшие
Представители легко растворяются в воде. По химическим свойствам они
221
в значительной степени аналогичны серной кислоте и карбоновым кисло­
там. Однако в отличие от последних это сильные кислоты.
Из производных сульфокислот наибольший интерес представляю,.
соли, хлорангидриды (сульфохлориды), эфиры И амиды.
1. Соли сульфокислот получают обычной реакцией нейтрализации:
R-SO:!H + NaOH ----+
R-SОаNа
+ Н 2 О.
2. Хлорангидриды получают либо реакцией сульфохлорирования ал­
канов, либо действием на сульфокислоты PCI 5 :
R-S0 2 -OH + PCI 5 ---+ R-S0 2CI + НСI + POCI:!.
3.
Эфиры могут быть получены этерификацией сульфокислот или из
сульфохлоридов:
R-S0 2 -CI + NaOR' ---+ R-S0 20R' + NaCI.
4.
Амиды сульфокислот (сульфамиды) образуются при действии на
сульфохлориды аммиака:
R-S0 2-CI + 2NH:! ---+ R-S0 2 -NH 2 + NH 4CI.
Применение.Соли высших предельных и непредельных сульфокислот
применяются как поверхностно-активные вещества. Сульфохлориды при­
меняются в кожевенной и текстильной промышлен-ности. Сульфоамиды
используются в промышленности как эмульгаторы, как поверхностно-ак­
тивные вещества при обработке металлов, для изготовления отбеливаю­
щих средств и т. д.
ГЛАВА
8
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Из органических соединений, содержащих азот, рассмотрим нитросое­
динения, амины, нитрилы и изоцианиды.
1.
НИТРОСОЕДИНЕНИЯ
Строение.' Предельные нитросоединения имеют общую формулу
или R-N0 2 . Они изомерны алкилнитритам (эфирам азоти­
стой кислоты) с общей формулой R-ONO.
CII H211 + ,N0 2
Отметим следующие различия между этими соединениями:
1. Алкилнитриты кипят при значительно более низкой температуре,
чем нитросоединения.
2.
Нитросоединения высокополярны и имеют большой дипольный
момент.
222
3.
АJlКИJlНИТРИТЫ легко омыляются щелочами и минеральными кисло­
тами с образованием соответствующих спиртов и азотистой кислоты или
ее соли. Нитросоединения реагируют иначе.
4. Восстановление нитросоединений приводит к аминам, а алкилнит­
ритов
-
к спиртам и гидроксиламину:
R-ONO + 2H 2--+R-OH
+ NH2 0H.
Нитросоединениям может быть придана следующая октетная формула,
в соответствии с которой один из атомов кислорода образует с азотом
двойную, другой
-
семиполярную связь:
О
R:N::b: или R-N(
О
'о
или
Эта формула вскрывает причину полярности нитросоединений, ОЩlако в
реальной молекуле связи обоих атомов кислорода с азотом не отличаются
друг от друга.
Поэтому правильнее изображать нитросоединения в виде двух гранич­
ных структур или формулой с дробными зарядами:
или
Изомерия. Номенклатура.
Изомерия нитросоединений начинается,
как и в случае других монозамещенных углеводородов (спиртов, галогеli­
алкилов и др.), с производных пропана. Различают первичные, вторичные
и
третичные
нитросоединения:
R-CH 2 -N0 2, R2CH-N0 2 и
R.з С -NО 2 . Нитросоединения обычно называют по углеводороду, добав­
ляя приставку нumро-. По систематической номенклатуре цифрой указы­
вается местонахождение нитрогруппы:
CH:\-N0 2
IIIIЧIOI\tСТНII
СН з -СН 2 -N0 2
CH:\-CH 2 -CH 2 -N0 2
IIИТjюэтаll
I-IIИТРОllРОllаll
сн.\-сн-сн,\
.
I
.
N02
2-IIИТIЩII!'Оllаll
CH:I-СНгСНгСНгN02
СН;гуН-СНгСН:\
1-lIитробyriШ
N02
2- llи ч к )(iУ,ОИII
СН\
СН;гуН-СНгN02
СН:\
1- llи ч ю -2-МСТИJIIIIЮШIII
. l'
СН.\-С-СН\
. I
.
N0 2
2-IIИЧЮ- 2- МС,.,IJIIIIЮI1311
223
Способы получения. Получение нитросоединений, по М. И. Конова­
лову, нитрованием в газовой фазе и из галогеналкилов было рассмотрено
вгл.1.1и2.1.
Физические свойства. Нитросоединения жирного ряда
-
жидкости,
обш\Дающие приятным запахом, перегоняющиеся без разложения; они
мало растворимы в воде,
ядовиты,
не вызывают коррозии
металлов, их
водные растворы имеют нейтральную реакцию. Плотность соединений с
- выше 1, с числом атомов четы­
1.
Нитросоединения ---: полярные вещества; их дипольные моменты по­
рядка 1,17-1,34' 10-29 Кл(м (3,5-4,0 О). Поэтому они кипят при бо­
числом атомов углерода менее четырех
ре и более
ниже
-
лее высоких температурах, чем спирты или карбонильные соединения.
ВИК-спектрах нитросоединений имеются интенсивные полосы в обла­
сти длин волн
1375
и
1580
CM- 1.
Химические свойства. Наиболее важные химические превращения
нитросоединений связаны со своеобразной структурой нитрогруппы.
1.
При
восстановлении
нитросоединений
образуются
первичные
амины:
R-NO~
+ бн-----.R-Nн~ + 2H~O.
2. Первичные и вторичные нитросоединения растворимы в щелочах
с образованием солей, т. е. проявляют свойства сопряженных СН-кислот
(см. гл.
1.4);
РКн нитрометана
10,2.
Это явление объясняется высокой
устойчивостыо образующегося при диссоциации карбаниона, стабилизи­
рованного сопряжением, как это показано ниже. В щелочной среде нитро­
соединения перегруппировываются в соли аци- нитроформы.
Таким образом, нитросоединения следует рассматривать как таутомер­
ные вещества, реагирующие в нитро- (а) и ацu-нитроформах (6).
Если щелочные растворы нитросоединений обрабатывать минеральной
кислотой, то происходит образование сильнокислой ацu-формы нитросо­
единения, которая затем легко изомеризуется в обычную нейтральную
форму:
Н
[
R_(~H_N.I'O?
а
~O
R-CH-N~]
t
~Q н+ Е
t
R-CH=N
jJ
~O
II+?
110
он
R-CH=N.I'
~O
(j
Поэтому нитросоединения относят к nсевдокuслоmа-м. Для псевдокислот
характерно, что сами они нейтральны, не обладают электропроводностью,
тем не менее образуют нейтральные соли щелочных металлов. «Нейтра­
лизация» нитросоединений основаниями (образование нейтральных со­
лей) идет Meд.neHHo, а нейтрализация истинных кислот происходит, как из­
вестно, мгновенно.
3.
Активность водородных атомов у атома углерода, непосредственно
связанного с нитрогруппой (СН-кислотность), проявляется и в ряде дру­
гих реакций.
224
Первичные и вторичные нитросоединения реагируют с азотистой кис­
лоТОЙ. а третичные не реагируют:
гСН,
I -
+ HD-NO
~
н.о
+ R-CH-N=O ?
R-C=N-OH
'1
N0 2
I
N0 2
N0 2
1111Т1)С)Jl(Jш.l~ КН":;JlI)'П.1
2
R YH + HO-NO
~
2T
HP + R
N~
-NO
N~
111.:~1\"t()llll·rtJ()..III.1
lUелочные соли нитроловых кислот В растворе имеют красный цвет.
ПсевдонитрОЛЫ в растворах и в расплавах окрашены в синий или зелено­
вато-синий цвет.
4.
Ilервичные и ВТОРИ'lНые нитросоединения конденсируются в при­
сутствии щелочей с альдегидами, образуя нитроспирты (НУКJlеофильное
присоединение по карбонильной группе):
снрн
R-CH, ~
I -
снрн
I
R-~-H .~
I
I
N0 2
N0 2
R.,CH
-I
N02
_
R-C-CHPI1
N0 2
~ R.. C-СНрн
<
I
-
N02
Нитрометан с формальдегидом дает три(гидроксиметил)нитрометан
О~N-С(СН20Н)з. Ilри восстановлении последнего получается соответ­
ствующий аминоспирт H2N-C(CH20H):~. используемыЙд.ля производст­
моющих средств и эмульгаторов. Азотнокислые эфиры нитроспиртов,
IIlIлример
°2N-С(СНzОNОz)з.
являются
ценными
ВЗРЫВ'lатыми
BlI
веществами.
5.
Соли ацu-формы первичных и вторичны нитросоединений lIа холоду
в водных
PllcTBopax
при действии минеральных кислот оБРllЗУЮТ lIJlьдеги­
ДЫ или ,(етоны (в момент выделения ацu-форма подвергается гидролизу):
2R-СН=N-ОNа
~
Существует несколько модифИКIЩИЙ этого метода превращения НlfтросоединеНIIЙ в ал[,­
депщы 111<етоны. позволяющих ПОЛУ'lать послеДllие с ХОРОШI1М11 выходаМ11. СреД111i11Х следует
ОТiI1епlТЬ ОбрабОТI<У НI1ТросоеДl1нениii TiCI:\ (реакцuя Нефа). В случае пеРВ11ЧНЫХ Н11Тросое­
д1 1 1tеНIIII Пр11 замене воды метанолом удается ПОЛУ'II'IТЬ ацетtlЛ11 аЛl,деГl1ДОВ.
б.
IlеРВИ1Iные нитросоединения при нагревании с 85%-I/ОЙ серной кис­
JlOтой переходят в карбоновые кислоты с отщеплением гидроксиламина:
R-CH~-NO~
8 Зак.181
+ H~S04 + H~O __ R-COOH + NH~-OH' H~S04'
225
Предполагаемый механизм реакции:
R-C=N-OH ~
~H
~ R-CO--NHOH ~
R-COOH + NH 20H
111+1
-----
Реакция служит промышленным методом получения гидроксилаМина
и некоторых киСлот.
Применение. Нитропарафины используются в технике как растворите­
ли, в производстве альдегидов, кислот, взрывчатых веществ, в реактивной
технике, резиновой промышленности (вулканизаторы), при изготовлении
пластмасс и т. д.
2.
АМИНЫ
Амины можно рассматривать как соединения, образующиеся в резуль­
тате
замещения
водородных
атомов
в
аммиаке
алкильными
группами.
В зависимости от того, сколько атомов водорода замещено радикалами,
разли'taют амины первичные
RNH 2, вторичные R2NH
и третичные RзN.
Таким образом, здесь понятия первичных, вторичных и третичных свя­
заны не с хараКl'ером углеродного атома, а со степенью замещения вода­
родов при атоме азота аммиака.
Изомерия. Номенклатура
Изомерия аминов зависит от положения аминогруппы в углеродной
цепи и от количества и строения радикалов, связанных с атомом 1130та.
Амины обычно называют по рациональной номенклатуре как алкилза­
мещенные аММИ<lка.
По систематической номенклатуре наЗВ<lНИЯ <lМИНОВ образуются добав­
лением суффикса -амин к Н<lзванию соответствующего Р<lдикала. Ниже
приведены Н<lзвания аминов состава С 4 Н 11 N:
CH2NH~-CH~-CH2-CH:\
6утиламин. !·аМl1но6утзн
CH:!-CH(NH~)-CH2-CH:!
IJmop-6УПiЛ2МИН. !,меТlfлпропилаМIIН
(CH:!)2CH":"CH2-NH~
flэо6утиламнн.
!·амино·2,меП1Лпропан.
2,меТИЛПРОПl1ламнн
гnреm·6утиламин.2·амнно·2,меТИЛПРОПilН.
!.!-днмеТИЛЭТl1лаМI1Н.
CH: 1 -NН-СН 2 -СН z -СН: 1
меТIIJ1пропиламин.
CZHfi-NН-СzН s
ДИЭТНJ1i1МИН
N· меТI1ЛПРОПliЛамнн
CH:1-NН-СН(СН:1)z
меТI1J11tЗОПРОПI1J1аМI1Н. N·меП1Л,!,меПIJ1ЭТI1J1аМIIН
(CH: 1 )zN-С 2 Н"
ДI1меТI1J1ЭТlIJ1амнн.
226
N.N· ДllмеТI1J1ЭТI1J1амнн
ТаКИМ образом, формуле
C4 H 11 N
отве'rают ',етыре лервичных амина,
три вторИЧНЫХ и один третичный.
Способы получения
АМИНЫ широко применяют в технике и лабораторной практике и поэто­
му разработано много способов их получения.
1. ПРО17усканием паров спирта и аммиака при 300 ос над катализато­
ром (АI 2 О;з; Th0 2 ) получают смесь первичных, вторичных и третичных
аминов с преобладанием первичных:
2. Действием аммиакя ня галогенопроизводные (реакция нуклео­
фильного замещения) получяют смесь солей рязличных аминов, так как
обраЗУlOщиеся в ходе реакции амины (благодаря частичному разложению
солей аммияком) вступают, в свою очередь, в реакцию с галогеналкилами
(А. Гофмян):
CH:11 + NH:1~ CH;INH 2 • НI
~OJII, МСТIIJlttМ~IШI
CH:1NH 2 '
НI
+ NH:1~ CH:1NH 2 + NH 41
CI-I:1-NH 2 + CH;II
~
(CH:1)2NH' 1-11
COJII,!tItM('TIIJltlMlllltI
(CH:1)2NI-I + CH:1I ~ (CH:1):IN' I-II
Co;ll, TPIiMCTIIJIiJMHIIH
Последний продукт рассматривают как полностью замещенное аммо­
Ниевое
соединение
и
называют
иодисmы.м.
mеmра.м.еmuла.м..м.онuе.м..
Смесь аминов обрабятывают щелочью и подвергают перегонке с водяным
паром. Первичные, ВТОРИ'lНые и третичные амины отгоняются с водяным
паром, а гидроксид полностью замещенного аммония [(СНЗ)4NjОН оста­
ется В перегонной колбе. Разделение яминов производят, пользуясь их
различной реакционной способностыо.
Реякционная способность алкилгалогенидов в реякции ялкилировю,ия
аминов, как обычно, уменьшается В ряду: R-I>R-Вг>R-СI>R-F и с
УвеЛичением степени замещения в амине и галогеналкиле. В реякциях с
аЛкилхлоридами и алкилбромидами добавление алкилиодидов облег',яет
замещение.
3. Амиды кислот при расщеплении гипобромитом или гипохлоритом
(А. Гофман) дают первичные ямины:
КllrO Э
(Вг,+КОll)
Мехянизм реакции см. гл. 24.5.
227
4. Нитросоединения восстанавливаются водородом в присутствии '<а­
тализаторов Pt, Pd, Ni или другими способами с образованием первичных
аминов:
R-N0 2 +
3Н 2
----+ R-NH 2 + 2Н 2 О.
5. Нитрилы при действии восстановителей или водорода в присутствии
(Pt, Pd, Ni) дают преимущественно первичные амины;
катализаторов
Восстановление изоцианидов приводит к образованию преимущественно
вторичных аминов:
R-CN + 2Н 2 ----+ R-CH 2 -NH 2
R-NC + 2Н 2 ----+ R-NH-CH:1
6.
Существует уникальная возможность непосредствениого превращения предельных
углеводородов в амины. но только с третичными углеводородными раДl1калаМII:
Физические свойства
Простейшие амины
метиламин, диметиламин и триметиламин
-
-
газы, хорошо растворимые в воде, обладающие аммиячным запахом.
Остальные низшие амины
ные амины
-
ны
-
-
жидкости с запахом аммиака. Более слож­
жидкости с неприятным запахом
рыбы.
Высшие ами­
твердые, нерастворимые в воде вещества, лишенные запаха.
Амины ассоциированы менее спиртов, и потому они кипят при более
низких температурах,
чем
спирты с тем же ,(ислом углеродных атомов.
При равном числе атомов углерода выше всего температура кипения у
первичных и ниже всего у трети'IНЫХ аминов. Так, диэтиламин кипит при
56 ·С, а бутиламин - при 76 ·С, н-гексиламин (первичный) кипит при
129 ·С, дипропиламин (вторичный) - при 110,7 ·С, а триэтиламин (тре­
тичный) при 89,5·с. Эта закономерность в изменении температуры
кипения аминов обусловлена изменениями в ассоциации их молекул с об­
разованием более или менее ПРОЧНЫХ водородных связей.
Простейшие амины в отличие от аммиака горят в воздухе.
ВИК-спектрах первичных и вторичных аминов наблюдаются поглоще­
ние в области 3300-3500 CM- 1, отвечающее валентным колебаниям
N-Н-связи. Полосы поглощения, соответствующие валентным колеба­
ниям связи
располагаются в области длин волн 1100-1300 см- 1
N-C,
и трудно идентифицируются.
Химические свойства
В химическом отношении амины очень сходны с аммиаком: вступают
в различные реакции как нуклеофильные реагенты.
228
Молекулы аминов, как и аммиака, имеют пирамидальную симметрию,
причем обращение конфигурации происходит 10:~-105 раз в 1 с (у амми­
ака 4' 10'0 раз в 1 с). Нуклеофильные свойства аминов связаны с наличи­
еМ У атома азота пары неподеленных электронов. При образовании за счет
этих электронов химической связи получаются аммониЙ.ные ионы, имею­
щие тетраэдрическую структуру.
1. Водные растворы аминов имеют явно основной характер, что можно
объяснить образованием полностью ионизированных алкилзамещенных
гидроксида аммония:
R-NH~ + НОН <=t [R-NH:1]+ + НО-.
2.
Амины дают с минеральными кислотами алкилзамещенные аммо­
нийные соли:
R-NH~ + HCI--+ [R-NН:1]+СГ.
ХJIOРИСТIJlii
ClJIКНJIИММOIlиii
Основные свойства аминов (К,)
=10-4)
оБУСJlOвлены способностью
свободных (неподеленных) электронов атомя юота присоединять протон
(координяционная связь):
R-
h
+
Н'
?[R'H'
Основность аминов выше, чем аммияка, блягодаря тому, что индук­
ционный эффект радикалов увеличивает электронную плотность на атоме
азота, электроны азота прочнее связывают протон.
Следует заметить, ,(то первичные и вторичные ямины проявляют
и о'(ень слабые кислотные свойства. Они образуют с щелочными металла­
ми
-
алкил- или диалкиламиды:
2R~NH
+ 2N~ --+ 2R~N-NII + H~.
Э. Амины вступают в реакцию алкилировяния (см. гл. 2.1 ).
4. Амины можно ацилировать, в частности ацетилировать, действуя
УКСУсным ангидридом или хлористым ацетилом:
31 LСТltJI'1ТIIJIИМIIII
IIJIII
Реакция ацилирования вия -
<1ТИJIИllСТtlМIЩ
типичная реакция нуклеофильного замеще­
может проходить по механизму SN 1 или SN2 (см. гл. 2.1 ).
5. Азотистая кислота реагирует с первичными аминами с выделением
i130ТЯ и образованием спиртов, алкенов или других веществ, со втори'(ными
229
аминами -
с образованием нитрозаминов. С третичными аминами на хо­
лоду она не реагирует:
R-NH.I + HN02 _ _ R-OH + N2 + Н 2 О
в peaKЦlIIt аминов с азотистоil КlICJlОТОЙ деiiСТВУЮUll1М реагентом является
N20:I • нитро­
ЗИРУЮЩI·lit амин по схеме:
~N20S+H20
2HN0 2
0-
-~:1...+ь'
N-O-N-O ~ r_~:tJ~) ~ N=O]~ -*t-N=O+NO;
--......
[ 1
1
а) в CJlучае пеРВИ'fНЫХ aMllHOB возникаЮЩIIi\ l\аТIЮН теряет протон 11 превращается в НlI­
трозаМIIН:
I(OTOPbIil
В IШС'nОЙ среде дает
o'leHb
"
RCH:/CH 2 N =
нестоiil(УЮ сo.nь ДНIIЗОНlIЯ
н+.
NOH~ RCH 2CH:/
раЗЛllгающуюся с ОбразоваНllем карбениевого lIона
11
+
N .... N +
Нр.
выделеНllем азота:
+
RCH:/CH 2 N """ N __ RCH2CH~ + N 2.
Конечными продуктами реаКЦIIИ являются обычно спирты. ЭфllРЫ или углеводороды в зави­
СIIМОСТИ от ПРIIРОДЫ оБРllзующегося 1(lIрбеflllевого Iюна:
R-CH ~H+
2
2
~ ~ R-CH~-CHPH
~
+
R-CH=CH 2 + Н+
Н+
* A.nllфаТII'lеСКllе диазосоеДllнения. особенно ДИlIзометан CH,N,. Ilграют существенную
рот, I! современном органическом С\lнтезе. ДИlIзомеТIIН оБЫ'IНО ПО'nУ'IIIЮТ щелО'IНЫМ
j1азложеНllем нитрозометилмочевины (гл. 10.6)
N("CH:1
о=с(
"NO +
NH2
21\0Н ~
CH 2 N2 + NH:1 + KlCO:\ + HP
а ТaI(же деilСТВllем хлороформа 11 СПIlРТОВЫХ PIICTBOPOB щелочей на ГllДраЗIIН (гл 9.2).
ДlllIзометан желтыi1 ГIIЗ (т. ЮШ. -24 ·С). ЯДОВI1Т. ВЗРЫВООПllсен. Имеет линейное
строение. которое невозможно ВЫРIIЗИТЬ одной формулой. Его Ilстинное СОСТОЯНllе промеЖУТО'lIlOе меж,ду изоБРllжеНlIЫМl1 двумя
сн,=
+
rpllHII'IHbIMII
+
N~CH,-N
N=
Главное применение .диазомеТIIНII -
СТРУКТУРIIМИ:
.. N.
меТИЛllроваНllе оргаНИ'lеских соединеНllil
связаliO с его способlЮСТЬЮ легко дaBIITb диазониевыif КIIТlЮII:
н+.
+
CH,N, ---+ CH,,-N " N
RCOO-
~
.
R-COOCH,,+N,.
С ДlIlIз(;метаном обычно работают в растворах ('1фнр. бензол).
230
Метиламин
образует
преимущественно диметиловый
СПllРТ (выход 60%), а пропнламин -
эфир,
этиламин
-
этиловый
пропиловый спирт (7 %), иэопропиловый спирт (32%),
прОllилен, циклопропен, а также пропил- и ИЗОПРОПliЛиитриты. Для высших аминов еще бо­
лее характериа изомеризация карбеииевого иона.
Таким образом, эта реакция не имеет препаративного значения.
б) В СЛУ'lае вторичных аминов катион отщепляет протон с образованием нитрозамина:
+
R2N Н Нитрозамины
+
N =O~ R2N-N=O+H .
желтые или оранжевые масла. Концентрированными кислотами они
-
расщепляются на исходный амин и азотистую кис.10ТУ.
в) Третичные амины в слабокислой среде (рН З-6) при нагревании расщепляются с об­
разованием ВТОРliЧНОГО
8MIIHa
и альдеГltДа или кетона, ПРИ'lем вторичный амин дает с избыт­
'<ОМ азотистой кислоты нитрозами н:
-HNO
6.
..
ПеРВliчные амины могут бытьдегидрированы в НlIТРliЛЫ действием раЗЛИ'IНЫХ реагеи­
ТОВ (IF", Pb(OCOCH:1)4 и др.) или каталитически:
R-CH 2-NH 2 ~ R-CN.
Эта реакция - обратная ПОЛУ'lению aMltHOB из нитрилов (гл. 8.З).
7. ПеРВliчные 11 вторнчные амины замещают атомы водорода в аМllногруппе галогенами
при обработке гипогалогенитаМli с образованием N-галогенаМliНОВ:
R-NH 2
NaOCI ~ R-NHCI _N_aO_C_I..... R-NCl 2
N-ГалогенаМIIНЫ
- оБЫ'IНО жидкости С резким запахом. АКПlвные галогенирующие ре­
18), сильные окислители. Взрывоопасны.
8. Амины легко окисляются. Третичиые aMI1Hbl окисляются гидропероксидами до окси­
агенты (гл.
дов амииов:
ПеРВИ'lные aMIIHbl типа R-CH 2-NH 2 ОI<ИСЛЯЮТСЯ персульфатами в щеЛО'lноii среде
в ПРItL'УТСТВIШ катаЛl\Тli'lеских КОЛllчеств AgNO:1 с образованием альдоксимов, ГИДРОЛItЗУЮ­
ЩIIХСII до альдеГIIДОВ и aMIIHoB. ПеРВliчные амины типа R2CH-NH 2 образуют в тех же усло­
ВIIЯХ "етоны. ПеРВИ'lные амины типа R: 1C-NH 2 при этом не изменяются.
В ДРУГltХ условиях последние окисляются с образованием f1ЛКИЛГltДроксилаМltна, нитро­
зосоеДllнения и, наконец, нитросоединения:
в реакциях окисления других первичны и вторичных аминов ПОЛУ'lают­
СЯ сложные смеси продуктов окисления.
Применение
Амины применяются в качестве органических оснований и для реакции
аминирования. Некоторые амины применяются как селективные раствори­
тели для извлечения урана из сернокислых растворов. Амины, обладающие
231
запахом
рыбы,
используются
как
приманка
в
борьбе
с
полевыми
грызунами.
В последние годы третичные амины и соли четвертичных аммонийных
оснований, особенно с большими алифатическими или жирноароматичес­
кими радикалами, получили широкое применение в качестве катализато­
ров межфаЗIIОГО катализа (см. гл.
2.2).
Понятие о диаминах
Соединения, содержащие две аминогруппы в молекуле, называются
диаминами:
ЭТllлеНДIl3Мlffl. 1.2-Дl-lаМllноэтан. 1.2-этандиа­
мин
ТlщмеТl1леНДIIНМIIН. 1.a-ДllаМllflопропан. l.a-npoпаflДll3МI1fI
H~N-CH~-TH-NH~
1.2-днаМИflопропан. 1.2-пропандиамнн
СН;\
H~N-CH~-(CH~)4-CH~-NH~
геl{сtlмеТl1ЛеНДIIt1МI1Н. 1.6-диаМflliOгексан.
1.6-геКСtlflДиtlМIIН
Диамины могут быть получены теми же способами, что и моноамины:
восстановлением динитросоединений, взаимодействием аммиака с дига­
логенидами, восстановлением динитрилов и др.
Низшие диамины растворимы в воде и являются более сильными осно­
ваниями, чем моноамины.
Диамины образуют соли с двумя эквивалентами кислот, могут алкили­
роваться и ацилироваться с участием как одной, так и обеих аминогрупп.
Гексамеmuлендuамuн в промышленности получают из адипиновой
кислоты. Аммонийная соль этой кислоты подвергается дегидратации с об­
разованием диамида адипиновой кислоты и затем ее динитрила. Каталити­
ческим
восстановлением
динитрила
адипиновой
кислоты
получают
гексаметилендиамин:
НООС(СН2)4СООН
2NH" I
NH400C(CH~)4COONH4 -2Н 2 О
- - . NH 2CО()
СН 2 4CONH~
- - . N....,C(CH2)4C""",
I
-2Н20
_--=.~
N~NH2(CH2)fiNH~
-8 другом промыленномM способе получения гексаметилендиамина ис­
ходным веществом является дивинил:
СН 2
= снсн = СН 2
Cl 2
---"--+ СН 2 С1сн
= снснр - 2NaCN
--+
- - . NCCH 2CH = CHCH~CN
~
- - . NH2CH~CH2CH~CH~CH~CH~NH2
232
Поликонденсацией адипиновой кислоты с гексаметилендиамином по­
лучают полиамиды с довольно высокой температурой плавления. Их при­
меняют в производстве синтетического волокна, по свойствам весьма
БJIИЗКОГО к натуральному шелку,
~С-ОН H-NH
о
••
I
-
-
~C-fОНН1-NН
__
. _. I
I ._._._--" I
(CH~~;
(~:H~ )~
найлона:
-
(СН 2 \;
(CH~)~
Н~-!t.СR.Qj-~
но-с=о
'III()
~
I7HOOC-(CH~)~-CO-NH-(CH~)I;NH~ ~
~
[-CO-(CH~)~-CO-NI-I-(CH~),;NH-]I/
в полиамидах полиметиленовые цепи -(СН 2 )4- и -(СН 2 )6- свя­
заны амидными группировками
-CO-NH-,
характерными для белко­
вых веществ, к которым относятся шерсть и натуральный шелк (гл.
3.
НИТРИЛЫ И ИЗОЦИАНИДЫ
НИТРИJlЫ имеют общую формулу
ИJlИ
32.1).
+
R - N ==с.
R-C ==N,
а изоцианиды
R-N
~ С
Соответствующие октетные формулы (электроны, предоставленные
для связи азотом, обозначены крестиком)
в нитрилах цианогруппа соединена с радикалом
изоцианидах
-
R атомом углерода, а
в
атомом азота, причем азот с углеродом в этом случае свя­
зан семиполярной связью, о 'lем свидетельствует высокий дипольный мо­
мент изоцианидов.
В случае нитрилов атомы углерода и азота образуют между собой одну
0"- и две 7t-СВЯЗИ, ПРИ'lем каждый из них дает для образования этих связей
по три "Jлектрона. Атом углерода находится в состоянии sр-гибридизации.
В сравнении с С == С связь С == N ОТЛИ'Jaется большей ПРО'IfIОСТЬЮ (на
368,4 кДж/моль) и высокой полярностью (дипольный момент около 4 D
или
1,34·10-29 Кл/м).
В молекулах изоцианидов атомы углерода и азота также образуют одну
0"- и две 7t-связи, однако ДJlя образования этих связей атом азота дает че­
тыре электрона, а атом углерода
- только два, 110 предоставляет ДJ1Я
"JJleKTpOHOB азота «пустую» р-орбиталь. Таким образом, в изоцианидной
группировке одна из связей донорно-акцепторная.
233
Изомерия. Номенклатура
Нитрилы называют по кислотам, в которые они переходят при омыле­
нии, или по углеводородам, отвечающим общему числу углеродных ато­
мов, с добавлением окончания -нитрил. Можно также их рассматривать
как цианистые алкилы:
нитрил уксусной кислоты (ацетонитрил). этаннит·
рил
НИТРIIЛ пропионовой кислоты (пропионнитрил),
ПРОПiIltНИТРИЛ
Нfприл масляной кислоты, бутаННИТРllЛ
CH.j-СН-СН ..N
.
нитрил изомасляной кислоты,
I
2-метилпропаннитрил
СН з
Изоцианиды (изонитрилы) обычно называют по радикалам с добавле­
нием окончания -изоцианид:
CH:1-N ;;;rC
CH;j-СН 2 -N;;;r С
"'-ИJIII:iОIIНЮIНII
МСТlIЛИ:llIIIННIIIЩ
Способы получения
Способы получения нитрилов и изоцианидов в соответствии с их раз­
личным строением большей частью сильно различаются.
1.
При взаимодействии с галогеналкилами соли синильной кислоты
щелочных
ра
-
металлов
дают
преимущественно
нитрилы,
соли
изоцианиды:
R-CI + KCN~R-CN + KCI
R-CI + AgCN~R- NC + AgCI.
2.
Амиды кислот при дегидратации превращаются в нитрилы:
R-CONH2~R-CN
Механизм дегидратации:
/ ОН
?R-C
~N-H
234
?
R-C=N
+ Н 2 О.
сереб­
з. Альдоксимы (но не кетоксимы) при дегидратации уксусным ангидри­
доМ тякже образуют нитрилы. Вна'lале возникают эфиры аJlЬДОКСИМОВ,
которые при нагревании разлагаются на нитрил и уксусную кислоту:
R-CH=NOH + (CH:1CO)20
~
4.
~ R-CH=N-OCOCH:I~
R-C=N + CH:1-COOH.
Для перви'lНЫХ аминов характерю'l так называемая изонитрильная
реякция: при нагревании первичных аминов с хлороформом в присутствии
КОН обрязуются изоцианиды, которые обнаруживаются по неприятному
запяху:
R-NH 2 + CHCI:1+ ЗКОН ~ R-NC + ЗКСI + ЗН 2 О.
Реакция
протекает
с
промежуточным
образованием
нестойкого
дихлоркарбена, который своей «октетной дыркой» присоединяется к сво­
бодной электронной шtре атома азота. Потеря двух молекул НСI приводит
к изоцианиду:
CHCI:! + КОН ~ :CCI 2 + I(СI + Н 2 О
R-NH 2 + :CCI 2 ---;.. R-NНг~СI2
21<0">
R-NЕt: + 2КСI + 2Нр
ВТОРИ'lные и третичные амины не дают этой реакции и, следователЬ/ю,
она может быть ИСПОЛЬЗОВЮlа для открытия первичных аминов.
Физические свойства
Низшие нитрилы (до С 11) -
жидкости со слабым эфирным запахом,
перегоняющиеся без разложения при атмосферном давлении;
и
C2 H5CN
CH;jCN
растворимы в воде. Температура кипения нитрилов БJlизка
I{ температуре кипения соответствующих спиртов с тем же числом угле­
родных атомов, например: С 2 Н 5 ОН
'С; C2 H5 -CN 97,1 .с.
78,3
·С;
C:JH70H 97,8
·С;
CH:J-CN
82
Изоцианиды кипят при несколько меньшей температуре, чем нитрилы
с тем же числом углеродных атомов, например, дЛЯ CH:J-CN т. кип.
82
·С, а для СНз-NС
-
59,6
·С.
Химические свойства
Нитрилы и изоцианиды сильно ОТЛИ'lаIOТСЯ по характеру ХИМИ'lеских
превращениЙ.
1.
Нитрилы омыляются водными растворами минеральных кислот
и щелочей с образованием соответствующих органических КИСJlОТ. Меха­
низм ОМЫJlения нитрилов в щелочной среде:
8+,....1- +НО-
R-C=::N: -
о-н
I "- +НОН
о-н
О
О
R-C#
_Н.
ОН R-C?
R-C=NI -НО-. R-C=N:H • ..
'NH 2 -NНз
'ONa
1"
235
в кислой среде (Х
-
анион кислоты):
~
~
н-х
R-C=N:
+-
#
н + Х
R-C::N:H +"-O-I1~
.-!.!.+
:I1+э
~ R-C=N-H
1+-6~
R-C=N-H
I
?
о-н
R]-NH 2 + н-х + Н 2 О
R-C~
~
О
"он
+ NH Х
1
О
Изо циан иды гидролизуются только растворами минеральных кислот
с образованием муравьиной кислоты и первичного амина:
(с.
2. Восстановление
228).
нитрилов
и
изоцианидов
приводит
к
аминам
ВCJlедствие известной «ненасыщенности» углеродного атома изоциа­
ниды способны к реакциям присоединения:
R-N~C
3.
СI
1<:11
R-с=NI
101
R-N=C=O
ISI
R-N=C=S
-ЕЕ
"'СI
При нагреванltIl нltтрнлов С Кllслотами происходит обмен раДIIкалами, если взятаl<ИС­
лота более слабая, чем отвечающая нитрилу. Методом меченых атомов установлено, что уг­
лерод-углеродная связь в реакции не
y'lacTByeT:
R-C"'N +R'-COOH ~ R-COOH + R'-C"'N.
Отдельные представители. Применение
Ацеmонumрuл СНз-СN, т. кип.
82
·С,
получяется дегидратацией
ацетамида. Применяется как полярный растворитель и как исходное ве­
щество в раЗЛИ'IНЫХ синтезах.
А"рuлонuтрuл (пропеннитрил)
CH 2 =CH-CN
получают из пропиле­
на аммонолизом по схеме:
а также из ацетилена. Это жидкость (т. кип.
запахом.
236
78
·С) со слабым приятным
Акрилонитрил применяют для получения синтеТИ'lеского волокна ак­
рuло на (нитрона):
и для
производства дивинилнитрильного
синтетического
каучука
марки
СКВ. обладающего масло- и бензостоЙкостью.
ГЛАВА
9
ЭЛЕМЕНТОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Подавляющее
большинство
органических соединений,
являющихся
объектом изучения классической органической химии, содержат кроме уг­
лерода и водорода атомы кислорода, азота, серы, и галогенов. В настоя­
щее время получены органические соединения почти со всеми элементами
периодической системы. Эту область органической химии А. Н. Несмея­
нов предложил называть элементорганической химией. Таким образом,
элементорганические соединения
это соединения, которые кроме
-
перечисленных выше оБЫ'IНЫХ элементов содержат какие-либо другие
элементы,
В табл.
атомы
которых
непосредственно
связаны
с
углеродом.
10 показано распределение в периодической системе элементов
по типу образуемых ими элементорганических соединений.
Стойкость элементорганических соединений весьма различна: некото­
рые из них не разлагаются при довольно высоких температурах и прояв­
ЛЯlOт химическую инертность, другие
-
очень нестойки и реакционно­
способны.
Строение. Номенклатура
В этом разделе рассмотрены только элементорганические соединения
с КОВRлентными или электровалентными связями. Представление о со­
еДинениях с орбитальными связями дано в гл.
27.
БОJlЬШИНСТВО элементорганических соединений имеет ковалентные
L:ВЯЗи элемент
-
углерод. Такие соединения летучи и растворимы ворга·
нических растворителях.
Электроположительные элементы (типичные
металлы) образуют металлорганические соединения с сильно полярными
СВязями. Они нелетучи и нерастворимы в органических растворителях.
Встречаются и соединения с ионными связями. Примером соединения
с ионной связью может быть СНзNа, сковалентной МОжет быть и двойной, как в CH 2 =AI-I.
SП(СН З )4; связь
237
I-.:J
c.v
т а БJlI1 ц а 10. Распределение ЭJlементов в периодической системе
по типу образуемых ими злементорганических соединений
00
1-
nр~имущественно IIOHHbIe;
11 -
преимущественно d-орбитаJlьные;
преимущественно коваJlентные
IIJ -
IП
г-----,
: Li
I
Ве :
,
I
I
: Na Mg :
11
r-------------------,
,. ____ ..)
I
I
I
I
: к Са
: :
I
I
: Rb Sr
:
I
I
II
Cs
, РТ
:
:,
I
Sc
Ti
V
У
Zr Nb
I ,
,
Ra : I
I
:
AL
Si' Р S
L_-.
Pd , I Ag Cd In
Sn Sb
Р!
РЬ
Ir
Ас
Zn
Оа Ое А5 i Se
I I
1II :, Аи
Лантаноиды.
АкТI!НОИДЫ.
Не
F
Ne
Hg Ti
L_,
ТЬ Ра
Ро
Bi
Nd Рт Sm Еи Gd ТЬ Dy Но Er Ти УЬ Lu I
U
Np
Ри Аm Ст
Br
Bk Cf Es
Рт
Kr
Те I 1
Хе
L_~
L ___________ ,
Pr
СI Ат
At: Rn
L- _ _ _ _ _ _ _ _ _ _ _ _ _
I
Md No Lr:
L _______________________________
2
О
N
МО Те
2
: Се
L_,
Ni : :
Ru Rh
' : Си
в ,с
Сг Мn Ре Со
Ва : " La ' Hf Та W Re 05
L _ _ _ _ _ .J
Н
г-,
~
...J
в табл.
11
приведены данные о структуре связи углерод
-
металл
(процент «ионности»).
та бл и ца
11. Характер связи углерод Ионность,
СВЯ3Ь
С-I(
0/..
С-Са
C-Mg
ИОННОСТЬ,
СВЯ3Ь
С-CI
51
47
43
43
35
C-Na
C-Li
металл
(1..
22
С-Zп
18
C-SIl
12
12
9
С-РЬ
C-Hg
rз одно соединение может входить несколько атомов элементов, одина­
ковых
или
разных,
связанных
между
собой
непосредственно:
(С6Нs):зGе-Sп(СНз)з или через атомы углерода:
СнНп'\..
,/СНа
, /AI-СН2-СНгАs,~
СН !
'\.-Н\
Органические радикалы, связанные с металлом или неметаллом, могут
содержать только заместители, не способные расщеплять связь угле­
род
-
элемент. Так, вещество HO-СН 2 -СН 2 -МgВг не может быть
полу'(ено, так как связь с- Mg энергично расщепляется гидроксилсодер­
жащими соединениями, однако вещество HO-СН 2 -СН 2 -НgВгустой­
чиво, так как ртутьорганические соединения стойки к действию гидро­
ксилсодержащих соединений.
Элементорганические
соединения
бывают
простые,
например
(СН:З)2Мg, и смешанные, например СНзМgВг.
Название металлорганического соединения складывается из названия
радикала,
СНзNа
связанного
с
металлом,
и
названия
металла,
например
- метилнатрий, (C2H5)2Hg - диэтилртуть, C2H5MgBr -
бро­
Мистый этилмагний. Соединения неметаллов и нехарактерных металлов
МОжно рассматривать как гидриды элементов, в которых некоторые или
Все
атомы
(СН:\)2РН -
водорода
замещены
органическими
диметилфосфин; (СН:з)зВ -
радикалами,
например
триметилбор.
Общие способы получения
Наибольшее значение имеют следующие общие методы получения
i\JlИфатических элементорганических соединений:
1. Реакция элементов с галогеналкилами:
СНэI
"фИ!,
+ Mg~CH:!MgI
С 2 Н"Вг + 2Li ~C2H"Li + LiВr
ПО этой схеме реагируют с галогенопроизводными многие элементы.
Iii\Иболее часто этот способ используется для приготовления магнийорга­
НИческих соединений (реактивов Гриньяра) и литиЙалкилов.
239
Метод особенно удобен для получения соединений типичных металлов.
Реакция
2.
металлоргани'.еских соединений
с галогенидами
более
электроотрицательного элемента:
ЗZП(С 2 Н 5 )2
+ 2BCI:1 --+ 2B(C 2H ii ):1 + ЗZпСI 2 ·
Реакция металлоргани'.еских соединений с более электроположите­
3.
льными металлами:
Hg(C 2H ii )2 + 2Nи --+ 2С 2 Н"Nи + Hg.
Последние два способа используются для получения органических про­
изводных большинства элементов с применением реактивов Гриньяра или
ртутьорганичес.<их соединений.
Вследствие высокой активности большинство алифатических металл­
органических соединений может быть получено только при полном отсут­
ствии кислорода, а во многих случаях и влаги.
Химические свойства органических соединений типичных металлов
резко отличаются от свойство соединений неметаллов. СледУет отметить,
что
свойства
органических
соединений
неметаллов
различных
групп
сил.)но различаются меЖдУ собой. Поэтому ниже кратко рассматриваются
только общие свойства металлорганических соединений. Свойства соеди­
нений других элементов
рассматриваются
по
группам
периодической
системы.
Общие реакции меТ8JJJJорганических соединений
Металлорганические соединения отличаются очень высокой реакцион­
ной способностью, некоторые из них на ВОЗдУхе самовоспламеняются. Их
активность является следствием высокой полярности связи метаЛJJ
лерод с частичным
ным
-
положительным
зарядом
на
металле
и
-
уг­
отрицатель­
на углероде. Эта полярность возрастает по мере увели'.ения элек­
троположительности металла. Максимум полярности достигается у сое­
динений щелочных металлов, которые могут рассматриваться как соли
углеводородов. Рассмотрим наиболее важные реакции металлорганичес­
ких соединений (на примере соединения магния).
А.
РасщеПJJение простых связей.
1.
Реакция с веществами, содержа­
щими активный водород (образование углеводородов):
RMgX +
НА --+
RH + Х - Mg-A.
НА может быть водой, спиртом, амином, кислотой, тиоспиртом. Эти реак­
ции используются для
ву
-
ЦеревитюlOВУ
-
определения
«активного водорода»
деляющегося из СНзМgI).
2.
Реакция с галогеналкилами:
RMgX+R'X--+R-R'+ MgX 2 .
240
по Чугае­
Терентьеву (измеряется количество метана, ВЫ­
ЭТО
превращение
иногда
требует
более
высокой
температуры
·С), чем обычно достигается в синтезах с применением реакти­
вов ГРИНl>яра в эфире, и осложняется некоторыми побочными процессами
(образование предельных углеводородов R-R' иолефинов).
:3. Реакция с глагенидами МХ tI (М - металл или неметалл, более
(50-100
электроотрицательный, чем магний). Это общий способ ПОЛУ'lения эле­
менторганических соединений.
4. Реакции с электроотрицательными элементами. Реагенты Гриньяра
окисляются всеми неметаллическими элементами
VI
и УН групп. Кисло­
род, сера, селен и теллур образуют соответствующие производные спир­
тов, меРЮ'lПтанов и т.
11.:
/Вг
2R-МgВг+ 02~2ROMgBг~2ROH +Mg"
5.
ОН
Присоединение к ЭПОКСИДIIМ может служить методом получеНllЯ спиртов. содержащих
в цеПII атомов углерода больше. чем в исходном металлоргаНI1'1еском соединеНИlI:
/0"
CH2-Cl--I2+RмgХ~RСН2-СН2-0мgХ~R-СН2-СН2-0н+мg(
Х
ОН
Б. Присоединение
по
месту двойных
связей.
1.
Присоединение
к карбонильной группе альдегидов, кетонов с последующим гидролизом
продукта I1рисоединения водой или разбавленной кислотой дает спирты
и является одной из наиболее часто применяемых реакций:
R'R"CO+R"MgX ---+ RR'R"C-ОМgХ
2.
+Н 2 О » RR'R"C-ОН+МgХОН.
Реакция с эфирами карбоновых кислот также приводит к получению
спиртов:
Муравьиные эфиры дают ВТОРИ'lные, а все другие эфиры
- третичные
спирты.
З. Диоксидуглерода легко присоединяет металлорганические соедине­
ния с образованием карбоновых кислот:
RMgX+C0 2 ---+
R-СООМgХ ~ R-СОOl-l+МgХ 2 .
Наиболее удобным способом введения углекислоты в реакционную
СМесь является добавление твердой углекислоты. АнаЛОГИ'IНО углекислоте
сероуглерод дает тиокислоты.
4. Металлорганические соединения присоединяются и по месту угле­
РОД-углеродной кратной связи, причем часто происходит полимеризация
lIепредельного соединения (см. гл. 1.2).
241
Биологические свойства элементорганических соединений
За
небольшими
исключениями
элементорганические
соединения,
токсичны для человека и животных. Токсичность зависит от природы ЭЛе­
мента и строения соединения. Особенно токсичны соединения мышьяка,
сурьмы, свинца, таллия, бериллия, ртути. Токсичны и некоторые соедине­
ния кремния, олова и фосфора. Некоторые элементорганические соедине­
ния подавляют жизнедеятельность низших организмов: грибов, бактерий,
на чем и основано их использование в технике, сельском хозяйстве и ме­
дицине. Применение любых элементорганических соединений требует!
тщательной проверки их токсичности и возможности биологического yдa~!
ления во избежание загрязнения окружающей среды.
1I
Многие микроорганизмы способны синтезировать элемеНТОРГtlничес-'
кие, в частности металлорганические, соединения. Это явление может'
иметь опасные экологические последствия.
1.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ЭЛЕМЕНТОВ
I ГРУППЫ
Общая фОРМУ.rJа органических соединений щеJJО'JНЫХ металдов
ДЛкильные соединения натрия, калия, рубидия и цезия
-
R-Me.
бесцвет-'
ные кристаллические вещества, нерастворимые в органических раствори­
телях и разлагающиеся без плавления при нагревании; на воздухе само­
воспламеняются, дают
растворы
в диметилцинке,
проводят
электриче­
ский ток.
1:
Из известных металлорганических соединений они наиболее активны~,
взаимодействуют со всеми органическими соединениями, за исключением:
парафиновых углеводородов.
Литийорганические соединения растворяются в органических раство­
рителях и образуют растворы, не проводящие электрический ток. Они пе­
регоняются или сублимируются при нагревании, на воздухе самовос­
пламеняются.
Литийалкилы могут быть приготовлены в эфире, бензоле или цикло­
гексане тем же способом, что и реактивы Гриньяра:
С 4 Н!lСI
+2Li __ C4H!lLi +LiCI.
В этой реякции лучше при менять ХЛОРllстые ЯЛЮ1ЛЫ. нк кяк бромиды И особенно 11одиды
взаllмодействуют с уже образовавшнмся литийоргани,/еским соеДl1нением по реакциИ
Вюрца.
ЛИТИlюргани,/еСКl1е соеДllнения могут быть таl(же ПОЛУ'lены I1З бутиллития обменноЙ
реякцнеil:
Формула
•
R-Li не соответствует истинному. значительно более сложному строеНl1Ю эТИХ
соеДllненш"i. В обы'/ных растворителях они существуют в виде тетрамеров или гексямеров.
AKТlIBHOCTb их падает с увеличеllнем ассоциации. Поэтому элеКТРОlIодонорные растворителИ
увеЛl1,/ивают 11Х активность.
Кроме Лl1Тl1ltаЛКI1ЛОВ известны 11 другие органические полилитневые соединения, няпрИ­
мер CLi 4, C2Li4, С 2 Цj. Это твердые хрупкие вещестм. При действии на них воды образуютСЯ
уrлеводороды.
242
Литийалкилы 'IRСТО применяются в органическом синтезе вместо реак­
тивов Гриньяра БJJагодаря БОJJьшей реакционноспособности.
2.
ОРГАНИЧЕСКИЕ СОЕдИНЕНИЯ ЭЛЕМЕНТОВ
11 ГРУППЫ
Органические производные кальция, стронция и бария изучены <:рав­
нителЫЮ мало. Большое значение имеют только соединения магния.
Магнийорганические соединения
При приготовлении магнийорганических соединений (реактив Гринья­
ря) необходима абсолютняя сухость всех материалов. Рекомендуется про-
водить реакции В атмосфере азота.
.
Очень важную роль играет растворитель. В смеси иодистого этила
и магния при комнатной температуре реакция не идет *. Однако в присут­
ствии простых эфиров галогеналкилы и магний реагируют легко с образо­
ванием эфиратов:
RMgX'
2(С2НБ)20.
Эфираты хорошо растворимы, и это дает возможносТI, галогеllалкилам
проникать к поверхности металла, которая в иных условиях обволакива­
ется метяллорганическим соединением.
Для приготовления реагентов Гриньяра могут быть также использова­
ны другие донорные растворители, особенно тетрагидрофуран, а также
третичные амины.
ОбрнзоваНllЮ маГНllйоргаНli'lеСКlIХ соедннений при взаllмодеikТВlill маГНIIЯ с галогенал­
IшлаМl1 предшествует возникновение IIОННОЙ пары:
,
,
RHlg + Mg --+ RHlg - + Mg +
RHlg- --+R' + HlgMg+ + Hlg- --+ HlgMg'
R' + HlgMg' --+ RMgHlg
Реакции с хлористыми алкилами обычно трудно инициируются, но дают
ЛУчшие выходы. Иодиды реагируют наиболее легко, но дают наименьшие
ВЫХоды. Чяще всего используются бромиды.
Первичные галогеналкилы дают лучшие выходы, чем вторичные, а по­
слеДние, в свою очередь, лучшие выходы, чем третичные.
В растворах гриньяровских реагентов обычно имеет место равновесие
2RMgX ~ R~Mg + MgX 2 .
В синтезах, осуществляемых с реактивами Гриньяра, участвуют как
ПРостые, так и смешанные магнийорганические соединения.
Р<lзличные синтезы с участием маГllийорганических соединений описа­
Ны
P<lHee.
----Разработаны способы проведения магнийорганичеСКI1Х Сllнтезов
•
раСТВОРlпелеЙ.
11
без примеflеflllЯ
243
Ртутьорганическиесоединения
РтутьоргаНllческие соединеНllЯ обнаруживают большую СТОЙI<ОСТЬ по отношению к кис­
лороду воздуха и влаге. Смешанные соединения особенно УСТОЙЧliВЫ. Например, хлористая
метилртуть CH:1-НgСI при перегонке с l<Онцентрированной соляной кислотой остается без
liзменений, а диметилртуть (CH:I)2Hg при тех же условиях разлагается на хлористую метил­
ртуть и метан.
1. Наllболее общий способ получеНlIЯ диаЛКИЛРТУТl1 или аЛКliЛсульфатов с амальгамой наТРI·IЯ в этил ацетате:
взаимодеiicТВliе галогеналкилов
2RX + 2Na + Hg ~ R 2Hg +2NaX.
2. Важный метод приготовления алифатичеСI(ИХ производных ртути -
действие избыт-.
ка реактива ГРlIньяра на галогениды ртути в эфире:
RMgX +HgCI 2 ~ RHgCI + MgCIX
RHgCI + RMgX ~ HgR 2 + MgCIX.
З. РеаКЦl1Я присоединения солей ртути к олефllНОВЫМ двойным связям ПРОIIСХОДIП I<ОЛИ-\'
чественио с IIСКЛЮ'lIпельной легкостью:
Если применяют соль минеральной кислоты. то выделяющуюся кислоту неiiтрализуют по
мере образования.
.
Хлорид ртути (1.1) в ПРИСУТСТВIIИ свободноii СОЛЯНОl1 кислоты анаЛОГl1ЧНО присоеДIНlяется
к ацетилену (А. Н. Несмеянов, Р. Х. ФреЙд.лина):
HgCI 2 +НС==СН ~ CICH=CH-НgСI.
Диалкильные производные ртути -
легколеТУЧllе бесцветные жидкости, устойчивые.
к действию воздуха и воды; чрезвычайно ядовиты.
Смешанные ртутьоргаНИ'lеские соединения способны, например. Прl1 деЙСТВIIИ аммиака
СlIмметризоваться:
RHgCI
NH
+ RHgCI ~
RHgR + HgCI 2 .
ИзвеСТНllli обратная реакция:
R-Hg-R + HgCI 2 ~ 2R-НgСI.
МехаНllЗМ этих реакций, ПРОХОДЯЩIIХ по схеме элекmрофuлыюго :IUАlещенuя, 11зучен
О. А. Реутовым и И. П. БелеЦl<ОЙ.
РтутьоргаНII'lеские соеДlшения являются важными ФУНГlщидаМli и применяются д.ля об­
работки семян, особенно хлебных злаков, перед посевом. Некоторые из ,тих соеДl1неНliЙ яв­
ляются леЮlрствеННЫМli препаратами.
В последнее время огромные КОЛl1чества ртути с промышленными стоками сбрасываются
в реlШ и озера. откуда OHII попадают в мировой OI<eaH. Только в результате СЖliгания ископае­
мых углеii в атмосферу ежегодно попадает около
8000 тонн
PTYТII. Многие бактерии перера­
батывают ее в каТliOН CH;jHg + и газообраЗНУЮДl1метилртуть. Органические соеДliНеНliЯ рту­
TI1 попадают в [lИЩУ человека, например, через рыбу. В Японии зарегистрировано миого
смертельных отравлеНI11t в результате употребления в пищу отравленной ртутью рыбы.
З.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ЭЛЕМЕНТОВ
111 ГРУППЫ
Алкильные соединения элементов главной подгруппы III группы имеюТ
обш,ую формулу RзМ. Эти соединения значительно менее полярны, чем
алкильные производные элементов 11 группы. В своем нормальном кова­
лентном состоянии с валентностью 3 элементы III группы - мощные
244
кцелТОРЫ электронов благодаря существованию в их валентной оболоч­
:е незаполненной орбитали. Алкильные группы, связанные с элементом
IiI группы, наиболее подвижны по сравнению с теми же группами в других
металлорганических соединениях.
Соединения бора
БорТРllалкилы обычно получаются реакцией бортрифторида с реактивами ГРИllьяра:
11ЛII прl1соединением бороводородов по кратным связям:
Бортриалкилы - бесцветные жндкости с запахом ЛУI(а и редьки. Их синтез ведут в атмо­
сфере азота. так как Ila воздухе они легко окисляются. При энеРГИ'lНОМ окислеlllН1 бортриал­
ЮI.%I воспламеняются 11 горят зеленым пламенем. При регулируемом окислеНIIИ КIIСЛОРОДОМ
воздуха OHII образуют аЛI(илборные ЭфllРЫ R2B-OR и RB(OR)2.
С водой БОРТРlltlЛкилы реагируют очень медленно. При гидролизе аЛl<илборных эФИIЮВ
холодноii водой или разбавленными кислотами ПОЛУ'lаются алкилборные КlIСЛОТЫ.
ЭфllРЫ алкилборных кислот ПОЛУ'lаются таl(же при реtllщии цинкаЛКlIЛОВ или реагентов
ГРI1lIl,яра с ТРlIэтилборным эфиром.
При взаимодействии диборана с аммиаком образуется бензоподобllое вещество
азол - бесцветная жидкость с т. кип. 55 'С:
-
бор­
При взаимодеliствии бороводорода с ацетиленом о'бразуется твердыlll(арборан. молеку­
.~aI\OTOpOro состоит из
10 атомов бора и двух атомов углерода (праВИЛЫIЫЙ двадцатиграll­
HI1I\). Карборан отличается термической (до 600 'С) и ХИМl\'lеCl(оi'1 (не реагирует с кислотами
11 ОI\l1слителями) стойкостью.
Соединения алюминия
Алюминийалкилы более активно реагируют с водой, кислородом 11 т. д.,
'leM органические соединения других элементов третьей группы. Химичес­
КИе свойства алюминийалкилов сходны с химическими свойствами соеди­
НеНИЙ элементов II группы. Алкилзамещенные гидроксида алюминия не
СУществуют.
Триалкильные производные алюминия могут быть получены различны­
мн Способами:
1) обработкой алюминий-магниевого сплава алкилгалогенидами:
A1 2Mg:1+ 6C 2H5 -Cl--+ 2AI(C 2 H"):1 +ЗМgСI 2 ;
2) непосредственным взаимодействием алюминия с водородом и оле­
фl1НОМ (к. Циглер):
245
Алюминийалкилы
вязкие бесцветные жидкости; низшие члены го
-
мологического ряда ассоциированы (димеры ).
с
"
Алюминийалкилы быстро окисляются на ВОЗдУхе, бурно реагиру
водой, часто с воспламенением,. многие из них самопроизвольн
загораются.
Наиболее новое и важное применение алюминийтриалкилов
-
не
пользование их в качестве катализаторов при полимеризации олефннов.·
Трuэmuлалюм.uнuЙ реагирует с этиленом при
100-120 ос с образ
ванием смеси различных соединений алюминия, дающих при гидроли
смесь н-углеводородов с четным числом атомов углерода в молекуле:
/ СС2 Н,;
Н
AI,,_ 2 ;;
C2Hr.
ер,
CH2-СН2с.,Н, ,/(С 11.)
/(C 2 H',)X- С2 Нг,
AI/ С Н
-"., "
~" 2 r,
~ АI"(:=2 1-Ц,- C2Hr.
с 2 н,;
(С2Н~)Z-С2Нr."
Трunроnuлалю.мuнuЙ с этиленом дает углеводороды с нечетным чис~
лом углеродных атомов.
Этим
способом
получают
полиэтилен
с
молекулярной
массоА
5000-3 000 000. Свойства полиэтилена, полученного при низком давле J
нии, отличаются 'от свойств полиэтилена,
давлении.
При более высоких температурах
полученного при
высоком
.
(200 ос и выше) триалкилаJlЮМИНиА
реагирует с олефинами иначе. В зависимости от условий реакции образу­
ются димеры или полимеры, триаЛJ<илаJlЮМИНИЙ регенерируется, играя
роль катализатора:
(R-CH 2-CH 2):,AI
+ЗR-СН=СН 2
--+ (R-СН2-СН2-СНR-СН2)зАI
(R-CH 2-CH 2-CHR-CH 2):\AI + ЗR-СН=СН 2 --+
--+ ЗR-СН 2 -СН 2 -СR=СН 2 + (R-СН 2 -СН 2 )зА1
Таким пyrем из 1-бутена получают 2-этил-1-гексен
-
исходный про­
дУкт в синтезе n-ксилола.
4. ОРГАНИЧЕСКИЕ СОЕдИНЕНИЯ ЭЛЕМЕНТОВ
IV
ГРУППЫ
Органические соединения кремния, германия, олова и свинца явля­
ются аналогами соединений углерода. Однако, за ИСКЛЮ'Iением тетраал­
кильных со~динений, в которых элемент окружен углеводородными ради­
калами, сходство с чисто углеродными соединениями только формальное.
В отличие от металлоргаНИ'lеских соединений первых трех групп соедИ­
нения IV группы элеJ<трононасыщены. Они не реагируют с кетонами и ~e
присоединяют галоге~IЫ или кислород. Кремнийалкилы достаточно стоя­
ки, и при их хлорировании замещение при атомах углерода происходит без
разрыва креМНИЙУГJlеродных связей.
Атомы элементов этой группы MOгyr соединяться меЖдУ собой, обраЗУЯ
цепи небольшой длины. Четырехвалентные атомы имеют тетраэдрическое
246
ожение валентностей. При наличии в соединениях асимметричных
расп олв кремния, германия и олова они могут быть разделены на оптичес-
атОМО вные формы (
1гл.
0 ).
см.
И
кИ аКТ
Кремнийорганическиесоединения
КремниЙ расположен в периодической системе непосредственно под
глеродом. Поэтому мож~о было бы ожидать существования кремниевых
~налогов всех соединении углерода. Однако, поскольку валентные элект­
роны кремния находятся дальше от ядра и связаны с ним менее прочно,
чем в атоме углерода, кремний является более электронодонорным, или
«метаЛЛИ'lеским», элементом по сравнению с углеродом. Поэtому крем­
ний не образует многих типов соединений, известных)l,l1Я углерода. Свой­
ства кремниевых аналогов заметно отличаются от свойств соединений
углерода.
Энергия связи Si-Si меньше, чем связи С-С, на 125,6 кДж/моль,
а энергия связи Si-O выше энергии связи с-о на 92,1 кДж/моль.
Атом кремния имеет свободные d-орбитали и может их использовать
для образования связи. Если в соседстве с атомом кремния находится
атом с заполненными р-орбиталями,
с d-орбиталями кремния
(d-,
то
возможно
перекрывание
их
р-взаuмодейсmвuе):
\...
-Si--X ......_ _.~
I
\. n·
~i-X
/
Благодаря такому взаимодействию укорачивается связь
Si - Х и YMeНl,­
Si=Si, Si=C,
шается полярность. Соединения с кратными связями типа
Si=O. Si=S в обы'IНЫХ условиях не существуют.
Номенклатура. Названия кремнийорганических соединений несколько
Отличаются от названий других элементорганических соединений и '!исто
УГJlеродистых соединений.
1. Соединения кремния общей формулы R(SiR 2 ),,- SiR з , где R -
ор­
ганические радикалы, водород, ал"о"сu- или арило"сu-грулпы, называ­
ются как производные силана (SiH 4 ):
H;jSiSiH:\
Si(CH;j)4
дисилан
тетраметилсилан
СНз-SiСI;j
меТИЛТРЮUЮРСИЛIIН
(CH;\)2SiCl 2
диметилдихлорсилан
(CH;j)2Si(OCH2CH:\)2
димеТИЛДИЭТОКСИСИЛIIН
з 2. Кремнийорганические соединения, содержащие группы Si-O, наыlаютсяя сuлоксанам.u:
(СНз);\Si-О-Si(СН:\):\
гексамеТИЛДИСllЛUI\С',ll1
(СНз)зSi-О-Si(СН:\}l-О-Si(СНз)з
октамеТИЛТРИСИЛОКСIIН
R;\Si-О-[SiR2-0In-SiR;\
ПОЛИСl1локсан
247
3.
Кремнийорганические соединения, содержащие одну или нескол
гидроксильных групп, связанных с атомом кремния, называют как проц'
водные силана, добавляя суффиксы -ол, -диол, -триол:
ТРШIЛJШЛСllланол
R:iSiOH
R2Si(OH)2
RSi( ОН ):!
ДllitЛКIIЛСllлitНДIЮЛ
аЛКliJ1СllлitНТРИОЛ
4. Органические
соединения
кремния
общей
R-(SiR2-NН)Il-SiRз называют как производные силазана:
(CH:i):iSi-NН2
5.
тримеТIIЛСllлitзан
(CH:i):ISi- NH - Si( СН:\)2
геl\самеТIiJ1ДИСl1лазан
(CH:I):\Si-NН-Si(СН:I)2-NН-Si(СН:I):\
ОКТitмеТIIлтрисилitзан
Когда в органической части молекулы имеется реакционная груп
не связанная с атомами кремния, соединения называют как соответств
щие
замещенные
органические
соединения,
наПР ИМ eJ,l
(CH~)~Si -СН 2 -СООН а-триметилсилилуксусная кислота.
s~
Способы ПОJJучения. Для получения кремнийорганических соединений
в качестве исходного вещества используются кремний (или его соедине~
'
ния с металлами) и четыреххлористый кремний.
Реагенты Гриньяра в эфирном растворе с тетрагалогенсиланам"
(а также тетраалкоксисиланами) дают 'Iастично или полностью замеще,,­
вые силаны. Это наиболее гибкий и широко используемый общий способ
1.
Ilолучения:
SiCl 4+ RMgX ----+ RSiCI:1
2.
RM/.:X
»R2SiCI2
RM/.:X
»R:1SiCI
RM/.:X
»R~Si.
Реакция аЛКИJlГалогенидов непосредственно с элементарным KpeMj
нием в присутствии твердого катализатора при нагревании дает смесь ал:
I<илсилангалогенидов с преобладанием диалкилдихлорсиланов:
Si+2CH:1CI
~ (CH:i)2SiCI2'
Этот метод широко используется в промышленности ДJIЯ получения ди­
метилдихлорсиланов и меТИJIтрихлорсилана - Ilромежуточных продуК­
тов ДJIЯ синтеза кремнийорганических полимеров.
3. Anкены или алкины с монометилсиланом или другими соединенИЯ­
ми, содержащими гидридную связь -Si - Н, образуют алкильные или аЛ­
кеНИЛЫlые соединения кремния без выделения водорода (присоединение
кремния и водорода к двойной или тройной связям). Катализаторами слу­
жат пероксиды и платиноxnористоводородная кислота и др.:
СН 2 =СН 2
+ SiHCI:1----+ C 2 H 5 -SiСI:1 ·
Физические и химические свойства. Тетраалкилсuлан.ы R4Si обна­
руживают болuшое сходство с углеводородами. Тетраметилсила н
(СНЗ)4Si - прозрачная жидкость легче воды, т. кип. 26 ос. У тетраэтИЛ­
силана(С2Н5~Siт.кип. 153"С.
248
.
n
и ХJ!ОРИРОВЯНИИ метилхлорсиланов (СН з )"SiСI 4 - u (при в(\гревании
cteTY) обрязуется хлормеТИЛХJ\орсиланы.
Н8 АЛКИJlХЛОРС/lланы обнаруживают только.формальное сходство с хлорДородами. Они гидролизуются водои, образуя соответствующие
евО
угл
гИдроксиды.
гидролиз триалкилхлорсиланов
в
присутствии
аммиака дяет триаJl-
киЛСИЛ8НОЛ:
R:\SiCI +Н 2 О +NH:\ ~ R:\Si-ОН + NH 4C1.
Силанолы легко теряют воду и образуют силоксаны:
2R:\Si-ОН ~ R:\Si-О-SiR:\
+
Н 2 О.
Часто эта реякция идет самопроизвольно, однако для более прочных
соединений, таких, как трифенилсиланол, требуется щелочная среда.
Реакция триалкилхлорсиланов с безводным аммиаком или аминами
дает сuлила}'tuНЫ (силазаны), которые легко гиДролизуются:
R:1SiCI
~ R:\Si-NН 2 ~ R:\Si-Ol-I+NН:\.
СИJlанолы не этерифицируются кислотами. При действии на силанолы
хлорянгидрндов кислот получяются не эфиры, а хлорпроизовдные, как это
происходит и с третичными спиртами:
R:\Si-ОН
+ CH:1-СОCl ~ R:1SiCI + СН:\-СООН.
Получить ненасыщенные соединения при отщеплении воды от силано­
JlОВ ИJlИ
HCI
от ялкилхлорсиланов не удалось.
Гидролизом диалкилдихлорсиланов R2SiCl 2 получают силандиолы, не­
растворимые в воде, но растворимые в водной щелочи:
R2-SiCI 2 + 2Н 2 О
~ 2HCI
+ R 2Si(OH)2
2NиОН
~ R 2 Si(ONa)2
+
2Н 2 О.
СИJlЯНДИОЛЫ легко теряют воду, образуя соединения, которые часто на­
ЗЫВяют силиконами. В результ(\те межмолекулярного отщепления воды
ПРоисходит конденсация многих молекул и в СЛУ'lае диметилсиландиола
Обрязуется бесцветное масло, представляющее собой смесь примерно
РЯ~IIЫХ КОличеств циклических полимеров (циклополисилоксанов) и ли­
неиных полимерных ДИОJlОВ:
[-Si(СН: 1 )2- 0 -Jn
HO-Si(СН:\)2-[О-Si(СН: 1 )2),,-О-Si(СН: 1 )2- 0Н .
В 1939 г. К. А. Андрианов обратил внимание н(\ возможность исполь­
ЗОВЯ НИН этих масел в качестве электроизоляционных материалов.
р В реЗУJlьт(\те обработки полисиландиолов триметилхлорсиланом водо-
11 ОДНЫе атомы гидроксильных групп замещаются остатками (СНз)зSi - ,
РИЧем образуются маслообразные продукты строения:
(СНз):\Si-[ O-Si(СН:1bln -O-Si( CH:1k
249
Эти масла отличаются большой термической стойкостью
(250 ОС) и су_!
-60 дo~
щественно не изменяют вязкости в интервале температур от
+60 ос
Они применяются в качестве смазок специального назначения.
При изменении условий приготовления и последУющей обработки про~
дУкта может быть получен материал со свойствами, напоминающими кау_;
чук
-
силиконовый каучук, силастик. Силиконовый каучук, подвергну_
тый обработке окислителями, образует трехмерную структуру, аналогиtj~
ную вулканизатам каучука. Силиконовые каучуки обладают ВЫСОКИМII
электроизоляционными качествами и большой термостойкостью и моро­
зостойкостью. Они сохраняют эластичность в интервале температур от
-60 до + 200 ос
Прочность силиконовых каучуков на разрыв невелнка - всего 20-30 кг/см 2
(2-3 МПа), в T~ время как прочность натурального и некоторых синтетических каучуков
ОIШЛО 200 кг/см (20 МПа) .. Введение наполнителей (диоксид кремния) повышает проч­
ность на разрыв до 120 кг/см 2 (12 МПа).
Алкuлmрuхлорсuланы при гидролизе
образуют алкuлсuланmрuолы
-
вещества очень нестойкие: в момент
образования они легко дегидратируются с образованием трехмерных по­
лисилоксанов:
R
I
R
I
0-
I
-O-Si-O-Si-O-Si-O-
I
I
I I
I
R
-O-Si-O-Si-O-Si-O -
I
R
Полuсuлоксаны
-
I
R
I
0-
твердые, хрупкие неплавкие смолы, которые ши­
роко применяются в качестве термостойкого электроизоляционного мате­
риала; изоляция элеКТР'lеских проводов из алкилполисилоксанов выдер­
живает температуры до
300 ос
Использование такой изоляции позволяет
уменьшить размеры и массу электродвигателей почти в два раза, что осо­
бенно Ba>I+НO в автоматике и реактивной технике.
'Все кремнийорганические материалы не смачиваются водой и сообш.а­
ют материалам, которые они покрывают, гидрофобность.
В последние годы кремний органические соединения получают все бо­
лее широкое применение в органическом синтезе как промежуточные
ПРОдУкты. Триалкилсилильная группировка используется как «заш.итная
группа», которая легко вводится в исходные ПРОдУкты и легко удаляется
из конечных ПРОдУктов.
250
Соединения олова
о ганичеСКllе соеДllнеНIIЯ олова ОТЛllчаются от opraHlI'lecКlIX соеДlIнеНllii креМНIIЯ и гер­
р Связь C-$11 более СЛllбая и более полярная. оргаНИ'lеские группы в TIIКlIX соеДlше­
маН~IЯ'егче обмеНlIваются или переГРУllПllровываются. Имеются соеДlшеlНiЯ. в ,<оторых ме­
\fIIЯХЛ
лл двухвалентеll.
..
та ОЛОВООРГIIНllчеСlше соеДlшения оБЫ'lНО называют по номенклатуре. примеНЯМОl1 в неорrIII1I1'IecKoil XHMIIII. HllnplIMep дихлорднбутнлолово. ХЛОРlIстое ТРIIUУТIIЛОЛОВО.
НII3Шll е члены ГОМОЛОГllческого ряда тетраllлкилзамещенных олова, бесцветнь!~ жид­
кост" выСОI\ОЙ плотности. сильно преломляющие свет: д.1lя (CH:I)4Sn т. Kltn. 78 С. д.1lЯ
(C~H,»I$11181 ос.
.д.;.ЮIльные производные олова не разрушаются водой npll температуре до 100 'с. Галоге­
НIIДЫ
1I
ГИДРОКСliДЫ алкилолова
PIICTBOPIIMbI в
воде: Гllлогениды дают ПРОВОДЯЩllе ток РIIСТВО­
ры. В которых они ЧIIСТИЧНО И обратимо ГИДРОЛlIзованы.
СIIльные основаllllЯ сна'lала оса>IЩают ОКСIIДЫ аЛКliЛолова. ЗlIтем растворяют IIX с обра­
ЗОВIIНllем натриевых солей. Галоген иды растворяются в CnllpTIIX без заметного СОЛЬВОЛИЗII.
однако аЛКОКСlшроизводные могут быть получены npll деiicтвии алкоголятов наТРIIЯ.
Галогены 11 галогеноводороды легко расщепляют связь С-Sп. СоеДlIнеlШЯ олова. осо­
бенно содержаЩllе галоген, ядовиты.
В послеДНllе годы onовооргаНН'lеские соединения ПРlюбреЛlI ваЖl10е промышленное Зllа­
'lеllllе.ДUЛU!JРllm cJuf'i!JnIllЛ()Л()(I(/ используют в Ka'leCTBe стабилизатора ПОЛИВIIНИЛХЛОРllда,
предупре>IЩая ОI<раШllваНllе и обугливание во время формования и npll освещеllllll солнеч­
ным светом. Соли ТРllБУТlIлолова 1-1 OpraHII'IeCI<IlX I<1ICnОТ обладают очень СIIЛЬНЫМИ фУНГlI­
ЦIIДНЫМII СВOI"tcтвами. таl<ИМII же. ,<ак у ртутьоргаНllчеСl<IlХ соединеlшii. 11 IIСПОЛl>ЗУЮТСЯ д.1lЯ
заЩIIТЫ бумаГlI. дерева I1 ДРУГIIХ МlIтер"IIЛОВ. НеБОЛЬШllе добаВКII IIIl!lIlрафеНItЛ(]Л(}(/U
(C,;H;;)4S11 КДllэлеl<ТРllкам предохраняют 11)( от разрушеllllЯ Прll ВОЗНlIкновеНlI1I пробоя. иск­
ры IIЛIIIЮРОIIЫ.
Способы ПОЛУ'lеНIIЯ оловооргаНlI'lеСКlIХ соеДlшеНIIЙ анаЛОГИ'lНЫ способам получеНIIЯ со­
еДlIнеНllii креМНIIЯ.
Соединения. свинца
Свинецорганические соединения по сравнению с соединениями крем­
ния, германия и олова нестойки и легко рязрушяются при нагревании и на
свету. Связь углерод -
свинец значительно более легко разрушается
кислотами. Дяже угольная кислотя оказывается достаточно сильной кис­
лотой, чтобы медленно отщеплять органи'rеские группы от свинца.
Наиболее важное применение имеет mеmраэmuлсвuнец, который по­
ЛУЧяют В промышленных масштабах взаимодействием сплавя натрия со
Свинцом с хлористым этилом:
4PbNa
+4CIC~H5
--+ РЬ(С 2 Н;;)4 +4NaCI
+ЗРЬ.
Ilо-видимому, реакция протекает с образованием в качестве промежу­
To'rHoro ПРОДУКТII этилнятрия.
Тетряэтилсвинец (ТЭС) используется в огромных количеСТВIIХ как
1111-
ттидетонятор для моторного топлива (этилированный бензин содержит
ЭС). Исклю<rительно ядовит.
В последние годы свинецорганические соединения стяли испоЛ!>зовять
в К<tчестве инсектицидов и Фунгицидов.
ПРlIмеllение тетраЭТIIЛСВlIнца в качестве антидетонатора ПРИВОДI1Т к тому. что ежеГОдl10 в
аТМОСферу выБРlIсывается около 200' [0·1 Т свинца. В ряде стран НllБJlюдается знаЧlIтельное
~агрязнение воз.цуха. водоемов. растеНlIЙ 11 ДРУГIIХ объектов окружающеii среды СВI1НЦОМ.
КР0811 11 моче человека обнаРУЖlIвают CBIIHeu. что представляет сеРI>еЗIlУЮ опасность д.1lЯ
251
.щоровья. В гумусовом слое пuчвы вБЛlIЗli шоссе Москва
Санкт-Петербург содеРЖани
-
СВllнца в 20 раз выше, 'ICM в Новгородской области. В I<лубнях I<артофеля вблизи шоссе co~.
деРЖ1lНllе свинца в
25 раз выше, чем в 3 км от шоссе. В ГОРОД1lХ Москве. Санкт-ПетеРбуРге It
Киеве применение ЭТliЛированного беНЗliН1I З1lпрещено.
5.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ЭЛЕМЕНТОВ
V ГРУППbl
Свойства органических соединений элементов V группы претерпевают
характерные изменения от фосфора к висмуту: соединения фосфора отли­
чаются стабильностью, соединения висмута
-
активностью.
Металлы V группы могут участвовать в образовании органических сое.
динений в нескольких валентных состояниях. При этом получаются веще­
ства следующих типов:
1)
отвечающие трехвалентному состоянию и содержащие неподелен­
ные пары электронов. К ним относятся триалкильные производные RзМ;
гидриды RMH 2, R2MH; галогениды RMX 2, R 2 МX;
RM(OH)2, RMO, R2MOH, (R 2M2)O;
гидроксиды и оксиды
2) отвечающие пятивалентному (четырехкоординированному) состоя­
нию: галоген иды RMX 4 , R 2 МХ з , R з МХ 2 , R4 MX; кислородные соединения
RзМО.
RMO(OH)2. R2MO(OH),
R4MOH;
пентаалкильные соединения
R5M.
Соединения фосфора
Низшие алкилфосфины
-
летучие, легко окисляющиеся, отврати­
тельно пахнущие жидкости. Многие из них воспламеняются на воздухе,
при действии азотной кислоты, хлора или брома. Они нерастворимы в
воде, но растворимы в органических растворителях.
АлКИЛфОСфИIIЫ
RPH 2• R2PH,
RзР имеют слабоосновные свойств/!.
Низшие члены ряда алкилфосфинов
-
более сильные основания, чем
фосфин РН з . Основность их увеличивается в ряду: РН з
«СНЗ)2РН
< (СНз)зР.
< СН З РН 2 <
Третичные фосфины имеют примерно такую же
основность. как третичные амины.
Первичные и вторичные фосфины
(RPH 2, R2PH)
получают нагревани­
ем иодистых алкилов с иодистым фосфонием РН 4 I и оксидом цинка при
150-180 ·С:
2R! +
2Ю
2РН 4
+ Zl10 ----+ 2RPH 2 • нl + ZП!2 + Н 2 О
+ РН 4 + ZnO ----+ R2 PH • нl + Znl2 + Н 2 О
Первичные фосфины образуют кристаллические гидрохлорид и гидро­
иодид, гидролизуемые водой.
При контролируемом окислении азотной кислотой фосфины превраща­
ются в алкилфосфоновые и диалкилфосфиновые кислоты:
RPH 2 ----+ RPO(OH)2
R2 PH ----+ R2PO(OH)
252
ме/llllЛфОСфllН СН:\РН2 - бесцветный ГilЗ, т. ЮIП., 14 'с. ЭlIl!lлфосфин 2 5'С н-Пр()пилфосфин - ЖIIДКОСТЬ, т. кип. 53 С.
т. I(fIП.·
ДIОlеl1l11 Л фОСфllН (СН :1 )2 РН ,т. ют. 21 , 1 'С',(}.
uэmил ф'ф
ос ин, т. I<IIП. 8Г<J 'С •
ЖIIДI{Q~ТЬ,
CII.II,lI-mреm-фосфины леП{Q получаются Прl! реакции peaKTIIBOB ГРI!ньяра с хлорндом
фосфора (II1) в ,фнре:
2RMgX + PCI:, ----. R:\P + 2MgXCI.
Третнчные фосфины могут быть IIдентифнцированы по ПРОДУlпам присоеДlIнення сероуг·
лерода R:IP+' CS' S (красные твердые вещества, образующиеся ПРI! смеШlIваНIIН ,<омпонсн06 в ,фнрных IIЛН спнртовых раСТВОРilХ) 11Л1I в BllДe комплексов с ХЛОРIIДОМ ртутн.
Т
ТРШlеmиЛфОСфllН (СН:,):,Р - подвижная жидкость, т. пл. -85 'С, т. "ип. 42 'с. ТРltэ­
lIl11лфОСфllН, т. I<IIП. 127,5 'с. Легко ОЮICJJяется кислородом воздуха в ОКСIIД трналкилфосфн­
на (СI-I:!):!РО (расплывающиеся на воздухе КРlIсталлы).
Четвертичные фосфины образуются, иногда со взрывом, при смеши~а­
нии третичного фосфина с галогеналкилами. Отвечающие им гидроксиды
являются сильными основаниями.
Алкилфосфоновые кислоты RPO(OH)2. образуются при ОКИСJlении
первичных фосфинов или алкилфосфинистых кислот, а также при гидро­
RPCI 4 . Низшие кислоты - расплывающиеся на воздухе кристаллы,
легко образуют соли с основаниями.
лизе
Интересным способом получения эфиров фосфоновых кислот является
ТilК называемая перегруппировка Арбузова, изученная А. Е. Арбузо­
вым, Б. А. Арбузовым и их учениками. Перегруппировка происходит при
взаимодействии галогеналкилов с эфирами фосфористой кислоты:
рсн
(С lr'-1 ,; О) :! Р + СI-I :! 1 --+ I!г.(С 2Н"О): !
: ! ]+,-
Наl'!,СВНIIИС ) (С 2 Н r. о) 2 РОС"·
С Н-I
П.! + 2 "
Среди органических соединений фосфора имеется ряд высокотоксич­
ных соединений, например изопропиловый эфир фторангидрида метил­
фосфоновой кислоты
- зарин:
о
СН: 1
-111
ОСН(СН:')2
F
Зарин "резвы"яйно токсичен; он проникает в организм через кожу и сли­
зистые оболочки, а также при вдыхании. В ничтожных концентряциях вы­
ЗЫвает сужение зрячков, при больших концентрациях действует как силь­
нейший судорожно-паралитический яд.
Еще более ТОКСИ'IНы тяк называемые V-газы. Они
BeCI,Ma
эффективно
ПОJlЯВJIЯЮТ яктивность ферментя холинэстеразы (см. гл. 32.2) и убивают
чеЛовека при попадании на кожу или через легкие в ничтожных количе­
CTBi\X.
253
Многие соединения фосфора могут быть использованы как СИЛЬНbJе
инсектициды. Из соединений, применяемых в практике, наибольшей из­
вестностью пользуется хлорофос:
CCI:!-CH(OH)-PO(OCH:I)~'
ФОСфОIlИТРИЛХЛОРИД (PNCI~)t/- производное фОСфОllllТРllла (P"'N)x)
144'С - получают нагреванием хлорида аММОНllЯ с пентахлоридом фосфора:
с
т.
пл.
nPCI:; + nNH 4CI--+ (PNCI~)n + 41lНСl
Продукт ре3lЩIIII пр"мерно на 3/4 COCTOIIT 11З тримера фОСфОНИТРИЛХЛОРllДа. а осталь_
lюе
тстрамер
-
массы
-
11
ВЫСШIIС ЦИКЛllчеСКllе
11
Лllнеiiные полимеры небольшой молекулярной
IJЛllгIJAtI!{JЫ:
ФОСфОНИТРllЛХЛОРllДобладает ПРIIЯТНЫМ I<1IМФОРНЫМ запахом. одню<о вдыхание его паров
ПРI1ВОДИТ к отравлению. ПО CBOIIM IlIIсектицидным свойствам он эффективнее арсената
СВИlща.
ЗаПОЛllмерilзованныii на повеРХIЮСТИ 11здеЛIIЯ фосфОНIПРИЛХЛОРИД образует термо- 11 ог­
HecToilKoe l<аУЧУI<Оподобное ПОКРЫТllе, оfiладающее преl<расными мехаНllческими свойства­
MII. В l<омбllнаЦИl1 с acfiecToM 11 стекловолокном полифосфОНIПРИЛХЛОРИД используется ДIIЯ
изоляции :;леКТРllчеСЮIХ проводов 11 кабелей. Аллиловые ЭфlРЫ фосфонитрилхлорида при­
меняют в Ka'lecTBe связующего при производстве СЛОIIСТЫХ пластИI<ОВ. БУП1Ловые эфиры
фОСфОНllТРИЛХЛОРllДа плаСТИфlЩllРУЮТ эфиры целлюлозы 11 являются составной частью ла­
ков и целлюлозных плеIЮI<. Пропитка хлопчатобумажных тканей 2,3-дибромпропиловым
ЭфlРОМ фосфОНIПРI1ЛХЛОРlща ПРlщает 11М огнеСТОЙI<ОСТЬ. Различные полимерные эфиры,
ПЮЭфllРЫ 11 aMllДbI фОСфОНlприлхлорида, а также сам ПОЛllфосфОНIПРI1ЛХЛОРI1Д находят при­
MelleHlle при IIЗГОТОВЛeflИII специальных смаЗО'lНЫХ масел 11 в I<ачестве добавок к гидравли­
чеСКlIМ ЖIIДКОСТЯМ. Производные фОСфОНlприлхлорида Пlпа диБУТОI<СИПОЛllфОСфОНИТРИЛХ­
лорида ПРllменяются в качестве инсеКПЩIЩОВ.
6.
ОРГАНИЧЕСКИЕ СОЕдИНЕНИЯ ЭЛЕМЕНТОВ
VI ГРУППЫ(ГЛАВНАЯ ПОДГРУППА)
ОргаНllчеСlше ПРОllзводные ";лементов главной подгруппы
ва подобны соединениям серы (см. гл. 7).
7.
V\ группы таБЛIЩЫ Менделее­
ОРГАНИЧЕСКИЕ СОЕдИНЕНИЯ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ
ТI1ПIIчные оргаНll'lеские производные переходных элементов оБJlадают очень низкой тер­
мос~оiiкостью. При HarpeBaHI1I1 11Х растворов до комнатной температуры образуются смеси
углеводородов. АромаПlчеСlше соединения более стойки, 'leM алифаПlческие.
МеПlлмедь. метил-, этил- И пропилсеребро образуются при обработке солей этих метал­
лов при НIIзкоii температуре (до
-70 'С) аЛКllЛЛlIТllем 11ЛИ тетраалкилоловом.
ПРII деЙСТВlIl1 маГНI1I11юдмеП1ла на ЭфИРНЫl1 раствор хлорной плап1НЫ PtC14 образуется
ряд сраВНlпельно стоiiЮIХ меПlлплаТl1НОВЫХ соеДI1НеНIIЙ:
(CH:'):IPtI, (CH:I)4PtCI2 и т. п.
К,Щ уже отме'/IIЛОСЬ, переходные элементы образуют Мf/ОГО'IIlсленные /<омплексны е
d-орбиталыIыe соеДllнения, в том числе с «саIlДВII'/еВОI1» структурой. Примером такиХ сое­
ДIIнеНllii является фе{J{Jоцен (гл.
254
27.2).
11. СОЕДИНЕНИЯ СО СМЕШАННЫМИ ФУНКЦИЯМИ
Органические соединения, содержащие две (или более) раЗЛИ'lные фун­
ональные группы, называют соединениями со смешанными фУНК­
K~~Mи. Если У'lитывать только важнейшие функциональные группы (НО,
to,
СООН,
то возможно существование шести классов соедине­
NH 2 ),
ний со смешанными функциями: гидроксиальдегиды и гидроксикетоны,
гидроксикислоты, альдегидо- и кетокислоты, аминоспирты, аминоальде­
гиды и кетоны, аминокислоты.
Наибольшее значение среди классов соединений со смешанными функ­
циями имеют функционально замещенные кислоты (гидроксикислоты,
альдо- и кетокислоты и аминокислоты). Этим соединениям и будет уделе­
но основное внимание.
Отдельные функциональные группы, входящие в состав соединений со
смешанными функциями, могут проявлять обычную для них реакционную
способность. Однако другие функциональные группы в той или иной мере
все же влияют на эту реакционную способность, причем это влияние про­
является по- разному в зависимости
от
в з а и м н о г о
р а с
nоложе -
ния различных функциональных групп. Этот вопрос явля­
ется главным при изучении химии соединений со смешанными функциями.
В последующем изложении сна'lала рассматриваются кислородсодер­
жащие, затем азотсодержащие соединения со смешанными функциями.
ГЛАВА
10
ГИДРОКСИКАРБОНИЛЬНЫЕ
И ГИДРОКСИКАРБОКСИЛЬНЫЕ СОЕДИНЕНИЯ
д.
ГИДРОКСИдЛЬДЕГИДЬI, ГИДРОКСИКЕТОНЫ
Г'uдрокcuальдегuды и гидроксикеmоны -
соединения, содержащ
Одновременно гидроксильную и карбонильную группы. По взаимному реК­
ПОЛожению этих групп они делятся на а-,
у- и т. д. гидроксиальдегиды
и ГИдроксикетоны:
CH~-CH2-CHOH-CHO
а'ГИДI)()ксllмаСJ""I",ii ИJII.ДСI·IIД
2-ГИДР()КСI1БУТИIl3J11.
13-,
CH a -СНОН-СН 2 -СНО
P'I'IIIlI}()KCI1M3CJIIIIII"ii ИJII,ДСП1д
3-I'НДРlIксиriУТ3113J11,
CH:1-CHOH-CO-CH 2 -CH:1
СН 2 ОН-СН 2 -СО-СН 2 -СН: 1
a'I'IIJlpOKCIIДII~THJlKCTOII
2-ГlIJIРОКCII-З'IIСIlТ311011
P-I'IIJIРОКСliЛll'НIIJIКСТОII
I-ГНJIРОКСI'I-3-IIСIIТaIlOlI
Гидроксиальдегиды и гидроксикетоны могут быть ПОЛУ'lены обычными
МеТодами из соответствующих соединений, уже содержащих гидроксиль­
liYIO ИJIИ карбонильную группы, например окислением многоатомных
255
спиртов - гликолей, гицерина и др., а также альдольной конде!iсаЦией
альдегидов и кетонов (гл. 5.1, с. 175).
Гидроксиальдегиды и гидроксикетоны обнаруживают кроме обычнЬ1)с
свойств спиртов И карбонильных соединений некоторые особеННОСТIf
связанные с взаимным влиянием функциональных групп:
'
1) а- и l3-гидроксиальдегиды образуют циклические полуацетали:
сн-с/
,/
2
rНO-,
I
1
~O
~
Н
t
Н
/он
сн2 -сн
/3
2'
.~
0-,
I
1_04
L_OH ....
'6
/
/ С-СН 2
/
10
8 '/
СН-СН 2
НО
2.$-диrцро"си-I.4-J(IIOkсаи
с&-rцpoкситerраrидрофураи
2) Р-гидроксиальдегиды и Р-гидроксикетоны при нагревании отщепля­
ют воду, образуя непредельные альдегиды и кетоны:
li:J C-СНОН-СН 2 -СНО _-Н 2 О ) СНз-СН=СН-СНО.
КРОТОIIОRЫЙ альдегид
3)
а-гидроксиальдегиды и а-гидроксикетоны способны своеобразно
реагировать с фенuлгuдразuном. (одна молекула на три молекулы фенил­
гидразина), образуя озаЗОНbl:
-но
СНРН-СНОН-СНО + H 2N -NH-C6H5~
rлнцеРНIJ08ыА алМ,егид
феННЛГНЩ)itЗНlf
~СН 2 -СН 2 -СН=N-NН-С6Нs
2NH,-NII-C,H,
>
6н 6н
фСllилгилразон
глицеРК'f(JВОro альn.eгкда
~NН з +NН 2С 6 Н 5 + Н 2 О+ rH2-n-СН=N-NН-С6НЕ
ОН
N-NН-С 6 Н s
ОЗ~Н ГnИllеРИНОВОПJ
м~сгида
. 4)
при действии щелочей на а-гидроксикарб.онильные соединения аль­
дегиды могут переходить в кетоны и наоборот (енольная форма у них одна
и та же):
СНз
СНа
СН1
tНОн~t-Он~t
tHO
256
~HOH
'0
tHPH
знание всех этих особенностей реакционной способности гидроксиаль­
ов и гидроксикетонов необходимо для изучения химии при родных со­
дегИД ний _ углеводов (гл. 33).
еди не
•
ИЗ отдельныХ представителеи гидроксиальдегидов представляют инте-
р
ес гликолевый и глицериновый альдегиды. Это кристаллические вещест­
ва,
легко растворимые в воде. Их можно рассматривать как родоначаль-
ников класса углеводов.
И
•
з гидроксикетонов важнеишими являются
д
иа-
ксиацеmо н НОСН 2 СОСН 2 ОН и ацетон СНзСНОНСОСН з .
Б.
гидроксикислоты
ГИДРQкислотами называют органические карбоновые кислоты, содержа­
щие кроме карбоксильных групп одну или несколько гидроксильных групп.
Число карбоксильных групп определяет основность гидроксикислоты. По
t!ИСЛУ гидроксилов, включая и входящие в состав карбоксильных групп,
определяют атомность гидроксикислот. Так, например, молочная кислота
СНзСНОН -СООН является одноосновной двухатомной кислотой, яб­
лочная НООС-СНОН-СН 2 -СООН двухосновной трехатомной и вин­
ная НООС-СНОН-СНОН-СООН двухосновной четырехатомной.
1. ОДНООСНОВНЫЕ ДВУХДТОМНЫЕ ГИДРОКСИКИСЛОТЫ
Изомерия. Номенклатура
Простейшие гидроксикислоты обычно называют по их природных ис­
точникам (например, молочная кислота).
Очень часто гидроксикислоты получают названия как гидроксипроиз­
водные соответствующих карбоновых кислот. Взаимное положение гид­
роксильных и карбоксильных групп обозначают буквами греческого алфа­
Вита, например а-гидроксипропионовая СНз-СНОН-СООН, fJ-гид­
роксипропионовая НОСН2-СН2-СООН.
По систематической номенклатуре Нqзвания гидроксикислот произво­
дят от названий карбоновых кислот, причем к этому названию прибавля­
ется характерная для спирта приставка гuдроксu-. Нумерацию обычно
наЧинают от карбоксильной группы. Так, например, молочная кислота мо­
Жет быть названа 2-гидроксипропановой кислотой.
Г омологи~еский ~Д_ЩI.~<:>_q~НQJ;3НЫ~LШШ9.!<9!!f!:lf.-!I...9Т наЧ!fJfае..I~8ЛiДp.Q-_.
КСимуравьи_ной или угольной кислотой. Затем идет гликолевая, или гидро­
КСИУксусная ·кИслОТа CH20H~cbOH. Эти две кислоты не имеют струк­
ТУРНЫХ изомеров. Следующий гомолог может существовать в виде двух
ИЗомеров, отличающихся по положению гидроксильной группы: молочная
и ~-гидроксипропионовая кислоты. Кислота с четырьмя углеродными ато­
мами МОжет суще;::твовать в виде пяти структурных изомеров. Три из них
МОЖно рассматривать как производные нормальной масляной кислоты;
ОНи ЯВЛЯются изомерами по положению ОН:
9 3ак. ]8]
257
a-ГИДРОКСllмасляная кислота. 2-гидроксиБУТа_
новая кислота
jJ-Гlщроксимасляная кислота. 3-гидроксибута_
новая Кliслота
Y-ГlЩРОКСliмасляная кислота. 4-гидроксибута_
новая кислота
Два других изомера
-
производные изомасляной кислоты и, слеДОва_
тельно, отличаются от первых строением углеродного скелета:
CHj-СОН-СООН
.
a-ГИДРОI\СliИзомасляная Кliслота. 2-меТИJl-
2-ГИДРОI{Сlшропановая кислота
. I
СН;I
СН20Н-СН-СООН
jJ-гидроксиизомасляная кислота. 2-метил-
I
3,гидроксипропановая кислота
СН;I
Среди гидроксикислот очень часто наблюдается также оптическая изо­
мерия, связанная с наличием ассиметрических углеродных атомов (см.
ниже).
Рассмотрим способы получения и свойства одноосновных двухатомных
гидрокислот. Ha'IHeM с наиболее простых гидроксикислот, опустив уголь­
ную кислоту, так как по свойствам эта кислота и ее производные сильно
отличаются от других гомологов и будут рассмотрены отдельно в конце
главы.
Способы получения
Гидроксикислоты можно получить из кислот введением гидроксильной
группы и из спиртов введением карбоксильной группы.
1.
-
зом
Получение гидроксикислот из галогенозамещенных кислот гидроли­
удобный способ синтеза а-гидроксикислот; а-галогенозамещен­
ные кислоты легко получаются галогенированием карбоновых кислот.
При нагревании с водой галоген легко замещается гидроксилом;, ..
СН;гСНСI-СООН
+ НОН
~ СН;!-СНОН-СООН
+ HCI.
Действием алкоголятов на эфиры а-галогенозамещенных кислот поЛУ­
чают простые эфиры гидроксикислот.
2. Омыление гидроксинитрилов - один из наиболее употребительныХ
Сl10собо~ ПОЛУ'lения а-гидроксикислот:
/ОН
CHj-СН
~СН:j-СНОН-СООН
"CN
3.
J3-Гидроксикислоты 'Iаще всего получают из эфиров галогенозаме­
щенных кислот по реакции Рефор.матского. Действием цинка на смесЬ
эфира галогенозамещенной кислоты и альдегида или кетона получаюТ
258
цинк
водЫ
О ВЫИ
Л егко
алкОГОЛЯТ эфира f3-гидроксикислоты, который при действии
дает гидроксикислоту:
RCHO + ZIl + BrCH~COOC2Hr, --+ RCH(OZIlBrX:H 2COOC 2Hr,
2Н 2 О.
--+ RСН(ОНХ:Н 2СООН + Zn(OH)Br + C2 H:i OH.
РеакцИЮ эту нельзя рассматривать как синтез с участием цинкорганичес­
когО
соединения,
так
как
из
галогенэфиров
такие
соединения
не
образуются.
вместо карБОНИJlЬНЫХ соединений в этой реакции можно использовать
нитрИЛЫ.
4. Присоединением воды к непредельным кислотам ПОЛУ'lают f3-гидро­
ксикислоты. Акриловая кислота, например, в присутствии H 2S0 4 присое­
диняет ВО.ду с образованием f3-гидроксипропионовой (гидракриловой)
кислоты:
Направление присоединения воды определяется здесь ВJIИШlием кар­
боксильной группы на поляризацию двойной связи. Конечный углеродный
атом оказывается более положительным (см. гл. 5.2).
5.
Недавно предложен новый удобный способ получения f3-гидрокси­
кислот:
о
---
11
CH2-С-ОС( СН з)з
I
СНз-С-ОLi
---
I
СНз
6. Окислением оксиаJlьдегидов и гликолей, например оксидом серебра
в аМмиачном растворе, получают гидроксикислоты с различным строени­
ем n зависимости от положения соответствующих групп в исходном
Соединении:
I
СН:lСНОНСНО
--+
2 rA.lNH )
l 1(\ " 2
СН з СНОНСООNН 4
]+ ОН-
I
+ NH 40H + 2NH:\ + 2Ag.
Поскольку гидроксиаJlьдегиды образуются при окислении ГJlиколей,
nOCJle""Вие
также можно использовать для получения гидроксикислот.
259
Физические и химические свойства
Гидроксикислоты
-
ЖИДКОСТИ или большей частью кристалличес
вещества. В воде они растворимы лучше, чем соответствующие карбон'
вые кислоты, не содержащие гидроксила. Низшие гидроксикислоты см
шиваются с водой в любых соотношениях.
Гидроксикислоты проявляют свойства кислот и спиртов. Как кислот
они дают соли, сложные эфиры, амиды и т. Д.:
СН:Г CHOH-СООNа
СН:Г СНОН- СООН
-Е :Н:Г :HOH-:OOC~H"
СН: Г
CHOH-CONH 2
По сравнению с карбоновыми кислотами с тем же числом углеродн
атомов гидроксикислоты (в особенности а-гидроксикислоты) обнаруж
вают более сильно выраженные кислотные свойства. Тик, константа ди
социации гликолевой кислоты в 8,5 раз больше, чем уксусной.
Как спирты гидроксикислоты образуют алкоголяты, простые
замещают гидроксил галогеном:
СН:гСНОН-СООН
-Е
СНгСНОNа-СООН
СНгСНОR-СООН
СНгСНCI-СООН
Вступление в реакцию спиртового или кислотного гидроксили опреде,
ляется выбором реагента и условиями реикции. Т('II<, при действии гало ге
новодородов замещ~ет<;!!nшогеном только, спиртовой ГИДРО~!:IЛ, а пр
действии пентяхлорид фосфора
-
и кислотный, и спиртовой. При дейс
вии щелочных металлов (натрий) сначала получаются соли кислот, аз
тем аЛКОГОЛЯТbI.
Во всех превращениях гидроксикислот приходится считаться с взаим
ным влиянием гидроксильной и карбоксильной групп. Особенно это влия
ние велико, если эти группы находятся в а-положении. а-Гидроксикисл01
ты обнаруживают ряд специфических реакций, обусловленных взаимны,
влиянием гидроксильной и карбоксильной групп.
i
1. a-ГuдРОКСШC/lслоmы легко восстанавливаются в карбоновые кис~
лоты, например при действии иодистого водорода:
2.
При кипячении с разбавленными кислотами a-гидроксикислотЫ
расщепляются с Вblделением муравь-иной кислоты:
CH:1-CH(OH)-COOH ~ CH:1-CHO + НСООН.
3.
Реакция отщепления воды позволяет отличить а-, ~- и r-ГИДРОКСИi
кислоты.
260
1
_гидроксикислоты при нагревании отщепляют воду с образованием
адов т. е. циклических сложных эфиров, построенных из двух моле-
ла Кrnu
'
ку сн
,н-со-он
JI кислоты:
;n6н
,
~H
+,
но-со- Н-СН:I
~
,
,
CH:г-;:H-~
О'"
/.0 +,
2Н 2 0
ОС-СН-СН:\
~_Гuдроксакаслоты теряют элементы воды и дают непред;льные кис­
лОТЫ. Такое направление дегидратации связано с ПОВ~lшенноиuподвижно­
стьЮ водородных атомов в соседстве с карбоксильнои группои, обуслов­
ЛеННОЙ устойчивостью (благодаря сопряжению) соответствующего
аниона:
CH~-CH-COOH
---+ CH2=CH-COOH+H~0 .
.... [........... .1.....
:ОН
н:
.......................
у- и о-гидроксикислоты дают при нагревании лактоны, т. е. внутрен­
ние сложные эфиры. Эта реакция открыта А. М. Зайцевым:
CH2-CH~-CH~-CO
---+ CH2-CH.)-CH~-CO+H~0.
I
I
ОН
он
I
.-
I
0----
В случае гидроксикислот с более далеким расположением функцио­
нальных групп эти группы реагируют независимо одна от другой.
Отдельные представители
Важнейший представитель одноосновных двухатомных гидроксикис­
JIOT -
молочная кислота СНз-СНОН-СООН. Молочную кислоту
получают из нитрила молочной кислоты (циангидрина ацетальдегида), мо­
ЛО'lНокислым брожением сахаристых веществ, действием щеЛОLlей ия вод­
ные растворы моносахаридов. МОЛОLlНая кислота брожения применяется
в технике (протравное крашение, кожевенное производство и т. д.).
Оптическая изомерия
МОЛО I IНЯЯ кислота встречается в природе в трех
ся ОТНошением к плоскополяризованиому свету.
формах, ОТЛИLlаIOЩИХ­
Молочная кислота, вращающая плоскость поляризации света вправо,
называется правовращающей или (+)-молочной кислотой *. Она содер­
жится в Мышцях животных.
Молочная кислота, вращающая плоскость поляризации света влево
(ПРотив часовой стрелки), образуется при ферментации сахарозы с помо­
ЩЬЮ бактерий Bacillus acidi laevolactici. Эта форма МОЛО'IНОЙ кислоты
наЗ~IВ<lется левовращающей или (- )-молочной кислотой.
Соединения, вращающие плоскость поляризации, называются оnти­
~ельными или оптически активными.
IOщ' Знак вращеНllЯ ранее обозначали буквами латинского алфаВI1Та: (1- Д/lЯ правовраща­
"х Соединений. 1 - Д/lЯ левовращаЮЩIIХ. г - Д/lЯ рацематов.
261
Изомеры, отличающиеся только знаком вращения, называются onrпц~~
ческш.tи антиподами.
Молочная кислота, полученная из кислого молока или синтетически, ие
вращает ПJlОСКОСТЬ поляризации света. Эта кислота состоит из смеСИфав_
ных КОЛИ'lеств право- и левовращающих форм и называется ОПТичеСКIt
недеятелыюй (неактивной)
(V)- молочной
кислотой. Равные КОличеСТва
право- и левовращающих изомеров одного и того же вещества могут даТЬ
оптически недеятельное молекулярное соединение
-
раuе.мат.
_
Неорганические и органические вещества могут быть оптически актив_
ны либо толыш в кристаллическом состоянии, либо независимо от агре­
'-
гатного состuяния.
Вещества, вращающие плоскость поляризации только в твердом состо­
янии, кристаллизуются в виде асимметрических кристаллов. Зеркальное
изображение их кристаллов не совпадает с оригиналом. Отдельные Моле­
кулы этих веществ симметричны (имеют плоскость или ось симметрии).
Вещества, вращающие плоскость поляризации независимо от фИЗИ­
ческого состояния, имеют асимметрически построенные молекулы.
В
что
1874
все
г.
r.
Вант-Гофф и Ж. ЛебеJIЬ почти одновременно отметили,
оптически
активные
вещества
известного
строения
содержат
в своих молекулах ПQ:. крайней мере один атом углерода, С'вязанный с
четырьмя раЗ.!lИЧНЫМИ группами. Такие ~TOMЫ называются аСш.tмеmр~
чески.МИ углеродными ятомами (хuраЛ/JНЫМU ценmраШl). Молочная кис­
лота содеrжит асимметрический атом углерода (в формулах его отмечают
звездочкой ):
н
1.
CH:\-i- COOH
ОН
ИЗ ранее изученных соединений такой атом содержит, например, оптически активный амиловый спирт:
н
1.
СН:!-СН 2 -С -СН 2 -ОН
.
1
СН:!
Молекулы (+) и (- )-МОЛО'lНых кислот по пространственному строению
являются зеркальными отражениями друг друга. Тетраэдрическая моделЬ
этих кис.тtOт изображена на рис.
48.
Из рис. 48 видно, что правая модель при наложении не совмещаетсЯ
с левой: группы СН З и СООН совпадают, а Н и ОН нет. В несовмещениМ
этих пространственных конфигураций можно убедиться и по тому, что на
рис. 48 а переход от атома водорода к гидроксилу идет 'Iерез СООН по ча­
совой стрелке, а на рис. 48 б - в обратном порядке. Это похоже на несО­
вмещение правой и левой рук, которые также можно рассматривать как
зеркально симметричные предметы.
262
n
и изображении оптически деятельных соединений обычно пользуют­
, n Роек.цион ными формулами, представлюящими собой проекции тет­
сЯ Ррических моделей соответствующих молекул на плоскость чертежа:
,
раэ,д
н+н
н+:
сиз
сиз
DН-молочн"
L(+)-молочиа.
КИCIIOТа
кислота
Чтобы убедиться в том, имеем ли мы дело с одинаковыми по геометри­
ческому строению молекулами или разными, необходимо проверить, со­
вмещаются ли их проекционные
формулы
при
наложении,
СНЗ
при­
чем перемещение проекционных
формул
допускается
только
плоскости чертежа. При изобра­
жении проекционных формул
принимается, что группы, распо­
ложенные сверху и снизу,
дятся за
плоскостью
нахо­
чертежа, а
/Ь H~
..~
.
в
но
СН з
о
о::
С
---
н
~
а
группы, рilсположенные слева и
СПрilВiI,
-
перед плоскостью чер­
теЖil, поэтому формулы нельзя
ПОВОРilЧИВilТЬ в плоскости черте­
жа НiI 90· и можно поворачивать
НiI 180·. Соединения, отвеЧilЮ­
щие формулам 1 и 11, не эквива­
лентны (изобажают ОПТИ'lеские
ilНТИПОДЫ), формула
леНТНiI формуле
1:
III
а
эквива­
Рис.
48.
6
Модели молеl<УЛ
(-)-
11 (+)-МОЛО1Iноii
КIIСЛОТЫ
H~H
СООН
111
1-I~lIдеНТI1'1НОСТЬ объеlпа с его зеркальным изобажеtlllем называется ХЩJалыюстью. Мо­
.1еI\Улы. IlдеНТIIЧНl>lе с зеркальным изображеНl1ем. называются llХUРUЛ"НhlАIU. Слово ХllраЛl>­
HO~TI, прОllСХОДl1Т от греческого слова «рука» И может быть переведено как «РУI<оподобllе».
IiаJlOжение двух формул, как страниц книги при перелистышшии, недо­
ПУСТI1Мо, ТilК КilК В этом случае будет только Кilжущееся совпадение: две
l~ilPbl I'рупп будут находиться в разных плоскостях, впереди и за плоско­
CTI)I() чертежа.
Направление и величина вращения плоскости поляризации не находЯ~
ся в каком-либо простом соотношении с конфигурацией соединения. Та
например, соли с металлами и сложные эфиры (+ )-молочной кислот
.
вращают плоскость поляризации света влево:
СН·,-СН-СООН
(CH,-СН-СОО).,Zп
., I
., I
ОН
СН·,-СН-СООСН.,
-
" )~
., I
ОН
.
он
lal,. = + 3,30*
lal"
= - 8,20
(CH:\-тН-СОО)2ZIl
СН·,-СН-СООН
., I
ОСН:\
ОС 2 Н,;
lal" = - 75,50
lal"
= - 66,40
ХИМИ'l-еских методов для устаНQl;\ления д.ДС~/1l9.тноЙ KO~"
оilТИчески-аКтивн.~~М·олеку.(l H~i. Однако ()лтическиаКJ.шшыцоедшшt я
можно-химичеёким путем'превращать друг в друга без нарушения конфи­
гурации асимметрических центров. Таким образом можно получить ряды
соединений с одной и той же конфигурацией.
М. А. Розанов (1906) предложил использовать в качестве относитель­
-;;Госта'ндарта fip-авовращаю-щий"(+)~гJiицерй·новыI·-альдегид,' которому
произвольно приписал конфигурацию D:
_ i HO
СНО
h-fОН HiH
снрн
снрн
1)
1.
Соответственно левовращающий антипод обозначили буквой
L.
Относительная конфигурация молочной кислоты была установлена
превращснием глицеринового альдегида в молочную кислоту. Альдегид­
ная ГРУГlllа глицеринового альдегида была окислена в карбоксильную
группу, а группа СН 2 -ОН восстановлена в группу СН з . Эксперимент
показал, что левовращающая молочная кислота соответствует по конфи­
гурации D-глицериновому альдегиду, следовательно, является D (-)-мо­
лочной кислотой. Подобным образом были установлены относительные
конфигурации многих веществ.
В 1951 г. было показано рентегноскопически, что выбор конфигурациИ
для О-глицеринового альдегида СЛУ'lайно оказался правильным.
Для обозначения конфигурации оптически активных веществ принято
пользоваться латинскими буквами
*
D
и
L.
ЕСЛI1 а является наблюдаемым вращением в градусах (+ для правого,
вращения; [ - ДЛl1на поляриметрической кюветы, дм; с -
-
для левогО
концентрация раствора, г/мл, иЛИ
плотность В случае ЧIIСТОЙ ЖI1ДКОСТИ), то величина
[a]h=~
называется ус)ельныAl арuщенuеАI. Он" выражает вращение, ПРllходящееся на единиuy дnиНЫ
ПОЛЯРlIмеТРllческоil кюветы и на еДIIНИUY концентрации.
264
леднее время в органической ХIIМИII все шире применяется номенклатура ОПТИЧt;-
В ПО~еров, предложенная Р. Каном, К. Ингольдом 11 В. Прелогом. Согласно этой [lOмен­
eKIIX 11З~ атомам, ПРIIМЫJ,аЮЩfIМ " хиральному центру. приписывается определенное стар­
((Лат~р о которое уменьшается с умеflьшением порядкового номера соответствуюшего эле­
IJjIlHCTB ПО ,тоЙ CJICTeMe JIСПОЛЬЗУЮТ символы R (от лат. reclus правыи) 11 5 (от лат.
M.eH~la·r _ левыii) для обозначения I<аждого хирального центра в заВJ·JСИМОСТII от его
."НН." е
·онфигураЦJIII.
к
СтарШIIНСТВО определяется на основе подсчета атомных номеров. Так. галогены распола-
тея в следУЮЩИJI ряд(по убыванию старшинства): 1. Вг, CI. F. Когда заместителями явля­
~:СЯ группы атомов. например CH: NH~. он, SO:IH, стаРШllНСТВО Прl1Пllсывается ГРУПП<lМ.
1.
в
которых пеРВЫl1 атом имеет наиБОЛЬШ!IЙ атомный номер: 1> BJ' > СI >SO:IH >
> F> ОН > NH~ > CH:I· ЕсЛl! атомы. соеДJfНенные СХИР<lЛЬНЫМ центром. ОДИН<I"ОВЫ. то учи­
тывают связанные с ними заместители
дУющему атому и т. д.
Согласно
и.
если
необходимо.
переходят далее
этому правилу СН а СН 2 > СН: 1 (так
к сле­
I\ак С> Н)
11
CH:I-CH~-CH2 > CHa-СН2' Если два замеСТl1теля связаны с ХIIР<lЛЬНЫМ центром ато­
маМII ОДJlнакового атомного номера. но в раЗЛlIЧflOМ 'lIIсле, то старшинство ОТД<lется З<lмеСТII­
телю
с
большим
'(ислом
атомов.
Это
ПРIIВОДIП
TaKoii
1\
последовательности:
(CH:I):iC > (CH:1)2CH > CH a -СН 2 (та" ка\{ 3С > 2С > I С); CH(OR)2 > CH20R (20) 10).
Если атом соединен с Хllр<lЛЬНЫМ атомом двоiiной связью. его СЧlIтают задва атома (или за
три в случае ТРОЙНОJI связи). В соответствии с этим ГРУППИРОВl<а СНО имеет преJlмущество
перед ГРУППIlРОВI<ОII СН2-0Н. но не перед CH(OCH:I)~' К<lрБОКСflльная ГРУПП<l соон IIме­
ет преимущество перед альдеГJ1ДНОИ группоii сно. T<lK как сумма атомных В0меров вторых
атомов в СО ОН больше. чем в сно (TpJI связи Кllслорода дают в сумме 48. а две связи с ЮIС­
лородом 11 одна с водородом - только 33).
Для уетановлеНlIЯ R- ИЛII S-I<ОНФllгураЦJШ молекулу рассмаТР"В<lЮТ с удаленной от младше­
го 3<1меСТIIТеля сторовы (в случае ГЛlщеринового альдеПlДа это атом водорода) вдоль оси. совпа­
Д<lющей со СВЯЗI,Ю этого заместителя с Хllральным центром (направление наблюдения ПОl\азаJIО
стреЛl<оii). ЕСЛII при этом стаРШ!IНСТВО трех оставшихся заместителей убывает в направлеНlIl1 по
часовоii стрелке. это соответствует аБСОЛЮТНOII конфигураЦИJI
УбываНllе стаРШJ1Нства в на­
правлеНll1I nlJOТlIB часовой стрелки соответствует абсолютной 1<0нфигураЦlll1 5:
R.
/он
Н-С--- снрн
\сно
(~-ГJlиItСРIllЮI\l"ii ~JlI,ДСГlЩ
--
S-I'JIIЩСРИIIОIII,lii HJII.;t~l·fl}!
ЕСЛlI В молекуле IIмеется несколько Хllр<lЛЬНЫХ центров. \{аждый ПОЛУЧ<lет оБОЗflачеНllе;
та". первый JIЗ четырех стереоизомерных 3-бром-2-бутанолов оБОЗJ1ачают
ЗS)-3-бром-2-бутанол, а (+)-ВИfJная Кllслота "ак (2R. 3R)-ВИlIная кислота:
СН, !
СН' I
СН 1
СН, !
1 .
1 .
·1 .
1 '
Н-С-Вг (51)
HO-~-H (8)
~H:I
Вг-С-Н (I~)
H-J-OH
~H:I
(I~)
н-с-вг (51)
1<<11< (25.
Вг-С-Н (Ю
H-(~-OH (I~) HO-(~-H (S)
~Ha
tH: 1
JtН<ll'Т~I)~()МСI)l,' ;!-(iIЮМ -:2 -(iУ'I'НIЮJlИ
т оон
Н-С-ОН
1
но-с-н
tOOH
(+)-ШIIIIIНfl
КlICJIOТИ (I~.
N)
(fOOH
но-с-н
l
(~OOH
н-е-он
(-)-IШIIIIЮI
I(IIС./ЮТИ
(S, S)
265
Следует отметить, что оптическая деятельность может наблюдаться It
в тех случаях, когда в молекулах вещества нет асимметрических аТОМО8
но они в целом асимметричны (не имеют плоскости или других элементо~
симметрии). В этом случае говорят о молекулярной асимметрии (см.
гл. 25.2).
ДВУХОСНОВНЫЕ ТРЕХАТОМНЫЕ ГИДРОКСИКИСЛОТЫ
2.
Для получения двухосновных гидроксикислот применимы те же общие
способы, что и для одноосновных. Так, например, важнейший представи­
тель двухосновных трехатомных гидроксикислот - яблочная кисло­
та
-
может быть получена гидролизом бромянтарной кислоты или при­
соединением воды к малеиновой и фумаровой кислотам.
Кислоты этой группы
-
кристаллические вещества. В химическом от­
ношении они ведут себя так же, как и другие гидроксикислоты. Так, на­
пример, яблочная кислота обнаруживает свойства а- и ~-гидроксикисло­
ты, так как гидроксильная группа здесь находится в а-положении к одно­
му карбоксилу и в ~-положении к другому. При восстановлении она дает
янтарную
кислоту,
при дегидратации
-
этилендикарбоновые
кислоты
(малеиновую или фумаровую).
СинтеТИ~lеские способы получения дают рацеМИ1lескую яблочную кис­
лоту (т. пл.
130-131 ·С). в природе распространена левая яблочная кис­
лота (незрелая рябина, яблоки, виноград, барбарис) с т. пл. 100·С.
(+)-Яблочная кислота получается восстановлением (+)-винной кислоты
и отличается от
(- )-яблочной только знаком
вращения плоскости поляри­
зации света.
ЯБЛО1IНые кислоты
-
удобный пример для изучения явления вальде­
новского обращения. Вальденовским обращением называют изменение
конфигурации в процессе реакции без полной рацемизации. В приведен­
ном ниже примере замещение галогена гидроксилом не сопровождается
изменением конфигурации, а замещение гидроксила галогеном идет с валь­
деновским обращением конфигурации.
Обращение или сохранение конфигурации во время реакции замеще­
-t
ния определяется механизмом реакции (ср. гл.
2.1 ):
СООН
(+)D-хnор.итари..
KHC~OTa
8
(+) D-.б.ОЧН8.
С\
KHO,llO'l'&
820008
(-) L-.БJlОЧН ••
кислота
o-f
н
н
~COO8
2бб
1:
СОО8
Со'
8
8 2 СОО8
(-)L-ХJlОрRнтарна.
КНСJlота
НуклеОФИЛЫlые реакции замещения, протекающие по бимолекулярно­
механиЗМУ (SN2). сопровождаются вальденовским обращением. Это
мУ
вано тем ' что переходное состояние 1, приводящее к обрящению конвЫЗ
фигурации, знергетически более выгодно, чем переходное сосояние 11,
прИ котором возможно сохрянение конфигурации:
R.X
У
11
III
Л·у .1<:.у
R
·
в IщеаJlЫIOМ CJlY'lae в переходном состоянии 1 входящая ГРУГlllа Х 11 уходящая У раСПОJlО­
жены на прямоi\. перепеНДl1I<УJIЯРНOI-1 ПJlОСI\ОСТII, в которой находятся Tpll замеСТllТеJlЯ R.
При НУl\.lIеОФIlJlЫIЫХ реакциях замещения. протекающих по МОНОМОJlеКУJlЯРНОМУ меха­
IIIIЗМУ
(SN 1).
часто происходит рацемизация, СОПРОВОЖДl1ющаяся частичным ваJlьдеНОВСI\ИМ
обращеНllем. РеаlЩllI1 ,того типа проходят через стаДIIЮ образоваНllЯ карбенневого Iюна
111.
Пос.леДНllii ЯВJlяется ПJlзнарным (nJlOCКlIM) 11 СJlедоваJlО бы ОЖlщаТl" что ДОJlЖllа ПРОIIСХОДIIТЬ
ПОJlная рацеМIIЗaLlllЯ. ЧаСТllчное ваJlьденовское обращеНllе оБЪЯСН!lется тем, что карБОНllе­
Bblii IЮН не успеВl1ет ПРIIНЯТЬ совершенно ПJlОСКУЮ конфигураЦIIЮ.
Иногда реакЦlIИ (SN 1) протекают с coxpaHeНlleM КОНфllгураЦИII. Это IIMeeT место в тех
СJlучаях, когда молеКУJlа содеРЖIIТ каКУЮ-Jlибо группу, мещающую иону карбеНIIЯ 111 11рllНЯТЬ
ПJlОСI<УЮ конфигураЦIIЮ (HanpIIMep. l<арБОКСIIJlЬНУЮ группу).
3.
ДВУХОСНОВНЫЕ ЧЕТЫРЕХДТОМНЫЕ ГИДРОКСИКИСЛОТЫ
Важнейшими представителями этой группы являются винные кислоты
НООС-СНОН-СНОН-СООН. Они различаются между собой толь­
ко пространственной структурой.
Дuгuдроксuянmарная, или винняя, кислота, как видно из формулы,
имеет двя ясимметри"еских атома углеродя. Каждому асимметрическому
ятому отвечяют двя янтипода и один рацемят. Общая формуля количества
ОПтических изомеров
N = 2t1 , где n -число асимметрических ятомов угле­
родя. ТЯКlIМ обрязом, для дигидроксиянтарной кислоты можно ожидять
СУЩССТ130ВЯНИЯ 'leTbIpex оптически деятельных изомеров и двух рацемя­
ТОН. Оптически деятельные изомеры винных кислот можно изобрязить
слел.ующими проекционными формулами:
СООН
СООН
со ОН
СО ОН
"*0" "0*" "*0" "0*"
НО
R,R
Н
Н
ОН
Н
ОН
НО
Н
СООН
СООН
СО ОН
СООН
1
11
111
IУ
(или
DJ
(+)-ВИННI.
S,S(ИЛИ
U
(-'-Iмина.
R ,5
-8инна8, или меSО'8иннаl
(нсаеlтельнаl .инна.)
267
Если проекцию
1 повернугь на 180· вокруг оси, перпендикулярн~
к плоскости чертежа, и наложить на проекцию П, то совпадут карбокси.n .
ные группы, а Н и ОН не совпадут. Это свидетельствует о том, что про~
ции 1 и II принадлежат разным молекулам.
.J
Такая же операция с формулами III и IV показывает, что эти вещеет,,;:
идентичны. Таким образом, вместо ожидаемых 'leTbIpex соединений СУще.'~
ствуют только три плюс рацемат (из первых двух стереоизомеров). Сте."
реоизомер III недеятелен вследствие внутренней коМ,nенсации враще~'
ния. Вращение, вызываемое верхним тетраэдром, уничтожается противо.
положным по знаку и равным по величине вращением, обусловленным
нижним тетраэдром. В этом можно убедиться: если мысленно снять верх.
ний тетраэдр, повернуть его на 180· вокруг оси, перпендикулярной к чер~'
тежу, и наложить на нижний тетраэдр, то совмещение не имеет места. Это
значит, что тетраэдры противопложного характера и вращение, вызывае.
мое одним, уничтожается (компенсируется) другим. Следовательно, могут
существовать соединения с асимметрическими углеродными атомами, но
оптически недеятельные вследствие симМ,етрии молекулы.
Вещества с одинаковыми заместилелями у хирального цеНТрR, распо­
ложенными в проекционной формуле по одну сторону, называют зрит­
po-иЗОм'ерам'и, по разные стороны
-
трео-иЗОм'ерам.и.
Первые две винные кислоты называются
называется м'езовинной
кислотой,
(+)-
и
(- )-винными, изомер III
рацемат из
первых двух изоме­
ров
- виноградная кислота. (+)- и (- Н3инные кислоты - ОПТИLlеские
антиподы. По отношению к этим кислотам МёЗОвИiшаяkис.лОта явJiяёТt:Я
так называемым диасmереоМ,ероМ, (но не их антиподом).
Винные кислоты получают синтетическими методами или из при родных
веществ. При гидролизе дибромянтарных кислот (рацемат и мезоформа)
получается смесь мезовинной и виноградной кислот. Присоединение двух
гидроксилов при действии
1%-ного раствора КМПО4 к малеиновой и фу­
маровой кислотам дает в первом случае мезовинную кислоту, во вто­
ром
-
виноградную:
н" /соон
Л
С
+{но-он]
н/ "соон
.
н" ,/соон
W
н--Г он
соон
H~~:
-+{но-он] - -OHfH н он--Г
н
с'
ноос/ "н
-- H~~:
СО ОН
Н
он
соон
СО он
(+)- ВИННRЯ, или виннокаменная, кислота широко распространена
в растительном мире (виноград, ряБИНR и Т. п.). Ее КИСЛRЯ калиевая соль
268
аетСЯ в виде винного камня при брожении виноградного сока. Это
осаЖд"ллическое
вещество с т. пл. 170 'С, легко растворимое в воде. При
стn
кри
аг еванИИ она
подвергается,
как и
.
многие другие 0.-,
/3-дигидрокси-
Н р основные кислоты, дегидратации и декарбоксилированию с образова­
~:~ преимущественно nировuноградной кислоты:
Н
.
QH
H{Q<;;"Q'--{-{-COOH
?Н
-СО 2 ' I-IP~ сн 2=с-соон ~ снгсо-соон
:(~HJ:{
винная кислота и ее соли имеют разнообразное применение. Винная
кислота применяется в пищевой индустрии и красильном деле, соли
винной кислоты, например сегнетов.~ __.~~~.~_~ilj4..QБКNа _~J-Ъ.Q._=-_!!..l?-i;1~ ..
диотехнике (пьезокристаллы), в химическом анализе (например, в виде
фелинговой жидкости). Двойная соль калия и антимонила известна в
медицине
и
в
протравном
крашении
под названием рвотного
ка.м.ня
2C4~06K' (SbO)2' Н 2 О.
(-)-ВИlIная кислота практически не отличается по свойствам от право­
го изомеРil, кроме знака вращения.
Она получается из ВИ~lOградной
кислоты.
Обе оптически деятельные кислоты при продолжительном нагревании
их растворов дают рацеическую виноградную кислоту (одновременно об­
разуется некоторое количество мезовинной кислоты). Та же кислота по­
лучается при смешении равных количеств двух антиподов.
Виноградная кислота отличается по физическим свойствам от винных
кислот. Она кристаллизуется с молекулой воды, т. пл. кристаллогидрата
204 ос. Отличаются по растворимости и соли этих кислот. В то же время
в Рilстворах она имеет молекулярную массу, соответствующую формуле
С"II 6 ОБ. Следоват~льно, при растворении рацемат диссоциирует.
Мезовинная кислота образуется из других изомеров при продолжи­
тельном кипячении их растворов с едкими щелочами. Это наиболее устой­
Чивая форма винных кислот. Она, как и виноградная кислота, кристалли­
зуется с молекулой воды. Безводная кислота плавится при 140 'с.
Методы разделения рацематов на оптические антиподы. Синтетичес­
кие методы получения органических соединений обычно дают рацемичес­
Кие соединения. Между тем в ряде случаев практика требует выделения
К(1КОГО-либо антипода. Это особенно относится к синтезу лекарственных
веществ, так как живые организмы совершенно по-разному реагируют на
ilНтиподы. Поэтому большой практический интерес представляют методы
РilЗделения рацематов на оптические антиподы. Это разделение имеет и
БО'1Ь шое теоретическое значение, так как является важным средством
УСТ~lIовлеllИЯ строения и конфигурации органических соединений.
СУществуют три главных классических метода разделения рацематов
Н(1 ОПТИ'lеские и'Зомеры. Все они открыты знаменитым французским уче­
H[,IМ Jlуи Пастером в середине XIX столетия. Широкое применение имеет
269
только третий метод. Два первых представляют только историчеСКИА
интерес.
1.
М е х а н и ч е с к и й о т б о р. При определенных условиях соли ра­
цемической смеси кислот кристаллизуются в виде правой и левой форм
отдельно, причем их кристаллы по форме относят друг к другу как преДМе'l'
к зеркальному изображению - они энанmuоморфны (рис. 49). ТаКие
кристаллы можно механически разделить, например, с помощью сильной
лупы и пинцета. Так кристаллизуется аммонийнонатриевая соль винной
кислоты при температуре ниже 28 ос.
2. Б и о л о г и ч е с к и й
о т б о р.
Различные микроорганизмы способны
потреблять в процессе жизнедеятель­
ности какую-либо одну из оптически
активных форм, обычно ту, которая
более распространена в природе. Дру­
гая форма остается в чистом состоя­
нии и может быть выделена из остат­
ка. Микроорганизмы ее используют
только после того, как первый изомер
будет полностью израсходован. Так,
РflС. 49. Форма кристаллов npaBo- и левовращающей IIММОНllйнонатриевой соли
винной кислоты
например,
требляет
чеРНИJlьная
плесень
преимущественно
по­
(+ )-вин-
ную кислоту и, если выращивать пле­
сень на растворе виноградной кислоты, в этом растворе остается только
(-)- винная кислота.
3. К р и с т а л л и за
Ци я
Д и а с т е р е о м е ров.
Выше уже было
сказано, что диастереомеры обладают различной растворимостью. Метод
и сводится к тому, что из смеси оптических изомеров получают смесь диа­
стереомеров, которую и раскристаллизовывают. Так, действуя на смесь
двух оптических изомеров какой-либо кислоты оптически активным осно­
ванием, получаются две соли, представляющие собой диастереомеры.
После разделения диастереомерных солей из.них выделяют действием бо­
лее сильных кислот две кислоты
-
D-Кислота
оптические антиподы:
+ L-Кllслота
L-основаfИiе
,j.
,j.
Соль D-кислоты"
L-основаНIIЯ
,j.
D-Кислота
Соль L-КlIСЛОТЫ
11
L-ОСНОВIIНIIЯ
,j.
L-КIIСЛОТII
В качестве основания берут сложные гетеРОЦИКЛИLlеские соединениЯ:
бруцин, цинкохинон, стрихнин.
Недавно ВОЗНIIК новый аспект стереОХИМIШ. связанный С ТIII( называеМЫМfI mоnuчесКUJ/U
1I:IUIIШJ()еtlСIl1IJ1/Jl.lIII. Многие молеl(УЛЫ содержат IIТОМЫ и группы. которые вданной молеку­
ле ЭI(ВИВllлеНТIIЫ. 110 npH ЗlIмещеНИII дают стеРН'IеСЮI не ЭI<ВИВllлентные соеДllнеНIIЯ. т. е. эти
молекулы не являются гlМlеlJfII(J1lНЫJ/U. ЕСЛlI при таком замещении вознltКIIЮТ IIНТИПОДЫ. ТО
270
мы называют :mантиОI/lОnНЫ.4lи. если при этом образуются Дl1астереомеры
-
()иа­
'~TH aT'~)/Il(}nHbl,'IlI. rOMeoTonHbIe атомы по отношению 1<0 всем реагентам проявляют одина­
c/llepe aKТlIBHOCTI>. Энантиотопные атомы реаги'руют с раЗЛl1ЧНОЙ СКОРОСТI>Ю ТОЛl>КО С Хl1раль­
КОВУЮреагентамн. Диастереотопные атомы реагируют с различной скоростью и с аXllральны­
HbI M1el"гентами. В спектрах ямр они дают различные пики.
ми Р n
4.
ТРЕХОСНОВНЫЕ ЧЕТЫРЕХдТОМНЫЕ ГИДРОКСИКИСЛОТЫ
Широко Рilспространена в природе лимон.н.ая кислота. ОНiI содержит­
ся в свекле, малине, крыжовнике, ВИНОГРilде; в лимонах ее 6-7%. Лимон­
ная кИСЛОТiI образует кристаллы состава С 6 Н В О 7 • Н 2 О, т. пл. 70-75 ос.
В технике ее получают одним из видов брожения глюкозы или из
махорки.
При Нilгревании лимонная кислота ведет себя как ~-гидроксикислота,
превращаясь в акон.итовую кислоту. При перегонке теряет воду и СО 2 ,
причем в зависимости от условий образуются цитраконовый (1) или итако­
новый
(II)
ilНГИДРИДЫ:
сн-со
11
н-сн-соон
ун-соон
HO-~-COOH ~ !-соон
tHrCOOH
th;-СООН
•
"о
с-сь
{
(~HI
I
~H2
С-СО
1
)0
СН 2-СО
11
При действии серной кислоты ЛИМОННilЯ кислота ведет себя как а-гид­
роксикислота: отщепляет муравьиную кислоту и дает ацетондикарбоновую кислоту:
.
он
I
HOoc-сн 2 -с-сн 2 -соон --+ нсоон+ноос-сн 2 -со-сн 2 -соон.
I
соон
.лимонная кислота широко применяется в пищевой промышленности,
в медицине и других областях.
5.
ГИДРОКСИМУРАВЬИНАЯ, ИЛИ УГОЛЬНАЯ, КИСЛОТА
~rгольную кислоту И ее соли изучают в курсе неорганической химии.
В Курсе органической химии рассматриваются производные угольной кис­
;ОТЫ, Хilрактерные для всех других органических кислот: эфиры, хлоран­
ИДРИДЫ, амиды и т. д.
б ЭФиры угольной кислоты. Сложные эфиры угольной кислоты могут
Ыть двух типов: кислые и средние.
КИСJlые эфиры угольной кислоты - алкилугольн.ые кислоты - мо·
гут быть получены из их солей. Последние легко образуются при пропус271
кннии
диоксида
углеродн
через
растворы
алкоголятов
щелочны(''
металлов:
С0 2
+ C2H,;ONa
+=t C 2 h,,0-СО-ОNа.
Эфиры этого типн весьма непрочны: они легко разлагнются на Спирт
и углекислоту. Более прочны их СОЛИ. Эфиры представляют интерес Д/lя
пищевой химии, тнк как весьма вероятно, что углекислота может связы­
ваться с пищевыми продуктнми, образуя кислые эфиры (возможно, час­
тично в таком состоянии присутствует углекислота в пиве).
Средние эфиры угольной
кислоты
-
диалкилкарбонаnzы
-
легко
получают действием фосгена или хлоругольных эфиров на алкоголяты:
COCI 2 + 2NaOCH:! - ) СО(ОСН:!)2 +2NaCI
CICOOCH:! + NaOCH:! - ) СО(ОСН:!)2 +NaCI.
Диалкилкарбонаты бесцветные жидкости, с фруктовым запахом,
плохо растворимы в воде. Диэтиловый эфир имеет т. кип. 126 ос.
Эфиры ортоугольной кислоты. При действии алкоголятов на хлор­
пикрин образуются эфиры ортоугольной кислоты:
CCI:!N0 2 +4C 2 H"ONa - ) С(ОС 2 Н")4 +ЗNаСI + NaN0 2 .
Эти эфиры могут быть ИСПОJlьзованы в органическом синтезе как аце­
тальобрнзующие реагенты, подобно ортомуравьиному эфиру:
R2CO + С(ОС 2 1-1")4 - ) R2 C(OC 2 H',)2 + ОС(ОС 2 1-1")2'
При действии воды в присутствии КИСЛОТ они распадаются на спирт и
средний эфир:
С(ОС 2 Н';)4 +Н 2 О
- ) СО(ОС 2 Н';)2 + 2С 2 Н"он.
Галогенангидриды угольной кислоты. Теоретически можно предста­
вить себе существование двух типов галогенангидридов угольной кислоты:
О=С(
CI
'ОН
11
О=С(
СI
'СI
Соединения первого типа носят название галогенугольных кислот.
Они неустоЙчивы. Из соединений второго типа известны фтористый кар­
бонил (фторангидрuд фтормурнвьиной КИСJlОТЫ) COF 2 и фосген COCI 2·
Наибольшее значение имеют хлористые производные.
Хлоругольная кислота в момент образования распадается на HCI
и С0 2 . Точно так же не могут существовать ее соли. Однако для нее изве­
стны до~т~точно прочные эфиры.
Эфиры хлоругольной кислоты ПОЛУ'lают действием фосгена на спир­
ты ИJlИ хлорировннием эфиров муравьиной КИСJlОТЫ:
COCI 2 +
НОСН:! - ) CI-СО-ОСН:!
+ Hel.
Это жидкости с резким запнхом, сильные л а к р и м а т о р ы (слезото­
чивые вещества). Атом хлора в этих эфирах весьма подвижен, и потому
они чнсто применяются для различных синтезов.
272
и
1. При
Hel:
действии воды они полностью распадаются на спирт, С0 2
CI-CO-OCH:\ + Н 2 О -----+ СН:\ОН + С0 2 + HCI;
2.
е алкоголятами дают полные эфиры угольной кислоты:
CH:pNa + CI-COOCH:\-----+ СН:Р-СООСН:\ + NaCI;
з. е аммиаком обрllЗУЮТ эфиры карбаминовой кислоты
-
уреmаны:
H 2N-H + CI-COOCH:\-----+ H 2N-COOCH:\ + HCI.
МеТИЛОВЫЙ (т. кип.
71,5
ОС) и этиловый (т. кип.
95
ОС) эфиры хлор­
УГОJlЬНОЙ КИСJlОТЫ применяются в органическом синтезе для получения
производных угольной кислоты, а также для введения карбоксильной
грУППЫ в ароматические соединения (гл. 24).
Продукт полного хлорирования метилового эфира хлоругольной кисло­
ТЫ
-
дuфосген
-
является нестойким боевым отравляющим вещест­
вом удушающего действия. Эта жидкость с т. кип. 127 0 с. Внебольших
концентрациях имеет приятный запах герани. При нагревании распадает­
ся, образуя фосген: СIСООСССI:з ~ 2COCCI 2 .
Фосген (хлористый карбонил, хлорангидрид хлормуравьиной КИСЛОТЫ)
известен с 1811 г. При обычных условиях это газ. Однако он легко сгуща­
ется В жидкость с т. кип. 8,2 ос. В небольших концентрациях пахнет пре­
Jlыии яблоками. Хорошо растворяется в не содержащих гидроксила орга­
нических растворителях (толуол). Является боевым нестойким отравляю­
щим веществом удушающего действия.
Фосген легко получают взаимодействием оксида углерода с хлором (на
свету над углем). Эта реакция при высоких температурах имеет равновес­
НЫЙ характер. При 500 ос равновесная концентрация фосгена 67%. Выше
800 'С фосген не существует.
Химические свойства фосгена аналогичны химическим свойствам дру­
гих ХJlOрангидридов.
1. Он медленно раЗЛ<'Iгается водой на С0 2 и HCI:
0=CC1 2 + Н 2 О -----+
С0 2
+ 2HCI.
:2 Со спиртом дает хлоругольные эфиры:
СН:\ОН
+ CI-CO-CI -----+ СН:\ОСОCl + НСI
или 1J0JiHble угольные эфиры:
2СН:рН
+ CI-CO-Cl-----+ (СН:Р)2СО + 2HCI.
3 С Яммиаком образует мочевину (карбамид):
--
,/СI
О=С"
СI
+
HNH 2
HNH 2
/NH 2
*
---+ о=с"
+ 2НСI
NH 2
• в деiicТВlIтелЬНОСТlI образуется NH 4C1.
273
Фосген очень широко применяется в современной технике: в СИНтезе
многих красителей, мочевины и других веществ.
АМИдbl угольной КИСЛОТbI. От угольной кислоты можно произвести дВа
амида: карбаминовую кислоту и мочевину (карбамид):
/ОН
О=С"
о-с/
NH 2
-
кнрБНМIIIЮIIН.,
NH
2
"NH 2
МОllСIШllit
КНСJIОПI
Карбаминовая кислота в свободном виде неизвестна. Хорошо изучены
- соли, эфиры.
ее многочисленные производные
При взаимодействии аммиака и СО 2 полу'/ается аммонийная соль кар.
баминовой кислоты
-
карбам.ат аммония:
СО 2
Уретаны
эфиры
-
+ 2NН:г-+NН 2 -СООNН 4 ·
карбаминовой кислоты
-
могут быть получены
многими путями, например:
1.
Из хлоругольных эфиров:
2NH:1 + CI-COOCH~ ---+ NH 2 -COOCH:1 + NH 4CI;
2.
Из угольных эфиров:
СО(ОС 2 Н")2
3.
+ NH:\ ---+ NH 2 -CO-OC 2 H" +С 2 Н"ОН;
Из мочевины:
Уретаны
бесцветные кристаллические вещества, перегоняющиеся
-
при обычном давлении без разложения.
Уретаны проявляют характерные свойства амидов и сложных эфиров.
Так, например, при длительном кипячении с водой подвергаются гидроли­
зу. Их применяют в медицине как снотворное.
Мочевина (карбамид) является полным амидом угольной кислоты. ОНа
содержится в моче человека (около 2 %) как продукт распада белковыХ
тел. В виде мочевины выделяется около 80% содержащегося в распадаю­
щемся белке азота.
Мочевина
-
бесцветные кристаллы с т.
пл.
133
'С,
растворимые
в воде и спирте.
Ввиду большого практического значения мочевины разработано много
способов ее получения. Основные из них следующие:
1.
Из углекислоты под давлением
СО 2
2.
274
Из фосгена:
+2NH:1
200·С
(20
~
МПа, или
200
(NH2)2CO + Н 2 О.
атм):
з. Из цианамида:
NH 2-CN +
4.
Н2О
- + NH 2-CO-NH 2;
Из карбоната аммония при нагревании:
(NH4)2CO;j - + (NH2)2CO +
2Н 2 О.
в химическоМ отношении МО:lевина проявляет свойства амида.
1.
u
При кипячении с водои в присутствии кислот или щелочеи подвер-
гаетсЯ гидролизу:
NH 2 -CO-NH 2 +
Н2О
- + 2NH:\ + СО 2 .
2. При действии минеральных кислот образует соли (с одним эквива­
лентом кислоты):
NH 2 -CO- NH2 +HNO;j - + NH2 -CO- NH2 • HNO:\.
Нитрат мочевины плохо растворим в воде. В виде этой соли выделяют
мочевину, например из мочи.
з. При действии на мочевину щелочного раствора гипобромита натрия
выделяется азот:
2Н 2 О
NH 2 -CO- NH 2 +ЗNаОВг - + ЗNаВг + N2 +
+
СО 2 .
4. Азот выделяется и при действии на мочевину азотистой кислоты
(А. п. Бородин):
CO(NH 2 )2 + 2HN0 2 - + СО 2 + 2N 2 +
ЗН 2 О.
Обе ,ни реакции служат для количественного определения мочевины
(по количеству освобождающегося азота).
5. При нагревании мочевина расщепляется с образованием несколь­
ких веществ, главным из которых является биурет:
NH 2 -CO-NH 2 + H-NH-CO-NH 2 - + NH 2 -CO-NH-CO-NH 2 + NH:\.
В щелочном растворе биурет дает с солями
меди фиолетовое
окрашивание.
о. При действии на мочевину алкилирующих средств получают
алкuлмочевuны:
NH2 -CO-NH 2 + СН:\! - + NH 2 -CO-NH-CH:\ + HI.
M~TIIJIM()'ICh~llltI
7.
При действии на мочевину ацилирующих средств получают уреиды:
NH2-CO-NH 2 + (СН:\СО)20 - + NH 2 -CO-NH-COCH:\ + СН:\СООН.
аILеТИJtМОII~rШllа
Уреиды применяются как снотворное. Так, уреид бромизовалерьяновой
КИслоты известен как снотворное бромурал:
(CH;j)2CH-СНВг-СО-NН-СО-NН2·
275
С двухосновными кислотами мочевина дает два ряда производных: уровые кисдоты
и уреиаы (Н. Н. 311НИН). Так, с щавелевой кислотой может быть получена оксадуровая И
nараfiан(}(/ал кu~'Л()mы:
ОКСНJlУIЮIIН/I
КИCJIOТft
Oc(NH 2 + НО- 1 О -211Р> OC/NH-<f0
'NH 2
НО-СО
"-NH-CO
IlfoIраl'»lIЮШ'Я t{JlCJIIIТ;\
(lIксаJIНJIМIJ'I~IIItШI )
в медицине широко применяются в качестве снотворных средств пронзводные 6ар6иту­
РО/JОЙ KllCAOlllbl -
малонилмочевнны:
НО-СО
NH-CO .
"-СН. -21 !.,(~ ОС/
"-сн.
2
"-NH-CO/ 2
/
НО-СО
tiнрБН1УIЮIIН/I КIICJЮТII
ДИЭТI1лбарбитуровая кнслота известна под названием веронал. этилфенилбарбllТУРО­
-
вая
под названнем д/(М/инад:
о
HN/~NH
)'с')'о
/,
Н'С 1
С,н,
этилфевllЛбарбитуpo8U
"1IC.IIOТ8
Многне природиые вещества, содержащие азот, можно рассматривать как диуреиды:
иуклеииовые основания
- ксантин, гипоксантин, аденин, гуанин; алкалоиды
мин, кофеин, мочевая кислота и т. д. (см. гл. 30 и 34).
МочеliШ/ кислота
-
-
теобро­
важный продукт азотистого обмена в организме человека и ЖliВОТ­
иых. Ее можно получить IIЗ трихлормолочной кислоты. Мочевая кислота - трудно раство­
pllMoe в воде кристаЛЛl1'lеское вещество. Одну из таутомерных ее форм можно рассматри­
вать как триоксипроизводное гетероциклического основания, которое ПОЛУ'IИЛО название
IlYPII':Ia~
276
ПРОftЗВОДНЫМН пурина являются два важных алкалоида: кофеин (содержится в кофе.
чае) Jt теобромин (в бобах какао) *:
О
СИ"N/
~
О
.......си з
'C_N\
I
l
,~.......
~И3
U
ИN/с-"'с-\
I ~ СИ
си
o~c~
/1
......
011
си,
сиз
теоБРО"ИИ
кофеин
Мочевина
при меняется
/1
в
качестве удобрения. Добавка
мочевины
в корм скоту увеличивает питательность корма.
Мочевина является исходным сырьем в синтезе некоторых высокомо­
лекулярных соединений. На основе мочевины получают так называемые
карбамидные смолы, отличающиеся твердостью, блеском.
Конденсация мочевины с формальдегидом идет через образование мо­
но- ({) и диметилолмочевины (II). В кислой среде эти вещества дегидрати­
руются с образованием легко полимеризующихся метиленмочевин (lП,
'У). При их полимеризации могут возникать как линейные, так и трехмер­
ные молекулы:
t
+
NH-CO-NH-CHOH НОСНгNJ-I-CО-NН-СНРН
2
I Ф_IIР 2
NH ~CO-N=CH
2
-
Шt
11
2
~-СНгN-СН2-
-N-СНгN-СНг
to to
н
~=CH2 ~=CH2
N1
2
to
do
н
N1
t _
t IV
CHpN-СО-N=CН2
t
2
-N-СНгN-СНг
doI
to
_ I
-N-СНr-N-СНг
ГУUНЩ)UН также можно рассматривать как ПРОlIзводное мочевины. Он представляет со·
бой расплывающиеся на воздухе кристаллы. Получается при HaгpeBaHНl! цианамида с хлори­
':!ОМ амман Jtя:
ItЛJJ деi!СТ8Jtем aMMllaJ<8 на ортоугольный эфир:
-----*
Об алкаЛОJtдах см. гл. 30.1.
277
1.
ПРII нагревании со щелочами ГУilНИДИН преВРilщается в мочевину:
2.
Является сильным
(NH 2}lC=NH + Н 2 О ~ (NH 2 }lCO + NH:\.
OCHoBilHlleM.
Образует с Кllслотами УСТОllЧllвые соли:
(NH2)2C=NH' HNO;\.
В оргаНlJ3ме животных важную биологичеСI<УЮ роль играет производное гуанидина
-
креатllН. ВХОДЯЩIII1 в состав мышц. КрОВII. мозга:
СН.,
I .,
N-CH
NH=C(
2"соон
NH 2
ТИОУГОЛЬНblе КИСЛОТbI и их производные. В технике применяются не·
которые сернистые аналоги угольной кислоты и ихпроизводные. Сероуг,
лерод является сернистым аналогом диоксида углерода. При действии его
на алкоголяты щелочных металлов получаются соли кислых эфиров дu­
тuоугольной кислоты (ксантогеновых кислот). Эти соли называютси
ксантогената,м,и.
l.
При действии галогеналкилов ксантогенаты дают полные эфиры
дитиоугольной кислоты:
s
S
1/
"
C2H"O-C-SK+C2H,,' ~ C 2 H,,-О-С-SС 2 Н г.+ Ю .
2.
При lIагревании они распадаются с образованием непредельных уг·
леводородов (на этом основан ксантогенатный метод синтеза этиленовых
УГJlеводородов Л. А. Чугаева):
Сг.Н11О-СS-SС2Н" ~ C2H"SH + COS +Cr,H\lI'
Ксантогенаты широко применяются в технике как флотационные сред­
ства и как эмульгаторы. Ксантогенат клетчатки ЯВJlяется полупродуктом
в производстве искусственного вискозного шеJlка (гл.
33.3).
Неполныii амид тиоугольнои кислоты П/I/IJКирБШIIIНО/JШ/ кислота. как и карбаМIIНОвая
кислота. в свободном BllДe не существует. В ПРОllзводстве важного ускорителя ВУЛI{nНllзации
KaY'IYKa - nШ!JриАШ - применяется натриевая СОЛL,ДlIмеПIЛДIПИОI<1II1баМIIНОВОЙ IШСЛОТЫ.
Ее получают деЙСТВllем на сероуглеРОДДllмеТllламинаl1 щелочи. Оl<ислением зтой соли полу­
'Iают тиурам:
(CH:\)2NH+CS2+NaOH ~ (CH;\)2N-С-SNа+Н20
11
S
2(CH:\)2N-С-SNа+СI2 ~ (CH:I)2N-С-S-S-С-N(СН:I)2+2NаСI.
- • . 11
S
11
S
11
S
При действии аммиака на тиофосген или при нагревании роданида аМ­
мония получается полный амид тиоугольной кислоты
-
тио,м,очевuн,а:
S=CCI 2 + 2NH:\ ~ S=C(NH 2) 2 + 2HCI
,
NH1SCN ~ NH" + S=C=NH ~
278
s=c",~H2
NH 2
Это крИСТilЛJlическое вещество с т. пл. 172 ·С, легко растворимое в воде.
Во многих реакциях участвует в таутомерной имидной форме. Например:
~NH
s=c(NH
2? HS-C(
NH
NH
2
2
~NH
+ CH\I ___ CH.\S-C(
·HI
NH 2
'
•
тиомочевина применяется в производстве пластмасс, красителей, ле­
KilpCTBeHHblx
веществ.
ГЛАВА
11
АЛЬДЕГИДО- И КЕТОКИСЛОТЫ
Альдегидокислотами называют органические соединения, содержащие
в МОJlекуле альдегидную и карбоксильную группу. Соответственно кето­
кислоты
-
это карбоновые кислоты, имеющие в молекуле еще и кетон­
ную группировку.
В зависимости от положения этих двух функциональных групп они раз­
деляютсн на а-, ~-, у- и т. д. альдегидо- и кетокиCJIОТЫ.
Нilзвания кетокислот часто связаны со способами получения веществ
из
природных
источников.
Например,
пировиноградная
кислота
СН:\СОСООН называется так по способу ее получения пиролизом вино­
градной кислоты. Альдегидо- и кетокислоты также рассматривают как
Производные соответствующей жирной кислоты, полученной замещением
водорода
HiI
ацильный остаток. Названия по систематической номенкла­
Туре производят от названий соответствующих карбоновых кислот добав­
лением приставки ОКСО-. Например: ацетоуксусная, или 3-0ксобутановая
КИСJlота, СН з -СО-СН 2 -СООН.
Гомологический ряд а л ь Д е г и Д о к и с л о т начинается с глиоксило­
вой кислоты Н-СО-СООН. Это единственная возможная а-альдеги­
ДОКИСЛОТiI.
Следующая
в
ряду - фор.м.uлуксусн.ая
ОСВ -СН 2 -СООН, в свободном состоянии неизвестна.
кислота
Глиоксиловая кислота встречается в природе в недозрелых фруктах. Ее
ПОJIУ'lilЮТ:
. 1) Окислением этилового спирта, гликоля, гликолевой кислоты азот­
Нои кислотой'
2) I'ИДРОЛ~ЗОМ дихлоруксусной кислоты:
CHCI~-COOH +H~O
---+ СНО-СООН + 2HCI.
г Под Влиянием карбоксильной группы альдегидная группа в молекуле
J1ИОКСИJlOВОЙ кислоты сильно поляризована, вследствие чего эта кисло­
~~ в свободном состоянии
IO-СООН • Н 2 О.
существует только
в
виде
гидрата:
279
Глиоксиловая кислота дает обычные реакции на альдегидную группу.
(с аммиачным раствором оксида серебра, синильной кислотой, ГИДРОСУль~i
фитом, гидроксиламином и т. д.) И на карбоксильную группу (образование'
солей, эфиров и т. д.).
Отмеченное выше влияние карбоксильной группы на альдеГИДНУIQ:
группу делает это соединение склонным
под влиянием щелочи вступаты;
в реакцию Канниццаро:
CH~OH
СООК
2СНО-СООК ~
+
1
.1',
..
1
СООК
СООК
Первой в гомологическом ряду к е т о к и с л о т является пировино­
градная кислота. Пировиноградная кислота - жидкость. Она являеТСI1
промежуточным продуктом в спиртовом брожении (гл. 33.1).
Пировиноградная кислота может быть получена:
1) пиролизом виноградной кислоты (в присутствии KHS0 4 );
2) окислением молочной кислоты:
CH:JCHOHCOOH ~ СНаСОСООН + H~O.
3)
гидролизом а., а.-дихлорпропионовой кислоты:
CH:!CCI~COOH ~ СН:\СОСООН + 2HCI.
Она значительно сильнее уксусной (сказывается влияние карбонила на
подвижность водорода карбоксильной группы), дает все характерные ре­
акции на кетоны и карбоксильную группу. Взаимное влияние двух карбо­
нильных групп делает ее способной при нагревании с серной кислотой
(а с дрожжами на холоду) расщепляться на уксусный альдегид и С0 2 :
О
СН:\СОСООН
11
H2S0 1
~ СНаСН + С0 2 .
Гомологический ряд ~-K е т о н о к и с л о т начинается ацетоуксусн.ой
кислотой. Она встречается в моче больных сахарной болезнью. Может
быть получена осторожным омылением ее эфиров или присоединением
воды к дикетену:
CH2=~~2
~O + Н 2 О ~ СН:\-СО-СН 2-СООН
Как кислота, так и ее анион легко декарбоксилируются:
G"11
Н
to
I
НзС-С~С==О
?"
-со:' Н'С-С=СН 2
....
Н,с-со-сн,
СН 2
0-
О
О
11
()
11 н с-с
с-о -::со- НЗС-С~СН2
3
"'-...fY 2
СН 2
280
+Н о" Нз С-СО-СНз
2
ВаЖНУЮ роль в органическом синтезе играет этиловый эфир этой кис­
ЛОТЫ. ОН примен~ется д.ля получеuния различных KeTO~OB и кислот.
Ацетоуксусныи эфир (этиловын эфир ацетоуксуснон кислоты) - жид­
кость с приятным запахом. Т. кип. 181 ос (с разложением). Нерастворим в
воде.
АцетоуКСУСНЫЙ эфир получается из дикетена:
СН~=С-СН~-СО+С2Н50н---.СНз-СО-СН~-СООС2Н!i
L-o_1
или ИЗ уксусноэтилового эфира с помощью играющей важную роль в ор­
ганическоМ синтезе сложн.оэфирн.оЙ кон.ден.сации (по Кляйзену):
2СН:!СООС 2 Н"
C:./H"ONa
.CH:ICOCH2COOC~H:. + с 2 н,;он.
ТетраЭДРИ'lеСКI1Й механизм конденсаЦl111 можно представить в следующем Вlще.
Под влиянием аЛl'оголята УКСУСНО''Пиловый эфир дает металлорганlt'lеский комплекс (1):
_
#
о
_
СН;гС-ОС2Нr.
.~ __
+NHOC,II"
')
I _
_
J-
+
[ CH2(~-OC~H;,
/""""'\
_
Na + С2 Н"он
I
Этот I(омплекс присоединяет еще одну молеl<УЛУ зтилацетата:
11
Комплекс (lI)за счет полуацетального эфирного остатка отщепляет молекулу алкоголята
с образованием ацетоуксусного эфира:
CH:!-П-СН2-СО-ОС2Нr.
О
Ацетоуксусный эфир -
классический пример соединения, способного
к кето-енольной таутомерии:
1 .1
СН
с=о
1
СН 2
1 .
[СН!
Е>
tOOC 2H5
C~O
Е
сн
tOOC 2H5
]-
+н+ Е>
1 .1
СН
с-он
11
СН
tOOC 2Hr,
кстш",RJI
t'IIOJlI.II;Ш
фО"МН
фО"МИ
Обе формы эфира могут быть получены в свободном состоянии: кетон­
ная - вымораживанием (она плавится при более высокой температуре),
еНОльная - перегонкой в кварцевой посуде (кипит при более низкой тем­
пературе, чем кетонная форма),
281
Однако эти формы неустойчивы и легко превращаются в
смесь с содержанием енольной формы менее
paBHoBecHYlO
10%. В различных раствори.
телях содержание енольной формы различно: чем более полярен раство_
ритель, тем больше содержание кетонной формы:
Растворитель
Содержание енола,
Вода. . . . . . . . . . . . . . . . . . . . . . . . . ..
МеТlIЛОВЫЙ спирт. . . . . . . . . . . . . . . . . ..
Этиловый CnllpT . . . . . . . . . . . . . . . . . . . .
Диэтиловый эфир . . . . . . . . . . . . . . . . . . .
Гексан . . . . . . . . . . . . . . . . . . . . . . . . . .
%
0,4
6,9
12,0
27,1
46,4
Енольная группировка энергетически менее выгодна, чем кетонная.
Однако в данном СЛУ'lае при образовании енола возникают сопряженная
система кратных связей и внутрициклическая водородная связь:
.
О
/".
7
СН:Гп
НС
О
".#
С
1
OC 2Hr•
Выигрыш энергии за счет этих двух факторов компенсирует в некото­
рой степени затрату энергии на образование енола, благодаря чему склон­
ность к енолизации возрастает.
В химических превращениях ацетоуксусный эфир в зависимости от ре­
агента ведет себя как кетон или как енол.
Реакции, отвечающие кетонной форме:
1)
присоединение синильной кислоты:
СН:!-С-СН 2 -СООС 2 Н" IHCNI )CH:!-C(CN)-CH 2 -COOC 2 H;;.
2)
11
1
о
он
действие фенилгидразина: нормальный продукт реакции теряет мо­
лекулу спирта и дает меmuлфенuлnuразолон (гл.
29.1):
СН,-С- СН 2-СО-ОС 2 Н,
.
~
11
0+ H2N-NH- СнН"
:
~ОН:'П-СН2-соtОС2Н;; _ C~II"OII~ СН:'-П-СН2-СР
•
N
N-i-H
N
I!
N-С.Н с
I}
.1
СнН"
РеаlЩИИ, отвечающие енольной форме:
* Для
енолы,ых форм карБОIШЛЬНЫХ соеДl1неНl1Й хараlперно появneНI1е окраски npll
деliСТВ11II на
282
*
IIX
раЗбавленныii раствор Xn0pflДa железа (Ш). Образуется I<омплеl<сная соль.
1)
ацетилирование в пиридине:
2) действие пятихлористого фосфора:
СН.,-С=СН-СООС
I'CI",. СН.,-С=СН-СООС 2 Н,
2 Н,.
. I
,. I
.,
ОН
СI
3) образование натрийацетоуксусного эфира:
2CH:,C(OH)=CHCOOC~H:;
+ 2NII~H2 + 2CH:,C(ONII)=CH-COOC2 H:;.
ДЛЯ каждой из таких реакций следует доказывать, 'IТO она идет с учас­
тием какой-либо одной из таутомерных форм, а не является проявлением
двойственной реакционной способности обеих форм (см. ниже).
Анетоуксусный эфир, как эфир ~-кетокислоты, расщепляется щелоча­
ми по СВЯЗII С-С:
2СН:,СООН
Разбавленные щелочи вызывают кеТОНllое расщепление эфира (а),
концентрированные
- кислотное (б).
Различия в направлении расщепления ацетоуксусного эфира и его го­
MOJlOrOB определяются особенностями действия разбавленных и концент­
рированных щелочей. Разбавленные щелочи омыляют эфир до кислоты.
Последняя при нагревании декарбоксилируется. Концентрированные ще­
лочи атакуют кетонную группу эфира и вызывают расщепление по связи
С-С:
О)
о)
о
о)
СII:i(~l-СН2СООС2Нr.---+снгфС'СН2СООС2Нr.---+ CHг~ + CН}~-OC~H5---+
ОН
ОН
•
_
---+СН,,-СО-О
он
•
+ CH:,-СО-ОС 2 Нr,
HO~ IIp
,.
,_
_
_
2СН:\-СОО
_
+ с"НоОН
Применение ацетоуксусного эфира в органическом синтезе. Натрий­
iщетоуксусный эфир содержит амбидентный анион, в котором заряд нахо­
Дится как на углеродном, так и на кислородном атомах и потому он может
Ilроявлять двойственную реакционную способность, т. е. реагировать по
с- и О-центрам с большей или меньшей селективностью:
О=СОС 2 Н,
Na+tH-
.,
O=~-CH"
ПО механизму
~
О=СОС 2 Н,
КН
.,
Na+Q=-С-СН:\
SN2 при кинетическом контроле реакции обычно идут по
С-центру как более основному. Поэтому реакции с галогеналкилами про­
Ходят с образованием С-алкилацетоуксусных эфиров. Эти реакции широ-
283
ко
используются
в
органическом
синтезе д.1Iя
получения
одноосновных
кислот, кетонов, двухосновных кислот, дикетонов и других соединений.
Приведем примеры:
а) получение метилпропилкетона или масляной кислоты:
_
_
_
СН:гСО-СН2-СООСzН"
+С,I'I,оNи
•
_
~_
_
q-
J
LНГ~ CH-COOC2H NIt
+C,II,.-Br
•
б) получение дикетонов или двухосновных кислот:
2СН:гСО-СНгСООС2Н" +С,IIДNи. 2 LН:Г~~-СН-СООС2НJ-Nа+__
СН:гС О- Т Н 2
11
+СII,Вг-СI'I,II~
СН:гСОтСН1СООС2Н"
! tH 2 !
+нр
! tH !
-C,11,011
Т Н2
Т Н2
-со,
СН:гСО-СН z
: I 2:
ch a-со+сн-i-соос 2 н"
!
11
!
В реакциях по механизму SN 1. например с a-ХЛОРЭфl1рами. более реакционноспособным
становится менее основный О-центр. Если возможно протеl(аНlfе реакции в нескольких на­
правлениях. предсказать. в l(aKOM именно направлении пойдет данная реакция. в некоторых
СЛУ'lаях позволяет принцип )КМКО (жестких и МЯГlШХ кислот 11 оснований): жесткие кисло­
ты реаГIfРУЮТ преимущественно с жесткими основаниями. а мягкие кислоты
-
с мягкими
основаниями (Р. ПI1РСОН).
Дпя жестких кислот и оснований характерны низкая поляризуемость и высокая злектро­
отрицательность. д.nя мягких
-
высокая поляризуемость и низкая эnектроотр,щательность,
Некоторые примеры жестких и мягких кислот и осиований приведены ниже:
Жесткие и мягкие кислоты н основания
Мягкие
Жеcrкие
Кислоты
Н+. Ме+. BFa• AICI:1•
R-Г:О. СО 2 • НХ
ОсноваllНЯ
F-' СГ.
NO-:,• ROH. RO-.
R20. NH:,• RN z
Н 2 О. НО-.
'2'
Brz. СН 2 •
Промежугочные
R:,C. С;;Н\, NO+
карбены
R2S. RSH. RS-. Г.
R:,P. CN-. СО. С 2 Н 4 •
С,;Н,;Н- . R-
ArNH 2• C:.H"N.
NO- 2
Вг-.
Принцип ЖМКО имеет формальный клаССИфlfкационный характер 11 никакого объясне­
НIIЯ Прll'!IfН того или IfНОГО направления те'lеНIIЯ реакций не дает.
284
применительно '( натрийацетоуксусному эфиру на основании ПРИНЦflПа ЖМКО следует
оЖllДать. 'ITO жесткая кислота н-со+ будет реагировать ~реимуществеиио по жесткому
основному центру - атому кислорода. а МЯГI(ая l<Ислота R по мягкому основному цент­
ру _ атоМУ углерода. что и наблюдается в деiicтвительности. Однако направление аЛI\ИЛИ­
рования заВИСIП от природы катиона. растворителя. добавок краун-эфиров и потому цен-
ность пр"нципа МЖКО весьма относительна.
.
ВариаЦl1ей синтезов с ацеТОУКСУСНblМ ,фиром являются синтеЗbl с использоваШlем в '(а­
честве промеЖУТО'IНОГО продукта стабилизированного сопряжеtшем Дl1аниона. образующе­
гося Пlнt деiiствии на ацетоуксусный эфир очень сильных оснований. ПРl1 действии на этот
диаНI1ОН алкил- или ацилгалогенидов в первую очередь в реакцию вступает конеЧНblЙ (более
основной) углеРОДНblЙ атом:
ГЛАВА
12
АМИНОСПИРТЫ
Аминоспиртами называют оргаНИ'lеские вещества, содержащие в мо­
лекуле спиртовую и аминогруппу. Аминогруппа, как и в случае обычных
RМИнов, может быть первичной, ВТОРИ'IНОЙ и треТИ'IНОЙ. Могут существо­
Вять и четвертичные аммониевые основания. Спиртовяя группировка так­
Же может быть первичной, вторичной и третичной. По систематической
I!оменклатуре аМИI/ОСПИРТЫ называют, как ПРОИЗВОДl/ые спиртов, няпри­
мер 2-амино-1-пропанол СН з -СНNН 2 -СН 2 ОН.
Аминоспирты с амино- и оксигруппами при одном и том же углеродном
ilTOMe в момент образования отщепляют воду и образующиеся азометины
ПОлимеризуются. Поэтому гомологический ряд первичных а-яминоспир­
ТОв нячинается эmанолам.uном.
NH 2 -CH 2 -CH 2 -OH.
Способbl получения. Наиболее вяжными являются следующие спосо­
Быl получения аминоспиртов.
1. Присоединение аммиака и аминов к а-эпоксидам (гл. 4.2).
2. Восстановление нитроспиртов. Последние, в свою О'lередь, получа­
ЮТ конденсацией нитросоединений с альдегидами и кетонами (гл. 5.1).
Физические свойства. Простейшие аМИI/ОСПИРТЫ - густые жидкости
с ilммиачным запахом, растворимые в воде.
285
Химические свойства. Аминоспирты проявляют свойства спиртов!
и аминов; а-аминоспирты при действии серной кислоты дают этuлен­
амины:
СН2 -СН2 "2S0,~ cн.}--CH2~CH2-CH2
I
I
он
I -
(-",О)
NH2
I
"'-:. /
OSO:IH HNH
NH
ОтделЬНblе представители. Этаноламины применяются как органиче­
ские основания ДJlЯ
связывания кислых газов,
входят в состав моющих
средс'Гв, используются в текстильной промышленности и т. д.
Из триэтаноламина получается N(CH 2 -СН 2 Сl)з - «азотистый ип­
рит», стойкое боевое отравляющее вещес'Гво кожно-нарывного действия.
Аминоспирты имеют и большое биологическое значение, так как они
ВХОДЯ'Г в состав тканей организмов человека и животных.
XO./lUH гидроксид 13-0ксиэтил-триме'Гиламмония. Обладает сильны­
ми ОСновными свойствами. Входит в СОСП\в тканей животных и растений.
Особенно высоко его содержание в нервных тканях, в частности в мозге,
а таКже в печени, почках, мышцах сердца. Холин играет важную роль
в обмене веществ, входит в состав лецитинов и сфингомиелинов
(гл. 35.3). Ацетилхолин участвует в механизме передачи нервных импуль­
сов, т. е. является медиатором.
Веществи. осущеСТВЛЯЮЩl1е в оргинизмах перенос нервного возбуждения. называют Ale()uamopaAIU (трансмиттерами). Механизм IIX деЙСТ811Я связан с влиянием на непроницае­
мость клето'lНЫХ мембран по отношению '( ионам Na 1- и К+. ВажнеiiШl1М меДl1атором являет­
ся ацеmuлхолuн. Действие ицетилхолина прекращается под влиянием фермента ацетил­
холестеризы. который вызывиет его гидролиз. на холин 11 уксусную кислоту. Другим
медиатором. содержащимся в ОКОН'Iаниях симпаТИ'lеСКlIХ нервов. является норut!реналuн.
роль медиаторов в центральной нервной системе могут также 11грать у-аминомисляная
кислОТа. глuцuн и другие вещества.
ДеЙСТВllе медиаторов на оргаЮIЗМ используется в медицине. Известны лекарственные
препараты. усиливающие или ослиБЛЯЮЩllе деятельность нервной
cIICTeMbI. -
mраНКlIll­
ЛIl:lаmОР'Jl·
ХОJlИН легко может быть получен из оксида этилена и триметиламина:
СН 2
[сн 2 -он
) О + N(CH:\):I+ HP J
СН 2
J+но-
CH 2N (CH:1):\
XOJIIIII
при отщеплении воды он образует очень токсичный нейрин:
[CH 2 0H-CH 2N( С H:1):1 ] +он-
-Н,О ~ [CH
- =CH-N(СН !:tl +ОН - .
з
2
ГЛАВА
13
АМИНОКИСЛОТЫ
Органические соединения, содержащие в молекуле карбоксильную
и аминогруппы, называют аминокислотами. Аминокислоты имеют "рез­
вычаАно большое значение, так как из O~TaTKOB аминокислот построены
белковые вещества ( гл. 32.1).
286
Изомерия. Номенклатура
Аминокислоты называют обычно как замещенные соответствующих
карБОНОВЫХ кислот, обозначая положение аминогруппы буквами грече­
скОГО алфавита. Применяется также систематическая номенклатура,
i1 ДJlЯ простейших аминокислот
эмпирические названия:
-
аминоуксусная кислота. аминоэтановая
кислота. ГЛИКОI(ОЛ. глицин
a-аМИНОПРОПllOновая кислота. 2-амино­
пропановая Кl1слота, алаНI1Н
cH3-СН2-СН -CHNH 2-COOH
2·амино-З-метилпентановая кислота,
I
изолейцин
СН:1
а-амино-f3-гидроксимасляная, 2·амино­
CH:1-CHOH-CHNH 2 -COOH
З-ГИДРОКСltбутановая кислот/!, треОНЮI
Изомерия аминокислот анаЛогична изомерии гидроксикислот.
Olia
мо­
жет быть связана с положением функциональных групп и со строением
УГJlеродного скелета.
МОJlекула аминокислоты МОЖет содержать одну или несколько карбо­
КСИJlЬНЫХ
групп,
в
соотвеТСТВl1и
с
этим
аминокислоты
различаются
по
основности. В молекуле аминокислоты может также находиться несколь­
ко аминогрупп.
Гомологический ряд одноосновных аминокислот следовало бы начи­
H 2N-COOH, Однако эта киСЛОта од­
нать с аминомуравьиной кислоты
новременно является неполныlVI амидом угольной кислоты. ОН(I уже Р(lС­
смотрена нами при изучении ПРОИЗВОДНЫХ угольной кислоты.
От
уксусной
КИСЛОТЫ
можно
произвести
H~N-CH2-COOH. От ПРОПl10НОВОЙ -
одну
CH~-CHNH2-COOH
CH 2NH 2 -CH 2-COOH
a-3МItIIOII)'>0IIШНlOваJI
(3-аМИIIOIII'OIIИОIIОIlИ>l
КИ<:JIOТИ (a-аЛИIIИII)
От масляной -
аМИНОКI1СЛОТУ
две:
КИ<:JIOТИ ((3-amtllllll)
три:
CH:t-СН2-СНNН2-СООН
CH:1-CHNH 2-CH 2 -COOH
a.-ёtМ"lllOм,Н:JI~IШШ КИСJIOТtI
(3-ИМIllIOМИСJIIIIIЮI КltСJIOТИ
CH2NH2~CH2-CH2-COOH.
y-аМIllIOМИ<:JIIIIIИ>l КlIСJIOТИ
От изомасляной -
две:
NH 2
I
. I
СН,-С-СООН
СН,
a-tlМИIIOИ:ЮМitСJIСIIIIНЯ
(3'ИМIllIOIIЭОМИ<:JIСIIIIЮI КltСJIOТИ
КlIСJlOпt
287
Способы получения
Способы получения а.-аминокислот. Разработано много способов по­
лучения а.-аминокислот. Важнейшие из них три:
1.
Действие аммиака на соли хлорзамещенных кислот:
2.
Действие аммиака и синильной кислоты на альдегиды (реакция
2NH 2 -H + CI-CH 2 -COONH 4 ---+ NH 2-CH 2COONH 4 + NH 4C1·
Штреккера ). Механизм реакции точно не установлен: два возможных
пути приведены на схеме
О
СН _С-Р" ~ СН _СН=Nн+НСNэ- СН -CH-CEN+H01-1;1 H+I ...
з
'н -1-120
3
I
3
-NН з
NH 2
в настоящее время этот метод используется в следующей модификации:
R-CHO +КНSОзэ- R-СН(ОН}SО К +KCN; +(NH2)2 CO...
-~SОЗ; -Н 2 О
з
---+R-CH-C=NH +Hgй;IH+) ... R-CH(NH )-СООН
I I
-NН з ; -С0 2
2
~/H
СО
з. а-Аминокислоты успешно синтезируются из аминомалонового эфира по схеме:
+R'ONO NO-CH(COOR)2 +Н 2
+С 6 Н 5 СОСI
CH 2(COOR)2 R'ОИ'"
ti
~ NH2-CH(COOR~ -НСI
эHON=C(COOR)2
+RONa
-
+ R"
~С б Н s СО-NН-СН(СООR)2 -RОИ'" [С Б Н s СО-NН-СН-С(СООR)2I Nа -NаI'''
~СБНr.СОNН-СR'(СООR)2
о
И+·I-I О
'2
...
-С 6 Н s СООН
NH2-CR'(COOH)2~C
- 02
---+NH2-CHR~COOH
4. При гидролизе белков получается около 25 разлчных аминокислот.
Разделение этой смеси представляет собой довольно сложную задачу. Од­
нако обычно одна или две кислоты получаются в значительно больших ко­
личествах, чем все другие,
просто.
и эти кислоты удается выделить довольно
.
В последнее время научились так нарушать нормальную жизнедеятель­
ность некоторых микроорганизмов, что они начинают вместо накоплениЯ
белка продуцировать какую-либо определенную аминокислоту. Таким пу­
тем получают в промышленности пищевой лизин. Из субстрата лизин
выделяют с помощью ионообменных смол.
Способы получения j3-аминокислот. Наиболее важны следующие два
способа получения J3-аминокислот:
288
1. Присоединение аммиака к непредельным кислотам. Аммиак к оле­
ФИll ам без катализаторов не присоединяется. Присоединение к кислотам
связано с наличием сопряженной системы с участием карбонила карбо­
ксильной группы. Присоединение здесь проходит, как и другие реакции
а, j3-непредельных кислот, не IlQ-.!!!lliВИЛУ Map-~Q~I!Ii!<Ова (гл.Ji3):
СН 2 = снсоон _+2N..!::!ц NH 2CH 2CH 2COONH 4.
2.
Большое
число
различных
аминокислот
было
синтезировано
В. М. Родионовым из малоновой кислоты:
CH~CHO + СН 2 (СООН)2 _+2N..!::!ц СН зСНNН 2СН 2 СООН + н 2 о + С0 2 .
Реакция эта сходна с реакцией получения J3-гидроксикислот из альде­
гидов (гл. 10.Б.l). Возможно, что промежуточными продуктами здесь яв­
ляются гидроксисоединения, однако точно механизм этой реакции не
установлен.
Способы получения других аминокислот. Аминокислоты с более уда­
ленными друг от друга функциональными группами получают действием
аммиака
на
галогенозамещенные
кислоты,
восстановлением
неполных
нитрилов двухосновных кислот и с помощью бекмановской перегруппи­
ровки (гл. 23.3), например:
Hf-c,2
н 2с
с=о
\
O
H 2 N-ОН:а
-н 2о
/
Н 2 С-СН 2
N-OH
[H2S04).
БекманоllCJOUl
переrpynпиров,,"
цимoreксаноиоксим
ЦИКJIоreксанон
-
O~
NH
u,пponаJCТaМ.
Капролактам при гидролизе образует ф- или в-аминокапроновую кис­
лоту,
а
при
нитровании
с
последующим
восстановлением
-
лактам
2,6-диаминокапроновой кислоты (лизина). Это современный промышлен­
ный метод синтеза лизина:
+1-120
Н 2 С-СН 2
Н 2Сl'
" с=о
I
I
NH
'-.../
Н 2С
-с
+НNОз
СН 2
NH2-CH2-CH2-CH2-CH2-CH2- СО он
+Н 2 О
H2C-CH-N~
H 2C-CH-NH2~
/'"
/'"
с=о [Н)
Н 2С
с=о
I
I~I
I
н 2с
NH
Н 2С
NH
............... /
............... /
Н2С
СН 2
СН2
~NH2-{CH2)4-CHNH2-COOH .
ЛИЗИII
10 Заж.181
289
Физические свойства
Аминокислоты
-
бесцветные кристаллические вещества с ВЫСОКИМIt
температурами ПJIaвления, которые мало отличаются для разных амино_
кислот и потому не характерны. Плавление сопровождается раложеНиеа.
вещества. В воде аминокислоты обычно хорошо растворяются. В водных
растворах одноосновные аминокислоты обнаруживают почти нейтраль_
ную реакцию.
Высокие температуры плавления, отсутствие в спектрах линий, харак­
терных для карбоксильной и аминогрупп, и некоторые другие СВОЙСТВа
аминокислот объясняются их своеобразным строением. Аминокислоты
представляют
__ ~QQQЙ__ . !i.НYТP.~_tItI!:I~ .. __ .<:'9}1J.i ... (биполярные
ионы):
+NН з -СН 2 -СО-О-. Такой ион в кислой среде ведет себя как катион,
так как подавляется диссоциация карбоксильной группы; в щелочной сре­
де
-
как анион:
В изоэлектрической точке концентрация биполярного иона максимальна
и перемещение его в электрическом поле не происходит. Положение рав­
новесия зависит от рН среды.
Пrиродные аминокислоты (кроме аминоуксусной кислоты) ОПТИ'Iески
активны вследствие наЛИ'lИЯ асиммеТРИ'lеского атома углерода. В приро­
де распространены кислоты L-ряда.
Химические свойства
Подобно другим соединениям со смешанными ФУНКЦИЯМИ, аминокис­
лоты проявляют свойства и кислот, и аминов. Однако в ряде превращений
сильно сказывается взаимное влияние двух функциоl/алы/хх групп.
АМ.I'!l:ШКI1С,JIОl:!~I_образуIOТ с.оли с основаl/ИЯМИ. Соли а-аминокислот
1.
с тяжелыми металлами могут иметь комплексный характер. Таким строе­
I/ием обладают, I/апример, интеНСИВI/О синие соли меди:
.
CHz-NНz, /о---со
L. tur5 t~:-
/со,
со--о
I
NHz-СНz
2. По~обно другим КИСJ\отам, аминокислоты образуют сложные эфИ­
_Р~l..!.!YIЬ.Rа.!!.~и.ltр~ды, амиды и Т.Д.
3.
(Нз
Аминокислоты образуют соли с неорганическими кислотами, например
+
N-CH 2 -COOH)CI.
4. При
действии
Эти соли обычно хорошо кристаJ\ЛИЗУЮТСЯ.
азотистой
кислоты
аМИI/ОКИСЛОТЫ
гидроксикислоты:
H2N-CH2 COOH
290
HNO~) N2 +H 20+HOCH 2 -COOH.
даюТ
эфиры
аминокиСЛОТ
образуют
при
этом
довольно
УСТОЙ'lивые
диазосоединения:
NН~-СН2-СООС2Нr. _H2~~~ I N:zCH-СООС:zН 5 .
Диазоуксусный (этиловый) эфир имеет строение:
+N-NСНСООС:ZН 5
+
++N = N =CHCOOC:zHij.
ОН применяется в органическом синтезе.
5.
Аминогруппа в аминокислотах легко ацилируется при действии ан­
гидридов или галогенангидридов кислот:
«H 2 NH 2 + (СНСО)." ~ «НгNН-СОСН:1 + СН.СООН
СООН
.1
'г"'"
СООН
.1
6. При алкировании аминогруппы получаются втори"ные, третичные
аминокислоты и, наконец, "етырехзамещенные аммонийные основания.
Внутренние соли ПIКИХ оснований называются бетаинами:
NH:\CH .• COO•
7.
+ЗСН:11
IN(CH. )·СН.СОО-.
-:3111
.I.I:Z
В зависимости от положения аминогруппы по отношению к карбок­
силу аминокислоты ведут себя при нагревании раЗЛИ'IНО:
1) а-аминокислоты образуют дuкетоnunеразuны:
\ ' [А
i\..J_
~.(.I.... yv
:снз-сн-со-fон
__ ,. , I
1
Ht-NH
+ НН-Н
1
I
1; _ _
!l2J-со-сн-снз
2) ....А -аминокислоты
отщепляют аммиак и дают аммонийную соль не-
предельной кислоты. ПРИ'IИНОЙ такой реакции является подвижность во­
ДОродных атомов в соседстве с карбоксильной группой:
",.,1
1,)
3) У-.
ды -
r.. ','.::' .'- \ ('
8-аминокислоtы дают при нагревании внутреllние ами­
лактамы:
291
Этим пользуются д,JJЯ установления строения аминокислоты: опреде.лll_
ют,
в
каком
положении
находится
аминогруппа
по
отношению к кар.
.
боксильной группе.
8.
В реакциях замещения а-аминокислот, связанных с изменеНие"
у асимметрического атома углерода, часто происходит вальдеНОВСкое Об­
ращение. Примером может служить взаимопревращение
пропионовых кислот и
(+)
и
(- )-аланина
(+)
и (-)-бро",_
по схеме:
NH
D-Бромпропионовая кислота -~D-Аланин
t NOBr
.j.. NOBr
NH
L·Аланин -~L-Бромпрпионовая кислота
Инверсия или сохранение конфигурации во время реакции замещения
зависит
от
механизма,
по
которому
протекает
реакция
замещения
(см. ниже).
9. В современной химии аминокислот и белков важную роль играет
цветная реакция на аминокислоты с нuнгuдрином. (синее окрашивание)
(гл.
26.5).
Отдельные представители. Применение
Ам.иноуксусная кислота (гликоль, глицин) получается гидролизом
желатины, фиброина шелка. Синтезируется из хлоруксусной кислоты.
Соответствующий бетаин (СНЗ)З
+
N-CH 2 -со-о- широко рас-
пространен в природе. В больших количествах содержится в свеклович­
ной патоке.
а-Ам.иноnроnuоновая кислота СН з -СНNН 2 -СООН (алании).
Ц+)-Аланин входит в состав всех белков, особенно фиброина шелка. Раце­
мический гланин получают циангидриновым синтезом из ацетальдегида.
а-Аминоизокаnроновая кислота (СНЗ)2СН-СН2-СНNН2-СООН
(леЙцин). Ц - )-Лейцин образуется при гидролизе большинства белкОВ,
особенно гемоглобина, мышечных тканей.
Ам.иноянтарная кислота
HOOC-CH 2-CHNH 2-COOH
(асnа­
рагиновая). Она также образуется при гидролизе белков. В природе
встречается
амид
аспарагиновой
кислоты - асnарагuн
впервыe он вьщелен из спаржи.
NH 2CO-CH 2-CHNH 2-COOH.
ПРОIjЗ~ДНЫМ аспарагиновой кислоты является полученное японскими химиками самое
сладкое из известных веществ (слаще сахара в
В
200 раз слаще
33000 раза).
сахарозы метиловый эфир L-аспарагил-L-фенилаланииа
-
аспартам.
Он допущен к ПРlIменению вместо сахара во многих странах.
Диам.uнокаnроновая кислота
NH2-(CH2)4-CHNH2-COOH (ли­
зин). Ц + )-Лизин входит В состав белков икры некоторых пород рыб. яв­
ляется сильным основанием. Относится к незаменимым аминокислотам.
Его получают синтетически из капролактама и биохимическим путем.
292
l1исm ин (HOCO-CHNH 2-CH 2-S)2. Остаток цистина входит в со­
"огих белкоВ (рога, шерсти, волос, перьев).
став мп
В последние годы производство белковых а-аминокислот приняло инстриальные масштабы (сотни тысяч тонн). При этом используются и
дУе ментативные, и синтетические методы.
Ф
kaK питательные,
вкусовые и лекарственные средства используются
все протоногенные а-аминокислоты. В качестве вкусовых добавок в пи­
щевой промышленности используются глутаминат натрия, аспарагиновая
кислота, цистин, глицин, аланин. В качестве добавок к фуражу использу­
ются лизин, метионин, триптофан (гл. 32).
ф_А.м.uнокаnроновая кислота. Полимеризацией капролактама (лак­
там ф-аминокапроновой кислоты) или поликонденсацией аминокапроно­
воЙ кислоты получают смолу капрон:
О
О
11
" -" .
...-NН-(СН 2)s-С-NН-(СН
2)5- С
Она применяется в производстве синтетического капронового волокна.
Комплексоны. Комплексонами называют группу а-аминокислот, со­
держащих два или три кислотных остатка, связанных с азотом. Наиболее
лростыми из этих аминополикарбоновых кислот являются иминодиуксус­
ная и нитрилотриуксусная кислоты:
H_N/CH2-COOH
'.,сн 2-соон
носо-сн _N/CH2-COOH
2
"сн 2-соон
ИМlIнодиуксусная кнслота
нитрилотриуксусная кислота
к ним относится также ряд кислот -
производных от алифатических
и циклических диаминов.
Наиболее эффективным комплексоном является этилендиаминтетра­
уксусная кислота (динатриевая соль которой известна как трилон Б):
HOOCCH2"\.N_CH. -сн _N/CH2COOH
нооссн 2/
2
2
"сн2соон
Все эти кислоты отличаются способностью образовывать комплексные
соединения с большинством катионов. Легкость образования хорошо рас­
ТВОРимых комплексов с магнием, кальцием, железом и другими металла­
Ми ПОЗВоляет применять комплексоны в химическом и фармацевтическом
ЛРоизводствах, для умягчения воды - всюду, где требуется устранить
следы катионов.
Ч
А
С
Т
Ь
ВТОРАЯ
Карбоцикnические
соединения
Как уже было сказано, органические соединения разделяются на две
большие группы: соединения с открытой цепью и ЦИКЛИ'lеские. Послед­
ние, в свою О'lерсдь, делятся на карбоциклические и гетероциклические
соединения.
Циклы карБОЦИКЛИ'lеских соединений построены только из атомов уг­
лерода, в то время как циклы гетероциклических соединений включают
атомы других элементов: серы, азота, кислорода и др. Карбоциклиtlеские
соединения включают два ряда: алициклический и ароматиtlескиЙ.
К али циклическому ряду относятся карбоциклические соединения, не
облядающие ароматическим характером (см. гл.
15),
в частности не со­
держащие беНЗОЛl,НЬJХ колец.
1. АЛИЦИКЛИЧЕСКИЙ РЯД
ГЛАВА
14
УГЛЕВОДОРОДЫ АЛИЦИКЛИЧЕСКОГО РЯДА
И ИХ ПРОИЗВОДНЫЕ
Простейшими соединениями алициклического ряда являются циклопа­
рафины. Их называют тякже полиметиленовыми углеводородами или на­
фmеflОМU. Последнее lIазвание было дано циклопарафинам с лять~
и шестью углеродными атомами в цикле В. В. Марковниковым,
KOTOPbl 1l
обняружил, '!то кавказская нефть состоит преимущественно из углевоДО­
родов этого типя.
294
Наряду с циклопарафинами существуют также циклоолефины, цикло­
иолефИНЫ, циклоацетилены и т. д. Углеводороды с шестичленными цик­
Д
лам
и обычно называют гuдроаром.аmuч.еск.uмu.
ДлИЦИКЛИ'lеским углеводородам соответствуют алициклические гало-
генопроизводные, спирты, карбонилсодержащие соединения, кислоты,
амины и т. д. Между всеми этими классами существуют взаимные перехо­
ды, аналогичные переходам между соединениями с открытой цепью.
Строение. Изомерия
Uиклические системы характеризуются некоторыми своеобразными
видами изомерии и стереоизомерии, которые рассматриваются ниже на
примере ЦИI{лоалканов. Для них характерна структурная изомерия следУ­
ющих видов:
1)
по числу углеродных атомов в кольце:
о
1
S
ЭТIUЩИlUlобутаи
м:стилц,ИlUlоnеltтан
циклогексзн
2)
o-C H
D-CH3
nРОПИnЦИlUlOПpOnaИ
по числу углеродных атомов в заместителях:
н
1-..етИJI-2-ПРОПИnЦИlUlогеllсаи
1.2-аИЭТИЛЦИkЛОfCКt8Н
3) по расположению заместителей в кольце:
~H23 СНз
65
~
3
1,2-диметllЛЦИlU\огексаи
6-~H~
5
4
3
СН
'Q~H:
S
3
1,3-диметКIIЦикnогексан
4
3
СН
1,4-диметил-
3 ЦИlU\огексаи
При наличии одного заместителя в кольце стереоизомерия невозмож­
на. При двух заместителях возможна геометрическая и оптическая изоме­
рия (рис. 50).
!Тf' ~'l~,
,,11
I
qUC
Рltс.50.
v
111
I
IIIpllHC
Модели цuс-транс-изомеров 1.2-димеТИЛЦIIКJIопропана
295
Геометрическая
изомерия (цис-транс-изомерия) наблюдается ПРИ
всех положениях заместителей, кроме геминального (заместители у одНо.
го углеродного атома).
ГеомеТРИ 1 1еские изомеры в алициклическом ряду очень устойчивы.
Изомеризация цис-изомера в транс-изомер или наоборот требует разры_
ва кольца и последующего его замыкания или разрыва связи углеродного
атома кольца с заместителем и образования новой связи с другой СТОРоны
кольца.
Оптическяя изомерия проявляется в том случае, если молекуля не име.
ет плоскости симметрии. В циклогексяновом ряду это, например, няблю­
дается при 1,2- и 1,3-транс-положении зяместителей:
-0-
~ЖГ-\\
U
<JJ U
I
I
О -е- 0\
I
Из восьми геомеТРl1ческнх изомеров гексnхлорциклогексана (гексахлоран) или гексаок­
СIЩl1клогексана (ИНО:НII1/) ТОЛbiШ один обладает оптнческой деятельностью. так как не имеет
плоскости
CHMMeTplHI (отмечен звеЗДО'lкоli). Все остаЛЬНblе построены Cflмметрично:
В ялициклическом ряду существенное значение имеет также поворот­
ная изомерия. Устойчивость конформеров алициклических соединений
опредеJIЯЮТ четыре фяктора:
1. Няпряженне, обусловленное искяжением валентных углов.
Этот вид напряжения был впервые Рпссмотрен в «теории напряжения»
А. Бейера
( 1885).
Он считал этот фактор единственным, определяющиМ
прочность цикла.
2. Торсионное напряжение, связанное с отклонением от наиболее вы­
годной «заторможенной» конформации (см. Введение, раздел 4). В плос­
ких циклах водородные атомы или замещающие их группы должны нахо­
диться в менее выгодной «заслоненной» конформации.
3. Няп,ряжение, связанное с оттялкивянием сближенных атомов.
4. Напряжение, обусловленное изменением межатомных расстояний.
О напряжении в цикле можно судить по теплоте сгорания циклических
соединений. Теплотя сгорания, приходящаяся на одну группу СН 2 , наи­
меньшяя для циклогексана. Если напряжение в этом цикле принять за
нуль, то, например, в трехчленном цикле оно составит 38,1 кДж на одну
группу СН 2 , а в пятичленном
-
5,4
кДж. В циклах сп> б величина на­
пряжения меняется в пределах О-б кДж.
296
uиклопропан существует ТОJlj,ко в одной плоской конформации (три
и всегда лежат в одной плоскости). Искажение валентных углов при
точк
sр3_ ги бридизации орбиталей углеродных атомов должно составлять (109· 28'- 60·): 2 =24· 44'. Это наи­
более напряженная циклическая система. В действи­
тельности
угол
между
углеродных атомов
во-химическим
связывающими
около
104·.
представлениям,
орбиталями
Согласно
кванто­
изменение угла
яв­
ляется результатом изменения гибридизации атомов
углерода (рис.
Рис. 51. Схемн оnра­
ЗОВННlIЯ связей
в ЦИКЛОПРОllане
51).
При этом меньшее перекрывание
орбиталей с избытком компенсируется уменьшением
напряжения. Гибридизация орбиталей в молекуле
циклопропана ближе к sр2_ ги бридизации алкенов,
чем к sр3_ ги бридизации алканов.
В циклобутане и особенно в циклопентане напряжение, связанное с ис­
кажением валентных углов атомов углерода, значительно ниже. При рас­
положении всех атомов углерода в одной плоскости искажение валентных
углов составляет соответственно (109· 28'- 90·): 2 = 9· 44' и (109· 28' - 108"): 2 = О· 44'. Но эти кольца неплоские. Один из атомов углерода lIeпрерывно выходит из плоскости (рис. 52). Поэтому кольца находятся в ко­
JlебатеJIЫfOМ движении. В результате уменьшается «заслоненность» ато­
мов водорода у соседних углеродных атомов и снижается напряжение.
а
и
МодеЛl1 молекул ЦИl(лобутанн (а) 11 ЦIIКЛОПРОПНllа
(конформ;щия «I<OHBepT» - (j И «полукресло» (1)
PIIC.52.
в молекуле циклогексана могут быть сохранены обычные валентные
углы при условии его существования внеплоских конформациях «кресла»
или «ванны» (рис. 53). Конформация «кресла» на
20,9 кДЖ/МОJlЬ менее
наПряжена.
Поэтому циклогексан существует преимущественно в виде конформе­
ров 1 и Ш, причем кольцо претерпевает непрерывную инверсию с Ilроме­
>КУТО'lнЬ)м возникновением конформера
II:
Н = ~"--,-....I,? = ~
Рис. 53. КонформаЦlюнные модели
1. 111 - I<ОНформнция «кресла», 11 -
молекул Цllклогеl(снна:
конфОРМНЦllЯ «ванны»
297
в конформации «кресла» циклогексан имеет
12 связей
С-Н, KOTOPbIe
можно разделить на две группы. Шесть связей направлены радиально от
кольца (к периферии молекулы), они названы экваториальными связям"
(е-связи). Остальные шесть связей направлены строго параллельно друг
другу
и
оси
симметрии
третьего
порядка;
их
называют
аксиальным"
(а-связи). Три из них направлены в одну сторону от плоскости кольца
а три -
в другую (имеет место чередование вверх ось
вниз):
'
симметрии
I
т
I
е-св.эм
а-С.IЭИ
Если один из атомов водорода заместить какой-либо группой, напри­
мер метильной, заместитель может занять либо аксиальное, либо эквато­
риальное положение (рис.
Рис.
54.
54).
Модель молекулы меТИЛЦlIIUlOгексана в форме «кресла»:
и·
-
СН;, н 8KCHaJII,IIOM IIOJIOЖСIIИИ;
6-
11 ~КlIитоrllаJII>IЮМ IIOJЮЖСIIIIII
Измерение электронной дифракции показало, что если возможен вЫ­
бор, заместитель неизменно становится в экваториальное положение.
Это, однако, не означает, что с появлением заместителей прекращается
инверсия кольца. В случае метилциклогексана инверсия происходит со
скоростью 106 качаний в 1 с. Но в равновесии преобладает экваториаль­
.
ная форма, так как в этом случае меньше пространственные затруднения:
a-КОIlФОРМСР
298
e-КОIlФОРМСР
н
н3ЛI 1Чl1lf В молекуле нескольких заместителей одинакового характера
061>I'IHO
60лее
~PII~BbIM оказывается такое IIX расположеиие. при котором заместители. l(aK несущие
уСТ О11Ч овые
элеlпрнчеСКliС заряды. так н нейтральные. в результате оттаЛЮIВilllllЯ друг
ОДI1 на к зайМУТ максимаЛl,НО удаленные друг от друга положеНIIЯ. HanpllMep. в ряду 1.2-
ОТ ~~;Iзамещенных Цllклогексанов mpaHC-l1зомеры устойчивее циС-I1З0меров. а в ряду
11 1.
ещен ныХ более стабильная цuе-форма. Такне энергеТlI'lескне соотношения объяс­
I.з-~~: тем. 'ITO в YCToii'lliBOii конформаЦl1l1 mpl!hc-I.2- 11 1.4-ДllзамещеНIIЫХ Цlшлогексанов
1I~~заместителя зкваТОРllальны. тогда как в цuе-изомерах один liЗ заместителеii всегда aKcllо
н В ряду 1.3-Дllзамещенных ЦИI(логексанов наблюдается обратная закономеРНОСТI>.
але устойчивые l(онформаЦI1I1 дизамещенных Цllклогексанов:
;;;:::ТХ
j}::::JX
Х
1,3-II U С-И3ONер
1,3-mРlIнс-и,о"ер
Более сложные циклы, как и циклогексан, образуются без существен­
ного искажения направлений валентностей (без «байеровского» напря­
жения) и обладают высокой устойчивостью.
Номенклатура
Названия циклических соединений строятся подобно наименованиям
соеДИllений жирного ряда с добавлением приставки ЦllКЛО-:
СН!
HzC-СНz
/,
I
I
HzC--СН-СН э
I
I
HzC-СНz
HzC-СНz
HzC, ,....CH-СН э
циклопропан
циклобутан
1,2 - I,иметиn циклопентан
СН!
сиz
НС"'" 'СН--СН=СН!
НС=СН
/
HzC
\С-СНЗ
11
I
НС, ,СН!
'c'f
С
1-IIC1'IUI-I,3-ЦIIUO_
H J , .,dI!H
df
z
4-8ииил-l-циIUlOl'CkCСВ
Пeнт.tдвеи
"СНОН
I
!пз
3-(2-"CТИII-I-пропеиил) -1-ЦIWIlII'eI<еен
CO-СНз
СН!
HzC""""
СН!
HzC"'" "CH-СН=С-СНз
I
HzC, /,СН!
I
/,
СН
HzC-СНz
HZ1-CH!
~CH-COOH
HzC-
Н!
СН!
ЦИlCЛоreксанол
"стилцвuo-
циклonевтаикарбоиоааа
aJICНIIW<_
кислота
ко СУществует много аЛИЦИКЛИ'lеских соединеНI1i1. молекулы которых содержат несколько
IщlщеНСl1роваНIIЫХ ЦIII(ЛОВ. Для таких соединений удобна следУющая lIомеНI(л<\Тура. В назва­
н У'll1Тывают все атомы углерода. входящие в ЦНКЛЫ. 11 В скобках ПОКlIзывают '1I1CnO IIТОМОВ
299
углерода, находящихея между О~ЩИМII углеродными атомами. Нумерацию ПРОИ3ВОДЯТОТ\Iгa_
ветвnеНI1Я по наиболее длиннои цепи, например:
"'1'111\111<.'101 :1,
:1, 1,
IlлеКИII, ИЩ'МЮIТИII
Способы получения
Алициклические соединения различных классов можно получать из со­
единений жирного или ароматического рядов или из других алИцикличе­
ских соединений. Последнюю группу способов мы специально рассматри­
вать не будем, так как это преимущественно обычные уже изученные ра­
нее
переходы
между классами органических соединений.
Некоторые
особенности синтеза аЛИЦИКЛИ'lеских соединений рассмотрены в разделе
«Химические свойства».
Способы ПОЛУ'lения али циклических соединений из соединений жирно­
го ряда можно разделить на о б щ и е, приемлемые для получения соеди­
нений с различной величиной цикла, и с п е Ц и а л ь н ы е, область приме­
нения которых ограничена только определенным видом циклов. Из много­
численных общих способов получения али циклических соединений
рассмотрим пять наиболее важных.
1.
Дегалогенирование дигалогенопроизводных с помощью цинка. Ме­
тод этот сходен с методом получения олефинов дегалогенированием вици­
нальных дигалогенопроизводных (гл.
/СН 2-Вг
Н 2 С" _
СН 2-Вг
1.2):
/СН 2
+zn~H2c"
l
СН 2
+ ZllBr2
Наиболее легко получаются этим методом циклопропан, его гомологи
и производные.
2. Взаимодействие дигалогенопроизводных с натриймалоновым эфи­
ром. В зависимости от выбора дигалогенопроизводного (1.2-, 1,3- и т. д.
дигалогениды) этим методом можно получать соединения с 3-6-членнЫ­
ми циклами:
300
3. Отщепление галогеноводородов от галогенкарбонильных соедине­
• Наиболее легко этим путем получаются соединения с трехчленными
нии.
.
цикламИ. Однако метод приемлем и для получения других циклов:
_
_
_
_
-lIl1г
_
_
CH:,-CO-?H-?H~ ~ CH:j-СО-С~ /СН 2
Н
ВГСН 2
СН 2
5·бром·2-пентанон
аЦИТНЛЦllклопропан
(метнлциклопропнлкетон)
4. Декарбоксилирование солей двухосновных кислот, начиняя с шести
атомов углерода в цепи, например адипиновой и пимелиновой кислот.
Этот метод применим для получения соединений с
5, 6
и более членами
в цикле:
CH.)-CH~-CO-O"
CH~-C~2
СН 2 -СН 2 -СО-О
СН 2 -СН 2
I -
/Ва ~
аднпинат бария
5.
I
/СО+ВаСО.,
.
циклопентанон
Сложноэфирные конденсации с У'lастием эфиров двухосновных кис­
JIOT. Конденсация сложных эфиров под влиянием алкоголятов часто идет с
образованием пяти- и шестичленных циклических систем (Дж. Дикман).
Например:
а)
межмолекулярная конденсация:
соос..Н.
I
•..
HCH-СООС 2 Н r.
I
I
+ СН
СООС Н.
~
_
-~ " нсн-СООС2Н"
б)
INиос..II-1
• ")0
-2С 2 1 1,,01 1
со-сн-соос. Н,
1
"
/СН 2
~ .,
СО-СН-СООС 2 Н,.
внутримолекулярная конденсация:
СН 2 -СН 2 -СООС 2 Н;,
I
INиОС..Н"1
,1;;.
~
-C}I}JII
CH 2 -СН 2 -СООС 2 Н r.
с п е Ц и а л ь н ы е с п о с о б ы получения али циклических соединений,
Применимые только для получения соединений с определенной величиной
ЦИкла.
. 1. Соединения с т р е х ч л е н н ы м циклом наиболее часто получают­
ся Присоединением карбенов (с. 123) к непредельным соединениям:
а)
CH 2 N2 ~ :CH 2 +N 2
JUfit:ЮМСТ311
СН:,-СН=СН 2 + :CH~ ~ CH:I-C~ /СН 2
СН 2
301
б) CHCla+R-ОNа
NaCI+R-ОН+:ССI 2
--+-
ДИXJI()I'КIIl'БСII
CH a -НС=СН 2 +:ССI 2
--+-
CH a - НZ/СН 2
СН 2
2.
Соединения с ч е т ы ре х ч л е н н ы м циклом можно получить при.
соединением тетрафторэтилена к непредельным соединениям:
СН 2 =СН-СН
CF2
11 + 11
СН 2
CF2
CH 2 =CH-CH-CF2
1
--+-
1
CH 2 -CF2
или димеризацией алле нов:
СН 2 =С=СН 2
+
СН 2 =С=СН 2
--+-
СН 2 =С-СН 2
1
1
СН 2=С-СН 2
+
СН 2 =С-СН 2
1
1
Н 2 С-С=СН 2
1.2·ДНМСТИJIСII·
1.:!·/lItМСТИJlСII·
II,НКJю(iУТЮI
III\КJlO(iYТ~1I
(ОСIЮlllюА
IIJЮДУКТ)
3.
Соединения с n я т и-
и
с е м и ч л е н н ы м и циклами чаще всего
получают декарбоксилированием соответствующих двухосновных кислот
(см. выше).
4.
Для получения соединений с ш е с т и '1 Л е н н ы м и циклами испо·
льзуется гидрирование соответствующих аромаТИ'lеских соединений:
.АСИ
НС.... .........си
и~'с(gН Н;
СН2
Н 2С ...... """~H2
3нz
(100- JSOOC).
нJ.,с(~И2
liCIIIOII
или диеновый синтез (гл.
СН,
,СН 2
I
Hc(''icH2
СН 2
НС
HC~_
1.3):
+
нМ,.........3 /4JH-CH....CH,
11
СН-СН-СН,
~H,
СН 2
4-......-1-1UI1UIOre1<CCll
5. Соединения с в о с ь М И Ч л е н н ы м и циклами могут быть полу­
чены на основе реакции тетрамеризации ацетилена в циклооктатетраен
(гл. 1.4):
НС=СН
НС/
4СН=СН --+-
11
НС
"
"
СН
. 11
СН
/
НС=СН
III\КJIШIКТИТС..,IIIСII
302
или н
а основе
реакции димеризации 1,3-алкадиенов на специальных ката­
лизаторах (гл. 1.3):
Hc/H2C-C~H
~II
11
НС
СН
"
/ 2
Н 2 С-СН
1,5-циклооктадиен
б. Для получения в ы с ш и х циклов с числом углеродных атомов 30
и более Л. Ружичка использовал сухую nерегон.к.у ториевых солей дикар­
бонОВЫХ кислот.
Все перечисленные общие и специальные способы получения алицик­
лических соединений могут быть использованы для синтеза не только сое­
динений, указанных в приведенных выше уравнениях. Путем обычных пе­
реходов между классами из них можно получить и соединения других клас­
сов с тем
же
циклом.
Однако
при
этом
всегда
следует учитывать
возможность изомеризации цикла (подробнее см. ниже).
Физические свойства
Циклические соединения обычно имеют более высокую температуру
кипения и плавления и большую плотность по сравнению с аналогично
построенными соединениями жирного ряда с тем же 'IИСЛОМ углеродных
атомов. Температура кипения тем выше, чем БОJlьше цикл (при том же со­
ставе). Главнейшие константы HeKoTopblX циклопарафинов приведены
в табл.
12.
та бл и ца
12. Физические свойства aJlканов и ЦИКЛОaJIканов
Соединение
Пропан
Циклопропан
Бутан
Ц11К,106vтаll
МеТIIЛ~;II(лопропан
Пентаl1
ЦIII(лопеНТiiН
МеТlIЛЦIIl(ло6утан
ЭТII."IЩГiJlопропан
Гексан
Цl1к.10гексан
МеТIIЛЦIII<ЛОllентан
ЭТI1.ЩIII(ЛО6утан
ПРОlllIлциклопропан
Т. пл.,·С
Т. кип .. ·С
-187.1
-126.9
-136
-80
-177,2
-129,7
-94.4
-149.3
-149,1
-94.0
6.5
-142.2
-142.9
-42.2
-33
-0.5
13
0.7
36.1
49.3
36.8
34.5
68.8
80.7
71.9
71.5
68.5
79.5
~1.0)гeKcaH
I
llри температуре Iшпения. :.1 При
-20.0
ос. з При
16.7
ос.
0.58241
0.6881
0.57881
0.7038
0.69122
0.6263
0.7460
0.6931
0.677
0.6594
0,7781
0,7488
0,7450
0.7120:\
0.8144
Химические свойства
Важнейшей особенностью, отличающей алициклические соединения
от соединений жирного ряда, является наЛИ'lИе цикла. Поэтому мы преж_
де всего рассмотрим на примере циклоалканов особенности разли'!Ных по
величине циклов.
Циклопарафины сильно отличаются между собой по устойчивости ЦИК­
ла. Из малых и средних циклов наименее устойчивы трехчленные и наИбо_
лее устойчивы пяти- и шестичленные циклы. Последние не разрываются
при действии на холоду перманаганата калия, озона, брома, бромистого
водорода. Эта закономерность связана с величиной напряжения в указан­
ных циклах. Особая неустойчивость трехчленного цикла связана со спе­
цифической гибридизацией орбиталей углеродных атомов, приближаю­
щейся по характеру к sр2_ ги бридизации алкенов.
Ниже рассмотрены направления химических превращений циклоалка­
нов в зависимости от величины цикла.
1.
Гидрирование. При каталитическом гидрировании трех-, четырех­
и пятичленные циклы разрываются с образованием парафИlЮВЫХ углево­
дородов. Особенно легко идет эта реакция в случае циклопропана и его
гомологов. Пятичленный цикл разрывается только при высоких темпе­
ратурах:
H~C-CH~
I- I-
,,/
н 2с
1'1
+ н., ~ сн.,-СН.,-сн.,-сн.,-сн.,
-
СН 2
.
:ЮО·С
-
•
•
.
СН 2
Соединения с шестичленными циклами при нагревании с катализато­
рами гидрирования дегидрируются и превращаются в ароматические:
/~2
Н.,С CH~ 1',1
-1
1
н. е
сн.
2,,/
2
Е
Галогенирование.
Э
1
11 + 3Н 2
:ЮО"С не
ен
~/
еН 2
2.
OC~
не:?" ен
Реакция
ен
циклопарафинов
с
галогенами
идет
в различных напраВJlениях в зависимости от величины цикла. Трехчлен­
ный цикл при'действии
raJloreHOB
разрывается:
ен.
/,,~ +CI2~ енр-ен 2 -енр
Н 2 С-СН 2
ХJlорирование с разрывом связи С-С сопровождается заместителЬ­
ным хлорированием. Бром действует на циклопропан при освещении или
в присутствии катализаторов с образованием смеси
304
1,3-, 1,2-
и
1, l-ди-
б омпропанов. Образование двух последних связывают с миграцией бра­
р в промежуточном карбениевом ионе.
ма uиклопарафИНЫ с пяти- и шестичленными циклами вступают в обыч-
ДЛ Я парафинов
направлениях):
ные
реакции замещения (циклобутаны реагируют в обоих
з. Действие галогеноводородов. Циклопропан и его гомологи реагиру­
ют с галогеноводородами с разрывом цикла:
сн;
/"-
+ НВг
R-HC-CH 2
~ CH j -СН 2 -СНВг-R
.
Реякция проходит в соответствии справилом Марковникова. Циклопа­
РЯфНIIЫ с ббльшим числом углеродных атомов в цикле с галогеноводоро­
адми не реагируют.
4.
Циклопропановый цикл расщепляется и при действии сильных кис­
лородных кислот с образованием спиртов и сложных эфиров также в со­
ответствии справилом Марковникова:
_ /СН 2
_
_
R-CH, I + CF.j-СООН ~ CH.,-CH,-CH-R
'СН
2
.
.,.
I
ОСОСЕ !
Циклы
с
ббльшим
числом
углеродных
атомов
кислотами
не
рясщепляются.
Все реакции циклопропанов с электрофильными реагентами рассмат­
риваются как реакции электрофильного присоединения с промежуточным
образованием различных видов карбениевых ионов.
5. Окисление. При действии сильных окислителей циклопарафины
(с разрывом цикла) образуют двухосновные кислоты с тем же числом уг­
леродных атомов. Этим они отличаются от изомерных олефинов, окисля­
IOЩихся с образованием кислот или карбонильных соединений с меньшим
числом углеродных атомов (гл. 1.2):
Y~2
СН 2 I()I
IС СН
I ~
H~C
Н
~
"-/
_.
_
_
_
_
НООС-СН.,-СН,-СН,-СН,-СООН
•
•
-
2
СН 2
СВ
Особенности непредельных a.JIициклических соединений. Двойную
связь можно ввести в любое кольцо, начиная с трехчленного. Две двойные
язи МОжно ввести только в пятичленное кольцо в сопряженном
305
положении. Циклопропадиен не существует. Циклобутадиен - BeCbt.la
неустойчивое соединение. Образует УСТОЙ'IИВЫЙ комплекс C4 H4 Fe( СО)
Циклопентадиен - устойчивое соединение:
3·
не-ен
11
не
11
ен
"../
еН 2
в шестичленное кольцо можно ввести две двойные связи в сопряженном и
несопряженном положении и три двойные связи в сопряженном ПОложении:
ен
ен
-f"..
/"..
ен
не
1 11
не
ен
2"../
11
не
не
11
ен
"../
еН 2
1,3-циклогексаДllен
ен
еН 2
1,4-ЦИl<логексадиен
ен
/'-ен
не
11
1
не
ен
"../
ен
1,5-ЦИl(JlOгексатриен
(бензол)
В сеМИ'Iленные и высшие кольца можно ввести две кумулированные,
1,2 - ЦШ<Jюгептадllен
1,3-Цl1клогеnтадиен
1,4-ц"клогеПТадl1ен
Тройную связь можно ввести в любой цикл, начиная с пятичленногО.
Устойчивы только соединения, начиная с циклооктина. Как показал
Г. Виттиг, углеводороды с тройной связью в ПЯТИ-, шести- и семичленноМ
циклах вступают в различные реакции в момент образования.
Циклические углеводороды с кратными связями по ХИМИ'Iеским свойСТ­
вам принципиалыю ничем не отличаются от соответствующих углеводо­
родов жирного ряда, за исключением особой склонности к реакциям изо­
меризации в момент реакции. Кратные связи в боковой цепи несколЬКО
более реакционнослособны, чем находящиеся в цикле.
Так, наПLJимер, 4-винил-l-циклогексен присоединяет бром последова­
тельно по стадиям:
Y-t'2
y-t'2
y-t'2
не eh-ен=еН 2 Вг не ен-енвг-ен 2 вг Вг вгне ен-снвг-ен 2вг
11
11
---4- 11 11
---4- 1 11
H~/eH2
H~/eH2
вгне"../еН 2
еН 2
еН 2
4-( 1,2-диб[!ОМЭТИJI)-IIIИКJIOI-СКССII
З06
еН 2
4-( I,:l-дибромэтил)-l, 2Дllб[!ОМIIIIКJlOгсксаll
НеСI(ОЛ ЬКО примеров реакц~й изомеризации циклических иепредельных соеДllнений ПРIfо ниже. ИСКJlючительныи IJИTepec в этом отношении представляют реаКЦИIf 1. З. 5.
веден oOKTilTeTpaeHa. Вещество это нормально гидрируется. однако присоединяет галогены
7 -ЦбIIКJIЗОВiIНllем 61ЩИКJIического соеДl1Нения. а окисляется до терефталевои IШСЛОТЫ:
С о ра
нс=сн
"11
нс/
сн
11
нс
"
сн
/
нс=сн
j
.(01
+
соон
1
сн
~"СН-СНСI
нс
I
I
нс
I
СН-СНСI
-~/
сн
с
/~
нс
сн
11
1
нс
сн
,,~
С
I
соон
Непредельные ГlщроаромаТII'lеские соединения способны ДИСПРОПОРЦIЮНllровать в аро­
маТllческие. Так. в присутствии платины или палладия. а в СЛУ'lае гексадиена уже при обы',­
ной температуре идут следующие превращения:
СН
ен
и"
не" ен.
3
/~
не
ен
НС
/.сн
1 2~ 11
I
"
Н 2 С /СН 2
еН 2
JH
3
1
+2
,,~
СН
JH
H<;:~'cH2
Hc~'cH
нс
не
I
1 ~2
ен.
~/
СН
2
1
1I
СН
~/
сн
~ти превращеllllЯ получили назваНllе «неоfiраmUАЮZО каmалlt:1U 3елuн.скоz()). Если
ДВОllНые Связи находятся в боковоrt цепи. то в этом случае OHII перемещаются в ядро.
Особенности производных алИЦИКJIических углеводородов. Для про­
ИЗВодных али циклических углеводородов (галогенопроизводные, спирты,
~ль~егиды и кетоны, кислоты, амины и т. д.) характерны те же химические
воиства, что и д,ля соответствующих производных углеводородов жирно­
го ряда. Однако при переходах между циклическими соединениями очень
'lacl'O в момент реакции наблюдаются реакции диспропорционирования
С ИЗменением величины цикла, поэтому следует соблюдать осторожность
в СУЖДеНИЯХ об их строении.
1-1. Nа~более важные работы по nepecTpoiiKe циклов проведены В. В. Марк~виик~вым.
С. с' нелинским. н. М. Кижнером. Я. Н. Демьяновым. Е. Е. Вагнером, Г. Меиервеином.
.
аметкиным и др. При ведем некоторые при меры превращеНlIЯ ЦИКJIов.
307
1.
При восстановлении галогенопроизводных (Марковников, Зелинский):
СН 2 -СН 2
/
H2~
Н 2 С-СН 2
1"
/CH-СН з -I2
"iH-I ~
1-11
СН 2-СН 2
2.
Н 2 С-СН 2
В реакциях спиртов (Демьянов, Кижиер):
Н2С,
'/СН-СН20Н
ив,
-
H 2 C-СНВr
I I
Н 2 С-СН2
H1C
и
(СООИ)2
3.
При дегалогенировании циклических галогенокетонов:
СН 2 -СНCI
Н 2<
;0
СН -СН
2
+2NаОНэ-
2
СН -СН
I
2
)CH-СООNа+NаСI+Нр
СН 2 -СН 2
В превращениях аминов (Н. Я. Демьянов). Действие азотистой кислоты на циклоал­
килметилаМI\НЫ является общим методом расширения циклов. Например, с циклобyrнлме­
4.
тиламином она дает четыре продукта: циклопентанол, циклопентен, циклобyrилкарбиноn
и метилен циклобутан.
Механизм превращения во всех случаях прннципиально один и тот же: перемещение свя­
зей в промежуточном карбениевом ионе. Мы разберем его более подробно на примередеАст­
ВIIЯ азотистой кислоты на амины.
Образующийся при диазотировании нестойкий ион дназония теряет азот с образоваиием
промежуточного карбениевого иона (1), который может претерпеть рядпревращениЙ.
Он может реагировать с водой с образованием соответствующего спирта (VI) или может
потерять протон от соседнего углеродного атома с образованием метиленциклобyrана (V);
но может произойти изомеризация с перемещением соседней связи с-с и образованием
нового циклического карбениевого иона (11).
Карбениевый нон (П) может аналогично иону (1) реагировать с водой или отщеплять про­
тон, образуя соответственно циклопентанол (111) и циклопентен (IV):
СН
-NH 2 +NH0
I 2-СН-СН
I
2
СН 2 -СН 2
2
>
[CIH2-CIH-CH2-N=NJ~
---....СН 2 -СН 2
ион дназония
Аналогично ведут себя карбениевые ионы и в других реакциях.
308
Отдельные представители. Применение
Простейший циклопарафин - цuклоnроnан - газообразное веще­
-34 ос. Его получ~ют В промышленном масштабе обработ­
во с т. кип.
ст ..1'-, 1,з_дихлорпропана
цинковои пылью в этаноле и используют в качест­
.
ко
ве ингаляциОННОГО анестезирующего средства.
1 3_Дихлорпропан
получают хлорированием пропана при
400
ос газо­
обр~ЗНblМ хлором. Образу~тся смесь дихлоридов, содержащая 19,3%
1 з_дихлорпропана,
которыи довольно легко отделяется от других изоме­
~B вследствие большой разницы в температурах кипения.
р Недавно синтезированный циклобутадиен устойчив только при темпе­
ратурах ниже
-35 ос.
Выше этой температуры он димеризуется:
D~IIIIII
Неустой'lИВОСТЬ циклобутадиена обусловлена не только стерическим
напряжением, но главныIM образом антиароматичностью (гл. 16): он на
76 кДж/моль
менее устойчив, чем 1,3-бутадиен. При обычных условиях
он может существовать в виде комплексов.
Как уже отме'lалось, гомологи циклопентана содержатся в кавказских
нефтях. Циклопентановое или циклопентеновое кольца входят в состав
ПРИРОДНblХ веществ - nросmагландuнов. Впервые простагландины
были обнаружены в предстательной железе млекопитающих. Теперь из­
вестио, что оии содержатся в небольших количествах почти во всех тканях
и оргаиах живых организмов. Неожиданным явилось их высокое содержа­
Hиe в мягком коралле. Один из простагландинов обнаружен в тканях лука.
Простагландины являются регуляторами функций клетки и обладают гор­
мональной активностью. В отличие от гормонов они синтезируются в ор­
ганизмах не в специальных железах, а непосредственно в клетках. Раз­
ЛИчные 'представители этих веществ (вьщелено около
нов) стимулируют сокращение гладких мышц,
20
простагланди­
понижают кровяное
давление и проявляют иные виды терапевтического действия, причем
в НИЧтожных концентрациях.
Простагландины являются производиыми простановой кислоты:
~OOH
простаиовая КИСЛОта
в Метках они, по-видимому, образуется из полиненасыщенных кислот в
реЗультате замыкания циклопентанового или циклопентенового цикла.
Простагландины получили широкое применение в медицине, ветерина­
Рии, растениеводстве. Так, например, простагландин Еl применяется при
лечении бронхиальной астмы.
б Цuк.логексан - жидкость с т. кип. 81 ос. Получается гидрированием
еНзола. Применяется как растворитель и д,ля получения адипиновой кис­
лотыI и капролактама.
309
Гексахлорцuклогексан (гексахлоран), получаемый оБЫ'IНО ПРИСоеДlt.
нением хлора к бензолу на свету, применяется как инсектицид.
Из непредельных циклических углеводородов особый интерес Пред.
ставляет цuклоnенmадuен (т. кип. 41 ·С), содержащийся в сыром бензо.
ле, откуда его можно извлечь превращением в димер. При нагревании дн_
мер вновь переходит в циклопентадиен:
НС=СН
2
I
('Н
.
)СН 2 Е"
НС=СН
СН2
...-~
HC...-г.... СН
СН
11 СН 2 1
11
НС ........ '...-СН-СН
СН
циклопеНТ3дllен
Дllмер
Циклопентадиен проявляет БОJIЬШУЮ химическую активность. Он лег­
ко присоединяет галогены и галогеноводороды и вступает в диеновый син­
тез:
СН
СН=СН,
СН-СО,
НС...-' ........ СН-СО,
I
'СН + 11
)0 ----+ 11 сн 2 1
)0
СН=СН/
2
СН-СО
Hc ........ I...-СН-Со
СН
эндометнлентетрагltдрофталевый ангидрид
Атомы водорода метиленовой группы, находящейся между двумя двой­
ными связями, обладают высокой подвижностью. Поэтому циклопентВДИ­
ен легко конденсируется в щелочной среде (спиртовой раствор щелочИ,
этилат натрия) с алифатическими альдегидами и кетонами, образуя так
называемые ФУЛ/Jвены
СН=СН"
I
СН=СН
-
окрашенные соединения, например:
-11 о
СН=СН
)С=С(С1Ч2
/CH2+0=C(CH:I)2~1
СН=СН
димеТlIлфульвен
о металлических производных циклопентадиена гл.
ферроценах -
СМ.
27.2.
Цuклогексен -
жидкость с т. кип.
82-83 ос.
Его полу'!ают дегидра­
тацией циклогексанола. При меняется в лабораторной практике как ти­
пичный циклоолефин. При окислении дает адипиновую кислоту.
В последние годы внимание химиков привлеКJIИ новые разнообразнО
построенные полициклические системы, ПОЛУ'lаемые в большинстве слу­
чаев синтетическими путями. К таким углеводородам прежде всего OTtl O-
310
а даманmан CloHI6 (т. пл. 268 ·С), впервые выделенный из нефти.
е <leTblpe кольца в его молекуле имеют кресловидную форму и свободны
СИТСЯ
Вс flряж ениЯ . Адамантан получают из димера циклопентадиена по схеме:
ОТ на
~I
~
111;11"11>
~ IЛIСI"I;170->
~ >l 3ОМС IJИЗ"I(Н"
или
a_MeTHJ1-[-адамантилметиламин под названием pt!AtaHmarJuH ПР'1меняется как противо­
ГРlmпозное средство.
Недявно довольно сложными путями синтезированы и таlше своеобразно построенные
углеводороды,
I(31( IIриаАШН (Т. пл. J 87 ·С). кубан (Т. пл. J 3 J ·С) н др.:
НС
'-....../сн
/'сн-сн
нЬ ~r.HH Ьн
нс, ттН' I
,/,СН 17СН
Нс-сн
~
"сн
кубан
призман
ДвядцаТIIСТЯДИЙНЫЙ синтез углеводорода r)пrJекаэдрана С 211 Н 211
УДЯJ1СЯ TOJlbI(O В 1982 г. после почти двадцатилетних неудячных попыток.
В Современной технике используются многие производные алицикли­
Ческ
ИХ углеводородов: из производных циклопропана, например, метил-
ЦИКJJопропилкетон, из производных циклопентана циклопентанол, цик­
JJOneHT<lHOH.
Из шестичленных циклических соединений важнейшим является спирт
ЦUК//огексанол (т. кип. 161 ·С). В технике его получают в больших коли­
Честв
<lX каталитическим гидрированием фенола:
CfjH!iOH
ЗН 2
Ni;
150·С
I
О
CfjH 11 н.
311
Циклогексилацетат С 6 Н 11 ОСОСН З по свойствам напоминает ИЗО В "'1
.
ацетат и во многих случаях заменяет его.
При дегидратации циклогексанола образуется циклогексен:
~2
Щ
/'-..
H~C
СНОН ЛI.,О., ИЛII
н.с
сн.
I
_.~
I
2'-../
КlISO,
2
/'-..
HP +
Н 2С
СН
н.с
СН
'
.
.~
'
I "
•
2'-../
СН 2
СН 2
цнклогексен
Окисление циклогексанола хромовой смесью или азотной кислотой
в зависимости от условий реакции дает цuклогекса/iО/i (т. кип.
156,5 'С)
или адипиновую кислоту, используемых как исходное сырье в производ.
стве полиамидных волокон
-
капрона и анида (найлона):
О
11
СНОН
с
/'-..
H~C
/
/'-..
СН 2
СООН
101 Н 2 С СН 2 /0/ Н2 С соон
~[[~II
Н"С сн..
н.,С сн.,
Н 2 С СН 2
-'-../
<
-'-../
<
'-../
If
СН 2
СН 2
СН 2
ЦНI<логексаион
iщнnиновая
кислота
11. АРОМАТИЧЕСКИЙ РЯД
Понятие об ароматичности. Ароматический ряд охватывает все карбо­
циклические соединения, в молекулах которых присутствует специфиче­
ская замкнутая р-электронная группировка с числом электронОВ
(4n
+ 2),
где n имеет значения
0,1,2,3
и т. д. (nравuлоХюккеля). В по­
давляющем большинстве случаев такой группировкой является бензоЛЬ­
ное кольцо (n
= 1).
Эти группировка атомов обусловливает определен­
ные химические и физические свойства иромитических соединений, иХ
ароматuч~скuй характер.
Для ароматических соединений характерна легкость образования в са­
мых различных реакциях, устойчивость к действию окислителей, трудное
протекание реакций присоединения по кратным связям, легкость заме!Де­
ния водорода различными группами в реакциях электрофильного заме!Де­
ния (нитрования, сульфирования, галогенирования, ацилирования, аЛК:И­
лирования, меркурирования и т. д.). Характерными свойствами обладаюТ
и некоторые заместители в ароматических системах: проявляет кислые
свойства ароматический гидроксил, ослиблена основность аминогрупп ы '
312
ЮТ устойчивостью и способны к реакциям азосочетания диазосое­
облада я мало реакционноспосОбен галоген в ядре и др.
ДИН~~:о~упность этих свойств является химическим критерием аро.матu ЧН
ос ти
на
основании
которого
определяется
принад.лежность того
'
и иного класса веществ ок аромат~ческим соединениям.
ил Важнейший физически и критерии ароматичности -
уменьшение (вы­
игрыш) энергии при образовании циклической системы из системы с от­
крытой цепьЮ углеродных атомов с тем же числом
п-электронов. Если
при такоМ переходе энергия п-электронов не изменяется, то возникаю­
щий цикл нельзя считать ароматическим. Если энергия п-электронов при
образовании
цикла увеЛИ'lивается,
цикл
называют антиаромаТИ'lеским.
Так, при переходе от 1,3-бутадиена к циклобутадиену энергия оп-электро­
нов
увеличивается,
что
указывает
циклобутадиена. При переходе от
на
антиароматическии
1, 3, 5, 7 -октатетраена
характер
к циклооктатет­
рае ну энергия п-электронов не изменяется и потому он является неарома­
ТИ'lеским соединением.
Имеются
и
другие
критерии
ароматичности
колец, характерные химические сдвиги
-
плоское
в спектрах ядерного
строение
магнитного
резонянся и др.
Кроме соединений, содержащих бензольное кольцо, аромятическими
свойствями облядают и некоторые другие алициклические соединения, не
содержящие бензольного кольца. Тякие соединения ряссмотрены в конце
ряздела. Аромятическим характером обладают и многие важные гетеро­
циклические соединения, рассмотрению которых посвящен специальный
ряздел книги.
В нястоящее времЯ" основными источниками ароматических соедине­
ний являются нефть и каменноугольная смола (см. с. 11).
КлассиФикация ароматических соединений. АромаТИ'lеские соедине­
ния, содержащие бензольные кольца, классифицируются в зависимости
ОТ Числя бензольных колец и характера связей между ними. Наиболее
простые ароматические соединения содержат одно бензольное кольцо.
ЭТО бензол и его гомологи, а также производные этих углеводородов ряз­
ЛИчных классов: галогенопроизводные, нитросоединения, сульфокислоты
и Т. Д.
Между соединениями различных классов в ароматическом ряду суще­
СТВУют взаимные переходы, похожие на переходы между аналогичными
СоеДИнениями жирного ряда. Однако бензольное кольцо оказывает силь­
Ное ВЛИяние на характер этих переходов. В свою очередь, различные фун­
КЦl10Няльные группы и атомы, связанные с бензольным кольцом, влияют
Ня его реакционную способность.
Ня при мере соединений этой группы ниже рассматриваются все основ­
НЫе ВОпросы химии соединений ароматического рядя.
n дРугая группа аромаТИ'lеских соединений - это углеводороды и их
/ОИЗводные с несколькими неконденсированными или конденсирован( :IМИ2 бензольными ядрами. В книге они рассматриваются в конце раздела
л.
5 и 26).
313
ГЛАВА
15
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
С ОДНИМ БЕНЗОЛЬНЫМ КОЛЬЦОМ
Строение бензола
К классу ароматических углеводородов наиболее простого типа с одни ..
бензольным кольцом и общей формулой C tl H 2tl - б (при
бензол и его гомологи.
n ~ 6)
ОТНосятCJI
В 70-х годах XIX в. экспериментальным путем было установлено, что
все шесть атомов углерода (а следовательно, и все шесть атомов водоро.,
да) в бензоле равноценны. Примерно в то же время было экспери­
ментально доказано (Ф. Ф. Бейльштейн и др.), что существует один изо­
мер монозамещенного бензола, по три изомера ди-, три- и тетразамещен­
ных и по одному изомеру пента- и гексазамещенных. Эти факты
совместимы только с циклической шеСТИ'lЛенной структурой молекулы
бензола:
o&o}~
ХУ
6:Х нУ хУХ
2
3
1
х
)ух )ухll
У"х
х
xJY х
х
4
х
х
х
NW
М х)У\
х
х
5
6
в соотвеТСТВIШ с этой структурой можно решать вопрос о строении ди- 11 полизамещеннЫХ
Ila основании КОЛl1'1ества ПОЛУ'lающихся изомеров. Действительно. например. при переходе от
двузамещенных бензолов к трехзамещенным прт()·изомер может дать два изомерных триза·
мещенных. ,мета·изомер - три. а nара·изомер - только один (nравил() Кернера):
314
х
се
х х
х
се
+Х
Х
lI:юме!'
~
Х
Х
1111(111-
~
Х
х
9~«
Хх
.II(!IIШ·
х
юоме!'
Х
в 1865 г. Кекуде предложил д.nя бензола ЦИКЛИ'Iескую формулу с чере­
дующимися двойными связями. Эта формула объясняла реакции присое­
динения ароматических соединений. Однако наличие двойных связей ука­
зывает на высокую непредельность, между тем бензол ее не проявляет.
Оставалось неясным, почему бензол более склонен к реакциям замеще­
ния и почему бензольное кольцо устойчиво к окислителям.
Формула Кекуле предполагает существование БОJIьшего числа изоме­
ров, чем есть в действительности, например, таких изомерных орmо-диза­
мещеНI-IЫХ бензола:
Однако получить их никогда не удавалось. Кекуле объяснил это наличием
гипотетической осцилляции связей в бензольном кольце:
О?О
На возможность такой осцилляции указываЛII. lIаПРllмер. ДIIlшые по озонированию
(}-КСIIЛОЛ~:
C~
~CH:I
-1tЗJ
C~
CCH:I-CO-CHO
~CH:I
СНО-СНО:Г ~СН.,-СО-СО-СJ-I. 1
А·'
.
Б
МеТI1JIГШЮl{саль МОГ образоваться 11З веществ/! с формулоil А. Дl1/!цетил Ф ОРМУло(j
Б.
из вещества с
Решающую роль в установлении строения бензола сыграли фИЗИ'Iеские
~eTOДЫ исследования веществ, открытые в основном в двадцатом веке.
OJIbKO сочетание физических и ХИМИ'Iеских методов исследоваlIИЯ позво­
ЛИJIO ВЫяснить структуру беlIзола.
м для определения строения бензола были ИСПОJIьзованы рефракто­
етрия, определение дипольного момента, изучение магнитных свойств,
315
ультрафиолетового и инфракрасного спектров, спектра ядерного магнит.
ног? ·резонанса, рентгенограмм и электронограмм, термодинаМическиJc
своиств.
Бензол не обнаруживает экзальтации молеклярной рефракции, харак.
терной ДJ1я сопряженных систем (гл. 1.3).
Молекула бензола неполярна и в магнитном отношении совершенно
симметрична. Бензол имеет ось симметрии шестого порядка. Следова_
тельно, ядра и электроны в нем располагаются симметрично.
В ультрафиолетовых и инфракрасных спектрах ароматических соеди_
нений наблюдается смещение полос поглощения, характерных ДJ1я 7t-свя­
зи, указывающее на наличие сопряжения.
В спектрах ядерного (протонного) магнитного резонанса сигналы аро­
матических протонов сильно сдвигаются по сравнению с этиленовыми в
слабое поле (примерно на
2
м. д.), что доказывает наличие кольцевог(,)
тока, создающего поле, налагающееся на внешнее магнитное поле, созда­
ваемое магнитом. В последнее время это явление рассматривает~я как
главный критерий ароматичности.
Важные данные были получены и при изучении рентгено- и электро­
нограмм бензола и его производных. Было установлено, что молекула
бензола плоская (рис. 55, 56), причем расстояния между всеми углерод­
ными атомами одинаковы и равны
зи 0,154 нм, а двойной 0,134 нм.
0,140
нм, тогда как ДJ1ина простой свя­
~ H~H
H,~>iВi
H~H
IАоА
Н
PI1C. 55. Схематическое изображение строения молекулы бензола
JLля характеристики отдельных связей в ароматических соединениях
'lacTo используют понятие порядок связи или кратность связи. Поря­
док связи может варьировать между 1 и 3. Порядок простой связи С-С
в этане принимают равным 1, связи с=с в этилене - 2, связи С!Е С
В ацетилене - 3.
:!1
:-
''~""'
~
Эm",!
0.140
~ 0.180
~
(1.0)
ОЛ0
Бен:шл
(1.67)
Эm/l.1I!/I (2.0)
1,120 L . . . . _ L - . _......._
0.1
1.5
2.0
. Aljt!"'UMH (3.0)
-=.....
_
........
2 ..5
:J.O
П()рm)ок ,·н.ч:m
PIIC. 56. Модель молекулы бен­
зола Стюарта - БРftглеба
316
Рис. 57. ЗаВI1Сl1МОСТЬ порядка связи с-с
от ее ДIIины
n
ядок связИ в молекуле бензола
1,67.
На рис.
57
приведенн кривая,
:~аюшая порядок и ДJlины связей с-с в различных соединениях.
святз uo тнк же плоской является и молекула гексаметилбензола (все 12
. )
:
очn
углер
одных атомов лежат в однои плоскости
СН 1
Н:\С*·СН: 1
%.1
СН: 1
H:1C
СН 1
плоская структура бензола определяет многие его особенности. В по­
следнее время выявлено исключительно сильное влияние на свойства
производных бензола положения заместителей в пространстве по отно­
шению к кольцу. Заместители только тогда влияют на свойства кольца,
когда они находятся с ним в одной плоскости и, следовательно, не наруша­
ется их сопряжение с бензольным кольцом (подробнее см. с.
:143).
Большой интерес представляют и термодинамические данные для бен­
зола. Бензол более устойчив термодинамически, чем это можно было
бы предполагать, исходя из формулы Кекуле. Это видно из следующих
данных.
Теплота
гидрирования
циклогексена
до
циклогексана
119,7 кДж/мою>. Следовнтельно, при гидрировании бензола до циклогек­
сана должно выделиться 119,7·3 = 359,1 кДж/моль. В действительно­
сти выделяется на 150,7 кДж/моль меньше. Превращение предельного
углеводорода в непредельный (этиленовый), т. е. образование двойной
связи,
требует
затраты
117,2-125,6 кДж/моль. Превращение же
1,3-циклогексадиена в беНЗОJl сопровождается выделением энергии:
СН
~"
НС СН 2
I I ~ О1;
не СН 2
~/
61/= -23,0 кДж/МОЛЬ.
%.
СН
Все зти данные свидетельствуют о том, что бензол стабильнее гипотети­
ческого циклогексатриена примерно на 150 кДж/моль. На ту же величину
меНЬше вычисленной экспериментально найденная теплота сгорнния
беНЗОJIН.
Величину 150 кДж/моль называют энергией стабилизации (ре:ю­
нанса) молекулы бензола.
б ~бъяснение всех этих физических, а также ХИМИ'lеских особенностей
еl1ЗОJ\а оказаЛОСl, возможным только в рамках квантовой химии.
В квантово-химической модели молекулы беНЗОЛ<t все шесть углерод­
ных НТОМов связаны друг с другом (J-связями, причем все эти связи нахо­
дятся в ОДНОЙ плоскости, т. е. они компланнрны. Каждый из углеродных
<1Томов
н
имеет, кроме того, по одному р-электрону. р-Электроны находятся
у а гавтелеподобных орбиталях, оси которых расположены под прямыми
ГЛ<1М\1 к ПJlOскости кольца.
317
Таким образом, все шесть атомов углерода бензола имеют sр2_ ГИб
дизованные орбитали. Кольцо замыкается без напряжения. каждыli
этих р-электронов должен взаимодействовать с р-электронами смежн
углеродных атомов,
поэтому все р-электроны
..
распределяются СИМII1
рично вокруг кольца и могут перемещаться по кольцу в том или ином На
правлении. Если приложить к молекуле бензола магнитное поле, пеРnе
дикулярное плоскости кольца, р-электроны будут двигаться в одном на.
правлении, что вызовет заметный диамагнетизм. Это подтвеР>lЩен
экспернментально. Бензольное кольцо рассматривается как замкнутw
сверхпроводник, в котором электроны движутся свободно, не испытыва.
сопротивления.
Необходимым условием сопряжения в ароматических системах ЯВЛЯet~···i.
ся параллельность осей орбиталей р-электронов: в противном случае Ha~·
рушается сопряжение и система теряет аромати'.ескиЙ характер. Так, на'!'
при мер, молекула циклооктатетраена не может иметь компланарного рас­
положения всех углеродных атомов вследствие большого напряжения при
валентном угле, равном
135°:
нс=сн
н(УЮ''сн
11
нс
"
11
сн
/
нс=сн
При выходе отдельных атомов из плоскости кольца нарушается парал­
лельность осей орбиталей р-электронов. Число р-электронов в кольце
циклооктатетраена не отвечает правилу Хюккеля (4n
2). Цикл оокта­
тетраен не обладает ароматическими свойствами.
Таким образом, в молекуле бензола достигается идеальное сопряжение
+
всех 1t-связеЙ. Это ведет к большой УСТОЙ'IИВОСТИ бензольного кольца, так
как сопряжение всегда дает выигрыш энергии. Нарушение сопряжения
в каком-либо месте бензольного ядра сразу приводит к потере УСТОЙL,ИВО­
сти. Поэтому очень трудно получить продукты присоединения к бензОЛ)'
каких-либо веществ с разрывом только одной двойной связи.
При квантово-химическом расчете молекулы бензола по методу злектроиных пар учиты­
ваются пять граНltчных структур молекулы бензола с различной долей У'IIIСТИЯ в резонансе: •
о-о-Ф-о-(;)
ПР"'lем YCTOJ'1'1~80CТb молекулы бензола выявляется КIIК следствне энергетнческой равНО­
ценност" двух главных граНИ'lНЫХ CTPYI(ТYP:
о-о
* «ДьюаРОВСКltе» граНlIчные структуры беНЗОЛII (три последНltх) нельзя путать с реальн)О
существующим
соедttнением
-
БИЦltкnо[2,2,О)-геКСllдltеном
(получен
в
1963 Г.·
Пр"веденные граннчные L"TPYJ(тypbI ПЛОСКllе, с неосущеСТ8"МОЙ в реальных молекуn81
дltагональноii связью, а молекула НlIзванного соединеНltя не плоская.
318
toBO-ХIIМJ1ческом расчете по методу молекулярных орбиталей предполагается.
npll
кван екрываЮЩllХСЯ р-орбиталей образуют шесть молекулярных орбиталей с раз­
что ш~с;~:r~еii. Устойчивость молекулы бензола является следствием необычайно НlIЗКОЙ
ЛII ЧНОJ1
1не
рГIfИ
Hlf3
шеif молекулярной п-орбlпали. которая включает все углеродные атомы без уз­
~"V HIIMlf (pIfC. 58).
лов ме"""
1:'
'Pfj
Разрыхляющие
орбlпали
Связывающие
орбитаJllf
Pllc.58.
Схема молекулярных п-орБJ1талеif бензола (даllЫ в СПlлизоваНllоi\ форме)
ИЗОБРRжение молекулы бензола должно предусматривать равноцен­
Ность всех связей между углеродными атомами. Поэтому формула Кекуле
~MeeT чисто условный характер. Можно пользоваться для обозначения
еНЗОЛR формулой Кекуле, просто шестиугольником или шестиугольни­
КОМ с ВПИСRННОЙ окружностью, символизирующей выравненность связей
в МОлекуле:
о
о
"IJензо
в ОТЛичие от незамещенного бензола в молекулярных производных
~R
I-i. ' электронная плотность распределена в цикле неравномерно.
п;РУU]Сll ие симметричности электронного облака бензольного кольца
I.!и и Введении в него заместителей может происходить различными путя. РRссмотренными ниже. Рентгеноструктурный анализ позволил
319
определить межатомные расстояния для некоторых производных бензOJta
(в нм), например д,/Iя 2,2'-дихлорбензидина:
С\
С\
Из схемы видно, что введение в бензольное кольцо заместителей СУщест_
венно меняет порядок связей, а следовательно, и распределение плотно­
сти электронов.
Изомерия. Номенклатура
Теория строения допускает существование только одного ближайшего
гомолога бензола с формулой С 7 Н В (толуол). Последующие гомологи мо­
гут существовать в виде нескольких изомеров. Так, существует четыре уг­
леводорода С 8 Н\О с бензольными кольцами:
СН\
СН,
с
С
1
С 2 Н,
СН
,j" /
СН СН
-7" /
.,
НС
С
НС
1
11
1
НС
СН
СН
11
НС
~/
этил бензол
-7"СН
,j"
НС
сн
1
"
СН;,
НС
11
НС
С
~/
СН
СН
.,
1 .
.
1
~/
сн
11
НС
С
"
СН
~/
С
СН:\
1
орmо-ксилол,
1,2-диметилбензол
СН;,
Ашmu-ксилол,
l,3-диметилбензол
nUPU-КСliЛОЛ,
1,4-димеТllлбензол
Здесь изомерия связана как с величиной и числом радикалов, так и с их
положением. Два радикала могут занимать в ядре три различных положе­
ния, носящие названия орто (1,2)-, мета (1,3)- и пара (1,4)-.
Из более сложных углеводородов следует упомянуть кумол и цUJtол:
Н,С-СН-СН,
.
1
.
С
-7"СН
НС
1
НС
11
СН
~/
СН
кумол, изопропилбензол
Н,С-СН-СН,
.
1
.
С
,j.I"
не
.,СН
1"
HC I ;
. 11
2СН
~I/
"с
1
СН;,
ЦltМОЛ, l-мепtл-4-изопропилбензол
Кроме эмпирических названий (толуол, ксилол, кумол) д,/IЯ ароматиче~
ских углеводородов существуют и систематическая HOMeHKJlaтypa. n
320
•
этоН
номенклатуре
бенЗОЛ
все
соединения
рассматриваются
как
замещенные
а н цифрами указывается положение заместителя. Примеры при­
веденЫ выше.
Способы получения
Ароматические углеВОДОРQДЫ,
как уже
отмечалось,
получают из ка­
МеННОУГОЛЬНОЙ смолы и нефти, а также из многих соединений жирного
яда. В лабораторных условиях ароматические углеводороды получают
~БЫЧНО из других, более доступных в чистом состоянии ароматических
соединений.
А. Из соединений жирного и a.JIИЦИКJIического рядов. Соединения
жирного и ароматического рядов взаимно переходят друг в друга. Извест­
но много способов превращения углеводородов, карбанилсодержащих со­
единений, кислот и их производных В ароматические соединения.
В этом разделе мы остановимся только на взаимных превращениях уг­
леводородов. Примеры подобных превращений производных углеводоро­
дов рассмотрены в других разделах.
1. Одновременно и независимо в трех лабораториях в СССР была от­
крыта реакция ароматизации парафинов (Б. А. Казанский и А. Ф. Платэ,
Б. Л. Молдавский, Г. Д. Камушер и др.). Катализаторами в этой реакции
могут служить различные вещества, например оксид хрома СГ20з:
сн.!
1 .
сн.,
СН
с
1 .,
/~
/'-.
Н 2С
СН з
1 l'
HzC СН.!
'-./ .
--~)I
НС
СН
11
1
НС
СН
'-.~
СН
С
1
. СН:!
1
СН:!
1,4-ДlIметил­
n-ксилол
гексан
2. Ацетилен и его гомологи дают ароматические углеводороды при
темперятуре красного каления (М. Бертло). В присутствии катализаторов
Эта реакция проходит при значительно более низких температурах и с хо­
РОШИМ выходом бензола.
3. Гидрояроматические углеводороды особенно легко превращаются
в аромятические. Как показал Н. Д. Зелинский, этот процесс идет при ка­
;~~и:~~еском воздействии палладия или платины при температуре около
CHz
HzC/ "'CHz
I
I
HzC, /CHz
CHz
\\ 3ак. \8\
СН
[Pd).
3ОО"С
нс"""'" ~CH
11
I
HC'c1tCH
+
3Hz
321
Б. Из ароматических соединений. 1. Бензол можно ПОЛучить пеРе
гонкой солей бензойной кислоты со щелочами:
•
Этот метод применим и для ПОЛУ'lения других углеводородов.
2.
Гомологи бензола легко получают из· галогенопроизводных реак-:
цией Вюрца -'Фиттига
(1864):
В отличие от синтеза Вюрца в жирном ряду здесь возможно легко раз­
делить продукты реакции. Побочные продукты типа Alk 2 и АГ2 имеют точ­
ки кипения, резко отличные от точек кипения углеводородов типа
(Alk -
алкил, радикал жирного ряда, Аг
-
Alk-Ar
арил, радикал ароматическа.,
го ряда). Механизм этого синтеза, по-видимому, не отличается от меха­
низма синтеза Вюрца (гл. 2.1 ).
ля
3.
-
Важный метод получения гомологов бензола
Крафmса (1877):
-
реакция Фриде­
В качестве катализатора могут быть использованы А!С!з и другие безвод­
ные хлориды, а также HF.
Метод этот очень широко используется в лабораториях и в промыш·
ленности. Недостатком его является образование в качестве побочных
продуктов полиалкилзамещенных бензола. а также изомеризация некото·
рых радикалов в процессе реакции. Так, например, из нормального хлори­
стого пропила и бензола получается кумол, из хлористого изобути­
ла
-
третичный бутилбензол:
Галогенопроизводные могут быть заменены в этой ре<)кции олефинамИ
или спиртами. Тогда в качестве катализатора применяются кислоты: фос­
форшш, серная, фтористоводородная.
_ 4. АромаТИ'lеские углеводороды получают также восстановлением СО­
ответствующих ароматических кетонов амальгированным цинком в соля­
ной кислоте (по Е. Клеменсену). Исходные кетоны легко получаются ре­
акцией Фриделя
322
-
Крафтса (гл.
23.3):
Физические свойства
А оматические углеводороды
- o6ы'lНo ЖИДКОСТИ И реже твердые ве­
Рва _ обладают сильным специфическим запахом. Температура ки­
!1lестя бензола (80,1 ·С) выше температуры кипения гексана (68,8 ·С).
пени
u
изомеры с несколькими радикалами кипят при более высокои темпеатуре, чем изомеры с одним, но большим радикалом. При сближении ра­
р КIIЛО В темпераТУРII кипения обычно возрастает. Поэтому opmO-И30ме-
дн
ы обычнО кипят при
б
u
олее высокои температуре, чем пара-изомеры.
~зомеры с изостроением заместителя кипят при более низкой температу­
ре чем имеющие заместитель с нормальным строением. Каждая новая
группа СН 2 повышает температуру кипения примерно на 30 .с.
Изомеры с симметричным строением имеют более высокую температу­
ру плавления. Из дизамещеННblХ пара-изомер плавится при наиболее вы­
сокой температуре.
Плотность и
показатели
преломления аромаТИ'lеских углеводородов
значительно выше, чем у УГJlеводородов жирного и аЛИЦИКЛИ'lеского ря­
дов (табл. 13).
т 8 б.~ 11 Ц8
13.
Физические свойства ароматических углеводородов
Вещество
ПJ10ТIIОСТЬ
dlU
Т. ПJl.,·С
Т. КИП.,·С
80,1
110.6
144,4
139.1
1.2.3. ТРlIмеТllлбензол
ПРОflllЛбеtlЗОЛ
+5.4
-93
-28
-53
+13
-95
-25.4
-99.5
-96.0
КУМОJl. IIЗОПРОПlfлбеlfЗОJl
/l·МеТIIЛЮОПРОПIIJlбензол. ЦИМОJl
136.1
176.1
159.0
152.4
0.8790
0.8669
0.8802
0.8642
0.8610
0.8669
0.8944
0.8632
0.8618
-67.2
177.2
0.8573
Бензол
ТOJIУОJl
КСIiЛОЛ
()р1lт·
AlelllU·
I/ара·
ЭПIJlбеltзол
13М
АРоматические углеводороды ПО'IТИ нерастворимы в воде. Вдыхание их
naiL: ВЫзывает отравление. Обладают канцерогенностью (см. гл. 26.4).
(180 я ароматического кольца характерно поглощение в УФ-области
нм) и вИК-области (1500- 1600 см- 1 ). В спектрах ямр про­
Т ОНЫ-300
б
64
ензольного
кольца
характеризуются
химическим
сдвигом
, -8,2 м. д.
17~O спектрам ямр и по поглощению в ИК-спектрах в области
8 б -2000 и 700-900 см- 1 можно определять характер замещения
еНЗОJ\ЬНом ядре.
Химические свойства
Ароматические углеводороды обладают большей склонностью к реак_
циям замещения, чем к реакциям присоединения. Характерна Ta~
:
устойчивость бензольного кольца к окислению.
А. Реакция присоединения.
1.
Присоединение к ароматическим УГЛ~~'
водородам молекулярного водорода происходит только в ПРИСУТСТВии ка­
тализаторов и при повышенной температуре. При этом получаются Ц!fl(_
'
логексан и его гомологи:
СИ
СИ2
и~ "си ЭНz И 2С/ 'сИz
111_11
ИС~ ./~И
И2 С
'~И
./СИ%
.......... Сиz
ХИМИ'lеское гидрирование бензола с помощью Na в жидком
ПРИВОДIIТ к 1,4-циклогексадиену. гидрирование с помощью
О
Li
NH;j (гидрирование ПО Бер'lУ)
- к циклогексену:
в аминах
Nи/NI'I"
О
l.i/l~NII~
О
2. На солнечном свету под влиянием ультрафиолетового излучения
бензол присоединяет хлор и бром с образованием гексагалогенидов. По­
следние при нагревании теряют три молекулы галогеноводорода и дают
тригалогенбензолы:
( ' 11
СИ
н
........ 1
-,СИСI
СН
н ~/еи
"У
C\H~
+ЗСl z --
СН
С\Н
/СИСI
..........снСI
reксахлорцихлоreксак
3.
f' ). . .
ССI
СНСI -энеl Н
-
CI~
С
С\
с........ ~XJIоpбeнэoll
Подобно другим непредельным соединениям бензол присоедиияет
озон, образуя mрuозонuд -
чрезвычайно взрывчатое вещество. При
действии воды этот озонид дает три молекулы глиоксаля:
ь СН
Не::::"" ........ СН
I~
1
HC~ /СН
СН
324
СИ
окисление бензола и его гомологов. Бензольное кольцо с боль-
6. УДОМ поддается действию окислителей. Такие окислители, как пер­
UJим ТРат калия, оксид хрома (Vl), азотная кислота, на холоду на бензол
манган
дейстВУЮТ'
не 1 При окислении бензола кислородом воздуха на V20 5 (гетерогенный
та~из) образуется малеиновая кислота (гл.
6.5).
ка 2. При окислении алкилбензолов кислородом воздуха образуются гид­
опероксиды. В реакции принимает участие углеродный атом в а-положе­
~ии к бензОЛЬНОМУ кольцу (подробнее см. гл. 20.1):
CHt-СНl
CHt-СН-QОН
6~6
З. Гомологи бензола при действии обычных окислителей превращают­
ся В ароматические кислоты. Независимо от длины боковой цепи она дает
карбоксильную группу. При нескольких заместителях путем подбора
окислителей можно окислить последовательно более длинную, затем бо­
лее короткую цепь или наоборот. Эта реакция служит для установления
строения ароматических углеводородов:
H3~COOH
/
1
[О)
1
(Y
~
~
СССН3
СС
1 СН3
~I
-1
о:
СНз
СООН
СООН
СООН
",.:;
",.:;
",.:;
ко Следует. ОДliако. заметить, что третичные алкильные группы, связанные с бензольным
л~цом, YCToii'II1BbI 1{ окислению: бензольное КОЛЬЦО окисляется легче, 'leM эти группы.
MI1 ~ APOMaТll'leCKOe КОЛI,ЦО может быть расщеплено только очень сильными окислителя­
ою;слаПРl1мер Rh0 4 в смеси с NaI0 4 или NaOCI. ЭТl1МИ ОКI1слитеЛЯМI1 Цl1КJ10гексилбензол
яется в ЦI1i(логексанкарбоновую кислоту:
IIог8 . Реакции замещения. Иначе реагируют бензол и его гомологи с га­
Все::ами в Присутствии катализаторов, с азотной и серной кислотами. Во
да б Тих случаях происходит электрофильное замещение атомов водоро-
ензольного ядра другими атомами или остатками.
:325
1. При действии на бензол хлора или брома в присутствии каталИЗ1'
ров, напрнмер желот:м:~Д:~:. cr~: г:огеном:
•_
2. При действии на бензол ни~рующей смеси (H 2S0 4 + НNО з ) ~.
,
водорода замещается нитрогруппои:
·1
3. При действии на бензол концентрированной серной кислоты ЦЦ~
реакция с у л ь фир о в а н и я: водородный атом замещается сульфоrpyn.
пой. При этом образуется моносульфокислота:
СБН Б
+ НОSОзН --+ СБНs-SОзН +Н 2 О
бензолсульфо,
кислота
4.
При действии на бензол галогенопроизводных в присутстви галоге.
нидов алюминия и некоторых других элементов образуются ГОМОЛО11l
бензола.
-r
5. Гомологи бензола подвергаются деалкилированию при нагревании
с кислотами Льюиса (А1Сl з • HF +ВF з ). Наиболее легко отщепляются тре­
тичные группировки. Они образуют олефины или полиалкилбензолы:
Эта реакция имеет промышленное значение: часть бензола получается
дезалкилированием толуола.
6. Бензол реагирует с трифторацетатом таллия в трифторуксусной кислоте с образова '
нием фенuлmаллuЙmрuфmорацеmаmа. КОТОРblЙ с успехом используется .мя синтеза аро­
матических соединеннй раЗЛИЧНblХ классов:
С 6 Н 6 + Т1(ОСОСF з )з""""С 6 Н 5 Т1(ОСОСFЗ )2+ СFзСООН
KHlg
.--"--=~
CuCN
I-=:"=';~
С 6Н sТl(ОСОСF З )2 -I-N_а_О_Н~
C6H5HIg
C6H5 CN
С 6 Н 5 ОН
~НзСОСI С6Нs СОСН з
Теория замещения в ароматическом ядре
Механизм злектрофильного замещения в ароматическом ядРе.
В жирном ряду реакции замещения обычно идут по механизму нуклеофJl:
льного замещения SN 1 или SN2 (гл. 2.1). В ароматическом рЯJIY подавлЯJOо
щее большинство таких реакций проходит по механизму электрофИЛЬНОГiI
замещения. Имеется определенное сходство между механизмами peaKЦ!I
326
офильного замещения в ароматическом ядре и электрофильного
зле~deдинения к олефинам. Многие реагенты, способные присоединяться
при
йной связи, способны вступать и в реакции замещения в ароматиче­
по::~дpe (CI 2, ВГ2' НNО з , H2S04 , HOCl, НОВг и др.). Оба типа реакций
ск
явля
ются по своему механизму полярными ступенчатыми процессами. В
обоИХ случаях реакции пр;дшествует быстрое образование 1t-комплекса,
но стадией, определяющеи скорость реакции, является образование про-
...uvточного
Me"'l'
карбениевого
иона
при
ароматическом
замещении
а_комплекса.
Электрофильное замещение (первая стадия):
@
О
6+ 3+ х+ (или х-у)
=@
.
::::;!::
Е\,"!-
~ (+V-)
н
t
х-у
н-"омплекс
11-"омпле"с
Электрофильное присоединение (первая стадия):
сн 2 =сн 2 +х
а-Комплекс
-
+
ъt
&+
(или х- У) <::!: 7t-комплекс <::!: СН 2 Х-СН 2
+ (У-).
это катион, лишенный ароматической структуры, с че­
тырьмя 7t-электронами, делокализованными в сфере воздействия ядер
пяти углеродных атомов.
Шестой углеродный атом при образовании
а-комплекса переходит из состояния
Sp2
В состояние sрЗ, приобретая та­
ким образом тетраэдрическую симметрию. Оба заместителя Х и Н лежат
в плоскости, перпендикулярной к плоскости кольца:
Образование а-комплекса не требует большой затраты энергии, так
как энергия сопряжения этой системы (108,7 кДж/моль) не очень сильно
ОТЛичается от энергии сопряжения в бензольном кольце (150 кДж/моль).
(1-
Комплекс - это не переходное состояние, а настоящее промежуточное
соединение, образование которого в некоторых случаях может быть дока­
зано спектроскопически и другими методами.
HHK~ rЯМ. случяев а,комплексы были выделены. например, а-комплекс (Т. пл. -15 ОС). воз­
-80 ,ЮЩIIII ПРII обработке мезитилена фтористым этилом в присугствии фторида бора при
С. ПРII Повышении температуры он дает нормальный ПРОдУкт алкилирования:
327
Вторые стадии реакций электрофильного присоединения и электроф,,_
льного замещения протекают различно.
При ароматическом замещении лабильный О'-комплекс превращаетCJI
в стабильный замещенный бензол с потерей протона. При этом выигры.
вается разница в энергии сопряжения в ароматическом кольце и в О'-КО,..
плексе. В СЛУ'Iае же олефинов потеря протона не приведет к значител ...
ному выигрышу энергии и промежуточный катион быстро реагирует
с
анионом
или
нуклеофильной
частицей
с
образованием
ПРОДУКТа!.'
присоединения.
Электрофильное замещение (вторая стадия):
Электрофильное присоединение (вторая стадия):
В
Ka'IeCTBe
примера рассмотрим механизм ранее приведенной реакции
алкилирования бензола. При алкилировании галогеналкилами О'-комплек,
сы образуются, по-видимому, без предварительной ионизации реагента:
© К-С'
+
+ AICI, • •
[r§;f~+ A\CI; _©-" + AICI, + "О
Менее электрофильные реагенты, например спирты, действуют только
в виде комплексов с катализатором:
-~~+so.и-+lи,О"so;и_©'R+2И,50, +н,о
Аналогично проходят реакции алкилирования ароматических углеводО­
родов олефинами, например:
Г~\JН(СН )2 J+S04H-~ ~
A-сН(СНз )t
© ~:~H2 -+==L~
+
328
+H2S04
З
энергетические изменения в системе при
офильном
замещении
Е
представлены
ЗЛ еКТ Р 59. Первым актом реакции является
на рис.
о б раз
циИ
О вание
с не
.".,.- комлекса
Ке
сун
б
u
u
ольшои энергиеи активаu
(первыи минимум
-б
на ри-
не показан), затем следует о разоваu
u
е уже со значительнои энергиеи актива-
ниии
а-комплекса.
П оследнииu
с не
б ольшои
V iJ I
:1
,1
"О ,коорuuнаmf1;реакцuu
U
~ергией активации превращается в коне'l- PIfC. 59. Схема I1зменеНlIЯ энеРГlll1
nPOnVKTbj',
Ы! - тепловой эффект в реаКЦl10нноii Сl1стеме npll элект·
3
Hb1e
рофильном замещеНI1II:
'-'v
реакциИ.
Является ли п- комлпекс обязательной
А -
IICXOIIIII,IC
ВСШСl"ТIЩ В -
IJ'КlIM'"
леКС; С - "родукт РСИКlllli; :IИМСШСIIЮI
стадией реакции замещения или переходное
состояние (второй максимум) может возникать непосредственно из на­
чальных продуктов, доказать очень трудно. Вследствие легкости образо­
вания 1t-комплексов, а следовательно, и незначительного их влияния на
направление замещения очень часто их образование не учитывают: рас­
сматривают только условия образования и строение а~комплексов.
ПРli электрофильном замещеНИI1 не обязательно замещаются толыю атомы водорода.
Могут замещаться
11 другие атомы 11 группы (алкилы,
аЦllЛЫ, галогены, НI1ТРО-
11 сульфогруп,
пы). ТаКllе реаlЩl1И называются ItflСО:ШАlещенuе,ll. ПРII l1ПсозамещеНIIII легкость ухода за­
меСТlпеля определяется его способностью принять ПОЛОЖlпельныil заряд. Ипсозамещение
ПРОIIСХОДИТ, HanplIMep. при ХЛОРllроваНlIИ и бромировании l,З,5-ТРlIметилбензола, при HI1троваНliИ n-иодаНI1зола. Особенно характерно ипсозамещение д.nя реаlщиii аРIIЛСllланов:
HNo,
~
6
NOz
Br
..
"___,1
+
{СНэ)эSiВr
329
Механизм нуклеофильного замещения в ароматическом ядре. Незамещенный беll
не pearllpyeT с нуклеофильными реагентами. Введение в молекулу бензола ЭЛеК'ГЗo.t
.:
нодонорных замеСТllТелей увеЛИЧllвает электронную плотность в бензольном ядре 11 тем Ро.
MblM еще бол;е затрудняет нуклеофильное замещение. При введении электроноакцеПТОРII~'
заместителеи, например НИТРОГРУППbl, электронная плотность в кольце понижается 11"'*
столько. 'IТO становится возможной реакция с нуклеОфИЛЬНblМII реагентами.
••
Реакции нуклеофильного замещения в ароматическом рядУ могут протекать по раЭJIII~
HblM механизмам. Многие 11З них ИдУт по мехаНI1ЗМУ 5 N2. Реакции галогеНОПРОllЗВОДНЫх ча~
проходят по механизму отщепление Прllсоединение с промеЖУТО'IНЫМ образованнем.
Гlщробензола. Такой механизм рассматривается в гл.
17.
В ОТЛИЧllе от процессов, протекаЮЩllХ по механизму
5 N2 в жирном рядУ. при которы
происходит одновременное присоединение заместите.(lЯ и отщепление замещающей группы~
при реакциях нуклеофильного замещения в ароматическом рядУ образуется метастаБилыlАA
промежуточный ПРОдУкт, в котором замещаеМblЙ атом 11 новый заместитель OДHOBpeMeHH~.
связаны с бензольным кольцом. Образование этого ПРОдУкта А сопровождается потереА
бензольного сопряжения и, следовательно, устой,IИВОСТИ. Бензольное сопряжение заменя,
ется сопряжением пентадиенатного IIOHaA. Углеродный атом, Прll котором происходит заме­
щение, приобретает тетраэдрическую конфигурацию:
©+ уА
в
пентадиенатныl aHllOH в ОТЛII'lllе от пентадиеl1l1ЛЬНОГО катиона, ВОЗНllкающего при элек,
трофильном замещении при ОТСУТСТВИII стабllЛllЗllРУЮЩИХ электроноакцепторных групп в
о- 11 n-положеНlIЯХ, неУСТОЙ'IIIВ. Это является оной 11З ПРИЧI1Н затрудвеНИI~ Прll проведенни
реаКЦlIЙ нуклеофильного замещения в ароматическом РЯдУ.
Механизм радикального замещения в ароматическом ядре, Имеются некоторые рак­
ЦIIИ apOMaТl1'1eCKOГO замещения, которые происходят в ПОЛIIОСТЬЮ неполярном окружении и
которые, следовательно, не могут протекать ни по электрофильному, ни по нуклеофильному
механизмам. ТаЮlе реакции часто проходят в паровой фазе при высоких температурах и при
воздействии радиации, однако известны некоторые реагенты, Вblзывающие неионное заме­
щеНllе
11
в растворах.
Во всех этих случаях бензольное кольцо атакуется незаряженными aToMaMI1 IIЛИ свобод­
HbIMl1
раДlIl(алами. Известны, например, реаlЩIШ аромаТllчеСКlIХ соединеНllЙ сметильнЫМ
раДlIкалом, феНИЛЬНblМ радикалом, гидроксильным радикалом и т. д.
В реакциях с рaдIlкальныии реагентами радикал атакует все возможные положения, од­
нако в большей мерео- и n-положения, независимо оттого, какой природы заместитель име­
ется в кольце.
Нитробензол, наПРllмер, Прll деilСТВИ11 пеРОКСlща водорода в Прl1СУТСТВИl1 ионов железа
(Ш) гидроксилируется во все Трll возможные положеНl1Я, однако преllмущсственно в о- и
n-положения.
Механизм раДllкального замещения (511) включает аТaI<У радикальным агентом R· ap~Ma­
ТllчеСКОI~ системы 1, возиикновение неустойчивых радикалов 11, I<OTopbIe далее взаимодеиСТ­
ВУЮТ меЖдУ собой по схеме ДИСПРОПОРЦИОНltрования или ПРllсоеДlIнения:
ДIII:ll\ЮIЮРIIIЮ­
©
ззо
~
g
11
+
IIIIIЮВ~IIIIС
III
IIPII~()CIIIIIICIIIIC
х
v.
н
Н
R~R
H~_H_H
чае ПРОИЗВОДНЫХ бензола состав продуктов реакции определяется ОТНОСlпеЛЬНОli
В. CJlУостью промежуточных свободных раДИJ<l!ЛОВ IV. У и VI. обраЗУЮЩllХСЯ в результате
уСТОllЧJJВ
"р"ф~""'
Q
НltЯ атакующеil чаСТIЩЫ в 0-.'\/- 1I tl-положеНJJЯ:
"-ОВ о-.
z
V
IV
VI
KbaHTObo-меХllflll'lесlotе расчеты показываЮТ.IJТО свободныil раДIIJ{ал
V. образующltiiся
в
зультате аТIIJ(l! в )l-положение. всегда менее YCToij'lItв. чем два дpyГltx. незаВltсимо от при­
~~ды замеСТlIтеля Z. Это 1I является причиной НИЗКlIХ выходов А/-замещенных продуктов. Из
этих же расчетов вытекает. 'по незамещеНllое бензолыtoе ЯДРОДОЛЖIIО быть менее аКТИВIIЫМ
по отношеНIIJО 1\ раДl1кальным реагентам по сравнеНlIЮ с ядром. содержащим какой бы то нlt
было замеСТllтель.
Отдельные представители. Применение
Бензол
-
жидкость, т. пл.
5,4
ОС, т. кип.
80,1
ос. Образует с водой
азеотропную смесь, благодаря этому легко обезвоживается при перегон­
ке. В настоящее время производится преимущественно из нефтяного
сырья катаJIитическим риформингом или гидродеметилированием толуо­
ла. Широко применяется в химической промышленности (см. схему 6).
Толуол
ине
-
-
жидкость, т. пл.
-93 ОС,
т. кип.
110,6 ос. Главное примене­
производство взрывчатых веществ (тринитротолуол, тротил), бен­
зойного аЛl>дегида, фенола и хлористого бензила -
полупродуктов ани­
J1ннокрасочной, пнрфюмерной, пищевой и других отраслей промышленно­
стн. Прнменяется как растворитель.
Ксuлолы. До недавнего времени в лабораторной практике и технике
Применялнсь смесь трех изомерных ксилолов, получавшихся при разгонке
у:леводородных фракций каменноугольной смолы. Такая смеСI> с т. кип.
138-142 ос используется главным образом как растворитель и как ком­
понент моторного топлива (октановое число более 120). В последние де­
СЯТИлетия получили широкое применение отдельные изомерные ксилолы,
ОСОбенно /l-КСИJIОЛ (как исходное сырье в производстве синтетического
ВОnОкня лавсан (терилен). Аминоксилолы (ксилидины) применяются в каЧеСТве янтидетонаторов.
•
Рязделяют ксилолы ступенчатым вымораживанием. В настоящее вре­
~я 90% всего потребляемого ксилола добывается из продуктов перера­
ОТКИ нефти.
ЭmuлбеliЭОЛ получают синтетически нлкилированием бензола этиле­
:ОМ в присутствии хлорида алюминия. Т. кип. 136,1 Ос. Применяется пре­
МУщественно для получения стирола.
т КУЛtoл получнют аналогично аJJкилированием бензола пропиленом.
(; ки2п. 152 Ос. Применяется в промышлеНlЮМ синтезе фенола и ацетона
n.
О. А).
331
схе ма
Промышленное использование бензола
6.
~Цв""о~ксаиок
,----- C,Htz
:-L
ЩIUIII"CКC8II
NHZOH
ЦвlUlOl"elCсаИОИОI<CIRI
_
АдИDИИO88JI
Г.кса..eтиnевдкамии
•
_
Капро"
___ НаЙJlOll
J<IICIIOnI
C,H,Cl,
ЗCl 2
Cl1
C,HsCl
(-на)
2C1J
Cl
(..,280)
n-
(lПICeItТIIцoW
НNО з
(HzS°.)
[н)
С6Н~-NОz
витра6еи3Ql\
HzSO.
(- Н2 О)
Cy~
H°SOzCl
..
пnаUeRИС
SO,
C,HsSOzCJ -
Nн,
бсн3Ql\-
С ,Н , SOzNHz.
бeнзon·
NaClO
и Сl .. C,HsSOzNClz
2
сут.фuпrд
сутфоXJIОpIUI
бсизonсуn*,ДIWIорамид,
морамииБ
н
[О)
НС-СО
11
.)0
{
HaC-СО
а ~~_c'ii0 I'Iщpoтu. ЯНТllj»WI " . I18Т8pюd
аRnщpRA
НС-СО
ПOnR3фмры~а"R.СМ~
М8IIeвнond
aвnщpIUI
СНа=СН а
С,
Лnu.u.
JI08IIIDIe
.
<А
мoro
chz=eh-СНз.
С
Ароматические углеводороды с кратными связями в боковой цепи.
В последнее время приобрели большое зна'lение ароматические углево­
дороды с кратными связями в боковой цепи. Простейшим представителем
этого вида УГJlеводородов является стирол.
Стирол
-
жидкость, т. кип. 146 0 с. Существует много способов его
получения. Важнейшие из них:
О,
. 0-'
ЛIО,
+CH2=Cн.,~
:::::."..
-
СН 1-СН:\
~
;.tКТIШII
-2//
~
ZnO
0-"СН=СН
1
~
)()-
щt1I Ill.Iii
КИСJIOIЮД
ИltСТ()ф~IЮII
Мt.·"ИJlфс.~lrИJI КИР()ИlЮJI
!
-11,0
О-СН=СН 1
При хранении и действии катализаторов стирол полимеризуется, пре­
вращаясь в твердую полупрозра'IНУЮ массу
-
полистирол. Полимериза-
ция идет по схеме:
(здесь n может иметь значение до 5000).
По месту двойной связи стирол присоединяет галогены, галогеноводо­
роды и т. д. Присоединение несимметричных лигандов идет по правилу
Марковникова:
Стирол легче, чем олефины, присоединяет спирты, вступает в диеновый
синтез.
Стирол применяется для получения различных ПJlастических масс. По­
листирол обладает очень высоким ЭJlектрическим сопротивлением и иск­
ЛЮчительно влагостоек. Это делает его незаменимым материалом дЛЯ
ИЗОJIЯТОРОВ.
Сополимеры стирола и дивинила представляют собой каучукоподоб­
I-!Ый материал, особенно пригодный для изготовления шинной резины (бу­
тадиенстирольный каучук СКС).
В последнее время усилился интерес к поливинилбензолам. Полиме­
Ризация с участием этих веществ идет в нескольких направлениях в
333
пространстве, и потому добавка поливинилбензолов ведет к сшиванию
цепей полимеров, к образованию трехмерных полимеров:
СН 2 -
J:. си,
х-сиr~и--О-Си=си,
СН=СН 2
CH-CH2- C H - - - f i -CH=CH 2
n9 --9
I
I---Y-
СН 2 -
Хорошо изучен также фенил ацетилен С 6 Н 5 -С
==
СН, углеводород
с ацетиленовой связью в боковой цепи.
Фенилацетилен
-
жидкость. Обладает подвижным водородным ато­
мом, за счет которого он способен вступать в различные реакции, харак­
терные ДIIЯ однозамещенных ацетиленов. Его получают из стирола через
дибромстирол.
ГЛАВА
16
ПРАВИЛА ОРИЕНТАЦИИ В БЕНЗОЛЬНОМ КОЛЬЦЕ
Существенной особенностью реакций получения и превращений про­
изводных ароматических углеводородов является то, что новые заместите­
ли вступают в бензольное кольцо в определенные положения по отноше­
нию к уже имеющимся заместителям. Закономерности, определяющие
направление реакций замещения в бензольном ядре, называются nрави­
лами ориентации.
Реакционная способность того или иного атома углерода в бензольноМ
колще определяется следующими факторами:
уже имеющихся заместителей,
2)
виями
Решающее
проведения
реакции.
1) положением
и природой
природой действующего агента,
влияние
имеют два
3) усло­
первых
фактора.
Заместиreли в бензольном кольце можно разделить на две группы.
ЭлектроноДонорные (п е р в о г о
р о Д а)
-
это группировки атомоВ,
способные отдавать электроны. К ним относятся ОН, OR, RCOO, SH,
SR, NH 2, NHR, NR2, NHCOR, -N=N-, СН з , CH 2R, СR з , F, CI, Вг, 1.
Электроноакцепторные заместители (в т о р о г о р о Д а)
-
это атом­
ные группировки, способные оттягивать, принимать электроны от бензО­
льного ядра. К ним относятся SОзН, N0 2 , СНО, COR, СООН, COOR,
CN, СCl з . и т. Д.
334
Действующие на ароматические соединения полярные реагенты можно
разделить на две группы: электрофильные ~ нуклеофильные. Наиболее
хярактерны
для
аромаТИ'lеских
соединении
процессы
алкилирования,
гаJlогенирования, сульфирования и нитрования. Эти процессы идут при
взаимодействии аромаТИ'lеских соединений с электрофильными реагента­
ми. Известны и реакции с нуклеофильными реагентами (NaOH, NH 2 Na
11 т. д.). например реакции гидроксилирования, аминирования.
Заместители первого рода (кроме галогенов, о влиянии галогенов см.
rJl. 17)
оБJ1егчают реакции с электрофильными реагентами, причем они
ориентируют новый заместитель в орто- и пара-положения.
Заместители второго рода затрудняют реакции с элеКТРОфИJIЬНЫМИ ре­
агентами: они ориентируют новый заместитель в мета-положение. В то
же время эти заместители облегчают реакции с нуклеофильными
реагентами.
Рассмотрим примеры реакций с различными ориентирующим действи­
ем заместитеJlеЙ.
1. Заместитель первого рода; реагент электрофильныЙ. Облегчающее
реакцию действие заместителя, 0-, n-ориентация:
ОН
).yNO z
он
6нo~
U
о -иитрофеиол
11 -иитрофеиол
2. Заместитель второго рода; реагент электрофильныЙ. Затрудняющее
реакцию действие заместителя; м-ориентация:
... -дииитробензол
3. Заместитель первого рода; реагент нуклеофильный; м-ориентация.
Затрудняющее действие заместителя. Примеры таких реакций с бесспор­
I/blM
механизмом неизвестны.
335
4.
Заместитель второго рода; реагент нуклеофильный, 0-, n-ориентация:
Систематические исследования влияния заместителей на ориентацию
в бензольном кольце были проведены А. Голлеманом. Ф. Бейльштейн
установил, что при ннличии нескольких заместителей преоблндающее на­
правляющее действие оказывает тот из них, который обладает наиболь­
шим активирующим эффектом.
Важнейшие знместители по селективности ориентирующего действия
в реакциях электрофильного замещения можно рнсположиТl, в следую­
щий ряд:
NH 2 > ОН > OR > СI > 1 > В,· > СВ:!:
СООН>
SO:!H > NO~.
Описанные выше правила не носят характера законов. Речь почти все­
гда идет только о глнвном направлении ренкции. Очень часто в реакции
обрюуются все возможные продукты, однако преобладнют количественно
те из них, которые образуются в соответствии с правилами ориентации.
Тнк, при нитровннии толуола образуется
4,5% мета-нитротолуолов.
62% орто-, 33,5% nара- и
J-Iебольшое изменение условий проведения реакции замещения обычно
не влияет нн тип ориентации, одннко изменяет соотношение между орто­
и парн-изомерами. Значительное изменение условий, ннпример сильное
повышение темпернтуры, окнзывает влияние и на тип ориентации, так как
изменяется механизм ренкции. Так, например, бромирование толуола при
обычной температуре дает преимущественно пара-изомер. При 400·С
соотношение между орто-, nара-, мета-изомерами 20, 57,
630·С - 18,9,21,2 и 59,9% (рндикальное бромирование).
23%, а при
Влияние растворителей незначительно. КнтализаТОРbl могут изменить
напрнвленltе процессн. Так, при бромировании ХJlорбензолн обычно обра­
зуется всего 1% мета-изомера. В присутствии АIСl з количество его ВОЗ­
растнет до 13%.
Механизм ориентирующего влияния заместителей. Кнк известнО,
в молекуле бензола имеет место совершенно равномерное рнспределение
электронной плотности. Присутствие знместителя нарушает эту равно'
мерность. Возникает чередующаяся полярность углеродных атомов в ко'
Jlьце
ЗЗб
-
так н~зывнемый альтернuруюlЦUЙ эффект.
Заместитель может взаимодействовать с бензольным ядром двумя спо­
собами, могут иметь место два эффекта: индукционный
(I) и сопряжения
(М) (см. «Введение»):
А
+
,~,+
б+
11
+
+
+
8~o-o-8"P"'''1''III,IC CTPYK1YI""
"РИIIII'IIII,'С
CTPYK1YI""
11
O'N/O-
+'i'6'щ
+1/:\
11
Б
в первом случае изменение плотности в ядре связано с поляризацией
а-связи между заместителем и ядром (1). Эффект (М) связан с возникно­
веНием сопряжения между р-электронами заместителя и кольца. При
"том ВОЗМОЖНЫ два случая: электроны могут смещаться в сторону кольца
(1) или в сторону заместителя (II).
в первом случае увеличивается реакционная способность бензольного
i<ОЛьца по отношению к электрофильным реагентам, во втором НОшению к нуклеофильным реагентам.
по от­
О существовании двух способов взаимодействия атомов говорит СрНВ­
НеВие Дипольных моментов ПРОИЗВОДНblХ бензола с соответствующими
ПРGИЗводными метана. Изданных табл. 14 видно, ЧТОДJIя соединений сза­
местителями первого рода дипольные моменты у производных бензола
меНЬше, чем у производных метана. При заместителях второго рода на­
БJl!одается обратная картина.
337
Та бл и ц а
14.
Дипольные моменты производных метана
и бензола,
RX
D•
X-эамеСТНТeJIЬ
X-эамеСТНТeJIЬ
первого рода
второго рода
ОН
СI
CN
NO"
СН,Х
1,68
1.87
3,94
3,50
CJ-I,X
1,40
1,72
4,39
4,23
+0,28
+0,15
-0.45
-0,72
* 1 D = 3,34·10·" Кл· м.
Дипольный момент уменьшается, если два эффекта - индукционныА
и сопряжения - действуют в противоположных направлениях. Наобо­
рот, при одинаковом направлении обоих эффектов дипольные моменты
увеличиваются:
ifW
У -Q-H
Таким образом, в зависимости от природы заместителя бензольное
кольцо обогащается или обедняется электронной плотностью, т. е. стано­
вится более или менее склонным к электрофильному замещению.
Реакции электрофильного замещения в ароматическом ряду обычно
либо необратимые процессы, либо проводятся в условиях, далеких от рав­
новесия. Поэтому их направление определяется не ббльшей устойчиво­
стью конечных продуктов по сравнению с исходными, а необходимой для
их протекания энергией активации, т. е. не термодинамическими, а кине­
тическими факторами *. Эти реакции идут в направлении образования бо­
лее выгодного переходного состояния, о структуре которого можно судить
по реальной структуре промежуточного продукта
циn ХЭм'м'онда, введение.
5).
-
(J'-комплекса (nРUН­
Следовательно, решающим фактором, опре­
деляющим направление электрофильного замещения, является влияние
заместителя на устойчивость образующегося (J'-комплекса. Вообще гово­
ря, замещение может идти в любое положение бензольного кольца, одна­
ко с различной скоростью, определяемой различной энергией активациИ,
Энергия активации тем меньше (а скорость реакции тем больше), чем
выше устойчивость (J'-комплекса, TO'IНee, чем меньшая энергия требуетсЯ
для возникновения соответствующего переходного состояния. Следовате­
льно, качественный анализ ориентационного действия каждого заместИ­
теля сводится к анализу его влияния на устойчивость возникающего при
реакции О'-комплекса. А поскольку главным фактором стабильносТИ сое­
динений является сопряжение, в первую очередь анализируется возмоЖ­
ность максимального сопряжения при образовании О'-комплексов с уЧ8С-
*
338
Об обратимосТII элеКТРОфftльного сульфироваНltя СМ. ГЛ.
19
и
27.1.
ти
ем различных атомов углерода бензольного кольца. Если сопряжение
не позволяет решить вопрос о
б
•
устоичивос~и О'-комплексов, то анализи-
уется характер распределения электроннои плотности с учетом того, [/то
~азмешение одноименных зарядов у рядом стоящих атомов требует затра­
тЫ большей энергии и, следоватеJIЬНО, является дестаБИJIИЗИРУЮШИМ
фактором.
РОЛЬ энергетических факторов при
Rыборе
направления
монстрирует рис.
60.
замещения
Е
де­
Реакция пойдет
преимущественно в условном положе­
нии З, так как в этом случае ниже энер­
гия активации.
При
":Iлектрофильном
заместители
первого
замещении
ряда
повышают
стабильносТЬ 0'- комплексов, отве[lаю­
щих
в
0-
и n-ориентации. Так, например,
случае
гаJlогенирования
анилина
стаБИJlИЗИРУЮТСЯ сопряжением с участнем аминогруппы толыш О'-комплек-
сы 1 и II. 8 случае O'-КОМJIПекса Ш та­
кая стабилизация невозможна; бензо­
JlbHOe
кольцо
не
может
Хоо (коороинаma) реакции
РИС.
60.
Кривые IlзменеНIIЯ потеНlLl1аль­
11pl1 элеКТРОфliJIЬНОМ заме-
Hoii 'JliеРГИII
щеНИ11 в различные положеllllЯ:
I -
,1/';
2-
п-;
:3 -
п·:mМСЩСIIИС
принять
электронную пару азота (нет сопряжения) и в соответствии с этим нельзя.
построить граниtlНУЮ структуру с положительным зарядом на атоме азота:
о Q
н
Вг
н
Вг
339
t&и
( 111)
Br
r- и-+~ и
NHz
NHz
~Br
~Br
Граничные формулы отражают крайние состояния (J-комплекса. В дей­
ствительности он существует в промежуточном «мезомерном» состоянии.
При наличии в бензольном кольце замеСтителя второго рода сОпряже­
ние С этим заместителем в (J-комплексе невозможно, так как эти замести­
тели не могут отдавать электроны для компенсации положительного заря­
да ядра. В этом случае относительно более выгоден (J-комплекс типа
11,
так как при его образовании не появляются два положительных заряда на
рядом стоящих атомах, что ИСКЛЮ<lИтельно невыгодно:
У
х
.;
н
_
+
N-O
+
11
111
H~
+ .;
Х
Х у+
O=N-O
Н +
I~
Н<5
1 1
9
+
+
-
+
O=N-O
+
O=N-O
+
-
+
H~
O=N-O
+
-
O=N-O
-
340
-
:97
~
:~
O=N-O
+
-
~~
O=N-O
O=N-O
-
,1
~9
H~
~
+
-
O=N-O
+
+
O=N-O
+
HJ?'.
:I/:I
+I/:I
O=N-Q
+
Н9-
+I/:I
+1f.1
. +11:1
O=N-O
+
-
Таким образом, электронные эффекты облегчают или затрудняют
взаимодействие реагентов с определенными атомами в бензольном коль­
це изменяя устойчивость промежуточного а-комплекса.
'При удалении заместителя, находящегося в боковой цепи, его ориенти­
рующее влияние быстро ослабевает. Это, например, видно из опытных
6'
8-
данных по нитрованию следующих нитропроизводных:
6,NO,
JI-!J:I'у.',
,NO,
CH
_11-48%
Ясно, что при наличии нескольких заместителей больше проявляется
действие того из них, который способен вызвать большее смещение элек­
тронов и сильнее стабилизировать а-комплекс.
При наличии в соединении двух заместителей одного типа (первого или
второго рода) согласованная ориентациях наблюдается только в том слу­
чае, когда они находятся в мета-положении:
&NП'
diNH. ~
согласоаанна.
NH1
ориентаци.
aiNO. Ф
согпсованна.
N 02
ориентаци.
cornacoaaннa.
ориентаци.
При Этом, если заместители разные, число изомеров, отвечающих влия­
нию каждого заместителя, будет различным. По ориентирующему влия­
IIНю заместители располагаются в ряды:
NH 2 > ОН > OR > OCOR > R > Hal:
СООН
> SO;\H > N0 2.
341
Примером могут служить результаТbI нитрован ия раЗЛИЧНblХ хлортолу­
олов (цифРbl покаЗblвают процентное содержаuие изомеров с данным по­
ложением заместителя):
СНз
СН
20.7
43.4
ij.ЗС1
"'~8
~ 118.9
32.3 СI
17.0
Если в соединении имеется два заместителя раЗЛИЧНblХ типов (первого
и второго рода), то согласованная ориентация будет при расположении их
в орто- и пара-положении. Однако в этом случае ориентирует только за­
меститель первого рода, так как только он стабилизирует промеЖУТОЧНblЙ
а-комплекс. НОВblЙ заместитель окаЗblвается в орто- или пара-поло­
жении к заместителю второго рода, КОТОРblЙ ориентирует в мета-поло­
жение. Так, например, при нитровании м-нитротолуола (несогласованная
ориентация) изомеРНblе дннитрбеНЗОЛbl образуются в следующих количествах:
25)::20
UN0
S5
2
При наличии в соединении любblХ двух заместителей в мета-положе­
нии появление нового заместителя между ними маловероятно по стериче­
ским соображениям.
В рассмотренных нами случаях реагентами бblЛИ ИОНbl или сильно по­
ляризоваННblе молеКУЛbl. ИНblе соотношения наблюдаются в тех случаях,
когда реагент представляет собой радикал. При атаке бензольного ядра
радикалом не возникает кулоновского взаимодействия его с каким-либо
определеННblМ атомом углерода, так как радикал нейтрален. Таким обра­
зом, отсутствие ориентирующего влияния раЗЛИЧНblХ по природе замести­
телей может бblТЬ доводом в пользу признания дЛя данной реакции ради­
кального механизма.
С СИЛЬНblМ увеличением темпераТУрbl ориентирующее влияние заме­
стителей постепенно утрачивается, так как скорости всех трех процессов
(0-,
м- И n-замещения) Вblравниваются.
Очень интересен, хотя еще мало изучен, вопрос о соотношении между
0-
и n-изом.ерами. Здесь следует УЧИТblвать несколько факторов:
1) в бензольном кольце о-положений два, n-положение одно;
2)
в о-положении могут наблюдаться пространствеННblе затруднения
(например, при нитровании толуола образуется 58% о-изомера, при ни­
тровании в тех же условиях трет-бутилбензола - 16% 0- и 73%
n-изомера;
3) индукционному влиянию особенно подвержеНbI о-положения, так
как оно сильно убblвает по цепи. Следовательно, если заместитель индук­
ционно дезактивирует бензольное кольцо, эта дезактивация проявляется
342
более
всего
(см. гл.
17);
4)
в
о-положении.
Пример
-
хлорирование
хлорбензола
эффект сопряжения по невыясненным причинам более всего прояв-
ляется в n-положении.
ИЗ рассмотренного видно, что наибольшее влияние на направление ре­
аКЦИЙ ароматических соединений оказывает эффект сопряжения. Меж.пу
тем сопряжение может существовать только в случае, если группы, кото­
рые могут участвовать в сопряжении, компланарны. Если оси облаков
р-электронов заместителя и р-электронов бензольного кольца не парал­
лельнЫ, сопряжение ослабляется и заместитель теряет свое влияние на
бензольное кольцо.
Эта особенность эффекта сопряжения подтвеждена многими примера ми. Ниже приведены компланарные системы
6 ~
атом хлора
мало подвижен
атомы хлора подвижны благодаря
влиянию нитvогрупп
и система, выведенная из компланарности (атом хлора мало подвижен)
С1 I .
4
изе:::::,..
сиз
N02
Корреляционный анализ. Полярное влияиие иа реакциоииый цеитр заместителей, иахо­
дЯщихся в n- и ,II-положеииях, может быть описано колнчественно с помощью корреляци­
Онного уравнения, предложенного Л. Гамметом:
К
Ig-=pa,
Ко
константа с!<оростн или константа равновесня Д1Iя замещенного соединения;
ГДе К К" - аllалогичная константа д.nя незамещенного соединения; а - константа, характеризу­
ЮЩая полярное влияние заместителя; р - константа, определяющая степень чувствитель­
ности реакционного центра к полярным эффектам. Константа а зависит только от природы
заместителя, а константа р - от характера реакции.
Соединения с различиыми заместителями, но с одиим И тем же реакционным центром об­
разуют реакционную серию.
11- Константы
некоторых заместителей приведены в табл. 15. а- Константа положительна,
если заместитель оттягивает электроны, и отрицательиа, если заместитель является доно­
Ром электронов.
343
Табл и ца
15.
Значения а-констант заместителей (по Мак-Даниэлю и Брауну)
cr
cr
Заместитель
Заместитель
.мета-
О
-Н
-сн,
-С,Н"
-с(сн,)"
-СЕ,
-СООН
-СОО
-СООС,Н,
-сосн,
-Е
-CI
-Вг
.мета-
nара-
-1
О
-0,069
-0,07
-0,10
0,43
0,355
-0,1
0,37
0,376
0,337
0,373
0,391
-0,170
-0,151
-0,197
0,54
0,265
0,0
0,45
0,502
0,062
0,227
0,232
-ОН
-о
-осн,
-NH,
-NHCOCH,
-N(CH,),
-N(CH,),
-NO,
-SO,
-SO,NH,
0,352
0,127
-0,708
0,115
-0,16
0,21
-0,211
0,88
0,710
0,05
0,46
nара-
0,18
-0,37
-0,519
-0,268
-0,66
0,00
-0,83
0,82
0,778
0,09
0,57
В зависимости от механизма реакции велвчина р также принимает положительные или
отрицательные значения. Она положительна, если увеличение скорости реакции вызвано
уменьшением электронной плотности в реакционном центре, и ОТРlщательна, еСЛli увеЛИ'lе­
ние скорости реакции связано с возрастанием элеКТРОНfiОЙ ПЛОТfiоспt в реакционном центре.
Таким образом, по знаку р можно судить о мехаfiизме реакции.
Дnя определеНliЯ веЛliЧltны р достаточно изучить Кltнепtку превращеннй ряда соедине­
ний, входящнх в данную реакционную серию'.
Для всехдругнх соеДltнений серии можно раССЧlпывать константы скорости реакции, ис­
пользуя значения а из табл.
15.
В настоящее время используется нескол!,ко систем реакционных констант а, учитываю­
щих более тонкие взаимные ВЛltяния атомов.
Установление возможноспt применения различных корреляционных уравнений называ­
ется корреЛJtЦUОННI>Ш UНUЛll:ЮМ.
Дnя о-замещенных соединений простая корреляция обычно не наблюдается, так как
o-замеСТIпелн влияют друг на друга не только ИНДУIЩИОННО, ио И различнымн ДРУГ1tми спосо­
бами (стерический эффект, водородная СВЯЗ!" эффект поля 11 Т. д.).
Корреляционный анаЛltз используется в органической Хltмии д.ля установления механИЗ­
ма реакций, строенвя реагирующих веществ. Отдельные примеры использоваНltя уравнениЯ
Гаммета приведены в гл.
17,24.
ГЛАВА
17
АРО.МАТИЧЕСКИЕ ГАЛОГЕНОПРОИЗВОДНЫЕ
Ароматические галогенопроизводные разделяются ПО строению, своЙ­
ствам и методам получения на две группы: 1) соединения, содержащие га­
логен в ядре; 2) соединения, содержащие галоген в боковой цепи,
* ЕСл1t
на осв абсцисс отложены значения а, то р д.ля каждой серии определяетсЯ каК
тангенс угла наклона соответствующей прямой.
344
Бензал абразует адна манагалагеназамещеннае, три дигалагеназаме­
ш.еннЫХ (с адинакавыми галагенами ), три тетрагалагеназамещенных,
адна пента- и адна гексагалагеназамещеннае.
Талуалу отвечают четыре манагалагеназамещенных, из катарых адна
имеет галаген в бакавай цепи:
СИз
СИз
Cla 6
о -хлортопуon
.. -хлортопyon
I
CI
хлористыА
бензил
n -ХJlОртопуon
Способы получения
1.
Прямае ваздействие галагенав на араматические углевадарады.
Галагены Maryт реагиравать с араматическим углевадарадам тремя
путями:
а) присаединяться к двайным связям бензальнага кальца;
б) замещать вадарадный атам бензальнага канца с абразаванием
галагенарила;
в) замещать вадарадный атам в алкильнай группе бакавай цепи с об­
разованием арилалкилгалогенида.
Реакция присоединения галогена была рассмотрена выше.
При действии на аромаТИ'{еские углеводороды галогенов (хлор, бром)
на холоду в присутствии катализаторов происходит замещение водород­
ных атомов в ядре с выделением галогеноводородов:
Катализатором при этом обычно является хлорид или бромид железа
(IП). в качестве катализаторов MOryт быть также испальзаваны хлариды
Других металлов, такие, как АIСl з , SЬСl з ,
SbCI 5 ,
а также иод.
Роль катализатора заключается в активации (поляризации) галагена,
который осуществляет электрофильное замещение в бензольном ядре.
В присутствии FеСl з хлорирование идет, например, по схеме:
н+
+ CI 2 --+ НСI + CI+
И Т. д.
В боковую цепь можно ввести галаген (правило БеЙЛьшmеЙн.а) в от­
СУТствие катализаторов на свету или при нагревании. Механизм замеще345
ния В этом случае радикальный. Для толуола эти превращения могут быть
выражены схемой:
CBtт.тeMO
СИЗ
ОСИzСI аСИСIZ
а СС1
I
~
I
~
I
з
~
6
+c1z
~
хлористый
беиэorрн-
беиэил
бензилиден
хлори.ц
СИЗ
катализато
~
хлориcrwй
СИз
9
аа
~I
и
СI
ЭффеlПИВНЫМ реагентом Д,ля введеНI1Я ХЛОр<l в боковую цепь является хлористый суль­
фУРIIЛ В ПРI·tСУТСТВI1И К<lтаЛlIТ11чеСКIIХ КОЛИ'lеств пеРОI(СIЩ" беНЗОltла: .
C(jH"CH:!
+ S02Cl2
(C(jH'iCO)202
.'
)C(jH 5CH 2Cl
+ S02 + HCI.
ПРl1 введеНИl1 в ядро бензола IlOда необходимо присутствие ОКl1СЛllТелеЙ. которые пре·
враЩ<lЮТ IIOД в более Сl1ЛЬНЫЙ электрофил HOI. В последнее время часто IIOДИРУЮТ IIOДОМ
Н трифтор"цет"том серебра. ИОДИРУЮЩI1М ре"гентом в этом СЛУ'lае ЯВJlяется аЦIIЛГИПОИОДИТ:
CF:!-СООАg
+ 12 --+ CF:!-COOI + AgI.
Галогены относятся к заместителям первого рода, и потому при галоге­
бензола второй атом галогена вступает преимущественно
нировании
в n-положение к первому. Однако галогены в отличие от других замести­
телей первого рода затрудняют замещение (по сравнению с бензолом) ..
При хлорировании n-фторхлорбензола третий атом галогена вступает
в O-ПОJlOжение к хлору, а не к фтору. Следовательно, решающее влияние
на порядок замещения оказывает индукционный эффект галогена (о-по­
ложение к атому фтора имеет большой положительный заряд, так как
-/F>
-/С\):
- 9P,~~p, +на
~
СI ~
I
"-фтор хлорбенэOJ\
I
3,4-днхлорфторбеи3OJ\
2. Замена аминогруппы галогеном через промежуточное образование
диазосоеДИl1ений (см. гл. 22). Этот способ позволяет получать любые га­
логенопроизводные, в том 'Iисле и фторпроизводные:
346
3. Любой галоген может также введен в бензольное ядро через феНI1лтаЛЛlljjДIПРИфТОРцетат ( с. 3:26).
..
а 4. Дnя ПОЛУ'lеIIIIЯ галогеНОПРОllЗВОДИЫХ с галогеном в БОI{ОВОИ цеПl1 ПРl1ГОДНЫ все метоы ПОЛУ'lеНlfЯ галогенопроизводных в ЖIIРНОМ ряду. Например. замещение Гl1ДРОI{СI1Ла гало­
~eHOM. обмен галогенов. присоединеиие галогеноводородов к непредеЛbFfЫМ соеДl1неНl1ЯМ.
аДl1кальнос галогеНllроваНI1е при освещеНИl1 и т. д.
р Сl1еЦIlф!1'1ССIШМ методом получения apOMaТl1'1eCКl1X галогеllОПРОИЗВОДНЫХ с ilTOMOM гало­
relfa в боковой цеПII является реаКЦlIЯ хлормеТИЛllрования. При действии на аромаТII'IеСЮ1е
соеДlllfСНllЯ формальдеГl1Дil и ХЛОРl1СТОГО водорода в ПРИСУТСТВI1If к,пализаторов. например
ХЛОРI1д1l IllIНKa. водород замещается хлорметильноii груПllOЙ:
C'f-I
1i fi+ СН ~ О + НСI
Z"CI
~
)
Сli:;
Н СН ~ СI + I-! ~ О .
МехаНIIЗМ этой реаКЦИl1 может быть представлен елеДУЮЩllМ образом:
Физические свойства
Галогенопроизводные бензола и
el'o
гомологов
-
жидкости ИЛИ крис­
таллические вещества. Из полихлорпроизводных бензола кристалличе­
ским является п-дихлорбензол (т. пл.
водных беНЗОJIа больше
1.
53
·С). Плотность галогенопроиз­
Температура кипения повышается от фторпро­
изводных к иодпроизводным.
Вещество
.. .
Т. ют .. ·С
.. .
C,;f-I)
188
Соединения с галогеном в ядре имеют «ароматический» заllах. Соеди­
нения с галогеном в боковой цепи в а-положении к ядру обладают раздра­
жающим действием (вызывают слезотечение).
В воде все соединения этого ряда нерастворимы. Растворяются в боль­
Шинстве органических растворителей.
Химические свойства
1. В отличие от галогеналкилов простые галоген.арu..лы -
весьма не­
реакционные вещества по отношению к нуклеофильным реагентам. Они
lIe реагируют с едким натром, солями серебра, цианидом, сульфидом и ал­
Коголятами натрия или с аммиаком в тех условиях, в которых IlpOTeKaeT
реакция замещения с участием галогеналкилов (см. гл. 2.1).
Хлор- и бромбензолы реагируют с едкими щелочами только IlрИ 300 ·С,
при более низких температурах в присутствии катализаторов, с аММИ(l­
ком - в присутствии солей меди или медного порошка при 180-200·с.
347
Подобная инертность наблюдается и у галогенопроизводных жирного
ряда с галогеном у двойной связи. Инертность галогена во всех этих слу­
чаях объясняют частичной двоесвязанностью его с ядром:
а также невыгодностью промежуточного карбаниона (гл. 15).
Реакции замещения галогенов в ароматическом ядре отличаются по
механизму от замещения в алифатическом ряду при действии нуклеофиль­
ных реагентов. Имеется много доказательств в пользу ступенчатого тече­
ния многих таких реакций. При действии сильных нуклеофильных реаген­
тов на галогенарилы сначала отщепляется галогеноводород с образовани­
ем очень реакционноспособного промежуточного продукта, называемого
дегuдробен.золом.
" т. е. наблюдается механизм «отщепление -
присо­
единение» (ариновый).
Скорость отщепления галогеН<I (при действии
в ряду: Вг> СI
KNH 2
в NН з ) падает
> F.
Дегидробензол далее быстро реагирует с присутствующим в системе
нуклеофильным реагентом, например с водой или <lммиаком, образуя про­
дукт присоединения:
~H
V
Веским ДОК<lЗ<lтельством в пользу именно такого механизма реакций
З<lмещения галогена в ароматическом ряду является тот факт, что входя­
Щ<lЯ группа не всегда занимает положение, которое освобождает галоген.
*
Следует
иметь
в
виду,
что
орбнтали,
образующие
третью
связь
в
молекуле
дегндробензола, не переl<рываются с 7t-орБI1талямн бензольного ){ольца и, следовательно, не
участвуют в сопряжен ни:
OJ:
анн Ilаходятся в той же ПЛОСКОСТII, что 11 кольцо. Перекрывание меЖдУ НI1МИ слабое. Связь
весьма реакционноспособна.
348
ТаК,
например,
гидролиз
n-XJIортолуола дает
эквимолярную
смесь М­
и п-крезолов:
си,
9
NaOH; [HzOI ..
34О"С
9.
си,
+
6~
ОИ
50%
50%
При аминировании O-XJIоранизола образуется исключительно м-ами­
ноанизоЛ:
ОСИ,
(Уl Сl NаNНz;LNНзl
~
-33"С
&1
ОСИз
..
~
НИ2
При аминировании меченного 14С XJlорбензола образуется равное ко­
личество Me'leHHbIX в 1-м и 2-м положениях анилинов:
~.
~NИz
Такие «перегруппировки» объясняются возможностью присоединения
нуклеофильных реагентов, например воды, к метилдегидробензолу по
тройной связи в двух направлениях:
hои
Н,О сн,
[6СИ']{V
~
Uои
НеОбходимо ЗRметить, что в некоторых случаях при введении других ЗRме­
СТителей в ядро подвижность галогена может резко возрасти. Это проис­
ХОдит, если в орmо- или пара-положениях по отношению к галогену на­
~одится электроноакцеПТОРНRЯ группа, особенно N02, а также СООН,
N, SО;зН. Легкость оБЫ'IНОГО нуклеофильного замещения ГRлогена
в
-iTOM
СЛУЧRе обусловлеНR тем, что ЗRмеетитель второго рода в 0- или
П-1I0J10жениях стабилизирует промежуточный а-комплекс путем чаСТИ'I­
ного перераспределения отрицательного ЗRряда (см. гл. 19).
349
Если галоген находится у углерода боковой цепи, связанного с бензо_
льным кольцом, то он легко вступает в обычные реакции нуклеофильного
замещения. Например, хлористый бензил легко гидролизуется ВОДНЫМ
раствором карбоната натрия, бромистый бензил реагирует с третичными
аминами с образованием четвертичной соли в 300 раз быстрее, чем
н-бромистый пропил.
Подвижность галогена в молекулах таких галогенопроизводных объяс­
няют особой УСТОЙ'IИВОСТЬЮ (благодаря сопряжению) катиона, возникаю_
щего при отщеплении аниона галогена:
©-СН 2СI
•
~ ~CH2
+
CI-
в связи с этим электронодонорные заместители увеличивают подвиж­
ность галогена (образуется более устойчивый катион), а электроноакцеп­
торные уменьшают ее.
Для описания целого ряда реакций нуклеофильного замещения атома
хлора в оМ- и n-замещенных хлористых бензилах пригодно корреляцион­
ное уравнение Гаммета (см. с. 343). Так, например, константа р ДIIЯ гидро­
лиза в водно-спиртовой среде при 30 ·С, протекающего по уравнению
Х
~ H2CI +Н 2О
~СНzОН +НСI
47.7% C 2HsOH •
30·С
Х
-2,178. Отрицательное зна'lение р показывает, что скорость реак­
ции определяется скоростью образования карбениевого иона. Зависи­
равна
мость константы гидролиза от зна'lения cr представлена на рис. 61.
2. С металлами ароматические гало­
генопроизводные дают металлорганиче­
-lgК
ские соединения почти с такой же лег­
8
костью,
..-N0 2
7
7
6
6
как
и
галогенопроизводные
жирного ряда, например:
C(;Hr,Bг
+Mg __ C(;HfiMgBг.
БJlагодаря этой особенности галогеН
в ядре легко может быть замещен раз­
личными группировками, например кар­
боксильной группой:
5
5
C(;HfiMgBг +СО 2 _ _ С(;Н,jСООМgВг.-!:!9.-.
СOJ11) (j~II:юiiIIOИ
КIIСJЮТЫ
__ С(;Н 5 СООН +MgCIBг.
Рис.
61.
ЗаВИСllМОСТЬ константы гидро­
лиза хлористого беНЗlfла от зна'lеllИЯ а:
р
= -2.178: -Ig~ = 5.608: г= 0.948:
s = 0.216
350
3.
Атомы водорода в ядре ароматиче­
ских галогенопроизводных способны з~­
мещаться.
галогенами,
нитрогруппо и ,
сульфогруппой И т. д. Все эти реакции проходят значи.тельно труднее, чем
в случае бензола. Атомы галогена ориентируют новыи заместитель в 0- и
n_положения. Так, при хлорировании хлорбензола получается главным
образом n-дихлорбензол, в меньших количествах ПОЛYLfается о-дихлор­
бенЗОЛ. Количество м-дихлорбензола НИЧТОЖНО.
МеНЬШ<lЯ реакционная способность галогенбензолов по сравнению
с незамещенным бензолом объясняется тем, что атомы галогенов облаД<I­
ют ОТРИll<lтеJlЬНЫМ индукционным эффектом и умеНЬШ<lЮТ электронную
плотНОСТЬ в беНЗОJlЬНОМ ядре.
Н<lПР<lВJlяющее действие галогенов обусловлено тем, что атомы Г<lлоге­
НОВ стабилизируют а-комплексы, отвечающие 0- и n-З<lмещению
С1
О
1?
х _~x
~
V~
Н
+
Н
&
1
_
+
Н
Х
+~
(1
и Ш):
+
С1
11
Н
_ах
11
-- III
Преобладание n-изомеров в ПРОДУКТ<lХ замещения объясняют дезакти­
вирующим влиянием <lТОМОВ Г<lлогенов Н<I о-положения по индукционному
меХ<lНИЗМУ.
4. Аl'oмаТllчеСl<l1е иодпроизводные способны давать соеДlIнеНIIЯ с раСШltрением ОктеТII
до деltеТII It более У аТОМII иода. Так. НlIпример. возможен слеДУЮЩltii ЦИI<J1 превращений:
1
ICl z
10
10,
6~6 нр~Щ. 6~6
СУществуют СОЛlt IЮДОНltя. например хлористыii дифеНИЛНОДОIНlit [(C1jH")2IjCI.
А. 1-1. Несмеяновым и Т. П. Толстой получены также значltтелJ.,НО менее устоiiЧllвые сою!
Д!IФеНllлбромонltя It дифенилхлоронltя по реакции (где Х = СI или Вг)
[C'jH"N:!j+BF"4+C'jH"x ---. [(C'iH,,)2 Xj+BF"4+N 2·
Отдельные представители. Применение
в ХИМической промышленности в особенно больших количеСТВ<lХ полу­
'I(lЮт И применяют хлорбензол. Он является промежуточным продуктом
в производстве феНОЛ<l, анилина, инсектицидов.
351
n-Дихлорбензол используют в качестве «лярвицида» (средство, Уби­
- вредителей сельскохозяйственных КУЛЬ­
вающее личинок насекомых
тур) и средства против моли.
Хлористый бензил является промежуточным продуктом в ПРОизводст_
ве бензилового спирта - важного полупродукта парфюмерной про­
мышленности (см. гл. 20. В).
ГЛА8А18
АРОМАТИЧЕСКИЕ СУЛЬФОКИСЛОТЫ
Ароматическими сульфокислотами называются соединения, содержа­
щие сульфогруппу SОзН в бензольном кольце или в боковой цепи. Разли­
чают моно-, ди- и трисульфокислоты, например:
бенэолсульфокислота
толуолсульфокислота (0- • .11- или
QO'"
n·)
.II-беНЗ0ддисульфокнслота
SO,H
ASO'H
НО3S-.ч._'
CU.ll-беНЗ0лтрисульФокислота
SОз Н
Строение сульфогруппы рассмотрено в гл.
7.2.
Способы получения
Сульфокислоты получают прямым сульфированием углеводородов или
их производных.
Монобензолсульфокислоту получают действием на бензол концентрИ­
рованной серной кислоты на холоду:
С6Н6
+HOS0 20H 42 C6H 5S0 20H +Н 2 О.
При понижении концентрации кислоты до 65% сульфирование прекра­
щается. Чтобы полностью использовать серную кислоту, реакцию верУТ
в избытке бензола и при нагревании. Образующаяся в реакции вода отго­
няется с избытком бензола, который (после отделения от воды) вновь на­
правляется в сферу реакции.
352
Для отделения сульфокислот от серной кислоты пользуются различия­
и в растворимости их солей. Кальциевые и бариевые соли сульфокислот
•
~ерной кислоты. Иногда выдел~ют сульфокислоты в форме натриевых со­
м.
астворяются в горячеи воде несравненно лучше соответствующих солеи
лей высаливанием (повареннои солью).
Сульфирование проходит по обычному механизму электрофильного за­
метениЯ. Активным электрофильным агентом являются прежде всего ион
НзSО;, а также Н З S 2 О; и другие гидраты SОз, например НЗS40~з:
-~
OI
~
?Н
-НО ©,Н
I
+Н 1О
+ SO-он ~
ОН
+
SO,"
Н
- ОSОз
I
~
~
Наиболее активным электрофильным реагентом является триоксид
(VI). Три атома кислорода сильно уменьшают электронную плот­
ность на атоме серы. Поэтому когда научились получать в промышленных
масштабах стаБИJ/изированный триоксид серы SОз (1947), сульфирова­
серы
ние стали проводить с его помощью:
ОН может быть использован в стехиометрических количествах. Продукты
реакции не содержат избытка серной кислоты.
Важным электрофильным реагентом является также пиридинсульфо­
Триоксид (см. гл.
30):
Когда применяют дымящую серную кислоту или 50з, может образо­
ваться немного сульфона:
C(jH,,-S020Н
+ С(;Н(; + SОз ~ C6H5-S02-C6H5 + H2S0 4·
СУJlhфОIl
Он нерастворим в воде и может быть удален после разбавления сульфиру­
Ющей смеси.
ди- и трисульфокислоты получают сульфированием ароматических уг­
JJеводородов дымящей серной кислотой при нагревании и в присутствии
катализаторов (Ag2S0 4 и др.). Сульфогруппа при электрофильном заме­
Щении ориеНТИРУf·Т новый заместитель в .мета-положение.
Гомологи бензола сульфируются в орто- и пара-положения.
12 Зах. 181
353
Физические и химические свойства
Сульфокислоты
-
кристаллические вещества, растворимые в воде;
гигроскопичны.
Сульфокислоты играют большую роль в химии соединений аромаТИче_
ского ряда, так как сульфогруппа способна к обмену на другие Группы. до
не которой степени роль сульфокислот в ароматическом ряду наПОМинает
роль галогенопроизводных в жирном ряду.
Реакции сульфокислот можно разделить на три вида: 1) реакции суль­
фогруппы; 2) реакции замещения СУЛЬфОl'РУППЫ другими остатками;
3) реакции бензольного ядра.
1. Реакции сульфогруппы. К этой группе реакций относятся, напри­
мер, следующие:
1)
образование солей (сульфокислоты
-
сильные кислоты):
C(jH"SO;IH +NaOH - . C(jH"SO;!Na + Н 2 О;
2)
образование хлорангидридов (сульфохлоридов):
C(jH"S020H + PCI" - . C(jH"S02C1 + POCI;I + HCI.
(iСII:ШJ1CУJ11,фоХЛОР11Д
Однако сульфохлориды обычно получают действием хлорсульфоновой
кислоты на углеводороды:
C(jH(j +2HOS0 2CI - . C(jH,jS02C1 + I-I l SО 4 .
Хлорангидриды сульфокислот,
подобно хлорангидридам карбоновых
кислот, можно превращать в эфиры, амиды и т. д.:
C1jH"SOlCl + NIIOC21-I" - . C(jI-I"SО20С21-I" +NиСI;
,ТШЮВl.,ii ,Фнr
(iL'IJ:ЮJ1~УJII.фОКI'~JIОТI.,
C(jI-I"SО2С1
+ 2NH;! - . C(jl-I"S02NH2 + NH 4CI.
(iС'I:ШJ1CУJ".Ф~МИJL
Эфиры сульфокислоm
-
жидкости или твердые вещества. Хорошие
-
кристаллические вещества, способные рас­
алкилирующие средства.
Амиды сульфокuслоm
творяться в щеЛО'lах. При действии хлорноватистой кислоты или ГИПОXJID­
ритов атомы водорода в амидах сульфокислот замещаются галогеном:
C(jH"S02NH2 + 2HOCl---+ CljHiiS02NCI2 + 2H l O.
В технике применяют как окислители натриевые соли монохлорамидов
арнлсульфокислот:
дихлорамин
Б (C 6HsS0 2 NCI 2 )
и
хлорамин т
(n-СН з -С 6 Н 4 SО 2 NСINа). В лабораторной практике их используют ДIIЯ
галогенирования и алкоксиr'алогенирования;
З) образование тиофенолов при энергичном восстановлении сульфО­
кислот цинковой пылью в растворе серной кислоты:
C(jH"S020H
354
Zn+H 2S0 2 ) CfjH"SH.
11.
1.
Реакции замещения сульФогруппы.
Гидролиз. При действии перегретого водяного пара в кислой среде
СУJ1l,ФОКИСЛОТЫ дают исходные ароматические углеводороды:
C(jH"SO:\H + Н 2 О +:t C(jHtj + H2S0~
возможный механизм (электрофильное замещение):
~I SОзН
cr
Обратимость реакции сульфирования ароматических соединений по­
зволяет использовать сульфогруппу в качестве блокирующей или направ­
ляющей группы (в м-положение) с последующим удалением. Например:
QдSОз Н
2.
Реакция щелочного плава. При сплавлении солей сульфокислот
с едкими щелочами образуются феноляты. Это важнейший процесс полу­
чения полупродуктов в промышленности красителей:
C(;H"S020Nn +2NnOH ~ C1jH"ONa + Nn~SO:\ + 1-120
феllOJI>IТ
IIНТрl1Я
2Cljl-l,jОNiI
+ H 2 S0 4 ~ 2C 1;H,PI-I + NII2S04
З. При сплавлении солей сульфокиолот с цианидами получаются ни­
трилы. Поэтому реакцию сульфирования можно использовать для пре­
вращения <!роматических углеводородов в кярбоновые кислоты:
C(jH"SO:\Nn + NIICN ~ C(jH;;-СN + Na2S0:\
C(jl-l,;-CN
Н 2 О(НХ)
C(jH,,-СООН + NH 4 X
Ш. Реакции бензольного ядра. Сульфогруппа зятрудняет электро­
фильное замещение и ориентирует новые заместители в мета-положение:
03"
(У
I +Br
~
qsозн
1 -
~
I
+
"Вг,
Br
А<-6ромсульфобенэол
тогд<! как при сульфировании галогенобензолов получаются почти исклю­
'iительно пара-галогенсульфокислоты.
355
Применение
Ароматические сульфокислоты широко применяются в технике. СУJlЬ­
фонаты натрия используются в производстве фенолов (сплавление с ед­
ким натром). Натрийсульфонатные группы обычно присутствуют в пря­
мых (субстантивных) красителях, они сообщают красителям раствори_
мость в воде. Большую роль в современной медицине играют суль­
фамидные препараты (гл. 21. Б. 1).
ГЛАВА
19
АРОМАТИЧЕСКИЕ НИТРОСОЕДИНЕНИЯ
Ароматическими нитросоединениями называют вещества, содержащие
бензольное кольцо и нитрогруппу В ядре или в боковой цепи. Примерами
таких веществ являются нитробензол C6H 5N0 2 , нитротолуол (0-, nи .м-изомеры) СН з -С 6 Н 4 -NО 2 , фенилнитрометан C6H 5 -CH 2N0 2, дн­
нитробензолы (0-, n-, м-изомеры). Строение IНIТРОГРУППЫ описано
в гл. 8.2.
Нитросоединения с нитрогруппой в ядре являются полупродуктами
в синтезе красителей, применяются как взрывчатые вещества, раствори­
тели, душистые вещества и т. д.
1. НИТРОСОIЩИНЕНИЯ С НИТРОГРУППОЙ В ЯДРЕ
Способы получения
Нитросоединения с нитрогруппой в ядре получают нитрованием арома­
тических углеводородов смесью азотной и серной кислот (нитрующая
смесь):
C(jH(j
+ HON02
H.)SO~
С!-{ NO 2 + Н 20
~ (; ii
При нитровании нитробензола вторая нитрогруппа вступает в мета­
положение. Реакция идет в более жестких условиях: требуются более вы­
сокая температура, концентрированные кислоты. Третья нитрогруппа
вводитсЯ' с большим трудом также в м-положение. При пятидневном на­
гревании дннитробензола с большим избытком дымящих азотной и серной
кислот выход три нитробензола составлят только 45%:
NO' qN02 NO'yNO'
О1- (J
1- 1I
~
356
~
~
NO.
~
NO.
Полинитросоединения с другими положениями нитрогрупп можно по-
ЛУI!IJТЬ только обходными путями, например окислением нитроанилинов:
Z ~
~ I И СFзС-О-ОН.
О(
~
~
I
((NO'
NO.
~
N0 2
При НilЛИЧИИ В ядре заместителей, облегчающих нитрование, удается
в обычНЫХ условия ввести три нитрогруппы. Так, например, толуол нитру­
етсЯ по следующей схеме:
СИз
Л-NО 2
U
СИз
..
N02~N02
U
~
СИ
О {~H' ~ ':н,
HO~HO'
~qN~
62%
. ,. 9
"
N0 2
N0 2
При НИТРОВilНИИ гомологов бензола, содержащих два разных замести­
теJIЯ, сказывается стерический эффект. Если, например, эти заместители
НilХОДЯТСЯ в n-положении, нитрогруппа становится рядом с меньшим за­
меститеJlем:
~N02
У
СН( СНЗ)Z
н
Скорость реакции нитрования зависит от природы объекта нитрования
COCTflBa нитрующей смеси; для каждого соединения существует оптима­
JlbJJЫЙ состав. Так, при нитровании нитробензола оптимальный результат
ДОСТигается при 90%-ной концентрации серной кислоты. Снижение ее
концентрации до 80% 1I0нижает скорость реакции в 3000 раз.
Механизму нитрования посвящено большое количество работ. В на­
СТОЯщее время доказано, что в растворе азотной КИСJlОТЫ в серной кисло­
Те УСТilНill3J1ивается равновесие:
2H 2S0 4 +HNO;J ~ NO~ + H;IO+ + 2HSO-:j.
АЗОТНilЯ КИСJlота в условиях нитрования диссоциирует по схеме:
2HON0 2 ~ NO~ + NO;; + Н 2 О.
:~57
Присутствие в кислотной смеси иона нитрония NO; подтвеРЖДено
многими способами. Так, например, установлено перемещение аЗОТсодер_
жащего ионя при электролизе к катоду. Найдена характеристическая час­
тота в спектре комбинационного рассеяния для этих смесей, которую
можно отнести только к иону нитрон ия. Выделена соль нитрония с ХЛор­
ной кислотой состава NO;CI04'.
Процесс нитрован ия с участием ионя NO; трактуется как замещеНие
водородя, причем отщепляющийся водород связывается с гидросульфат_
ным ионом:
©
О +
Г~H
L~
NO; • •
] ~ &N0
J ~
HSO-
NO
2
+
H 2S0 4
HIITpoBaHlle можно ПРОВОДJ1ТЬ 11 раствором азотной IШСЛОТЫ в уксуёном ангидриде. В этом
- ацеТJ1ЛНl1трат:
случае НIПРУЮЩНМ реагентом является СIJJlЫiЫЙ ,лектрофил
Физические свойства
Мононитросоединения
-
жидкие или твердые вещества, бесцветные
или бледно-желтые. Они тяжелее воды и в ней нерястворимы. Обладают
запахом горького миндаля. Ядовиты. Особенно ядовит нитробензол, так
как он труднее удаляется из организма (в виде аминофенола), чем его го­
мологи (в виде аминобензойных кислот).
Нитросоединения кипят при очень высоких темперятурах. Это связано
с полнрностыо нитрогруппы, обусловливающей сильное взаимодействие
между молекулами. Блягодаря высокой полярности нитросоедннения мо­
гут рястворять такие вещества, которые не растворяются в обычных рас­
творителнх, например природный краситель индиго (см. гл.
28.4).
Химические свойства
Химические свойства нитросоединений ароматического ряда обуслов­
лены присутствием в молекулах нитрогруппы и бензольного ядра и их вза­
имных влиянием друг на друга.
1.
Наиболее важное свойство нитрогруппы
-
ее способность вос­
станавливаться в аминогруппу. Впервые нитробензол был восстановлен
в анилин с помощью сульфида яммония в
1842
г. Н. Н. Зининым В Каза­
ни. Это открытие сыграло исключительную роль в развитии химичесКОЙ
технологии,
особенно
в
области
синтеза
крясителей,
медикаментов
и фотохимикятов.
Ароматические нитросоединения в зависимости от условий восстанов­
ления дают различные промежуточные продукты. Ароматические амины являются конечными ПРОДУКПIМИ восстановления. Обычно они образуют­
сн в кислой среде. В нейтральной, щелочной и слабокислой среде можно
задержать восстановление на различных промежуточных стадиях. иссл е -
358
дованием схемы восстановления иитросоединений занимались Ф. Габер и
В. О. Лукашеви;. Ниже приведена современная схема восстановления
нитросоединении:
~ /O-f-' с н
'1
'1."
+
C·J-I . . N,
1;
" "1 "ОН
Н
п-
NO
11
э С Нr.- NHOH ~
4 С Н
----
IIIПР"()СШЮJl
1)
1.
111
ФСJlIUII"ИДIЮК":IIШIМШI
5-
NH
1\'
flllltJIИII
2l
!)
'16,.,_.",
с,;НгN02~ C'ih:.-N=N11-С'i!-l,;2-C,;H,,-N=N-С'iН" ~ C'iH"NH-NНС'iН"
+111
V
О
ЮIIКl.:llсоt:j\ИIIСIIIIС
У\
VJJ
ft:ШССICilНIIСIIIIС
1'ltдP~:IO(iCII:t(JJI
(ЮI)(il'IIЖJJI)
(~:tIIKCH(j~II:lf)J1 )
в неЙТР(JЛЫIOЙ и кислой среде идут реакции 1-4, причем в кислой сре­
де не удается выделить промежуточные продукты. В нейтряльной среде
можно выделить нитрозобензол и фенилгидроксиламин. В щеЛО'IНОЙ сре­
де нитро- или нитрозобензолы конденсируются с фенилгидроксилямином,
обрязуя iIЗоксибензол (идут реакции 5-7).
Рязличные продукты восстяновления можно получать методом элект­
ролитического восстановления. В зависимости от потенциала ня электро­
дах оБР<lЗУЮТСЯ различные вещества.
Схема получения некоторых промежуточных продуктов ХИМИ'lеского
ВОССТ<lновления <lроматических нитросоединений с указанием условий
восстановления приведена ниже:
О
~
f
<:11,.011
INи()111
Cr,H"N0 2
..
C'iH,,-N ~~:'iHr,
+SnCl.1 NиО 111
SnCl 2
INиОIl( C'iH"N N-С(iНr.
~
IN:~;1l1
~ZllINИОIII
C,;Hr.-NН-NН-С,;Н"
ZlllNaOll1
-----'
2. Ароматические ЮlТросоединения, как и бензол, способны к Р<lЗЛИ'I­
ным ре<lКЦИЯМ замещения водородных атомов бензольного кольца. Ни­
ТРОгруппа в реющиях электрофильного замещения З<lтрудняет вступление
нового заместителя в ядро и напрявляет его в мета-положение.
В ре<lКЦИЯХ нуклеофильного замещения нитрогруппа направляет новые
3(Jместители в 0- и n-положения. Так, при нагревании нитробеНЗОЛ<l с по­
РОLIJКООбразным КОН получается смесь 0- и n-нитрофенолятов:
359
3.
Благодаря сильно выраженному электроноакцепторному характеру
нитрогруппа оказывает значительное влияние на ятомы и группы, находЯ_
щиеся по отношению к ней в 0- и l1-положениях. Тяк, в случае 0- и n-ни­
ТРОХJlOрбензолов галоген под влиянием нитрогруппы приобретает высо­
кую подвижность и легко замещается на гидроксил, алкокси- или амино­
группу:
Тяк же легко замещается гидроксилом, алкокси- или аминогруппой
одна из нитрогрупп в 0- или n-динитробензоле.
Все эти реакции проходят по механизму аромятического нуклеофиль­
вого замещевия. Увеличевие подвижности различных заместителей в 0и п-положениях по отношению к нитрогруппе связано с тем, что под влия­
нием
нитрогруппы
атом
углерода
поляризуется
положительво
и
легко
взяимодействует с атакующими анионами, образуя стабилизированный
сопряжением с нитрогруппой (J-комплекс:
У"величеНllе ПОДВI1ЖIЮСТН в (J-положеНI1I1 в случае ТРltНI1тросоеДlшеНl1l1 распространяет·
ся 11 на водородные атомы бензольного ядра. 1al<, ТРIНlliтро6ензол ОКl1сляется в щелочноil
среде гексацнаноферратом (Ш) каJ1lIЯ в ТРНlIllТрофенол. а с ГlIДIЮКСl1J1амНlЮМ образует амин
(mшрамид):
н
~H*HO'
~I
•
O~VN~
~I
NO.
N02
Н
NH2
~NVO'
N02
360
(о)
K 1[FB(CN),]
NH2 0H
•
~NqNO'
N02
ПРII КИПЯ'lеНIIII с водоii тринитробензойная КlICJ\ОП'1 декарБОКСI1Лllруется:
СООН
О'НуНО'
O'N'Q'NO'
~
-
1
~
НО.
I
+ со.
НО.
в прИСУТСТВИII нитрогруппы большую подвижность преобретают водородные атомы ме­
Т\IЛЬНОЙ группы. благодаря чему TaКlle соедl1нения вступают во всевозможные реЮ(ЦIII1 КОН­
денсаЦIIII. Il-НIIТРОТОЛУОЛ при нагревании со спиртовым раствором КОН ОКllсляется ЮIСЛО­
родом Rоздуха в ДИНltтРОСПlльоен:
20tN~"'Hl
+ 02 "=Г-2НzО
o.hOch=chO-'НО.
n,n· -динитростиnьбен
ДII-
11 ТР"НIIТРОТОЛУОЛЫ КОf\Денсируются с бензоiiным альдеГI1дОМ, образуя ди- 11 TP"HfIT-
РОСТИЛuбены:
O'N-Q:CH 1
+ ОСН-О
НО.
4.
I-Iитрогруппа может быть замещена водородом при действии шt ни­
трососдинения борогидридом натрия.
5. Иfпересной особенностью нитросоединений является их способ­
НОСТЬ образовывать «комплексы с переносом заряда», например с аро­
матическими углеводородами,
кислотами. Нитробензол дает комплекс
с серной кислотой. Тринитробензол и ТРИНИТРОТОЛУОJl образуют Iюмплек­
сы с многоядерными ароматическими углеводородами, стильбеном, гекса­
метилбензолом. Такие комплексы часто имеют характерную интенсивную
окраску и 'Iсткие температуры плавления. Так, комплекс ТРИlIитробензола
с нафталином
-
желтые кристаллы с т. пл.
ные кристаллы с т. пл_
с т. пл.
227
164 ·С,
с бензпиреном
153·, с антраценом - крас­
- ярко-красные кристаллы
.с.
В Этих молекулярных соединениях осуществляется донорно-акцеrпор­
lIая связь, причем нитросоединение являетя акцептором электронов:
N02
.
~NO'
~СНЗ
CH~
СН з
Отдельные представители. Применение
НитрОбензол (т. кип. 210 ·С) получают в больших количествах нитро­
вавнем бензола. В чистом состоянии - бесцветная жидкость в запахом
ГОРЬКQI'О миндаля. Нерастворим в воде. Тяжелее воды. Ядовит. Является
ЗБI
растворителем ДJlЯ некоторых веществ. Применяется почти исключитель_
но в производстве анилина.
Тринитробензол получают с плохим выходом при нитровании бензо­
ла. ОБЫ'IНЫЙ путь получения - окисление и декарбоксилирование три­
нитротолуола. Т. пл. 172 ос. Сильнодействующее, но маЛОДОСТУПНое
взрывчатое вещество.
Нитротолуолы
получают нитрованием толуола.
n-Нитротолу_
ол - кристаллическое вещество. НИТРОТОJlУОЛЫ применяют ДJlЯ получе­
-
ния толуидинов
важных полупродуктов в производстве красителей.
Тринитротолуол (тротил, тол) получают нитрованием толуола. Жел­
тые кристаллы. Т. пл. 80,6 ос. Важнейшее взрывчатое вещество.
I-Ill1nf/ОАIУСКУСbl ТIIЛЬНОЙ
полинитросоединения ароматичеСКIIХ углеводородов с треТIIчнобу­
rpynnol1:
02N~
Ус(СН з)з
NO.
Имеют запах. напоминающий МУСКУСНЫЙ. ПРlIменяется в парфюмеРIII'. преимуществен­
но д.nя «ОТДУШЮI» дешевых сортов мыла.
2. НИТРОСОЕДИНЕНИЯ С НИТРОГРУППОЙ В БОКОВОЙ ЦЕПИ
Способы получения. Нитросоединения с нитрогруппой в боковой цепи
получают
теми
же
методами,
'по
и
нитросоединения
жирного
ряда
(гл.
8.1).
1. Нитрованием
гомологов бензола разбавленной азотной кислотой
(реакция Коновалова):
C'jH,,-СН: 1
+ HON02 --+ C,jH,,-СН 2 NО 2
+Н 2 О.
Нитрующим агентом в этом случае является радикалоподобный диок­
сид азота.
RH+NO';--+ R'+HN0 2:
2.
R'+ NO'; --+RN0 2 .
Реакцией галогенопроизводных с галогеном в боковой цепи с ни­
тритом серебра:
СнН г,-СН 2 С1
3.
+ AgN0 2 --+ C(jH,,-СН 2 NО 2 +AgCI.
Декарбоксилированием
а-нитрокислот
с
карбоксильной и нитро­
ГРУППОЙ в БОl<ОВОЙ цепи. Это оБы'ныый метод получения фенилнитрометана:
_
_
С •. Н,-СН .. +
.., I
CN
362
<
_
CH,ONO..
•
<
IN~OC}lr.1
-ClI})11
)1
C•. H,-CHN02
,.,
I
CN
INнОЩ+211.,D
-NII"
-)1
физические
и
химические
свойства.
Нитросоединения
ядя - жидкости или твердые тела. Плохо рястворимы в воде.
этого
р Наиболее важным свойством нитросоединений является способность
восстанявливаться и образовывать соли.
1.
Нитросоединения
восстанавливаются
рязличными
способами до
аминов. Эта реакция отли'шет их от эфиров азотистой кислоты:
C 1i Hr,-СН 2 N0 2
2.
--+ C 1i H,,-СН 2 NН 2
Со щелочами нитросоединения образуют соли ацu-формы:
+/O-NаОI!
+/0- 11.,SO,
/0
ChH,,-сн -N~ Е
.)0 Cr,Hr.-СН=N"
Е)о C1iH,i-СН=N"
"о 112S01
ONa Nи()11
он
При действии на эти соли кислот выделяется аци-форма нитросоедине­
ния, например ацu-фенилнитрометан желтое кристаллическое веще­
ство.
При
стоянии
ацu-форма
вновь
переходит
в
жидкий
фенил­
нитрометян.
Этя реакция отличает нитросоединения с нитрогруппой в боковой цепи
от нитроt:оединений с нитрогруппой в ядре. НитросоеДИllения жирного
ряда (первичные и вторичные) также растворяются в щелочах, OAllaKO BblдеJlИТЬ их aLlU-ФОРМЫ трудно.
З. Нитрососдинения этого рода могут вступаТl> в раЗJlичные реакции
замещения в ароматическом ядре. НитромеТИJlьная группа ЯВJlяется сме­
шанныM ориентантом. Чем дальше нитрогруппа от ядра, тем сильнее ал­
КИJlьная орта-пара-ориентация. Например:
содержанне JCгm"-изомера
48%
ГЛАВА
13%
20
АРОМАТИЧЕСКИЕ ГИДРОКСИСОЕДИНЕНИЯ
Ароматические гидроксисоединения - производные ароматических
Углеводородов - разделяются на две группы: фенолы IJ ароматические
Спирты. В феНОJlах ГИДРОКСИЛЫlая группа связана непосреДСТВСlll10 с яд­
ром. Ароматические спирты содержат гидроксильную группу в боковой
цепи.
363
В то время как енольные формы простых аJlьдегидов и кетонов нестой.
ки и переходят почти полностью в карбонильную форму, большинство фе.
нолов существуют исключительно в енольной форме:
(У О ...
~
.
аон
I
~
Большая устойчивость енольной формы фенолов обусловлена значи­
тельно более высокой степенью сопряжения по сравнению с кетонной
формой.
д. ФЕНОЛЫ
В зависимости от числа гидроксильных группы фенолы разделяются по
атомности: одноатомные, двухатомные и т. д. для бензола
-
до шести­
атомных. Называют фенолы либо тривиальными названиями, либо как
производные углеводородов:
О-он
нзс-О-он
феИQ/\
1.
n-крсзол
ОдноаТОМНblе феНОJ\bI
СпособblПОJ\учения
Существует несколько методов введения гидроксильной группы в аро­
маТИ'lеское ядро. Некоторые из них имеют промышленное применение.
1.
Сплавление солей сульфокислот со щелочами:
Этот метод широко используется в промышлешlOСТИ. Реакцию обычно
ведут при 320-350 ·С с едким натром, хотя лучшие выходы дает более
дорогое едкое кали. Выход фенола порядка 60-79% от взятого для суль­
фирования бензола. В технике используют открытый и автоклавныЙ
процессы.
Реакцию оБЫ'IНО рассмаТРl1вают как протекающую по мехашtзму SN2 Лг • хотя точно меха­
низм не YCTaHOВJ1eH. ДеГltДробензол не ЯВJ1яется здесь промежуточным продуктом.
Реакция СОПРОВО>Кдается побо'tными окислитеЛЬНЫМI1IJРОllессами. ПРlt сплавлеНИlt с ед­
КltM натром натриевой соли бензолсульфокислоты наряду с фенолом получаются ре:юрцUН
(1). флор()глюЦI.IН (11) и n.гН)UОКСII(JuфеНIIЛ (Ш):
он
~
Ц он
он
~
HO~OH
HO-Q-O-oн
11
111
в СЛУ'lае аЛI(l1Лфенолов ПРОИСХОДIП 'lаСТl1чное ОКltсление аЛКlIЛЬНЫХ групп.
364
ш
2. гидролиз галогенопроизводных. В технике получают фенол с хоро­
ими выходами из хлорбензола:
NaOH
C(jH"C1 Со; -250 .C~ C(jH"OH.
XJlOP, связанный с ядром, малоподвижен, и потому процесс ведут либо
в присутствии солей меди с 8%-ным раствором едкого натра в автоклаве
при 250 ОС, либо раствор щелочи пропускают вместе с хлорбензолом че­
рез систему трубок длиной более километра при 300 ос и давлении до
20 МПа (200 атм). (Механизм реакции был рассмотрен в гл. 17).
Процесс сопровождается
C1jH,,oC1jH,j. (). 11
образоваНltем побочных ПРОДУIПОВ: дифенилового эфира
I/·ОКСIIДltфеНltлов. Чтобы I·tзбеж/!ть обр/!зов/!нltя ЗН/!'lIпельных КОЛИ'lеств
;J.ефIIНItJIOUОГО эфир/!. его спеЦlt/!льно вводят в систему д,IIЯ смещения равновесия:
2C(jH,;OH
;::::!
C(jHr.OC(jHr. + Н 2 О.
Известно тнкже несколько к/!талитических процессов гидролиз/! галогенопроизводных
в паровой ф/!зе при обычном давлении (Рашиг).
З. Разложение гидропероксидов. По другому промышленному способу
фенол получают кислотным разложением гидропероксидов некоторых ал­
I<НJlбензолов. Так, гидропероксид кумола разлагается на ацетон и фенол:
у
Н
у-он
о-он
h,C-!-СН! Н,С 6Н' HsC-t-С:l,
+н+
-н2о
О +СЭН6 Л +[0]
~
1 iAiёiТU
01
1""
(ка';) ~
~
1 -
-
+
ОН 2
+
h,C-у-СН s
1
н,с-т-сн,
6 +~. 6
+СН,--'со-сн з
+ Н+
Побочными продуктами в этом процессе являются а-метилстирол,
П'КУМИJlфенол, 2,2-бис( 4-0ксифенил)-пропан.
Аналогично ведет себя гидропероксид вmор-БУТИJlБеНЗОJlа.
4. ОКИСJlитеJlьное декарБОКСИJlирование карбоновых КИСJlОТ. Реакция
ПРоходит при 200-300 ос в присутствии СОJlей меди (11). В реактор про-
ПУскает водяной пар и воздух:
соо"
9' I
(У
:::::,...
.
°2;
н2о. ((он
~ I
cu2+:::::,...
+
СО 2
Промежуточным продуктом В этой многостадийной реакции ЯВJlяется
салициловая КИСJlота. С помощью «меченых» атомов устаНОВJlено, что
365
гидроксил оказывается у атома углерода, находящегося в ортО-ПОЛОЖе_
нии
к
ятому
углеродя,
связанному
в
исходной
бензойной
КИСЛОТе
с кярбоксилом.
5. Действие на первичные яромятические амины язотистой КИСЛОТОЙ.
В кячестве промежуточных продуктов в этом процессе получаются аРОма_
тические диазосоединения (гл. 29):
V
~NHl
+HN02
;
+НСI
V
~N2Cl
..
+н 2о.
V
~OH
+ N2
+НСl
Диазогруппа зямещается гидроксилом при стоянии В кислом растворе
или, быстрее, при кипячении. Присутствие солей меди облегчает процесс.
6. Фенолы могут быть получены 1I непосредственным Оl\llслеНllем аромаТИ'lеских угле­
водородов по раДIIкальному механизму. Бензол ОЮlсляется в газовоii фазе кислородом в при­
сутствии lIода. ОЮlслеНllе в ЖIIДI\ОЙ фазе IШСЛОРОДОМ l<атализируlOТ соли меДII. Дnя окисле­
НlIЯ бензола IIСПОЛЬЭУЮТ таl\же cllcTeMbI Fe~ + + H20~. Ti:1+ + H20~ Н др.
Прямое элеlПРОфllльное ГIЩРОКСI1ЛироваНllе аромаТИ'lеСЮIХ углеводородов ОL-уществля­
етс!!
с
помощью
CF:1-CO-OOH
в
ЩJl1СУТСТВIIII
BF:1
IIЛlI
H20~
+(HF +BF;j)
или
H~O~ + AICI;j. Наllболее успешно метод пр"меllяется в случае 1.З.5-триаЛl\lIлбензолов.
Обы'lНО ПОЛУ'lаются смеси моно- и ПОЛllOllсисоеДlIнеНllii 11 XIHIOHOB:
7. Гомологи фенола можно получить аналогичными реакциями
из сульфо-, галогено- или аминопроизводных rOMOJlOrOB бензола. Однако
существуют и методы введения алкильной группы в ядро феноля. Алкили­
рование фенолов идет легче, 'leM алкилирование бензола и его гомологов,
благодаря яктивирующему действию гидроксильной группы. В качестве
катялизатора можно использовать хлорид цинка, а в качестве алкилирую­
щих средств
-
спирты:
~OH
V
Физические свойства
Фенолы -обычно кристяллические вещества, трудно растворимые
в воде. Летучи с парами воды. Обладают характерным запахом. являются
янтисептиками, очень ядовиты. При попадании на кожу вызывают ожоги.
С водой образуют кристаллогидряты с более низкой темперятурой плав­
ления, чем исходный фенол.
Химические свойства
у феНОJlОВ очень реакционноспособны как гидроксильная группя, так
и аРОМЯТИ'lеское ядро.
366
1.
ФенолЫ проявляют значительно большую кислотность, чем спирты
и
BOAR, OAHRKO как кислоты они слабее, чем угольная и карбоновые кис­
~~TЫ. Так, KOHCTRHTa диссоциации уксусной кислоты 1,8· 10-5; угольной
кислоты 4,9·10-7; синильной кислоты 7,2·10-10; фенола 1,3·10-10 и
воды 1,8· 10-16. Поэтому фенолы реагируют с раствором едкого натра
с обрRзованием фенолятов, однако не вытесняют СО 2 из карбоната на­
трИЯ. НRоборот, фенолы выделяются из растворов фенолятов угольной
кислотой:
Аг-ОН + Na+ + НО- +.t [АгОГNа+ + H~O:
[АгОГNа+ + CO~ + H~O ~AгOH + NaHCO:1.
Приведенные реакции используют для разделения фенолов и спиртов
ИЛИ КRрбоновых кислот.
Б6ЛЬШRЯ КИСЛОТНОСТЬ фенолов по сравнению со спиртами может быть
объяснеНR тем, что образование фенолят-аниона выгоднее, 'lем алкого­
ЛЯТ-<lниона в жирном ряду, так как в первом случае возможна делокализа­
I~ИЯ ЗRРЯДR и, следовательно, дополнительная стабилизация системы,
в случае же алкоголят-аниона такой возможности нет:
6--0-6
-6
t
-
Феноляты железа имеют комплексный характер. Их растворы интен­
сивно окрашены. Это используют для качественного открытия фенолов.
ФеllОЛ дает с раствором FeCI:J фиолетовую окраску, крезолы - голубую.
2. ФеllОЛЫ легко RЛКИЛИРУЮТСЯ при действии на феноляты галогено­
производных, особенно в присутствии порошка меди, а также при дейст­
вии на фенолы алкилсульфатов, эфиров сульфокислот или диазометана:
C"Ii"ONa +C~HiiBr~CljH"OClH5 + NaBr
ф~"~Т()JI
("ТIIJJф~II1IJЮlшit ·,фир)
CiIIШIOJI
э фир ы
нии с
Ф е н о л о в - устойчивые вещества. Однако при нагрева­
Na или NaNH 2 в инертном растворителе они расщепляются, как
и ,;,фиры жирного ряда. Щелочи на них действуют мало.
3. Фенол конденсируется с эпоксидом этилена с образованием фени­
ЛОПого эфира полиэтиленгликоля:
0-'ОН+
_
n (/\,
\fH~CHz
)
~
0-'O-!СНz-СНz-О]-Н
_
"
367
Такие эфиры обладают поверхностно-активными свойствами, особен_
но если в молекуле фенола присутствует алкильная группа. В этом СЛучае
алкилфенильная часть молекулы является гидрофобной, а ПОЛИЭтилен_
гликольная часть молекулы
-
гидрофильной.
Полиэтиленовые эфиры октилфенола, известные под названием ОП-7
ОП-IО (цифра в названии указывает ЧИСЛО остатков этиленгликоля х): '
CXH17-С(jН4-0-СН2-СН2-[О-СН2-СН2].
_ I-OH.
применяются ДJ151 очистки текстильных материалов.
4. Эфиры фенолов могут быть получены действием (!НГИДРИдов
или галогенангидридов кислот на феноляты или на растворы фенолов
в пиридине:
C(jH,;ONa + CH:iCOCl ~ C(jH,jOOCCH:i + N<lCI.
ФСНIIJlОlшil ,.фllР
ую..:уt:llOi'l ЮII.:JIOТI.I
Возможна этерификация фенола и кислот(!ми в присутствии H2S0 4
И НзВО;j в УСЛОВИЯХ азеотропной ОТГОНКИ воды.
5. ГИДРОКСИЛЫШЯ групп(! В фенолах с большим трудом замещается га­
логеном. При действии трихлорида фосфора получаются главным образом
эфИРЫ фосфористой кислоты:
ЗС(jН,;ОН
+ PCI:I~
(C(jH,-,О):iР
+ ЗНСI,
В случае пент(!хлорид(! фосфора т(!кже ПОЛУЧ(!IOТСЯ эфиры, но уже
хлорфеllОЛОВ. Этот ре(!геllТ хлорирует фенолы.
Замещение галогеном фенольного гидроксида достаточно легко прохо­
дит только тогда, когда в
0-
или n-положениях находятся электроотрица­
тельные группы, н(!пример нитрогруппа. В этом случ(!е промеЖУТОЧIIЫЙ
а-комплекс БОJlее устойчив БJlагодаря деJlокализации отрицательного за­
ряда с уч(!стием НИТРОГРУПIlЫ *:
О/СП РС1 ,(
O~NVNO~
I
~
--
O-N=O
СI
O~NVNO~
I
+ но
~
O-N=O
• Ни схеме не Ilзобрижены ГРИНI1'lные CTPYI<Typl,l. связанные с резон ин сом в бензольнОМ
ядре с УЧИСТlfем IIfПРОГРУППЫ.
368
б. При перегонке фенолов с ЦИНКОВОЙ пылью ГИДРОКСИЛЬЮIЯ группа
замеwа етсн водородом. Этим методом иногдя пользуются ДЛН определе­
вия структуры сложных фенолов:
C'iH"OH + Zп ---+ C'iH'i + ZпО.
7. Гидроксильная группа оказывает очень большое влияние ня ярома­
ти"еское ядро, увеличивая его реакционную способность в 0- и n-ПОJIоже­
ниях, По~томУ фенол очень легко вступает во всевозможные реакции за­
меwениЯ и конденсации. Гялогенирование фенола действием растворов
ГllлогеllОВ ИЛИ Гllлогенирующих средств идет с большой скоростью и преи­
мущественно в пара-положение. При хлорировании образуется много
о-изомера. Конечным аромnтическим продуктом гаJIогенировnния в ядро
являются тригалогенофенолы. Возможно дальнейшее галогенирование:
0Н
6+
17
~
I
Br~OH
BrvOH Br
ЗВr 2.
(-ЗНВr)
~
Br
B r v OBr
I ~
~
~ I I
-НВr
\ т)
Br
Br Br
Br Br
ПОЛУЧllющиеся вещеСТВII выделяют иод из иодида каJIИЯ.
Иод непосредственно не иодирует феНОJIЫ. Требуется применение
окислителей.
8. Нитрование фенола идет при действии разбавленной азотной КИСJIО­
ТЫ. ПОЛУ'lnется cMecl, 0- и n-нитрофенолов с преоБЛIIДЮlием o-изомеРIl.
Изомерные нитрофеllОЛЫ легко разделяlOТСН благодаря тому, что только
о-изомер обладает летучестью с водяным пnром. Большая леТУ'lесть
O-lIитрофеНОJIОВ объясняется обраЗОВlIнием внутримолекулярной водо­
родной свнзи, В то время как при ином расположении окси- и нитрогрупп
ВОЗIIИКIIЮТ межмолекулярные водородные связи:
неассоциироваииыii o-иитрафеИQll
O~N-O-'
он,·,о"}N
_
о'
О
-0-"
'1
_
~
O~N-o-'
ОН
_
он,·,оу
ассоциированный n-иитрофенOJI
. HIiTPOBilHlle фенолов в Рllзбавленноii IIзотноl1lшслоте ,!Дет через преДВiI\JlIтеJII,ное 1If1ТJ10.!IIPOBi\iIlIC С 1l0слеДУЮЩl1М окислеНI1ем НlпрозосоединеНIIЯ азотноii КlIслотоii. ЕСЛII добивJ.lТЬ
МО'JеВIIНУ.'I,ЛЯ jJllзрушеlНlЯ ilЗОТlIстоii кислоты (присутствующеii в ЯЗОТНОII КIIСЛОТС IIЛl1 оБРil­
.JОВ<lвшеikя ПРII ВОССТilновлениlt я:ютноii IШСЛОТЫ феfIOЛОМ). НIпроваfl11Я не ПJ1011СХОДИТ.
369
При дальнейшем нитровании концентрированной азотной кислотой По­
лучается тринитрофенол
-
пикриновая кислота:
ОН
ОН
JгN~2N~N02
OH/U
U~ он
6~ ~ ~ ~ ~"'.O'
~~NO'
у-у
N0 2
N0 2
При нитровании фенола MOryT протекать окислительные процессы.
Поэтому реакцию следует вести в мягких условиях.
9. При сульфировании фенолов получаются 0- и n-фенолсульфокис­
лоты. При комнатной температуре концентрированная серная кислота
дает главным образом о-изомер, в то время как при 100·С преобладает
n-изомер:
10.
Фенолы легко конденсируются с альдегидами: а) при действии ще­
лочных или кислых катализаторов на смесь фенола и какого-либо альде­
гида жирного ряда происходит конденсация в 0- и n-положениях. Эта ре­
акция имеет очень большое практическое значение, так как лежит в осно­
ве получения важных пластических масс и лаковых основ
C(jH ii OH+CH 2 0
н+ ИJlИ НО- » HOCH 2 -С 1i Н 4 -ОН (0_ или 11-).
При обычной температуре рост молекулы за счет конденсации фенола
с альдегидом идет в линейном направлении:
(Н'I _(roH
j H1_]~OHI
j hr[-(гoН
n н 1со+( n+ ОС.Н s ОН --:-:-~.
-
nн 2 о
~
~
n-!
НQволачиаsr смола (новолаки)
370
~
Если реакцию проводят при нагревании, начин~ется конденсация с 06ов "нием разветвленных молекул. Конечныи продукт становится
"
раз
нерастворимым;
б) конденсация фенолов с ароматическими альдегидами лежит в основе ПОЛУ'lения некоторых важных красителей трифенилметанового ряда
(гл.
25.2):
11.
Бл~годаря СКЛОННОСТli к оБР~ЗОВ~НIiЮ O"-I<ОМПлеI\СОВ в
()-
н /l-положеНIIЯХ MHoГlie
пронзводные фенолов. содерж~щие замеСТlfтели в ГIiДРОКСllльноii группе, способны пере­
ГРУППНРОВ1IТl,СЯ с перемещеНllем 'ПliХ замеСТlfТелей в SlДpo.
Т1II<. H~nrliMep, liзвестно, что деiiтерий леГI<О переХОДlfТ Ifз ГIfДРОКСliльноii группы в о­
н II-ПОJlOжеНIIЯ ядра:
~OH • • ~OO~ ~OH
DN
V~D
ПРII Н1IгреВalНШ ,фllРОВ фенолов с кислотаМli 1IЛI<IIJI переХОДlfТ в ядро с оБР1lзоваНllем ал­
l(lfлфенолов:
Q-0HL.OO-R ~R-о0Н
АлJlllльные ЭфllРЫ феНОJЮВ претерпевают эту переГРУППliРОВКУ пr1i простом H1IrpeB1I1iI111
(реШЩll.'l КЛJltlаена). Обр~зуются (}-замещенные фенолы:
О-о-сн,-СН=СН, -Q-°н
CHz-СН=СН z
к АЦllлuные 'фIfРЫ фенолов Прl1 деikТВIШ ЛIСI:\ преВР1lЩ1lЮТСЯ в IIРОМ1IТИ'lеСКllе Гllд)JOI\Сli­
~ТЩН'I. ПовышеНllе темпер~туры БЛIIГОПРIIятствует ЗlIмещению в (j-положеllllll (реакцuя
РlIСlI) (I-л.
23.3)( с. 412):
O-CO-R
~
()
ОН
~CO-R
~()
ПереГРУППНРОВЮI Кляiiзена 1I Фрнса могут идтlt в Зависимости от условий по ВНУТРИМОЛе_
кулярному (сuгШlfnропные nерег.РУПl1иР(){)Кll) It по межмолекулярному механизмам. Сиr_
матрапные перегруппировки КЛЯllзена идут по схеме:
При занятых o-положеНIIЯХ происходltт вторnя сиГматропная Ilерегруппировка с переме_
щением радикала в l1-положенltе:
12.
-
Вступленне пщроксильноi1 группы в ядро делает его менее устойчивым к действию
ОКlIСЛlпелеЙ. В заВИСIIМОСТИ от при роды последнего Ij условий проведения реакции получа;
ются РilЗЛИЧltые продукты.
Так. при ОКltслении феНОЛil пероксидом водорода
11 присутствни железного катализатора
получается с неБОЛI,шltм выходом nирокаmехин:
~OH
[ f.]
V
При окислеНlIII XPOMOBOii смесью образуется п-бензохинон и продукты его дальнейших
изменений:
-
6
о
ПРIt более энеРПl'lНОМ деi\ствии ОКНСЛlпелеt"1 разрушается бензольное ядро.
Благодаря СКЛОННОСТlI к окltслению фенолы могут 'жрашиваться пр'" храненltи сдоступо м
воздуха. Образованltе окрашенного вещества свяЗано с промежуточным образованием
хинонов.
13. При гидрировании водородом в ПРI1СУТСТВИИ катализаторов фена­
Jlы-превращаются в спирты ряда циклогексана. Так, из фенола получаюТ
циклогскс;шол:
Эта реакция применяется в производстве капрона (перлона), анида
(наЙ.JIOНR ).
372
Отдельные представители. nрименение
фенОЛ -
кристаллическое вещество, т. пл.
воряется в воде (при
15 ос
-
43
около 8 %).
ОС, т. кип.
С
181
ОС, рас-
водой дает гидрат
(т. ПЛ. 16 ОС), называемый обычно карболовой кислотой. Даже неболь­
шие количества воды сильно снижают температуру плавления фенола.
фенОЛ обладяет характерным едким запяхом. Он вызывает ожоги ня
коже. Является одним из первых примененных в медицине антисептиков.
ФеноЛ содержится в моче человека и животных, так как белковые ами­
нокислоты, содержащие бензольное кольцо, при расщеплении в организ­
ме дяют фенол.
Фенол получают из каменноугольной смолы, а также СИlпетичеСКl1МИ
методами: из хлорбензола, щеJlОЧНЫМ плавлением из солей бензолсульфо­
кислоТЫ, из бензола и пропилена через кумол, из бензойной кислоты и др.
Фенол применяется в больших количествях для получения плаСТИче­
ских масс (конденсация с формальдегидом), лекарственных препарятов
(сялициловая кислота и ее производные), красителей, взрывчатых ве­
ществ (пикриновяя кислота).
Метиловый эфир фенола ан.изол - жидкость, т. кип. 153 ос. Приме­
няется для получения душистых веществ и красителей.
Этиловый эфир фенола
-
фен.еmол. Т. кип.
172
Ос.
Крезолы выделяют из каменноугольной смолы в виде смеси всех трех
возможных изомеров (трикрезол). о-Изомер отделяют от двух других пе­
регонкой (т. кип. 191 ОС). М- и n-Крезолы (т. кип. 203 и 202 ОС) разделя­
ют су.%фированием. Сульфокислота,
полученная из м-крезоля, легко
nоДвергяется гидролизу.
В лябораториях чистые вещества получают из соответствующих ями­
нов (через диазосоединения, гл. 20).
Крезолы применяют в производстве пластических масс, красителей,
дезинфицирующих средств. Смесь трикрезола с мылами и другими веще­
ствями
под
названием
лизол,
к.реолин.
применяют
в
ветеРИIIЯРIIОЙ
nряктике.
Токсичность гомологов фенола уменьшается, я бактерицидняя ЯКТив­
Ность увеличивяется по мере усложнения ялкильной группы. Тяк, бакте­
РИЦИДНi-lЯ яктивность крезола в два раза выше, чем феНОJlа, а ЯМИЛ-М-кре­
ЗОЛЯ - В 250 раз.
ТII.,щл (2-JJЗОПРОПliЛ-5-метилфенол) - кристаллическое вещество в т. пл. 51 ос JJ
Т. J\IJП. 2:32 'с. Содержнтся во многих эфирных маслах. ПРJiмеllяется как аНТl1септик в .1убо·
ВрачеGноi1 праКТlше.
Его JJ30Mep - КlIрlШКfЮЛ
масле.
-
ТaJ<же содержится в эфЩJНЫХ маслах. наПРJJмер в МЯ1'ном
А не/l1l1Л (II-пропениланизол) -
ется в парфюмеРJJJt.
основная часть aHJiCOBOrO и УJ<РОПНОГО масел. ПР1Jменя­
~H ~H ~
СН(СНЗ)2
ТИМDЛ
СЩСНЗ)2
карв"рап
сн=сн-сн з
анетол
373
2.
Двухатомные фенолы
ОН
~H
V-OH
~
6-0Н
ОН
резорцин
пирокатехин
rидpoХИИQН
Способы получения. Двухатомные фенолы ПОJlучают теми же общими
методами, что и одноатомные, однако для каждого из них имеются ограни­
чения, делающие невозможным образованием фенола с данным располо­
жением гидроксильных групп. Так, например, при щелочном плавлении
солей м-бензолдисульфокислоты с хорошим выходом получается резор­
цин. о-Бензолдисульфокислота дает при этом о-фенолсульфокислоту
и немного пирокатехина. n-Бензолдисульфокислота, получающаяся тер­
мическим диспропорционированием бензолсульфокислоты, при щелоч­
ном плавлении д(!ет только n·-фенолсульфокислоту, не образующую далее
гидрохинона.
Пирокатехин и гидрохинон можно получить восстановлением соответ­
ствующих хинонов. о-Хинон мало доступен. обы'lоo получается окисле­
нием пирокатехина.
Физические и химические свойства. Двухатомные фенолы
-
крис­
таллические вещества, легко растворимые в воде.
В химическом отношении для них характерно большинство реакций од­
ноатомных фенолов. Однако в их те'lении имеют место и специфические
'lepTbI.
1. Двухатомные фенолы обнаруживают более сильные кислотные
свойства, чем фенол. Благодаря этому они способны образовывать соли
не только с щелочными метяллами. Для пирокатехина, например, харак­
терно выпадение нерастворимой свинцовой соли при его прибавлении
к раствору ацетата свинца:
~H
~OH
+ (СНэСОО)2 РЬ - ~O>Pb +
~O
2СНзСООН
2. Реяк\J.ИИ замещения и конденсации с У'lастием водорода ядра .идУТ
у двухатомных феНОJlОВ еще легче, чем у фенола. Даже в мягких усл~иях
удается ПОJlучать из них ди- и тризамещенные фенолы:
HOYfJ
~
ОН
374
+
,нощи
_
но))Н + ,",о
УSОз Н
ОН
q
~
OH
I
+
3HON02-
ОН
~Nq::
ОН
стифИИНD8а. КИСЛО1'S
З. Двухятомные фенолы очень легко окисляются и являются сильными
восстнновителями. Пирокатехин и гидрохинон окисляются с образовани­
еМ соответствующИХ хинонов:
JvoH Jvo
V
~U
о-ХИНОR
~-6
.
ОН
О
4. Ароматический характер у двухатомных фенолов, особенно у резор­
цина, менее выражен, чем у фенола, и потому здесь ярче проявляется спо­
собность к таутомерии '. Так, резорцин способен гидрироваться водоро­
дом в момент выделения с образованием гидроаромаТИ'lеского соединения
дигидрорезорциня:
ОН
I
с
HI~
. . . .си
HC~
~""vH
~./
-
+2~I
....
СН
Отдельные представители. Пuрокатехuн. Т. пл. 104 ·С, т. кип.
245 0 с. При хрянении темнеет. С FеСl з дает зеленое окряшивяние, пере­
ХОДЯЩее в крясное при добавлении соды. Встречается во многих растени­
ЯХ, в ЛОlIJНДИНОЙ моче. Особенно распрострянен его метиловый эфир, IIЯ­
ЗЫl3нется гваяколом.
ПИРОКiпехин получают в промышленности из гваякола путем его деме­
ТИ.1Ировяния нагреванием с АIСl з или другими методами или из сялицило­
Вого яльдегида действием пероксида водорода и щелочи:
~CHO
~OH
... Й
салиципо
альдегид
Гlрименяется кяк проявитель в фотографии и ДТlЯ получения ряда про­
ВЗВОДIIЫХ, lIапример адреналина (гл. 21).
---
I:T
НЗ природных производных пирокатехина наиБОJIЬШИЙ интерес пред­
НВЛЯЮТ гваякол, вератрол, эвгенол и изоэвгенол.
'В
(JЗМОЖfЮ. '!ТО это двоiiственная реаКЦИОlIная способllОСТЬ.
375
Гваякол. метиловый эфир пирокатехина, получают из букового деrrя
(креозита). Из гваякола получают пирокатехин и ряд лекарственных
средств, например mиокол (сульфокислота гваякола). Последний ПРИМе_
няется при Jlечении простуДных заболеваний легких и тубеРКУJlеза.
Резорцин. Т. пл. 118 ·С. т. кип. 276 ·С. Получают щеJlОЧНЫМ плаВле_
нием бензолдисульфокислоты. Применяется для синтеза ряда ценных
красителей и в медицине как дезинфицирующее средство. С FеСl з дает
фиолетовое окрашивание.
Гидрохинон. Т. пл. 170·с. Содержится в растениях в виде ГЛИКОЗИда
арбутина:
H0-o-0-C6HI10S
в промышленности его получают восстановлением хинона.
Важнейшей особенностью гидрохинона ЯВJIяется его способность лег­
ко окислиться до хинона. Окисление это проходит через стадию образова­
ния интеllСИВНО окрашенного молекулярного соединения (комплекса с пе­
реносом заряда) хинона с гидрохиноном хингидрона (гл. 23.4). Гидро­
хинон ОДИН из наиболее употребительных фотографических проя·
вителей.
АМИlJопроизводные дифеНИJIОВОГО эфира гидрохинона используются
для
получения
поликонденсационных смол,
обладающих высокой
термостойкостью.
3. TpexaToMHble
феНОЛbl
Существует три изомерных трехатомных фенола: пирогаЛЛОJI, оксИГИД'
рохинон И фЛОРОГJIЮЦИН:
ОН
<Уа"
~I
~
Q:"
~
ОН
он
но ~
ОН
ОН
ОН
флороrлюцнн
ОJCсигидрохинон
пироrамол
Все Tpll IIзомеРII могут быТ!, получены оБЩИМII методами. ПщюгаЛЛIJЛ обычио получают
нз галловоii I<ИСЛОТЫ. I\ОТОРIIЯ достаточно раСПРОСТРlIнеНII в I1рllроде. HllrpeBlllllleM с ВОДОI'
В IIвтоклаВIIХ.
ОI{СIIГIIДРОХИНОН получают 113 XliНolla (см. гл. 23.4) по схеме:
6
ОСОСНэ
ОСОСНэ
ОН
+(CH~~O}z~ ~ Н _~~ H~~.~
о
ХИНОН
376
~ОСОСНЭ
+он
Ь ОСОСНэ УОн
Н
он
флорогЛlliljUН можно ПОЛУ'IИТЬ гидролизом 1.3.5-ТРI1аМИНОбензолэ в ПРИСУТСТВIШ соля­
ной I<IIСЛОТЫ. В I1ромышленности его ПОЛУ'lают по схеме:
Все трехатомные фенолы
-
кристаллические вещества, легко раство­
римые в воде.
Производные
пирогаллола
широко
распространены
в
растительном
мире. Пирогаллол применяется в качестве очень сильного восстановите­
ля, например в фотографии, при определении КИСJJOрода в газах, в меди­
цине и в приготовлении красителей.
Флороглюцин весьма распространен в природе в виде сложных произ­
водных. Применяется в качестве реактива для открытия пентоз, фурфура­
ла, лигнина. Из всех рассмотренных фенолов он наиболее склонен к тау­
томерии (возможно, 'ITO, как и в случае двухатомных фенолов. это двойст­
венная реакционноспособность). Например, с гидроксиламином он дает
триоксим:
Q
OH
НО
~
N-OH
11
I~
фенолы.... форма
Н
кетонн'" форма
ПРII меПIЛltровании нэгреВЭНl1ем с CH:1I 11 КОН дает геl<самепtлциклогексантрltон:
_ф в то Же время Флороглюцин мепtЛltруется диэзометаном с образованием метилового
, Itpa:
377
Полигидроксибензолы
4.
Из ПОJlигидроксибеНЗОJlОВ наиБОJlЬШИЙ интерес представляет геlCса.
гllдроксuбен.зол, образующийся при действии оксида углерода (11) на ме.
таллический калий:
БСО
+
K~OK
6К
-коУок
ок
Б.
ЗАМЕЩЕННЫЕ ФЕНОЛЫ
1.
ГаJ\огенофеНОJ\Ы
0-, n-Галогенофенолы получают методами прямого галогеНИрОВ8lfИЯ.
ГаJlогенирование фенолов дает главным образом n-изомеры. Только при
хлорировании образуется значительное количество о-изомера
-
около
25%.
0-, Лt-Изомеры могут быть получены косвенным путем с использовани­
ем реакции диазотирования (гл.
22).
Так. НitПРl1мер. о-бромфенол можно ПОЛУЧI1Тh из O-НI1Трофенола восстановлением и за­
тем Дl1азореаКЦI1Й:
А/-Бромфенол можно ПОЛУ'II1ТЬ исходя из "'1-ДИНllтробензола по схеме:
QI --'!!!-QI
NO,
~
NHl
NO,
ОН-,.,.
ГалогенофеllОЛЫ
...."."
-
QI
N,Br
+ HN0 2.
NO,
+НВ,
~
+CU 2 B'1 ..
NO.
жидкости или твердые тела. Они обладают непри:
ятным запахом. Атомы галогенов в 0- и n-положениях к гидроксильнои
группе усиливают кислотные свойства галогенофенолов, благодаря чему
они образуют более устойчивые к гидролизу соли.
378
Некоторые галогенофенолы примеllЯЮТ как антисептики. МаСJIЯНЫМИ
астворами пентахлорфенола пропитывают древесину для предохранения
~e от разрушения грибками и термитами. Натриевую соль пентахлорфе­
нола используют для обработки проuмышленных вод, для предупреждения
оста слизевых грибов и водорослеи.
р висмутовую соль трибромфенола применяют как антисептик под на­
званием ксероформ.
Галогенофенолы являются также промежуточными продуктами при
получении многоатомных фенолов.
СОЛИ и эфиры галогенированных феноксиалифатических кислот­
важные избирательные яды для растений
гербициды.
-
Широко применяющийся гербицид 2,4-ДУ (2,4-дихлорфеноксиуксус­
ная кислота) получают из 2,4-дихлорфенолята ш\Трия и натриевой соли
хлоруксусной кислоты:
~N.
+
с,-{
OCH,COON. -
rH'COON.
а
+ _.CI
а
ГерrJLtЦIНJШIll IНIЗЫВ~ЮТСЯ вещества, используемые д.nя борьбы с
COPHbIMl1
РilстеНIIЯМII.
OIНI способны Лllбо полностью УНllчтожать всю растительность (сплошное деЙСТВllе), либо
Ilзбllрательно уничто~ть отдельные KJ\~CCbI растений, напр"мер только двудольные IIЛII од·
IIOДОЛЫ1Ые РilстеНlIЯ. IIЛИ определенные семейств~
paCTeHl1ii
(НЯПРllмер, крестоцветные,
сложноцветные и т. п.). Часто одно 11 то же вещество, в ЗilВИСllМОСТИ от КОНLlеИТрilЦl1И и норм
pilcxoAa, может деЙСТВОВilТЬ KilK гербиЦlЩ Лllбо сплошного, либо I1збllРilтельного деikТВI1Я.
В l\ilждOl"I группе раЗЛИ'lают гербициды контактиого действия (поражают листья и стеБЛII npll
IlaHeCCНlIII HiI HIIX препарата), системные гербициды (способllые перемещаться по COCYAIIстой cIICTeMe растеиий) и гербlЩI1ДЫ корневого деi\сТВIIЯ, ПОРilЖilЮЩllе ПРОРilстающие семе­
на ИЛlI
I\OPHII
РilстеНIIЙ.
,Двудольные сорные растеНIIЯ, .1асоряющне посевы злаков (однодольные растения). ',асто
УIIII'IТОЖ1lЮТ 2,4-дихлорфеноксиуксусноii и 2-меТjlл-4-хлорфеНОКСИУКСУСlюi·j кислотаМI1 ющ
в Свободном виде, так 11 в Вlще солей 11Л11 эфиров . Однодольные сорные растеНI1Я в посевах
ПРОпnшных ку.nьтур уничтожnют ТРl1хлорацетатом НilТРИЯ, ДИХЛОРПРОПltol1i1ТОМ НilТРИЯ,
З-хлорфеllИЛlIЗОПРОПllлкарбаматом (хлор-ИФК) и др.
ГсрбllЦИДЫ позволяют механизировать такую трудоемкую работу, KilK прополка посевов,
11 ЯВЛЯЮтся средством повышения урожайности сельскохозяйственных культур.
В К1Iчестве корневых герБИЦI1ДОВ сплошного действия используют ХЛОрПlIКрllН, сероугле­
род. Д1lхлорпропан, бромистый метил, аРИЛДl1метилмочевины и др. ПРlIмером контактных
герБНЦIIДОВ сплошиого действия являются нефтяные 11 каменноугольные масла, бог~тые
8РОМ n тичеСКИМII углеводородами, пентахлорфенол, пентахлорфенолят натрия, хлорат на­
ТРия If др. Гербициды сплошногодеiiствия используются д.nя УНlIчтожения растительности HiI
железнодорожном полотне, спортивных сооружениях, дорожках парков.
• ПрименеНllе хлорсодержащих гербицидов ограНИ'lиваетя образованием при IIХ синтезе в
i1l'ieCTEle пр"меСII самого ЯДОВI1ТОГО 113 IIзвестных веществ 2,З,7,8-тетрIIХЛОРДlluеIlЗОДИОКСlIна
в () Тысяч рilЗ более ядовитого, чем циаНI1Д наТf1ИЯ).
CI:O::XX~СI
СI
~
I
I
Q
I
379
ФеНОJlСУJlЬФОКИСJlОТЫ
2.
Фенолы сульфируются в 0- И п-положения. Изомерные кислоты разде_
ляют благодаря различной растворимости их бариевых солей (соль о-кис­
лоты растворяется труднее). о-Фенолсульфокислота неустойчива, П-фе­
нолсульфокислота
-
гигроскопическое кристаллическое вещество.
3.
НитрофеНОJlЫ
0-. п-Нитрофенолы получают нитрованием фенола разбавленной азот­
ной кислотой. При дальнейшем нитровании обоих изомеров получаются
2.3-динитрофенол и, наконец, пикриновая кислота.
.
м-Нитрофенол можно 1l0ЛУ'IИТЬ издинитробензола по следующей схеме:
Все нитрофенолы
-
кристаллические вещества, трудно растворимые
в воде. о-Изомер окрашен в желтый цвет. Два других изомера бесцветны.
у нитрофенолов кислотные свойства выражены зна'lительно сильнее, чем
у фенола. Они вытесняют угольную КИСJlОТУ из ее солей. Константы диссо­
циации
составляют для о-нитрофенола 6.8· 10-8; м-нитрофенола
2,4-динитрофенола 8,3· 10-5 и 2,4,6-тринитрофенола (пикри­
новая кислота) 4,2·10-:1. В мононитрофенолах влияние нитрогруппы в
5,3· 10-9;
орто- и пара-положениях больше, чем в мета-положении. Две нитро­
группы в орто- и пара-положениях дают кислотность примерно столь же
СИЛl>ную, как у карбоновых кислот. Пикриновая кислота с тремя нитро­
группами в орто- и пара-положениях близка по силе к минеральным
КИСJlOтам.
0-, п-НитрофеНОJIЫ дают окрашенные соли. Образование солей, оче­
видно, связано с таутомерией:
Действительно, из нитрофенолов можно получать два вида эфиров.
При действии CH:~I на серебряные соли нитрофенолов получают окра­
шенные в красный цвет вещества с радикаJlОМ у кислорода нитрогруппы.
Они легко перегруnrlИровываются в бесцветные фенольные эфиры.
Нитрофенолы применяют как индикаторы, так как переход в соль
ацu-нитроформы связан с усилением окраски. Они являются также прО­
межуточными продуктами в синтезе аминофенолов (в промышленности
краситеJlей и фотоматериалов).
380
Пикриновая кислота применялась как взрывчатое вещество. Особенно
взрь!Вчаты ее соли. Некоторые соли пикриновой кислоты (аммонийная)
плохо растворимы в воде, благодаря чему пикриновая кислот(! примсняет­
ся в химическом анализе.
С ~рОМ~ТllчеСI\НМII углеводородами ПИКРlIновая кислота дает комплеК~lIые соеДllнеНIIЯ,
которые хорошо кристаллизуются и используются д.IlЯ выделения и идеНТllфlll{~ЦI1И ~pOMaTH­
'lecКtIX углеводородов-
ГlIIКРIIНОВ~Я Кllслота ядовита_ Ра!jьше из вее ПОЛУЧ~ЛlI 08 хлорпикрнн_ 8 настоящее вре­
мя хлорrllll<РIIН получают хлорированием нитромеТllНа.
Благод~ря тому. что гидроксltл В пикриновой l\Ислоте наХОДIt'Гся в
()- 1I Гl-положеНIIII
к трем НltТРОГРУПflам, он легко замещается на другие группы. Так, при деiiСТВI1Ii на пикршlO­
вую кислоту пентахлорида фосфора ГИДРОКСI1Льная группа замещается хлором 11 образуется
ПI!I<\Jltлхлорltд CI;H~(N02):ICI. который обладает свойстваМII хлораНГlщрида I<ИСЛОТЫ_ С им­
MllaKoM это соеДlIнение превращается в пltкрамид Ct;H 2(N0 2):INH 2:
ОН
o,NANO z
У
NO,
пикриноваll кислота
CI
NHz
02 NA N O ,
+PCls .-
У
o,NANO,
NH]
~
NO,
У
N0 2
пикриnхлорид
пикрамид
Все ЭТlI реаlЩlill идут по механизму SN2. pIlM : нитрогруппы сильно стабllЛIIЗllРУЮТ ШlТер­
меДllаты (ClJЛll !vIейаенгеUАlера, не/{оторые из HItX БЫЛIt выделены в свободном СОСТОЯIIIIII):
В. ДРОМДТИЧЕСКИЕ СПИРТЫ
Как уже отмечалось, ароматические спирты содержат гидроксигруппу
в боковuй цепи. По способам получения и химическим превращениям они
скорее похожи на спирты жирного ряда,
'leM
на фенолы.
Ароматические спирты в свободном виде и в виде эфиров широко рас­
ПРострннены в растительном мире (эфирные масла). Они имеют прият­
НЫЙ ЗНllах и применяются в парфюмерии (часто в виде сложных эфиров).
Способы получения. Способы ПОЛУ'Iения ароматических спиртов раз­
ЛИЧilЮТся в зависимости от положения гидроксила по отношению к бен­
ЗОЛЬному ядру.
1. Спирты с гидроксилом У соседнего с ядром УГJlеродного атома (т. е.
в а-положении) легко ПОЛУ'IЮОТ гидролизом соответствующих галогено­
ПРОИЗВОДНhlХ. Для полного гидролиза галогенопроизводного достаТО'lI1O
381
кратковременного нагревания с раствором соды. Это промышленный СПо­
соб получения бензилового спирта:
I
а
~
СН2СI
((Н20Н
+Н20
~~
I
2. Другой способ получения ароматических спиртов основан на реак­
ции Канниццаро (гл. 28.1). При действии на смесь двух альдегидов, на­
пример бензойного и муравьиного, концентрированным раствором щело-
чей получаются спирт и кислота:
#0
#0
"н
"н
(
c.H--C~ + H-C~ K()H~ С.н,-сн. -он + Н-С';
/."
/, .,
О
"он
2
БСII:ШJIОвыи
мура ВI,H IIЮI
CIIIIIIT
KHCJIOTtI
Общим методом, применяемым иноrда для получения ароматиче­
3.
ских спиртов, является восстановление эфиров кислот металлическим
натрием (спиртовой раствор):
C(iH5-СО-ОС2Нfi ~ C(iH:;-СН~-ОН+С~НfiОН.
Спирты с гидроксилом В J3-положении по отношению к ядру уже не
4.
могут быть получены гидролизом галогеIiОПРОИЗВОДНЫХ. При действии
щелочей на соответствующие галогенопроизводные легко отщепляется
галогеноводород:
CIiH5-CH2-CH~C!
+ NaOH ~ C!iH,,-СН=СН2 + NaCI + н 2 о.
Наиболее рациональным способом получения таких спиртов являются
реакции органических эпоксидов с метаЛJlOрганическими соединениями
с ароматическим радикалом. Например:
С(.Н, MgBr + СН 2-СН 2 -С(.Н,-сн 2 сн 2 ом<>вг
, .•
в
дом
"0/
промышленности
-
• .•
эти
спирты
..
+ 11,0
~ С(.н,-сн 2 сн.,он
- Mf,:nrOII
получают
более
,..
выгодным
-
мето­
из ароматических углеводородов и Эпоксидов с применением в ка­
честве катализатора хлорида алюминия, например:
•
•
ЛIСI: 1
•
•
с 6 н(; + C~г/CH2 ----"+- C 1i H,,-СН 2 -снрн
О
в качестве побочного продукта получается фениловый эфир этилеиглиКО­
ля С 6 Н-О-СН 2 СН 2 ОН.
5. Спирты с у-положением гидроксила гro отношению к ядру получаюТ
гидрированием непредельных ароматичеСКIiХ спиртов или кислот:
C!iH';-СН=СН-СООН ~ C!iH5-СН~-СН~-СН2-0Н.
382
6. Разумеется, могут быть использованы и общие способы получения
спиртов жирного ряда, например восстановление бензойного альдегида:
СН
(; ,,-С#,О
"н
112
~
СН
(; ,-,-.СН
2-
ОН
химические свойства. По химическим свойствам ароматические спир­
тЫ очеНl> похожи на предеJII>ные спирты жирного ряда. В отличие от феl-IO­
пав они не реагируют со щелочами, но дают алкоголяты (как и спирты
;кирного ряда) при действии щелочных металлов. Подобно спиртам жир­
ного ряда они образуют с кислотами сложные эфиры и т. д.
Отметим некоторые особенности этих спиртов.
1.
Спирты с а-положением гидроксила по отношению к ядру легко за­
мешают гидроксил галогеном при действии галогеноводородных кисло.:
С(jНг.-1Н-СН;i+НСI ~ C(jH"-СНCI-СН а +Н 2 О.
ОН
2. Спирты с гидроксилом В j3-положении легко дегидратируются с об­
рюоваllнем арилолефинов:
C(jH,,-СН 2 -СН 2 -ОН
(.
н+ ~ СНН,,-СН=СН 2
Отдельные представители. Бензиловый спирт
-
+
Н 2 О.
жидкость с т. кип.
206 ос. Плохо растворяется в воде. В природе встречается в эфирных мас­
ШIХ и б"ЛI,зам"х. Содержится в свободном виде или в виде эфиров в мас­
JI"X Ж"СМИН", туберозы, гиацинта, в бальзам"х
ском, в виде гликозида
-
-
пеРУiiНСКОМ и толуан­
в кукурузе.
Применяется в парфюмерии в виде эфиров уксусной, бензойной, 1<0РИ'IНПЙ И других кислот.
~-Фенuлэmиловый спирт (2-фенилэтанол) - жидкосТl> с т. кип.
219 ос. Содержится в розовом и неролиновом маслах. Применяется в пар­
фIомерии к"к стабилизатор заШIХОВ под названием «искусственное розо­
вое масло».
у-Фенилnроnиловый спирт (З-фенилпропанол) обладает запахом ги­
illtHHTOB. Встречается в виде эфиров коричной кислоты в смолах и баЛI>Зii­
MilX.
Применяется в парфюмерии.
J-/епредельные аРО.матuческ.ие спирты. Из этого ряда спиртов Наи­
БО.1Jt,fllес значение имеет встречающийся в бальзамах коричный спирт.
13 I1РОМыwленности его получают восстановлением коричного альдегида:
C(jll,i-CH=CH-CHO ~
П
C(jH"-СН=СН-СН 2 ОН.
РИменяется в виде эфиров.
Ся Фенолосnuрmы. В природе широко встречаются вещества, являЮЩие­
О!НlOвременно и спиртами и фенолами. Важнейшим из них является са­
ЛцгеНIlН (2-0ксиметилфенол). Он в виде гликозида салицила содержится
I~ JlИСТЫIХ и коре ивы.
Очень большое зна'lение как исходный материал для построения лиг_
нина (основная составная часть древесины) наряду с клетчаткой им~
конuфериловый спирт, входящий в состав соков хвойных деревьев:
т
qOCH,
ОН
~OH
~CHOH
2
салиreнии
lI:онифериловыii СП!lрт
ГЛАВА
21
АРОМАТИЧЕСКИЕ АМИНЫ
Ароматические амины являются производными аммиака (как и амины
жирного ряда). Аминогруппа может быть связана непосредственно с яд­
ром или находиться в боковой цепи. Как и в жирном ряду, ароматические
амины могут быть первичными, вторичными и третичными. В зависимости
от того, какие РflДИКflЛЫ (только аРОМflтические или ароматические и алИ­
фатические) связаны с атомом азота, различают амины чисто ароматиче:
ские и жирноароматические.
А. АМИНЫ С АМИНОГРУППОЙ В ЯДРЕ
Ароматические амины с аминогруппой в ядре называют как производ­
ные ароматических углеводородов по Нflименованию радикалов или эмпи­
рическими (тривиальными) Нflзваниями.
Способы получения
Первичные амины. Общая формула Аг-NН z . Например: C6HsNI-I2
аНИJIИI! (фениламин), СН з -С 6 Н 4 -NН 2 0-, ,М- И n-аминотолуолы или
толуидины.
1. Прямое аМИНИРОВflние беНЗОJlЬНОГО кольца аммиаком протекает
в КРflйне жестких условиях H<I сложных юпаЛИЗ<lторах (соли молибдена,.
вольфрама или хрома и оксиды никеля или меди):
01
~
384
+
NНз
MoS1;CuO
..
3МЛа;4000С
0'1
"
NHz
2.
Обычным способом получения первичных аромаТИ'lеских аминов
является восстановление нитросоединений:
Ar-N0 2 ~ Ar-NH 2 +2H 20.
В качестве восстановителей могут быть использованы железо и соля­
ная илИ серная кислоты, олово и соляная кислота, сероводород и СУЛl,фи­
ды шелочных металлов, гидросульфиты и, наконец, восстановление мож­
но вести каталитическими или электрохимическими методами.
В
зависИМОСТИ
от
характера
среды
процесс
идет
разными
путями.
В кислой среде в качестве промежуточных продуктов образуются нитро­
зосоединения и производные гидроксиламина. Последние могут быть по­
лучены как конечные продукты при восстановлении в нейтральной среде.
В щеJJOЧНОЙ среде процесс идет более сложно. Вслед за нитрозосоедине­
ниями получаются арилгидроксиламины, азоксисоединения, затем азосо­
единения, гидразосоединения и, наконец, амины (с.
3.
359).
В последнее время аромаТИ'lеские амины ПОЛУ'lЭют из галогенопро­
изводных ароматического ряда и аммиака:
-+ С li Н r. NH 2+ NH ~.
СI
C1iH,jCI _.:-.12_N_Н·::..с
.II )
Д~НJIСIIIi(,'\1
КIIТlfJ'ЮIlТ()I'
Вследствие малой подвижности галогена, связанного с аромаТИ'lеским яд­
ром, реакцию приходится вести в автоклаве при высоком давлении и тем­
пературе в присутствии катализаторов -
меди и ее соединений. Реакция
проходит с промежуточным образованием дегидробензола (см. гл.
17).
ТОЛl,ко в тех случаях, когда в 0- или n-положении к галогену находятся
СИJIЫIO электроотрицательные группы, например нитрогруппа, галоген
замещается аминогруппой по механизму SN2 иll . (см. с.
IIhTPO-О-ХJlорбеIIЭOJI
349):
O-llитроаllИJIИII
4. Амины можно также получить из кислот через амиды реакцией Гоф­
М<lна (механизм реакции см. с. 227)
ВТОричные амины. Общая формула чисто ароматиеских вторичных
<lМИНf)В Ar2NH, жирноаромаТИ'lеских Aг-NH-Alk, например дифенила­
MI1H (С П Н 5 )2NН , метилфениламин (метиланилин ) С 6 1-1 5 - NH -сн з .
1. Вторичные жирноароматические амины получают обычными мето­
Ц<lМИ <lлкилирования первичны аромаТИ'lеских аминов с помощью галоге­
/{ОIlР
ОИЗводных или спиртов. В промышленности алкилирование ведется
13 З811:. 181
385
обычно спиртами в присутствии кислот, причем получается смесь СОлеА
вторичного и третичного аминов:
C(jH,,-NН 2 ' НСI
+ СН:\ОН ---+ C(jHiiNH-СН а ' НСI + Н 2 О;
С()Л~III{)КИСJlыii
МСТНЛ3Ir~IJIИII
C tj H 5 -NНСН а ' НСI
+ СН:рН ---+ CtjHr,N(CH:\)2' НСI + Н 2 О.
СОJlЯllОКИCJIыii
димеТИJI3IIИJIИII
Вторичные жирноароматические амины (без примеси третичных) полу­
чают алкилированием ацильных производных аминов с последующим гид_
ролизом, например по схеме:
C(jH"HNCOCH a
+СI-I.I
-Hi'
СНа
I
+11011
э> CGH5NCOCHa~CGH5NHCH:1 + СН:,СООН
N-мстилацст­
N-ЮIСТИJI~IIИJIИII
( ~цстаЛИIIИД)
ЮIИJIИД
2. Вторичные жирноароматические амины получают также гидрирова­
нием так называемых шиффО8ЫХ оснований (азометинов):
С(jНг,N=СН-СН:\
+ 2Н 2 ---+ C(jH ii -NН-СН 2 -СН:\.
~ТИJIНIIИJI1111
3. Чисто ароматические вторичные амины получают нагреванием аро.­
матических аминов с их слоями:
C(jHr,NH 2
+ C(jH ii NH 2 ' HCI---+ (C1jH,,)2NH + NH 4C1.
Третичные амины: трифениламин (С6Нs)зN (чисто аромаТИ<lеский
амин), дифенилметиламин (С6Н5)2NСНз, диметиланилин С6Н5N(СНзn
(жирноароматические амины).
Третичные ароматические амины обоих видов получают алкилировани­
ем или арилированием первичных или вторичных аминов:
Более трудно доступные третичные чисто ароматические амины полу­
чают нагреванием вторичных аминов с арилиодидами в присутствии мед­
ного порошка:
Физические и химические свойства
Ароматические амины - жидкости или твердые вещества с характер·
ным неприятным запахом. Сильно токсичны. В воде растворяются МаЛО.
Накопление аминогрупп ведет к увеличению растворимости.
Ароматические амины вступают в химические превращения с участие ..
аминогруппы или ароматического ядра_
386
1.
р
Ароматические амины имеют менее выраженный основной харак­
чем
жирные
амины.
Так,
константа
диссоциации
~~4"10-5. тогда как для анилина она равна З,8'10- IО
метиламина
C(jH:jNH~+H~O +::t СIiН:jNН~+ОН-.
УмеНЫllсние основности анилина по сравнению с алифатиtlескими ами­
нами может быть объяснено взаимодействием неподеленной пары элек­
тронов азота С электронами ароматического ряд<'l
-
их сопряжением:
(NH 2
ССУ
\J
Такое сопряжение понижает способность неподеленной пары электронов
присосДинять протон; к тому же при солеобр<'lЗОВ<'IНИИ теряется сопряже­
ние З<'lместителя с кольцом, что также энергетически невыгодно.
Присутствие электроноакцепторных групп
в ядре умеНЬШ<'lет основ­
ность. Например, константы основности для 0-, М-, П-НИТРО<'lнилинов со­
ответственно
1· 10-14, 4·10-12
И
1· 10-12.
С другой стороны, алкилирование аминогрупп увеличивает основность:
константы
7,1' 10-10
основности
и
N-метилаllилина
и
N,N-диметилаНИJ1ина
1,1' 10-9.
Введение второго ароматического ядра сильно уменьшает основность.
Константа основности дифеНИJ1амина 7,6' 10-14. ДифеНИJ1амин образует
СИ.JII,НО гидролизуюшиеся в растворах соли только с СИJ1ЬНЫМИ кислотами.
Трифеllиламин основными свойствами практически не обладает. Таким
образом, фенильная группа сильно снижает основные свойства амино­
группы. Ароматические полиамины по основным свойствам мало отлича­
ются от аНИJlина.
2. Подобно аминам жирного ряда, первичные и вторичные ароматиче­
СКИе амины способны замещать водород аминогруппы алкилами. Эта ре­
<'IКЦия является способом ПОJ1учения вторичных и третичных аминов:
C(jH:jNH~
+ СН:\! ~ C(jH;;NHCH:!' HI:
СгН,-NН-Сн.\ +сн.\l ~ СгН,-N(
I
,]
, .
I
.)
СН
а. Нl
СН:\
3. При действии <lЦилирующих средств водородные атомы пеРВИ'lIlЫХ
и ВТОРИ'IНЫХ аминов замещаются аЦИJ1ЬНЫМИ остатками. Так, анилин пе­
рехо;щт 13 ;щетанилид при дейстl3ИИ уксусного ангидрида или ПрИ нагрева­
нии С уксусной КИСЛОТОЙ:
C(jH"NH 2 + (СН;\СО)20 ~ C(jH"NHCOCH;\ + CH;JCOOH:
( 1)C,NH 2
+ СН;\СООН ~ C(jH:,NH 2 ' НООССН;\ ~ C(jH:;NHCOCH:\ + Н 2 О.
Ацильные производные аминов
TO'IHO
-
кристаллические вещеСТl3а с доста­
l3ысокими и четкими температурами плавления. Они являются ами-
387
дами кислот, не обладающими основными свойствами. Ациламиды УСТоА_
чивы к окислителям и потому используются в качестве промеЖУТОЧНbtJt
веществ при окислении аминов.
4. При слабом нагревании аромаТИ'lеских первичных аминов с аРОма_
тическими альдегидами легко получаются шuффовы основания или азо­
метины (гл. 23.1 ):
C 1i H 5 -NН 2
+ O=CH-СliНii--+СIiНii-N=СН-СIiНr. + Н 2 О.
б~II:-I()jiIIЫЙ
НJII,J1СПЩ
При действии разбавленных кислот эти основания подвергаются рас­
щеПJlению на альдегид и амин:
CIiHr.-N=СН-СliН" + Н 2 О ~ C1iH"NH2 + C1iHiiCHO.
5.
При нагревании первичных ароматических аминов с хлороформом
и спиртовой щелочью получаются карбиламиды или изоцианиды
щества с ИСКЛЮ'lИтельно неприятным тош~отворным запахом (с.
C1iH,j-NН:l
+ СНС):! + ЖОН --+ C/iH,,-N ~
С
-
ве­
235):
+ 3H:l0 + 3КС).
Эта реакция используется ДJlЯ обнаружения первичных аминов.
6. Особенно большое значение имеет реакция аминов с азотистой кис­
лотой. При действии азотистой кислоты на пер в и ч н ы е ароматические
амины в кислой среде получаются так называемые соли диазония. Это
весьма реакционноспособные -вещества, химические превращения и ме­
ханизм образования которых рассмотрены в гл. 22:
CIiH,,-NН1
+((("(
+
~
HO-N=O
[CIiHr.-NJ+
111
N
СГ+2Нр
Амины жирного ряда в этих условиях, как известно, дают спирты, эфиры и
другие вещества (гл. 8.2):
C2H,,-NH2
+ ON-OH--+C2 H"OH + N2 + Н 2 О.
В Т О Р И ч н ы е ароматические амины реагируют с азотистой кислотоЙ
- дают нитрозоамины:
подобно аминам жирного ряда
CIiHr.-NН-СН:J
+ HONO --+ CliHii-N-СН~.
I
NO
M~TIIJI- N -lIIlтrО;Ю3l11IJIИII
При действии минеральных кислот эти вещества перегруппировываЮТ СЯ с перемещением нитрозогруппы в n-положение ядра:
NO
C6HS-~--СНз
-
ON-Q-NH-CH3
n. ·ННТр030мeтиnанилии
388
т р е т и ч н ы е аромаТИ'Jеские амины на ХОЛОДУ дают с азотистой кисло­
той ll_нитрозосоединения. Третичные амины жирного ряда С Я30ТИСТОЙ
кислотой В этих условиях дают соли (см. гл. 8.3):
(СНЭ)2N-Q
+ HO-NO
(СНЭ)2NОNО + HzO
-
n -НИТjЮ3O.QИМ'eтиJIаикnнн
Если
П-ПОJlожение
занято,
нитрозогруппа
п_НитрозодиаЛI<илаНИJJИНЫ легко
вступает
расщепляются
в
о-положение.
щеJJО'Jами на
нитрозо­
фенол и ВТОРИЧНЫЙ амин. Эта реакция является удобным способом полу­
ченИЯ индивидуальных ВТОРИЧНЫХ аминов жирного ряда:
~ NЩСНэ)z + ON-{ }-ОК
(CH])2NONO
7.
Ароматические амины в отличие от жирных аминов легко окисляют­
ся, БJJагодаря чему при хранении они оБЫ'JНО приобретают окраску. При
контролируемом окислении анилина в кислой среде образуется ХЮIOн.
При окислении анилина ХРОМОВОЙ кислотой ПОЛУ'Jается черный краСИТСJlЬ
«анилиновый черный». При ОКИСJJении гидропероксидом трифторацети­
JIа ароматические амины легко образуют соответствующие нитросоедине­
ния с хорошим выходом:
C{jH,,-NН~
8.
+ ЗСF:,со-оон ~ C(jHr.N02 + 3CF:1COOH + H~O.
Благодаря склонности к образованию а-комплексов в 0- и п-поло­
жения к аминогруппе ароматические амины легко вступаю в
реакции
ЭJlектрофильного замещения. При этом получаются главным образом
П-ПРClдукты.
Галогенирование анилина свободными галогенами обы'шо дает смесь
прОдуктов различной степени замещения и сопровождается окислением.
Поэтому свободными галогенами обычно гаJJOгенируют не сами амины,
а их аЦИJlьные производные:
NHCOCH]
..
+ СНэсоон
6
NНСОСНэ
NHz
С\
С\
~Q ~Q
МОжно галогенировать амины непосредственно с помощыо гаЛОJ"еllами­
Дов. При 3ТОМ постепенно можно вводить один и тот же ИJJИ разные
Г(JЛогены:
C(jH"NH 2
+ Ю + NHCI-COCH:, ~ CfjH~I' NH2 + КСI + CH:,CONH 2 ;
CfjH~CINH2 + КВг + NHCI-COCH:\ ~ C(jH:\CIBrNH 2 + КСI + CII;,CONH~.
389
При
галогенировании
аминов
в
растворе
сильных
кислот
наря.цу
с п-изомером получается много .м-изомера. Обънсняется это тем, что
в этих условиях галогенированию подвергается не
и его
COJlb,
TOJlbKO
сам амин, но
а аммонийная группа является м-ориентантом:
+Н+
C 6H sNH1
1:
+В'2
-НВ,
C6Hs-NН; ~
~NHJ
-НВ,
)=1
Br
NH1
-O-~
_
Br
При нитровании ПОJlучаются rJlaBHblM образом п-изомеры. Во избежа­
ние ОКИСJlения аминов азотной кислотой их предварительно ацетилируют.
ПОJlучаемые при нитровании нитроацетанилиды гидролизом переводят
в нитроамины:
CHCONH
Q
'6
NO~
При сульфировании также ПОJlучается п-изомер *:
o - NH2
+Н 2504
..
o - N H 1 ' H1S0 ,
сеРНQКИСЛЫЙ анилин
~;.. НОЭS~Н2
суяьфаниnава.
KlКJloтa
9.
БJJaгодарн подвижности атомов водорода в п-положении к аминог­
руппе, оБУСЛОВJlенной возможностью образования стаБИJlизованного со­
IIряжением Q"-комплекса, ароматические третичные амины
JlerKO
вступа­
ют в реакции конденсации со слабыми элеКТРОфИJlЬНЫМИ реагентами.
К такого рода реакциям прежде всего относится конденсация с альдегида­
ми, приводящая к образованию п-изомеров производных ди- и трифенил­
метана:
СН10 + 2~6H5N(CHJ)2 -
(CHJ)lN-o-CH2--Q-N(CH3)2
"
, /CI;H4-N(CH~)~
СI;Н,,-СНО + 2CI}1r.N(CH)2~ С(;Н;-.-СН, '
,
C1;1-I 4- N(CI-I:;)2
1/,11' -( N.
N'-ТСТРИМСТIIJI)ДIIИМIНЮТI'II­
фСllflJIМt'ТИII
• СУЛl.Фllруется не со.nь. я свободныii ilIШ'nI1Н. НЯХОдЯЩllЙСЯ в рявновеСIШ с СО'nЬЮ.
390
1О.
ПО той же причине различные атомы и группы могут легко переме­
UJ.атьСЯ из аминогруппы в ядро. Так, при нагревании хлористоводородной
соли диметиланилина под давлением получается смесь хлористо водород­
ных n-толуидина, ксилидина и мезидина:
6
N(CH3)Z'HCl
~
I
qNH2'H~H3
9NH2.HCl
-
~
I
+
СНз
~
I
нзс*NН2'Н~нз
+
СИз
I
СН з
хсилИJ(ИИ
11.
~
мези.аии
Гидрирование анилина в присутствии никеля можно получить цик­
логексиламин. Однако реакция осложняется идущим одновременно от­
UJ.еплением
аминогруппы
с
образованием
бензола,
цикnогексана
и
аммиака:
ч;Н;;NНz ~~i21) C(jHIlNHz·
IHiКJIOI'CKCHJI­
ёiМIШ
Отдельные представители. Применение
Анилин кость с т. кип.
бесцветная, трудно растворимая в воде маслянистая жид­
182
ос и т. пл. 6 0 с. При хранении темнеет. Пары его весь­
ма ядовиты. Дает характерное фиолетовое окрашивание при действии на
его водный раствор хлорной извести. Впервые анилин получен в результа­
те перегонки индиго с известью (1826). В незна'lительных КОЛИ'lествах со­
держится в каменноугольной смоле. В промышленности анилин получают
Восстановлением нитробензола в паровой фазе водородом в присутствии
никеJlевых или медных катализаторов.
ПреД/lожеliО применять в качестве ВОССТlIновителя природный ГIIЗ в ПРИСУТСТВIЩ
хром '1i11К~ЛЬ, кобllЛЬТОВОГО К/Iтализатора.
В Промышленности анилин в значительных количествах используется
в производстве ингредиентов резиновых смесей, ленолластов, красите­
лей, лекарственных препаратов и т. д.
Дuмеmиланилцн - жидкость с т. кип. 193 ос. Применяется в произ­
ВОДстве красителей и взрывчатых веществ.
ДиФенuламцн -
кристаллическое вещество с т. пл. 54 ос. Сернокис­
ЛОТный раствор его является реактивом на азотную кислоту и ее соли.
Г1Рименяется в производстве циаиновых красителей, а также в качестве
СТRБНJlИЗRТора дЛя пороха.
Толуuдины. n- Толуидин - вещество кристаллическое, остальные
ИЗОмеры - жидкости. Широко применяются в производстве красителей,
особенно ФУКСИНR.
391
0-, М-, n-Фенuлендuа.AtUНЫ C6H4(NH 2 )2' Получают восстановлеНиеt.t
нитроанилинов и м-динитробензола. Это бесцветные кристалличеСкие ве.
щества, легко окисляющиеся при хранении на воздухе.
о-Фенилендиамин чрезвычайно склонен к всевозможным реакцияt.l
конденсации за счет двух аминогрупп:
с диальдегидами, дикетонами, альдегидокетонами, альдо- и кета.
1)
кислотами, а также с оксикетонами он дает гетероциклические продукты
конденсации. Например, с глиоксалем он дает хuноксалuн:
NH1
~
(
(
~
I
о=сн
+
1-
о=сн
NH1
N)
(X
~I~
ХИКDксалнн
2)
с карбоновыми кислотами получаются производные бензимидазола:
о
NH1
((
+
~
NH
но
I
~/с-снз- ( ( N
I ~С-СНз+2Н10
~
2
/
NH
м-Фенилендиамин наиболее устойчив из всех диаминов. Он широко
применяется в синтезе красителей и в производстве искусственных смоn.
Токсичен.
n-Фенилендиамин применяется в производстве различных красителей.
Его алкильные и гидроксиалкильные производные используют как проя­
вители в цветной фотографии. Весьма токсичен.
Б. ЗАМЕЩЕННЫЕ АМИНЫ С АМИНОГРУППОЙ В ЯДРЕ
1.
Галогено-, нитро- и сульфозамещенные амины
О методах получения галогено- и нитрозамещенных ароматических
аминов говорилось ранее. Основность этих веществ ниже основности ис­
ходных аминов.
НитроаllllЛIfНЫ находят большое прнменение в производстве красителей. Тетранитро­
метилаНИЛl1Н применяется под названием тетрила в качестве бризантного взрывчатого ве­
щества:
СН э -N-NОl
01N~NOl
У
NO z
Производное n-НИТРО/lНИЛИН/I
-
суосин
-
в
350 раз слаще сахара:
NOz-Q-NН-СО-NН-СНZ-СН1-СООNа
392
При нагревании анилина с серной кислотой до
200
ос получается суль­
фаниловая кислота.
Сульфанилован кислота плохо растворима в воде. Она представляет
собой внутреннюю соль. Со щелочами дает нормальные соли:
S03-{
}-~H3 ~ Nаозs-О-NН2 + Н20
С кислотами солей не дает.
Сульфаниловая кислота широко применяется ванилинокрасочной про­
мышленности. Амид сульфаниловой кислоты
NH 2-S0 2- O - N H 2
используют в медицине как противомикробное и противовирусное средст­
во (белый стрептоцид). Это простейший представитель большой груп­
пы лекарственных веществ - сульфамидных препаратов, применение
которых (с середины 30-х годов ХХ в.) произвело переворот в медицине.
В настоящее время во врачебной практике применяется более 10 сульфа­
мидных препаратов, из которых только некоторые упоминаются в этой
книге (бисептол, сульфодиазин).
Механизм их действия на микроорганизмы рассмотрен на с. 542. Они
являются антиметаболитами.
м-Сульфокислоту анилина (метаниловую кислоту) получают восста­
новлением м-нитробензолсульфокислоты. Применяется в производстве
красителей. о-Изомер получают сульфированием м-броманилина с по­
следующим удалением атома брома восстановлением.
2.
Аминофенолы
довольно
Ам И нофен ол ы
широко
используются
в
лабораторной
практике.
Способы получения.
1.
Обычным методом получения аминофенолов
является восстановление соответствующих нитрофенолов. Восстановле­
ние ведут цинковой пылью или Дитионитом натрия
Na2S204
в щелочном
растворе:
ОН
ОН
О' ~~
U
' N O2
NH 2
2. Аминофенолы можно также получить нагреванием с аммиаком
двухатомных фенолов, особенно мета-ряда:
6'ОН' +NНз~ U~
ОН
ОН
+Н2О
NH 2
393
3. Промышленным способом получения n-аминофенола является
электролитическое восстановление нитробензола в присутствии кон цент.
рированной серной кислоты. Образующийся фенилгидроксиламин пре­
терпевает перегруппировку с образованием n-аминофенола:
C6H5N02
~ C6H5NO ~C6H5-NH-OH~ NH2-o-0H
Указанная перегруппировка проходит по межмолекулярному механиз­
му:
4.
Удобным лабораторным способом получения аминофенолов явля­
ется восстановление гидроксиазосоединений:
H0-o-N=N-C6H5
~OH-O-NH2+ C6HsNH2
Физические и химические свойства. Аминофенолы
-
бесцветные
кристаллические вещества, растворимые в воде.
1. Аминофенолы обладают двумя весьма активными функциональны­
ми группами. Поэтому они образуют соли с кислотами и феноляты с едки­
ми щелочами, т. е. проявляют амфотерные свойства:
. -С
NИОН
H0-Q-NH
-
2.
Аминофенолы
2
-
Nao-Q-NH2
Ho-O-NH2. HCI
HCI
-
очень сильные восстановители, благодаря чему
применяются в фотографии:
НО
'1
NH 2 Е101э'
-о_
'НI
О
=0=
NH
-
ХИНОНМОIIOИМИII
3.
При ацилировании аминофенолов в первую очередь реагирует ами­
ногруппа:
H0-O-NH
_
394
2
(СН зСО)20 э' но-О-'
NHCOCH
3
_
-СН СООН
з
4.
о-Аминофенолы при всевозможных реакциях легко дают гетероцик­
лические соединения. Например, при взаимодействии с уксусным ангидридом:
мстилбснзоксазол
фосгеном:
. I
CX
~
NH
NH2
+
СI )со ~ ОС"
I со + 2НСI
он СI
~
и т. д.
/
о
БСIJ:ЮКСдЗОЛОII
Отдельные представители. Аминофенолы применяются как проявите­
ли в фотографии, в производстве красителей и лекарственных веществ.
Обычными проявитеЛЯМI1 являютсяроrJuнuл (n-аминофенол), метол (n-метиламинофе­
нол) СН з NН-С'jН 4 ОН, а,\lurJол (2,4-диаминофеиол):
H2N - Q : 0 H
NH2
амидол
Все эти вещества обычно примеl!яют в виде солей.
АнuзuiJuны (метоксианилины) и фенеmuдuны (этоксианилины) используются в произ­
водетве азокрасителей, n-аминофенол - в производстве сернистых красителей, ..II-диметил­
аминофенол - в производстве родаминовых и розаминовых красителей. В медицине приме­
няется фенацеmuн - n-ацетофенетидин.
-Q'ОСЗН7 в
Пропиловый эфир 2-амино-4-нитроФенола
02 N
400
-
сладок. чем обычный сахар.
.
раз более
N~
В. АМИНЫ С АМИНОГРУППОЙ В БОКОВОЙ ЦЕПИ
Амины. содержащие остатки аммиака в боковой цепи, получают способами, обычными
Мя получения аминов жирного ряда, при взаимодействии аммиака с хлористым бензилом об­
разуются бензилаМllН, дибензиламин и трибензиламин:
CGH5CH 2C1 _+NН з
I
C6H 5CH 2NH 2; (C6H5CH2)2NH и (С6Н5СН2)зN.
Амины такого рода - несколько менее сильные основания, чем алифатичеСКllе амины.
Связь между атомом азота и беНЗIIЛОМ легко расщепляется при каталитическом гидрирова­
Юllt. Поэтому беНЗltльная группа может быть использована ДlIЯ защиты аминогруппы во
время конденсации (в il.pyroii части молекулы) и затем легко может быть удалена:
R2NCH2C6H5 +
.a-ФеНИЛЭТttламин
Леикарmа:
обычно
С н Н 5 СОСН з
Н2
INi)
----<-+R2NH +СН ЗС 6 Н 5 ·
получают в
лаборатории
из
ацетофенона реакцией
+ HCOONH 4 ---+ С 6 Н 5СНСН З + С0 2 +
Н 2 О.
I
NH 2
395
Он легко может быть разделен надве ОПТИ'lеСКlI aKTllBHbIe формы, KOTopt.le легко 11СПОЛЬ3уют
ДIIЯ разделения рацеМllчеСКlIХ кислот. Важным преllмуществом реакцнй Лейкарта по сравне_
НIIЮ с другими методаМII восстановления является то, что галоген и НllТрогруппа, которые
могут ПРllсутствовать в ароматическом ряду, не затрагиваются.
!3-ФеННЛЭТllлаМIIН можно paccMaTpllBaTb как РОДОНlI'lальное вещество БОЛЬШОl1 группы
важных леКllрственных веществ. Ilзвестных как СИМПТОМllметнчеСЮlе амнны. НlIзвание ука­
зывает на то, что 3TII соедннеНIIЯ IIМIIТИРУЮТ явления. ВОЗНflкаЮЩllе при возбуждении симпа­
ТllчеСКОli Ilервной системы. НIIПРllмер, они раСШllРЯЮТ зрачок глаза, усиливают сердцебие_
ние. увеЛИ'ШВIIЮТ давлеиие крови. К 'IИСЛУ таких соединеНИlI ПРllнаДllежат: .~фе(}рuн, бен­
аеарuн (феНаАIIlН) - препарат. снимающий чувство УСТIIЛОСТИ. u()ренuлuн - гормон
надпоче'IНIIКОВ. о(iЛ8ДаЮЩIIЙ способностью сужать кровеносные сосуды:
Q
Q
CH-CH-NHCH!
I
ОН
~OH
I
.
CH,-CH-NH ..
- I
СН:!
•
У
TH-CH~-NHCH:!
ОН
СН:!
~ФСJЦlltll
'ЩРСII"JIНlI
к ЭТОII же груп пе веществ ОТIЮСИТСЯ
fl
Rнтибиотш< ХЛПРЩlllцеmLlН (СLlнmIJAILЩLlН)
N02~CH-CH-NH-COCHCI2
~-II
он
снрн
выделеННЫlll1З микрооргаНI13МОВ почки. Это первыii антибиотик,
KOTOPbIii
был синтезирован
способом, ПОЗВОЛЯЮЩIIМ оргаНИЗОВRТЬ промышленное ПРОIIЗВОДСТВО.
ГЛАВА
22
ДИАЗО- И АЗОСОЕДИНЕНИЯ
Ароматическuми диазосоединениямtt называют различные по строе­
нию, однако легко взаимопревращаемые соединения: соли диазония, диа­
зогидроксиды и метаЛЛИ'lеские соли последних (диазотаты), диазоцианиды
и другие лодоб.ные вещества.
Строение
В молекуле диазо- и азосоединений два атома азота связаны между со­
бой. В диазосоединениях эти два атома соединены только с одним углево­
дородным радикалом, в азосоединениях
-
с двумя.
Наиболее важными соединениями являются соли диазония. Строение
солей диазония в настоящее время не вызывает сомнений. Они состоят из
396
дuазокаmllона и аниона, например [C 6H 5N 2]+CI- (хлористый бензолди­
азониЙ). ПО своему характеру они подобны аммониевым солям.
Диазокатион сопряженный ион, в котором каждый из атомов азота
несет частичный положительный заряд:
O.14211M
U,IIOIIM
[ Aг---N====N
J+ _
Х
Измерение межатомных расстояний в бензолдиазонийхлориде показа­
ло, что они БJ!ИЗКИ К рассто~ниям соответственно в простой и тройной
связях.
Способы получения
Реакцию оБР<IЗования диазосоединений из аминов называют дuазоmu­
рованием. Диазотирование проводят действием на водный раствор амина
азотистой КИСJlОТЫ, полу'шемой из ее солей, в присутствии избытка мине­
ра.nI,llОЙ кислоты. На один ~:lквивалент амин(\ следует брать не менее
2,5
эквивалентов минераJlЬНОЙ КИCJIоты. Один эквивалент идет на выделение
азотистой кислоты, один
-
на образование СОJlИ диазония:
c"H"NH 2 + 2НСI + NaN0 2 ~ С(;Н5N~СГ +NaCI+2I-l 2 О.
Избыток кислоты необходим для стабилизации соли диазония. В его
отсутствие идут побочные реакции, например образование диазоаминосо­
единений (см. ниже).
Таким путем получают водные растворы солей диазония. ОБЫ'IНО эти
СОJlИ очень хорошо растворимы в воде.
Если требуется получить свободную соль диазония, то реакцию ДШIЗО­
тирования проводят в каком-либо органическом растворителе с помощью
эфиров азотистой КИCJIоты. Тогда соль диазония выпадает в осадок:
C1;H,jNH 2 + НСI + С:;НIIОNО~[С(;НiiN2)+СГ + C,jH II OH + Н 2 О.
По мере уменьшения основности IIМIIИОВ ПjJ11менеНl1е оБЫ'IНОГО метода ДIIi1ЗОТ1ЧJOВЮШЯ
СТIIНОВIIТСЯ все более затруднительиым. так КIIК IIммониеВО-lIминное
в сторону трудно раствор"мого в воде основания:
Aг-NI-I 2
+Н
+
paBHOBeClte
смещается
+
+:t Aг-NH: 1 .
Поэтому с убываlшем осиовности аминов обычно увеЛllчивают концентрацию ЮIСЛОТЫ. с.1Iа­
(jOOCHoBHbIe aMI1HbI гладко диаЗОТ1tруются в 90-96%'Hoii серной Кllслоте нлlt с помощью
III1ТJJOЗlt.~серноЙ I(ИСЛОТЫ.
Так как соли диазония Llувствительны к повышеl1ИЮ температуры, ре­
акцию диазотирования ведут, охлаждая реакционную смесь JlЬДОМ, при
температуре не выше
5 ос.
Соли диазония -
В сухом состоянии они весьма взрывоопасны.
кристаллические вещества.
397
Образование диазосоединений из аминов можно предстаВИТI> следую­
щим образом. Азотистая кислота в кислой среде дает несколько диазоти­
рующих агентов (H 2NO;, N 2 О з , NO+, NOCI):
HN0:l
+ н+
;::t H:lNO~;
2HN0:l ;::t N:l0:1 + H:l0;
+ H+;::t NO+ + H:l0;
HN0:l + н+ + CI- ;::t NOCI + 1-I:l0.
I-IN°:l
Роль каждого из них в реакции зависит от концентрации кислоты
и амина. Взаимодействуя с аминами, все OIш дают нитрозоамины, превра­
щаются в кислой среде в соли диазония:
C(jH,,-NН:l
C(jH5-NН:l
+ NO+ + H:lO---,С(jН;;-NН-N=О + H:lO+;
+ H:lNO~ + н 2 о ---. C(jH,j-NI-I-N=О + 1-120+;
C(jH,,-NН:l
C(jH5-NН:l
+ N20:I - - - . C(jH,,-NН-N=О + HN0:l;
+ NOCI + H 2 0---,С(jН,,-NН-N=0 + н:р+ + СГ;
C(jH,,-NН-N=О;::t C(jh"-N=N-ОН~[С(jн,,N:l]+СГ + H:lO.
При IlOдщелачивании растворов солей диазония происходит образова­
ние диазогидроксида:
п
+п
[Ar-N=N] ... он
~
Ar-N=N-OH
Образование диазогидроксида объясняется тем, что при взаимодейст­
вии диазокатиона с гидроксильным ионом положительный заряд полно­
стью смещается к крайнему атому азота и между ним и гидроксильной
группой .возникает ковалентная связь.
Диазогидроксиды в свободном виде не выделены. В водных растворах
они ПРОЯВJIЯЮТ амфотерные свойства: при действии кислот дают соли диа­
зония, при действии щелочей
Ar-N=N-OH
-
дuазоmаmы:
+ NaOH---+[Аг-N=N-ОГNа+ + H:lO.
JlЩI:ЮТНТ IIНТI'ИlI
Диазогидроксиды, диазотаты, диазоцианиды и другие подобные веще­
ства
мах
с
-
группировкой-N=N-
с",.,.·
398
могут
существовать
в двух
СИН- и анmи-:
{/Нl/lи-
син·
(/НI/I{/-
фор­
Под подкислении диазотата образуется два таутомерных соедине­
ния
-
диазогидроксид и нumрозоам.uн:
б-
б-
[Aг-N=N-O[
ilИН:ЮНlIНО/l
_ -11+
~
Е ~ Ar-NH-N=O
110-
НIIИJlllИТlЮ30НМИII
Арилнитрозоамин плохо растворим в воде и Вblпадает в осадок. Диазогид­
роксид в кислой среде постепенно переходит в соль диазония.
Таким оБРllЗОМ, в растворах диазосоединения существуют диазокатио­
ны и диазоаНИОНbI: [AгN 2 ]+ и [АгN 2 О]-. Концентрацию того или иного
иона в Р1lстворе можно увеЛИ'IИТЬ изменением рН среды.
Общая схема рассмотренных взаИМНblХ превращений диазосоеДИliений
имеет вид
Физические и химические свойства
НlIибольший праКТИ'lеский интерес представляют соли диазония. Они
способны вступать в цеЛblЙ ряд превращений и ОТКРЫВlIЮТ путь К Сliнтезу
из lIМИIЮВ самых раЗЛИЧНblХ классов соединений.
Реакции солей диазония могут протекать с Вblделением и без выдле-­
Ния азота.
А. Реакции с выделением азота. 1. При кипячении КИCJIЫХ растворов
солей ДИllЗОНИЯ выдляетсяя азот и образуются фенолы:
[ArN~I+OSO;IH + H~O - + Аг-ОН + N~ +H2S04 .
Лучше всего применять д.nя этой цели соли серной кислоты, так как с
ДРУгими кислотами могут происходить поБо'Iныe явления.
2. При нагревании солей диазония с иодидом калия диазогруппа заме­
щается иодом:
[АгN~I+СГ + Ю-+Аг-I + N~ + КCI.
З. 311мещение диазогруппы на другие атомы или ГРУППbl требуе1' при­
менения в качестве катализаторов соответствующих солей меди ил\-! мед-
399
ного порошка (Л, Гаттерман, Т. ЗандмеЙер). Ниже приводится несколько
типичных реакций:
[С 6Н 5 N 2 ]+СГ ~Сu~ СнН 5 СI + N2:
/С(jН 5 N 2 ]+СГ + КВг ~Сu 2 ВГ 2] ~ С 6 Н5 Вг + КСI + N2;
[Сг.Н5N2]+СГ
+ К!Сu(СN)2]
~С6Н s СN
+ КСI + CuCN + N2;
[С(jН 5 N 2 ]+СГ + KSCN ~СuSСN] ~ C6Hs SCN + КСI + N2;
[Сг.Н5N21+СГ + NaONO ~СuNО 2 ] » C6H5N0 2 + NaCI + N2:
[С 6Н 5N 2 ]+СГ
[С6 Н s N 2 ]+СГ
+ NазAsОз
~С6Н5АsОзNа2
+ R-CH=NOH ~СuSО4];[NаfЮз]
8JJ1..дОКСИМ
+ NaCI + N2;
•
-N2;-H
--+ С 6 Н 5 -С = NOH
I
_.!:!~ C6H s -СО-R.
-NH 20H
R
Эти реакции MOryт быть использованы ДЛЯ получения ароматических
соединений различных классов.
Каталитическое действие солей медИ скорее всего связано с тем, что они
способствуют образованию арuльнblX радикалов, например, по схеме:
C(jH5N~
+ Си+ ~С(jН 5 N 2 + Си 2 +;
Нагревание фторборатных солей диазония является лучшим методом
введения фтора в ароматическое кольцо (реакция Шuм.ана):
в отличие от реакций Зандмейера промежуточной частицей здесь явля­
ется не ради~ал, а арильный катион. Разложение соли проходит по меха­
низму SNl.
4. А. Н. Несмеяновым разработан метод получения металлорганиче­
ских соединений многих металлов действием металлических порошков на
двойные соли диазония, например:
С(jН5N~СГ' HgCI 2 + 2Си ~С(jН 5 НgСI
+ N2 + Си2С12;
5. Некоторые восстанавливающие агенты MOryr быть использованы
для замещения диазониевой группы водородом. Фосфорноватистая кисло­
та дает ЛУ'Iшие выходы:
[АгN 2 ]+ОSОз Н
+ Н з Р0 2 + Н 2 О --+Аг-Н + N 2 + H 2S04 + НзРО з .
Можно проводить
восстановление
щелочным
раствором формаль­
дегида:
[АгN2]+ОSОзН + НСНО + 3NaOH ~АгН + N2 + Na2S04 + HCOONa + 2Н 2 О.
Восстановление дает возможность использовать аминогруппу для ак­
тивирования ядра или для требуемой ориентации; затем она может быть
удалена диазотированием и восстановлением. Этот принцип органическо­
го синтеза иллюстрируется следующим рядом реакций (получение
1,3. 5-трибромбензола):
6
+ -
;- I +звг2 ,. Bf.'9NH2I Вг +11 S0. Bf.'QN20S~:H
I Нз Р02 30 вгувг
I
NH2
"'::::,...
;-
-31IВг
"'::::,...
2
430
+NaN02
Вг
2,4,6-три6ром3IIИЛIIII
;-
"'::::,...
;-
Н 2О
'-
Вг
Вг
сернокислый
2,4,6 -три6ром6еllзолдиаЗOlIИЙ
',:\, 5 -ТJlИ6ром6ензол
Восстановление диазониевых соединений иногда достигается с по­
мощью алифатических спиртов, однако эта реакция часто сопровождается
образованием алкоксипроизводных:
+
[Аг N02 ] СГ+ СН з СН 2 -ОН
-(Ar-OC2 H5 +N 2+HCI
,;-0
Ar + N2 + Н СI + СНЗ-С'Н
[АгN2]+ОSОзН + СНзОН ~АгОСН з + N 2 + H 2S04·
В. Реакции без выделения азота. К реакциям диазосолей без выделе­
ния азота относятся реакции восстановления, окисления и сочетания.
1. Восстановление диазосоединениЙ. В мягких условиях при действии,
например, солянокислого раствора хлорида олова или цинковой пыли в
Уксусной кислоте диазосоли восстанавливаются с образованием солей
аРИлгидразинов:
[С 6 Н5 N 2 ]+СГ
+ 2SnCI2 + 4HCI--+C6H5 -NH-NH2 'HCI + 2SnC1 4·
солянокислыil
фенилгидраЗИl1
Эта реакция имеет большое значение, так как арилгидразины применя­
lOТся для получения некоторы красящих и лекарственных веществ, а так­
Же как реагенты на альдегиды и кетоны.
401
Окисление диаэосоединениЙ. При окислении диаэотатов перокси_
2.
дом водорода получаются нитроамины и нитроэогидроксиламины:
3. Реакция аэосочетания. Эта реакция легко идет при действии солей
диаэония на фенолы в слабощелочном растворе и на ароматические ами­
ны в слабокислом растворе:
'
[с.Н,N=Nj+СГ+О-' ОН
б
••
_
+NaOH
~
-NаСI; -Н 2 О
0-'
_
N = N_- o - '
ОН:
n-ДIIметилаМИllоазобеllЗОЛ
Аэосочетание
-
реакция электрофильного эамещения, аналогичная
нитрованию, сульфированию и галогенированию. Активным реагентом
является только диаэокатион (другие формы диаэосоединений в реакции
аэосочетания участия не принимают):
(СНЗ)2~+ [C6Hs -N=N]Т CГ~
~ [<СН З) 2N --О:
N-C6H5] CI-
~
~ (СНЗ)2N -Q--N=N-C6H5 + НСI
Диаэониевый ион эамещает водород только в ароматическом ядре, со­
держащем СI1ЛЬНО активирующие группы, такие, как амино- или гидрок'си­
льная группа. Сочетание не идет в сильнокислом растворе, так как ами­
ногруппа превращается в аммонийную. деэактивируюшую бенэольное
ядро. Сочетание с фенолами идёт в слабощелочной среде, так как фено­
ЛЯТНЫЙ ион эначительно активнее, чем сам фенол. Благодаря участию
в сопряжении с ядром свободных электронов кислородного атома повЫ­
шается электронная плотность в бенэольном ядре. Сочетание всегда идет
в n-положение. а если это положение эанято, то в о-положение.
402
в случае первичных и вторичных ароматических аминов в нейтральной
и слабокислой среде азогруппа вступает не в ароматическое ядро, а в ами­
ногруппу. Образуются диазоамин.осоедuн.ен.uя:
-----+C 6H 5N=N-NHC6H 5 + NaCI
+ СНзСООН.
диазоаминобензол
Под влиянием кислот при нагревании диазоаминосоединения превра­
щаютСЯ в аминоазосоединения. Это превращение не имеет характера мо­
ЛеКУЛЯРНОЙ перегруппировки. Оно идет через промежуточное образова­
ние соли диазония:
•
C,.H,N=N-NH-C
6 H,.•
• .•
+1-1+ -
+
~C6H5N2
+ C6H,NH
2~
.•
-НCI
ltиазоаМШlOБСllЗОJl
~o-N=N-o-NH2
аминоазобеНЗОJI
Азосоедин.ен.uя - вещества окрашенные, так как содержат хромо­
форн.ую группу -N=N-, способствуюшую поглощению света в види­
мой области спектра. Гидрокси- и аминоазосоединения являются кра­
сителями.
Ауксохромн.ые гидрокси- и аминогруппы углубляют цвет и способству­
ют связыванию красителей с волокном.
Появл'ение окраски обусловливается поглощением веществом света в интервале д.пин
волн Л = 400-800 нм. Этим д.1Iинам волн отвечает энергия 297,3-153,7 кДж/моль. По­
глощаемая энергия расходуется на возБУ)IЩение внешних электронов: эти электроны пере­
ходят на более высокую (обычно разрыхляющую) орбиталь. ВозБУ)IЩенная молекула может
далее путем перераспределения энергии диссоциировать или вернуться в основное состоя­
ние с излучеинем (флуоресценция нли фосфоресценция) нли без излучения.
Для появления окраски необходимо присутствие в соединении достаточно д.1IIIHHOli сопря­
женной системы кратных связей (хромофора).
Для того чтобы краситель связывался с волокном, необходимо, чтобы он содержал по­
Лярные группы, способные взаимодействовать с полярными группами волокна (nРЯ,llOе
Крашение), либо растворялся в волокне (дисперсионные красители), либо связывался
СДРУП1М веществом, нанесенным иа ткань (nротраllное крашение).
в современной промышленности азосоеДИllения составляют свыше по­
ловины красителей по номенклатуре и четверти по тоннажу.
В лабораторной практике в качестве ИНДlJкатора используется азокра­
ситель метиловый оран.жевыЙ:
403
Переход его из одной окрншенной формы в друryю в зависимости от peal(_
ции среды опредеJJяется равновесием:
'-:;)07, E-Q-'
(CH')2N
••
N-N
_
_
-h
110-
SO,,-О ~
L
ЖСJlТНII фОРМН
.... (CH,,';NONt:7-о- s0,-О­
н
КР~СIIЮI фОРМН
АзокраситеJJИ часто ПОJJучают непосредственно нн волокне (ледяное
крашение): сначаJJа обрабатывают ткань азосостаВJJяющей (каким -либо
феНОJJОМ ИJJИ амином), а затем наносят рисунок ледяным раствором ка­
КОЙ-JJибо СОJJИ диазония.
ГЛАВА
23
АРОМАТИЧЕСКИЕ АЛЬДЕГИДЫ И КЕТОНЫ
Для ароматических аJJьдегидов и кетонов, подобно анаJJОГИЧНЫМ соеди­
нениям жирного ряда, характерно наJJичие карБОНИJJЬНОЙ группы )с=о,
связанной с атомом углерода беНЗОJJЬНОГО ядра ИJJИ боковой цепи.
Альдегиды с карБОНИJJЬНОЙ группой первого типа обычно называют по
соответствующим им аромаТИ'lеским КИСJJотам '. а с карБОНИJJЬНОЙ груп­
пой в боковой цепи как аРИJJзамещение НJJьдегиды жирного ряда.
Например:
0_' c~O
"н
H:1C-o-CHO
'~CH2-CHO
H:1C - o - C H 2-CHO
*
tl-толуиловый альдегид
феюtЛуКеусный альдегид
Il-ТОЛIIЛУКСУСНЫЙ альдегид
По lIомеllКЛflтуре ИЮПАК ЦIIКЛIJllеСКllе альдепщы называют, добавляя К наЗВflНИЮ
углеВОДОРОДfl ОIШН'lflНllе -кар6алы)еzш}.
404
бензойный альдегид
КетОНЫ бывяют 'IИСТО ароматическими и жирноаРОМЯТИ'lескими. Назы­
вают их по радикалам, например:
' с-О'
0-
11
дифенилкетон или бензофенон
-
о
0' с-9'
-
11
o-толилФеЮIЛI<етон
-
о
СН:\
CH-c-Q'
.\
11
метилфенилкетон 11Л11 ацетофенон
-
о
1.
АРОМАТИЧЕСКИЕ AJ1ЬДЕГИДЫ
Способы получения
По способям ПОЛУ'lения и химическим свойствам аРОМЯТИ'lеские альде­
гиды напоминают соответствующие соединения ЖИРНОI'О ряда. Однако
имеются и некоторые существенные особенности.
1. Окисление углеводородов. Получение ароматических альдегидов,
особенно бензяльдегида, окислением углеводородов давно уже перестало
быть только лабораторным методом. Няиболее перспективно окисление
КИСJlОРОДОМ воздуха на катализаторе (например, ня У 2 О 5 ) и 111'1 оксидях
ураня и молибдена или в присутствии нитратов аммония-церия):
Можно Т~I<же применять и другие ОКllслители, н~пр"мер диоксид M~pгaHцa в 65%-Hoii
cepHoii Юlслоте пр" 40 ·С.
2. Гидролиз геминальных дигалогенопроизводных. До последнего вре­
мени бензойный альдегид получали превращением толуола в хлористый
беНЗИJIИДСН с последующим гидролизом:
Хлорировяние ведут при облучении. Полученный продукт фракциони­
РУЮт. Отвечающую хлористому бензилидену фракцию гидролизуют водой
при 95-100 ос в присутствии железного катализатора.
405
Этот меТОДIII:ПОJlьзуется 11 ДЛЯ получеНllЯ раЗЛllчныхзамещенных бензальдегидов,
мер Дllхлор6ензал!,деПlДiI IIЗ ДI1XJЮРТОЛУОJlИ:
Сl-I.\
СIЮ"
HanPII_
СНО
C I 6 C 1 2<:1, C I 6 c 1 11,0 C I ' 6C1
~
---=--;;.
+ 2HCI"
"1
"1
"1
~
~
~
-
Э. ГИДРОЛIIЗ 11 Ul<llслеНllе моногалогеНОIlРОI13ВОДНЫХ. Из галогеНОПРОllЗВОДНЫХ типа ХЛО­
ристого 6еНЗltла можно получат!' аЛl.дегиды, действуя на них, HanplIMep, ВОДIIЫМIt раство_
рами HltтpaTa СВIIнца IIЛII
MeJlII:
IIЛlI хромата калия в гексамеТИЛфОСфОТРllаМI1де (гексаметаполе) в ПРIIСУТСТВИИ краун-эфи_
ров (днцltклогеl(сил-18-краУII-6) (см. гл. 4) IIЛlI ионообменных смол. содержащих хромовую
КlIСЛОТУ.
4.
Прямое введение альдегидной группы в ядро. Для ароматического
ряда известны реакции прямого введения альдегидной группы, не имею­
щей аналогий в жирном ряду.
а) При действии на ароматические углеводороды смеси оксида углеро­
да (II) с НСI в присутствии катализатора (АIСl з
+ CU2C12) •
получаются
ароматические альдегиды. Бензол в эту реакцию вступает очень плохо.
Его гомологи дают альдегиды с выходом
на
-
50-60% (реакция Гаmmер.м.а­
Коха):
Предполагается, что в качестве промежуточного продукта здесь обра­
зуется неустойчивый хлористый формил.
б) Ароматические альдегиды получают также действием на углеводо­
роды ДИХJlOрметилового эфира в присутствии катализаторов реакции
Фриделя - Крафтса:
Аг-Н + CHCI~OCH~
ТЮ 1 • Аг-СНCI-ОСН;j~Аг-СНО.
В) Ароматические соединения (фенолы, эфиры, амины) формулируют
действием диалкиламидов муравьиной кислоты и РОСl з (реакция вuльс­
.м.еЙера):
Аг-Н + HCON(CH~)~
POCI:1
•
Аг-СНО + (CH:I)~NH
+
-Н +
/ CI
Н О
,#0
~r-:-H+(CH:I)~N-CI-H ~Aг-CH
~ Ar-CZ
CI
"-N (СН)2
Н
#
О
CI
1
+
OPOCI~
CI
_
(CH\)2 N- C"-H+ POCI:I ~ (Cl-l.\)2 N -cr- н ~ [(CH)2N-1-H)OPOCI~
*
406
Под давлеНltем реаКЦIIЯ IlДeT 11 без Cll,CI,.
5.
получение ароматических альдегидов из производных кислот. Этот
способ находит большое применение. Так, например, на палладиевых
никелевых катализаторах удается восстанавливать хлорангидриды кис­
и ОТ до альдегидов. Катализатор обычно несколько отравляют серой, что-
л
u
бы предупредить дальнеишее восстановление альдегида в спирт
Розен.м.унда) :
6.
(
реакция
CljH,,-СО-CI.J!:!4 C(jH"-СНО.
Другие способы. Для получения ароматических альдегидов могут
быть ИСIЮЛЬ30ваны различные способы, применяемые и для ПОЛУ'lения
альдегидОВ жирного ряда: окисление первичных спиртов, синтезы с учас­
тием магнийорганических соединений и др.
Физические и химические свойства
Ароматические альдегиды - большей частью нерастворимые в воде
жидкости с запахом горьких миндалей. Альдегиды с удаленной от ядра
карбонильной группой имеют более резкий запах.
Ароматические альдегиды вступают в большинство реакций, свойст­
венных альдегидам жирного ряда. Они окисляются оксидом серебра до
кислот с тем же числом углеродных атомов. Присоединяют синильную
кислоту и гидросульфит натрия. Реагируют с гидроксиламином, гидрази­
ном и его производными с образованием кристаллических веществ.
Альдегиды типа бензойного не способны к альдольной конденсации, ха­
рактерной для альдегидов жирного ряда, так как не имеют атомов водоро­
да в а-положении к карбонильной группе.
Однако для ароматических альдегидов возможны и такие превращения,
которые не характерны для альдегидов жирного ряда:
1.
Ароматические альдегиды при хранении с доступом воздуха в корот­
кое время самопроизвольно окисляются до кислот. Окисление ускоряется
светом и катализаторами солями металлов, например железа. Реакция
имеет цепной радикальный характер, причем в качестве промежуто'lНЫХ
ПРодуктов получаются гидропероксиды. Пероксиды легко обнаруживают­
ся в окисленном бензальдегиде:
АгСНО
+ '/у _ _ Аг-СНО*;
+ Аг-СНО __ Лг-СО· + Лг-СН-ОН;
+ 02 __ Аг-СО-ОО·;
Аг-СО:; + Аг-СНО __ Аг-СО-ООН + Аг-СО·;
Аг-СО-ООН + Аг-СНО __ 2Аг-СООН.
ЛГ-СНО*
Аг-СО·
Окисление предотвращается присутствием ничтожных количеств инги­
биторов (фенолов или аминов). Присутствие 0,001% гидрохинона задер­
ЖИвает окисление бензальдегида. Это указывает на цепной характер
реакции.
2. В отличие от альдегидов жирного ряда ароматические альдегиды реа­
3 : 2. Из бензойного альдегида
ГНруют с аммиаком в молярном отношении
407
получается гuдро6ензамuд, превращающийся при нагревании в присут.
ствии кислот вамарин:
С("Н,-СНО
• ,.
+
С(;Н;;-СНО
H2NH
+ ОНС-С(;Н;; ~
H2NH
'2
C("H,-CH=N"
• ,.
/CH-C(;H,,~
C(;H,,-CH=N
('НlllюtiС((:IИМНI!
ИМИРНII
3. Ароматические альдегиды полимеризуются гораздо труднее, чем
альдегиды алифатического ряда из-за большей стабильности их протони.
рованной формы (стабилизация сопряжением).
4. В присутствии водного или спиртового раствора щелочи (50%) аро­
матические альдегиды образуют соответствующие спирт и соль кислоты
(реакция Каннuццаро):
С(;Н,,-СНО
+ КОН + C(;Hii-СНО ---+ C(jHii-СООК + СпН,,-сн 2 он.
БОЛhШИНСТВО альдегидов жирного ряда в этих условиях подвергается
осмолению·, однако если в молекуле альдегида отсутствуют атомы водо,
рода в а.-положении, то реакция протекает вполне гладко (гл.
5.1).
Вероятный механизм реакции, происходящей в водной среде, следую·
щий. Альдегид присоединяет гидроксильный ион и образующийся анион
либо непосредственно (а), либо после взаимодействия еще с одним гид­
роксильным ионом (6) передает гидридный анион другой молекуле аль·
дегида:
0-
О
11
R-C-H + Он Е
..
1
R-C-H
(11)
1
ОН
0-
н
О
н
еn- l
I!
l_
R-C-H + с=о ~ R-C + н-с-о
1
он
1
1
1
ОН
R
(6)
R
н
0-
0-
I
+с={)
О
1
1)
I
11
R-C-H ~ R-C.J::'H ---=..:H,---;..
~ R-C +
1 -IIР
1)
1
он
O~
0-
Н
1
1
I-I-С-ОR
* в других УСЛОВIIЯХ. например npl1 нагревании с водиыми Pi'lCTBOpaMI1 Гl1ДРОКСИДОВ
щеЛО'lно-эемельных металлов. в реакцию Канииццаро вступают 11 альдегиды. содержаши е
а-водородные атомы, lIanplIMep IIЭОМ8СЛЯНЫЙ альдеГlIД.
408
Образующиеся анионы кислоты и спирта взаимодействуют с водой:
О
О
11
R-C-OR-CH 2 -O-
11
+ H~O ~ R-C-OH + ОН-;
+ H~O ~ R-CH 2 -OH + ОН-.
При нагревании ароматического альдегида с избытком муравьиного
альдегида в присутствии концентрированного раствора едкого натра аро­
матичеСI<ИЙ aJlьдегид полностью восстанавливается в соответствующий
спирт, в то время как муравьиный альдегид окисляется в муравьиную кис­
лоту (смешанная реа/(,ция Канниццаро):
СпН,,-СНО
+ Н-СНО + NaOH
----. НС,дi-СН20Н
+ H-СООNа.
5. АромаТИ'lеские альдегиды очень легко вступают в реакции конден­
сации с альдегидами, кетонами, эфирами и ангидридами кислот жирного
ряда. Рассмотрим примеры таких реакций:
а) конденсация Кляйзена:
CI;Hfi-СН=СН-СО-СН:\
C1;Hfi-СНО + СН:\-СО-СН:\ - { •
.
(iCII:<:JII:C~()1I
. _.
..
Сt;Нг.-СН-СН-СО-СН-СН-СI;Н!i
JuiCiСI13ИJlI,ИIIСТOII
C1iH,,-СНО
+
CH:I-СО-С'jНг.~ C(jH 5 -СН=СН-СО-С(jН".
(jеШlаJllllIl~еТ(}фСIIOII
C(jH,,-СНО
+ CH:I-COOC2H,,~ C 1jH,,-СН=СН-СООС 2 Н:i :
ЭТШIOВЫЙ '1ф11Р КЩНt'llюi.j КН~ЮТIII
б) реакция Пер/(,ина:
C1jH,,-СНО
+ (CH:I-CO)~O
СН:!СООК • c.H"-СН=СН-СООН.
175-180.C
11.1
ВО всех этих случаях в качестве катализаторов применяются щелочные
реагенты. Механизму этих реакций посвящено большое 'IИСЛО работ. Ве­
РОЯТный механизм реакции Перкина выражается схемой (ср. со схемой
альдольной конденсации):
СН:!-СОО-
+ CHa-СО-О-СО-СН:! ~
~
CH:1-COOH
+ CH 2-CO-0-CO-CH:1:
О
CI·H,-C(
+ СI-I .. -СО-О-СО-Сн..---+••
'Н'
•
0~
I
C1·H,-CH-CH.-CO-0-CO-CH.
,.,.
..
-11.,0
-
>"
(СII:РЮII)
409
--+
C(·Hr.-СН=СН-СО-О-СО-СНj ~
J
,)
I
--+
6.
C(jH"-СН=СН-СООН+СН:j-СООН.
Аналогично проходят реакции между ароматическими альдегидами It
ароматическими соединениями с подвижными атомами водорода. Так, на­
пример, большое значение в синтезе красителей имеет реакция конденса_
ции альдегидов с фенолами и ароматическими аминами. Так получают
красители трифенилметанового ряда (гл. 25.2):
J:)-OH
U-
c(.H,-CHO+2c(.HДH~H.,o+O-' CH~
)
••
)
.)
<
-
OH
7. с первичными ароматическими аминами альдегиды образуют азо­
метины (гл. 21), с третичными - производные трифенилметана (гл. 26):
8. СпецифичноЙ.д.ля ароматических альдегидов является бензоиновая
конденсация, идущая под влиянием солей синильной кислоты (Н. Н. Зи­
нин). В жирном ряду такие конденсации идут только при действии
энзимов:
ChH,,-СН=О
+
ChH,,-СН=О--+ C(jH,,-СН(ОН)-СО-С(jН,,--+
()СШOlIII
()СIIЗИJl
Бензоил легко окисляется в дикетон бензuл. ~еханизм бензоиновой
конденсации:
CN
CN
f"',1
1
Аг-С=О + CN? Аг-С-О-? Аг-С-ОН
1
1
н
н
-о
CN
CN
ОН
"
1
1 (1
1
Аг-С=О + -С-Аг? Аг-С-С-Аг? А('-С-С-Аг + CN1
1
1 1
1 11
н
9.
ОН
н
ОН
н
О
При действии хлора на бензальдегид получается хлорангидрид бен·
зойной кислоты:
10., При 'Э'лектрофильном замещении альдегидная группа направляет
заместители в м-положение. Так, например. при нитровании бензальдегИ·
да образуется м-нитробензальдегид:
()I
СНО
~
410
-IINO.
~
Отдельные представители. Применение
ИЗ Щ1ОмаТИ'lеских яльдсгид()в наибольшее зна'lение имеет бенаальде­
- жидкость с зяпахом горького миндялSl. Т. кип. 179 ос. На воздухе
бысТРО окисляется в 6ензойную кислоту и поэтому хранится в доверху lIа­
гид
nOJ1lICHHbIX и плотно закрытых склянках. БеllЗЯJlьдегид встречается в виде
гликозидя амигдалина в масле горьких миндалеи, в косточках вишни, 1'16рикоса, персика и т. д. Амигдалин под влиянием энзимов дает бевза.'lbде­
гид,
синильную
кислоту
и
генцио6иозу
(дисахарид -
6-ГJlIОКОЗИДО­
глюкозу):
CliH:.CH(CN)-О-СllНlIОIIl
+ HlO ----+ C1iH,,:-СНО + HCN + CIlH2l011'
Бензальдегид широко применяется в производстве красителей, души­
стых веществ.
В парфюмерной ПРОМЫШJlенности применяется коричный альдегид
С 6 Н 5 -СН=СН-СНО.
2.
ЗАМЕЩЕННЫЕ АРОМАТИЧЕСКИЕ АЛЬДЕГИДЫ.
ГИДРОКСИАЛЬДЕГИДЫ
Из зямещенных ЯРОМЯТl1чеСЮIХ яльдеГИДОR Н~llбольшес зн~ченне IIMelOT Г1tд1JOI\СII~льде·
Гlt.lbI. Их IlОЛУ'I~IOТ ОЮlслеН11ем фенолов с непредеЛЬНЫМlt Р~Дltl(~JШМI1:
ОН
<:т
~
I
ОСНа
~
СН=СН-СН: 1
IIИIIIIJlIШ
I1ЛI1 реакцией ТШlUна
6
01-1
РеLiJlшра:
-
.
: I + CHCI
2+
3NaOH
~
~CHO
(J
+ 3NaCI +
2Нр
С;.lJII11LНJIOШ.li", tlJll.JLСГИJL
Последняя реаlЩltя идет толы<о с фенолаМ11. но не с их ,Фl1раМ11. В I\ачестве поБОЧIIЫХ про·
ЦУКТОLl получаются кеТОIIЫ. Мехинltзм peaKЦlII1:
CHCl a+ NиОН ~ :CCI 2 + NиСI + HP
6 <:С', dtш;
+
--'>-
--'>-
ЬСНС', ;:,':::,r 6рю
НЯllfiольшее знячение из оксиильдепlДОВ I1меет саЛIЩIIЛ()(lы!i алы)егl/(). ОН 8С·I речиется
8 ПРllроде. Главное его применеНllе - синтез KYMapl1Ha (гл. 24) 11 иеl\UТОРЫХ I\раСl1телеii.
ШIlРОКО Прltменяется в Ka'IeCTBe вкусового средства (/l/НI1ЛIIН. ЯВJIЯIOIШIЙСЯ В ТО же время
половым феромоном самцов КJlопа·черепаШЮI.
411
3.
АРОМАТИЧЕСКИЕ КЕТОНЫ
Способы получения
Для получения ароматических кетонов могут быть использованы мно­
гие методы получения кетонов жирного ряда, например окисление вто-
.
ричных ароматических спиртов:
С6 Н 5 -СНОН .JQ4 Н2 О + C 6H 5 -СО-СН з ·
I
СНз
Кроме того, имеются и специфические методы получения кетонов Этого
ряда.
1. Основным методом получения ароматических кетонов служит реак­
ция Фриделя - Крафтса:
С6 Н 6 + CI-СО-СН з ~lQз ) C G H 5 -СО-СН з + HCI.
хлорнстыА ацетил
Предполагается, что хлорид алюминия образует с хлорангидридом ком­
плекс, который становится активным началом в реакции под влиянием из­
бытка хлорида алюминия:
СНз-СОCl
+ АlCl з ~[СНз-СО)+ AICI4'
СНз
[сн,-со] "a;+c,н.~~~O ] AlCI.~
+311.0
~ C 6 Hr.-СО-СН з · АlCl з ~ C 6 Hr.-СО-СН з + AI(ОН)з
"
-31-ICI"
В качестве исходных веществ ДJJЯ этой реакции могут применяться уг­
леводороды, эфиры фенолов.
2. Непредельные ароматические кетоны получают конденсацией аро­
матических альдегидов с жирными кетонами:
CljH'i-СНО
•
-Н о
+ HaC-СО-СН
з -~ CGHG-СН=СН-СО-СН з ·
.
(НО-I
З. Ароматические оксикетоны получают реакцией Фриса (гл.
'
0-
о_с(О нэомернэация~
СНз
_
20):
'~C~OH
СНз
~_
n-ГIlдpОКСИ3 1 lетоФенои
фСIIИJI3IIL'Т"dТ
4. Для ПОЛ)'Чl!ния ароматических фенолокетонов применяется также метод Геша. ис­
ходными веществами являются многоатомные фенолы, особенно с ГIIДРОКСИЛЬНЫМИ группа­
ми B,I!-положеИIlИ:
НОуОН
Н~НVЗ
С N~~HCI+H20~
I +С~з-СN;Н.CI ~ ~ I
'ОН
412
(ZnCI2 1; О С
'ОН
-NH 4C1
O=C-СН з
H o h OH
У
ОН
Физические и химические свойства
Ароматические кетоны
-
жидкости или твердые вещества с приятным
цветочным запахом. Нерастворимы в воде.
Ароматические кетоны менее реакционноспособны, чем кетоны жир­
ноГО ряда; они, например, не реагируют с гидросульфитом натрия.
1.
Большинство кетонов реагирует с гидроксиламином и производны­
МИ гидразина по обычной схеме (механизм см. гл.
АГ2С=О
5.1):
+ H 2NOH ---+ Н 2 О + Ar2C=NOH;
кетоксимы
АГ2С=О
+ Н 2 О + H 2N-NH-C6H 5 ---+ Н2 О + АГ2С=N-NН-С6Н5'
фенилгидраЗОIIЫ
ИЗ всех этих азотистых производных кетонов наибольший интерес
представляют оксимы.
Оксимы ароматических несимметричных кетонов существуют в двух
геометрически изомерных формах, син- и анmи-:
C6Hs-n-С6Н40R
СБНS-n-С6Н40R
HO-N
N-OH
сuн-кетоксим
анmи-кетокснм
Более стойкой является анmи-форма. Она получается из син-формы
действием
кислот.
Облучением
можно
превратить
анmи-форму
в син-фОрму. Все эти превращения напоминают переход малеиновой кис­
лоты в фумаровую и обратно (рис.
62).
Aг.~
____
AГ~--AH
\\:~"'7:/'? Аг-С-Н
\ )(, /
':: "
...... "
\...
\ "
\ ...
'.',
-A--н
,
,
, I
I
I
' : Аг-С-Н
11
'\ /", /
N-OH
, -;,
11
HO-N
""
HOt~"
':~'OH
•••• ~•• N
N~-~~~~
а
PIIC. 62.
СхемаТllческое изображеИllе строения оксимов ароматических альдегидов:
а
-
син-форма;
6-
анти-форма
син-Формой принято считать изомер, содержащий меньший радикал
в ЦиС-положении с гидроксильной группой оксима.
Дnя оксимов кетонов обозначеиия син- и анти- неудобны, так как при этом обязательно
надо указывать, по отношению к какому из радикалов находится в син- или анти-положении
ГИдроксильная группа. Поэтому д.nя однозначного обозначения конфигурации оксимов все
чаще используется E,Z-Сlfстема, в которой старшинство заместителей определяется подсче­
том атомных номеров (гл. 1.2). Обозначение Z соответствует при этом цuс-положению стар­
ШИХ групп, обозначение Е - их транс-положению. Приведенные ранее стереоизомеры ок­
симов получают следующие названия:
СUН-бензальдоксиw. - Е-бензальдоксим;
антU-бензальдоксим - Z-бензальдоксим;
Сuн-т-бромацетофеноноксим
-
а нтu ,т- бромацетофеноноксим
Е-т-бромацетофеноноксим;
- Z-т-бромацетофеноноксим.
413
OI\CllMbI ЖllрноаромаТllllеСКlIХ l<eToHoB обычно (НО не всегда) существуют в одной БОJ\е
cToill<oil форме. Возможно. это связано со способность IIX 1< таутомерИII. I\оторая ведет к пе~
реходу одного ОКСI1МЯ в другой. более СТОlll\иii:
C(.H,-C-CH1 ?
,.. 11
.
HO-N
С(.Н.--С=СН, ?С(.Н,-С-СН,
•.•
1
"
N(OH)
..,
11
.
N-OH
cuh.-lt:ЮМСI)
аНftШ-II:ЮМЩ'
J-IЯЛllчне :lяместителеii в бензоЛl.ном ядре повышает стабильность стереОl1зомерных ОК­
шмов; т3(,. например. 2-бром-5-НIпроацетоФеНОНОI<СIIМ существует в Вl1де устоilЧI1ВЫХСUН_
ahml/-фОРМ с т. пл. 171 11 132·С соответственно.
11
Большое
зн(\чение
происходящая
под
имеет
влиянием
бекм(\новск(\я
перегруппировка оксимов,
концентрироваННblХ
минер(\льных
КИслот,
хлорангидридов и ангидридов кислот. Два изомеРНblХ оксида дают при
этом два изомерных амида:
С(.Н,-С-С(.НДСН., ~HO-C-C(.H.oCH,?O=C-C(.H IOCH,
,..
11
.,.
N-OH
11""
N-C(;H"
1'"
NH-Сt;Н"
UHII1Il-Ф~II"JI-f/-МСТОК­
аШIJШJL fl-МСТОКСlt­
С~lф~IIIIJ1К~Т()КСI1М
()t'II:ШЙlюi", КИСJIOТI.,
C,.H,-C-C(.H'IOCH,~ С(.Н,-С-ОН
•.•
11
•
HO-N
.
•.•
11
?
С,.Н.--СО
•.•
1
NH-Сt;НрСН:,
CH:,OC1;H.1-N
CUH-ф~IIIIJI-f/-М~ТОКСII­
ЮlfШIД (iСII:шiIllОЙ
фl'lIlIJIКСТОКСIIМ
KIICJlOTI~1
Предполагаемый мехаНI1ЗМ -~Toii переГРУПГJIIРОВЮI следующий:
2.
Присоединение водорода к ароматическим кетонам в раЗЛИLIНЫХ
условиях приводит к раЗЛИЧНblМ проДУктам_ При каталитическом восста­
новлении кетонов с а-положением карбонильной группы по отношениЮ
к бензольному ядру образуются углеводороды:
Восстановление по Клименсену
-
нагреванием альдегидов или кетона
с амальгамой цинка в водной HCI - также приводит к углеводородам.
При восстановлении щеЛОЧНblМИ метаJIлами в апротонных растворите­
JIЯХ кстоны изучаемого ряда дают пинаконы:
2(C(;H,,)~CO ~
(С('Н')2 С - ОН
•.• 1
(C1;H)2C- OH
414
здесЬ имеет место перенос электрона от металла к карбонилу:
R' R
I I
I I
0- 0-
R-C-C-R'
3.
Магнийорганические
БОЛЬШИНСТВУ кетонов (гл.
4.
соединения
нормально
присоединяются
к
3.1).
Присоединение щелочных металлов к чисто ароматическим кетонам дает металлкети­
лЫ. Это I,нтенсивно окрашенные вещества, которым приписывается радикальная структура:
5.
Жирноароматические кетоны легко окисляются. При окислении Se02 они дают аль­
дегидокетоны или а-дикетоны:
+SC 02
)
СпН,,-СО-СНО:
+ SC 02 ) снн,,-СО-СО-СН:\.
При действии более сильных окислителей образуются аромаТII'lеские кислоты.
б. ЖltрноаромаТИ'lеские кетоны благодаря ПОДВllжностlt водородных атомов у а-угле­
родного атома весьма склонны к реакциям замещения водородных атомов. Так, они легко га­
логеНltруются, причем даже в присутствии таких катализаторов, как железо, замещение идет
в боковой цепи:
+ ВГ 2
C(jH:"I-СО-СН:i--~) ChH 5 -СО-СН 2 Вг
БРОММСТИJlФСllИJlКСТOII
~ C'iH:j-СО-СНВГ2
+ ВГ 2
) C'iHii-СО-СВг:\.
диБРОММСТIIJI-
тр"(jРОММСТИJI-
ФСIIИJIКСТ()II
феШIJlКСТ()II
Моногалогенозамещенные ацетофенона называют фенuцuлгuлогенur}UАШ. Они приме­
Няютея для идентификаЦИII кислот (в виде фенациловых эфиров). Лакриматоры.
7. По той же причине жирноароматические кетоны способны к раз­
ЛИчным реакциям конденсации за счет а.-водородных атомов по отноше­
нию к карбонильной группе:
а) конденсация Кляйзена:
C1iH,j-СО-СН: i
+ CHO-С'iН" ~ ChH,,-СО-СН=СН-СнН,,:
l.'uh-(jСII:ЮНJIФСllliJI'-:tТИJIСII
C1iH,,-СО-СН а
+ CH:i-СО-СfiН" ~ CtiH,,-С(СН;i)=СН-СО-С1iН,,:
ДlIIIII()1I
б) реакция Манниха:
C1iH,,-СО-СН:i + CHlO + (NH(C fi H ii )2]' НСI ~
~(С(jН,,-СО-СН2-СН2N(С(iН,,)2]'НСI
+ Н 2 О.
415
Возможный механизм:
9.
Чисто ароматические кетоны расщепляются амидом натрия по СХе­
ме:
ОNи
_
_
+NaN 112
(C1;Hr.)2 CO
l
_
_.
+IICI.
_
~ Ct;H,;-т-сг.Нr. -CHII:~ ChHr.-П-ОNа ~ C1;H 5-CONH 2
NH 2
NH
Эта реакция позволяет устанавливать строение кетонов.
Отдельные представители. Применение
Ацеmофенон - т. пл. 20 "С, т. кип. 202 "с. Имеет запах цветов чере­
мухи. Встречается в каменноугольной смоле. Ацетофенон в настоящее
время производит в промышленных масштабах каталитическим окислени­
ем этил бензола кислородом воздуха:
CtiH5-СН2-СН:1
+ 02
+Sc02
_
) CtiH'j-СО-СН' 1
130 ·С; 3,5 зтм'
,
+ Н 2 О.
Применяется в паРфlOмерии.
Бензофенон существует в двух модификациях с т. пл.
27 и 49
"с. Устой­
чивой является последняя. Применяется в парфюмерной промышлен­
ности.
Галогенозамещенные о-аминобензофеноны
применяются
в синтезе
большой группы успокаивающих лекарственных препаратов (транквили­
заторов) производных бензазепина, например mазеnама
(7 -хлор-2,З-ДИ­
гидро-З-окси-5-фенил-l Н-l,4-диазепин-2-0Н):
1
.
2
NH-CH
CXI 5 _ _ 4 /
7~
('
. NH-CH~
(:(
~
:lCН
C--N
'6
CI
~
I
"(НОН
C=N/
6
ТИ:tСllам
416
4.
ХинОНЫ -
ХИНОНЫ
специфический класс циклических карбонильных соедине­
ний. Они не являются в CTporOM смысле ароматическими соединениями.
Ядро хинона не проявляет ароматического характера. Однако хиноны так
легко получаются из ароматических соединений и так легко в них перехо­
дят. что оказывается наиболее целесообразным рассматривать их при
изучении соединений ароматического ряда. Первый представитель ряда
хинонов - n-бензохинон - был получен А. А. Воскресенским в 1838 r.
окислением хинной кислоты, откуда и получил название весь класс соеди­
нениЙ. 0- и n-Хиноны имеют строение непредельных аЛИЦИКЛИ'lеских ди­
кетоНОВ:
6
о
Замещенные хиноны встречаются в природе в форме пигментов в рас­
тениях, включая бактерии и грибы.
Способы получения
Хиноны
в К<lчестве
Н<lиболее
о-Хиноны
в качестве
получают окислением 0- и n-дизамещенных бензола, причем
заместителей MOryT фигурировать гидрокси- или аминогруппы.
легко образуются n-хиноны, так как они более устойчивы.
надо получать в отсутствие воды. В СЛУ'lае окисления аминов
промежуточных продуктов образуются хинонимины:
6 ~ 6 '~.'''".'''". ~~rr~n
NH 2
N~
NHOH
у
О
NH
-11,0
У
ОН
-NII'I
о
У
О
ХIIIЮIIМОIIOIIМIIII
но-О-' он ~
O~O
-11/1
""=г"
l'IVIIIOХШЮII
XItlIOII
Особенно легко получается n-хинон при окислении гидрохинона.
В Промышленности n-бензохинон получают окислением анилина хромо­
вой КИСJlОТОЙ.
Наllболее удобным окислителем является соль ФреАIlI NO(SO:IK)2' Применяют также
FeCI:1. Ag2CO:1" др. В()JМОЖНО
14 З•. 181
It
электрохимическое окислеllllе бензола.
417
Физические свойства
Хиноны
вещества кристаллические и обычно имеют интеНСИВНУIQ
-
окраску: n-хиноны
желтую, о-хиноны
-
оранжевую или красную. Ле­
-
тучи с водяным паром. Образуют яркоокрашенные молекулярные соеди­
нения с фенолами - комплексы с переносом заряда (КПЗ) СДОНОрНо-ак_
цепторными связями:
О=<
С троение
)=0
но---@-он
.!'
~
и особенности таких комплексов подробно рассматриваются';·'.
в курсах общей и неорганической химии.
Соединение
рон
-
хинона
с
гидрохиноном
'
-
так
называемый
хингuд~,
применяется д/lя определения концентрации водородных ионов 8~
растворе.
Химические свойства
Хиноны вступают в ряд обычных д/lЯ кетонов реакций.
1.
'"
С солянокислым гидроксиламином n-бензохинон образует моно- и!'
диоксимы, способные к таутомерии.
H0-o-N=O
t~
0=0=0
+NllpII
-IIP
_
~ O~NOH
~_
---;о. HONONOH ?
+NIIpII
-IIP
~
HONH-o-N=O
;.'.
I
'.>j~,
2.
Хиноны присоединяют бром. Продукты реакции легко теряют бро- '!
моводород И дают замещенные хиноны:
oOO+Bг2....."..HBг+0~0
"=<вг
3.
ХИНОНIoI весьма реакционноспособные диенофилы и легко вступаюТ
(11CH~ WIСНа
в реакцию диенового синтеза:
СН
нС'
2+
не
~
СН 2
418
О
О
О
О
Эта реакция применяется в синтезе красителей и лекарственных ве­
lllесТВ, например М,еmuн.он.а (с.
4.
420).
Во многих превращениях хинонов применяют участие одновременно
карбонильная и этиленовая двойные связи. Это реакция
1,4-
и 1,6-присо­
единения. Таким путем хиноны очень легко присоединяют водород, пре­
вращаясь в гидрохиноны:
ф+~~~
Ю
ОН
Бензохинон восстанавливается в гидрохинон быстро и количественно. Этот процесс мо­
жет быть представлен электрохимическим уравнением:
СНН 4 О 2
Таблиц!!
Нормальные
16.
потенциалыхинонов
ХИНОН
+ 2Н+ + 2е-
+=t C1iH 4(OH)2'
Нормальный окислительно-восстановительный по·
тенциал пары XI!HOH - двухатомный фенол характе­
ризует окttСЛllТельные свойства хинонов или восста­
Нормальный
новительные свойства отвечающих 11М двухатомных
потенциал. В
фенолов. Нормальные потенциалы некоторых хино­
()·БеНЗОХИНОII
0.792
0.699
0.555
0,470
II-Бензохttнон
~-НафТОХItНОН
а-Н!!фтохинон
нов приведены в табл.
Как видно из табл.
16.
16,
()-ХИIIОНЫ имеют большие
нормальные ОКИСЛllТельно,восстановttтельные
циалы.
потен,
'ITO соответствует 11Х меньшей УСТОЙ'lIiВОСТИ.
Следует заметить. что элеlпронодонорные заместltтели
повышают, а электроноаlщепторные ПОНИЖ!!ЮТ окис-
Лllтельно-восстановительный потенциал хинонов.
Окt!слительно-восст!!новttтельные пары хинон­
двухатомный фенол широко используются при определении электродных потеНЦlt!!ЛОВ в фи31t1{Q·хltмнческих исследованиях.
5.
Аналогично
NаНSО з (8):
а)
б)
присоединяются
о
ОН
О
О
галогеноводороды
(а),
HCN (6),
ОН
rr~~CI'~~
у
VH ~CI
Q
(r
о +IICN~ I ~
У
О
О
<i
ОН
CN
Е"
;-
Н'
I
CN
ОН
(1)
419
6.
НарядУ с реакциями присоединення д.nя хннонов характерны и некоторые реакции
замещення.
7.
Хиноны реагируют сдиазосоединениями с выделением азота н образованием ПРОдУк.
тов арилирования:
~CГoH
V
.:N,+HCI
..
О
ОтдеЛЬНblе представители. Применение
Наибольшее значение имеет n-бензохинон. Золотисто-желтые крис­
таллы с т. пл.
166 ос.
-
Его производное
Служит сырьем для получения гидрохинона.
хлоранил
-
применяется как окислитель в про­
изводстве красителей, а также резины:
ClyyCI
CIYCI
О
О
XJЮРИIIИJI
n- Толухинон является промежуточным продуктом в синтезе витамина
кз (метинона) (гл. 26.1).
Многие ПРОllзводные хинона встречаются в пр"роде. Среди них СЛедУет упомянуть iJue-.
mшссихинон. который содержится в лекарственном растении Atlonis !Jl!гnalis; Фумига­
тин - красящее вещество плесени; ПРОlIзводные 2.5·дIIФенилбензохинона - пигмеиты
грибов. В частности, пигмент этого вида содержится в красной I<ОЖlще мухомора -
руфин:
О
",ус"а- о
~
О
СНРnО<Ж.
.у
CH,yyo~
VOCH:1
О
О
JUIМСТОКСИХIШОII
ФУМШ'ИТlIII
мусКltРУфlll1
ПРОll3ВОДНЫМИ ХIIНОНОВ являются также многие И3 при меняемых в настоящее времЯ
краСllтenеЙ.
420
00
о
ГЛАВА
24
АРОМАТИЧЕСКИЕ КАРБОНОВЫЕ КИСЛОТЫ
Ароматическими
карбоновыми
кислотами назыавются
производные
беНЗОJlа, содержащие карбоксильные группы, непосредственно связан­
ные с углеродными атомами бензольного ядра. Кислоты, содержюцие кар­
боксильные
группы
в
боковой
цепи,
рассматриваются
как
жирно­
ароматические.
Ароматические кислоты могут быть разделены по количеству карбо­
ксильных групп на одно-, двух- и более основные. Названия кислот, у ко­
торых карбоксильная группа непосредственно связана с ядром, произво­
дятся от ароматических углеводородов. Названия кислот с карбоксилом в
боковой цепи производятся обычно от наименований соответствующих
кислот жирного ряда. Наибольшее зна'lение имеют кислоты первого типа:
например, бензойная (бензолкарбоновая) С 6 Н 5 -СООН, n-толуиловая
(n-толуолкарБОllовая), фталевая (1 ,2-бензолдикарбоновая), изофталевая
(1 ,З-беllзолдикарбоновая),терефталевая (1 ,4-бензолдикарбоновая):
АН ЛООН ~H
У
C~
() U
АН
У
COOH
ОООН
Il-ТШIУ()J1О1IИЯ
ФТИJIСIIИII
l1:\офТИJIСII""
тсрсфТ"J1СIl""
КИCJЮТ"
КI1CJ!ОПI
КI1CJЮТИ
Кl1СJIOПI
Из кислот второго типа отметим фенилуксусную кислоту
нилуксусную, или 2-феllилпропановую, кислоту
(1),
метилфе­
(Il):
СН. 1
I.
C ti H 5 -СН 2 -СООН
ChH,,-СН-СООН
II
д. ОДНООСНОВНЫЕ ДРОМДТИЧЕСКИЕ КИСЛОТЫ
Способы получения
Одноосновные карбоновые кислоты ароматического ряда могут быть
получены всеми общими способами, известными д.т1я кислот жирного
РЯДЯ. Здесь будут рассмотрены только специфические наиболее 'racTo
ПРflменяемые способы.
1. Окисление алкильных групп гомологов бензола. Это один из наибо­
Jlee Чясто применяемых способов ПОJlучения аромати'rеских КИСJlОТ:
CtiH"-СН:1 ~ ChH,,-СООН + Н 2 О
421
Окисление проводят либо при кипячении углеводорода с щелочным
раствором перманганата калия, J\ибо при нагревании в запаянных трубках
С разбавленной азотной кислотой. Как правило, этот метод дает ХОРОШие
результаты. Осложнения бывяют только в тех случаях, когда при действии
ОКИСJ\ителей разрушается бензольное кольцо.
2. Окисление ароматических кетонов. Ароматические кетоны дегко
получяются реакцией Фриделя - Крафтса. Окисление обычно ведут с
помощью гипохлоритов по схеме:
ChH,,-СО-СН:! + 4NaOCI
N~OH) ChH,,-СООН + 4NaCI + H~O + CO~.
Однако могут быть использованы и другие окислители. Ацетопроизвод­
ные окисляются легче, чем углеводороды.
3. Гидролиз тригаJ\огенопроизводных с галогенами у одного углерод­
ного атома. При XJlорировании толуола образуется три вида XJlоропроиз­
водных: XJlористый бензил (идет для получения бензилового спирта), хло­
ристый бензилиден (для получения бензойного альдегида), бензотриXJIО­
рид (перерабатывается в бензойную кислоту и в XJlористый бензоил) *.
4.
Гидролиз нитрилов:
Этот способ широко применяется в жирном ряду. В ароматическом
ряду исходные нитрилы получают из диязосоединений, из галогенопроиз­
водных обменом с цианидом меди в пиридине или сплавлением сульфона­
тов с цианидом калия. Нитрилы кислот с нитрильной группой В боковой
цепи получают обменной реакцией из галогенопроизводных.
5.
Реакция
ароматических углеводородов
с
галогенопроизводными
угольной кислоты. Карбоксильную группу можно ввести в ядро посредст­
вом реакции, ЯНЯJ\ОГИЧНОЙ синтезу кетонов по Фриделю
-
Крафтсу. Ка­
тализатором служит хлорид алюминия:
СННН + COCI~ --O.IA_I_C-,I, :. :.1..., C(iH,,-СОСI;
-
НСI
ХJlоr~III'llДrИII
(}СII:юiiIIOЙ КI"CJIOTbl
(XJЮIШСТЫЙ riCI1:<!IIIJI)
С tj Н (i+ СI - СО - ОСН
:1
МСТIIJЮ1l1.lii ~фl1r
IAICI"I)-
-НCI
XJIOPYI·OJlI.llOii KflCJIOTbl
C(iL1.,-СООСН:1.
1"
МСТИJlО1I1.lii ~фflР
riСl1:юii110ii К11СJ1ОТI.I
(МСТИJlriСIIЗО~Т )
* Непосредственныii гидролиз бензотрихлорида идет плохо. Пщтому бензотрихлорИд
нагреваНllем с беНЗОI"lноii ЮIСJlОтоil превращают в ХЛОРlIстыii бензоил. который далее п~и
ГИДРОЛllзе легко дает бензойную КИCJ\оту:
с,Я"-СС\1 + С"Н,-СООН ~ 2с,н.сос\
С,;Н" -СО-С\
422
+ Н,О ~
С,Н. -СООН
+ HCI;
+ НС\.
6.
Реакции металлорганических соединений с СО 2 :
c"H,iBr + 2Li
Обычно исползуются литий- или магнийорганические соединения.
Физические свойства
Монокарбоновые кислоты ряда бензола
ские
вещества
с
температурой
-
бесцветные кристалличе­
плавления
выше
100
ос.
Кислоты
с пара-положением заместителей плавятся при значительно более высо­
ких температрах, чем их изомеры. Ароматические кислоты кипят при не­
сколько более высоких и плавятся при значительно более высоких темпе­
ратурах, чем кислоты жирного ряда с тем же числом углеродных атомов.
Монокарбоновые кислоты довольно плохо растворяются в холодной воде
и значительно лучше в горячей. Низшие кислоты летучи с парами воды.
В водных растворах монокарбоновые кислоты обнаруживают большую
степень диссоциации, чем кислоты жирного ряда: константа диссоциации
бензойной кислоты
6,6·10-5,
уксусной кислоты
1,8·10-5.
Химические свойства
Ароматические кислоты вступают во все те реакции, которые свойст­
венны и кислотам жирного ряда. Реакциями с участием карбоксильной
группы получают различные производные кислот.
1.
2.
Соли получают действием КИСJЮТ на карбонаты или щелочи.
Эфиры
-
нагреванием смеси кислоты и спирта в присутствии ми­
неральной (обычно серной) кислоты:
C(jH:;-СООН
+ НОС 2 Н 5 ~ C(jH,,-СООС 2 Н:; + Н 2 О.
(i('II:шiiIЮ'1ТНJЮВI,lii
·.Фиr
Если заместителей в орта-положении нет, то этерификация карбокси­
JIЫJQЙ группы происходит так же легко, как в случае алифатических кис­
JlОТ. Если одно из орта-положений замещено, скорость этерифиющии
СИJlЬНО уменьшается, а если оба орта-положения заняты, этерификация
оБЫЧIIО не идет (пространственные затруднения).
Эфиры орта-замещенных бензойных кислот могут быть получены ре­
i\Кitией солей серебра с галогеналкилами *. Вследствие пространственных
Зi\труднений они с трудом подвергаются гидролизу. Группы большие, чем
водород, в такой степени заполняют пространство вокруг УI'Jlеродного
i\TOMa
карбоксильной группы, что затрудняют образование и омыление
эфира.
~-----
• Эфltры пространственно затрудненных аромаПI'lеСI<ИХ IШСnОТ nегко
ОМЫJlЯЮТСЯ в присутствии краун-эфltров (см. гn.4)
It
КОnl1'1ественно
423
-1f.(К г--------------,
Гидролиз
m-NII"
n -(:11:1
алифатических
11
а,О
эфиров
ароматических
кислот, так же как и гидролиз эФИРО8
m-OCII:1
проведении
II-О"
среде
идет
как
8
гидролиза
в
щелочной
электроноакцепторные
заМе­
стители увеличивают скорость гидро­
т-Вг
2,0
кислот,
кислой, так и в щелочной среде. при
лиза, а электронодонорные замедля­
ют реакцию. В связи с этим КОнстан­
n-NO:1
о
Рис.
0,67
1.0 cr
ЗаВllСllМОСТЬ константы СКО­
63.
POCТlI гидролиза этилбензоата в зависи­
MOCTII
р
реакционных серий М- и n-замеще­
ных эфиров имеет положитеЛьНое
значение. Зависимость констант ско­
рости
от а:
= 2,431; -Ig 1\, = 3.051; r = 0.992;
3.
та р в уравнении Гаммета (с.343) для
гидролиза
ставлена на рис.
от
величин
cr
пред­
63.
Хлорангидриды получают действием на кислоты хлористого тиони­
ла или пентахлорида фосфора:
4.
Ангидриды получают перегонкой смеси кислоты с уксусным ангид­
ридом в присутствии фосфорной кислоты или действием ХЛОР(\НГИДРИДО8
на соли:
5.
При действии хлористого бензоила на пероксид натрия получается
кристаллический пероксид бензоила:
При действии алкоголята на пероксид бензоила получ(\ется соль над­
беНЗОЙllOЙ кислоты (гидропероксид бензоила). Эта кислота применяется
ДJlя получения оксидов из непредельных соединений (реакция Прuлежа­
ева, см. гл. 4):
(CtiH!i-СОО)~
+ NIIOC~H" ----+ CtiH"COOONa + CtiH;;-СООС~Нfi'
6. Декарбоксилирование. При сплавлении соли ароматической карбо­
новой кислоты со щеЛО'IЫО карбоксильная группа замещается водородом.
Обычно в качестве реагента берут натронную известь:
Аг-СООNа
424
+ NaOH
IIHI'PCBдlIIIC) АгН
+
Na~CO:!.
Отдельные представители, nрименение
Бензойная кислота встречается в свободном состоянии в некоторых
смолах, особенно в бензойной смоле и в «драконовой крови» *, В виде
бенЗИЛОВОГО эфира она входит в состав перуанского бальзама. В виде гип­
пуровой кислоты (бензоилглицин) содержится в моче травоядных живот­
ных. Основными способами получения бензойной кислоты являются
окисление толуола и декяр60ксилирование фтялевой кислоты.
Бензойная
121,5
кислота
-
бесцветные
ос, кристаллогидрат плавится при
пластинки
90
или
иглы
с
т. пл.
Ос. Применяется в производ­
стве красителей и душистых веществ, а также в кячестве консервирующе­
го средства в пищевой промышлеююсти блягодяря сильному антисепти­
ческому действию.
O'IeHb важным производным бензойной кислоты является ее хлорян­
- хлористый бензоил. Это жидкость с характерным запахом
гидрид
и сильным лакриматорным действием. Используется как 6ензоилирую­
ший агент.
Пероксид бензоила используется как инициатор д,1Iя реакций полиме­
ризяции, а также как отбеливающий агент для пищевых масел, жиров,
муки.
Толуиловые кислоты. Метилбензойные кислоты назывяют толуило­
выми кислотами. Они образуются при частичном окислении 0-, М­
И п-ксилолов. N,N-Диэтил-м-толуилмид является эффективным репел­
лентом
-
препяратом, отпугивающим насекомых:
n-трет-Бутилбензойную кислоту ПОЛУ'lают в промышленных масшта­
бах жидкофазным окислением трет-бутилтолуола в присутствии ряство­
римой соли кобальта в качестве катализатора. Применяется в производ­
Стве полиэфирных смол.
Фенилуксусную кислоту получают из хлористого 6еНЗИJlа через ни­
ТРИJl ИJlИ через магнийорганические соединения. Это кристаллическое ве­
Щество с т. пл.
76
Ос. Благодаря подвижности подородных ятомов метило­
вой I'РУППЫ легко вступает в реакции конденсяции. Этя кислота и ее эфи­
ры применяются в парфюмерии.
Непредельные одноосновные кислоты, Из одноосновных неllредель­
III,IX ароматических кислот наибольшее значение имеет коричная кисло­
та. Ее получяют либо реакцией Перкина, либо по Кляйзену (с. 409). Из­
BeCTl1Q несколько форм коричной кислоты с т. пл. 133, 57, 68 и 38 0 с.
Первыйе две кислоты являются геомеТРИ'lескими изомерами (mранс- и
~-), две другие -
их полиморфными модификациями.
• КраСНilЯ твердая смола, добываеМilЯ из одного Bltдa пальмы.
425
Коричнан кислота применяется в парфюмерии и медицине. Из нее по.
лучают ro-бромстирол (обладает запахом гиацинтов), фенилацетальдегид,
фенилацетилен и другие вещества.
Б. ЗАМЕЩЕННЫЕ ОДНООСНОВНЫЕ АРОМАТИЧЕСКИЕ КИСЛОТЫ
1_
Галогенобензойные кислоты
ПРIi ХЛОРIIРОВIIНIiИ беизоi1иой КIIСЛОТЫ получается главным образом AI-хлорбеИЗОйная
Кllслота. ОДНIIКО метод прямого галогенирования дает обычио трудио разделимую смесь мо­
но- 1I ПОЛllгалогенозамещенных кислот. Галогенобензойные кислоты обычно получают див.
зореакцией IIЗ аМlIнобензоiitlЫХ кислот.
2_
Нитробензойные кислоты
При нитрован ии бензойно!\ кислоты получается
78 % Alemu·. 20% ПрПЮ· и 2% пири-нн­
тробензойtlЫХ кислот. Два последних изомера без примесей других изомеров получают окис­
леНllем ()рmо- и пири-нитротолуолов.
НIIтробеllЗ0йные КIiСЛОТЫ Qбладают более сильиыми кислотными свойствами, чем бен­
ЗОЙНIIЯ ЮIслота (К =
мер
-
в
5,6
6,6 - 10- а ): о-изомер -
в
100 раз, А!-изомер -
в
4,7 раза и /I-ИЗО­
раза. АнаЛОГИ'lная закономерность иаблюдается и в СЛУ'l8е галогенозамещен­
ных кислот (табл.
17).
Т а б л и ца
17.
Коистаиты иоtlизации замещеиных бензойных кислот
По.ложение
3амсститCJI ь
СН: 1
ОН
OCH~
Вг
CI
N02
орто-
.мета-
пара-
1,2 - 10-~
1.1- 10-:1
8,0-10-;;
1,4- 10-:1
1,2- 10-:1
6,7 - 10-:1
5.3- 10-r.
8,3- 10-"
8.2- 10-r.
1,5- 10-4
1,5- 10-4
3.1 - 10-4
4.2- 10-r.
3.3- 10-"
3.4-10-5
1.0 - 10-4
1,0- 10-4
3,7 - 10-4
УвеЛlI'lеНllе снлы IШСЛОТ с :меl\Троноа·кцеПТОРНЫМII замеС1'lIтелямн в Н- И ..и-положении·
объясняется увеличеиием ПОДВНЖНОСТlI IШСЛОТНОГО протона благодаря ОСЛllблению свяЗИ
О-Н (уменьшение :1лектронной плотности)
О
(11
~.-c-O-H
O-N r"O
УРlIвнение Гаммета (с.
343) было впервые использовано Прll
изучеНИII диссоциации..и- и
l!-замещеtlflЫХ беизоilных кислот. Для зтой реакционной серии значение р было принятО
К
равным 1 и, следовательно, уравнение Гаммета имело вид Ig = а. Поскольку введение
К"
элеl\тРОНОlIкцепторных заместителеii в бензойную кислоту усиливает ДИССОЦШЩIIЮ, а введе-
Hlle элеКТРОIIОДОНОРНЫХ ослабляет ее, константа р для электроноакцепторных заместителей
IIMeeT положитеЛl>НЫЙ знак, а для элеl\ТРОНОДОНОРНЫХ - отрицатеЛl>НЫЙ.
426
ЗаместитеЛlI в o-положеНIIИ действуют более сложно. ОпределеliНУЮ IJOЛЬ 11грает здесь
обряЗОВ3IНlе водородной СВЯЗII. Последним можно объясниТl, ббJIЬШУЮ СIIЛУ салициловой
I\IIСЛОТЫ по сравненню с беНЗОЙНОl1 (в 17 раз):
О-Н.
г<- сС;о
~- "O~H
3.
СульфобеНЗ0йные кислоты
в I1l1щеВОII промышленности пр"меняется натр"евая <.:оль aMllДa O-СУЛuфобензойноii
ЮIСЛОТЫ - сахарин. Это вещество в 500 раз слаще сахара. но организмом не усваllвается.
Получают сахарин по схеме:
C~X~I'IIII
4. Ароматические фенолокислоты
Ароматические гидроксикислоты,
как и гидроксикислоты жирного
ряда, различают по их основности И атомности.
Моногидроксикарбоновые КИCJIоты. Наибольшее значение имеет
о-гцдроксибензойная, или салициловая, кислота. Ее получают дейст­
внем диоксида углерода под давлением на фенолят натрия (способ /(оль­
бе -
Ш.м.итта) и многими другими методами:
427
Салициловая кислота - бесцветные иглы с т. пл. 157 ос. Хорошо рас.
творяется в воде. С FеСl з дает фиолетовую окраску. Реагирует как фенOJI
и как кислота. Легко восстанавливается до пимелиновой кислоты:
Салициловая кислота и ее эфиры встречаются в природе. Она приме­
няется в медицине и анилинокрасочной промышленности.
В медицине применяют салициловокислый натрий (1), ацетат сали­
кислоты
или
ацетилсалициловую
кислоту
(аспи­
- жаропонижающее средство, фениловый эфир салициловой
кислоты (салол) (Ш) средство, дезинфицирующее кишечник:
циловой
рин) (Щ
6"
'1
6
,,1
I
111
СООС,;Н:.
ОН
COONa
ОН
Аt·Гидрокснбензоitную КlICJIOTY получают щело,/ным плавлением Аt'СУЛl>фОбензоllноii
кислоты. ПРlIменяется в приготовлеНIIИ красителей.
n·ГидроксибензоЙную кислоту получают деiiСТВllем формиата натрия и соды в атмосфере
СО 2 ПР11260'С и6 МПа (60 атм) на фенолят натрия. Ее эфиры обладают ВЫСОКИМII антисеп­
ТlI'/еСКlIМИ свойствами и ПРllменяются для консервировання пищевых продуктов.
3на'lI1тельный интерес представляет также ()·гm)роксuк()рuчнця кисл()тu. существую·
щая в цис- 11 транс-формах (кумариновая и о-кумаровая). В свободном состоянии сущест­
вует только транс-форма. цuс-Форма известна лишь в виде солеrl. При попытке выделить
кумариновую кислоту ПРОИСХОДIIТ дегидратация и образуется КУАсарин (лактон о,гидрокси­
коричной кислоты).
Кумарин в растениях не содержится, но он обрязуется при срезании растений И3 гликози­
да ()-гидроксикоричной кислоты благодаря ферментативиому гидролизу. В промышленностИ
его получают синтезом ПеРКltна из салицилового альдегида:
СНО
, .1
сх
"
ОН
cxCH=CH-СООН
~'
"
1
он
CXC~
~'
"
1
~TH
,......С,о
о
KYMHI'"II
Применяется как душистое вещество (имеет запах свежескошеННОl1 травы).
Дuку,tщрttН (З,3-меТllлен-бltс·4,оксикумарин) 11 некоторые аналоги'/ные соединения уд­
линяют время свертывания крови, вследствие чего Itспользуются в медицине ДЛЯ предупреж­
деНI1Я образования кровяного тромба, например после операЦltи, ИШI ДЛЯ ле'/ения коронар­
ного тромбоза (инфаркт). Дикумарин легко образуется в гнилом сене и тогда вызывает «кле-
428
ер~УЮ» болезнь скота, '!асто ПРИВОДЯЩУЮ к его падежу. СннтеТllчеСIШ дикумарин получают
~о~де~сацией 4-гидроксикумарина с формальдегидом:
ДИКУМИРИII
Дигидроксикарбоновые кислоты.ДИГllДроксикарбоновые кислоты н их производные ве·
сьма распространены в природе. особенно' это относится к протокатеховоl1 11 орсиновой
KIICJlOTaM.
ПротокатеХОlJая кислота - кристаллическое вещество. Окрашивает раствор хлори·
да жеJlеза FeCI:j в сине-зеленый цвет. Легко образуется при нагревании пирокатехина с кар­
бо~атом аммония Прll 140 ·С. Ее также ПОЛУ'lают из 0- гидроксибензоiiной кислоты хлориро­
BaHlleM 11 затем
нагреванием полученного соединения с КОН:
~H ~QI~~I
СООН
-1-1<:1
'-
СI
ОН
СООН
-К<:I
'-
НО
ОН
ОН
IIIЮТОКИТСХOIIIIII
КИC.lюта
в Прllроде протокатеховая кислота встре'lается в свободном виде и в виде производиых.
MHoГlle природные вещества - катехины, антоцианы - дают ее при сплавлении со щело­
чами. Она обладает сильными восстановительными свойствами. При HarpeBaНlIII разлагает­
ся на пирокатехин и СО 2 .
ТригидроксикарБОНОВblе КИСЛОТbI. Наибольшее значение из этой
группы веществ имеют производные пирогаллола.
В природе распространена галловая кислота. Она в свободном виде
или в виде дигалловой кислоты и глюкозидов входит В состав различных
дубильных веществ (чернильные орешки, сумах, листья чая и т. д.). Ее
МОжно получать щелочным плавлением галогенопроизводных протокате­
ХОвой кислоты (1):
0Н
0Н
ВГ'9
ОН
ОН'9
'1 ~ '1 ОН
'-
СООН
-Nиllr
"'-
СООН
li- БIЮМIIIЮ11ЖНТСХОRИII
I'НJIЛОIIIIII
КIIC.lЮТИ
КИCJIОТ'А
Галловая кислота - кристаллическое вещество. Обладает сильными
ВОССТ<lновительными свойствами.
429
Китайский танин представляет собой смесь эфиров глюкозы (гл. 33.1) и попигаллоВOJi
и галловой кислот (ПГ - остаток полигалловой кислоты). Дубовая кора содержит дрУГОе
дубильное вещество, являющееся производным .~ллаг(J(ЮЙ кислоты:
ОН
НО
~
CH20Г о Н
Н
ог
Н
н
опг
го
опг
ОН
lIyUllJIJ.lIOC IIСЩС~"IIO i\yuo"oii корм
КlпиiiСКlIЙ TH'II~II
э. Фllшеру удалось получить 11З глюкозы 11 Дllгалловой кислоты пентаэфир, обладающий
главнейшими свойствами танина. TaHI1Hbl применяются д.ля дубления КОЖII и в про­
BceM11
травном крашении тканей.
дроматические гидроксикислоты с ГИДРОКСИJlОМ В боковой цепи_ Среди этих кислот
наибольшее значеНl1е IIмеет ~ШН()lIльнаJ/ Кllслота. образующаяся при Гl1дролизе в присуг­
ствии соляной кислоты ГЛI1КОЗltдаамигдалина. содержащегося в горьком миндале. Синтети­
чески ее легко получают ГИДРОЛIIЗОМ циаНГlIДjJI1на бензальдегида:
МlIндальная
KlIcnoTa
обладает аСIIмметричеСКllМ атомом углерода. На ее примере изуче­
ны многие вопросы стереОХИМIШ, в частности явления аСlIммеТРllческого синтеза. При син­
тезе циангидрина бензальдеГllда в присутствии энзима эмульсина образуется левовращаю­
щая форма, в ПРIIСУТСТВИИ алкалоида хинина
-
правовращающая форма (в обоихcnучаяхне
в '1IIСТОМ состоянии) .
. 5.
Ароматические аминокислоты
Аминокислоты могут быть классифицированы по положению амиНО­
группы и карбоксила в ядре или в боковой цепи. Наибольшее flрактиче­
ское значение имеют кислоты с аминогруппой и карбоксилом в ядре.
Все три аМИllобензойные кислоты могут быть flолучены восстановле­
нием соответствующих нитробензойных кислот. Наибольшее значение
имеет о-изомер
-
антранuловая /(ислота. Ее получают из фталиМИД8
действием гипобромитов (nерегруnnиров/(а Гофмана):
430
иО
иО
С(
О=
: ,. . 'о
,
сl
NH
ВГ2 + КО!!~ Ос' С( NBr~
О!!(КВгО)
сl
'о
[
((,
~
/:::'. .""
J-!Шг
~
C-NВг
11 ••
о
~(X COO-J..
~ -.:Р',
::::,...
~
СООН
IICJ>CI-J>УIIIIII!>ОПК~
((СОО
~ ,
-
~
C-N:
~
N=C=O
11
о
она может быть также получена своеобразной реакцией окисления-в.ос­
становления из о-нитротолуола при нагревании его с серной кислотой или
растворОМ щелочи:
СН;1
СХСООН
сх
,1 -;',1
N02
Антраниловая кислота
-
NH 2
кристаллическое вещество, легко растворя­
ется в воде. Применяется в больших количествах для Ilроизводства раз­
личных красителей, особенно индиго.
Метиловый эфир антраниловой кислоты содержится в масле цветов
жасмина, померанца и туберозы. Применяется в Ilарфюмерии как души­
стое вещество.
Al-АМflнобензоitная кислота ТRкже примеияется в производстве красителей.
/Z·АМIIнобензоЙную кислоту получают восстановлеНliем ll,нитробеНЗОЙ/lоti кислоты IIЛИ
ОКllслением ацетильного ПрОll3ВОДНОГО n-ТОЛУИДltна. Ее производные оБЛRДilЮТ Rнеt."Тезиру­
ЮЩIIМ действием и применяются в медицине; ЭТИЛОВЫl1 ЭфltР - под НИЗВИНflем анесmе:щн и
ХЛОрltстоводородная соль ДliЭтиламиноэтилового эфира (нщюкаuн):
IЮIЮКННII
(1 1IС\.:ТСЭИl 1
в ПРltроде Ilграют существенную роль ароматические аминокlIслоты. содержащие аМИflO­
III\RрБОI<Сltльную группы в боковой цепlt. Две аМИНОКIfСЛОТЫ являются ПРОДУКТИМII гидролиза
(jt'JII<OBblX веществ:
.
C 1j H,,-СН 2 -СН(NН 2 )-СООН
фСIIIIJIНJШIIlI1I
(до
•
n-НО-С(jН 4 -СН 2 -СН(NН 2 )-СООН.
ТltrО;ШII
Особенно много ТII!>ОЗlIна образуется при гидролизе казеина (3.5%) 11 фиброина шелки
10%).
АМIIНОКliСЛОТИ mироксин является гормоном ЩllТовltдноi'l железы, реГУЛИРУЮЩIIМ обмеll
веществ в организме:
1
1
H~ )-o~ )-СНгСН(Nн,J-СООН
431
МНОГООСНО8НЫЕ АРОМАТИЧЕСКИЕ КИСЛОТЫ
8.
Известны три бензолдикарбоновые кислоты: фталевая (о-изомер),
изофmалевая (м-изомер) и терефталевая (n-изомер); из кислот вы.·
сшей
основности
представляет
интерес
nиРОАtелиmовая
кислота
( 1,2,4,5·бензолтетракарбоновая):
соон
~
Q ноос
усоан
соон
Осоон
соон
,1
соон
соон
~coaH
1
'
соон
фТИJlСllИ'1
ш()(jтгаJIСIIИ'1
ТСРСФТИJlСI1И'1
I1ЩЮМСТИJIOIIИ'1
КlIСJIOПI
IПICJIOТИ
КИСJIOТtI
KHCJIOTtI
Способы получения. Двухосновные кислоты получают теми же мето­
дами, что и одноосновные кислоты, только здесь подвергаются превраще­
нию две группы или два атома. В частности, все эти кислоты получают
окислением гомологов бензола с соответствующими положением и коли­
чеством заместителей.
Физические и химические свойства. Двухосновные кислоты - крис­
таллические вещества с высокой температурой плавления. Они плохо
растворимы в воде, особенно терефталевая.
По химическим свойствам двухосновные кислоты принципиально не
отличаются от одноосновных. Производные этих кислот: соли, эфиры,
амиды, нитрилы
-
могут быть ПОЛУ'lены за счет как одной, так и двух кар·
БОКСИЛl,НЫХ групп. Галогенангидриды могут образоваться только с У'lасти'
ем двух карбоксильных групп: моногалогенангидриды в момент образова­
ния реагируют со второй карбоксильной группой, образуя ангидриды или
полимерные
соединения.
Кислоты
с
карбоксильными
группами
в орто-положении, например фталевая кислота, отличаются от других
изомеров способностью легко образовывать ангидриды и другие цикличе­
ские производные. Так, при перегонке фталевой кислоты с уксусным ан­
гидридом образуется кристаллический фталевый ангидрид с т. пл.
130 "с. Он обладает свойствами, характерными и для других веществ это­
го класса. Его специфическими реакциями являются реакция образова­
ния фmалu.мида, идущая при нагревании ангидрида с аммиаком:
О=СО"/0 + NH. ~ н"О1
,СО
•
1
ФТИJIСIlIdИ
Ю\l·IIII\"fJI
+
О=СО
1
"/NH
,
со
фТИJIИМИД
и реакция конденсации за счет кислорода одного из карбонилов. послед­
няя реакция имеет важное значение для синтеза красителей (фталеи­
нов
-
см. гл.
26.2).
Атом водорода у азота во фталимиде способен легко замещаться метал­
лами. С помощью таких металлических производных можно осуществляТЬ
некоторые важные ДЛЯ техники синтезы.
432
отдельные представители. Применение. Промышленным методом
получения фталевой КИСЛОТbI - одной из наиболее ваЖНblХ кислот аро­
MaTH'lecKoro ряда - является окисление нафталина и о-ксилола:
co
,.#
1 "~(XI СООН ~
'СООН
CX1
СН:1
'СНа
Раньше в качестве окислителя нафталина при меняли олеум в присутст­
вии солей ртути. В настоящее время окисление проводят кислородом воз­
духа в присутствии у 2 о 5 ·
Фталевая кислота применяется в технике глаВНblМ образом в виде
фгnалевого ангидрида. Около ПОЛОВИНbI производимого фталевого ан­
гидрида расходуется д.1Iя производства метилового, этилового, бутилового
и высших аЛКИЛЬНblХ эфиров фталевой кислоты, KOTopble применяются
как пластификаТОРbl д.1Iя синтетических полимеров, особенно поливинил­
хлорида. Диметилфталат является эффективным репеллентом.
Значительное количество фталевого ангидрида ИСПОЛl>зуется д.1Iя про­
изводства ПОЛИЭфИРНblХ смол, простейшей из которых является глu­
фmалевая. Ее получают конденсацией глицерина с фталевым ангидри­
дом *:
со
11
ОН
((1 "о/ +nHOCH2-~H-CH20H ~
~
со
~[-! гсн,J:_сн,о_]~
IIJItШКiШ
CMOJlit
-Сь'О
COOCH2-<rН-СН20со
+~n
ОС "/
~
1
о
?
l'
СОУ')
-
CO~
со
~
I
I
о
-со
- -
СООСН,-СН-СН,О-
Ь
11
-----ПО Связь межцу цеПЯМli осуществляется в отдельных звеньях,
IIСllJlitНКИSl
•
I<Нз,що НII схеме.
CMOJltI
2"
11 fle в КIIЖДОМ, какупрощеlJНО
433
Фталевый ангидрид служит исходным веществом для
ряда красителей.
Изофталевую и терефталевую кислоты получают окислением
ответствующих ксилолов кислородом воздуха в присутствии ка
ров (соли кобальта). Важным способом получения терефталевой
(выход 95%) является также изомеризация калиевой соли фталевой
лоты при 400 ·С в атмосфере СО 2 в присутствии фталата цинка и Ka.rtMI!IR
cx::::~. ~K
СООК
Терефталевая кислота может быть также получена каl)О()КСИЛIИР()В811Ц
ем калиевой соли бензойной кислоты при 340 ·С под давлением
(300 атм) в присутствии гидрокарбоната калия (выход 60%):
8 ~~~: с5
К
К
соок
Большое практическое значение в последние десятилетия
полимерные эфиры терефталевой кислоты и этиленгликоля, П"n>ЛН'<>.U..'
алкоголизом метилтерефталата этилен гликолем
--
латы:
СНзООС-О-соосн з + 2НО-СН2-СН2-ОН СНзО;
диметилтерефталат
~ 2СН з -ОН + НОСН 2 -СН 2 ООС
-O-~
'1_'
соосн 2-снрн
nCH 2 0H-СН 2 00С-О-соосн 2 -снрн ~
'!;
~ (n-l)НОСН 2СН 2ОН + HOCH2CH20-(-OC-o-COOCH2CH2-)n-OIf
Текстильные волокна из полиэтилентерефталата в России называЮ1'
лавсан, в ~еликобритании
-- терилен, в США -- дакрон. Прозрачные
пленки из полиэтилентерефталата применяют в фотографии.
N ,N' -ДlIметил -N ,N' -динитрозотерефталамид применяют Д1Iя получения пеноплаСТО8
и губчатой резины. При нагревании он разлагается с вьщелением азота:
434
ГЛАВА
25
АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
С НЕСКОЛЬКИМИ НЕКОНДЕНСИРОВАННЫМИ
БЕНЗОЛЬНЫМИ ЯДРАМИ
И ИХ ПРОИЗВОДНЫЕ
Ароматические углеводороды с несколькими бензольными циклами
можно разделить на две группы:
и
2) углеводороды
1) углеводороды снеконденсированными
с конденсированными циклами.
К соединениям с неконденсированными бензольными ядрами относят­
ся дифенил и его производные, а также многочисленная группа соедине­
ний, которые можно рассматривать как арилзамещенные алканы (в част­
ности, метан), алкены или алкины.
ГРУППД ДИФЕНИЛД
1.
Дифенил образуется при пиролизе бензола. В небольших количествах
содержится в каменноугольной смоле. Лабораторным методом получения
является действие натрия или меди на иодбензол, а также действие бро­
мистого таллия на магнийбромбензол:
2С 6 Н 6
---+ С6 Н 5 -С 6 Н 5
+ Н2 ;
2C6H5MgBr + 2TIВг ---+ С6 Н 5 -С 6 Н 5 + 2MgBr2 + 2TI.
Дифенил
-
кристаллическое вещество с т. пл.
70
ос, т. кип.
254 ОС.
Термически весьма устойчив. В химическом отношении ведет себя анало­
Гично
бензолу.
Применяется
в
промышленности
как термостойкий
теплоноситель.
Положение заместителя в формуле дифенила обозначается цифрами или приставками:
орто- или
2,6,2',6', Alema- или 3,5,3'5', nара- или 4,4':
At'
о
At
Q'leHb широкое применение благодаря термической и химической стойкости имеют поли­
ХЛОРllрованные дифенилы (теплоносители, трансформаторные жидкости. присадки к лако­
Красочным материала,,,, пластификаторы и т. д.). Они ядовиты и, попадая в окружающую
среду, создают серьезную угрозу для живых организмов.
Важнейшим производным дифенила является диамин бен.зuдuн..
ОБЫЧНО его получают восстановлением нитробензола до гндразобензола
435
и изомеризацией последнего под влиянием кислот (бензидиновая nереl
группировка)
:
'
,)
O-NH-NH-Q IIЯI:)~:I~~III~d-~NН2-Q -+
;;_~
-+NH2~NH2~H2N-O-O-NH2
f
;-
П. 1l'-ДIfИМIllIOДИФСIlИJI «(\СII:IИДИII)
"
Эта реакция открыта Н. Н. Зининым И широко применяется в оРгаНИЧJ'
ской синтезе.
.
Бензидин является исходным веществом для получения многих суб
'
стантивных (прямых) красителей. Наличие двух аминогрупп, способн
диазотироваться, позволяет получить бис-азокрасители, обладающие б
.
"
лее глубокой окраской, чем моноазокрасители (черные, TeMHO-KpaCH~"
синие). Примером красителя, получаемого из бензидина, является инди.,
катор конго красный (с.
455).
.
в связи с исследованием пространственного расположения колец в мо<
лекуле бензидина было изучено важное в теореТИ'lеском отношении яме-
ние поворотной оптической изомерии (атропоизомерии). При замеще; ..
нии водородных атомов дифенила по крайней мере в двух орто-полож~,
ниях в различных кольцах на обемистые группы возникают два оптичес~
изомера. Эта изомерия связана с затруднением в повороте двух колец ОТ·
.
носительно друг друга.
Два ароматических ядра в дифениле имеют ось, вокруг которой ВОЗ·
можно свободное вращение, если только не присутствуют заместители
определенного объема в положениях 2.2' и 6,6'.
В этих СЛУ'lаях исчезает (или сильно затрудняется) свободное враще­
ние вокруг общей оси, и два бензольных кольца располагаются подуглом:
< )~O
Так, в СЛУЧllе 6,6' -динитродифеновой кислоты ароматические ядра
не могут располагаться компланарно, так как нитрогруппа в одном кольц~
не может -при вращении пройти мимо нитрогруппы или карбоксильноИ
группы в другом кольце. Таким образом, возникают две энантиоморфны е
формы:
Q1J
СООН
436
N0 2
:
Объемное влияние заместителей в 2,2' - и 6,6' -положениях доказано во многих случаях.
способность расщепляться на ОПТllческие антиподы и скорость рацеМИЗIЩI1И таких оптиче­
CI<II аКТИВНЫХ форм зависят от размеров заместителей в 0.0' -положениях молекулы дифени­
.~a. РадиУСЫ различных атомов и групп приведены ниже:
Атом или группа
Радиус, нм
Атом или группа
Радиус, нм
....
F ....................
ОН ..................
0.094
0,139
СН: 1 . ............
0.173
0,189
СО 2 Н ................
0,156
NH 2 ............... ..
0,156
Н
................
...............
N0 2 . ............
Вг ............. ...
1 . . . . . . . . . . . . . . ....
CI
0,145
0,192
0,211
0,220
Две группы в орта-положениях бензольных колец позволяют им принимать КОМПЛilнар­
ное fJоложение, если сумма радиусов этих групп до 0,290 нм. Если эта \:умма ЗНiI'lIlТельно бо­
льше 0,290 нм, заместители мешают компланарному расположеНlIЮ ядер.
В 6,6'-динитродифеновоi\ кислоте (см. выше) сумма РilДИУСОВ д,IIЯ двух нитрогрупп
0.384 нм. ДI1Я двух карбоксильных групп 0,312, для нитро- И Кilрбоксильной групп 0,348 нм.
ДB~ ззмеСТllТеля в 2,2' -положениях, если они ДОСТilТОЧНО веЛИЮi, также могут вызвать моле­
i\УЛЯРНУЮ ilсимметрию, наПРflмер:
1
1
HO,C-d-b-СО,н
Даже ОДIIН заместитель, если он достаточно велик, может меШilТЬ КОМПЛilliИРНОМУ поло­
жеНIIЮ обеих ядер li ВЫЗЫВilТЬ энаНТI10МОРфность, наПРllмер:
Вг
ь-р
Лs(СН:\):\Х
2.
дн- И ПОЛИФЕНИЛМЕТДНЫ
Способы получения. 1. Ди- и полифенилметаны легко получаются ре­
<lКЦИЯМИ Фриделя
-
Крафтса из полигалогенметанов и ароматических
соединений:
СН 2 С1 2 + 2Сн Нп
CHCI:!
AICI:1 I 2HCI
+ CHH5-СН2-СliН5;
+ 3СнН н AICI~ » 3HCI + (СпН,,)~СН
Или из галогенарилметанов и ароматических соединений:
C li I-l ii СН 2 СI
+ Сг,I-Ilj
AICI"
Cli H 5 CI-IСI 2 + 2C1jH Ii
» HCI + С I; Н ,,- СН 2- СI;Н "'.
AICI"
» 2HCI + (C(jH 5):ICI-I.
2. дЛЯ получения ди- и полиарилметанов могут быть также использо­
реакции конденсации карбонильных соединений с ароматическими
У['Jlеводородами ИJJИ их производными, например:
B<lHbl
а) СН 2 О + 2C1jH Ii
H 2SO I
» Н 2 О + (CljH5)2CHt;
437
6) (СПН5)2СО
+ С(jН(jМgВг--+(С(jН 5 ):!С-ОМgВг НОН,
+ (C(jH5)aCOH.
--+ МgВг(ОН)
тrИфСllllJlкиrБИllo.n
Физические и химические свойства. Полиарилметаны и их произвоД_
ные - кристаллические вещества. Они проявляют все обычные СВОЙС'l'Ва
нроматических соединений. Специфическим их свойством является ВЫСО.
кая подвижность водородных атомов (или других группировок), находЯ.
щихся между двумя бензольными ядрами, что связано с высокой УСТОЙЧИ.
востью возникающих при таких реакциях промежуточных частиц.
Отдельные представители. Дuфенuлмеmан
-0
':1
СН 2
1
.'
·1
Ii
[,
вещество с т. пл. 26-27 ос. обладает запахом апельсина.
.,'
Существенный интерес представляют две специфические реакции эТfi~
го углеводорода: окисление с образованием бензофенона:
,.
СпН 5 -СН 2 -СпН,; ~ C(jH,;-СО-С(jН 5
UСII:ЮфСIIIIII
и конденсация с образованием флуорена:
1н Н:О1 раСКИЛёllll"'С~
((
труБКII
.....
......
СН 2
~
~
1-1. +
2
0::01
"1
~
~
..
(jJJlY"PCII
Бензофенон применяется в парфюмерии. При получении ряда краен-.
'Гелей как исходное вещество применяется аминопроизводное бензофено~
на - кеmон Михлера. Его получают конденсацией фосгена с диметила~:
нилином:
2
2C1·H,N(CH'
,..
.I)2 +CO<:1
-110 эо (CH..J2N
.
-0-'-0-'
СО
-
-
N(CH'.j )2
11, 11: N: N -тст),аМСТILIIIUlамmЮUСII:юфсшm
(кеТОII МЮI.IIСРИ)
Трифенилметан (СБН5)зСН. Т. пл. 92,5 Ос. С бензолом дает кристал­
лическое молекулярное соединение (т. пл. 78 ОС).
Трифенилметан легко окисляется до трифенилкарбинола, ВОДОРОДНЫil
атом в его молекуле легко замещается метаЛJlами и галогенами. В своЮ
очередь ТР'1фенилкарбинол при действии НСI легко образует трифенил­
хлорметан. Трифенилхлормета~1 при восстановлении дает трифенилметан,
а при гидролизе
-
трифенилкарбинол:
(С(.Н, )'jC-Н Е
• .•.
r
C~II 11~1CI
(CIjHr.):IC-Nа
438
10/
эо (С(Н, ).,С-ОН
111/)
.•.,
(C(jHr.)aC-С!
все эти данные свидетельствуют о том, что связь трифенилметильной
группы с другими группами и атомами весьма непрочна.
Вначале это объясняли тем, что у атомов углерода, связанных с тремя
фенИЛЬНЫМИ группами, не остается дocTaTo'lНoгO «сродства», 'lТобы ПРО'I­
но связать четвертый атом или радикал. В настоящее время установлено,
что причиной подвижности атомов и групп, соединенных с трифенилме­
тильной группировкой, является особенно большая устойчивость трифе­
нилметильных радикалов или ионов.
При растворении трифенилкарбинола в концентрированной серной
кислоте образуется окрашенный раствор, в котором присутствует ион
(C 6H 5);jC+ (галохромия). При разбавлении этого раствора выделяется
неизменившийся трифенилкарбинол.
Взаимные переходы между трифенилметаном, трифенилкарбинолом и
трифеНИЛХJюрметаном имеют прямое отношение к химии очень важного
KJ1aCCil трифенилметановых красителей.
Трифенилметановые красители
КРilсители трифенилметанового ряда получают из производных трифе­
НИJ1метаНiI. содержащих в бензольных кольцах амино-
или
гидрокси­
группы.
Аминотрифенилметаны соединениями (от греч.
бесцветные вещества, их называют лейко­
leukos -
белый, бесцветный). При окислении
в КИСJ10Й среде дают окрашенные соли. В этих солях носителем окраски
(хромофор) является сопряженный ион с положительным зарядом, рас­
пределенным между атомами углерода и азота. Если вывести аминогруппу
из сопряжения образованием соли (прибавить большое КОЛИ'lество кис­
JlОТЫ), то окраска ис'!езнет.
При подщелачивании раствора красителя происходит медленная ней­
ТРilJlизация и выделяется бесцветный карбинол (карбинолыюе основание
красителя ).
НIIllболее простым из красителей этой группы является малаХIIТОВЫЙ зелеНЫ!"I. Его полу­
'IIIЮт ПО схеме:
_
_
_
_
ZIlC!2
_
_
_
_
!'Ы)2
C(jH,,-СНО + 2C(;H"N(CH:\)2 (-IIP)'" C(jH,,-СН [.С(jН.IN(СН\)~12-:тii'7
JIСIIК()\:()СДIIIIСIIИС
+
КI'ИСНТCJII.
Кilр(')ItIIOJIЫЮС ОСIЮШIII~IС
4~!)
Вместо приведенной мезомерной формулы ДТlя красителя можно использовать раа,,"
значную хиноидную формулу:
..
~~
N{СНз)Р
-
·f
r<
o-~-
·О
t ~(CH)
.:
3 2 протраве), шелк и шерсты.
'.
Малахитовый зеленый окрашивает хлопок (по таниновой
леный цвет.
Хорошо известный краситель кристаллический фиолетовый получают из кетона Миxne~
РОСl з
.. "
(СНЭ)2N-С6Н4-СО-С6Н4N{СНз)2
+ С6Н s N{СНЗ )2
~
(?
~
."
~ {СН3)2~9с-Q--tN(СН3)2 сг
"
~
G{СНЭ )2
к этой же группе красителей относится широко применяемый индикатор фенолфmdiJ
ин. Его получают конденсацией фталевого ангидрида с фенолом в присутствии KOHцellТp~
...~:<еР~ОЛО,Ы H"'Q
2--t-2 -",о
:н
О
н: IHSo.;;"
0(---' , но
I
,()'ОН
0]2- .~
0-
1()1~4-4=0 2N80H;;O[ V.&~cPIIL ~;
'~t'(I) он
o~- .~
<2НСI
&СООокрашеll в М8ЛllllOвыА цвет (11)
NаОНИНС1
Q
O~C-OH
~QCOOбесцветеll
440
(1\1)
зNа~
При подщелачиваиии лактоиа (1) образуется окрашеииый в малииовый цвет двухзаряд­
(11). Увеличение концентрации щелочи ведет к превращеиию его
Hbl J1 сопряженный анион
в 6есцветное трехзарядиое карбинольное основание (Ш). Подкисление ведет к исходиому
6eCllBeTHoMY лактону (1).
3.
дн- и ПОЛИФЕНИЛЭТДНЫ
Дифенилэтан может существовать в виде двух структурных изомеров.
симметричный дифенилэтан дuбензuл получают действием натрия на
хлористый бензил, несимметричный - из l,l-дихлорэтана.
Хлорпроизводное несимметричного дифенилэтана, образующееся при
конденсации хлораля с хлорбензолом, - n,n' -дuхлордuфенuлmрuхлор­
этан (mрuxлор.меmuл-n,n'-дихлордифенилметан) - вещество, извест­
ное под названием ДДТ
2CI-Q'
_
.
+ O'C- СО з
н
~ 0-0
- ' cн~o
_
'~
(:0з
широко применялось как сильный инсектицид.
ДДТ помог избавить многие страны от ряда болезней, переносчиками которых служат на­
секомые, в частности от малярии. ОднакоДЦТ биологически разрушается в почве очень мед­
ленно. В значительных количествах он попал в воды морей и океанов, в организмы птиц, рыб
11 многих животных, В том числе и человека. Накапливаясь в организмах, он нарушает их нор­
мальную жизнедеятельность. Поэтому применение ДДТ в большинстве стран запрещено.
Ценным аналогом ДДТ является l,l-ди-( 4-метоксифенил)-2,2,2-трихлорэтан. В отли­
чие от ДДТ он относительно быстро разрушается в природе микроорганизмами, не накапли­
вается в жировой ткани, не переходит в молоко, легко выводится из организмов теплокров­
ных животных:
Из других фенилированных этанов интерес представляет гексафенил­
этан. В 1901 г. М. Гомберг действием металлов на трифенилхлорметан
ПОЛучил углеводород СЗВН ЗD , которому до последнего времени приписы­
валось строение гексафенилэтана. В настоящее время установлено, что
ПОЛученный димер трифенилметила
имеет строение
l-дифенилмети­
лен -4 -трифенилметил- 2, 5- ЦИКJIогексадиена:
2(С,нs)зсо + 2Ag( .... Zn) -
(C,HS)zC~
~(C,Hs)s
+ 2AgCl
ЭТО бесцветное кристаллическое вещество, однако растворы его име­
ют ГЛУбоко-желтый цвет. Такие растворы быстро поглощают кислород из
ВОЗдуХа~ образуя бесцветный пероксид трифенилметила:
(C'HS)2C=CX
+ 02 (C,HS)J
(С'НS)ЗС-О-О-С(С'Н')J
441
Димер обесцве'lивает раствор иода с образованием иодистого триФенЧi'
метила
и
реагирует с
щелочными
металлами, давая
соли:
(C6HS)ZC=Q<H
+ 12 С(С6 Н S)З
(C6HS)ZC=(
-
Х\Н
+
с(с,Н,)з
2К -
кирпично-краСНbIt
2(С6Нs)з СI
2(С6НS)ЗСГ к+
'16
'
.(.iJ
.
Все .ти нвnеиин обънсинютсн тем, "'о ДИ"ер частично диссоци:ii
в растворах на два свободных трифенилметильных радикала, ка
из которых имеет неспаренный электрон:
(C,h,)'l.C-<::::;(Н
.
.'. ~
l~.'
~ 2(С,н,).с·
.
С(С,н.)э
Наличие неспаренных электронов позволяет радикалам присоедиН:~
молекулу кислорода или атом иода с образованием ковалентной CB~
ОНИ могут также принимать электроны от атомов металлов с образован.
ем ионной связи.
~
Окончательное доказательство того, что диссоциация С зs Н зо дает CiI
бодные радикалы, получено с помощью магнитных измерений; pacT~oВl
этого соединения являются парамагнитными: радикалы благодаря
Hal!Wf
чию неспаренного электрона, спин которого нескомпенсирован, име_
постоянный магнитный момент и дают характерный сигнал в спект"
электронного парамагнитного резонанса (см. Введение.
3).
',.
с накоплением фенильных ядер степень диссоциации повышае~
«Гексабифенилэтан» уже почти полностью распадается на свободные P8.~
дикалы фиолетового цвета.
Относительная устойчивость свободных радикалов этого типа свЯЗ~l:(f
с возможностыо распределения электронного облака между болы:U~
числом углеродных атомов трех бензольных колец. Неспаренный элеК!ii
рон «метанового» углерода входит в сопряжение с электронами бензол..,·
ных ядер. что снижает ненасыщенность каждого углеродного атома. Элек­
тронная плотность свободного электрона распределена между «метанО­
вым» углеродом и находящимся с ним в споряжении тремя бензольныМ"
кольцами. Подобное сопряжение в свободных радикалах жирного ряда оТ­
сутствует, ПОЭ10МУ они очень недолговечны.
4.
ди- И ПОЛИАРИЛЭТИЛЕНЫ И АЦЕТИЛЕНЫ
Возможно существоваНllе двух СТРУКТУРНОl1зомерных днфениmIПlленов. одного трифе~
НIIЛ-
11
одного тетрафенилэтнлена.
ГЛIIВНЫМ преДСТIIВllТелем этого РЯд/l углеводородов является сmuльfiен:
CH=CH~
~
442
El'o ПОЛУ'lают действием бромистого бензилмаГНllЯ на бензойный альдеГI1Д с последуюподкислением серной кислотой 1-1 перегонкой, Это КРl1стаЛЛlI'lеское вещество
~T_ пл- 124 'с. При действии ультрафиолетового излучения стильбен переХОДI1Т в ЦllС-фОР­
МУ - В 11ЗОСТI1льбен (маслянистая ЖI1ДКОСТЬС т. кип. 143·С ПРl112 мм рт, СТ.,I1ЛИ 1,6 КПа):
11М
БеНЗОЛl,ные КОЛl>ца оказывают существенное влияние на реаКЦl10ННУЮ спосоБНОСТI>
двоiiноli связи. Хотя стильбен реагирует с галогенами, галогеноводородами, озоном, надбен­
ЗОЙНОЙ I<ИСЛОТОЙ 11 Т. П., скорость присоединения ниже, 'leM можно ОЖI1ДатьД/lЯ соединеНllЯ,
содержащего 3ТI1леновую систему, связанную с двумя ароматическими ядрами. В СЛУ'lае
mрuнс-стильбена скорость присоединения брома составляет только 0,01 скорости присое­
ДlIнеН\lЯ брома к СТl1рОЛУ.
СПlльбен способен присоединять щелочные металлы:
Продукт присоеДllнения при обработке спиртом превращается в 1,2-дифенилэтан:
Na
Na
I
I
CjiH!i-СН-СН-СtjН" ~С2N"~СliН,,-СН2-СН2-СtjН:1 + 2C2H,;ONa
БОЛl>шое значеНl1е имеют замещенные производные стильбена. наПР\lмер 4,4'-Дl1аМII­
но-2.2' -СТl1лt.беНДИСУЛI>ФОКllслота. Это соединение наряду с беНЗНДI·IНОМ применяется для
ПРОlIЗводства раЗЛllЧНЫХ l<раСllтелеii. Производные стильбева составляют неСIЮЛЬКО про­
центов от общей ПРОДУКЦИI1 краСl1телеЙ.
Особую группу стильбеновых краСlпелей составляют «опти'!еСI<ие отбеЛl1ватеЛI1», флуо­
реСЦI1РУЮЩl1е в Сl1вей области ВI1ДИМОГО спектра. При haheCeHI1I-1 на пожелтеВШllе матеРllалы
ОНI1 компеНСI1РУЮТ виднмое пожелтение. Прнмером оптического отбеливателя целлюлозных
и полиаМI1ДНЫХ материалов является бuс-трнаЗl1нильное производное стильбена:
Ацетилену отвечает только один дифеиилацеТllлен - !n()лан. Его получают действием
Щело,1И на Дllбромид стильбена. Это кристаллическое вещество с т. пл. 60 .с.
В последние годы большое внимание исследователей привлекают соединения,
:Одержащие несколько кратных связей в цепи в кумулированном или сопряженном
~О~ТОЯНI1Н. Известны соединения, содержащие в Ilепи до 5 кумулированныx двойных свя­
сеl1
(CliH:i)2C=C=C=C=C=C(CliH,,)2'
до
15
сопряженных
двойных
связеll
11~~;;-(СН=СН)15-С(jНг., дО 8 ацетиленовых остатков CliH5-(С",С)х-СtjНг.. Все они
n
еНСIIВНО окрашены, имеют высокую температуру плавления н представляют IIHTepec как
олупроводннки.
443
ГЛАВА
26
АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ"'~
С КОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЯДРАМи.
И ИХ ПРОИЗВОДНЫЕ
1.
НАФТАЛИН
Нафталин ЯВJlяется основной составной частью камеННОУГОJlЬНОЙ смо­
лы, которая и служит сырьем для получения нафталина и его ПРОИЗВо4.
ных. Однако в последнее время большая часть потребности в наФталиf
удовлетворяется за счет нефтяного сырья.
.:
Состав нафталина был установлен А. А. Воскресенским (1838), астр...·
ение
-
(1866).
Э. Эрленмейером
.
Строение нафталина
Формулу нафталина можно представить в виде двух конденсированных
бензольных ядер (рис.
64).
Положения
1, 4, 5, 8 обозначаются (1, а 2, 3,6.
7-~:
Соответственно для нафталина возможно существование двух однозаме~
щенных, которые носят название
(1- и ~-производных, и десяти двухзаме­
щенных изомеров. Все они имеют названия, однако в последнее время
употребляются только некоторые из них:
.'Р"
IUlфа
Ннличие двух бензольных колец в нафталине докнзывается сле.дую1ll.М '"
"0-
простым способом. При окислении нафталина хромовым ангидридом
лу'шется фталевня кислота. Следовательно, одно из колец нафталина ЯВ­
ляется бензольным.
444
.
Нафталин легко нитруется, причем окисление нитронафталина дает
з_нитрофталевую кислоту. Следовательно, кольцо, содержащее нитрог­
рупПУ. является бензольным.
Рис.
64.
Модель молекулы нафтаЛllна
При восстановлении нитронафталина ПОЛУ'l<lется нафтиламин, кото­
рый при окислении дает фталевую кислоту. В этом СЛУЧ<lе разрушилось
кольцо, содержавшее ранее нитрогруппу, и осталось бензольным КОЛl>ЦО,
не содержавшее нитрогруппу. Следовательно, оба кольца являются бен­
зольными:
((
I
со он
окисление
J>
~
сн
НСI~6'1с-соон
I11
нс~з 2С-соон
"'с""'"
I
N0 2
3- НИТРОфталевая
[01
~
~
N02
а- ннтронафталнн
+ 2СО 2
СО он
.QC~ .........С[
ВОССТ8нОВ- H~ С
левие
»
~H
~ с.......
11 11~CH
I
Н ~
I
СН
,/
NH2
а- нафТИJlамнн
~окисление
КИслота
0:I СООН
11
~
оон
Ук Отсутствие дипольных моментов у 1,5- и 2,б-производных нафталина
<lЗЫВ<lСТ на то, что оба кольца лежат в одной ПJlОСКОСТИ.
445
РентгенографИ'lеские измерения длины связей в нафталине дали
дующие значения (нм):
CJre.
..
Таким образом, в молекуле нафталина облако п-электронов менее
симметрично, чем в бензоле. Связи в положении 1,2 более похожи на
двойные, чем связи 2,3. Связи 1,2 и 3,4 в нафталине в некоторой степени
аналогичны сопряженной системе связей в 1,3-бутадиене.
Химические свойства нафталина также свидетельствуют о неравноцен.
ности связей в ядре.
Способы получения
В лабораторных условиях нафталин может быть получен несколькими
путями.
1.
Пропусканием паров бензола и ацетилена через накаленные труб.
ки:
нс=сн
НСеен
2.
-
Конденсацией хин она с ДИВИНИJIOМ с последующими реакциями де­
гидрирования и восстановления полученного продукта:
Q-.cQl ~ CQ ~ЗНz 001
О
H(CHZ+
~
'CHz
О
О
~
О
О
~
..
~
О
Все эти методы хорошо подтверждают строение нафталина.
Физические и химические свойства
Нафталин -
кристаллическое вещество с т. пл. 80 ·С, отличаЮUJ.еесЯ
большой летучестью.
Нафталин, как и бензол, обладает способностью вступать в реакцИИ
замещения и присоединения.
Реакции замещения. Нафталин вступает в реакции замещениЯ легче.
е
чем бензол. При этом заместитель почти всегда становится в а.-поло >К -
446
1"11'1 е ,
так как в этом случае возникает более энергетически выгодный (при-
Mepl"lO ня
41,8
кДж) а-комплекс, чем при замещении в j3-положении.
В первом случяе а-комплекс стаБИJlизуется перераспределением электОI"lI"lОЙ плотности без нярушения ароматичности второго кольца, во вто­
~OM случяе такая стабилизация невозможна:
- -
НХ+
НХ
со
~
р+
c
t)HX
~
~
+
1.
I"IbI
-
НХ
со
+~
~
~
При галогенировании нафталина получаются а-галогено-нафтали­
с примесыо небольших количеств (около
5%) j3-изомера:
+CI'_~
+на
C0
~
~
~
1 .."
11 -ХJlOриафтаJlИR
в присутствии катализаторов можно заместить все восемь атомов во­
дорода хлором.
2. При нитровании нафталина получается а-нитронафталин с неболь­
ШОЙ примесью j3-изомера (около 4,5%):
НМО, ~
00
~
VJ н.о
1 .."
+
+
-
3. Сульфирование нафталина -
технически наиболее важная реак­
Ция, так как образующиеся сульфокислоты являются исходным материа­
лом для ПОЛУ'Iения многих красителей.
В Зявисимости от температуры реакция идет по-разному. При 80 ·С по­
ЛУчается исключительно а-сульфокислота, так как энергия активации ре­
афкции ее образования ниже, чем энергия активации образования P-СУJIЬ­
ОКислоты, и равновесия между двумя этими кислотами при этой темпе­
раТУре нет (действует кинетический фактор).
При 160·С она превращается в j3-нафталинсульфокислоту. Это пре­
ВР'Нцение не является непосредственной изомеризацией: оно идет путем
деСУЛЬфирования, т. е. гидролитического отщепления сульфогруппы, и
~ОСJlеДУlOщего СУJlьфирования образующейся серной КИСЛОТОЙ; так как
еакция сульфирования обратима, образуется более стойкий в условиях
447
реакц~и продукт из участвующих в равновесии (действует теРМОДина18lt.
чески и фактор):
05
..
+82804; -8zO; lБO"C
•
4. Нуклеофильное замещение в молекуле нафталина ПРОl1СХОДИТ очень трудно, но ВСе
же легче, 'leM в молекуле бензола. При нагреваНИl1 нафталина с амидом натрия Образуете"
с небольшим выходом а-нафтиламин:
_.. ~
~
a-IIЯФТIIJIЯМIIII
Реакции присоединения_ Нафталин обладает значителыlo большей «непредельно­
стью», чем бензол.
1. В отличие от беllзола 011 гидрируется водородом в момент выделения (натрием из ами­
лового спирта) с образовitнием 1,4-дигидронафталина, I<ОТОРЫЙ легко изомеризуется
в 1.2-ДI1Гl1дронафталин (с сопряженной системой кратных связей):
И3QмеризаЦИJI
•
со
l,l-диnoдро иaф-rалии
1,4-диnoдро­
иафraлии
При каталитическом гидрировitюlИ нафтitлина получаются mеmралuн
IIHeMbIe
11 декалин, приме-
в технике в качестве раСТВОРlпелей:
CHz
Pt,Ni; 182.
~ •....уН2
~ ........CH2
+3Н2 •
СН2
тeтpanии
дскалин
Деl<аЛIIН Иlпересен l<aK вещество. имеющее геомеТРИ'lеСЮlе 11зомеры. Если в молекуле
нафтitЛllнit все атомы углеродit рitсположены в одноii ПЛОСКОСТlI. ТОУ де каЛltна это невозмоЖ­
но вследствие значительного наl1ряжения, В03НI1кающего в коиденсированных циклах.
Деl<аЛl1ll способен существовitть в ВI1де двух геомеТРl1ческих изомеров без байеровского
напряжения:
mPIIHC:-/Ie&aJIИИ
448
14UС:-/lекцни
Благодаря разли'lИЮ температур кипения на 8'С ~~ти 11зомеры могут быть выделены
113 теХНИ'lеского декалина тщательным фракционированием. Содержание каЖДОli из форм
в продуктах восстановления нафталина зависит от nримененного катализатора (никель,
пла тнна ).
2.
Нафталин при соединяет хлор несколько труднее, 'lем олефины, но зна'lllтельно легче,
"ем бенЗОЛ.
:~. 1,2,3,4 - Тетраметилнафталин легко образует npoДYIH nРllсоеДllнеНIJЯ С мзлеиновым
анГIIДР"ДОМ. Нафталин таl<же может образовать такой продукт, ОДНtlКО С БОЛЬШIIМ трудом:
сиз
I !\
си-со,.
СИЗ
.......----СИ-СО
4. Осторожное окисление нафталина nРИВОДI1Т к образованию 1,4-нафтохинона. Более
3HeprlI'lIlOe окисление дает фталевую кислоту и немного малеиновоii (см. ниже).
5.
Нафталин образует хорошо кристаЛЛl1зующиеся комnлеl<СЫ С ПОЛI1НитросоединеНIIЯ­
MII, IItlnp"Mep с nl1КРИНОВОЙ кислотой (пикраты): C1oH M• СIjН2(NО2)зОН.
Правила ориентации
в нафталиновом ядре
Новые заместители вступают в нафталиновое КОЛЬЦО только в опреде­
ленные положения по отношению к уже имеющимся заместителям. Пра­
вила ориентации в нафталиновом кольце аналогичны правилам ориен­
тации в бензольном кольце, однако имеются и специфические черты,
связанные с наЛИ'lием второго кольца и более выраженной неравноцен­
Ностью связей.
Место вступления нового заместителя в нафталиновое кольцо опреде­
Jlяется:
1)
ориентационным
влиянием уже
имеющегося заместителя
и
2) различиями в реакционной способности а- и f3-положениЙ.
1. Если в одном из колец нафталина имеется заместитель первого
рода, то новый заместитель при электрофильном замещении вступает в то
Же КОЛЬЦО.
При наличии ориентирующего заместителя в а-положении новый за­
меститель
направляется
преимущественно
в
n-положение,
которое
I{ тому же является и а-положением (согласованная ориентация). о-Изо­
мер образуется в незначительных количествах. Следующий заместитель
напраВJlяется в свободное о-положение:
СИз
~
~~ _Н_N_О~з~ ~I
..
~
NOz
15 Зах. 181
NOz
~
NOz
449
в СЛУ'lае сульфирования первона'IМЬНО образующаяся a-СУЛЬфОКllслота при ПроJlnJм..._
тельн,ом нагревании с H 2S0 4 благодаря обраТliМОСТII реакЦliИ L)'льфироваНIIЯ превращ;'?'II-
в р-изомер с переходом сульфогруппы в другое кольцо, например:
~
SOa H
'1:.;.
~~~. фОН""~,~~:~,.,,
При наличии заместителя первого рода в ~-положении новый замести­
тель при электрофильном замещении направляется в а-положение, явля,­
ющееся о-положением
по отношению к ориентирующему заместителю
(согласованная ориентация). Замещение во второе о-положение
(Hecor-
ГЛilсованная ориентация) происходит o'leHb редко: при Дilльнейшем заме­
щении новый Зilместитель обычно направляется в положение
6
второго
ro ro
кольца, которое является n-положением по отношению к ориентирующе­
му заместителю:
I " " ОН
()V
~
~
~ . 1?
~
~
I
NOZ
~
ОН НNОз.
~
17
OzN
I
~
NOZ
~
~
в HCI(OTOPbIX СЛУ'lаях новый заместитель ориентируется все же в положение
на то, что оно занято. При этом бензольное кольцо переХОДl1Т в Хl1НОlщное:
Ф
I
~
СНS
~
~
о
ОН
тН
CI~
+ '.О"';"'Н
~
I
_
~
-СI
~
h
ОН
1 несм.
СН3 С\ О
ш
~
~
I
+иi"
Q
2. Если в одном IIЗ колец нафталина находится заместитель второго рода, то это кольцо
дезактивируется по отношению к злеlПРОфилыiOМУ замещеНI1Ю и новый заместитель вступа~
ет во второе кольцо.
Наибольшее СНllжение электронной ПЛОТНОСТII. вызваl1Ное электроноакцепторноr1 груП­
ПОII (замеСТllТель второго рода), должно происходить В положеНI1ЯХ 2,4,511 7, еСЛlI эта груп~
па находится в а
(1 )-положеНI1И, и в положениях 1. 3, 6 11 8, если эта группа находитСЯ в l'
(2)-положеНIIИ. Таким образом, замещеНI1е должно ПРОl1СХОДl1ТЬ в первом случае в положе НIIЯХ 611 8, во втором - в 5 и 7:
у
Lб6J
3+
450
".
при этом ориентирующий эффект конкурирует с большей активностью
а_положений по сравнению с Р-положениями. Поэтому если ориентирую­
!Uий эффект в незамещенном ядре недостаточно силен и противоречит
о иентации нового заместителя в а-положение (несогласованная ориен­
т~ция), то он не влияет на направление замещения. Оно происходит толь.
КО в а.-положение.
При этом надо иметь в виду особенности реакции сульфирования: при
высоких температурах и продолжительном нагревании сульфогруппа все­
гда направляется в Р-положения.
Приведенные ниже примеры иллюстрируют рассмотренные выше за­
кономерности:
NOz
~SОзН НNOs. ~SОз"+ ~SOsH
~
H~4~
VJ
NOz
Галогены как ориентанты в нафталиновом кольце занимают промежу­
ТОЧНОе положение между заместителями первого и второго рода. При на­
ЛИЧИи галогена в положении 1 образуются 4- и 5-замещенные. При нали­
'/Ии галогена в положении 2 замещение происходит в положениях 5 и 8.
Производные нафТaJlина
Галогенопроизводиые нафталина. a-ГалогеНОПРОИЗВОДНbIе получают прямым галоге­
ННРованием нафталина. Галогенирование носит элеКТРОфИЛЬНblЙ характер. ОДНIIКО при бо­
lIee ВЫсоких температурах элеКТРОфИЛЬНblЙ механизм переходит в радикаЛЬНblЙ. Бромнрова­
ННе в Интервале температур 500-650 ·С дает равное количество а- Ii Р-бромнафталинов.
(к P-ГалогенонафтаЛИНbI получают каталитической изомеризацией а-галогенонафталинов
атализаторы - AICI:1• алюмосиликаты и др.) или rJuuзореа"цuей 3анд",еUера.
451
Моногалогенопроизводные -
жидкости или твердые тела. Температура Пnав.nеlt
~-производных выше. а-Галогенонафталины .легче, чем соответствующие га.логеНобенз Itи
вступают в реакции обмена, .легко образуют магнийорганичеСI<ие соединения.
I»JbI,
Нитросоединения. Нитрование нафта.лина дает главным образом а- нитронафта.r.ин с
бо.льшоil примесью ~,нитронафта.лина
(4,5%).
Одновременно идет замещение во вто;:­
ядре с образованием 1.8- 11 1,5-динитронафта.линов. Для по.лУ'lения чистого МОНОНитрос 11
динения необходимо прнменять бо.лее разбавленную азотную кис.лоту и строго соблю~
температурные ус.ловия peaKЦlIII.
Р-Нитропроизводные ма.лодоступны. Их по.лучают из аминосоединений (по 3андмеАеру):
'~
. . I '<:::::: NHz+ H C
HN02
(JC)
l,;
НlIтронафталины -
СО NzCl
~
,;
CuNOz
N"
-2
CO~
N02
"'iI
I
~
""
кристаллические вещества. При восстановлеНИII они дают соответ_
ствующие aMIIHbI. Промыш.ленное ана'lение имеет реаКЦl1Я восстановления a-нитронаФТа_
лина до а-нафтиламина.
Сульфокислоты. Сульфокислоты нафталина IIмеют большое зна'lение как промежуточ_
ные вещества в синтезе нафтолов. По.лучают их прямым сульфированием нафталина. I(aK
уже отмеЧАЛОСЬ, та и.ли ИНАЯ кислота образуется в заВИСИМОСТlI от условий реакцИи
(от температуры).
МOIlOсу.льфОКIIСЛОТЫ
-
I<ристаллические вещества, растворимые в воде.
Нафтолы. liнфтолы MoryT быть получены всеми обычными методами
получения фенолов. Промышленным способом их получения является
почти исключительно сплавление сульфокислот с щелочами. а-Нафгon
может быть также получен из нафтиламина гидролизом (Н. Н. Во­
рожцов).
Оба нафтола
-
кристаллические вещества (~-нафтол имеет более
высокую температуру плавления), трудно растворяющиеся в воде. ДаЮТ
окрашивание с FеСl з . Гидроксильная группа проявляет фенольный харак­
тер, однако более склонна к реакциям обмена, чем в фенолах. Нафтолы
растворяются в едких щелочах.
Реакции замещения нафтолов в соответствии с ранее рассмотренными
правилами ориентации идут сначала в том же ядре, где находится гидро­
I(сигруппа. При галогенировании, нитровании и сульфировании а-нафто­
ла получаются n-производные. Следующий заместитель вступает в оста В­
шееся свободным о-положение, например:
4-ннтроиафтап
l-ntдpootCн-4-Ннтро-
2-нафr8JIИНСУЛъфа"иcлara
в случне р-нафтолн вступление нового заместителя идет тольt<О
в а-положение. Следующий заместитель направляется в другое ядроэ"е­
от
смотря на то, 'по в первом ядре остается свободным о-положение.
452
т
ЗlIместитель вступает в положение 6, которое играет роль n-положения
ПО отношению к гидроксильной группе:
c 6 B r ОН
, I "" ОН ~~
I ~ ~
(О
~.JP
Br
ro
I
~
Br
~
ОН
~
l-брам-2нафтм
1,6-.цн6poм-
2-нафтМ
При сульфировании ~-нафтола в мягких условиях получается нафтол­
сульфокислота с сульфогруппой в положении 1, которая при нагревании
I1ерегруппировывается в 2-гидрокси-8-нафталинсульфокислоту, а при бо­
лее высокой температуре - в 2-гдирокси-6-нафталинсульфокислоту.
При дальнейшем сульфировании в более жестких условиях получаются две
применяющиеся в производстве красителей гидроксидисульфоксилоты
(G- И R-сульфокислоты):
SОзН
SO)H
~OH
~OH
~OH
~-~- HO)S ~50)Н
_
I ~ОН
Ф
HO)S~SO)H
~OH
и
НОзS
~
.JP
G-хиCJIDТ8
Няфтолы широко применяются в производстве красителей.
Эфиры нафтолов обладают приятным запахом. Метиловый эфир ~-lIa­
фтола при меняется в парфюмерии.
N -МеТliл-()(нафтол-1 )-I<ар6омат -
се/юн
МОпковоii СОВЮ!. яблонеВОl1 ПЛОДОЖОРЮ1
-
11 ДРУГИХ
аl<ТI1ВНЫИ 11 нсеl<ТИЦI1Д. осо6еllНО ПРОТI1В
вреДJПелеii:
Дlill1lТро-а-нафтол ПРllменяется как желтый краСl1тель_ Он леl-КО получается IIHTpOBaHI1ем а-нафтола:
45:~
Из дигидроксипроизводных нафталина наибольший интерес представляет
1,8-
си-З,6-нафтаЛИНДИСУЛЬФОI(ислота, или ХРО,lютроnmшя кuслота. Синтез ее осущест:OI•
ся по схеме:
нет.
-
H03SW~ sозн (н)
-
I
~
нозs
-
4
H03SW~ sозн
I
~
НОа
нозs
-
н.он
18О"С
NHz
H03SW~ sозн
~
I
ОН
он
Хромотроповая J(ислота при меняется ДIIЯ приготовnеиия различных красителей, дающих
с солями металлов на ткани лаки. Азокраситель, полученный СО'Iетанием диазотированноro
анилина с хромотроriовой кислотой, окрашивает ткань в красный цвет по алюминиевоii про­
траве и в фиолетовый -
по хромовой протраве.
Нафтиламины. а-Нафтиламин получают восстановлением а-нитро­
нафталина. ~- Нафтиламин также может быть получен восстановлением
~-нитронафталина, но практически этот способ недоступен. ~-Нафтила­
мин получают с хорошим выходом из ~-нафтола нагреванием с сульфитом
аммония и аммиаком в автоклаве при 150 ·С:
~ ОН +НS03
••
CO
I 4
~
-НS03
Н Ho~@H
Н ~
Ф
I
I
н~
~
So;
н
н
н
н
SO;
н
~NHz~~NH2
~
Н
So;
+нso, ~
Промежуточный продукт может быть выделен в процессе реакциИ иЛИ
получен из нафтиламина действием сульфита натрия. Реакция обмена 06ратима. Из нафтиламина может быть получен тем же путем нафтол.
Нафтиламины -
бесцветные кристаллические вещества. a-НаФТИ­
ламин обладает фекальным запахом, ~-нафтиламин лишен запаха. В BO~~
нафтиламины плохо растворимы; хорошо растворяются в кислотах, 06р
454
я соли. Обладают канцерогенными свойствами. В химическом отноше­
~~и нафтиламины аналогичны анилину и отличаются только большей по­
движностью аминогруппы. Реакции замещения у нафтиламинов идут
в тоМ же кольце, в котором находится аминогруппа.
а_Нафтиламин галогенируется, нитруется и сульфируется с образова­
ниеМ 4- и затем 2,4-дипроизводных. При сульфировании а-нафтиламина
образуется нафтионовая кислота (4-аминонафталинсульфокислота).
При ее азосочетании с бис-д~азотированным бензидином получается
азокраситель
-
конго красныи:
NHz
Ni-O-O-'
,- '\ N:i + ~I
~D
~
-
Оз Н
N~
_
~
0)1
N~
N=Nфl
~
_ -ON=N
" _O - '
D
~
SОзН
Конго красный
-
. +
+2Н
D
~
SОЗН
дешевый субстативный краситель. Он также приме­
няется в качестве индикатора: в кислой среде он синего цвета, а в щеЛО'I­
НОЙ
-
красного.
~- Нафтиламин бромируется в положение
1.
Затем получается 1,6-диб­
ромпроизводное:
При СУJlьфировании oJleYMoM аминогруппа превращается в аммоний­
ную, которая затрудняет вступление заместитеJlей в то же ядро. Поэтому
ПРОдуюами сульфирования j3-нафталамина в этих условиях являются три
СУЛЬфоаминокислоты:
SОзН
НОзS~NНz
6-амии0-2- иафтапии­
сулr.фoкислота
~
6-амино-2,4-иафruки­
дисул>ФсжИCllота
SОзН
6-а..иио-l,3,S-иафтапии­
трисулr.фo"ислота
455
Все эти кислоты применяются в синтезе красителей. Большое значенн
в той же области имеет так называемая Н-кислота. Это соединение име~
и Фенольную и аминную группы. Синтез Н-кислоты проводится по схеМе.
HO'SW~ SO,H
:. .- I
~
~
HO,S
NHz
I
H O ' S W " " SO,H
NaOH.
~
ОН
~
NHz
Другие проиэводные tlафталина. В последнее время ПОЛУ'IИЛИ некоторое ПрименеНие
в
Ka'leCTBe
веществ. уменьшающих изменеНllе ВЯЗI<ОСТИ масла с ПОНllжением температуры,
ГОМОЛОГII нафтаЛlIна с большими радикалами.
2.6·ДиБУТflлнафтаЛl1н-4-сульфокислота под названием некаль ВХ широко применяется
в качестве эмульгатора
в производстве синтетического каучука. а также .д.nя смачиваНIfII
и мытья теКСТllЛЬНЫХ материалов в промышлеННОСТII.
.
ПРII ледяном I<рашении применяются производные ГИДРОКСИКlIСЛОТ иафталина под наэВа­
нием а:шпюлl>t.
HanpllMep аНI1ЛИДЫ
J3·ГИДРОI<синафтоЙноii кислоты:
'" ОН
ОСХ
~ I .; CONHAr
а· Нафтилуксусная кислота при меняется в сельском хозяiicтве
теНlIИ. Ее можно ПОЛУЧIПЬ из нафПlлина по следУющеii схеме:
l<aK ускоритель роста
рас·
а . НIlФПIJIУКСУСI 11111 КИСJЮТII
Возможно сущеСТВОВlIние трех н
О
сх)
о
rr -иафlioooнон
си·
11 Ф Т О х и н о н о в:
О
сОо
lI- иафloxнЩlН
fX).O
О
~
~
fиI4ш -иафroхииои
а·НафТОХI1НОН - желтые кристаллы: оБРllзуется npll окислеНlIl1 НllфТIIЛl1на, l,4-диОК'
11 1-lIмино-4-ГИДРОI<СIIНlIфталинов хромовой смесью.
J3·НафТОХIIНОII - l<pllcHbIe IIГЛЫ: получюат окислеНllем l,2·IIМIIНОГДИРОI<СllнафтаЛllна.
llА/фU-НllфТОХIIНОН - желто-красные кристаллы: получают окислеНllем 2,6-ДIIГIIДРО'
КСIIНllфтаЛlIна.
456
Некоторые природыне I<р~сители являются производными a-нафТОХlIнона. T~K. наПРII­
/Аер. в шелухе грецких орехов содержится юzлон. КраСЯЩIIМ веществом бациллы туберкуле­
з является фmuокол_ CtlнтеТllческим красителем является производное Н~фТОХIIНОН~ ни-
..
•••
з
фlll U :IU [1UН: он красит по ХРОМОВОII протраве в очень стоикии черныи цвет:
~
~CH)
~OH
О
О
Rафraаарии
IIII'.IIOИ
ПроltЗВОДНЫМ Н~фТОХIIнона является аНТllгеморрагичеСЮil1 (спосоБСТВУЮЩIII~1 свертыва­
НIlIO I<POBI'I) витамин 1<1 (гл. 32.3). СинтеТИ'lеским ан~логом витаМI1На К 1 является 2-метил­
нафтохltнон-l.4. KOTOPbIl1 под н~званием .меnшнон (витамин 1<:1) ШllрОКО применяется в ме­
AllЦlllle. Его легко получают непосредственным ОЮlслением 2-метилнафтаЛIIна:
или ДlleHoBbIM синтезом из ТОЛУХIIнона.
2.
АНТРАЦЕН
Наращиванием еще одного кольца из нафталина можно получить два
изомерных углеводорода - антрацен и фенанmрен_
Они имеют одинаковый состав и отличаются строением. В молекуле
антрацена бензольные циклы конденсированы л и н е й н о, в МОJlекуле фе­
нантрена
-
а н гу л я р н о (под углом).
В антрацене положения
1О - У или J.1 (мезо -
1, 4, 5, 8
называются а.;
2, 3, 6, 7 -
J3
и
9,
среднее положение):
I!
11
Способы получения
1. Антрацен в промышленности выделяют из фракции каменноуголь­
ного дегтя, кипящей при 300-350 ·С, известной как антраценовое, ИJlИ
зеJl(~ное, масло. Содержание антрацена составляет 0,25-1,0
%.
2. Синтетически антрацен ПОJlУ'lают реакцией Фриделя - Крафтса:
О
~ 1+
CHBrz
bHBr/
О [AlВrzl
~
~ I -4НВr- ~
457
ПОЛУ1~ение антрацена в этом случае связано с разрывом связи
3.
C-cl
.
имеющеися в исходном соединении.
.~
Используется также реакция Фиmmига:,
~HaB~ Вr~~OCI c~AOCOI
~ ,,:
~~Br
4.
ВrcHA)I
а'
~
~
~
CH z
~
Антряцен может быть получен из фталевого ангидрида и беНЗола
с последующим восстановлением антрахинона:
".
:'1
o-беиэоилбснзоJiнu ICИCllота
СО
-ос:о
СО
антpaxJIIIOII
Физические и химические свойства
Антрацен
-
кристаллическое вещество с т. пл.
213
·С. Все три его
кольца лежат в одной плоскости.
Для антрацена характерна еще большая непредельность, чем для на:.
фталина. Наиболее активны в его молекуле мезо-положения (9 и 10).
1. Антрацен легко присоединяет в положения 9 и 1О водород, брамt
.
малеиновый ангидрид:
, ~ ~ tШ-~СН~
(СО
~bb~H2~
Br
~+Br2.OCICHBr~~~
~
458
~
Chbr./-V
Ц)J
ПрОдУкт присоединения брома легко теряет бромоводород и дает
g_бромантрацен. ПРОдУкт присоединения малеинового ангидрида при на­
еванИИ разлагается на компоненты.
гр 2. При действии окислителей антрацен дает антрахинон (9,10-антраценДИОН):
воздействию кислорода подвергаются те же 9-й и 1О-й углеродные атомы.
Активность положений 9 и 1О связана с тем, что они находятся под вли­
янием двух бензольных ядер. И замещение и окисление по этим положе­
ниям не связано со значительной утратой устойчивости'.
Отдельные представители. Применение
Анmрахинон. Наиболее важным ближайшим производным антрацена
является антрахинон. Антрахинон получают либо окислением янтрацена
хромовой смесью, хромовым ангидридом и другими окислителями, либо
циклизацией бензоилбензойной кислоты. которую, в свою очередь, полу­
чают из бензола и фталевого ангидрида (см. выше). Циклизацию ведут
в присутствии серной кислоты. Антрахиноны с различными положениями
зяместителей могут быть также получены реакцией Дильса - Альдера из
нафтохинона или бензоилакриловой кислоты и соответствующего l,3-ал­
кадиена:
Антрахинон - желтое кристаллическое вещество с т. ПJI. 285 ос. Тер­
мически весьма устой,IИВ. Вследствие присутствия дезактивирующих кар­
бонильных групп антрахинон трудно вступает в реакции замещения
с электрофильными реагентами.
-------
1"-О· 7Энергия сопряжения (резонанса) антрацена 351.7 КДж/МОJlЬ. двух беll30JlЫiЫХ КОJlец
х 2 = 301.4 КДж/МОJlЬ. Таким образом. потеря энеРГltli сопряжения СОСТIIВJlяет всего
с 6' кДж/МОJlЬ. При этом не У'lитывается выигрыш :~нерГliИ сопряжеНI!Я ЗlIместитеJlЯ
50:1
еIlЗОJl~НЫми ядрами.
459
ПРII действии щелочей антрахиноны расщепляются с образованием бензойиой Кltc.nOTbI
или еезамещенных. Эта реакция позволяет определять строеиие замещенных aHTpaXltHoHOB'
ОКИСJ1llтельные свойства у антраЮlнона менее выражены, чем у нафтохинона 11 ОСОбенн~·
беНЗОХltнона.
9.10-ДИГIЩРOl(сиантрацен при окислении воздухом ИJ1l! кислородом превращается вант.
рахинон; одновременно образуется пероксид водорода. На этой реакции основано ПРОIllЫIU.
ленное
получение
пеРОI(сида
водорода
с
использованием
более
растворнмого
2-этилантрахинона.
Примерно для пятидесяти пигментов растений, грибов, лишайников
и насекмоых установлено, что они являются производными антраХИНОна.
Наиболее важными являются дигидрокси- и аминопроизводные антра.
ХИНОЮI.
Гидроксиантрахиноны
распространены
в
природе,
широко.
исопльзуются в технологии протравных красителей.
Ализарин
(1 ,2-дигидроксиантрахинон).
Получается при сплавлении
соли антрахинон-2-сульфокислоты со щелочью:
в этой реакции наряду со щелочным плавлением происходит также за·
мещение водорода гидроксильной группой. Реакцию проводят в присут~­
вии окислителей, таких, как нитрат или хлорат натрия.
Ализарин
кристаллическое вещество оранжевого цвета. По алюми­
-
ниевой протраве он окрашивает ткани в красный, по хромовой
и по железной
-
-
в бордо
в фиолетовый цвет. Аналогичные лаки более глубоких
оттенков образуют на тканях и другие гидроксипроизводные антрахинона.
Синтез
в
ализарина
из
каменноугольной
смолы,
осуществленный
1868 г. К. Гребе и Ж. Либерманом, произвел переворот в химическоii
технике. Ранее ализарин получали из растения марены, произрастающего
на юге Европы, в Индии, Египте, Иране.
Hel<OTopbIe другие природные красители являются гидроксипроизводными антрахино на •
HanpllMep кошениль. Ее полу"али 113 насекомых. ЖIIВУЩИХ на кактусах (в Мексике и некоТО­
рых других странах). Дnя получения 1 г кошеНIIЛИ надо собрать 1О 000 насекомых. Из 1 кг
кошеНIIЛИ удается выдеЛIIТЬ 50 г красящего вещества - каРJolино(юй кислоты:
.
о
он
соонО
он
но
ПРОl13ВОДНЫМИ аминоантрахинонов являются o"eНl) ценные кубовые антрахиноновые
красители
460
-
Ilндантрены и флавантрены.
инrJuнmрен получают сплавленнем 2-амнноантрахннона с КОН и КNO:\ при 250 ·с. Это
i\НИЙ кубовый краситель. Сплавлением тех же веществ при более выокойй температуре по­
~учают желтый кубовый краситель фЛUCluнmрен:
о
икдантрсн
о
~
~NHz
О
Н
•
Н
HzN
о
фпаааитрен
3.
ФЕНДНТРЕН
Фенантрен входит в состав кам.енноугольноЙ смолы. Подобно антраце­
ну, он образуется при пиролизе многих органических соединений, таких,
как ацетилен, пропан, бензол, толуол и т. п. Фенантрен лучше растворим
В спирте и бензоле, благодаря чему может быть отделен от антрацена.
НаИболее важным методом синтеза различных производных фенантре­
на ЯВляется сuнтез Пшорра: производные о-стильбенамина диазотиру­
!от И диазониевое соединение нагревают в присутствии меди; таким обра­
Зом, из цuс-2-стильбенамина образуется фенантрен:
cS-NН~ )-( ~H':< )- < ~ о
бе ПРОllзводное о-стильбеllзмина получают конденсацией Зl1мещенных производных IIИТРО­
НзаЛьдегида с соответствующим производным фенилуксусной КlIСЛОТЫ. В результате
461
образуется производное ()-нитростильбенкарбоновоli кислоты, которое превраЩ8ЮТ в
81111.
носоединение:
сн=с-соон
0--0·0 -
lI-фенил-о-нитрокориqна8 киcnora
сн==сн
СО2
сн=сн
О-но. Ь ~ ONН. Ь
,Фенантрен
+
ПОЛУ'lается
также
при
Пllролизе
стильбена,
дифеиила
и
этилена,
(),О ·Дllметилдифенила.
Фенянтрен - кристяллическое вещество с т. пл. 99 ос. Способен к ре­
акциям присоединения в положения 9, 10.
1. При гидрировании фенантрена каталитически возбужденным водо­
родом получается 9,1 О-дигидрофенантрен:
2Н
2.
•
При бромировании получается 9,10-дибромид, нагревание которого
(с выделением НВг) дает 9-бромфенантрен:
.--г'h.
снв.-сн.,
u---u ~ ~ 3.
~
{)-U-' +ивr
При окислении фенантрена хромовой смесью получается фенан­
тренхинон и затем
2,2' -дифеновая
кислота:
со-со
0=<>-6 Ь -
соон
СООИ
6Ь
Гидрированное фенантреновое кольцо входит в состав многих прироД­
ных продуктов
462
-
стеринов, гормонов, алкалоидов, смоляных кислоТ.
углеродный цикл стеринов представляет собой конденсированную сис­
теМУ пергидрофенантренового и пятичленного циклов:
Ниже приведены формулы морфина
частИ канифоли
-
-
алкалоида мака· и составной
абиетиновой кислоты:
морфин
4.
ВЫСШИЕ ПОЛИЦИКЛИЧЕСКИЕ
УГЛЕВОДОРОДЫ
Высшие полициклические углеводороды можно разделить на три груп­
пы: 1) линейные многоядерные углеводороды, 2) углеводороды сангуляр·
liblM строением и 3) углеводороды с конденсированными ядрами за счет
трех и более углеродных атомов.
Линейные многоядерные углеводороды. При дальнейшем конструи­
РОВ<lНИИ молекул путем линейной конденсации бензольных ядер в ряду
беНЗОJl -
нафталин
-
антрацен можно получить нафтацен, nентацен
и гексацен. По мере накопления циклов углубляется окраска и уменьша­
ется устойчивость углеводородов:
антрац.н (бесцветн"й)
п.нтац.н (синий)
каФт"ц.н (оранж....й)
reксацен (aenсн ..Й)
• Об аЛI<аЛОllДах СМ. гл. 30.1.
463
Ядро нафтацена обнаружено в некоторых при родных аНТИБИОТИках
(тетрациклин, террамицин и др.).
Углеводороды с ангулярным расположением
ядер. ВажнеЙWI1МИ
представителями этого ряда углеводородов являются хрuзен и бензаlt_
mрацен:
беИЗ8НТрацен
хризсн
Они менее реакционноспособны, чем изомерный нафтацен. Особенно это
относится к хризену.
Углеводороды с конденсированными ядрами (за счет трех и БOJlее
углеродных атомов). Главнейшими представителями этой группы угле­
водородов являются пирен, перилен и коронен:
о
пеpиlJеи
пНреи
Пuрен содеРЖllТСЯ в каменноугольной смоле. По реаlЩl1ОнноспосоБНОСТII он близок к ан­
трацеltу. ПРI' реаlЩИЯХ электрофltльного замещения наиболее уязвимыми являются поло­
жения 311
10. куда
вступают галогеlt, иитрогруппа, сульфогруппа и т. д.
Перилен может бblТЬ легко полу'tен из дlt-р-нафтола. Это КРltсталлическое вещество
желтого цвета. При реаКЦIIЯХ замещеltия реагирует в а(3)-положеltиях. ПРIt нагревании
пр"соед"няет малеиновыil аНГIIДРИД.
К()р()нен - светло-желтое кр"сталлическое вещество с т. пл.
440 ·С.
Обладает исКJIЮ­
ЧllТельной термической устойчивостью.
Многоядерные углеводороды привлекают к себе все БОJIьшее внима­
ние, так как OH(I могут стать новым сырьем для аНИJIинокрасочной и других
видов промышленности. С другой стороны, некоторые из них обладаюТ
канцерогенным действием и усиленно изучаются в связи с пробелмамИ
ВОЗlIикновения и профилактики рака.
Родоначальником этой группы веществ является бензантрацен (1). Ак'
тивен не сам безантрацен, а его замещенные. особенно в .мезо-поло же •
нии. Наиболее простым из активных соединений является 1Q-метилбен'
зантрацен (11). Хорошо изучены такие канцерогенные вещества, как ДИ'
бензантрацеll
464
(111).
бензпирен
(IV):
СНа
111
11
Бен:muрен. образующийся при неполном сгорании самых различных оргаНllческих мате­
риалов. является ОДНIIМ liЗ СИЛЫlейших канцерогенов. Загрязнение атмосферы бензпиреном
реЗI<О возросло в связи с развитием автомобильного транспорта и интенсивным потреблеНII­
ем ГОРЮ'IIIХ ископаемых в промышленностн. Так. например. в США ежегодно выпускается в
атмосферу до 1300 т бензпирена. А чтобы вызвать рак легких ИЛII кожи человеl<а. достаточно
нескольких миллиграммов этого вещества. Попадая из воздуха в почву. воду 11 растения.
(\еНЗПllрен может загрязнять и продукты ПliТания. БеНЗПliрен содержится в табачном дыме и
является ПРИЧI·lноil заболевания I<УРIIЛЬЩИКОВ раком легких.
Канцерогенные углеводороды отличаются СliЛЬНО выраженным аромаПI'lеСКIIМ характе­
ром. особой СКЛОННОСТl>ю к реакциям замещения. Они. например. СО'lетаются с солями диа­
ЗОНIIЯ. тогда
l<aK для других углеводородов
СО'lетание идет только
npll
наЛIIЧИИ облегчающих
замешение групп.
Механизм I\аlщерогенного деikТВllЯ не установлен. Большой интерес представляет тот
факт. что в организме человека Ilмеются вещества. "оторые могут быТ!., IIСТОЧНИI<ОМ I<alluepoгенных агентов. Близок к целой группе при родных соединений обладающий высокой канце­
poreHHoii
активностью х()ланmрен:
Рассмотренные соединения относятся к
o'leHb aKТlIBHbIM «эталонным» канцерогенам.
Однако в последнее деСЯТliЛетие СПlIСОК веществ. обладающих l<aHueporeflHbIMII своЙстваМII.
ЗllаЧllТельно раСШIlРИЛСЯ. Из упоминаемых в этой книге веществ в него попали. например.
X.10p11CTblit ВIIНИЛ.
3Т1lлеНIIМИН. аl<РIIЛОНИТРIIЛ. НИТРОЗОДllмеТllлаНIIЛИН. бензол. бензидин. на­
фТllламины. Работа со всеми этими веществами требует особо"i осторожности: не следует
допускать попадаЮIЯ IIХ на кожу и вдыхания их паров.
5.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ С КОНДЕНСИРОВАННЫМИ
БЕНЗОЛЬНЫМИ И ПЯТИЧЛЕННЫМИ КОЛЬLlt\МИ
Известны углеводороды 11 IIX ПРОlIзводные. углеродны .1 скелет I<OTOPbIX построен из бен­
ЗОльных 11 Цlшлопентанового I(олец. Важне"1шие представитеЛl1 углеводородов ,то . ! груп1l~1 -
инден и флу()рен:
ИIIДСII
ФIIYОРСII
465
при
Инден и флуорен содержатся в небольших количествах в каменноугольной смоле. Ив.Цен
обыкновенной температуре - жидкость, флуорен - кристаллическое вещество
(т. пл. 115 ·С); растворы его флуоресцируют.
..
Характерной особенностью обонхуглеводородов является высокая СН-кислотность сРе.
ДlI углеводородов: У индена рК. = 20, У флуорена рК. = 23, что является следствием высокой
устойчивости отвечающих им ионов вследствие сопряжения с п-электронами бензольных
колец.
Атомы метиленовой группы могут замещаться металлами, участвовать в реакциях кон.
денсации с карбонильными соединениями, замещаться при окислении кислородом:
ау ,щ-со-щO:=J~('r-l
СН -С-СН
3
ИIЩСIII
3
~
Na
,О,
су
.\
О
IIIIДСIЮII
Инден проявляет высокую непредельность. При гидрировании водородом в момент выде·
ления он дает гuдрuнден:
~Д~CH2
~
~~<:,tH2
2
СН
При хранении IIнден полимеризуется. Его полимеры применяются в технике.
Производиыми индена является при меняемый при анализе аминокислот нингидрин:
О
(ХI ~'\c>=o
"
f(
о
Флуорен имеет явно выраженный ароматический характер. Он сульфируется, нитруeтCJI
и т. д. В положение
2.
ГЛАВА
27
НЕБЕНЗОИДНЫЕ КАРБОЦИКЛИЧЕСКИЕ СИСТЕМЫ
.
С АРОМАТИЧЕСКИМИ СВОЙСТВАМИ
в начале этого раздела было дано определение ароматических систеld.
Этому определению соответствуют не только бензол и его производны е ,
но и другие соединения, в замкнутой п-электронной системе которых со'
держится (4n
2) р-электронов.
+
466
1. ЦИКЛОПРОПЕНИЛЬНЫЙ КАТИОН
Наиболее простой ароматической системой, содержащей всего три уг­
леродных атома (при n = О), является циклопропенильный катион.
Устойчивые соли циклопропенилия были синтезированы в 1967 г.
(А. Бреслоу). Соли трифенилциклопропенилия получены еще в 1957 г. по
схеме:
.
Известны н другне пронзводные ЦНКJ\опропенильноro катиона. Напрнмер, д. Н. Курса­
новым и М. Е. 8ольпиным получены соли днфенил6ромциклопропенилия и днфенилгидро­
ксициклопропениJiия по схеме:
С•. Н.
.Н С
1) ..
5 6,
m (CI-lВгз + RONa~
C, , . . / 8 r
II
С
I
С Н
6 5
(:СВг2 )
c/~8Г
/
Н5С6
2. ЦИКЛОПЕНТдДИЕНИЛЬНЫЙ АНИОН. МЕТAJ1ЛОЦЕНЫ
Аро~атическими системами с четырьмя углеродными атомами в цикле
являются двухэарядные ионы C;H~n (n в формуле Хюккеля равно О) и
С ~H~- (n = 1). Соли таких ионов известны.
Важнейшая пятичленная ароматическая система - циклопентадие­
нильный анион (n = 1). Карбоциклическое пятичленное кольцо, включа­
ющее две двойные связи, имеет циклопентадиен
(1).
Он ведет себя как
алкадиен,. например, при дненовом синтезе. Однако он дает калиевую
соль, анион которой (1I) обладает устойчивостью сопряженного аромати­
ческого иона III (6е-):
OQ
11
или
111
Все пять атомов кольца имеют по одному электрону. Шестой электрон
равномерно распределен между пятью незаполненными р-орбиталями
467
(на каждой из них может быть по два электрона), т. е. каждая из пяти Ор­
биталей с равным правом может обладать этим электроном.
ЦиклопентадиеНИJIЬНЫЙ анион легко взаимодействует с электрофиль_
ными реагентами, легко сульфируется комплексом пиридина с SОз, мер­
курируется при действии сулемы в метиловом спирте, вступает в реакцию
нзосочетания с диазотированным
n- нитроанилидом.
При действии на циклопентадиен солей хлорноватистой и бромновати­
стой кислот в очень мягких условиях все атомы водорода замещаются га­
Jlогеном,
по-видимому,
с
промежуточным
образованием
циклопен­
тадиенил-аниона.
Интересные соединения дает ЦИКJlопентадиенильный анион с катиона­
ми двухваJlентных металлов группы железа (жеJlезо, кобальт, никель),
а та".. с Mac:H~apГВHЦ'M' хромом: ~
м,В, + ,.о,
I!s;
~
+ 2MgBrCI
ФСРР(ЩСII
Эти вещества (ферроцен, коабльтоцен, никелецен) ГJlубоко окрашены,
очень устойчивы, перегоняются без разложения и оБJlадают ароматичес­
ким характером, т. е. имеют явно ковалентные связи.
Рентгеноструктурный анализ показаJl, что оба циклопентадиенильных
цикла в ферроцене расположены друг над другом, как два куска хлеба
в сандвиче, и заключают между собой атом двухвалентного железа, как
начинку, -
«сандвичевая структура». Таким образом, атом железа связан
со всеми
10 атомами углерода.
Ферроцен - оранжевое кристаллическое вещество, т. пл. 172173 ос. Растворим в обычных органических растворителях и нерастворим
в воде. Он обладает ароматическим характером, не вступает в реакции,
характерные д.ля циклопентадиена, устойчив к нагреванию (до
470 ос
в парах), каталитическому восстановлению (на платине), не разрушается
разбавленными щелочами или кислотами даже при кипячении, вступает
в реакции эл~ктрофильного замещения.
ГалогеНllровltть IIЛlt Нlпровftть ферроцен нельзя. так Kftl< при этом он ОКl1сляется в ферро­
ценневый "он (C;;Ii5)~Fe +. АЦI1Лl1ровftНl1е же I1дет обычным путем по методУ фриде­
ЛЯ-Крltфтсlt.
Ферроцен легко сульфируется смесью серной I<liСЛОТЫ 11 YI<CYCHOrO ItНГИДРllда. При этом
БЫЛII получеliЫ кяк моно-. так 11 дисульфоферроцены.
МеРI\УРllрование ферроценft в отли'ше от бензола осуществляется ацетатом ртути при
I'ОМНЯТНОI1 температуре. Через ртутные прОllзводные ферроценft синтеЗllровftны некоторые
дрУГllе зftмещенные ферроцены. в чftСТНОСТl1 гftлогенопроизводные. которые не удается полу­
чить прямым гltлогенированием (А. Н. Несмеянов).
468
Ферроцен, подобно
apoMaTII'leCKIIM углеводородам,
конденсируется с MypaBЫIHbIM
11 бен­
зоftным альдегиДIIМИ. Он реагирует сдиазосоеДl1неНИЯМII с выделеНltем азотаlt арилироваНlt­
еМ ядра:
Соединения,
содержащие
альдегидную,
кетонную,
карбоксильную,
сульфо- и аминогруппы, связанные с ферроценовым кольцом, как прави­
ло, проявляют главнейшие свойства соответствующих соединений арома­
тического ряда.
Введение заместителей в ферроценовое ядро, как и в бензоле, оказы­
вает сильное влияние на способность к последующему замещению.
Предложено применять ферроцен в качестве присадки к минеральным
маслам, в качестве антидетонатора и термически стойкого теплоносителя,
а также для осуществления бездымного сгорания масел.
Растворимая в воде натриевая соль продукта аЦltЛl1рования ферроцеНII фталевым ангид­
PIIДOM - ферр()церон - может быть использована при лечении раЗЛИ'IНЫХ форм анемии.
3. ЦИКЛОГЕnТДТРИЕНИЛЬНЫЙ КАТИОН. СОЛИ ТРОПИЛИЯ.
ТРОПОЛОНЫ_ ДЗУЛЕНЫ
ШестиtlЛенной ароматической системой (при n = 1) является уже рас­
смотренный ранее беIlЗОЛ. Семичленной ароматической системой (при
11 =
1) является
циклогептатриенильный катион
-
троnuлuЙ.
Карбоциклическое семичленное I<ОЛЬЦО, включающее три двойные свя­
зи, имеет 1.3.5-lIuклогеnтатрuен. Это типичное непредельное соедине­
ние, лишенное ароматического характера.
Если в случае циклопентадиена для образованин яроматической струк­
туры необходимо было отнять протон, то для превращения циклогептат­
риена в устойчивую ароматическую систему троnuлuевый кати­
ОН необходимо отнять гидридный анион (водород с парой электронов):
~=CH
нс
11
нс,
HC-~
"сн
н(r=\ сн
11
~
1
I + н. . . . . сн
нс.....:::: __сн
СН 2
\.J
сн
I
Тропилиевый катион (1) - плоская система, в которой между семью
Углеродными атомами равномерно распределены 6 электронов. Седьмой
атом предоставляет для этих электронов как бы «пустую» р-орбиталь (не
заштрихована ):
469
Бромистый тропилий впервые был ПОЛУ'lен в 1891 г. Мерлингом. но химическое СТРоеНИе
этого вещества было установлено лишь в 1954 г. Дерингом и Ноксом. Он был получен тер_
мическим отщеплением бромистого водорода от ДlfБРОМЦIfКJ10гептадиена:
н
~ ~aBГ~
O
~
.--;;
Вг
Н
Несколько позднее было найдено. что ион ТРОПI1ЛIfЯ как устойчивая аромаТИ'lеская систе­
ма может образоваться непосредственно из ЦИКJ10гептатриена (ТРОПИЛl1дена) в реЗУльтате
отрыва от меТl!леновой группы гидридного иона и перехода атома углерода из состояния sp3_
в состояние sp2 -Гlfбридизации.
Один из таких способов (Д. Н. Курсанов и М. Е. Вольпин) основан НII
отнятии гидридного иона с помощью хлорида алюминия:
/~CH
\ /н
11
/С +
нс
нс,
,~CH
\н
/C~CH
'-----', \
1. ( + ) сн [НАIСlзГ
нс,',_ ,-/
нс
AICI:! -----+
,
сН-
:;-сн
СН
Возможно также использовать пентахлорид фосфора. Реакция идет
при комнатной температуре с почти количественным выходом:
/
нс
сн
-=:::::сн
~C
11
нс.
......... ~H
\н
СН+ ")\нJСГ+НСI
/,_::-сн
\/н
нс,-
+ PCI:! -----+ [
Сн
1(
HC~-:'::!н
+ PCI:!
сн
Соединения тропилия обладают солеобразным характером: бромид
легко растворим в воде, но нерастворим в неполярных органических рас'
творителях, нитрат серебра на холоду осаждает весь ионогенный бром.
Ион тропилия
ионы карбения
-
-
редкий случай устойчивого иона карбения. ОбычнО
только промежуточные соединения, с трудом поддаю'
щиеся прямому изучению.
ВажнеЙШIfМ свойством иоиа тропилия является его элеКТРОфltЛЬИОСТЬ. т. е. спосоБНОСТЬ
реаГlfровать с нукnеофильными реагентами по схеме:
НС
11
сн
-=:::::СН
/
\/н
нс,
С
/\В
,~CH
Сн
В соответствии с этим соли тропилия реагируют с меТОКСИЛЬНЫмli нонами с образование..
меТОКСIIЦliклогептатрнена (В
470
=
ОСН а ).
Ион тропилия проявляет кислотные СВОЙСТВiI (по кислотным СВОЙСТВilМ он близок к
~уСIlОЙ кислоте) - с водой он оБРilзует спирт:
сн
сн
/,_:-сн
не,'
--,\\
l :'
+ : сн
не \... ,/ /
YI<-
не
+2НР
/-,:::::::сн
\/он
С
11
нс,.
"-:::.-ен
I\H
+ нр+
. . . . . ..--::::сн
СН
сн
Этот спирт существует только в растворе: при попытке выделить его он преВРilщается вдитро­
ПflЛОВЫЙ эфир:
АРОМilТl1чеСКИМI1 свойствами обладают и некоторые другие системы с сеМI1членными цик­
лаМII. например трополоны, азулены.
Трополоны. Рilзработано много способов синтеза трополонов. IIЗ КОТОРЫХ наl1более
удобным является следующий. Реакция бензола сдиазометаном под влиянием улuтрафиоле­
тового излучения ПРIIВОДИТ к образованию Цl1клогептатриена,
KOTOPbIi1
можно окислить пер­
мянгаНilТОМ калия непосредственно в трополон:
о
+I(Мп(),
;;о
Трополон I<ристаллизуется в виде бесцветных игл, т. пл. 49-50 'С, легко растворим
в воде. дает темно-зеленое окрашнвание с FeCI:!. Методами электроно- и рентгенографии
установлена плоская структура его цикла с равной Д/\иной всех связей с-с (0,139 нм).
Энергия сопряжения трополона около
163 кДж/моль. Все это хорошо согласуется с арома­
Тl!чеСl<IlМИ свойствами этой системы. Они выражаются в том, что трополон меД/\енно гидри­
руется катиmlТllчески и подобно фенолу вступает в реакции ароматического замещения.
Ароматическое состояние трополона связано с возможностью поляризации карбониль­
Hoii
группы и образования шестиэлектронной тропилиевой
cllcTeMbI:
в Прllроде встречаются различные производные трополона, из
МII являются а.-,
а.
I<OTOPbIX наиболее важны­
/3-, y-туЙяплицины. выделенные из древесины красиого кедра:
у
471
и алкалоиды (гл.
31) -
К(}ЛХU/{UН" К:ОЛХllАtllН. выделенные из семян и клубней беэвремен.
ника:
K()JIXIIMIIII
К()J'ХIЩIIII
осн ~
Колхицин используется в растениеводстве и генетике (вызывает ПОЛИПЛОIIДНОСТЬ). При­
меняется Прl' ле'.ении некоторых форм рака.
Природные трополоны обладают СI.ЛЬНЫМ фУНГИllИДНЫМ действием 11 оБУСЛОвливают
стойкость к гниению некоторых гюроддерева. содеРЖ!!ЩIIХ трополоиы.
Азулеиы. Азулены могут быть получены многими способами.
1. Азулен впервые СlIнтезирован пропусканием бицикло[ 5. 3. О!цеканола над палладие.
вым катализатором при 300-350 ·С. При этом ПРОIIСХОДЯТ одновременнодегидратаЦIIЯ иде­
гидрирование:
2.
Он образуется также кондеНС!!Цltей пяти молекул ацетилена при получении циклоокта­
тетраен!! из !!цеТllлен!! в ПР"СУТСТВIIИ Цllанида нltI(еля.
Многие способы получеНIIЯ азулена и его гомологов основ!!ны на деГllДрировании раМI!Ч­
ных производных Цllклопент!!ноциклогепт!!на. ПОЛУ'lаемых многообразными тщательно раз­
работаННЫМII путями.
3. Наltболее IIнтересным способом получения азулена
1I
его гомологов является недавно
открытая реакция ЦllклопентаДllена спиридином.
РеаКЦIIЯ основана на том, что 2,4-ДlIнитрохлорбензол с ПНРИДIIНОМ образует четвертиЧ­
ную соль (1). которая реагирует с моиометtlланилином, образуя производное меТllланНJlИД­
глютаконового альдегида (11), кондеНСllрующееся с ЦIII(лопентадиеном с образован нем фу­
лhtll!Нll (111). ПослеДНIIН, в свою очередь, легко циклизуется в азулен с выходом 73%:
'cI. . . ~
нс-сн
~
HC~
I
HC~
НС.:::::::,.
сн
~CH
/
сн
I
H:,C-N-С'iН:1
111
472
сн
Азулен (бицикло[ 5,3,0, ]Декапентаен) - кристаЛЛИ'lеское вещество
синего цвета. В молекуле его имеется 1О подвижных электронов, по одно­
му от каждого из 10 атомов углерода. Благодаря стреМJlению получить
секстет электронов в каждом кольце, один электрон семичленного кольца
склонен переходить к пятичленному кольцу. В результате возникает бипо­
лярная структура, в которой частично поделенные ароматические сексте­
тЫ имеются у каждого кольца (два электрона
-
общие дJlЯ двух колец):
Биполярность структуры подтверждается заметным дипольным момен­
том
(3,34' 10-30 Кл/м, или 1,0 О) и квантово-механическими расчетами.
Согласно этим расчетам все атомы углерода ПЯТИ'lленного кольца не­
сут отрицательный заряд, а семичленного положительный (кроме об­
щих обоим кольцам атомов):
Энергия сопряжения азулена равна 188,4 кДж/моль. Ароматический
характер азуленов проявляется в склонности к реакциям электрофильно­
го замещения в пятичленном кольце. Азулен в таких реакциях значитель­
но более активен, чем его изомер гда вступает в положение 1, второй
-
нафталин. Первый заместитель все­
в положение 3.
ПРl1 НIпроваНI1I1 азулена деЙСТВI1ем Нlпрата меДIf в уксусном ангидриде нли тетраннтро­
метане получается с хорошим выходом l-нитроазулен. При деЙСТВИl1 азотноii кислоты в ук­
сусном аНГI1дриде образуется смесь l-НI1ТРО-
11
I.З-ДI1Нlпроазулена.
Азулен легко сульфируется Прlf действии ДИОl\саНСУЛЬфОТРIЮI{СИда с обраЗОВIIНllем IIЗУ­
JleII-1-МОНОСУЛЬфОI<ИСЛОТЫ. ПРl1 ГllлогенироваНl1l1 с помощью
разуются l-галоген- 11Лl1 I.З-ДI1галогеНllзулены.
N -галогенсукцинимидов
об­
Ацетнлнрование азулеНII по Фриделю- КРllфТСУ Дllет I.З-диацетильное ПРОIIЗВОДfюе.
в более МЯГЮ1Х условиях (уксусный анГl1дРИД и SllC1 4) можно получить l-ацетилазулен.
Азулены леГl<О вступают в реllКЦl1Ю с солями арилдиазония с образованием l-аРИЛIlЗОIlЗУ­
ленов. ПРl1 де11СТВ11I1 на IIзулены солей ртути уже на холоду сразу выпадают продукты
MepKYPI1poBaHHI1.
Азулен раСТВОРl1ется в минеральных КИСЛОТIIХ. ПРllсоеД11НЯI1 протон в ПОJюжение I н об­
разуя азуленовый катион. ОБРlIзование солей происходит с нарушением хромофорной систе­
МЫ. что проявляется в переходе СIIней Оl{раски в желтую.
Исходя 11З рассмотренного строения азулена следует ОЖI1дIlТЬ. 'по реаКЦlII1 нуклеОфl1ЛЬ1i0ГО замещеНIIЯ должны ПРОl1СХОДIПЬ в сеМI1'Iленном кольце 8 положение 4. Хотя нуклео­
ФIIЛЫ10е замещение азулена изучено недостаточно. праВllЛI.НОСТЬ Tal<oro предположения
подтверждается присоединением металлоргаНИ'lеских соединений н реакцией с амидом
натрия.
473
Различные алкилзамещенные азулена состава C l5 H l8 широко распро_
странены в природе как составная часть эфирных масел растений. В.рее­
тениях часто содержатся вещества, относящиеся к класу сесквитерпеifов
дегидрирование которых приводит к образованию азуленов. ПРОТИВО80С~
Ilалительное действие ромашки и тысячелистника приписывается при<:ут_
ствующим в этих растениях азуленам.
4.
АРОМАТИЧЕСКИЕ СИСТЕМЫ С ЧИСЛОМ
УГЛЕРОДНЫХ АТОМОВ БОЛЕЕ СЕМИ
Восьмичленная замкнутая система с восемью 7t-электронами в цик­
ле
- циклооктатетраен, как мы уже отмечали, не обладает плоским стро­
ением и не имеет ароматических свойств. Этого и следовало ожидать, так
как ДЛЯ циклооктатетраена не выполняется правило Хюккеля. Восьмиуг­
леродная циклическая система может стать ароматической, если ей при­
дать два электрона. Действительно, недавно удалось получить соли двух_
зарядного циклооктатетраенильного аниона (Д. Н. Курсанов, Г. Ола):
В качестве примера ароматической структуры, содержащей
тронов,
4/1
+ 2,
можно привести
где
n = 18 -
18 7t-элек­
циклооктадеканонаен (соблюдается
правило
аннулен-18):
Н
Н
I
I
H"'c~C'c~c"""",c/H
I
I
I
H'-c~C"""H Н н/С'с/ Н
~
н/ ~C/
н
Н
н
Н.........С/~'н
I
I
"
/C~/C:::::::C'/C,
I
I
н
н
н
Это соединение и,меет плоскую структуру и устойчиво к нагреванию до
230 0 с.
AHHYJleh-18 - твердое вещество кирпично-красного цвета с диамаг­
Нитными свойствами. Подобно бензолу, он способен в специфическиХ
условиях подвергаться нитрованию и ацилированию.
Ч
А
С
Т
Ь
т
р
Е
Т
Ь
Я
Гетероциклические
соединения
Гетероциклическими называют соединения с замкнутой цепью, вклю­
чающей не только атомы углерода, но и атомы других элементов. Гетеро­
циклические системы весьма разнообразны. Теоретически любой атом,
способный образовать по крайней мере две ковалентные связи, может
Y'laCTBoBaTb
в образовании кольца. Наиболее хорошо ИЗУ'lенными и ши­
роко распространенными
являются
ЦИКЛИ'Iеские соединения
кислорода,
серы и азота.
Элементы, которые участвуют вместе с углеродом в образовании цик­
ла, называют геmероаmом.ами. В соответствии с их числом различают
МОНО-, ди- или три- И т. д. гетероатомные кольца.
Гетероциклы могут содержать три, четыре, пять, шесть и большее чис­
ло атомов в цикле. Аналогично карбоциклическим соединениям, пяти­
и шестичленные гетероциклы наиболее стойки. Число возможных гетеро­
циклических систем увеличивается благодаря существованию гетероцик­
лов с конденсированными ядрами.
Ulирокое распространение гетероциклических соединений в природе
(витамины, алкалоиды, пигменты и т. д.), их важная роль в биологических
процессах и в промышленности красителей и лекарственных веществ,
а также возможность получения из отходов сельского хозяйства и летучей
'Iасти ПРОдУктов коксования угля обусловливают необходимость обстоя­
тельного изучения этого класса соединений.
Некоторые гетероциклические соединения, по свойствам близкие к со­
единениям жирного ряда, уже былJ.t рассмотрены ранее, например окись
Этилена, лактоны, ангидриды двухосновных кислот, циануровая кислота
и т. п. Эти соединения легко образуются из соединений с открытой цепью
и при разрыве кольца снова легко в них превращаются.
Отдельно от других типов органических соединений рассматриваются
гетероциклические соединения, в большей или меньшей степени обнару­
>кивающие в химическом и физическом поведении ароматический харак­
тер, т. е. по свойствам сходные с бензолом. Эти гетероциклы, как и бен­
Зол, более склонны к реакциям замещения, чем к реакциям присоедине-
475
ния. Они вступают в типичные для бензола реакции галогенирования
СУJJьфирования, нитрования, реакцию ФридеJJЯ- Крафтса и т. д. ДоЩ).nь~
1-10 устойчивы по отношению к восстановителям и окислителям. Эти Ос:о­
бенности в химическом поведении опредеJJЯЮТСЯ наличием в их кольЦах
электронного секстета. Благодаря сопряжению связи выравниваются
кольцо становится плоским. Однако стабильность секстетов р-электро~
нов в молекуле бензола и в молекулах гетероциклов различна.
Кроме обычных для ароматических систем реакций замещения I!.'~_
соединения для гетероциклов характерны также реакции обменэ. retepo_
атома и реакции раскрытия ЦИКJJа. Подобные превращения для бензола,н
его производных не характерны.
Для наименования гетероциклических систем в настоящее время ис­
ПОJJьзуется следующая номенклатура. Природа гетероатома обозначается
приставками -окса- (О), -тиа- (S), -аза- (N), размер цикла - основа­
ми -ир-
(3),
-ет-
(4),
-ол-
(5),
-ин-
(6),
степень насыщенности
-
суф_
фиксами -идин- (насыщенный ЦИКJJ с атомом N), -ан- (без атома N), -ин­
(ненасыщенный цикл). При этом допускается ряд упрощений. Например:
""7
""7
О
NH
D
N
И:lII'"I\ИII
ОКСIII'ИII
rI:i~"II)t1i11
(И:iЮ1I'flДlfII),
(ОКСЮ1РЮI),
(ЮИСТIU\flll)
'iТИ.flеllНМИl1
ОКС"Д
':jTIIJICII;t
П
П
О
ИЗОЛ
ИЗИJlflДНII
ЮIIII
(~:!ИОJI),
(И:i~ОnИДfIll ),
(H:iHIIII),
IIIII'IЮJI
IIИРIЮШUlIIII
""I"HI1II
NH
NH
.
NH
ПОСJJедними здесь приведены обычные названия гетероциклов,
.
В гетеРОЦИКJJах с одним гетероатомом нумерацию начинают с этого ге­
тероатома. Если в цикле имеется несколько гетероатомов, то их нумеруют
в следующем порядке: О, S, N. Если имеются группы NH и третичный
азот, цифрой 1 обозначают NH, т. е. соБJJюдается такой порядок: О, 5,
NH,N:
~J
'
1
О
4 :1\
~
t!z.1)!I
s
~IJ
NH
I3 пятичленных гетероциклах ПОJJожения 2 и 5 часто обозначают а, а',
а 3 и 4 - ~, ~'. в шестичленных гетероциклах положения 2 и 6 обознаtJа~
ют а, а', 3 и 5 - ~, ~', ПОJJожение 4 - у.
дJJЯ соединений с конденсированными циклами обычно пользуютСЯ
специаJlЬНЫМИ названиями (кумарон, индол, акридин и т. д.). Однако этн
соединения могут быть назва~IЫ и по названиям ЦИКJJОВ, из которых по'
строены их молекулы. Для этого перед названием гетероцикла ставятсЯ
476
приставки бензо-, нафmо- и т. Д., отвечающие второму, негетероцикли­
ческОМУ ряду, например:
OQ O:J
NH
КУМИI'ОIl, ИJIН
ИIU1ОJI, ИJlИ
ХИIIOJIИII, IIJI~I
(jСIl:lОФУI'НlI
БСII:IОlIIll'l'ОЛ
(jСII:lOlIfIIНЩИII
Если в конденсированных системах гетероатом не находится рядом
с местом конденсации циклов, нумерация на'lИнается с ,!Тома, находяще­
гося рядом с этим же местом, и ведется таким образом, чтобы номер гете­
роятома был наименьшим из возможных:
ГЛАВА
28
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
С ОДНИМ ГЕТЕРОАТОМОМ
Строение. Номенклатура
Простейшие пятичленные гетероциклические соединения с ароматиче­
ским характером
-
фуран, muофен и nuррол:
Ь>.)
о
Ь>.)
s
в их молекулах шесть р-э:лектронов (четыре электрона двух п-связей
и два электрона гетероатома, не затраченных на образование связей) об­
разуют, как и в бензоле, общее электронное облако.
В результате сопряжения кольцо становится плоским, простые связи
укорачиваются.
РентгенографИ'lеские измерения дали следующие значения межатом­
ных расстояний в молекулах фурана, тиофена и пиррола (нм):
0,14:31
0,142:\
О,142!)
477
Вместо обычных формул ДIIЯ каждого из упомянутых гетероциклов мо­
гут быть приведены следующие граничные структуры:
(здесь Х
-
это О,
S
или
NH).
Поэтому они могут быть изображены, подобно бензолу, формулами:
10 10 10
о
s
NH
На основании сопоставления всех известных критериев рассматривае­
мые гетероциклы по убыванию ароматических свойств могут быть разме­
щены в ряд:
бензол> тиофен
>
пиррол
> фуран.
Общие методы получения
Однотипность структуры пятичленных гетероциклов с одним гетеро­
атомом определяет существование некоторых общих методов их получе­
ния. Однако есть и многочисленные специальные методы синтеза пяти­
членных гетероциклических систем.
Важнейшим общим методом получения фурана, тиофена и пиррола яв~
ляется дегидратационная циклизация l,4-диоксосоединений или их серо­
или азотсодержащих аналогов.
а) При получении фурана нуклеофильный атом кислорода одной из
карбонильных групп атакует электрофильный атом углерода другой кар­
бонильной группы. Этому способствует протонизация последней (или
комплексообразование с другими электрофильными реагентами). Фура­
новый цикл образуется в результате последующей дегидратации и депро­
тонирования:
478
б) Аналогично проходит реакция и при получении тиофена, с той лишь
разницей, что предварительно одна из карбонильных групп при действии
пСlIтасульфида фосфора заменяется тионовой:
/
н-с
.
в)
СН.,-сн
-
~
'-/
Н
С
~
Промежуточным продуктом в аналогичном синтезе пиррола из
1,4-дикарбонильных соединений
и аммиака (обычно
-
хлорида диаммин­
цинка) является имин:
:н-·
1--нс-сн
HJ/
"
нс--сн
н!!
\jH _
/,,--'
NH
:2.~
-11.0
2
"
~H
/
NH
Общие физические и химические свойства
Фуран, тиофен и пиррол -
бесцветные жидкости, практически нерас­
творимые в воде. Температура их кипения значительно выше, '(ем у соот­
ветствующих им по числу углеродных атомов соединений жирного ряда
(имеются в виду эфиры, сульфиды и амины), а дипольные моменты ниже.
Спектральные характеристики близки к харяктеристикам соединений
ряда бензола.
Химические свойства пятичленных гетероциклов определяются при­
Сутствием двойных связей, ароматического цикла и гетероатомов. Наи­
большего сходства между ними, естественно, следует ожидать в превра­
Щениях с участием двойных связей и ароматического цикла, а наименьше­
го
-
в превращениях с участием гетероатомов, так как последние сильно
ОТличнются по своей природе.
Химические превращения гетероциклов можно классифицировать сле­
ДУЮщим образом:
1) кислотно-основные превращения с У'12стием гетеро­
ilToMa; 2) реакции присоединения; 3) реакции замещения; 4) реакции рас­
(llИрения цикля; 5) реакции замены гетероатомя.
479
1.
Кислотно-основные превращения. От кислотно-основных свойств
гетероциклов
зависят
возможность
и
условия
проведения
всех ДРУгих
реакций.
Фура н и пиррол при действии кислот легко протонируются по а-УГле_
родному атому, утрачивая при этом ароматические свойства, поскольку
в реакции солеобразовнния принимают участие электроны, ВХОДЯЩИе
в аРОМНТИ'Iеский секстет:
При этом происходит либо разрыв цикла, либо полимеризация образу­
ющегося замещенного алкадиена.
Фура новое кольцо расщепляется концентрированной серной кислотой,
хлоридом алюминия уже на холоду, с другими минеральными кислотами
при нагревании. С разбавленной соляной кислотой фуран дает бурый оса­
док. С метннолом, насыщенным HCl, он образует ацеталь янтарного аль­
дегида:
нс-сн
11
11
нс
4СН,ОН;
сн
,/
-
н2о
(Н']
•
О
ацеталь
StHTapHOI'O
a.nbДel'll,U
Так же бурно реагирует с концентрированными кислотами и пиррол,
образуя окрашенный полимер.
Кипячение со спиртовым гидроксиламином превращает многие произ­
водные пиррола в диоксимы 1,4-дикетонов:
R-C-C-R
11 11
R-C
C-R
+ 2NH2-0H---
,/
R-C-CHR-CHR-C-R
11
N-OH
11
N-OH
+
NH,
NH
Эта реакция обратна замыканию цикла в превращениях 1,4-дикарбо­
нильных соединений. Гидроксиламин сдвигает равновесие в сторону дике­
тона, удаляя его в виде оксима.
Алкильные заместители облегчнют, н ацильные, карбоксильные и фе­
нильные группы тормозят этот тип расщепления.
Тнким обрн~ом, фуран и пиррол, как и многие их производные, прояв­
ляют ацuдофобн'ые свойства. Это резко ограНИ'lивает возможность про­
ведения различных реакций.
Тиофен в отличие от фурана и пиррола не дает с обычными кислотамИ
тиониевых солей и, следовательно, в кислой среде не утрачивает аромати­
ческих свойств. Он не обладает ацидофобностью. Тиониевые соли MOr)'f
быть получены из тиофена только при действии таких реагентов, как, на­
пример, (СНз):зО+· BF~.
480
Фуран и тиофен устойчивы к действию щелочей и щелочных металлов.
Г1иррол является очень слабой кислотой (К = 5,4 • 10-15), более слабой,
"еМ фенол (К
= 1,3· 10-10). Он реагирует с калием, освобождая водород
(1) может быть ПОЛУLlен сплавлен и -
и образуя соль пиррола. Пирролкалий
еМ пир рола с едким кали:
нс-сн
11
11
нс
сн
+кон-
нс-сн
11
нс
11
сн
,/
,/
NK
NH
Соли других металлов получают в жидком аммиаке.
Реакции присоединения. 1. Присоединение водорода. Водород
присоединяется к фурану, например, при 100-150 ос и 10-15 МПа
11.
( 100-150 атм)
в присутствии н.икеля Рен.ея (скелетного никеля):
нс-сн
11
11
НС
сн
+ 2Н 2
(Ni]
..
'-/
О
тетраrидpoфуран
КятаЛИТИ'lеское присоединение водорода к тиофену происходит при
МПа
0,2-0,4
(2-4
атм) и комнатной температуре в присутствии паJlла­
диевого катаJlизатора с обрязованием тетрагидротиофеН<I (тиофана):
о
s
..
(Pd)
При гидрировании тиофена в присутствии никеля Ренея реакция со­
провождается десульфированием:
о
s
+68; +Ni
..
Эти гетероциклы, кроме ПИРРОJlа, не гидрируются водородом в момент
Выделения. При восстановлении пиррола цинком в уксусной кислоте
06-
рнзуется 2,5-дигидропиррол (nирролин.), 'ПО укюывает на его частично
«диеновый» характер. При гидрировании над платиной образуется nир­
ролuдин.:
zn +СНэСОО8
Q--1
16
3ах.
181
+2Hz(Pt)
:Q
CJ
481
2.
Присоединение галогенов. Фуран и тиофен образуют неСТОЙКие
.
продукты присоединения галогенов.
Галогены при низкой температуре присоединяются к фурановому ядру
в 2,5-положение. Образующиеся продукты присоединения легко теряют
галогеноводород и дают а-галогенофураны:
нс-сн
нс=сн
IIII~II
нс
СН
BrHC
'0/
-ИВr
CHBr
НС-СН
..
11
11
,/
НС
\(
CBr
О
Продукт присоединения XJ\opa к тиофену выделяется в виде кристал­
лов. Он превращается при обработке щелочью в дихлортиофены:
нс-сн
11
;~z.
11
,,/
нс
СН
1I 1I
Н-С
2,S-дихлоpmофен
_
Сl
2%
44%
3.4-ДихлортиофеиS4%
с-н
/'/'
S
3.
{ 2,4-Дихлортиофен
CI-C-C-Cl
Сl
S
Реакции диенового синтеза. Фуран вступает в диеновый синтез как
обычный диен, образуя нормальные аДДУкты, однако склонные к обратной
диссоциации на исходные компоненты. Так, например, фуран присоединя­
ет малеиновый ангидрид:
+
сн-со,
11
СН
О...,!:.
СН-СО/
hc/I"'ch-СО
9 I
"о
I. . . . . CH-CO/
11
HC........
СН
Тиофен реагирует только с особенно реакционноспособными диенофи­
лами, такими, как дицианацетилен, причем образующееся соединение от­
щепляет серу и дает фталодинитрил:
D
-
C-CN
+ Ш-СN
---
~N
rr1'ir-CN
W-CN
::S-
V-<N
Пиррол реагирует с диенофилами, но по другой схеме. Так, например,
с малеиновым ангидридом он образует ангидрид 2-пирил-янтарной кис­
лоты:
сн-со,
нс-сн
11
НС
11
СН
,,/
NH
482
+
~H_CO/O
нс-сн
-
H~ ~-CH-CO
ун
I
)0
CHz-СО
4. Окисление. tI) В условиях, исключtlющих рtlскрытие кольцtl (в ней­
трtlЛЬНОЙ или слабощелочной среде), фуран окисляется в малеиновый ан­
гидрид, пиррол - в имид мялеиновой кислоты:
нс-си [О]
"
ис
11 си
нс=си
1
с
'0/
ис-си
1
с
,,/,
о
о
[О)
ис-=си
1111си - - СI
нс
,/
о
1
С
,,/,
NИ
О
NИ
О
мuеино."Й anlrДerнд
в мягких условиях в щелочной среде можно превращать алкилпирролы в
lIирролкарбоновые кислоты.
Тиофен окисляется очень трудно.
б) Фурян И пиррол легко подвергаются озонолизу. Эта реакция позво­
ляет формально судить о локализации двойных связей в этих соединениях
в момент реакции. Фуран и пиррол при озонолизе дают глиоксаль, 2,5-ди­
метилфуран и 2,5-диметилпиррол
-
глиоксаль и меТИЛГЛИОКСtlль:
;eJ-'
сн з
т
х
сн з ---- н з с
t
онс-сно
-
это О или
l'
_/
Х
,
-
-
снз
Н з С-СО-СНО
ОСН-СНО
(здесь Х
4+'
NH).
Разумеется, по количеству образующихся при озонолизе глиоксаля
и МСТИJIГлиоксаля нельзя судить о доле участия в резонансе той или иной
грю!ичной структуры, так как оно определяется другими факторами
и прежде всего стаБИJlЬНОСТЬЮ соответствующих переходных состояний.
111. Реакции замещения. Фуран, тиофен и пиррол вступают в обычные
для ароматических соединений реакции электрофильного замещения,
причем легче, чем беНЗОJl.
3t1мещение во всех случаях происходит в первую очередь в а.-положе­
ние и только если это положение занято - в ~-положение. Такое няправ­
Jiение реакций электрофильного замещения определяется большей ста­
бильностью (J'-комплексов, образующихся при а.-замещении, благодаря
более выраженному сопряжению:
(](-- (J( --- +0<
х
х
х
а.-замещение
~-замещенне
(эдесь Х
-
это О,
S или NH, а Е -
электрофил).
483
Мета-ориентирующие группы. такие. как иитро-. карбонильная. сульфогруппа. HaxoДII_
Щllеся в ОДНОМ НЗ а-положений. не препятствуют вхождению следующего замеСТитеJ1\1
во второе положение. Если оба а-положения заняты. замещеНllе происходит в одно из ДВух
f3-положеНIIЙ в заВИСИМОСТl1 от характера заместителей в а-положении. Так. например. СУЛЬ­
фllрование 5-бромфуранкарбоновой кflслотыдетT в положение 4. но не 3. Группа. уже нахо_
дящаяся в f3-положении. также может определять. какое И3 двух свободных a-положеНИА
может занять IIОВЫЙ заместитель.
При выборе условий для проведения реакций электрофильного заме­
щения необходимо учитывать ацидофобность фурана и пиррола. При вве­
дении в фурановое или пиррольное кольцо электроноакцепторных заме­
стителей ацидофобные свойства значительно ослабляются и такие соеди­
нения можно вводить в реакции электрофильного замещения в оБЫ'IНЬ[Х
условиях. Это относится, например, к фуран- и пирролкарбоновым кисло­
там, карбонильным соединениям и т. д.
1. Галогенирование. Галогенирование фурана, тиофена и пиррола
приводит сначала к образованию
2-,
затем 2,5-замещенных. Возможно
замещение и всех атомов водорода. Хлорирование обычно осуществляет­
ся с помощью хлористого сульфурила, бромирование
-
комплексом бро­
ма с дикосаном.
2. Нитрование. Нитрование азотной кислотой возможно только д,IIЯ
тиофена и то в мягких условиях. В случае фурана и пиррола нитрование
проводят ацетилнитратом в пиридине при низкой температуре с низким
выходом продуктов нитрования:
ПИРIIДIIН
3. Сульфирование. Тиофен легко сульфируется серной кислотой (лег­
че, чем бензол). Фуран и пиррол можно сульфировать комплексом SОз с
пиридином В пиридине. Во всех случаях продуктами реакции являются ПН­
ридиневые соли а-сульфокислот:
..
4.
Ацилирование. Ацилирование фурана и пиррола осуществляется
ангидридами кислот под влиянием мягко действующих катализаторов, та­
ких, как хлорид цинка, хлорид олова
(IV),
ВF: з . Ацилирование тиофена
возможно не т"лько ангидридами, но и хлорангидридами кислот в присут­
ствии хлорида алюминия. Во всех случаях активно а-положение:
о
х
5.
-СНэСООН
..
~COCH3
Реакции с хлорной ртутью. Для всех пятичленных гетероциклов ха­
рактерна реакция с HgCI 2 с замещением водорода в а-положении. кис-
484
латным гидролизом продукта хлормеркурирования выделяют чистый тио­
фен:
о
_+H=gClz~. 'Г",
~_.A
- HCI
х
Х
+НgCIz
HgC\
-НСI
ГП,
•
HgC\
....ч..._.л
Х
HgC\
IV. Реакции расширения ЦИКJIа. В случае пятичленных гетероциклов
знячительно легче,
в ароматическом ряду, идут реакции с расширени­
'leM
еМ цикла при действии дихлоркарбена.
Пиррольное кольцо превращается в пиридиновое кольцо при реакции
пирролкалия с хлороформом (или другими галогенопроизводными, таки­
ми, как бензальхлорид) в присутствии ЭТИJlата натрия. Реакция идет
с промежуточным образованием дихлоркарбена (гл. 2.2):
О
+ CHC1!
(NaOC;Hsl.
NK
У.
~Cl
~)
N
Реакции замены гетероатома. Замещение кислорода в цикле се­
рой или азотом является обычным в химии гетероциклических соедине­
))ий. Эта реакция в случае соединений фурана протекает с некоторым тру­
дом. Тем не менее фуран над оксидом алюминия при 450 ·С дает с серово­
дородом или аммиаком соответственно тиофен или пиррол. С анилином
при тех же условиях фуран дает n-фенилпиррол. Фуран, тиофен и пиррол
могут переходить друг в друга при 450·С над
О,
~
O~
"20
AI 20 a (ю.
К. Юрьев):
О,
N~NH
Q
Выход продуктов при этих превращениях оБЫ'lНО невелик. Наиболее
Высокий выход превращения дают фураны.
1.
ФУРАИ
Фуран впервые получен при сухой перегонке (декарбоксилирование)
Ilнрослизиевой кислоты (бариевая соль):
G
-О+СО}
О
соон
О
в настоящее время исходным веществом для получения фурана обы'шо
ЯВляется альдегид
-
фурфурол:
~O
а'
О
C~
'н
+
Н20
(с.о + NаОЩ
3S0-36O"C·
О'
о
+ CO + Н1
Z
48!>
Наиболее
ран
-
эффективный
способ
превращения
фурфурола
в
фу_
пропускание его вместе с парами воды над катализатором, СОстоя­
щим из смеси оксидов хрома, цинка и марганца. Выход фурана в этом слу_
чае
92-95%.
- бесцветная
Фуран
.
жидкость, т. кип.
31
ос с запахом хлороФОРма.
Нерастворим в воде. Фуран и его гомологи содержатся в древесном деn-е.
Радикал С 4 Н з О называется фур ил , а радикал С 4 Н з О-СН 2 _
фурфурил.
Из производных фурана наиболее важным соединением является аль­
дегид фурфурол. В промышленных масштабах фурфурол получают в ка­
честве побочного продукта при кислотном гидролизе древесины и пенто­
зансодержащих отходов сельского хозяйства, главным образом кукуруз­
ных кочерыжек, подсолнечной лузги, соломы и т. д. (гл. 33.1.9). Фурфу­
рол - жидкость с характерным запахом печеного хлеба, т. кип. 162 ос.
Слабо растворим в воде.
Фурфурол дает все типичные реакции альдегидов (схема 7). Он присое­
диняет гидросульфит, окисляется в ПИРОCJIизевую кислоту, восстанавли­
вается в фурфуриловый спирт, подвергается реакции Канниццаро, обра­
зует фуроин (аналогичный бензоину), реагирует с аммиаком с образова­
нием фурфурамида:
зQ
О
+2NНэ
СНО
-3Н2О.
Q
О
~N=HC-Q
СН
-о
"N=HC
I
О
I
фурфураМИJI
и образует шиффово основание с анилином.
Фурфурол применяется как селективный растворитель при очистке не­
фтяных фракций, в производстве пластмасс, для получения фумаровой
кислоты, а также многих соединений с фурановым кольцом, в частностИ
лекарственных препаратов.
Многие производные 5,нитрофурфурола являются сильными антисептиками (фураци1IИН, фурагенин, фурадонин, фуразонол, фуразолидон) и широко применяются в медицине.
Существенную роль в их открытии и проиэводстве в СССР сыграл С. А. ГИJIер.
NoMcH=N-NН-СО-NНl
фураЦКIIIUI
NОДСН=СН-СН=N-N::=L
фураreнии
486
O~NH О
Схема
Превращения фурфурола
7.
o-l :10
о
О-Н
............
I
t/ ОН
'НnЩP'"
.
О
'SO,Na
0~o'l~".CJO,
/~ o.CH,-ОН
О дифуpфypJu............
[У,О,)
Отerp&nЩ>Oфурфуlfll·
~
<\\'
:
.
~
t фуm + N•ОН
а+I ~
tН,; Н;
.
aЦOТOll н.ОН~ ~H
С<
О-СН=СН-СО-СН,.
lГl1
1 CH=CH-CO-CH=CH-Q
n..... <llJlpr
....
1
О
+
- -
O'!")~
~-~ С>-е,,,,н
о
\ t
~..-:~
',...~.,
+D..
_.:..
~
~= 8t~N~
~~
~ ~ 1;~
8
фуро. .
Q
'~
U~
I
А.'/
У
+~O
\,/
tJ'f
~
<NН,
фурфуplU08'"
ai8pr
Исоон
о
fI"
u.poc:n..............
;&"'
О
• [AI,O,)
о
фу.....
пиррол
[NiJ1H'
но н,с,--т ,.....!!2- I
~
СН
Cl-CH,
н
=-е::.;.н-сн, ,-, ~
+
6н,-он
СН,-СН,
'1~
.
Cl-(CH,).-C!
НО-(СН,).-ОН -
l,04-ДНlJIорбyrан
~
---r. . . .
NC-(CH,).-CN
+Н,/
NJ{ -(CH,),-NH,
z
ra.:UNeткn:ендиа".н
/'
1ICIICmI
соон-(сн,).-соон
....
П8ИО8U
k1lCl101'8
487
2.
ТИОФЕН
В промышленности тиофен получnют из бутnна:
СНз-СНz-СНz-СНз
+4S; 6500С
..
о
s
Предварительно нагретые до 600 ос реnгенты смешивают в реакцион­
ной трубе при 650 ос и времени контакта 0,07 с. Выходящий газ быстро
охлаждnют.
Тuофен
В
-
жидкость с т. кип.
84
ос, нерастворим в воде.
г. А. Байер обнаружил. что бензол при смеШИВ8Н1f11 С юатином 1I концеНтрирован_
11011 cepHoii Юlслотоii дает синее окрашнвание (uн()офеНОlIllЯ реакция). В 1882 г. В. Мейер на
1879
одной из леКЦIIЙ попытался продемонстрнров<!ть эту реакuию на образце бензола. приготов­
лением декарБОI\СIIЛllрованием бензоiiноii кислоты. ЛеКUl1Онная демонстрация не удалась.
ПРII выяснеНll1f ПРIIЧIIНЫ неуда'lIl было обнаружено. что «lIндофеновая» реакция характерна
не для бензола, а для Тllофена, который содержится в техничеСI\ОМ бензоле 1I очень сходен по
фllЗlfческим и ХИМllческим свойствам с бензолом. Замена бензольного кольц<! в физиологи­
чеСЮI al<ТlIBHbIX соеДlIнеНIIЯХ тиофеновым кольцом мало изменяет 11Х активность.
В Дi!ЛI,неiiшем разВIПllе Xl1MI1II тиофена пошло столь быстро, что уже через пять лет после
его выделения В. Mei1ep опуБЛlfl<ОВ<!Л монографию, посвященную ТllOфену.
Ин"Терес 1\ химии тнофен<! возрод1ШСЯ в HeAaBHlle годы в связи с тем. что не1\Оторые его
ПРОlIзводные обладают ЮПflПlстаМIIННЫМ деiicтвием (способностью предупреждать разви­
Tlle анафилаlПllчеСI\ОГО ШОl\а). а также оказываlOТ ПРОТlIвовоспаЛlпеЛl,ное AeiicTBfle.
Кроме того. было ПОI(iIЗЮIO. что природныii npoJIYI\T ВlпаМI1Н (jIЮlllllН содеРЖl1Т
Тllофеновое кольцо.
Радикал С 4 Н: з S называется muенuл.
Тиофен более всех других пятичленных гетероциклов с одним гетеро­
атомом похож Нn бензол. Это обусловлено нескоЛL,КИМИ причинами. Зна­
чителыlO больший, чем у кислорода и il30Тn, nтомный радиус серы дает
возможность I~ИКJ\У замкнуться с меньшим искажением валентных УГЛОВ
(с меньшим напряжением). Тиониевая (трехвnлентная) сера более ста­
бильна, чем оксониевый кислород (трехвалентный), и, следовательно, В
пюфене Jlегче передается электронная плотность по кольцу:
0-0---0 --о -- 0s
s
s
s
s
ВОЗМОЖIЮ, игрпет роль и способность nТОМn серы КnК элемента второго
периода
использовnть
ДJ\Я
перемещения
электронов
вакантные
{l-орбитали.
ПРОНЗВОДНblе тиофеня тnкже очень сходны по свойствам с соответстВУ­
ющими пронзв'ОДНblМИ бензола. Это относится к гnлогенопроизводныМ,
IlIпросоеДlНlениям,
сульфОКИСЛОТnМ,
оксисоединениям,
аминnм, солям
Дli(!З0IlИЯ, <lльдегидам, кетонам, кnрБОНОВblМ кислотам и т. д. Все эти про­
И3ВОДllые получаются СХОДНblМИ с производными бензола методами и про­
являют Юliiлогичные своЙствn.
Важнейшие превращения тиофенn предстnвлены на схеме 8.
Тетрягидротиофеl1 н(!3ывnют тиофnном. Гомологи тиофnна присутству­
ют В нефти.
488
схема
8.
Превращения тиофеllа
п со-си з
ис\
S
~s)J-
2-хлортиофен
метип~2·ТИСllиnкеТOII
п
~s,/- си-с\
2
2-хлорметИЛТИофсll
2-тиофеИСУJlъфоJtислота
2-тиеНИ1Iметиламмоний хлорид
3.
ПИРРОЛ
ДЛЯ получения пиррола помимо перечисленных ранее общих методов
синтеза
пятичленных
гетероциклов
могут
быть
использованы
также
следующие.
1.
Пропускание аммиака и паров
1,4-бутиндиола
над смесью оксидов
алюминия (95 %), тория (5 %) при 300 ос
-2Н,о
'0
NИ
Если аммиак заменить первичными аминами, получаются
N -замещен­
Hыe пиррqла; например, анилин дает N-фенилпиррол.
2.
Перегонка имида янтарной кислоты с цинковой пылью:
Гl-п
OAN~O -но NH ОН
2zn
наrpeвaние
НИИД .нтарноЙ
-
NH
пиррол
кислоты
ПИРРОJf
.. о
бесцветная жидкость с т. кип. 130 0 с. При хрннеllИИ окрн­
Wиваетсн и осмоляется. Кипит при значитеJIЬНО более высокой темперн­
туре, чем н-бутиламин
(78
ОС). Практически нернстворим в воде, в то
время как н-бутиламин смеWИl3нется с водой.
489
Название пиррол (красное масло) было дано Дж. Рунге ( 1834) предполагаемой состав_
ной части некоторых фракций каменноугольной смолы, обусловливающей покраснение сос­
новой лучинки, смоченной соляной кислотой. Вещество было выделено в чистом виде в
1858 г. Андерсеном, а строение его было установлено в 1870 г. БаеЙром. Пиррол содержит_
ся в каменноугольной смоле и совместно с метильными гомологами в костяном масле.
Производные пиррола имеют большое биологическое значение. К ним
относятся такие вещества, как хлорофилл растений, гемин крови, пигмен­
ты желчи. Восстановленное кольцо пиррола (пирролидиновое) присутст­
вует во многих алкалоидах и аминокислотах белков.
Дигидропирролы называют nuрролuнам.u. Полностью восстановлен­
ные пирролы - тетрагидропирролы - nuрролuдuнам.u. Кетопирролы
называют nuрролонамu, а кетопирролидины - nuрролuдонамu:
~o
о
о
NH
NH
DНРРМИДИИ
nИрpclJlидDН
В химии пиррола большую роль играет его способность замещать водо­
род при атоме азота металлами с образованием пирролиевого аниона.
Различные реакции замещения в пиррольном ядре можно проводить, ис­
пользуя металлические производные в качестве промежуточных продук­
тов. Наиболее часто применяют пирролмагнийгалогениды, образующиеся
при реакции пиррола с реагентами Гриньяра:
о +RmgX-О
NH
+RH
N
I
MgX
Эти магниевые соединения с ацил- или алкилгалогенидами при низких
температурах образуют N-ацил- или N-алкильные соединения, перегруп­
пировывающиеся при
150-200 ос
в соответствующие С 2 -производные:
о
N
I
MgBr
JRcoa
~COR
~CICOOC;H5
!НСООС;Н,
C!LrooCili,
Cl<
Способность пиррола давать пирролиевый анион позволяет проводИТЬ
некоторые реакции замещения в Р-положение. Так, например, амилнИТ-
рат реагирует с пирролом в присутствии этилата натрия с образованием
натриевой соли 3-нитропиррола:
Важную роль в природе играют производные продукта исчерпывающе­
го гидрирования пир рола
-
пирролидина.
Пирролидин (т. кип. 88 ОС) является типичным вторичным амином. Он
смешивается с водой, его константа диссоциации как основания
К= 1,3010-3.
Образование гидрох.лорида пирролиднна при нагревании l-х.лор- 4·аминобутана является доказательством строения пирролидина:
CHz-СНz
I
I
нагревание
I
I
CHz
CHz
Cl
NHz
•
Важными производными пирролидина являются nролuн (2-пирроли­
динкарбоновая кислота) и оксunролuн (4-гидрокси-2-пирролидинкарбо­
новая кислота). образующиеся при распаде белковых веществ:
НО
~COOH
ь
NH
пралнн
СООН
I'Идрохсипролин
Пuрролuдон является лактамом у-аминомасляной кислоты. Произво­
дится В промышленных масштабах из у-бутиролактона и аммиака. В при­
сутствии щелочного катализатора он дает линейный полимер, называе­
мый найлон-4:
HzC-СНz
х
I IС
HzC
.
-
'/~O
наЙЛон-.
NH
Конденсация пирролидона с ацетиленом лриводит к N-винилпирроли­
Дону, который ПОJiИмеризуется в nолuвuнuлnuрролuдон:
Q
NH
О
нс=сн.
uN
О
!H==CHz
[а
N
О
]
-Jн-СНz- х
491
Последний дает коллоидные растворы в воде, которые используются
в качестве заменителя плазмы крови, а также в качестве клеящего и свя­
зующего материала.
Производные порфина. Алкилированные пиррольные ядра образуют
основу многих биологически важных пигментов, например пигментов кро.
ви, зеленых частей растений, желчи, а также витамина 812'
Поэтому пиррол и алкилированные пирролы присутствуют в костном масле - ОНII обра_
зуются при разложении костного мозга, KOTOPbIl"! вырабатывает пигмент крови. Все эти пиг­
менты содержат плоское lб-членное кольцо - ядро nОрфUНll:
Природные пигменты являются метаЛЛИ'lеСЮIМИ хелатными (клеШI!еобраЗIIЫМИ) комп­
лексаМI! порфиринов. Так, протопорфИРИII с FeCl:! в щелочном растворе дает пигмент кро­
BII -
ze,lIUH.
reMHH
Сllнтез гемина описан Г. Фишером
(1929).
Из геМlша при действии щелочи образуется
свободное основание гематин (C:!4H:!2N404Fe J+OH-.
Хлорофuлл является магниевым комплексом порфирина, этерифицированным д,IIHHHO­
цепным непредельным спиртом ФUnЮЛО,l1 C 2o H:!!!-ОН:
СН 2=СН
СН)
CH)JY~2Hs
__НС\r~"'~)j-g
/Ф-\_-~
и СН
~/'f # )
СН)
Н
СН
~
Н2 Н
I
С
I
C'~
/C'l;"" ~
СН 2 СООСН з
~OOC20H)9
....орафипл
492
а
Хлорофилл Ь в ОТЛИ'Нlе от хлорофилла а имеет альдегидную группу (вместо метильноii
группы) в положении
3. Разделение хлорофиллов а и!J PYCCКliM ботаНliКОМ М.
С. Цветом по­
лОЖliЛО начало раЗВllТИЮ хроматографии.
Методом Me'IeHbIX атомов было установлено, что ПОРфИРliНовое ядро и reMllHa и хлоро­
фllлла синтезируется биологически по одной и той же схеме из ГЛIЩliНа и уксусной кислоты.
01 нтез ХЛОРОфllлла в лабораТОРl1li осуществлен в 1960 г. (Р. Вудворд).
Витамин B I2 , CIi:\HmPI4N 14РСО' получаемый I1З печени и эффективно применяемый прн
лечеНllИ злокачественного малокровия, является I(обальтовым l(омплеl(СОМ, содеРЖllЩИМ
порфИРlIновое ядро. Его строение полностью УСТlIновлено химическим и рентгеноструктур­
ным анализом в 1955 г. Он является наllболее сложным органическим соединением 11звест­
ногО строения, не относящимся к высокомолекулярным веществам.
1-I11"елеRЫЙ
и
ваНlIдиевый
"омплексы порфирина
встре'lаются
в
нефПl Hel<OTopbIX
меСТОРОЖдений.
4,
В
качестве
примера
ИНДОЛ
конденсированных
гетероциклических
систем
здесь рассмотрен uндол:
4
s~э
. .d'2
6~
7
NH
1
Он впервые получен А. Байером в 1886 г. при перегонке с цинковой
пылью оксииндола - продукта распада индиго. Найден в каменноуголь­
ной смоле. Это бесцветное кристаллическое вещество с т. пл.
52
ос.
Наиболее важными являются следующие способы получения индола
и его гомологов.
1.
Внутримолекулярная конденсация Формил-о-толуидина. Этот син­
тез наглядно доказывает строение индола:
~m- с.н,оК)
•
OCJ
NH
2.
Внутримолекулярная конденсация различных других о-замещенных
анилинов, например из о-аминофенилацетальдегида с выделением воды:
3.
Наиболее общий способ получения замещенных производных индо­
ла заКЛЮ'lается в нагревании фенилгидразонов, альдегидов и кетонов
493
с хлоридом цинка или с серной кислотой (г. Фишер), или с хлоридом меди
(А. Е. Арбузов):
-
Индол И скатол (3-метилиндол, т. пл. 95 ·С) образуются при гниеtlии
белков. Они обусловливают характерный запах фекалий. Чистый индол
в большом разбавлении имеет цветочный запах. Он содержится в цветах
жасмина и апельсина.
Реакции индола и его простых производных сходны с реакциями пирро­
ла. Индол, подобно пирролу, обладает слабой ОСI-IОВНОСТЬЮ и в то же
время слабыми кислотными свойствами. Он проявляет явно выраженную
ароматичность, более склонен к реакциям ЭJlектрофилыlOГО замещения,
чем присоединения. Индол осмоляется кислотами, окрашивает в вишне­
во-красный цвет сосновую лучинку, СМО'lенную соляной кислотой.
1.
Индол образует металлические производные
-
индолкалий и ин­
долнатрий:
(Q~CtJ
NH
2.
При
электрофильном
NK
замещении
заместитель
предпочтительно
вступает в положение
3 (отличие от пиррола ); если это положение занято,
то заместитель направляется в положение 2. а-Комплекс, возникающИЙ
в ~-ПОJ\ожении, энергетически более выгоден, чем образующийся за счет
Q.-положения, так как резонансная стабилизация первого не ведет к поте­
ре сопряжения в бензольном кольце:
Q-j.'--- o::t
NH
NH
w
~+
~_.)(--~
~
NH
Н
Галогенировать индол можно только мягко действующими реагентами,
например с помощью хлористого сульфурила, диоксандибромида. При ни­
тровании Иllдола этилнитратом в присутствии этилата натрия в эфирноМ
494
растворе ПОЛУ'l8ется 3-нитроиндол. При сульфировании индола комплек­
сом пиридина с SОз получается 3-сульфокислота. Точно так же в положе­
lIие
3
ИДУТ реакции ацилирования, азосочетания, Манниха:
S~CIz
. С1
О:1
~
I
.~
S~CIz.
(С(Сl
~ I
<;H,ON02
I I
o:1
~
I
NH
NH
Сl
N02
NH
С5Н5Н' SОз
(0-
O J " S 0 3H
~ I
I
NH
NH
R-CO
·Х
o:r
~ I
I
COR
NH
~H,N2CI
~N=N-C6HS
NH
СН 1 О
+ R 1 NН
.~СН1-NRl
NH
Восстановление индола водородом в присутствии платинового катали3<1тора дает 2,3-дигидроиндол.
Мягкое окисление индола дает индиго (см. ниже).
С хлороформом и щелочью индол дает 3-индолкарбальдегид и 3-хлор­
хинолин:
на хападу
+2КОН
((J
NH
CHCI)
[КОН)
• OJ.
I
::::::,..
I
NH
-2НСI
~CHO
~LJ
NH
CHC1 1
-
иаrpcаанис
С КОН
-HCI
~Cl
~~
N
495
Тяк же, кяк в ряду пирроля, в индольном ряду большую роль играют ре­
акции с участием метяллических производных индола. При действии гало_
геналкилов ня N -магнийиодиндол образуются 3-алкилиндолы:
со C~~~~
O:J ~ O=1
..
NH
N
R
NH
1
MgI
Индолилкарбоновые кислоты. Многие кислоты ряда индола получают
по методу Г. Фишера (нягреванием фенилгидразонов кетоно- или альде­
ГИДОКИСJJOТ,
таких,
как
пировиноградная
или
левулиновая,
с
хлоридом
цинка). Это твердые вещества с отчетливыми кислотными свойствами.
При нагревянии разлагяются на СО 2 и производные индола.
3-Индолuлуксусная кислота - гетероауксин (т. пл. 164 ·С) обра­
зуется при разложении белков и синтезируется гидролизом 3-индолил­
яцетонитрила, получаемого взаимодействием иодистого индолилмагния
с хлоряцетонитрилом:
~ I
I
со
Oc1
+СIСНэСN.
~
~
-МgСII
~
I
I
CH2CN
+ЩО.
-NH]
OJCH3COOH
~
~
I
~
N
I
~
I
MgI
Оня является гормоном роста растений (гл. 36).
Трunтофан, или 3-( 3' - индолил )-2-яминопропановяя КИСJlота
~СНz-СН-СООН
~
•.)
NH
~H2
входит 13 состав большинства беJlКОВ и может быть синтезирована из индо­
ла. Из него образуются все ПРОИЗВОДllые ИНДОJlа при гниении беJlКОВ.
Гидроксииндолы. 2-Гuдроксuuндол (а-гидроксииндол)
~
~N!,-OH
(1)
~
~N~O
11
существует в тяутомерной форме ляктамя о-яминофенилуксусной кисло­
ты (11). Может быть получен нягреванием этой кислоты с минеральными
кислотями, восстяновлением изатина (см. ниже), конденсацией анилина
с хлорацеТИЛХJlОРИДОМ:
QI
~
+
NH z
CI-С-СНzСI
11
О
-2HCI
..
~
~~O
Гидроксииндол восстанавливается в индол при lIягревании с цинком.
496
3-Гuдроксuuндол(~-инДоксил)
Q10H~
NH
~O
~-.)
NH
содержится в растениях рода /ndigojera в виде гликозида
11 в моче человека, в виде сульфата:
uндuкана
-
~:'OHf.ГCO (t:r""0'K
он
н
Н
NH
Н
ИНДИКа"
как щелочные растворы индоксила легко ОКИСJIЯЮТСЯ
TRK
HR
воздухе
в индиго, индоксил является полупродуктом при промышленном синтезе
индиго:
0с1
17
'- I
0 --:m;o
02
NH
IП\IIRI'O
НЮlболее ВRЖНЫМ способом получения индоксила,
R следовательно,
и индиго является предложенное К. Гейманом сплавление N-фенилгли­
цина
(1)
или N-(о-карбоксифенил) глицина
(II)
со щелочью (позже было
IIRйдено, что лучше использовать амид натрия):
r?)
СООН
~ )Н2 ---н-2о-'
NH
~COOH
-н 2о
~NH-CH2-COO;---
~O
~L.d
NH
~O
~..)
NH
11
497
N-фенилглицин
получают
ИЗ
анилина
и
хлоруксусной
кислоты
а N-(о-карбоксифенил)глицин ИЗ антраниловой и хлоруксусной кислот: •
Q
'1
~
СООН
+~H]
I
Q
~'I
6н]
~./
СI
NHz
СООН
NH
N·ФСНlIЛГnИЩIН
ос
I
~
NHz
СООН
СООН
+
I
СН]
ы
~ I СООН
- ос
-HCI
/CHzNH
.
N- (О -
СООН
карбоксифенил)rлиции
Разработан непрерывный способ получения индоксила. Из анил'Иliа 11 ОКl1СИ ,тилена по­
лучают ~-ГИДРОКСll7таЛliНанилин, щелочное деГlщрирование которого дает ItНДОКСliЛ:
tNaOH.
3QO"C
(NI
~
Н
Индоксил может быть восстановлен в ИIЩОЛ амальгамой натрия или
цинковой пылью со щелочью.
Индиго имеет плоскую молекулу и обладает транс-строением, Синие
кристаллы с т. пл. 390 ос. Оно почти нерастворимо в обычных раствори­
телях, в кислотах и щелочах_ Чтобы можно было применить индиго.в каче­
стве красителя, его восстанавливают в щелочных растворах в диенол (бе­
лое индиго), которым и обрабатывают волокно. Последующее окисление
белого индиго в порах волокна на воздухе дает синюю окраску (кубовое
крашение ):
----[Н)
[О)
ИНДIIГО недает реакциii, характерныхДllЯ карБОНliЛЬНОЙ группы. Оно легко сульфируетсЯ
бромируется. При разлlt'IНЫХ УСЛОВIIЯХ четыре атома "ли группы могут быть введены в мо­
лекулу в положеНl1Я 5,5', 6,6' и 7,7'.
11
Продукты галorенщ>ОваНIIЯ индиго дают окраШl1вание с лучшеii ПРО'IНОСТЬЮ к свету
11
CТltpKe:
Br
6.6-ДllброМIlIIAИnJ. краСlщес иач8llO 8.,._чи0r0
498
nypny..
Индиго может быть ОКl·lслено в изатин азотной или хромовой КlIСЛОТОЙ:
-
2~I о
[О)
~_A
NH
о
(НNО з)
И3аТRИ
Н:ШI11UН
(1) -
светло-красное кристаллическое вещество. Не содержит гетероаромати­
чеСl\оГО цикла. однако чрезвычаiiно ароматичен по характеру (стоек к окислению). Он явля­
~TOI лаl<тамом o-аМflноФеНИЛГЛI1ОКСI1ЛОВОЙ кислоты (<<u:шm()(юй кuслоты»)
и легко
(11)
дает соли этой кислоты при нагревании со щело'1ЬЮ:
О
ОС:(
I
~
~
0-
NH
Q?:O
I
~
~ ОН
N
111
II
Группа СО в положеНИII 2 не активна. имеет амидный характер. а в положеНIIИ
1lI1ЧНО кетонныЙ. Изатин существует главным образом в Ilмидноii форме (111).
5.
КuрБU:lОЛ
КдРБД30Л
конденсированная система, состоящая IIЗ двух бензольных
-
3 - TII-
11
одного пир­
ро,%ного колец.
Много карбазола содержится в каменноугольной смоле (особенно в антраценовом мас­
ле). Его извлекают обработкой соответствующей ФРaIЩl1ll смолы еДКlIМ 1(i1Л11. с I<OTOPbIM кар­
базол дает I(Мllевую соль. Он может быть получен слеДУЮЩllМИ методами:
1) пропусканием дифенилаМllна через раСI(i1ленные трубки:
~HH~~~
~ NH ~
~.~
NH
2) нагреванием o,o'-диаминодифеНllла в ПРИСУТСТВИII кислот:
Карбазол
КРllсталлическое вещество с т. пл.
-
238
'с. По химичеСЮIМ
cBoiicTBaM 011
скорее напоминает дифенилаМIIН. чем Пl1ррОЛ. Проявляет более Юlслыi'l харю<тер. Mellee
склонен к реакциям элеl<ТРОфильного замещеНIIЯ. С ацеТl1Леном образует ВlIНllлкарбазол,
Способный к ПОЛllмеризаЦИII (карбазоловые смолы).
Карбазол
.1еЙ
11
11
его производные находят ограниченное
npllMeHeHlle
в ПРОlIзводстве
Kpacl·ITe-
пластмасс.
499
ГЛАВА
29
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
С НЕСКОЛЬКИМИ ГЕТЕРОАТОМАМИ
Соединения этого класса, имеющие ароматический характер, как прави­
ло, содержат один или более атомов азота в гетероциклическом ядре. ОНИ
известны под общим названием азолы и различаются по природе второго
гетероатома: оксазол, тиазол, имидазол, пиразол, триазол (с тремя атомами
азота), тетразол (с четырьмя атомами азота) и т. д.
Если в формулах фурана, тиофена или пиррола заменить группу СН ато­
мом азота, мы получим формулы важнейших представителей азолов. Фура­
ну соответствует два соединения
-
оксазол и изоксазол:
If43N
uz.lJ
О
оксаЗOJI
Тиофену
-
ИЗОJCСЦ30Jl
тиазол и изотиазол:
о
s
тиа30Jl
Пирролу соответствуют диазолы
_зarиaЗQJI
-
пиразол и имидазол:
~]
NH
имидазал
пиразол
1.
ПИРАЗОЛ
Номенклатура производных пиразола ОСНОвана на принятой для произ­
водных пиррола. Нумерацию начинают с аТОМа азота иминогруппы и про­
должают в направлении второго атома азота.
Способbl
IЮлучения.
Пиразолы
получают
способами.
1.
Действием диазометана на ацетилены:
ен
111
ен
'+-
еН1
+ N
111
N
не-ен
11
11
N
не
'\ /
NH
пмраэал
500
следУЮЩИМИ
общиМИ
2.
Гомологи пиразола ПОЛУ'lают также из
1,3-дикетонов
и гидразинов,
няпример из ацетилацетона и гидразина образуется 3,5-диметилпиразол:
CH1-СО-СНз
I
снз-с=о
+
нс-с
I
N
/V
снз
нн
кристаллическое вещество (т. пл.
-
/снз
11
С
NHz
NHz
Пиразол
П
-_
..
70
·С). Его ПРОИЗВОдные
lIяйдены в природе и получаются синтетически. Они широко применяются
в качестве лекарственных препаратов и красителей.
Химические свойства.
1. Пиразол является основанием. Он устойчив
к действию окислителей, а также кислот и щеЛО'lеЙ.
2. В противоположность пирролу он нитруется и сульфируется соот­
ветствующими кислотями в положение 4, т. е. не проявляет ацидофобных
свойств.
4-Амuноnuразол, получающийся восстановлением 4-нитропроизвод­
~lOго. способен диазотироваться и сочетаться с солями диазония, т. е. про­
являет свойства, сходные с анилином:
-
[н]
3. Водородом в момент выделения (реакция натрия со спиртом) пира­
зол Meд,1leHHO восстанавливается в дигидропроизводное пиразолин. Ката­
литическое гидрирование приводит к пиразолидину:
о
Он
нн
нн
пНра..... ИАНН
пираэолин
Пиразолин
-
более сильное основание,
'leM пиразол. Легко окис­
ляется.
П"раЗ0ЛОН и его производные. Важнейшим производным пиразолина
является пиразолон:
oU
нн
Производные пиразолона легко получают конденсацией замещенных
гидразинов с эфирами ~-кетонокисот или присоединением гидразинов
к дикетену.
501
При конденсации феНИJIГидразина с ацетоуксусным эфиром или дике­
теном обрюуется l-фенил-3-метилпирюолон-5 (Л, Кнорр, 1883):
H2C-СО-СНз
I
COOC 2 Hj
СН2=С-СН2
I
I
о-со
3-Метил-l-фенил-5-пирюолон может сущеСТВОВiПЬ в трех таутомер­
ных формах:
11
III
Метилированием l-фенил-3-метил-5-пиразолона (Ш) иодистым мети­
лом получают антипирин (1-фенил-2,3-диметилпиразолон-5). Таким
образом фиксируется таутомер с формулой Ш:
Антипирин известное жаропонижающее средство. Он обладает го­
рьким вкусом. Хорошо растворим в воде, что объясняется его солеобраз­
ным характером. Антипирину приписывают биполярную структуру:
502
Производными антипирина являются два широко при меняемых жаро­
понижающих средства, обладающих также антиневралгическим действиеМ а.мидопирин
(1-фенил-2,3-диметил-4-диметиламино-5-пиразолов)
и
анальгин
(1-фенил-2,3-диметил-4-метиламино-5-пиразолов -1-метансульфонат натрия).
Для получения амидопирина антипирин переводят с помощью азоти­
стой кислоты в 4-нитрозопроизводное. Последующее восстановление
даст
4-аминоантипирин,
который
при
метилировании
превращается
в амидопирин:
4~нитрозоаНТИПIIРИН
антипирин
4-аминоантипирин
2.
Имидазол (т. пл.
JJИрамидон, амидопирин
ИМИдАЗОЛ
90 ос, т. кип. 256 ОС) -
изомер пиразола. Его полу­
Ч<lЮТ из глиоксаля, аммиака и формальдегида:
NНз
+
NНз
CHzO
Производные имидазола оразуются аналогичным путем при действии
<lммиака на соединения, содержащие рядом две группы СО (глиоксаJ\Ь,
ДН<lцетил и т. п.).
Имидазол является более сильным основанием, чем изомерный ему
ПНР<IЗол
Л(j -
(константа
основности
имидазола
1,2' 10-7,
пиразо-
3,4' 10-12).
В~ЖНЫМI1 ПРОНЗВОДНЫМН I1мндазол~ ЯВЛЯЮТСЯ аМI1НОЮIСЛОТ~ Гl1СТllДflН. ВХОДЯЩ~Я В состав
(jеЛI\ОВ. 11 гuсmа.МllН -
ПрОДУКТ распада П1СТIIДина пр" гниеНlIИ 6еЛl<ОВ. Ядро ИМllДазола ЯВ-
503
ляется составным элементом скелета ряда IIЛКIIЛОИДОВ
,например nuлrжарnuна, синтез
торого был впервые осуществлен Н. А. и В. А. ПреображеНСКliМli
I
=t""'. СНI-СН-СООН
1--'1
1
~
HNVN
1(0.
(1935):
(CHz-СНZ- NН l
HN~N
NHl
rистзмин
rиСтНДИК
CZHS:O- CHz-Т- N
о
о
""СН э
,)
пилокарпин
ТИА30Л
3.
Тuазол (т. кип.
·С) в природе не найден, однако ядро тиазола вхо­
117
дит в состав многих при родных соединений:
ГЭ~
~.L)!I
s
тиазол
Расщепление витамина 81 дает производное тиазола; пенициллин так­
же является производным тиазолидина. Ряд производных тиазола образу­
ет группу лекарственных препаратов сульфтиазолов.
Т"азолы образуются Прlf взаllмодеlkТВlН1 Тl1OIIMIIДOB и XJlоркетонов или а'XJlоральдеГII­
дов:
NH
+
-HZO;-HCI •
11
/C-СНэ
СНЭ'п- N
IlS~СНЭ
HS
тиоацетамIIД
хnорацетон
(ИNндиаа фор"а)
Если в этоii реакЦlШ использовать тиофОРМIIМIfД
.
2 ,4-диметилтиззол
11 XJlоруксусный альдегид. то образуется
ТllI1ЗОЛ:
::'СН- С)
S
ПеНUЦ!lЛЛllн~ыделен IIЗ I<УЛЬТУРЫ плесневых грибов PenicilLium notcltum. Это первый из
открытых н НllшеДШltх применение антибllОТИI<ОВ, IIспользуемых в ле'lении ба,,-теРllальныХ
IIнфекционныхзаболеваНllii. ПеЮЩllЛЛИН содерЖIП в молекуле ТШlзолидиновое I<ОЛЬЦО, кон­
деНCllРОВlIнное с jJ-лаIПIIМНЫМ циклом. Он имеет три IIСllммеТРИ'lеСКlIХ углеродных IIтома:
*
HOOC-CH--N-CO
СНз
I
I I
........С
~H-CH-NH-CO-R
CHr ..........5.......... *
.
*
504
Об аЛКIIЛОIIДIIХ см. гл.
30.1.
Наиболее 11звестные пениЦl1ЛЛИНЫ различаются только замеСТI1ТеЛЯМI1
R = -CH~-C(;H:)
R = -CH~-OCBH;,
пеНlЩИЛЛИН
пеНИЦlIЛЛИН
G
V
R:
(беНЗlfлпеницилЛl1Н)
(феноксиметилпеНИЦИЛЛIIН)
ПеНIЩl'ЛЛllН препятствует размножеНl'Ю бактеРI'Й. мешая образованию "х клето"ной
о(ЮЛО"IШ. Он реагирует с аминогруппой ответственного за Сl,нтез ;поt", оболо"ю, ЭН311мlt
l ~ paCKpbITlleM
лактамного кольца) 11 делает его неакп,вным.
ГЛАВА за
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ
СОЕДИНЕНИЯ С ОДНИМ ГЕТЕРОАТОМОМ
1.
ПИРИДИН
Пиридин можно Р1\ССМ1\тривать как бензол, в котором трехвалентная
группа СН замещена атомом азота:
у
II'~II
«'у«
Согласно теории строения должно существовать три монозамещенных
и шесть или десять дизамещеНIIЫХ продуктов в зависимости от того, оди­
наковые или Р1\зные эти заместители.
Монометилпиридины
ВЫ -
называются
луmuдuна.иu, триметилпиридины
nuколuна).{u,
-
диметилпириди­
коллuд"на.мu.
Способы получения
Пиридин впервые извлечен из костяного MaCJJa (1851), 1\ затем из ка­
менноугольного дегтя (1854). До 1950 г. каменноугольная смола была
единственным
промышленным
источником
содержание его в смоле менее 0,1
%.
получения
ПИРИДИН1\,
хотя
в настоящее время выделяемых из
каменноугольной смолы пиридина и его гомологов недостаточно, чтобы
удовлетворить потребности промышленности.
Для синтеза пиридина и его гомологов предложен ряд реакций; наибо­
Jlее важные из них основаны на конденс;щии карбонильных соединений
с аммиаком.
1. Акролеин при конденсации с аммиаком образует /3-пиколин:
505
Эта реаКЦliЯ легла в основу гипотезы А. Баilера о возникновеНИIi пиридиновых ОСноваНИjj
в I\ОСТЯНОМ масле из акролеина и аммиака, которые образуются Прli пиролизе глицеРИна It
азотистых соедliНеюtii.
2. ПИРliДиновые основаНliЯ образуются из насыщенных альдепlДОВ и альдегидаммиаков
(А. Е. Чичибабин, 1937). Так, например, ацетальдегид и аммиак в присутствии ацетата ам­
мония при 250 'С дают 69%-ный выход 2-метил-5-зпtЛПИРИдliна:
4СНз-СНО
+
CIHS'Q
NНз
-4Н 1 О
•
I
~
N
СНз
3. Ацетилен и аммиак в присутствии сложного никелевого или кобаль­
тового катализатора также дают 2-метил-5-этилпиридин (В. Реппе):
C1Hs~
4 HCsCH + NНз
•
~.. ~
•
N
СНз
Физические свойства
Пиридин и его ближайшие гомологи
-
бесцветные жидкости с непри­
ятным запахом, растворимые в воде. Структурное сходство пиридина
и бензола подтверждается измерением электронной дифракции, которое
показало,
что
пиридиновое
кольцо
является
почти
правильным
шести­
УГОЛI,НИКОМ (длина связей УЮlзана в нм):
tj
IZ~~
q~.$'
",,-
~
N O~~'
Ультрафиолетовые спектры пиридина и бензола o'leHb сходны. Бензол
имеет полосы поглощения при 179 (интенсивная), 200 (средняя) и 255 нм
(слабая), пиридин имеет максимумы при 170 (интенсивный), 200 и
250 нм.
В отличие от бензола пиридин имеет большой дипольный момент:
7,3' 10-3 Кл' М (2,2 О).
Химические свойства
Пиридин вступает в реакции присоединения, замещения, реагирует как
третичный aMJ.fH, способен раскрывать свой цикл.
1. Реакции присоединения. 1, В отличие от бензола пиридин восста­
(Na + С 2 Н 5 ОН) с образова­
навливается водородом в момент выделения
нием пиперидина:
506
Бензол с иодистоводородной КИСJlОТОЙ при
280
·С образует метилцик­
лопентан, но не гексан, в то время как в сходных условиях пиридин дает
н-пентан и иодид аммония:
Бензол при катаJlитическом гидрировании
(180
·С) дает ци KJlOreKCa н , в то
время как пиридин дает аМИJlамин, т. е. как и в предыдущем случае, идет
раскрытие пиридинового кольца:
о
N
2. Озонолиз пиридина также проходит значительно труднее, 'leM бен­
зола. При озонолизе 3,4-диметилпиридин дает глиоксаль, метилглиоксаль
идиацетил:
СНз
СУI СНз4:СНО-СНО
СНз-СО~
+0з
~N
СН О
СНз-СО -СОСНз
11. Реакции замещения_ Водородные атомы пиридинового кольца
подвергаются замещению при действии электрофильных, нуклеофильных
и радикальных реагентов.
А. Элекmрофильное замещение. Пиридин весьма мало склонен
к электрофильному замещению. Атом азота обедняет кольцо электронной
плотностью, так как он более ЭJlектроотрицателен, чем углерод. Кроме
того, электрофильные реагенты в первую очередь атакуют атом азота, об­
разуя на нем электроположительный центр. Поэтому
(J-комплексы в
а-положении, образование которых в данном СJlучае требует возникнове­
ния в молекуле второго электроположительного центра, мало вероятны.
Несколько большей устойчивостью обладают (J-комплексы в (3-ПОJlоже­
нии, .резонансная стабилизация которых не связана с возникновением
второго положительного заряда на атоме азота:
~~--q.~--~~
It..+~
+
+L..~
НХ
'1>.+
NX
;
507
1.
Галогены
при
низких температурах присоединяются
к пиридину
с образованием N-галогенидов, которые при нагревании превращаются
в J3-галогенопиридины:
О
N
+e1 -[OJ+el---- (Jel+ неl
1
N
N
I
еl
При
жениях
300-400 ос без катализатора замещение идет только в J3-поло­
(3 и 5). При 500 ос бромирование происходит очень гладко с обра­
зованием продуктов замещения в а.-положениях (2 и 6):
3ОО-4ОО"С
~BC
-
~.)
N
о
N
Br~Br
~..N)
~-u
Вс ~N Вс
~N.Jl...Br
2. При нагревании пиридина в течение 24 <1 с дымящей серной кисло­
той до 220-230 ос в присутствии сульфата ртути образуется пири­
дин-3-сульфокислота.
Сульфироание пиридина без ртутного катализатора идет при 300 ос
a
и дает низкие выхйды пиридин-3-сульфокислоты:
О + Н050зН
-
N
S03H
+
Н10
N
3. Нитрование пиридина также требует жестких условий. Действие
раствора
нитрата
калия
в
азотной
кислоте
на
раствор
пиридина
в 100%-ной серной кислоте при 300 ос в присутствии железного катали­
затора дает 3-нитропиридин с 22%-ным выходом. При 370 ос образуется
также 2-нитропиридин:
300"С
О
N
C
~
HNO]
37&'С
~NOz
~.)
N
~N01
~
~••
,l
N
If
NO z
~.)
N
в БОJlее мягких условиях нитрование не идет. 2- и 4-нитропиридины
образуются с 75%-ным выходом при окислении 2- или 4-аминопиридина
пероксидом водорода.
508
4.
Алкилирование пиридинового ядря ПО реакции Фриделя-Кряфтся
не происходит.
Б. Нуклеофuльное замещение. Обеднение электронной плотностыо
пиридинового кольца, зятрудняющее электрофильное замещение, облег­
чяет нуклеофильное замещение. В отличие от бензола пиридин довольно
легко реагирует с нуклеофильными реагентами, причем атакя ориентиру­
ется в а или у-положения. В этих положениях легче образуются (У-комп­
лексы, так как их резонансная стабилизация не связяна с появлением от­
рицательных зярядов рядом с электроотрицательным атомом азота:
()(-
()<
I- н
о<н----О<н
н---'
....N Y
-у
У-.
У
~
(ХНУ-~
-
Q<H
у
-.&
х- _НХ Х
~~---V--y
1. При нагревании пиридина с амидом натрия обрязуется аминопири­
дин (реакция Чичибабuна):
о
NaNНz
..
ClI
~
N
N
- NИз
,~I
..~
NИNа
N
+ NаNИ%
NИz
Ренкция лучше всего идет в жидком аммиаке. Механизм ее может быть
представлен схемой
2.
При действии паров пиридиня на сухое едкое кали при
250-300
·С
образуется а-оксипиридин (А. Е. Чичибабин):
0
~H
1
~~
~~
2
-Н
~H~OK
~N)l.ои
+
КОИ
Этя реякция аналогичня реакции нитробензола с концентрированной
щелочью, дающей о-нитрофенол (гл.
3.
29.1).
Известен ряд НУI(леОФIIЛЬНЫХ реаlщиii. в которых
aKTI1BHbIM реагентом являются
I(~Рбин"оны. Например. литиiiбутил ИЛКl1Л11рует ПИрl1Дl1Н в a-положеНIНI:
О
N
LiC4Hv ..
cl
N
+
LiИ
С4 ИV
509
В. РШ)UКUЛhН()(! :Ю)I(!IЦ(!НU(!.
ПРII добавлеНIIИ ВОДНОГО раствора диазониевой соли
C(jH"N 1 C1 к избытку пирндина Прl! 20-70 ·С образуется смесь а. (3-
(S
It у-арилпиридинов:
N
Реакции пиридина как третичного амина.
111.
1.
Пиридин и его гомо­
логи проявляют слабые основные свойства: K()~II = 4,0· 10-10, а ДЛЯ пипе­
ридина 1,33· 10-:1). Они легко образуют соли с кислотами, такими, как
соляная, бромистоводородная, серная и др.:
[QJaПикриновая кислота дает соль, которая используется ДЛЯ идентификации
пиридина. Для определения пиридина применяются также двойные соли с
хлоридами ртути, платины и золота.
Многие соли пригодны ДЛЯ разделения смесей гомологов пиридина
кристаллизацией, например соль с хлоридами ртути, цинка и т. п.
2.
Пиридин как третичный амин легко присоединяет галогеналкилы
с образованием галогеналкилатов (соли алкилnиридинuя):
0+
[О]+Х- наrpС8анис.
RX -
N
При
[Cll+x-
NR
нагревании
NH
галогеналкилатов
алкильные
RJ
радикалы
от атомов азота к углероду ядра в а- или у-положение
(2
или
переходят
4),
но не
в j3-положение. Так. иодэтилат пиридина изомеризуется в иодистый
2-этилпиридиний:
rO]:--[Cl j:N
N
I
I
Н
CzHs
Эта
реаlSЦИЯ
служит
CzHs
методом
получения
некоторых
гомологов
пиридина.
3.
При обработке пиридина в уксуснокислом растворе пероксидом во­
дорода образуется N-оксид:
о
N
о
N
+
О
510
N-Оксид пиридина значительно более способен к электрофильному за­
мещению, чем пиридин. Например, нитрат калия в дымящей серной кис­
лоте при 100·С дает 90%-ный выход N-оксида 4-нитропиридина:
о
N
t
-6
N
~
О
о
Промежуточный а-комплекс в СЛУ'lае N -оксида энергетически более
выгоден благодаря возможности сопряжения с участием грани'IНОЙ струк­
туры:
(50'
N
11
о
4. Пиридин С SОз образует соединение C 5 H5 N· SОз, используемое
для сульфирования фурана, пиррола и т. д. Это мягкий СУJIЬфИРУЮЩИЙ ре­
агент, не содержащий свободной кислоты.
IV.
Раскрытие пиридинового кольца. Пиридин существенно отлича­
ется от бензола по легкости раскрытия КОЛЬЩI. Выше уже рассмотрено
раскрытие пиридинового кольца при каталитическом гидрировании и при
действии иодистого водорода. Известны и другие реакции подобного типа.
При нагревании с 2.4,динитрохлорбензолом пиридин образует хлористый 2,4,Динитро;
ФеНIfЛПИРllДИНliИ, который при действии щеЛО'1II разлагается на глутаконовыii альдеГl1Д
112.4·динитроанилин:
о <;Нз(NО2)zCl.
N
[9
]+CI-
С.6 Н з(NО 2 )2
глупконовыА
aJJW\el1lД
Отдельные представители. Применение
Пuрuдuн - бесцветная жидкость с сильным и неприятным запахом,
т. пл. -42 ·С, т. кип. 115,3 ·С, плотность 0,9772. С водой образует смесь
с мяксимаJIЬНОЙ плотностью
1,00347 (при 0,18 молярных долей).
Большое
уменьшение объема и выделение теплоты при смешивании с водой указы­
Вяет ня обрязовяние гидратя пиридина. Пиридин с тремя молями воды об­
РilЗует нераздельно кипящую смесь (т. кип.
92-93
·С).
• Глутаl\ОНОВЫЙ IIльдегид в свободном виде не существует: его выделяют в виде IIIшла (д.ля
СВЯЗЫВIIНIIЯ ГЛУТIIКОНОВОГО альдеГИДII в реаlЩllЮ вводят IIНI1ЛИН).
511
Пиридин широко используется в качестве растворителя и катализаТОра
для проведения органических реакций.
ГОМОЛОГИ пиридина
угольного дегтя. однаl<О
- а·. (3- и Y-nUКIJЛIIНЫ - получают главным
OHII HailДeHbI также в некоторых нефтях.
образом из каменно_
1. Водородный атом в a-ПИКОЛlIне способен замещаться ЛlIТl1ем при деЙСТВI1I1 буТl1ЛЛИ­
ТIIЯ; образовавшийся пиколиллитиii может pe<lГltpOBaTb с формальдегидом или бензальдеги_
дом, образуя соответствующие карбинолы:
~CН'-CH'-OH
2. а " y-МеrnuлnuрurJuны легко конденсируются с бензальдегидом в присутствии хлори­
да цинка при 225 ·С:
(3-Пиколин В этих условиях нереаКЦИОНflоспособен и может быть TaКlIM способом О'lищен
от следов ЭТIIХ изомеров. Он применяется дпя получеНllЯ НИКОТI1Новоii I<ИСЛОТЫ.
3. 2-Меmuл-5-ЭI1I11ЛГlllf1I/(}IIН (получение см. с. 506) деГИДfНlрованием переводят в 2-ме­
Тltл-5-ВИНIIЛПl1РIЩIШ, нашеДШllii широкое применеНl1е в производстве синтетических каучу­
ков и плаСТltчеСКlIХ масс.
Амииопиридины, АМl1НОПlIРflДltны можно получить следующими методаМI1: из амидов
кислот по реаКЦIIИ Гофмана, ИЗ Нltтросоединеиttй восстановлением ((3-аминопиридин), реак­
цией ЧII'/ИбабllН<I (a-аминопирИДин). 3 -ААIUН0I1UРUrJIIН обычно получают ИЗ 3-бромпириди­
на деtiствием аммиака при 140 ·С в присутствии сульфата меДII.
2- и 4-ААl!Iноm/р!/а!/ны являются более сильными ОСlюваниями, чем анилин или пирн­
дин. 3-АМИНОПltридин образует дихлоргидрат, в то время ,(ак другие аМИНОПИРИДI1НЫ образу­
ют только МОНОХЛОРГltДР<lТЫ. 3-АМИНОПltРИДIlН существенно ОТЛИ'lается от 2- 11 4-изомеров 11
ВДРУГltх отношениях. АМИНОПltРIIДllНЫ с аминогруппой в положеНllЯХ 3 и 5 проявляют свойст­
ва аромаТltчеСКIIХ аминов. Они могут быть диазотированы, и диазонltеВ<lЯ группа может за­
мещаться галогеном, НИТРI1ЛI,НОЙ 11 ДРУГltми группами. Такие диазониевые СОЛl1 могут соче­
таться с фенолами 11 аминаМII.
Если aMIIHorpynna Н<lХОДltтся в 2- Itли 4-положениlt, попытка диаЗОТllровать обычно ведет
к обраЗОВ<lНИЮ Пltридонов. В концеНТРИРОВ<lнноil соляной "Jl" плаВllКОВОЙ Кltслотах амино­
группа пр" деiiСТВltI1 Hltтpltтa натрия дает соответствующее хлор- или фТОРПРОlIзводное.
1. 2-Аминопиридин можно превратить вдиазотат натр"я деiiствием <lМИJlНИТРllта и алко­
голята натрия:
(l
N
+
CSHII-0-N==O
NHz
ПОДlшслеНltе концеНТРИРОВ<lННОГО P<lCTBOpa диазотата УКСУСНОЙ кислотой дает ГИДРОКСlt­
ПllрIЩИН. <1 в присутствltи ИОДllда каЛIIЯ - 2-и()()l/иРL/1}ин. Дl1аЗОТИРОВ<lННЫЙ 2-аМIIНОПИРИ­
ДI1Н может вступать в реющltю сочетания с фенолами.
2. 2-АМИНОПItРИДИН легко ХЛОРltруется 11.111 БРОМllруется при комнатной температуре
с обраЗОВЮlllем 5-галоген- It 3,5-дигалоген-2-аМIIНОПIlРIlДIIНОВ:
Cl'(XCl
~
N
512
I
+
NHz
HCl
З. 2-Аминопиридин СУЛЬфllруется при более низкон температуре. чем ПllРИДИН (145 ·С).
При этом образуется с 70-80%-ным выходом 2-аМI1Н0-5-ПИРIIДlIнсульфОКlIслота:
~
~_..l
N
+ Н150 4
НОЗ5~
~_.-l
-
NH1
N
+ Н10
NH1
4. 2-Аминопиридин pearlipyeT с нитрующеli смесью npll низко н температуре с образова­
нием Нlпрамина. который при 40'С перегруппировывается в 5-нитро-2-аМIIIЮПИРИДИН:
~
~~NH1
НNОз
•
cl
~
~
.01
'(r
N
~~NHl
NHN01
Гидрокспиридины (пиридоны). ГИДРОКСlIльная группа в ШIРИДИНОВОМ ядре ведет себя
раЗЛIIЧНО в заВИСllМОСТИ от положения. В положенни 3 она проявляет свойства фенольного
гидроксила. 3-Гидроксипиридин дает реаlЩИII с хлоридом желеЗII. IIMeeT СЛllБОКliслые свой­
ства. 2- и 4-ГIIДРОКСliПРОllзводные ПИРIIДИН3 способны К TayтoMepltн. ФliзичеСКlIМИ методами
установлено. что а-гидроксипиридин существует в Пllридоновоli форме.
При обрабоше Дllазометаном 2- 11 4-ГlЩРОI<СI1ПI>ОllOзводные оБРIIЗУЮТ меТОI(СНПРОИЗВОД­
ные. С другой стороны. если liX нагреть с ИОДIIСТЫМ меТliЛОМ. образуется N -меТlIЛПИРIIДОН:
Cl~Cl
NH
О
N
О
I
СНз
ПиридинкарБОНОВblе
КИСЛОТbI.
Карбоновые
кислоты
пиридинового
ряда получаются при окислении гомологов пиридина, а также некоторых
алкалоидов и производных хинолина.
а- Пиридинкарбоновая кислота называется nиколин'овой кислотой,
~-пиридинкарбоновая кислота - Н,икотиН,овой и у-пиридинкарбоно­
вая - изоН,икотиН,овой. Эти кислоты являются твердыми веществами,
имеющими амфотеРНblЙ характер. Основные свойства проявляются сла­
бо. а-Кислоты очень легко декарбоксилируются, ~ и у-кислоты разлага­
ются с образованием пиридина и СО 2 только при нагревании с известью.
Кислоты ряда пиридина во многих отношениях подобны ароматическим
кислотам. Они образуют хлорангидриды, эфиры, амиды и т. п. Амиды под­
вергаются реакции Гофмана с образованием аминопиридинов, эфиры
конденсируются с этилацетатом, давая ацилацетаты:
~- Пиридинкарбоновую кислоту (никотиновая кислота) получают окис­
лением никотина и анабазина азотной кислотой. Она широко распростра­
нена в природе: содержится в печени, в экстракте дрожжей, в молоке и
17
Зu.
181
зародышах пшеницы. Применяется под названием витамина рр (см. гл.
34.3). Ее диэтиламид под названием кордиамин применяется в меДИЦИне
как важнейший стимулятор сердечной деятельности.
ПипериДин С 5 Н 11 N. Строение пиперидина доказывается его получени­
ем из пиридина в результате присоединения шести атомов водорода и из
1,5-дибромпентана действием аммиака:
Пиперидин получают из пиридина восстановлением натрием и хлори­
дом аммония в жидком аммиаке.
Чистый пиперидин - бесцветная жидкость, т. кип. 105,6 ·С, смешива­
ется с водой. Как и цикnогексан, пиперидин имеет «креслообразную»
конформацию.
Пиперидин обладает свойствами алифатического амина. Он значитель­
но более сильное основание, чем пиридин. Основность его такая же, как
удиэтиламина.
Подобно алифатическим вторичным аминам, в пиперидине иминный
атом водорода замещается различными остатками (алкилы, ацилы, нитро­
зогруппа и т. п.). Пиперидин может быть дегидрироан в пиридин нагрева­
нием с серной кислотой или с помощью никелевых или палладиевых ката­
лизаторов. ДостаТОLIНО устойчив к таким окислителям, как перманганат
калия в кислом растворе, триоксид хрома, азотная кислота.
Важным ПРОI1ЗВОДНЫМ ПlщеРl1дина является обезболивающее лекарственное вещество
npO,l,e(}OA. полученный в СССР И. Н. Назаровым. В промышленности его получают по схе­
ме:
(CH,)aCOH-СЕС-СН=СНа ~ CHz-С-Сас-сн==снz
IUIllerмл8инн.ютИНlUIкарбllНQII
+НаО
I
..
СН,
О
11
С
___
CHa-С-СО-СН-СН-СН, +НzNСНз ..
I
СН,
СНз-НС ...........<;Н2
I
1
НаС ........... СН-СН,
N
tнз
С'И~n~
N
I
СН,
про"одм
514
<1IНsU
СН,
..
Алкалоиды. Производными пиридина и пиперидина являются некото­
рые представители большой группы при родных веществ основного харак­
тера - алкалоидов. Алкалоиды содержатся в растительных организмах
и часто обладают сильным физиологическим и фармакологическим
действием.
БОЛЬШIIНСТВО алкалоидов обладает ОППl'lеской активностью. Многие из них ПОЛУ'IIIЮI на­
звания. ПРОllзводимые от названий растениii. в которых они содержатся.
Алкалоиды являются хорошо кристаллизующимися бесцветными веществами; лишь не­
многие 11З HIIX - жидкости (KOHНlIH, никотин). Жидкие алкалоиды обычно не содержат I<НС­
лорода. Окрашенные алкаЛОIЩЫ редки. Почти все алкалоиды образуют кристаЛЛllчеСКllе
СОЛlI. ЭТII соли часто используют для выделеНllЯ алкалоидов и их ОЧИСТКlI.
Большинство алкаЛОIIДОВ реагирует с галогеналкилаМll, особенно с IIOДИСТЫМ меТIIЛОМ.
образуя кристалличеСI<не ПРОДУIПЫ присоединеНIIЯ.
Так называемые алкалоидные реагенты, используемые для обнаружения 11 часто для
идентификации минимальных количеств при родных оснований или их ПРОI1ЗВОДНЫХ, могут
()ыть разделены на осаждающие и цветные реагенты. Осаждающие реагенты, соединяясь
с алкалоидами, образуют нерастворимые продукты присоединения и тем самым обнаружива­
ют присутствие даже в очень малых I(ОЛИ'lествах алкалоидов
OcaДКlI
'laCTo
в раСТlIтельных экстрактах.
имеют определенный постояиный состав и могут быть 11спользованы для ана­
J11lза. Иногда они кристаллlIЗУЮТСЯ в хараlперной форме, 11 кристаллы могут СЛУЖIIТI> дЛЯ
IщентификаЦИl1 соединений. Наиболее важными, осаждающими peareHTaMl1 являются реак­
швы Мейера (K~HgI4)' ЗОlIненшейна (фОСфОРНОМОЛllбденовая кислота) 11 др.
Цветные реагенты преимущественно состоят 11З дегндратирующих IIЛИ ОI<lIСЛЯЮЩIIХ реа­
гентов или их комбинаций, к которым могут быть добавлены альдегиды.
Алкалоиды присутствуют далеко не во всех растениях. Число алкаЛОIЩОНОСНЫХ видов не­
неЛIIКО. Распределение алкалоидов между ботаническими семействаМl1 неравномерно. Су­
ществует несколько семейств, особенно богатых алкаЛОllДаМll, в то же время в ряде других
не известно ни одного такого представителя. В большинстве случаев в растениях
содержится смесь неСIШЛЫ(ИХ алкалоидов - до 15-20 (мак, хинное дерево).
Из большого числа выделенных из растеннй алкалоидов значительная часть расшифро­
вана. Большинство изученных алкаЛОIЩОВ имеет в своей основе более или менее сложио по­
ceMei1cTB
строенные гетеРОЦllклические системы;
OHII
могут быть клаССllфlщированы по природе
гетеРОЦl1l\ЛОВ:
Алl(алоиды группы ПИРИДl1на (КОНИI1Н, Ii1IКОТlIН, анабазин).
АлкаЛОIЩЫ группы Хllнолина (хинин, цинхонин).
З. Алкалоиды группы изохинолина (nanaBepllH, наркотин, курарин).
1.
2.
4.
АлкаЛОIЩЫ группы фенантренизохинолина (МОРфIIН, кодеин, тебаин).
5.
Алкалоиды группы конденсированных ПllрролидинпипеРИДllНОВЫХ ЦIIКЛОВ, группы тро­
пина(атропин,кокаин~
6.
Алкалоиды группы пурина (кофеин, теобромин).
Ниже более подробно рассмотрены наиболее известные и простые ал­
калоиды, относящиеся к группе пиридина. Алкалоид группы ХИНОЛl1на (хи­
НИН) описан в следующем разделе, а алкалоиды группы фенантреllИЗОХИ­
НОJIина (кофеин, теобромин)
-
Кониин, 2-пропилпиперидин
в гл.
10.5.
C8H I7 N. Содержится
в болиголове (Со­
nium maculatum):
515
~аслообразная >К~KOCTb. BpaLЦaeT плоскость поляризации вправо.
Пахнет мышами, >КI)'ЧИЙ на вкус. Является сильным основанием. Чрезвы­
чайно ядовит; вызвает паралич двигательных нервных окончаний.
Строение кониина было подтверждено синтезом. При конденсации
о.-пиколина с уксусным альдегидом образуется ~-пропенилпиридин (ко­
нирин), превраLЦаемый восстановлением в рацемической кониин:
ICORИRИ
кон"рии
'ПIIКo.n:ии
.
Никотин, 3-[2-(N-метилпирролидил)Jпиридин. Содер>Кится в листьях
и корнях табака .
. Бесцветная >кидкость, смешиваЮLЦаяся с водой. BpaLЦaeT плоскость
поляризации влево. Обладает запахом табака. На воздухе быстро буреет.
При окислении различными окислителями дает никотиновую (~-пири­
динкарбоновую) кислоту:
4'
"~O-COOH
"икотинова. кислота
Небольшие количества никотина возбуждают нервную систему, боль­
шие количества вызывают параЛИ'1 дыхательных центров. Никотин явля­
ется одним из наиболее ядовитых алкалоидов смертельная доза д/lЯ че­
ловека составляет около 40 мг.
Никотин В больших количествах (ТЫСЯLIИ тонн) используется в качестве
инсектицида д/lЯ борьбы с вредителями сельского хозяйства.
Анабазин, 2-(3-пиридил)пиперидин. Ва>Кнейший алкалоид ядовитого
среднеазиатского растения Anabasis aphylla (А. п. Орехов, 1929). Стро­
ение анабазина было доказано окислением в никотиновую кислоту и р.е­
гидрированием в 0., j3-бипиридил:
0-0
-3Н2
•
N
аиalSааии
«, fJ - бипиpидIIJI
Анабазин, подобно никотину, изомером которого он является, очень
ядовит и обладает высоким инсектицидным действием.
516
2.
ХИНОЛИН
Хинолин можно рассматривать как а, Р-бензопиридин или как нафта­
лин, в котором группа СН в а-положении замещена атомом азота:
у
4~зfl
Некоторые гомологи хинолина имеют тривиальные названия: 2-метил­
хинолин оБЫ'IНО называют хuнальдuном, 4-метилхинолин-леnuдuном.
Хинолин впервые выделен из продуктов перегонки каменноугольной
смолы (Дж. Рунге, 1834). Большое число производных хинолина выделе­
но из некоторых нефтеЙ.
Цикл ХИНОJlина является основной частью молекул большой группы ал­
калоидов, главные из которых относятся к группе хинина.
Хинолиновые основания
-
бесцветные жидкости с характерным запа­
хом, летучие с паром. Они менее растворимы в воде, чем пиридиновые
основания.
Способы "мучения хинолина и его производных. Строение хинолина
110дтверждается рядом его синтезов, из которых наиболее важным являет­
ся реакция Скрауnа. Эта реакция заключается в нагревании анилина
с глицерином и концентрированной серной кислотой в присутствии нитро­
беНЗОJlа или ванадиевой кисоты в качестве окислитеJlеЙ.
В результате дегидратации серной кислотой глицерин превращается
в акролеин, который конденсируется с анилином с образованием р-анили­
нопропионового альдегида
лин
(II),
(1), последний теряет воду и дает дигидрохино­
окисляющийся в хинолин нитробензолом:
СНО
QI
~
+CHz=CНCHO .. ~
........
THz ~
~/CHz
NHz
NH
I
он
I
-
СН
~ ~CH
~/bHZ
NH
11
Здесь приведен один из многих предложенных для реакции Скраупа
механизмов.
Конденсацией акролеина с гомологами анилина или его замещенными
J.f производными, такими, как галогено-, нитрозамещенные, а также ами­
нокарбоновые кислоты, аминосульфокислоты и аминофенолы, получают
С<lмые разнообразные производные хинолина, содеРЖ<lщие З<lмеСТИТСJlИ
в бензольном ядре.
517
Физические и химические свойства. Хинолин - бесцветная жидкость
с т. кип. 338 ос, плохо растворимая в воде. Имеет неприятный запах.
Хинолин и его проиозводные вступают в хорошо известные для бензола
и пиридина реакции, модифицированные только присутствием второго
КОЛhца в качестве заместителя.
Электроноакцепторное влияние азота кольца проявляется в распределении электронной плотности:
0,958
0,772
O'989(X)~ 0,978
0,947
~
I ~
1,003
1.
0,789
1,633
Х и н о л и н обнаруживает многие химические свойства, присущие
третичным аминам. Подобно пиридину, хинолин образует соли, такие, как
гидрохлорид(l), сульфат (Щ, нитрат (Ш), пикрат и т. П., четвертичные ам­
мониевые соли (IV) и N-оксид (У) (при окислении гидропероксидом бен­
зоила):
[OO]~-
[00]:'0< [00]:0.
111
11
[СУ]:-
I~
CO
~
.&
N
t
о
СНз
IУ
V
Электрофильные реагенты, легче реагирующие с бензолом,
чем с пиридином, естественно, атакуют бензольную половину молекулы
хинолина. Активными положениями в реакциях замещения являются по­
ложения 5 и 8.
1. Нитрат хинолина, добавленный к крепкой серной кислоте и остав­
ленный стоять 1 ч без нагревания, превращается в смесь 5- и 8-нитро- хи­
II.
ноли нов:
518
2. При сульфировании концентрированной серной кислотой при
220-230 ос замещение идет в положение 8; при 300 ос - в положе­
ние 6. 8-Хинолинсульфокислота при 300 ос изомеризуется в 6-сульфо­
кислоту:
3. Незамещенный хинолин не ацилируется; при нали'IИИ в положении
электронодонорного заместителя ацилирование происходит в положе­
нии 5.
4. Окисление хинолина в щелочной среде перманганатом дает хиноли­
новую (2,3-пиридиндикарбоновую) кислоту. Даже если бензольное коль­
цо стабилизировано нитрогруппой, пиридиновое кольцо сохраняется:
8
I ~ (о) ..- HOOC=O~
НООС
~
'~J0 0 ' ......:..~
,~
ш.
+2СО 2
При действии нуклеофильных реагентов замещение идет
в пиридиновое кольцо.
1.
С амидом натрия реакция идет так же, как спиридином, т. е. проис­
ходит замещение в а-положение:
2.
С едким кали при
250-260
ос образуется а-оксихинолин, так на­
зываемый карбосmuрuл:
со -
кон
N
3.
ЛИТИЙIIЛКИЛЫ IIЛI<ИЛИРУЮТ хинолин также в а-положение:
519
4. Как 11 в случае пнридина. д.nя метильной группы хинолинового ядра. находящейся в
а- ИЛII 'Y-положеНliЯХ. характерна способность вступать в реакции конденсацlШ. С формали­
ном хинальдин образует СПliрТ (1). с бензальдегидом - беНЗliЛlщенхинаЛЬДllН (ll):
~.
~
I
11
~~ClfzCH10H
~N~СН=СН-С.нs
Ряд замещенных хинолина используется в синтезе лекарственных пре­
паратов и красителей.
8-0к.сихинолин, ок.син, получают по реакции Скраупа. Он широко
применяется в качестве реагента в анаJlитической химии. Пространствен­
ная близость гидроксильной группы И неподеленной пары электронов ато­
ма азота обусловливает возникновение внутримолекулярной водородной
связи между этими группями, 'ITO проявляется в низкой температуре
плявления
(75-76
·С) и летучести с паром (ср. гл.
20.3):
1~
97
~
~
ь
О-Н
С рядом металлов 8-0КСИХИНОЛИН образует нерастворимые координа-
'N
ционные КОМПЛQ?ексы«хелаnzы»: 8 - .
2'
~
I
~
ь
MgClz
-
2NaOH •
N
\.
аЗ'
"/
в
о
-
/Mg,
N\
В
ОН
Это свойство 8-0ксихинолина используется в янализе.
Хинолиновый цикл содержит важное природное соединение
-
алка­
лоид хинин.
Хинин С20Н2402Н2' Открыт в
1820
г. в коре хинного дерева. Бесцвет­
lIoe вещество, мало растворимое в воде, левовращающее, т. пл. 177"с.
Его соли чрезвычайно горьки на вкус. Растворы обладают сильной синей
флуоресценцией. Строение подтверждено многочисленными превраще­
ниями и полным синтезом
( 1944).
Молекула хининя содержит две различ­
ные гетроциклические системы: хинолиновое ядро и хинуклидиновое ядро.
Она обладает четырьмя асиммеТРИ'lескими атомями углерода:
•
си
/1"""·
И 2С
СИ СН-СИ=СН2
I
•
.,
I 2
НОСН--НС"""1~СИ2
СНз-О~
U)
N
520
N
Хинин оказывает сильно токсическое действие на протоплазму низших
организмов, особенно вызывающих малярию.
ИЗ0ХИНОЛИН
3.
Изохинолин, подобно хинолину, содержит конденсированные пириди­
новые и бензольные кольца. В этом случае, однако, они соединены не
в а-,
13-, а в 13-, у-положениях пиридинового кольца:
ИЗОХИНОЛlIН можно РIIССМIIТРИВIIТЬ как нафталин. в котором СН-группа в j3-положении
замещена атомом аЗОТII. Такое cTpoeHlle подтверждается как реакциями распада. так и
синтезом.
Изохинолин Ilзвлекают из сырой хинолиновой фракЦlIИ каменноугольной смолы (содер·
жание около 1%). IIСПОЛЬЗУЯ большую его основность ИЛII переводя его в КlIСЛЫЙ сульфат.
нерастворимый в ,тиловом спирте. Кислые сульфаты хинолина и хинаЛЬДllна хорошо раство·
римы в спирте. Изохинолин был таl<же выделен из основных фракций погонов нефти с т. кип.
236-280"с. Он бесцветен. т. 11Л. 23 "С. т. ЮШ. 240"с. По заПIlХУ 11 ДРУГIIМ СВОЙСТВIIМ очень
похож на ХIIIЮЛIIН. Многие алкалоиды являются производнымиизохинолина (см. гл. 30.1).
ОДНlIМ из наиболее важных методов синтеза ИЗОХИllOЛlIна является дегидратация ациль,
ных производных j3-феНИЛ'Jтиламина Р20:; В юшящем ксилоле (реакцuя Бllшлера - На­
lluраЛhСК()Z()). Полученное ДИГllДРОПРОllзводное подвергается дегидрированию. чаще всего
над палладием:
CHz
~
-~-!~ VyN
r?Y'r
V
нн
-HZO
HZ
..
./
-2Н
[pd)
~I
~
~H
R
COR
R
При окислении изохинолина перманганатом РIIЗРУШIlIOТСЯ как бензольное.
новое ядра 11 образуется смесь фталевой 11 цинхомероновой кислот:
~
НООС:О
I~
~,.&:H
НООС ~ N
CO
I
цинхомеРОНОВ.8
TIIK и ПИРИДII'
О:СООН
~I
А
СООН
фталев••
И30ХНИQIIИН
кислота
".СЛ0f8
4.
АКРИДИН
Акридин является дибензопиридином и относится к хинолину так же,
как антрацен к нафталину. Его можно рассматривать как антрацен, в ко­
тором одна центральная группа
=СН- замещена азотом.
Нумерация атомов производится следующим образом:
1
11
521
В ряде стран, в том чнсле и в России, принята нумерация
США) -
1,
в других странах (Англия,
нумерация П.
Акридин открыт в 1870 г. в нео'шщенноil антраценовой фракции каменноугольного дегтя.
Он плавится при 107 'С, кипит при 345-346 'С, легко возгоняется. Обладает характерным
запахом, вызывает раздражение дыхательных путей, раздражает кожу, откуда и произошло
его названltе (асе, - едкий).
Акридии светится при треиии (mри(jОДЮАtUнесценция). Разбавленные растворы имеют
СIfНЮЮ флуоресценцию. СОЛli акридина в разбавленных растворах обладают зеленой флуо­
ресценцией. Прн дальнейшем разбавлении, вызывающим гидролиз, флуоресценция перехо­
ДIIТ в синюю, характерную ДIIЯ свободного акридина.
Акридиновое ядро составляет основу некоторых алкалоидов. Многие синтеТИ'lеСКliе про­
Ilзводные акридина являются ценными лекарственными препаратами
1I
красителями.
Способы получении, Несмотря на то что акридин содержится в каменноугольной смоле.
его производные If сам акриднн получают синтеТli'lески из производных бензола.
1. Наlfболее общим способом получении аКРИДlfна является циклизация о-анилинобен­
зоilНОli кислоты. Замыкание цикла может быть достигнуто с помощью серной кислоты, и в
этом случае образуется g-гидроксиакридин (а"ридон). Он может быть восстановлен амаль­
гамой натрия в дигидроакридин (а"ридан), который затем окисляют хлоридом железа в ак­
ридин:
9-I1IДJIОКСИ8КРМРВ
Однако 'Iаще всего циклизацию ПРОliЗВОДЯТ с помощью РОСl з получая g-хлораКРIfДИН:
Сl
оса
N
Хлор, находящийся в мезо-положении, ОТЛИ'lается большой реакционной способностью
I1 легко может быть замещен IIЛКОКСИ-, аминогруппой ИЛII водородом. Используя замещен­
ные о-анилинобензойные кислоты, можно получить различные производные акрl1ДIlна.
2. Конденсация AI-фенилеНДllамина с муравьиной кислотой или формальдегидом позво­
ляет получать 3- и 6-диаминоакридины:
~+
H2N~NH2
522
Химические свойства. АКРИДliН является слабым основанием. образует СОЛfI. таЮlе. как
хлорид. иитрат, пикрат и т. п .. окрашенные 'IетвеРПl'lные
РИДliНИЯ)
aMMoHliCBbIe
li N -оксид (при обрабОТl\е Гllдропероксидом беизоила).
соли (соеДliнения
al\-
Акридии кипит при высокой температуре без разложения и не изменяется при сплавле­
нии с еДКlIМ кали. Окисление перманганатом чаСТИ'IНО разрушает молеl<УЛУ с образованием
lIК{Jш)uнщmй кuслоты (2.3-ХliНОЛfiндикарбоновая кислота) (1). однакодихромат в уксусной
КlIслоте не разрушает ЦIШЛИ'lеСI<УЮ етруктуру акридина, /Ю превращает его в aKpllДoH
(11) 11
10.1 О' -диаКРИДОНIIЛ (III):
~COOH
~ЛСООН
11
111
Между аКРIЩИНОМ и антраценом имеется сходство. Оно выражается в способности аl<РИ­
дина к восстановлению водородом в момент выделения (при деЙСТВIIII наТРJiЯ в водных и
CnllpTOBbIX растворах или
при J<атаЛftтическом ГИдlJIJроваНJIJI в 9,1 O-ДIIГllдроаКРllДИfl. ПРJlСО­
единение натрия с образованием 9.1 O-ДIIнатриевого производного. которое со сп JЧJТОМ дает
аJ<РJщан. напоминает реаКЦliЮ натрня с антраценом.
Hel<OTOpbIe реакции акр"Дlна напоминают реаКЦIIII ПИР"ДIIIJа ") его ПРОIJЗВОДНЫХ. ЛJJТJJЙ­
аЛКJiЛЫ ПРliсоединяются к акридину в положения 9. 10. т. е. по J<оицам сопряженной CIICTeМЫ. ПослеДУЮЩJН"1 ГlIДРОЛJJ3 дает ПРОllзводное 9.10-дигидроаКРllДllна.
Ме:ю-метилаКРJЩИН. подоБJЮ 4-ПJiКОЛИНУ. конденсируется с альдегидами.
Производные акридина. Из производных <lкридина важное примене­
ние имел T<lK называемый акрихин. - 6-хлор-2-метокси-9-( l-меТИJl4-1~И7ТИЛ<lМИНО )бутиламнноакрндин дихлоргидрат - же.IIТое кристаJIJlИ­
ческое вещество с т. пл. 248-250 ос.
Акрихин широко liспользовался для предупреждения и лечения маля­
рии. Он в известной степени является З<lменителем хинина.
Риван.ол
-
соль МОJIOЧНОЙ кислоты <lКРИДИНОВОГО производного следу­
ющего строения:
Эффективный антисептик. Применяется также для Jlечения <lмебной
дизентерии.
ГЛАВА
31
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ
СОЕДИНЕНИЯ С ДВУМЯ ГЕТЕРОАТОМАМИ
Наибольший интерес из этой группы гетероциклических соединений
представляют аромати"еские системы, содержащие два атома азота, объе­
диняемые под общим названием диазины: пиридазин, nири.мидин и nи­
разин:
ПИРИА8ЭИН
пиразин
ПИРНИИА"И
Пиридазины в природе не найдены. Некоторые соединения с таким
циклом имеют практи"еское значение. Так, например, циклический гид­
разид малеиновой кислоты применяется как избирательный ингибитор
роста растений (борьба с сорняками).
Некоторые производные пиразина встре"аются в природе, например
антибиотик асnергилловая кислота. Пиразиновый цикл лежит в основе
ряда синтети"еских лекарственных веществ.
Производные пиримидина играют исключительно важную роль во мно­
гих биологи"еских процессах. Они являются, например, фрагментами
нуклеиновых кислот (гл. 34), некоторых витаминов и коэнзи.мов. Пири­
мидиновое кольцо является составной частью кольца распространенных в
природе пуринов, например мо"евой кислоты (с.
276).
ские
ка"естве
производные
пиримндина
применяются
в
Многие синтетиче­
лекарственных
веществ (сульфодиазин и др.). Поэтому из всех диазинов здесь рассматри­
вается только пиримидин.
1. ПИРИМИДИН
Один из наиболее важных методов полу"ения пиримидина основан на
таутомерном поведении барбитуровой кислоты, I<оторая может существо­
вать в кето- и енольной форме и в последней реагирует с хлороксидом
фосфора, образуя трихлорпиримидин, который при восстановлении дает
пиримидин:
oyN~o _
HNy
О
-
HO"N~OH
N~
ОН
барбНтуро..... киcnота
CIYI?,N~
Сl ~()
11
N
+POCI].
N
~
С\
2,4,6- ТРИIUIор­
пиримидии
524
N
~
ПИРИМИДИН
Пиримидин - безцветное кристаллическое соединение. Т. пл. 21 "с.
Т. кип. 124 "с. Легко растворим в воде.
Пиримидин по свойствам сходен с пиридином, во еще более отличается
от бензола. Он более сильное основание, чем пиридин (pKh = 1,3).
Пиримидин имеет пониженную плотность электронов в положениях 2,
4,6; положение 5 наименее обеднено электронами. Нуклеофильные реа­
генты атакуют ПОJlожения 2, 4, 6, электрофильные - положение 5, обра­
зуя энергетически более выгодные а-комплексы (сопряженные карбани­
он и карбкатион).
В соответствии с этим при действии амида натрия на 6-метилпирими­
дин образуются 2-мино- и 2,4-диамино-6-метилпиримидин:
7::J.N...... N::J- '''',N.. "3.
~ СНз
NHZ~ СНз
NHZ~ СНз
NHz
Электрофильные реагенты реагируют с пиримидинами только в том
случае, когда они содержат электронодонорные группы
(-NH 2 , -ОН,
в других положениях.
Нитрование требует присутствия двух электронодонорных групп. Ни­
-SH)
трованием в серной кислоте при 50 "С были получены с хорошими выхо­
дами 2-амино~4-гидрокси-5-нитро-, 4-амино-6-гиДрокси-5-нитропири­
мидины; условия реакции могут быть более мягкими д.ля 2,4- и 4,6-дигид­
роксипиримидинов:
ОН
_~
NHz~
ОН
+НNОз
N~NOz
NHzAнJ
•
+НNОз
•
Для галогенирования достаточно одной электронодонорной группы.
Так, 2-аминопиримидин хлорируется и бромируется, а 4-аминопиримидин
иодируется в положение 5:
N~~ N~Br
~)
А)
NHz
N
NHz
N
-
ICI
525
Пиримидины, имеющие по крайней мере две электронодонорные груп­
пы, СО'lеТ<lЮТСЯ с диаЗОТИРОВ<lННЫМИ аромаТИ<lескими <lминами в щелоч­
ных растворах в положение
5.
Для реакции нитрозирования также требуется не менее двух электрр1I0ДОНОРНЫХ групп.
Производные пиримидина. При действии аммиаК<I на трихлорпирими­
дин с последующим восстановлением образуется 2-aм.иHonиpu.мидиH.
2-Аминопиримидин служит для получения важного леК<lрственного пре­
П<lраТ<I сульфаниламидопиримидина (сульфадuазuн):
При гидролизе НУJ<леиновых кислот образуются производные пирими­
дина
-
урацuл, muм.uн и цumозuн:
)
oy~.15
o~
HN
I
6
ТИМ""
урацил
снз
_~
NH,
О
О
oyNH
цитозин
Простеl1шш", способ сннтеТllческого получения урацuла - l<онденсаЦIIЯ мочеВflНЫ с яб·
лочноii КlIслотоii. ЯБЛОЧНilЯ кислота с концентрllрованноi'l серной ЮIСЛОТОЙ дает ФОРМIIЛУК­
сусную КlIСЛОТУ. I<оторая в момент образования кондеНСllруется с мочевиной:
.
ноос-сн,-сн(он)-соон
'сНа
1+1
ос
сно
•
:)0
но-со
HzN
{H2S04J
---
HN·
-
'NHz
I
ОЛА
N
+
ноос-сн 2 -сно
нсоон
"~
о
NH
ТIIJШН очеllЬ леtlЮ образуется при восстановлеНИII меТIIЛЦlI<lноаLlеТlIлмочеВlIlIЫ водоро­
дом в ПРIIСУТСТВIIII плаТlIIIЫ:
-NНз ..
526
Uumo:lult может быть получен конденсацней натрневой соли ФОРМИЛУI(СУСНОГО эфира
с S-ЭТИЛ-ИЗОТИОМО'lевиной:
COOR
I
ИzN
I
СИ
+NНz
C-SСzИs
" 'СИ
+
,I
11·
•
NИ
ОНа
HN\:NH
~
~
У
О
НН
Конденсированной системой ПИРИМИДlIна ЯВJ1ЯЮТСЯ пуриновые основания (гл. 11.5,4).
В Кilчестве ПРОТИВОМltкробного средства в медицине применяется препарат бuсеnтол, в
состав которого ВХОДl1Т 2,4-диамино-5-(3,4,5-триметоксибензил)пнримидин и 3-(n-амино­
бензолсульфамидо)- 5- меТИЛИЗОI(сазол .
2.
ТИА3ИН
в последнее время в медицинской практике широкое применение в качестве успокаllваю­
- иеЙРОЛИТl1КОВ - получили производные феНОТl1азина, из которых важней­
Шltм ЯВJ1яется (L\lUItU:IUIt солянокнслая соль 2-хлор-lО-(3-димеТllлаМIIНОПРОПI1л)-фено­
Щl1Х средств
ТИ1!ЗlIна:
s
()
NИ
тиаэин
феиотиазни
аминазнн
Производным той же гетеРОЦИКJ1I1ческой системы является краситель АlетuлеltО/lыи си­
ю/и - N,N.N,N-тетраметил-2,7-диаминофенаЗОНltЙХЛОРltД, широко при меняемый в меди­
цине
K1!I(
антисеПТИ'lеское средство
527
Ч
А
С
Т
Ь
Ч
Е
Т
В
Е
Р
Т
А
Я
Элементы
биоорганической химии
Биоорганическая химия -
раздел органической химии, сложившийся
во второй ПОJlовине ХХ в. Она изучает органические вещества, участвую­
щие
в
процессах жизнедеятельности,
метаболизма
-
биополимеры
(белки, полисахариды, нуклеиновые кислоты и т. п.), биорегуляторы
(ферменты, гормоны, витамины и др.), а также синтетические биологиче­
ски активные соединения (лекарственные препараты, ростовые вещества,
гербициды и т. п.). В задачи биоорганической химии входит изучение стро­
ения и синтез природных и синтетических БИОJlогически активных соеди­
нений, выяснение зависимости между их строением и биологическим дей­
ствием, изучение их химических превращений внутри и вне организмов.
Решение всех этих задач CTaJlO возможным только ПОСJlе ПОЯВJlения со­
временных фИЗИ'lеских методов разделения, очистки и исследования орга­
НИ'lеских соединений.
Успехи биоорганической химии в значительной степени определяют
дальнейшее развитие биологии и физиологии, так как без знания строения
и химических превращений веществ, участвующих в метаБОJlизме, неJlЬЗЯ
понять его сущности, нельзя разрабатывать методы управления БИОJlОГИ­
ческими явлениями, такими, как размножение, передача наследственных
признаков, передача нервного импульса и т. д.
Биоорганическая химия тесно связана с биохимией, изучающей состав
организмов, структуру, свойства и локализацию обнаруженных в них со­
единений, пути и закономерности их образования, последовательность
и механизмы пр·евращениЙ, а также их биологическую и физиологическую
роли.
С другой стороны, биоорганическая химия связана с биофизикой наукой о фИЗИ'lеских и физико-химических ЯВJlениях в живых организмах,
а также о закономерностях и физико-химических механизмах воздействиЯ
физических факторов на организмы.
Значение биоорганической химии не ограничивается ее ролью в позна­
нии явления жизни. Знания в области химии высокоэффективных и высо-
528
коселективных биологических процессов могут быть использованы д.ля
создания новых биохимических производств, д.ля разработки принци­
пиально новых основ химической технологии путем моделирования кле­
точных процессов.
В процессах метаболизма участвует много органических веществ, при­
над.лежащих к различным рядам и классам и содержащих по крайней мере
20
различных химических элементов. Без многих из них, как и без многих
неорганических
веществ,
невозможно
существование
высокоразвитых
организмов. Органические вещества, участвующие в процессах метабо­
лизма, называются м,етаболитам,и. В биохимии рассматриваются нача­
льные, промежуточные и конечные метаболиты.
Структурные аналоги метаболитов, по большей части представляющие
собой синтетические вещества, конкурирующие с метаболитами в биоло­
гических процессах и нарушающие таким образом нормальный метабо­
лизм, называются антим,етаБО.(tитам,и. Антиметаболиты могут вызы­
вать
симптомы
а у бактерий
-
недостаточности
сопряженного
с
ними
метаболита,
торможение роста. Обычно такой биологический эффект
может быть устранен простым повышением концентрации в организме
недостающего метаболита. Антиметаболиты могут оказывать химиотера­
певтическое действие при инфекционных заболеваниях, подавляя функ­
цию роста бактерий.
Важнейшие классы биоорганических соединений, без которых невоз­
можен метаболизм на самом низком уровне,- это белки, углеводы, нук­
леиновые кислоты и липиды.
ГЛАВА
32
БЕЛКИ. ФЕРМЕНТЫ. ВИТАМИНЫ
1.
Белки, или протеины, -
БЕЛКИ
сложные высокомолекулярные органические
соединения (сложные полипептиды), построенные из остатков аминокис­
лот, соединенных между собой амидными связями. В состав одного и того
же белка входят различные аминокислоты. При полном гидролизе белок
превращается в смесь аминокислот.
,
В организмах животных и растений белки выполняют самые различные
функции. Они составляют основу опорных, мышеLIНОЙ и покровных тка­
ней (кости, хрящи, сухожилия, мышцы, кожа), играют решающую роль
в процессах обмена веществ и размножения клеток. Белковыми телами
являются многие гормоны, энзимы, пигменты, антибиотики, токсины.
529
Большинство белков в твердом состоянии сохраняет при родную· форму'
(шерсть, шелк) или существует в виде порошка. Только некоторые белки
удается выделить в кристаллическом состоянии.
Белки очень сильно различаются по молекулярной массе. Так, напри­
мер, инсулин имеет молекулярную массу около 6000, фермент рибонукла­
за 12000-14000, гемоглобин - 64 500, глобулин лошади-
150000, вирус
6600000.
табачной мозаики
- 4000000,
гемоцианин улитки
-
Многие белки растворимы в воде, в разбавленных растворах солей,
в кислотах. Почти все белки растворяются в щелочах, и все они нераство­
римы в органических растворителях. Растворы белков имеют коллоидный
характер и могут быть очищены диализом. Из растворов белки легко
осаждаются органическими водорастворимыми растворителями (спиртом,
ацетоном), растворами солей, особенно тяжелых металлов
Fe
(Cu,
РЬ,
Hg,
и др.), кислотами и т. д. Осаждением растворами солей различной кон­
центрации белки могут быть О'lИщены и разделены. При осаждении неко­
торые белки меняют конформацию цепей и переходят внерастворимое
состояние. Этот процесс называется денатурацией. Денатурация многих
белков может быть вызвана и нагреванием.
Вследствие исключительной нестойкости белки не имеют определен­
ной температуры плавления и не перегоняются. Это затрудняет их выде­
ление и идентификацию.
Как и аминокислоты, белки обладают а м Ф о т е р н ы м
ха р а к т е
-
р о м. Положение изоэлектрической точки для белков зависит от приро­
ды входящих в их состав аминокислот: желатина
яйца
4,8;
гемоглобин
6,8;
глиадин пшеницы
9,8;
4,2;
казеин
клупеин
4,6; альбумин
12,5.
Различия в кислотно-основных свойствах белков позволяют их разде­
лять методом электрофореза.
Все белки оптически деятель~ Боль~и_н.ств?_~а них ~~~~aeT левыМ
вращением.
Существует ряд цветных реакций на белки.
1.
Ксантопротеиновая. С азотной кислотой белки дают желтое окра­
шивание, переходящее при действии аммиака в оранжевое. При. этой ре­
акции
происходит нитрование ароматического кольца содержащихся в
белках ароматических аминокислот.
2.
Биуретовая. С солями меди и щелочами белки дают фиолетовую
окраску. Подебную окраску дают все вещества, содержащие пептидные
связи
-NH-CO-
(например, биурет) (см. с.
275).
Реакция Миллона. С раствором нитрата ртути в азотистой кислоте
белки дают красное окрашивание. Эта реакция связана с наличием фе­
3.
нольной группировки.
4.
СУJlьФгидрильная. При нагревании белков с раствором плюмбита
натрия выпадает черный осадок сульфида свинца. Эта реакция указывает
на присутствие сульфгидрильных групп
530
(SH).
Классификация белков
Белки разделяются на протеины (простые белки), в соспш которых
входят только остатки аминокислот и протеиды (сложные белки). По­
следние дают при гидролизе аминокислоты и какие-либо другие вещеСТВ<t,
н<tпример фосфорную кислоту, глюкозу, гетероциклические соединения
и т. д.
Про т е и н ы разделяются на группы по раЗЛII'lНЫМ признакам: по pacTBop"MOCТlI. по
продуктам гидролиза, по функцням в оргянизме и т. д.
По растворимости в водных средах протеины ряздеJlЯЮТСЯ ня следующие важнеl"lшие
группы:
1.
АЛhбу,шlltы. Растворимы в воде
11 разбавленных растворах солей. Осаждаются кон·
KpOBII.
центрированными раСТВОРЯМl1 солей. Входят в состав мыше"ных волокон, яиц,
молока.
2.
Гл()БУЛIIНЫ, Мало растворимы в воде, Растворяются в рязбавленных растворях солеl"1
11 осяждаются l<Онцентрированными. Входят
BII, растительных семян (I<ОНОПЛЯ, горох).
в состав мыше"ных волокон, яиц, молока, кро­
а. ПролаА!IlНЫ. Нерастворимы в воде. Рястворяются в 50-90%-ном ЭТЮ1Оле. Входят
n состяв РЯСТlпельных белков (глиядин пшеницы, гордеИII я"меня, зеин I(УКУРУЗЫ).
4. ГлютеЛIIНЫ. НеРЯСТВОРllМЫ в воде, разбявленных рястворах солеii 11 водном
,таноле.
Растворяются в разбявленных рястворах кислот и щело"еii.
5.
Склер()пр()теIlНI>l. Нерастворимы в воде, рязбявленных рястворах солеii, I{ИСЛОТ, ще­
ло"ей 11 ,танола. К этой I'руппе относятся белки опорных и покровных ТКЯllей: коллаген кос­
Teii 11 I(ОЖII, I(ератины шерсти, волос, рога, фиброин шеЛI{Я.
По продуктам Гllдролиза сложные беЛЮI
-
про т е и д ы разделяются на следующие
группы (в заВИСIIМОСТИ от состава небелковой '1aCТlI):
1.
Hlle. в
Нукле()nр()теш)ы. Гидролизуются на простой белок
11 нуклеllновые
ЮIСЛОТЫ. Послед­
свою О'lередь, Гl1дролизуются с образовянием углевода, фосфорной ЮIСЛОТЫ, гетеро­
ШIКЛII"еСI(ОГО основяния. Растворимы в щело"ах и неряствор"мы в КlIСЛОТЯХ. Входят В СОСТilВ
"IJOТОПЛilЗМЫ. клето"ных ядер,
2.
BIIPYCOB.
Ф()сф()пр()mеllr)ы. Гидролизуются на простой белок
11
фосфорную 1<I1СМТУ. Слабые
IШСЛОТЫ. Свертываются не Прll нагревании, а от деЙСТВIIЯ кислот. К ним отноCIIТСЯ казеин
молока.
З. Глюкrmрml1еш)ы. Гидролизуются ня простой белок 11 углевод. НеРЯСТВОРIIМЫ в воде.
Рястворяются в разБЯl3ленных щеЛО'lах. Нейтральны. Не свертывюотся Прll flilrpeBaHl1II.
Входят в состав слизей.
4.
Хршшпр()тешJI>l. Ряспадаются при ГllДролизе ня простой белок и красящее вещест­
во. Примером является гемоглобин крови.
Имеются
11 дрУГllе группы сложных беЛl<ОВ.
В последнее время белки к л а с с и Ф 11 Ц 11 ру Ю т с я преимущественно по IIХ ФУНIЩIIЯМ
В оргаНIIЗМIIХ.
1. Pe:lep(JHble
беЛКII. Альбумин ЯЙЦII, казеllН молока, ГЛllаДllН пшеНIЩЫ, зеин I(УI(УРУЗЫ,
феРРIПИН селезенки и т. п.
2. Структурные беЛКII. МIIOЗИН мышц,
KepaTIIHbI волос, porlI, коллаген KocTeii 11 сухо­
ЖIIЛlIЙ, фиброин шеЛl(а, эластин связок, фибриноген-фибрин крови и т. п.
а.
БеЛКlI, Уl1рааЛЯЮЩllе ,l/етаб()ЛII:IАtfНt (сложные беЛКII, беЛКII, соединенные с ДРУГlI­
М" молеl<улаМIIIIЛИ IIOHIIMII):
11) ферменты (хеМОТjJИПСIIН, Рllбонуклеllза, ЛIIЗОЦИМ):
б) гормоны 11 регулярные беЛКII (инсулин, глюкагон, гастрин, ГlICTOHbI
11
бет", клето,,­
-
nepelloC"HKII
III,IX ядер):
В)
иммунопротеllНЫ (например, глобуЛlШЫ):
г)
транспортные беЛЮI (МllоглоБIlН, немоглобин, ЦlIТOXPOMIlfI, беЛЮI
ч~рез мембраны):
.'1.) фото- 11 хеморецепторы (HanplIMep, опеJ1lI).
Строение белков
Гидролиз белков проводят нагреванием с разбавленными кислотами
или щелочами при обычном или повышенном давлении. В результате по­
лучаются смеси а-аминокислот. Некоторые аминокислоты при этом пре­
терпевают изменения.
Мощными гидролитическими агентами для белков являются протеоли­
тические ферменты (протеазы): пепсин (фермент желудка), трипсин
(фермент поджелудочковой железы), пеnтидазы (ферменты кишечника).
Действие ферментов специфично: каждый расщепляет пептидную связь,
образованную только одной определенной аминокислотой.
В настоящее время предложен ряд методов, которые позволяют рас­
шифровать аминокислотный состав белка при наличии очень небольших
его количеств. Среди этих методов наибольшее значение имеют хромато­
графия, изотопное разбавление.
В состав белков входит около
25
различных аминокислот (табл.
18).
При гидролизе каждого данного белка могут образоваться все эти амино­
кислоты или только некоторые из них в разных пропорциях для каждого
белка. Из
20
различных аминокислот можно построить
2,3' 1018
изоме­
ров белковой молекулы, что подчеркивает сложность определения струк­
туры и осуществления синтеза белков.
Растворимые белки м о н о Д и с пер с н Ы, так как имеют строго опре­
деленный аминокислотный
состав
и чередование
отдельных остатков
аминокислот.
Остатки аминокислот связаны в белковой молекуле линейно пепmид­
ными связями
•.
Карбоксильная группа одной молекулы аминокислоты
образует амид, взаимодействуя с аминогруппой соседней молекулы ами­
нокислоты. Отдельные пептидные звенья
- NH -CO-CHR-
отлича­
ются друг от друга только боковыми группами:
Соединения-, содержащие несколько аминокислотных остатков, назы­
ВНЮТ пепmидами. Соединения с большим количеством пептидных звень­
ев Н<lЗывнют полuпепmидами.
•
Предположение о таком
Ф. Гофмеiiстер.
532
строении белков высказывали еще в
1907
г. Э. Фишер 11
Т а б л и ц а 18. L,Дминокислоты, найденные в белках
Формула аМИIIОКИСЛОТЫ
Название
Сокращение
H 2N-CH 2 -COOH
ГЛИЦliН
Gly
сн\-сн-соон
длаНI1Н
Ala
BaJ1lНl
Val
. I
NH 2
(СН")2СН-СН-СООН
..,
I
I
NH 2
(CH:\)2CH-CHZ-TH-COOH
Лейцнн
Leu
I
NH 2
сн·,-сн.,-сн-сн-соон
.,
I
<
I
СН:\
Изолейцин I
I1e
NH 2
~ CHz-СН-СООН
OI
ФеНИJlаланин
H.,N-CO-CH 2 -CH-COOH
Аспарагнн
ASll
Глутамин
Gln
ТРliПтофан I
Тгр
VнCOOH
Пролин
Рго
НО-СН 2 -СН -СООН
Серин
Ser
ТреОНIIН I
Thr
Тирозин
Туг
ОКСИПРОЛlIН
Орг
I
Phe
NH2
.
I
NH2
H 2NCOCH 2CH 2CH -соон
I
NH2
~CH2-TH-COOH
~.)
NH
NH2
I
NH 2
снз-сн-сн-соон
. I
он
I
NH 2
но-О-' СН2-СН-СООН
-
Но
I
NH2
n
NH
соон
533
Продолжение mи6л.
НН:ШC:llllt~
ФОJlМУJIИ ИМIiIЮКIIСJЮТI,1
NH:l
18
СОКРИЩСIIИС
!J,истеин
Cys
Uистин
Cys·Cys
1
HS-CH2 -CH-COOH
NH:l
1
S-CH:I-CH-COOH
1
S-СН:l-СН-СООН
1
NH2
CH:1-S-СН:l-УН-СООН
Метионин I
Ме!
Аспарагиновая
Asp
NH:l
НООС-СН 2 -СН -СООН
1
NH:/
кислота
HOOC-СН:/-СН:l-СН-СООН
Глутамнновая
GILI
Iшслота
1
NH:l
H 2N -СН:/СН:/СН2СН:lСН -СООН
1
NH2
ЛltЗltн
H:lN-С-NН-СН:lСН:lСН2-СН-СООН
АРГltнин
Aгg
ГltСТllДИН
His
11
NH
N
I
Lys
1
NH 2
p
l л.снz-снI -соон
NH
NHz
I Незаменнмая аминокислота.
Белки построены еще более сложно, чем полипептиды. Однако фраг­
менты белковой молекулы могут рассматриваться как полипептидные
звенья
•.
Группы R могут содержать свободные амино- или карбоксильные груп­
пы, так как некоторые белковые аминокислоты содержат две амино- (ли­
зии) или две карбоксильные (аспарагиновая кислота) группы. Они могут
содержать также группы ОН, SH и амидные.
*
Условно
соедllнеНl·IЯ.
полипептидаМlt, более
534
100 -
содержащие
белками.
MfHee
100 остатков амltнокислот, называюТ
Дипептид, состоящий из остатков двух различных аминокислот, может
быть ПОСТр'оен двумя способами. Например, дипептид, построенный из
глицина и аланина, может иметь строение
NH:z-СН2-СО-NН-rН-СООН
1 или ll:
CH:I-rН-СО-NН-СН:z-СООН
CH~
NH 2
ГJIIЩIIJIИJIНIIИIl (1)
НJIНШIJIГЛlЩИII (11)
Три различные аминокислоты могут быть соединены шестью различными
способами и т. д.
Порядок чередования остатков аминокислот в цепи может быть уста­
новлен последовательным отщеплением с обоих концов молекулы отдель­
ных аминокислот, которые предварительно «метят» превращением в ка­
кие-либо устойчивые к гидролизу производные. Этим путем было уста­
новлено
строение
многих
наиболее
простых
белков
(инсулина,
миоглобина, рибонуклеазы и др.), молекулы которых построены из несколь­
кихдесятков или сотен различных и одинаковых остатков
и имеют молекулярную массу порядка
а-аминокислот
Эти данные допол­
5000-20 000.
няются результатами рентгеноструктурного анализа. Для многих более
сложных белков установлен порядок чередования нескольких аминокис­
лотных звеньев с каждого конца молекулы
•.
Для последовательного отщеплення амииокислотиых остатков от карбонильного конца
белковой молекулы может быть использован следующий метод:
H:zN -CHR-CO-NH-CHR' -CO-CHR" -СООН
~
C1;H"COCI
СfiНг,-СО-NН-СНR-СО-NН-СНR' -CO-NH-CHR" -СООН
~
NH 4SCN, (CH:1COJp,
нагревание
C.H,-CO-NH-CHR-CO-NH-CHR-CO-N-CHR"
1,
.,
!
I
.
I
S=C" /С=О
NH
NaOH
C.K-CO-NH-CHR-CO-Nh-CHR'-COOH + NH- CHR"
I
1",
I
S=C" /С=О
NH
~ IIн(ШI)~
NH2-
"
CHR - СО ОН
Выделениая таким образом аМИНОКllслота может быть идентифицирована. Весь процесс
Можно повторить с деградированным пептидом, и тогда будет установлено строение следую­
щеi\ аминокислоты с карбоксильного конца молекулы ПОЛlшептида.
• в наl..'тоящее
время расшифрована пеРВИ'lиая структура эна'lительно более
100 белков
~ содержанием нескольких сотеи аминокИСЛОТНЫХ остатков.
535
Для последовательного отщеплеюtя остатков 3МI1нОкttСЛОт от аминного конца молекулы
белка преможен следующнй метод:
C()H"NCS
+ NH 2 -CHR.-CO- NH -CHR.' -со- NH -CHR." -СООН
Ф
CtjHr,NH-СS-NН-СНR.-СО-NН-СНR.'-СО-NН-СНR"-СООН
~HC\
NH-CHR + NH. -CHR'-CO-NH-CHR"-COOH
I
I
2
S=C
с=о
"N/
I
C(jHr,
фВЯ(ОII)2
NH 2-CHR-COOH
Таким образом может быть идентltФIЩl1jJована конечная аминокислота. Процесс может быт..
снова повторен ДЛЯ деГJlдратнрованного пеПТJlда.
в случае сложных бел~ов или полипептидов расшифровке подвергают
продукты
их
частичного
гидролиза
-
простые
полипептиды,
причем
определяются места их «стыковки» (по р(!зличию в аминокислотном со­
ставе отдельных осколков) в сложную молекулу.
В современных лабораториях анализ аминокислотного состава и опре­
деление простых
графов
-
OCKOJIKOB
проводится с помощью специальных хромато­
автоматических аминокислотных анализаторов.
Уникальная последовательность аминокислотных остатков в цепи, ха­
рактерная для каждого белка, называется nервичной структурой белка.
Первичная структура белков строго специфИ'lНа для каждого вида орга­
низмов. Так, гормон инсулин, построенный из 51 остатка одинаковых и раз­
ЛИ'IНЫХ а-аминокислот в виде двух цепей, соединенных дисульфидными мос­
тиками, имеет неодинаковый состав у различных видов животных (схема
9).
Трехчленные звенья в определенном месте цепи А молекулы инсулина содер­
жат следующие аминокислотные остатки: у быка аланин у свиньи треонин - серин - изолейцин; у лошади
цин
-
изолейцин; у овцы аланин
-
глицин
-
серин треонин
-
валин;
гли­
валин; у человека трео­
нин - серин - изолейцин (на схеме 9 они отмечены звездочками). РазлИ­
чия наблюдаются также в С-концевом остатке В-цепи: в инсулине человека
это остаток l'реонина, а в инсулине быка - остаток аланина.
Отдельные молекулы белка взаимодействуют друг с другом, образуЯ
водородные связи, причем цепи «свертываются» В виде спиралей. В таК
называемых фибрuлярных белках отдельные цепи более растянутЫ.
В глобулярных белках упаковка цепей более компактна.
В крист(!ллическом виде получены только глобулярные белки; фибри­
лярные белки не способны кристаллизоваться. Кристаллы белков. расту­
щие из растворов, содержат растворитель, который входит в структурУ
белка, так что удаление его вызывает потерю кристалличности.
536
Схема
9.
Аминокислотная последовательность ИIIСУЛИН;!. быка и человека
Цепь А
Цепь В
Gly
Ile
Val
Glll
5 Glll
Phe
Val
Asn
G1n
5 His
г-Суs
Leu
S
Cys - S - S - Cys
Ala*
Gly
I
5ег*
I
~
10 His
Leu
Va1
G1u
Ala
15 Leu
Cys
5ег
Lell
Туг
15 Gln
Leu
Glll
Цепь В
Gly
Phe
11e
Val
ASll
Val
Glll
Glll
5 Gln
5 His
г- Cys
Lell
5
Cys - 5 - - 5 - - Cys
Thr*
Gly
5ег
~ Val*
Цепь А
5ег*
10
L--
Ile*
Cys
5ег
10
5ег
Lell
Туг
15
Туг
Leu
дsп
Va1
Туг
,-Cys
20 Cys-S-S-1 20 G/y
ASIl
G1u
Glll
Leu
Glll
ASIl
Туг
20
15
Туг
Lell
Val
г--Суs
Cys -S-S-.J 20
ASIl
Ащ
G1y
Phe
25 Phe
His
Leo
Val
Glll
Ala
LeLI
25
Gly
GllI
Arg
Gly
Plle
Phe
Туг
Туг
Thr
Thr
Рго
Рго
30 Lys
:30
А1а*
инсулин быка
Lys
Tllr·
инсулин 'Iеловека
Особенности скручивания цепей белковых молекул (взаимное положе­
ние фрагментов в прострянстве, возможность существовяния а- и l3-спи­
-
рялей
вой
скручивания по и против часо­
стрелки)
называются
вторичной
структурой белков.
Полипептидные цепи белков могут сое­
диняться между собой за счет боковых це­
пей яминокислот. В результате возникно­
вения этих связей происходит закручива­
ние
спирали
в
клубок (рис.
65).
Эти
особенности строения белков называют
третичной структурой.
Наиболее всесторонне исследован бе­
лок, придающий красную окраску тканям
мышц, - .миоглобин. Его молекулярная
масса 17000. Он содержит одну окрашиВilЮЩую группу на молекулу. П оследняя
PIIC.
65. Модель молекулы белка
МI1ОГJlООlша
537
имеет вид глобулы. Ход пептидной цепи в молекуле миоглобина схемати_
'/ески показан на рис.
65.
Пигмент крови - гемоглобин имеет четыре окрашивающих группы
на молекулу. Его молекулярная масса в четыре раза больше, чем
миоглобина.
Миоглобин и гемоглобин выделяются среди глобулярных белков высо­
ким содержанием спиральных участков.
При денатурации пептидные связи сохраняются. Меняется характер
взаимодействия между молекулами, т. е. вторичная и третичная структуры.
Большинство белков с большой молекулярной массой представляет
собой агрегаты, включающие две и более полипептидные цепи, что харак­
теризует их четвертичную структуру. Так, например, белок гемогло­
бин построен из двух а- и двух ~-полипептидных цепей.
Полилептидные цели удерживаются в четверти'/ной структуре BOДO~
родными связями, электростатическим взаимодействием и т. п., т. е. теми
же взаимодействиями, которые создают и третичную структуру белков.
Первичная структура белка, т. е. порядок чередования остатков амино­
кислот в полипептидной цепи, полностью определяет вторичную, третич­
ную и 'lетверти'lНУЮ структуры белков. После разрушения третичной
и четвертичной структуры белки могут их самопроизвольно восстанавли­
вать с возвращением биологических функций. Синтезируемая в клетке
полипептидная цепь также самопроизвольно приобретает свойственные
данному белку вторичную, третичную и четвертичную структуры и начина­
ет выполнять свои биологические функции.
Синтез полипептиДов и белков
Проблема синтеза белков имеет огромное практическое, теоретиче­
ское и философское значение.
Прежде
'leM
синтезировать белки, необходимо было научиться полу­
чать более простые вещества, построенные по тому же принципу, что
и белки,- nолиnеnтиды.
Простейшие полипептиды
-
кристаллические
вещества,
раствори.­
мые в воде и почти нерастворимые в спирте. Они дают биуретовую реак­
цию. Полипептиды, как и белки, играют важную роль в процессах жизне­
деятельности и являются продуктами частичного гидролиза белков.
Синтез полипептидов осуществляется различными методами. Простей­
шие из них ррзработаны Э. Фишером и Э. Абдергальденом в начале два­
дцатого века. В последнее время разработаны новые методы, позволяю­
щие получать более сложные полипептиды.
Сннтез полнпептндов ЭТIIМН методамн осуществляется в три стадии:
1. ПолучеНllе аминокнслот с защищенными амиио- или карбоксильными группами.
2. Образование пептндной связи.
3. Избщ>ательное отщепление защищающих групп.
СIIнтез пеПТllДОВ 'Iрезвычаliно трудоемок. так как неоБХОДllМО после каждой стадии выде­
лять н О'IIlщать продукт реакции. При зтом неизбежны потери вещества. Дnя синтеза рибо-
538
НУl\леllЗЫ
-
белка, содержащего 124 IIМИНОКИСЛОТНЫХ остатка, необходнмо провести
включающих 11 931 стадию. Если проводить такой синтез класси­
369 ХИМИ'lеСI(ИХ реакций,
чССЮIМ путем. с выделеНllем
11 O'l11CTKOi\
вещества на каждой стадии, вещество будет полно­
стыо потеряно задолго до ДОСТllжеlШЯ эаключитеЛЫlOii стадии.
В настоящее время Т3Iше многостадийные сннтезы проводЯТ ТIIК называемым твеРДОф8З­
ным СllОсобом. когда молекулы вещества, ПОд,llежащего последовательным превращенИ!lМ.
ПРlшреl1лены к твердой ПОДllожке ковалентными свя.~ЯМИ. Это позволяет избежать потерь,
так "ак очистка вещества после каждой очередной стадии СliНтеза ДОСТl1гается простой про­
MbIBKOii. На KOHe'JИOl1 стаДIШ готовый ПрОДУI<Т СНl1мают с под.nожки расщеплением ковалеtlТ­
H()il СВЯЗI1. При ТIIКОМ способе все операЦliИ осуществляются автомаТI1'lеСI(И.
Существуют автоматические устройства. СliНтеэирующие полипептиды с задаиной про­
граммирующим устройством послеДОВlIтельностью IIМИНОКI1СЛОТ.
Использование новых методов привело к значительным успехам в син­
тезе сложных полипептидов. Начиная с 1954 г. осуществлен синтез ряда
гормонов, представляющих собой сложные полипептиды. Так, например,
синтезированы один из гормонов гипофиза - окситоцин (8 остатков ами­
нокислот); гормон инсулин, построенный из нескольких полипептидных
фрагментов, самый большой из которых содержит 30 аминокислотных
остатков, фермент пакреатическая нуклеаза и ряд других.
В растениях белки синтезируются из неорганических соединений при
воздействии энзимов, в организме животных
-
из аминокислот.
Последние поступают с пищей в виде растительных или животных бел­
ков. Только некоторые аминокислоты в организме животных синтезиру­
ются из кетокислот и аммиака или других аминокислот. Такие аминокИС­
лоты называются заменимыми (глицин, аланин, орнитин и др.)_
Из простейших аминокислот незаменuмымu являются валин, лейцин,
лизин и др.
Потребляемые организмами животных белки обязательно должны со­
держать незаменимые аминокислоты, иначе белковая пища будет неПQЛ­
ноценной: прекратится рост организма, и он может даже погибнуть. Не­
полноценными белками являются желатина (нет триптофана), зеин куку­
рузы (не содержит лизина) и др.
Организм
может усваивать и
свободные аминокислоты,
вводимые
с пищей.
Применение белков
Белки входят'в состав пищевых продуктов. Организм взрослого чело­
века должен получать ежедневно около
100
г белков.
Белковыми веществами являются кожа, шерсть, шелк, столярный
КJlей, желатина. Белки кровяной сыворотки и желатины служат для изго­
Товления фотоэмульсий.
В последние годы стала бурно развиваться новая отрасль промышлен­
ности
-
производство кормовых дрожжей на основе углеводородов не­
фти и отходов промышленности.
Установлено, что некоторые микроорганизмы типа дрожжей способны
в соответствующей солевой среде усваивать углеводороды, начиная от ме­
T<lH<I, превращая их в белок. По аминокислотному составу такие белки не
539
уступают наиболее качественным белкам животного происхождения.
Скорость накопления беJlКОВОЙ массы микроорганизмами во много раз
превышает скорость ее накопления животными. Органическая масса
дрожжей удваивается за 10-16 мин, в то время как у птиц в период их
наиболее интенсивного роста она удваивается за несколько суток, а у ро­
('атого скота
-
за несколько месяцев. Изучается возможность ИЗГОТОвле_
ния на основе дрожжевых белков пищи для человека, не ОТJlичающейся по
вкусовым качествам
(А. Н. Несмеянов).
и
питательности
от
обычной
белковой
пищи
Многие беЛКl1 или полипеПТIЩЫ применяются как лекарственные вещества. например
ИНСУЛIIН (ПРИДllабете). Недавно открыта группа полипептидов «()nиоUl)Ы), проявляющих по.
добное морфию обезболивающее деЙСТВllе. Применение их не ведет к наркомании. Белок
mаумаРIlН в 5000 раз слаще сахарозы. Население Западной АфрИl<Н использует плоды рас.
тения, содержащего этот сверхсладкий белок.
2.
ФЕРМЕНТЫ
Метаболизм клетки складывается из двух хорошо сбалансированных
процессов. Первый из них
-
расщепление пищевых белков, углеводов
и жиров с целью полу'(ения необходимых для клетки строительных мате­
риалов и энергии или удаления из клетки не свойственных ей веществ'.
Второй процесс - это синтез из доставляемого первым процессом стро­
ительного материала элементов собственной структуры клетки. Оба про­
цесса невозможны один без другого.
Как синтез, так и расщепление органических веществ в клетке прохо­
дят с участием специфических биокатализаторов - ферментов. Для
ферментов как катализаторов характерна чрезвычайно высокая актив·
ность, исключительная специфичность и высокая чувствительность к из·
менению внешних условий (температуры, рН, присутствия других ионов
и т. п.). Единственная молекула фермента может вызвать превращение
нескольких миллионов молекул субстрата. Каждую реакцию в клетке· ка­
тализирует специальный фермент. Поскольку в клетках проходят тысячи
различных реакций, в метаболизме у'(аствует много тысяч различных
ферментов.
По химической природе ферменты являются простыми или сложными
белками. В последнем случае в качестве небелковой '!аСТИ (кофактора)
могут фигурировать ионы металлов или органические соединения, в раз­
личной степени связанные с белковой частью фермента.
Активность ферментов может зависеть и от присутствия веществ, не­
посредственно не связанных с ферментом,- кофеРАtентов. В их роли
могут выступать доставляемые в организм с пищей витамины (рибофла­
вин, тиамин, пантотеновая кислота, никотинамид).
Наряду с ферментами, которые в следовых количествах способствуют
действию ферментов, в клетках могут присутствовать и их антагонИ­
сты - ферментативные яды, и ингибиторы, мешающие действию
ферментов.
.
Названия ферментов производят от названия изменяющегося под его
воздействием субстрата с добавлением суффикса -аза, например пепси-
540
даза, карбоксилаза, метаза и т. д. Широко используются также тривиаль­
ные названия. Для ферментов разработана и систематическая номенк­
латура.
Изучение ферментов необходимо не только для развития биологии, фи­
зиологии и биохимии. Многие ферменты проявляют химическую актив­
ность и вне клетки. С их помощью некоторые ферментативные реакции
успешно осуществляются в промышленности, например синтез ЭТИJlОВОГО
и бутилового спиртов, уксусной, молочной и лимонной кислот, сорбита,
витамина С и др. Ферментативные процессы широко ИСПОJlЬЗУЮТСЯ в хле­
бопекарной и кондитерской промышленности, в виноделии и пивоваре­
нии, при дУблении кож и т. д.
3.
Витаминами
ВИТАМИНbI КАК КОФЕРМЕНТbI
называют
вещества
различного
строения,
которые
в следовых количествах должны присутствовать в клетках для поддержа­
ния их нормальной жизнедеятельности, а также для обеспечения нор­
мального роста и воспроизведения организма. Они поступают в организ­
мы с пищей или синтезируются в них из других веществ.
Витамины делятся на два класса: водорастворимые и жирораствори­
мые. К водорастворимым относятся витамины В 1, В 2 , В з , С, РР, к жиро­
растворимым - А, D, Е (табл. 19). Жирорастворимые витамины имеют
обшуlO структурную особенность: все они изопреноиды, т. е. построены из
фрагментов изопреноидного типа. Изопреноидная структура особенно
выражена в молекулах витаминов А, Е и К. Витамин D - стероид, однако
и стероиды имеют изопреноидных предшественников. Витамин А содер­
жится только в животных тканях. Растения лишены витамина А, однако
они содержат пигменты - (Х- и /3-каротины, окислительный распад кото­
рых в тканях животных дает витамин А.
Отдельные виды организмов животных способны синтезировать нуж­
ные им витамины. Если такой способностью они не обладают, витамины
обязательно должны поступать с пищей. Так, например, организмы чело­
века, обезьян, морских свинок не способны синтезировать витамин С, и
он должен обязатеЛl,НО содержаться в пище.
В настоящее время можно утверждать, что каждый витамин выполняет
в разных организмах одну и ту же функцию. Витамины В 1, В 2 , В з , РР явля­
юTcя коферментами или предшественниками собственно коферментов.
Другие витамины, функции которых изучены менее полно, требуются для
некоторых специализированных видов активности высших организмов.
Каждый витамин стимулирует деятельность ферментов, катализирую­
щих строго определенный вид химических превращений в организмах.
Так, например, витамин В 1 стимулирует действие декарбоксилирующих
ферментов, В з - ацилирующих ферментов, С - ферментов, катализи­
рующих окислительно-восстановитеЛЫlые процессы.
Многие витамины в настоящее время получают в промышленных мас­
штабах синтетически (витамины А, В, С, РР и др.) или выделяют из при­
родного сырья как в ,(истом виде, так и в виде концентратов. Они
541
используются в медицине при витаминозной недостаточности и связанныIx
с нею заболеваниях (например, витамин А при нарушении зрения, вита­
мин В,
-
при заболевании бери-бери, витамин С
-
при заболевании
цингой). В животноводстве витаМИНbI широко используют для ПОВblшения
его продуктивности.
Антивитамины. Большая группа органических соединений обладает
свойством подавлять биологическую активность витаминов. Такие соеди­
нения называются антивитаминами. АнтивитаМИНbI играют важную
роль при изучении специфического действия витаминов на животных и
ростовых факторов на микроорганизмах. Как и антиметаболиты, антиви­
тамины в биокаталитических реакциях подменяют истинные катализато­
ры-витамины, проявляющие свои каталитические функции в составе фер­
ментных систем. По-видимому, антивитамины наряду с витаминами спо­
собны входить в состав ферментных систем, образуя псевдоферменты, не
обладающие биокаталитическими функциями, но способные подавлять
биокаталитическую активность истинных ферментов, в состав· которых
входят
витамины,
или
Вblтеснять
витаМИНbI
из
коферментов
или
ферментов.
Характерными представителями антивитаминов являются сульфанил­
амидные препараты, бактериостатическая активность которых основана
на том, что они в БИОХИМИ'lеских реакциях, протекающих в микробной
клетке, конкурируют с витамином Н, (n-аминобензойной кислотой) и по­
давляют его активность. Действие сульфамидных лекарств объясняется
их сходством с n-аминобеНЗ0ЙНОЙ кислотой, которая является кофермен­
том,
необходимым для
нормального метаболизма
многих патогенных
бактерий.
Антивитаминная активность обычно является следствием геометриче­
ского и функционального сходства между витамином и его антагонистом.
Витамину
С L-аскорбиновой
кислоте
противостоит
антивита­
мин - D-аскорбиновая кислота; витамину РР (никотинамиду) - пири­
дин -З-сульфокислота; витамину В з (пантотеновой кислоте) - сульфо­
пантотеновая кислота и т. д.
г ЛАВА ЗЗ
УГЛЕВОДЫ
Углеводами называют группу природных веществ, близких по свойСТ­
вам к гидроксиальдегидам и гидроксикетонам. Большинство углеводов
имеет общую формулу C ГI (H 2 0)ГI' например С Б Н I2 О Б , C I2 H22 0'I' На долю
углеводов приходится около 80% сухого вещества растений и около 20%
животных. Растения синтезируют углеводы из неорганических соединений
(С0 2 и Н 2 О).
542
Табл и ца
Формула
~H)
СН)
d( h.:.ch-с=сн-сн.k:н-J=сн-снzон
" I
,
I
19.
Важнейшие витамины
НазваJlие
Бнологиtlеско~ действие
Ретинол, витамин А 1
Участвует в зрительном процессе в составе зритель­
ного пурпура. Недостаток ведет к слепоте. похуданию
I
Н)
NНZ
C:fLgs
j-c
н'
Hz-N
1.
CH~
-
Нз
Тиамин, внтамин
Является коферментом карбоксилазы. Недостаток
81
вызывает заболевание
-
полиневрит
HzCHzOH
Ch]--r'Y"N~NН
Рибофлавин, витамин
82
I(офермент флавиновых ферментов, осуществляющих
реакции дегидрироваиия. Участвует в мехаиизме зрения
CH~~J=o
tНr<СНОН)ГСН I0И
СИ)
О
hoch 2-t-СИ-!\-NН-СН z СНz СООН
I
I
СН) ОН
CJ1
"'"
~
Пантотеновая кислота,
витамин 8 з
Составная часть ферментов, осуществляющих реакции
аЦИЛllрования в организме
'"
*'*'""
Прor)олжеnuе табл.
Формула
1
Е
~
сн)
tt'
Биологическос дсйствие
Название
Пиридоксин. витамин 86
2 0Н
но'
J9
Кофермент ферментов аминокислотного обмена
HzOH
~HZOH
Аскорбиновая кислота.
витамин С
н-с-он
I
Катализатор окислительно-восстановительных реак­
ЦlIЙ. протекающих в живой клетке. Недостаток вызывает
заболевание цингой
С -Н
Г t-OH
О 11
L ~-OH
С=О
СИ]
си
СИ]
СИ
1]
J
' R~""""C..!!.. сн СИ]
СИ]
си с-н' "-
Ф
Кальциферол.
витамин
D2
ПО-ВI1дИМОМУ.
является
коферментом.
ВЛИЯЮЩИМ
на активность ферментов. регулирующих обмен фосфора
и кальция в растущем организме. Недостаток вызывает
заболевание рахитом
~СИil
ио~
о СН2 СН С.Н ~CнСН] Н
СХХI
~
.
сн)
I
I
11
О
I
I
.........
сн
~C/
I
СИ)
{2
I
.........
CH
z
CH
I
z
}
Токаферал. витамин Е
Прнродный аНТllOкислнтель. Преnятствует автоокис­
лению сильно ненасыщенных веществ. таких. как нена­
сыщенные жирные КlIСЛОТЫ. Недостаток вызывает нару­
шения в функции размножеиия
Пр()()олженuе таил.
..
~
Е
19
Формула
НаЗВ8liие
Биологическое действие
s<
\со
си--си-'и
I
.
Биотин, витамин Н
Входит в состав ферментов, способствующих клеточ­
ному делению. Недостаток вызывает замед.nение роста,
chrCH-NН
I
поражеиие кожных покровов, выпадение волос
(СИ2)4-СООН
~си.
"';И1
~cН;-СИ'с..9'1/c~
' СН2 ~l{ Н
!И3
g
V
<:11
,j:o.
<:11
котииамид, витамин РР
Оn
N
СН 2
ЬН
I 2
2У:;!'1 NH-o-~ С-NИ-СИ
~
N:::".
Н
c1I
2
Обладая окислительио-восстановительной системой,
катализирует синтез протромбина. Регулирует свертыва­
ние крови
Никотииовая кислота, ни­
ONH2
(
N
K1
си]
СООН
NH
Филлохинон, витамин
-
!оон
Фолиевая кислота
в форме никотинамида входит в состав никотинамид­
ферментов, осуществляющих биокатаЛИТlfческие
функцни в реакциях гидрирования и дегидрирования,
протекающих в живых клетках. Недостаток вызывает за­
болевание пеллагрой
ных
Участвует в синтезе пуриновых и пиримидиновых осно­
ваний. Недостаток вызывает нарушение роста, анемию .
В живых организмах углеводы выполняют различные функции. Они по­
ставляют энергию д.IIЯ биологических процессов, а также являются исход­
ным материалом д.IIЯ синтеза в организме других промежуточных или ко­
ие'!Ных метаболитов.
Углеводы делятся на 2 группы: 1) м,оносахариды (монозы) и 2) nолu­
сахариды (полиозы). Последние подразделяются на: сахароnодобные
(олигосахариды), к которым относятся дисахариды (биозы), трисахариды
и т. д. И несахароnодобные полисахариды.
Моно- и олигосахариды - хорошо растворимые в воде вещества с не­
большой молекулярной массой. Несахароподобные углеводы имеют боль­
шую молекулярную массу, а если и образуют растворы, то только
коллоидные.
Олиго- и полисахариды могут быть расщеплены гидролизом до моноз.
Они построены соответственно из 2, 3, 4 и т. д. молекул моноз.
Несахароподобные углеводы (крахмал, клетчатка) построены из очень
большого Ч\'Iсла молекул моноз.
1.
МО н оз ы
МОНОСДХдРИДЫ (МОНО3Ы)
наиболее простая группа углеводов. В природе наиболее
-
распространено два вида моноз: nентозы
CsH100s
и гексозы
C6H 120 6.
Одни моносахариды ведут себя как гидроксиальдегиды (альдозы ), дру­
гие
-
как гидроксикетоны (кетозы). Больщую роль в природе играют
альдозы.
Наиболее часто встречаются два моносахарида: глюкоза и фруктоза.
- альдоза, фруктоза - кетоза.
Они относятся к гексозам; глюкоза
Строение
Строение глюкозы и фруктозы доказано рядом реакций.
Глюкоза.
1.
При восстановлении
HI
глюкоза дает 2-иод-гексан:
C1;H I2 0tj.....!!!.... CH:1 -CНI-CH 2 -CH 2 -CH 2 -CH:\.
ЭТО превращение говорит о том, ,{то никаких разветвлений в ее угле­
родном скелете нет (нормальная углеродная цепь).
2.
При окислении в мягких условиях ГЛЮкоза образует глюконовую
кислоту:
C1i H I2 0,; -ШL. СН 2 ОН-СНОН-СНОН-СНОН-СНОН-СООН.
ЭТО показывает, что глюкоза имеет альдегидную группу.
Ацилированием и алкилированием глюкозы доказано присутствие
3.
пяти гидроксильных групп:
C1i H I2 0lj + 5(CH:1CO)20 ~СIjН 7 0(ОСОСН:1 ),, +5CH:1COOH.
Фруктоза.
1.
Образование иодгексана при действии
HI
на то, что углеродная цепь фруктозы не имеет разветвлений:
СIjН 1201i.....!!!.... CH:1 -CНI-CH 2 -CH 2 -CH 2 -CH:\.
546
указывает
2. Окисление с разрывом цепи показывает, что фруктоза является ке­
2:
тозой с группой СО в положении
СООН
J
СООН
CIiHI~O(;
I
---+
СНОН
I
+
СООН
Фl'укт();,~
СНОН
I
1Il.ИltСJlСllltf1
СО ОН
КЩ:JlОта
IIИIIIIИ~I
КНCJюта
3.
Как и глюкоза, фруктоза реагирует с пятью молекулами уксусного
ангидрида и, следовательно, имеет пять гидроксильных групп.
Отсюда структурные формулы глюкозы и фруктозы:
СНО-СНОН-СНОН-СНОН-СНОН-СН 2 ОН:
l'JIЮКЩI,ы
CH~OH-CO-CHOH -СНОН -СНОН -СН 2 ОН.
ФrУКТlIЗn
Согласно этим формулам глюкоза и фруктоза ДОJIЖНЫ легко
pearl1po-
6ать с NаНSОз . Но в действительности эта реакция идет очень медпенно.
Гексозы (в обычных концентрациях) не окрашивают раствора фуксино­
сернистой кислоты. СудЯ по приведенным формулам, все группы ОН дол­
жны иметь одинаковые свойства; между тем в действительности один гид­
роксил отличается по реакционной способности от четырех других. При
действии на глюкозу СНзI и Ag2 0 можно получить пентаметилглюкозу;
при действии СНзОН и НС! реагирует только один гидроксил. АлКИЛl1ро­
вание глюкозы и фруктозы приводит к исчезновению альдегидных и ке­
тонных свойств. Эти, а также другие данные позволяют приписать глюко­
зе и фруктозе формулы полуацеталеЙ. Полуацетали могут возникать за
счет нескольких ГI1ДРОКСИЛОВ. Преобладают 8-полуацетали.
При образовании таутомерной (циклической) полуацетальной формы
к кислороду группы С=О переходит атом водорода, принадлежавший гид­
роксилу при пятом атоме углерода, с образованием глюкозuдн.ого
гидрокеила.
Таким образом, для рассматриваемых сахаров характерно КОЛЬ'lа-
то-цепное таутомерное равновесие
•
Н
I
I
с=о
н-с-он
I
НО-С-Н
I
Н-С-ОН
I
Н-С-ОН
I
сн2он
J
СН-ОН
H~b-OH
Р
I
у
I
~но-е-и
н-е-ОН
и-Ч-_...
tиtOН
11
• С помощью полярографltll YLoтaHoвneHo. что раствор D-глюкозы содержит ЛlIШЬ
0.0026% свободного альдеГIIДII.
547
Доказательство строения кольца глюкозы. Метилирование глюкозы прнводит кобра·
зоваНllЮ пентаметиЛl{ГЛЮКОЗЫ. частичный ГI1дРОЛIIЗ которой в кислой среде (омыляется
только ЭфIlР. обраЗОВilННЫЙ с участнем полуацетального глюкозидного Гl1дроксила) ПРIlВО­
дит к тетраметилглюкозе:
H-i он I
HO-Y=:J
н-с-он
I
О
Н-!--<>Н I
н-t-осн з
+СНз l
I
[Ag2~ •
O~
НЗСО-С~
H-{-ОСН з
Н-С-ОН
I
н-с
н-с
I
I
СН 2 ОСН з
СН 2 ОН
а. ·D·ГJlIОItОЭI
nеНТIМетил- а. -D-rЛЮКD38
тетраметил- а. -D-ГЛIOКО31
(циклич ••••• фор..а)
СООН
н-с=о
-
I
I
н-с-осн з
I
Н зС О -С-Н
I
н-с-осн
I
H-С-ОСН а
окислеиие
слабым
•
I
I
н СО-С-Н
3
з окислителе ..
H-С-ОСН
а
-----+---11
С=О
н-с-он
-----t---I
I
СН 2 ОСН а
СН 2 ОСН з
СООН
I
H-С-ОСН
О&ИCllение
бonее
СИЛЬНЫМ
окислителе
СООН
Н-С-ОСН
I
СООН
I
H-С-ОСН а
а
• HCO-t-H
а
I
..
---
и
а
I
н СО-С-Н
а
I
СООН
СО ОН
tOOH
ОЮ1слеНl1е тетрамеТI1ЛГЛЮI{ОЗЫ может идти по двум направлениям (на схеме указаны
стреЛКitми 1 11 11). Образование при этом меТI1ЛОВЫХ эфиров триоксиглутаровой и ДIIОКСИ­
янтарной КlIСЛОТ (триметоксиглутаровая и диметоксиянтарная КlIСЛОТЫ) свидетельствует о
том. что кольцо образовitно с участием группы ОН. стоящей у пятого атома углерода. Если
бы кольцо было образовано с участием гидроксила. например у четвертого атома углерода.
то в продуктitх ОКllслеНI1Я не оказалась бы триметоксиглутаровой кнслоты.
Так же можно доказitть строение кольца 11 д.nя кетогекзосы -
фруктозы. Здесь кольцо
может быть образовано за счет гидроксила у пятого и шестого атомов углерода:
548
,
сн 2он
с-он
HO-t~
,
о
н-т
,
I
он
ун2 он
С=О
с-он
HO-t-H
но-!,-н
~I
• ..
I
• •
н-с-он
н-Ь-он
н-с
н-с-он
О
H-t-OH
I
I ~
,
сн 2 он
сн 2 он
сн,
,,-D-фрукто,. (цикли­
D-фруктозз (откры­
а-D-фруктоза (цикли­
ческая
1~OH
та., цспнаи форма)
ПАТИЧJlсннаl
ческа_
wестичлсинак
форма; " -D-фрукто-
форма; а -D-фрукто-
пираноэа)
фураноза)
Пятичленное кислородсодержащее гетероциклическое соединение на­
зывается фураном (см. гл.
членные
монозы
28),
шестичленное
называются
nuраном. Отсюда пяти­
-
фуранозамu,
а
шеСТИ'Iленные
-
nuранозамu.
Глюкоза в открытой форме
YLIacTByeT в реакциях, характерных для аль­
- в реакциях, характерных для спиртов,
дегидов, в циклической форме
так как глюкозидный гидроксил обычно реагирует в первую очередь.
Цепная формула требует существования
8-
D-ряда и
8-
16 (24)
изомерных гексоз:
L-ряда, так как в tоединении имеется четыре асиммет­
рических атома углерода. При рассмотрении этих изомеров необходимо
пользоваться проекционными формулами, так как они различаются между
собой только расположением водородных атомов и гидроксильных групп
В пространстве по отношению к углеродной цепи.
Отнесение сахаров к о- или L-ряду не связано со знаком вращения и
зависит от строения 5-го тетраэдра, как это показано на схеме
11.
Сахара
D-ряда генетически связаны с D-глицериновым а.JIьдегидом (могут быть
из него получены), сахара L-ряда аналогично связаны с L-глицериновым
альдегидом. Для получения сахаров из о- и L-глицеринового альдегида
может быть использован оксuнитрuльный синтез (с.
сно
н
но
н
н
н
но
н
он
н
г------,·
,,
г-
-- ---..,.
1 ______
сн 2 он,
'.J
н'
,,
''
2
'- ______
.J
D (+)-Г.lIОКОЭ8
L (-).ГЛ~К~tа
'н
1
555):
н
,
1
,но
1
сн он,
549
Сахара, отличающиеся строением только одного, обычно второго, тет­
раэдра, называют эnuм.ерамu:
но
н
сно
но
он
г.
г.----,
н
- -.- -.,
,но
Н,
Н
,
он ,
он'
,но
н
'н
он,
I
I
I
Н
,L
сн2он I
____
J
,'н
,L
I
сн 2он'
____
.J
'
он I
D( + )-М.llllоэа
D(+).rа ...оз.
Циклическая полуацетальная формула требует существования уже
32 (25)
изомерных гексоз: каждый из
8
изомеров D-ряда и
8
изомеров
L-ряда будет иметь а- и ~-формы, называемые аномерами и отличающи­
еся положением водорода и гидроксильной группы В верхнем тетраэдре:
Н" /ОН
Н" ~()
н-1I ОН I
н-{ ОН I
н-1-0Н
I
Н-!I ОН. I
Н-Ь-ОН
н-Ь ОН j
но-ё-н
НО" /Н
О ~ НО-С-Н ~ НО-С-Н
н-с
I
H-t-OH
I
"а
I
СН 2 ОН
а. -D·rлIOltОПМ раноза
СН 2 ОН
О
H-tI
СН 2 ОН
IIб
~-D·r",о,опир.ноз.
Свежеприготовленные растворы сахаров в воде со временем изменяют
угол вращения плоскости поляризации до не которой определенной вели­
чины. Это явление получило название муmароmации. Оно обусловлива­
ется тем, что в растворе аномеры (а- и ~-формы сахаров) переходят друг
в друга, причем устанавливается подвижное равновесие. Так как аномеры
вращают плоскость поляризации на различные углы, а концентрация их
до установления
равновесия
меняется, то изменяется
и угол
2IJ
раствора. Так, например, удельное вращение а-глюкозы [а]м
вращения
=+110,1°,
j3-глюкозы + 19"'з·, равновесной же концентрации отвечает удельное вра2IJ
щение [а]к =+52,3°,
в КРllСТIIЛЛИ'lеском состояннн каЖдЫЙ моносахарид существует только в одной, большей
частью Пflранозидноli, форме. В растворах могут наХОДliТЬСЯ все возможные формы моноса­
харида в равновесии (с преобладанием наиболее термодинамически устойчивой). Состав
paBHoBecHoii смеси зависит от растворителя. В водных растворах рассматриваемых в этой
книге моноз только В случае рибозы присутствует значительное количество фуранозной
формы.
550
Содержание различных форм моносахаридов в растворе,
%
а-Пираноэнаи
форма
~-Пираноэна.
а- и ~-Фураноэные
форма
формы
Рибоза
20
Арабиноза
63
33
36
67
27
56
34
67
64
33
73
6
3
ДЛьдоэа
Ксилоза
Глюкоза
Манноза
Галактоза
Ациклическая, фуранозная и септеноэная формы присутствуют в НИ'IТОЖНЫХ количест­
вах, однако моносахариды благодаря равновеСliЮ могут целиком прореагировать с подходя­
ЩflМ реагентом так, как будто они существуют в этих формах.
Для изображения молекул сахаров удобнее пользоваться наглядными
перспективными фор.мулам.u Хеуорса. При переходе от проекционных
формул к перспективным следует атомы и группы, расположенные в про­
екционной
ва
-
формуле
внизу кольца
слева,
Н
11.-
писать наверху,
а
расположенные спра­
":
ОН
ОН
Н
D(+)-ГЛlOk~l1ираНО:;Jа
Необходимо обратить внимание на то, что в этих формулах атом водо­
рода у пятого углеродного атома
оказался внизу, хотя
в
проекционных
формулах находится слева_ Это объясняется тем, что для образования
кислородного мостика необходим поворот части молекулы вокруг валент­
ной оси, соединяющей четвертый и пятый углеродные атомы. После тако­
го
поворота
гидроксил пятого углеродиого атома занимает положение,
благоприятное д,ля замыкания кольца (приближается к группе Н -с=о):
/ОН
4
Н-С=О
Н-С
Н-С-ОН
Н-С-ОН
11
11
21
НО-С-Н
....
31
н-с-он
41
н-е-он
51
еСН 2ОН
21
но-с-н
31
Н-С
41
ОН
О
I
н-с
51
6СН 2 ОН
А
• Глюкозидный гиДРоксил а-формы всегда находится в транс-положении по отношению
к группе СН,ОН.
551
r.CH 20H
1
5С---ОН---"
Н/ 1
I
I
I н
4С ОН
I~
НО
tI
H,/L~HO
II
с-с
31
21
Н
ОН
СледУет заметить, что д.nя сахаров в циклической форме возможен еще один вид изоме-
1'1111 -
fl(}(юроmНUЯU:lсшерuя, связаниая с расположеНliем в пространстве углеродных ато­
мов шестltчленного кольца. Пиранозный цикл, подобно циклогексановому, способен суще­
CTBOB;lTI>
в Вltде нескольких I<онформеров с раЗЛII'lноli УСТОЙ'ItIВОСТЫО. От ЦИlUlогексанового
он ОТJllI'1ается несиммеТРИ'lНОСТI>Ю, обусловленноil присутствием в Цllкле кltСЛОРОДНОГО ато­
ма, 'lто увеличивает чltсло возможных конформационных изомеров. В то время как д.nя цик­
логексанового I(ольца возможно всего два l<Онформационных изомера, кресловидный и ван­
но06разный, пиранозное КОЛI>ЦО может существовать в виде восьми ненапряженных конфор­
М;lЦИИ, две из которых кресловидные и шесть ваннообразные. Эти шесть ваннообразных
конформаций энергеТl1чески менее выгодны, и их существование можно не учитывать. Две
более УСТОИ'1I1вые креслообразные конформации получаются при такой конвеРСIШ пираноз­
ного КОЛl>ца, в результате которой все аксиальные замеСТliтеЛI1 становятся экваториальны­
ми, и наоборот:
ПреДПО'lтитеЛI>НОСТI> тои или иной конформаЦliИ д.nя данного сахара определяется имею­
ЩI1МI1СЯ в Пllранозном кольце заместителями и 11Х пространственным расположением. Так,
например, а- и (3-изомеры О-глюкозы преДПО'lТlпельно существуют в виде следУЮЩИХ кои­
формаций:
н
HW",
но
HO~
Н
.. -
и
/1
Н
Н
-rnюкопираноэа
Способы получения
Моносахариды обычно получают из природного сырья
1. Гидролизом ди- и полисахаридов под влиянием кислот или энзимов
(в зависимости от строения дисахаридов могут получиться два одинковых
или разных моносахарида):
ILIICHXHI'IIIL
2.
МOIюснхар"Д
IЮJIIlснхаРIЩ
ОКИСJlением многоатомных спиртов обычными окислителями или ПОД
ВJlиянием энзимов. При обычном окислении получается смесь вещестВ.
Например, при химическом окислении шестиатомного спирта D-сорбита
наряду с D-ГJlЮКОЗОЙ образуется и L-гулоза: первая - за c'leT окислениЯ
552
«верхней»
группы
СН 2 ОН:
СН 2 ОН,
а
сн 2 он
I
н-с-он
I
но-с-н
I
н-с-он
I
н-с-он
I
вторая
-
за
счет
«нижней»
сно
сно
I
н-с-он
I
но-с-н
I
н-с-он
I
н-с-он
I
101
~
снрн
I
I
но-с-н
I
н-с-он
I
но-с-н
I
но-с-н
11
сн 2 о.н
сн 2 он
D·сорfiит
группы
L'I)'JЮ:IИ
D·ГЛЮКО:<II
При энзиматическом окислении можно окислить определенную груп­
- в этом его преимущество. Так, например, при биологическом окисле­
нии (в присутствии Acetobacter хуиnиm) D-сорбита получается L-сорбоза:
пу
сн 2 он
I
н-с-он
I
но-с-н
I
н-с-он
I
н-с-он
I
сн 2 он
I
I
но-с-н
I
н-с-он
I
Н-С=О
I
н-с-он
~
сн 2 он
сн 2 он
D'сорfiит
3.
L·сорfiО:iИ
Оксинитрильным синтезом (см. ниже, с.
555 ).
Физические и химические свойства
Моносахариды - кристаллические вещества, хорошо растворимые
в воде, большей 'Iастью сладкие на вкус. Они оптически активны.
Моносахариды проявляют свойства спиртов, карбонильных соедине­
ний и полуацеталеЙ.
1.
ВосстаНОВJlение сахаров дает многоатомные спирты:
СНО
СН 2 ОН
н
он
НО
н
н
J-I
Н
Н
СН 2 ОН
D-rлюко3а
-
н
НО
н
н
Н
Н
Н
Н
СН 2 ОН
D,сорбит
в качестве восстановителя в этой реакции применяют амальгаму на­
трия, водород в присутствии никеля или хромита меди, а также алюмогид­
рид лития и боргидрид натрия.
* Для удобства сравнения формула окисленного D-сорбита (L-гулозы) повернута на 180'.
553
Из О-глюкозы при восстановлении образуется шеСТliатомный спирт О-сорбит, в то
время как из кетоз образуются два изо мерных спирта; из О-фруктозы - О-сорбит и О-ман­
нит (КОТОРЫЙ также образуется из О-маннозы). Это объясняется тем, что карбонильная
группа при атоме С 2 фруктозы дает новый асимметрический атом С.
Сахарные спирты
-
бесцветные, сладкие вещества; они хорошо кристаЛЛliЗУЮТСЯ,
легко растворяются в воде и трудно в спирте. Названия их образуют от названий соответству­
ющих углеводов, заменяя окончание -о,за на -ит (тривиальная номенклатура).
В природе, например, из тетритов встречается неактивный эритрит, из пентитов Pliбlп(адонит), из гекситов - О-маннит,дульцит, О-сорбит и IIДИТ,liЗ гептитов - персенит и
волемит. Сорбит является исходным продуктом при синтезе L-аскорбиновой кислоты (вита­
мин С). Он заменяет сахар больным диабетом.
На основе сорбита получаются синтетичеСI<ие моющие средства шпоны и змульгато­
ры - mllllHhl. Дnя приготовления этих материалов сорбит дегидратируется в так называе­
мый сор6ид, который в результате этерификации жирными кислотами дает шпоны. При де­
H0L:L:l
гидратации шпонов с полиэтилен гликолем получаются твины:
O~
Динитрат сорбита
нuтр()сорбu(),
-
ОН
или u;ю()иниm, -
наиболее распространенное
сердечное средство, расширяющее коронарные сосуды сердца.
2.
Окисление сахаров дает полигидроксикислоты (альдОНО8ые или
сахарные ):
СНО
Н
ОН
НО
..
Н
ОН
н
ОН
Н
ОН
Br2+H20 Н
н
н
СООН
СООН
(mrO)
н
C~OH
D-rлlOlt038
Н
Н
----[о]
НNО з
СН 2 ОН
r.lllO&0808I1 кислота
Н
Н
Н
Н
Н
Н
Н
СООН
сахариа8Хl1C.llOТA
Окисление сахаров проводят, применяя мягко действующие окислите­
ли, например бромную воду. Образующийся галогеноводород связывают
карбонатом кальция или бария.
Наилучшими окислителями являются тетраоксид рутения RhO~ с периодатом натрия
а также комплекс триоксида хрома с бliПИРИДИНОМ.
В кислых растворах образовавшиеся альдоновые кислоты превращаются в соответству­
Nal04'
ющие лактоны, например О-глюкоза - в y-лаl<ТОН О-глюконовой кислоты.
Альдоновые кислоты способны к образованию не только у-лактонового кольца
(l.4-цикл), но и б-лактонового кольца (l,5-цикл).
В ОТЛИ'lие от сахаров, у которых наиболее стабилен l,5-цикл, у альдоновых кислот более
устой'швым является l,4-лактон. Обычно из альдоновых кислот образуются у-лактоны и
только при особых,условиях б-лактоны.
Сильными окислительными средствами пеРВltчная спиртовая группа гексоновой кислоты
ОКltсляется в карбоксильную группу. При этом получается двухосновная сахарная (альдаро­
вая ) Кllслота с тем же числом атомов С, что и монокарбоновая кислота. ОБЫ'IНО дПЯ такого
окислеНltя ПРltменяют азотную кислоту.
В случае кетоз углеродная цепь разрушается по месту карбонильной группы с образова­
HlieM двухосновной кислоты. Двухосновные сахарные кислоты легко переходит в лактонЫ.
При благоприятном пространственном расположении образуются также днлактоны. Так,
слизевая (галактаровая) Кltслота, полученная IIЗ О-галактозы, лактонизируется с трудом.
О-сахарная (глюкаровая) кислота, полученная из О-глюкозы, образует преимущественио
554
монолактон, в то время как D-манносахарная (маннаровая) I<ИСJlOта (из D-маннозы) леГl<О
переходит в дилактон:
соон
Н
н+он
он
но
н
но
н
н
соон
r+
соон
rлиаеаа_
OH
I H--tОН
L-C=O
он
3,6-JWtТOН D-сахаркоА
lUICIIora
jIlIJI8lt_
М8Нкcк:aapвoilltllC..."...
IUICJI01'W
При восстановленин сахарных кислот первой восстанавливается та карбоксильная груп­
па, которая легче лактонизируется. При этом могут образоваться альдегидокарбоновые кис­
лоты - УРОНОО"l.е кислоты. Так, при восстановлении монолактона сахарной кислоты
амальгамой натрия в кислом растворе образуется D-глюкуроновая кислота.
3.
ОКСИНИТРИJlЬНЫЙ
синтез.
Синильная
кислота
присоеДИflяется
к карбонильной группе сахаров с образованием двух диастереомерных
гидроксинитрилов, отличающихся конфигурацией у первого атома углеро­
да, Рядом представлеННblХ на схеме реакций (омыление гидроксинитрила
в гидроксикислоту. образование лактона и восстановление последнего)
оба гидроксинитрила могут быть превращены в две диастереомерные геп­
тозы. Переход на схеме подробно показан только для оксинитрила
CN
соон
н-с-он
н
он
он
н
он
I
н
но
СНО
Н
но
Н
он
но
Н
ОН
Н -H~ НО
О
Н
ОН
н
ОН
HI~--~
н
он
н
ОН
Н
снаон
н
он
-
С
H=~
н
Н
н
н
О
1:
он
снаон
снаон
д-nактон
+HCN
!80сстано
... евне
CN
снаон
но
Н
Н
ОН
но
н
Н
Н
но
н
он
н
н
н
он
н
он
СН 2ОН
11
СН 2 ОН
D-геПТОЭ8
555
Синтезы с помощью
метод определения конфигурации и метод
HCN -
получения высших сахаров из низших.
Реакция с гидроксиламином. Сахара легко образуют оксимы. Де­
4.
гидратацией оксимов могут быть получены гидроксинитрилы, которые
при отщеплении
HCN
влажным оксидом серебра дают оксиальдегиды
с меньшим числом углеродных атомов в цепи.
Реакция с гидроксиламином
метод установления строения углево­
-
дов и перехода от высших сахаров к низшим:
н*он ."'~'". н: p:~:P'
НО$СН:
СНО
но
Н
н
он
н
он
-НаО
H:*CN:
H
Н
ОН
Н
ОН
Н
ОН
Н
ОН
СНаОН
СНаОН
ЛrОН
~
Н
он
НаО
Н
ОН
СНаОН
CНzOH
D-аpl6миou.
ntдp!JlI.синитрм
Реакция с феНИJlгидразином. С помощью этой реакции можно пе­
5.
рейти от альдоз к кетозам:
CH=N-NН-С.Н а
CH=-N-NH-C 6H&
Н
НО
НО
-
Н
Н
ОН
Н
ОН
Н +2NH2-NН-СsНs НО$Н
НО
~~------_.
Н
ОН -(NНЗ +Н2 N -CsНJ
Н
ОН
Н
ОН
Н
ОН
СН 2 ОН
СН 2 ОН
феННЛГНJlразон
мзннозз
I
C=N-NН-С.Н s
Н
Н
+Н20
~
СН 2 ОН
03830Н
-C6HSNH2~(CUS041
СН 2 ОН
СНа
r н; r~:
I
I
.~
H~ ~H
Н
[Н]
~
..
ОН
СН 2ОН
кеТ3ЛЬJlеГНII (озон)
СН 2 ОН
D-фруктоза
НС=Н,
I
С=Н
/Н--С 6 Н,
H~±~H
H=FH
СН 2 ОН
фенилоэотриазол
Эпимеры - манноза, глюкоза, а также фруктоза дают один и тот же
озазон. При окислении озазонов. например сульфатом меди, образуются
хорошо кристаллизующиеся фенилозотриазолы. которые применяются
ДJlя идентификации сахаров.
556
ПРII взаимодействии моносахаридов с фенилгидразином последующие ВТОРИ'IНО-СШIРТО­
вые группировки не затрагиваются вследствие образования водородных связей (формула
1):
С,н,
I
I
N-N
,
Н
СН
\
I
N=C
C,Hs-N(
fHCHOHCHOHCH20H
н---о
I
Н
Если вместо фенилгидразина взять N-меТllлфенилгидразин, т. е. замеСТIIТЬ водород при
азоте. образующий водородную связь, то в реакцию вступают и все другие спиртовые группи­
РОВI<Н
6.
(Il).
Действие щелочей приводит к изомеризации моноз в смесь саха­
ров, отличающихся строением или конфигурацией первого и второго ато­
мов углерода. Так, из глюкозы, маннозы или фруктозы получается равно­
весная смесь этих трех сахаров:
сно
Н
Н
он
н
н
он
н
он
сн-он
СН 2-ОН
~HO !-~Н~HO 10~
Н
он
н
н
н
он
н
н
сн 2 он
сн 2 он
и
глюкоза
сн 2 он
фруктоза
но
но
н
но
н
н
н
н
н
СН 2 ОН
манноза
Причина изомеризации глюкозы при действии щелочей
-
образова­
ние енола, который является общим для глюкозы, маннозы и фруктозы.
Щелочь способствует енолизации.
557
При действии на глюкозу пиридина можно получить фруктозу с хоро­
шим выходом (с. Н. Данилов, э. Д. Данилова). Подобные превращения
происходят в организмах при действии специальных энзимов.
7. Реакция алкилирования. При алкилировании сахара реагируют
в полуацетальной (цикличекой) таутомерной форме:
6CSH20H
~
Н
4
он
но
3
Н
Н
..
(HCI)
он
2
Н
снзон
I
н
он
он
меТI\ЛГЛlOКО3ИД
~cн,oc~ (::~~~:~( ~H'OC~_
_
ОСНз Н
снзо
осн з
н+
осн з Н
снзо
осн з
Н
он
осн з
Н
тетраметИЛ-Q-ГЛЮКОЭ8
пеитамеТИЛ-Q-Г люкоэа
~*~~H
снзо
Н
Н
осн з
тетраметнл-~ -глюкоза
8.
Реакция ацетилирования. При действии на глюкозу уксусного ан-
гидрида получается пентаацетилгюкоза:
~
CHH20H О
он
Н
C~OCOC~
5(СНзСО)20
н"
НО
он
Н
+ 5СН зСО ОН
снзсо
он
ососн з
9. Дегидра~ация с циклизацией. При нагревании с разбавленной
H2S0 4 пентозы дают фурфурол, гекозы - оксиметилфурфурол:
но-сн--сн-он
а)
и}
I
I
НС-СН
11+
11
11
н-с-н С-Н ~ НС С
I НО/"СНО -:IIIP
"<{'сно
он
IIСIIТО:iИ
558
ФУРфУIЮJI
но-сн
б) б)
I
- - сн-он·
с
I
с-н
нон 2 с/'он но/""-сно
нс-сн
""
нс
-----+-
НОН 2 С
С
/""-О/""-сно
a.-ОКСIIМСТИJlфурфуРОJI
ГСКСШ43
в отличие от фурфурола а-оксиметилфурфурол нестоек и легко гидро­
лизуется до левулиновой кислоты:
Hc----сН
сн 2он-с,
/-с=о ~
11
11
н
I
но
о
f
СН'-СН 2
I
сн 2он-с
11
О
Н
J
с' ~=o
1
11:
О
-НСООН
•
I
I
Н--+-ОН
I
~CH2-CO-CH2-CH2-CHO
.. СН з-СQ-cн 2-сн,-соон
I
neperpynон
пирово
Эта реакция позволяет легко отличить гексозы от пентоз.
10.
Брожение сахаров. Брожением называют расщепление молекул
сахаров с выделением углекислоты под влиянием ферментов (ЭНЗШlОВ).
Брожению подвергаются сахара с числом углеродных атомов, кратным
трем.
Известно много видов брожения. Наиболее известный вид
вое брожение
-
-
спирто­
происходит под влиянием фермента дрожжей зимазы:
C,jH I20fj зИма:'1I ) 2С"Н"ОН
+ 2С0 2 ·
При ацетоно-бутаноловом брожении образуются ацетон и бутило­
вый спирт. Известны лимоннокислое брожение (используется д.lIЯ полу­
чения лимонной кислоты), маслянокислое и другие виды брожения.
Одним из промежуточных продуктов при спиртовом брожении явля­
ется фосфат глицеринового альдегида. За счет превращения его в пирови­
ноградную кислоту и получается спирт (схема 10). Но эту реакцию можно
прекратить добавлением медных солей или других веществ и получить из
сахара глицерин. Большую роль в спиртовом брожении играет фосфорная
кислота.
Генетический ряд сахаров. Родоначальниками ряда сахаров ЯВЛЯЮТСЯ
правый и левый глицериновые альдегиды. От О(
+ )-глицеринового альде­
гида производится D-ряд сахаров.
Каждое вещество в этом ряду, начиная от глицеринового альдегида,
при введении еще одного углеродного атома, например присоединением
Н CN, может дать два диастереомерных сахара (схема
11).
559
с11
8
схем а
10.
Механизм спиртового брожения (упрощенная схема)
г-- О --,
HO(H 2........ ch-( снон )з-(нон
глюкоза
г-- О --,
t
изомеризация
(гlO)РРО-СН 2 -СН -(СIЮI-I)з-СНОН
..
..
г-- О --,
(ОН)20РОСН2-СН-(СНОIЛ1-СОН-СН20Н
б-фосфат глюкозы
б-фосфат фруктозы
I
I
t
г-- О --,
(HO)20PO-СН2-СН-(СIЮН~1-СОН-(Н20РО(ОЩl
I,б-дифосфат фруктозы
I
+
(/Ю)20РО-(Н2-СНОН-СНО
!окислеllие
--f
.... HOCH2-CO-CH 2 0PO(OII)2
{3-фосфаг ГЛЮIОРИf(ОВОГО алt.1егида
фосфат ДИОКСИЯ(lстона
ОРО(ОН)2
OPO(OII).,
(JiО~10РО-СII2 -снон-соон
нзомеРИЗЯI1ИЯ
I
I
..
изомеризация
HOCI-l 2 -СН-СООН
l3-фосфат глицерино"оА кислоты
-НzО
фосфат IIИРОRИIЮ'
градllОН кислоты
а,фосфят глицериновой
КИСЛОТЫ
-
СН2=Т-СООН
он
.... ([l з-СО-СОOlI --:--- СНэСНО
-<':0,
f(ирооиноградН8Я"
кислота
С,н,о,-ОРО(ОН),
уксусный
I
сн 2 =с-соон
..
СН з -СII 2 ОН
+
спирт
аЛI..дегид
+
mO)20POC[-12-СНО[-[-СООН
l3-фосфат глицериновой кисло,,"
гидролиз
-''з РО ,
с х е м 11
11. Генетический D-ряд сахаров
сно
н+он
СН,ОН
D-глицерино ... "
альдеГИА (TpCOJ3)
H.r:H
~
_______
СНО
H~*H
Нт ОН
:р( ~ r:'·"· '(""'~~;t;H/
СН,ОН
н
ОН
СН,ОН
н
СН,ОН
D-рибо].
D-
HfCH~H~fCH:
сн"он
араБМНОЭI
Н
Н
ОН
Н
Н
Н
ОН
Н
ОН
Н
Н
НО
Н
ОН
Н
ОН
Н
~
Н
~
Н
СН,ОН
СН.ОН
D-ГЛlOкоза
СН,ОН
D-маиноз.
Н
~
,
ОН
D-ЛНКС:О31
"'"
НО
Н
Н
СН,ОН
Н
Сн,ОН
H~fCH:H :~~CH: :fCH;: H~fCH~H
Н
сн.оН
/
НО
Н
СН,ОН
D·ксиnоз&
neн~озw
СНО
НО$Н
HfOH
ОН
/' "
~
~
СН,ОН
/"
HfCH:H Ho~CII:
ноннон
но
Н
Н
он
НО
н
СН,ОН
Н
н
сн,он
D-галаК1'оэа
гесСо].,
ОтделЬНblе представители
ПеНТОЗbl_ Арабuноза
н
н
н
НО
н
НО
н
HO~?он
он
он
н
н
Ц+)-арабиноэа
н
н
он
.. -
Ц+)-арабиКОЭ8
в природе встречаются преимущественно L( + )-арабиноза (в вишне­
вом клее, свекле, аравийской камеди).
19
Зах.
181
561
При восстановлении арабинозы получается м!{огоатомный спирт ара­
бит (встречается в лишайнике), при окислении
СН Н
НО$
2:
-
арабон.овая кислота:
НО$СО:Н
н
ОН
н
Н
н
ОН
Н
ОН
СН 2 ОН
СН 2 ОН
O-ара60НОlа. кислота
D-ар.а6ит
КсиJtоза:
СНО
Н
I
Н
ОН
НО
Н
Н
ОН
Н2ОН
~
ОН
НО
Н
НО
Н
ОН
ОН
Н
"
D(+)-оtСIUlО38
-DI+)-Jtсилопир.аноэа
в природе распространена Ь( + )-ксилоза. Полисахарид ксилан содер­
жится в соломе, отрубях, древесине, шелухе подсолнечника. При гидроли­
зе дает ксилозу.
При восстановлении ксилозы получается спирт ксилит, при окисле­
нии
-
ксилоновая кислота:
СООН
:$: $"
НО
н
н
н
СН 2 ОН
СНаОН
ItCIUIOIlO88.
ItCИJlIIТ
ItИCJIar8
Рибоза:
5
Н
ОН
н
ОН
Н
ОН
"O".~
4
Н
3
Н
н
Н
I
2
Н
Н
СНаОН
он
" -DН-рибофураноэа
(с.
" -DI-)-рвбonиран038
Рибоза играет большую биологическую роль. В виде нуклеозидов
576) она входит в состав клеточных ядер. При восстановлении дает
562
недеятельный спирт рибит (i-адонит), при окислении
-
рибоновую
кислоту:
f= :t"
СО он
Н
ОН
Н
ОН
Н
ОН
ОН
СН 2 ОН
СН 2 ОН
рибоно... кнслота
риБИ't
Гексозы. Глюкоза, или виноградный сахар О(
+ )-глюкоза,
очень ши­
роко распространена в природе, она содержится в соке виногдада и других
сладких плодов.
Причина наибольшей среди сахаров распространенности ГЛЮКОЗbl
в энергетической стабильности ее конформации: все объеМИСТblе группы
в ее молекуле занимают экваториальное положение:
..
р -D-г lO~о,,
у всех остальных гексоз хотя бы одна объемистая группа находится
в аксиальном положении.
Из остатков глюкозы построены важнейшие полисахариды
-
гексо­
заны (клетчатка и крахмал).
Глюкоза -
кристаллическое веществ, сладкое на вкус (2/3 сладости
тростникового сахара). При восстановлении дает спирт - сорбит, при
окислении - глюконовую кислоту (см. выше).
Источником получения ГЛЮКОЗbl является крахмал или клеТ'18тка. При­
меняется глюкоза в пищевой промышленности как дешеВblЙ заменитель
тростникового сахара, в ряде производств
-
как восстановитель, а также
в медицине. Из глюкозы получают витамин С:
СН2ОН
СНО
Н
Н
Н
Н
ОН
н
ОН
Н
он
СН 2 ОН
D-г"IOК038
..
lосставов- НО
Jlеиие
ОН
Н
Н
ОН
н
ОН
сИtОН
D-<орбвт
[о]
..
(зваиы.ти'!еское)
Н
~~=
Н
Н
ОН
ок"Сnение
(nocJle
..
защиты
ОН-группы)
со
I
СН 2 ОН
L-copбoaa
563
СН 2 ОН
СН 2 ОН
I
н-с-он
I
НО-С-Н
I
н-с-он
I
С=О
I
--
сн 2он
I
н-с-он
I
с
г: I -н
лакrонн-
~
заu.ия
-
н-с-он
I
О
~
L!
соон
I
н-с-он
г tЬ-он
-н
О
11
L?-OH
с=о
аскорбннова. кислorа
(вит."ин с)
МИННО:IU:
сна
НО
~
н
н
но
Н
ОН
Н
ОН
~H НО
НО
Н
СН 2ОН
НО
ОН
Н
D(+)-....ННоза
ОН
tL-D(+)-маllнопираноза
МаННОЗII сравнительно мало
pllcnpoCTpaHeHa в прнроде. содержнтся в ячмене. корке
апельсина. Получается из полисахарида маннана ГltДролизом. При восстановлеНIIИ дает
СПIlРТ
."UHH/lm.
при ОКllслеНlIИ
-
.IIЦННОНОllУЮ кислоту:
СН 2ОН
НО
НО
СООН
Н
Н
Н
Н
НО
Н
ОН
ОН
Н
Н
ОН
Н
ОН
СН 2ОН
СН 2 ОН
D-маНl\оиоваl
D"маИНIIТ
киа.ота
D-МаННIIТ распространен в ПРllроде (содержится в грибах. маслинах и Т. д.).
ruл.аКIIЮ;IlI:
СНА
Н
ОН
НО
Н
НО
Н
Н
ОН
H~:H20Hoн
ОН
564
н
ОН
н
н
D (+) -rалактоза
ОН
ОН
Q.
·О(+) -галаКТОПИPlноза·
D-Галактоза может быть получена гидролизом МОЛО'IНОГО сахара. ПРI1 BOCCTaHOВJIeHlI1I
дает недеятельный спирт кuслоту
-
rJУЛhЦUI1!. npl1 окислении галаКI1!ОНlЮУЮ, а затем СЛU:lеllУЮ
вещеL'ТВО, плохо растворяющееся в воде:
СН 2 ОН
Н
соон
Н
но
н
но
н
н
н
но
н
он
н
н
он
СН 2 ОН
СООН
аульцкт
СЛИ3Сll31
кислота
Фрукmо:lU:
СН 2 ОН
I
~
H
H~f:H
О ОН
HOH2~Oон
Н
Н
Н+ОН
но
н
СН 2 ОН
он
СН 2 ОН
D-(-)-фрУКТО'8
н
но
НО
СН 2 ОН
он
Н
"-D(-)-ФРУkтопираНQ,а
Н
Р -D(-I-фруктофураноэа
Фруктоза входит в состав сока многнх плодов, а также меда. Она в три разя слltще трост­
никового сахара.
Следует отметить, 'по в природе встре"аются пентозы и гексозыи с разветвленной угле­
родной цепью. Так, например, в петрушке содержится аncю:IU, в состав антибиотика стреп­
ТОМlщина входит сmрептО:Il!:
СНОН
2
"СОН-СНОН-СНО
СНРН/
СН -СНОН-СОН-СНОН-СНО
.1
I
СНО
ИllliШ4И
lOТPCIIT(!:i8
Встречаются также сахара с меньшим 'тслом гидроксильных групп. так называемые
дезоксисахltра. Примером дезоксисахаров может служить 2-деЗОКСII-D-рибоза - соСТявная
'lacTb дезоксирибонуклеиновых ЮIСЛОТ, имеЮЩI1Х большое бllOJIOГИ'lеское ЗШl'lенне (гл. 34):
СНО
I
H+~H
HO-~C2ОН
Нт ОН
Н
Н
Н
СН 2 ОН
Н
ОН
Н
Помимо широко раСПРОСТРЯllенных пеlПОЗ
i!Льдозы
11 геl<СОЗ в природе раСПРОСТjllll1ены 11 высшие
11 кетозы с 7. 8, 911 11 атомами углерода в молекуле. Так, напрнмер, в СDСПlвлистьев
всех зеленых растеНllЙ входит (и участвует в фотосинтезе) D-ltльтрогеПТУЛОЗIt. Многие выс­
ШJ1е альдозы входят в состав ПОЛflсахар"дов грамотрнцательных
6aKTepflli; "екоторь,е IIХ
flредстаВlIтели выделены 11З ТРОПlI',еСЮIХ растений.
565
Аминосахара. ВажнеЙШIfМИ распространенными в природе производными сахаров явля­
ются aMliHocaxapa. Наиболее распространены О-глюкозамин If