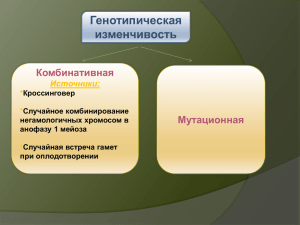
ТЕМА 1. ВВЕДЕНИЕ В ГЕНЕТИКУ ПРЕДМЕТ, ОБЪЕКТЫ И ЗАДАЧИ ГЕНЕТИКИ Лектор: ст.п. Мамедова М. З. 1. Генетика – наука о наследственности и изменчивости. Предмет, объекты и задачи генетики 2. Генетическая информация; еѐ свойства 3. Основные типы наследования признаков 4. Разделы генетики. Генетика – фундамент современной биологии 5. Методы генетики 6. Краткая история генетики. 1. Генетика – наука о наследственности и изменчивости. Способность к воспроизведению с изменением – это одно из основных свойств биологических систем. Принцип Франческо Реди – «подобное порождает подобное» – проявляется на всех уровнях организации жизни: – на молекулярном уровне молекулы ДНК воспроизводят сами себя; – на клеточном уровне любая клетка происходит от клетки; – на онтогенетическом (организменном) уровне организмы порождают подобные себе организмы; – на популяционно-видовом уровне популяции каждого вида воспроизводят себя и дают начало популяциям того же вида; – на биогеоценотическом (экосистемном) уровне биогеоценозы (устойчивые экосистемы) – воспроизводят подобные биогеоценозы; – на биосферном уровне биосфера Земли воспроизводит себя в течение миллиардов лет. Генетика – это наука о наследственности и изменчивости живых организмов и методах управления ими; это наука, изучающая наследственность и изменчивость признаков. Наследственность – способность организмов порождать себе подобных; свойство организмов передавать свои признаки и качества из поколения в поколение; свойство организмов обеспечивать материальную и функциональную преемственность между поколениями. Изменчивость – появление различий между организмами (частями организма или группами организмов) по отдельным признакам; это существование признаков в различных формах (вариантах). Понятия «наследственность» и «изменчивость» неразрывно связаны между собой. Изменчивость – это… 1) существование признаков в различных формах (вариантах); 2) появление различий между организмами (частями организма или группами организмов) по отдельным признакам. Существуют мономорфные и полиморфные признаки. Мономорфные признаки в норме представлены одним вариантом (например, у наземных позвоночных животных в норме одна голова, две пары передних и две пары задних конечностей, а на каждой конечности имеется по пять пальцев). Отклонение от нормального варианта – это аномалия или даже уродство. Полиморфные признаки в норме представлены двумя и более вариантами. Например, люди различаются по цвету глаз (карие, голубые и множество оттенков), цвету волос (черные, каштановые, русые, рыжие, светлые и множество оттенков), группам крови системы АВ0 (0, А, В, АВ)... Однако из множества вариантов полиморфного признака не всегда удается выделить «нормальный» (попробуйте доказать, что II группа крови – это норма, а III – аномалия!). Наследственность – это… 1) способность организмов порождать себе подобных; 2) способность организмов передавать (наследовать) свои признаки и качества из поколения в поколение; 3) сохранение определенных вариантов признаков при смене поколений. 2. Генетическая информация; еѐ свойства Что же позволяет биологическим системам воспроизводить подобные системы? Очевидно – наличие некоторой информации. Информация – это идеальное (нематериальное) понятие, то есть информация не обладает ни массой, ни энергией. Однако всегда существуют материальные носители информации: речь (звуки), бумага, CD-диски... Существует множество подходов к определению понятия «информация». Мы будем рассматривать информацию как некоторую программу, при выполнении которой можно получить определенный результат. В биологии информация, которая сохраняется при смене множества поколений (то есть наследуется), называется генетической информацией (от греч. genesis, geneticos – происхождение; от лат. genus – род). Однако не любая наследственная информация является генетической. Негенетическая (парагенетическая, эпигенетическая) информация – это информация, благодаря которой подобное воспроизводит подобное, но, как правило, это подобие детерминировано факторами внешней среды или эффектом материнского организма. Механизмы передачи негенетической информации из поколения в поколение исключительно разнообразны, и мы их пока рассматривать не будем. Генетическая информация – это такая наследственная информация, носителем которой является ДНК (у части вирусов – РНК). ДНК – это химическое вещество, которое входит в состав хромосом – окрашенных структур, которые возникают на месте ядра при делении клетки. Минимальный набор хромосом и одновременно минимальный объем ДНК определенного биологического вида называется геномом (имен. падеж, ед. число – геном). Участок ДНК, который несет информацию о некотором элементарном признаке – фене (имен. падеж, ед. число – фен), называется геном (имен. падеж, ед. число – ген). Многие гены могут существовать в виде двух и более вариантов – аллелей. Например, у мышей ген А, определяющий общую окраску тела, представлен аллелями: AY – желтая окраска, AL – окраска агути («серые») со светлым брюхом, A – агути, «серые», норма, at – черная с подпалинами, a – черная, нон-агути. Совокупность всех генов (точнее, аллелей) определенного организма называется генотипом (имен. падеж, ед. число – генотип). Генетическая информация обладает рядом важных свойств: – дискретность (существование элементарных единиц информации – генов, входящих в состав хромосом); – устойчивость (сохранение); – самовоспроизведение (репликация ДНК, копирование); – реализация (выполнение программы с получением некоторого результата); – передача из поколения в поколение; – комбинирование дискретных единиц информации (генов, хромосом); – изменение (мутирование) – появление новых генов и хромосом. Основное свойство генетической информации – это отсутствие прямого влияния результатов еѐ реализации на исходную информацию. В системах, созданных человеком (в технике, экономике…) информация изменяется осознанно, на основе обратной связи между исходной информацией и результатами еѐ реализации. Генетическая информация изменяется случайным образом: за счет мутаций и рекомбинаций. Прямого влияния результатов реализации информации на исходную информацию не существует. Сохранение и передача измененной информации осуществляется путем отбора (естественного или искусственного) по результатам еѐ реализации. 3. Основные типы наследования признаков Существует множество типов наследования признаков: прямое, непрямое и сложное. Прямое наследование, при котором варианты признаков сохраняются в неизменном виде из поколения в поколение – это самый простой тип наследования признаков. Прямое наследование часто наблюдается у растений, которые размножаются вегетативным путем или образуют семена при самоопылении, реже – при размножении животных (в пределах одной породы) или перекрестном опылении у растений (в пределах одного сорта или линии). – Прямое наследование при вегетативном размножении растений Пример 1. Розы сорта «Чайнэтаун» характеризуется ярко-желтыми цветками. При вегетативном размножении из черенков этого сорта всегда вырастают растения с ярко-желтыми цветками. Пример 2. Некоторые сорта ивы плакучей характеризуются ярко-желтыми побегами. При вегетативном размножении из черенков этих сортов всегда вырастают деревья с плакучей кроной и ярко-желтыми побегами. – Прямое наследование при самоопылении у растений Пример 1. Сорта гороха с зелеными семенами и белыми цветками при самоопылении всегда дают в своем потомстве зеленые горошины, из которых вырастают растения с белыми цветками. Пример 2. Сорта томатов с желтыми продолговатыми плодами при самоопылении всегда образуют семена, из которых вырастают растения с желтыми продолговатыми плодами. – Прямое наследование при размножении чистопородных животных и перекрестном опылении чистосортных растений Пример 1. При скрещивании чистопородных коров и быков черно-пестрой породы все их потомки характеризуются черно-пестрой мастью. Пример 2. При перекрестном опылении чистосортных растений томатов с красными шаровидными плодами всегда образуются семена, из которых вырастают растения с красными шаровидными плодами. Непрямое наследование – это более сложный тип наследования, который наблюдается при размножении животных и семенном размножении у растений (которое по сути также является половым). Для изучения непрямого наследования необходима гибридизация – скрещивание организмов, различающихся по генотипу. При непрямом наследовании некоторые варианты признаков проявляются в каждом поколении (такие признаки называются доминантными, «господствующими»), а другие варианты могут временно «исчезать», а затем проявляться в последующих поколениях (такие признаки называются рецессивными, «отступающими»). Пример 1. Древний Китай – родина декоративных золотых рыбок с разнообразной окраской, длиной плавников и формой тела. Золотые рыбки (а также карпы) – удобный объект для демонстрации скрещивания: у них наружное оплодотворение, и гаметы (икра и молоки) видны непосредственно. Тысячи лет назад было замечено, что в потомстве тускло окрашенных рыбок могут появляться особи с золотистой, оранжевой, черной и пѐстрой окраской. При скрещивании тускло и ярко окрашенных особей между собой в некоторых случаях все их потомство имело тусклую окраску – это доминантный признак. Однако при скрещивании этих потомков между собой в последующих поколениях вновь появлялись особи с ранее «исчезнувшими» рецессивными признаками. Пример 2. В средневековой Японии были популярны декоративные мыши с необычной окраской: белые, желтые, черные, пятнистые. При скрещивании между собой белых и черных мышей в некоторых случаях все их потомки были черными (рецессивная белая окраска проявлялась только в последующих поколениях), а в других случаях – белыми (теперь черная окраска была рецессивной). Только в XX веке было доказано, что в разных случаях белая окраска определялась разными генами. Пример 3. При скрещивании многих декоративных растений (львиного зева, ночной красавицы) с красными и белыми цветками из гибридных семян вырастают растения с промежуточной розовой окраской. Однако при скрещивании этих розово-цветковых гибридных растений между собой в их потомстве появляются растения и с красными, и с белыми, и с розовыми цветками. Сложные типы наследования признаков потому и называются сложными, что заранее предсказать появление новых вариантов признаков очень трудно. В некоторых случаях «внезапно» возникают новые варианты признаков, которых не было ни у родителей, ни у бабушек–дедушек, ни у тетушек–дядюшек. Иногда такое «внезапное» появление признаков совершенно необоснованно называют мутацией. Пример 1. Аквариумные рыбки меченосцы (и близкая к меченосцам группа – пецилии) характеризуются разнообразной окраской: зеленоватосерой, темно-красной (кирпичной), ярко-красной (алой), лимонной (светложелтой), пятнистой (тигровой и ситцевой). Эти рыбки – удобный объект для демонстрации скрещивания, поскольку у них внутреннее оплодотворение, а самки рождают живых мальков. При скрещивании чистопородных алых самок с чистопородными темно-красными самцами всегда получаются зеленовато-серые гибриды. Однако при скрещивании этих гибридов между собой в их потомстве появляются особи с самой разнообразной окраской, в том числе, и лимонно-желтой, которой не было у всех известных предков. Пример 2. Многие пищевые (плодовые, ягодные) и декоративные растения размножают вегетативным путем. При этом на протяжении десятков лет каждый сорт сохраняет свои особенности. Если же собрать семена с такого растения и посеять их, то из этих семян вырастут растения с самыми фантастическими сочетаниями признаков. 4. Разделы генетики. Генетика – фундамент современной биологии Структура современной генетики Вся генетика (как и любая наука) подразделяется на фундаментальную и прикладную. Фундаментальная генетика изучает общие закономерности наследования признаков у лабораторных, или модельных видов: вирусов (например, Т-чѐтных фагов), прокариот (например, кишечной палочки), плесневых и дрожжевых грибов, дрозофилы, мышей и некоторых других. К фундаментальной генетике относятся следующие разделы: – классическая (формальная) генетика, – цитогенетика, – молекулярная генетика (в т.ч., генетика ферментов и иммуногенетика), – генетика мутагенеза (в т. ч., радиационная и химическая генетика), – эволюционная генетика, – геномика и эпигеномика, – генетика индивидуального развития и эпигенетика, – генетика поведения, – генетика популяций, – экологическая генетика (в т.ч., генетическая токсикология), – математическая генетика. Прикладная генетика разрабатывает рекомендации для применения генетических знаний в селекции, генной инженерии и других разделах биотехнологии, в деле охраны природы. Идеи и методы генетики находят применение во всех областях человеческой деятельности, связанной с живыми организмами. Они имеют важное значение для решения проблем медицины, сельского хозяйства, микробиологической промышленности. Генетическая (генная) инженерия – это раздел молекулярной генетики, связанный с целенаправленным созданием in vitro новых комбинаций генетического материала, способного размножаться в клетке-хозяине и синтезировать конечные продукты обмена. Генная инженерия возникла в 1972, когда в лаборатории П. Берга (Станфордский ун-т, США) была получена первая рекомбинантная (гибридная) ДНК (рекДНК), в которой были соединены фрагменты ДНК фага лямбда и кишечной палочки с кольцевой ДНК обезьяньего вируса SV40. В прикладной генетике в зависимости от объекта исследования выделяют следующие разделы частной генетики: 1. Генетика растений: дикорастущих и культурных: (пшеница, рожь, ячмень, кукуруза; яблони, груши, сливы, абрикосы – всего около 150 видов). 2. Генетика животных: диких и домашних животных (коров, лошадей, свиней, овец, кур – всего около 20 видов) 3. Генетика микроорганизмов (вирусов, прокариот, низших эукариот – десятки видов). В особый раздел частной генетики выделяется генетика человека (существует специальный Институт медицинской генетики АМН России) Генетика человека изучает особенности наследования признаков у человека, наследственные заболевания (медицинская генетика), генетическую структуру популяций человека. Генетика человека является теоретической основой современной медицины и современного здравоохранения (СПИД, Чернобыль). Известно несколько тысяч собственно генетических заболеваний, которые почти на 100% зависят от генотипа особи. К наиболее страшным из них относятся: кислотный фиброз поджелудочной железы, фенилкетонурия, галактоземия, различные формы кретинизма, гемоглобинопатии, а также синдромы Дауна, Тернера, Кляйнфельтера. Кроме того, существуют заболевания, которые зависят и от генотипа, и от среды: ишемическая болезнь, сахарный диабет, ревматоидные заболевания, язвенные болезни желудка и двенадцатиперстной кишки, многие онкологические заболевания, шизофрения и другие заболевания психики. Задачи медицинской генетики заключаются в своевременном выявлении носителей этих заболеваний среди родителей, выявлении больных детей и выработке рекомендаций по их лечению. Большую роль в профилактике генетически обусловленных заболеваний играют генетико-медицинские консультации и пренатальная диагностика (то есть выявление заболеваний на ранних стадиях развития организма). Существуют специальные разделы прикладной генетики человека (экологическая генетика, фармакогенетика, генетическая токсикология), изучающие генетические основы здравоохранения. При разработке лекарственных препаратов, при изучении реакции организма на воздействие неблагоприятных факторов необходимо учитывать как индивидуальные особенности людей, так и особенности человеческих популяций. 5. Методы генетики Совокупность методов исследования наследственных свойств организма (его генотипа) называется генетический анализ. В зависимости от задачи и особенностей изучаемого объекта генетический анализ проводят на популяционном, организменном, клеточном и молекулярном уровнях. Основу генетического анализа составляет гибридологический анализ, основанный на анализе наследования признаков при скрещиваниях. Гибридологический анализ, основы которого разработал основатель современной генетики Г. Мендель, основан на следующих принципах: 1. Использование в качестве исходных особей (родителей), форм, не дающих расщепления при скрещивании, т.е. константных форм. 2. Анализ наследования отдельных пар альтернативных признаков, то есть признаков, представленных двумя взаимоисключающими вариантами. 3. Количественный учет форм, выщепляющихся в ходе последовательных скрещиваний и использование математических методов при обработке результатов. 4. Индивидуальный анализ потомства от каждой родительской особи. 5. На основании результатов скрещивания составляется и анализируется схема скрещиваний. Гибридологическому анализу обычно предшествует селекционный метод. С его помощью осуществляют подбор или создание исходного материала, подвергающегося дальнейшему анализу (например, Г. Мендель, который по существу является основоположником генетического анализа, начинал свою работу с получения константных – гомозиготных – форм гороха путѐм самоопыления); Однако в некоторых случаях метод прямого гибридологического анализа оказывается неприменим. Например, при изучении наследования признаков у человека необходимо учитывать ряд обстоятельств: невозможность планирования скрещиваний, низкая плодовитость, длительный период полового созревания. Поэтому кроме гибридологического анализа, в генетике используется множество других методов. Цитогенетический метод. Заключается в цитологическом анализе генетических структур и явлений на основе гибридологического анализа с целью сопоставления генетических явлений со структурой и поведением хромосом и их участков (анализ хромосомных и геномных мутаций, построение цитологических карт хромосом, цитохимическое изучение активности генов и т. п.). Частные случаи цитогенетического метода – кариологический, кариотипический, геномный анализ. Популяционный метод. На основе популяционного метода изучают генетическую структуру популяций различных организмов: количественно оценивают распределение особей разных генотипов в популяции, анализируют динамику генетической структуры популяций под действием различных факторов (при этом используют создание модельных популяций). Молекулярно-генетический метод представляет собой биохимическое и физико-химическое изучение структуры и функции генетического материала и направлен на выяснение этапов пути «ген → признак» и механизмов взаимодействия различных молекул на этом пути. Мутационный метод позволяет (на основе всестороннего анализа мутаций) установить особенности, закономерности и механизмы мутагенеза, помогает в изучении структуры и функции генов. Особое значение мутационный метод приобретает при работе с организмами, размножающимися бесполым путѐм, и в генетике человека, где возможности гибридологического анализа крайне затруднены. Генеалогический метод (метод анализа родословных). Позволяет проследить наследование признаков в семьях. Используется для определения наследственного или ненаследственного характера признака, доминантности или рецессивности, картирования хромосом, т. е. для установления принадлежности гена, кодирующего данный признак, к определенной группе сцепления, сцепленности с Х- или Y-хромосомами, для изучения мутационного процесса, особенно в случаях, когда необходимо отличить вновь возникшие мутации от тех, которые носят семейный характер, т. е. возникли в предыдущих поколениях. Как правило, генеалогический метод составляет основу для заключений при медико-генетическом консультировании (если речь не идет о хромосомных болезнях). Близнецовый метод, заключающийся в анализе и сравнении изменчивости признаков в пределах различных групп близнецов, позволяет оценить относит, роль генотипа и внешних условий в наблюдаемой изменчивости. Особенно важен этот метод при работе с малоплодовитыми организмами, имеющими поздние сроки наступления половой зрелости (например, крупный рогатый скот), а также в генетике человека. В генетическом анализе используют и многие другие методы: онтогенетический, иммуногенетический, сравнительно-морфологические и сравнительно-биохимические методы, методы биотехнологии, разнообразные математические методы и т. д. 6. Краткая история генетики. Явления наследственности и изменчивости признаков были известны с древнейших времен. Сущность этих явлений была сформулирована в виде эмпирических правил: «Яблочко от яблони недалеко падает», «От худого семени не жди доброго племени», «Не в мать, не в отца, а в прохожего молодца» и т.д. Натурфилософы античного мира пытались объяснить причины сходства и различия между родителями и их потомками, между братьями и сестрами, механизмы определения пола, причины рождения близнецов. Преемственность поколений описывалась терминами «генус» (род), «геннао» (рождаю), «генетикос» (имеющий отношение к происхождению), «генезис» (происхождение). В Новое время в Англии (Т. Найт), Германии (Й. Кѐльрейтер), Франции (О. Сажрэ) были разработаны методики постановки опытов по гибридологическому анализу, были открыты явления доминантности и рецессивности, сформулированы представления об элементарных наследуемых признаках. Однако раскрыть механизмы наследственности и изменчивости долгое время не удавалось. Для объяснения феноменов наследственности и изменчивости использовались концепции наследования благоприобретенных признаков, панспермии, изменчивости признаков под прямым влиянием среды и др. В основу современной генетики легли закономерности наследственности, обнаруженные Г. Менделем при скрещивании различных сортов гороха (1865), а также мутационная теория X. Де Фриза (1901–1903). Однако рождение генетики принято относить к 1900 г., когда X. Де Фриз, К. Корренс и Э. Чермак вторично открыли законы Г. Менделя. В 1906 г. на основании корня «ген» У. Бэтсон (Англия) предложил термин «генетика», а в 1909 г. В.Л. Иоганссен предложил термин «ген». Ещѐ в 1883–1884 гг. В. Ру, О. Гертвиг, Э. Страсбургер, а также А.Вейсман (1885) сформулировали ядерную гипотезу наследственности, которая в начале XX в. переросла в хромосомную теорию наследственности (У. Сеттон, 1902–1903; Т. Бовери, 1902–1907; Т. Морган и его школа). Т. Морганом были заложены и основы теории гена, получившей развитие в трудах отечественных учѐных школы А.С.Серебровского, которые сформулировали в 1929–1931 гг. представления о сложной структуре гена. Эти представления были развиты и конкретизированы в исследованиях по биохимической и молекулярной генетике, которые привели к созданию Дж. Уотсоном и Ф. Криком (1953) модели ДНК, а затем и к расшифровке генетического кода, определяющего синтез белка. Значительную роль в развитии генетики сыграло открытие факторов мутагенеза – ионизирующих излучений (Г. А. Надсон и Г. С. Филиппов, 1925; Г. Мѐллер, 1927) и химических мутагенов (В. В. Сахаров и М.Е.Лобашѐв, 1933–1934). Использование индуцированного мутагенеза способствовало увеличению разрешающей способности генетического анализа и представило селекционерам метод расширения наследств, изменчивости исходного материала. Работами С. Райта, Дж. Б. С. Холдейна и Р. Фишера (20–30-е гг.) были заложены основы генетико-математических методов изучения процессов, происходящих в популяциях. Фундаментальный вклад в генетику популяций внѐс С.С.Четвериков (1926), объединивший в единой концепции закономерности менделизма и дарвинизма. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 2. ЦИТОЛОГИЧЕСКИЕ ОСНОВЫ НАСЛЕДСТВЕННОСТИ. Лектор: ст.п. Мамедова М. З. 1. Строение клетки и функции ее органелл 2. Деление клеток. Митоз. Кариотип 3. Мейоз 1. Строение клетки и функции ее органелл Элементарной структурной и функциональной единицей живого является клетка. Наука, изучающая строение и функции клеток называется цитология (греч. cellula, cytos – оболочка, покров, панцирь). Современные представления о строении и функциях клетки получены с помощью световой, электронной микроскопии и других методов. Характерной особенностью растительной клетки является наличие клеточной стенки, состоящей из целлюлозы, которая окружает и защищает протопласт. Протопласт клетки содержат цитоплазму, ограниченную снаружи плазматической мембраной – плазмалеммой. В цитоплазме находятся органеллы, которые выполняют специфические функции. В световой микроскоп хорошо видны ядро с ядрышками, пластиды, крупные митохондрии, вакуоли и сферосомы. В электронной микроскопии различимы плазмалемма, аппарат Гольджи (комплекс Гольджи), эндоплазматический ретикулум, рибосомы и элементы цитоскелета, к которому относятся микротрубочки, микрофиламенты и промежуточные филаменты. Таким образом, клетка имеет сложную внутреннюю организацию и специфическое взаимодействие органелл в процессе жизнедеятельности. Клетка – это наименьшая самовоспроизводящаяся единица жизни, на уровне клетки протекают рост и развитие, размножение клеток, обмен веществ и энергии. В многоклеточном организме протекающие процессы складываются из совокупности координированных функций его клеток. В 1838-39гг. Т. Шванном, М Шлейденом и Л. Окена была сформулирована клеточная теория как одно из величайших научных обобщений XIX века. Позднее, в 1858г. Р. Вирхов внес существенные уточнения в ее формулировку. Современная клеточная теория содержит следующие положения: 1. Клеточная организация возникла на заре жизни и прошла длительный путь эволюции. 2. Новые клетки образуются путем деления ранее существовавших. 3. Клетка является микроскопической живой системой, состоящей из цитоплазмы и ядра, окруженных мембраной (за исключением прокариот). 4. В клетке осуществляются: а) метаболизм – обмен веществ; б) обратимые физиологические процессы – дыхание, поступление и выделение веществ, раздражимость, движение; в) необратимые процессы – рост и развитие. 5. Клетка может быть самостоятельным организмом (прокариоты и простейшие одноклеточные водоросли и грибы). Все многоклеточные организмы также состоят из клеток и их производных. Рост, развитие и размножение многоклеточного организма – следствие жизнедеятельности одной (зигота) или нескольких клеток (культура тканей). Органеллы клетки выполняют определенные функции. Клеточное ядро. Было открыто Броуном в 1931г. Оно играет важную роль в регулировании протекающих в клетках процессов; оно содержит носители генной информации, или ядерные гены, определяющие признак клетки и всего организма. Основное вещество ядра – кариоплазма или нуклеоплазма, в нем находятся хромосомы. В период между делениями ядра (в интерфазе) хромосомы неразличимы, а вместо них в интерфазном ядре видны темные зоны, которые называются гетерохроматин. Гетерохроматин представляет собой более плотные структуры ядра, способные окрашиваться основными красителями. В ядре имеется одно или несколько сферических телец, или ядрышек. Ядрышки участвуют в синтезе рибосомальной РНК и в сборе субъединиц рибосом. Пластиды (впервые описаны Эррера в 1888г.) характерны только растительным клеткам. Существуют три основные разновидности пластид: лейкопласты, хлоропласты и хромопласты. Хлоропласты содержат зеленый фотосинтезирующий пигмент хлорофилл. Хлоропласты окружены двумембранной оболочкой, имеют систему внутренних мембран. В строение хлоропласта имеется кольцевая молекула ДНК, которая контролирует цитоплазматическую пластидную наследственность и изменчивость и рибосомы 70s. Митохондрии (впервые описал Бенда в 1897г.) двумембранные органеллы в которых происходит клеточное дыхание. Содержат кольцевую молекулу ДНК и рибосомы 70s. Митохондрии являются одним их факторов цитоплазматической наследственности и изменчивости. Вакуоли – одномембранные полости, отделенные от цитоплазмы мембраной, называемой тонопласт. Функции вакуоли разнообразны. С их помощью осуществляется осморегуляция, поддерживается тургор. В стареющей клетке в центральной вакуоли концентрируются отходы метаболизма. В вакуолях запасаются ассимилянты, например, сахара и белки. Запасание белков семян происходит в алейроновых зернах или белковых тельцах. И, наконец, еще одна функция вакуолей связана с процессом лизиса: переваривание экзогенных веществ и отдельных частей своей же клетки (автофагия). У животных выделяются специфические вакуоли: осморегуляции, пищеварительные, выделительные и сократительные. Сферосомы были обнаружены Ганштейном в 1880г., которые как и вакуоли, ограничены мембраной, в их образовании принимает участие ЭПР. Сферосомы содержат различные ферменты, но у всех обнаружен фермент липаза, следовательно, сферосома является центром синтеза и накопления масел. Сходны со сферосомами по происхождению, размерам и строению микротельца. В них находятся твердые и кристаллические включения. Микротельца, содержащие каталазу, называют пероксисомами. Плазмалемма – мембрана, окружающая протопласт клетки. Плазмалемма выполняет различные функции: защиту, поглощение (эндоцитоз) и выделение веществ (экзоцитоз), активный и пассивный транспорт веществ. Плазмалемма имеет свойства полупроницаемости. В мертвых же клетках через плазмалемму диффундируют любые молекулы. Биологические мембраны обеспечивают компартментализацию клетки. Существует морфологическая непрерывность ограниченных мембранами цитоплазматических структур, таких, как ЭПС, аппарат Гольджи, вакуоли. В клетке наблюдается «поток» мембран, переход внешней мембраны ядерной оболочки в мембраны ЭПР и этих последних в мембраны аппарата Гольджи, и, наоборот. Происходит постоянный процесс превращения мембран одних структур в другие, одних компонентов клетки в другие. ЭПР (эндоплазматический ритикулум), который был открыт в 1945г. Портером, Клауде и Фуллманом – специализированная внутриклеточная мембранная система, элементы которой пространственно взаимосвязаны и образуют мембранную сеть тяжей, пузырьков, цистерн. Компоненты ЭПР окружены элементарной мембраной, поверхность которой может быть гладкой (гладкий ЭПР) или шероховатой, если она покрыта рибосомами (шероховатый ЭПР). ЭПР является системой транспорта веществ в клетке, она принимает участие в биосинтезе липидов, в накоплении синтезированных на рибосомах белков. Мембраны ЭПР принимают участие в формировании провакуолей, сферосом и аппарата Гольджи. Аппарат Гольджи (впервые был описан К. Гольджи в 1898г.) состоит из цистерн и системы пузырьков разного размера, расположенных по краям этих цистерн. Цистерны получили название диктиосом. В образовании аппарата Гольджи принимают участие как ЭПР, так и внешняя мембрана ядерной оболочки. Функциями аппарата Гольджи является секреция веществ, полимеризация полисахаридов, накопление различных биологически активных веществ (липопротеидов, ферментов), пузырьки Гольджи участвуют в построении клеточной оболочки. Содержимое пузырьков превращается в матрикс клеточной стенки, а мембраны пузырьков включаются в плазмалемму, способствуя ее росту. Рибосомы (обнаружены в 1955г. Палладе) являются немембранными структурами. Они состоят из двух субъединиц. Они могут объединяться в комплексы по 50-70 штук, образуя полирибосому (полисому). Рибосомы состоят из двух основных химических компонентов – рибосомальной РНК (р-РНК) и белка. В рибосомах содержится 80-90% всей РНК клетки. Рибосомы являются важными органеллами, т.к. именно на них осуществляется синтез полипептидных цепей. В клетках животных, мхов, папоротников и голосеменных растений (в клетках покрытосеменных растений – не обнаружен) имеется клеточный центр. Клеточный центр – ультрамикроскопическая органелла немембранного строения, состоящая их двух центриолей. Клеточный центр – динамический центр клетки. В профазе происходит деление центриолей и они удваиваются. Каждая центриоль перемещается к соответствующему полюсу клетки и участвует в образовании митотического веретена. Микротрубочки – нитевидные структуры, состоящие из белка тубулина. Они имеют вид длинных полых цилиндров, стенки которых состоят из белков – тубулинов. Микротрубочки пронизывают всю цитоплазму клетки, формируя ее цитоскелет, обусловливают циклоз (струйчатое движение цитоплазмы), внутриклеточные перемещения органелл, расхождение хромосом при делении ядерного материала. На белок тубулин разрушительно действует алкалоид колхицин. Это свойство используют для получения полиплоидов.В клеточных технологиях, например, при гибридизации соматических клеток, растительную клетку освобождают ферментативным путем от клеточной стенки и протопласты растений успешно сливаются как с протопластами растений, так и с животными клетками, образуя соматические гибриды. Животные клетки, в отличие от растительных, не имеют клеточной стенки, они окружены только мембраной, на наружной поверхности которой имеется гликокаликс, содержатся вакуоли специального назначения (сократительные, выделительные, пищеварительные). Особую роль в хранении и передаче наследственной информации выполняют хромосомы, впервые обнаруженные Флемингом (1882г.) и Страсбургером (1884г.). Термин «хромосома» предложил Вальдейер в 1888г. Хромосомами называются постоянные компоненты ядра клетки, имеющие особую организацию, функциональную специфичность, способные к самовоспроизведению и сохранению свойств на протяжении всего онтогенеза. Выполняя функции сохранения, передачи и реализации наследственной информации, они способны к изменению своей структуры и морфологии. В интерфазном ядре они выполняют функции транскрипции и репликации, поэтому находятся в деконденсированном (неуплотненном) состоянии, имеют вид тонких деспирализованных нитей, представляющих собой комплексы ДНК и основных белков – гистонов. Во время деления клетки основная функция хромосом – сохранение и передача наследственной информации в дочерние клетки, поэтому они находятся в компактном (конденсированном) состоянии, обусловленном максимальной спирализацией хроматиновых нитей. В настоящее время изучены способы компактизации хромосом от интерфазной микрофибриллы до метафазной хромосомы. Наиболее четко морфологические особенности хромосом проявляются в метафазе митоза, поэтому подсчет числа хромосом, определение их размеров, описание и идентификацию проводят именно в этой фазе. Особенно важным для генетики было открытие в конце XIX столетия (К. Рабль, Е. Ван-Бенедин и Т. Бовери) постоянства и парности числа, а также индивидуальности хромосом для каждого вида. Г.А. Левитский (1931г.) установил единый принцип морфологического строения метафазных хромосом. Каждая метафазная хромосома состоит из двух хроматид, имеет определенную длину и форму, которая зависит от положения первичной или центрической перетяжки. В области первичной перетяжки расположен центромер (или кинетохор), к которому прикрепляются тянущие нити митотического веретена. Кроме центромера некоторые хромосомы имеют вторичную перетяжку. Такие хромосомы называют спутничными, иногда бывает несколько спутников. В районе вторичной перетяжки образуется ядрышко. В некоторых тканях находятся политенные хромосомы и хромосомы типа ламповых щеток. Хромосомы имеют сложное химическое строение и на 90% состоят из дизоксирибонуклеопротеидов (ДНП). При специфическом окрашивании в каждой хромосоме выявляются эухроматиновые и гетерохроматиновые зоны. эухроматиновые зоны окрашиваются слабо, их рассматривают как активные зоны хромосом, содержащие основной комплекс работающих генов. Гетерохроматиновые зоны хромосомы окрашиваются более интенсивно. Предполагается, что в них находятся блоки идентичных генов, обладающих сходным действием и малоактивных в онтогенезе. Совокупность хромосом, присущая соматической клетке данного вида называется кариотипом. Кариотип характеризуется числом, формой и размерами хромосом, а также распределением гетерохроматина. В кариотипе хромосомы представлены гомологичными парами (2n). При изучении кариотипа изучают их морфологичесие параметры к которым относятся абсолютная длина хромосомы, плечевой индекс, центромерный индекс, процент гетерохроматиновой зоны. При описании кариотипа используют условные обозначения для идентификации по длине, а так же составляют формулу кариотипа. Структурные компоненты Часть клетки Строение Функции ЯДРО Хроматин Комплекс ДНК с гистоновыми и негистоновыми белками; гетерохроматин— сильноконденсированный, неактивный; эухроматин— слабоконденсированный, активный; в митозе хроматин максимально конденсируется и получает название хромосом Ядрышко Округлое темно-окрашенное тельце в ядре; место образования рибосом; Образование рибосомальных формируется вокруг участка ДНК, РНК и сборка субъединиц где закодирована структура рибосом рибосомальных РНК Нуклеоплазма Жидкая среда ядра, содержащая молекулы РНК, структурные и Хранение и передача наследственной информации, управление всеми процессами в клетке Диффузия веществ внутри ядра; в ней идут сплайсинг и регуляторные белки, углеводы, молекулы АТФ Ядерная оболочка Часть клетки Состоит из 2 мембран, между которыми имеется перинуклеарное пространство, оно сообщается с полостью гранулярного эндоплазматического ретикулума. К внутренней поверхности ядерной оболочки прикреплены специальные белки, образующие ядерную пластинку. В ядерной оболочке имеются отверстия — ядерные поры, которые по краям окружены специальными белками, регулирующими пропускную способность ядерной поры процессинг РНК Структурное разграничение ядра и цитоплазмы; разграничение по времени транскрипции и трансляции. Ядерная пластинка служит для прикрепления молекул ДНК и для сборки ядерной оболочки после митоза. Поры обеспечивают транспорт веществ в ядро и из ядра ЦИТОПЛАЗМА (органеллы, включения, цитозоль) ОРГАНЕЛЛЫ (мембранные и немембранные) Плазматическая мембрана Шероховатый (гранулярный) эндоплазматический ретикулум МЕМБРАННЫЕ ОРГАНЕЛЛЫ Окружает клетку снаружи и входит в состав мембранных органелл. Основу мембраны составляет Белки обеспечивают билипидный слой, образованный из транспорт веществ из клетки двух слоев липидов (фосфолипиды, и в клетку (транспортные), холестерин, гликолипиды). В регулируют липиды погружены белки, которые внутримембранные и как бы плавают в липидном бислое. внутриклеточные процессы Белки могут насквозь пронизывать (ферменты), выполняют мембрану (интегральные), могут рецепторную функцию быть наполовину погруженными (рецепторы), участвуют в (полуинтегральные) и располагаться организации межклеточных на поверхности липидного бислоя контактов и служат для (примембранные). К липидам и прикрепления белкам могут прикрепляться внутриклеточных структур к углеводы с образованием мембране (структурные). гликолипидов и гликопротеидов. Липиды выполняют Эти углеводные цепи располагаются барьерную функцию, над мембраной и получают название являются диэлектриком гликокаликса, он есть только на наружной поверхности мембраны Система плоских мешочков — цистерн, стенка которых сделана из мембраны. К внешней поверхности мембраны прикреплены рибосомы. Они синтезируют белок, который поступает в полость ретикулума. В Синтез белка рибосомами, модификация синтезированного белка (отщепление и присоединение углеводов, отщепление кусочков мембрану встроены ферменты, полипептидной цепи), катализирующие присоединение и транспорт белков в комплекс отщепление углеводов от белков, Гольджи расщепляющие пептидные связи; транспортные белки, регулирующие поступление молекул белков и углеводов в полость ретикулума Гладкий (агранулярный) эндоплазматический ретикулум Система трубок, стенка которых сделана из мембраны. В мембрану встроены белки синтеза липидов, разрушения ряда веществ, транспортные белки, обеспечивающие поступление веществ в полость и из полости ретикулума, регуляторные белки, которые регулируют работу транспортных белков Синтез липидов, обезвреживание некоторых токсинов, хранение ионов кальция (в основном в мышечной ткани) Комплекс Гольджи Система плоских мембранных мешочков, сложенных наподобие стопки тарелок, и ассоциированных с ними пузырьков. Такая стопка называется диктиосомой. Их в клетке может быть от 1 до сотни. Обращенная к ядру сторона диктиосомы называется незрелой поверхностью, а к цитомембране — зрелой. В мембраны цистерн встроены ферменты, катализирующие присоединение и отсоединение углеводов от белков; углеводные рецепторы, белки, регулирующие отпочковывание и слияние транспортных пузырьков с цистернами комплекса Гольджи. Вещества попадают в комплекс Гольджи с незрелой стороны и продвигаются к зрелой, где сортируются и упаковываются в транспортные или секреторные пузырьки Модификация белков и гликопротеидов — отщепление полипептидных фрагментов от молекул белков, образование дисульфидных связей, присоединение и отщепление углеводов от молекул белков. Сортировка белков и гликопротеидов с помощью углеводных рецепторов. Формирование транспортных и секреторных пузырьков, образование лизосом, пероксисом Митохондрии Мешочки округлой или вытянутой формы, стенка состоит из двух мембран. Наружная мембрана гладкая, обладает обычной проницаемостью. Внутренняя мембрана обладает избирательной проницаемостью, в ней есть впячивания — кристы, в нее встроены ферменты дыхательной цепи, ферментный комплекс АТФсинтетаза, транспортные белки. Окисление жирных кислот и пирувата (продукт распада глюкозы) с одновременным синтезом молекул АТФ — окислительное фосфорилирование Полость митохондрии заполнена матриксом, который состоит из множества ферментов (цикл Кребса, ,бета-окисление липидов и др.), рибосом, ДНК, РНК, промежуточных продуктов распада жирных кислот и углеводов Лизосомы Мешочки, стенка которых сделана из мембраны, внутри находятся гидролитические ферменты (протеазы, нуклеазы, гликозидазы, липазы, фосфолипазы, сульфатазы — более 40 ферментов), разрушающие макромолекулы — белки, углеводы и жиры до низкомолекулярных продуктов, которые могут через мембрану диффундировать в цитозоль. Внутри лизосом поддерживается кислая рН, так как ферменты активны в кислой среде. Вновь образованные лизосомы называются первичными лизосомами, фаголизосомы называются вторичными лизосомами, лизосомы с оставшимися в них непереваренными компонентами называются остаточными тельцами Расщепление биоплимеров (белков, углеводов и жиров) до мономеров (аминокислот, глицерина и жирных ксслот, моносааров), расщепление фагоцитированного материала Пероксисомы Округлые мешочки, стенка которых сделана из мембраны, внутри находятся ферменты, генерирующие активные метаболиты кислорода — супероксид анион, гидроксильный радикал, синглетный кислород, перекись водорода (пероксидаза) и утилизирующие их избыток (каталаза). Пероксидаза использует молекулярный кислород для отщепления атомов водорода от субстратов с образованием перекиси водорода, а каталаза утилизирует перекись водорода для окисления других субстратов Расщепление органических веществ, преимущественно липидной природы, с помощью активного кислорода Транспортные (окаймленные) пузырьки Округлые мембранные пузырьки, отшнуровываются от комплекса Гольджи, эндоплазматического ретикулума, поверхностной мембраны клетки, на наружной поверхности их мембраны имеется белок клатрин, формирующий каемку; с помощью него пузырьки Служат для переноса веществ от одной органеллы к другой (от комплекса Гольджи к формирующимся лизосомам и пероксисомам, перенос нейромедиаторов в нейронах), образование фагосом могут легко отшнуровываться и сливаться с мембранами других органелл или клеточной мембраной Рибосомы НЕМЕМБРАННЫЕ ОРГАНЕЛЛЫ Сложный мультиферментный комплекс, построенный из РНК и белков. Состоят из 2-х субъединиц — малой (1 молекула рРНК и 33 молекулы белков) и большой (3 молекулы рРНК и 40 белков). Имеются 2 участка, связывающие тРНК: А-участок — связывает Биосинтез белка тРНК, несущую только одну аминокислоту; Р-участок — связывает тРНК, соединенную с вновь синтезируемым пептидом. Большая и малая субъединицы соединяются вместе только на молекуле мРНК для синтеза белка Микротрубочки Полые цилиндры, сделанные из белка тубулина (13 протофиламентов) и ассоциированных с ним белков (динеин, динактин, кинезины). Способны к самосборкесаморазборке. Динеин способен расщеплять АТФ и обеспечивает смещение микротрубочек друг относительно друга, что приводит в движение реснички и жгутики, расхождение полюсов клетки и хроматид при делении Поддержание формы клетки, участие в формировании ресничек, жгутиков, веретена деления и связанные с ними функции Центриоли и клеточный центр Центриоль состоит из 9 триплетов микротрубочек (одна полная микротрубочка и 2 неполных; 13 и 9 протофиламентов соответственно), располагающихся по окружности. В клетке 2 центриоли, располагающиеся под прямым углом друг к другу. Клеточный центр состоит из 2-х центриолей и бесструктурной массы вокруг них — центросферы Центросфера клеточного центра — место роста всех микротрубочек клетки. Центриоли определяют плоскость деления клетки, от них растут микротрубочки веретена деления и образуются базальные тельца ресничек и жгутиков Реснички и жгутики Состоят из 2 частей: базального тельца, расположенного в цитоплазме и состоящего из 9 триплетов микротрубочек и аксонемы — выроста над поверхностью клетки, который Движение клетки, направление движения жидкости над клеткой снаружи покрыта мембраной, а внутри имеет 9 пар микротрубочек, располагающихся по окружности, и одну пару в центре. Между соседними дуплетами имеются поперечные сшивки из белка нексина. От каждого дуплета внутрь отходит радиальная спица. К микротрубочкам центральной части присоединены белки, образующие центральную капсулу. К микротрубочкам присоединен белок динеин (см. выше) Микрофиламенты Тонкие нити, образующие в клетке трехмерную сеть. Состоят из белка актина и ассоциированных с ним белков: фимбрин (связывает в пучки параллельно расположенные филаменты); альфа-актинин и филамин (связывают филаменты, независимо от их пространственной ориентации); винкулин (служит для прикрепления микрофиламентов к внутренней поверхности цитомембраны). Филаменты способны к сборке и разборке. В небольшом количестве в клетке встречаются миозиновые микрофиламенты, сделанные из белка миозина. Вместе с актиновыми они формируют сократительные структуры Поддержание формы клетки, опора для внутриклеточных структур, направление движения внутриклеточных процессов, движение и сокращение клетки, формирование межклеточных контактов. Регуляция функций клетки путем сигнализации от межклеточных контактов о состоянии внеклеточного матрикса Мкроворсинки — выросты цитоплазмы длиной до 1 мкм и диаметром 0,1 мкм. В их сердцевине есть около 40 пролольно расположенных актиновых филаментов, к верхушке они прикрепляются с помощью белка винкулина, а в цитоплазме заканчиваются в терминальной сети филаментов, где есть и миозиновые филаменты Промежуточные филаменты Толстые прочные нити толщиной 8– 10 нм, образованные из белков — виментина, десмина, нейрофибриллярных белков, кератина; не способны к самосборке-разборке Поддержание формы клетки, упругость клетки, участие в формировании межклеточных контактов ВКЛЮЧЕНИЯ Включения — необязательнве, непостоянные подразделяются на: трофические (запас питательных липиды, гликоген); секреторные (секреторные экскреторные (отработанные ненужные вещества, структуры клетки; веществ в клетке — продукты клетки); хранящиеся внутри клетки); пигментные (гемоглобин, гемосидерин, меланин, липофусцин), пигментные могут быть экзогенными (попавшие в клетку извне) и эндогенными (образовавшиеся в самой клетке) Изучение кариотипа является основой цитогенетического метода, который широко используется как в генетике растений и животных, так и в генетике человека. В 1874г. открыт митоз у растительных клеток (И.Д. Чистяков), в 1878г. – у животных клеток (В.Флеминг, П.И. Перелижко). В 1882г. – открытие мейоза у животных (В. Флеминг), 1888г. – у растений (Э. Страсбургер), были описаны к-митоз, эндомитоз, установлено поведение хромосом, изменение морфологии и их числа в этих делениях. Таким образом, клетка – это единая взаимосвязанная система органелл, обеспечивающая жизнедеятельность клетки, сохранение и реализацию наследственной информации. Одновременно шло изучение половых клеток и механизма оплодотворения у животных и растений. В 1975г. впервые обнаружено слияние ядра сперматозоида с ядром яйцеклетки у иглокожих (О. Гертвиг), а в 1880 – 1884гг. – у растений (Н.Н. Горожанкин, Э. Страсбургер). Генетическое значение оплодотворения заключается в том, что после слияния женской и мужской гамет в зиготе восстанавливается характерный для данного вида диплоидный набор хромосом. Образование зиготы и развитие из нее особи в процессе индивидуального развития (онтогенеза) являются характерными чертами полового размножения. Обычный тип полового процесса называется амфимиксис. Явлением, противоположным амфимиксису является апомиксис. При апомиксисе зародыш семени развивается из клеток гаметофита при различных нарушениях спорогенеза и полового процесса вплоть до полного их отсутствия. Апомиксис может быть регулярный и нерегулярный в результате нерегулярного апомиксиса можно получить маложизнеспособные гаплоидные растения (как ценный генетический и селекционный материал), а в результате регулярного апомиксиса – устойчивое семяобразование и жизнеспособные диплоидные растения. Зародыш хвойных в естественных условиях развивается только из зиготы. Явление же апомиксиса характерно для покрытосеменных. Ксенийность является следствием двойного оплодотворения, в результате которого при скрещивании гибридным становится не только диплоидный зародыш, но и триплоидный эндосперм, признаки которого будут зависеть от соотношения доминантностирецессивности соответствующих аллелей родительских форм. Ксенийность может характеризоваться проявлением на эндосперме семян материнского растения любых доминантных признаков, характерных для эндосперма отцовских семян (окраска, форма, размер, консистенция). Цитогенетические основы полового размножения объясняют образование пустых семян, как выражение генетического груза, как следствие нарушения споро- и гаметогенеза, цитоплазматической наследственности, дают обоснование биотехнологическим методам, расширяют возможности чистой генетики и селекции. Процесс двойного оплодотворения у цветковых растений открыт в 1898г. С.Г. Навашиным. В те же годы был установлен факт, что в процессе развития половых клеток, в отличие от соматических, происходит уменьшение числа хромосом вдвое, а при оплодотворении – слияние ядер женской и мужской половых клеток и восстановление прежнего, диплоидного числа хромосом, построенного для каждого вида. При этом было показано, что в зиготе – первой клетке будущего организма – происходит объединение половинного набора отцовских и половинного (гаплоидного) набора материнских хромосом. В 1902-1903гг. У Сеттон установил связь между поведением хромосом при редукционном делении и оплодотворении и независимым расщепление признаков в потомстве гибридов, открытым Г. Менделем. Основным способом размножения соматических клеток является митоз (непрямое деление), который обеспечивает дочерние клетки идентичной с материнской клеткой генетической информацией. Гораздо реже клетки делятся путем амитоза, который не обеспечивает равенства генетического материала у дочерних клеток. Путем амитоза делятся клетки простейших организмов и некоторые специализированные клетки животных и растений. 2.Деление клеток. Митоз. Кариотип. В основе воспроизведения биологических систем лежит деление клеток: «От клеточного деления зависят не только явления наследственности, но и сама непрерывность жизни». В 1831–1833 гг. Р. Браун доказал, что одним из основных компонентов эукариотической клети является ядро. Главным компонентом ядра является хроматин – субстанция, которая хорошо окрашивается определенными красителями. В конце XIX в. была установлена ведущая роль ядра в хранении и передаче наследственной информации (опыты Т. Бовери с морскими ежами, опыты Р. Геммерлинга с ацетабулярией). Однако при делении клеток их ядра разрушаются, а на их месте появляются компактные структуры, хорошо окрашиваемые некоторыми красителями. В 1888 г. немецкий гистолог В. Вальдейер назвал эти структуры хромосомами. В 1924 г. Фѐльген доказал, что в состав хромосом входит ДНК. В дальнейшем было установлено, что в состав хроматина ядра и хромосом входят одни и те же химические вещества: ДНК (1 часть), белки (1,3 части), РНК (0,2 части), а также неорганические ионы Число хромосом постоянно для каждого вида организмов. На этом основании в 1903 г. американский цитолог Уильям Сэттон пришел к выводу, что в хромосомах локализованы носители наследственной информации, которые датский генетик Иоганнсен в 1909 г. назвал генами. Раздел генетики, изучающий хромосомы как носители наследственной информации, называется цитогенетикой. Существует два основных способа деления эукариотических клеток: митоз и мейоз. При митозе и мейозе часть хромосом перемещается к одному полюсу клетки, а часть – к другому. При этом морфология хромосом изменяется. Митоз и мейоз различаются по способам перемещения хромосом. Впервые митотическое деление клеток (дробление яиц лягушки) наблюдали французские ученые Прево и Дюма (1824). Более подробно этот процесс описал итальянский эмбриолог М. Рускони (1826). Процесс деления ядер при дроблении яиц у морских ежей описал К. Бэр (1845). Первое описание деления клеток у водорослей выполнил Б. Дюмортье (1832). В дальнейшем деление клеток наблюдали: немецкий ботаник В. Гофмейстер (1849; клетки тычиночной нити традесканции), российские ботаники Э. Руссов (1872; материнские клетки спор папоротников, хвощей, лилии) и И.Д. Чистяков (1874; споры хвоща и плауна), немецкий зоолог А. Шнейдер (1873; дробящиеся яйца плоских червей), польский ботаник Э. Страсбургер (1875; спирогира, плаун, лук). Для обозначения процессов перемещения составных частей ядра немецкий гистолог В. Шлейхнер предложил термин кариокинез (1879), а немецкий гистолог В. Флемминг ввел термин митоз (1878). Отдельные фазы мейоза у животных описал В. Флемминг (1882), а у растений – Э. Страсбургер (1888), а затем российский ученый В.И. Беляев. Первое подробное описание мейоза в ооцитах кролика дал Уиниуортер (1900). Бельгийский зоолог ван Беденен (1883) установил, что число хромосом в клетках тела (соматических клетках) вдвое больше, чем в половых клетках. Митоз Митоз (от древнегреч. «митос» – нить) является универсальным способом деления эукариотических клеток. Иногда митоз называют непрямым делением. Митоз включает кариокинез (деление ядра) и цитокинез (деление цитоплазмы). Кариокинез включает ряд фаз: профазу, метафазу, анафазу и телофазу. Профаза – первая фаза митоза. Хромосомы спирализуются и становятся видны в световой микроскоп в виде тонких нитей. В конце профазы ядрышки исчезают, ядерная оболочка разрушается, и хромосомы выходят в цитоплазму. Метафаза. Формируется митотический аппарат, в состав которого входит веретено деления (ахроматиновое веретено) и центриоли или иные центры организации микротрубочек. Хромосомы располагаются в экваториальной плоскости клетки, образуя метафазную пластинку. В метафазе хромосомы максимально спирализованы. Каждая хромосома состоит из двух продольных субъединиц – хроматид. Обе хроматиды совершенно идентичны. В основе каждой хроматиды лежит одна молекула ДНК. Конечные участки хроматид называются теломеры. Хроматиды связаны между собой в области первичной перетяжки, которая называется центромера. Метафазная хромосома состоит из двух продольных субъединиц – хроматид, связанных между собой в области первичной перетяжки – центромеры. Обе хроматиды несут совершенно идентичный набор генов (разумеется, при отсутствии мутаций). Центромера делит хромосому на два плеча: короткое – р и длинное – q (это номенклатура хромосом человека; у мушки дрозофилы различают плечи L – левое и R – правое). Анафаза. Происходит разделение хромосом на хроматиды. С этого момента каждая хроматида становится самостоятельной однохроматидной хромосомой, в основе которой лежит одна молекула ДНК. Однохроматидные хромосомы в составе анафазных групп расходятся к полюсам клетки. Телофаза. Веретено деления разрушается. Хромосомы у полюсов клетки деспирализуются, вокруг них формируются ядерные оболочки. В клетке образуются два ядра, генетически идентичные исходному ядру. Содержание ДНК в дочерних ядрах становится равным 2c. Телофаза (окончание кариокинеза) сопровождается цитокинезом. В цитокинезе происходит разделение цитоплазмы и формирование мембран дочерних клеток. У животных цитокинез происходит путем перешнуровывания клетки. У растений цитокинез происходит иначе: в экваториальной плоскости образуются пузырьки, которые сливаются с образованием двух параллельных мембран. На этом митоз завершается, и наступает очередная интерфаза. Интерфаза – это период между двумя клеточными делениями. В интерфазе ядро компактное, не имеет выраженной структуры, хорошо видны ядрышки; хромосомы в большинстве случаев не видны. Интерфаза включает три стадии: пресинтетическую (обозначается символом G1 – «джи-один»), синтетическую (S – «эс») и постсинтетическую (G2 – «джи-два»). На пресинтетической стадии в основе каждой хромосомы лежит одна двуспиральная молекула ДНК. Количество ДНК в диплоидной клетке на этой стадии обозначается символом 2с. Клетка активно растет. На синтетической стадии происходит репликация ДНК. Параллельно удваиваются центриоли (если они имеются). На постсинтетической стадии репликация ДНК уже завершена. В состав каждой хромосомы входит две двуспиральные молекулы ДНК, которые являются точной копией исходной молекулы ДНК. На этой стадии количество ДНК в диплоидной клетке обозначается символом 4с. Синтезируются вещества, необходимые для деления клетки. После этого вновь происходит митоз. Таким образом, митоз – это циклический (повторяющийся) процесс, важнейшим моментом которого является расщепление каждой хромосомы на две дочерние хромосомы и их распределение по двум вновь образующимся клеткам. Интервал между завершением митоза в исходной клетке и завершением митоза в ее дочерней клетке называется клеточный цикл. Полный клеточный цикл включает интерфазу и собственно митоз. Биологическое значение митоза. В ходе митоза образуется две клетки с идентичными хромосомными наборами. При митозе полностью сохраняется объем и качество исходной наследственной информации. Успех митоза не зависит от числа хромосом в клетках. Поэтому именно митоз является основой индивидуального развития многоклеточных организмов. Кроме того, митоз является цитологической основой вегетативного размножения у грибов и растений и бесполого размножения у животных. Кариотип Кариотип – это совокупность метафазных хромосом, характерных для определенного вида организмов. Постоянство кариотипа поддерживается с помощью точных механизмов митоза и мейоза. Изучение кариотипов и их изменчивости важно для здравоохранения (многие генетические заболевания связаны с изменением кариотипа), селекции (многие сорта растений различаются по кариотипу) и экологического биомониторинга (кариотип может изменяться под воздействием экологических факторов). Кариотип используется в качестве видовой характеристики (существует особый раздел систематики – кариосистематика). Кариотипический критерий является одним из важнейших критериев вида. Сущность этого критерия заключается в том, что все особи данного вида характеризуются определенным кариотипом (см. рис. в конце темы). В понятие «кариотип» включается число хромосом, их размеры, морфология, особенности продольной дифференцировки. Если оба плеча хромосомы равны по длине, то такая хромосома называется метацентрической, если неравны – то такая хромосома называется субметацентрической, если же одно из плеч очень короткое, то такая хромосома называется акроцентрической. Конечные участки хроматид называются теломеры. У некоторых хромосом в области теломер имеются удаленные структуры (спутники); это спутничные хромосомы. При специальных методах окраски (дифференциальная окраска) видно, что хромосомы состоят из чередующихся участков – дисков: С, Т, R, G, N, Q. Чередование дисков специфично для каждой хромосомы. Таким образом, метафазные хромосомы обладают индивидуальностью. Минимально возможный набор хромосом в клетке называется геном. Термин геном (нем. Genom) предложил немецкий ботаник Ганс Винклер в 1920 г. для обозначения минимального набора хромосом. Такое представление о геноме сохраняется и в современной цитогенетике. Однако вскоре было доказано, что в состав хромосом входит ДНК (Фѐльген, 1924), а к середине XX в. было установлено, что именно ДНК является носителем наследственной информации (О.Эвери с сотр., 1944; Дж.Уотсон и Ф.Крик, 1953). Поэтому в настоящее время в молекулярной генетике термином геном все чаще обозначают минимальную упорядоченную совокупность всех молекул ДНК в клетке. Геном – это характеристика вида, а не особи. Геномы разных видов обозначаются латинскими буквами (А, B, C…). Кариотипы «чистых» видов включают только один геном (например, в клетках культурной ржи содержится геном R). Кариотипы гибридов и видов гибридного происхождения включают несколько геномов (например, в клетках тритикале содержатся геномы A, B и R; в клетках твердых пшениц – геномы А и В (у отдельных видов А и G)). Тогда геном «чистого» вида можно назвать элементарным, а геном гибрида – комплексным. Число хромосом в геноме называется основным хромосомным числом и обозначается символом х. Например, для голосеменных растений х = 12, а для покрытосеменных основное число х исходно равно 7 (хотя у ряда покрытосеменных встречаются и иные основные хромосомные числа: х = 12 у пасленовых, х = 19 у ивовых). Изучение геномов важно с точки зрения медицины, теории селекционного процесса и теории эволюции. Организацию генома удобнее рассмотреть на примере многоклеточных животных. У этих организмов различают два типа клеток: соматические клетки, из которых построено тело (сома) организмов, и половые клетки (гаметы). Число хромосом в половых клетках большинства животных соответствует основному хромосомному числу и называется гаплоидным числом хромосом (обозначается символом n), тогда x = n. В гаплоидном наборе каждая хромосома существует в единственном числе (представлена одним гомологом). В соматических клетках содержится удвоенный, или диплоидный набор хромосом, который обозначается символом 2n. В диплоидном наборе каждая хромосома представлена двумя гомологами (исключение составляют половые хромосомы у гетерогаметного пола, например, у самцов большинства млекопитающих X и Y–хромосомы негомологичны). Рассмотрим организацию генома человека на цитогенетическом уровне. Число хромосом в гаплоидном наборе (основное число) равно 23. Все хромосомы пронумерованы и распределены по классам. Из них к классу А относятся хромосомы 1, 2, 3; к классу В – хромосомы 4, 5; к классу С – хромосомы 6, 7, 8, 9, 10, 11, 12; к классу D – хромосомы 13, 14, 15; к классу Е – хромосомы 16, 17, 18; к классу F – хромосомы 19, 20; к классу G – хромосомы 21, 22. Перечисленные хромосомы называются аутосомы, они имеются и у мужчин, и у женщин. В диплоидном наборе (2 n = 46) каждая аутосома представлена двумя гомологами. Двадцать третья хромосома является половой хромосомой (гоносомой), она может быть представлена или X или Y–хромосомой. Половые хромосомы у женщин представлены двумя X–хромосомами, а у мужчин одной X–хромосомой и одной Y–хромосомой. 3. Мейоз. Мейоз – это особый способ деления эукариотических клеток, при котором исходное число хромосом уменьшается в два раза (от древнегреч. «мейон» – меньше – и от «мейозис» – уменьшение). Главной особенностью мейоза является конъюгация (спаривание) гомологичных хромосом с последующим расхождением их в разные клетки. Поэтому в первом делении мейоза вследствие образования бивалентов к полюсам клетки расходятся не однохроматидные, а двухроматидные хромосомы. В результате число хромосом уменьшается в два раза, и из диплоидной клетки образуются гаплоидные клетки. Исходное число хромосом в клетке, которая вступает в мейоз, называется диплоидным (2n). Число хромосом в клетках, образовавшихся в ходе мейоза, называется гаплоидным (n). Мейоз состоит из двух последовательных клеточных делений, которые соответственно называются мейоз I и мейоз II. В первом делении происходит уменьшение числа хромосом в два раза, поэтому его называют редукционным. Во втором делении число хромосом не изменяется; поэтому его называют эквационным (уравнивающим). Предмейотическая интерфаза отличается от обычной интерфазы тем, что процесс репликации ДНК не доходит до конца: примерно 0,2...0,4 % ДНК остается неудвоенной. Однако в целом, можно считать, что в диплоидной клетке (2n) содержание ДНК составляет 4с. При наличии центриолей происходит их удвоение. Таким образом, в клетке имеется две диплосомы, каждая из которых содержит пару центриолей. Первое деление мейоза (редукционное, или мейоз I) Сущность редукционного деления заключается в уменьшении числа хромосом в два раза: из исходной диплоидной клетки образуется две гаплоидные клетки с двухроматидными хромосомами (в состав каждой хромосомы входит 2 хроматиды). Профаза I (профаза первого деления) включает ряд стадий. Лептотена (стадия тонких нитей). Хромосомы видны в световой микроскоп в виде клубка тонких нитей. Зиготена (стадия сливающихся нитей). Происходит конъюгация гомологичных хромосом (от лат. conjugatio – соединение, спаривание, временное слияние). Гомологичные хромосомы (или гомологи) – это парные хромосомы, сходные между собой в морфологическом и генетическом отношении. В результате конъюгации образуются биваленты. Бивалент – это относительно устойчивый комплекс из двух гомологичных хромосом. Гомологи удерживаются друг около друга с помощью белковых синаптонемальных комплексов. Количество бивалентов равно гаплоидному числу хромосом. Иначе биваленты называются тетрады, так как в состав каждого бивалента входит 4 хроматиды. Пахитена (стадия толстых нитей). Хромосомы спирализуются, хорошо видна их продольная неоднородность. Завершается репликация ДНК. Завершается кроссинговер – перекрест хромосом, в результате которого они обмениваются участками хроматид. Диплотена (стадия двойных нитей). Гомологичные хромосомы в бивалентах отталкиваются друг от друга. Они соединены в отдельных точках, которые называются хиазмы (от древнегреч. буквы χ – «хи»). Диакинез (стадия расхождения бивалентов). Хиазмы перемещаются к теломерным участкам хромосом. Биваленты располагаются на периферии ядра. В конце профазы I ядерная оболочка разрушается, и биваленты выходят в цитоплазму. Метафаза I (метафаза первого деления). Формируется веретено деления. Биваленты перемещаются в экваториальную плоскость клетки. Образуется метафазная пластинка из бивалентов. Анафаза I (анафаза первого деления). Гомологичные хромосомы, входящие в состав каждого бивалента, разъединяются, и каждая хромосома движется в сторону ближайшего полюса клетки. Разъединения хромосом на хроматиды не происходит. Телофаза I (телофаза первого деления). Гомологичные двухроматидные хромосомы полностью расходятся к полюсам клетки. В норме каждая дочерняя клетка получает одну гомологичную хромосому из каждой пары гомологов. Формируются два гаплоидных ядра, которые содержат в два раза меньше хромосом, чем ядро исходной диплоидной клетки. Каждое гаплоидное ядро содержит только один хромосомный набор, то есть каждая хромосома представлена только одним гомологом. Содержание ДНК в дочерних клетках составляет 2с. В большинстве случаев (но не всегда) телофаза I сопровождается цитокинезом. После первого деления мейоза наступает интеркинез – короткий промежуток между двумя мейотическими делениями. Интеркинез отличается от интерфазы тем, что не происходит репликации ДНК, удвоения хромосом и удвоения центриолей: эти процессы произошли в предмейотической интерфазе и, частично, в профазе I. Второе деление мейоза (эквационное, или мейоз II) В ходе второго деления мейоза уменьшения числа хромосом не происходит. Сущность эквационного деления заключается в образовании четырех гаплоидных клеток с однохроматидными хромосомами (в состав каждой хромосомы входит одна хроматида). Профаза II (профаза второго деления). Не отличается существенно от профазы митоза. Хромосомы видны в световой микроскоп в виде тонких нитей. В каждой из дочерних клеток формируется веретено деления. Метафаза II (метафаза второго деления). Хромосомы располагаются в экваториальных плоскостях гаплоидных клеток независимо друг от друга. Эти экваториальные плоскости могут быть параллельны друг другу или взаимно перпендикулярны. Анафаза II (анафаза второго деления). Хромосомы разделяются на хроматиды (как при митозе). Получившиеся однохроматидные хромосомы в составе анафазных групп перемещаются к полюсам клеток. Телофаза II (телофаза второго деления). Однохроматидные хромосомы полностью переместились к полюсам клетки, формируются ядра. Содержание ДНК в каждой из клеток становится минимальным и составляет 1с. Таким образом, в результате описанной схемы мейоза из одной диплоидной клетки образуется четыре гаплоидные клетки. Дальнейшая судьба этих клеток зависит от таксономической принадлежности организмов, от пола особи и ряда других факторов. Типы мейоза. При зиготном и споровом мейозе образовавшиеся гаплоидные клетки дают начало спорам (зооспорам). Эти типы мейоза характерны для низших эукариот, грибов и растений. Зиготный и споровый мейоз тесно связан со спорогенезом. При гаметном мейозе из образовавшихся гаплоидных клеток образуются гаметы. Этот тип мейоза характерен для животных. Гаметный мейоз тесно связан с гаметогенезом и оплодотворением. Таким образом, мейоз – это цитологическая основа полового и бесполого (спорового) размножения. Биологическое значение мейоза. Немецкий биолог Август Вайсман (1887) теоретически обосновал необходимость мейоза как механизма поддержания постоянного числа хромосом. Поскольку при оплодотворении ядра половых клеток сливаются (и, тем самым, в одном ядре объединяются хромосомы этих ядер), и поскольку число хромосом в соматических клетках остается константным, то постоянному удвоению числа хромосом при последовательных оплодотворениях должен противостоять процесс, приводящий к сокращению их числа в гаметах ровно вдвое. Таким образом, биологическое значение мейоза заключается в поддержании постоянства числа хромосом при наличии полового процесса. Мейоз обеспечивает также комбинативную изменчивость – появление новых сочетаний наследственных задатков при дальнейшем оплодотворении. Таблица - Сравнение митоза и мейоза Фаза Митоз Набор хромосом 2n Идет интенсивный Интерфаза синтез белков, АТФ и других органических веществ Мейоз 1 деление Набор хромосом 2n Наблюдаются те же процессы, что и в митозе, но более продолжительна, особенно при образовании яйцеклеток. 2 деление Набор хромосом гаплоидный (n). Синтез органических веществ отсутствует. Удваиваются хромосомы, каждая оказывается состоящей из двух сестринских хроматид, скрепленных общей центромерой. Непродолжительна, происходит спирализация хромосом, исчезают ядерная оболочка, ядрышко, образуется веретено деления Профаза Метафаза Анафаза Телофаза Происходит дальнейшая спирализация хромосом, их центромеры располагаются по экватору. Центромеры, скрепляющие сестринские хроматиды, делятся, каждая из них становится новой хромосомой и отходит к противоположным полюсам. Делится цитоплазма, образуются две дочерние клетки, каждая с диплоидным набором хромосом. Исчезает веретено деления, формируются ядрышки. Более длительна. В начале фазы те же процессы, что и в митозе. Кроме того, происходит конъюгация хромосом, при которой гомологичные хромосомы сближаются по всей длине и скручиваются. При этом может происходить обмен генетической информацией (перекрест хромосом) — кроссинговер. Затем хромосомы расходятся. Происходят процессы, аналогичные тем, что и в митозе. Короткая; те же процессы, что и в митозе, но при n хромосом. Центромеры не делятся. К противоположным полюсам отходит одна из гомологичных хромосом, состоящая из двух хроматид, скрепленных общей центромерой. Длится недолго Гомологичные хромосомы попадают в разные клетки с гаплоидным набором хромосом. Цитоплазма делится не всегда. Происходит то же, что и в митозе, но при n хромосом. Происходит то же, что и в митозе, но при n хромосом. Делится цитоплазма. После двух мейотических делений образуется 4 клетки с гаплоидным набором хромосом. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 3. МОЛЕКУЛЯРНЫЕ ОСНОВЫ НАСЛЕДСТВЕННОСТИ. Лектор: ст.п. Мамедова М. З. 1. Нуклеиновые кислоты, их строение, функции и генезис 2. Основные этапы биосинтеза белков. Генетический код, его основные свойства 3. Регуляция экспрессии генов 1. Нуклеиновые кислоты, их строение и функции Нуклеиновые кислоты – это линейные неразветвленные гетерополимеры, мономерами которых являются нуклеотиды, связанные фосфодиэфирными связями. Нуклеотиды – это органические вещества, молекулы которых состоят из остатка пентозы (рибозы или дезоксирибозы), к которому ковалентно присоединены остаток фосфорной кислоты и азотистое основание. Азотистые основания в составе нуклеотидов делятся на две группы: пуриновые (аденин и гуанин) и пиримидиновые (цитозин, тимин и урацил). Дезоксирибонуклеотиды включают в свой состав дезоксирибозу и одно из азотистых оснований: аденин (А), гуанин (Г), тимин (Т), цитозин (Ц). Рибонуклеотиды включают в свой состав рибозу и одно из азотистых оснований: аденин (А), гуанин (Г), урацил (У), цитозин (Ц). В ряде случаев в клетках встречаются и разнообразные производные от перечисленных азотистых оснований – минорные основания, входящие в состав минорных нуклеотидов. Свободные нуклеотиды и сходные с ними вещества играют важную роль в обмене веществ. Например, НАД (никотинамидадениндинуклеотид) и НАДФ (никотинамидадениндинуклеотидфосфат) служат переносчиками электронов и протонов. Свободные нуклеотиды способны присоединять еще 1...2 фосфорные группы, образуя макроэргические соединения. Универсальным источником энергии в клетке является АТФ – аденозинтрифосфорная кислота, состоящая из аденина, рибозы и трех остатков фосфорной (пирофосфорной) кислоты. При гидролизе одной концевой пирофосфатной связи выделяется около 30,6 кДж/моль (или 8,4 ккал/моль) свободной энергии, которая может использоваться клеткой. Такая пирофосфатная связь называется макроэргической (высокоэнергетической). Кроме АТФ существуют и другие макроэргические соединения на основе нуклеотидов: ГТФ (содержит гуанин; участвует в биосинтезе белков, глюкозы), УТФ (содержит урацил; участвует в синтезе полисахаридов). Нуклеотиды способны образовывать циклические формы, например, цАМФ, цЦМФ, цГМФ. Циклические нуклеотиды выполняют роль регуляторов различных физиологических процессов. Нуклеиновые кислоты Существует два типа нуклеиновых кислот: ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота). Нуклеиновые кислоты обеспечивают хранение, воспроизведение и реализацию генетической (наследственной) информации. Эта информация отражена (закодирована) в виде нуклеотидных последовательностей. В частности, последовательность нуклеотидов отражает первичную структуру белков (см. ниже). Соответствие между аминокислотами и кодирующими их нуклеотидными последовательностями называется генетическим кодом. Единицей генетического кода ДНК и РНК является триплет – последовательность из трех нуклеотидов. Нуклеиновые кислоты – это химически активные вещества. Они образуют разнообразные соединения с белками – нуклеопротеиды, или нуклеопротеины. Дезоксирибонуклеиновая кислота (ДНК) – это нуклеиновая кислота, мономерами которой являются дезоксирибонуклеотиды. ДНК является первичным носителем наследственной информации. Это означает, что вся информация о структуре, функционировании и развитии отдельных клеток и целостного организма записана в виде нуклеотидных последовательностей ДНК. Нуклеиновые кислоты были открыты Мишером в 1868 г. Однако лишь в 1924 г. Фѐльген доказал, что ДНК является обязательным компонентом хромосом. В 1944 г. Эвери, Мак-Леод и Мак-Карти установили, что ДНК играет решающую роль в хранении, передаче и реализации наследственной информации. Существует несколько типов ДНК: А, В, Z, Т–формы. Из них в клетках обычно встречается В–форма – двойная правозакрученная спираль, которая состоит из двух нитей (или цепей), связанных между собой водородными связями. Каждая нить представлена чередующимися остатками дезоксирибозы и фосфорной кислоты, причем, к дезоксирибозе ковалентно присоединяется азотистое основание. При этом азотистые основания двух нитей ДНК направлены друг к другу и за счет образования водородных связей образуют комплементарные пары: А=Т (две водородных связи) и Г≡Ц (три водородных связи). Поэтому нуклеотидные последовательности этих цепей однозначно соответствуют друг другу. Длина витка двойной спирали равна 3,4 нм, расстояние между смежными парами азотистых оснований 0,34 нм, диаметр двойной спирали 1,8 нм. Длина ДНК измеряется числом нуклеотидных пар (сокращ. – пн). Длина одной молекулы ДНК колеблется от нескольких тысяч пн (сокращ. – тпн) до нескольких миллионов пн (мпн). Например, у наиболее простых вирусов длина ДНК составляет примерно 5 тпн, у наиболее сложных вирусов – свыше 100 тпн, у кишечной палочки ~ 3,8 мпн, у дрожжей ~ 13,5 мпн, у мушки дрозофилы ~ 105 мпн, у человека ~ 2900 мпн (размеры ДНК даны для минимального набора хромосом – гаплоидного). Длину ДНК можно выразить и в обычных метрических единицах длины: общая длина молекулы ДНК у кишечной палочки составляет ~ 1,3 мм, а длина молекулы ДНК в составе первой хромосомы человека ~ 16 см, а длина ДНК во всем геноме человека (в 23 хромосомах) ~ 1 метр. В эукариотических клетках ДНК существует в виде нуклеопротеиновых комплексов, в состав которых входят белки-гистоны. Репликация (самоудвоение) ДНК – это один из важнейших биологических процессов, обеспечивающих воспроизведение генетической информации. В результате репликации одной молекулы ДНК образуется две новые молекулы, которые являются точной копией исходной молекулы – матрицы. Каждая новая молекула состоит из двух цепей – одной из родительских и одной из сестринских. Такой механизм репликации ДНК называется полуконсервативным. Реакции, в которых одна молекула гетерополимера служит матрицей (формой) для синтеза другой молекулы гетерополимера с комплементарной структурой, называются реакциями матричного типа. Если в ходе реакции образуются молекулы того же вещества, которое служит матрицей, то реакция называется автокаталитической. Если же в ходе реакции на матрице одного вещества образуются молекулы другого вещества, то такая реакция называется гетерокаталитической. Таким образом, репликация ДНК (то есть синтез ДНК на матрице ДНК) является автокаталитической реакцией матричного синтеза. К реакциям матричного типа относятся, в первую очередь, репликация ДНК (синтез ДНК на матрице ДНК), транскрипция ДНК (синтез РНК на матрице ДНК) и трансляция РНК (синтез белков на матрице РНК). Однако существуют и другие реакции матричного типа, например, синтез РНК на матрице РНК и синтез ДНК на матрице РНК. Два последних типа реакций наблюдаются при заражении клетки определенными вирусами. Синтез ДНК на матрице РНК (обратная транскрипция) широко используется в генной инженерии. Все матричные процессы состоят из трех этапов: инициации (начала), элонгации (продолжения) и терминации (окончания). Репликация ДНК – это сложный процесс, в котором принимает участие несколько десятков ферментов. К важнейшим из них относятся ДНКполимеразы (несколько типов), праймазы, топоизомеразы, лигазы и другие. Главная проблема при репликации ДНК заключается в том, что в разных цепях одной молекулы остатки фосфорной кислоты направлены в разные стороны, но наращивание цепей может происходить только с того конца, который заканчивается группой ОН. Поэтому в реплицируемом участке, который называется вилкой репликации, процесс репликации протекает на разных цепях по-разному. На одной из цепей, которая называется ведущей, происходит непрерывный синтез ДНК на матрице ДНК. На другой цепи, которая называется запаздывающей, вначале происходит связывание праймера – специфического фрагмента РНК. Праймер служит затравкой для синтеза фрагмента ДНК, который называется фрагментом Оказаки. В дальнейшем праймер удаляется, а фрагменты Оказаки сшиваются между собой в единую нить фермента ДНК–лигазы. Репликация ДНК сопровождается репарацией – исправлением ошибок, неизбежно возникающих при репликации. Существует множество механизмов репарации. Рибонуклеиновая кислота (РНК) – это нуклеиновая кислота, мономерами которой являются рибонуклеотиды. В пределах одной молекулы РНК имеется несколько участков, которые комплементарны друг другу. Между такими комплементарными участками образуются водородные связи. В результате в одной молекуле РНК чередуются двуспиральные и односпиральные структуры, и общая конформация молекулы напоминает клеверный лист на черешке. Азотистые основания, входящие в состав РНК, способны образовывать водородные связи с комплементарными основаниями и ДНК, и РНК. При этом азотистые основания образуют пары А=У, А=Т и Г≡Ц. Благодаря этому возможна передача информации от ДНК к РНК, от РНК к ДНК и от РНК к белкам. В клетках обнаруживается три основных типа РНК, выполняющих различные функции: 1. Информационная, или матричная РНК (иРНК, или мРНК). Составляет 5% клеточной РНК. Служит для передачи генетической информации от ДНК на рибосомы при биосинтезе белка. В эукариотических клетках иРНК (мРНК) стабилизирована с помощью специфических белков. Это делает возможным продолжение биосинтеза белка даже в том случае, если ядро неактивно. 2. Рибосомная, или рибосомальная РНК (рРНК). Составляет 85% клеточной РНК. Входит в состав рибосом, определяет форму большой и малой рибосомных субъединиц, обеспечивает контакт рибосомы с другими типами РНК. 3. Транспортная РНК (тРНК). Составляет 10% клеточной РНК. Транспортирует аминокислоты к соответствующему участку иРНК в рибосомах. Каждый тип тРНК транспортирует определенную аминокислоту. В клетках имеются и другие типы РНК, выполняющие вспомогательные функции. Все типы РНК образуется в результате реакций матричного синтеза. В большинстве случаев матрицей служит одна из цепей ДНК. Таким образом, синтез РНК на матрице ДНК является гетерокаталитической реакцией матричного типа. Этот процесс называется транскрипцией и контролируется определенными ферментами – РНК–полимеразами (транскриптазами). 2. Основные этапы биосинтеза белков Биосинтез белков в клетках представляет собой последовательность реакций матричного типа, в ходе которых последовательная передача наследственной информации с одного типа молекул на другой приводит к образованию полипептидов с генетически обусловленной структурой. Биосинтез белков представляет собой начальный этап реализации, или экспрессии генетической информации. К главным матричным процессам, обеспечивающим биосинтез белков, относятся транскрипция ДНК и трансляция мРНК. Транскрипция ДНК заключается в переписывании информации с ДНК на мРНК (матричную, или информационную РНК). Трансляция мРНК заключается в переносе информации с мРНК на полипептид. Последовательность матричных реакций при биосинтезе белков можно представить в виде схемы. нетранскрибируемая ДНК цепь А Г Т Г Ц Г Т Т А транскрибируемая ДНК цепь Т Ц А Ц Г Ц А А Т транскрипция ДНК А Г кодоны мРНК трансляция мРНК У Г Ц Г У У А У А Ц Ц А У антикодоны тРНК Ц Г А аминокислоты белка метионин глицин тирозин На схеме видно, что генетическая информация о структуре белка хранится в виде последовательности триплетов ДНК. При этом лишь одна из цепей ДНК служит матрицей для транскрипции (такая цепь называется транскрибируемой). Вторая цепь является комплементарной по отношению к транскрибируемой и не участвует в синтезе мРНК. Молекула мРНК служит матрицей для синтеза полипептида на рибосомах. Триплеты мРНК, кодирующие определенную аминокислоту, называются кодоны. В трансляции принимают участие молекулы тРНК. Каждая молекула тРНК содержит антикодон – распознающий триплет, в котором последовательность нуклеотидов комплементарна по отношению к определенному кодону мРНК. Каждая молекула тРНК способна переносить строго определенную аминокислоту. Соединение тРНК с аминокислотой называется аминоацил–тРНК. Молекула тРНК по общей конформации напоминает клеверный лист на черешке. «Вершина листа» несет антикодон. Существует 61 тип тРНК с разными антикодонами. К «черешку листа» присоединяется аминокислота (существует 20 аминокислот, участвующих в синтезе полипептида на рибосомах). Каждой молекуле тРНК с определенным антикодоном соответствует строго определенная аминокислота. В то же время, определенной аминокислоте обычно соответствует несколько типов тРНК с разными антикодонами. Аминокислота ковалентно присоединяется к тРНК с помощью ферментов – аминоацил-тРНК-синтетаз. Эта реакция называется аминоацилированием тРНК. На рибосомах к определенному кодону мРНК с помощью специфического белка присоединяется антикодон соответствующей молекулы аминоацил-тРНК. Такое связывание мРНК и аминоацил-тРНК называется кодонзависимым. На рибосомах аминокислоты соединяются между собой с помощью пептидных связей, а освободившиеся молекулы тРНК уходят на поиски свободных аминокислот. Рассмотрим подробнее основные этапы биосинтеза белков. 1 этап. Транскрипция ДНК. На транскрибируемой цепи ДНК с помощью ДНК-зависимой РНК-полимеразы достраивается комплементарная цепь мРНК. Молекула мРНК является точной копией нетранскрибируемой цепи ДНК с той разницей, что вместо дезоксирибонуклеотидов в ее состав входят рибонуклеотиды, в состав которых вместо тимина входит урацил. 2 этап. Процессинг (созревание) мРНК. Синтезированная молекула мРНК (первичный транскрипт) подвергается дополнительным превращениям. В большинстве случаев исходная молекула мРНК разрезается на отдельные фрагменты. Одни фрагменты – интроны – расщепляются до нуклеотидов, а другие – экзоны – сшиваются в зрелую мРНК. Процесс соединения экзонов «без узелков» называется сплайсинг. Сплайсинг характерен для эукариот и архебактерий, но иногда встречается и у прокариот. Существует несколько видов сплайсинга. Сущность альтернативного сплайсинга заключается в том, что одни и те же участки исходной мРНК могут быть и интронами, и экзонами. Тогда одному и тому же участку ДНК соответствует несколько типов зрелой мРНК и, соответственно, несколько разных форм одного и того же белка. Сущность транс–сплайсинга заключается в соединение экзонов, кодируемых разными генами (иногда даже из разных хромосом), в одну зрелую молекулу мРНК. 3 этап. Трансляция мРНК. Трансляция (как и все матричные процессы) включает три стадии: инициацию (начало), элонгацию (продолжение) и терминацию (окончание). Инициация. Сущность инициации заключается в образовании пептидной связи между двумя первыми аминокислотами полипептида. Первоначально образуется инициирующий комплекс, в состав которого входят: малая субъединица рибосомы, специфические белки (факторы инициации) и специальная инициаторная метиониновая тРНК с аминокислотой метионином – Мет–тРНКМет. Инициирующий комплекс узнает начало мРНК, присоединяется к ней и скользит до точки инициации (начала) биосинтеза белка: в большинстве случаев это стартовый кодон АУГ. Между стартовым кодоном мРНК и антикодоном метиониновой тРНК происходит кодонзависимое связывание с образованием водородных связей. Затем происходит присоединение большой субъединицы рибосомы. При объединении субъединиц образуется целостная рибосома, которая несет два активных центра (сайта): А–участок (аминоацильный, который служит для присоединения аминоацил-тРНК) и Р–участок (пептидилтрансферазный, который служит для образования пептидной связи между аминокислотами). Первоначально Мет–тРНКМет находится на А–участке, но затем перемещается на Р–участок. На освободившийся А–участок поступает аминоацил-тРНК с антикодоном, который комплементарен кодону мРНК, следующему за кодоном АУГ. В нашем примере это Гли–тРНКГли с антикодоном ЦЦГ, который комплементарен кодону ГГЦ. В результате кодонзависимого связывания между кодоном мРНК и антикодоном аминоацил-тРНК образуются водородные связи. Таким образом, на рибосоме рядом оказываются две аминокислоты, между которыми образуется пептидная связь. Ковалентная связь между первой аминокислотой (метионином) и еѐ тРНК разрывается. После образования пептидной связи между двумя первыми аминокислотами рибосома сдвигается на один триплет. В результате происходит транслокация (перемещение) инициаторной метиониновой тРНКМет за пределы рибосомы. Водородная связь между стартовым кодоном и антикодоном инициаторной тРНК разрывается. В результате свободная тРНКМет отщепляется и уходит на поиск своей аминокислоты. Вторая тРНК вместе с аминокислотой (в нашем примере Гли–тРНКГли) в результате транслокации оказывается на Р–участке, а А–участок освобождается. Элонгация. Сущность элонгации заключается в присоединении последующих аминокислот, то есть в наращивании полипептидной цепи. Рабочий цикл рибосомы в процессе элонгации состоит из трех шагов: кодонзависимого связывания мРНК и аминоацил-тРНК на А–участке, образования пептидной связи между аминокислотой и растущей полипептидной цепью и транслокации с освобождением А–участка. На освободившийся А–участок поступает аминоацил-тРНК с антикодоном, соответствующим следующему кодону мРНК (в нашем примере это Тир–тРНКТир с антикодоном АУА, который комплементарен кодону УАУ). На рибосоме рядом оказываются две аминокислоты, между которыми образуется пептидная связь. Связь между предыдущей аминокислотой и еѐ тРНК (в нашем примере между глицином и тРНКГли) разрывается. Затем рибосома смещается еще на один триплет, и в результате транслокации тРНК, которая была на Р–участке (в нашем примере тРНКГли), оказывается за пределами рибосомы и отщепляется от мРНК. А–участок освобождается, и рабочий цикл рибосомы начинается сначала. Терминация. Заключается в окончании синтеза полипептидной цепи. В конце концов, рибосома достигает такого кодона мРНК, которому не соответствует ни одна тРНК (и ни одна аминокислота). Существует три таких нонсенс–кодона: УАА («охра»), УАГ («янтарь»), УГА («опал»). На этих кодонах мРНК рабочий цикл рибосомы прерывается, и наращивание полипептида прекращается. Рибосома под воздействием определенных белков вновь разделяется на субъединицы. Модификация белков. Как правило, синтезированный полипептид подвергается дальнейшим химическим превращениям. Исходная молекула может разрезаться на отдельные фрагменты; затем одни фрагменты сшиваются, другие гидролизуются до аминокислот. Простые белки могут соединяться с самыми разнообразными веществами, образуя гликопротеины, липопротеины, металлопротеины, хромопротеины и другие сложные белки. Кроме того, аминокислоты уже в составе полипептида могут подвергаться химическим превращениям. Например, аминокислота пролин, входящая в состав белка проколлагена, окисляется до гидроксипролина. В результате из проколлагена образуется коллаген – основной белковый компонент соединительной ткани. Реакции модификации белков не являются реакциями матричного типа. Такие биохимические реакции называются ступенчатыми. Энергетика биосинтеза белков. Биосинтез белков – очень энергоемкий процесс. При аминоацилировании тРНК затрачивается энергия одной связи молекулы АТФ, при кодонзависимом связывании аминоацилтРНК – энергия одной связи молекулы ГТФ, при перемещении рибосомы на один триплет – энергия одной связи еще одной молекулы ГТФ. В итоге на присоединение аминокислоты к полипептидной цепи затрачивается около 90 кДж/моль. При гидролизе же пептидной связи высвобождается лишь 2 кДж/моль. Таким образом, при биосинтезе большая часть энергии безвозвратно теряется (рассеивается в виде тепла). Генетический код, его основные свойства В ходе реакций матричного синтеза на основании генетического кода синтезируется полипептид с наследственно обусловленной структурой. Отрезок ДНК, содержащий информацию о структуре определенного полипептида, называется ген. Однако, ген – это не просто участок ДНК, а единица наследственной информации, носителем которой являются нуклеиновые кислоты. Установлено, что ген имеет сложную структуру. В большинстве случаев кодирующие участки (экзоны) разделены некодирующими (интронами). В то же время, благодаря альтернативному сплайсингу, деление участка ДНК на кодирующие и некодирующие оказывается условным. Некоторые участки ДНК могут перемещаться относительно друг друга – их называют мобильными генетическими элементами (МГЭ). Многие гены представлены несколькими копиями – тогда один и тот же белок кодируется разными участками ДНК. Еще сложнее закодирована генетическая информация у вирусов. У многих из них обнаружены перекрывающиеся гены: один и тот же участок ДНК может транскрибироваться с разных стартовых точек. Процесс экспрессии генов обладает гибкостью: одному участку ДНК может соответствовать несколько полипептидов; один полипептид может кодироваться разными участками ДНК. Окончательная модификация белков происходит с помощью ферментов, которые кодируются различными участками ДНК. Общие свойства генетического кода Отражение одних объектов с помощью других называется кодированием. Отражение структуры белков в виде триплетов ДНК называется кодом ДНК, или генетическим кодом. Благодаря генетическому коду устанавливается однозначное соответствие между нуклеотидными последовательностями нуклеиновых кислот и аминокислотами, входящими в состав белков. Генетический код обладает следующими основными свойствами: 1. Генетический код триплетен: каждая аминокислота кодируется триплетом нуклеотидов ДНК и соответствующим триплетом иРНК. При этом кодоны ничем не отделены друг от друга (отсутствуют «запятые»). 2. Генетический код является избыточным (вырожденным): почти все аминокислоты могут кодироваться разными кодонами. Только двум аминокислотам соответствует по одному кодону: метионину (АУГ) и триптофану (УГГ). Зато лейцину, серину и аргинину соответствует по 6 разных кодонов. 3. Генетический код является неперекрывающимся: каждая пара нуклеотидов принадлежит только одному кодону (исключения обнаружены у вирусов). 4. Генетический код един для подавляющего большинства биологических систем. Однако имеются и исключения, например, у инфузорий и в митохондриях разных организмов. Поэтому генетический код называют квазиуниверсальным. 3. Регуляция экспрессии генов 3.1. Общие принципы регуляции экспрессии генов Активность генов определяется объемом генопродуктов (РНК и белков). Степень активности генов называется их экспрессией. Все гены клетки (и целостного организма) можно разделить на две группы: регуляторные и структурные. Регуляторные гены не транскрибируются, т.е. в обычных условиях им не соответствует ни один из типов РНК. Структурные гены способны транскрибироваться с образованием РНК (матричной, рибосомальной, транспортной). В свою очередь, структурные гены делятся на конститутивные и индуцибельные. Конститутивные гены постоянно включены: они функционируют на всех стадиях онтогенеза и во всех тканях. К конститутивным относятся гены, обслуживающие матричные процессы (кодирующие тРНК, рРНК, ДНКполимеразы, РНК-полимеразы, рибосомальные белки), гены, кодирующие обязательные структурные компоненты клетки (например, белки-гистоны), гены, контролирующие постоянно протекающие обменные процессы (например, гликолиз). Иначе говоря, это «гены домашнего хозяйства», без которых клетки не могут существовать. Индуцибельные гены функционируют в разных тканях на определенных этапах онтогенеза, они могут включаться и выключаться, их активность может регулироваться по принципу «больше или меньше». Это тканеспецифичные гены, или «гены роскоши». К индуцибельным генам относятся как гены, контролирующие ход онтогенеза (переключатели, или диспетчеры), так и гены, прямо определяющие структуру и функции компонентов клетки и целостного организма. (Нужно отметить, что строгой разницы между перечисленными группами генов не существует, поскольку один и тот же участок ДНК может выполнять разные функции.) Существуют индуцибельные гены, в норме включенные, и гены, в норме выключенные. Включение нормально выключенных индуцибельных генов называется индукцией, выключение нормально включенных – репрессией. Регуляцию активности генов осуществляют молекулярно-генетические системы управления. На индукцию и репрессию могут влиять самые разнообразные факторы, которые называются эффекторами. Одни из них прямо закодированы в геноме организма (например, белки теплового шока; см. ниже), другие образуются как промежуточные продукты обмена веществ, третьи поступают в клетку извне в готовом виде из внешней среды или из других клеток (тканей) организма, четвертые образуются в клетке под влиянием физических факторов (экстремальных температур, ультрафиолета) и т.д. Особую группу эффекторов составляют белки теплового шока, которые синтезируются в клетке при различных видах стресса (при повышении температуры, при воздействии других неблагоприятных факторов). Эти белки эволюционно консервативны, они обнаружены у самых различных организмов; вероятно, они являются универсальными эффекторами. Именно регуляцией активности генов объясняется тот факт, что, несмотря на идентичность генотипов клеток многоклеточного организма, они значительно различаются по строению и функции. Переключение синтеза с одних белков на другие лежит в основе всякого развития, будь то репродукция вирусов в зараженных клетках, рост и спорообразование у бактерий, развитие эмбрионов или дифференцировка тканей. На каждом этапе этих процессов синтезируются специфичные белки. Известно несколько типов механизмов, с помощью которых один и тот же набор генов в неодинаковых условиях жизнедеятельности организма и на разных стадиях развития детерминирует синтез белков. Регуляция экспрессии (выражения) генов может осуществляться на нескольких уровнях: генном, транскрипционном, трансляционном и функциональном. Первый из них связан с изменением количества или локализации генов, контролирующих данный признак. Второй определяет, какие и сколько мРНК должны синтезироваться в данный момент. Третий обеспечивает отбор мРНК, транслирующихся на рибосомах. Четвертый связан с аллостерической регуляцией активности ферментов. Наконец, контроль действия генов может осуществляться путем посттрансляционной модификации полипептидов, посттранскрипционной модификации мРНК, и другими путями. Прежде чем детально проанализировать перечисленные механизмы регуляции экспрессии генов, рассмотрим подробнее транскрипционный уровень регуляции, в отношении которого имеется большое число данных, полученных главным образом на бактериях. 3.2. Регуляция экспрессии генов у прокариот Переключение генов лучше всего изучено у прокариот (бактерий). Рассмотрим механизмы регуляции активности генов на примере лактозного оперона кишечной палочки (Escherichia coli) – классического объекта генетики микроорганизмов. Единицей регуляции экспрессии генов у прокариот является оперон. Оперон – это участок бактериальной хромосомы, включающий следующие участки ДНК: Р – промотор, О – оператор, Z, Y, А – структурные гены, Т – терминатор. (В состав других оперонов может входить до 10 структурных генов и более.) Промотор – это регуляторный участок ДНК, который служит для присоединения РНК-полимеразы к молекуле ДНК. В лактозном опероне присоединение РНК-полимеразы происходит с помощью комплекса CAPцАМФ (CAP – это специфический белок; в свободной форме является неактивным активатором, цАМФ – циклоаденозинмонофосфат – циклическая форма аденозинмонофосфорной кислоты). Оператор – это регуляторный участок ДНК, который способен присоединять белок-репрессор, который кодируется соответствующим геном lac. Если репрессор присоединен к оператору, то РНК-полимераза не может двигаться вдоль молекулы ДНК и синтезировать мРНК. Структурные гены кодируют три фермента, необходимые для расщепления лактозы (молочного сахара) на глюкозу и галактозу. Молочный сахар лактоза – менее ценный продукт питания, чем глюкоза, поэтому в присутствии глюкозы сбраживание лактозы является невыгодным для бактерии процессом. Однако при отсутствии глюкозы бактерия вынуждена переходить на питание лактозой, для чего синтезирует соответствующие ферменты Z (β-галактозидазу), Y (галактозидпермеазу), А (тиогалактозидтрансацетилазу). Терминатор – это регуляторный участок ДНК, который служит для отсоединения РНК-полимеразы после окончания синтеза мРНК, соответствующей ферментам Z, Y, А, необходимым для усвоения лактозы. Для регуляции работы оперона необходим ген cya, кодирующий белок CYA, который катализирует образование цАМФ из АТФ, Если в клетке имеется глюкоза, то белок CYA вступает с ней в реакцию и переходит в неактивную форму. Таким образом, глюкоза блокирует синтез цАМФ и делает невозможным присоединение РНК-полимеразы к промотору. Следовательно, глюкоза является репрессором лактозного оперона. Если же в клетке имеется лактоза, то она взаимодействует с белкомрепрессором и превращает его в неактивную форму. Белок-репрессор, связанный с лактозой, не может присоединиться к оператору и не преграждает путь РНК-полимеразе. Таким образом, лактоза является индуктором лактозного оперона. Предположим, что первоначально в клетке имеется только глюкоза. Тогда белок-репрессор присоединен к оператору, а РНК-полимераза не может присоединиться к промотору. Оперон не работает, структурные гены выключены. При появлении в клетке лактозы и при наличии глюкозы белокрепрессор отщепляется от оператора и открывает путь РНК-полимеразе. Однако РНК-полимераза не может присоединиться к промотору, поскольку глюкоза блокирует синтез цАМФ. Оперон по-прежнему не работает, структурные гены выключены. Если же в клетке имеется только лактоза, то белок-репрессор связывается с лактозой, отщепляется и открывает путь РНК-полимеразе. В отсутствии глюкозы белок CYA катализирует синтез цАМФ, и РНКполимераза присоединяется к промотору. Структурные гены включаются, РНК-полимераза синтезирует мРНК, с которой транслируются ферменты, обеспечивающие сбраживание лактозы. Таким образом, лактозный оперон находится под двойным контролем индуктора (лактозы) и репрессора (глюкозы). Общие принципы регуляции активности генов Кроме лактозного оперона, у кишечной палочки хорошо изучены и другие опероны: триптофановый (trp), гистидиновый (his) и другие. Общие принципы регуляции активности генов в оперонах разработали Франсуа Жакоб и Жак Моно (1961; Нобелевская премия 1965). Согласно концепции Жакоба–Моно, единицей регуляции активности генов у прокариот является оперон. Транскрипция группы структурных генов, регулируется двумя элементами – геном-регулятором и оператором. Оператор часто локализуется между промотором и структурными генами; ген-регулятор может локализоваться рядом с опероном или на некотором расстоянии от него. Если продуктом гена-регулятора является белок-репрессор, его присоединение к оператору блокирует транскрипцию структурных генов, препятствуя присоединению РНК-полимеразы к специфичному участку – промотору, необходимому для инициации транскрипции. Напротив, если белком-регулятором служит активный апоиндуктор, его присоединение к оператору создает условия для инициации транскрипции. В регуляции работы оперонов участвуют также низкомолекулярные вещества – эффекторы, выступающие как индукторы либо корепрессоры структурных генов, входящих в состав оперонов. Различают индуцируемые (включаемые) и репрессируемые (выключаемые) опероны в зависимости от типа влияния на их работу молекул-эффекторов. У индуцируемых оперонов эффектор присоединяется к белкурепрессору и блокирует его связывание с оператором, препятствуя транскрипции структурных генов. Такой тип регуляции работы оперона называют негативным. При негативном контроле эффектор, являющийся корепрессором, присоединяется к неактивному репрессору и активирует его. В результате репрессор приобретает способность присоединяться к оператору и тем самым блокировать транскрипцию оперона. Таким образом, при негативном контроле эффектор связывается с репрессором, что приводит к его инактивации либо активации и соответственно индуцирует либо репрессирует транскрипцию оперона. Наряду с этим, индуцируемые опероны могут находиться под позитивным контролем регуляции, при котором эффектор связывается с регуляторным белком и активирует его. Активный апоиндуктор присоединяется к оператору, что обеспечивает возможность транскрипции оперона. Оба типа контроля регуляции действуют и в отношении репрессируемых оперонов. При позитивном контроле функционирования репрессируемого оперона корепрессор связывается с активным апоиндуктором. Такой комплекс не может присоединяться к оператору, и структурные гены не транскрибируются. При позитивном контроле эффектор присоединяется не к репрессору, а к апоиндуктору, что разрешает, или, напротив, блокирует транскрипцию в зависимости от того, какую форму (активную или неактивную) приобретает апоиндуктор в результате связывания с эффектором. Поскольку при транскрипции оперона, состоящего из нескольких структурных генов, образуется один общий транскрипт в виде молекулы полицистронной мРНК, все эти гены экспрессируются координировано. Особые типы регуляции активности генов У прокариот процессы транскрипции (синтез мРНК на матрице ДНК с помощью РНК-полимеразы) и трансляции (синтеза белка на матрице мРНК при участии рибосом и тРНК) тесно связаны между собой: синтез матрицы мРНК еще не закончен, а синтез белка на этой матрице уже начинается. Таким образом, мРНК одновременно связана и с РНК-полимеразой, и с рибосомой. В результате регуляция активности некоторых оперонов (например, his-оперона) часто связана с активностью специального контролирующего элемента – аттенюатора (от англ. attenuate – ослаблять), представляющего собой лидерный участок ДНК, локализованный в случае his-оперона между оператором и первым структурным геном. В присутствии корепрессора (особым образом модифицированной гистидиновой тРНК) аттенюатор обеспечивает терминацию (обрыв синтеза) мРНК в начале оперона и, таким образом, транскрипции структурных генов не происходит. Аттенюаторы широко распространены среди прокариот. Однако наряду с аттенюаторами, выполняющими функцию негативно действующего регулятора транскрипции, существует и позитивный регулятор his-оперона, присутствие которого облегчает присоединение РНК-полимеразы к промотору. Следует добавить, что транскрипция может осуществляться с разных промоторов. Различают сильные промоторы, к которым РНК-полимераза присоединяется сравнительно легко, и слабые промоторы, к которым РНКполимераза присоединяется только с помощью вспомогательных частиц (их обычно обозначаются символом ζ). Чем больше промоторов задействовано в процессе транскрипции, тем больше образуется РНК. Точно также существуют терминаторы с различной степенью сродства к РНК-полимеразе. От одних терминаторов РНК-полимераза отсоединяется без особых затруднений, а от других – с помощью вспомогательных частиц (их обычно обозначают символом ρ). Биологическое значение оперонов. С одной стороны, оперонная организация дает преимущество с точки зрения регуляции генов, объединенных функционально. Однако оперонная организация не отражает генезиса генов, так как гены в оперонах не являются родственными по происхождению. Поэтому для клетки проблема скорее заключается в том, чтобы дифференцировать действие единой регуляторной системы на каждый отдельный ген. Объединение функционально близких генов в опероны, видимо, постепенно сложилось в эволюции бактерий по той причине, что у них перенос генетической информации обычно осуществляется небольшими порциями (например, при трансдукции или посредством плазмид). Значение имеет само по себе сцепление функционально родственных генов, что позволяет бактериям приобретать необходимую функцию в один этап. 3.3. Регуляция экспрессии генов у высших эукариот Важнейшая особенность функционально-генетической организации эукариот – отсутствие у них оперонов, подобных оперонам бактерий. Однако промоторные и терминаторные участки у эукариот имеются; более того, они более разнообразны, чем у прокариот. Однако структурные гены, контролирующие последовательные этапы метаболического процесса, могут находиться у эукариот в разных участках одной хромосомы или даже в разных хромосомах. Физико-химический и электронно-микроскопический анализ вновь синтезированной РНК показывает, что она состоит из огромных молекул длиной в несколько десятков тысяч нуклеотидов. Поэтому правильнее говорить о функциональной генетической единице у эукариот как о транскриптоне (Г.П. Георгиев), т. е. участке ДНК, с которого считывается единая непрерывная молекула РНК. Доказано, что в ответ на действие указанных индукторов активируется целая батарея структурных генов, среди которых находятся как гены, кодирующие определенные белки, так и гены рРНК и тРНК. Наряду с обычными нуклеотидными последовательностями промоторной и терминаторной областей транскрипции у эукариот обнаружены такие специфические элементы регуляции, как усилители (энхансеры), и глушители (сайленсеры). Энхансеры – это участки ДНК, которые действуют как усилители транскрипции, находясь на расстоянии нескольких сот и даже тысяч пар нуклеотидов от регулируемого гена; в других случаях энхансеры находятся в самих структурные генах в составе интронов. Вероятно, механизм действия энхансеров связан с изменением нуклеосомной структуры хроматина. Сайленсеры – это участки ДНК, которые, располагаясь в нескольких сотнях пар нуклеотидов до или после регулируемого гена, выключает транскрипцию, изменяя структуру хроматина. Существуют мутации, которые не затрагивая сам глушитель, делают его неактивным и тем самым «разрешают» транскрипцию с промотора регулируемого гена. Существенная особенность генетической регуляции в клетках эукариот заключается в том, что процесс транскрипции зависит от состояния хроматина. В частности локальная компактизация ДНК в еѐ отдельных участках полностью блокирует синтез РНК. Вероятно, это связано с тем, что в такие области не может проникнуть РНК-полимераза.Сам факт тотальной регуляции действия генов в настоящее время не вызывает сомнений. Активность генов оценивается по числу типов генных продуктов (РНК-вых копий) в цитоплазме. Этот вопрос был исследован на клетках человека линии HeLa – «стандартной» раковой ткани, культивируемой in vitro в течение десятков лет. Геном клеток HeLa считается сильно дерепрессированным, т. е. в них функционирует значительно большее (около 35 тыс.) число генов, чем в обычных соматических клетках, хотя это не означает, что клетки HeLa производят столь же большое количество конечных генных продуктов – полипептидов. Оказалось, что по функциональной активности гены клеток HeLa могут различаться почти на четыре порядка. Так, существует около 10…12 генов, представленных 12…13 тыс. РНК-вых копий, и несколько десятков генов, которым в цитоплазме соответствуют единичные молекулы мРНК. Регуляция активности генов в ходе онтогенеза у эукариот Клетки различных тканей растений и животных отличаются друг от друга главным образом тем, что в них происходит синтез различных групп белков, что и определяет их структурную и функциональную специфику. Таким образом, проблема генетического контроля индивидуального развития тесно связана с проблемой дифференциальной экспрессии генов. Экспрессия генов зависит от факторов внешней и внутренней среды и, в то же время, находится под контролем генотипа. Например, известны особые гомеозисные гены, контролирующие экспрессию других генов. Экспрессия генов закономерно изменяется в ходе онтогенеза. В качестве примера рассмотрим изменение структуры гемоглобина у человека. Гемоглобин – тетрамерный белок, в состав которого входят четыре полипептидных цепи и четыре молекулы гема. Каждая молекула гема содержит один атом железа, связывающий одну молекулу кислорода или молекулу углекислого газа. Две полипептидных цепи, входящие в состав одного тетрамера, носят общее название α, а две – общее название β. В целом структура тетрамера описывается формулой α2β2. Однако эта общая формула нуждается в уточнении. Полипептиды типа α представлены двумя подтипами – δ и а. Оба подтипа кодируются дуплицированными генами, локализованными в 16-й хромосоме, однако гены δ экспрессируются в раннем эмбриогенезе, а гены α – преимущественно у плодов и у взрослых организмов. Полипептиды типа β представлены подтипами ε, γ, δ, β. Кодирующие их гены расположены в 11-й хромосоме в указанном порядке, который соответствует порядку их экспрессии: ген ε экспрессируется на ранних стадиях развития эмбрионов, γ – у плода, δ – у новорождѐнных, β – у взрослых. В целом «взрослый» гемоглобин состоит из четырех цепей (двух цепей α и двух цепей β) и описывается формулой α2β2. Однако экспрессия гена δ у взрослого человека полностью не прекращается, и около 1% β-цепей замещено на гемоглобин δ (детский гемоглобин). Регуляция экспрессии генов в ходе онтогенеза осуществляется на различных уровнях: генном, транскрипционном, посттранскрипционном, трансляционном и посттрансляционном (функциональном). 1. Регуляция на генном уровне 1.1. Модификация ДНК (замена мажорных «обычных» азотистых оснований – аденина, гуанина, цитозина и тимина – на минорные «редкие» азотистые основания, обычно на метил-цитозин или метил-гуанин). Доказано, что метилирование цитозина существенно влияет на экспрессию генов. Например, активные гены гемоглобина менее метилированы, чем неактивные. 1.2. Увеличение объема ДНК в клетке путем дифференциальной амплификации ДНК или за счет образования политенных хромосом. Дифференциальная (избирательная, или селективная) амплификация ДНК, которая заключается в многократном копировании отдельных генов, например, генов рРНК. Это явление наблюдается у прокариот, а также у эукариот, например, в ооцитах многих животных, в частности, у амфибий. Амплификация связана с увеличением объема яйца в сотни и тысячи раз. Чтобы заполнить такой огромный объем клетки рибосомами, гены рДНК сами увеличиваются в числе настолько, что, например, у шпорцевой лягушки по окончании амплификации содержание рДНК почти равно количеству ДНК, заключенному в диплоидном наборе хромосом. Число ядрышек (органоидов, контролирующих образование рибосом) возрастает с 2 единиц до 1,5 тыс. Амплификация рРНК происходит и при мегаспорогенезе у растений. (Замечательная особенность молекулярного механизма амплификации заключается в том, что он осуществляется по принципу катящегося кольца – как у прокариот. Одна из копий гена рДНК покидает хромосому, превращается в экстрахромосомную копию, затем замыкается в кольцо, из которого как бы вытягивается хвост длиной в несколько десятков микрометров. Затем эта структура вновь циклизуется, образуя большое кольцо, на основе которого формируется ядрышко.) Другим механизмом увеличения объема ДНК в клетке является образование политенных хромосом, например, в слюнных железах личинок двукрылых насекомых, в клетках зародышевого мешка Покрытосеменных растений. Частичная политения обнаружена и у млекопитающих: происходит многократное удвоение не всей молекулы ДНК, а только некоторых ее участков. 1.3. Различные случаи программированных количественных изменений ДНК. Примером регуляции, обусловленной транспозицией, служит феномен смены фаз (типа жгутиков) у сальмонелл. Действующий в клетках сальмонелл переключатель содержит промотор, который может изменять свою пространственную ориентацию. В одной ориентации промотор обеспечивает транскрипцию гена Н2, кодирующего синтез жгутиков одного типа, с одновременной репрессией гена H1, кодирующего синтез жгутиков другого типа. В противоположной ориентации промотора ген Н2 не экспрессируется, в то время как экспрессия гена H1 становится возможной. 1.4. Сплайсинг ДНК. Регуляция, связанная со сплайсингом ДНК, изучена на примере генов, кодирующих синтез антител. Известно, что разнообразные чужеродные вещества – антигены, попадающие в наш организм, – связываются особыми белками – антителами, или иммуноглобулинами. Млекопитающие могут продуцировать до миллиона различных антител, которые вырабатываются Ти В-лимфоцитами иммунной системы. Существует особый раздел генетики – иммуногенетика,– который изучает генетический контроль иммунного ответа. Основу молекул иммуноглобулинов составляет сложный белок, состоящий из четырех полипептидных цепей – двух тяжелых (Н) и двух легких (L), – связанных дисульфидными мостиками. Оба типа цепей имеют константные (С) и вариабельные (V) участки. Центр связывания антигена образуют вариабельные участки Н- и L-цепей. Механизм объединения константных и вариабельных участков в одной и той же полипептидной цепи подробно изучен. Доказано, что у эмбрионов фрагменты ДНК, кодирующие V- и С-участки, пространственно разделены. При развитии системы иммунитета у позвоночных животных и человека происходит дифференцировка лимфоцитов, в ходе которой гены, кодирующие V- и Сучастки, перестраиваются таким образом, что в итоге они оказываются частями одного и того же гена, транскрибируемого как целое. Таким образом, сплайсинг ДНК обеспечивает сшивание консервативных (т.е. постоянно присутствующих) районов этих генов с различными варьирующими. В результате появляется большое число типов антител, поскольку любая консервативная область может быть присоединена к любой варьирующей. 1.5. Диминуция хроматина. У некоторых организмов (у аскарид, циклопов) в соматических клетках происходит необратимая утрата части генетического материала (от 20 до 80% ДНК). В полном объеме исходная генетическая информация сохраняется только в клетках зародышевого пути, т. е. в клетках, которые дадут в дальнейшем начало половым клеткам. Именно гаметы содержат всю полноту генетической информации данного вида и составляют непрерывный, потенциально бессмертный зародышевый путь. Смертны соматические клетки индивидуумов, представляющих собой как бы ответвления от зародышевого пути, возникающие после оплодотворения. А. Вайсман считал диминуцию хроматина универсальным механизмом дифференцировки клеток и тканей, однако в дальнейшем было показано, что этот способ дифференцировки встречается довольно редко. Например, подобное явление наблюдается у инфузорий: в диплоидном микронуклеусе полностью сохраняется исходный набор генов, а в полиплоидном макронуклеусе ~10% генов (правда, за счет полиплоидизации оставшаяся информация многократно дублируется). 1.6. Изменение активности целых хромосом. Известно, что у самок млекопитающих в кариотипе присутствует две Xхромосомы, а у самцов одна X- и одна Y-хромосома. Несмотря на то, что женские особи млекопитающих имеют две Х-хромосомы, а мужские – только одну, экспрессия генов Х-хромосомы происходит на одном и том же уровне у обоих полов. Это объясняется тем, что у самок в каждой клетке полностью инактивирована одна Х-хромосома. Эту хромосому можно видеть в интерфазе в форме гетерохроматинового тельца, названного тельцем Барра. Х-хромосома инактивируется на ранней стадии эмбрионального развития, соответствующей времени имплантации. При этом в разных клетках отцовская и материнская Х-хромосомы выключаются случайно. Состояние инактивации данной Х-хромосомы наследуется в ряду клеточных делений. Таким образом, женские особи, гетерозиготные по генам половых хромосом, представляют собой мозаики. Широко известный пример проявления такой мозаичности — черепаховые кошки, имеющие черные и желтые пятна. Эти кошки гетерозиготны по гену С Y /С B (C Y – желтый мех, С B – черный мех). Желтые и черные пятна у них развиваются в результате случайной инактивации в раннем эмбриогенезе Х-хромосомы с аллелью СB или CY. Черепаховую окраску почти всегда имеют кошки, если же изредка обнаруживаются коты такой окраски, то они имеют хромосомную конституцию XXY. 2. Регуляция на уровне транскрипции Во многих случаях дифференцировка происходит путем регуляции транскрипции мРНК. Интенсивное функционирование отдельных генов или их блоков соответствует определенным этапам развития и дифференцировки. При изучении гигантских политенных хромосом (в слюнных железах личинок дрозофил) и петель в хромосомах типа «ламповых щеток» (в ооцитах на стадии профазы I) было установлено, что мРНК синтезируется с разной скоростью в разных участках хромосом, в частности, образование пуфов и петель связано с повышением интенсивности синтеза мРНК. Динамика образования пуфов. В гигантских политенных хромосомах часто наблюдаются вздутия определенных районов хромосом, обусловленные декомпактизацией отдельных дисков и интенсивным синтезом в них РНК. Эти вздутия называются пуфы (или кольца Бальбиани). Пуфы представляют собой места интенсивного синтеза мРНК. Динамика образования пуфов на гигантских хромосомах в процессе развития двукрылых является отражением смены активности генов. Формирование комплексов пуфов, характерных для клеток отдельных тканей и органов дифференцированного организма, является показателем общего уровня наиболее интенсивно протекающих метаболических процессов в данных клетках. При снижении синтетической активности петли синтезированная мРНК отделяется от хромосомы и пуфы политенных хромосом исчезают. Установлена роль стероидных гормонов (в частности, экдизона – гормона окукливания) в индукции пуфов, а также роль белков, синтезированных ранними пуфами, в индукции поздних пуфов. Таким образом, стероидные гормоны и белки, вероятно, не единственные факторы, ответственные за переключение генов в онтогенезе, а, следовательно, и за смену фаз индивидуального развития организма. Доказано, что после введения этого гормона молодым личинкам довольно быстро возникают специфические пуфы, причем продолжительность их образования зависит от количества введенного гормона. Последовательность образования пуфов изменяется также при воздействиях различными химическими агентами или температурными условиями. Некоторые антибиотики, влияющие на обмен РНК (например, актиномицин), подавляют образование пуфов, а антибиотики, ингибирующие синтез белка (например, пуромицин), не влияют на этот процесс. Следовательно, активность пуфов находится под контролем гормональных факторов (закодированных в генотипе) и факторов внешней среды. Особенно велика роль стероидных гормонов в регуляции генной активности у животных. Известно, что гормоны синтезируются в специализированных клетках желез внутренней секреции и циркулируют по всему организму. Однако отдельные гормоны активируют гены не во всех клетках, а только в клетках-мишенях, которые содержат специальные рецепторные белки, с которыми специфически связываются молекулы гормона. Это связывание происходит в цитоплазме, а затем образовавшийся комплекс проникает в ядро, где он взаимодействует с определенными негистоновыми белками хромосом. В отсутствие гормонов эти белки блокируют либо промоторные, либо иные, пока неизвестные регуляторные участки определенных генов. Комплекс «гормон – рецепторный белок» снимает блокирующее действие негистонового белка-репрессора, следствием чего являются транскрипция данного гена, созревание мРНК, транспорт ее в цитоплазму и синтез белка. Образование и функционирование хромосом типа «ламповых щеток». Связь синтетической активности с морфологическими преобразованиями хромосом была установлена при изучении оогенеза у амфибий, в ходе которого образуются хромосомы типа «ламповых щеток» (рис. _____ в конце лекции). Эти хромосомы получили свое название за сходство со щетками, которыми когда-то чистили керосиновые лампы. Они имеют отчетливо выраженное хромомерное (узелковое) строение. Из хромомеров в виде петель вытянуты ДНК-вые оси хромосом. Поскольку хромосомы типа ламповых щеток существуют в диплотене и состоят из четырех хроматид, каждый участок таких хромосом представлен четырьмя хромомерами и четырьмя петлями. Окружение петель представляет собой гранулы и фибриллы, состоящие из вновь синтезированной РНК и белков. Таким образом, петли – это участки хромомера с интенсивной транскрипцией. Обычно в них легко различают тонкий конец, где начинает свое движение РНК-полимераза, и толстый конец, где транскрипция заканчивается. При снижении синтетической активности петли синтезированная РНК отделяется от хромосомы и петля спадает. Число петель близко к числу типов РНК, присутствующих в цитоплазме. Эта РНК частично используется для синтеза рибосом и белков цитоплазмы яйца. Однако большая часть молекул мРНК, синтезированных хромосомами типа ламповых щеток, используется позже во время раннего эмбриогенеза. Цитохимическое изучение хромосом типа «ламповых щеток» выявило их функциональное сходство с политенными хромосомами. 3. Регуляция на посттранскрипционном уровне: модификации (сплайсинг) мРНК Регуляция на уровне процессинга РНК обеспечивает возможность образования различных типов зрелой, функционально активной мРНК. Процессинг РНК регулируется с помощью рибозимов (катализаторов рибонуклеиновой природы) и ферментов матураз. Одной из форм сплайсинга является альтернативный сплайсинг, при котором одному участку ДНК и одному первичному транскрипту (пре-мРНК) может соответствовать несколько типов зрелой мРНК и, соответственно, несколько изотипов (т.е. разных форм) одного и того же белка, например, мышечного белка тропонина. Твердо установлено, что некоторые генетические заболевания человека (фенилкетонурия, некоторые гемоглобинопатии) обусловлены нарушением сплайсинга. Сплайсинг РНК открыт сравнительно недавно, поэтому достоверных данных по регуляции активности генов на этом уровне недостаточно. Наиболее подробно изучена регуляция генов, контролирующих усвоение галактозы у дрожжей. Показано, что эти системы регуляции действуют как на уровне транскрипции, так и на посттранскрипционном уровне. При этом осуществляется многоступенчатая, или каскадная, регуляция, в которой участвуют элементы позитивного и негативного контроля, последовательно регулирующие активность друг друга. 4. Регуляция на уровне трансляции Регуляция на уровне трансляции обусловлена различной активностью разных типов мРНК. Например, у прокариот некоторые мРНК транслируются только в присутствии эритромицина. У эукариот регуляция генной активности на уровне трансляции хорошо прослежена на примере морского ежа. Его неоплодотворенные яйца содержат большое количество «замаскированной» (нетранслируемой) мРНК. У дрозофилы подобные мРНК, кодирующие белки оболочки яйцеклетки, накапливаются в цитоплазме. 5. Регуляция на уровне посттрансляционной модификации белков. Экспрессия генов на уровне посттрансляционной модификации полипептидов регулируется путем посттрансляционной модификацией белков (фосфорилированием, ацетилированием, расщеплением исходной полипептидной цепи на более мелкие фрагменты и т.д.). Например, белковый гормон инсулин, синтезирующийся в клетках поджелудочной железы, образуется в форме препроинсулина, из которого затем путем отщепления «лишних» пептидов образуется проинсулин. Из проинсулина вырезаются две субъединицы, представляющие собой А- и В-цепи инсулина. Эти две цепи сшиваются между собой с помощью дисульфидных мостиков. Четыре образовавшиеся АВ-структуры соединяются в белковый тетрамер, который присоединяет два иона Zn2+, и в результате образуется зрелый инсулин. Широко распространен механизм регуляции активности ферментов, основанный на присоединении к ним молекул-эффекторов. Чаще всего в роли эффекторов выступают конечные продукты цепей биосинтеза, которые связываются с первым или с одним из первых ферментов данного метаболического пути и подавляют его активность, тем самым выключая всю цепь синтеза. Это ингибирование конечным продуктом, благодаря которому регулируются сразу несколько этапов метаболизма. Конечный продукт связывается с ферментом не в его активном центре, а в аллостерическом центре, и такое взаимодействие индуцирует изменение (инактивацию) активного центра фермента. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 4. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ НАСЛЕДСТВЕННОСТИ ВО ВНУТРИВИДОВОЙ ГИБРИДИЗАЦИИ. Лектор: ст.п. Мамедова М. З. Лектор: ст.п. Мамедова М. З. 1. КАРИОТИП 2. ГЕНОМ. 3. ЗАКОНЫ МЕНДЕЛЯ. Кариотип Кариотип – это совокупность метафазных хромосом, характерных для определенного вида организмов. Постоянство кариотипа поддерживается с помощью точных механизмов митоза и мейоза. Изучение кариотипов и их изменчивости важно для здравоохранения (многие генетические заболевания связаны с изменением кариотипа), селекции (многие сорта растений различаются по кариотипу) и экологического биомониторинга (кариотип может изменяться под воздействием экологических факторов). Кариотип используется в качестве видовой характеристики (существует особый раздел систематики – кариосистематика). Кариотипический критерий является одним из важнейших критериев вида. Сущность этого критерия заключается в том, что все особи данного вида характеризуются определенным кариотипом. В понятие «кариотип» включается число хромосом, их размеры, морфология, особенности продольной дифференцировки. Если оба плеча хромосомы равны по длине, то такая хромосома называется метацентрической, если неравны – то такая хромосома называется субметацентрической, если же одно из плеч очень короткое, то такая хромосома называется акроцентрической. Конечные участки хроматид называются теломеры. У некоторых хромосом в области теломер имеются удаленные структуры (спутники); это спутничные хромосомы. При специальных методах окраски (дифференциальная окраска) видно, что хромосомы состоят из чередующихся участков – дисков: С, Т, R, G, N, Q. Чередование дисков специфично для каждой хромосомы. Таким образом, метафазные хромосомы обладают индивидуальностью. Минимально возможный набор хромосом в клетке называется геном. Термин геном (нем. Genom) предложил немецкий ботаник Ганс Винклер в 1920 г. для обозначения минимального набора хромосом. Такое представление о геноме сохраняется и в современной цитогенетике. Однако вскоре было доказано, что в состав хромосом входит ДНК (Фёльген, 1924), а к середине XX в. было установлено, что именно ДНК является носителем наследственной информации (О.Эвери с сотр., 1944; Дж. Уотсон и Ф.Крик, 1953). Поэтому в настоящее время в молекулярной генетике термином геном все чаще обозначают минимальную упорядоченную совокупность всех молекул ДНК в клетке. Геном Геном – это характеристика вида, а не особи. Геномы разных видов обозначаются латинскими буквами (А, B, C…). Кариотипы «чистых» видов включают только один геном (например, в клетках культурной ржи содержится геном R). Кариотипы гибридов и видов гибридного происхождения включают несколько геномов (например, в клетках тритикале содержатся геномы A, B и R; в клетках твердых пшениц – геномы А и В (у отдельных видов А и G)). Тогда геном «чистого» вида можно назвать элементарным, а геном гибрида – комплексным. Число хромосом в геноме называется основным хромосомным числом и обозначается символом х. Например, для голосеменных растений х = 12, а для покрытосеменных основное число х исходно равно 7 (хотя у ряда покрытосеменных встречаются и иные основные хромосомные числа: х = 12 у пасленовых, х = 19 у ивовых). Изучение геномов важно с точки зрения медицины, теории селекционного процесса и теории эволюции. Организацию генома удобнее рассмотреть на примере многоклеточных животных. У этих организмов различают два типа клеток: соматические клетки, из которых построено тело (сома) организмов, и половые клетки (гаметы). Число хромосом в половых клетках большинства животных соответствует основному хромосомному числу и называется гаплоидным числом хромосом (обозначается символом n), тогда x = n. В гаплоидном наборе каждая хромосома существует в единственном числе (представлена одним гомологом). В соматических клетках содержится удвоенный, или диплоидный набор хромосом, который обозначается символом 2n. В диплоидном наборе каждая хромосома представлена двумя гомологами (исключение составляют половые хромосомы у гетерогаметного пола, например, у самцов большинства млекопитающих X и Y–хромосомы негомологичны). Рассмотрим организацию генома человека на цитогенетическом уровне. Число хромосом в гаплоидном наборе (основное число) равно 23. Все хромосомы пронумерованы и распределены по классам. Из них к классу А относятся хромосомы 1, 2, 3; к классу В – хромосомы 4, 5; к классу С – хромосомы 6, 7, 8, 9, 10, 11, 12; к классу D – хромосомы 13, 14, 15; к классу Е – хромосомы 16, 17, 18; к классу F – хромосомы 19, 20; к классу G – хромосомы 21, 22. Перечисленные хромосомы называются аутосомы, они имеются и у мужчин, и у женщин. В диплоидном наборе (2 n = 46) каждая аутосома представлена двумя гомологами. Двадцать третья хромосома является половой хромосомой (гоносомой), она может быть представлена или X или Y–хромосомой. Половые хромосомы у женщин представлены двумя X–хромосомами, а у мужчин одной X–хромосомой и одной Y– хромосомой. Законы Менделя Генетика — наука о закономерностях наследственности и изменчивости. Датой «рождения» генетики можно считать 1900 год, когда Г. Де Фриз в Голландии, К. Корренс в Германии и Э. Чермак в Австрии независимо друг от друга «переоткрыли» законы наследования признаков, установленные Г. Менделем еще в 1865 году. Наследственность — свойство организмов передавать свои признаки от одного поколения к другому. Изменчивость — свойство организмов приобретать новые по сравнению с родителями признаки. В широком смысле под изменчивостью понимают различия между особями одного вида. Признак — любая особенность строения, любое свойство организма. Развитие признака зависит как от присутствия других генов, так и от условий среды, формирование признаков происходит в ходе индивидуального развития особей. Поэтому каждая отдельно взятая особь обладает набором признаков, характерных только для нее. Фенотип — совокупность всех внешних и внутренних признаков организма. Ген — функционально неделимая единица генетического материала, участок молекулы ДНК, кодирующий первичную структуру полипептида, молекулы транспортной или рибосомной РНК. В широком смысле ген — участок ДНК, определяющий возможность развития отдельного элементарного признака. Генотип — совокупность генов организма. Локус — местоположение гена в хромосоме. Аллельные гены — гены, расположенные в идентичных локусах гомологичных хромосом. Гомозигота — организм, имеющий аллельные гены одной молекулярной формы. Гетерозигота — организм, имеющий аллельные гены разной молекулярной формы; в этом случае один из генов является доминантным, другой — рецессивным. Рецессивный ген — аллель, определяющий развитие признака только в гомозиготном состоянии; такой признак будет называться рецессивным. Доминантный ген — аллель, определяющий развитие признака не только в гомозиготном, но и в гетерозиготном состоянии; такой признак будет называться доминантным. Методы генетики Основным является гибридологический метод — система скрещиваний, позволяющая проследить закономерности наследования признаков в ряду поколений. Впервые разработан и использован Г. Менделем. Отличительные особенности метода: 1) целенаправленный подбор родителей, различающихся по одной, двум, трем и т. д. парам контрастных (альтернативных) стабильных признаков; 2) строгий количественный учет наследования признаков у гибридов; 3) индивидуальная оценка потомства от каждого родителя в ряду поколений. Скрещивание, при котором анализируется наследование одной пары альтернативных признаков, называется моногибридным, двух пар — дигибридным, нескольких пар — полигибридным. Под альтернативными признаками понимаются различные значения какого-либо признака, например, признак — цвет горошин, альтернативные признаки — желтый цвет, зеленый цвет горошин. Кроме гибридологического метода, в генетике используют: генеалогический — составление и анализ родословных; цитогенетический — изучение хромосом; близнецовый — изучение близнецов; популяционностатистический метод — изучение генетической структуры популяций. Закон единообразия гибридов первого поколения, или первый закон Менделя Успеху работы Менделя способствовал удачный выбор объекта для проведения скрещиваний — различные сорта гороха. Особенности гороха: 1) относительно просто выращивается и имеет короткий период развития; 2) имеет многочисленное потомство; 3) имеет большое количество хорошо заметных альтернативных признаков (окраска венчика — белая или красная; окраска семядолей — зеленая или желтая; форма семени — морщинистая или гладкая; окраска боба — желтая или зеленая; форма боба — округлая или с перетяжками; расположение цветков или плодов — по всей длине стебля или у его верхушки; высота стебля — длинный или короткий); 4) является самоопылителем, в результате чего имеет большое количество чистых линий, устойчиво сохраняющих свои признаки из поколения в поколение. Опыты по скрещиванию разных сортов гороха Мендель проводил в течение восьми лет, начиная с 1854 года. 8 февраля 1865 года Г. Мендель выступил на заседании Брюннского общества естествоиспытателей с докладом «Опыты над растительными гибридами», где были обобщены результаты его работы. Опыты Менделя были тщательно продуманы. Если его предшественники пытались изучить закономерности наследования сразу многих признаков, то Мендель свои исследования начал с изучения наследования всего лишь одной пары альтернативных признаков. Мендель взял сорта гороха с желтыми и зелеными семенами и произвел их искусственное перекрестное опыление: у одного сорта удалил тычинки и опылил их пыльцой другого сорта. Гибриды первого поколения имели желтые семена. Аналогичная картина наблюдалась и при скрещиваниях, в которых изучалось наследование других признаков: при скрещивании растений, имеющих гладкую и морщинистую формы семян, все семена полученных гибридов были гладкими, от скрещивания красноцветковых растений с белоцветковыми все полученные — красноцветковые. Мендель пришел к выводу, что у гибридов первого поколения из каждой пары альтернативных признаков проявляется только один, а второй как бы исчезает. Проявляющийся у гибридов первого поколения признак Мендель назвал доминантным, а подавляемый — рецессивным. При скрещивании гомозиготных особей, отличающихся по одной паре альтернативных признаков, наблюдается единообразие гибридов первого поколения как по фенотипу, так и по генотипу. Генетическая схема закона единообразия Менделя (А — желтый цвет горошин, а — зеленый цвет горошин) Р Типы гамет F1 ♀AA желтые А Закон расщепления, или второй закон Менделя × Aа желтые 100% ♂аа зеленые а Г. Мендель дал возможность самоопылиться гибридам первого поколения. У полученных таким образом гибридов второго поколения проявился не только доминантный, но и рецессивный признак. Результаты опытов приведены в таблице Признаки Доминантные Рецессивные Всего Форма семян Число 5474 % 74,74 Число 1850 % 25,26 7324 Окраска семядолей 6022 75,06 2001 24,94 8023 Окраска семенной кожуры 705 75,90 224 24,10 929 Форма боба 882 74,68 299 25,32 1181 Окраска боба 428 73,79 152 26,21 580 Расположение цветков 651 75,87 207 24,13 858 Высота стебля 787 73,96 277 26,04 1064 Всего: 14949 74,90 5010 25,10 19959 Анализ данных таблицы позволил сделать следующие выводы: 1. единообразия гибридов во втором поколении не наблюдается: часть гибридов несет один (доминантный), часть — другой (рецессивный) признак из альтернативной пары; 2. количество гибридов, несущих доминантный признак, приблизительно в три раза больше, чем гибридов, несущих рецессивный признак; 3. рецессивный признак у гибридов первого поколения не исчезает, а лишь подавляется и проявляется во втором гибридном поколении. Явление, при котором часть гибридов второго поколения несет доминантный признак, а часть — рецессивный, называют расщеплением. Причем, наблюдающееся у гибридов расщепление не случайное, а подчиняется определенным количественным закономерностям. На основе этого Мендель сделал еще один вывод: при скрещивании гибридов первого поколения в потомстве происходит расщепление признаков в определенном числовом соотношении Второй закон Менделя – закон расщепления – формулируется следующим образом: при скрещивании гибридов первого поколения наблюдается расщепление в соотношении 3 : 1 по фенотипу и 1 : 2 : 1 по генотипу. Генетическая схема закона расщепления Менделя (А — желтый цвет горошин, а — зеленый цвет горошин): ♀Aa желтые P Типы гамет F2 × ♂Aa желтые A a A a AA желтые Aa желтые 75% Aa желтые aa зеленые 25% Закон чистоты гамет С 1854 года в течение восьми лет Мендель проводил опыты по скрещиванию растений гороха. Им было выявлено, что в результате скрещивания различных сортов гороха друг с другом гибриды первого поколения обладают одинаковым фенотипом, а у гибридов второго поколения имеет место расщепление признаков в определенных соотношениях. Для объяснения этого явления Мендель сделал ряд предположений, которые получили название «гипотезы чистоты гамет», или «закона чистоты гамет». Мендель предположил, что: 1. за формирование наследственные факторы; признаков отвечают какие-то дискретные 2. организмы содержат два фактора, определяющих развитие признака; 3. при образовании гамет в каждую из них попадает только один из пары факторов; 4. при слиянии мужской и женской гамет эти наследственные факторы не смешиваются (остаются чистыми). В 1909 году В. Иогансен назовет эти наследственные факторы генами, а в 1912 году Т. Морган покажет, что они находятся в хромосомах. Для доказательства своих предположений Г. Мендель использовал скрещивание, которое сейчас называют анализирующим (анализирующее скрещивание — скрещивание организма, имеющего неизвестный генотип, с организмом, гомозиготным по рецессиву). Наверное, Мендель рассуждал следующим образом: «Если мои предположения верны, то в результате скрещивания F1 с сортом, обладающим рецессивным признаком (зелеными горошинами), среди гибридов будут половина горошин зеленого цвета и половина горошин — желтого». Как видно из приведенной ниже генетической схемы, он действительно получил расщепление 1:1 и убедился в правильности своих предположений и выводов, но современниками он понят не был. Его доклад «Опыты над растительными гибридами», сделанный на заседании Брюннского общества естествоиспытателей, был встречен полным молчанием. Р Типы гамет F ♀Аа желтые A Аа желтые 50% × a ♂aа зеленые a аa зеленые 50% Цитологические основы первого и второго законов Менделя Во времена Менделя строение и развитие половых клеток не было изучено, поэтому его гипотеза чистоты гамет является примером гениального предвидения, которое позже нашло научное подтверждение. Явления доминирования и расщепления признаков, наблюдавшиеся Менделем, в настоящее время объясняются парностью хромосом, расхождением хромосом во время мейоза и объединением их во время оплодотворения. Обозначим ген, определяющий желтую окраску, буквой А, а зеленую — а. Поскольку Мендель работал с чистыми линиями, оба скрещиваемых организма — гомозиготны, то есть несут два одинаковых аллеля гена окраски семян (соответственно, АА и аа). Во время мейоза число хромосом уменьшается в два раза, и в каждую гамету попадает только одна хромосома из пары. Так как гомологичные хромосомы несут одинаковые аллели, все гаметы одного организмы будут содержать хромосому с геном А, а другого — с геном а. При оплодотворении мужская и женская гаметы сливаются, и их хромосомы объединяются в одной зиготе. Получившийся от скрещивания гибрид становится гетерозиготным, так как его клетки будут иметь генотип Аа; один вариант генотипа даст один вариант фенотипа — желтый цвет горошин. У гибридного организма, имеющего генотип Аа во время мейоза, хромосомы расходятся в разные клетки и образуется два типа гамет — половина гамет будет нести ген А, другая половина — ген а. Оплодотворение — процесс случайный и равновероятный, то есть любой сперматозоид может оплодотворить любую яйцеклетку. Поскольку образовалось два типа сперматозоидов и два типа яйцеклеток, возможно возникновение четырех вариантов зигот. Половина из них — гетерозиготы (несут гены А и а), 1/4 — гомозиготы по доминантному признаку (несут два гена А) и 1/4 — гомозиготы по рецессивному признаку (несут два гена а). Гомозиготы по доминанте и гетерозиготы дадут горошины желтого цвета (3/4), гомозиготы по рецессиву — зеленого (1/4). Закон независимого комбинирования (наследования) признаков, или третий закон Менделя Организмы отличаются друг от друга по многим признакам. Поэтому, установив закономерности наследования одной пары признаков, Г. Мендель перешел к изучению наследования двух (и более) пар альтернативных признаков. Для дигибридного скрещивания Мендель брал гомозиготные растения гороха, отличающиеся по окраске семян (желтые и зеленые) и форме семян (гладкие и морщинистые). Желтая окраска (А) и гладкая форма (В) семян — доминантные признаки, зеленая окраска (а) и морщинистая форма (b) — рецессивные признаки. Скрещивая растение с желтыми и гладкими семенами с растением с зелеными и морщинистыми семенами, Мендель получил единообразное гибридное поколение F1 с желтыми и гладкими семенами. От самоопыления 15-ти гибридов первого поколения было получено 556 семян, из них 315 желтых гладких, 101 желтое морщинистое, 108 зеленых гладких и 32 зеленых морщинистых (расщепление 9:3:3:1). Анализируя полученное потомство, Мендель обратил внимание на то, что: 1) наряду с сочетаниями признаков исходных сортов (желтые гладкие и зеленые морщинистые семена), при дигибридном скрещивании появляются и новые сочетания признаков (желтые морщинистые и зеленые гладкие семена); 2) расщепление по каждому отдельно взятому признаку соответствует расщеплению при моногибридном скрещивании. Из 556 семян 423 были гладкими и 133 морщинистыми (соотношение 3:1), 416 семян имели желтую окраску, а 140 — зеленую (соотношение 3:1). Мендель пришел к выводу, что расщепление по одной паре признаков не связано с расщеплением по другой паре. Для семян гибридов характерны не только сочетания признаков родительских растений (желтые гладкие семена и зеленые морщинистые семена), но и возникновение новых комбинаций признаков (желтые морщинистые семена и зеленые гладкие семена). При дигибридном скрещивании дигетерозигот у гибридов имеет место расщепление по фенотипу в отношении 9:3:3:1, по генотипу в отношении 4:2:2:2:2:1:1:1:1, признаки наследуются независимо друг от друга и комбинируются во всех возможных сочетаниях. Р Типы гамет F1 P Типы гамет ♀АABB желтые, гладкие AB × ♂aаbb зеленые, морщинистые ab AaBb желтые, гладкие, 100% ♀АaBb желтые, гладкие AB Ab aB ab × ♂AаBb желтые, гладкие AB Ab ab aB Генетическая схема закона независимого комбинирования признаков: ♂ AB Ab aB ab AABB желтые гладкие AABb желтые гладкие AaBB желтые гладкие AaBb желтые гладкие Ab AABb желтые гладкие AАbb желтые морщинистые AaBb желтые гладкие Aabb желтые морщинистые aB AaBB желтые гладкие AaBb желтые гладкие aaBB зеленые гладкие aaBb зеленые гладкие ab AaBb желтые гладкие Aabb желтые морщинистые aaBb зеленые гладкие aabb зеленые морщинистые Гаметы: ♀ AB Анализ результатов скрещивания по фенотипу: желтые, гладкие — 9/16, желтые, морщинистые — 3/16, зеленые, гладкие — 3/16, зеленые, морщинистые — 1/16. Расщепление по фенотипу 9:3:3:1. Анализ результатов скрещивания по генотипу: AaBb — 4/16, AABb — 2/16, AaBB — 2/16, Aabb — 2/16, aaBb — 2/16, ААBB — 1/16, Aabb — 1/16, aaBB — 1/16, aabb — 1/16. Расщепление по генотипу 4:2:2:2:2:1:1:1:1. Если при моногибридном скрещивании родительские организмы отличаются по одной паре признаков (желтые и зеленые семена) и дают во втором поколении два фенотипа (21) в соотношении (3 + 1)1, то при дигибридном они отличаются по двум парам признаков и дают во втором поколении четыре фенотипа (22) в соотношении (3 + 1)2. Легко посчитать, сколько фенотипов и в каком соотношении будет образовываться во втором поколении при тригибридном скрещивании: восемь фенотипов (23) в соотношении (3 + 1)3. Если расщепление по генотипу в F2 при моногибридном поколении было 1:2:1, то есть было три разных генотипа (31), то при дигибридном образуется 9 разных генотипов — 32, при тригибридном скрещивании образуется 33 — 27 разных генотипов. Третий закон Менделя справедлив только для тех случаев, когда гены анализируемых признаков находятся в разных парах гомологичных хромосом. Цитологические основы третьего закона Менделя Пусть А — ген, обусловливающий развитие желтой окраски семян, а — зеленой окраски, В — гладкая форма семени, b — морщинистая. Скрещиваются гибриды первого поколения, имеющие генотип АаВb. При образовании гамет из каждой пары аллельных генов в гамету попадает только один, при этом в результате случайного расхождения хромосом в первом делении мейоза ген А может попасть в одну гамету с геном В или с геном b, а ген а — с геном В или с геном b. Таким образом, каждый организм образует четыре сорта гамет в одинаковом количестве (по 25%): АВ, Ab, aB, ab. Во время оплодотворения каждый из четырех типов сперматозоидов может оплодотворить любую из четырех типов яйцеклеток. В результате оплодотворения возможно появление девяти генотипических классов, которые дадут четыре фенотипических класса. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИРПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 5. ХРОМОСОМНАЯ ТЕОРИЯ НАСЛЕДСТВЕННОСТИ Лектор: ст.п. Мамедова М. З. 1. Хромосомная теория наследственности 2. Кроссинговер 3. Принципы генетического картирования 1. Хромосомная теория наследственности. Вскоре после переоткрытия законов Менделя немецкий цитолог Теодор Бовери (1902) представил доказательства в пользу участия хромосом в процессах наследственной передачи, показав, что нормальное развитие морского ежа возможно только при наличии всех хромосом. В это же время (1903 г.) американский цитолог Уильям Сэттон обратил внимание на параллелизм в поведении хромосом в мейозе и гипотетических факторов наследственности, существование которых предсказал еще сам Мендель. Уильям Сэттон предположил, что в одной хромосоме может находиться несколько генов. В этом случае должно наблюдаться сцепленное наследование признаков, т.е. несколько разных признаков могут наследоваться так, как будто они контролируются одним геном. В 1906 г. У. Бэтсон и Р. Пеннет обнаружили сцепленное наследование у душистого горошка. Они изучали совместное наследование: окраски цветков (пурпурная или красная) и формы пыльцевых зерен (удлиненная или округлая). При скрещивании дигетерозигот в их потомстве наблюдалось расщепление 11,1:0,9:0,9:3,1 вместо ожидаемого 9:3:3:1. Создавалось впечатление, что факторы окраски и формы пыльцы имеют тенденцию при рекомбинации задатков оставаться вместе. Это явление авторы назвали «взаимным притяжением факторов», но природу его им выяснить не удалось. Дальнейшее изучение хромосом как носителей информации происходило в первые десятилетия ХХ века в лаборатории Томаса Ханта Моргана (США) и его сотрудников (А. Стѐртеванта, К. Бриджеса, Г. Мѐллера). В качестве основного объекта исследований Морган использовал плодовую мушку дрозофилу (Drosophila melanogaster), которая оказалась очень удобным модельным объектом: – Во-первых, эта мушка легко культивируется в лабораторных условиях. – Во-вторых, она характеризуется малым числом хромосом 2 n = 8). – В-третьих, в слюнных железах личинок дрозофилы имеются гигантские (политенные) хромосомы, удобные для прямого наблюдения. – И, наконец, дрозофила отличается высокой изменчивостью морфологических признаков. На основании экспериментов с плодовой мушкой дрозофилой Морганом и его учениками была разработана хромосомная теория наследственности. Основные положения хромосомной теории наследственности: 1. Ген – это элементарный наследственный фактор (термин «элементарный» означает «неделимый без потери качества»). Ген представляет собой участок хромосомы, отвечающий за развитие определенного признака. Иначе говоря, гены локализованы в хромосомах. 2. В одной хромосоме могут содержаться тысячи генов, расположенных линейно (подобно бусинкам на нитке). Эти гены образуют группы сцепления. Число групп сцепления равно числу хромосом в гаплоидном наборе. Совокупность аллелей в одной хромосоме называется гаплотип. Примеры гаплотипов: ABCD (только доминантные аллели), abcd (только рецессивные аллели), AbCd (различные комбинации доминантных и рецессивных аллелей). 3. Если гены сцеплены между собой, то возникает эффект и сцепленного наследования признаков, т.е. несколько признаков наследуются так, как будто они контролируются одним геном. При сцепленном наследовании в череде поколений сохраняются исходные сочетания признаков. 4. Сцепление генов не абсолютно: в большинстве случаев гомологичные хромосомы обмениваются аллелями в результате перекреста (кроссинговера) в профазе первого деления мейоза. В результате кроссинговера образуются кроссоверные хромосомы (возникают новые гаплотипы, т.е. новые сочетания аллелей.). С участием кроссоверных хромосом в последующих поколениях у кроссоверных особей должны появляться новые сочетания признаков. 5. Вероятность появления новых сочетаний признаков вследствие кроссинговера прямо пропорциональна физическому расстоянию между генами. Это позволяет определять относительное расстояние между генами и строить генетические (кроссоверные) карты разных видов организмов. 2. Кроссинговер Кроссинговер (от англ. crossing-over – перекрѐст) – это процесс обмена гомологичными участками гомологичных хромосом (хроматид). Обычно кроссинговер происходит в мейозе I. При кроссинговере происходит обмен генетическим материалом (аллелями) между хромосомами, и тогда происходит рекомбинация – появление новых сочетаний аллелей, например, AB + ab → Ab + aB. Механизм кроссинговера «разрыв–воссоединение» Согласно теории Янссенса–Дарлингтона, кроссинговер происходит в профазе мейоза. Гомологичные хромосомы с хроматидами АВ и ab образуют биваленты. В одной из хроматид в первой хромосоме происходит разрыв на участке А–В, тогда в прилежащей хроматиде второй хромосомы происходит разрыв на участке a–b. Клетка стремится исправить повреждение с помощью ферментов репарации–рекомбинации и присоединить фрагменты хроматид. Однако при этом возможно присоединение крест–накрест (кроссинговер), и образуются рекомбинантные хроматиды Ab и аВ. В анафазе первого деления мейоза происходит расхождение двухроматидных хромосом, а во втором делении – расхождение хроматид (однохроматидных хромосом). Хроматиды, которые не участвовали в кроссинговере, сохраняют исходные сочетания аллелей. Такие хроматиды (однохроматидные хромосомы) называются некроссоверными; с их участием разовьются некроссоверные гаметы, зиготы и особи. Рекомбинантные хроматиды, которые образовались в ходе кроссинговера, несут новые сочетания аллелей. Такие хроматиды (однохроматидные хромосомы) называются кроссоверными, с их участием разовьются кроссоверные гаметы, зиготы и особи. Таким образом, вследствие кроссинговера происходит рекомбинация – появление новых сочетаний наследственных задатков в хромосомах. Согласно другим теориям, кроссинговер связан с репликацией ДНК: или в пахитене мейоза, или в интерфазе. В частности, возможна смена матрицы в вилке репликации. Генетические (кроссоверные) карты Алфред Стѐртевант (сотрудник Моргана) предположил, что частота кроссинговера на участке между генами, локализованными в одной хромосоме, может служить мерой расстояния между генами. Иными словами, частота кроссинговера, выражаемая отношением числа кроссоверных особей к общему числу особей, прямо пропорциональна расстоянию между генами. Тогда можно использовать частоту кроссинговера для того, чтобы определять взаимное расположение генов и расстояние между генами. Единицей расстояния между генами служит 1 % кроссинговера; в честь Моргана эта единица называется морганидой (М). На основании генетического картирования составляются генетические карты – схемы, отражающие положение генов в хромосомах относительно других генов. На генетических картах крайнему гену (т.е. наиболее удаленному от центромеры) соответствует нулевая (исходная) точка. Удаленность какого-либо гена от нулевой точки обозначается в морганидах. Построение генетических карт различных организмов имеет большое значение в здравоохранении, селекции и экологии. При изучении признаков человека (и в частности, генетических заболеваний) важно знать, какой именно ген определяет рассматриваемый признак. Эти знания позволяют составлять прогнозы при медико-генетическом консультировании, при разработке методов лечения генетических заболевания, в т.ч. и для коррекции генома. Знание генетических карт культурных растений и домашних животных позволяет планировать селекционный процесс, что способствует получению надежных результатов в краткие сроки. Построение генетических карт дикорастущих растений и диких животных важно и сточки зрения экологии. В частности, исследователь получает возможность изучать не просто фенотипические признаки организмов, а конкретные, генетически обусловленные признаки. Двойной и множественный кроссинговер Морган предположил, что кроссинговер между двумя генами может происходить не только в одной, но и в двух и даже большем числе точек. Четное число перекрестов между двумя генами, в конечном счете, не приводит к их перемещению из одной гомологичной хромосомы в другую, поэтому число кроссинговеров и, следовательно, расстояние между этими генами, определенное в эксперименте, снижаются. Обычно это относится к достаточно далеко расположенным друг от друга генам. Естественно, что вероятность двойного перекреста всегда меньше вероятности одинарного. В принципе она будет равна произведению вероятности двух единичных актов рекомбинации. Например, если одиночный перекрест будет происходить с частотой 0,2, то двойной – с частотой 0,2 × 0,2 = 0,04. В дальнейшем, наряду с двойным кроссинговером, было открыто и явление множественного кроссинговера: гомологичные хроматиды могут обмениваться участками в трех, четырех и более точках. Интерференция – это подавление кроссинговера на участках, непосредственно прилегающих к точке происшедшего обмена. Рассмотрим пример, описанный в одной из ранних работ Моргана. Он исследовал частоту кроссинговера между генами w (white – белые глаза), у (yellow – желтое тело) и m (miniature – маленькие крылья), локализованными в Х-хромосоме D. melanogaster. Расстояние между генами w и у в процентах кроссинговера составило 1,3, а между генами у и m – 32,6. Если два акта кроссинговера наблюдаются случайно, то ожидаемая частота двойного кроссинговера должна быть равна произведению частот кроссинговера между генами у и w и генами w и m. Другими словами, частота двойных кроссинговеров будет 0,43%. В действительности в опыте был обнаружен лишь один двойной кроссинговер на 2205 мух, т. е. 0,045%. Ученик Моргана Г. Меллер предложил определять интенсивность интерференции количественно, путем деления фактически наблюдаемой частоты двойного кроссинговера на теоретически ожидаемую (при отсутствии интерференции) частоту. Он назвал этот показатель коэффициентом коинциденции, т. е. совпадения. Меллер показал, что в Х-хромосоме дрозофилы интерференция особенно велика на небольших расстояниях; с увеличением интервала между генами интенсивность ее уменьшается и на расстоянии около 40 морганид и более коэффициент коинциденции достигает 1 (максимального своего значения). Цитологическое доказательство кроссинговера Прямые цитологические свидетельства обмена частей хромосом во время кроссинговера были получены в начале 30-х годов у дрозофилы и кукурузы. Рассмотрим опыт Штерна, проведенный на D. melanogaster. Обычно две гомологичные хромосомы морфологически неразличимы. Штерн исследовал Х-хромосомы, которые имели морфологические различия и, следовательно, были гомологичны не полностью. Однако гомология между этими хромосомами сохранялась на большей части их длины, что позволяло им нормально спариваться и сегрегировать в мейозе (то есть нормально распределяться по дочерним клеткам). Одна из Х-хромосом самки в результате транслокации, т. е. перемещения фрагмента Y-хромосомы, приобрела Г-образную форму. Вторая Х-хромосома была короче нормальной, так как часть ее была перенесена на IV хромосому. Были получены самки, гетерозиготные по указанным двум, морфологически различным, Ххромосомам, а также гетерозиготные по двум генам, локализованным в Х- хромосоме: Bar (В) и carnation (cr). Ген Bar – это полудоминантный ген, влияющий на количество фасеток и, следовательно, форму глаза (мутанты с аллелем В имеют полосковидные глаза). Ген cr контролирует окраску глаз (аллель cr+ обусловливает нормальную окраску глаз, а аллель cr – окраску глаз цвета красной гвоздики). Г-образная Х-хромосома несла аллели дикого типа В+ и cr+, укороченная хромосома – мутантные аллели В и cr. Самки указанного генотипа скрещивались с самцами, имевшими морфологически нормальную Х-хромосому с аллелями cr и В+. В потомстве самок было два класса мух с некроссоверными хромосомами (crB / crB+ и cr+B+ / crB+) и два класса мух, фенотип которых соответствовал кроссоверам (crB+ / crB+ и cr+B / crB+). Цитологическое исследование показало, что у кроссоверных особей произошел обмен участками Х-хромосом, и, соответственно, изменилась их форма. Все четыре класса самок имели по одной нормальной, т. е. палочковидной, хромосоме, полученной от отца. Кроссоверные самки содержали в своем кариотипе преобразованные в результате кроссинговера Х-хромосомы – длинную палочковидную или двуплечую с короткими плечами. Эти опыты, так же как и одновременно полученные аналогичные результаты на кукурузе, подтвердили гипотезу Моргана и его сотрудников о том, что кроссинговер представляет собой обмен участками гомологичных хромосом и что гены действительно локализованы в хромосомах. Соматический (митотический) кроссинговер. В соматических клетках иногда происходят обмены между хроматидами гомологичных хромосом, в результате которых наблюдается комбинативная изменчивость, подобная той, которая регулярно генерируется мейозом. Нередко, особенно у дрозофилы и низших эукариот, гомологичные хромосомы синаптируют в митозе. Одна из аутосомно-рецессивных мутаций человека, в гомозиготном состоянии приводящая к тяжелому заболеванию, известному под названием синдром Блюма, сопровождается цитологической картиной, напоминающей синапс гомологов и даже образование хиазм. Доказательство митотического кроссинговера было получено на дрозофиле при анализе изменчивости признаков, определяемых генами у (yellow – желтое тело) и sn (singed – опаленные щетинки), которые находятся в Х-хромосоме. Самка с генотипом y sn+ / y+sn гетерозиготна по генам у и sn, и поэтому в отсутствие митотического кроссинговера ее фенотип будет нормальным. Однако если кроссинговер произошел на стадии четырех хроматид между хроматидами разных гомологов (но не между сестринскими хроматидами), причем место обмена находится между геном sn и центромерой, то образуются клетки с генотипами y sn+ / y+ sn+ и y+ sn / y+ sn. В этом случае на сером теле мухи с нормальными щетинками появятся близнецовые мозаичные пятна, одно из которых будет желтого цвета с нормальными щетинками, а другое — серого цвета с опаленными щетинками. Для этого необходимо, чтобы после кроссинговера обе хромосомы (бывшие хроматиды каждого из гомологов) y+ sn отошли к одному полюсу клетки, а хромосомы y sn+ – к другому. Потомки дочерних клеток, размножившись на стадии куколки, и приведут к появлению мозаичных пятен. Таким образом, мозаичные пятна образуются тогда, когда рядом расположены две группы (точнее, два клона) клеток, фенотипически отличающиеся друг от друга и от клеток остальных тканей данной особи. Неравный кроссинговер Это явление было детально изучено на примере гена Bar (В – полосковидные глаза), локализованного в Х-хромосоме D. melanogaster. Неравный кроссинговер связан с дупликацией какого-либо участка в одном из гомологов и с утратой его в другом гомологе. Обнаружено, что ген В может присутствовать в виде тандемных, т. е. следующих друг за другом, повторов, состоящих из двух и даже трех копий. Цитологический анализ подтвердил предположение о том, что неравный кроссинговер может вести к тандемным дупликациям. В области, соответствующей локализации гена В, на препаратах политенных хромосом отмечено увеличение числа дисков, пропорциональное дозе гена. Предполагается, что в эволюции неравный кроссинговер стимулирует создание тандемных дупликаций различных последовательностей и использование их в качестве сырого генетического материала для формирования новых генов и новых регуляционных систем. Регуляция кроссинговера Кроссинговер – это сложный физиолого-биохимический процесс, который находится под генетическим контролем клетки и подвержен влиянию факторов внешней среды. Поэтому в реальном эксперименте о частоте кроссинговера можно говорить, имея в виду все те условия, в которых она была определена. Кроссинговер практически отсутствует между гетероморфными Х- и Y-хромосомами. Если бы он происходил, то хромосомный механизм определения пола постоянно разрушался бы. Блокирование кроссинговера между этими хромосомами связано не только с различием в их величине (оно наблюдается не всегда), но и обусловлено Yспецифичными нуклеотидными последовательностями. Обязательное условие синапса хромосом (или их участков) — гомология нуклеотидных последовательностей. Для абсолютного большинства высших эукариот характерна примерно одинаковая частота кроссинговера как у гомогаметного, так и гетерогаметного полов. Однако есть виды, у которых Кроссинговер отсутствует у особей гетерогаметного пола, в то время как у особей гомогаметного пола он протекает нормально. Такая ситуация наблюдается у гетерогаметных самцов дрозофилы и самок шелкопряда. Существенно, что частота митотического кроссинговера у этих видов у самцов и самок практически одинакова, что указывает на различные элементы контроля отдельных этапов генетической рекомбинации в половых и соматических клетках. В гетерохроматических районах, в частности прицентромерных, частота кроссинговера снижена, и поэтому истинное расстояние между генами в этих участках может быть изменено. Обнаружены гены, выполняющие функции запирателей кроссинговера, но есть также гены, повышающие его частоту. Они иногда могут индуцировать заметное число кроссоверов у самцов дрозофилы. В качестве запирателей кроссинговера могут выступать также хромосомные перестройки, в частности инверсии. Они нарушают нормальную конъюгацию хромосом в зиготене. Обнаружено, что на частоту кроссинговера влияют возраст организма, а также экзогенные факторы: температура, радиация, концентрация солей, химические мутагены, лекарства, гормоны. При большинстве указанных воздействий частота кроссинговера повышается. В целом кроссинговер представляет собой один из регулярных генетических процессов, контролируемых многими генами как непосредственно, так и через физиологическое состояние мейотических или митотических клеток. Частота различных типов рекомбинаций (мейотический, митотический кроссинговер и сестринские хроматидные обмены) может служить мерой действия мутагенов, канцерогенов, антибиотиков и др. Биологическое значение кроссинговера Благодаря сцепленному наследованию удачные сочетания аллелей оказываются относительно устойчивыми. В результате образуются группы генов, каждая из которых представляет собой как единый суперген, контролирующий несколько признаков. В то же время, в ходе кроссинговера возникают рекомбинации – т.е. новые комбинации аллелей. Таким образом, кроссинговер повышает комбинативную изменчивость организмов. Эволюционное значение сцепленного наследования. В результате сцепления одна хромосома может содержать как благоприятные аллели (например, А), так и нейтральные или относительно неблагоприятные (например, N). Если некоторый гаплотип (например, AN) повышает приспособленность его носителей за счет наличия благоприятных аллелей A, то в популяции будут накапливаться как благоприятные аллели, так и сцепленные с ними нейтральные или относительно неблагоприятные N. Пример. Гаплотип AN обладает преимуществом перед гаплотипом ―дикого типа» (++) за счет наличия благоприятного аллеля А, и тогда аллель N будет накапливаться в популяции, если он селективно нейтральный или даже относительно неблагоприятный (но его отрицательное влияние на приспособленность компенсируется положительным влиянием аллеля А). Эволюционное значение кроссинговера. В результате кроссинговера неблагоприятные аллели, первоначально сцепленные с благоприятными, могут переходить в другую хромосому. Тогда возникают новые гаплотипы, не содержащие неблагоприятных аллелей, и эти неблагоприятные аллели элиминируются из популяции. Пример. Гаплотип Al оказывается неблагоприятным по сравнению с гаплотипом «дикого типа» (++) за счет наличия летального аллеля l. Поэтому аллель А (благоприятный, нейтральный ил несколько снижающий приспособленность) не может проявиться в фенотипе, поскольку данный гаплотип (Al) содержит летальный аллель l. В результате кроссинговера возникают рекомбинантные гаплотипы A+ и +l. Гаплотип +l элиминируется из популяции, а гаплотип A+ фиксируется (даже в том случае, если аллель А несколько снижает приспособленность его носителей). 3. Принципы генетического картирования Алфред Стѐртевант (сотрудник Моргана) предположил, что частота кроссинговера на участке между генами, локализованными в одной хромосоме, может служить мерой расстояния между генами. Иными словами, частота кроссинговера, выражаемая отношением числа кроссоверных особей к общему числу особей, прямо пропорциональная расстоянию между генами. Тогда можно использовать частоту кроссинговера для того, чтобы определять взаимное расположение генов и расстояние между генами. Генетическое картирование – это определение положения какого-либо гена по отношению к двум (как минимум) другим генам. Постоянство процента кроссинговера между определенными генами позволяет локализовать их. Единицей расстояния между генами служит 1 % кроссинговера; в честь Моргана эта единица называется морганидой (М). На первом этапе картирования необходимо определить принадлежность гена к группе сцепления. Чем больше генов известно у данного вида, тем точнее результаты картирования. Все гены разбивают на группы сцепления. Число групп сцепления соответствует гаплоидному набору хромосом. Например, у D. melanogaster 4 группы сцепления, у кукурузы – 10, у мыши – 20, у человека – 23 группы сцепления. Как правило, число генов в группах сцепления зависит от линейных размеров соответствующих хромосом. Так, у плодовой мушки имеется одна (IV) точечная (при анализе в световом микроскопе) хромосома. Соответственно число генов в ней во много раз меньше, чем в остальных, значительно превосходящих ее по длине. Следует также отметить, что в гетерохроматических районах хромосом генов нет или почти нет, поэтому протяженные области конститутивного гетерохроматина могут несколько изменить пропорциональность числа генов и длины хромосомы. На основании генетического картирования составляются генетические карты. На генетических картах крайнему гену (т.е. наиболее удаленному от центромеры) соответствует нулевая (исходная) точка. Удаленность какоголибо гена от нулевой точки обозначается в морганидах. Если хромосомы достаточно длинные, то удаление гена от нулевой точки может превышать 50 М – тогда возникает противоречие между отмеченными на карте расстояниями, превышающими 50%, и постулированным выше положением, согласно которому 50 % кроссоверов, полученных в эксперименте, фактически должны означать отсутствие сцепления, т. e. локализацию генов в разных хромосомах. Это противоречие объясняется тем, что при составлении генетических карт суммируются расстояния между двумя наиболее близкими генами, что превышает экспериментально наблюдаемый процент кроссинговера. Цитогенетическое картирование Этот метод основан на использовании хромосомных перестроек. В случае гигантских политенных хромосом он позволяет прямо сопоставлять результаты генетического анализа расстояний между изучаемыми локусами и их взаимного расположения с данными о физических размерах определенных хромосомных областей. При облучении и действии других мутагенов в хромосомах часто наблюдаются выпадения (делеции) или вставки небольших фрагментов, сравнимых по величине с одним или несколькими локусами. Например, можно использовать гетерозиготы по хромосомам, одна из которых будет нести группу следующих друг за другом доминантных аллелей, тогда как гомологичная ей – группу рецессивных форм тех же генов. Если хромосома с доминантными генами будет последовательно терять отдельные локусы, то в гетерозиготе будут проявляться рецессивные признаки. Порядок проявления рецессивных признаков указывает на последовательность расположения генов. При порядке генов AbC в случае делеции, захватывающей ген С, у мух с укороченной хромосомой, потерявшей фрагмент, равный гену С, в фенотипе проявятся аллели с, b и А. В целом сравнение генетических (кроссинговерных) и цитологических карт показывает их соответствие: чем больший процент кроссинговера разделяет пару генов, тем больше и физическое расстояние между ними. Однако на несоответствие расстояний, определяемых указанными двумя методами, могут влиять два фактора. Во-первых, это области, в которых затруднен или отсутствует кроссинговер (например, в гетерохроматических районах); во-вторых, физическое расстояние будет больше, чем генетическое, если гены разделены зоной «молчащей» ДНК. Расчеты Бриджеса показали, что каждой единице перекреста на карте политенных хромосом слюнных желез D. melanogaster соответствует 4,2 мкм длины политенных хромосом. Эта длина как минимум равна двум-трем средним генам. Особенности построения генетических карт у прокариот Для построения генетических карт у прокариот используется явление конъюгации – переноса генетического материала из одной клетки в другую с помощью специальных кольцевых молекул ДНК (плазмид, в частности, с помощью F–плазмиды). Вероятность переноса определенного гена в клетку–реципиент зависит от его удаления от F–плазмидной ДНК, а точнее, от точки О, в которой начинается репликация F–плазмидной ДНК. Чем больше время конъюгации, тем выше вероятность переноса данного гена. Это дает возможность составить генетическую карту бактерий в минутах конъюгации. Например, у кишечной палочки ген thr (оперон из трех генов, контролирующих биосинтез треонина) находится в нулевой точке (то есть непосредственно рядом с F– плазмидной ДНК), ген lac переносится через 8 мин, ген recE – через 30 мин, ген argR – через 70 мин и т.д. Более подробно этот вопрос будет рассмотрен при изучении генетики прокариот. Картирование хромосом человекаКартирование генов основано на составлении групп сцепления. Чем больше известных мутаций и чем меньше число хромосом, тем легче проводить картирование. В этом отношении человек (помимо того, что у него невозможен классический гибридологический анализ) как объект вдвойне неблагоприятен для картирования: известных генов у него сравнительно немного (по крайней мере, так было до конца 70-х годов), а гаплоидное число хромосом достаточно велико – 22 (не считая половых). Это означает, что вероятность того, что два вновь открытых гена окажутся сцепленными, равна 1/22. По этим причинам анализ родословных, который в какой-то мере заменяет гибридологический анализ, дает довольно ограниченную информацию о характере сцепления. Более перспективными для картирования генов человека оказались методы генетики соматических клеток. Суть одного из них заключается в следующем. Методы клеточной инженерии позволяют объединять различные типы клеток. Слияние клеток, принадлежащих к разным биологическим видам, называется соматической гибридизацией. Сущность соматической гибридизации заключается в получении синтетических культур путем слияния протопластов различных видов организмов. Для слияния клеток используют различные физико-химические и биологические методы. После слияния протопластов образуются многоядерные гетерокариотические клетки. В дальнейшем при слиянии ядер образуются синкариотические клетки, содержащие в ядрах хромосомные наборы разных организмов. При делении таких клеток in vitro образуются гибридные клеточные культуры. В настоящее время получены и культивируются клеточные гибриды «человек × мышь», «человек × крыса» и многие другие. В гибридных клетках, полученных из разных штаммов разных видов, один из родительских наборов хромосом, как правило, реплицируется быстрее другого. Поэтому последний постепенно теряет хромосомы. Эти процессы интенсивно протекают, например, в клеточных гибридах между мышью и человеком – видами, различающимися по многим биохимическим маркерам. Если при этом следить за каким-либо биохимическим маркером, например ферментом тимидинкиназой, и одновременно проводить цитогенетический контроль, идентифицируя хромосомы в клонах, образующихся после их частичной утраты, то, в конце концов, можно связать исчезновение хромосомы одновременно с биохимическим признаком. Это означает, что ген, кодирующий этот признак, локализован в данной хромосоме. Так, тимидинкиназный ген у человека находится в хромосоме 17. Некоторая информация о локализации генов может быть получена при анализе числовых и структурных мутаций хромосом, по встречаемости в семьях хромосом с морфологическими вариациями и по учету наследственных признаков. Для этой же цели используют и частичные моносомии, возникающие в результате делеций. Однако в этих случаях необходимо иметь в виду, что иногда изучаемый ген остается в центрическом фрагменте, но его проявление может быть резко ослаблено в результате эффекта положения или каких-либо иных механизмов регуляции (изменение порядка репликации, отрыв промоторного участка и т. д.). В конце 60-х годов был разработан метод гибридизации in situ, в основе которого лежит специфичность комплементарных взаимодействий гена и его копии (мРНК, а также полученной с помощью обратной транскрипции комплементарной ДНК). Разрешающая способность этого метода гораздо выше на политенных хромосомах, чем на митотических хромосомах человека, однако он постоянно совершенствуется. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 6. ЦИТОПЛАЗМАТИЧЕСКАЯ НАСЛЕДСТВЕННОСТЬ. Лектор: ст.п. Мамедова М. З. 1. Цитоплазматическое наследование. Пластидное наследование. Цитоплазматическая мужская стерильность 2. Особые типы наследования. Предетерминация цитоплазмы. Наследование через инфекцию и эндосимбионтов 3. Генетика соматических клеток. Соматические мутации. Химеры. Генетика онкологических заболеваний 1. Цитоплазматическое наследование Для того чтобы та или иная структура могла выполнять функции материального носителя наследственности и обеспечивать количественные закономерности наследования, она должна содержать материальные носители генетической информации (нуклеиновые кислоты), обладать способностью к самовоспроизведению и точно распределяться по дочерним клеткам при делении. Всем трем условиям полностью удовлетворяют только структуры ядра – хромосомы. Наследование, определяемое хромосомами, получило название ядерного или хромосомного. Полуавтономные органоиды цитоплазмы – митохондрии и пластиды – содержат ДНК и обладают способностью к саморепродукции. В тех случаях, когда материальной основой наследования являются элементы цитоплазмы, оно называется нехромосомным или цитоплазматическим. В отличие от хромосом, митохондрии и пластиды не распределяется при делении клетки с абсолютной точностью. Именно в этом и состоит главное отличие ядерных структур (хромосом) от цитоплазматических. Кроме того, ядро содержит ограниченное и характерное для каждого вида число хромосом; в цитоплазме же обычно много однозначных органоидов, число их, как правило, непостоянно. Ядро в большинстве случаев не способно исправить и заместить возникшие дефекты хромосом, они воспроизводятся при делении клетки; поврежденные и неспособные к размножению органоиды цитоплазмы могут быть замещены путем размножения одноименных неповрежденных структур. Приведенные различия в свойствах хромосом и полуавтономных органоидов цитоплазмы должны обусловливать и различия в закономерностях наследования, определяемых этими элементами клетки. Поскольку и у растений, и у животных яйцеклетка содержит много цитоплазмы, а мужская гамета ее, как правило, почти лишена, следует ожидать, что цитоплазматическое наследование, в отличие от хромосомного, должно осуществляться по материнской линии. Поскольку для органоидов цитоплазмы нет такого точного механизма распределения при делении клеток, который существует для хромосом, то, очевидно, цитоплазматическое наследование не может характеризоваться такими строгими количественными закономерностями, как ядерное. Генетический материал митохондрий включает несколько десятков кольцевых и линейных двуспиральных правозакрученных молекул ДНК, которые отличаются по нуклеотидному составу от ядерной ДНК (яДНК) и не связаны с гистонами. Длина одной молекулы митохондриальной ДНК (мтДНК) – 15–75 тпн. (в тысячи раз меньше, чем длина яДНК), что позволяет кодировать несколько десятков белков (25– 125 полипептидов с молекулярной массой М = 40000). В мтДНК закодированы: транспортные и рибосомальные РНК (рибосомы митохондрий отличаются от рибосом цитоплазмы), некоторые ферменты (3 из 7 субъединиц цитохромоксидазы, две субъединицы комплекса цитохромов b–с1, иногда – субъединицы АТФазы). Этого недостаточно, чтобы обеспечить существование и функционирование митохондрий. Часть белков (ДНК- и РНК-полимеразы, белки митохондриальных рибосом, субъединицы дыхательных ферментов) поступает в готовом виде из цитоплазмы или в виде соответствующих иРНК, закодированных в яДНК. мтДНК человека представлена кольцевой молекулой длиной 16569 пн и содержит 13 белковых генов, 22 гена тРНК и 2 гена рРНК. Кодирующие последовательности разделены короткими межгенными некодирующими участками, для которых характерен высокий уровень полиморфизма, обусловленный заменами, потерями и вставками нуклеотидов. Генетический материал хлоропластов включает несколько десятков кольцевых двуспиральных правозакрученных молекул ДНК, которые являются копиями друг друга. ДНК хлоропластов (хлДНК) также отличается по нуклеотидному составу от яДНК и не связана с гистонами, однако имеются и черты сходства с яДНК (некоторые гены тРНК имеют интронэкзонную структуру, а именно гены аланиновой и изолейциновой тРНК). Длина одной молекулы хлДНК – несколько сотен тпн (примерно в 10 раз больше, чем одиночная молекула мтДНК). хлДНК кодирует: часть транспортных и рРНК (рибосомы пластид отличаются от рибосом цитоплазмы), некоторые белки ( 3 субъединицы АТФазы, белки наружной и внутренней мембран, большую субъединицу рибулезодифосфаткарбоксилазы – всего около 30 белков, хотя теоретически может кодировать 100–150 белков). Большая часть белков хлоропласта закодирована в яДНК. Особенности генетической информации, закодированной в ДНК полуавтономных органоидов. Генетическая информация, закодированная в полуавтономных органоидах, в наибольшей степени наследуется через цитоплазму, то есть по материнской линии. Считается, что мтДНК и хлДНК в наименьшей степени подвержены действию естественного отбора. Эти обстоятельства используются в микросистематике для выявления родственных связей между группами организмов. Однородность мтДНК человека позволяет предположить, что современное человечество происходит от немногих особей женского пола. Существует гипотеза, согласно которой некоторые гены способны переходить из одних типов ДНК в другие, например, из хлДНК в мтДНК. В то же время генетический код полуавтономных органоидов обладает специфичностью, например, триплет АУА в яДНК кодирует изолейцин, а в мтДНК – метионин, кодон ЦУГ – в яДНК – лейцин, в мтДНК – треонин. Существуют и другие разночтения кодонов. Пластидное наследование О первых фактах пластидного наследования сообщили Э. Баур и К. Корренс еще на заре развития генетики (в 1909 г.). Так, Корренс изучил наследование белой пестролистности у ночной красавицы (Mirabilis jalapa). У этого вида встречаются пестролистные растения, которые имеют в точках роста разные группы клеток: с нормальными пластидами и с пластидами, неспособными к образованию хлорофилла. Вследствие этого иногда на растении образуются три типа побегов: чисто-зеленые, пестрые или совершенно белые. Белые побеги на мозаичном растении существуют за счет ассимилятов, поступающих из зеленых и пестрых побегов, в которых идет фотосинтез. Семена, полученные с белых ветвей, дают нежизнеспособные всходы, так как у них не идет процесс фотосинтеза. При опылении цветков на разных типах побегов пыльцой с разных типов побегов дает следующие результаты: Материнские побеги зеленые пестрые белые Отцовские побеги зеленые пестрые белые зеленые пестрые белые зеленые пестрые белые Растения, выращенные из гибридных семян только зеленые зеленые, (леталь) пестрые, белые только белые (леталь) На основании этого был сделан вывод, что наследование пестролистности у ночной красавицы связано с передачей и распределением при клеточных делениях двух типов пластид – зеленых и неокрашенных, причем передаются пластиды яйцеклеткой, в результате чего наследование осуществляется по материнской линии. Развитие белых или зеленых частей растений из зиготы, содержащей пластиды обоих типов, определяется скоростью воспроизведения разных пластид и их распределением в ходе клеточных делений. Например, клетки, получившие только зеленые пластиды, дают зеленые участки тканей, а из клеток, имеющих только неокрашенные пластиды, образуются белые участки. В некоторых случаях, например у герани, пластиды передаются не только яйцеклеткой, но и спермием, содержащим цитоплазму. При этом пестролистность наследуется не только по материнской, но и по отцовской линии, т. е. имеет место так называемое двуродительское наследование. Наследование через митохондрии У некоторых грибов (дрожжи, нейроспора) была обнаружена дыхательная недостаточность, которая обусловлена необратимыми наследственными изменениями функции митохондрии – у них утрачена активность цитохромоксидазы. Б. Эфрусси обнаружил штаммы дрожжей Saccharomyces cerevisiae, которые спонтанно образуют карликовые колонии с дыхательной недостаточностью. Поскольку колонии возникают при вегетативном размножении гаплоидных дрожжей, эта форма была названа вегетативным карликовым штаммом. Наряду с вегетативными карликовыми колониями была обнаружена форма, по фенотипу – росту и дыхательной недостаточности – сходная с первой, но она давала расщепление по признаку карликовости, как будто он определялся одним ядерным геном; эта форма была названа расщепляющимся карликовым штаммом. Генетический анализ вегетативного и расщепляющегося карликовых штаммов показывает, что фенотип расщепляющейся карликовости определяется ядерным геном (при скрещиваниях наблюдается расщепление в отношении 1:1). При скрещивании вегетативных карликов и нормальных дрожжей диплоидная зигота, в которой есть митохондрии от нормальной формы, не дает расщепления – из спор (аскоспор) не появляются мелкие колонии. Следовательно, у этих форм геномы одинаковы, различалась лишь цитоплазма. Расщепления по типу цитоплазмы в мейозе не происходит. В данном эксперименте факт цитоплазматического наследования очевиден. Получено и прямое доказательство роли митохондрии в наследственной передаче дыхательной недостаточности у дрожжей. Вегетативных карликов, лишенных клеточных оболочек, выращивали в присутствии изолированных митохондрии нормальных дрожжей. В результате часть образовавшихся колоний (2–2,5%) имели нормальные размеры. Этот факт можно объяснить, предположив, что «нормальные» митохондрии, попав в клетки вегетативных карликов, исправили дефект их дыхательной системы и, передаваясь из клетки в клетку в ходе деления, способствовали образованию нормальных колоний. Цитоплазматическая мужская стерильность (ЦМС) Один из самых ярких примеров цитоплазматического наследования – явление цитоплазматической мужской стерильности (ЦМС), обнаруженное у многих растений – кукурузы, лука, свеклы, льна и др. Цитоплазматическая мужская стерильность у кукурузы была открыта в 30-х годах одновременно в СССР М. И. Хаджиновым и в США М. Родсом. Кукуруза – однодомное растение, женские цветки у нее собраны в початок, мужские – в метелку. У некоторых сортов кукурузы были обнаружены растения, имевшие в метелках недоразвитые пыльники, часто совершенно пустые, а иногда с недоразвитой стерильной пыльцой. Оказалось, что этот признак определяется особенностями цитоплазмы. Опыление растений с мужской стерильностью нормальной пыльцой с других растений в большинстве случаев дает в потомстве растения со стерильной пыльцой. При повторении этого скрещивания в течение ряда поколений признак мужской стерильности не исчезает, передаваясь по материнской линии. Даже тогда, когда все 10 пар хромосом растений со стерильной пыльцой замещаются хромосомами от растений с фертильной пыльцой, мужская стерильность сохраняется. Это послужило убедительным доказательством того, что наследование данного признака осуществляется через цитоплазму. Цитоплазма, обусловливающая стерильность пыльцы, была обозначена символом цитS (стерильная цитоплазма), а цитоплазма растений с фертильной пыльцой – символом цитN (нормальная цитоплазма). Установлено, что генотип растения может оказывать определенное влияние на действие стерильной цитоплазмы. Цитоплазма цитS может обусловить стерильность пыльцы только при наличии в генотипе растения рецессивного гена rf в гомозиготном состоянии rfrf. Если же этот ген представлен доминантной аллелью Rf, то растение цитS RfRf или цитS Rfrf имеет нормальную пыльцу. Аллель Rf является, таким образом, восстановителем фертильности пыльцы. Следовательно, фертильную пыльцу могут иметь растения и цumN rfrf, и цитNRf–-, и цитS Rf–, а полностью стерильную – только растения цитS rfrf. Многократное повторение скрещивания ♀ цитS rfrf × ♂ цитN rfrf всегда дает потомство с полностью стерильной пыльцой. И только в случае скрещивания цumS rfrf × цumS RfRf (или цитN RfRf) может быть получено потомство, где все растения будут иметь нормальную пыльцу, несмотря на наличие цитоплазмы цumS. Следует еще раз подчеркнуть, что ген Rf не изменяет структуру и специфичность цитоплазмы цumS, а лишь тормозит проявление ее действия. Таким образом, взаимодействие ядерных и внеядерных факторов, определяющих ЦМС, можно записать следующим образом: Генотип ядра и цитоплазмы Фенотип N цит Rf – цитS Rf – мужская фертильность N цum rfrf цитS rfrf мужская стерильность Примечание. К сожалению, локализация факторов цитS и цитN в цитоплазме до сих пор не установлена; можно лишь предположить, что эти факторы закодированы в геноме митохондрий. Однако явление ЦМС широко используется для получения гибридных семян у пасленовых, тыквенных с/х растений, так как для получения F1 не требуется производить трудоемкие операции кастрации и изоляции материнских цветков. 2. Особые типы наследования Наследование при предетерминации цитоплазмы Предетерминацией называется предопределение свойств организмов в последующих поколениях. В ряде случаев наследование признаков связано с особенностями цитоплазмы, возникающими в процессе индивидуального развития организма либо под влиянием факторов внешней среды (онтогенетическая или фенотипическая предетерминация), либо под влиянием генотипа (генотипическая предетерминация). Онтогенетическая предетерминация. В этом случае наследование некоторых признаков по материнской линии обусловлено изменениями в цитоплазме, возникающими и ней под влиянием определенных внешних факторов. Обычно такие изменения нестойки и через несколько поколений постепенно исчезают, возвращаясь к исходному типу. Например, воздействие повышенной температурой на яйца самок наездника Habrobracon до оплодотворения приводит к изменению окраски тела у их потомства. В последующих поколениях при размножении в нормальных температурных условиях это изменение постепенно затухает. Когда температурному воздействию подвергаются самцы, а самки выращиваются в нормальных условиях, подобного эффекта не наблюдается. Подобные изменения, затухающие в ряду поколений при возвращении организмов в исходные условия, называют длительными модификациями. Механизм их до сих пор не выяснен. Длительные модификации могут постоянно проявляться в ряду поколений при условии сохранения вызывавших их факторов; при отсутствии последних происходит постепенный возврат к исходному состоянию. Генотипическая предетерминация цитоплазмы происходит под влиянием генотипа материнского организма. Яркий пример – наследование направления завитка раковины у пресноводных гермафродитных моллюсков Limnea. Большинство из них – перекрестно оплодотворяющиеся формы, но некоторые из них способны к самооплодотворению. У этих моллюсков встречаются два типа закручивания раковины: против часовой стрелки (левозакрученные) и по ходу часовой стрелки (правозакрученные). Направление закручивания раковины определяется одной парой аллелей: правозакрученность D доминирует над левозакрученностью d. При реципрокных скрещиваниях гибриды F1, имеющие один и тот же генотип Dd, различаются по фенотипу. В скрещивании ♀ DD × ♂ dd все гибридные особи имеют материнский тип – правозакрученные раковины. В скрещивании ♀ dd × ♂ DD потомство также имеет материнский тип завитка, то есть левозакрученную раковину. От самооплодотворения гетерозиготных форм F1 (Dd) в обоих скрещиваниях все потомки F2 обладают правозакрученной раковиной, хотя гибриды F1 (как и материнские формы) различались по фенотипу. Когда было исследовано потомство от каждой особи F2 в отдельности, то выяснилось, что 1/4 семей имели левый завиток, а 3/4 – правый. Результаты опытов можно отобразить в виде схемы: Вариант 1. P: F1: F2: F3: ♀ DD право ♂ dd лево Dd право самооплодотворение DD Dd Dd dd право право право право самооплодотворение 1 DD : 2 Dd: 1 1 DD : 2 Dd: 1 DD dd dd dd право право право лево Вариант 2. P: F1: F2: F3: ♀ dd лево ♂ DD право Dd лево самооплодотворение DD Dd Dd dd право право право право самооплодотворение 1 DD : 2 Dd: 1 1 DD : 2 Dd: 1 DD dd dd dd право право право лево Таким образом, простое менделевское расщепление по данной паре признаков 3 : 1 выявилось не в F2, а только в F3. При этом типе наследования фенотип потомков соответствует генотипу матери, а не генотипу зигот, из которых они развиваются. Данный признак предопределяется генотипом материнского организма в цитоплазме яйца в процессе его развития. Рассмотренный тип наследования и является в собственном смысле материнским. Направление завитка раковины определяется характером спирального дробления оплодотворенного яйца, то есть расположением бластомеров по спирали вправо или влево, что, в свою очередь, зависит от ориентации веретена при втором делении дробления. В данном случае свойства цитоплазмы детерминированы действием хромосомных генов, а не элементами самой цитоплазмы, то есть здесь действует механизм хромосомного наследования, который изменяет цитоплазму яйцеклетки еще до оплодотворения. Наследование через инфекцию У мышей имеется линия с наследственной предрасположенностью к развитию рака молочной железы, которая передается по материнской линии и только при выкармливании потомства. Если к матерям-кормилицам из раковых линий подсадить мышат из нераковой линии, то такие мышата также становятся предрасположенными к раку молочной железы. Если мышат из раковой линии с момента рождения вскармливают нормальные кормилицы, то мышата остаются здоровыми. Таким образом, опухоли в данном случае вызываются инфекцией через молоко матери. Этот инфекционный агент был назван фактором молока. Установлено, что он имеет вирусную природу. Наследование через эндосимбионтов У инфузорий Paramecium aurelia известны линии, которые содержат в цитоплазме и выделяют в среду специфические частицы, называемые каппачастицами. Сами носители каппа-частиц («убийцы») от них не страдают, но парамеции из других линий (чувствительные) под их действием погибают. Каппа-частицы представляют собой бактерии, являющиеся по отношению к парамеции эндосимбионтами. Они содержат своеобразную белковую ленту, на которой находятся фаги – симбионты бактерий. Таким образом, здесь имеет место своеобразный тройной симбиоз: инфузория – бактерия – фаг. При попадании каппа-частиц в пищеварительную вакуоль чувствительной инфузории белковая лента бактерии разворачивается. В результате жизнедеятельности фагов вырабатываются вещества, являющиеся причиной гибели инфузорий. Сохранение каппа-частиц в цитоплазме и выделение их инфузорией-«убийцей» контролируется доминантным геном К, его рецессивная аллель k не способствует их сохранению. У данного вида инфузорий существует бесполое размножение и две формы полового процесса: конъюгация и автогамия. При бесполом размножении инфузории-«убийцы» постоянно дают однотипный клон со свойствами «убийц». При скрещивании (конъюгации) двух клеток – «убийцы» с генотипом KK и чувствительной клетки с генотипом kk – образуются «убийцы»–гетерозиготы Kk. Вследствие автогамии вновь образуются гомозиготные клетки KK и kk, у которых способность к сохранению каппа-частиц определяется следующим образом. Вариант 1. Кратковременная конъюгация. Происходил обмен микронуклеусами, но цитоплазмой эксконъюганты не успевают обменяться, и каппа-частицы не попадают в цитоплазму чувствительного партнера и остаются только в исходной клетке. В результате автогамии у гетерозигот Kk наблюдается расщепление по генотипу в соотношении – 1 KK : 1kk. Половина клеток с генотипом KK (происходящая от клона KK) будет содержать каппа-частицы, и в дальнейшем эти клетки дадут начало клону «убийц». Другая половина клеток с генотипом KK (происходящая от клона kk) не будет содержать каппа-частицы и в дальнейшем эти клетки дадут начало клону, нечувствительному к каппачастицам, но не «убийцам». Половина клеток с генотипом kk (происходящая от клона KK) будет содержать каппа-частицы, но в цитоплазме этих клеток каппа-частицы не размножаются и в ряду делений постепенно «разбавляются», впоследствии исчезая. Другая половина клеток с генотипом kk (происходящая от клона kk) исходно не содержит каппа-частицы. Таким образом, в данном случае наблюдается расщепление – 1 часть KK «убийцы» : 1 часть KK «не-убийцы» : 2 части kk чувствительные. Вариант 2. Длительная конъюгация. Происходит обмен микронуклеусами и цитоплазмой. Клетка из клона «убийц» исходно содержит каппа-частицы, а клетка из чувствительного клона получает цитоплазму с каппа-частицами от клетки клона «убийц». В результате автогамии у гетерозигот Kk наблюдается расщепление по генотипу в соотношении – 1 часть KK («убийцы») : 1 часть kk (чувствительные). Каппа-частицы будут размножаться в цитоплазме инфузории с генотипом KK, в дальнейшем эти инфузории дадут клон «убийц». В цитоплазме чувствительной клетки (kk), каппа-частицы не размножаются и в ряду делений постепенно исчезают. Итак, в цитоплазме иногда обнаруживаются эндосимбионты, которые могут быть передатчиками ряда свойств по материнской линии. Но эти симбионты по существу не являются неотъемлемыми элементами живой клетки. Заключение Во многих случаях наследование признаков происходит при участии генетических структур цитоплазмы. Цитоплазматическое наследование, как и хромосомное, дискретно. Его отличает от ядерного материнское наследование и отсутствие регулярных количественных закономерностей расщепления. Цитоплазматические гены, подобно ядерным, характеризуются стабильностью, неизменяемостью в гетерозиготном состоянии, расщеплением аллелей, к ним применимо представление о генотипе и фенотипе. На основе изложенных фактов можно считать, что материальная и функциональная преемственность между поколениями обеспечивается всеми самовоспроизводящимися структурами клетки: ядерными и цитоплазматическими. Однако ядерные структуры (хромосомы) осуществляют общий контроль наследования признаков. Таким образом, единство ядерных генов и генов цитоплазмы (плазмогенов) основано на взаимодействии различных носителей наследственной информации при определяющей роли ядра. Расширенное понятие генотипа должно включать в себя всю генетическую систему клетки, что наилучшим образом соответствует современному представлению о наследственности. 3. Генетика соматических клеток Соматическими называют клетки, составляющие тело (сому) многоклеточных организмов и не принимающие участия в половом размножении. Входя в состав разнообразных тканей тела, соматические клетки каждой ткани обладают специфическими структурными, метаболическими и химическими особенностями, которые приобретаются в процессе дифференцировки. Соматические и половые клетки имеют общее происхождение, так как образуются из генетически одинаковых эмбриональных клеток, которые содержат всю генетическую информацию, необходимую для образования клеток различных типов в ходе развития организма. Различные ткани многоклеточных организмов представляют собой популяции клеток, которые могут изменяться с возрастом и в зависимости от состояния организма. Входящие в состав таких популяций клетки в результате дифференцировки приобретают стабильные наследственные свойства соответствующего типа. Эта стабильность сохраняется даже при культивировании in vitro выделенных из организма соматических клеток. Многие генетические процессы, характерные для половых клеток, происходят и в соматических клетках (мутации, хромосомные перестройки, рекомбинации, расщепления, полиплоидизация и др.). Изучение наследственности и изменчивости соматических клеток необходимо для решения многих важных проблем, среди которых особо следует выделить проблему старения, патологии клеток, действия на организм различных физических факторов, а также проблему дифференцировки клеток в онтогенезе и их интеграции в ткани. При изучении наследственности соматических клеток используют методы культуры клеток и тканей, пересадку тканей между разными мутантными линиями растений и животных, а также получение химерных организмов. Рассмотрим некоторые методы подробнее. 1. Методы клеточных культур растений. Позволяют культивировать клетки с различной плоидностью (гаплоидные, диплоидные, полиплоидные), хромосомными перестройками, различными морфологическими и биохимическими особенностями. В культурах гаплоидных клеток рецессивные аллели сразу же проявляются в фенотипе, что позволяет отбирать соматические мутации из исходной популяции клеток или путем индуцированного мутагенеза. Для отбора таких мутаций используются селективные среды. В дальнейшем из культуры ткани можно получить гаплоидные регенераты, а затем с помощью колхицина перевести их на диплоидный уровень и получить генетически однородные гомозиготные линии. Эти процедуры ускоряют селекцию на получение хозяйственно ценных форм, например, растений, устойчивых к засолению (осмоустойчивых). 2. Методы клеточных культур животных и человека. Позволяют получать и изучать клетки с различным уровнем плоидности, с хромосомными аберрациями, генными мутациями и другими изменениями, которые для целостного организма летальны. Эти методы особенно важны с точки зрения радиационной генетики и химического мутагенеза. 3. Методы соматической гибридизации. Позволяют совместить в одной клетке геномы разных организмов. Это дает возможность изучать взаимодействие генетических систем разных биологических видов и использовать гибридные клетки (гибридомы) для получения некоторых веществ (моноклональных антител, вакцин, биологически активных веществ). 4. Методы прививочных гибридов и получение химерных растений. Позволяют изучать взаимодействие геномов разных биологических видов на целостных организмах. Широко известны работы по получению у растений так называемых прививочных или «вегетативных» гибридов. Начиная с работ Винклера (1907–1935), прививочные гибриды были получены многими авторами на различных растениях. Ряд исследователей склонны были считать прививочные гибриды истинными гибридами, но это оказалось заблуждением. В данном случае мы имели дело с химерными организмами, т. е. такие «гибриды» состоят из тканей подвоя и привоя. Химеры могут быть периклинальными, секториальными и мериклинальными. В химерных организмах клетки и ткани подвоя и привоя могут чередоваться или смешиваться, но они не сливаются, сохраняя относительную автономность и четкие морфологические различия. Таким образом могут возникать новые формы растений, похожие на истинные гибриды, поскольку их признаки бывают промежуточными по сравнению с признаками подвоя и привоя. Если бы это были истинные гибриды, то промежуточный характер признаков сохранился бы в потомстве, полученном из семян. Этого, однако, не происходит, так как генеративные органы обычно образуются за счет тканей одного из компонентов прививки. Иначе говоря, семенное потомство будет соответствовать тому растению, из ткани которого развились половые клетки. Прививочные гибриды можно размножать только вегетативным путем. При прививках, когда различные соматические ткани находятся в тесном контакте, возможны различные цитоплазматические изменения, которые могут наследоваться при семенном размножении по типу длительных модификаций). Причиной цитоплазматических изменении в этом случае может быть обмен между клетками подвоя и привоя, например рибосомами или другими структурами цитоплазмы. Пока это лишь предположения. Без ответа остается и вопрос о возможности изменения генотипа привоя под влиянием подвоя. Хорошо известные методы ментора и вегетативного сближения, применяемые И.В.Мичуриным и другими исследователями, позволяют изменить степень выраженности признаков у привоя, а в некоторых случаях облегчить отдаленную гибридизацию. В этих случаях мы имеем дело с временными модификациями, а не с наследственными изменениями. Неправильным является представление, что метод прививок был основным при выведении новых сортов Мичуриным и другими селекционерами. Основным методом получения новых исходных форм для селекции была половая гибридизация, о чем неоднократно писал и сам Мичурин. Прививки же использовались для усиления фенотипического выражения желаемых признаков, т. е. для получения модификаций, которые можно сохранить при вегетативном размножении. Иначе это можно назвать фенокопиями, при которых наблюдаются изменения фенотипа, имитирующие мутантные состояния, но не наследуемые при половом размножении. На фоне таких модификаций значительно повышалась эффективность отбора. Направленных же генотипических изменений, сохраняющихся в ряду семенных поколений, при прививках не обнаружено. 5. Трансплантация тканей и получение химерных животных. Позволяет изучать генетические закономерности совместимости тканей при пересадках. В настоящее время разработан метод получения химерных животных, например, аллофенных мышей. Суть его состоит в том, что конструируется бластула, состоящая из генетически различных бластомеров, которая затем имплантируется в матку гормонально подготовленной мыши. Таким образом, у химерных животных было установлено, что гены можно условно разделить на два типа: автономного и неавтономного действия. К первым относятся такие гены, доминантные аллели которых не подавляют проявление рецессивных аллелей этого же гена, находящихся в соседних клетках в гомозиготном состоянии. С другой стороны, продукты активности доминантных генов неавтономного действия, проникая в соседние клетки, определяют их фенотип. Генетика онкологических заболеваний Онкологические заболевания – это процессы, связанные с развитием раковых опухолей в различных тканях. Обычно раковые опухоли развиваются в тех тканях, в которых клетки интенсивно делятся. Известно около 100 типов раковых опухолей, из них наиболее часты встречающиеся: раки легких, молочной железы, толстой кишки, простаты и матки. Смертность от рака составляет 20% смертности в развитых странах. Раковые опухоли – это скопления интенсивно делящихся клеток. Процесс развития раковой опухоли называется канцерогенез. Начинается канцерогенез с нарушений клеточного цикла одной-единственной клетки, которая начинает интенсивно делиться (пролиферировать). К моменту обнаружения раковой опухоли путем рентгеноскопии в ее состав входит около 10 миллионов клеток (диаметр опухоли ~ 1 мм), к моменту обнаружения путем пальпирования ~ миллиард клеток (диаметр опухоли ~ 10 мм), при достижении опухолью размера 10 см (~ триллиард клеток) наступает летальный исход. Достаточно условно все раковые опухоли подразделяются на доброкачественные и злокачественные. Доброкачественные опухоли развиваются медленно, и образующие их клетки располагаются компактно. Одной из основных особенностей злокачественных опухолей является относительная автономность раковых клеток, их способность к неограниченному числу делений, обособление и способность метастазировать (разноситься по всему организму). Раковые клетки не подчиняются контрольным механизмам, регулирующим жизнедеятельность нормальных клеток. Раковые заболевания вызывают самые разнообразные факторы – канцерогены. С помощью близнецового метода показано, что в развитии раковых заболеваний человека значение внешних факторов исключительно велико. К физическим канцерогенам относятся: ионизирующее излучение, ультрафиолет, температурные и механические воздействия. При облучении покровов организма развивается рак кожи, при общем облучении – лейкозы, опухоли костей, рак щитовидной железы, при вдыхании радиоактивной пыли – рак легких. К химическим канцерогенам относятся самые разнообразные органические вещества: от четыреххлористого углерода до сложных полициклических и гетероциклических соединений. Например, смолы табачного дыма провоцируют рак легких (плоскоклеточную карциному), причем заболевание интенсивно развивается у курильщиков с 10…20-летним стажем. К биологическим канцерогенам относятся вирусы и их производные (провирусы). В клетках позвоночных животных присутствуют десятки встроенных в хромосомы геномов ДНК-содержащих опухолеродных вирусов (провирусов). Доказана вирусная природа рака молочной железы у мышей. Считается, что вирусы могут провоцировать раковые заболевания у человека (например, вирус гепатита – рак печени), однако это положение не доказано. Заметим, что часто канцерогенами являются известные мутагены. В то же время, рак – это генетическое заболевание. Злокачественность, т.е. способность одной или многих клеток приводить к развитию опухолей и метастазированию, передается в ряду соматических клеток. Известны случаи семейных раков (опухоли желудка, молочной железы, легких, матки и т. д.). Однако по наследству передается не сам рак, а лишь предрасположенности к раковым заболеваниям. В некоторых популяциях частота отдельных раковых заболеваний значительно ниже средней (в окрестностях Бомбея в 200 раз реже встречается рак кожи, в Нигерии – в 300 раз реже рак пищевода, в Англии – в 100 раз реже рак печени). К эндогенным генетическим факторам канцерогенеза относятся мобильные элементы генома: эндогенные провирусы, транспозоны и ретротранспозоны. Генетические причины раковых заболеваний могут быть самыми различными, поэтому существует несколько генетических теорий рака. В начале XX в. Бовери предложил, что рак обусловлен нарушениями в ядре клетки. Вскоре Де Фриз обосновал мутационную теорию рака, в которой подчеркивалась роль генных и хромосомных соматических мутаций в этиологии рака. В середине XX в. российский вирусолог Л. А. Зильбер сформулировал вирусо-генетическую теорию, согласно которой генетический материал онкогенных вирусов встраивается в хромосому клетки. Такое изменение генома, точнее отдельных, немногих локусов, нарушает биохимический механизм клеток, они приобретают автономность и начинают усиленно делиться. В 1980-1990-е гг. мутационная и вирусо-генетическая теории развития опухолей были объединены. Согласно синтетической генетической теории причиной рака являются самые разнообразные повреждения в генах, отвечающих за деление и дифференцировку клеток. Выявлено три группы таких генов. 1 группа – онкогены. В состав генома входят гены, активирующие деление клеток на ранних этапах эмбриогенеза – протоонкогены. У сформировавшегося организма эти гены находятся в функционально неактивном состоянии либо очень слабоактивны. Однако под воздействием внешних факторов (канцерогенов) или спонтанной перестройки структуры регулирующих участков ДНК (например, за счет инсерционного мутагенеза – вставки мобильных генетических элементов) экспрессия этих генов резко усиливается, и протоонкогены превращаются в онкогены. 2 группа – гены-супрессоры клеточных делений. В норме эти гены нормально функционируют, и их продукты ограничивают число клеточных делений. Однако под влиянием перечисленных факторов гены-супрессоры выключаются, и клетки начинают неограниченно делиться. 3 группа – гены, контролирующие упорядоченность структуры ДНК, например, гены репарации ДНК. Нарушения их функциональной активности приводит к повреждениям регуляторных последовательностей. В настоящее время продолжается изучение причин раковых заболеваний и разработка мер по их профилактике. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 7. МУТАЦИЯ, МОДИФИКАЦИЯ И ПОЛИПЛОИДИЯ. Лектор: ст.п. Мамедова М. З. 1.Изменчивость, ее причины и методы изучения. Классификация форм изменчивости. 2.Мутационная изменчивость. Основные положения мутационной теории. Общие свойства мутаций. 3.Генные мутации. Последствия мутаций. Методы выявления генных мутаций. 4.Общие закономерности мутационного процесса. Механизмы возникновения генных мутаций. 5.Хромосомные перестройки (аберрации). Молекулярные механизмы хромосомных перестроек 6.Изменение числа хромосом: автополиплоидия, аллополиплоидия, анеуплоидия. 1. Изменчивость, ее причины и методы изучения. Классификация форм изменчивости. Самовоспроизведение с изменением – это одно из основных свойств жизни. Термин «изменчивость» служит для обозначения различных понятий; как и большинство других терминов, он полисемантичен (многозначен). Юрий Александрович Филипченко различал два основных подхода к определению изменчивости. 1. Изменчивость как состояние. В этом значении термин «изменчивость» служит для обозначения отличий биологических объектов друг от друга в данный момент времени. Всегда существуют различия между частями одного организма, между разными организмами в популяции, между разными внутрипопуляционными группировками, между популяциями. 2. Изменчивость как процесс. В этом значении термин «изменчивость» служит для обозначения изменения биологического объекта во времени. В этом случае изменчивость отражает развитие особи, отличие потомков от родителей. Любая наблюдаемая изменчивость является фенотипической. В свою очередь, фенотипическая, или общая изменчивость включает три компонента: – Наследственная (генетическая, или генотипическая изменчивость) – в значительной мере обусловлена влиянием генетических факторов. Например, в сходных условиях выращивается несколько сортов одного вида растений. Тогда различия между результатами эксперимента (например, урожайность) обусловлены генетическими особенностями каждого сорта. В основе генетической изменчивости лежит мутационная и комбинативная изменчивость. – Ненаследственная (модификационная) изменчивость – в значительной мере обусловлена действием негенетических (экзогенных) факторов. Например, один сорт растений выращивается в разных условиях. Тогда различия между результатами эксперимента (например, урожайность) обусловлены влиянием условий выращивания растений. – Неконтролируемая (остаточная изменчивость) – обусловлена неконтролируемыми (по крайней мере, в данном эксперименте) факторами. Для разных признаков влияние генотипа и условий среды на общую фенотипическую изменчивость неодинаково. Например, окраска шерсти, жирномолочность у крупного рогатого скота, масса яиц у кур зависят, в основном, от особенностей породы (т.е. от генотипа) – эти признаки обладают высокой наследуемостью. Другие признаки: качество шерсти, общая удойность у КРС, яйценоскость у кур – зависят, в основном, от условий выращивания и содержания – эти признаки обладают низкой наследуемостью. 2. Мутационная изменчивость. Основные положения мутационной теории. Общие свойства мутаций Термин «мутация» (от лат. mutatio – изменение) долгое время использовался в биологии для обозначения любых скачкообразных изменений. Например, немецкий палеонтолог В. Вааген называл мутацией переход от одних ископаемых форм к другим. Мутацией называли также появление редких признаков, в частности, меланистических форм среди бабочек. Современные представления о мутациях сложились к началу XX столетия. Например, российский ботаник Сергей Иванович Коржинский в 1899 г. разработал эволюционную теорию гетерогенезиса, основанную на представлениях о ведущей эволюционной роли дискретных (прерывистых) изменений. Однако наиболее известной стала мутационная теория голландского ботаника Хьюго (Гуго) Де Фриза (1901 г.), который ввел современное, генетическое понятие мутации для обозначения редких вариантов признаков в потомстве родителей, которые не имели этого признака. Де Фриз разработал мутационную теорию на основе наблюдений за широко распространенным сорным растением – ослинником двулетним, или энотерой (Oenothera biennis). У этого растения существует несколько форм: крупноцветковые и мелкоцветковые, карликовые и гигантские. Де Фриз собирал семена с растения определенной формы, высевал их и получал в потомстве 1…2% растений другой формы. В дальнейшем было установлено, что появление редких вариантов признака у энотеры не является мутацией; данный эффект обусловлен особенностями организацией хромосомного аппарата этого растения. Кроме того, редкие варианты признаков могут быть обусловлены редкими сочетаниями аллелей (например, белая окраска оперения у волнистых попугайчиков определяется редким сочетанием aabb). Основные положения мутационной теории Де Фриза остаются справедливыми и по сей день (разумеется, с некоторыми современными уточнениями): 1 2 3 4 5 6 Положения мутационной теории Современные уточнения Де Фриза Мутации возникают внезапно, существует особый тип мутаций, без всяких переходов. накапливающихся в течение ряда поколений (прогрессирующая амплификация в интронах). Успех в выявлении мутаций без изменений зависит от числа проанализированных особей. Мутантные формы вполне при условии 100%-ной устойчивы. пенетрантности (мутантному генотипу соответствует мутантный фенотип) и 100%-ной экспрессивности (одна и та же мутация проявляется у разных особей в равной степени) Мутации характеризуются существуют ликовые мутации, в дискретностью результате которых происходит (прерывистостью); это незначительное изменение качественные изменения, характеристик конечного которые не образуют продукта непрерывных рядов, не группируются вокруг среднего типа (моды). Одни и те же мутации могут это касается генных мутаций; возникать повторно. хромосомные аберрации уникальны и неповторимы Мутации возникают в разных сами по себе мутации не носят направлениях, они могут быть адаптивный характер; только в вредными и полезными. ходе эволюции, в ходе отбора оценивается «полезность», «нейтральность» или «вредность» мутаций в определенных условиях; при этом «вредность» и «полезность» мутаций зависит от генотипической среды В настоящее время принято следующее определение мутаций: Мутации – это качественные изменения генетического материала, приводящие к изменению тех или иных признаков организма. Организм, во всех клетках которого обнаруживается мутация, называется мутантом. Это происходит в том случае, если данный организм развивается из мутантной клетки (гаметы, зиготы, споры). В ряде случаев мутация обнаруживается не во всех соматических клетках организма; такой организм называют генетической мозаикой. Это происходит, если мутации появляются в ходе онтогенеза – индивидуального развития. И, наконец, мутации могут происходить только в генеративных клетках (в гаметах, спорах и в клетках зародышевого пути – клетках-предшественницах спор и гамет). В последнем случае организм не является мутантом, но часть его потомков будет мутантами. Различают «новые» мутации (возникающие de novo) и «старые» мутации. Старые мутации – это мутации, появившиеся в популяции задолго до начала их изучения; обычно о старых мутациях едет речь в генетике популяций и в эволюционной теории. Новые мутации – это мутации, появляющиеся в потомстве немутантных организмов (♀ АА × ♂ АА → Аа); обычно именно о таких мутациях идет речь в генетике мутагенеза. Мутация – это случайное явление, т.е. невозможно предсказать: где, когда и какое изменение произойдет. Можно только оценить вероятность мутации в популяциях, зная фактические частоты определенных мутаций. Например, вероятность появления у кишечной палочки устойчивости к тетрациклину равна 10–10 (одна десятимиллиардная), поскольку лишь одна из 10 миллиардов клеток обнаруживает устойчивость к этому антибиотику (зато все потомство этой бактерии будет устойчивым к тетрациклину). Установлено, что мутабильность гена (т.е. частота появления определенной мутации) зависит от природы гена: существуют гены, склонные к мутированию, и относительно стабильные гены. Вероятность события – это математическая абстракция, математическое ожидание того, или иного события. Вероятность случайного события лежит в пределах от 0 до 1. Математическое ожидание определяется вне опыта (априорно), на основании дедуктивных рассуждений. Однако в биологии вероятность многих событий не может быть найдена вне опыта, например, вероятность рождения ребенка с синдромом Дауна. Тогда понятие математической вероятности подменяется понятием статистической вероятности. Статистическая вероятность определяется опытным путем (апостериорно). Численно статистическая, или апостериорная вероятность события равна относительной частоте этого события. Например, на 700 новорожденных приходится один ребенок с болезнью Дауна. Тогда статистическая вероятность рождения ребенка с этим заболеванием равна 1/700 ≈ 0,0014. Относительная частота колеблется около некоторого постоянного числа, которое и является математическим ожиданием события. Чем больше проведено наблюдений, тем больше апостериорная вероятность приближается к математическому ожиданию данного события. В одной и той же клетке может произойти несколько мутаций. Однако единичная мутация – это редкое событие. Поэтому для нахождения вероятности одновременного появления двух, трех и более мутаций нельзя использовать правило перемножения вероятностей. Вероятность того, что в клетке не произойдет ни одной мутации, произойдет одна мутация или более рассчитывается по закону Пуассона (чем выше вероятность одиночной мутации, тем более симметричной становится кривая распределения): Множественные аллели и генокопии В одном и том же гене могут возникать разные мутации: тогда возникают серии множественных аллелей. Например, у мушки дрозофилы ген white («уайт» – белый), определяющий окраску глаз представлен последовательно доминирующими аллелями: w + (темно-красные глаза) > w ch (вишневые) > w a (абрикосовые) > w bf (тускло-желтые) > w (белые) и т.д. У кроликов ген, определяющий степень выраженности альбинизма, представлен последовательно доминирующими аллелями: C (нормальная, неальбинистическая окраска) > c ch (шиншилловая) > c h (горностаевая) > с (полный альбинизм). У мышей ген, определяющий общую окраску тела, также представлен последовательно доминирующими аллелями: AY (желтая) > AL (агути со светлым брюхом) > A (агути, норма) > at (черная с подпалинами) > a (черная). Исходное, нормальное состояние аллеля традиционно называется дикими типом (часто обозначается символом +). Диким типом называют также нормальный генотип и нормальный фенотип. Сочетание двух мутантных аллелей называется компаундом (например, w ch // w bf или at // a). В то же время, в неаллельных, т.е. в разных генах (или в разных участках одного и того же гена) могут возникать мутации со сходным фенотипическим эффектом. Такие мутации называются генокопиями. Генокопии необходимо учитывать в здравоохранении (сходные наследственные заболевания – например, гемоглобинопатии – могут быть обусловлены разными мутациями), в селекционном процессе (например, мутациями в разных генах может быть обусловлена устойчивость к фитопатогенным грибам у разных сортов растений). Общие свойства мутаций В настоящее время считается, что многие мутации не оказывают существенного влияния на жизнеспособность особей; такие мутации называются нейтральными. Нейтральность мутаций часто обусловлена тем, что большинство мутантных аллелей рецессивно по отношению к исходному аллелю. Однако существуют мутации, приводящие к гибели организма (летальные) или заметно снижающие его жизнеспособность (полулетальные). В определенных условиях мутации могут повышать жизнеспособность организмов (как в примере с серповидноклеточной анемией). По способности передаваться при половом размножении различают соматические и генеративные мутации. Соматические мутации не затрагивают половые клетки и не передаются потомкам. В результате соматических мутаций возникают генетические мозаики. Генеративные мутации происходят в половых клетках и могут передаваться потомкам. При участии мутантных половых клеток образуются полностью мутантные организмы. Мутации возникают как в аутосомах, так и в половых хромосомах; соответственно различают аутосомные мутации и мутации, сцепленные с полом. Кроме того, по возможности проявления в фенотипе различают доминантные, полудоминантные и рецессивные мутации (заметим, что подавляющее большинство мутаций является рецессивными). Мутантный аллель может возвращаться в исходное состояние. Тогда первоначальная мутация называется прямой (например, переход А → а), а другая – обратной мутацией, или реверсией (например, обратный переход а → А). Классификации мутаций Мутации классифицируют на основании различных критериев. Например, по уровню фенотипического проявления различают следующие мутации: биохимические (изменяется структура белков); физиологобиохимические (изменяется обмен веществ); онтогенетические (изменяется характер онтогенеза); физиолого-репродуктивные (изменяются плодовитость, границы репродуктивного периода); анатомо-морфологические (изменяется внутреннее и внешнее строение организмов); этологические (поведенческие). По уровню организации генетического материала, затронутого изменением, все мутации делят на генные, хромосомные и геномные. 3. Генные мутации. Последствия мутаций. Методы выявления генных мутаций Генные мутации выражаются в изменении структуры отдельных участков ДНК. По своим последствиям генные мутации делятся на две группы: мутации без сдвига рамки считывания и мутации со сдвигом рамки считывания. Мутации без сдвига рамки считывания происходят в результате замены нуклеотидных пар, при этом общая длина ДНК не изменяется. В результате возможна замена аминокислот, однако из-за вырожденности генетического кода возможно и сохранение структуры белка. Пример 1. Замена аминокислотного остатка в составе полипептида (миссенс–мутации). В состав молекулы гемоглобина человека входят две цепи (-цепь закодирована в 16-ой хромосоме) и две -цепи (-цепь закодирована в 11-ой хромосоме). В состав -цепи входит 146 аминокислотных остатков, при этом в нормальной –цепи шестым аминокислотным остатком является глутаминовая кислота. С участием нормальной -цепи образуется нормальный гемоглобин – HbA. В нетранскрибируемой нити участка ДНК, кодирующего -цепь, глутаминовая кислота закодирована триплетом ГАА. Если же в результате мутации в ДНК произойдет замена триплета ГАА на триплет ГТА, то на месте глутаминовой кислоты в молекуле гемоглобина в соответствии с генетическим кодом появится валин. В итоге вместо гемоглобина HbA появится новый гемоглобин – HbS. Такая замена всего лишь одного нуклеотида и одной аминокислоты приводит к развитию тяжелого заболевания – серповидноклеточной анемии. На клеточном уровне серповидноклеточная анемия проявляется в том, что при гипоксии (недостатке кислорода) эритроциты приобретают форму серпа и теряют способность к нормальному транспорту кислорода. Гомозиготы HbS/HbS умирают в раннем детстве. Зато гетерозиготы HbA/HbS характеризуются слабо измененными эритроцитами. При этом изменение формы эритроцитов значительно повышает устойчивость гетерозигот к малярии. Поэтому в тех регионах Земли, где свирепствует малярия (например, в Африке), отбор действовал в пользу гетерозигот. Таким образом, серповидноклеточная анемия – это пример относительности «полезности» и «вредности» мутаций. Пример 2. Мутация без замены аминокислотного остатка в составе полипептида (сеймсенс-мутации). Если в нетранскрибируемой нити участка ДНК кодирующего –цепь гемоглобина, произойдет замена триплета ГАА на триплет ГАГ, то из-за избыточности генетического кода замены глутаминовой кислоты не произойдет. В итоге структура –цепи гемоглобина не изменится, и в эритроцитах будет обнаруживаться только нормальный гемоглобин HbA. Таким образом, вовсе не любая генная мутация проявляется в фенотипе. Особую группу образуют ликовые мутации, в результате которых происходит незначительное изменение характеристик конечного продукта. Это связано с заменой аминокислотных остатков в пассивной части белка: такие замены не оказывают существенного влияния на структуру и функции белка. Мутации со сдвигом рамки считывания (фреймшифты) происходят в результате вставки или потери нуклеотидных пар, при этом общая длина ДНК изменяется. В результате происходит полное изменение структуры белка. Однако если после вставки пары нуклеотидов происходит потеря пары нуклеотидов (или наоборот), то аминокислотный состав белков может восстановиться. Тогда две мутации хотя бы частично компенсируют друг друга. Это явление называется внутригенной супрессией. Мутации со сдвигом рамки считывания составляют 80% от всех генных мутаций. Вставки иначе называются инсерциями, а потери – эксцизиями. Процесс образования вставок называется инсерционным мутагенезом. Инсерционный мутагенез необходимо учитывать в генной инженерии. Нонсенс–мутации. Особую группу генных мутаций составляют нонсенс-мутации с появлением стоп-кодонов (замена смыслового кодона на стоп-кодон). Нонсенс-мутации могут возникать как вследствие замен нуклеотидных пар, так и с потерями или вставками. С появление стопкодонов синтез полипептида вообще обрывается. В результате могут возникать нуль-аллели, которым не соответствует ни один белок. Соответственно, возможно и обратное явление: замена нонсенс-кодона на смысловой кодон. Тогда длина полипептида может увеличиваться. Дополнение 1. Существуют особые мутации, влияющие на экспрессию генов у эукариот 1. Мутации, изменяющие степень компактизации ДНК. В гигантских политенных хромосомах и в хромосомах типа ламповых щеток описаны мутации, инактивирующие ген, расположенный в каком-либо одном участке ДНК, т.е. блокирующие декомпактизацию хроматина. Скрещивание гетерозигот по таким регуляторным мутациям в F2 дает расщепление 3:1, указывая на то, что они затрагивают единичные менделирующие факторы. 2. Гомеозисные мутации. Изменяют порядок экспрессии генов. Фенотипический эффект гомеозисных мутаций заключается в превращении одних органов в другие. Например, у мушки дрозофилы мутация группы bithorax, контролирующих развитие грудных и брюшных сегментов у дрозофилы, может приводить к появлению крылоподобных образований вместо галтеров; мутации группы antennapedia выражаются в том, что у насекомых на месте антенн вырастают ножки; мутации ophthalmoptera – развитие крыла из имагинального диска глаза; мутации proboscipedia – развитие ноги или части антенны (в зависимости от температуры) вместо хоботка; у мутантов tumorous head ткани головы замещаются другими типами тканей, включая структуры, характерные для гениталий. Дополнение 2. Некоторые мутации обладают плейотропным действием, т.е. приводят к изменению сразу нескольких признаков. Пример 1. Ароматические аминокислоты – триптофан, фенилаланин, тирозин – образуются из хоризмовой кислоты. Если некоторая мутация заблокирует хотя бы один этап синтеза хоризмовой кислоты, то клетка (организм) утрачивает способность к синтезу сразу трех аминокислот. Пример 2. Один и тот же фермент (трансаминаза) контролирует синтез валина (из α–кетоизовалериановой кислоты) и изолейцина (из α–кето–β– метилвалериановой кислоты). Если некоторая мутация нарушит функции этого фермента, то клетка (организм) утрачивает способность к синтезу сразу двух аминокислот. Пример 3. Один и тот же полипептид (продукт экспрессии одного гена) может входить в состав разных ферментов. Например, белок-апофермент липоатдегидрогеназы кишечной палочки в качестве субъединицы входит в состав других ферментов: пируватдегидрогеназы, 2оксоглутаратдегидрогеназы, глицинового расщепляющего комплекса. Тогда мутация в гене LDH скажется на активности всех перечисленных ферментов. Дополнение 3. Мутация в одном гене может подавлять мутации, происходящие в других (неаллельных) генах. Это явление называется межгенной супрессией. Методы выявления генных мутаций Сложность выявления генных мутаций связана, во-первых, с рецессивностью большинства мутаций (вероятность их фенотипического проявления ничтожно мала), а во вторых с летальностью многих из них (мутанты не выживают). Все множество методов выявления генных мутаций можно разделить на две группы: методы генетического анализа и биохимические методы. 1. Методы генетического анализа основаны на скрещивании возможных носителей мутации с тестерными линиями (линиями-анализаторами). Самый простой метод – это скрещивание носителей предполагаемой мутации с соответствующей рецессивно-гомозиготной линией, т.е. обычное анализирующее скрещивание. Однако этот метод не позволяет выявить неизвестные мутации, а также летальные мутации. Поэтому создаются специальные тестерные линии для учета летальных мутаций. Например, у мушки дрозофилы синтезирована тестерная линия М–5 (Мь wa – абрикосовые глаза; кроме того, имеется еще один аллель – sc, контролирующий отсутствие щетинок, но он в анализе обычно не учитывается). В хромосомах М–5 изменен порядок генов: имеется одна большая инверсия и одна малая, расположенная внутри большой (инверсии будут рассмотрены ниже); такое строение хромосом исключает появление кроссоверных особей при скрещивании мушек М–5 с другими линиями. Для выявления мутаций используются самцы дикого типа – с нормальными X–хромосомами (аллели В+ и w+ – нормальные красные глаза, sc+ – нормальные щетинки; нормальный порядок генов). Эти самцы подвергаются обработке мутагенами (факторами, повышающими частоту мутаций). В результате в их половых клетках часть X–хромосом мутирует, т.е. в них возникают мутации. Обработанные самцы скрещиваются с самками М–5. В первом поколении (F1) все самки имеют полосковидные темно-красные глаза, а самцы – абрикосовые полосковидные глаза. Кроме того, часть самок получает от отцов по нормальный X–хромосоме, а часть – по мутантной X– хромосоме. Все самцы получают от матерей М–5 только немутантные хромосомы с аллелями В и wa. В F1 рецессивные мутации у самок, даже если они есть, не дают летального эффекта, поскольку они находятся в гетерозиготном состоянии: мутантная X–хромосома дикого типа от отца сочетается с немутантной М–5–хромосомой от матери. Затем гибриды первого поколения скрещиваются между собой, и потомство каждой самки выращивается отдельно. Часть самок несет немутантную X– хромосому дикого типа, и в их потомстве обнаруживаются немутантные самцы дикого типа. Однако некоторая часть самок несет мутантную X– хромосому дикого типа с летальной мутацией; соответственно их сыновья, получившие такие хромосомы, не выживают, и самцы дикого типа в потомстве самок–носительниц не обнаруживаются. Ниже приведены схемы скрещивания, иллюстрирующие принцип использования метода Мѐллер–5 (символом l обозначены летальные мутации). Р: GP: F1: ♀ wa B // wa B ♂ w+ B+ // Y – обработка самцов абрикосовые полосковидные красные нормальные – окраска и форма глаз wa B w+ B+ – немутантная хромосома w+ B+ l – мутантная X –хромосома Y – Y–хромосома × ♀ w+ B+ // wa B ♀ w+ B+ l // wa B красные полосковидные глаза; без летальных мутаций красные полосковидные глаза;носители летальных мутаций X ♂ wa B // Y абрикосовые полосковидные глаза – 1 вариант скрещивания – без летальных мутаций F1: ♀ w+ B+ // wa B G1: красные полосковидные глаза w+ B+ ♂ wa B // Y × абрикосовые полосковидные глаза wa B wa B F2: ♀ w+ B+ // wa B красные полосковидные глаза Y ♀ wa B // wa B абрикосовые полосковидные глаза ♂ w+ B+ // Y красные нормальные глаза ♂ wa B // Y абрикосовые полосковидные глаза 2 вариант скрещивания – при наличии летальных мутаций F1: ♀ w+ B+ l // wa B G1: красные полосковидные глаза w+ B+ l × ♂ wa B // Y абрикосовые полосковидные глаза wa B wa B F2: ♀ w+ B+ l // wa B красные полосковидные глаза Y ♀ wa B // wa B абрикосовые полосковидные глаза ♂ w+ B+ l // Y самцы не обнаруживаются (летали) ♂ wa B // Y абрикосовые полосковидные глаза В настоящее время, кроме тестерной линии М–5 используются и другие тестерные лини мушек дрозофил и других модельных объектов. Например, существуют тест-системы, позволяющие выявлять мутации X-хромосомах самцов в первом же поколении, а также мутации в аутосомах. Применение этих линий позволяет изучать закономерности мутационного процесса, однако классический генетический анализ далеко не всегда можно использовать для выявления мутаций в популяциях человека и многих других организмов. 2. Биохимические методы выявления мутаций исключительно разнообразны и основаны на применении различных методик. а). Методики, основанные на выявлении определенных биохимических продуктов мутантных генов. Легче всего выявлять мутации по изменению активности ферментов или по утрате какого-либо биохимического признака. Например, у микроорганизмов на селективных питательных средах выявляются ауксотрофные формы, не способные синтезировать определенные вещества (по сравнению с нормальными, прототрофными формами). б). Методики, основанные на непосредственном выявлении измененных нуклеиновых кислот и белков с помощью гель-электрофореза в сочетании с другими методиками (блот-гибридизации, авторадиографии). 4. Общие закономерности мутационного процесса. Механизмы возникновения генных мутаций Причины возникновения мутаций По причинам возникновения различают спонтанные и индуцированные мутации. Спонтанные (самопроизвольные) мутации возникают без видимых причин. Эти мутации иногда рассматривают как ошибки трех Р: процессов репликации, репарации и рекомбинации ДНК. Это означает, что процесс возникновения новых мутаций находится под генетическим контролем организма. Например, известны мутации, которые повышают или понижают частоту других мутаций; следовательно, существуют гены-мутаторы и геныантимутаторы. В то же время, частота спонтанных мутаций зависит и от состояния клетки (организма). Например, в условиях стресса частота мутаций может повышаться. Индуцированные мутации возникают под действием мутагенов. Мутагены – это разнообразные факторы, которые повышают частоту мутаций. Впервые индуцированные мутации были получены отечественными генетиками Г.А. Надсоном и Г.С. Филипповым в 1925 г. при облучении дрожжей излучением радия. Различают несколько классов мутагенов: – Физические мутагены: ионизирующие излучения, тепловое излучение, ультрафиолетовое излучение. – Химические мутагены: аналоги азотистых оснований (например, 5бромурацил), альдегиды, нитриты, метилирующие агенты, гидроксиламин, ионы тяжелых металлов, некоторые лекарственные препараты и средства защиты растений. – Биологические мутагены: чистая ДНК, вирусы, антивирусные вакцины. – Аутомутагены – промежуточные продукты обмена веществ (интермедиаты). Например, этиловый спирт сам по себе мутагеном не является. Однако в организме человека он окисляется до ацетальдегида, а это вещество уже является мутагеном. Общие закономерности мутагенеза Мутации возникают не мгновенно. Вначале под воздействием мутагенов возникает предмутационное состояние клетки. Различные репарационные системы стремятся устранить это состояние, и тогда мутация не реализуется. Основу репарационных систем составляют различные ферменты, закодированные в генотипе клетки (организма). Таким образом, мутагенез находится под генетическим контролем клетки; это – не физико-химический, а биологический процесс. Например, ферментные системы репарации вырезают поврежденный участок ДНК, если повреждена только одна нить (эту операцию выполняют ферменты эндонуклеазы), затем вновь достраивается участок ДНК, комплементарный по отношению к сохранившейся нити (эту операцию выполняют ДНК-полимеразы), затем восстановленный участок сшивается с концами нити, оставшимися после вырезания поврежденного участка (эту операцию выполняют лигазы). Существуют и более тонкие механизмы репарации. Например, при утрате азотистого основания в нуклеотиде происходит его прямое встраивание (это касается аденина и гуанина); метильная группа может просто отщепляться; однонитевые разрывы сшиваются. В некоторых случаях действуют более сложные, малоизученные системы репарации, например, при повреждении обеих нитей ДНК. Однако при большом числе повреждений ДНК они могут стать необратимыми. Это связано с тем, что: во-первых, репарационные системы могут просто не успевать исправлять повреждения, а во-вторых, могут повреждаться сами ферменты систем репарации, необратимые повреждения ДНК приводят к появлению мутаций – стойких изменений наследственной информации. Физические мутагены К физическим мутагенам относятся: ионизирующее излучение (альфа-, бета-, гамма-, нейтронное и рентгеновское излучение), коротковолновое ультрафиолетовое излучение, СВЧ-излучение, действие экстремальных температур. Действие ионизирующего излучения основано на ионизации компонентов цитоплазмы и ядерного матрикса. При ионизации возникают высокоактивные химические вещества (например, свободные радикалы), которые различным образом действуют на клеточные структуры. Рассмотрим наиболее изученные механизмы мутагенного воздействия ионизирующего излучения. 1. Непосредственное воздействие частиц с высокой энергией на ДНК, которое приводит к ее разрывам: одиночным (под воздействием гаммаквантов, рентгеновских лучей) или множественных (под воздействием альфачастиц, нейтронного излучения). Это универсальный механизм возникновения хромосомных перестроек на всех стадиях клеточного цикла, но он действует очень грубо – обычно клетки теряют способность к нормальному делению и погибают. К разрывам ДНК приводит и ультрафиолетовое облучение. 2. Опосредованное воздействие ионизирующих факторов связано с нарушением структуры ферментов, контролирующих репликацию, репарацию и рекомбинацию ДНК. Этот механизм наиболее эффективно действует на синтетической стадии интерфазы. При больших дозах мутагенов клетки погибают. (Поскольку раковые клетки делятся непрерывно, то облучение является универсальным средством подавления развития метастазов при онкологических заболеваниях – непрерывно делящиеся раковые клетки более уязвимы, чем медленно пролиферирующие или непролиферирующие нормальные клетки.) Опосредованное воздействие ионизирующих факторов индуцирует самые разнообразные генные и хромосомные мутации. При опосредованном действии ионизирующих факторов их мутагенный эффект может быть снижен с помощью специальных веществ – радиопротекторов. К радиопротекторам относятся различные антиоксиданты, взаимодействующие с продуктами ионизации. В то же время, мутагенный эффект может быть усилен, например, высокая температура повышает мутагенный эффект радиации. 3. Особенности мутагенного действия ультрафиолетовых лучей. ДНК интенсивно поглощает жесткий ультрафиолет с длиной волны ≈ 254 нм. Основным продуктом является образование нуклеотидных димеров: два нуклеотида, расположенных рядом в одной цепи ДНК, «замыкаются» сами на себя, образуя пары «тимин–тимин» или «тимин–цитозин». При репликации ДНК напротив такой пары в достраивающейся цепи могут стать два любых нуклеотида, т.е. принцип комплементарности не выполняется. Ультрафиолетовый свет – это сравнительно мягкий мутаген, поэтому его широко используют в селекции растений, облучая проростки. 4. Особенности мутагенного действия экстремальных температур. Собственный мутагенный эффект экстремальных температур не доказан. Однако очень низкие или очень высокие температуры нарушают деление клетки (возникают геномные мутации). Экстремальные температуры усиливают действие других мутагенов, поскольку снижают ферментативную активность репарационных систем. Химические мутагены К химическим мутагенам относятся самые разнообразные вещества. Рассмотрим мутагенное действие некоторых из них. Алкилирующие агенты. Вызывают алкилирование ДНК (например, метилирование, этилирование и т.д.). В результате при репликации ДНК нарушается принцип комплементарности, и происходит замена нуклеотидных пар: ГЦ → АТ; ГЦ → ЦГ; ГЦ → ТА Некоторые из алкилирующих агентов в природе не встречаются, их не распознают ферменты защитных систем. Такие вещества называются супермутагенами (например, N-метил-N-нитрозомочевина). Супермутагены применяются в селекции растений для получения индуцированных мутаций; их используют также как стимуляторы роста (в сверхмалых концентрациях). Гидроксиламин. Избирательно аминирует цитозин, что также нарушает принцип комплементарности при репликации ДНК. В результате происходит замена ГЦ → АТ. Нитриты. Осуществляют окислительное дезаминирование гуанина, аденина, цитозина. Также нарушается принцип комплементарности при репликации ДНК. В результате происходит замена АТ → ГЦ. Аналоги оснований. Это вещества, сходные с «обычными» азотистыми основаниями. Однако они способны образовывать комплементарные пары с разными «нормальными» основаниями. Например, при репликации ДНК напротив гуанина вместо цитозина достраивается 5-бромурацил (аналог тимина). В дальнейшем напротив 5-бромурацила достраивается аденин, а напротив аденина – обычный тимин. Этот же процесс может идти и в противоположную сторону. В результате происходят замены: ГЦ → АТ или АТ → ГЦ. Существует множество иных химических факторов, обладающих мутагенным, канцерогенным и тератогенным действием. Например, ионы тяжелых металлов, связываясь с ферментами репликации, репарации и рекомбинации, снижают их ферментативную активность. Таким образом, не являясь собственно мутагенами, ионы тяжелых металлов способствуют появлению мутаций. Кроме того, нужно учесть, что воздействие совершенно разных мутагенов может приводить к сходным результатам. Опасность загрязнения окружающей среды мутагенами Проблемы генетической безопасности Во второй половине ХХ века над биосферой нависла угроза загрязнения мутагенами. Любая популяция способна выдержать лишь определенный груз мутаций. Увеличение частоты мутаций может привести к снижению устойчивости популяций из-за нарушения генетического гомеостаза. Необходимо дальнейшее усиление эколого-генетического мониторинга – контроля за состоянием окружающей среды на популяционно-генетическом уровне. В качестве профилактических мер следует использовать развитие «безотходных» технологий, ограничение производства веществ с мутагенным действием, усиление всех видов контроля за состоянием потенциально опасных предприятий: АЭС, химические и микробиологические производства, научно-промышленные установки биотехнологического характера. Существуют факторы, которые снижают частоту мутаций – антимутагены. К антимутагенам относятся некоторые витамины–антиоксиданты (например, витамин Е, ненасыщенные жирные кислоты), серосодержащие аминокислоты, а также различные биологически активные вещества, которые повышают активность репарационных систем. Установлено, что мутагены при определенных условиях оказывают канцерогенное и тератогенное действие. Канцерогены – это факторы, провоцирующие развитие онкологических заболеваний; тератогены – это факторы, провоцирующие развитие различных аномалий, уродств. Тератогенный эффект дают многие лекарственные препараты. Например, в 1960-е гг. на Западе широко использовалось снотворное талидомид, применение которого привело к рождению большого числа детей с недоразвитыми конечностями. Наряду с тератами – уродствами – часто встречаются морфозы – изменения, которые не ведут к утрате органом его функций. Отличить мутагенное действие от тератогенного сравнительно легко: тераты (уродства) являются ненаследственными модификациями, они предсказуемы (направлены) и не сохраняются в последующих поколениях. Например, серая окраска тела у дрозофилы – это нормальный признак. В то же время известна мутация yellow – желтое тело (эту мутацию легко получить искусственно, обрабатывая родительских особей различными мутагенами; при этом разные мутагены могут давать одинаковый фенотипический эффект). Если же личинкам дрозофилы добавлять в корм азотнокислое серебро, то все эти личинки разовьются в мух с желтым телом. Но, если от этих желтых мух получить потомство и выращивать его на обычной питательной среде, то все потомки вновь станут серыми. Таким образом, в данном случае «пожелтение» тела мух – это не мутация, а модификация, или фенокопия (модификация, по фенотипу копирующая мутацию); азотнокислое серебро в данном случае является не мутагеном, а тератогеном. 5.Хромосомные перестройки (аберрации). Молекулярные механизмы хромосомных перестроек Хромосомными перестройками, или хромосомными аберрациями называются видимые изменения структуры хромосом. (Иногда хромосомные перестройки называют хромосомными мутациями.) Хромосомные аберрации (в отличие от генных мутаций) всегда уникальны, неповторимы. Поэтому при отсутствии близкородственного скрещивания хромосомные аберрации встречаются только в гетерозиготном состоянии: в сочетании с нормальными хромосомами или в компаунде с другими аберрациями. При близкородственном скрещивании (инбридинге) возможно образование гомозигот. Различают внутрихромосомные аберрации (фрагментацию, нехватки, дупликации, инверсии, транспозиции) и межхромосомные (транслокации). Рассмотрим подробнее основные типы хромосомных аберраций. Фрагментация – это дробление хромосом с образованием множества различных фрагментов. У некоторых организмов существуют полицентрические хромосомы, и при фрагментации каждый из фрагментов получает центромеру, тогда он может нормально реплицироваться и участвовать в делении клетки. Концевые нехватки, или дефишенси – потери концевых, теломерных участков хромосом. В результате образуются линейные фрагменты, лишенные центромеры (линейные ацентрики). Ацентрики не участвуют в делении клетки и утрачиваются. Нехватки внутренних участков, или делеции – потери участков хромосом, не затрагивающие теломеры. Утраченные участки, лишенные центромер, обычно образуют кольцевые ацентрики, которые также утрачиваются. Дупликации – это удвоения участков хромосом. В результате возникают тандемные последовательности генов, например: abcabc. Дупликации – один из путей возникновения новых генов. Инверсии – повороты участков хромосом на 180°. Различают перицентрические инверсии (инвертированный участок включает центромеру) и парацентрические (инвертированный участок лежит в одном из плеч хромосомы вне центромеры). У гетерозигот при перекресте нормальных и инвертированных хромосом возникают ацентрики и дицентрики; в результате возникают неполноценные клетки, и продукты кроссинговера не переходят в последующие поколения (поэтому инверсии образно называют «запирателями кроссинговера»). Таким образом, инверсии способствуют сохранению целых блоков генов – супергенов. Если инверсии сочетаются с дупликациями, то могут возникать палиндромы, например: abccba. Транспозиции – это перемещения участков хромосомы в другие локусы (точки) этой же хромосомы. Существуют участки хромосом, склонные к транспозициям, их называют «прыгающими генами», мобильными генетическими элементами, или транспозонами. При транспозициях гены, изменившие свое положение, могут изменять свою активность – такое явление называется эффектом положения. В результате эффекта положения гены изменять свои первоначальные функции, что приводит, в сущности, к появлению новых генов. Транслокации – это перемещения участков хромосомы или всей хромосомы в другую хромосому. В некоторых случаях происходит полное слияние гомологичных хромосом с образованием двуцентромерных структур – дицентриков. В других случаях из двух акроцентрических хромосом образуется одноцентромерная двуплечая хромосома. Такое слияние хромосом называется робертсоновской транслокацией. Робертсоновские транслокации часто встречаются у грызунов. Последствия хромосомных аберраций у разных организмов различны. У относительно низкоорганизованных организмов (у растений, насекомых, грызунов) хромосомные перестройки могут приводить к появлению новых признаков, но могут и не проявляться фенотипически. У человека хромосомные перестройки в гетерозиготном состоянии снижают плодовитость, а в гомозиготном – летальны. Механизмы возникновения хромосомных аберраций разнообразны: – неравный кроссинговер между гомологичными хромосомами (возникают делеции и дупликации) и негомологичными хромосомами (возникают транслокации); – внутрихромосомный кроссинговер (возникают делеции и инверсии); – разрывы хромосом (возникают различные фрагменты); – разрывы хромосом с последующим соединением фрагментов (возникают инверсии, транспозиции, транслокации); – копирование гена и перенос копии в другой участок хромосомы (возникают транспозиции). Причины хромосомных аберраций и механизмы их возникновения различны. Хромосомные аберрации могут возникать в длительно хранящихся семенах или в тканево-клеточных культурах спонтанно, без видимых причин. Появлению хромосомных аберраций способствуют различные химические вещества, которые не являются мутагенами, но нарушают нормальную жизнедеятельность клеток (ионы тяжелых металлов, альдегиды, окислители и др.). Хромосомные аберрации часто возникают при облучении клеток. В этом случае возникают как одиночные разрывы хромосом, так и двойные (или множественные). Одиночные разрывы ведут к появлению концевых нехваток, двойные (множественные) разрывы – к появлению всех остальных типов аберраций. При разрывах на пресинтетической стадии изменяется вся хромосома, и наблюдаются двойные аберрации; при разрывах на постсинтетической стадии изменяется только одна хроматида, и наблюдаются одиночные аберрации. Методы выявления хромосомных аберраций. Для выявления хромосомных аберраций используются различные методы цитогенетического анализа. Например, анафазный анализ позволяет выявить мосты и отставания (дицентрики и другие продукты транслокаций), фрагменты (ацентрики). Метафазный и пахитенный анализ позволяют выявить изменение структуры хромосом, линейные и кольцевые фрагменты. Особое место в выявлении хромосомных аберраций занимает анализ гигантских политенных хромосом, встречающихся в слюнных железах личинок двукрылых (комаров, мух) и в некоторых клетках других организмов. Этот метод основан на нарушении нормальной соматической конъюгации политенных хромосом у гетерозигот по хромосомным аберрациям; в результате образуются различной формы петли. 6. Изменение числа хромосом: автополиплоидия, аллополиплоидия, анеуплоидия. Прочие цитогенетические феномены. Механизмы геномных мутаций Изменение числа хромосом в клетке означает изменение генома. (Поэтому такие изменения часто называют геномными мутациями.) Известны различные цитогенетические феномены, связанные с изменением числа хромосом. Автополиплоидия Автополиплоидия представляет собой многократное повторение одного и того же генома, или основного числа хромосом (х). Этот тип полиплоидии характерен для низших эукариот и покрытосеменных растений. У многоклеточных животных автополиплоидия встречается крайне редко: у дождевых червей, некоторых насекомых, некоторых рыб и земноводных. Автополиплоиды у человека и других высших позвоночных погибают на ранних стадиях внутриутробного развития. У большинства эукариотических организмов основное число хромосом (x) совпадает с гаплоидным набором хромосом (n); при этом гаплоидное число хромосом – это число хромосом в клетках, образовавшихся в хорде мейоза. Тогда в диплоидных (2 n) содержится два генома x, и 2 n = 2 x. Однако у многих низших эукариот, многих споровых и покрытосеменных растений в диплоидных клетках содержится не 2 генома, а некоторое иное число. Число геномов в диплоидных клетках называется геномным числом (Ω). Последовательность геномных чисел называется полиплоидным рядом. Например, у злаков при x = 7 известны следующие полиплоидные ряды (знаком + отмечено наличие полиплоида определенного уровня): Названия видов Овсяница красная Геномные числа (Ω), уровни плоидности числа хромосом в соматических клетках 2 3 4 5 6 7 8 9 x x x x x x x x 1 2 2 3 4 4 5 6 4 1 8 5 2 9 6 3 + + + Овсяница овечья Полевица побегообразующая Костер безостый + + + + + + + 1 0x 7 0 + + + + + + + Различают сбалансированные и несбалансированные автополиплоиды. Сбалансированными полиплоидами называются полиплоиды с чѐтным числом хромосомных наборов, а несбалансированными – полиплоиды с нечетным числом хромосомных наборов, например: несбалансированные полиплоиды гаплоиды 1x триплоиды 3x пентаплоиды 5x гектаплоиды 7x эннеаплоиды 9x сбалансированные полиплоиды диплоиды 2x тетраплоиды 4x гексаплоиды 6x октоплоиды 8x декаплоиды 10 x Автополиплоидия часто сопровождается увеличением размеров клеток, пыльцевых зерен и общих размеров организмов, повышенным содержанием сахаров и витаминов. Например, триплоидная осина (3х = 57) достигает гигантских размеров, долговечна, еѐ древесина устойчива к гниению. Среди культурных растений широко распространены как триплоиды (ряд сортов земляники, яблони, арбузов, бананов, чая, сахарной свеклы), так и тетраплоиды (ряд сортов ржи, клевера, винограда). В природных условиях автополиплоидные растения обычно встречаются в экстремальных условиях (в высоких широтах, в высокогорьях); более того, здесь они могут вытеснять нормальные диплоидные формы. Положительные эффекты полиплоидии связаны с увеличением числа копий одного и того же гена в клетках, и, соответственно, в увеличении дозы (концентрации) ферментов. Однако в ряде случаев полиплоидия приводит к угнетению физиологических процессов, особенно при очень высоких уровнях плоидности. Например, 84-хромосомная пшеница менее продуктивна, чем 42-хромосомная. Однако автополиплоиды (особенно несбалансированные) характеризуются сниженной плодовитостью или полным бесплодием, что связано с нарушениями мейоза. Поэтому многие из них способны только к размножению вегетативным путем. Аллополиплоидия Аллополиплоидия представляет собой многократное повторение двух и более разных гаплоидных хромосомных наборов, которые обозначаются разными символами. Полиплоиды, полученные в результате отдаленной гибридизации, то есть от скрещивания организмов, принадлежащих к различным видам, и содержащие два и более набора разных хромосом, называются аллополиплоиды. Аллополиплоиды широко распространены среди культурных растений. Однако, если в соматических клетках содержится по одному геному от разных видов (например, один геном А и один – В), то такой аллополиплоид – бесплоден. Бесплодие простых межвидовых гибридов связано с тем, что каждая хромосома представлена одним гомологом, и образование бивалентов в мейозе оказывается невозможным. Таким образом, при отдаленной гибридизации возникает мейотический фильтр, препятствующий передаче наследственных задатков в последующие поколения половым путем. Поэтому у плодовитых полиплоидов каждый геном должен быть удвоен. Например, у разных видов пшеницы гаплоидное число хромосом (n) равно 7. Дикая пшеница (однозернянка) содержит в соматических клетках 14 хромосом лишь одного удвоенного генома А и имеет геномную формулу 2n = 14 (14А). Многие аллотетраплоидные твердые пшеницы содержат в соматических клетках 28 хромосом удвоенных геномов А и В; их геномная формула 2n = 28 (14А + 14В). Мягкие аллогексаплоидные пшеницы содержат в соматических клетках 42 хромосомы удвоенных геномов А, В, и D; их геномная формула 2n = 42 (14A + 14B + 14D). Плодовитые аллополиплоиды можно получать искусственным путем. Например, редечно-капустный гибрид, синтезированный Георгием Дмитриевичем Карпеченко, был получен путем скрещиванием редьки и капусты. Геном редьки обозначается символом R (2n = 18 R, n = 9 R), а геном капусты – символом B (2n = 18 B, n = 9 B). Первоначально полученный гибрид имел геномную формулу 9 R + 9 B. Этот организм (амфигаплоид) был бесплодным, поскольку в мейозе образовывалось 18 одиночных хромосом (унивалентов) и ни одного бивалента. Однако у этого гибрида некоторые гаметы оказались нередуцированными. При слиянии таких гамет был получен плодовитый амфидиплоид: (9 R + 9 B) + (9 R + 9 B) → 18 R + 18 B. У этого организма каждая хромосома была представлена парой гомологов, что обеспечило нормальное образование бивалентов и нормальное расхождение хромосом в мейозе: 18 R + 18 B → (9 R + 9 B) и (9 R + 9 B). В настоящее время ведется работа по созданию искусственных амфидиплоидов у растений (например, пшенично-ржаных гибридов (тритикале), пшенично-пырейных гибридов) и животных (например, гибридных шелкопрядов). Тутовый шелкопряд – объект интенсивной селекционный работы. Нужно учесть, что у этого вида (как и у большинства бабочек) самки – гетерогаметный пол (XY), а самцы – гомогаметный (XX). Для быстрого размножения новых пород шелкопряда используют индуцированный партеногенез – из самок извлекают неоплодотворенные яйца еще до мейоза и нагревают их до 46 °С. Из таких диплоидных яиц развиваются только самки. Кроме того, у шелкопряда известен андрогенез – если яйцеклетку нагреть до 46 °С, убить ядро рентгеновскими лучами, а затем осеменить, то в яйцеклетку могут проникнуть два мужских ядра. Эти ядра сливаются между собой, и образуется диплоидная зигота (ХХ), из которой развивается самец. Для тутового шелкопряда известна автополиплоидия. Кроме того, Борис Львович Астауров скрещивал тутового шелкопряда с дикой форой мандаринового шелкопряда, и в результате были получены плодовитые аллополиплоиды (точнее, аллотетраплоиды). У тутового шелкопряда выход шелка из коконов мужского пола на 20-30 % выше, чем из коконов женского пола. В.А. Струнников с помощью индуцированного мутагенеза вывел породу, у которой самцы в Х– хромосомах несут разные летальные мутации (система сбалансированных леталей) – их генотип l1+/+l2. При скрещивании таких самцов с нормальными самками (++/Y) из яиц выходят только будущие самцы (их генотип l1+/++ или l2/++), а самки погибают на эмбриональной стадии развития, поскольку их генотип или l1+/Y, или +l2/Y. Для разведения самцов с летальными мутациями используются специальные самки (их генотип +l2/++·Y). Тогда при скрещивании таких самок и самцов с двумя летальными аллелями в их потомстве половина самцов погибает, а половина – несет два летальных аллеля. Существуют породы тутового шелкопряда, у которых в Y–хромосоме имеется аллель темной окраски яиц. Тогда темные яйца (XY, из которых должны вывестись самки), отбраковываются, а оставляются только светлые (ХХ), которые в дальнейшем дают коконы самцов. Анеуплоидия Анеуплоидия (гетерополиплоидия) – это изменение числа хромосом в клетках, некратное основному хромосомному числу. Различают несколько типов анеуплоидии. При моносомии утрачивается одна из хромосом диплоидного набора (2n – 1). При полисомии к кариотипу добавляется одна или несколько хромосом. Частным случаем полисомии является трисомия (2n + 1), когда вместо двух гомологов их становится три. При нуллисомии отсутствуют оба гомолога какой-либо пары хромосом (2n – 2). У человека анеуплоидия приводит к развитию тяжелых наследственных заболеваний. Часть из них связана с изменением числа половых хромосом (см. главу 17). Однако существуют и другие заболевания: – Трисомия по 21-ой хромосоме (кариотип 47, +21); синдром Дауна; частота среди новорожденных – 1:700. Замедленное физическое и умственное развитие, широкое расстояние между ноздрями, широкая переносица, развитие складки века (эпикант), полуоткрытый рот. В половине случаев встречаются нарушения в строении сердца и кровеносных сосудов. Обычно понижен иммунитет. Средняя продолжительность жизни – 9-15 лет. – Трисомия по 13-ой хромосоме (кариотип 47, +13); синдром Патау. Частота среди новорожденных – 1:5.000. – Трисомия по 18-ой хромосоме (кариотип 47, +18); синдром Эдвардса. Частота среди новорожденных – 1:10.000. Гаплоидия Уменьшение числа хромосом в соматических клетках до основного числа называется гаплоидия. Существуют организмы – гаплобионты, для которых гаплоидия – это нормальное состояние (многие низшие эукариоты, гаметофиты высших растений, самцы перепончатокрылых насекомых). Гаплоидия как аномальное явление встречается среди спорофитов высших растений: у томата, табака, льна, дурмана, некоторых злаков. Гаплоидные растения отличаются пониженной жизнеспособностью; они практически бесплодны. Псевдополиплоидия (ложная полиплоидия) В некоторых случаях изменение числа хромосом может произойти без изменения объема генетического материала. Образно выражаясь, изменяется число томов, но не изменяется число фраз. Такое явление называется псевдополиплоидия. Различают две основные формы псевдополиплоидии: 1. Агматополиплоидия. Наблюдается в том случае, если крупные хромосомы распадаются на множество мелких. Встречается у некоторых растений и насекомых. У некоторых организмов (например, у круглых червей) происходит фрагментация хромосом в соматических клетках, но в половых клетках сохраняются исходные крупные хромосомы. 2. Слияние хромосом. Наблюдается в том случае, если мелкие хромосомы объединяются в крупные. Встречается у грызунов. Механизмы возникновения полиплоидии. Использование геномных мутаций в селекции Исходно автополиплоидия является следствием нерасхождения хромосом при делении клетки: при митозе (тогда возникают митотические полиплоиды) или при мейозе (тогда возникают мейотические полиплоиды). [Нарушения нормального расхождения хромосом иначе называют нарушением сегрегации хромосом.] Митотические полиплоиды обычно возникают вследствие нерасхождения хромосом в анафазе: вместо двух ядер образуется одно, в котором число хромосом становится в два раза большим, чем в исходном ядре. Таким образом, из диплоидной клетки (2n, или 2х) образуется тетраплоидная (4n, или 4х). У низших эукариот при дальнейших делениях клеток число хромосом может возрастать, и одно ядро может содержать множество хромосомных наборов (8х...16х...32х; и даже до 4000...6000х, например, в макронуклеусе у инфузорий). Причины нерасхождения хромосом многообразны. Например, существует спонтанная полиплоидизация, которая происходит без видимых причин. В экспериментальных условиях нерасхождение хромосом можно вызвать путем воздействия на клетки митозными ядами. К митозным ядам относятся: колхицин, винбластин, аценафтен и др. Митозные яды разрушают микротрубочки веретена деления, что делает невозможным нормальное расхождение хромосом (такой митоз называется К–митозом). Полиплоидные клетки можно получать, используя рентгеновское облучение, повышенные или пониженные температуры, некоторые химические вещества (эфир, хлороформ). При воздействии перечисленных фактор может изменяться не только число геномов, но и число отдельных хромосом (т.е. возникает анеуплоидия), а также и структура хромосом (т.е. возникают хромосомные перестройки). Полиплоидные клетки меристем в дальнейшем могут давать начало спорогенным клеткам, и тогда образуются полиплоидные гаметы, например: 4х (спорогенные диплоидные клетки)→ мейоз → 2х (гаплоидные споры с двойным набором хромосом, дающие начало гаплоидным яйцеклеткам или спермиям). Мейотические полиплоиды возникают вследствие нерасхождения хромосом при мейозе. Рассмотрим типичные нарушения сегрегации хромосом. 1. Нерасхождение по всем хромосомам. а). Сегрегация вообще отсутствует (например, при полном разрушении веретена деления). Тогда из исходной диплоидной клетки образуется одна тетраплоидная клетка, в которой остается весь исходный хроматин. б). Первое деление мейоза протекает как митоз: в результате из исходной диплоидной клетки образуется диада – две диплоидные клетки с однохроматидными хромосомами. Образовавшиеся клетки идентичны по отношению друг к другу и по отношению к материнской клетке. При этом в каждой из диплоидных клеток содержится два разных хромосомных набора (два разных генома, например, Х 1 Х 2). Эти клетки утрачивают способность к делению и дают начало спорам или гаметам. Подобные нарушения встречаются у гибридов, если невозможно образование бивалентов. в). Первое деление происходит нормально (с образованием гаплоидных клеток с двухроматидными хромосомами), но второе деление блокируется на стадии метафазы II. В результате происходит диплоидизация гаплоидных клеток: каждая двухроматидная хромосома расщепляется на две хроматиды, эти хроматиды не расходятся, и диплоидное число хромосом восстанавливается. Конечным результатом такого мейоза также является образование диады – двух диплоидных клеток, которые дают начало спорам или гаметам. При этом в каждой из диплоидных клеток содержится два одинаковых хромосомных набора (два разных генома, например, в одной клетке Х 1 Х 1, а в другой – Х 2 Х 2). Подобные нарушения встречаются значительно реже, чем предыдущее. 2. Нерасхождение по отдельным хромосомам. Эти нарушения аналогичны предыдущим, но нарушение сегрегации затрагивает лишь отдельные хромосомы. В результате в одних дочерних клетках появляются избыточные хромосомы, а в других клетках эти хромосомы утрачиваются. Нерасхождение хромосом (как и при митозе) может быть спонтанным, но может быть обусловлено и действием определенных внешних факторов, как при митозе. В дальнейшем полиплоиды могут использоваться для получения новых полиплоидов путем гибридизации. Например, триплоидные семена получают, скрещивая автотетраплоидные и диплоидные сорта. В этом случае гаметы с удвоенным основным хромосомным числом (2х) сливаются с нормальными гаметами (х). Этот процесс может протекать и в природных условиях, т.е. спонтанно. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 8. ГЕНЕТИЧЕСКИЕ ОСНОВЫ ИНДИВИДУАЛЬНОГО РАЗВИТИЯ Лектор: ст.п. Мамедова М. З. 1. Общая характеристика онтогенеза 2. Генетическая детерминация онтогенеза. Генотип и среда. Поливариантность онтогенеза. Программы онтогенеза 3. Механизмы реализации программ онтогенеза 1. Общая характеристика онтогенеза Индивидуальное развитие организмов является предметом исследования многих биологических наук: эмбриологии (биологии индивидуального развития), физиологии, биохимии, гистологии, цитологии, цитогенетики и генетики. Каждая из этих наук, используя свои методы, изучает различные стороны и закономерности индивидуального развития. Раздел генетики, изучающий действие генов в онтогенезе, называется генетикой индивидуального развития, феногенетикой или онтогенетикой. Генетические методы исследования открыли новые возможности для изучения индивидуального развития. При этом особое значение имеют исследования действия мутантных генов. Получая прямые и обратные мутации генов, можно включать и выключать отдельные звенья развития, что позволяет установить последовательность процессов. Индивидуальное развитие особи называется онтогенезом (Э. Геккель, 1866). Особью, или индивидом (от лат. individuum – неделимый) называется неделимый далее организм (от лат. organizo и франц. organisme – устраиваю, придаю стройность). Главные существенные признаки особи – это еѐ целостность, строгая взаимозависимость всех частей, органов и систем органов: разделить особь на части без потери морфофункциональной индивидуальности невозможно. Само выражение «особь» подразумевает обособленность: таким образом, особь обособлена, отделена от других подобных особей, она способна (хотя бы частично) к самостоятельному существованию. С эволюционной точки зрения, особью называется морфофизиологическая единица, происходящая от одного зачатка: от одной зиготы (при половом размножении), яйцеклетки (при партеногенезе), споры (при споровом размножении), почки или любого другого зачатка (при бесполом или вегетативном размножении). В дальнейшем зачаток, дающий начало новой особи, будем для краткости называть зиготой, поскольку именно при образовании зиготы возникают новые сочетания наследственных факторов, определяющих индивидуальность особи. Именно особь является объектом воздействия эволюционных факторов, в первую очередь – естественного отбора. Целостность и дискретность онтогенеза. Онтогенез особи начинается с момента еѐ образования. Этим событием особи может быть прорастание споры, образование зиготы, начало дробления зиготы, возникновение особи тем или иным путем при вегетативном размножении (иногда начало онтогенеза относят к образованию исходных клеток, например, оогоний). В ходе онтогенеза происходят рост, дифференцировка и интеграция частей развивающегося организма. Онтогенез особи может завершиться еѐ физической смертью или еѐ воспроизведением (в частности, при размножении путем деления). Каждый организм в период индивидуального развития представляет собой целостную систему, следовательно, и онтогенез – это целостный процесс, который не может быть разложен на простые составляющие части без потери качества. Однако существует морфологическая и функциональная дискретность онтогенеза, обусловленная дискретной генетической детерминацией. Реализация генотипа в онтогенезе изменчива и происходит приспособительно к конкретным условиям среды. Таким образом, генотип способен обеспечивать в определенных пределах изменчивость онтогенеза в зависимости от изменяющихся условий внешней среды. Степень возможной изменчивости в ходе реализации генотипа называется нормой реакции и выражается совокупностью возможных фенотипов при различных условиях среды. Это определяет так называемую онтогенетическую адаптацию, обеспечивающую выживание и репродукцию организмов иногда даже при значительных изменениях внешней среды. Необратимость онтогенеза. Онтогенез растений и животных состоит из качественно различных периодов: эмбриогенез, юность, зрелость и старость. Онтогенез многоклеточных организмов сопровождается рядом общих основных процессов: рост – увеличение числа клеток и/или их объема (растяжение); гистогенез – образование и дифференцировка тканей; органогенез – образование органов и систем органов; морфогенез – формирование внутренних и внешних морфологических признаков; физиолого-биохимические преобразования. Все это происходит на основе биохимической, физиологической, генетической и морфологической дифференцировки клеток, тканей и органов. В ходе онтогенеза возникает ряд особенностей, обеспечивающих приспособление организма к окружающей среде. Онтогенез включает две группы процессов: морфогенез и воспроизведение (репродукцию). При соблюдении принципов дискретности и необратимости онтогенеза особь вначале должна использовать энергию для осуществления морфогенетических процессов, и лишь по достижении зрелости – для воспроизведения. Основные типы онтогенеза Существует множество основных типов онтогенеза и еще большее число производных типов, например: Онтогенез организмов с бесполым размножением и/или при зиготном мейозе (прокариоты и некоторые низшие эукариоты). Онтогенез организмов с чередованием ядерных фаз при споровом мейозе (большинство растений и грибов). Онтогенез с чередованием полового и бесполого размножения без смены ядерных фаз. Чередование поколений с половым и бесполым размножением у Кишечнополостных называется метагенезом. Чередование партеногенетического и амфимиктического поколений у червей, некоторых членистоногих и низших хордовых называется гетерогонией. Онтогенез с наличием личиночных и промежуточных стадий: от первично-личиночного анаморфоза до полного метаморфоза. Онтогенез с утратой личиночных стадий и/или стадий бесполого размножения: пресноводные гидры, олигохеты, наземные и вторично-водные брюхоногие моллюски. Онтогенез с утратой конечных стадий и размножением на ранних этапах онтогенеза; проявляется в виде педоморфозов (сохранении личиночных черт) и неотении (размножения на личиночной стадии). Особенности онтогенеза у животных. У животных важную роль в регуляции онтогенетических процессов играют эндокринная и нервная системы. В онтогенезе высших животных выделяют следующие этапы (периоды) онтогенеза: предзародышевый (преэмбриональный) – развитие половых клеток (гаметогенез) и оплодотворение; зародышевый (эмбриональный) – развитие организма под защитой яйцевых и зародышевых оболочек или под защитой материнского организма; послезародышевый (постэмбриональный) – до достижения половой зрелости; взрослое состояние – размножение, забота о потомстве, старение и гибель. В рамках эмбрионального периода различают следующие типы онтогенеза: первично-личиночный – личинка способна к самостоятельному существованию (паренхимулы губок, планулы кишечнополостных, трохофоры полихет, головастики амфибий); неличиночный (яйцекладный) – прохождение ранних этапов гисто- и морфогенеза под защитой яйцевых оболочек (представители губок, кишечнополостных, кольчатых червей, ракообразных и многие другие группы, утратившие первично-личиночные стадии) и зародышевых оболочек (насекомые с прямым развитием, яйцекладущие амниоты); вторично-личиночный – характеризуется разнообразием вторичных типов личинок, например, свободноживущие (редко паразитические) личинки насекомых с полным превращением (личинки жуков, гусеницы бабочек и т.п.); в данном случае появляется особая стадия – стадия куколки; отдельно выделяются личинки-паразиты (например, у паразитических червей); внутриутробный – зародыш развивается под защитой материнского организма; при этом различают яйцеживорождение (морфологических связей между зародышем и материнским организмом не возникает), истинное живорождение (у плацентарных млекопитающих) и множество промежуточных типов (например, у живородящих акул, у сумчатых млекопитающих). Смена типов эмбрионального развития повышает независимость гистои морфогенеза от внешней среды, способствует автономизации онтогенеза и возможности выхода в новую адаптивную зону. Особенности онтогенеза у высших растений. Для растений характерны жизненные циклы с чередованием полового и бесполого поколений со сменой ядерных фаз (гаплоидного гаметофита и диплоидного спорофита), а также вегетативное размножение каждого из названных поколений. В зависимости от особенностей жизненного цикла зачатком новой особи может считаться спора, зигота (или – при партеногенезе – яйцеклетка), семя или вегетативный зачаток (почка, более или менее видоизмененный побег и пр.). Наиболее полно разработано учение об онтогенезе у семенных растений. Целостность онтогенеза у этих организмов обеспечивается за счет образования и взаимодействия фитогормонов, а также за счет обмена метаболитами между органами и частями растений. В онтогенезе семенных растений выделяют следующие периоды: предзародышевый (преэмбриональный) – развитие гаплоидных структур – микроспорогенез и образование пыльцевых зерен, мегаспорогенез и образование эндосперма с архегониями (у голосеменных) или зародышевого мешка (у покрытосеменных); опыление и оплодотворение; зародышевый (эмбриональный) – развитие семени из семязачатка; стадия проростка – проросток образуется при прорастании семени и существует за счет запасов питательных веществ; ювенильная стадия – растение переходит к самостоятельному питанию; имматурная стадия – происходит ветвление стебля, формируется корневая система; виргинильная стадия – формируется общий облик взрослого растения (габитус); однако генеративные органы отсутствуют; генеративная стадия – на этой стадии происходит семенное размножение: образуются генеративные органы: цветки, а затем семена и плоды; различают три этапа генеративной стадии: ранняя генеративная стадия, средняя и поздняя; сенильная стадия – семенное размножение прекращается, и растение отмирает. Онтогенез растений в значительной степени зависит от условий внешней среды. В результате у них выработались защитные реакции (период покоя, фотопериодизм, термопериодизм), благодаря которым период активной жизнедеятельности приурочен к наиболее благоприятному времени года. Цикличность онтогенеза. Онтогенез представляет собой циклический процесс. Внешне цикличность проявляется в виде повторения морфогенетических и/или физиолого-биохимических процессов. Особенно ярко эта закономерность проявляется у многолетних растений, онтогенез которых должен быть адаптирован к сезонным изменениям факторов среды. Отечественный ботаник Н.П. Кренке (1940) разработал теорию циклического старения и омоложения растений в онтогенезе. Согласно этой теории, развитие организма есть борьба и единство противоположных процессов в нем – старения и омоложения. Онтогенез определяется исходным потенциалом жизнеспособности, который обусловлен генетическими особенностями разных организмов; исходный потенциал жизнеспособности является эволюционно сложившимся признаком. Онтогенетическое старение выражается в циклическом понижении потенциала жизнеспособности этих частей, что неизбежно приводит к естественной смерти индивидуума. Омоложение есть новообразование и развитие молодых веществ и структур, а также задержка старения существующих элементов, но не возврат индивидуума или его частей к прошлому. Таким образом, цикличность вовсе не означает возврат на предыдущие этапы онтогенеза; онтогенез – это процесс необратимый. Представления Н.П. Кренке о цикличности онтогенеза широко используются в современной биологии индивидуального развития. 2. Реализация генотипа в онтогенезе Взаимосвязь между генотипом и фенотипом в онтогенезе. Генотип – это программа развития, обусловленная историей развития вида. Фенотип можно определить как результат реализации генотипа в ходе онтогенеза при определенных условиях внешней среды, для которого характерна система признаков и свойств организма. Например, у растений синтез хлорофилла, который контролируется действием генов, не может происходить в темноте, и для этого процесса обязательно наличие света. Подобное наблюдается и при образовании антоциана: при недостаточном освещении гены, контролирующие образование этого пигмента, действуют очень слабо или совсем не действуют. Известно, что для нормального развития, цветения и плодоношения каждый вид растений на определенных этапах онтогенеза нуждается в определенной продолжительности светового дня. Экспрессивность и пенетрантность генов. В идеале каждому генотипу должен соответствовать строго определенный генотип. Однако такое однозначное соответствие встречается сравнительно редко. Для количественного описания неоднозначного соответствия фенотипа генотипу выдающийся российский генетик Н.В. Тимофеев-Ресовский ввел понятия экспрессивности и пенетрантности генов. Экспрессивностью называется степень выраженности рассматриваемого признака у организмов с одинаковым генотипом. Экспрессивностью характеризуется конкретная особь. Например, у дрозофил с генотипом eyey (eyeless – безглазые) уменьшено число глазных фасеток, но абсолютное число фасеток варьирует от 0 до 50% от нормы (779 фасеток). Тогда экспрессивность аллеля ey при полном отсутствии фасеток у особи равна 100%, а у особи с числом фасеток, уменьшенным в два раза, – 50%. Пенетрантностью проявления гена называется отношение числа особей, у которых проявляется данный признак, к общему числу с данным генотипом. Пенетрантностью характеризуется признак в однородной группе особей. При полной пенетрантности (100%) мутантный ген проявляет свое действие у всех особей, имеющих его, а при неполной – лишь у некоторых. Например, у дрозофилы доминантная мутация Lobe (L) вызывает уменьшение размера глаз, однако этот признак проявляется только у 75% особей; у остальных 25% мух – носителей гена L – глаза нормальные. Тогда пенетрантность аллеля L равна 75%. Экспрессивность и пенетрантность часто зависят от условия среды, в которой развивается организм: освещения, температуры или влажности. Пример 1. У дрозофилы с генотипом vgvg (vestigial – остаточный) крылья недоразвитые, зачаточные, но эта мутация сильнее проявляется при пониженной температуре. (Примечание. Аллель vestigial обладает плейотропным действием: приводит к редукции крыльев, но также к модификации галтеров, изменению положения определенных щетинок на дорсальной стороне тела, снижению плодовитости и продолжительности жизни и другим отличиям мутантных мух от нормальных. Однако из этого не следует, что ген vestigial в равной мере может считаться и геном щетинок, и геном плодовитости и т. д.) Пример 2. У примулы известен ген окраски цветка, действие которого зависит от температуры. При температуре 30…35° и высокой влажности цветки примулы оказываются белыми, а при низкой температуре – красными. Пример 3. У кроликов фенотипическое проявление гена Ch при нормальной температуре (~ 20°) выражается в том, что при общей белой окраске уши, нос, кончики лап и хвост оказываются черными (такая окраска называется горностаевой, или гималайской). При температуре выше 30° окраска кроликов оказывается сплошь белой. Если же любой участок тела, на котором выщипана белая шерсть, систематически охлаждать, то на нем вырастает черная шерсть. Пример 4. У пшеницы (и многих других растений) хорошо известны озимые и яровые формы. Озимые формы, посеянные весной, обычно растут, кустятся, но не переходят к колошению, т. е. не развиваются. Если же семена озимых форм перед весенним посевом подвергнуть на протяжении определенного времени действию пониженных температур при определенной влажности (яровизация), то растения будут развиваться по яровому типу и перейдут к плодоношению. В рассмотренных примерах экспрессивность аллелей зачаточных крыльев у дрозофилы, белой окраски цветков у примулы, горностаевой (гималайской) окраски у кроликов, типа развития у злаков зависит от температуры. В других случаях пенетрантность и экспрессивность определяются генами-модификаторами, которые создают генотипическую среду для проявления гена. Значение генетических факторов в определении характера проявления признаков доказывается эффектом отбора в линиях с не полностью пенетрантными генами. Можно получить линии как с резко сниженной пенетрантностью по сравнению с исходной линией, так и со 100%-ной пенетрантностью. Таким образом, в фенотипе никогда не реализуются все генотипические возможности, т. е. фенотип каждой особи есть лишь частный случай проявления ее генотипа в определенных условиях развития. Формирование различных вариантов признака на основе одного и того же генотипа называется поливариантностью онтогенеза. Морфозы и тераты. Нормальным может быть назван такой фенотип, который возникает в оптимальных условиях среды под контролем нормального, или «дикого» генотипа. Фенотипические отклонения от «дикого типа» образуют морфозы и тераты. Морфозы – это такие изменения органов, которые не препятствуют нормальному функционированию организма (например, сросшиеся цветоносные побеги у одуванчика, изменение конфигурации листьев). Тераты (уродства) приводят к частичной или полной утрате органом его функций (например, превращение плодолистиков в обычные листья–трофофиллы, тычинок в лепестки). Морфозы и тераты не связаны с изменениями в генах, непосредственно отвечающих за формирование рассматриваемых признаках. Иначе говоря, это результат нарушения действия генов. Поскольку генотип остается неизменным, морфозы и тераты не наследуются, однако склонность к появлению таких нарушений может быть обусловлена особенностями генотипа. Морфозы и тераты могут быть обусловлены воздействием различных физических и химических факторов. Пример 1. Серая окраска тела у дрозофилы – это нормальный признак. Если личинкам дрозофилы добавлять в корм азотнокислое серебро, то все эти личинки разовьются в мух с желтым телом. Но, если от этих желтых мух получить потомство и выращивать его на обычной питательной среде, то все потомки вновь станут серыми. Таким образом, в данном случае «пожелтение» тела мух – это не мутация, а морфоз. Пример 2. У некоторых насекомых понижение температуры вызывает развитие меланистической окраски («почернение» тела). Если от меланизированных форм получить потомство и выращивать личинок при нормальной окраске, то все потомки вновь вернутся к исходной окраске. Пример 3. В 1960-е гг. в Европе широко использовался транквилизатор талидомид. Однако у беременных женщин, принимавших этот препарат, родилось около 7 тысяч детей с врожденными уродствами (отсутствие или деформация ушных раковин, больших пальцев на руках, укорочение конечностей, смещение бедра; тератогенное действие талидомида было особенно сильным на 20…36 сутки развития зародыша). Пример 4. Некоторые косметические препараты (например, для лечения угрей) содержат аналог витамина А (13-цис-ретиноевую кислоту). У 59 беременных женщин, использовавших эти препараты, родился 21 ребенок с различными уродствами, а 12 плодов были спонтанно абортированы (критическим периодом для 13-цис-ретиноевой кислоты также являются 20…35 сутки развития зародыша). Пример 5. У беременных японок, переживших ядерную бомбардировку Хиросимы и Нагасаки, часто рождались дети с недоразвитыми конечностями. В результате Чернобыльской катастрофы в районах с уровнем загрязнения более 15 Ки/км2 (по Cs-137) частота врожденных аномалий возросла почти в 2 раза (по сравнению с Минском в 1980–1985 гг.). Отклонения от «дикого фенотипа» не всегда являются аномалиями. Сельскохозяйственная практика показывает, что, изменяя условия выращивания растений и животных, можно в широких пределах варьировать конечные результаты без ущерба для самих организмов. Для многих видов растений хорошо известны условия выращивания, обеспечивающие наибольшую продуктивность. Известно значение витаминов и гормонов для онтогенеза животных, что можно использовать для регулирования их индивидуального развития. Например, установлены особенности влияния освещения и температуры на яйценоскость у домашней птицы. Фенокопии и генокопии Довольно часто при реализации разных генотипов могут возникать сходные фенотипы: фенокопии и генокопии. Термин «фенокопия» употребляется в том случае, если рассматриваются «дикий» и мутантный генотипы. Корректное применение термина «фенокопия» предполагает, что для одного генотипа данный результат считается нормальным, а для другого – аномальным. Фенокопии – это, в сущности, морфозы и тераты. Они не наследуются, но наследуется предрасположенность к образованию фенокопий. Пример 1. У насекомых темная окраска тела может быть обусловлена генетически. Однако при низких температурах появляются меланистические формы и у насекомых с генотипом, который при в стандартных условиях дает обычную окраску. Тогда морфоз «темное тело» является фенокопией мутации «темное тело». Пример 2. Яровой тип развития у злаков обусловлен определенным генотипом. Яровизация озимых злаков обусловлена воздействием внешних факторов. Тогда развитие озимых злаков по яровому типу является фенокопией наследственно яровых форм. Примеры фенокопий у дрозофилы (по И.А. Рапопорту): Химические индукторы Мутация (генотип) морфозов у мушек «дикого типа» Фенотип (фенокопия мутантного фенотипа) (генотип +/+) yellow (генотип самок y/y, азотнокислое серебро желтое тело генотип самцов y/Y) brown (bw/ bw) соединения сурьмы коричневые глаза Minute соединения ртути тонкие щетинки eyeless (ey/ey) соединения бора безглазие превращение арист в ноги aristopedia соединения бора (ариста – придаток последнего членика усика) Термин «генокопия» используется, если рассматривается два и более мутантных генотипа. Например, у дрозофилы ярко-красную окраску глаз обеспечивают мутации в разных генах: v, cn, st, cd. Тогда дрозофилы с разными генотипами, но ярко-красными глазами будут генокопиями друг друга. Механизмы возникновения генокопий различны. Например, цепочка превращений исходного вещества в конечный продукт X→Y→Z может быть прервана в результате мутаций в гене A, контролирующем переход X→Y, или в гене B, контролирующем переход Y→Z. 3. Генетические программы онтогенеза По современным представлениям, в зачатке особи (например, в зиготе) заложена программа развития особи. В ходе онтогенеза происходит реализация этой программы в результате взаимодействия между ядром и цитоплазмой, между разными частями зародыша; в общем, между молекулярно-генетическими факторами, с одной стороны, и внутренней и внешней средой, с другой. Доказана генетическая запрограммированность продолжительность жизни. Какие бы идеальные условия ни были созданы для лабораторных мышей, они живут не более 3…3,5 лет, причем есть линии короткоживущие и долгоживущие. На среднюю продолжительность жизни существенно влияют внешние факторы, но максимальную продолжительность жизни изменить очень трудно. Так, средняя продолжительность жизни человека за последние 100 лет увеличилась примерно в два раза, тогда как на максимальной продолжительности жизни это никак не сказалось. Молекулярные механизмы генетической детерминации продолжительности жизни до сих пор детально не изучены, хотя в геронтологии выдвинуто множество гипотез, объясняющих закономерности старения. Например, допускается, что старение начинается с накопления повреждений в ДНК, которые постепенно разрушают систему генетической регуляции. Ионизирующие излучения и химические мутагены, дефекты репарации ДНК, ускоряющие накопление повреждений в геноме, снижают продолжительность жизни. Наконец, эндогенные факторы, в частности свободные радикалы – побочные продукты клеточного метаболизма, в числе других химических компонентов клетки повреждают и генетические молекулы. Предполагается, что нарушение генов регуляции систем репарации, постепенно развивающееся под действием эндогенных факторов, приводит к накоплению ошибок в процессе «текущего ремонта» ДНК вплоть до ее деградации с последующей гибелью клетки. Устойчивость онтогенеза Онтогенез характеризуется известной устойчивостью, для обозначения которой Ф. Добжанский и Б.Уоллес ввели понятие «гомеостаз развития». Механизмы, обеспечивающие устойчивость онтогенеза, изучал английский эмбриолог и генетик Кондрат Уоддингтон (на примере температурной зависимости экспрессии гена Bar у дрозофилы). Устойчивость процессов развития Уоддингтон назвал гомеорезом – стабилизированным потоком событий, который представляет собой процесс реализации генетической программы строения, развития и функционирования организма. Уоддингтон описывал процесс онтогенеза как пространство возможностей, или эпигенетический ландшафт. Эпигенетический ландшафт представляет собой набор эпигенетических траекторий, ведущих от начального состояния организма к взрослому состоянию. Эпигенетический ландшафт и эпигенетические траектории можно представить как поверхность с системой параллельных углубляющихся желобов. Эпигенетические траектории в некоторой степени связаны между собой, то есть под воздействием различных факторов (внутренних и внешних, генетических и негенетических) возможен переход с одной траектории на другую. В результате на основании одной и той же генетической программы возможно формирование множества траекторий онтогенеза. что и приводит к поливариантности онтогенеза. Первоначально эпигенетические траектории более или менее равноценны, но в ходе канализирующего отбора некоторые траектории углубляются и получают преимущество перед другими траекториями. Траектории, получающие преимущество, Уоддингтон назвал креодами. (Канализирующий отбор – это одна из разновидностей стабилизирующего отбора. Канализирующий отбор контролирует нормальный ход онтогенеза, выбраковывая особи с отклонениями. Эта форма отбора представляет собой фактор стабилизации развития.) Программы онтогенеза Для анализа программ развития особи представим онтогенез как совокупность множества процессов морфогенеза, закономерно сменяющих друг друга в ходе развития. Морфогенез (формообразование) – это внешнее проявление развития организма. В ходе морфогенеза количественные изменения переходят в качественные. К проявлениям морфогенеза относятся: особенности роста, анатомо-морфологической дифференциации тела растения, полярности, симметрии, корреляции. В качестве единицы морфогенеза может рассматриваться целостный организм, часть организма, орган, часть органа; элементарной единицей морфогенеза является клетка. Результатом морфогенеза является появление завершившего развитие органа (например, завершившего рост побега) или части органа (например, метамера или серии метамеров). Иначе говоря, результатом морфогенеза является формирование признака. По числу возможных конечных результатов морфогенез может быть моновариантным (инвариантным) и поливариантным (мультивариантным). Морфогенез протекает при участии генетических и парагенетических факторов. Множество генетических факторов (генотип) образует генетическую программу морфогенеза, которая возникает в момент образования единицы развития (например, нового организма или его части). Поливариантность морфогенеза может быть заложена уже в самой генетической программе. Парагенетические факторы появляются в единице развития уже в ходе самого морфогенеза, они создают условия для реализации наследственной программы. Из всего множества программ морфогенеза рассмотрим только их основные типы. I Одностадийные и многостадийные программы Одностадийные программы предусматривают только один переход от начала морфогенеза к его завершению. Одностадийные программы всегда являются элементарными. Понятие элементарности подразумевает неделимость программы на составные части, ее устойчивость к парагенетическим воздействиям: слабые воздействия не влияют на ход морфогенеза, а сильные – прерывают выполнение программы. По количеству возможных траекторий морфогенеза одностадийные программы делятся на неразветвленные и разветвленные. В неразветвленной программе закодирована только одна возможная траектория морфогенеза. В результате реализации такой программы оказывается возможным только один нормальный результат развития. В разветвленной программе закодировано несколько взаимоисключающих траекторий морфогенеза. В результате реализации такой программы оказывается возможным достижение нескольких взаимоисключающих нормальных результатов развития. Многостадийные программы включают несколько переходов, каждый из которых завершается достижением определенного промежуточного состояния (узла). Многостадийные программы могут быть элементарными и составными. Элементарная программа должна быть выполнена до конца, в противном случае наблюдаются нарушения морфогенеза (морфозы и тераты). В этом отношении элементарные программы внешне сходны с одностадийными линейными программами. Составные программы основаны на явлении анаболии: каждое последующее промежуточное состояние является надстройкой по отношению к предыдущему. При этом морфогенез может остановиться при достижении любого промежуточного состояния. В результате образуются гипоморфозы – недоразвитые структуры. II Неразветвленные и разветвленные программы Неразветвленные программы предусматривают лишь одну траекторию морфогенеза; любое отклонение от этой траектории приводит к гибели организма. Разветвленные программы предусматривают существование нескольких траекторий морфогенеза. Разветвление обусловлено триггерным эффектом – по достижении определенного промежуточного состояния перед биологической системой открывается возможность переключения, или выбора дальнейшего пути развития (таким образом, триггер можно представить себе как железнодорожную стрелку, перевод которой осуществляется стрелочником или диспетчером). Многостадийные разветвленные программы делятся на древовидные и сетевые. В древовидных программах траектории морфогенеза не пересекаются. Тогда выбор одной из траекторий морфогенеза в узловых точках исключает ряд возможных конечных результатов. В сетевых программах траектории морфогенеза пересекаются в узловых точках таким образом, что достижение одного результата возможно разными способами. III Простые и сложные программы Простые программы включают только одну подпрограмму или несколько идентичных подпрограмм. Каждая подпрограмма обозначается определенным символом (например, А). Тогда диплоидные единицы развития содержат две идентичные подпрограммы развития, дублирующие друг друга. Тогда простая программа может быть обозначена двумя одинаковыми символами (например, АА). С точки зрения формальной генетики, носитель простой программы может быть назван гомозиготой. Сложные программы включают несколько подпрограмм, которые обозначаются сходными символами (например, А и а). В этом случае диплоидные единицы развития содержат две сходные подпрограммы развития, различным образом взаимодействующие между собой. Тогда сложная программа может быть обозначена двумя сходными символами (например, Аа), а носитель сложной программы может быть назван гетерозиготой. Таким образом, для многих генов характер их проявления жестко не предопределен; фенотип организма формируется в ходе развития на основе взаимодействия генотипа и среды. Информационно-энергетические аспекты морфогенеза Если запрограммирован нормальный ход онтогенеза, то запрограммировано и изменение интенсивности жизнедеятельности в ходе онтогенеза. Интенсивность жизнедеятельности может быть представлена как интенсивность метаболизма – т.е. интенсивность обменных процессов в организме. В свою очередь, интенсивность метаболизма может быть выражена в единицах выделенной тепловой энергии (например, ккал/сутки; заметим, что энергия АТФ рано или поздно переходит в тепловую энергию), а также в единицах потребления кислорода или в единицах выделения углекислого газа в соответствии с уравнением кислородного дыхания: С 6 Н 12 О 6 + 6 О 2 + 38 АДФ + 38 Фнеорг → 6 СО 2 + 6 Н 2 О + 38 АТФ + Q Показателем интенсивности жизнедеятельности может быть и интенсивность морфогенетических (ростовых) процессов. Тогда об интенсивности жизнедеятельности можно судить по изменению количественного признака (или комплекса таких признаков). Изменение интенсивности жизнедеятельности в зависимости от возрастного состояния организма t можно представить в виде информационно-энергетических профилей, например, в виде графиков функций Y = f (t). Поверхности онтогенеза. Поскольку в ходе онтогенеза всегда наблюдается изменчивость признаков, то информационно-энергетический профиль можно представить в виде поверхности. Для этого к осям абсцисс (t) и ординат (Y) нужно добавить ось аппликат (Х), по которой будет откладываться отклонение признака от его среднего значения. Информационно-энергетические траектории (желоба, или креоды). Понятно, что любая развивающаяся система будет стараться преодолеть любое препятствие с наименьшей затратой энергии. Тогда наиболее выгодным оказывается такая траектория онтогенеза, которая проходит через точки, соответствующие минимальным энергетическим затратам. В результате формируются информационно-энергетические желоба – креоды. При наличии разветвленных программ онтогенеза происходит разветвление креодов. В процессе эволюции ход онтогенеза изменяется таким образом, что дисперсия признака уменьшается. В итоге информационно-энергетические желоба (креоды) становятся более глубокими и узкими. Сечение ИЭ–желоба может быть различным: V-образным, U-образным, W-образным и более сложным, в т.ч. асимметричным. При этом дисперсия может изменяться неравномерно; например, при подъеме на более высокий энергетический уровень дисперсия увеличивается, а при снижении энергетических затрат – уменьшается. 4. Механизмы реализации программ онтогенеза Реализация программ морфогенеза происходит под воздействием комплекса генетических и негенетических (парагенетических) факторов. Генетические программы морфогенеза образованы двумя группами генов: 1 Гены, управляющие переключением: главные гены, «гены–господа». К ним относятся гены–регуляторы, продукты которых влияют на экспрессию других генов, и гомеозисные гены, продуцирующие морфогены – вещества, определяющие морфогенетические процессы. К морфогенам относятся как тканеспецифические вещества (например, гормоны), так и неспецифические низкомолекулярные соединения (ретиноивая кислота). 2 Гены, обеспечивающие переход от одного состояния (узла) к другому: исполняющие гены, «гены–рабы», продуктами которых являются ферменты, структурные белки. Историческая справка. Термины «гены–господа» («Master–Genes») и «гены– рабы» («Slaves–Genes») предложил шведский цитолог Ян-Эрик Эдстрем в начале 1960-ых гг. Супер-регуляторные гены у дрозофилы открыл швейцарский эмбриолог и генетик Вальтер Геринг (начало 1990-ых гг.). Термин «гомеозис» предложил У. Бэтсон в 1894 г. Под гомеозисом он понимал превращение одной части организма в другую. Гомеозисные гены у дрозофилы открыли Эдвард Льюис (США) и Кристина Нюссляйн-Вольхардт и Эрик Вишхаус (Германия) (Нобелевская премия). Экспрессия всех генов контролируется разнообразными эффекторами. Часть из них закодирована в генотипе, часть – поступает в клетки извне или образуется в ходе метаболических реакций. Синтез эффекторов контролируется условиями внешней среды, например, белки «теплового шока», регулирующие процессы транскрипции, синтезируются у дрозофилы при температуре свыше 35 °С, при воздействии антибиотика антимицина А, гидроксиламина, колхицина, хлорида аммония и других веществ. Регуляция экспрессии всех генов происходит на различных уровнях: 1. Регуляция на генном уровне происходит различным образом 1.1. Модификация ДНК (например, замена цитозина или гуанина на метил-цитозин или метил-гуанин; метилирование оснований снижает активность генов). 1.2. Увеличение объема ДНК в клетке путем дифференциальной амплификации ДНК (например, многократное копирование генов рРНК) или за счет образования политенных хромосом. 1.3. Программированные количественные изменения ДНК (например, изменение ориентации промотора). 1.4. Сплайсинг ДНК (например, вырезание участков генов, кодирующих антитела). 1.5. Диминуция хроматина – необратимая утрата части генетического материала в соматических клетках некоторых организмов (инфузорий, аскарид, циклопов). 1.6. Изменение активности целых хромосом (например, инактивация одной из двух X–хромосом у самок млекопитающих). 1.7. Изменение последовательностей ДНК с помощью подвижных генетических элементов, например, транспозонов. 2. Регуляция на уровне транскрипции – путем регуляции транскрипции мРНК. Интенсивное функционирование отдельных генов или их блоков соответствует определенным этапам развития и дифференцировки. Регуляторами транскрипции у животных часто являются стероидные гормоны. 3. Регуляция на уровне сплайинга (посттрансляционной модификации мРНК) – обеспечивает возможность образования различных типов зрелой, функционально активной мРНК. Процессинг РНК регулируется с помощью рибозимов (катализаторов рибонуклеиновой природы) и ферментов матураз. Некоторые генетические заболевания человека (фенилкетонурия, некоторые гемоглобинопатии) обусловлены нарушением сплайсинга. 4. Регуляция на уровне трансляции – обусловлена различной активностью разных типов мРНК. 5. Регуляция на уровне посттрансляционной модификации белков – регулируется путем посттрансляционной модификацией белков (фосфорилированием, ацетилированием, расщеплением исходной полипептидной цепи на более мелкие фрагменты и т.д.). Рассмотренные примеры свидетельствуют о многообразии способов реализации генетической информации путем регуляции активности самих генов либо их продуктов. Следует, однако, отметить, что для клетки наиболее экономична регуляция на уровне транскрипции, поскольку она препятствует образованию соответствующих мРНК и белков, когда клетка не испытывает в них потребности. Вместе с тем регуляция на уровне транскрипции идет сравнительно медленно, тогда как, например, активация белков путем расщепления молекул-предшественников хотя и неэкономична, но происходит очень быстро. Гомеозисные мутации. При нарушении структуры гомеозисных генов возникают гомеозисные мутации, которые изменяют порядок экспрессии исполняющих генов. Фенотипический эффект гомеозисных мутаций заключается в превращении одних органов в другие. Например, у мушки дрозофилы мутация группы генов bithorax, контролирующих развитие грудных и брюшных сегментов у дрозофилы, может приводить к появлению крылоподобных образований вместо галтеров. Мутации группы генов antennapedia выражаются в том, что у насекомых на месте антенн вырастают ножки. Мутации ophthalmoptera приводят к развитию крыла из имагинального диска глаза. Мутации proboscipedia приводят к развитию ноги или части антенны (в зависимости от температуры) вместо хоботка. У мутантов tumorous head ткани головы замещаются другими типами тканей, включая структуры, характерные для гениталий. Заключение: Основные атрибуты онтогенеза На основании изложенного материала сформулируем основные атрибуты (черты, свойства) онтогенеза: Исходная запрограммированность процессов. Наличие уникальной неизменной генетической программы развития, сформированной вследствие мейоза и оплодотворения Необратимость онтогенеза. При реализации генетической программы невозможен возврат к предыдущим стадиям Углубление специализации: по мере развития уменьшается вероятность смены траектории онтогенеза Адаптивный характер: поливариантность онтогенеза обеспечивает возможность приспособления к различным условиям Неравномерность темпов: скорость процессов роста и развития изменяется. Целостность и преемственность отдельных этапов. Признаки, появляющиеся на более поздних стадиях, базируются на признаках, проявляющихся на ранних стадиях Наличие цикличности: существует цикличность старения и омоложения Наличие критических периодов, связанных с выбором пути в узловых точках (точках бифуркации) или с преодолением энергетических порогов. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 9. ГЕНЕТИЧЕСКИЕ ПРОЦЕССЫ В ПОПУЛЯЦИЯХ Лектор: ст.п. Мамедова М. З. 1. История понятия «популяция». Современное определение популяции. Генетическая структура популяции 2. Закон Харди–Вайнберга – основной закон популяционной генетики 3. Выполнение закона Харди–Вайнберга в природных популяциях. Практическое значение закона Харди–Вайнберга 4. Биологическое разнообразие. Генетический полиморфизм популяций как основа биологического разнообразия. Проблема сохранения биоразнообразия 1. История понятия «популяция». Современное популяции. Генетическая структура популяции определение Термин «популяция» происходит от латинского populus – население. Долгое время (начиная с конца XVIII в.) популяцией называли (а часто называют и сейчас) любую группировку организмов, обитающих на определенной территории. В 1903 г. датский генетик Вильгельм Людвиг Иоганнсен впервые употребил термин «популяция» для обозначения группы особей, неоднородной в генетическом отношении. Иоганнсен впервые применил комплекс генетических и статистических методов для изучения структуры популяции самооплодотворяющихся (самоопыляющихся) организмов. Он избрал объектом исследования популяции самоопылителей, которые можно было легко разложить на группы потомков отдельных самоопыляющихся растений, т. е. произвести выделение чистых линий. Анализу была подвергнута масса (размеры) семян фасоли Phaseolus vulgaris. В настоящее время известно, что масса семян определяется полигенно и в сильной степени подвержена влиянию факторов внешней среды. Иоганнсен провел взвешивание семян одного сорта фасоли и построил вариационный ряд по этому показателю. Масса варьировала в пределах от 150 до 750 мг. В дальнейшем семена массой 250…350 и 550…650 мг были высеяны отдельно. С каждого выросшего растения семена были вновь взвешены. Тяжелые (550…650 мг) и легкие (250…350 мг) семена, выбранные из сорта, представляющего популяцию, дали растения, семена которых отличались по массе: средняя масса семян растений, выросших из тяжелых семян, составила 518,7 мг, а из легких – 443,4 мг. Этим было показано, что сорт – популяция фасоли состоит из генетически различных растений, каждое из которых может стать родоначальником чистой линии. На протяжении 6…7 поколений Иоганнсен отбирал тяжелые и легкие семена с каждого растения в отдельности. Ни в одной линии не произошло сдвига массы семян. Изменчивость размеров семян внутри чистой линии была ненаследственной, модификационной. Таким образом, В. Иоганнсен генетически неоднородные (гетерогенные) популяции противопоставлял однородным чистым линиям (или клонам), в которых невозможен отбор (нет выбора!). Вскоре подобные исследования были выполнены и для перекрестнооплодотворяющихся организмов (работы Д. Джонса и Е. Иста с табаком). Английский математик Годфри Харди (1908) сформулировал понятия панмиксии (свободного скрещивания) и создал математическую модель для описания генетической структуры панмиктической популяции, т.е. популяции свободно скрещивающихся раздельнополых организмов. Немецкий врач-антропогенетик Вильгельм Вайнберг (в этом же 1908 г.) независимо от Харди создал сходную модель панмиктической популяции. Учение о неоднородности популяций развил российский генетик Сергей Сергеевич Четвериков. Его работой «О некоторых аспектах эволюционного процесса с точки зрения современной генетики» (1926) было положено начало современной эволюционной и популяционной генетики. В 1928 г. Александр Сергеевич Серебровский создает учение о генофонде. В течение 1920–1950-ых гг. в англоязычных странах формируется понятие идеальной популяции, и на основании этого понятия интенсивно развивается математическая генетика (Сьюелл Райт, Рональд Фишер, Джон Холдейн (J.B.S. Haldane, не путать с физиологом Холдейном) и др.). В нашей стране, несмотря на господство лысенковщины, учение о популяциях развивалось в работах И.И. Шмальгаузена (популяция рассматривалась как элементарная единица эволюционного процесса), А.Н. Колмогорова (анализировались случайные процессы в популяциях) и других ученых. Однако в большинстве случаев популяция рассматривалась с экологической точки зрения (например, как форма существования вида; С.С. Шварц). Лишь в 1906–1970-гг., благодаря работам Н.В. ТимофееваРесовского и его сотрудников формируется синтетический подход к определению популяции как эколого-генетической системы. Рассмотрим три основных подхода к определению понятия «популяция»: экологический, генетический и синтетический. ЭКОЛОГИЧЕСКИЙ ПОДХОД С точки зрения экологии, популяцией является совокупность особей одного вида в пределах одного биоценоза (фитоценоза), то есть целостная внутривидовая группировка, которой соответствует минимальная реализованная экологическая ниша. Такую группу особей иначе называют экологической, или локальной популяцией, а также (для растений) ценотической популяцией, или просто ценопопуляцией. Для описания экологических ниш используют пространственные, временные и собственно экологические характеристики. Реализованную экологическую нишу можно представить как фактическую совокупность пространственно-временных и собственно экологических условий, в которых протекает существование и воспроизведение вида. Совокупность пространственно-временных и собственно экологических условий, необходимых для воспроизведения вида, иначе называется его регенерационной нишей. У растений именно специфические особенности регенерационных ниш определяют основные типы хорологической (пространственной) структуры популяций. Таким образом, с точки зрения экологии, популяция представляет собой множество особей, объединенных в пространственно-временном и экологическом отношении. Популяции – это надорганизменные биологические системы, которые обладают рядом свойств, которые не присущи отдельно взятой особи или просто группе особей. Различают статические характеристики популяции (численность, плотность, популяционный ареал) и динамические (рождаемость, смертность, относительный и абсолютный прирост численности). Статика популяций Численность. Численностью называют общее число особей в популяции. Существует нижний предел численности, ниже которого популяция не может существовать длительное время. При этом нужно учитывать не всех особей, а только тех, которые принимают участие в размножении – это эффективная численность популяций. Например, если из 100 особей – 50 самцов и 50 самок, то Nэ. = 100. Если из 100 особей – 90 особей одного пола, а 10 другого, то Nэ. = 36. Если же из 100 особей на 99 особей одного пола приходится 1 особь другого пола, то Nэ. = 4. При наличии популяционных волн средняя численность популяции определяется как средняя гармоническая. Обычно численность популяций измеряется сотнями и тысячами особей (такие популяции называют мезопопуляции). У крупных наземных млекопитающих численность популяций может снижаться до нескольких десятков особей (микропопуляции). У растений и беспозвоночных существуют также мегапопуляции, численность которых достигает миллионов особей. У человека минимальная численность популяций составляет около 100 особей. Плотность. В большинстве случаев абсолютную численность популяции определить невозможно. Тогда используют производную характеристику – плотность популяции. Плотность определяется как среднее число особей на единицу площади или объема занимаемого популяцией пространства. В экологии плотность определяется также как масса (биомасса) членов популяции в единице площади или объема. Низкая плотность популяции уменьшает ее шансы на воспроизведение, но увеличивает шансы на выживание. Высокая плотность, наоборот, увеличивает шансы на воспроизведение, но уменьшает шансы на выживание. Следовательно, каждая конкретная популяция должна обладать некоторой оптимальной плотностью. Популяционный ареал Плотность популяции тесно связана с ее пространственной структурой. В популяциях островного типа (с хорошо выраженной границей распространения) плотность распределения особей может быть равномерной. Однако в равнинных популяциях граница распространения всегда размыта. В идеальной популяции можно выделить ее ядро (территория с максимальной плотностью, например, круг), субпериферию (территорию с пониженной плотностью, например, кольцо) и периферию (территорию с низкой плотностью, не обеспечивающей воспроизведение популяции). В реальных популяциях существует множество типов пространственной структуры и, соответственно, типов распределения плотности. Обычно различают следующие типы популяционных ареалов: сплошные, разорванные, сетчатые, кольцевые, ленточные и комбинированные. Динамика популяций Рождаемость. Размножение приводит к появлению в популяции новых особей. Число новых особей, появляющихся в популяции за единицу времени, называется абсолютной рождаемостью. Понятие «новая особь» определяется достаточно произвольно и зависит от видовых особенностей, от целей и задач исследования и других факторов. Например, новой особью (или особью нулевого возраста) может считаться зигота, яйцо, личинка или особь, вышедшая из-под родительской опеки. Отношение числа новых особей к числу имевшихся особей называется относительной (удельной) рождаемостью. Относительная рождаемость может рассчитываться или на одну особь, или на 1000 особей. В ходе размножения численность популяции постоянно изменяется, поэтому вводится понятие мгновенной удельной рождаемости – то есть рождаемости в пересчете на одну особь за бесконечно малый промежуток времени. Этот промежуток зависит от видовых особенностей; для человека достаточно малым промежутком времени считается 1 год. Существуют моноциклические (у растений монокарпические) виды, представители которых размножаются один раз в жизни, и полициклические (у растений поликарпические) виды, представители которых размножаются неоднократно. У раздельнополых диплоидных организмов оценка рождаемости осложняется тем, что для воспроизведения одного потомка требуется пара родителей. В демографии часто учитываются только женские особи. Однако, с точки зрения генетики, самки и самцы в равной степени передают свои гены (аллели) в последующие поколения. Поэтому следует различать плодовитость самок и коэффициент воспроизведения в пересчете на одну особь, независимо от ее пола. Например, в популяции из 500 самцов и 500 самок за единицу времени появилось 1000 особей нулевого возраста. Удельная рождаемость составила одного новорожденного на одну особь, однако каждая самка оставила двух потомков, и каждый самец оставил двух потомков. Численность популяции может увеличиваться не только за счет рождаемости, но и за счет иммиграции особей из других популяций. Существуют зависимые и полузависимые популяции, которые поддерживают и увеличивают свою численность именно за счет иммиграции. Смертность. Смертность – это понятие, противоположное рождаемости. Различают абсолютную смертность (количество погибших особей за единицу времени) и относительную (удельную) смертность (количество погибших особей за единицу времени в расчете на одну особь или на 1000 особей). Характер смертности описывается таблицами и кривыми выживаемости, которые показывают, какая часть новорожденных особей дожила до определенного возраста. Кривые выживаемости обычно строятся в системе координат: «возраст – логарифм числа выживших особей». В этом случае кривые могут быть выпуклыми, вогнутыми и комбинированными. В связи с постоянной смертностью вводится понятие мгновенной удельной смертности, то есть отношению погибших особей к общему числу особей за бесконечно малый промежуток времени (аналогично мгновенной удельной рождаемости). Численность популяции может уменьшаться не только за счет смертности, но и за счет эмиграции особей. Относительный прирост численности. Первоначально при расчете прироста популяции учитывается мгновенная удельная рождаемость и мгновенная удельная смертность (относительные показатели). Тогда прирост популяции называется биотический потенциал, или мальтузианский параметр (r). Для изолированной популяции r = рождаемость – смертность В открытой популяции r = (рождаемость + иммиграция) – (смертность + эмиграция) Прирост популяции может быть положительным, нулевым и отрицательным. Если r > 0, то популяция увеличивает свою численность, если r = 0, то популяция сохраняет стабильную численность, если r < 0, то численность популяции сокращается. Абсолютный прирост численности. Если r величина постоянная (не зависит от численности популяции), то изменение абсолютной численности популяции в единицу времени (dN/dt) и абсолютная численность популяции в данный момент времени (Nt) описываются уравнениями экспоненциального роста. Однако в реальных сообществах всегда существует ограниченность ресурсов. Емкость экологической ниши (К) – это максимально возможная численность популяции в данных условиях. В условиях экологического вакуума (то есть при неограниченности ресурсов среды и при отсутствии конкуренции) величина r остается максимально возможной и постоянной. Но при увеличении численности популяции эта величина снижается; в простейшем случае линейно уменьшается при увеличении численности популяции. В этом случае изменение абсолютной численности популяции описывается уравнением Ферхюльста–Пѐрла. Графически эта закономерность отображается логистической (сигмовидной) кривой. Однако в реальных популяциях зависимость r от N и К носит нелинейный характер (эффект группы). Кроме того, при изменении численности происходит изменение экологических характеристик популяции (например, происходит переход с основной пищи на второстепенную), и тогда величина К может измениться. Нужно учитывать также инерционность процессов размножения и гибели, то есть для изменения этих показателей требуется время. За это время может измениться характер действия экологических факторов (например, сезонные или многолетние изменения среды). В природных популяциях могут возникать колебательные процессы (популяционные волны) из-за наличия обратной отрицательной связи между r и N. Уравнение Ферхюльста–Пѐрла достаточно точно описывает динамику лишь простых популяций, например, искусственных популяций инфузорий и других мелких организмов с коротким временем генерации в лабораторных условиях. Однако это уравнение помогает выявить основные закономерности роста природных популяций и при введении поправочных коэффициентов достаточно точно прогнозировать их динамику. Дополнительные факторы, определяющие динамику популяций. На динамику популяции влияют факторы, зависящие и независящие от плотности (численности) популяции. Например, действие климатических факторов в большинстве случаев (но не всегда!) не зависит от плотности популяции. Однако такие факторы как доступность ресурсов, межвидовые взаимоотношения, как правило, зависят от плотности. Популяции видов, у которых рождаемость и смертность в значительной мере зависят от действия внешних факторов, подвержены быстрому изменению биотического потенциала и, соответственно, быстро изменяют свою численность, называются оппортунистическими. Амплитуда популяционных волн достигает 3-6 порядков (то есть за короткий период времени численность изменяется в тысячи и миллионы раз). Эти популяции редко достигают численности К и существуют за счет высокой плодовитости (высокое значение rmax). Такой способ сохранения популяций называется r–стратегия. r–Стратеги («шакалы») характеризуются высокой плодовитостью, низкой конкурентоспособностью, быстрым развитием и короткой продолжительностью жизни. Популяции видов, у которых рождаемость и смертность в значительной мере зависят от их плотности (то есть от характеристики самой популяции), в меньшей степени зависят от действия внешних факторов. Эти популяции называются равновесными, или стационарными. Они поддерживают численность, близкую к величине К, поэтому способ сохранения таких популяций называется К–стратегия. К–Стратеги («львы») характеризуются низкой смертностью, высокой конкурентоспособностью, длительным развитием и длительной продолжительностью жизни. ГЕНЕТИЧЕСКИЙ ПОДХОД С точки зрения генетики, популяция – это генетическая система, обладающая исторически сложившейся генетической структурой. Основные положения популяционной генетики сложились на основании изучения природных и модельных популяций высших раздельнополых животных (моллюсков, насекомых, позвоночных), которые воспроизводят себя с помощью нормального полового размножения – амфимиксиса, или объединения женских и мужских гамет. В таких случаях группировка особей, способных скрещиваться между собой и производить полноценное (т.е. жизнеспособное и плодовитое) потомство, называется генетической, или менделевской популяцией. В свою очередь, потомки, достигшие половозрелости, также должны скрещиваться между собой и производить полноценное потомство, то есть популяция должна существовать длительное число поколений. Таким образом, с точки зрения генетики, популяция представляет собой множество особей, объединенных достаточно высокой степенью родства. В рамках генетического подхода выделяется представление об идеальной популяции. Идеальная популяция – это абстрактное понятие, которое широко используется в моделировании микроэволюционных процессов. При описании систем скрещивания в идеальной популяции широко используется понятие панмиксии – случайного свободного скрещивания, при котором вероятность встречи гамет не зависит ни от генотипа, ни от возраста скрещивающихся особей. Если исключить половой отбор, то к панмиктической популяции применима концепция гаметного резервуара, согласно которой в популяции в период размножения формируется гаметный резервуар (генный пул), включающий банк женских гамет и банк мужских гамет. Если члены популяции равноудалены друг от друга, то встреча гамет и формирование зигот происходят случайным образом. (Подробнее понятие идеальной популяции будет рассмотрено ниже.) Реальные популяции в большей или меньшей степени отличаются от идеальной. Одним из наиболее существенных отличий является множество способов воспроизведения. По способу воспроизведения различают следующие типы популяций: амфимиктические – основным способом размножения является нормальное половое воспроизведение; амфимиктические панмиктические – при формировании брачных пар наблюдается панмиксия (свободное скрещивание); амфимиктические инбредные – при формирование брачных пар наблюдается близкородственное скрещивание (инбридинг, инцухт, инцест); крайним случаем близкородственного скрещивания является самооплодотворение; апомиктические – наблюдаются различные отклонения от нормального полового процесса, например, апомиксис, партеногенез, гиногенез, андрогенез; наблюдается у агамных (бесполых) форм; клональные – при отсутствии полового процесса и размножении только вегетативным путем или с помощью спор бесполого размножения (например, конидий); частным случаем клонирования является полиэмбриония – развитие нескольких зародышей из одной зиготы: комбинированные – например, клонально-амфимиктические при метагенезе у кишечнополостных (чередовании бесполого и полового размножения) и гетерогонии (чередовании партеногенетического и амфимиктического поколений у червей, некоторых членистоногих и низших хордовых). Определения Панмиксия (свободное скрещивание) означает, что на формирование брачных пар не влияет генотип или возраст особей, участвующих в размножении. Фактически это означает, что рассматриваемый признак не оказывает заметного влияния на формирование брачных пар. Инбридинг – близкородственное скрещивание у животных; инцухт – близкородственное скрещивание у растений; инцест (кровосмешение) – близкородственное скрещивание у человека. Апомиксис – это множество форм образования зародышей, при которых не происходит объединения двух клеток. Обычно этот термин используют по отношению к растениям. При апомиксисе новый организм может развиваться из неоплодотворенной яйцеклетки (см. партеногенез), а также из какой-либо другой специализированной клетки зародышевого мешка (например, из клеток–антипод или синергид), реже – непосредственно из клеток нуцеллуса или покровов семязачатка. Примеры растений–апомиктов: ястребинки, одуванчики, манжетки. Партеногенез – это девиантная форма полового процесса, при которой новый организм развивается из неоплодотворенной яйцеклетки без участия мужских гамет. Различают нередуцированный партеногенез с развитием зародыша из диплоидной клетки и редуцированный партеногенез с развитием зародыша из гаплоидной яйцеклетки. Как правило, партеногенез чередуется с нормальным половым размножением (при цикломорфозе у коловраток, дафний, тлей). Гиногенез – это девиантная форма полового процесса, при которой мужские гаметы служат для стимуляции развития нового организма из яйцеклетки, но оплодотворения не происходит, и мужское ядро (пронуклеус) погибает. В этом случае у дочернего организма сохраняются только материнские хромосомы. Гиногенез встречается у гибридов рыб, земноводных, а также в бессамцовых популяциях. Андрогенез – это девиантная форма полового процесса, при которой происходит оплодотворение, но затем женское ядро (пронуклеус) погибает, а мужское ядро замещает его в качестве ядра зиготы. В этом случае у дочернего организма сохраняются только отцовские хромосомы. Андрогенез обычно наблюдается в лабораторных условиях. Агамные формы – организмы, у которых отсутствует нормальный половой процесс. Генетическая структура популяций Каждая популяция обладает собственной генетической структурой. Генетическая структура популяций определяется исходным соотношением аллелей, естественным отбором и элементарными эволюционными факторами (мутационный процесс и давление мутаций, изоляция, популяционные волны, генетико-автоматические процессы, эффект основателя, миграции и др.). Для описания генетической структуры популяций используются понятия «аллелофонд» и «генофонд». Аллелофонд. Аллелофонд популяции – это совокупность аллелей в популяции. Если рассматриваются два аллеля одного гена: А и а, то структура аллелофонда описывается уравнением: pA + qa = 1. В этом уравнении символом pA обозначается относительная частота аллеля А, символом qa – относительная частота аллеля а. Популяции, в которых структура аллелофонда остается относительно постоянной в течение длительного времени, называются стационарными. Если рассматриваются три аллеля одного гена: а1, а2,, а3, то структура аллелофонда описывается уравнением: p а1 + q а2 + r а3 = 1. В этом уравнении символами p, q, r обозначаются соответствующие частоты аллелей. Если рассматриваются несколько аллелей нескольких генов (a, b, c), то структура аллелофонда описывается системой уравнений: p1 a1 + p2 a2 + p3 a3 + ... + pi ai = 1 q1 b1 + q2 b2 + q3 b3 + ... + qi bi = 1 r1 c1 + r2 c2 + r3 c3 + ... + ri ci = 1 ....................................................... В этих уравнениях символами pi, qi, ri обозначены относительные частоты аллелей разных генов. Однако в простейших случаях рассматриваются только моногенные диаллельные системы, например: А–а. В популяции с общей численностью особей Nобщ и известной численностью особей с генотипами АА, Аа, аа относительные частоты аллелей рассчитываются по формулам: p (A) 2 N (AA) + N (Aa) 2 N общ. q (a) 2 N (aa) + N (Aa) 2 N общ. = = или q (a) = 1 – р (А) Генофонд. Термин генофонд употребляется в разных значениях. Основоположник учения о генофонде и геногеографии Александр Сергеевич Серебровский называл генофондом «совокупность всех генов данного вида..., чтобы подчеркнуть мысль о том, что в лице генофонда мы имеем такие же национальные богатства, как и в лице наших запасов угля, скрытых в наших недрах» (1928). Однако это выражение в настоящее время используется для определения генетического потенциала, а генофондом называют совокупность всех генотипов в популяции. При изучении природных популяций часто приходится сталкиваться с полным доминированием: фенотипы гомозигот АА и гетерозигот Аа неразличимы. Кроме того, в природе широко распространено полигенное определение признаков, причем типы взаимодействия неаллельных генов (комплементарность, эпистаз, полимерия) не всегда известны. Поэтому на практике часто изучают не генофонд, а фенофонд популяций, то есть соотношение фенотипов. В настоящее время развивается раздел генетики популяций, который называется фенетика популяций. СИНТЕТИЧЕСКИЙ ПОДХОД Популяция как эколого-генетическое единство Наиболее полным и всеобъемлющим определением популяции является следующее: Популяция – минимальная самовоспроизводящаяся группировка особей одного вида, более или менее изолированная от других подобных группировок, населяющая определенный ареал в течение длительного ряда поколений, образующая собственную генетическую систему и формирующая собственную экологическую нишу. К этому определению обычно добавляют ряд уточнений: Популяция есть форма существования вида. Популяция есть элементарная единица эволюции. Популяция есть единица биомониторинга. Популяция есть единица управления, то есть единица эксплуатации, охраны и подавления. В некоторых случаях удобно использовать понятие «формы популяционного ранга». Формой популяционного ранга (ФПР), или группой популяционного ранга (ГПР) называют группу особей, несколько меньшую или несколько большую, чем собственно популяция. К ФПР (ГПР), меньшим, чем «настоящие» популяции, относятся внутрипопуляционные и внепопуляционные группировки особей одного вида, которые хотя бы частично способны к самовоспроизведению. В то же время, эти группировки недостаточно изолированы от других подобных группировок, не образуют устойчивые генетические системы и не формируют собственные экологические ниши. К ФПР, большим, чем «настоящие» популяции, относят популяционные системы, состоящие из нескольких популяций, связанных между собой в пространственно-генетическом и/или историческом (микроэволюционном) отношении. Для обозначения внутрипопуляционных группировок используют различные термины: панмиктические единицы, соседства, демы и другие. Отдельно выделяют псевдопопуляции – внутривидовые группировки, неустойчивые во времени и, как правило, не оставляющие после себя потомства. Группировки популяционного ранга, внутрипопуляционные группировки и псевдопопуляции могут быть частью истинных популяций, или на их основе формируются в дальнейшем истинные популяции. Примеры таких группировок: поле пшеницы, березовая роща, колония грызунов, муравейник, население административного района (например, вороны Брянской области). 2. Закон Харди–Вайнберга – основной закон популяционной генетики Структура генофонда в панмиктической стационарной популяции описывается основным законом популяционной генетики – законом ХардиВайнберга, который гласит, что в идеальной популяции существует постоянное соотношение относительных частот аллелей и генотипов, которое описывается уравнением: (p A + q a)2 = р2 АА + 2·р·q Aa + q2 aa = 1 Если известны относительные частоты аллелей p и q и общая численность популяции Nобщ, то можно рассчитать ожидаемую, или расчетную абсолютную частоту (то есть численность особей) каждого генотипа. Для этого каждый член уравнения нужно умножить на Nобщ: p2 AA · Nобщ + 2·p·q Aa · Nобщ + q2 aa · Nобщ = Nобщ В данном уравнении: p2 AA · Nобщ – ожидаемая абсолютная частота (численность) доминантных гомозигот АА 2·p·q Aa · Nобщ – ожидаемая абсолютная частота (численность) гетерозигот Аа q2 aa · Nобщ – ожидаемая абсолютная частота (численность) рецессивных гомозигот аа Действие закона Харди-Вайнберга при неполном доминировании Рассмотрим действие закона Харди-Вайнберга при неполном доминировании на примере наследования окраски шерсти у лис. Известно, что основное влияние на окраску шерсти у лисиц оказывает ген А, который существует в виде двух основных аллелей: А и а. Каждому возможному генотипу соответствует определенный фенотип: АА – рыжие, Аа – сиводушки, аа – черно-бурые (или серебристые) На заготовительных пунктах пушнины в течение многих лет (в России с XVIII века) ведется учет сданных шкурок. Откроем книгу учета сданных шкурок лис на одном из заготовительных пунктов Северо-Востока России и выберем произвольно 100 идущих подряд записей. Подсчитаем число шкурок с различной окраской. Предположим, что получены следующие результаты: рыжие (АА) – 81 шкурка, сиводушки (Аа) – 18 шкурок, чернобурые (аа) – 1 шкурка. Подсчитаем число (абсолютную частоту) доминантных аллелей А, учитывая, что каждая лиса – диплоидный организм. Рыжие лисы несут по 2 аллеля А, их 81 особь, всего 2А×81=162А. Сиводушки несут по 1 аллелю А, их 18 особей, всего 1А×18=18А. Общая сумма доминантных аллелей NА = 162 + 18 = 180. Аналогичным образом подсчитаем число рецессивных аллелей а: у черно-бурых лис 2а×1=2а, у сиводушек 1а×18=18а, общая сумма рецессивных аллелей Nа = 2 + 18 = 20. Общее число всех аллелей гена А = NA + Na =180 + 20 = 200. Мы проанализировали 100 особей, у каждой по 2 аллеля, общая сумма аллелей равна 2 × 100 = 200. Число аллелей, подсчитанных по каждому гено/фенотипу, и число аллелей, подсчитанных по общему количеству особей, в любом случае равно 200, значит, расчеты проведены правильно. Найдем относительную частоту (или долю) аллеля А по отношению к общему количеству аллелей: рА = NA : ( NA + Na ) = 180 : 200 = 0,9 Аналогично найдем относительную частоту (или долю) аллеля а: qa = Na : (NA + Na ) = 20 : 200 = 0,1 Сумма относительных соотношением: частот аллелей в популяции описывается рА + qa = 0,9 + 0,1 = 1 Приведенное уравнение является количественным описанием аллелофонда данной популяции, отражает его структуру. Поскольку в книге учета особи представлены случайным образом, и выборка в 100 особей достаточно большая, то полученные результаты можно обобщить (экстраполировать) на всю популяцию. Рассмотрим изменение структуры аллелофонда (то есть частот всех аллелей) и генофонда (то есть частот всех генотипов) данной популяции при чередовании поколений. Все самцы и самки дают аллели А и а в соотношении 0,9А : 0,1а. В этом отличие генетики популяций от классической генетики. При рассмотрении законов Менделя изначально задавалось соотношение 1А : 1а, поскольку родители всегда были гомозиготны: АА и аа. Для нахождения относительных частот генотипов составим решетку Пеннета. При этом учтем, что вероятность встречи аллелей в зиготе равна произведению вероятностей нахождения каждого аллеля. Гаметы самцов A a Гаметы самок A pA = 0,9 pA = 0,9 AA qa = 0,1 Aa p2 AA = 0,81 pq Aa = 0,09 рыжие сиводушки Aa aa pq Aa = 0,09 q2 aa = 0,01 сиводушки черно-бурые a qa = 0,1 Найдем итоговые относительные и абсолютные частоты генотипов и фенотипов: Генотипы (фенотипы) p Относительные частоты 2 AA 2 pq Aa q2 aa Сумма чернобурые рыжие сиводушки 0,81 0,18 0,01 1,00 81 18 1 100 Абсолютные частоты (в пересчете на 100 особей) Сравнивая полученный результат с первоначальным состоянием популяции, видим, что структура аллелофонда и генофонда не изменились. Таким образом, в рассмотренной популяции лис закон Харди-Вайнберга выполняется с идеальной точностью. Действие закона Х арди-Вайнберга при полном доминировании Рассмотрим действие закона Харди-Вайнберга при полном доминировании на примере наследования окраски шерсти у кошек. Известно, что черная окраска шерсти у кошек определяется генотипом аа. При этом черная окраска может быть или сплошной, или частичной. Генотипы АА и Аа обусловливают все остальное разнообразие типов окраски, но черный цвет при этом полностью отсутствует. Предположим, что в одной из городских популяций кошек на о. Сахалин из 100 просмотренных животных полную или частичную черную окраску имели 36 животных. Прямой расчет структуры аллелофонда популяции в этом случае невозможен из-за полного доминирования: гомозиготы АА и гетерозиготы Аа фенотипически неразличимы. Согласно уравнению Харди-Вайнберга частота черных кошек составляет q2 аа. Тогда можно рассчитать частоты аллелей: q2aa = 36/100 = 0,36; qa = 0,36 –1/2 =0,6; pA = 1 – 0,6 = 0,4 Таким образом, структура аллелофонда данной популяции описывается соотношением: р А + q a = 0,4 + 0,6 = 1. Частота рецессивного аллеля оказалась выше, чем частота доминантного. Рассчитаем частоты генотипов: р2 АА = 0,42 = 0,16; 2 pq Аа = 2 0,4 0,6 = 0,48; q2aa = 0,62 = 0,36 Однако проверить правильность расчетов в данном случае невозможно, поскольку неизвестны фактические частоты доминантных гомозигот и гетерозигот. 3. Выполнение закона Харди–Вайнберга в природных популяциях. Практическое значение закона Харди–Вайнберга В ряде случаев (например, в случае полного доминирования) при описании структуры генофонда природных популяций приходится допустить, что они обладают чертами идеальных популяций. Сравнительная характеристика идеальных и природных популяций Идеальная популяция Природные популяции 1. Численность популяции 1. Популяция состоит бесконечно большая, и случайная конечного числа особей элиминация (гибель) части особей не влияет на структуру популяции из 2. Отсутствует половая дифференцировка, женские и мужские гаметы равноценны (например, при гомоталличной изогамии у водорослей) 2. Существуют различные типы половой дифференцировки, различные способы воспроизведения и различные системы скрещивания 3. Наличие панмиксии – 3. Существует избирательность свободного скрещивания; при образовании брачных пар, при существование гаметного встрече гамет и образования зигот резервуара; равновероятность встречи гамет и образования зигот независимо от генотипа и возраста родителей 4. В популяции отсутствуют мутации 5. В популяции естественный отбор отсутствует 4. Мутации происходят всегда 5. Всегда существует дифференциальное воспроизведение генотипов, включающее дифференциальное выживание и дифференциальный успех в размножении 6. Популяция изолирована от 6. Существуют других популяций этого вида поток генов миграции – В большинстве изученных популяциях отклонения от перечисленных условий обычно не влияют на выполнение закона Харди-Вайнберга. Это означает, что: – численность природных популяций достаточно большая; – женские и мужские гаметы равноценны; самцы и самки в равной степени передают свои аллели потомкам); – большинство генов не влияет на образование брачных пар; – мутации происходят достаточно редко; – естественный отбор не оказывает заметного влияния на частоту большинства аллелей; – популяции в достаточной степени изолированы друг от друга. Если же закон Харди-Вайнберга не выполняется, то по отклонениям от расчетных величин можно установить эффект ограниченной численности, различие между самками и самцами при передаче аллелей потомкам, отсутствие свободного скрещивания, наличие мутаций, действие естественного отбора, наличие миграционных связей между популяциями. В реальных исследованиях всегда существуют отклонения эмпирических, или фактических абсолютных частот (Nфакт или Nф) от расчетных, или теоретических (Nрасч, Nтеор или Nт). Поэтому возникает вопрос: закономерны эти отклонения или случайны, иными словами достоверны или недостоверны? Для ответа на этот вопрос нужно знать фактические частоты доминантных гомозигот и гетерозигот. Поэтому в популяционногенетических исследованиях выявление гетерозигот играет очень важную роль. Практическое значение закона Харди–Вайнберга 1. В здравоохранении – позволяет оценить популяционный риск генетически обусловленных заболеваний, поскольку каждая популяция обладает собственным аллелофондом и, соответственно, разными частотами неблагоприятных аллелей. Зная частоты рождения детей с наследственными заболеваниями, можно рассчитать структуру аллелофонда. В то же время, зная частоты неблагоприятных аллелей, можно предсказать риск рождения больного ребенка. Пример 1. Известно, что альбинизм – это аутосомно-рецессивное заболевание. Установлено, что в большинстве европейских популяций частота рождения детей-альбиносов составляет 1 на 20 тысяч новорожденных. Следовательно, q2aa = 1/20000 = 0,00005; qa = 0,00005–1/2 = 0,007; pA = 1 – 0,007 = 0,993 ≈ 1 Поскольку для редких заболеваний рА ≈ 1, то частоту гетерозиготных носителей можно рассчитать по формуле 2·q. В данной популяции частота гетерозиготных носителей аллеля альбинизма составляет 2 q Аа = 2 0,007 = 0,014, или примерно каждый семидесятый член популяции. Пример 2. Пусть в одной из популяций у 1% населения выявлен рецессивный аллель, который не встречается в гомозиготном состоянии (можно предположить, что в гомозиготном состоянии этот аллель летален). Тогда 2 q Аа = 0,01, следовательно, qa = 0,01:2 = 0,005. Зная частоту рецессивного аллеля, можно установить частоту гибели зародышей– гомозигот: q2aa = 0,0052 = 0,000025 (25 на миллион, или 1 на 40 тысяч). 2. В селекции – позволяет выявить генетический потенциал исходного материала (природных популяций, а также сортов и пород народной селекции), поскольку разные сорта и породы характеризуются собственными аллелофондами, которые могут быть рассчитаны с помощью закона ХардиВайнберга. Если в исходном материале выявлена высокая частота требуемого аллеля, то можно ожидать быстрого получения желаемого результата при отборе. Если же частота требуемого аллеля низка, то нужно или искать другой исходный материал, или вводить требуемый аллель из других популяций (сортов и пород). 3. В экологии – позволяет выявить влияние самых разнообразных факторов на популяции. Дело в том, что, оставаясь фенотипически однородной, популяция может существенно изменять свою генетическую структуру под воздействием ионизирующего излучения, электромагнитных полей и других неблагоприятных факторов. По отклонениям фактических частот генотипов от расчетных величин можно установить эффект действия экологических факторов. (При этом нужно строго соблюдать принцип единственного различия. Пусть изучается влияние содержания тяжелых металлов в почве на генетическую структуру популяций определенного вида растений. Тогда должны сравниваться две популяции, обитающие в крайне сходных условиях. Единственное различие в условиях обитания должно заключаться в различном содержании определенного металла в почве). 4. Биологическое разнообразие. Генетический полиморфизм популяций как основа биологического разнообразия. Проблема сохранения биоразнообразия Под биологическим разнообразием понимается все «множество различных живых организмов, изменчивость среди них и экологических комплексов, частью которых они являются, что включает разнообразие внутри видов, между видами и экосистемами»; при этом следует различать глобальное и локальное разнообразие. Биологическое разнообразие представляет собой один из важнейших биологических ресурсов (биологическим ресурсом считается «генетический материал, организмы или их части, либо экосистемы, используемые или потенциально полезные для человечества, включая природное равновесие внутри экосистем и между ними»). Различают следующие типы биологического разнообразия: альфа, бета, гамма и генетическое разнообразие. Под α -разнообразием понимают видовое разнообразие, под β-разнообразием – разнообразие сообществ на определенной территории; γ-разнообразие – это интегральный показатель, включающий α- и β-разнообразие. Однако в основе перечисленных типов биоразнообразия лежит генетическое (внутривидовое, внутрипопуляционное) разнообразие. Наличие двух и более аллелей (а, соответственно, и генотипов) в популяции называется генетическим полиморфизмом. Условно принято, что частота наиболее редкого аллеля при полиморфизме должна быть не менее 1% (0,01). Существование генетического полиморфизма – обязательное условие сохранения биоразнообразия. Представления о необходимости сохранения генетического полиморфизма в природных популяциях были сформулированы еще в 1920-ых гг. нашими выдающимися соотечественниками. Николай Иванович Вавилов создал учение об исходном материале, обосновал необходимость создания хранилищ мирового генофонда культурных растений. Александр Сергеевич Серебровский создал само учение о генофонде. В понятие «генофонд» вкладывалось то генетическое разнообразие вида, которое сложилось в ходе его эволюции или селекции и обеспечило его адаптивные и продукционные возможности. Сергей Сергеевич Четвериков заложил основы учения и методов оценки генетической гетерогенности популяций диких видов растений и животных. Глобальные экологические проблемы обострились после Второй мировой войны. Для их решения в 1948 г. был образован Международный союз охраны природы и природных ресурсов (МСОП). Первоочередной задачей МСОП являлось составление Красных книг – списков редких и находящихся под угрозой исчезновения видов. В 1963-1966 гг. была издана первая Международная Красная книга. В 1980 г. вышло ее четвертое издание. В 1978-1984 гг. издается Красная книга СССР, а в 1985 г. – Красная книга Российской Федерации. Однако человечество осознало всю серьезность этой проблемы лишь в последней четверти XX века. Чуть более тридцати лет назад (1972 г.) в Стокгольме состоялась первая конференция ООН по окружающей человека природной среде. На этом форуме были намечены общие принципы международного сотрудничества в области охраны природы. На основе решений Стокгольмской конференции были сформулированы современные принципы сохранения среды жизни. Первый принцип – это принцип всеобщей связи в живой природе: выпадение одного звена в сложной цепи трофических и иных связей в природе может привести к непредвиденным результатам. Этот принцип основан на классических представлениях о существовании причинноследственных связей между элементами надорганизменных биологических систем, причем, множество этих связей приводит к образованию различных цепей, сетей и пирамид. Отсюда вытекает принцип потенциальной полезности каждого компонента живой природы: невозможно предвидеть, какое значение для человечества будет иметь тот или иной вид в будущем. В общественном сознании утрачивает значение разграничение видов на «полезные» и «вредные», утверждается представление о том, что «вредный или сорный вид – это всего лишь организм не на своем месте». На основании принципов всеобщей связи и потенциальной полезности каждого компонента живой природы формируется концепция невмешательства в процессы, протекающие в природных экосистемах: «Мы не знаем, к чему это приведет, поэтому лучше оставить все как есть». Идеальным способом сохранить status quo считалось создание охраняемых территорий с абсолютным заповедным режимом. Однако практика заповедного дела показала, что современные экосистемы уже утратили способность к естественному самовосстановлению, и для их сохранения требуется активное вмешательство человека. В результате стал неизбежным переход от концепции невмешательства и консервации существующего положения к концепции устойчивого развития общества и биосферы. Концепция устойчивого развития подразумевает повышение экологического и ресурсного потенциала природных экосистем, создание устойчивых контролируемых экосистем, удовлетворение потребностей общества в природных ресурсах на основе научно обоснованного рационального, неистощительного и многоцелевого природопользования, охраны, защиты и воспроизводства всех компонентов экосистем. Дальнейшее развитие концепции устойчивого развития неизбежно привело к принципу необходимости сохранения биологического разнообразия: только многообразная и разнообразная живая природа оказывается устойчивой и высокопродуктивной. Принцип необходимости сохранения биологического разнообразия в полной мере согласуется с основными принципами биоэтики: «каждая форма жизни уникальна и неповторима», «каждая форма жизни имеет право на существование», «что не нами создано, не должно быть нами разрушено». При этом ценность генотипа определяется не его полезностью для человека, а его уникальностью. Таким образом, было признано, что «сохранение генофонда есть ответственность перед дальнейшей эволюцией» (Франкель, XIII Международный генетический прогресс в Беркли, 1974). Сваминатан (Индия) выделил три уровня ответственности за сохранение генофонда: профессиональный, политический и общественный. В 1980 г. Международным союзом охраны природы и природных ресурсов была разработана «Всемирная стратегия охраны природы». В материалах Всемирной стратегии отмечается, что одной из глобальных экологических проблем является проблема питания: 500 млн. человек систематически недоедают. Труднее учесть число людей, не получающих полноценного питания, сбалансированного по белкам, витаминам и микроэлементам. Всемирная стратегия сформулировала первоочередные задачи охраны природы: – поддержание главных экологических процессов в экосистемах. – Сохранение генетического разнообразия. – Долгосрочное рациональное использование видов и экосистем. В 1992 г. в Рио-де-Жанейро на конференции Организации Объединенных Наций по окружающей среде и развитию (UNCED) был принят ряд документов, подписанных представителями 179 государств: – Программа действий: Повестка дня на XXI век. – Заявление о принципах в отношении лесов. – Конвенция ООН об изменении климата. – Конвенция о биологическом разнообразии. В материалах Конвенции о биологическом разнообразии отмечается, что «...разнообразие важно для эволюции и сохранения систем жизнеобеспечения биосферы». Для сохранения систем жизнеобеспечения биосферы необходимо сохранение всех форм биологического разнообразия: «Страны, которые присоединяются к Конвенции, должны определять компоненты биологического разнообразия, ...осуществлять контроль за видами деятельности, которые могут оказать вредное воздействие на биологическое разнообразие». На конференции UNCED было признано, что снижение уровня биологического разнообразия является одной из основных причин прогрессирующей деградации природных экосистем. Не вызывает сомнения, что только при условии сохранения оптимального уровня разнообразия возможно создание экосистем, устойчивых к экстремальным воздействиям физико-химических факторов, вредителей и болезней. В 1995 г. в Софии на конференции министров окружающей среды европейских стран была принята Общеевропейская стратегия сохранения биологического и ландшафтного разнообразия. Перечислим принципы Общеевропейской стратегии сохранения биологического и ландшафтного разнообразия природы: – Охрана наиболее уязвимых экосистем. – Охрана и восстановление нарушенных экосистем. – Охрана территорий с наибольшим видовым разнообразием. – Сохранение эталонных природных комплексов. Прекращение роста продуктивности искусственных экосистем также связывается с низким уровнем биоразнообразия: в настоящее время возделывается всего 150 видов культурных растений и разводится 20 видов домашних животных. При этом низкий уровень глобального разнообразия сочетается и с низким уровнем локального разнообразия, с господством монокультуры или культурооборотов с коротким сроком ротации. Погоня за однородностью сортов растений и пород животных привела к резкому сужению генетического разнообразия. Следствием снижения разнообразия является снижение устойчивости к экстремальным физико-химическим факторам среды и, в еще большей степени, к вредителям и болезням. Многочисленными исследованиями доказано, что единственный надежный путь к повышению устойчивости и продуктивности природных экосистем – это повышение уровня их гетерогенности, поскольку в генетически неоднородных системах возникают компенсаторные взаимодействия особей с различными особенностями роста и развития, чувствительности к динамике факторов среды, болезням, вредителям. Именно гетерогенные насаждения обеспечивают возможность непрерывного и неистощительного природопользования. Следовательно, назрела необходимость более широкого использования видового и внутривидового (генетического) потенциала возможно большего числа видов, пригодных для культивирования в контролируемых условиях. Все разнообразие материала, подлежащего сохранению, включает следующие категории организмов: сорта и породы, возделываемые и разводимые в настоящее время; сорта и породы, вышедшие из производства, но представляющие большую генетическую и селекционную ценность по отдельным параметрам; местные сорта и аборигенные породы; дикие сородичи культурных растений и домашних животных; дикие виды растений животных, перспективные для введения в культуру и доместикации; экспериментально созданные генетические линии. Естественно, что для решения комплекса задач, связанных с проблемами биологического разнообразия, требуется вначале выработать критерии для оценки биоразнообразия, выявить и оценить уровень разнообразия в конкретных экосистемах (природно-территориальных комплексах), разработать рекомендации по сохранению и приумножению выявленного разнообразия, апробировать и внедрить эти рекомендации в агропромышленное производство. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 10. ОТДАЛЕННАЯ ГИБРИДИЗАЦИЯ И ГЕТЕРОЗИС. Лектор: ст.п. Мамедова М. З. 1. Структура современной селекции 2. Теория селекционного процесса. Гибридизация, гетерозис 3. Искусственный отбор 4. Работы И.В.Мичурина.Частная селекция растений и микроорганизмов 1. Структура современной селекции Селекция (от лат. selectio, seligere – отбор) – это наука о методах создания высокопродуктивных сортов растений, пород животных и штаммов микроорганизмов. Современная селекция – это обширная область человеческой деятельности, которая представляет собой сплав различных отраслей науки, производства сельскохозяйственной продукции и ее комплексной переработки. В ходе селекции происходят устойчивые наследственные преобразования различных групп организмов. По образному выражению Н.И. Вавилова, «…селекция представляет собой эволюцию, направляемую волей человека». Известно, что достижения селекции широко использовал Ч. Дарвин при обосновании основных положений эволюционной теории. Современная селекция базируется на достижениях генетики и является основой эффективного высокопродуктивного сельского хозяйства и биотехнологии. Задачи современной селекции - Создание новых и совершенствование старых сортов, пород и штаммов с хозяйственно-полезными признаками. - Создание технологичных высокопродуктивных биологических систем, максимально использующих сырьевые и энергетические ресурсы планеты. - Повышение продуктивности пород, сортов и штаммов с единицы площади за единицу времени. - Повышение потребительских качеств продукции. - Уменьшение доли побочных продуктов и их комплексная переработка. - Уменьшение доли потерь от вредителей и болезней. Структура современной селекции Учение о современной селекции было нашим выдающимся соотечественником – агрономом, ботаником, географом, путешественником, всемирно признанным авторитетом в области генетики, селекции, растениеводства, иммунитета растений, крупным организатором сельскохозяйственной и биологической науки в нашей стране – Николаем Ивановичем Вавиловым (1887–1943). Многие хозяйственно-полезные признаки являются геноти- пически сложными, обусловленными совместным действием многих генов и генных комплексов. Необходимо выявить эти гены, установить характер взаимодействия между ними, иначе селекция может вестись вслепую. Поэтому Н.И. Вавилов утверждал, что именно генетика является теоретической основой селекции. Н.И. Вавилов выделил следующие разделы селекции: 1) учение об исходном сортовом, видовом и родовом потенциалах; 2) учение о наследственной изменчивости(закономерности в изменчивости, учение о мутациях); 3) учение о роли среды в выявлении сортовых признаков (влияние отдельных факторов среды, учение о стадиях в развитии растений применительно к селекции); 4) теория гибридизации как в пределах близких форм, так и отдаленных видов; 5) теория селекционного процесс (самоопылители, перекрестноопылители, вегетативно и апогамно размножающиеся растения); 6) учение об основных направлениях в селекционной работе, таких, как селекция на иммунитет, на физиологические свойства (холодостойкость, засухоустойчивость, фотопериодизм), селекция на технические качества, химический состав; 7) частная селекция растений, животных и микроорганизмов. Учение Н.И. Вавилова о центрах происхождения культурных растений Учение об исходном материале является основой современной селекции. Исходный материал служит источником наследственной изменчивости – основы для искусственного отбора. Н.И. Вавилов установил, что на Земле существуют районы с особенно высоким уровнем генетического разнообразия культурных растений, и выделил основные центры происхождения культурных растений (первоначально Н.И. Вавилов выделил 8 центров, но затем сократил их число до 7). Для каждого центра установлены характерные для него важнейшие сельскохозяйственные культуры. 1. Тропический центр – включает территории тропической Индии, Индокитая, Южного Китая и островов Юго-Восточной Азии. Не менее одной четверти населения земного шара до сих пор живет в тропической Азии. В прошлом относительная населенность этой территории была еще более значительной. Из этого центра ведет начало около одной трети возделываемых в настоящее время растений. Это родина таких растений, как рис, сахарный тростник, чай, лимон, апельсин, банан, баклажан, а также большого количества тропических плодовых и овощных культур. 2. Восточноазиатский центр – включает умеренные и субтропические части Центрального и Восточного Китая, Корею, Японию и большую часть о. Тайвань. На этой территории живет примерно также около одной четверти населения Земли. Около 20% всей мировой культурной флоры ведет начало из Восточной Азии. Это родина таких растений, как соя, просо, хурма, многих других овощных и плодовых культур. 3. Юго-западноазиатский центр – включает территории внутренней нагорной Малой Азии (Анатолии), Ирана, Афганистана, Средней Азии и Северо-Западной Индии. Сюда же примыкает Кавказ, культурная флора которого, как показали исследования, генетически связана с Передней Азией. Родина мягкихпшениц, ржи, овса, ячменя, гороха, дыни. Этот центр может быть подразделен на следующие очаги: а) Кавказский со множеством оригинальных видов пшеницы, ржи и плодовых. По пшенице и ржи, как выяснено сравнительными исследованиями, это наиболее важный мировой очаг их видового происхождения; б) Переднеазиатский, включающий Малую Азию, Внутреннюю Сирию и Палестину, Трансиорданию, Иран, Северный Афганистан и Среднюю Азию вместе с Китайским Туркестаном; в) Северо-западноиндийский, включающий помимо Пенджаба и примыкающих провинций Северной Индии и Кашмира также Белуджистан и Южный Афганистан. Около 15% всей мировой культурной флоры ведет начало с этой территории. В исключительном видовом разнообразии здесь сосредоточены дикие родичи пшеницы, ржи и различных европейских плодовых. До сих пор здесь можно проследить для многих видов непрерывный ряд от культурных до диких форм, т. е. установить сохранившиеся связи диких форм с культурными. 4. Средиземноморский центр – включает страны, расположенные по берегам Средиземного моря. Этот замечательный географический центр, характеризующийся в прошлом величайшими древнейшими цивилизациями, дал начало приблизительно около 10% видов культурных растений. Среди них такие, как твердые пшеницы, капуста, свекла, морковь, лен, виноград, маслина, множество других овощных и кормовых культур. 5. Абиссинский центр. Общее число видов культурных растений, связанных по своему происхождению с Абиссинией, не превышает 4% мировой культурной флоры. Абиссиния характеризуется рядом эндемичных видов и даже родов культурных растений. Среди них такие, как кофейное дерево, арбуз, хлебный злак тэфф(Eragrostis abyssinica), своеобразное масличное растение нуг (Guizolia ahyssinica), особый вид банана. В пределах Нового Света установлена поразительно строгая локализация двух центров видообразования главнейших культурных растений. 6. Центральноамериканский центр, охватывающий обширную территорию Северной Америки, включая Южную Мексику. В этом центре можно выделить три очага: а) Горный южномексиканский, б) Центральноамериканский, в) Вест-Индский островной. Из Центральноамериканского центра ведет начало около 8% различных возделываемых растений, таких, как кукуруза, подсолнечник, американские длинноволокнистые хлопчатники, какао (шоколадное дерево), ряд видов фасоли, тыквенных, многих плодовых (гвайява, аноны и авокадо). 7. Андийский центр, в пределах Южной Америки, приуроченный к Андийскому хребту. Это родина картофеля, томата. Отсюда ведут начало хинное дерево и кокаиновый куст. Как видно из перечня географических центров, начальное введение в культуру подавляющего числа возделываемых растений связано не только с флористическими областями, отличающимися богатой флорой, но и с древнейшими цивилизациями. Лишь сравнительно немногие растения введены в прошлом в культуру из дикой флоры вне перечисленных основных географических центров. Семь указанных географических центров соответствуют древнейшим земледельческим культурам. Южноазиатский тропический центр связан с высокой древнеиндийской и индокитайской культурой. Новейшие раскопки показали глубокую древность этой культуры, синхронной передне-азиатской. Восточноазиатский центр связан с древней китайской культурой, а Юго-западно-азиатский — с древней культурой Ирана, Малой Азии, Сирии, Палестины и Ассиро-Вавилонии. Средиземноморье за много тысячелетий до нашей эры сосредоточило этрусскую, эллинскую и египетскую культуры. Своеобразная абиссинская культура имеет глубокие корни, вероятно совпадающие по времени с древней египетской культурой. В пределах Нового Света Центральноамериканский центр связан с великой культурой майя, достигшей до Колумба огромных успехов в науке и искусстве. Андийский центр в Южной Америке сочетается в развитии с замечательной доинкской и инкской цивилизациями. Н.И. Вавилов выделил группу вторичных культур, которые произошли от сорняков: рожь, овес и др. Н.И. Вавилов установил, что «важным моментом при оценке материала для селекции является наличие в нем разнообразия наследственных форм». Н.И. Вавилов различал следующие группы исходных сортов: местные сорта, иноземные и инорайонные сорта. При разработке теории интродукции (внедрения) инорайонных и иноземных сортов «необходимо отличать первичные очаги формообразования от вторичных». Например, в Испании обнаружено «исключительно большое число разновидностей и видов пшениц», однако это объясняется «привлечением сюда многих видов из разных очагов». Н.И. Вавилов придавал большое значение новым гибридным формам. Разнообразие генов и генотипов в исходном материале Н.И.Вавилов назвал генетическим потенциалом исходного материала. Развитие учения Н.И. Вавилова о центрах происхождения культурных растений. К сожалению, многие идеи Н.И. Вавилова не были в должной мере оценены современниками. Лишь во второй половине XX века крупные центры по сохранению генофонда культурных растений и их диких сородичей были созданы на Филиппинах, в Мексике, в Колумбии и других зарубежных странах. Во второй половине XX в. появились новые данные о распределении культурных растений. С учетом этих данных академик П.М. Жуковский развил учение Н.И.Вавилова о центрах происхождения культурных растений. Он создал теорию мегацентров (генетических центров, или генцентров), объединяющих первичные и вторичные очаги происхождения культурных растений, а также их некоторых дикорастущих сородичей. В своей книге «Мировой генофонд растений для селекции»(1970) П.М.Жуковский выделил 12мегацентров: Китайско-Японский, Индонезийско-индокитайский, Австралийский,Индостанский,Среднеазиатский,Переднеазиатский,Средизем номорский, Африканский, Европейско-сибирский, Среднеамериканский, Южноамериканский, Североамериканский. Перечисленные мегацентры занимают обширные географические регионы(например, к Африканскому центру отнесена вся территория Африки к югу от Сахары). В то же время, П.М. Жуковский выделил 102 микрогенцентра, в которых обнаружены отдельные формы растений. Например, родиной душистого горошка – популярного декоративного растения – является о. Сицилия; из некоторых районов Грузии происходят уникальные формы пшениц, в частности, пшеница Зандури, представляющая собой надвидовой комплекс, устойчивый к многим грибковым заболеваниям (кроме того, среди этих пшениц обнаружены формы с цитоплазматической мужской стерильностью). Закон гомологических рядов Систематизируя учение об исходном материале, Н.И. Вавилов сформулировал закон гомологических рядов (1920 г.): 1. Виды и роды, генетически близкие, характеризуются сходными рядами наследственной изменчивости с такой правильностью, что, зная ряд форм в пределах одного вида, можно предвидеть нахождение параллельных форм у других видов и родов. Чем ближе генетически расположены в общей системе роды и виды, тем полнее сходство в рядах их изменчивости. 2. Целые семейства растений в общем характеризуются определенным циклом изменчивости, проходящей через все роды и виды, составляющие семейство. Согласно этому закону, у генетически близких видов и родов существуют близкие гены, которые дают сходные серии множественных аллелей и вариантов признака. Например, в пределах разных родов злаков существует параллельная изменчивость окраски зерна: Варианты окраски зерна Роды злаков Рожь Пшеница Ячмень Овес Просо Белое есть есть есть есть есть Красное Зеленое Черное Фиолетовое есть есть есть есть есть есть есть есть есть есть есть есть нет есть нет нет нет есть нет нет Теоретическое и практическое значение закона гомологических рядов: - Н.И. Вавилов четко разграничил внутривидовую и межвидовую изменчивость. При этом вид рассматривался как целостная, исторически сложившаяся система. - Н.И. Вавилов показал, что внутривидовая изменчивость небезгранична и подчиняется определенным закономерностям. - Закон гомологических рядов является руководством для селекционеров, позволяя предсказать возможные варианты признаков. Н. И. Вавилов впервые осуществил целенаправленный поиск редких или мутантных аллелей в природных популяциях и популяциях культурных растений. В наше время продолжается поиск мутантных аллелей для повышения продуктивности штаммов, сортов и пород. Выявление уровня биологического разнообразия и его сохранение Для отыскания центров разнообразия и богатства растительных форм Н.И. Вавилов многочисленные экспедиции, которые за 1922…1933 гг. побывали в 60 странах мира, а также в 140 районах нашей страны. Важно подчеркнуть, что поиски культурных растений и их диких сородичей шли не вслепую, как в большинстве стран, в том числе и в США, а опирались на стройную строгую теорию центров происхождения культурных растений, разработанную Н.И. Вавиловым. Если до него ботаники-географы искали «вообще» родину пшеницы, то Вавилов искал центры происхождения отдельных видов, групп видов пшеницы в различных областях земного шара. При этом особо важно было выявить области естественного распространения (ареалы) разновидностей данного вида и определить центр наибольшего разнообразия его форм (ботанико-географический метод). Чтобы установить географическое распределение разновидностей и рас культурных растений и их диких родичей, Н.И. Вавилов изучал очаги древнейшей земледельческой культуры, начало которой он видел в горных районах Эфиопии, Передней и Средней Азии, Китая, Индии, в Андах Южной Америки, а не в широких долинах крупных рек – Нила, Ганга, Тигра и Евфрата, как утверждали ученые прежде. В результате экспедиций был собран ценный фонд мировых растительных ресурсов,насчитывающий свыше 250 000 образцов.Подобная коллекция была создана и в США,однако она значительно уступала вавиловской коллекции и по числу образцов, и по видовому составу. Коллекционные образцы, собранные под руководством Н.И. Вавилова, хранились в Ленинграде во Всесоюзном институте растениеводства (ВИРе), созданном Н.И. Вавиловым в 1930 г. на основе Всесоюзного института прикладной ботаники и новых культур (ранее – Отдела прикладной ботаники и селекции, еще ранее – Бюро по прикладной ботанике). В годы Великой Отечественной войны во время блокады Ленинграда сотрудники ВИРа несли круглосуточное дежурство при коллекции семян зерновых культур. Многие сотрудники ВИРа умерли голодной смертью, но бесценное видовое и сортовое богатство, из которого и поныне селекционеры всего мира черпают материал для создания новых сортов и гибридов, было сохранено. Во второй половине XX столетия были организованы новые экспедиции по сбору образцов для пополнения коллекции ВИРа; в настоящее время эта коллекция насчитывает до 300 тысяч образцов растений, принадлежащим к 1740 видам. Для хранения исходного материала в живом виде используются разнообразные насаждения: коллекционные питомники, коллекционноматочные, маточные и производственные плантации. Для сохранения коллекционных образцов используются самые разнообразные методы: хранение семян с периодическим пересевом, хранение замороженных образцов (черенков, почек), поддержание тканево-клеточных культур. В 1976 г. на Кубани было построено Национальное хранилище семян для генофонда ВИРа, вместимостью 400 тысяч образцов. В этом хранилище семена хранятся при строго определенной температуре, позволяющей сохранить всхожесть и предотвратить накопление мутаций, в т.ч. при температуре жидкого азота (–196 °С). Планомерное изучение мировых растительных ресурсов важнейших культурных растений коренным образом изменило представление о сортовом и видовом составе даже таких хорошо изученных культур, как пшеница, рожь, кукуруза, хлопчатник, горох, лен и картофель. Среди видов и множества разновидностей этих культурных растений, привезенных из экспедиций, почти половина оказались новыми, еще не известными науке. Собранная богатейшая коллекция тщательно изучается с применением самых современных методов селекции, генетики, биотехнологии, а также с помощью географических посевов. Снижение генетического разнообразия на популяционном уровне – знамение нашего времени Многие современные сорта растений (зернобобовых культур, кофейного дерева и др.) ведут начало от немногих особей-основателей. На грани вымирания находятся сотни пород домашних животных. Например, развитие промышленного птицеводства привело к резкому сокращению породного состава кур во всем мире: наибольшее распространение получили всего лишь 4..6 из известных 600 пород и разновидностей. Та же ситуация характерна для других сельскохозяйственных видов. Значительную роль в процессе снижения уровня разнообразия играет нерациональное ведение хозяйства, игнорирующее эволюционно сложившуюся системную организацию как природных, так и сельскохозяйственных популяций, их естественную подразделенность на генетически отличающиеся субпопуляции. Идеи Н.И.Вавилова о необходимости выявления и сохранения разнообразия были развиты в работах А.С. Серебровского, С.С.Четверикова и других отечественных ученых. Методы селекции, направленные на сохранение биологического разнообразия, будут рассмотрены ниже. В настоящее время исходным материалом для селекции признаются: - Сорта и породы, возделываемые и разводимые в настоящее время. - Сорта и породы, вышедшие из производства, но представляющие большую генетическую и селекционную ценность по отдельным параметрам. - Местные сорта и аборигенные породы. - Дикие сородичи культурных растений и домашних животных: виды, подвиды, экотипы, разновидности, формы. - Дикие виды растений и животных, перспективные для введения в культуру и доместикации. Известно, что в настоящее время культивируется всего лишь 150 видов сельскохозяйственных растений и 20 видов домашних животных. Таким образом, огромнейший видовой потенциал диких видов остается неиспользованным. - Экспериментально созданные генетические линии, искусственно полученные гибриды и мутанты. В наше время общепризнанно, что в качестве исходного материала должен использоваться как местный, так и инорайонный исходный материал. Исходный материал должен быть достаточно разнообразен: чем больше его разнообразие, тем больше возможность выбора. В то же время, исходный материал должен быть максимально приближен к идеальному образу (модели) результата селекции – сорта, породы, штамма (см. ниже). В настоящее время продолжается поиск мутантных аллелей для повышения продуктивности сортов, пород и штаммов. Индуцированный мутагенез. Экспериментальное получение мутаций у растений и микроорганизмов и их использование в селекции Эффективными способами получения исходного материала являются методы индуцированного мутагенеза – искусственного получения мутаций. Индуцированный мутагенез позволяет получить новые аллели, которые в природе обнаружить не удается. Например, этим путем получены высокопродуктивные штаммы микроорганизмов(продуцентов антибиотиков), карликовые сорта растений с повышенной скороспелостью и т.д. Экспериментально полученные мутации у растений и микроорганизмов используют как материал для искусственного отбора. Этим путем получены высокопродуктивные штаммы микроорганизмов(продуцентов антибиотиков), карликовые сорта растений с повышенной скороспелостью и т.д. Для получения индуцированных мутаций у растений используют физические мутагены (гамма-излучение, рентгеновское и ультрафиолетовое излучение) и специально созданные химические супермутагены (например, N-метил-N-нитрозомочевина). Дозу мутагенов подбирают таким образом, чтобы погибало не более 30…50% обработанных объектов. Например, при использовании ионизирующего излучения такая критическая доза составляет от 1…3 до 10…15 и даже 50…100 килорентген. При использовании химических мутагенов применяют их водные растворы с концентрацией 0,01…0,2 %; время обработки – от 6 до 24 часов и более. Обработке подвергают пыльцу, семена, проростки, почки, черенки, луковицы, клубни и другие части растений. Растения, выращенные из обработанных семян (почек, черенков и т.д.) обозначаются символом M1 (первое мутантное поколение). В M1 отбор вести трудно, поскольку большая часть мутаций рецессивна и не проявляется в фенотипе. Кроме того, наряду с мутациями часто встречаются и ненаследуемые изменения: фенокопии, тераты, морфозы. Поэтому выделение мутаций начинают в M2 (втором мутантном поколении), когда проявляется хотя бы часть рецессивных мутаций, а вероятность сохранения ненаследственных изменений снижается. Обычно отбор продолжается в течение 2…3 поколений, хотя в некоторых случаях для выбраковки ненаследуемых изменений требуется до 5…7 поколений (такие ненаследственные изменения, сохраняющиеся на протяжении нескольких поколений, называют длительными модификациями). Полученные мутантные формы или непосредственно дают начало новому сорту (например, карликовые томаты с желтыми или оранжевыми плодами) или используются в дальнейшей селекционной работе. Однако применение индуцированных мутаций в селекции все же ограничено, поскольку мутации приводят к разрушению исторически сложившихся генетических комплексов. У животных мутации практически всегда приводят к снижению жизнеспособности и/или бесплодию. К немногим исключениям относится тутовый шелкопряд, с которым велась интенсивная селекционная работа с использованием авто- и аллополиплоидов (Б.Л. Астауров, В.А. Струнников). Соматические мутации. В результате индуцированного мутагенеза часто получают частично мутантные растения (химерные организмы). В этом случае говорят о соматических (почковых) мутациях. Многие сорта плодовых растений, винограда, картофеля являются соматическими мутантами. Эти сорта сохраняют свои свойства, если их воспроизводят вегетативным путем, например, прививая обработанные мутагенами почки (черенки) в крону немутантных растений; таким путем размножают, например, бессемянные апельсины. Полиплоидия. Как известно, термин «полиплоидия» используется для обозначения самых разнообразных явлений, связанных с изменением числа хромосом в клетках. Автополиплоидия представляет собой многократное повторение в клетке одного и того хромосомного набора (генома). Автополиплоидия часто сопровождается увеличением размеров клеток, пыльцевых зерен и общих размеров организмов. Например, триплоидная осина достигает гигантских размеров, долговечна, еѐ древесина устойчива к гниению. Среди культурных растений широко распространены как триплоиды (бананы, чай, сахарная свекла), так и тетраплоиды (рожь, клевер, гречиха, кукуруза, виноград, а также земляника, яблоня, арбузы). Некоторые полиплоидные сорта (земляника, яблоня, арбузы) представлены и триплоидами, и тетраплоидами. Автополиплоиды отличаются повышенной сахаристостью, повышенным содержанием витаминов. Положительные эффекты полиплоидии связаны с увеличением числа копий одного и того же гена в клетках, и, соответственно, в увеличении дозы (концентрации) ферментов. Как правило, автополиплоиды менее плодовиты по сравнению с диплоидами, однако снижение плодовитости обычно с лихвой компенсируется увеличением размеров плодов (яблони, груши, винограда) или повышенным содержанием определенных веществ (сахаров, витаминов). В то же время, в ряде случаев полиплоидия приводит к угнетению физиологических процессов, особенно при очень высоких уровнях плоидности. Например, 84-хромосомная пшеница менее продуктивна, чем 42-хромосомная. Аллополиплоидия – это объединение в клетке разных хромосомных наборов (геномов). Часто аллополиплоиды получают путем отдаленной гибридизации, то есть при скрещивании организмов, принадлежащих к различным видам. Такие гибриды обычно бесплодны (их образно называют «растительными мулами»), однако, удваивая число хромосом в клетках, можно восстановить их фертильность (плодовитость). Таким путем получены гибриды пшеницы и ржи (тритикале), алычи и терна, тутового и мандаринового шелкопряда. Полиплоидия в селекции используется для достижения следующих целей: - получение высокопродуктивных форм, которые могут непосредственно внедряться в производство или использоваться как материал для дальнейшей селекции; - восстановление плодовитости у межвидовых гибридов; - перевод гаплоидных форм на диплоидный уровень. В экспериментальных условиях образование полиплоидных клеток можно вызвать воздействием экстремальных температур: низкими (0…+8 °С) или высокими (+38…+45 °С), а также путем обработки организмов или их частей (цветков, семян или проростков растений, яйцеклеток или эмбрионов животных) митозными ядами. К митозным ядам относятся: колхицин (алкалоид безвременника осеннего – известного декоративного растения), хлороформ, хлоралгидрат,винбластин, аценафтен и др. 2. Теория селекционного процесса. Методы селекции Комплекс мероприятий, выполняемых селекционером от начала работы до создания нового сорта (породы, штамма), называется селекционным процессом. В общих чертах селекционный процесс включает три этапа: получение исходного материала для отбора, собственно отбор и испытание. Нужно иметь в виду, что современный селекционный процесс начинается с создания модели сорта (породы), предназначенного для эксплуатации в определенных условиях, на определенном уровне агро(зоо)техники. Например, при моделировании сортов растений учитывается множество параметров, в частности: - общая продуктивность; - качество химического состава (сбалансированность по аминокислотному составу, по содержанию сахаров, кислот, витаминов и биологически активных веществ); - устойчивость к комплексу физико-химических факторов среды (холодоустойчивость, засухоустойчивость, устойчивость к засолению и т.п.); - устойчивость к неблагоприятным биологическим факторам (вредителям и болезням); - конкурентоспособность; - особенность ритма развития, фотопериодические реакции; - безопасность для человека и окружающей среды. После создания модели сорта (породы) прогнозируются финансовые и ресурсные затраты на создание сорта (породы), оценивается возможность его комплексного использования, разрабатывается комплекс мероприятий от подбора исходного материала до внедрения сорта (породы) в сельскохозяйственное производство. И лишь после этого составляется непосредственный план селекционной работы. Организм и среда Для успешного ведения селекции необходимо изучение закономерностей наследования признаков в различных условиях среды. Любой генотип проявляется в фенотипе только при соблюдении ряда условий. Одни признаки в большей степени зависят от условий выращивания и ухода (удойность, яйценоскость), другие признаки в большей степени зависят от генотипа (жирномолочность, масса яиц). По первой группе признаков селекцию вести очень трудно, необходимо подбирать комплекс агро- и зоотехнических мероприятий. По второй группе признаков селекцию вести легче, т.к. генотип и фенотип более тесно связаны между собой (говорят, что признак характеризуется высокой наследуемостью). Таким образом, селекции подвергается не сам признак, а его норма реакции – генетически обусловленная способность организма изменять степень выраженности своих признаков в определенных пределах в определенных условиях внешней среды. Известно, что норма реакции зависит и от особенностей генотипа, и от действия экзогенных факторов (условий среды), и от специфики данного признака. Под особенностями генотипа подразумевается и сочетание аллелей главных генов (олигогенов), и особенности генотипической среды, включающей полигены, эпистатические гены и гены–модификаторы. Для полной характеристики нормы реакции по определенному признаку необходимо изучить все распределения этого признака в градиентах разных условий среды. Поэтому даже хорошо известные сорта и породы подвергаются дальнейшему изучению с целью выявления таких условий выращивания, которые позволили бы усовершенствовать агро- и зоотехнику с целью максимальной реализации генетического потенциала сорта или породы. Для повышения отдачи сорта (породы) широко используются возможности управления доминированием. В нашей стране приоритетные исследования в этой области были выполнены И.В. Мичуриным (см. ниже). Методы селекции Современная селекция использует целый комплекс методов, основанных на последних достижениях множества наук: генетики, цитологии, ботаники, зоологии, микробиологии, агроэкологии, биотехнологии, информационных технологий и т.д. (некоторые из них будут рассмотрены в лекции «Генетика как научный фундамент биотехнологии»). Однако основными специфическими методами селекции остаются гибридизация и искусственный отбор. Гибридизация Скрещивание организмов с разным генотипом является основным методом получения новых сочетаний признаков. Иногда гибридизация является необходимой, например, для предотвращения инбредной депрессии. Инбредная депрессия проявляется при близкородственном скрещивании и выражается в снижении продуктивности и жизненности (виталитета). Инбредная депрессия – это явление, противоположное гетерозису (см. ниже). Различают следующие типы скрещиваний: Внутривидовые скрещивания – скрещиваются разные формы в пределах вида (не обязательно сорта и породы). К внутривидовым скрещиваниям относятся и скрещивания организмов одного вида, обитающих в разных экологических условиях и/или в разных географических районов (экологогеографические скрещивания). Внутривидовые скрещивания лежат в основе большинства других скрещиваний. Близкородственные скрещивания – инцухт у растений и инбридинг у животных. Применяются для получения чистых линий. Межлинейные скрещивания – скрещиваются представители чистых линий (а в ряде случаев – разных сортов и пород). Межлинейные скрещивания используются для подавления инбредной депрессии, а также для получения эффекта гетерозиса (см. ниже). Межлинейное скрещивание может выступать как самостоятельный этап селекционного процесса, однако в последние десятилетия межлинейные гибриды (кроссы, или гибриды первого поколения F1) все чаще используют для получения товарной продукции. Возвратные скрещивания (бэк-кроссы) – это скрещивания гибридов (гетерозигот) с родительскими формами (гомозиготами). Например, скрещивания гетерозигот с доминантными гомозиготными формами используются для того, чтобы не допустить фенотипического проявления рецессивных аллелей. Анализирующие скрещивания (являются разновидностью бэк-кроссов) – это скрещивания доминантных форм с неизвестным генотипом и рецессивногомозиготных тестерных линий. Такие скрещивания используются для анализа производителей по потомству: если в результате анализирующего скрещивания расщепление отсутствует, то доминантная форма гомозиготна; если же наблюдается расщепление 1:1 (1 часть особей с доминантными признаками :1 часть особей с рецессивными признаками), то доминантная форма гетерозиготна. Насыщающие (заместительные) скрещивания также являются разновидностью возвратных скрещиваний. При многократных возвратных скрещиваниях возможно избирательное (дифференциальное) замещение аллелей (хромосом), например, можно постепенно уменьшить вероятность сохранения нежелательного аллеля. Отдаленные скрещивания – межвидовые и межродовые. Обычно отдаленные гибриды бесплодны и их размножают вегетативным путем; для преодоления бесплодия гибридов применяют удвоение числа хромосом, таким путем получают амфидиплоидные организмы: ржано-пшеничные гибриды (тритикале), пшенично-пырейные гибриды. Соматическая гибридизация – это гибридизация, основанная на слиянии соматических клеток совершенно несходных организмов. Более подробно соматическая гибридизация будет рассмотрена в лекции «Генетика как научный фундамент биотехнологии». Гетерозис. В ходе гибридизации часто проявляется гетерозис – гибридная сила, особенно в первом поколении гибридов. Механизмы гетерозиса до сих пор недостаточно изучены. Наиболее популярны две теории гетерозиса: теория доминирования и теория сверхдоминирования. Теория доминирования исходит из представлений о том, что при скрещивании гомозигот у гибридов первого поколения неблагоприятные рецессивные аллели переводятся в гетерозиготное состояние: AAbb × aaBB → AaBb; тогда AaBb > AAbb, AaBb > aaBB. Теория сверхдоминирования предполагает повышенную конститутивную (общую) приспособленность гетерозигот по сравнению с любой из гомозигот: Aa > AA и Aa > aa. Существуют и более сложные представления о гетерозисе, например, теории гетерозиса В.А. Струнникова; суть этой теории в том, что в чистых линиях происходит накопление генов-модификаторов, подавляющих нежелательные эффекты некоторых аллелей; при скрещивании разных чистых линий каждая из них привносит свой компенсаторный комплекс генов-модификаторов, что усиливает подавление вредных аллелей. В некоторых случаях возможно сохранение полученных генотипов и тем самым закрепление гетерозиса, например, при размножении растений вегетативным путем. Эффект гетерозиса сохраняется также при переводе диплоидных гетерозисных гибридов на полиплоидный уровень. Оценка материала Важнейшим методом селекции был и остается искусственный отбор. Однако процесс отбора включает две группы мероприятий: оценку исходного материала и избирательное размножение (воспроизведение) отобранных организмов или их частей. Рассмотрим методы оценки исходного материала на примере растений. В процессе селекции материал оценивают по его хозяйственным и биологическим свойствам, являющимися объектом селекции. Но независимо от особенностей объекта и задач селекции, производится оценка материала по следующим критериям: - определенный ритм развития, соответствующий почвенноклиматическим условиям, в которых планируется дальнейшая эксплуатация сорта; - высокая потенциальная продуктивность при высоком качестве продукции; - устойчивость к неблагоприятному воздействию физико-химических факторов среды (морозоустойчивость, зимоустойчивость, жароустойчивость, засухоустойчивость, устойчивость к различным видам химических загрязнений); - устойчивость к воздействию болезней и вредителей (оценка по иммунитету); - отзывчивость на агротехнику. В идеале сорт должен отвечать не отдельным требованиям, а их комплексу. Однако на практике это часто оказывается невозможным, и именно поэтому создание композиций, состоящих из линий (клонов) с разными наследственными свойствами, считается наиболее быстрым и надежным способом повышения общей устойчивости агроэкосистем. Доказано, что в генетически неоднородных системах возникают компенсаторные взаимодействия особей с различными особенностями роста и развития, чувствительности к динамике факторов среды, болезням, вредителям. Оценка материала ведется на всех стадиях онтогенеза, поскольку разные признаки проявляются в разных возрастных состояниях. При этом материал оценивается как по прямым, так и по косвенным признакам. Например, при оценке зимостойкости озимых злаков и многолетних растений наиболее важным прямым признаком служит общая степень подмерзания в баллах. В то же время зимостойкость можно оценить, определяя содержание сахаров в клеточном соке. Данный показатель является косвенным. Оценка по косвенным признакам считается менее точной, но в ряде случаев она становится удобной и даже неизбежной, например: - если между прямыми и косвенными признаками существует высокая и устойчивая корреляция; - если прямые признаки проявляются только в отдельные годы (аномально засушливые, дождливые…); - если прямые признаки проявляются на поздних стадиях онтогенеза; - если прямые признаки характеризуются высокой модификационной изменчивостью. Для оценки селекционного материала используют полевые, лабораторные и лабораторно-полевые методы. Полевые методы дают наиболее надежные результаты, поскольку материал оценивается в естественных условиях по прямым признакам. Однако использование полевых методов не всегда возможно. Например, для оценки морозоустойчивости однолетних сеянцев необходима морозная бесснежная зима; если же в данном году такой зимы не было, то материал остается без оценки. Точно так же оценку на иммунитет на фоне естественного заражения можно проводить только в годы сильного распространения болезни или вредителя. Лабораторные методы позволяют изменять градацию факторов среды по воле экспериментатора. Например, повреждения побегов имитируются с помощью обрезки. Однако в ряде случаев применение экспериментальных методов требует специального оборудования; например, для изучения зимостойкости требуются морозильные камеры с интенсивными источниками света. Лабораторно-полевые методы совмещают достоинства и недостатки собственно полевых и лабораторных методов. В особую группу выделяются провокационные методы, с помощью которых искусственно создается провокационный фон, то есть условия для выявления отношения растений к неблагоприятным физико-химическим и биотическим факторам. Интенсивность провокационных методов должна быть оптимальной. При слишком слабом провокационном фоне не гарантируется проявление нежелательного признака, а при слишком жестком фоне могут быть выбракованы растения, обладающие достаточной устойчивостью к действию данного фактора. К провокационным методам относится создание инфекционного фона при селекции на устойчивость к вредителям и болезням. Это направление селекции является крайне важным и, в тоже время, очень трудным, поэтому рассмотрим его несколько подробнее. Оценка селекционного материала на устойчивость к болезням и вредителям Известно, что не менее 25% сельскохозяйственной продукции человек отдает в качестве дани болезням и вредителям. Для снижения указанных потерь применяются все возрастающие дозы ядохимикатов: фунгицидов, инсектицидов, акарицидов и т.п. Ясно, что продукция, полученная с применением ядохимикатов, не может считаться безвредной для человека, а само применение ядохимикатов не только снижает устойчивость агроэкосистем, но и нарушает структуру смежных экосистем. Поэтому селекция на иммунитет, т.е. на устойчивость к болезням и вредителям является едва ли не самой важной составляющей селекционного процесса. Основы учения об иммунитете были заложены Н.И. Вавиловым. Давно известно, что оцениваемый материал может быть устойчив к одним расам паразита, но поражаться другими. Устойчивость растений определяется различными факторами: ритмом их роста и развития, а также анатомическими, физиологическими и биохимическими особенностями. Перечисленные признаки являются в значительной мере наследственно обусловленными. Однако генетика иммунитета исключительно сложна и до сих пор недостаточно изучена. Растения с наиболее благоприятным сочетанием генов устойчивости встречаются крайне редко. При этом устойчивость может отрицательно коррелировать с хозяйственно ценными признаками; например, наиболее устойчивыми к данному патогену могут быть карликовые растения. Кроме того, устойчивость к патогену может разрушаться при семенном возобновлении. На развитие болезни влияют факторы внешней среды, которые создают условия для заражения и распространения возбудителя болезни. Знание этих условий позволяет создавать лучшие провокационные фоны для выявления и браковки поражаемых растений. Например, проявлению многих болезней способствует монокультура, а также применение культурооборотов с короткой ротацией. Для выявления устойчивости или неустойчивости растений к данной расе патогена создают инфекционный фон путем искусственного заражения растений этой расой. Устойчивость или восприимчивость растений к патогену является следствием коэволюции (сопряженной эволюции) двух генофондов – растения ипатогена. Чем выше разнообразие этих генофондов, тем выше темпы образования новых рас патогена. В результате образование новых рас у патогенных организмов наиболее интенсивно протекает в условиях селекционных учреждений, где имеется наибольшее разнообразие генотипов растений и генотипов патогенов. В результате вновь созданный сорт, обладающий иммунитетом к данному патогену, через несколько лет утрачивает устойчивость. Для предотвращения этого нежелательного эффекта можно рекомендовать выполнение следующих условий. 1. Создавать новые коллекционные посадки на достаточном удалении от естественных насаждений данного вида, причем, в культурообороте в числе предшественников не должно быть близких видов. 2. Создавать диспергированные коллекции, то есть выращивать группы растений, потенциально устойчивые к данному патогену, в пространственной изоляции по отношению к другим подобным группам. 3. Искусственный отбор. Основные методы (формы) отбора Отбором называется процесс дифференциального (неодинакового) воспроизведения генотипов. При этом не следует забывать, что фактически отбор ведется по фенотипам на всех стадиях онтогенеза организмов (особей). Неоднозначные взаимоотношения между генотипом и фенотипом предполагают проверки отобранных растений по потомству. Существует множество форм искусственного отбора. Рассмотрим более подробно наиболее часто применяемые формы отбора. Массовый отбор – отбору подвергается вся группа. Например, семена с лучших растений объединяются и высеваются совместно. Массовый отбор считается примитивной формой отбора, поскольку не позволяет устранить влияние модификационной изменчивости (в том числе, и длительных модификаций). Применяется в семеноводстве. Рекомендуется при селекции новых, вводимых в культуру растений или культур, мало проработанных в селекционном отношении. Достоинством этой формы отбора является сохранение высокого уровня генетического разнообразия в селектируемой группе растений. Индивидуальный отбор – отбираются отдельные особи, и собранные с них семена высеваются раздельно. Индивидуальный отбор считается прогрессивной формой отбора, поскольку позволяет исключить влияние модификационной изменчивости. Одним из наиболее прогрессивных методов отбора, учитывающим модификационную изменчивость, считается метод «педигри» (англ. Pedigree – родословная), основанный на индивидуальном отборе лучших особей с оценкой их потомства. При оценке материала бракуются не отдельные особи, а целые линии, содержащие нежелательные для селекционера аллели. Этот метод особенно эффективен при селекции самоопылителей с коротким жизненным циклом (однолетников). Однако метод «педигри» неприменим для видов, склонных к инбредной депрессии, а тем более, для двудомных видов растений. Поэтому в селекции перекрестноопыляющихся растений используется особая форма индивидуального отбора – семейный отбор (семья – это совокупность особей, выращенных из семян, собранных с одного растения, причем донор пыльцы, как правило, неизвестен). Если разные семьи изолированы друг от друга, то такой отбор называют индивидуально-семейным. При воспроизведении каждой семьи выбраковываются особи с нежелательными признаками, а оставшиеся лучшие особи свободно переопыляются. Затем производится оценка семьи по ее потомству. Те семьи, в которых велика доля растений с нежелательными признаками, бракуются и исключаются из селекционного процесса, а семьи с высокими средними показателями используются для дальнейшего семенного размножения и отбора. Такой метод селекции представляет собой модификацию метода «педигри» применительно к перекрестноопыляющимся растениям. Жесткость отбора предполагает беспощадную выбраковку худших, с точки зрения селекционера, семей, а это противоречит представлениям о биоразнообразии как одном из важнейших природных ресурсов. Поэтому семейный отбор должен дополняться методами повторяющегося отбора, основанного на сохранении исходного материала. При повторяющемся отборе в каждом поколении с лучших особей отбирается материал для клонирования и предварительного сортоиспытания. Параллельно в каждой семье продолжается ее семенное возобновление. При этом интенсифицируется работа по созданию коллекций семей с использованием генетического потенциала организмов, обитающих в иных эколого-географических условиях, а также генетического потенциала экспериментально полученных растений–мутантов. Для предотвращения гомозиготизации и инбредной депрессии применяется семейно-групповой отбор. Этот метод основан на объединении в одну группу семей, фенотипически сходных по селектируемым признакам, но различающихся по происхождению. Каждая такая группа изолируется от других подобных групп. Тогда в пределах группы происходит переопыление между членами разных семей. Разновидностью семейного отбора является сиб-селекция. В основе сибселекции лежит отбор по ближайшим родственникам (сибсам – братьям и сестрам). Частным случаем сиб-селекции является отбор подсолнечника на масличность методом половинок. При использовании этого метода соцветие (корзинку) подсолнечника делят пополам. Семена одной половины проверяют на масличность: если масличность высокая, то вторая половина семян используется в дальнейшей селекции. Рассмотрим кратко некоторые другие формы искусственного отбора. Негативный, позитивный и модальный. При негативном отборе отбраковываются худшие особи (с точки зрения селекционера); при позитивном отборе оставляются для дальнейшего воспроизведения лучшие особи (опять же с точки зрения селекционера). При модальном отборе для разведения оставляются типичные для данного сорта или данной породы особи; применяется для сохранения устойчивых сочетаний генов; модальный отбор является аналогом стабилизирующей формы естественного отбора и применяется для сохранения устойчивых сочетаний генов. Сознательный и бессознательный отбор. При сознательном (методическом) отборе заранее планируется конечный результат (см. выше). При бессознательном отборе селекционер контролирует только некоторые, интересующие его признаки.Однако не все признаки могут контролироваться селекционером, тогда возникают неожиданные, часто нежелательные эффекты,например, повышение зимостойкости сопровождается снижением продуктивности. В XIX в. для получения наиболее крупных семян хлебных злаков применялся двойной обмолот: сноп слегка ударяли о землю, и при этом, в первую очередь, осыпались наиболее крупные зерна: шел отбор генотипов, обеспечивающих наибольшую массу зерен. Но в то же время шел бессознательный отбор генотипов, повышающих осыпаемость хлебных злаков. В ходе искусственного отбора, направленного на усиление полезных для человека признаков, всегда происходит и естественный отбор, направленный на сохранение полезных для организмов признаков. Это противоречие может тормозить селекцию. Многократный и однократный отбор. Многократный отбор ведется в течение многих поколений. Обычно он используется при высоком уровне генетического разнообразия исходного материала. При многократном отборе в каждом поколении часть растений используется для сортоиспытания, а часть – сохраняется в качестве исходного материала. Ниже будет рассмотрен повторяющийся отбор как современная форма многократного отбора. Однократный отбор используется в том случае, если отобранные растения не дают расщепления в последующих поколениях. Такой отбор эффективен при семенном размножении самоопыляющихся растений при наличии в исходном материале гомозигот, фенотипически отличающихся от гетерозигот. Тогда в результате однократного отбора создаются чистые линии, в которых дальнейший отбор неэффективен.Однократный отбор у перекрестноопыляющихся растений возможен в том случае, если отобранные растения можно размножать вегетативным путем, тогда он дополняется клоновым отбором. Клоновый отбор. Производится путем вегетативного размножения в течение 2...3 поколений. При этом возникновение новых генотипов за счет рекомбинаций оказывается невозможным, и тогда каждый сеянец может потенциально считаться родоначальником нового сорта. Таким образом, клоновый отбор – это особая форма отбора, направленная на выявление и устранение соматических (почковых) мутаций и длительных модификаций. Творческая роль искусственного отбора. В ходе искусственного отбора ослабляются нежелательные признаки и многократно усиливаются хозяйственно полезные признаки. Творческая роль искусственного отбора заключается в том, что создаются формы, которых ранее не существовало. Отбор на разнообразие. Долгое время конечным результатом отбора считалось создание генетически однородных, гомогенных групп, в которых отбор становится невозможным (или малоэффективным). Эффективность отбора в популяциях (неоднородных генетических системах) и неэффективность отбора в чистых линиях (однородных генетических системах) еще в начале XX в. доказал выдающийся датский генетик В.Л. Иоганнсен. В результате отбора на однородность генетический потенциал исходного материала истощается. Тогда необходимо искать новый материал, новые генотипы. Таким образом, искусственный отбор в классической форме неизбежно приводит к снижению уровня биологического разнообразия. Для сохранения необходимого уровня биоразнообразия необходимо постоянно осуществлять комплекс мероприятий по сохранению генофонда (см. выше). Гораздо менее затратным является отбор на разнообразие. Например, из нескольких сходных сортов (пород) сохраняется не самый лучший сорт (самый продуктивный, самый устойчивый к заболеваниям, самый конкурентоспособный и т.п.), а вся группа сортов (пород). Если получено несколько сортов (пород),фенотипически неразличимых, но генетически различных, то должна быть сохранена вся группа. Таким образом, уже само по себе разнообразие рассматривается как важнейший биологический ресурс (напомним, что биологическим ресурсом считается генетический материал, организмы или их части, либо экосистемы, используемые или потенциально полезные для человечества, включая природное равновесие внутри экосистем и между ними). Частным случаем отбора на разнообразие является отбор на разнообразие ритмов развития. 4. Работы И. В. Мичурина Неоценимый вклад в развитие селекции растений внес отечественный селекционер, выдающийся преобразователь природы Иван Владимирович Мичурин (1855–1935). Объектом селекции служили разнообразные плодовоягодные культуры: семечковые, косточковые; всего И.В. Мичуриным было создано свыше 300 сортов культурных растений, часть которых эксплуатируется до сих пор. Основные принципы работ И.В. Мичурина: гибридизация, отбор и воздействие условий среды. И.В. Мичурину принадлежит крылатое выражение; «Мы не можем ждать милостей от природы, взять их у неѐ – наша задача». И.В. Мичурин был не просто талантливым садоводом-любителем. Он внес неоценимый вклад в мировую науку. В частности, Иван Владимирович экспериментально обосновал эффект смены доминирования: в зависимости от почвенно-климатических условий, характера подвоя и привоя и других факторов генотип может проявиться в фенотипе, а может и не проявиться. И.В. Мичурин использовал в своих работах метод ментора, основанный на различных комбинациях прививок. Для получения гибридов И.В. Мичурин широко использовал эколого-географические скрещивания – если родители происходят из разных географических районов или из разных местообитаний, то гетерозис проявляется наиболее сильно. Это вызвано тем, что эти родители имеют наиболее сильно различающиеся генотипы, сформировавшиеся в ходе естественного отбора в разных условиях. И.В. Мичурин установил, что селекцию сорта нужно вести в тех условиях, в которых планируется его дальнейшая эксплуатация. Частная селекция растений и микроорганизмов Селекция растений Особенности растений как объекта селекции: –Высокая плодовитость. –Короткий жизненный цикл у травянистых растений: однолетников и двулетников. –Очень длительный жизненный цикл у древесных растений. –Возможность самоопыления (не всегда). –Возможность вегетативного размножения (не всегда). –Возможность межвидовой гибридизации с последующим восстановлением плодовитости. –Возможность применения индуцированного мутагенеза. Все это позволяет вести селекцию растений на самые разнообразные признаки в сжатые сроки и с наименьшими затратами. Сорта растений Сорт – это искусственная популяция растений или клон, прошедшие сортоиспытания и предназначенные для выращивания в определенных районах при соблюдении соответствующей агротехники. Существует множество подходов к определению самого понятия «сорт» и множество типов и подтипов сортов, однако главным признаком сорта является его способность сохранять свои наследственные признаки при возобновлении. Современные сорта делятся на две большие группы: сорта-популяции (которые воспроизводятся при половом размножении) и сорта-клоны (которые сохраняются только при вегетативном размножении). В каждой из групп сортов имеются подгруппы: сорта–самоопылители, сортосмеси, сортагибриды, сорта-химеры и др. Сорт является основой интенсивного земледелия. Используя особенности сорта, можно добиться получения максимального выхода продукции при минимальных затратах и с наивысшими качествами. Например, в Великобритании во второй половине ХХ века урожайность зерновых культур выросла в 2 раза, при этом 50 % прироста продукции получено за счет внедрения новых сортов. Особенности микроорганизмов как объекта селекции: - Исключительно высокая скорость размножения. - Преимущественная гаплоидность или, наоборот, высокий уровень полиплоидии. - Способность переносить высокие дозы мутагенов. Микроорганизмы – это сборная группа, включающая бактерии, актиномицеты, настоящие грибы. Микроорганизмы используются в традиционных биотехнологиях (хлебопечение, производство кисломолочных и других продуктов), а также в современных биотехнологиях: для получения разнообразных чистых веществ – ферментов, аминокислот, антибиотиков, биологически активных веществ, в качестве бактериальных удобрений, для утилизации разнообразных отходов и т. д. Поскольку половой процесс у большинства микроорганизмов отсутствует, то при размножении мутантной особи (клетки) может быть получена культура генетически идентичных организмов – клон. Длительно сохраняемый клон микроорганизмов, характеризующийся собственными генетически устойчивыми признаками, называется штамм. Основные методы селекции микроорганизмов: индуцированный мутагенез и последующий отбор. Поскольку скорость размножения микроорганизмов очень велика, то из множества полученных мутантов можно отобрать те, продуктивность которых в десятки и сотни раз превышает продуктивность «диких» штаммов. В настоящее время при селекции микроорганизмов используются методы биотехнологии, в частности, методы генной инженерии, которые позволяют внедрять требуемый аллель непосредственно в генетический аппарат клетки. Если микроорганизмы находятся в гаплоидной фазе, то новая мутация (или внедренный аллель) сразу же проявляется в фенотипе, и мутантов можно легко выявить. Затем полученных мутантов можно перевести в полиплоидное состояние (например, увеличив число ядер, нуклеоидов или других носителей генетической информации в клетках). В этом случае продуктивность штаммов резко возрастает. Однако продуктивность микроорганизмов нельзя повышать до бесконечности: например, если усиливается продуцирование антибиотиков, то снижается общая жизнеспособность клеток. Поэтому одной из проблем селекции микроорганизмов является повышение устойчивости, жизнеспособности и конкурентоспособности новых штаммов. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 11. ГЕНЕТИКА КАК НАУЧНЫЙ ФУНДАМЕНТ БИОТЕХНОЛОГИИ Лектор: ст.п. Мамедова М. З. 1. Основы биотехнологии. Задачи биотехнологии. Структура современной биотехнологии 2. Клеточная инженерия: достижения и перспективы 3. Генная инженерия: достижения и перспективы 4. Генетические основы высоких технологий 1. Основы биотехнологии. Задачи биотехнологии. Структура современной биотехнологии Биотехнология – это область человеческой деятельности, которая характеризуется широким использованием биологических систем всех уровней в самых разнообразных отраслях науки, промышленного производства, медицины, сельского хозяйства и других сферах. Биотехнология отличается от технологий сельского хозяйства, в первую очередь, широким использованием микроорганизмов: прокариот (бактерий, актиномицетов), грибов и водорослей. Это связано с тем, что микроорганизмы способны осуществлять самые разнообразные биохимические реакции. Традиционные биотехнологии, существующие уже тысячи лет, используют существующие в природе микроорганизмы… –для производства продуктов питания (хлебопечение, производство молочнокислых продуктов); –для производства алкогольных напитков (пивоварение, виноделие); –для производства промышленных товаров (кожевенное, текстильное производство); –для повышения плодородия почв (использование органических и зеленых удобрений). Традиционные биотехнологии сложились на основании эмпирического опыта многих поколений людей, они характеризуются консерватизмом и сравнительно низкой эффективностью. Однако в течение XIX–XX столетий на основе традиционных биотехнологий начали формироваться технологии более высокого уровня: технологии повышения плодородия почв, технологии биологической очистки сточных вод, технологии производства биотоплива. Использование микроорганизмов для повышения плодородия почв. Микроорганизмы издавна используются при производстве органических удобрений(компостов)путем переработки биологических отходов. Особую группу составляют азотфиксирующие микроорганизмы: свободноживущие и симбиотические. Например, культуры симбиотических бактерий рода Ризобиум в виде бактериальных удобрений (нитрагина и ризоторфина) вносятся в почву при посеве бобовых растений (люцерны, клевера, люпина). В дальнейшем бактерии в составе клубеньков обеспечивают фиксацию атмосферного азота и его накопление в почве. Сконструированные штаммы микроорганизмов неконкурентоспособны по отношению к своим «диким» родичам, поэтому их нужно разводить в искусственных условиях и ежегодно вносить в почву. Биологическая очистка сточных вод. С начала ХХ в. микроорганизмы в сочетании с химическими методами используются для биологической очистки сточных вод. Интенсивную очистку производят в особых ѐмкостях: аэротенках, метантенках. Различают две технологии минерализации (очистки вод от органических загрязнителей): аэробную и анаэробную. При аэробной минерализации в аэротенках используется активный ил, содержащий бактерий и одноклеточных гетеротрофных эукариот. В результате такой очистки происходит полное окисление органических веществ. При анаэробной минерализации в метантенках происходит сбраживание органических веществ с образованием метана, который в дальнейшем используется как топливо (биогаз). Для разложения синтетических органических веществ (например, моющих средств) используют бактерий, полученных путем искусственного мутагенеза. Некоторые микроорганизмы используются для избирательного накопления отдельных химических элементов: диатомовые водоросли для накопления кремния, железобактерии для накопления железа и т.д. Эти же микроорганизмы используются для обогащения металлургического сырья. Производство биотоплива. К биологическому топливу относятся углеводороды и спирты, полученные путем переработки различных органических отходов с помощью микроорганизмов.Например, отходы крахмального и сахарного производства, текстильной и деревообрабатывающей промышленности служат сырьем для производства спирта и биогаза – дешевого топлива для автомобильных двигателей и других силовых установок. Отметим, что спирты и биогаз относятся к экологически чистым видам топлива – при их сжигании образуются полностью окисленные соединения. Структура современной биотехнологии Современная биотехнология включает ряд высоких технологий, которые базируются на последних достижениях экологии, генетики, микробиологии, цитологии, молекулярной биологии. В современной биотехнологии используются биологические системы всех уровней: от молекулярногенетического до биогеоценотического (биосферного); при этом создаются принципиально новые биологические системы, не встречающиеся в природе. Биологические системы, используемые в биотехнологии, вместе с небиологическими компонентами (технологическое оборудование, материалы, системы энергоснабжения, контроля и управления) удобно называть рабочими системами. К основным разделам современной биотехнологии относятся: микробиологический синтез, клеточная инженерия и генная инженерия. Современная биотехнология призвана решить следующие задачи: –Промышленное производство продуктов питания, в первую очередь, белков и незаменимых аминокислот. –Повышение плодородия почв, производство биологически активных веществ для нужд сельского хозяйства. –Производство лекарственных препаратов и биологически активных веществ, повышающих качество жизни людей. –Использование биологических систем для производства и обработки промышленного сырья. –Производство дешевых и эффективных энергоносителей (биотоплива). –Использование биологических систем для утилизации отходов различного характера, биологической очистки сточных вод. –Создание организмов с заданными свойствами. Генетическая безопасность Используя методы генной и клеточной инженерии, современная биотехнология осуществляет широкое конструирование генетически модифицированных организмов (ГМО), в том числе микроорганизмов, растений и животных. Целый ряд ГМО используется в неконтролируемых условиях (в сельском хозяйстве, рыбоводстве, для биологической борьбы с вредителями сельского и лесного хозяйства и т.д.). Однако перед генной инженерией стоит ряд этических и технологических проблем. Например, при выпуске ГМО в окружающую среду они могут взаимодействовать с разнообразными организмами, сообществами и экосистемами конкретных территорий. При этом процесс и исход таких взаимодействий не всегда поддается прогнозированию. В результате возникает проблема генетической безопасности как отдельных популяций человека, растений и животных, так и экосистем в целом. В частности, существует опасность внедрения трансгенов («искусственных генов») в геном неконтролируемых организмов в результате скрещивания и/или рекомбинации ГМО и «диких» форм. Многие ученые и организации возражают против создания генетически модифицированных организмов (ГМО), поскольку при этом возможны непредсказуемые последствия. Поэтому развитые страны должны принять нормативные акты, регулирующие создание, испытание и использование ГМО, включающее выпуск в окружающую среду. Микробиологический синтез (МБС) Микробиологическим синтезом называется синтез самых разнообразных веществ с помощью микроорганизмов. Становление современного МБС связано с открытием антибиотиков и разработкой способов их промышленного производства с помощью актиномицетов и грибов. В настоящее время микроорганизмы используются в различных высоких технологиях: для производства антибиотиков, кормового белка и аминокислот, биологически активных соединений (витаминов, гормонов, ферментов, стимуляторов роста) и т.д. Превращение одних веществ, в другие с помощью микроорганизмов называется биоконверсия. При микробиологическом синтезе исходным сырьем служат разнообразные источники углерода (природные углеводороды, органические отходы), минеральные соли и атмосферный азот. В качестве микроорганизмов используются прокариоты (бактерии, актиномицеты) и грибы. Обычно микробиологический синтез проводят по следующей технологии. Чистые культуры микроорганизмов предварительно размножают на питательной среде. Затем их вносят в специальные ѐмкости–ферментаторы с подготовленным и простерилизованным сырьем. Обработка сырья– ферментация –протекает при определенной температуре, определенной кислотности, в аэробных или анаэробных условиях. Процесс ферментации обычно продолжается 5...6 дней. После этого производится очистка требуемого продукта от примесей (например, при производстве лекарственных препаратов). В ряде случаев полученный продукт подвергают дополнительной обработке. Например, антибиотики, полученные с помощью микроорганизмов, модифицируют химическими методами, что усиливает их терапевтическое действие (полусинтетические пенициллины и тетрациклины). Разновидностью микробиологического синтеза является ферментативный синтез. При этом используются не сами микроорганизмы, а выделенные из них ферменты. Ферментативный синтез уменьшает вероятность побочных реакций, устраняет опасность бактериального загрязнения окружающей среды, снижает количество биологически активных отходов, облегчает очистку продуктов. Для увеличения продолжительности службы ферментов их подвергают иммобилизации, соединяя с полимерными матрицами. Иммобилизации могут подвергаться и живые клетки. Иммобилизованные ферменты и клетки позволяют осуществлять непрерывный процесс ферментации. 2. Клеточная инженерия: достижения и перспективы Клеточная инженерия – это один из основных разделов современной биотехнологии, основанный на выделении и культивировании тканей и клеток высших многоклеточных организмов. Культивирование тканей и клеток происходит вне организма – in vitro («в пробирке, в колбе, в стеклянной посуде»), в специально подобранных условиях. Клеточно-тканевые культуры растений. Основным типом культивируемой растительной клетки является каллусная – это наименее дифференцированная ткань, которая в обычных условиях возникает при повреждениях и функционирует непродолжительное время. Каллус получают из паренхимы корнеплодов, стеблей, листьев, а также из гаплоидных тканей пыльников. Культивирование клеток растений производят или поверхностным способом, или в жидкой питательной среде. В любом случае необходимо подобрать определенное соотношение компонентов питательной среды. В состав питательной среды обязательно входят: углеводы (сахароза или глюкоза), минеральные соли, витамины, регуляторы роста и развития (определенные фитогормоны); иногда добавляют дрожжевой экстракт или растительные экстракты. Поддерживается определенная температуры, кислотность, газовый состав. Клеточно-тканевые культуры животных. Основным типом культивируемой животной клетки являются опухолевые клетки миеломы или саркомы (раковые клетки). В то же время, культивированию поддаются и другие типы клеток: клетки селезенки, фибробласты соединительной ткани, гепатоциты печени, лимфоциты и т.д. Культуры опухолевых клеток практически бессмертны, они переносят неограниченное количество пассажей (пересевов на свежую питательную среду); длительность существования культур других тканей ограничена. Простейшей питательной средой для животных клеток служит сыворотка крови, но в ряде случаев используются полусинтетические и синтетические среды. Соматическая гибридизация. Гибридомы. Методы клеточной инженерии позволяют объединять различные типы клеток. Слияние клеток, принадлежащих к разным биологическим видам, называется соматической гибридизацией. Сущность соматической гибридизации заключается в получении синтетических культур путем слияния протопластов различных видов организмов. Для слияния клеток используют различные физические и химические методы. После слияния протопластов образуются многоядерные гетерокариотические клетки. В дальнейшем при слиянии ядер образуются синкариотические клетки, содержащие в ядрах хромосомные наборы разных организмов. При слиянии антителообразующих клеток (например, В– лимфоцитов человека) и раковых клеток (например, клеток миеломы мышей) образуются гибридомы. Это клеточные гибриды, сохраняющие свойства лимфоцитов (способность к образованию строго определенных антител) и свойства раковых клеток (способность к неограниченному числу делений). Гибридомы вырабатывают однородные антитела, взаимодействующие со строго определенными возбудителями заболеваний или другими антигенами. Такие антитела называют моноклональными. Значение клеточной инженерии 1.Применение клеточных культур позволяет преодолеть многие проблемы биоэтики (биологической этики), связанные с умерщвлением животных. Поэтому культуры клеток широко используются в научных исследованиях. 2.В культуре можно выращивать строго определенные клетки в неограниченном количестве. Поэтому культуры клеток и тканей, выделенные из природного материала, широко используются при промышленном производстве биологически активных веществ. В частности, на клеточнотканевом уровне выращиваются женьшень, родиола розовая и другие лекарственные растения. 3. Из апикальных меристем путем микроклонирования получают посадочный материал ценных сортов растений, свободный от многих болезней (например, от вирусов и микоплазм), в частности, безвирусный посадочный материал цветочных и плодово-ягодных культур. На питательной среде размножают и каллусныеткани, которые в дальнейшем дифференцируются с образованием целостных растений. 4.Решаются проблемы получения отдаленных гибридов растений. Вопервых, путем соматической гибридизации можно скрещивать растения, которые не скрещиваются обычным путем. Во-вторых, полученные отдаленные гибриды можно воспроизводить, минуя семенное размножение и мейотический фильтр. 5.На культурах клеток получают вакцины, например, против кори, полиомиелита. В настоящее время решается вопрос крупномасштабного производствамоноклональных антител на основе гибридомных культур. 6.Сохраняя культуры клеток, можно сохранять генотипы отдельных организмов и создавать банки генофондов отдельных сортов и даже целых видов, например, в виде мериклонов (культур меристем). 7. Манипуляции с отдельными клетками и их компонентами используются для клонирования животных. Например, ядра из клеток кишечного эпителия головастика внедряются в энуклеированные яйцеклетки лягушки. В результате из таких яйцеклеток развиваются особи с генетически идентичными ядрами. 3. Генная инженерия: достижения и перспективы. Возможности коррекции генотипа при генетических заболеваниях Генная инженерия представляет собой совокупность методов, позволяющих создавать синтетические системы на молекулярнобиологическом уровне. Генная инженерия дает возможность конструировать функционально активные структуры в форме рекомбинантных ДНК вне биологических систем (in vitro), а затем вводить их в клетки. Генная инженерия возникла в 1972 г. когда в лаборатории П. Берга (Станфордский ун-т, США) была получена первая рекомбинантная (гибридная) ДНК (рекДНК), в которой были соединены фрагменты ДНК фага лямбда и кишечной палочки с кольцевой ДНК обезьяньего вируса SV40. С конца 1980-х гг. генетически модифицированные растения начинают использоваться в сельском хозяйстве. Методы генной инженерии основаны на получении фрагментов исходной ДНК и их модификации. Для получения исходных фрагментов ДНК разных организмов используется несколько способов: –Получение фрагментов ДНК из природного материала путем разрезания исходной ДНК с помощью специфических нуклеаз (рестриктаз). –Прямой химический синтез ДНК, например, для создания зондов (см. ниже). –Синтез комплементарной ДНК (кДНК) на матрице мРНК с использованием фермента обратной транскриптазы (ревертазы). Определение нуклеотидного состава фрагментов ДНК производится с помощью радиоактивных зондов – молекул ДНК с заранее известной структурой, в состав которых входят радиоактивные изотопы фосфора или водорода. Если структура выделенного фрагмента хотя бы частично комплементарна структуре зонда, то происходит ДНК–ДНК–гибридизация, и на микрофотографии препарата появляется засветка от радиоактивного изотопа. Выделенные участки ДНК встраивают в векторы переноса ДНК. Векторы – это небольшие молекулы ДНК, способные проникать в другие клетки и реплицироваться в них. В состав вектора входит не менее трех групп генов: 1. Гены, которые интересует экспериментатора. 2. Гены, отвечающие за репликацию вектора. 3. Гены-маркеры, по деятельности которых можно судить об успешности трансформации (например, гены устойчивости к антибиотикам или гены, отвечающие за синтез белков, светящихся в ультрафиолетовом свете). Для внедрения векторов в прокариотические или эукариотические клетки используют различные способы: 1.Биотрансформация. Используются векторы, способные сами проникать в клетки. Частным случаем биотрансформации является агробактериальная трансформация. 2.Микроинъекции. Используются, если клетки, подлежащие трансформации, достаточно крупные (например, икринки, пыльцевые трубки). 3.Биобаллистика (биолистика). Векторы «вбивают» в клетки с помощью специальных «пушек». В качестве векторов часто используют плазмиды (кольцевые молекулы ДНК прокариотических клеток), а также ДНК вирусов. У эукариот в качестве векторов используют мобильные генетические элементы – участки хромосом, способные образовывать множество копий и встраиваться в другие хромосомы. В составе одного вектора можно комбинировать различные фрагменты ДНК (различные гены). Вновь образованные фрагменты ДНК называют рекомбинантными. Векторы переноса ДНК вместе с внедренными фрагментами ДНК различными способами вводят в прокариотические или эукариотические клетки и получают трансгенные клетки. В ходе размножения трансгенных клеток происходит клонирование требуемых фрагментов ДНК, в частности, отдельных генов. Клонированные гены эукариот подвергают различным модификациям (например, добавляют перед ними сильные промоторы) и внедряют в клетки-продуценты. Основная проблема состоит в том, чтобы чужеродные гены экспрессировались постоянно, то есть должен происходить синтез необходимых веществ без ущерба для клетки–хозяина. Практические достижения современной генной инженерии заключаются в следующем: –Созданы банки генов, или клонотеки, представляющие собой коллекции клонов бактерий. Каждый из этих клонов содержит фрагменты ДНК определенного организма (дрозофилы, человека и других). –На основе трансформированных штаммов вирусов, бактерий и дрожжей осуществляется промышленное производство инсулина, интерферона, гормональных препаратов. На стадии испытаний находится производство белков, позволяющих сохранить свертываемость крови при гемофилии, и других лекарственных препаратов. –Созданы трансгенные высшие организмы (некоторые рыбы и млекопитающие, многие растения) в клетках которых успешно функционируют гены совершенно других организмов. Широко известны генетически модифицированные растения (ГМР), устойчивые к высоких дозам определенных гербицидов, а также Bt-модифицированные растения, устойчивые к вредителям. – Разработаны методы клонирования строго определенных участков ДНК, например, метод полимеразной цепной реакции (ПЦР). ПЦР-технологии применяются для идентификации определенных нуклеотидных последовательностей, что используется при ранней диагностике некоторых заболеваний, например, для выявления носителей ВИЧ-инфекции. Возможности генной инженерии практически безграничны. В настоящее время интенсивно изучается возможность коррекции генома человека (и других организмов) при генетических и негенетических заболеваниях. 4. Генетические основы высоких технологий. Преодоление недостатков монокультуры, создание поликлональных композиций. Получение экологически чистой продукции Современная биотехнология развивается настолько динамично, что невозможно разработать унифицированную классификацию ее компонентов. Лишь в самом грубом приближении (по аналогии с промышленными небиологическими технологиями) можно выделить следующие типы технологий: технологии низкого и высокого уровня, экстенсивные и интенсивные технологии, а также безотходные, безопасные, ресурсо- и энергосберегающие, трудоемкие, наукоемкие, прорывные. Современные биотехнологии различных направлений и различных уровней неразрывно связаны между собой в единую научно-производственную систему. Технологии низкого уровня – это технологии традиционные, в известной мере, устаревшие. Они характеризуются низкой наукоемкостью, т.е. базируются на использовании рабочих систем, полученных методами традиционной селекции. Для реализации таких технологий не требуется специального оборудования и специальной подготовки материала. Такие технологии широко используются в рамках обычного сельскохозяйственного производства, в частности, в растениеводстве (тогда рабочей системой можно считать агроэкосистему, например, обрабатываемое картофельное поле). К биотехнологиям низкого уровня относятся технологии биологической очистки сточных вод, получения биотоплива, некоторые виды микробиологического синтеза. Технологии низкого уровня с минимальными затратами материальных ресурсов, энергии и человеческого труда называются экстенсивными. Примером таких технологий служит повышение плодородия почв путем вывоза на поля навоза, торфа, путем запашки пожнивных остатков и сидератов (специально выращенных бобовых растений). Эффективность подобных технологий невелика: при их использовании продуктивность агроэкосистем мало отличается от продуктивности природных экосистем. Низкая эффективность экстенсивных технологий низкого уровня компенсируется расширением площади сельскохозяйственных угодий: вырубаются леса (при этом древесина используется на топливо, для производства бумаги), распахиваются степи. Вырубка лесов и распашка степей неизбежно сопровождаются эрозией почв, оскудением водных ресурсов. Подобные технологии показали свою неэффективность уже в первой половине XX столетия. Более эффективными являются интенсивные технологии. Их эффективность достигается, в первую очередь, путем внедрения новых интенсивных сортов растений (в животноводстве и микробиологическом синтезе – интенсивных пород животных и штаммов микроорганизмов). Интенсивность сортов (пород, штаммов) определяется их повышенной продуктивностью при увеличении затрат человеческого труда, при увеличении затрат сырьевых и энергетических ресурсов путем все более широкого использования средств механизации, автоматизации и химизации. Примером таких технологий служит повышение плодородия почв с помощью предварительно подготовленных компостов, путем совместного внесения бактериальных и минеральных удобрений. Широчайшее внедрение подобных технологий характерно для второй половины XX столетия. Например, в Великобритании в период с 1950 по 1980 гг. удалось увеличить урожайность зерновых в 2 раза (50% прироста получено за счет внедрения новых интенсивных сортов, а 50% – за счет увеличения затрат сырьевых и энергетических ресурсов). В настоящее время в экономически развитых странах на производство 1 пищевой калории затрачивается 5…7 калорий ископаемого топлива. Однако в результате применения интенсивных технологий низкого уровня многократно усиливается локальная нагрузка на природные экосистемы, происходит механическая эрозия почв, возрастает их загрязненность минеральными удобрениями и средствами защиты растений. Возрастает и глобальная нагрузка на биосферу, в первую очередь, за счет выбросов углекислого газа: количество СО2, образовавшегося при сжигании ископаемого топлива, в несколько раз больше, чем количество СО2, ассимилированного в ходе фотосинтеза в агроэкосистемах. Одним из самых существенных недостатков интенсивных технологий является резкое снижение качества продукции (такую продукцию часто называют «экологически грязной»). Уже в 1970-е гг. стало ясно, что использование технологий низкого уровня –это тупиковый путь. Выходом из этого тупика стало использование прорывных технологий. Прорывные технологии базируются на самых современных достижениях науки и техники. В качестве прорывных эти технологии они существуют недолго: то, что вчера казалось невероятным, непривычным, фантастичным – сегодня становится обыденным, рутинным. В свое время прорывными технологиями стали технологии микробиологического синтеза (в частности, получения антибиотиков), технологии клеточной инженерии (в частности, гибридизация соматических клеток и клонирование организмов), технологии генной инженерии (в частности, получение кДНК, получение векторов переноса ДНК и создание трансгенных организмов). Прорывные, принципиально новые технологии могут быть опасными для человека и окружающей его среды, поскольку последствия их применения непредсказуемы. Внедрение прорывных технологий, как правило, сопровождается появлением новых типов продуктов и новых типов отходов. В принципе, любой новый пищевой или промышленный продукт должен проходить всестороннюю проверку на аллергенность, канцерогенность и мутагенность, на совместимость с другими продуктами, на безопасность для окружающей среды и т.д. Однако прорывные технологии, по своему определению делают такую проверку невозможной. Поэтому прорывные технологии вызывают у населения вполне понятное недоверие, как, например, в случае с внедрением в наш рацион генетически модифицированных источников (ГМИ). В дальнейшем на основе прорывных технологий создаются биотехнологии высокого уровня (или просто высокие биотехнологии). В противоположность технологиям низкого уровня, высокие биотехнологии характеризуются высокой наукоемкостью, т.е. использованием рабочих систем, полученных с использованием самых современных методов экологии, генетики, микробиологии, цитологии, молекулярной биологии. Материалы, применяемые в высоких биотехнологиях, часто нуждаются в специальной подготовке. Для реализации таких технологий требуется специальное технологическое оборудование, обслуживаемое квалифицированными специалистами. Из-за нехватки таких специалистов расширение высокотехнологичного производства сопровождается его автоматизацией и компьютеризацией. Такие технологии используются как в рамках обычного сельскохозяйственного производства, так и в других областях человеческой деятельности: в здравоохранении, в промышленности, в различных областях науки, при планировании и проведении природоохранных мероприятий. Высокие биотехнологии также делятся на экстенсивные и интенсивные. Экстенсивные высокие биотехнологии характеризуются относительно невысокой квалификацией обслуживающего персонала, относительно низкими затратами сырьевых и энергетических ресурсов. К технологиям подобного типа относится большинство микробиологических производств, технологических процессов по подготовке и переработке промышленного сырья, а также часть производства продукции на основе тканево-клеточных культур. В настоящее время эти технологии частично интенсифицируются за счет компьютеризации производства. Интенсивные высокие биотехнологии (в противоположность экстенсивным) реализуются с привлечением специалистов высочайшей квалификации, с использованием уникального оборудования и самых современных материалов. Эти биотехнологии используются в медицине, а также для создания организмов с заранее заданными свойствами. Нужно отметить, что интенсификация высоких технологий, в отличие от интенсификации технологий низкого уровня, заключается не просто в повышении их трудоемкости и повышении уровня ресурсо- и энергозатраты, а в повышении качества ресурсного и информационного обеспечения. Технологии разных уровней неразрывно связаны между собой. С одной стороны, высокие технологии базируются на технологиях низкого уровня, для их осуществления требуется определенный ресурсный, энергетический и информационный фундамент. С другой стороны, достижения высоких технологии используются на низших уровнях биотехнологических производств. Высокие технологии представляют собой величайшее достижение человеческого разума. Однако они по ряду параметров они не только не превосходят технологии низкого уровня, но даже и уступают им. В частности, высокие технологии требуют все больших и больших вложений ресурсов всех видов. Кроме того, они не решают проблемы получения экологически чистой продукции, а само биотехнологическое производство представляет собой угрозу для человека и окружающей его природной среды. Преодоление перечисленных проблем возможно только при решении комплекса задач. Поэтому современные биотехнологии необходимо развивать по следующим направлениям. 1. Повышение безопасности для человека и окружающей его среды. Для повышения безопасности биотехнологического производства необходимо создание таких рабочих систем, которые не могут функционировать в неконтролируемых условиях. Например, штаммы кишечной палочки, используемые в биотехнологии, лишены надмембранных структур (оболочек); такие бактерии просто не могут существовать вне лабораторий или вне специальных технологических установок. Перспективным направлением является создание и внедрение в производство ауксотрофных форм, не способных синтезировать некоторые необходимые вещества(по сравнению с нормальными, прототрофными формами). Повышенной безопасностью обладают и многокомпонентные системы из двух и более систем, каждая из которых не способна к самостоятельному существованию 2. Снижение доли отходов, внедрение ресурсосберегающих технологий. Отходами производства называются его побочные продукты, которые не могут использоваться человеком или другими компонентами биосферы (а также побочные продукты, использование которых нерентабельно или сопряжено с каким-то риском). Отходы производства могут накапливаться в пределах производственных помещений (территорий), но могут и выбрасываться в окружающую среду. Вообще-то, абсолютно безотходных технологий не существует (как не существует вечного двигателя). Однако необходимо стремиться к изменению соотношения полезный продукт/отходы в пользу полезного продукта. Этого можно достичь различными способами. Во-первых, отходам можно найти полезное применение. Во-вторых, отходы можно направить на вторичную переработку, создав замкнутый технологический цикл. И, наконец, можно изменить саму рабочую систему так, чтобы уменьшить долю отходов. 3. Снижение энергетических затрат на производство продукта, т.е. внедрение энергосберегающих технологий. Принципиальное решение этой проблемы возможно, в первую очередь, за счет использования возобновляемых источников энергии. Например, годовое потребление энергии ископаемого топлива соизмеримо с объемом чистой валовой продукции всех фотосинтезирующих организмов на Земле. Для трансформации солнечной энергии в формы, доступные для современных силовых установок, создаются энергетические плантации быстрорастущих растений. В экономически развитых странах для получения посадочного материала используются методы клеточной инженерии. Полученная биомасса используется для получения целлюлозы, биотоплива, а также биогумуса. Всесторонние выгоды подобных технологий очевидны. Использование методов клеточной инженерии для постоянного обновления посадочного материала обеспечивает получение в кратчайшие сроки большого количества растений, свободных от вирусов и микоплазм; при этом отпадает необходимость создания маточных плантаций. Снижается нагрузка на естественные насаждения древесных растений (которые в значительной мере вырубаются для получения целлюлозы и топлива), уменьшаются потребности в ископаемом топливе (которое, в общем-то, является экологически грязным, поскольку при его сжигании образуются недоокисленные вещества). В ходе фотосинтеза солнечная энергия непосредственно преобразуется в энергию биотоплива – без всякого рода технических преобразователей энергии, для изготовления которых требуются полупроводниковые материалы и цветные металлы. Кроме того, при фотосинтезе связываются углекислый газ и водяные пары, то есть снижается содержание в атмосфере важнейших факторов парникового эффекта. При уборке урожая часть углерода вместе с корнями (а также лиственным опадом, элементами ризосферы и органическим веществом, преобразованным фитофагами) остается в почве – этот углерод на длительное время изымается из глобального цикла. При сжигании биотоплива образуются углекислый газ и водяные пары, которые поступают в атмосферу, но вновь связываются растениями на энергетических плантациях. 4. Снижение доз минеральных удобрений и доз химических средств защиты растений. Минеральные удобрения и ядохимикаты не только ухудшают качество сельскохозяйственной продукции, но и наносят колоссальный ущерб природным экосистемам. Преодолеть негативные последствия химизации сельскохозяйственного производства можно различными способами. В первую очередь, необходимо отказаться от монокультур – использования ограниченного набора биотипов (сортов, пород, штаммов). Недостатки монокультуры были выявлены еще в конце XIX столетия; они очевидны. Во-первых, в монокультуре возрастают конкурентные отношения между выращиваемыми организмами; в то же время, монокультура оказывает лишь одностороннее воздействие на конкурирующие организмы (сорняки). Во-вторых, происходит избирательный вынос элементов минерального питания, что ведет к деградации почв. И, наконец, монокультура неустойчива к патогенам и вредителям. Поэтому монокультуры в течение XX века поддерживались за счет исключительно высокой интенсивности производства. Разумеется, использование монокультур интенсивных сортов (пород, штаммов) упрощает разработку технологии производства продукции. Например, с помощью высоких технологий созданы сорта растений, устойчивые к определенному пестициду, который при возделывании именно этих сортов можно применять в высоких дозах. Однако в этом случае уже нет смысла говорить о безопасности такой рабочей системы для человека и окружающей его среды. Кроме того, рано или поздно появятся расы патогенов (вредителей), устойчивые к данному пестициду. Поэтому неизбежен планомерный переход от монокультуры к многокомпонентным (поликлональным) композициям, включающим разные биотипы культивируемых организмов, которые иначе называют культиварами (от англ.cultivated varieties – культивируемые разновидности). Многокомпонентные композиции должны включать культивары с разным ритмом развития, с различным отношением к динамике физикохимических факторов среды, к конкурентам, патогенам и вредителям. В генетически гетерогенных системах возникают компенсаторные взаимодействия особей с различными генотипами. В первую очередь, это снижает уровень внутривидовой конкуренции и автоматически увеличивает давление культивируемых организмов на конкурирующие организмы других видов (сорняки). По отношению к патогенам и вредителям такая гетерогенная экосистема характеризуется коллективным групповым иммунитетом, который определяется взаимодействием множества структурных и функциональных особенностей отдельных биотипов. Таким образом, гетерогенные биологические системы обеспечивают возможность непрерывного и неистощительного природопользования с минимальными затратами минеральных удобрений и химических средств защиты растений. Разумеется, создание многокомпонентных композиций предполагает дальнейшее развитие высоких технологий, комплексное экспресс-тестирование полученных рабочих систем, немедленное их внедрение в сельскохозяйственное производства и в другие разделы биотехнологии. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ РОЛЬ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ В СЕЛЕКЦИИ РАСТЕНИЙ. ВОЗМОЖНОСТИ И ДОСТИЖЕНИЯ Лектор: ст.п. Мамедова М. З. План: 1. Введение 2. Возможности и достижения генетической инженерии 3. Сочетание методов селекции и генетической инженерии растений 4. Ограничения и опасности генетической инженерии "Между крайними точками зрения лежит не истина, а проблема». И.В. Гете "Наука в гораздо большей степени представляет собой вопрос как видеть, чем что видеть». L. Croizat (1964) Главное внимание уделено сочетанию методов адаптивной системы селекции растений и трансгеноза. Показано, что в современной селекции генетическая инженерия может выполнять хотя и важную, но лишь вспомогательную роль. Рассмотрены ограничения генетической инженерии, а также возможные эволюционные, биологические и экологические последствия широкого использования генетически модифицированных организмов. Обсуждаются вопросы государственного регулирования в области генно-инженерной деятельности. Современные подходы к управлению генотипической изменчивостью в селекции растений основаны на положениях экологической генетики об особенностях формирования и функционирования адаптивного потенциала высших организмов. В числе таковых принципиально новые взгляды на роль мутаций и рекомбинаций у цветковых растений; на генетическую природу структурной организации и функционирование количественных признаков; на растение как интегрированную систему генетических детерминантов ядра и цитоплазмы (всего идиотипа), а не мешка горошин-генов менделирующих признаков; роль абиотических и биотических условий внешней среды, выступающих не только в качестве факторов отбора (функция сепарации), но и индукторов мутационной и рекомбинационной изменчивости организмов. Таким образом, речь идет о несостоятельности представлений об онтогенетической адаптации высших растений как "реестре" конститутивных и приспособительных признаков, о якобы свободном комбинировании признаков при скрещивании, то есть неограниченной генотипической изменчивости и ее достаточности, о возможностях сохранения генофонда в условиях его экологической пассивности (по принципу "эрмитажа", "ноева ковчега" и даже стержневой коллекции) и т.д. Можно считать доказанным, что целостность генома вида (а во многих аспектах и сорта) защищена каскадом генетических систем, канализирующих процессы генетической изменчивости и ограничивающих спектр доступных естественному и искусственному отбору рекомбинантов (особенно интрогрессивных и трансгрессивных). Другими словами, status quo генофонда высших эукариот количественно и качественно поддерживается множеством механизмов. Разумеется, роль канализированности генетической изменчивости, весьма относительная при естественной эволюции, оказывается существенной в селекции, когда на создание новых сортов растений со все большей урожайностью и комплексом хозяйственно ценных признаков отводятся лишь считанные годы. Бесспорно, мы еще весьма далеки от полного использования той генетической изменчивости, которая обеспечивается за счет традиционных методов селекции. Однако необходимость расширения и качественного изменения спектра доступной отбору генотипической изменчивости культурных растений стала очевидной и неотложной. В настоящее время в дискуссиях по проблемам генетической инженерии основной упор делается на критериях, показателях и методах оценки пищевой безопасности генетически модифицированных организмов (ГМО) и получаемых из них продуктов. Между тем главное внимание, на наш взгляд, должно быть уделено эволюционной, биологической и экологической безопасности ГМО. Вся история развития сельского хозяйства (да и цивилизации в целом) многократно доказывала пагубность подмены широкого научного базиса узким сиюминутным прагматизмом и всякого рода целесообразностью (экономической, политической, конъюнктурной и пр.). Санитарно-гигиеническая и медико-биологическая экспертизы играют хотя и важную, но только вспомогательную роль, когда речь идет об эволюции организмов, действительно управляемой волей человека. Кроме того, следует соотносить угрозу голода (которая вполне реальна) с действительными возможностями биоинженерии вообще и генетической инженерии, в частности, в обеспечении продовольственной безопасности населения в предстоящий период. Генная инженерия - хотя и исключительно важный, но лишь один из многочисленных методов управления генетической изменчивостью организмов, широко используемых в селекционной практике. И если число трансгенных сортов в настоящее время исчисляется десятками, то обычных десятками тысяч и охватывает не 150, а свыше 5 тыс. культивируемых видов растений. Задачи традиционной селекции значительно шире: они включают как продукционные, так и средоулучшающие направления, а также введение в культуру новых видов. И наконец, современные методы селекции позволяют манипулировать одновременно десятками признаков, включая полигенные, тогда как возможности трансгеноза ограничиваются единичными генами. Такое действительно выдающееся достижение человеческого разума, как генетическая инженерия, не нуждается в вымыслах и преувеличениях, которые и без того усиливают чувство неуверенности людей при использовании продуктов, производимых с помощью ГМ-растений и животных. Очевидно, что наряду с принципиально новыми возможностями, которые связаны с передачей наследственной информации между таксономически отдаленными организмами (принадлежащими к различным царствам, родам, семействам и видам), будет постоянно увеличиваться и число направлений, по которым методы генной инженерии будут интегрироваться в современную технологию селекции растений. Возможности и достижения генетической инженерии "Неверно считать, что вся биология может сжаться в одну последовательность ДНК". К. Grene (1971) Еще в 1970-х годах генетическая инженерия обсуждалась в духе чудес F. Hoyle, предсказывавшего в XIX веке возможность получения гибридов между растениями и животными. Изначально термин "генетическая инженерия" применяли для обозначения целенаправленной манипуляции наследственными детерминантами с целью изменения существующих видов. В настоящее время этим термином обычно обозначают генетические манипуляции, с помощью которых формируется организм, имеющий новую комбинацию наследуемых признаков. Заметим, что в смысле управления наследственностью "генетическую инженерию" использовали в течение тысячелетий безымянные селекционеры, благодаря которым еще в эпоху неолита и было введено в культуру абсолютное большинство возделываемых в настоящее время видов растений. Следует признать, что биоинженерия в отличие от традиционных методов селекции обладает наибольшей возможностью технологизировать достижения в области фундаментальных знаний, и в частности молекулярной биологии. Кроме того, методы биотехнологии являются качественно новым инструментом для непосредственного изучения структурно-функциональной организации генетического материала. А это в свою очередь позволяет предположить, что генетическая инженерия растений окажет наибольшее влияние при селекции на такие адаптивно и хозяйственно ценные признаки, как интенсивность чистого фотосинтеза, индекс урожая и др. Наиболее перспективные направления в области защиты растений включают получение трансгенных сортов, устойчивых к гербицидам и вредным видам, биопестицидов, новых форм микроорганизмов и др. Очевидно также, что сама генетическая инженерия, став экспериментальным полигоном эволюции, будет непрерывно совершенствоваться и усложняться, расширяя возможности человека в целенаправленном преобразовании организмов. И вполне вероятно, что дальнейшее развитие методов молекулярной биологии, в том числе трансгеноза, позволит поднять современную селекцию растений на качественно новый уровень. И все же адаптивная система селекции растений, базирующаяся на мобилизации генофонда, управлении наследственностью, сортоиспытании и семеноводстве, и в обозримом будущем будет обеспечивать повышение величины и качества урожая сельскохозяйственных культур на бoльшей части земледельческой территории Земли. При этом именно селекционеры растений будут выполнять роль стратегов в улучшении сельскохозяйственных культур и обеспечении продовольственной безопасности, осваивая новые, в том числе и трансгенные технологии. Поэтому ближайшая проблема в области селекции состоит в том, чтобы интегрировать и скооперировать усилия селекционеров и молекулярных биологов для решения общей задачи - повышения величины и качества урожая, ресурсоэнергоэкономичности, экологической надежности, безопасности и рентабельности растениеводства. Однако исследования в области генетической инженерии несут с собой не только радужные ожидания. Они подчас оказываются столь же опасными, сколь и выгодными. Вот почему генетическая инженерия стала самым мощным возбудителем спокойствия мировой общественности в начале XXI столетия. Связано это с тем, что, как и любое другое судьбоносное для Homo sapiens направление науки, генетическая инженерия может иметь не только позитивные, но и негативные последствия. И главная трудность заключается в том, что мы пока не в силах точно спрогнозировать в долговременной перспективе все последствия ее широкого использования. Хотя разделение сложного целого на составляющие элементы и является почти универсальным подходом (методом) в биологических исследованиях, структура не может быть важнее функции, а независимые компоненты совокупности сами по себе не характеризуют целое, которое фундаментально отличается от составляющих частей. Вот почему даже выдающиеся достижения в области молекулярной биологии не способны объяснить сущности биологических явлений на уровне жизни. XXI век - действительно век биологии, но это вовсе не означает, что биология как наука о закономерностях органической жизни исчерпывается представлением только о ее молекулярном уровне организации и преобразовании. Между тем при обсуждении возможностей генетической инженерии все больше доминирует тенденция недооценивать сложность, а также динамический и непрерывный характер "живых явлений" и преувеличивать роль отдельных генов в определении способности организмов к адаптации, в том числе за счет саморегуляции. Односторонний структуралистский подход, ориентирующий на манипуляцию отдельными генами, кодирующими "признаки с определенными функциями", и рассматривающий онтогенез в качестве их "реестра", позволяет решить лишь небольшую, причем далеко не самую главную часть современных селекционных задач. Что же касается ответа на фундаментальный вопрос, может ли реальный мир быть лучше объяснен с функционалистской или структуралистской точки зрения, то очевидна неправомерность игнорирования интегрированности процесса биологической адаптации, определяющей эволюционную сущность всего живого. Современная селекция растений - это научно обоснованная технология управления наследственностью и изменчивостью высших эукариот, позволяющая реализовать социально-экономические, экологические, дизайно-эстетические и другие цели. Являясь средством биологического контроля над адаптивными и адаптирующими реакциями растений с целью непрерывного увеличения их продукционных и средообразующих возможностей, адаптивная система селекции технологизирует достижения как прикладных, так и фундаментальных знаний. Другими словами, селекция выступает в качестве синтетической дисциплины, широко использующей достижения физиологии, биохимии, почвоведения, микробиологии, цитогенетики, экологии и других наук и функционально объединяющей этапы мобилизации генофонда, самой селекции, сортоиспытания и семеноводства, агроэкологического районирования и конструирования агроэкосистем. Анализ роста урожайности в XX веке показывает, что наряду с минеральными удобрениями, пестицидами и средствами механизации основную роль в этом процессе сыграло генетическое улучшение растений. Так, вклад селекции в повышение урожайности важнейших сельскохозяйственных культур за последние 30 лет оценивают в 40-80 %. Именно благодаря селекции на протяжении последних 50 лет, например в США, была обеспечена ежегодная прибавка урожая в размере 1-2 % по основным полевым культурам. Имеются все основания считать, что в обозримом будущем роль биологической составляющей, и в первую очередь селекционного улучшения сортов и гибридов, в повышении величины и качества урожая будет непрерывно возрастать. Сочетание методов селекции и генетической инженерии растений Рекомбинационная селекция обеспечивает непрерывное расширение спектра доступной отбору генетической изменчивости хозяйственно ценных и адаптивно значимых признаков, в том числе постоянное увеличение числа идентифицированных генетических доноров потенциальной урожайности и экологической устойчивости. Для этого широко применяют методы эндогенного и экзогенного индуцирования генетической изменчивости, преодоления половой несовместимости между видами одного семейства, гаметофитного отбора, позволяющего на основе больших популяций пыльцы идентифицировать на искусственных фонах генотипы, функционально эквивалентные искомым спорофитам и т.д. Рассматривая возможности интеграции адаптивной системы селекции и генетической инженерии следует прежде всего определить принципиально новые приоритеты самой селекции растений, вытекающие из современного понимания: - роли интегрированности генома и всего идиотипа у высших эукариот, проявляющейся в формировании блоков коадаптированных генов и сохранении их status quo при передаче наследственной информации от одного поколения другому; -необходимости перехода от управления изменчивостью моногенных признаков к комбинаторике количественных (полигенных) признаков, многие из которых относятся к хозяйственно ценным; - первостепенной роли мейотической рекомбинации (а не мутаций) в формировании потенциальной, свободной и доступной отбору генетической изменчивости у цветковых растений; - роли абиотических и биотических факторов внешней среды, определяющих не только направление и темпы естественного отбора ("формирующее" влияние биоценотической среды), но и выступающих в качестве индукторов генетической изменчивости (мутационной, рекомбинационной, репарационной, транспозиционной); - необходимости сочетания в сортах и гибридах высокой потенциальной продуктивности, устойчивости к действию абиотических и биотических стрессоров, а также продукционных и средообразующих (почвоулучшающих, фитомелиоративных, фитосанитарных, ресурсовосстанавливающих, дизайно-эстетических и др.) функций; - важности развития новых направлений селекции, включая фито(био)ценотическое, биоэнергетическое, экотипическое, экологическое, симбиотическое, а также апомиктическое, гаметное и др. ; - возможности использования "доместикационного синдрома" с целью введения в культуру новых видов и экотипов растений (экологическая и экотипическая селекция). В то же время современная селекция характеризуется целым рядом трудностей и нерешенных проблем, к числу важнейших из которых можно отнести следующие: 1. Чем больше признаков селекционер стремится объединить в одном сорте или гибриде, тем ниже темпы искусственного отбора, тем больше времени требуется для создания нового сорта. Наличие отрицательных генетических и биоэнергетических по своей природе корреляций между признаками существенно снижает темпы создания новых сортов. 2. Возможности традиционной селекции особенно ограничены при использовании зародышевой плазмы таксономически неродственных и отдаленных видов. Основным препятствием при этом являются генетически детерминированные презиготические и постзиготические барьеры. При использовании в качестве доноров ценных признаков диких родичей культурных растений продолжительность и масштабы селекционного процесса резко возрастают. 3. Дальнейший рост урожайности по важнейшим культурам сдерживается уже достигнутым высоким индексом урожая (0,5-0,8). 4. Усиление зависимости вариабельности величины и качества урожая от нерегулируемых факторов внешней среды, доля которых по основным зерновым культурам превышает 60 %. 5. При внесении больших доз минеральных удобрений и мелиорантов, использовании полного набора пестицидов и средств механизации происходит экспоненциальный рост затрат исчерпаемых ресурсов на каждую дополнительную единицу урожая, в том числе пищевую калорию, усиливается зависимость продуктивности агроэкосистем от техногенных факторов, ускоряются процессы и возрастают масштабы загрязнения и разрушения окружающей среды. 6. Антиэволюционные тенденции в селекции и конструировании агроэкосистем, проявляющиеся в увеличении генетической однородности сортов и однотипности агроценозов в противовес их агроэкологической специализации, гетерогенности и дизайно-эстетической привлекательности. 7. При интеграции селекционно-агротехнических и генно-инженерных программ в большинстве случаев оказывается неизвестной генетическая природа хозяйственно ценных количественных признаков, а также эффектов их взаимодействия. 8. Как в традиционной селекции, так и при трансгенозе использование новых генетических доноров, как правило, требует значительной предварительной селекционной работы. Анализ достижений селекции в 50-80-х годах XX столетия свидетельствует также о том, что большинство улучшенных агрономических признаков, обусловивших рост урожайности, имеет полигенный, комплексный характер. Созданы сорта и гибриды с широкой агроэкологической адаптацией, более медленным старением листьев, устойчивостью к полеганию, толерантностью цветков к абортированию в условиях жары и засухи, горизонтальной устойчивостью к болезням и др. Основное внимание в современных селекционных программах уделяется сочетанию высокой потенциальной продуктивности сортов и способности противостоять действию абиотических и биотических стрессоров. В числе основных причин такой ориентации - тенденции к увеличению разрыва между рекордной и средней урожайностью по важнейшим сельскохозяйственным культурам (обычное соотношение 4:1), повышению зависимости величины и качества урожая от применения техногенных средств, а также погодных флуктуаций (вариабельность урожайности по годам на 60-80 % обусловлена "капризами" погоды). Следовательно, дальнейшее успешное развитие селекции растений требует использования качественно новых методов, технологий и биологических концепций. Известно, что генетика количественных признаков, игнорируя реальную генетическую природу их структурной организации и функционирования, длительное время базировалась на методах, сводящих сложные признаки к простым ("главным факторам" и пр.). В дальнейшем была признана динамичность формирования количественных признаков в морфогенезе, обусловливающая многовариантность реализации матричных структур (на пути ген-признак), перераспределение экспрессии генов и блоков генов в процессе формирования сложного признака и т.д. В настоящее время количественные признаки обычно рассматривают как динамичную многовариантную целостность, выявить генетическую природу всех составляющих которой практически невозможно. Что же касается генетических маркеров (marker-assisted-selection - MAS), реализующих свой эффект в отношении количественных признаков, то их идентификация остается весьма сложной, а практическое использование в селекции ограниченным. Поскольку с помощью генетической инженерии не создают, а только улучшают уже адаптированные к определенным условиям внешней среды, а также технологиям возделывания сорта и гибриды, в комплексных селекционно-агротехнических программах должны быть изначально определены цели и этапы использования классических и биоинженерных методов управления наследственной изменчивостью при реализации той или иной морфофизиологической модели сорта (гибрида). Показано, например, что высокая адаптивность сорта озимой пшеницы Мироновская 808, получившего широкое распространение в самых разных почвенноклиматических и погодных условиях возделывания, объясняется идеальной агроэкологической "подогнанностью" его генома и цитоплазмы (плазмона), что и определяет высокую зимостойкость и гомеостатическую способность колоса, а также выносливость при загущении стеблестоя (Хангильдин, 1996). Параллельно с использованием генетического потенциала окультуренных видов, а также с учетом многочисленных неудачных попыток повысить их морозоустойчивость и зимостойкость, солеи кислотоустойчивость, скороспелость и фотосинтетическую производительность в предстоящий период особое внимание будет уделено введению в культуру новых видов (направление "смены вида"), обладающих бoльшим потенциалом конститутивной адаптивности. В число первоочередных задач при этом выдвигается "приручение" новых видов бобовых культур, в том числе клубнеплодных, кустарниковых, пастбищных, фуражных и др. Перспективно также введение в культуру новых видов масличных, зерновых, зернобобовых, луковичных и корнеклубнеплодных, многие из которых не только устойчивы к действию экологических стрессоров, но и характеризуются высоким содержанием биологически ценных веществ. При этом повышение урожайности новых культур будет обеспечиваться за счет признаков, как усиливающих потенциальную продуктивность растений, так и снижающих отрицательное действие лимитирующих величину и качество урожая абиотических и биотических факторов. Особенно большие возможности генетической инженерии открываются, на наш взгляд, в плане использования методов трансгеноза для индукции мейотической рекомбинации на основе переноса в межвидовые гибриды растений эндогенных индукторов кроссинговера (Жученко, 1980, 1988, 2001). В последние годы доказано, что перенос гена reс A в растения табака позволяет увеличить рекомбинационную изменчивость. В опытах Авдеева с соавт. (2000) установлено, что у регенерантов и гибридов трансгенных растений томата, несущих ген кристаллического белка дельта-эндотоксина, повышается частота выщепления "редких" мутаций. В наших опытах обнаружено изменение частоты рекомбинации между локусами ful-e у гибридов томата, полученных при участии трансгенной формы с Dsэлементом в 4-й хромосоме. Одновременно отмечены и изменения расщепления по фенотипическим классам (Соловьев с соавт., отчет лаборатории рекомбиногенеза ВНИИ сельскохозяйственной биотехнологии за 2002 год). В процессе интеграции методов адаптивной системы селекции и трансгеноза первостепенное внимание должно быть уделено повышению устойчивости сортов и гибридов к болезням, вредителям и сорнякам. О важности этого направления селекции свидетельствует уже тот факт, что общее число потенциально вредоносных для агроэкосистем видов достигает 80-100 тыс., в том числе свыше 30 тыс. возбудителей грибных, бактериальных и вирусных заболеваний, около 10 тыс. членистоногих и др. Несмотря на увеличение количества применяемых в сельском хозяйстве пестицидов (например в США 400 тыс. т в год) к началу XXI столетия потери урожая составляют в среднем 33 %. Общая же цена потерь урожая сельскохозяйственных растений в мире, согласно имеющимся оценкам, только от болезней достигает 50 триллионов долларов в год. В этой связи большие перспективы представляет сочетание методов традиционной селекции и трансгеноза при создании сортов с вертикальной устойчивостью, а также многолинейных и синтетических сортов. Связано это с тем, что методы генной инженерии позволяют встраивать в растение-реципиент сразу несколько разных генов устойчивости, создавая, таким образом, "пирамиду генов", обеспечивающую комплексную резистентность сорта. Однако нет оснований утверждать, что генная инженерия якобы сокращает время выведения сортов с требуемыми характеристиками (Шеламова, 2001 и др.), так как для этого всегда используют уже приспособленные к местным условиям внешней среды (почве, климату, погоде, технологиям возделывания) сорта, для создания которых необходимо 5-10 лет и более. На многих объектах установлена корреляция между признаками, проявляющимися на гаметофитном и спорофитном уровнях (Мирюта, 1967; Жученко, 1980; Кравченко с соавт., 1988 и др.). Например, экспериментально показано, что устойчивость томата к повышенной температуре (жаростойкость) коррелирует с определенным спектром эстераз в пыльце, их активностью и термостабильностью, а также характером изменчивости морфоцитохимических признаков самой пыльцы (Кравченко, 2000). При этом на гаплоидном уровне могут экспрессироваться такие признаки, выявить которые у диплоидов обычно не удается (Hollingshead, 1930; Muntzing, 1934; Katayama, 1954). Однако с переходом к отбору на гаплоидном уровне, например у кукурузы, существенно изменяется отношение между признаками (Ротаренко, 2000), что в свою очередь усложняет прогноз их проявления у диплоидов. К настоящему времени доказана возможность введения экзогенной ДНК в растения посредством прорастающей пыльцы (Чесноков, 2000). Таким образом, с помощью гаметной селекции и гаметофитного отбора можно успешно решать следующие селекционно-генетические задачи: - Улучшение показателей самих репродуктивных структур, и в частности пыльцы (изменение аэродинамических свойств и фертильности; повышение пыльцепроизводящей функции растений, а также способности пыльцы прорастать при пониженных или, наоборот, повышенных температуре, влажности, освещенности и других стрессовых ситуациях). - Изменение признаков спорофита за счет оценки и отбора генетически разнокачественных пыльцевых зерен, то есть на основе использования корреляций между признаками гаметофита и спорофита. - Оценка эндогенного (включая трансгеноз) и экзогенного индуцирования частоты и спектра рекомбинационной изменчивости, проявления признаков пыльцы у гибридов F1, характера их наследования, а также дифференциального роста пыльцевых трубок in vitro и in vivo. - Исследование особенностей проявления признаков на гаплоидном уровне, в том числе с учетом того, что у диплоидов некоторые признаки не экспрессируются. -Повышение точности гибридологического анализа за счет учета возможностей элиминации маркированных рекомбинантных микрогамет, а также изменения соотношений между фенотипическими классами растений в расщепляющихся поколениях. Поскольку гаметная селекция, базирующаяся на прямом (свойства самой пыльцы) и косвенном (корреляция между признаками гаметофита и спорофита) отборе пыльцы, позволяет значительно ускорить селекционный процесс, очевидна не только возможность, но и целесообразность сочетания методов гаметной селекции и трансгеноза. В основу такой интеграции может быть положена гибридизация трансгенных форм с сортами-реципиентами, а также использование самой пыльцы в качестве генетически модифицируемого объекта. Главные преимущества сочетания методов гаметной селекции и генной инженерии состоят, на наш взгляд, как в возможности оценки громадного числа гамет для прямого отбора искомых генотипов на специально созданных и сравнительно легко регулируемых фонах, так и в увеличении вероятности идентификации ценных спорофитов на основе корреляционного анализа (косвенный гаметофитный отбор). В интеграции методов современной селекции и биоинженерии исключительно важную роль играет возможность с помощью последней решать две принципиально разные, но одинаково приоритетные для селекции и семеноводства растений задачи: различать генотипы растений и паспортизировать сорта, а также выявлять гены, контролирующие хозяйственно ценные и адаптивно значимые признаки (Хавкин, 2000). Благодаря достижениям молекулярной биологии и популяционной генетики в настоящее время генетическая гетерогенность растений и пыльцы может быть оценена не только по агрономическим и биохимическим признакам, как это было во времена Н.И. Вавилова, но и на молекулярном уровне (изоферментный анализ, одномерный и двумерный электрофорез, рестрикция ДНК и др.). При оценке генетического разнообразия особого внимания заслуживает учет новых аллелей, а также новых сочетаний генов (с указанием географического происхождения и генеалогии образцов, их географической отдаленности, степени генеалогического родства и т.д.). О биологическом разнообразии объектов исследования можно также судить по индикаторам расстояния или дивергенции между признаками (Masson, 1986). Выбор признаков и их число в каждом конкретном случае определяют с учетом поставленной задачи, а сами признаки, в том числе продуктивности и устойчивости, оценивают в потомстве отборов. Итак, в XXI веке роль сочетания методов адаптивной системы селекции и трансгеноза в формировании величины и качества урожая, а также средоулучшающих и ресурсовосстанавливающих функций агроэкосистем может не только существенно возрасти, но и оказаться решающей при целенаправленном управлении наследственностью и изменчивостью культурных растений. При этом основополагающее значение селекции в дальнейшем наращивании производства сельскохозяйственной продукции обусловлено тем, что применение техногенных средств интенсификации в промышленно развитых странах уже достигло порога антропогенного насыщения агробиогеоценозов, а для большинства развивающихся стран остается недоступным. Поскольку уже практически полностью использованы резервы расширения площадей плодородных почв и запасов пресной воды, а затраты невосполнимых ресурсов на каждую дополнительную единицу урожая и масштабы деградации природной среды имеют постоянную тенденцию к росту, будущее цивилизации зависит от возможностей биологизации и экологизации интенсификационных процессов в системе сельскохозяйственного природопользования. Ограничения и опасности генетической инженерии "Не навреди, не ищи выгоды, советуйся с коллегами и соблюдай высокую мораль". Бессмертные принципы клятвы Гиппократа При оценке возможностей генетической инженерии важно учитывать те ограничения и опасности, которые вытекают из законов генетической и экологической изменчивости живых организмов. Известно, что генетическая сложность цветковых растений на много порядков выше, чем бактерий. При этом барьеры, обусловливающие половую несовместимость и инконгруентность у высших растений, весьма многочисленны и вовсе не исчерпываются известными презиготическими и постзиготическими механизмами. Поскольку многие закономерности генетической инженерии остаются до конца неизвестными и мы не знаем, сколько времени потребуется на их познание, было бы весьма опасным пренебрегать традиционными методами селекции, которые сегодня, действительно, "кормят" население Земли. Высоко оценивая роль генетической инженерии в селекции растений, особенно в плане преодоления межвидовых и даже межродовых барьеров несовместимости, следует, однако, учитывать и ограничения, обусловленные следующими причинами: 1. Большинство хозяйственно ценных и адаптивно значимых признаков являются полигенными по своей природе, более того, они контролируются коадаптированными в масштабе хромосом, генома и даже идиотипа ядерными и цитоплазматическими детерминантами; из более чем 50 тыс. генов, контролирующих идиотип высшего растения, лишь у некоторых видов изучены 200-300 генов (локализация в хромосомах); большинство адаптивно и хозяйственно значимых полигенных признаков остаются генетически не идентифицированными и биохимически не охарактеризованными; методы генетической инженерии разработаны только для небольшого числа культур и т.д. Наиболее распространенной ошибкой является отождествление гена с признаком. Однако именно на этом базируется рабочая концепция трансгеноза как метода "переноса генов". Между тем любой ген - это лишь одна из важнейших, но не единственная предпосылка проявления признака, в том числе его пенетрантности, экспрессии, плейотропных эффектов и т.д. 2. Неопределенность конечного результата трансгеноза (как и при индукции мутаций) и ограниченные возможности переноса искомых генов. Эта ситуация обусловлена рядом причин: - отсутствие методов сайт-направленной интеграции генов, или вставки интродуцируемых генов в определенный сайт ДНК-хозяина. Между тем без точной и мишень-направленной генной хирургии (targetoriented gene-surgery) тДНК будет встраиваться в геном растения-хозяина случайно; - быстрый выход из строя ГМ-растений, полученных на основе бактериальных генов, под воздействием систем инактивации чужеродной ДНК, с помощью которых растения обычно защищаются от вторжения вирусов (silensing - подавление активности трансгенов); - наряду с чужеродным геном трансгенные растения нередко несут и немало "строительного мусора", включающего нежелательные генетические элементы вектора (маркерные гены и пр.); - невозможность использования Agrobacteria для переноса генов с помощью Ti-плазмид в однодольные растения, к которым принадлежат многие хозяйственно ценные виды; - поиск генных векторов для хлоропластов и митохондрий, так как Tiплазмиды переносят гены исключительно в ядро; - недостаточные знания о структуре, функциях и регуляции генов, определяющих большинство хозяйственно ценных и адаптивно значимых признаков. Остается также неисследованным влияние трансгеноза на экспрессию собственных генов хозяина (реципиента); место интеграции ДНК в геноме хозяина при безвекторном варианте переноса оказывается случайным; возможны феномены запуска (индукция) непрогнозируемых событий "инсерционного" мутагенеза, усиления вариабельности трансгенной экспрессии, а также проявление нежелательных плейотропных эффектов трансгена. Опасность случайности генно-инженерных последствий связана и с тем, что чужеродные гены могут активировать "молчащие" гены, а также индуцировать эндогенные системы мейотической и митотической рекомбинации. 3. Каждый вид, организм и даже клетка имеют мощную противоинформационную защиту (системы узнавания и репарации, подавляющие функционирование экзогенной ДНК). Кроме того, у высших эукариот функционирует весьма сложная и многоэшелонированная регуляция экспрессии генома (включающая транскрипционный и посттранскрипционный уровни), причем каждый уровень многократно задублирован. Наличие этого механизма, с одной стороны, предотвращает получение эволюционно неапробированных генетических вариантов, то есть усиливает биобезопасность трансгеноза, а с другой, - сдерживает получение нетрадиционных генетических вариантов, что является главной задачей самой генетической инженерии и селекции в целом. 4. Широко известны многие нетрадиционные пути обмена генетической информацией между организмами, принадлежащими к разным систематическим группам: трансдукция (встраивание и перенос вирусом фрагментов чужеродной ДНК), трансформация (естественная или искусственная передача признаков и ДНК от одного организма к другому), обратная транскрипция и др. В числе природных векторов, способных переносить информацию от одного вида к другому, - плазмиды, вирусы, транспозоны, инсерции (Кордюм, 1982). Например, плазмиды могут переносить самые различные признаки - от патогенности грибов до фертильности или стерильности растений. Подробно исследован перенос генов из бактерий в грибы, растения и клетки млекопитающих. В результате возможно не только локальное, но и глобальное нарушение экологического равновесия в естественных и антропогенных экосистемах. Вместе с тем, например, спутниковые сорные виды и расы пшеницы, ячменя, овса, риса, рапса, сорго, подсолнечника, земляники, редиса, моркови, лука и других культур (всего около 50 видов) являются "резервуарами" генетического разнообразия и составляют основу интрогрессивного обогащения генофонда соответствующих культурных видов растений. При этом интрогрессия у ряда культур достигает 30-50 % и более, а возможность передачи пластидного материала пыльцой у некоторых видов растений делает незащищенной не только ядерную, но и цитоплазматическую наследственность. Особенно велика вероятность перекрестного опыления у аутбридинговых и в первую очередь энтомофильных видов растений. Определенную опасность представляет и неконтролируемое распространение семян самих трансгенных растений. Важно также учитывать, что сохранение, например, свойств гербицидоустойчивости в ауткроссинговых популяциях диких сородичей не требует постоянного давления гербицидного фона. Уже известно более 40 видов сорных растений, которые очень быстро приобрели устойчивость к производным сульфонилмочевины. Зарегистрирован ряд видов злаковых и бобовых сорняков, устойчивых к глифосату. Кроме того, широкое распространение гербицидоустойчивых сортов увеличивает не только масштабы применения гербицидов и вытеснения альтернативных методов борьбы с сорной растительностью (многовидовые севообороты, разные способы обработки почвы, безгербицидные технологии и т.д.), но и способствует обеднению видового состава полезной энтомо- и орнитофауны в агроэкосистемах, а также загрязнению природной среды и пищевых продуктов. Особую опасность в этой связи представляет разрушение механизмов и структур биоценотической саморегуляции агроландшафтов, что неизбежно приводит к дальнейшему увеличению затрат пестицидов на защиту агроценозов от вредоносных видов. В результате образуется замкнутый порочный круг, при котором наносится все больший ущерб экологической безопасности человека. С учетом вероятности и опасности неконтролируемого переноса наследственной информации генетически модифицированных культурных растений к их диким сородичам, в том числе сорнякам, важно учитывать следующие особенности гаметофитного отбора: конкурентная способность пыльцы является наследуемой и играет важную роль в эволюции покрытосеменных, обусловливая неслучайное опыление; степень конкурентоспособности пыльцы влияет на фенотип потомства, может увеличивать число и энергию прорастания семян, усиливать рост сеянцев; пыльцевая функция культурных растений обычно ослаблена по сравнению с дикорастущими видами и полукультурными разновидностями; между проявлением хозяйственно ценных и адаптивно значимых признаков на гаметофитной и спорофитных стадиях роста растений может существовать как положительная, так и отрицательная корреляция. Очевидно, что если трансформируемый ген прямо или косвенно усиливает конкурентоспособность пыльцы (а этой возможностью в гаплоидной пыльце обладают и рецессивные аллели) или спорофита (начиная с прорастания семян), то он будет подхвачен естественным отбором и может предопределять доминирование соответствующих генотипов в гетерогенных популяциях. Вероятность "утечки" трансгенной информации зависит от степени совместимости культурного вида и базисного сорта с дикими, в том числе сорными, видами, характера размещения последних во времени и пространстве (малые или большие группы), а также расстояния, на которое может быть перенесена соответствующая пыльца и др. В повышении вероятности такого переноса особенно большую роль будут играть полиплоидные формы дикорастущих видов растений, способных как "губка" впитывать экзогенную наследственную информацию. В настоящее время широко используют устойчивые к вредителям трансгенные растения, в том числе с высоким содержанием Bt-токсина, который может переноситься с пыльцой и фитофагами в другие организмы экосистемы. Попадая в ризосферу, Bt-токсин способен накапливаться в почве, оказывая влияние на биогеоценоз и грунтовые воды. Трансгенные культуры, устойчивые к фитовирусам, могут изменять вирулентность существующих вирусов, приводить к появлению новых вирулентных штаммов. Возможен также прямой перенос генов вирусоустойчивости от трансгенных растений к диким сородичам. В результате неконтролируемого переноса трансгенов, появления устойчивых к гербицидам и эндотоксинам вредоносных видов, снижения биологического разнообразия агроценозов может быть существенно нарушено экологическое равновесие в агроэкосистемах. Не случайно, например, в США для предотвращения или снижения темпов естественного отбора вредных насекомых, устойчивых к Bt-токсинам, создают "убежища" для полезной энтомофауны из обычных сортов той же культуры. Вероятность неконтролируемого распространения трансгенов значительно возрастает и в результате индуцированного рекомбиногенеза. Известно, что рекомбинация является главным механизмом передачи трансформированных генов близкородственным видам высших эукариот (совместимых при половом скрещивании). Однако показано, что при действии экологических стрессоров могут увеличиваться не только частота и спектр кроссоверов, но и идти отбор на увеличение рекомбинационного потенциала популяции (Жученко с соавт., 1985; Parsons, 1988). А это в свою очередь означает, что в неблагоприятных и особенно экстремальных условиях внешней среды рекомбинационная изменчивость растений, включая передачу трансформированных генов, может быть значительно увеличена. 5. Все возрастающие масштабы использования ГМ-растений требуют более тщательного рассмотрения вопроса о связи биологического разнообразия агроэкосистем с их генетической и экологической уязвимостью. Известно, что непрерывное использование лучших сортов в качестве исходного селекционного материала приводит к концентрации в селекционном пуле генов, полученных из ограниченных коммерческих источников. Последние в большинстве случаев не включают представленные на уровне соответствующего вида аллели того или иного признака. Генетическое разнообразие, возможно, будет снижаться также по мере того, как трансгенные сорта начнут занимать все бoльшие площади. В результате генетическая база некоторых важнейших видов растений может оказаться крайне узкой, что неизбежно повысит опасность массового поражения фитоценозов вредными видами. Очевидно, что имеющиеся генно-инженерные варианты одного и того же признака пока несопоставимы с соответствующим аллельным полиморфизмом, представленным в коллекциях местных сортов, примитивных форм и т.д. Так, в семенном банке CIMMYT в Мексике хранится и поддерживается 13000 линий кукурузы. По мере увеличения идентифицированной по ценным признакам части коллекции генетическое разнообразие исходного материала постоянно увеличивается. Однако большинство геноисточников не может быть использовано непосредственно и необходима большая работа по их предварительной селекции. Это же обстоятельство ограничивает биоразнообразие и трансгенных вариантов. 6. Особую опасность представляет повсеместное использование неизбирательности гербицидов и энтомотоксинов, что неизбежно приведет (и уже приводит) к эффекту "пестицидного бумеранга". Так, при широкомасштабном и длительном применении гербицидов с одним и тем же спектром действия (типа раундап) малораспространенные, но не чувствительные к гербицидам сорные виды растений могут оказаться в агроценозах доминирующими. Считается, что только за последние годы десятки видов сорных растений сравнительно быстро приобрели устойчивость к производным сульфонилмочевины. Аналогичные эффекты "пестицидного бумеранга" известны при длительном применении однотипных инсектицидов и фунгицидов. Из-за повышения пестицидоустойчивости растений приходится увеличивать дозы химикатов, что в свою очередь резко снижает возможность экологически безопасного и рентабельного использования химических средств защиты растений. Кроме того, широкое применение пестицидов сплошного спектра действия является причиной нарушения трофических связей и экологического равновесия в агробиогеоценозах. 7. Международные корпорации ("Монсанто", "Доу Хемикал", "Новартис" и др.), в которых в настоящее время сосредоточена основная часть работ по генетической инженерии растений, стремятся к монопольному контролю за рынком сортов-семян, а следовательно, и за рынком продовольствия. Так, фирма "Монсанто" владеет 94 % всех трансгенных растений, выращиваемых в мире. Известно также, что гербицид раундап был создан на этой фирме в конце 70-х годов на основе глифосата. Со времени внедрения сортов сои, устойчивых к раундапу (1995), использование этого гербицида возросло с 20 до 62 % (2000) общей площади, обрабатываемой гербицидами. На 52,6 млн га, занятых ГМ-растениями, преобладают глифосатоустойчивые сорта сои, кукурузы, хлопчатника, масличного рапса, доля которых составляет 85 %; остальная часть - Bt-защищенные культуры. Начиная с 70-80-х годов прошлого столетия идет быстрое слияние крупных химических, фармацевтических и энергетических компаний с селекционно-семеноводческими фирмами. Между тем сугубо коммерческие интересы транснациональных компаний ограничивают число сортов и гибридов, реализуемых во всем мире, что неизбежно снижает генетическое разнообразие агроэкосистем. Другими словами, монополизация в области биотехнологического бизнеса, в том числе собственности на трансгенные сорта (эксклюзивные права на сою как культуру, семена и разновидности этого растения; создание частных банков генов и т.д.), при которой получение прибыли является самодавлеющим фактором, может иметь крайне отрицательные последствия для всего мирового сообщества. 8. По своей сути генетическая инженерия относится к числу двойных технологий. Так, некоторыми фирмами были начаты разработки "терминаторных технологий", имеющих своей целью ограничение продолжительности жизнеспособности семян и, таким образом, обеспечение физической защиты авторских прав создателей трансгенных растений. В дальнейшем "по политическим соображениям" эти работы были прекращены. И все же возможности практической реализации "терминаторных технологий" на основе использования методов генетической инженерии очевидны. Справедливости ради следует, однако, заметить, что "терминаторные технологии" могут быть разработаны и методами традиционной селекции. В этой связи специального рассмотрения заслуживает синдром дисгенеза у растений, вызываемый гаметоцидными генами. Так, Endo с соавт. (1975) установили, что несколько видов рода Triticum, имеющих геномы C, S или S1 Aegilops, содержат гаметоцидные гены, которые были внесены в геном пшеницы в результате гомологичного спаривания хромосом или добавления чужеродной хромосомы. В случаях, когда гаметоцидные гены или хромосомы видов рода Aegilops (A. speltoides, A. sharonensis, A. longissima, A. triuncialis) присутствуют в гетеро- или гемизиготном (моно-сомном) состоянии в геноме мягкой пшеницы, они вызывают разрыв хромосом и мутации, мужскую или женскую стерильность, сморщивание семян. При этом если гаметоцидный ген Gcl, полученный из A. speltoides, вызывает стерильность, сморщивание семян и мутации у растений F1, то гаметоцидные хромосомы обусловливуют стерильность. В "терминаторных технологиях" может быть использована и различная скорость роста пыльцевых трубок, определяющих мужской и женский пол, что получило специальное название "сертация". В некоторых случаях сертацию вызывают гаметофитные факторы (у ряда видов растений идентифицированы десятки соответствующих локусов). Однако число причин, обусловливающих различную конкурентоспособность пыльцевых зерен и изменение соотношения полов, значительно больше. Так, в этом же ряду факторов находится асинхронность развития зародышевых мешков и прохождения стадии эмбриогенеза, в результате чего на этапе оплодотворения снижается завязываемость семян. 9. Наибольшую тревогу ученых, промышленников и законодателей вызывает использование трансгенных растений в полевых условиях (спонтанный перенос генов), а также употребление конечных продуктов трансформированных (трансгенетически модифицированных) растений. Особую опасность представляет возможное влияние ГМО на аллергические реакции человека. К настоящему времени идентифицированы сотни индукторов аллергии, от которой страдает около 10 % населения. Необходима тщательная оценка потенциальной аллергенности трансгенных растений и полученных из них продуктов. Причиной токсичности соответствующего белкового продукта может также служить экспрессия маркерных (репортерных) генов. Поскольку аллергенный потенциал привнесенного с помощью трансгеноза белка в растение-реципиент обусловлен большим числом факторов, применение даже всех имеющихся на сегодня методов тестирования аллергенности не может дать полную гарантию пищевой безопасности ГМ-продукта (Семенюк, 2001), тем более, что широко используемые сельскохозяйственные растения содержат более десятка тысяч различных белков, часть из которых является аллергенами. Сложность методов контроля многочисленных возможных последствий широкого использования трансгенных организмов хорошо известна. Так, в Германии проверка на безвредность генетически измененных растений, животных и микроорганизмов продолжается от 5 до 6 лет. В то же время реальная ценность многих оценок (аналогичных испытаниям пестицидов) остается весьма сомнительной. Обусловлено это несовершенством методов определения безопасности (риска) использования ГМ-растений, связанным со слабой пока научной базой экологических, медико-биологических и токсиколого-гигиенических оценок последствий широкого распространения трансгенных растений и Bt-защищенных культур. В этой связи практически невозможно доказать как полную безопасность использования трансгенных растений, так и проверить возможные негативные последствия. Противоречивые оценки последствий ГМ-продукции связаны не только с их возможным влиянием на здоровье и окружающую среду, но и неоднозначным отношением к этому вопросу людей по нравственным и религиозным соображениям. А это в свою очередь предполагает широкое привлечение всего массива соответствующих знаний, в том числе обоснованных "общих соображений" и "здравого смысла". Для этого, однако, необходимо выйти за пределы медико-гигиенических проблем использования ГМО, включив эволюционные, социально-экономические и морально-этические критерии оценок. Недопустимо, во всяком случае, чтобы интересы межнациональных корпораций были выше интересов всего общества, а население бедных стран служило в качестве дешевого испытательного полигона для ГМ-продукции. Исторический опыт развития цивилизации свидетельствует о том, что когда достижения науки используют главным образом с позиций политической и экономической целесообразности, преграда, отделяющая добро от зла, действительно оказывается хрупкой и ненадежной (Лопухин, 2001). 10. Обычно при обосновании безопасности использования ГМО, в том числе трансгенных растений, ссылаются на аналоги, происходящие в природной среде (спонтанное скрещивание между близкородственными видами растений; перенос генов между видами с помощью плазмид, вирусов и пр.). Действительно, имеются многочисленные доказательства горизонтального переноса генов в процессе эволюции растений. Считается, например, что хлоропласты произошли эндосимбиотически от фотосинтетических бактерий, то есть от общего предка (Jacob, 1982). Наряду с ранним переносом ( 400 млн лет тому назад) от общего прародителя гена tuf A, который кодирует синтез белка (EF-Tu) в хлоропластах, был обнаружен ген rpl 22, перенесенный примерно 50 млн лет тому назад от общего прародителя бобовых из хлоропласта в ядро и детерминирующий синтез фибросомного белка (L22) (Ganit с соавт., 1984). Вместе с тем при обсуждении примеров горизонтального переноса генов обычно замалчивается тот факт, что наряду с положительными природными аналогами имеются и негативные примеры. 11. К числу опасностей широкого использования ГМ-растений относят возможность влияния целенаправленного изменения содержания какого-либо одного белка на изменение других белков. Показано также, что в полевых условиях устойчивая к глифосату трансгенная соя неожиданно оказалась чувствительной к действию высоких температур (Gertz с соавт., 1999). Широкое использование трансгенных растений, обеспечивающих устойчивость к вредным насекомым за счет синтеза специфических белковых токсинов (эндотоксины Bt), а также протеолитических ферментов, осложняется крайне низкой эффективностью экспрессии интродуцированных генов вследствие нестабильности матричной ДНК. Так, обычно на долю накопленного Cry-протеина приходится лишь 0,0002-0,002 % от общего количества растворимых протеинов, которых, как правило, оказывается недостаточно для защиты растений от вредителей. Поэтому в соответствии с требованиями Агентства по охране окружающей среды США в Bt-сортах должно содержаться достаточно высокое количество токсинов для уничтожения большей части растительноядных насекомых. И все же если учесть, что к настоящему времени уже известно более 500 видов, популяции которых обладают устойчивостью к инсектицидам, то вероятность преодоления Bt-токсиноустойчивости сортов и гибридов также достаточно велика. Кстати, использование Bt-устойчивых сортов не освобождает фермеров от необходимости проведения всех остальных мероприятий по борьбе с вредителями. Бесспорно, пока нет веских оснований сдерживать исследования в области получения трансгенных растений и животных, как, впрочем, и для всеобещающих заявлений по этому поводу. Ошибочно было бы рубить яблоню только из-за того, что на ней могут появиться червивые плоды. В то же время нельзя и отрицать наличие определенного биологического и экологического риска при широком использовании трансгенных организмов. Показано, например, что растительные остатки трансгенных культур могут оказывать влияние как на генетичеcкую структуру и динамику численности популяций почвенной биоты, так и на функционирование различных структур и механизмов биоценотической саморегуляции агроценозов. Очевидна также связь между "здоровой пищей", "экологической устойчивостью" агроэкосистем и их "биологическим разнообразием". Само же использование трансгенных растений требует не только модифицированных технологий возделывания культур, но и значительно более высокого уровня экологического мониторинга, маркировки соответствующей продукции и т.д. В целом степень риска при использовании трансгенных организмов следует оценивать с учетом долговременных интересов жизнеобеспечения всего общества. Бесспорно, произвольная изменчивость высших растений ограничивается "системой саморегуляции" и в этом одна из эволюционных гарантий безопасности использования методов трансгеноза в селекции растений. Многие опасности в научно-техническом прогрессе обусловлены, как известно, неопределенностью тех или иных знаний, а нередко и ошибочностью отдельных положений. ТЕМА 12. ГЕНЕТИКА ЧЕЛОВЕКА (АНТРОПОГЕНЕТИКА) Лектор: ст.п. Мамедова М. З. 1. Методы изучения наследственности человека: генеалогические, близнецовые, цитогенетические, биохимические и популяционные 2. Генетические заболевания и наследственные болезни. Значение медико-генетических консультаций и пренатальной диагностики. Возможности генетической коррекции заболеваний Генетика человека – это особый раздел генетики, который изучает особенности наследования признаков у человека, наследственные заболевания (медицинская генетика), генетическую структуру популяций человека. Генетика человека является теоретической основой современной медицины и современного здравоохранения. В настоящее время твердо установлено, что в живом мире законы генетики носят всеобщий характер, действительны они и для человека. Однако, поскольку человек – это не только биологическое, но и социальное существо, генетика человека отличается от генетики большинства организмов рядом особенностей: – для изучения наследования человека неприменим гибридологический анализ (метод скрещиваний); поэтому для генетического анализа используются специфические методы: генеалогический (метод анализа родословных), близнецовый, а также цитогенетические, биохимические, популяционные и некоторые другие методы; – для человека характерны социальные признаки, которые не встречаются у других организмов, например, темперамент, сложные коммуникационные системы, основанные на речи, а также математические, изобразительные, музыкальные и иные способности; – благодаря общественной поддержке возможно выживание и существование людей с явными отклонениями от нормы (в дикой природе такие организмы оказываются нежизнеспособными). Генетика человека изучает особенности наследования признаков у человека, наследственные заболевания (медицинская генетика), генетическую структуру популяций человека. Генетика человека является теоретической основой современной медицины и современного здравоохранения. Известно несколько тысяч собственно генетических заболеваний, которые почти на 100% зависят от генотипа особи. К наиболее страшным из них относятся: кислотный фиброз поджелудочной железы, фенилкетонурия, галактоземия, различные формы кретинизма, гемоглобинопатии, а также синдромы Дауна, Тернера, Кляйнфельтера. Кроме того, существуют заболевания, которые зависят и от генотипа, и от среды: ишемическая болезнь, сахарный диабет, ревматоидные заболевания, язвенные болезни желудка и двенадцатиперстной кишки, многие онкологические заболевания, шизофрения и другие заболевания психики. Задачи медицинской генетики заключаются в своевременном выявлении носителей этих заболеваний среди родителей, выявлении больных детей и выработке рекомендаций по их лечению. Большую роль в профилактике генетически обусловленных заболеваний играют генетикомедицинские консультации и пренатальная диагностика (то есть выявление заболеваний на ранних стадиях развития организма). Существуют специальные разделы прикладной генетики человека (экологическая генетика, фармакогенетика, генетическая токсикология), изучающие генетические основы здравоохранения. При разработке лекарственных препаратов, при изучении реакции организма на воздействие неблагоприятных факторов необходимо учитывать как индивидуальные особенности людей, так и особенности человеческих популяций. Приведем примеры наследования некоторых морфофизиологических признаков. Доминантные и рецессивные признаки у человека (для некоторых признаков указаны контролирующие их гены) Доминантные Нормальная пигментация кожи, глаз, волос Близорукость Нормальное зрение Цветовое зрение Катаракта Косоглазие Толстые губы Полидактилия (добавочные пальцы) Брахидактилия (короткие пальцы) Веснушки Нормальный слух Карликовость Нормальное усвоение глюкозы Нормальная свертываемость крови Круглая форма лица (R–) Круглый подбородок (K–) Ямочка на подбородке (А–) Рецессивные Альбинизм Нормальное зрение Ночная слепота Дальтонизм Отсутствие катаракты Отсутствие косоглазия Тонкие губы Нормальное число пальцев Нормальная длина пальцев Отсутствие веснушек Врожденная глухота Нормальный рост Сахарный диабет Гемофилия Квадратная форма лица (rr) Квадратный подбородок (kk) Отсутствие ямочки (аа) Ямочки на щеках (D–) Густые брови (B–) Брови не соединяются (N–) Длинные ресницы (L–) Круглый нос (G–) Круглые ноздри (Q–) Свободная мочка уха (S–) Отсутствие ямочек (dd) Тонкие брови (bb) Брови соединяются (nn) Короткие ресницы (ll) Заостренный нос (gg) Узкие ноздри (qq) Сросшаяся мочка уха (ss) Неполное доминирование (указаны гены, контролирующие признак) Признаки Расстояние между глазами – Т Размер глаз – Е Размеры рта – М Тип волос – С Цвет бровей – Н Размер носа – F Варианты Большое Среднее Малое Большие Большой Курчавые Очень темные Большой Средние Средний Вьющиеся Темные Средний Маленькие Маленький Прямые Светлые Маленький Наследование цвета волос (контролируется четырьмя генами, наследуется полимерно) Количество доминантных аллелей 8 7 6 5 4 3 2 1 0 Цвет волос Черные Темно-коричневые Темно-каштановые Каштановые Русые Светло-русые Блондин Очень светлый блондин Белые Примечание. Рыжий цвет волос контролируется геном D; это признак проявляется, если доминантных генов меньше 6: DD – ярко-рыжие, Dd – светло-рыжие, dd – не-рыжие 1. Методы изучения наследственности человека: генеалогические, близнецовые, цитогенетические, биохимические и популяционные Генеалогические методы (методы анализа родословных) Родословная – это схема, отражающая связи между членами семьи. Анализируя родословные, изучают какой-либо нормальный или (чаще) патологический признак в поколениях людей, находящихся в родственных связях. Генеалогические методы используются для определения наследственного или ненаследственного характера признака, доминантности или рецессивности, картирования хромосом, сцепления с полом, для изучения мутационного процесса. Как правило, генеалогический метод составляет основу для заключений при медико-генетическом консультировании. При составлении родословных применяют стандартные обозначения. Персона (индивидуум), с которого начинается исследование, называется пробандом (если родословная составляется таким образом, что от пробанда спускаются к его потомству, то ее называют генеалогическим древом). Потомок брачной пары называется сиблингом, родные братья и сестры – сибсами, кузены – двоюродными сибсами и т.д. Потомки, у которых имеется общая мать (но разные отцы), называются единоутробными, а потомки, у которых имеется общий отец (но разные матери) – единокровными; если же в семье имеются дети от разных браков, причем, у них нет общих предков (например, ребенок от первого брака матери и ребенок от первого брака отца), то их называют сводными. Каждый член родословной имеет свой шифр, состоящий из римской цифры и арабской, обозначающих соответственно номер поколения и номер индивидуума при нумерации поколений последовательно слева направо. При родословной должна быть легенда, т. е. пояснение к принятым обозначениям. При близкородственных браках высока вероятность К обнаружения у супругов одного и того же неблагоприятного аллеля или хромосомной аберрации (рис. 4): Приведем значения К [X–Y] для некоторых пар родственников при моногамии: К [родители–потомки]=К [сибсы]=1/2; К [дед–внук]=К [дядя–племянник]=1/4; К [двоюродные сибсы]= К [прадед–правнук]=1/8; К [троюродные сибсы]=1/32; К [четвероюродные сибсы]=1/128. Обычно столь дальние родственники в составе одной семьи не рассматриваются. На основании генеалогического анализа дается заключение о наследственной обусловленности признака. Например, детально прослежено наследование гемофилии А среди потомков английской королевы Виктории. Генеалогический анализ позволил установить, что гемофилия А – это рецессивное заболевание, сцепленное с полом. Близнецовый метод Близнецы – это два и более ребенка, зачатые и рожденные одной матерью почти одновременно. Термин «близнецы» используется по отношению к человеку и тем млекопитающим, у которых в норме рождается один ребенок (детеныш). Различают однояйцевых и разнояйцевых близнецов. Однояйцевые (монозиготные, идентичные) близнецы возникают на самых ранних стадиях дробления зиготы, когда два или четыре бластомера сохраняют способность при обособлении развиться в полноценный организм. Поскольку зигота делится митозом, генотипы однояйцевых близнецов, по крайней мере, исходно, совершенно идентичны. Однояйцевые близнецы всегда одного пола, в период внутриутробного развития у них одна плацента. Разнояйцевые (дизиготные, неидентичные) близнецы возникают иначе – при оплодотворении двух или нескольких одновременно созревших яйцеклеток. Таким образом, они имеют около 50% общих генов. Другими словами, они подобны обычным братьям и сестрам по своей генетической конституции и могут быть как однополыми, так и разнополыми. Таким образом, сходство между однояйцевыми близнецами определяется и одинаковыми генотипами, и одинаковыми условиями внутриутробного развития. Сходство между разнояйцевыми близнецами определяется только одинаковыми условиями внутриутробного развития. Частота рождения близнецов в относительных цифрах невелика и составляет около 1%, из них 1/3 приходится на монозиготных близнецов. Однако в пересчете на общую численность населения Земли в мире проживает свыше 30 млн. разнояйцевых и 15 млн. однояйцевых близнецов. Для исследований на близнецах очень важно устано¬вить достоверность зиготности. Наиболее точно зиготность устанавливают с помощью реципрокной трансплантации небольших участков кожи. У дизиготных близнецов трансплантаты всегда отторга¬ются, тогда как у монозиготных близнецов пересаженные кусочки кожи успешно приживаются. Так же успешно и длительно функционируют трансплантированные почки, пересаженные от одного из монозиготных близнецов другому. При сравнении однояйцевых и разнояйцевых близнецов, воспитанных в одной и той же среде, можно сделать заключение о роли генов в развитии признаков. Условия послеутробного развития для каждого из близнецов могут оказаться разными. Например, монозиготные близнецы были разлучены через несколько дней после рождения и воспитывались в разных условиях. Сравнение их через 20 лет по многим внешним признакам (рост, объем головы, число бороздок на отпечатках пальцев и т. д.) выявило лишь незначительные различия. В то же время, среда оказывает воздействие на ряд нормальных и патологических признаков. Близнецовый метод позволяет делать обоснованные заключения о наследуемости признаков: роли наследственности, среды и случайных факторов в определении тех или иных признаков человека, Наследуемость – это вклад генетических факторов в формирование признака, выраженный в долях единицы или процентах. Для вычисления наследуемости признаков сравнивают степень сходства или различия по ряду признаков у близнецов разного типа. Рассмотрим некоторые примеры, иллюстрирующие сходство (конкордантность) и различие (дискордантность) многих признаков (см. табл.). Степень различия (дискордантность) по ряду нейтральных признаков у близнецов Признаки, контролируемые небольшим числом генов Цвет глаз Частота (вероятность) появления различий, % Наследуемость, % однояйцевые разнояйцевые 0,5 72 99 Форма ушей 2,0 80 98 Цвет волос 3,0 77 96 Папиллярные линии 8,0 60 87 среднее <1% ≈ 55 % 95 % Биохимические признаки 0,0 от 0 до 100 Цвет кожи 0,0 55 Форма волос 0,0 21 Форма бровей 0,0 49 Форма носа 0,0 66 Форма губ 0,0 35 100 % Степень сходства (конкордантность) по ряду заболеваний у близнецов Признаки, контролируемые Частота (вероятность) Наследуемость, появления сходства, % % большим числом генов и зависящие от негенетических факторов Умственная отсталость Шизофрения Сахарный диабет Эпилепсия среднее Преступность (?) однояйцевые разнояйцевые 97 37 95 69 65 67 ≈ 70 % 68 10 18 30 ≈ 20 % 28 66 57 53 ≈ 65 % 56 % Обращает на себя внимание высокая степень сходства однояйцевых близнецов по таким тяжелым заболеваниям, как шизофрения, эпилепсия, сахарный диабет. Кроме морфологических признаков, а также тембра голоса, походки, мимики, жестикуляции и т. д. изучают антигенную структуру клеток крови, белки сыворотки, способность ощущать вкус некоторых веществ. Особый интерес представляет наследование социально значимых признаков: агрессивности, альтруизма, творческих, исследовательских, организаторских способностей. Считается, что социально значимые признаки примерно на 80 % обусловлены генотипом. Цитогенетические (кариотипические, кариотипические) методы Цитогенетические методы используются, в первую очередь, при изучении кариотипов отдельных индивидов. Кариотип человека довольно хорошо изучен (рис. 6). Применение дифференциальной окраски позволяет точно идентифицировать все хромосомы. Общее число хромосом в гаплоидном наборе равно 23. Из них 22 хромосомы одинаковы и у мужчин, и у женщин; они называются аутосомы. В диплоидном наборе (2 n = 46) каждая аутосома представлена двумя гомологами. Двадцать третья хромосома является половой хромосомой, она может быть представлена или X или Y–хромосомой. Половые хромосомы у женщин представлены двумя X–хромосомами, а у мужчин одной X–хромосомой и одной Y–хромосомой. Изменение кариотипа, как правило, связано с развитием генетических заболеваний (см. ниже). Благодаря культивированию клеток человека in vitro можно быстро получить достаточно большой материал для приготовления препаратов. Для кариотипирования обычно используют кратковременную культуру лейкоцитов периферической крови. Цитогенетические методы используются и для описания интерфазных клеток. Например, по наличию или отсутствию полового хроматина (телец Барра, представляющих собой инактивированные X-хромосомы) можно не только определять пол индивидов, но и выявлять некоторые генетические заболевания, связанные с изменением числа X-хромосом (см. ниже). Картирование хромосом человека. Для картирования генов человека широко используются методы биотехнологии. В частности, методы клеточной инженерии позволяют объединять различные типы клеток. Слияние клеток, принадлежащих к разным биологическим видам, называется соматической гибридизацией. Сущность соматической гибридизации заключается в получении синтетических культур путем слияния протопластов различных видов организмов. Для слияния клеток используют различные физико-химические и биологические методы. После слияния протопластов образуются многоядерные гетерокариотические клетки. В дальнейшем при слиянии ядер образуются синкариотические клетки, содержащие в ядрах хромосомные наборы разных организмов. При делении таких клеток in vitro образуются гибридные клеточные культуры. В настоящее время получены и культивируются клеточные гибриды «человек × мышь», «человек × крыса» и многие другие. В гибридных клетках, полученных из разных штаммов разных видов, один из родительских геномов постепенно теряет хромосомы. Эти процессы интенсивно протекают, например, в клеточных гибридах между мышью и человеком. Если при этом следить за каким-либо биохимическим маркером (например, определенным ферментом человека) и одновременно проводить цитогенетический контроль, то, в конце концов, можно связать исчезновение хромосомы одновременно с биохимическим признаком. Это означает, что ген, кодирующий этот признак, локализован в данной хромосоме. Дополнительная информация о локализации генов может быть получена при анализе хромосомных мутаций (делеций). Биохимические методы. Все многообразие биохимических методов делится на две группы. а). Методы, основанные на выявлении определенных биохимических продуктов, обусловленных действием разных аллелей. Легче всего выявлять аллели по изменению активности ферментов или по изменению какого-либо биохимического признака. б). Методы, основанные на непосредственном выявлении измененных нуклеиновых кислот и белков с помощью гель-электрофореза в сочетании с другими методиками (блот-гибридизации, авторадиографии). Использование биохимических методов позволяет выявить гетерозиготных носителей заболеваний. Например, у гетерозиготных носителей гена фенилкетонурии изменяется уровень фенилаланина в крови. Методы генетики мутагенеза Мутационный процесс у человека у человека, как и у всех других организмов, ведет к возникновению аллелей и хромосомных перестроек, отрицательно влияющих на здоровье. Генные мутации. Около 1% новорожденных заболевают вследствие генных мутаций, из которых часть вновь возникшие. Темп мутирования различных генов в генотипе человека неодинаков. Известны гены, которые мутирует с частотой 10–4 на гамету на поколение. Однако большинство других генов мутируют с частотой, в сотни раз меньшей (10–6). Ниже приведены примеры наиболее частых генных мутаций у человека: Типы и названия мутаций Аутосомно-доминантные Поликистоз почек Нейрофиброматоз Множественный полипоз толстой кишки Аномалия лейкоцитов Пельгера Несовершенный остеогенез Синдром Марфана Аутосомно-рецессивные Микроцефалия Ихтиоз (не сцепленный с полом) Рецессивные, сцепленные с полом Мышечная дистрофия Дюшена Гемофилия А Гемофилия В Ихтиоз (сцепленный с полом) Частота мутаций (на 1 млн. гамет) 65...120 11...100 10...50 9...27 7...13 4...6 27 11 43...105 37...52 2...3 24 Хромосомные и геномные мутации в абсолютном большинстве возникают в половых клетках родителей. Один из 150 новорожденных несет хромосомную мутацию. Около 50% ранних абортов обусловлено хромосомными мутациями. Это связано с тем, что одна из 10 гамет человека является носителем структурных мутаций. Возраст родителей, особенно возраст матерей, играет важную роль в увеличении частоты хромосомных, а возможно, и генных мутаций. Полиплоидия у человека встречается очень редко. Известны случая рождения триплоидов – эти новорожденные рано умирают. Тетраплоиды обнаружены среди абортированных зародышей. В настоящее время мутационный процесс у человека характеризуется тем, что протекает на фоне повышенной концентрации мутагенных факторов, созданной производственной деятельностью самого человека. Важнейшая задача сегодняшнего дня – выявление мутагенных свойств загрязнителей, особенно новых химических веществ (лекарств, пестицидов, пищевых добавок, различных видов топлива и т.д.), и разработка методов технологии, позволяющих предотвратить возникновение опасных концентраций этих агентов. Одним из сильнейших мутагенов является радиация (ионизирующие излучения). Доказано, что не существует пороговой дозы ионизирующих излучений. Другими словами, индукция мутаций может быть достигнута при действии любых доз, а при увеличении дозы пропорционально растет число мутаций. Мутагенным действием на клетки человека обладают и некоторые вирусы, причем даже в ослабленной форме, которая используется для приготовления вакцин. Известно также, что большинство мутагенов обладают и канцерогенными свойствами, то есть они могут индуцировать развитие злокачественных опухолей (см. ниже). В то же время существуют факторы, которые снижают частоту мутаций – антимутагены. К антимутагенам относятся некоторые витамины– антиоксиданты (например, витамин Е, ненасыщенные жирные кислоты), серосодержащие аминокислоты, а также различные биологически активные вещества, которые повышают активность репарационных систем. Популяционные методы Главными чертами человеческих популяций являются: общность территории, на которой живет данная группа людей, и возможность свободного вступления в брак. Факторами изоляции, т. е. ограничения свободы выбора супругов, у человека могут быть не только географические, но и религиозные и социальные барьеры. В популяциях человека наблюдается высокий уровень полиморфизма по многим генам: то есть один и тот же ген представлен разными аллелями, что приводит к существованию нескольких генотипов и соответствующих фенотипов. Таким образом, все члены популяции отличаются друг от друга в генетическом отношении: практически в популяции невозможно найти даже двух генетически одинаковых людей (за исключением однояйцевых близнецов) В популяциях человека действуют различные формы естественного отбора. Отбор действует как во внутриутробном состоянии, так и в последующие периоды онтогенеза. Наиболее выражен стабилизирующий отбор, направленный против неблагоприятных мутаций (например, хромосомных перестроек). Классический пример отбора в пользу гетерозигот – распространение серповидноклеточной анемии (см. ниже). Популяционные методы позволяют оценить частоты одних и тех же аллелей в разных популяциях. Кроме того, популяционные методы позволяют изучать мутационный процесс у человека. По характеру радиочувствительности человеческая популяция генетически неоднородна. У некоторых людей с генетически обусловленными дефектами репарации ДНК радиочувствительность хромосом повышена в 5…10 раз по сравнению с большинством членов популяцией. 2. Генетические (наследственные) заболевания. Примерно 10% болезней человека определяются патологическими генами либо генами, обусловливающими предрасположенность к определенным болезням. Следовательно, необходимо различать собственно генетические (наследственные) заболевания и заболевания с генетической предрасположенностью. Собственно генетические заболевания практически на 100% зависят от генотипа. Известно несколько тысяч таких заболеваний. Обычно это моногенные заболевания, то есть связанные с дефектом одного генетического фактора. Проявление их подчиняется общим закономерностям реализации действия гена. Генетические заболевания можно разделить на геномные (изменяется число хромосом, например, при синдроме Дауна, или трисомии 21), хромосомные (изменяется структура хромосом, например, при синдроме «кошачьего крика»), и молекулярные (изменяется последовательность нуклеотидов ДНК – большинство заболеваний, например, при фенилкетонурии). Заболевания с наследственной предрасположенностью зависят и от генотипа, и от среды, например: гипертоническая (ишемическая) болезнь, сахарный диабет, ревматоидные заболевания, язвенные болезни желудка и двенадцатиперстной кишки, многие онкологические заболевания, шизофрения и другие заболевания психики. Обычно это полигенные заболевания, обусловленные сочетанием нескольких генетических дефектов. Факторами, способствующими развитию этих заболеваний, являются неправильное питание, гиподинамия, различные вредные привычки. Иначе говоря, эти болезни имеют мультифакториальную природу. Рассмотрим несколько примеров генетических (наследственных) болезней человека, связанных с нарушением обмена веществ. Различные нарушения обмена веществ обычно связаны с изменением активности ферментов или структуры клеточных мембран (а как следствие, часто связаны с изменением активности гормонов). Как правило, нарушения обмена веществ обусловлены изменениями в структуре гена – точковыми мутациями. Однако нужно иметь в виду, что сходные нарушения обмена веществ могут быть обусловлены как генетическими факторами, так и неблагоприятным воздействием среды. Алкаптонурия – неполное окисление одного из продуктов метаболизма (гомогентизиновой кислоты). Аутосомно-рецессивное заболевание. Проявляется в виде артритов конечностей и позвоночника. Сопутствующим признаком является «мышиный» запах мочи у больных людей. Это первое заболевание, для которого была доказана его молекулярно-генетическая природа (А. Гаррод, 1909). Галактоземия – невозможность усваивать молочный сахар. Аутосомное полудоминантное заболевание. Связано с недостаточной активностью фермента, обеспечивающего превращение галактозы (молочного сахара) в глюкозу. У гетерозигот Аа активность указанного фермента составляет 50% от нормы, а у гомозигот аа – не превышает 10% от нормы. При этом наблюдаются желтуха, диспепсические расстройства, поражение печени и селезенки, катаракты, а главное – умственная отсталость. Частота заболевания составляет 1:50 тыс. новорожденных; частота носителей – 1:100. Диета, не содержащая молочного сахара, предотвращает развитие указанных симптомов. Подобный способ лечения наследственных болезней можно рассматривать как генотерапию. Муковисцидоз (МВ), или кистозный фиброз поджелудочной железы относится к наиболее тяжелым наследственным заболеваниям. Характеризуется моногенным аутосомно-рецессивным типом наследования. В среднем 1 из 20 представителей белой расы является гетерозиготным носителем гена муковисцидоза. Частота среди новорожденных – 1 : 2.000; ежегодно в странах СНГ рождается 2…2,5 тысячи детей с этим тяжелым, часто ведущим к летальному исходу заболеванием. В последнее время продолжительность жизни этих больных увеличивается, и их удельный вес в популяциях возрастает. Дефект гена МВ обусловлен рядом мутаций, одна из которых является делецией трех нуклеотидов, что приводит к утрате одной из аминокислот в трансмембранном регуляторном белке МВ. МВ проявляется в кишечной форме (недостаточность поджелудочной железы), легочной и смешанной форме. Фенилкетонурия (ФКУ) – нарушение высшей нервной деятельности. Аутосомно-рецессивное заболевание. Обусловлено различными мутациями в гене, контролирующем метаболизм фенилаланина (одной из аминокислот). Фенилаланин превращается не в тирозин, а в фенилпировиноградную кислоту. В результате нарушается миелинизация мозга, что приводит к нарушениям в развитии нервной системы, к слабоумию, микроцефалии. Частота среди новорожденных – 1 : 10 тыс., частота носителей – 1 : 50. При своевременном выявлении этого заболевания и назначении диеты с пониженным содержанием фенилаланина симптомы ФКУ значительно смягчаются. Гиперхолестеринемия. Это мультифакториальное заболевание, связанное с нарушением обмена холестерина. Избыток холестерина откладывается на стенках сосудов в виде атеросклеротических бляшек, что приводит к развитию ишемической болезни. Холестерин является компонентом клеточных мембран, на его основе синтезируются стероидные гормоны, холевые (желчные) кислоты; кроме того, холестерин входит в состав кожного сала. Это означает, что холестерин необходим нашему организму. В среднем около 1000 мг холестерина в сутки синтезируется у человека в клетках печени, а около 500 мг поступает с животной пищей. При избытке пищевого холестерина он поступает в клетки печени и подавляет синтез холестерина этими клетками. Но при нарушениях холестеринового обмена (например, при гиперхолестеринемии) холестерин, поступивший в организм с пищей, не поступает в клетки печени. Тогда в кровеносных сосудах накапливается и избыток пищевого холестерина, и холестерина, синтезированного в печени. Гемоглобинопатии – это нарушения структуры гемоглобина (гемоглобин – переносчик О2, СО2, К, Н; измененный гемоглобин не может нормально выполнять свои функции). Распространены в регионах, неблагополучных по малярии. Известны десятки молекулярно-генетических причин, ведущих к нарушению структуры гемоглобина: точковые мутации, делеции, нарушения процессинга мРНК. В странах Южной Европы широко распространены гемоглобинопатии под общим названием талассемия. Различают легкие и тяжелые формы этих заболеваний. Одной из форм гемоглобинопатий является серповидноклеточная анемия – аутосомное заболевание, которое в полной мере проявляется у гомозигот. В состав молекулы гемоглобина взрослого человека входят две –цепи (– цепь закодирована в 16-ой хромосоме) и две –цепи (–цепь закодирована в 11-ой хромосоме). В состав –цепи входит 146 аминокислотных остатков, при этом в нормальной –цепи шестым аминокислотным остатком является глутаминовая кислота. С участием нормальной –цепи образуется нормальный гемоглобин – HbA. В нетранскрибируемой нити участка ДНК, кодирующего –цепь, глутаминовая кислота закодирована триплетом ГАА. Если же в результате мутации в ДНК произойдет замена триплета ГАА на триплет ГТА, то на месте глутаминовой кислоты в молекуле гемоглобина в соответствии с генетическим кодом появится валин. В итоге вместо гемоглобина HbA появится новый гемоглобин – HbS. Такая замена всего лишь одного нуклеотида и одной аминокислоты приводит к развитию тяжелого заболевания – серповидноклеточной анемии. На клеточном уровне эта болезнь проявляется в том, что эритроциты приобретают форму серпа и теряют способность к нормальному транспорту кислорода. Гомозиготы HbS/HbS умирают в раннем детстве. Зато гетерозиготы HbA/HbS характеризуются слабо измененными эритроцитами. При этом изменение формы эритроцитов значительно повышает устойчивость гетерозигот к малярии. Поэтому в тех регионах Земли, где свирепствует малярия (например, в Африке), отбор действовал в пользу гетерозигот. Таким образом, серповидноклеточная анемия – это пример относительности «полезности» и «вредности» мутаций. Сахарный диабет. Болезнь связана с дефицитом гормона инсулина. Мультифакториальное заболевание. Часто наследуется рецессивно. Имеются данные и о полигенном наследовании. Генотерапия нередко сводится к ежедневному введению в организм дефицитного гормона. Обычно для этих целей используют гормональный препарат, получаемый из поджелудочной железы крупного рогатого скота. Однако при этом примерно у 5% больных возникают аллергические реакции, обусловленные антигенной несовместимостью гормона и клеток человека. Решение этой проблемы, фактически спасающее от неминуемой гибели эту часть больных диабетом, было найдено с помощью методов генной инженерии. Инсулиновый ген человека был введен в плазмиду и при определенных условиях активно функционировал в клетках кишечной палочки. Он вырабатывал гормон с антигенными характеристиками, полностью соответствующими человеческому гормону. Хромосомные и геномные болезни (синдромы) Хромосомные болезни в большинстве случаев не наследуются. Нарушения числа или структуры хромосом возникают в гаметогенезе родителей. Синдромы, обусловленные хромосомными аберрациями, исключительно разнообразны, но каждый из них встречается сравнительно редко (1 случай на десятки тысяч новорожденных). Наиболее изучен синдром «кошачьего крика», связанный с делециями в коротком плече 5-й хромосомы. Основное проявление – необычный плач детей из-за патологии гортани и голосовых связок. Сопутствующие признаки: лунообразное лицо, микроцефалия, синдактилия, врожденные пороки сердца и др. Частота – 1 на 50 тыс. новорожденных. Обычно больные дети умирают в раннем возрасте. Геномные болезни менее разнообразны, но встречаются чаще. Из геномных болезней наиболее детально изучен синдром Дауна (болезнь Дауна, БД), в основе которого лежит трисомия по 21-й хромосоме. Больные дети с синдромом Дауна рождаются с достаточно высокой частотой – 1:750. В 80% случаях непосредственной причиной является нерасхождение хромосом в I делении мейоза. Главным морфологическим признаком болезни Дауна можно считать монголоидный тип лица, однако более важно отметить умственную отсталость, проявляющуюся в широком диапазоне от полной идиотии до сравнительно легких степеней дебильности. При синдроме Дауна описаны пороки сердца и крупных сосудов, органов пищеварительного тракта, снижение продолжительности жизни в 5…10 раз, черты преждевременного старения, отклонения в дерматоглифике, высокая частота злокачественных опухолей (особенно лейкозов), иммунодефицитные состояния, многочисленные врожденные уродства, нарушения репарации первичных молекулярных повреждений ДНК. Кроме синдрома Дауна, существует и множество других генетических заболеваний, связанных с изменением числа хромосом: синдромы Патау, Эдвардса, Тѐрнера, Кляйнфельтера и др. Причины возникновения таких заболеваний до сих пор не выявлены. Однако имеются достоверные данные, указывающие на повышенный риск рождения больного ребенка у матерей в возрасте свыше 30…35 лет. Генетика онкологических заболеваний (злокачественных, или раковых опухолей) Рак – это заболевание, связанное с образованием злокачественных опухолей в различных органах (например, рак легких, желудка, кишечника, поджелудочной железы, молочной железы, яичников, матки, простаты, периферической нервной системы, кожи) и тканях (например, саркомы, остеосаркомы, нейробластомы, глиобластомы, лейкемии, меланомы, ретинобластомы, ксеродермы). Обычно раковые опухоли развиваются в тех тканях, в которых клетки интенсивно делятся. Известно около 100 типов раковых опухолей, из них наиболее часты встречающиеся: раки легких, молочной железы, толстой кишки, простаты и матки. Смертность от рака составляет 20% смертности в развитых странах. Раковые опухоли – это скопления интенсивно делящихся клеток. Одной из основных особенностей раковых клеток является их относительная автономность, способность к неограниченному числу делений, обособление и способность метастазировать (разноситься по всему организму). Раковые клетки не подчиняются контрольным механизмам, регулирующим жизнедеятельность нормальных клеток. Злокачественность, т.е. способность одной или многих клеток приводить к развитию опухолей и метастазированию, передается в ряду соматических клеток. Процесс развития раковой опухоли называется канцерогенез. Начинается канцерогенез с нарушений клеточного цикла однойединственной клетки, которая начинает интенсивно делиться (пролиферировать). К моменту обнаружения раковой опухоли путем рентгеноскопии в ее состав входит около 10 миллионов клеток (диаметр опухоли ~ 1 мм), к моменту обнаружения путем пальпирования ~ миллиард клеток (диаметр опухоли ~ 10 мм), при достижении опухолью размера 10 см (~ триллиард клеток) наступает летальный исход. Достаточно условно все раковые опухоли подразделяются на доброкачественные и злокачественные. Доброкачественные опухоли развиваются медленно, и образующие их клетки располагаются компактно. Злокачественные опухоли развиваются быстро и сопровождаются метастазами. Причины возникновения рака до сих пор не установлены. Считается, что это большая неоднородная группа мультифакториальных заболеваний, которые вызываются взаимодействием генотипа и определенных факторов среды – канцерогенов. Канцерогены. Раковые заболевания вызывают самые разнообразные факторы – канцерогены. С помощью близнецового метода показано, что в развитии раковых заболеваний человека значение внешних факторов исключительно велико. К физическим канцерогенам относятся: ионизирующее излучение, ультрафиолет, температурные и механические воздействия. При облучении покровов организма развивается рак кожи, при общем облучении – лейкозы, опухоли костей, рак щитовидной железы, при вдыхании радиоактивной пыли – рак легких. К химическим канцерогенам относятся самые разнообразные органические вещества: от четыреххлористого углерода до сложных полициклических и гетероциклических соединений. Например, смолы табачного дыма провоцируют рак легких (плоскоклеточную карциному), причем заболевание интенсивно развивается у курильщиков с 10…20-летним стажем. К биологическим канцерогенам относятся вирусы и их производные (провирусы). В клетках позвоночных животных присутствуют десятки встроенных в хромосомы геномов ДНК-содержащих опухолеродных вирусов (провирусов). Доказана вирусная природа рака молочной железы у мышей. Считается, что вирусы могут провоцировать раковые заболевания у человека (например, вирус гепатита – рак печени), однако это положение не доказано. Заметим, что часто канцерогенами являются известные мутагены. Генетика злокачественных опухолей. В настоящее время доказано, что рак – это генетическое заболевание. Злокачественность, т.е. способность одной или многих клеток приводить к развитию опухолей и метастазированию, передается в ряду соматических клеток. Известны случаи семейных раков (опухоли желудка, молочной железы, легких, матки и т. д.). Однако по наследству передается не сам рак, а лишь предрасположенности к раковым заболеваниям. В некоторых популяциях частота отдельных раковых заболеваний значительно ниже средней (в окрестностях Бомбея в 200 раз реже встречается рак кожи, в Нигерии – в 300 раз реже рак пищевода, в Англии – в 100 раз реже рак печени). Строго научная точка зрения состоит в том, что признается передача по наследству лишь предрасположенности к раковым заболеваниям, причем иногда речь идет о моногенной, в других случаях – о полигенной наследственности. Например, при генетически обусловленных дефектах репарации ДНК (или, точнее, при синдромах хромосомной нестабильности) частота рака возрастает в 100…10000 раз. В начале XX в. была предложена мутационная теория рака, в которой подчеркивалась роль генных и хромосомных соматических мутаций в этиологии рака. В настоящее время получила признание вирусо-генетическая теория рака, согласно которой генетический материал онкогенных вирусов встраивается в хромосому клетки. Такое изменение генома, точнее отдельных, немногих локусов, нарушает биохимический механизм клеток, они приобретают автономность и начинают усиленно делиться. Вирусо-генетическая теория была дополнена концепцией онкогенов. Онкогены – это участки хромосом нормальных клеток, которые под действием повреждающих ДНК факторов активируются и продуцируют белки, вызывающие злокачественность. В норме онкогены на протяжении большей части индивидуального развития (за исключением раннего эмбриогенеза) находятся в функционально неактивном состоянии либо очень слабоактивны. В целом можно сказать, что активация онкогенов обусловлена дестабилизацией генома мутагенами и другими агентами. В последнее десятилетие доказано, что в клетках позвоночных животных присутствуют десятки встроенных в хромосомы геномов ДНК-содержащих опухолеродных вирусов (провирусов). К эндогенным генетическим факторам канцерогенеза относятся мобильные элементы генома: транспозоны и ретротранспозоны. Медико-генетическое консультирование Еще в 1883 г. Фрэнсис Гальтон выдвинул идею о необходимости улучшения человеческого рода генетическими методами. Им же предложен термин «евгеника», означающий учение о наследственном здоровье человека и путях улучшения его наследственных свойств. Евгеника была популярна в России в 1920-е гг. (Н. К. Кольцов). Однако данные популяционно-генетических исследований позволяют утверждать, что в обозримом будущем такие работы не имеют никаких перспектив. Человек как биосоциальное существо сложился в ходе длительных эволюционных преобразований, и надеяться изменить вид за исторически короткие сроки бессмысленно. С точки зрения генетики человека ни одна группа людей, несмотря на определенные различия между ними, не имеют каких-либо преимуществ друг перед другом. Поэтому генетика отвергает евгенические вмешательства в наследственность человека с целью улучшения его природы. Методы, предлагавшиеся старыми евгениками, были сугубо селекционными: ограничения на межрасовые браки, иммиграционные барьеры, даже стерилизация генетически неполноценных людей. На практике методы евгеники послужили основанием для создания концентрационных лагерей в фашистской Германии, где подвергались массовому уничтожению представители неарийских рас. Естественно, что подобная теория и практика несовместимы с гуманистической моралью общества, в центре внимания которого находится человек. Поэтому в настоящее время наибольшее внимание уделяется мерам по предотвращению рождения детей с наследственной патологией. Медико-генетическое консультирование призвано избавить человечество от страданий, связанных с наследственными (генетическими) заболеваниями. Главные цели медико-генетического консультирования заключаются в установлении роли генотипа в развитии данного заболевания и прогнозировании риска иметь больных потомков. Рекомендации, даваемые в медико-генетических консультациях в отношении заключения брака или прогноза генетической полноценности потомства, направлены на то, чтобы они учитывались консультируемыми лицами, которые добровольно принимают соответствующее решение. В распоряжении врачей имеется весь арсенал перечисленных выше методов генетики человека и некоторые специальные методы. Методы пренатальной диагностики разнообразны: от УЗИ до фетоскопии (прямом рассматривании плода через специальный зонд). К собственно генетическим методам относятся: – хорионбиопсия (на 8-й неделе беременности) – отбор материала из ворсинок хориона. – плацентобиопсия (на 12-й неделе) – отбор материала из плаценты. – амниоцентез (на 15…18-й неделе) – отбор материала из амниотической жидкости. – кордоцентез (на 18…22-й неделе) – отбор материала из кровеносных сосудов пуповины. Хорионбиопсия и плацентобиопсия позволяют производить наиболее раннюю диагоностику, но риск осложнений достигает 3 %. Кордоцентез производится слишком поздно, что затрудняет повторные исследования в случае сомнений. Поэтому среди методов, позволяющих диагностировать заболевание до рождения ребенка, ведущее место занимает амниоцентез – получение амниотической жидкости и клеток плода с помощью прокола плодного пузыря операции под контролем УЗИ – простейшей, не травмирующей плод хирургической. Этим методом диагностируют многие хромосомные болезни и некоторые заболевания, в основе которых лежат генные мутации. Риск осложнений относительно невелик – примерно 0,2 %. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ ТЕМА 12. ГЕНЕТИКА ЧЕЛОВЕКА (АНТРОПОГЕНЕТИКА) Лектор: ст.п. Мамедова М. З. 1. Методы изучения наследственности человека: генеалогические, близнецовые, цитогенетические, биохимические и популяционные 2. Генетические заболевания и наследственные болезни. Значение медико-генетических консультаций и пренатальной диагностики. Возможности генетической коррекции заболеваний Генетика человека – это особый раздел генетики, который изучает особенности наследования признаков у человека, наследственные заболевания (медицинская генетика), генетическую структуру популяций человека. Генетика человека является теоретической основой современной медицины и современного здравоохранения. В настоящее время твердо установлено, что в живом мире законы генетики носят всеобщий характер, действительны они и для человека. Однако, поскольку человек – это не только биологическое, но и социальное существо, генетика человека отличается от генетики большинства организмов рядом особенностей: – для изучения наследования человека неприменим гибридологический анализ (метод скрещиваний); поэтому для генетического анализа используются специфические методы: генеалогический (метод анализа родословных), близнецовый, а также цитогенетические, биохимические, популяционные и некоторые другие методы; – для человека характерны социальные признаки, которые не встречаются у других организмов, например, темперамент, сложные коммуникационные системы, основанные на речи, а также математические, изобразительные, музыкальные и иные способности; – благодаря общественной поддержке возможно выживание и существование людей с явными отклонениями от нормы (в дикой природе такие организмы оказываются нежизнеспособными). Генетика человека изучает особенности наследования признаков у человека, наследственные заболевания (медицинская генетика), генетическую структуру популяций человека. Генетика человека является теоретической основой современной медицины и современного здравоохранения. Известно несколько тысяч собственно генетических заболеваний, которые почти на 100% зависят от генотипа особи. К наиболее страшным из них относятся: кислотный фиброз поджелудочной железы, фенилкетонурия, галактоземия, различные формы кретинизма, гемоглобинопатии, а также синдромы Дауна, Тернера, Кляйнфельтера. Кроме того, существуют заболевания, которые зависят и от генотипа, и от среды: ишемическая болезнь, сахарный диабет, ревматоидные заболевания, язвенные болезни желудка и двенадцатиперстной кишки, многие онкологические заболевания, шизофрения и другие заболевания психики. Задачи медицинской генетики заключаются в своевременном выявлении носителей этих заболеваний среди родителей, выявлении больных детей и выработке рекомендаций по их лечению. Большую роль в профилактике генетически обусловленных заболеваний играют генетикомедицинские консультации и пренатальная диагностика (то есть выявление заболеваний на ранних стадиях развития организма). Существуют специальные разделы прикладной генетики человека (экологическая генетика, фармакогенетика, генетическая токсикология), изучающие генетические основы здравоохранения. При разработке лекарственных препаратов, при изучении реакции организма на воздействие неблагоприятных факторов необходимо учитывать как индивидуальные особенности людей, так и особенности человеческих популяций. Приведем примеры наследования некоторых морфофизиологических признаков. Доминантные и рецессивные признаки у человека (для некоторых признаков указаны контролирующие их гены) Доминантные Нормальная пигментация кожи, глаз, волос Близорукость Нормальное зрение Цветовое зрение Катаракта Косоглазие Толстые губы Полидактилия (добавочные пальцы) Брахидактилия (короткие пальцы) Веснушки Нормальный слух Карликовость Нормальное усвоение глюкозы Нормальная свертываемость крови Круглая форма лица (R–) Круглый подбородок (K–) Ямочка на подбородке (А–) Рецессивные Альбинизм Нормальное зрение Ночная слепота Дальтонизм Отсутствие катаракты Отсутствие косоглазия Тонкие губы Нормальное число пальцев Нормальная длина пальцев Отсутствие веснушек Врожденная глухота Нормальный рост Сахарный диабет Гемофилия Квадратная форма лица (rr) Квадратный подбородок (kk) Отсутствие ямочки (аа) Ямочки на щеках (D–) Густые брови (B–) Брови не соединяются (N–) Длинные ресницы (L–) Круглый нос (G–) Круглые ноздри (Q–) Свободная мочка уха (S–) Отсутствие ямочек (dd) Тонкие брови (bb) Брови соединяются (nn) Короткие ресницы (ll) Заостренный нос (gg) Узкие ноздри (qq) Сросшаяся мочка уха (ss) Неполное доминирование (указаны гены, контролирующие признак) Признаки Расстояние между глазами – Т Размер глаз – Е Размеры рта – М Тип волос – С Цвет бровей – Н Размер носа – F Варианты Большое Среднее Малое Большие Большой Курчавые Очень темные Большой Средние Средний Вьющиеся Темные Средний Маленькие Маленький Прямые Светлые Маленький Наследование цвета волос (контролируется четырьмя генами, наследуется полимерно) Количество доминантных аллелей 8 7 6 5 4 3 2 1 0 Цвет волос Черные Темно-коричневые Темно-каштановые Каштановые Русые Светло-русые Блондин Очень светлый блондин Белые Примечание. Рыжий цвет волос контролируется геном D; это признак проявляется, если доминантных генов меньше 6: DD – ярко-рыжие, Dd – светло-рыжие, dd – не-рыжие 1. Методы изучения наследственности человека: генеалогические, близнецовые, цитогенетические, биохимические и популяционные Генеалогические методы (методы анализа родословных) Родословная – это схема, отражающая связи между членами семьи. Анализируя родословные, изучают какой-либо нормальный или (чаще) патологический признак в поколениях людей, находящихся в родственных связях. Генеалогические методы используются для определения наследственного или ненаследственного характера признака, доминантности или рецессивности, картирования хромосом, сцепления с полом, для изучения мутационного процесса. Как правило, генеалогический метод составляет основу для заключений при медико-генетическом консультировании. При составлении родословных применяют стандартные обозначения. Персона (индивидуум), с которого начинается исследование, называется пробандом (если родословная составляется таким образом, что от пробанда спускаются к его потомству, то ее называют генеалогическим древом). Потомок брачной пары называется сиблингом, родные братья и сестры – сибсами, кузены – двоюродными сибсами и т.д. Потомки, у которых имеется общая мать (но разные отцы), называются единоутробными, а потомки, у которых имеется общий отец (но разные матери) – единокровными; если же в семье имеются дети от разных браков, причем, у них нет общих предков (например, ребенок от первого брака матери и ребенок от первого брака отца), то их называют сводными. Каждый член родословной имеет свой шифр, состоящий из римской цифры и арабской, обозначающих соответственно номер поколения и номер индивидуума при нумерации поколений последовательно слева направо. При родословной должна быть легенда, т. е. пояснение к принятым обозначениям. При близкородственных браках высока вероятность К обнаружения у супругов одного и того же неблагоприятного аллеля или хромосомной аберрации (рис. 4): Приведем значения К [X–Y] для некоторых пар родственников при моногамии: К [родители–потомки]=К [сибсы]=1/2; К [дед–внук]=К [дядя–племянник]=1/4; К [двоюродные сибсы]= К [прадед–правнук]=1/8; К [троюродные сибсы]=1/32; К [четвероюродные сибсы]=1/128. Обычно столь дальние родственники в составе одной семьи не рассматриваются. На основании генеалогического анализа дается заключение о наследственной обусловленности признака. Например, детально прослежено наследование гемофилии А среди потомков английской королевы Виктории. Генеалогический анализ позволил установить, что гемофилия А – это рецессивное заболевание, сцепленное с полом. Близнецовый метод Близнецы – это два и более ребенка, зачатые и рожденные одной матерью почти одновременно. Термин «близнецы» используется по отношению к человеку и тем млекопитающим, у которых в норме рождается один ребенок (детеныш). Различают однояйцевых и разнояйцевых близнецов. Однояйцевые (монозиготные, идентичные) близнецы возникают на самых ранних стадиях дробления зиготы, когда два или четыре бластомера сохраняют способность при обособлении развиться в полноценный организм. Поскольку зигота делится митозом, генотипы однояйцевых близнецов, по крайней мере, исходно, совершенно идентичны. Однояйцевые близнецы всегда одного пола, в период внутриутробного развития у них одна плацента. Разнояйцевые (дизиготные, неидентичные) близнецы возникают иначе – при оплодотворении двух или нескольких одновременно созревших яйцеклеток. Таким образом, они имеют около 50% общих генов. Другими словами, они подобны обычным братьям и сестрам по своей генетической конституции и могут быть как однополыми, так и разнополыми. Таким образом, сходство между однояйцевыми близнецами определяется и одинаковыми генотипами, и одинаковыми условиями внутриутробного развития. Сходство между разнояйцевыми близнецами определяется только одинаковыми условиями внутриутробного развития. Частота рождения близнецов в относительных цифрах невелика и составляет около 1%, из них 1/3 приходится на монозиготных близнецов. Однако в пересчете на общую численность населения Земли в мире проживает свыше 30 млн. разнояйцевых и 15 млн. однояйцевых близнецов. Для исследований на близнецах очень важно устано¬вить достоверность зиготности. Наиболее точно зиготность устанавливают с помощью реципрокной трансплантации небольших участков кожи. У дизиготных близнецов трансплантаты всегда отторга¬ются, тогда как у монозиготных близнецов пересаженные кусочки кожи успешно приживаются. Так же успешно и длительно функционируют трансплантированные почки, пересаженные от одного из монозиготных близнецов другому. При сравнении однояйцевых и разнояйцевых близнецов, воспитанных в одной и той же среде, можно сделать заключение о роли генов в развитии признаков. Условия послеутробного развития для каждого из близнецов могут оказаться разными. Например, монозиготные близнецы были разлучены через несколько дней после рождения и воспитывались в разных условиях. Сравнение их через 20 лет по многим внешним признакам (рост, объем головы, число бороздок на отпечатках пальцев и т. д.) выявило лишь незначительные различия. В то же время, среда оказывает воздействие на ряд нормальных и патологических признаков. Близнецовый метод позволяет делать обоснованные заключения о наследуемости признаков: роли наследственности, среды и случайных факторов в определении тех или иных признаков человека, Наследуемость – это вклад генетических факторов в формирование признака, выраженный в долях единицы или процентах. Для вычисления наследуемости признаков сравнивают степень сходства или различия по ряду признаков у близнецов разного типа. Рассмотрим некоторые примеры, иллюстрирующие сходство (конкордантность) и различие (дискордантность) многих признаков (см. табл.). Степень различия (дискордантность) по ряду нейтральных признаков у близнецов Признаки, контролируемые небольшим числом генов Цвет глаз Частота (вероятность) появления различий, % Наследуемость, % однояйцевые разнояйцевые 0,5 72 99 Форма ушей 2,0 80 98 Цвет волос 3,0 77 96 Папиллярные линии 8,0 60 87 среднее <1% ≈ 55 % 95 % Биохимические признаки 0,0 от 0 до 100 Цвет кожи 0,0 55 Форма волос 0,0 21 Форма бровей 0,0 49 Форма носа 0,0 66 Форма губ 0,0 35 100 % Степень сходства (конкордантность) по ряду заболеваний у близнецов Признаки, контролируемые Частота (вероятность) Наследуемость, появления сходства, % % большим числом генов и зависящие от негенетических факторов Умственная отсталость Шизофрения Сахарный диабет Эпилепсия среднее Преступность (?) однояйцевые разнояйцевые 97 37 95 69 65 67 ≈ 70 % 68 10 18 30 ≈ 20 % 28 66 57 53 ≈ 65 % 56 % Обращает на себя внимание высокая степень сходства однояйцевых близнецов по таким тяжелым заболеваниям, как шизофрения, эпилепсия, сахарный диабет. Кроме морфологических признаков, а также тембра голоса, походки, мимики, жестикуляции и т. д. изучают антигенную структуру клеток крови, белки сыворотки, способность ощущать вкус некоторых веществ. Особый интерес представляет наследование социально значимых признаков: агрессивности, альтруизма, творческих, исследовательских, организаторских способностей. Считается, что социально значимые признаки примерно на 80 % обусловлены генотипом. Цитогенетические (кариотипические, кариотипические) методы Цитогенетические методы используются, в первую очередь, при изучении кариотипов отдельных индивидов. Кариотип человека довольно хорошо изучен (рис. 6). Применение дифференциальной окраски позволяет точно идентифицировать все хромосомы. Общее число хромосом в гаплоидном наборе равно 23. Из них 22 хромосомы одинаковы и у мужчин, и у женщин; они называются аутосомы. В диплоидном наборе (2 n = 46) каждая аутосома представлена двумя гомологами. Двадцать третья хромосома является половой хромосомой, она может быть представлена или X или Y–хромосомой. Половые хромосомы у женщин представлены двумя X–хромосомами, а у мужчин одной X–хромосомой и одной Y–хромосомой. Изменение кариотипа, как правило, связано с развитием генетических заболеваний (см. ниже). Благодаря культивированию клеток человека in vitro можно быстро получить достаточно большой материал для приготовления препаратов. Для кариотипирования обычно используют кратковременную культуру лейкоцитов периферической крови. Цитогенетические методы используются и для описания интерфазных клеток. Например, по наличию или отсутствию полового хроматина (телец Барра, представляющих собой инактивированные X-хромосомы) можно не только определять пол индивидов, но и выявлять некоторые генетические заболевания, связанные с изменением числа X-хромосом (см. ниже). Картирование хромосом человека. Для картирования генов человека широко используются методы биотехнологии. В частности, методы клеточной инженерии позволяют объединять различные типы клеток. Слияние клеток, принадлежащих к разным биологическим видам, называется соматической гибридизацией. Сущность соматической гибридизации заключается в получении синтетических культур путем слияния протопластов различных видов организмов. Для слияния клеток используют различные физико-химические и биологические методы. После слияния протопластов образуются многоядерные гетерокариотические клетки. В дальнейшем при слиянии ядер образуются синкариотические клетки, содержащие в ядрах хромосомные наборы разных организмов. При делении таких клеток in vitro образуются гибридные клеточные культуры. В настоящее время получены и культивируются клеточные гибриды «человек × мышь», «человек × крыса» и многие другие. В гибридных клетках, полученных из разных штаммов разных видов, один из родительских геномов постепенно теряет хромосомы. Эти процессы интенсивно протекают, например, в клеточных гибридах между мышью и человеком. Если при этом следить за каким-либо биохимическим маркером (например, определенным ферментом человека) и одновременно проводить цитогенетический контроль, то, в конце концов, можно связать исчезновение хромосомы одновременно с биохимическим признаком. Это означает, что ген, кодирующий этот признак, локализован в данной хромосоме. Дополнительная информация о локализации генов может быть получена при анализе хромосомных мутаций (делеций). Биохимические методы. Все многообразие биохимических методов делится на две группы. а). Методы, основанные на выявлении определенных биохимических продуктов, обусловленных действием разных аллелей. Легче всего выявлять аллели по изменению активности ферментов или по изменению какого-либо биохимического признака. б). Методы, основанные на непосредственном выявлении измененных нуклеиновых кислот и белков с помощью гель-электрофореза в сочетании с другими методиками (блот-гибридизации, авторадиографии). Использование биохимических методов позволяет выявить гетерозиготных носителей заболеваний. Например, у гетерозиготных носителей гена фенилкетонурии изменяется уровень фенилаланина в крови. Методы генетики мутагенеза Мутационный процесс у человека у человека, как и у всех других организмов, ведет к возникновению аллелей и хромосомных перестроек, отрицательно влияющих на здоровье. Генные мутации. Около 1% новорожденных заболевают вследствие генных мутаций, из которых часть вновь возникшие. Темп мутирования различных генов в генотипе человека неодинаков. Известны гены, которые мутирует с частотой 10–4 на гамету на поколение. Однако большинство других генов мутируют с частотой, в сотни раз меньшей (10–6). Ниже приведены примеры наиболее частых генных мутаций у человека: Типы и названия мутаций Аутосомно-доминантные Поликистоз почек Нейрофиброматоз Множественный полипоз толстой кишки Аномалия лейкоцитов Пельгера Несовершенный остеогенез Синдром Марфана Аутосомно-рецессивные Микроцефалия Ихтиоз (не сцепленный с полом) Рецессивные, сцепленные с полом Мышечная дистрофия Дюшена Гемофилия А Гемофилия В Ихтиоз (сцепленный с полом) Частота мутаций (на 1 млн. гамет) 65...120 11...100 10...50 9...27 7...13 4...6 27 11 43...105 37...52 2...3 24 Хромосомные и геномные мутации в абсолютном большинстве возникают в половых клетках родителей. Один из 150 новорожденных несет хромосомную мутацию. Около 50% ранних абортов обусловлено хромосомными мутациями. Это связано с тем, что одна из 10 гамет человека является носителем структурных мутаций. Возраст родителей, особенно возраст матерей, играет важную роль в увеличении частоты хромосомных, а возможно, и генных мутаций. Полиплоидия у человека встречается очень редко. Известны случая рождения триплоидов – эти новорожденные рано умирают. Тетраплоиды обнаружены среди абортированных зародышей. В настоящее время мутационный процесс у человека характеризуется тем, что протекает на фоне повышенной концентрации мутагенных факторов, созданной производственной деятельностью самого человека. Важнейшая задача сегодняшнего дня – выявление мутагенных свойств загрязнителей, особенно новых химических веществ (лекарств, пестицидов, пищевых добавок, различных видов топлива и т.д.), и разработка методов технологии, позволяющих предотвратить возникновение опасных концентраций этих агентов. Одним из сильнейших мутагенов является радиация (ионизирующие излучения). Доказано, что не существует пороговой дозы ионизирующих излучений. Другими словами, индукция мутаций может быть достигнута при действии любых доз, а при увеличении дозы пропорционально растет число мутаций. Мутагенным действием на клетки человека обладают и некоторые вирусы, причем даже в ослабленной форме, которая используется для приготовления вакцин. Известно также, что большинство мутагенов обладают и канцерогенными свойствами, то есть они могут индуцировать развитие злокачественных опухолей (см. ниже). В то же время существуют факторы, которые снижают частоту мутаций – антимутагены. К антимутагенам относятся некоторые витамины– антиоксиданты (например, витамин Е, ненасыщенные жирные кислоты), серосодержащие аминокислоты, а также различные биологически активные вещества, которые повышают активность репарационных систем. Популяционные методы Главными чертами человеческих популяций являются: общность территории, на которой живет данная группа людей, и возможность свободного вступления в брак. Факторами изоляции, т. е. ограничения свободы выбора супругов, у человека могут быть не только географические, но и религиозные и социальные барьеры. В популяциях человека наблюдается высокий уровень полиморфизма по многим генам: то есть один и тот же ген представлен разными аллелями, что приводит к существованию нескольких генотипов и соответствующих фенотипов. Таким образом, все члены популяции отличаются друг от друга в генетическом отношении: практически в популяции невозможно найти даже двух генетически одинаковых людей (за исключением однояйцевых близнецов) В популяциях человека действуют различные формы естественного отбора. Отбор действует как во внутриутробном состоянии, так и в последующие периоды онтогенеза. Наиболее выражен стабилизирующий отбор, направленный против неблагоприятных мутаций (например, хромосомных перестроек). Классический пример отбора в пользу гетерозигот – распространение серповидноклеточной анемии (см. ниже). Популяционные методы позволяют оценить частоты одних и тех же аллелей в разных популяциях. Кроме того, популяционные методы позволяют изучать мутационный процесс у человека. По характеру радиочувствительности человеческая популяция генетически неоднородна. У некоторых людей с генетически обусловленными дефектами репарации ДНК радиочувствительность хромосом повышена в 5…10 раз по сравнению с большинством членов популяцией. 2. Генетические (наследственные) заболевания. Примерно 10% болезней человека определяются патологическими генами либо генами, обусловливающими предрасположенность к определенным болезням. Следовательно, необходимо различать собственно генетические (наследственные) заболевания и заболевания с генетической предрасположенностью. Собственно генетические заболевания практически на 100% зависят от генотипа. Известно несколько тысяч таких заболеваний. Обычно это моногенные заболевания, то есть связанные с дефектом одного генетического фактора. Проявление их подчиняется общим закономерностям реализации действия гена. Генетические заболевания можно разделить на геномные (изменяется число хромосом, например, при синдроме Дауна, или трисомии 21), хромосомные (изменяется структура хромосом, например, при синдроме «кошачьего крика»), и молекулярные (изменяется последовательность нуклеотидов ДНК – большинство заболеваний, например, при фенилкетонурии). Заболевания с наследственной предрасположенностью зависят и от генотипа, и от среды, например: гипертоническая (ишемическая) болезнь, сахарный диабет, ревматоидные заболевания, язвенные болезни желудка и двенадцатиперстной кишки, многие онкологические заболевания, шизофрения и другие заболевания психики. Обычно это полигенные заболевания, обусловленные сочетанием нескольких генетических дефектов. Факторами, способствующими развитию этих заболеваний, являются неправильное питание, гиподинамия, различные вредные привычки. Иначе говоря, эти болезни имеют мультифакториальную природу. Рассмотрим несколько примеров генетических (наследственных) болезней человека, связанных с нарушением обмена веществ. Различные нарушения обмена веществ обычно связаны с изменением активности ферментов или структуры клеточных мембран (а как следствие, часто связаны с изменением активности гормонов). Как правило, нарушения обмена веществ обусловлены изменениями в структуре гена – точковыми мутациями. Однако нужно иметь в виду, что сходные нарушения обмена веществ могут быть обусловлены как генетическими факторами, так и неблагоприятным воздействием среды. Алкаптонурия – неполное окисление одного из продуктов метаболизма (гомогентизиновой кислоты). Аутосомно-рецессивное заболевание. Проявляется в виде артритов конечностей и позвоночника. Сопутствующим признаком является «мышиный» запах мочи у больных людей. Это первое заболевание, для которого была доказана его молекулярно-генетическая природа (А. Гаррод, 1909). Галактоземия – невозможность усваивать молочный сахар. Аутосомное полудоминантное заболевание. Связано с недостаточной активностью фермента, обеспечивающего превращение галактозы (молочного сахара) в глюкозу. У гетерозигот Аа активность указанного фермента составляет 50% от нормы, а у гомозигот аа – не превышает 10% от нормы. При этом наблюдаются желтуха, диспепсические расстройства, поражение печени и селезенки, катаракты, а главное – умственная отсталость. Частота заболевания составляет 1:50 тыс. новорожденных; частота носителей – 1:100. Диета, не содержащая молочного сахара, предотвращает развитие указанных симптомов. Подобный способ лечения наследственных болезней можно рассматривать как генотерапию. Муковисцидоз (МВ), или кистозный фиброз поджелудочной железы относится к наиболее тяжелым наследственным заболеваниям. Характеризуется моногенным аутосомно-рецессивным типом наследования. В среднем 1 из 20 представителей белой расы является гетерозиготным носителем гена муковисцидоза. Частота среди новорожденных – 1 : 2.000; ежегодно в странах СНГ рождается 2…2,5 тысячи детей с этим тяжелым, часто ведущим к летальному исходу заболеванием. В последнее время продолжительность жизни этих больных увеличивается, и их удельный вес в популяциях возрастает. Дефект гена МВ обусловлен рядом мутаций, одна из которых является делецией трех нуклеотидов, что приводит к утрате одной из аминокислот в трансмембранном регуляторном белке МВ. МВ проявляется в кишечной форме (недостаточность поджелудочной железы), легочной и смешанной форме. Фенилкетонурия (ФКУ) – нарушение высшей нервной деятельности. Аутосомно-рецессивное заболевание. Обусловлено различными мутациями в гене, контролирующем метаболизм фенилаланина (одной из аминокислот). Фенилаланин превращается не в тирозин, а в фенилпировиноградную кислоту. В результате нарушается миелинизация мозга, что приводит к нарушениям в развитии нервной системы, к слабоумию, микроцефалии. Частота среди новорожденных – 1 : 10 тыс., частота носителей – 1 : 50. При своевременном выявлении этого заболевания и назначении диеты с пониженным содержанием фенилаланина симптомы ФКУ значительно смягчаются. Гиперхолестеринемия. Это мультифакториальное заболевание, связанное с нарушением обмена холестерина. Избыток холестерина откладывается на стенках сосудов в виде атеросклеротических бляшек, что приводит к развитию ишемической болезни. Холестерин является компонентом клеточных мембран, на его основе синтезируются стероидные гормоны, холевые (желчные) кислоты; кроме того, холестерин входит в состав кожного сала. Это означает, что холестерин необходим нашему организму. В среднем около 1000 мг холестерина в сутки синтезируется у человека в клетках печени, а около 500 мг поступает с животной пищей. При избытке пищевого холестерина он поступает в клетки печени и подавляет синтез холестерина этими клетками. Но при нарушениях холестеринового обмена (например, при гиперхолестеринемии) холестерин, поступивший в организм с пищей, не поступает в клетки печени. Тогда в кровеносных сосудах накапливается и избыток пищевого холестерина, и холестерина, синтезированного в печени. Гемоглобинопатии – это нарушения структуры гемоглобина (гемоглобин – переносчик О2, СО2, К, Н; измененный гемоглобин не может нормально выполнять свои функции). Распространены в регионах, неблагополучных по малярии. Известны десятки молекулярно-генетических причин, ведущих к нарушению структуры гемоглобина: точковые мутации, делеции, нарушения процессинга мРНК. В странах Южной Европы широко распространены гемоглобинопатии под общим названием талассемия. Различают легкие и тяжелые формы этих заболеваний. Одной из форм гемоглобинопатий является серповидноклеточная анемия – аутосомное заболевание, которое в полной мере проявляется у гомозигот. В состав молекулы гемоглобина взрослого человека входят две –цепи (– цепь закодирована в 16-ой хромосоме) и две –цепи (–цепь закодирована в 11-ой хромосоме). В состав –цепи входит 146 аминокислотных остатков, при этом в нормальной –цепи шестым аминокислотным остатком является глутаминовая кислота. С участием нормальной –цепи образуется нормальный гемоглобин – HbA. В нетранскрибируемой нити участка ДНК, кодирующего –цепь, глутаминовая кислота закодирована триплетом ГАА. Если же в результате мутации в ДНК произойдет замена триплета ГАА на триплет ГТА, то на месте глутаминовой кислоты в молекуле гемоглобина в соответствии с генетическим кодом появится валин. В итоге вместо гемоглобина HbA появится новый гемоглобин – HbS. Такая замена всего лишь одного нуклеотида и одной аминокислоты приводит к развитию тяжелого заболевания – серповидноклеточной анемии. На клеточном уровне эта болезнь проявляется в том, что эритроциты приобретают форму серпа и теряют способность к нормальному транспорту кислорода. Гомозиготы HbS/HbS умирают в раннем детстве. Зато гетерозиготы HbA/HbS характеризуются слабо измененными эритроцитами. При этом изменение формы эритроцитов значительно повышает устойчивость гетерозигот к малярии. Поэтому в тех регионах Земли, где свирепствует малярия (например, в Африке), отбор действовал в пользу гетерозигот. Таким образом, серповидноклеточная анемия – это пример относительности «полезности» и «вредности» мутаций. Сахарный диабет. Болезнь связана с дефицитом гормона инсулина. Мультифакториальное заболевание. Часто наследуется рецессивно. Имеются данные и о полигенном наследовании. Генотерапия нередко сводится к ежедневному введению в организм дефицитного гормона. Обычно для этих целей используют гормональный препарат, получаемый из поджелудочной железы крупного рогатого скота. Однако при этом примерно у 5% больных возникают аллергические реакции, обусловленные антигенной несовместимостью гормона и клеток человека. Решение этой проблемы, фактически спасающее от неминуемой гибели эту часть больных диабетом, было найдено с помощью методов генной инженерии. Инсулиновый ген человека был введен в плазмиду и при определенных условиях активно функционировал в клетках кишечной палочки. Он вырабатывал гормон с антигенными характеристиками, полностью соответствующими человеческому гормону. Хромосомные и геномные болезни (синдромы) Хромосомные болезни в большинстве случаев не наследуются. Нарушения числа или структуры хромосом возникают в гаметогенезе родителей. Синдромы, обусловленные хромосомными аберрациями, исключительно разнообразны, но каждый из них встречается сравнительно редко (1 случай на десятки тысяч новорожденных). Наиболее изучен синдром «кошачьего крика», связанный с делециями в коротком плече 5-й хромосомы. Основное проявление – необычный плач детей из-за патологии гортани и голосовых связок. Сопутствующие признаки: лунообразное лицо, микроцефалия, синдактилия, врожденные пороки сердца и др. Частота – 1 на 50 тыс. новорожденных. Обычно больные дети умирают в раннем возрасте. Геномные болезни менее разнообразны, но встречаются чаще. Из геномных болезней наиболее детально изучен синдром Дауна (болезнь Дауна, БД), в основе которого лежит трисомия по 21-й хромосоме. Больные дети с синдромом Дауна рождаются с достаточно высокой частотой – 1:750. В 80% случаях непосредственной причиной является нерасхождение хромосом в I делении мейоза. Главным морфологическим признаком болезни Дауна можно считать монголоидный тип лица, однако более важно отметить умственную отсталость, проявляющуюся в широком диапазоне от полной идиотии до сравнительно легких степеней дебильности. При синдроме Дауна описаны пороки сердца и крупных сосудов, органов пищеварительного тракта, снижение продолжительности жизни в 5…10 раз, черты преждевременного старения, отклонения в дерматоглифике, высокая частота злокачественных опухолей (особенно лейкозов), иммунодефицитные состояния, многочисленные врожденные уродства, нарушения репарации первичных молекулярных повреждений ДНК. Кроме синдрома Дауна, существует и множество других генетических заболеваний, связанных с изменением числа хромосом: синдромы Патау, Эдвардса, Тѐрнера, Кляйнфельтера и др. Причины возникновения таких заболеваний до сих пор не выявлены. Однако имеются достоверные данные, указывающие на повышенный риск рождения больного ребенка у матерей в возрасте свыше 30…35 лет. Генетика онкологических заболеваний (злокачественных, или раковых опухолей) Рак – это заболевание, связанное с образованием злокачественных опухолей в различных органах (например, рак легких, желудка, кишечника, поджелудочной железы, молочной железы, яичников, матки, простаты, периферической нервной системы, кожи) и тканях (например, саркомы, остеосаркомы, нейробластомы, глиобластомы, лейкемии, меланомы, ретинобластомы, ксеродермы). Обычно раковые опухоли развиваются в тех тканях, в которых клетки интенсивно делятся. Известно около 100 типов раковых опухолей, из них наиболее часты встречающиеся: раки легких, молочной железы, толстой кишки, простаты и матки. Смертность от рака составляет 20% смертности в развитых странах. Раковые опухоли – это скопления интенсивно делящихся клеток. Одной из основных особенностей раковых клеток является их относительная автономность, способность к неограниченному числу делений, обособление и способность метастазировать (разноситься по всему организму). Раковые клетки не подчиняются контрольным механизмам, регулирующим жизнедеятельность нормальных клеток. Злокачественность, т.е. способность одной или многих клеток приводить к развитию опухолей и метастазированию, передается в ряду соматических клеток. Процесс развития раковой опухоли называется канцерогенез. Начинается канцерогенез с нарушений клеточного цикла однойединственной клетки, которая начинает интенсивно делиться (пролиферировать). К моменту обнаружения раковой опухоли путем рентгеноскопии в ее состав входит около 10 миллионов клеток (диаметр опухоли ~ 1 мм), к моменту обнаружения путем пальпирования ~ миллиард клеток (диаметр опухоли ~ 10 мм), при достижении опухолью размера 10 см (~ триллиард клеток) наступает летальный исход. Достаточно условно все раковые опухоли подразделяются на доброкачественные и злокачественные. Доброкачественные опухоли развиваются медленно, и образующие их клетки располагаются компактно. Злокачественные опухоли развиваются быстро и сопровождаются метастазами. Причины возникновения рака до сих пор не установлены. Считается, что это большая неоднородная группа мультифакториальных заболеваний, которые вызываются взаимодействием генотипа и определенных факторов среды – канцерогенов. Канцерогены. Раковые заболевания вызывают самые разнообразные факторы – канцерогены. С помощью близнецового метода показано, что в развитии раковых заболеваний человека значение внешних факторов исключительно велико. К физическим канцерогенам относятся: ионизирующее излучение, ультрафиолет, температурные и механические воздействия. При облучении покровов организма развивается рак кожи, при общем облучении – лейкозы, опухоли костей, рак щитовидной железы, при вдыхании радиоактивной пыли – рак легких. К химическим канцерогенам относятся самые разнообразные органические вещества: от четыреххлористого углерода до сложных полициклических и гетероциклических соединений. Например, смолы табачного дыма провоцируют рак легких (плоскоклеточную карциному), причем заболевание интенсивно развивается у курильщиков с 10…20-летним стажем. К биологическим канцерогенам относятся вирусы и их производные (провирусы). В клетках позвоночных животных присутствуют десятки встроенных в хромосомы геномов ДНК-содержащих опухолеродных вирусов (провирусов). Доказана вирусная природа рака молочной железы у мышей. Считается, что вирусы могут провоцировать раковые заболевания у человека (например, вирус гепатита – рак печени), однако это положение не доказано. Заметим, что часто канцерогенами являются известные мутагены. Генетика злокачественных опухолей. В настоящее время доказано, что рак – это генетическое заболевание. Злокачественность, т.е. способность одной или многих клеток приводить к развитию опухолей и метастазированию, передается в ряду соматических клеток. Известны случаи семейных раков (опухоли желудка, молочной железы, легких, матки и т. д.). Однако по наследству передается не сам рак, а лишь предрасположенности к раковым заболеваниям. В некоторых популяциях частота отдельных раковых заболеваний значительно ниже средней (в окрестностях Бомбея в 200 раз реже встречается рак кожи, в Нигерии – в 300 раз реже рак пищевода, в Англии – в 100 раз реже рак печени). Строго научная точка зрения состоит в том, что признается передача по наследству лишь предрасположенности к раковым заболеваниям, причем иногда речь идет о моногенной, в других случаях – о полигенной наследственности. Например, при генетически обусловленных дефектах репарации ДНК (или, точнее, при синдромах хромосомной нестабильности) частота рака возрастает в 100…10000 раз. В начале XX в. была предложена мутационная теория рака, в которой подчеркивалась роль генных и хромосомных соматических мутаций в этиологии рака. В настоящее время получила признание вирусо-генетическая теория рака, согласно которой генетический материал онкогенных вирусов встраивается в хромосому клетки. Такое изменение генома, точнее отдельных, немногих локусов, нарушает биохимический механизм клеток, они приобретают автономность и начинают усиленно делиться. Вирусо-генетическая теория была дополнена концепцией онкогенов. Онкогены – это участки хромосом нормальных клеток, которые под действием повреждающих ДНК факторов активируются и продуцируют белки, вызывающие злокачественность. В норме онкогены на протяжении большей части индивидуального развития (за исключением раннего эмбриогенеза) находятся в функционально неактивном состоянии либо очень слабоактивны. В целом можно сказать, что активация онкогенов обусловлена дестабилизацией генома мутагенами и другими агентами. В последнее десятилетие доказано, что в клетках позвоночных животных присутствуют десятки встроенных в хромосомы геномов ДНК-содержащих опухолеродных вирусов (провирусов). К эндогенным генетическим факторам канцерогенеза относятся мобильные элементы генома: транспозоны и ретротранспозоны. Медико-генетическое консультирование Еще в 1883 г. Фрэнсис Гальтон выдвинул идею о необходимости улучшения человеческого рода генетическими методами. Им же предложен термин «евгеника», означающий учение о наследственном здоровье человека и путях улучшения его наследственных свойств. Евгеника была популярна в России в 1920-е гг. (Н. К. Кольцов). Однако данные популяционно-генетических исследований позволяют утверждать, что в обозримом будущем такие работы не имеют никаких перспектив. Человек как биосоциальное существо сложился в ходе длительных эволюционных преобразований, и надеяться изменить вид за исторически короткие сроки бессмысленно. С точки зрения генетики человека ни одна группа людей, несмотря на определенные различия между ними, не имеют каких-либо преимуществ друг перед другом. Поэтому генетика отвергает евгенические вмешательства в наследственность человека с целью улучшения его природы. Методы, предлагавшиеся старыми евгениками, были сугубо селекционными: ограничения на межрасовые браки, иммиграционные барьеры, даже стерилизация генетически неполноценных людей. На практике методы евгеники послужили основанием для создания концентрационных лагерей в фашистской Германии, где подвергались массовому уничтожению представители неарийских рас. Естественно, что подобная теория и практика несовместимы с гуманистической моралью общества, в центре внимания которого находится человек. Поэтому в настоящее время наибольшее внимание уделяется мерам по предотвращению рождения детей с наследственной патологией. Медико-генетическое консультирование призвано избавить человечество от страданий, связанных с наследственными (генетическими) заболеваниями. Главные цели медико-генетического консультирования заключаются в установлении роли генотипа в развитии данного заболевания и прогнозировании риска иметь больных потомков. Рекомендации, даваемые в медико-генетических консультациях в отношении заключения брака или прогноза генетической полноценности потомства, направлены на то, чтобы они учитывались консультируемыми лицами, которые добровольно принимают соответствующее решение. В распоряжении врачей имеется весь арсенал перечисленных выше методов генетики человека и некоторые специальные методы. Методы пренатальной диагностики разнообразны: от УЗИ до фетоскопии (прямом рассматривании плода через специальный зонд). К собственно генетическим методам относятся: – хорионбиопсия (на 8-й неделе беременности) – отбор материала из ворсинок хориона. – плацентобиопсия (на 12-й неделе) – отбор материала из плаценты. – амниоцентез (на 15…18-й неделе) – отбор материала из амниотической жидкости. – кордоцентез (на 18…22-й неделе) – отбор материала из кровеносных сосудов пуповины. Хорионбиопсия и плацентобиопсия позволяют производить наиболее раннюю диагоностику, но риск осложнений достигает 3 %. Кордоцентез производится слишком поздно, что затрудняет повторные исследования в случае сомнений. Поэтому среди методов, позволяющих диагностировать заболевание до рождения ребенка, ведущее место занимает амниоцентез – получение амниотической жидкости и клеток плода с помощью прокола плодного пузыря операции под контролем УЗИ – простейшей, не травмирующей плод хирургической. Этим методом диагностируют многие хромосомные болезни и некоторые заболевания, в основе которых лежат генные мутации. Риск осложнений относительно невелик – примерно 0,2 %. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/ НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ ЧЕЛОВЕКА Лектор: ст.п. Мамедова М. З. ПЛАН: 1. Хромосомные болезни 2. Классификация по типу мутаций 3. Факторы, вызывающие геномные и хромосомные мутации 4. Механизм нарушения развития при хромосомных болезнях Наследственность всегда представляла собой одно из наиболее труднообъяснимых явлений в истории человечества. Ещѐ в древности люди старались разгадать явление наследственности, бессознательно применяя генетические методы в разведении растений и животных. В отношении человека также имелись жизненные наблюдения, относящиеся к наследованию самых разнообразных признаков: цвета волос, глаз, формы уха, носа, губ, роста, телосложения и прочих признаков, наследование уродств, наблюдаемых у предков и потомков одной семьи. Такая наследственная болезнь, как гемофилия, известна с давних времѐн. Именно поэтому в древних законах некоторых народов запрещались браки с родственниками больных эпилепсией и гемофилией. Многие ученые выдвигали свои гипотезы о возникновении наследственных патологии. Однако их предположения не были основаны на строгих научных наблюдениях. В XX веке с развитием науки ―генетики― было выяснено и научно подтверждено, что такие патологии имеют наследственную природу. До этого такие заболевания считались болезнями с неустановленной этиологией. Изучением наследственных болезней занимается наука, получившая название ―медицинская генетика―. ―Генетика― в современном понимании – это наука о наследственности и еѐ изменчивости. Законы, лежащие в основе современной генетико-хромосомной теории наследственности были открыты ещѐ и начале XX столетия. Особенно больших успехов достигла генетика в последнее время в связи с внедрением в биологию достижений физики, химии, и их принципиально новых направлении. Наследственные болезни – это болезни, обусловленные нарушениями в процессах хранения, передачи и реализации генетической информации. ХРОМОСОМНЫЕ БОЛЕЗНИ. Все наследственные заболевания, обусловленные наличием одного патологического гена, наследуются, в соответствии с законами Менделя. Возникновение наследственных болезней обусловлено нарушениями в процессе хранения, передачи и реализации наследственной информации. Ключевую роль наследственных факторов в возникновении патологического гена, приводящего к заболеванию, подтверждает очень высокая частота ряда заболеваний в некоторых семьях по сравнению с населением в целом. В основе возникновения наследственных заболеваний лежат мутации: преимущественно хромосомные и генные. Следовательно, выделяют хромосомные и наследственные генные болезни. Хромосомные болезни классифицируются по типу генной или хромосомной мутации и сопутствующей индивидуальности, вовлекаемой в изменение хромосомы. В связи с этим выдерживается важный для подразделения по нозологическому принципу наследственной патологии патогенетический принцип: 1. для каждой болезни устанавливается генетическая структура (хромосома и еѐ сегмент), которая определяет патологию; 2. выявляется, в чѐм состоит генетическое нарушение. Оно определяется недостатком либо избытком хромосомного материала. Определение хромосомных болезней по клиническим наблюдениям имеет второстепенное вспомогательное значение, поскольку она всегда затруднена из-за значительной общности нарушений физического либо умственного развития при совершенно разных хромосомных аномалиях. В каждом случае болезни необходимо определить, где произошла мутация: в гаметах родителей или же в зиготе, а также установить: является мутация возникшей заново или она унаследована от родителей, имевших еѐ в соматических клетках до формирования гамет. Сама по себе мутация ведѐт к нарушению синтеза определѐнного полипептида (структурного белка или фермента). В зависимости от того, какова роль этого полипептида в жизнедеятельности организма, у больного возникают нарушения фенотипа, локального, а чаще системного порядка. Клиникоцитогенетические сопоставления при хромосомных болезнях преследуют две цели: правильную диагностику болезни и выяснение роли отдельных хромосом и их сегментов в возникновении аномалий развития. Такие сопоставления помогают определить связь патологического фенотипа с изменениями хромосом. Нарушение нормального хромосомного баланса приводит к расстройству развития организма, как единой системы. Степень отклонений в развитии организма зависит от степени хромосомных нарушений. Дисбаланс по крупным хромосомам встречается реже, чем по мелким. Полные формы хромосомных аномалий вызывают более серьѐзные отклонения, нежели частичные. Недостаток генетического материала вызывает более серьѐзные пороки, чем его избыток. Качественный, то есть генный состав численно или структурно изменяющихся хромосом, является важнейшим фактором тяжести и спектра нарушений в развитии организма. Но всѐ же фенотипический эффект определяется не только относительным содержанием в хромосоме генетически неактивного материала, но и составом структурных генов. Об этом свидетельствует значительная разница в частоте вовлеченности индивидуальных хромосом в полный или частичный дисбаланс. Множественные врождѐнные пороки развития, как главное фенотипическое проявление хромосомных болезней, формируется в раннем эмбриогенезе, когда только начинается гистогенез (формирование тела зародыша) и происходит органогенез (формирование органов). К моменту рождения все пороки развития уже имеются. Исключение составляют лишь те, которые связаны с формированием первичных или вторичных половых признаков в период полового созревания. Они наблюдаются при нарушениях в системе половых хромосом. Ранее и множественное нарушение развития систем организма объясняет такую характерную черту фенокариотипических связей, как общность клинических признаков при разных хромосомных болезнях. Задержка общего физического или умственного развития, черепно-лицевые дисморфии и аномалии других частей скелета, порока сердечно-сосудистой, мочеполовой, нервной и других систем, различные отклонения в гормональном, иммунологическом и биохимическом статусе организма служат проявлениями различных хромосомных болезней. Они вызывают развитие какого-либо отдельного специфического порока. Зачастую хромосомное заболевание выражается в сочетании нескольких пороков. Именно из-за всего выше изложенного, постановка диагноза по клиническим или патолого-анатомическим показателям возможна лишь для некоторых болезней и всегда нуждается в цитогенетическом подтверждении. КЛАССИФИКАЦИЯ ПО ТИПУ МУТАЦИЙ. Все хромосомные болезни классифицируются по типу мутаций их вызывающих. По этому принципу все хромосомные болезни можно разделить на две большие группы: болезни, вызванные изменением числа хромосом при сохранении их структуры (геномные мутации), и болезни, обусловленные изменениями структуры хромосом (хромосомные мутации). У человека все известные виды мутации изучены и описаны. ЧИСЛЕННЫЕ НАРУШЕНИЯ: состоят в изменении плоидности хромосомного набора и в отклонении числа хромосом от диплоидного по каждой их паре в сторону уменьшения (такое нарушение называется моносомия) или в сторону увеличения (трисомия и другие формы полисомий). Хорошо изучены триплоид-ные и тетраплоидные организмы; частота их возникновений низкая. В основном это самоабортировавшие эмбрионы (выкиды-ши) и мѐртворождѐнные. Если всѐ-таки и появляются новорождѐнные в с такими нарушениями, то живут они, как правило, не больше 10 дней. Геномные мутации по отдельным хромосомам многочисленны, они составляют основную массу хромосомных болезней. Полные моносомии наблюдаются по X-хромосоме, приводя к развитию синдрома Шеревского-Тернера. Аутосомные моносомии среди живорождѐнных очень редки. Живорождѐнные – это организмы с существенной долей нормальных клеток: моносомия касается аутосом 21 и 22. Полные трисомии изучены по значительно большему числу хромосом: 8, 9, 13, 14, 18 ,21, 22 и Х-хромосом. Число Х-хромосом у индивида может доходить до 5 и при этом сохраняется его жизнеспособность, в основном непродолжительная. Изменения количества индивидуальных хромосом вызывают нарушения их распределения по дочерним клеткам во время первого и второго мейотического деления в гаметогенезе или в первых дроблениях оплодотворѐнной яйцеклетки. Причинами такого нарушения могут быть: 1.Нарушение расхождения во время анафазы ре-дуплицируемой хромосомы, в результате чего удвоенная хромосома попадает лишь в одну дочернюю клетку. 2.Нарушение конъюгации гомологичных хромосом, что также может нарушить правильность расхождения гомологов по дочерним клеткам. 3.Отставание хромосом в анафазе при их расхождении в дочерней клетке, что может привести к утрате хромосомы. Если одно из выше изложенных нарушений происходит в двух или более последовательных делениях, возникают тетросомии и другие виды полисомии. СТРУКТУРНЫЕ НАРУШЕНИЯ. Какого бы вида они ни были, вызывают части материала по данной хромосоме ( частичная моносомия), либо его избытка (частичная трисомия). К частичной моносомии могут привести простые делеции всего плеча, интерстициальные и концевые (терминальные). В случае концевых делеций обоих плеч Х-хромосома может стать кольцевой. Такие события могут произойти на любом этапе гаметогенеза, в числе и после завершения половой клеткой обоих мейотических делений. Также к частичной моносомии могут привести имеющиеся в организме родителя сбалансированные перестройки типоинверсий, реципрокных и робертсоновских транслокаций. Это является результатом формирования несбалансированной гаметы. Частичные трисомии также возникают неодинаково. Это могут быть возникшие заново дубликации того или иного сегмента. Но чаще всего они являются унаследованными от нормальных фенотипических родителей, которые являются носителями сбалансированных транслокаций или инверсий в результате попадания в гамету хромосомы несбалансированной в сторону избытка материала. Порознь частичные моносомии или трисомии встречаются реже, чем в комбинации, когда пациент одновременно имеет частичную моносомию по одной хромосоме и частичную трисомию по другой. Основную группу составляют изменения содержания в хромосоме структурного гетерохроматина. Это явление лежит в основе нормального полиморфизма, когда вариации в содержании гетерохроматина не ведут за собой неблагоприятных изменений фенотипа. Однако в ряде случаев дисбаланс по гетерохроматиновым районам приводит к разрушению умственного развития. ФАКТОРЫ, ВЫЗЫВАЮЩИЕ ГЕНОМНЫЕ И ХРОМОСОМНЫЕ МУТАЦИИ. Решающим фактором в проявлении хромосомного заболевания является возникновение в гаметах или зиготе на первых этапах еѐ дробления хромосомного нарушения. Схема этих нарушений у человека недостаточно хорошо изучена из-за резвычайной сложности изучения влияния внешних и внутренних факторов на гаметогенез и первые дробления оплодотворѐнной яйцеклетки. К примеру, в мутации в яйцеклетках могут иметь место ещѐ во внутриутробном периоде развития, поскольку в это время протекает первое мейотическое деление. Фактором, провоцирующим хромосомное нарушение может быть мутагенный фактор физической, химической или биологической природы, действующей в окружающей среде. Иногда мутагенами могут выступать и факторы эндогенного происхождения. Это подтверждают наблюдения за повышенной частотой хромосомных аберраций в организмах при нарушении обмена витамина В12 при некоторых аутоиммунных состояниях. Однако в каждом конкретном случае заболевания выделить мутагенный фактор практически не удаѐтся и поэтому вернее всего предположить, что такие геномные или хромосомные мутации спонтанны, а не индуцированы. Возникновение хромосомных болезней зависит от возраста, физического здоровья родителей и других факторов. Учѐт этих факторов важен для правильного прогнозирования здоровья потомства. Риск иметь ребѐнка с трисомией 13, 18 или 21 для женщин в возрасте 40 лет и старше в несколько раз выше, чем у женщин в возрасте 23-25 лет. Механизм такого влияния возраста не выяснен. Влияние возраста матери может быть и обратным: Х-хромосомия чаще встречается у молодых матерей. На примере болезни Дауна обоснована разная роль женского и мужского организмов в рождении детей с трисомией 21: не расхождение хромосомы 21 в мейозе у женщин встречается в 3 раза чаще, а в первом мейотическом делении в 5 раз чаще, чем у мужчин. Если судить по частоте передачи хромосомно несбалансированных гамет от носителей сбалансированных перестроек, между мужчинами и женщинами также имеется существенная разница. Ещѐ одним внутренним фактором, влияющим на возникновение хромосомного заболевания, является наследственное предрасположение (семейное предрасположение). В семьях, имевших ребѐнка хромосомной болезнью при кариотипически нормальных родителях, повторный риск рождения ребѐнка с хромосомной патологией хоть и незначителен, но повышен. Известно много подобных случаев, но основные причины остаются до сих пор неясными. Поскольку из экспериментальной цитогенетики известно, что стадии мейоза, включая расхождения хромосом, находятся под генетическим контролем, можно предполагать, что предрасположение к повторному возникновению гамет с численным дисбалансом хромосомного набора также является генетическим. МЕХАНИЗМ НАРУШЕНИЙ РАЗВИТИЯ ПРИ ХРОМОСОМНЫХ БОЛЕЗНЯХ. Хромосомные болезни развиваются вследствие того, что изменение количества вещества какой-то части генетической информации в сторону еѐ избытка или недостатка расстраивает ход нормальной реализации генетической программы развития. Существенно именно несбалансированное изменение генетической информации. Избыток хромосомного материала при триплоидии огромен, однако его увеличение пропорционально при всех составных частях. И у триплоидного новорождѐнного организма пороки развития выражены относительно слабо. И эти пороки, и гибель таких организмов обусловлены аномалиями формирования плаценты. При трисомиях или моносомиях любого типа можно выделить три вида генетических эффектов: специфические, полуспецифические и неспецифические. СПЕЦИФИЧЕСКИЕ: связаны с изменением содержания структурных генов, кодирующих определѐнные специфические белки. Выяснение таких эффектов зависит от определения локализации отдельных генов в конкретных хромосомах и их участках, а также необходимо уметь с точностью определять активность соответствующих белков или иных ферментов организма. ПОЛУСПЕЦИФИЧЕСКИЕ: эффекты, обусловленные изменением содержания таких генов, которые содержатся в многочисленных копиях и контролируют ключевые этапы метаболизма клетки, важные для еѐ деления, миграции и других форм поведения. К этим генам относятся гены рибосомных и транспортных РНК, гистоновых и рибосомных белков, сократительных белков: актина, тубулина и других. Каковы фенотипические эффекты их дисбаланса сказать пока трудно. Они являются важнейшими в изучении этого вопроса на человеке. НЕСПЕЦИФИЧЕСКИЕ: связаны с изменѐнным содержанием гетерохроматина в клетке. Генетическая роль гетерохроматина в конкретных понятиях действия гена изучена полностью. Однако, многочисленные наблюдения, накопленные при изучении эффектов дисбаланса по гетерохроматину на многих биологических видах, дают основание говорить о важной роли гетерохроматина для нормального протекания делений клеток и клеточного роста. Также гетерохроматин необходим для нормального формирования в онтогенезе количественных признаков, определяемых полигенно (рост, длина конечностей, размер тела). Выяснению полуспецифических и неспецифических эффектов генного дисбаланса при хромосомных болезнях помогает изучениефенотипа на клеточном уровне. Исследования показали, что клеточные характеристики при хромосомных болезнях могут меняться. Из этого следует, что существует общий для многих трисомий ―клеточный синдром‖. Этот синдром как раз и включает отклонения в параметрах клеточной репродукции. Следствием отклонений в фенотипе клетки могут стать наруженные межклеточные взаимодействия, важные для нормального морфогенеза. ПРИМЕРЫ ПОЛИСОМНЫХ БОЛЕЗНЕЙ. ПОЛИСОМИИ ПО ПОЛОВЫМ ХРОМОСОМАМ. Полисомии по половым хромосомам очень разнообразны. Они отличаются числом лишних хромосом, их типом и перекомбинациями. Частота Х и Yполисомий в популяции, если еѐ определять на основании хромосомного исследования, составляет 2:1000. Подавляющая часть Х и Y-полисомий приходится на трисомии: ХХХ, ХХY, ХYY. Х-полисомии при отсутствии Y-хромосомы. При хромосомном обследовании группы новорождѐнных девочек частота наиболее распространѐнного варианта Xполисомий – Х-трисомий составляет 1,3:1000. Заподозрить у больных Хтрисомию по фенотипу невозможно. У больных с кариотипом 47ХХХ нормальное умственное и физическое развитие, нормальная плодовитость, половое без отклонений. Однако риск хромосомных нарушений у детей таких больных повышен. Соматические аномалии обнаруживаются при тщательном обследовании почти у всех таких больных, но они выражены слабо, касаются отдельных органов и не служат поводом для обращения к врачу-специалисту. Интеллектуальное развитие нормальное, но в пределах нижней границы нормы. Больные намного чаще страдают шизофренией. С увеличением числа лишних Ххромосом в хромосомном наборе частота и степень отклонений от нормы нарастают, однако даже больные с тетросомией и пентосомией могут быть уже умственно неполноцеными, иметь черепно-лицевые дисморфии, аномалии зубов, скелета, различные отклонения в системах организма. Синдром Клайнфельтера. Страдают только женщины. Синдром характеризуется мужской конституцией, но часто имеющей явные или скрытые признаки гепоандризма (скудный волосяной покров, слабо развитая мускулатура, евнуховидные пропорции). Встречается односторонняя или двусторонняя гинекомастия. Половые органы отрафированы, наблюдается бесплодие. Х-моносомии. Моносомии по всей Х-хромосоме или какой-то еѐ составной части, которая лежит в основе полового недоразвития у женщин. Суммарная частота Х-моносомии составляет 0,7:1000 новорождѐнных девочек. Основной клинико-цитогенетической формой Х-моносомии является синдром Шерешевского-Тернера. Синдром Шерешевского-Тернера. Постановка диагноза этого синдрома возможна лишь в том случае, если у больной имеется три группы отклонений: 1. недоразвитие половых признаков; 2. врождѐнные соматические пороки развития; 3. низкий рост. В классическом виде синдром развивается при полной Х-моносомии, когда все клетки или их большинство имеют хромосомный набор 45Х. Приполной Хмоносомии клинические проявления синдрома многочисленны и характерны. Со стороны половой системы часто встречаются следующие отклонения: гипоплазия матки и фаллопиевых труб, первичная аменорея, отсутствие оволосения лобка и подмышечных впадин, недоразвитие грудных желез, бесплодие. Многочисленные отклонения наблюдаются и со стороны соматического статуса: нарушение скелета, черепно-лицевые дисморфии, девиация коленных суставов, укорочение костей, бочкообразная грудная клетка, характерен избыток кожи на шее, низкая линия волос, многочисленны кожные складки, лимфатический отек стоп, голеней, кистей рук и предплечий. В подростковом возрасте характерны: отставания в росте, слабое развитие вторичных половых признаков, аменорея, костные аномалии. Интеллект больных не отличается от нормального. ПОЛНЫЕ ТРИСОМИИ АУТОСОМ. Результаты анализа частоты встречаемости у человека полных трисрмий и моносомий по аутосомам объясняют положения о неравном генетическом эффекте избытка и недостатка хромосомного материала и о большом различии между индивидуальными аутосомами по патологическому морфогенетическому эффекту. Полная моносомия по аутосоме у живорождѐнных – исключительно редкое явление, недосказанное окончательно даже для наименее генетически ценной хромосомы, которой можно было бы считать аутосому 21. Полные моносомии нежизнеспособны уже на стадии гамет и зиготы по всем аутосомам, поскольку даже среди спонтанных абортов такие находки единичны и относятся к немногим аутосомам. Трисомии среди спонтанных абортов встречаются по всем аутосомам, исключая хромосому 1, с различной частотой. В постнатальном периоде с сохранением жизни в течение непродолжительного времени совместимы полные трисомии по немногим аутосомам: 8, 9, 13, 18, 21, 22, причем по аутосомам 8 и 9 часты случаи с наличием скопированных нормальных клеток, что уменьшает летальный эффект, вызванный дисбалансом генетического материала. Цитогенетические механизмы возникновения полных трисомий сводятся для всех аутосом главным образом к не расхождению пары гомологичных хромосом в мейозе у родителей. В небольшой части случаев наблюдается расхождение при делении зиготы. Для трисомии акроцентрических хромосом 13, 21, 22 имеет значение передача дополнительной хромосомы в транслокациях робертсоновского типа. Совсем редка передача полной аутосомы в транслокации с другими хромосомами. Трисомия 8. Хромосома 8 относится к числу тех немногих аутосом, трисомное состояние которых наблюдается у живорождѐнных младенцев. Количество новорождѐнных составляет 1:50000.Имеет место значительный полиморфизм клинической картины. Отмечается сравнительно неглубокая умственная отсталость, физическое недоразвитие, пороки умственного развития встречаются с частотой от 80% и более физические пороки до 20% (в основном лицевые дисморфии). При выраженном полиморфизме клинической картины более типичными проявлениями являются: удлинѐнность конечностей, скелетные аномалии, аплазия мышц конечностей, нарушение речи. Такие больные относительно жизнеспособны. В половозрелом возрасте могут иметь потомство. Трисомия 9. Частота обнаружения трисомии 9 среди спонтанных абортов равна 1:1000 беременностей. Практически все зачатия кончаются внутриутробной гибелью носителя лишней хромосомы 9. Для больных характерно: выраженное физическое внутриутробное недоразвитие, ряд черепно-лицевых пороков (расщелина нѐба, микрофтальмия), аномалия костей и суставов, порок сердца, пороки крупных сосудов, патология почек, выделительной системы, половых органов. Зафиксировано всего 5 живорождений. Продолжительность жизни не превышает трѐх месяцев и двух недель. Трисомия 21 (болезнь Дауна). Синдром Дауна характеризуется уменьшенным размером черепа, плоским затылком, косым расположением глаз, отсталостью в росте, несоответствием размеров туловища с размером конечностей, недораз-витием половых признаков, не проявлением вторичных половых признаков, значительной задержкой умственного развития. Синдромом Дауна поражаются оба пола в одинаковой степени, на 800 новорождѐнных приходится 1 с болезнью Дауна. Возникновение заболевания приходится на 8-10 неделю внутриутробного заболевания. При исследовании детей с синдромом Дауна обнаружили в клетках 47 хромосом. Наличие клеток с 47 хромосомами было установлено у всех 20 обследованных детей, независимо от половых различий. Лишняя хромосома, вызывающая болезнь Дауна, появляется вследствие нерасхождения соответствующей пары хромосом в мейозе. В некоторых случаях при рождении детей с болезнью Дауна у матерей найдено 46 хромосом вместо 47 типичных для этого заболевания. Одна из аутосом в этих случаях оказывается изменѐнной (удлинѐнной). Наблюдения за близнецами подтверждают сугубо наследственный характер этого заболевания. Изучено более 120 случаев этого деффекта у новорождѐнных близнецов. Конкордатность однояйцевых близнецов составляет около 88,89%, а двуяйцевых – 6,67%, что достоверно доказывает большую роль наследственности в этой болезни. В 1960 году наблюдались 3 случая болезни Дауна у близнецов – 2 случая у двуяйцевых в возрасте от трѐх лет и 1 – у однояйцевых в возрасте одного года. ГЕННЫЕ БОЛЕЗНИ. ТИПЫ НАСЛЕДОВАНИЯ ГЕННЫХ БОЛЕЗНЕЙ. Диагностика каждого наследственного заболевания всегда начинается с клинического анализа, далее проводится генеалогический анализ и за тем устанавливается тип наследования как заключительный этап клиникогенетического обследования больного и ого семьи. В зависимости от того, где локализован патологический ген – в аутосоме или половой хромосоме – и каковы его взаимоотношения с нормальным аллелям, то есть, является ли мутация доминантной (нормальный ген подавляется патологическим) или рецессивной (патологический ген подавляется нормальным), различают следующие основные типы наследования: аутосомно-доминантный, аутосомно-рецессивный и сцепленный с полом (Х-сцепленное наследование). Тип наследования устанавливается путѐм анализа родословной. При составлении последней учитывают распространение в семье изучаемого заболевания и родственные отношения между носителями патологических генов. Построение и анализ родословной составляют предмет клинико-генеалогического исследования. Аутосомно-доминантный тип наследования. Фенотипически при этом типе наследования патологическое состояние обнаруживается у гетерозигот. Генетическая характеристика болезней, наследующихся по этому типу, представлена наиболее полно на примере таких патологических состояний, которые не наносят серьѐзного ущерба здоровью индивида и не влияют на его способность иметь потомство. Родословные таких лиц особенно широко описаны в прошлом, когда в семьях было по многу детей, дают возможность отметить несколько характерных черт аутосомно-доминантных форм наследственной патологии. 1.Патологический признак встречается в каждом поколении родословной и проявляется у гетерозиготных носителей гена. Если сибсов в данном поколении много, соотношение больных и здоровых сибсов приближается к 1:1. 2.Полная пенетрантность патологических проявлений наблюдается далеко не всегда. Чаще всего она ниже 100%, в том или ином поколении могут встретиться индивиды без выраженных признаков болезни, но являющихся гетерозиготами, о чѐм свидетельствует появление болезни у части их детей. 3.Для доминантно наследуемых состояний характерна различная выраженность клинических проявлений не только между разными семьями, но и внутри каждой семьи. Например, при множественном нейрофиброматозе у одних членов семьи нейрофибромы распространены генерализванно, а у других – имеются лишь отдельные кожные поражения. 4.Клинические проявления некоторых доминантных болезней могут развиваться спустя ряд лет после рождения, и по сроку появления имеется также большая вариабельность между членами разных семей и даже в одной семье. Традицион-ным примером этому служит хорея Гентингтона. При анализе больших выборок больных возрастное проявление первых еѐ симптомов описывается нормальным распределением с наибольшей проявляемостью в возрасте 41-45 лет. У редко встречающихся гомозиготных особей по доминантному признаку все проявления болезни бывают более тяжелыми. Объяснение этому простое: в случаях болезней с расшифрованным биохимическим эффектом у гомозигот патологический дефект касается всего продукта, у гетерозигот 50% его составляет нормальный белок. При значительной тяжести поражения, особенно если снижается способность индивида оставить потомство, родословная не является типичной, часто в таких случаях врач имеет дело с заново возникшей мутацией. Аутосомно-рецессивный тип наследования. Фенотипически при этом типе передачи патологического состояния гетерозиготы не отличаются от носителей обоих нормальных аллелей. Для клинического проявления болезни патологический ген должен быть в гомозиготном состоянии. Гомозиготы образуются в нескольких типах потомства. 1.Потомство, оба родителя которого гетерозиготы, встречается чаще всего. Сегрегация потомства следует менделеевскому соотношению 1:2:1, то есть риск рождения больного ребѐнка в таком браке 25%. В современных малодетных семьях установление затруднено. Правильному анализу способствует: а) указание на кровное родство родителей; б) биохимическое обследование, помогающее выявить носительство родителями патологического гена по биохимическому дефекту при болезни с выясненным первичным дефектом. Это обстоятельство важно, поскольку рецессивные болезни в основном являются энзимопатиями, многие из них – с известным биохимичес-ким эффектом. 2.Потомство, когда оба родителя гомозиготы. Такие случаи редки. Теоретически все сибсы должны быть больными. Однако описаны семьи, например, альбиносов, когда у родителей все дети были здоровыми. Такие случаи свидетельствуют о том, что родители несут мутации в разных участках гена. По своей генетической сущности эти случаи следует квалифицировать как двойные гетерозиготы, хотя мутации и относятся к одному гену; это одно из проявлений генетической гетерозиготности болезни. 3.Потомство гетерозигот с гомозиготами, которые возможно вследствие кровнородственных браков. Менделевское расщепление больных и здоровых сибсов будет 1:1.Такое сегрегационное отношение аналогично тому, что имеется при аутосомно-доминантном типе наследования, поэтому его иногда называют псевдодоминантным. Х-сцепленное наследование. Родословные с наследственной передачей патологических признаков, как и ранее разобранных нормальных признаков, если определяющие их гены локализованы в Х-хромосоме, имеют свои особенности, которые зависят от того, является ли признак рецессивным или доминантным. При Х-сцепленном рецессивном типе наследования, который характерен для таких сравнительно распространѐнных болезней, как гемофилия и некоторые типы мышечной дистрофии, гетерозиготы фенотипически будут здоровыми. Ими являются женщины, так как в норме лишь они несут две Х-хромосомы. У женщины болезнь развивается лишь в том случае, если мутацию несут обе Х-хромосомы, возможно проявление такой мутации при кариотипе 45Х. Такие случаи исключительно редки, так как браки между гетерозиготной женщиной и больным мужчиной. В основном эти формы патологий встречаются среди мужчин, у которых патологический ген проявляет своѐ действие в гомозиготном состоянии. На практике источником обычного потомства являются браки гетерозиготных женщин и здоровых мужчин. В таком браке сегрегационные характиристики сибсов будут следующие: 1) больными будут только сыновья. Статическое соотношение здоровых и больных мужчин составляет 1:1. 2) все гетерозиготные дочери будут носительницами аномального гена, их соотношение с дочерями без аномального гена будет составлять 1:1. Х-сцепленный доминантный тип наследования. Присущ немногим формам патологии, например, витамин D-рахиту. Фенотипическое проявление заболевания будут иметь как гомозиготы, так и гетерозиготы. Генетически возможны разные браки, но информативными являются те, в которых больным будет отец. В браке со здоровой женщиной наблюдаются следующие особенности наследования патологий: 1) все сыновья и их дети будут здоровыми, так как от отца им может быть передана только Y-хромосома; 2) все дочери будут гетерозиготами, причем фенотипически больными. Этими двумя особенностями данный тип отличается от аутосомно-доминантного типа, при котором соотношение больных и здоровых сибсов составляет 1:1 и одинаково для детей неотличимы от таковых при аутосомно-доминантном топе наследования (1:1),и половых различий также не должно быть. Отмечается более сильное проявление заболевания у мужчин, поскольку у них отсутствует компенсирующее действие нормального аллея. В литературе описаны родословные при некоторых болезнях с этим типом передачи, у которых нет сибсов мужского пола, поскольку сильная степень поражения вызывает их внутриутробную гибель. Такая родословная выглядит своеобразно: в потомстве только женщины, около половины их больны, в анамнезе могут значиться спонтанные аборты и мертворождения плодов мужского пола. Перечисленные типы наследования предусматривают главным образом моногенные заболевания (определяемые мутацией одного гена). Однако патологическое состояние может зависеть от двух и более мутантных генов. Ряд патологических генов обладает сниженной пенетрантностью. При этом присутствие их в геноме, даже в гомозиготном состоянии, необходимо, но недостаточно для развития болезни. Таким образом, не все типы наследования болезней человека укладываются в три перечисленные выше схемы. Литература 1. Лобашев М.Е., Ватти К.В., Тихомирова М.М. Генетика с основами селекции. – М.: Просвещение, 1979. – 304 с. 2. Барабанщиков Б.И., Сапаев Е.А. Сборник задач по генетике. – Казань: Изд-во КГУ, 1988. – 192 с. 3. Беркенблит М.Б., Жердев А.В. и др. Почти 200 задач по генетике. – М.: МИРОС, 1992. – 120 с. 4. Генетика / Б. Гуттман, Э. Гриффитс, Д. Сузуки, Т. Куллис. – М.: ФАИР-ПРЕСС, 2004. – 448 с. 5. Генетика человека / В.А. Шевченко, Н.А. Топорнина, Н.С. Стволинская. – М.: ВЛАДОС, 2004. – 240 с. 6. Геном, клонирование, происхождение человека / Под ред. Л.И. Корочкина. – Фрязино: «Век 2», 2004. – 224 с. 7. Гужов Ю.Л. Генетика и селекция – сельскому хозяйству: Кн. для учителя. – М.: Просвещение, 1984. – 240 с. 8. Гуляев В.Г. Задачник по генетике. – М.: Колос, 1980. – 76 с. 9. Кайданов Л.З. Генетика популяций. М.: Высш. шк., 1996. – 320 с. 10. Левитский Г.А. Цитогенетика растений. (Избранные труды). – М.: Наука, 1978. – 248 с. 11. Леск А. Введение в биоинформатику. – М.: БИНОМ. Лаборатория знаний, 2009. – 318 с. 12. Примроуз С., Твайвен Р. Геномика. Роль в медицине. – БИНОМ. Лаборатория знаний, 2010. – 277 с. 13. Лукашов В.В. Молекулярная эволюция и филогенетический анализ. – М.: БИНОМ. Лаборатория знаний, 2009. – 256 с. 14. Спицын В.А. Экологическая генетика человека. – М.: Наука, 2008. – 503 с. 15. Инге-Вечтомов С.Г. Генетика с основами селекции. М.: Высш. шк., 1989. – 591 с. <http://afonin-59-bio.narod.ru/2_heredity/2_heredity.htm> www.koipkro.kostroma.ru/Buy/muk/VPSH/DocLib8/.../AllItems.aspx www.med-edu.ru/genetic/